Галогенированные диэтилтолуолдиамины
Номер патента: 23023
Опубликовано: 29.04.2016
Авторы: Мюллер Констанце, Ла-Дельфа Гаэтано, Эллингер Штефан
Формула / Реферат
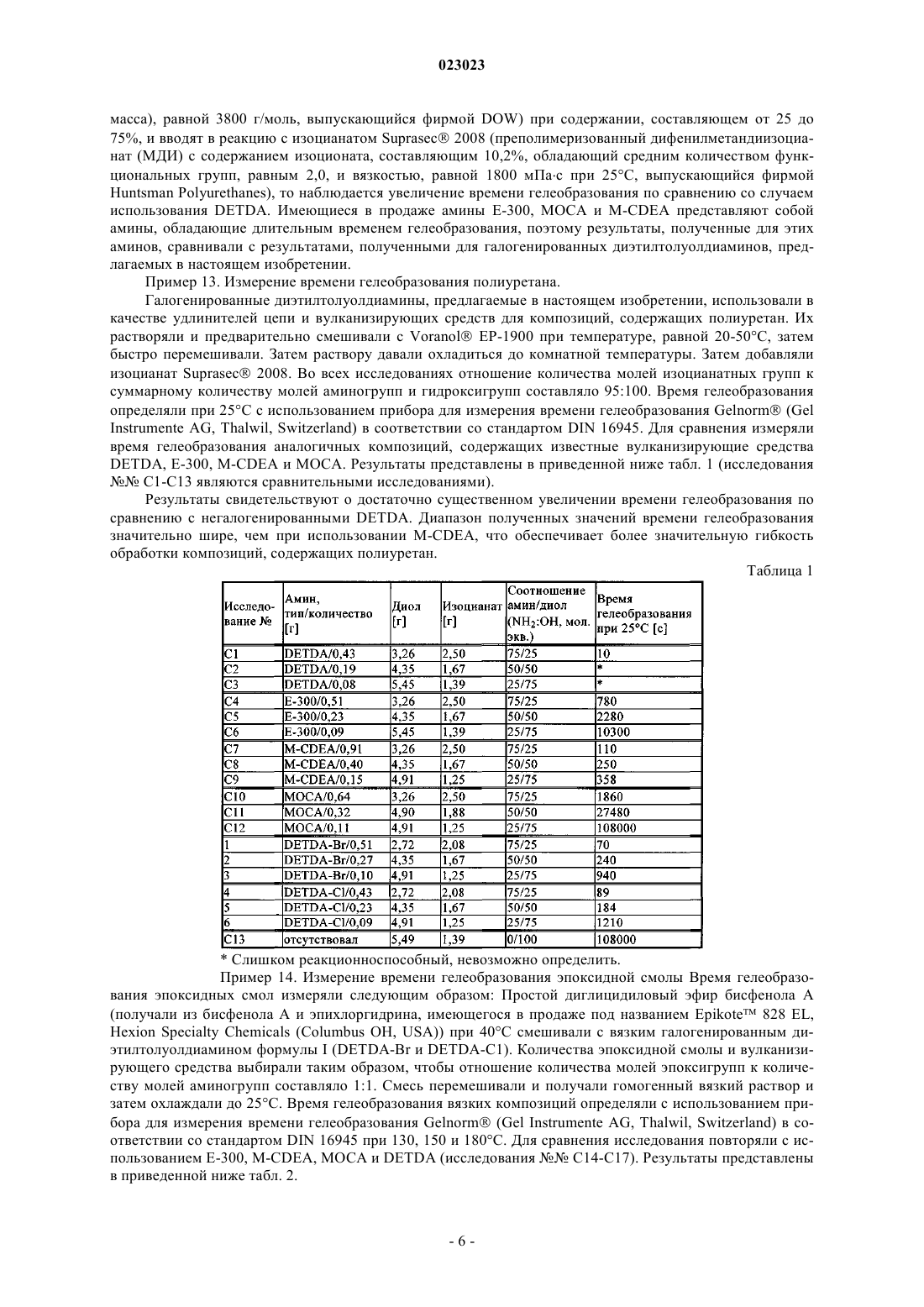
1. Галогенированный диэтилтолуолдиамин формулы
в которой или R1 обозначает аминогруппу и R2 обозначает хлор или бром, или R2 обозначает аминогруппу и R1 обозначает хлор или бром, или смесь его изомеров по положению аминогруппы, представленной R1 или R2.
2. Галогенированный диэтилтолуолдиамин по п.1, в котором или R1 обозначает аминогруппу и R2 обозначает хлор, или R2 обозначает аминогруппу и R1 обозначает хлор, или смесь его изомеров по положению аминогруппы, представленной R1 или R2.
3. Галогенированный диэтилтолуолдиамин по п.1, в котором или R1 обозначает аминогруппу и R2 обозначает бром, или R2 обозначает аминогруппу и R1 обозначает бром, или смесь его изомеров по положению аминогруппы, представленной R1 или R2.
4. Применение галогенированного диэтилтолуолдиамина по любому из пп.1-3 в качестве удлинителя цепи или вулканизирующего средства для получения полиуретанов.
5. Применение галогенированного диэтилтолуолдиамина по любому из пп.1-3 в качестве отвердителя для эпоксидных смол.
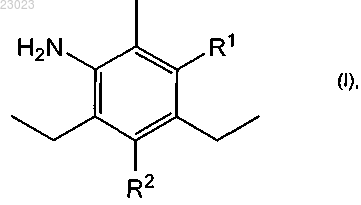
6. Способ получения галогенированного диэтилтолуолдиамина по п.2, включающий стадию реакции диэтилтолуолдиамина формулы
в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2, с хлором в серной кислоте.
7. Способ по п.6, в котором количество серной кислоты составляет от 5 до 50 мол.экв. в пересчете на количество диэтилтолуолдиамина (II).
8. Способ по п.6 или 7, в котором хлор добавляют в количестве, составляющем от 2 до 10 мол.экв. в пересчете на количество диэтилтолуолдиамина (II).
9. Способ по любому из пп.6-8, в котором температура проведения реакции составляет от 15 до 80°C.
10. Способ получения галогенированного диэтилтолуолдиамина по п.3, включающий стадии:
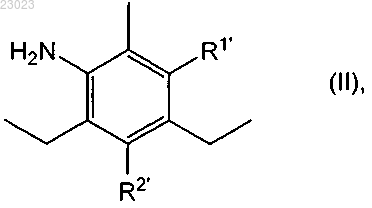
(i) реакции диэтилтолуолдиамина формулы
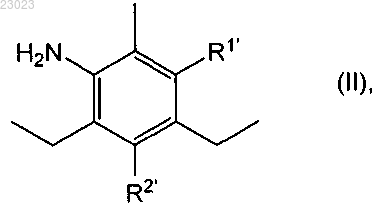
в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2, с ацетилирующим реагентом с получением диацетилсодержащего соединения формулы
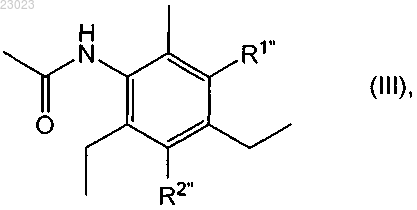
в которой или R1'' обозначает ацетиламиногруппу и R2'' обозначает водород, или R2'' обозначает ацетиламиногруппу и R1'' обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2,
(ii) бромирования указанного диацетилсодержащего соединения (III) с использованием бромисто-водородной кислоты и пероксида водорода с получением соответствующего бромированного диацетилсодержащего соединения формулы
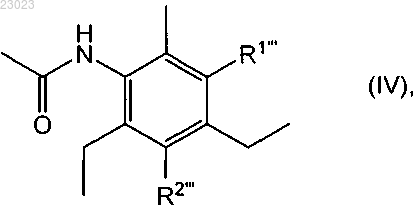
в которой или R1''' обозначает ацетиламиногруппу и R2''' обозначает бром, или R2''' обозначает ацетиламиногруппу и R1''' обозначает бром, или смеси его изомеров по положению аминогруппы представленной R1 или R2, и
(iii) гидролиза указанного бромированного диацетилсодержащего соединения (IV) с получением соответствующего бромированного диэтилтолуолдиамина (I).
11. Способ по п.10, в котором ацетилирующим реагентом, использующимся на стадии (i), является ацетилхлорид в присутствии триэтиламина.
12. Способ по п.10 или 11, в котором стадию бромирования (ii) проводят при температуре, равной от -10 до +20°C.
13. Способ по любому из пп.10-12, в котором стадию гидролиза (iii) проводят с использованием хлористо-водородной кислоты в метаноле.
14. Бромированное диацетилсодержащее соединение формулы
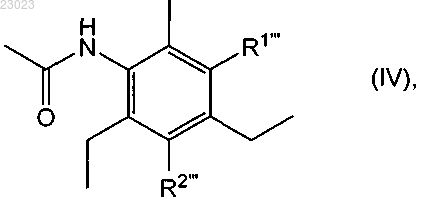
в которой или R1''' обозначает ацетиламиногруппу и R2''' обозначает бром, или R2''' обозначает ацетиламиногруппу и R1''' обозначает бром, или смесь его изомеров по положению аминогруппы, представленной R1 или R2.
Текст
В изобретении описаны галогенированные диэтилтолуолдиамины формулы в которой или R1 обозначает аминогруппу и R2 обозначает хлор или бром, или R2 обозначает аминогруппу и R1 обозначает хлор или бром, или смесь их изомеров по положению аминогруппы,представленной R1 или R2. Галогенированные диэтилтолуолдиамины формулы I применимы в качестве удлинителей цепи для полиуретанов и отвердителей для эпоксидных смол, обладающих относительно длительным временем гелеобразования. Область техники, к которой относится изобретение Настоящее изобретение относится к новым хлорированным и бромированным диэтилтолуолдиаминам, которые применимы в качестве удлинителей цепи или вулканизирующих средств для полиуретанов и в качестве отвердителей для эпоксидных смол. Настоящее изобретение также относится к применению этих новых соединений в качестве удлинителей цепи и вулканизирующих средств для полиуретанов и в качестве отвердителей для эпоксидных смол и к способам получения указанных галогенированных диэтилтолуолдиаминов, и к новым промежуточным продуктам, использующимся в указанных способах. Уровень техники Использование удлинителей цепи и вулканизирующих средств для получения полиуретанов и отвердителей для эпоксидных смол хорошо известно в данной области техники. Полиуретаны можно получить, например, по реакции соединений, включающих группы, содержащие реакционноспособный H,таких как простые полиэфирполиолы или сложные полиэфирполиолы, с диизоцианатом с образованием преполимера, который затем на следующей стадии вводят в реакцию с вулканизирующим средством и получают полиуретан. С другой стороны, эпоксидные смолы можно получить по реакции эпихлоргидрина со спиртом или фенолом с получением производного глицидила, которое затем вводят в реакцию с отвердителем и получают вулканизированную эпоксидную смолу. Структуру вулканизирующих средств и реакционную способность их функциональных групп часто используют для изменения характеристик конечного продукта или для регулирования скорости реакции образования полимера и технологических характеристик полимера. Удлинители цепи и вулканизирующие средства, обычно использующиеся для получения полиуретанов (ПУ) и эпоксидных смол, представляют собой ароматические диамины, такие как алкилзамещенные и/или хлорированные фенилендиамины или 4,4'-метилен-бис-анилины. При получении полиуретанов аминогруппы, содержащиеся в этих диаминах, вступают в реакцию с изоцианатными группами с образованием мочевиновых фрагментов. Влияние таких соединений на характеристики полимерной системы в значительной степени зависит от природы и положений алкильных заместителей и/или количества и/или положений атомов хлора в ароматических кольцах. Стерически затрудненные диамины, такие как 4,4'-метиленбис-(3-хлор-2,6-диэтиланилин) (M-CDEA) и 4,4'-метиленбис-(2,6-диэтиланилин) (MDEA), часто используют в качестве вулканизирующих средств. Однако эти соединения сложно перерабатывать, поскольку они обладают относительно высокой температурой плавления. Другие хорошо известные соединения, такие как 4,4'-метилен-бис-(2-хлоранилин) (MOCA) или 3,5-бис(метилтио) толуолдиамины (E-300), являются токсичными и/или обладают неприятным запахом. Задачей настоящего изобретения является получение новых ароматических диаминов, обладающих низкой токсичностью и не обладающих неприятным запахом, одновременно обладающих умеренной реакционной способностью, обеспечивающей подходящее время гелеобразования (или продолжительность нахождения в реакторе) при смешивании с уретановыми преполимерами или эпоксидными смолами. Необходимо, чтобы диамины при комнатной температуре являлись жидкими или полужидкими или по меньшей мере растворимыми в (невулканизированных) эпоксидных смолах, изоцианатах и диолах,использующихся в качестве исходных веществ для получения вулканизированных эпоксидных смол и полиуретанов. Краткое изложение сущности изобретения Согласно изобретению было установлено, что галогенированные диэтилтолуолдиамины формулы в которой или R1 обозначает аминогруппу и R2 обозначает хлор или бром, или R2 обозначает аминогруппу и R1 обозначает хлор или бром, и смеси их изомеров при комнатной температуре являются жидкими или полужидкими и хорошо смешиваются с исходными веществами и преполимерами, обычно использующимися для получения полиуретанов и эпоксидных смол, или растворимы в них. Они также обладают подходящим временем гелеобразования, не обладают неприятным запахом и являются менее токсичными по сравнению, например, с MOCA. Их можно легко синтезировать с хорошим выходом из имеющихся в продаже диэтилтолуолдиаминов путем прямого хлорирования в серной кислоте или путем бромирования соответствующих диацетилсодержащих производных с последующим гидролитическим отщеплением ацетильных групп. Бромированные диацетилсодержащие соединения являются новыми и также являются объектом настоящего изобретения. Подробное описание изобретения Настоящее изобретение относится к галогенированным диэтилтолуолдиаминам формулы в которой или R1 обозначает аминогруппу и R2 обозначает хлор или бром, или R2 обозначает аминогруппу и R1 обозначает хлор или бром, а также к смесям их изомеров. Смеси изомеров предпочтительно являются такими, которые можно получить из имеющихся в продаже смесей диэтилтолуолдиаминов, которые содержат, например, примерно 80% 3,5-диэтилтолуол-2,4-диамина и примерно 20% 3,5-диэтилтолуол-2,6-диамина. В одном предпочтительном варианте осуществления галогенированные диэтилтолуолдиамины формулы I являются хлорированными, что означает, что или R1 обозначает аминогруппу и R2 обозначает хлор, или R2 обозначает аминогруппу и R1 обозначает хлор. В другом предпочтительном варианте осуществления галогенированные диэтилтолуолдиамины формулы I являются бромированными, что означает, что или R1 обозначает аминогруппу и R2 обозначает бром, или R2 обозначает аминогруппу и R1 обозначает бром. Другим объектом настоящего изобретения является применение галогенированных диэтилтолуолдиаминов в качестве удлинителей цепи и вулканизирующих средств для получения полиуретанов. Указанное применение эквивалентно способу получения полиуретана по реакции по меньшей мере одного ди- или полифункционального изоцианата по меньшей мере с одним диолом или полиолом в присутствии по меньшей мере одного из галогенированных диэтилтолуолдиаминов, предлагаемых в настоящем изобретении, или при последующем его добавлении. Еще одним объектом настоящего изобретения является применение галогенированных диэтилтолуолдиаминов, предлагаемых в настоящем изобретении, в качестве отвердителей (вулканизирующих средств) для эпоксидных смол. Указанное применение эквивалентно способу получения вулканизированной эпоксидной смолы по реакции по меньшей мере одного ди- или многофункционального эпоксида по меньшей мере с одним из галогенированных диэтилтолуолдиаминов, предлагаемых в настоящем изобретении. В обоих случаях можно использовать чистые изомеры или смеси изомеров галогенированных диэтилтолуолдиаминов, предлагаемых в настоящем изобретении, по отдельности или в комбинации с другими аминами или смесями других аминов. Другим объектом настоящего изобретения является способ получения хлорированных диэтилтолуолдиаминов формулы I, в которой или R1 обозначает аминогруппу и R2 обозначает хлор, или R2 обозначает аминогруппу и R1 обозначает хлор, или смесей их изомеров, включающий стадию реакции диэтилтолуолдиамина формулы в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров, с элементарным хлором в серной кислоте. Исходные диэтилтолуолдиамины формулы II можно использовать в виде чистых изомеров, получение которых описано в US 3275690, или в виде смеси изомеров. Смеси изомеров имеются в продаже, например выпускаются фирмой Lonza Ltd., Switzerland, под торговым названием Lonzacure DETDA 80 (смесь изомеров,содержащая примерно 80% 2,4-диамино-3,5-диэтилтолуола и примерно 20% 2,6-диамино-3,5-диэтилтолуола). Хлорирование обычно проводят без добавления катализатора, отличающегося от серной кислоты. В предпочтительном варианте осуществления способа получения хлорированных диэтилтолуолдиаминов формулы I количество серной кислоты составляет от 5 до 50 мол.экв. в пересчете на количество диэтилтолуолдиамина (II). В другом предпочтительном варианте осуществления способа получения хлорированных диэтилтолуолдиаминов формулы I хлор добавляют в количестве, составляющем от 2 до 10 мол.экв. в пересчете на количество диэтилтолуолдиамина (II). В еще одном предпочтительном варианте осуществления способа получения хлорированных диэтилтолуолдиаминов формулы I температура проведения реакции составляет от 15 до 80C. Более предпочтительно, если температура проведения реакции составляет от 20 до 60C, например примерно 40C. Поскольку хлорирование проводят с использованием элементарного хлора, который является газообразным при температуре проведения реакции, реакцию предпочтительно проводить в закрытом сосуде, таком как автоклав, изготовленный из устойчивого к воздействию хлора материала. В присутствие серной кислоты исходные диэтилтолуолдиамины формулы II, а также хлорированные продукты формулы I находятся в протонированной форме в виде гидросульфатов и/или сульфатов. При проведении обработки реакционную смесь нейтрализуют, например, путем добавления сильного основания, такого как гидроксид натрия, и получают свободные хлорированные диамины формулы I. Другим объектом настоящего изобретения является способ получения бромированных диэтилтолуолдиаминов формулы I, в которой или R1 обозначает аминогруппу и R2 обозначает бром, или R2 обозначает аминогруппу и R1 обозначает бром, или смесей их изомеров, включающий стадии: в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров, с ацетилирующим реагентом с получением диацетилсодержащего соединения формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает водород, или R2 обозначает ацетиламиногруппу и R1 обозначает водород, или смеси его изомеров,(ii) бромирования указанного диацетилсодержащего соединения (III) с использованием бромистоводородной кислоты и пероксида водорода с получением соответствующего бромированного диацетилсодержащего соединения формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает бром, или R2 обозначает ацетиламиногруппу и R1 обозначает бром, или смеси его изомеров, и(iii) гидролиз указанного бромированного диацетилсодержащего соединения (IV) с получением соответствующего бромированного диэтилтолуолдиамина (I). Ацетилирующим реагентом, использующимся на стадии (i), может являться любой ацетилирующий реагент, известный в данной области техники, например уксусный ангидрид или ацетилгалогенид. В предпочтительном варианте осуществления способа получения бромированных диэтилтолуолдиаминов формулы I ацетилирующим реагентом, использующимся на стадии (i), является ацетилхлорид в присутствии триэтиламина. Стадию бромирования (ii) можно проводить в относительно мягких условиях. В предпочтительном варианте осуществления способа получения бромированных диэтилтолуолдиаминов формулы I стадию бромирования (ii) проводят при температуре, равной от -10 до +20C. Стадию гидролиза (iii) можно проводить в кислой или щелочной среде путем добавления сильной кислоты или сильного основания. В предпочтительном варианте осуществления способа получения бромированных диэтилтолуолдиаминов формулы I стадию гидролиза (iii) проводят с использованием хлористо-водородной кислоты в метаноле и таким образом получают соответствующие гидрохлориды, которые затем нейтрализуют путем добавления основания и получают свободные диамины. Бромированные диацетилсодержащие соединения формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает бром, или R2 обозначает ацетиламиногруппу и R1 обозначает бром, или смеси их изомеров, являются новыми и также являются объектом настоящего изобретения. Приведенные ниже примеры, которые не следует рассматривать как ограничивающие объем настоящего изобретения, более подробно иллюстрируют выбранные варианты осуществления и предпочтительные способы осуществления настоящего изобретения. Степень превращения и чистоту полученных продуктов определяли с помощью газовой хроматографии (ГХ) при следующих условиях: колонка с диметилполисилоксаном (0,35 мм), 30 м 0,32 мм, температурная программа: начальная температура: 130C, скорость нагрева: 1 К/мин до 145C, затем 15 К/мин до 190C, в заключение 30 К/мин до 250C, приготовление образца: образцы массой 0,2 г растворяли в 1 мл толуола. Пример 1. 6-Хлор-3,5-диэтилтолуол-2,4-диамин и 4-хлор-3,5-диэтилтолуол-2,6-диамин.Lonzacure DETDA 80 (смесь изомеров, 80% 3,5-диэтилтолуол-2,4-диамина и 20% 3,5-диэтилтолуол-2,6-диамина) (3,4 г, 18,6 ммоль) и 96 мас.% серной кислоты (28,5 г, 279 ммоль) помещали в автоклав, изготовленный из сплава Хастеллой НС 22. Автоклав нагревали до 40C и продували азотом. После окончания продувки азотом в автоклав со смесью подавали газообразный хлор (5,3 г, 74,4 ммоль). Реакционную смесь перемешивали при 40C в течение 18 ч (время проведения реакции) и затем выливали на лед (50 г). Суспензию нейтрализовывали 10% водным раствором гидроксида натрия (230 г) и после разделения фаз водную фазу экстрагировали дихлорметаном (50 мл). Объединенные органические фазы сушили над сульфатом магния и растворитель выпаривали при пониженном давлении и получали 4,5 г смеси изомеров соединения I (R1 = Cl, R2 = NH2 и R1 = NH2, R2 = Cl). По данным анализа с помощью ГХ площадь пика смеси изомеров, содержащей 6-хлор-3,5-диэтилтолуол-2,4-диамин и 4-хлор 3,5-диэтилтолуол-2,6-диамин, состава 4:1 составляла 96%. Выход: 3,7 г (93%). Время удерживания в ГХ: tR= 12,0 мин (3,5-диэтилтолуол-2,4-диамин), 13,3 мин (3,5-диэтилтолуол 2,6-диамин), 18,3 мин (6-хлор-3,5-диэтилтолуол-2,4-диамин), 18,4 мин (4-хлор-3,5-диэтилтолуол-2,6 диамин). Пример 2. 6-Хлор-3,5-диэтилтолуол-2,4-диамин. Повторяли процедуру примера 1 с использованием чистого 3,5-диэтилтолуол-2,4-диамина (получали в соответствии с US 3275690) вместо Lonzacure DETDA 80. Выход: 3,5 г (88%). 1H ЯМР (ядерный магнитный резонанс) (ДМСО-d6 (ДМСО = диметилсульфоксид), 500 МГц, 30C):4,48 (br. s, 4H), 2,57 (q, J = 7,4 Гц, 2H), 2,42 (q, J = 7,4 Гц, 2H), 2,06 (s, 3H), 0,99 (t, J = 7,4 Гц, 3H), 0,98 (t,J = 7,4 Гц, 3H). 13 С ЯМР (ДМСО-d6, 125 МГц, 30C):142,38, 141,63, 131,20, 113,92, 110,46, 107,77, 21,42, 17,96,14,43, 12,98, 11,90. Пример 3. 4-Хлор-3,5-диэтилтолуол-2,6-диамин. Повторяли процедуру примера 1 с использованием чистого 3,5-диэтилтолуол-2,6-диамина (получали в соответствии с US 3275690) вместо Lonzacure DETDA 80. Выход: 3,6 г (90%). 1H ЯМР (ДМСО-d6, 500 МГц, 30C):4,48 (br. s, 4H), 2,56 (q, J = 7,4 Гц, 4H), 1,87 (s, 3H), 0,99 (t, J = 7,4 Гц, 6H). 13 С ЯМР (ДМСО-d6, 125 МГц, 30C):142,25, 130,80, 113,88, 104,50, 21,33, 12,98, 11,33. Пример 4. N,N'-Диацетил-3,5-диэтилтолуол-2,4-диамин и N,N'-диацетил-3,5-диэтилтолуол-2,6 диамин. В трехгорлую круглодонную колбу объемом 2 л помещали Lonzacure DETDA 80 (120 г, 0,67 моль), триэтиламин (179 г, 1,77 моль) и дихлорметан (550 мл). Смесь охлаждали до 0C и затем по каплям добавляли ацетилхлорид (127 г, 1,62 моль). Смесь перемешивали при комнатной температуре в течение 3,5 ч и затем ее фильтровали и твердое вещество промывали водой (3100 мл). После сушки твердого вещества в вакууме получали 107 г (61%) смеси изомеров соединения III (R1 = ацетиламиногруппа,R2 =H и R1 = Н, R2 = ацетиламиногруппа). Пример 5. N,N'-Диацетил-3,5-диэтилтолуол-2,6-диамин. Повторяли процедуру примера 4 с использованием чистого 3,5-диэтилтолуол-2,6-диамина (получали в соответствии с US 3275690) вместо Lonzacure DETDA 80. Выход: 105 г (60%). 1C ЯМР (ДМСО-d6, 125 МГц, 30C):168,21, 139,40, 133,65, 132,73, 125,12, 24,38, 22,40, 14,48,13,49. Пример 6. N,N'-Диацетил-3,5-диэтилтолуол-2,4-диамин. Повторяли процедуру примера 4 с использованием чистого 3,5-диэтилтолуол-2,4-диамина (получали в соответствии с US 3275690) вместо Lonzacure DETDA 80. Выход: 111 г (62%). 1 диэтилтолуол-2,6-диамин. Водный раствор бромисто-водородной кислоты (40 мас.% HBr, 493 г, 2,44 моль) при 0C по каплям добавляли к раствору смеси изомеров соединения III (получали в соответствии с примером 4) (40 г, 0,15 моля) в метаноле (650 мл). Затем при 0C добавляли водный раствор пероксида водорода (30 мас.% Н 2 О 2,259 г, 2,29 моль) и реакционной смеси в течение ночи давали нагреться до комнатной температуры. Реакцию в желтой смеси останавливали насыщенным водным раствором NaHSO3, смесь фильтровали и промывали водой. Твердое вещество сушили в вакууме и получали 41 г (79%) смеси изомеров соединения IV (R1 = ацетиламиногруппа, R2= Br и R1= Br, R2= ацетиламиногруппа). Пример 8. N,N'-Диацетил-6-бром-3,5-диэтилтолуол-2,4-диамин. Повторяли процедуру примера 7 с использованием N,N'-диацетил-3,5-диэтилтолуол-2,4-диамина(получали в соответствии с примером 6) вместо смеси изомеров соединения III. Выход: 46 г (62%). 1C ЯМР (ДМСО-d6, 125 МГц, 30C):169,03, 140,30, 139,68, 135,37, 134,02, 133,39, 123,88, 26,20,22,36, 21,18, 19,55, 13,52, 13,02. Пример 9. N,N'-Диацетил-4-бром-3,5-диэтилтолуол-2,6-диамин. Повторяли процедуру примера 7 с использованием N,N'-диацетил-3,5-диэтилтолуол-2,6-диамина(получали в соответствии с примером 5) вместо смеси изомеров соединения III. Выход: 43 г (60%). 1(t, J = 7,4 Гц, 3H). 13 С ЯМР (ДМСО-d6, 125 МГц, 30C):168,55, 139,98, 134,71, 134,02, 122,72, 26,15,22,32, 13,65,13,09. Пример 10. 6-Бром-3,5-диэтилтолуол-2,4-диамин и 4-бром-3,5-диэтилтолуол-2,6-диамин. Смесь изомеров IV (получали в соответствии с примером 7) (30 г, 0,09 моль), метанол (250 мл) и концентрированную хлористо-водородную кислоту (360 мл) помещали в колбу и смесь кипятили с обратным холодильником в течение 120 ч. После охлаждения до комнатной температуры смесь концентрировали в вакууме. Добавляли воду для растворения твердого вещества, значение pH доводили до 9 водным раствором гидроксида натрия и продукт экстрагировали дихлорметаном. Органический слой концентрировали и неочищенный продукт очищали с помощью колоночной флэш-хроматографии и получали 15 г (65%) смеси изомеров соединения I (R1= NH2, R2= Br и R1= Br, R2 = NH2). 1(s, 2,4H), 1,85 (s, 0,6H), 1,00-0,97 (m, 6H). Пример 11. 6-Бром-3,5-диэтилтолуол-2,4-диамин. Повторяли процедуру примера 10 с использованием N,N'-диацетил-3,5-диэтилтолуол-2,4-диамина(получали в соответствии с примером 8) вместо смеси изомеров соединения IV. Выход: 14 г (61%). 1H ЯМР (ДМС 0-d6, 500 МГц, 30C):4,38 (br. s, 4H), 2,65 (q, J = 7,4 Гц, 2H), 2,44 (q, J = 7,4 Гц, 2H),2,13 (s, 3H), 0,99 (t, J = 7,4 Гц, 3H), 0,98 (t, J =7,4 Гц, 3H). 13 С ЯМР (ДМСО-d6, 125 МГц, 30C):142,60, 141,84, 125,38, 115,38, 110,94, 109,42, 24,60, 18,03,17,92, 12,88, 11,77. Пример 12. 4-Бром-3,5-диэтилтолуол-2,6-диамин. Повторяли процедуру примера 10 с использованием N,N'-диацетил-3,5-диэтилтолуол-2,6-диамина(получали в соответствии с примером 9) вместо смеси изомеров соединения IV. Выход: 12,5 г (54%). 1H ЯМР (ДМСО-d6, 500 МГц, 30C):4,48 (br. s, 4H), 2,64 (q, J = 7,4 Гц, 4H), 1,86 (s, 3H), 0,99 (t, J = 7,4 Гц, 6H). 13 С ЯМР (ДМСО-d6, 125 МГц, 30C):142,50, 124,82, 115,28, 104,96, 24,50, 12,88, 11,36. Применение галогенированных диэтилтолуолдиаминов в качестве удлинителей цепи и вулканизирующих средств для полиуретанов и отвердителей для эпоксидных смол. Аббревиатуры:DETDA = 3,5-диэтилтолуолдиамины (смесь 80% 2,4- и 20% 2,6-диамина),DETDA-Cl = хлор-3,5-диэтилтолуолдиамины (получали в соответствии с примером 1),DETDA-Br = бром-3,5-диэтилтолуолдиамины (получали в соответствии с примером 10),M-DEA = 4,4'-метиленбис(2,6-диэтиланилин),M-CDEA = 4,4'-метиленбис(3-хлор-2,6-диэтиланилин),MOCA = 4,4'-метиленбис(2-хлоранилин),Е-300 = 3,5-бис(метилтио)толуолдиамины (смесь изомеров 2,4- и 2,6-диамина). Новые удлинители цепи и вулканизирующие средства формулы I для полиуретанов и эпоксидных смол обладают более длительным временем гелеобразования по сравнению с DETDA. Поскольку эти амины при комнатной температуре являются жидкими/полукристаллическими, их можно обрабатывать при более низких температурах, чем другие ароматические амины (M-DEA, M-CDEA, MOCA). Если соединение формулы I смешивают с диолом Voranol ЕР 1900 (простой полиэфирдиол на основе полипропиленгликоля с количеством OH-групп, равным 26-29, и Mw (среднемассовая молекулярная масса), равной 3800 г/моль, выпускающийся фирмой DOW) при содержании, составляющем от 25 до 75%, и вводят в реакцию с изоцианатом Suprasec 2008 (преполимеризованный дифенилметандиизоцианат (МДИ) с содержанием изоционата, составляющим 10,2%, обладающий средним количеством функциональных групп, равным 2,0, и вязкостью, равной 1800 мПас при 25C, выпускающийся фирмойHuntsman Polyurethanes), то наблюдается увеличение времени гелеобразования по сравнению со случаем использования DETDA. Имеющиеся в продаже амины Е-300, MOCA и M-CDEA представляют собой амины, обладающие длительным временем гелеобразования, поэтому результаты, полученные для этих аминов, сравнивали с результатами, полученными для галогенированных диэтилтолуолдиаминов, предлагаемых в настоящем изобретении. Пример 13. Измерение времени гелеобразования полиуретана. Галогенированные диэтилтолуолдиамины, предлагаемые в настоящем изобретении, использовали в качестве удлинителей цепи и вулканизирующих средств для композиций, содержащих полиуретан. Их растворяли и предварительно смешивали с Voranol ЕР-1900 при температуре, равной 20-50C, затем быстро перемешивали. Затем раствору давали охладиться до комнатной температуры. Затем добавляли изоцианат Suprasec 2008. Во всех исследованиях отношение количества молей изоцианатных групп к суммарному количеству молей аминогрупп и гидроксигрупп составляло 95:100. Время гелеобразования определяли при 25C с использованием прибора для измерения времени гелеобразования Gelnorm (GelInstrumente AG, Thalwil, Switzerland) в соответствии со стандартом DIN 16945. Для сравнения измеряли время гелеобразования аналогичных композиций, содержащих известные вулканизирующие средстваDETDA, Е-300, M-CDEA и MOCA. Результаты представлены в приведенной ниже табл. 1 (исследованияС 1-С 13 являются сравнительными исследованиями). Результаты свидетельствуют о достаточно существенном увеличении времени гелеобразования по сравнению с негалогенированными DETDA. Диапазон полученных значений времени гелеобразования значительно шире, чем при использовании M-CDEA, что обеспечивает более значительную гибкость обработки композиций, содержащих полиуретан. Таблица 1 Слишком реакционноспособный, невозможно определить. Пример 14. Измерение времени гелеобразования эпоксидной смолы Время гелеобразования эпоксидных смол измеряли следующим образом: Простой диглицидиловый эфир бисфенола А(получали из бисфенола А и эпихлоргидрина, имеющегося в продаже под названием Epikote 828 EL,Hexion Specialty Chemicals (Columbus OH, USA при 40C смешивали с вязким галогенированным диэтилтолуолдиамином формулы I (DETDA-Br и DETDA-C1). Количества эпоксидной смолы и вулканизирующего средства выбирали таким образом, чтобы отношение количества молей эпоксигрупп к количеству молей аминогрупп составляло 1:1. Смесь перемешивали и получали гомогенный вязкий раствор и затем охлаждали до 25C. Время гелеобразования вязких композиций определяли с использованием прибора для измерения времени гелеобразования Gelnorm (Gel Instrumente AG, Thalwil, Switzerland) в соответствии со стандартом DIN 16945 при 130, 150 и 180C. Для сравнения исследования повторяли с использованием Е-300, M-CDEA, MOCA и DETDA (исследованияС 14-С 17). Результаты представлены в приведенной ниже табл. 2. в которой или R1 обозначает аминогруппу и R2 обозначает хлор или бром, или R2 обозначает аминогруппу и R1 обозначает хлор или бром, или смесь его изомеров по положению аминогруппы, представленнойR1 или R2. 2. Галогенированный диэтилтолуолдиамин по п.1, в котором или R1 обозначает аминогруппу и R2 обозначает хлор, или R2 обозначает аминогруппу и R1 обозначает хлор, или смесь его изомеров по положению аминогруппы, представленной R1 или R2. 3. Галогенированный диэтилтолуолдиамин по п.1, в котором или R1 обозначает аминогруппу и R2 обозначает бром, или R2 обозначает аминогруппу и R1 обозначает бром, или смесь его изомеров по положению аминогруппы, представленной R1 или R2. 4. Применение галогенированного диэтилтолуолдиамина по любому из пп.1-3 в качестве удлинителя цепи или вулканизирующего средства для получения полиуретанов. 5. Применение галогенированного диэтилтолуолдиамина по любому из пп.1-3 в качестве отвердителя для эпоксидных смол. 6. Способ получения галогенированного диэтилтолуолдиамина по п.2, включающий стадию реакции диэтилтолуолдиамина формулы в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2, с хлором в серной кислоте. 7. Способ по п.6, в котором количество серной кислоты составляет от 5 до 50 мол.экв. в пересчете на количество диэтилтолуолдиамина (II). 8. Способ по п.6 или 7, в котором хлор добавляют в количестве, составляющем от 2 до 10 мол.экв. в пересчете на количество диэтилтолуолдиамина (II). 9. Способ по любому из пп.6-8, в котором температура проведения реакции составляет от 15 до 80C. 10. Способ получения галогенированного диэтилтолуолдиамина по п.3, включающий стадии: в которой или R1' обозначает аминогруппу и R2' обозначает водород, или R2' обозначает аминогруппу и R1' обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2, с ацетилирующим реагентом с получением диацетилсодержащего соединения формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает водород, или R2 обозначает ацетиламиногруппу и R1 обозначает водород, или смеси его изомеров по положению аминогруппы, представленной R1 или R2,(ii) бромирования указанного диацетилсодержащего соединения (III) с использованием бромистоводородной кислоты и пероксида водорода с получением соответствующего бромированного диацетилсодержащего соединения формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает бром, или R2 обозначает ацетиламиногруппу и R1 обозначает бром, или смеси его изомеров по положению аминогруппы представленной R1 или R2, и(iii) гидролиза указанного бромированного диацетилсодержащего соединения (IV) с получением соответствующего бромированного диэтилтолуолдиамина (I). 11. Способ по п.10, в котором ацетилирующим реагентом, использующимся на стадии (i), является ацетилхлорид в присутствии триэтиламина. 12. Способ по п.10 или 11, в котором стадию бромирования (ii) проводят при температуре, равной от -10 до +20C. 13. Способ по любому из пп.10-12, в котором стадию гидролиза (iii) проводят с использованием хлористо-водородной кислоты в метаноле. 14. Бромированное диацетилсодержащее соединение формулы в которой или R1 обозначает ацетиламиногруппу и R2 обозначает бром, или R2 обозначает ацетиламиногруппу и R1 обозначает бром, или смесь его изомеров по положению аминогруппы, представленной
МПК / Метки
МПК: C07C 209/74, C07C 211/52
Метки: диэтилтолуолдиамины, галогенированные
Код ссылки
<a href="https://eas.patents.su/9-23023-galogenirovannye-dietiltoluoldiaminy.html" rel="bookmark" title="База патентов Евразийского Союза">Галогенированные диэтилтолуолдиамины</a>