Способ синтеза 9a-гидроксистероидов
Номер патента: 15734
Опубликовано: 31.10.2011
Авторы: Олац Каталин, Хантош Габор, Ганчош Валериа, Тегдеш Анико, Эрдейи Шандор, Балог Габор, Кенцель Кальман
Формула / Реферат
1. Способ селективного синтеза соединений общей формулы (I)

где -А-А'- представляет собой -СН2-СН2- или -СН=СН-группу,
посредством биоконверсии соединений общей формулы (II)
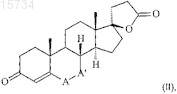
где -А-А'- представляет собой -СН2-СН2- или -СН=СН-группу,
отличающийся тем, что в качестве гидроксилирующего микроорганизма при биоконверсии используют штамм бактерии Nocardia farcinica, зарегистрированный под депозитарным номером NCAIM (Р) - В 001342.
2. Способ по п.1, отличающийся тем, что биоконверсия составляет более чем 80%.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Настоящее изобретение относится к новому селективному способу синтеза производных 9 гидроксистероида общей формулы (I) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу, посредством биоконверсии соединений общей формулы (II) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу, посредством использования в качестве гидроксилирующего микроорганизма при биоконверсии штамма бактерии Nocardiafarcinica, депозитарный номер которого представляет собой NCAIM (Р) - В 001342. 015734 Область техники Настоящее изобретение относится к новому селективному способу синтеза производных 9 гидроксистероида общей формулы (I) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу,посредством биоконверсии соединений общей формулы (II) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу. Предшествующий уровень техники Известно, что 9-гидроксистероиды нашли широкое применение в терапии, например 9 гидроксипроизводные прегнановых стероидов проявляют глюкокортикоидную активность, а также 9 гидроксипроизводные производных андростана применяются в качестве активных ингредиентов антиандрогенных и антиэстрогенных лекарственных средств. 9-Гидроксистероиды, незамещенные в позиции 11, могут быть легко дегидратированы с помощью известных химических способов и 9(11)-дегидростероиды, полученные таким образом, представляют собой важные промежуточные продукты для синтеза соединений, проявляющих высокую биологическую активность. Указанные соединения представляют собой, например, гидрокортизон (химическое название 11,17,21-тригидроксипрегн-4-ен-3,20-дион) и преднизолон (химическое название 11,17,21 тригидроксипрегн-1,4-диен-3,20-дион), обладающие противовоспалительной активностью, или эплеренон (химическое название 9,11-эпокси-17-гидрокси-3-оксопрегн-4-ен-7,21-дикарбоновой кислоты лактон), который имеет широкий спектр показаний к использованию, например в качестве -блокатора он уменьшает риск смерти, вызываемой заболеваниями сердца и кровеносной системы, а также он применяется для лечения высокого кровяного давления и как мочегонное средство. Соединения, относящиеся к группе 4-3-кетопрегнанов, были впервые гидроксилированы в 9 положении Hanze и др. в 1958 г. с использованием плесневого грибка штаммов Cunninghamella и Helicostylum (см. патентный документ US 3038913). В 1960 г. Sih и др. описали 9-гидроксилирование стероидов с использованием микроорганизмов, обладающих ферментативной активностью 1-дегидрогеназы, в присутствии ингибитора 1-дегидрогеназы (см. патентный документ US 3065146). Два года спустя Sebek осуществил 9-гидроксилирование стероидов, используя штамм Ascochyta linecola (см. патентный документ US 3116220). В патентном документе, указанном ранее, Sih и др. также описали штаммы микобактерий как микроорганизмов, имеющих ферменты, способствующие 9-гидроксилированию стероидов (см. патентный документ US 3065146). Известно, что в 1977 г. Frederick и др. посредством мутагенной обработки выделили новый штамм микобактерий, который только частично разрушает опытные стероидные субстраты, что приводит к накапливанию 9-гидроксипроизводных (см. патентный документ US 4029549). Wovcha применял тот же самый штамм - Mycobacterium fortuitum штамм NRRL В-8119 для синтеза новых 9-гидроксипроизводных (см. патентный документ US 4035236).Wovcha и др. изучали роль Mycobacterium fortuitum штамм АТСС 6842 при разрушении основной цепи стероида. Они обнаружили, что ключевой стадией в разрушении до диоксида углерода и воды является последовательное действие ферментов 1-дегидрогеназы и 9-гидроксилазы. Две стадии превращения могут быть поменены местами, т.е. обе стадии реакции могут осуществляться с помощью два-два фермента (группы ферментов), например один из них - фермент 1-дегидрогеназа превращает исходный материал, а другой 1- дегидрогенизирует 9-гидроксипроизводное. При проведении исследований авторы предположили, что указанные выше ферменты могут быть индуцированы, и количество и композиция образующихся продуктов существенно варьируется из-за использования различных индуцирующих агентов [Biochimica et Biophysica Acta 574, 471-479 (1979)]. В 1981 г. Marsheck и др. осуществили 9-гидроксилирование стероидных соединений, используя новый мутант штамма Nocardia canicruria, таким способом, что отпала необходимость в использовании ингибитора фермента 1-дегидрогеназы. Согласно указанным примерам синтез 9-гидроксикетолактона(химическое название 9,17-дигидрокси-3-оксо-17-прегн-4-ен-21-карбоновой кислоты -лактон) описан, начиная с кетолактона (химическое название 17-гидрокси-3-оксо-17-прегн-4-ен-21-карбоновой кислоты -лактон), используя концентрацию кетолактонного субстрата 0,5 г/дм 3, при этом желаемый гидроксилированный продукт получают со степенью конверсии 30% (см. патентный документ US 4397947). В числе прочих Mutafov и др. изучали индуцибельность (способность к индуцированию) фермента стероид 9-гидроксилазы, используя штамм Rhodococcus sp. и обнаружили, что 9-гидрокси-4 андростен-3,17-дион, полученный в качестве продукта, представлял собой очень слабый индуцирующий агент, поскольку использование его как индуцирующего агента приводило к скорости реакции вдвое меньшей, а количество образующегося 9-гидроксипродукта было в четыре раза меньше, чем при использовании в качестве индуцирующего агента 4-андростен-3,17-диона [Process Biochemistry 32 (7), 585589 (1997)].Brzostek и др. изучали разрушение основной цепи стероида на генном уровне и обнаружили, что блокирование ферментативной активности 1-дегидрогеназы, которое необходимо для синтеза 9 гидроксистероидных производных, затруднено ввиду того, что существуют не только различные типы ферментов 1-дегидрогеназ, но и геном в некоторых случаях содержит пять генов 1-дегидрогеназы [Microbiology 151, 2393-2402 (2005)]. Известно, что при синтезе эплеренона микробиологическая стадия осуществляется наряду с химическими стадиями реакции, в том числе гидроксилирование ценного промежуточного продукта - канренона (химическое название 17-гидрокси-3-оксо-17-прегн-4,6-диен-21-карбоновой кислоты -лактон) осуществляют с помощью микроорганизмов (Diplodia, Aspergillus, Absidia sp.) (см. заявки на патент США 2004/087562 и 2004/097475 и далее международная заявка РСТ 2005/000865). Другой способ синтеза эплеренона может быть осуществлен посредством 9 а-гидроксилирования канренона. 9-Гидроксиканренон (химическое название 9,17-дигидрокси-3-оксо-17-прегн-4,6-диен 21-карбоновой кислоты -лактон) был впервые получен Ng и др. посредством микробиологического гидроксилирования (см. публикация международной заявки WO 97/21720 и патент Венгрии 222453) и описан в примере 17 указанных выше патентных документов. 9-Гидроксиканренон как индивидуальный продукт был впервые описан в 1998 г. в формуле изобретения патентного документа, авторами которого были Ng и др. (см. публикацию международной заявки WO 98/25948 или позднее патентный документ US 7129345). Международный поисковый орган обнаружил 18 независимых изобретений в публикациях международных заявок WO 97/21720 и WO 98/25948, поэтому авторам было предложено подать отдельные заявки на изобретения. В результате было подано более 100 заявок на изобретения, из которых несколько содержат пример 17 ранее указанного патентного документа WO 97/21720 (см. WO 2005/239761). В примере 17 описаны данные скрининга 83 микроорганизмов, которые потенциально обладают 9-гидроксилирующей ферментной активностью, и указаны данные ТСХ (тонкослойной хроматографии), ВЭЖХ/УФ (высокоэффективной жидкостной хроматографии с использованием УФ-матрицы) и хромато-масс-спектрометрометрии продуктов, полученных в результате биоконверсии канренона. Из данных, приведенных в таблице примера 17, видно только то, что 9-гидроксиканренон может быть обнаружен посредством указанных аналитических методов среди возможных продуктов. В таблице указана микобактерия Mycobacterium fortuitum штамм АТСС 6842, но данные анализа в соответствующих колонках не приведены. Способность к биоконверсии этого штамма известна из литературы [публикации начинаются с 1936 г., Acta Med. Rio de Janeiro 1,1], поэтому можно предположить, что разложение канренона имеет место (см. патентные документы US 4029549 и 4035236). Это предположение подкрепляется публикацией, которая была написана в 2003 г. микробиологами и авторами указанного выше семейства патентов-аналогов. Эта публикация содержит такую же таблицу,но штамм Mycobacterium fortuitum в этой таблице представляет собой вариант указанного выше штамма,разработанного для 9-гидроксилирования стероидов, регистрационный номер NRRL B-8119 [J. Nat.Prod. 66, 350-356 (2003)]. В этом случае согласно авторам Mycobacterium fortuitum NRRL B-8119 не продуцирует гидрокси- или дегидрогенизированного продукта и метаболизма не происходит. Согласно примеру 17 существует 3 вида штаммов Nocardias, а именно штаммы Nocardia aurentis,Nocardia cancicruria и Nocardia coralline. Согласно показаниям ТСХ и ВЭЖХ продукты конверсии двух штаммов подобны 9-гидроксиканренону, но образование 9-гидроксиканренона обнаруживается с помощью хромато-масс-спектрометрии. В указанной выше публикации, где приводятся количественные данные, описан только микробиологический синтез 9-гидроксиканренона: Corynespora cassiicola штамм АТСС 16718 использовали для аэробной ферментации, осуществляемой в колбе, используя концентрацию канренона в субстрате 0,1 г/дм 3 и желаемый гидроксилированный продукт образовывался с 30% конверсией [J. Nat. Prod. 66, 350356 (2003)]. Как видно из приведенных публикаций, не существует такого микробиологического способа синтеза 9-гидроксипроизводных канренона или кетолактона, который был бы промышленно применим.-2 015734 Сущность изобретения Поэтому задачей настоящего изобретения является разработка промышленно применимого микробиологического способа гидроксилирования стероидов общей формулы (II), где -А-А'- представляет собой -CH2-СН 2- или -СН=СН-группу, как субстрата в позиции 9 без значительного разрушения и образования побочных продуктов. В предварительных экспериментах авторы настоящего изобретения определяли штаммы микобактерий, наиболее подходящие для микробиологического синтеза 9-гидроксиканренона. Был проведен скрининг 38 микобактерий и штаммов Nocardia с использованием в качестве субстрата кетолактона и канренона для определения их способности к конверсии. Среди исследованных штаммов были обнаружены штаммы, разрушающие стерол дикого типа, например Mycobacterium fortuitum ATCC 6842 или частично разрушающие главную цепь - Mycobacterium fortuitum NRRL В-8129, а также несколько штаммов наиболее подходящих для 9-гидроксилирования: Mycobacterium fortuitum NRRL B-8119, Mycobacterium sp. NCAIM 1072, Mycobacterium sp. NCAIM 324. При проведении скрининга авторы настоящего изобретения обнаружили 3 штамма, которые согласно анализам с помощью ТСХ продуцируют 9-гидроксипроизводные в обнаружимых количествахMycobacterium fortuitum NCAIM 00327, Mycobacterium fortuitum NCAIM 00323 и Nocardia sp. RG 1369. Все указанные штаммы способны превращать соединение общей формулы (II), где -А-А'- представляет собой -СН 2-СН 2-группу, в 9-гидроксипроизводное. Однако авторы настоящего изобретения обнаружили, что только штамм Nocardia sp. RG 1369 способен превратить соединение общей формулы (II),где -А-А'-представляет собой -СН=СН-группу, в 9-гидроксипроизводное. Для того чтобы усилить способность к превращению (конверсии), авторы настоящего изобретения проводили эксперимент во встряхиваемых колбах, используя глюкозу, сахарозу или глицерин в качестве источника углерода, предпочтительно 5-25 г/дм 3 глицерина, более предпочтительно 15 г/дм 3 глицерина, а также используя дрожжевой экстракт, растительный пептон или экстракт солода в качестве источника азота, предпочтительно используя дрожжевой экстракт, растительный пептон и экстракт солода совместно в концентрации 1-10 г/дм 3, более предпочтительно в концентрации 5-5 г/дм 3, в данном случае внося аммоний, фосфат, калий, магний и железо в виде их соответствующих соединений. Температура культивирования составляла 28-35 С, предпочтительно 32 С. Когда штамм Nocardia sp. RG 1369 культивировали так, как описано выше, и добавляли конренон в качестве субстрата в концентрации 4 г/дм 3, было обнаружено, что значительное количество стероида разложилось в течение нескольких часов, хотя продукт 9-гидроксиканренон все еще можно было выделить, но после добавления субстрата в течение 24 ч наблюдалось полное разложение главной цепи стероида. В дальнейших экспериментах, используя селективный индуцирующий агент, авторы настоящего изобретения попытались сдвинуть равновесие реакции в сторону образования 9-гидроксиканренона. Из числа известных индуцирующих агентов в условиях экспериментов являются активными AD (химическое название 4-андростен-3,17-дион) и 10,11-дигидроксилеводион (химическое название 13-этил 10,11-дигидрокси-4-гонен-3,17-дион). При использовании в качестве индуцирующего агента 10,11 дигидроксилеводиона разложение происходило на 6-10 ч позднее, чем в случае использования AD. Индуцирующий агент 10,11-дигидроксилеводион растворяли в смеси метанол-вода, предпочтительно в соотношении смеси 3:1 при повышенной температуре, предпочтительно при 50 С, и фильтровали с получением стерильного раствора. Полученный раствор добавляли к культуре в конце латентного периода,возраст культуры 10-24 ч, предпочтительно возраст культуры 18 ч, в концентрации 0,01-0,5 г/дм 3, предпочтительно в концентрации 0,05 г/дм 3. Согласно проведенным экспериментам разрушение может быть замедлено добавлением ингибиторов фермента 1-дегидрогеназы, таких как антибиотики левомицетин (хлорамфеникол), террамицин (окситетрациклин) и стрептомицин, а также хинонов, например гидрохинона, нафтохинона и нингидрина. Авторы настоящего изобретения добились самых лучших результатов при использовании стрептомицина, а именно время разложения было на 3-7 ч дольше. Согласно экспериментам антибиотик добавляли через 2-8 ч после индукции, предпочтительно через 6 ч, в концентрации 2-10 мг/дм 3, более предпочтительно в конечной концентрации 6 мг/дм 3. Анализируя результаты проведенных экспериментов, авторы настоящего изобретения пришли к выводу, что нужно попытаться получить штамм, который может быть использован в промышленности для синтеза соединения общей формулы (I), где -А-А'- представляет собой -СН 2-СН 2- или -СН=СНгруппу посредством мутагенной обработки и селекции штамма Nocardia sp. RG 1369. Из числа возможных мутагенных обработок было выбрано облучение УФ светом с длиной волны 254 нм. Во время мутагенной обработки культура Nocardia sp. RG 1369, которая была суспендирована в физиологическом растворе и содержалась в стерильных условиях, была обработана известным способом с использованием лампы Mineralight UVGL-58 типа с расстояния 15 см в течение 23 мин, время облучения было выбрано на основании предварительно рассчитанной кривой смертности. Был проведен скрининг чистых культур, которые были получены известными способами, и неожиданно было обнаружено, что имеется одна культура, которая способна превращать соединение общей-3 015734 формулы (II), где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу, в соединение общей формулы (I), где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу без значительного разрушения. Полученный таким образом мутант бактерии Nocardia sp. F1a (RG 4451) способен обеспечить более чем 80% конверсию. При секвенировании рРНК бактерия была идентифицирована как Nocardia farcinicaNCAIM (P) - В 001342 и депонирована в соответствии с положениями Будапештского договора о международном признании депонирования микроорганизмов (Budapest Treaty) для дальнейшей процедуры получения патента. Сведения, подтверждающие возможность осуществления изобретения В соответствии с указанными выше фактами настоящее изобретение относится к способу селективного синтеза соединения общей формулы (I) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу,посредством биоконверсии соединения общей формулы (II) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу,включающий использование штамма бактерии Nocardia farcinica, депозитарный номер которого NCAIM(Р) - В 001342, в качестве гидроксилирующего микроорганизма в биоконверсии. Морфологические характеристики нового мутантного штамма Nocardia farcinica NCAIM (P) - В 001342 немного отличаются от характеристик исходного штамма Nocardia sp. RG 1369. Это различие является наиболее видимым на поверхности YTA агара (состав которого следующий: 10 г/дм 3 трипказеина; 1 г/дм 3 дрожжевого экстракта; 5 г/дм 3 хлорида натрия; 0,25 г/дм 3 гептагидрата сульфата магния; 0,07 г/дм 3 дигидрата хлорида кальция; 20 г/дм 3 агар-агара); исходный штамм Nocardia sp. RG 1369 продуцирует пигмент желто-оранжевого цвета, поверхность культуры гладкая, блестящая, основная часть растущей культуры может быть обнаружена под поверхностью агара, а не на поверхности. В отличие от исходного штамма, поверхность культуры нового мутантного штамма Nocardia farcinica NCAIM (Р) - В 001342 не гладкая, а складчатая, и только небольшая часть растущей культуры может быть обнаружена под поверхностью агара. Идентификация бактериального штамма была осуществлена посредством анализа частичной последовательности 16S рРНК гена.-4 015734 Полученная последовательность (1396 пар оснований) охватывает 91% всего гена (1527 пар оснований). Определение видовой принадлежности изучаемого штамма может быть осуществлено на базе Национального центра биотехнологической информации (NCBI) с помощью программы BLAST поиска посредством использования генотаксономического способа: правильным обозначением штамма RG 4451 является Nocardia farcinica. Его место в систематике живых организмов: Nocardia farcinica Trevisan 1889 [3] Клеточные организмы: Bacteria; Actinobacteria; Actinobacteria; Actinobacteridae; Actinomycetales;Corynebacterineae; Nocardiaceae; Nocardia; Nocardia farcinica. Точные данные использованной идентификации NCBI BLAST [2]: Возможность доступа: http://www.ncbi.nlm.nih.gov/blast/, Версия: BLASTN 2.2.16 (Mar-25-2007). База данных: все последовательности GenBank+EMBL+DDBJ+PDB, а не EST, STS, GSS, природные образцы или фазы 0, 1 или 2 HTGS последовательности); 5,284,371 последовательности; 20,692,750,832 общие символы, алгоритм: megablast. Последовательность 16S рРНК гена штаммов, принадлежащих к видам Nocardia farcinica, является идентичной или очень похожей для указанных штаммов. Сходство является также значительным в подродах, но семейства родов Corynebacterineae (см. Nocardiaceae, Mycobacteriaceae) сильно различаются. Важным и четко видимым различием между двумя штаммами является способность к конверсии при синтезе соединения общей формулы (I), где -А-А'-представляет собой -СН 2-СН 2- или -СН=СНгруппу, т.е. то, что новый штамм мутант Nocardia farcinica NCAIM (P) - В 001342 сохранил способность к 9-гидроксилированию, однако, разрушение основной цепи стероида подавляется. Поэтому при определенных ранее условиях проведения эксперимента, вследствие подавления разрушения, количество 9 гидроксипродукта увеличивается, он может быть выделен, он может быть использован для синтеза в промышленных масштабах. Краткое описание графических материалов Графики, изображенные на фиг. 1, демонстрируют характеристики конверсии стероида образцом материнского штамма Nocardia sp. RG 1369 в условиях ферментации, описанных выше, с использованием канренона в качестве субстрата. Графики, изображенные на фиг. 2, демонстрируют способность к конверсии штамма Nocardia farcinica NCAIM (P) - В 001342 в тех же самых условиях. Описание примеров осуществления изобретения Далее настоящее изобретение проиллюстрировано с помощью следующих неограничивающих примеров. Пример 1. Культуру Nocardia farcinica NCAIM (P) - В 001342 поддерживают на скошенном агаре следующего состава: Инокулированную культуру инкубируют при температуре 32 С в течение 4 дней, затем ее выдерживают при температуре +4-10 С в течение последующих 30 дней для того, чтобы инициировать пролиферацию. Клеточную культуру, находящуюся в вегетативной фазе, готовят посредством переноса суспензии поверхностной культуры в 100 см 3 стерильной культуральной среды следующего состава (в колбе объемом 500 см 3). Культуру встряхивают при 32 С в течение 48 ч с частотой 200 об/мин, затем 10% клеточной культуры используют для инокулирования 100 см 3 стерильной культуральной среды следующего состава (в колбе объемом 500 см 3): Культуру встряхивают при 32 С в течение 72 ч с частотой 200 об/мин, затем 10% клеточной культуры используют для инокулирования 100 см 3 стерильной культуральной среды следующего состава (в колбе объемом 500 см 3): Культуру встряхивают при 32 С в течение 72 ч с частотой 200 об/мин, затем, когда возраст культуры составит 18 ч, индуцируют образование фермента 9-гидроксилазы посредством добавления 5 мг 10,11-дигидроксилеводиона, растворенного в смеси метанол-вода 3:1. После 6 ч от начала индукции к культуре добавляют 0,4 г кетолактонного субстрата (химическое название 17-гидрокси-3-оксо-17 прегн-4-ен-21-карбоновой кислоты -лактон), растворенного в диметилформамиде. После дополнительного культивирования в течение 16 ч культуру экстрагируют хлороформом, органический слой концентрируют, остаток перекристаллизовывают из этилацетата, фильтруют и сушат. Таким образом, получают 456 мг кристаллического материала. Согласно результатам ВЭЖХ он содержит 74,3% продукта, что составляет 339 мг (т.е. выход составляет 84,7%) 9-гидроксикетолактона (химическое название 9,17 дигидрокси-3-оксо-17-прегн-4-ен-21-карбоновой кислоты -лактон). Полученный таким образом продукт был идентифицирован с помощью ЯМР-спектрометрии. Характерные значения химических сдвигов приведены ниже. 1 Н ЯМР 500 MHz, DMSO-d6 (TMS),(ppm): 0,87 (3H, s, 18-Me); 1,201,67 (2H, mm, H-12),1,25 (3H, s, 19-Me); 1,321,54 (2H, mm, H-15); 1,431,48 (2H, mm, H-7); 1,471,67 (2H, mm,H-11); 1,582,33 (2H, mm, H-1); 1,65 (1H, m, H-9); 1,862,05 (2H, mm, H-16); 1,90 (1H, m, H-8); 1,922,37 (2H, mm, H-20); 2,172,38 (2H, mm, H-2); 2,202,43 (2H, mm, H-6); 2,402,54(C-14); 44,0 (C-10); 44,9 (C-13); 75,1 (C-9); 95,3 (C-17); 124,9 (C-4); 170,6 (C-5); 176,3 (C-22); 197,9 (C-3) Пример 2. Эксперимент проводят так же, как описано в примере 1, за исключением того, что основную часть культуры получают в лабораторном ферментере. Инокулированную культуру встряхивают при 32 С в течение 72 ч с частотой 200 об/мин, затем содержимое 5 колб используют для инокулирования 5 дм 3 стерильной основной части культуральной среды следующего состава в сосуде-ферментере объемом 9 дм 3: Культуру перемешивают при 32 С со скоростью 300 об/мин и скоростью аэрации 200 дм 3/ч. Когда возраст культуры составит 18 ч, индуцируют в культуре образование фермента 9-гидроксилазы посредством добавления 250 мг 10,11-дигидроксилеводиона, растворенного в смеси метанол-вода 3:1. После 6 ч от начала индукции к культуре добавляют 5 г субстрата канренона (химическое название 17-гидрокси-3 оксо-17-прегн-4,6-диен-21-карбоновой кислоты -лактон), растворенного в этаноле. Биоконверсию осуществляют в том же самом ферментере при 30 С, перемешивании со скоростью 300 об/мин и скорости аэрации 200 дм 3/ч. После дополнительного культивирования в течение 16 ч культуру экстрагируют хлороформом, органический слой концентрируют, остаток перекристаллизовывают из этилацетата,фильтруют и сушат. Таким образом, получают 5,66 г кристаллического материала. Согласно результатам ВЭЖХ он содержит 72,4% продукта, что составляет 4,1 г (т.е. выход составляет 82%) 9 гидроксиканренона (химическое название 9,17-дигидрокси-3-оксо-17-прегн-4,6-диен-21-карбоновой кислоты -лактон). Полученный таким образом продукт был идентифицирован с помощью ЯМР-спектрометрии. Характерные значения химических сдвигов приведены ниже. 1 Н ЯМР 500 MHz, DMSO-d6 (TMS),(ppm): 0,92 (3H, s, 18-Me); 1,15 (3H, s, 19-Me); 1,221,75(C-13); 74,1 (C-9); 94,9 (C-17); 124,6 (C-4); 127,9 (C-6); 136,2 (C-7); 162,5 (C-5); 176,2 (C-22); 198,1 (C-3). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ селективного синтеза соединений общей формулы (I) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу,посредством биоконверсии соединений общей формулы (II) где -А-А'- представляет собой -СН 2-СН 2- или -СН=СН-группу,отличающийся тем, что в качестве гидроксилирующего микроорганизма при биоконверсии используют штамм бактерии Nocardia farcinica, зарегистрированный под депозитарным номером NCAIM (Р) - В 001342. 2. Способ по п.1, отличающийся тем, что биоконверсия составляет более чем 80%.
МПК / Метки
МПК: C07J 21/00
Метки: синтеза, 9a-гидроксистероидов, способ
Код ссылки
<a href="https://eas.patents.su/9-15734-sposob-sinteza-9a-gidroksisteroidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза 9a-гидроксистероидов</a>
Предыдущий патент: Фунгицидные смеси на основе триазолов
Следующий патент: Фармацевтические композиции на основе 2-[[6-[(3r)-3-амино-1-пиперидинил]-3,4-дигидро-3-метил-2,4-диоксо-1(2н)-пиримидинил]метил]бензонитрила
Случайный патент: Усиление действия ингибиторов прорастания картофельных клубней путем применения различных комбинаций агентов