Фармацевтическая комбинация для лечения мышечной спастичности и/или боли
Номер патента: 7732
Опубликовано: 29.12.2006
Авторы: Далмади Балаж, Тарнава Иштван, Кочиш Паль, Немет Дьёрдь, Тиханьи Карой
Формула / Реферат
1. Фармацевтическая композиция для лечения спастичности и/или боли, характеризующаяся тем, что композиция содержит терапевтически эффективное количество комбинации активных ингредиентов, представленной 70-95 мас.% вещества с формулой I, где R представляет собой метильную или этильную группу, и 5-30 мас.% декстрометорфана (химическое название: (+/-)-3-метокси-17-метилморфинан), и при необходимости фармацевтически приемлемый носитель
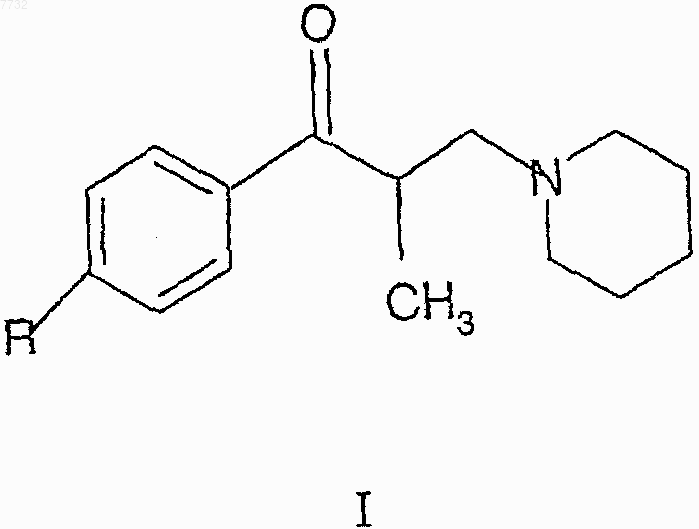
2. Фармацевтическая композиция по п.1, в которой вещество с формулой I, где R представляет собой метильную группу, представлено в количестве от 80 до 90 мас.%, а декстрометорфан представлен в количестве от 10 до 20 маc.%.
3. Фармацевтическая композиция по любому из предыдущих пунктов, где единица композиции содержит 150 мг толперизона и 30 мг декстрометорфана в смеси с фармацевтически приемлемыми носителями.
4. Фармацевтическая композиция по любому из пп.1-3, предназначенная для перорального применения.
5. Способ лечения и/или предотвращения спастичности и/или боли, который включает введение эффективного количества фармацевтической композиции по любому из пп.1-4.
Текст
007732 Область техники, к которой относится изобретение Настоящее изобретение касается фармацевтической комбинации для лечения мышечной спастичности (судороги, спазмы) и/или боли. Уровень техники Известно, что толперизон (химическое название: 2-метил-1-(4-метилфенил)-3-(1-пиперидинил)-1 пропанон) является активным ингредиентом мидетона, продукта, который присутствует на рынке в течение десятилетий. Толперизон является мышечным релаксантом центрального действия (CMR, centrallyacting muscle relaxant). Он применяется для лечения мышечной спастичности и болезненных рефлекторных мышечных спазмов, связанных с различными расстройствами скелетно-мышечной системы, такими как люмбаго, спастические состояния после спинальной или мозговой травмы, инсульт, перинатальные ушибы головы или множественный склероз, боковой амиотрофический склероз (болезнь Шарко) и т.д. Механизм действия мышечных релаксантов центрального действия может быть различным. Они могут действовать через рецепторы GABAA, GABAB, альфа 2 или NMDA, в то время как некоторые из них блокируют потенциалчувствительные Na+ и Са 2+ каналы. Топлеризон представляет собой лекарственное средство, которое можно безопасно применять, так как он практически не дает побочных эффектов. Его биодоступность при оральном применении является низкой; у человека она составляет 16-20%. Следует отметить, что пока нет четких клинических данных, свидетельствующих о действии толперизона в качестве анальгетика. Хорошо известно, что декстрометорфан (химическое название: (+/-)-3-метокси-17-метилморфинан) имеет сходную структуру с кодеином. Декстрометорфан, в основном, применяется в клинической практике как супрессор кашля. Он является безопасным лекарственным средством, которое имеет незначительное количество побочных эффектов, и используется также в педиатрии. Для него известно только одно взаимодействие с лекарственными препаратами - декстрометорфан нельзя применять совместно с ингибиторами МАО. На рынке представлены комбинированные препараты декстрометорфана с эфедрином и ацетаминофеном, которые применяются для расширения бронхов (бронходиляторы) и показаны для лечения простуды с симптомами кашля. Декстрометорфан идентифицирован как лекарственное средство - антагонист глютаматных рецепторов NMDA типа, но, как известно, проявляет также и другие значительные эффекты. Главным его метаболитом является декстрофан, который является более эффективным антагонистом NMDA. Предполагают, что терапевтическое действие декстрометорфана основано на этом механизме. Отмеченный выше NMDA антагонизм послужил теоретической основой для создания комбинации декстрометорфана с морфином для лечения болевых симптомов. Ожидалось, что декстрометорфан будет блокировать или отменять толерантность к болеутоляющему эффекту морфина. Однако клиническое испытание этой комбинации оказалось неудачным. Мы подчеркиваем, что был проведен ряд клинических испытаний для демонстрации болеутоляющего действия декстрометорфана. Однако было обнаружено, что он неэффективен в лечении хронической боли (Ben-Abraham and Weinbroum, Isr. Med. Assoc. J. 2000. 2, 708.). Данная молекула также не уменьшала у человека острой ишемической боли (Plesan et al., Acta Anaesthesiol. Scand. 2000. 44, 924). Сообщалось также, что в экспериментальной модели боли человека декстрометорфан не проявлял эффекта в клинически приемлемом диапазоне дозировки (Kaippula et al., Pharmacol. Biochem. Behav. 1995. 52, 611). Согласно клиническим испытаниям не обнаружено значительного обезболивающего эффекта при использовании следующих комбинаций: декстрометорфан-NSAID (нестероидное противовоспалительное средство), декстрометорфан-пропоксифен, декстрометорфан-морфин (Mercandate et al., J. PainSymptom. Manage. 1998. 16, 317). В педиатрии при периоперационном использовании декстрометорфан не усиливает болеутоляющего действия, индуцируемого морфином или ацетаминофеном (Rose et al.,Anesth. Analg. 1999. 88, 749). Согласно исследованиям, упомянутым выше, не доказано, что декстрометорфан обладает обезболивающим эффектом сам по себе или в комбинации, и лечение боли не входит в число показаний для применения декстрометорфана. Его антиспастический эффект также не был показан, поэтому это также не входит в число показаний для его применения. Целью нашего изобретения является разработка фармацевтической комбинации, пригодной для эффективного лечения мышечной спастичности и боли. В наших первых экспериментах мы исследовали способность декстрометорфана усиливать эффективность действия толперизона. Мы подчеркиваем, что взаимодействие толперизона и декстрометорфана не было изучено ни в фармакологических экспериментах на животных, ни в клинических исследованиях на человеке. Удивительно, что в моделях мышечной спастичности наши экспериментальные результаты продемонстрировали до сих пор неизвестный и неожиданный потенциирующий эффект, полученный,когда эти два продаваемых фармацевтических продукта применялись совместно. В дополнение к этому мы обнаружили новый фармакологический эффект комбинации - обезболивающее действие, которое не было ранее обнаружено при индивидуальном применении любого из этих лекарственных средств для лечения человека. Напротив, как мы отмечали выше, согласно научной литературе все исследования на-1 007732 человеке с комбинациями декстрометорфана были неудачными. В соответствии с вышеизложенным нашим изобретением является фармацевтическая комбинация для лечения мышечной спастичности и/или боли, которая содержит в качестве активных ингредиентов вещество, соответствующее формуле I, где R представляет собой метильную или этильную группу,70-95 маc.%, и декстрометорфан (химическое название: (+/-)-3-метокси-17-метилморфинан), 30 маc.%. В предпочтительной фармацевтической композиции согласно настоящему изобретению толперизон присутствует в количестве от 80 до 90 маc.%, декстрометорфан присутствует в количестве от 10 до 20 маc.%. Единица фармацевтической композиции настоящего изобретения предпочтительно содержит 150 мг толперизона и 30 мг декстрометорфана в смеси с фармацевтически приемлемыми носителями. Композиция данного изобретения предназначена для орального применения. Для подтверждения эффективности фармацевтической комбинации данного изобретения были проведены следующие эксперименты: Влияние декстрометорфана на активность толперизона как миорелаксанта и ингибитора рефлекса Метод для оценки эффективности миорелаксанта Тремор-тест на мыши. Ингибирование тремора у мыши, индуцируемого лекарственным средством, является хорошим показателем эффективности действия миорелаксантов на человеке. Тремор можно индуцировать посредством применения GYKI 20039 (3-(2,6-дихлорфенил)-2-иминотиазолидин). Метод был опубликован KocsisP., Tarnawa I., Kovacs Gy., Szombathelyi Zs., Farkas S., 2002; Acta Pharmaceut. Hung., 72:49-61; US 5340823, 1994, US 5198446, JP 1992270293, EP 0468825,1990 HU 4647. Наши эксперименты показали, что GYKI 20039 индуцирует интенсивный тремор у мыши при дозе 10 мг/кг внутрибрюшинно, который продолжается 30-60 мин и достигает максимума между 4 и 8 мин. Механизм действия GYKI 20039 не вполне понятен, но его структурное сходство с LON-954, другим треморогенным веществом, предполагает вовлечение нисходящих допаминергических и серотонинэргических систем (Mohanakumar, K.P., Ganguly, D.K., 1989; Brain Res. Bull. 22: 191-5). Тремор, индуцированный GYKI 20039, может дозозависимо ингибироваться расслабляющими мышцы лекарственными средствами с различными механизмами действия; поэтому данный метод пригоден для сравнения эффективности действия лекарственных средств-миорелаксантов. Применение модели было обосновано посредством использования нескольких разных расслабляющих мышцы лекарственных средств, используемых в клинической практике (табл. 1). Все они проявляли дозозависимый ингибирующий эффект, который хорошо коррелировал с клинической эффективностью антиспастического действия мышечных релаксантов. Цель наших экспериментов состояла в том, чтобы выяснить, зависит ли эффект толперизона от совместного применения с декстрометорфаном. Для выяснения этого вопроса мы выбрали низкую дозу декстрометорфана, в которой он сам по себе не ингибирует тремор, индуцированный GYKI 20039. Таблица 1 Дозы различных лекарственных средств-миорелаксантов, вызывающие 50% ингибирование тремо-2 007732 ра (введение внутрибрюшинно, предварительная обработка 15 мин). Табл. 2 и 3 четко демонстрируют, что декстрометорфан, использованный для тестирования в разных дозах, значительно увеличивает эффект различных доз толперизона. Декстрометорфан, применяемый за 15 мин до введения GYKI 20039, внутрибрюшинно, вызывал дозозависимое ингибирование тремора с ED50, равным 24,4 мг/кг. 10-минутная предобработка 10 мг/кг декстрометорфана не приводила к значительному ингибированию тремора, но значительно увеличивала ингибирующее действие толперизона, применяемого в количестве 40 или 60 мг/кг (табл. 3.). ВеличинаED50 для одного толперизона, ингибирующего тремор, была 55,07,2 мг/кг, в то время как при комбинировании с декстрометорфаном в пропорции 5:1 его ED50 было равно 33,00,7 мг/кг. При соотношении компонентов 10:1 ED50 было равно 26,64,7 мг/кг, в то время как при соотношении 20:1 ED50 для толперизона было равно 34,46,8 мг/кг. Таблица 2 Ингибирующее действие на тремор толперизона самого по себе, взятого в количестве 60 мг/кг, и толперизона в присутствии декстрометорфана при различных соотношениях компонентов (20:1, 10:1 и 5:1). Декстрометорфан значительно увеличивает эффект толперизона (р=0,00045; ANOVA). При тестировании (апостериорное вычисление, многоранговый критерий Дункана) сравнивали результат каждой группы, обработанной комбинацией декстрометорфан-толперизон, с результатом группы, обработанной соответствующей дозой одного толперизона. Таблица 3 Увеличение эффективности толперизона, 40 и 60 мг/кг, при совместном применении с 10 мг/кг декстрометорфана, который сам по себе неэффективен. Декстрометорфан (10 мг/кг) значительно увеличивал эффективность толперизона, взятого в количестве 40 и 60 мг/кг (р 0,001 и р 0,01). Ингибирование рефлексов спинного мозга in vitro. Наши эксперименты были проведены в соответствии с методами, описанными Отсука и КонишиBull. 2003. 60, 81). Толперизон или эперизон (химическое название: 2-метил-1-(4-этилфенил)-3-(1-пиперидинил)-1 пропанон), который имеет похожие структуру и фармакологическое действие с толперизоном, значительно ингибировал рефлекс на препарате полурассеченного спиного мозга in vitro. Такой эксперимент проводят для тестирования активности миорелаксантов центрального действия. В тремор-тесте на эффективность лекарственных средств могут влиять метаболические и фармакокинетические факторы, поэтому для изучения фармакодинамического взаимодействия между компонентами комбинации мы использовали модель in vitro, в которой исключено вмешательство вышеназванных факторов. Наши исследования показали, что декстрометорфан сам по себе ингибирует рефлекторную актив-3 007732 ность. Мы построили кривую зависимости ингибирования моносинаптического рефлекса одним декстрометорфаном и в присутствии толперизона или эперизона от дозы лекарственных средств. В контрольном исследовании мы измеряли эффект декстрометорфана при концентрациях 0,25, 0,5 и 1 мкМ. В других экспериментах мы добавляли толперизон (25 мкМ) или эперизон (20 мкМ) к перфузионному раствору, и, принимая равновесные ответы в этих условиях как контрольные, мы измеряли рефлекс-ингибирующее действие декстрометорфана. Было обнаружено, что декстрометорфан, применяемый совместно с толперизоном, в 4 раза более эффективен, чем сам по себе. Потенциирующий эффект эперизона был еще более выражен (см. табл. 4). Мы также продемонстрировали синергический эффект при применении лекарственных средств в обратном порядке, т.е. мы измеряли эффект одного толперизона и толперизона в присутствии 0,25 мкМ декстрометорфана и сравнивали две зависимости доза-ответ (см. табл. 5). Таблица 4 Рефлекс-ингибирующая активность декстрометорфана самого по себе и в присутствии толперизона или эперизона. Совместное применение с толперизоном снижало значение IC50 декстрометорфана примерно на 75% (IC50 одного декстрометорфана: 1,56 мкМ; декстрометорфана в присутствии 25 мкМ толперизона: 0,38 мкМ), то есть эффективность лекарственного средства увеличивалась в 4 раза. Различие между двумя кривыми зависимости эффекта от применяемых доз препаратов достоверное (ANOVA,многоранговый критерий Дункана, р=0,003259). Совместное использование с эперизоном также уменьшало значение IC50 декстрометорфана (IC50 декстрометорфана с эперизоном: 0,19 мкМ). Отличие от контрольной кривой также достоверное (ANOVA, многоранговый критерий Дункана, р=0,000198). Таблица 5 Рефлекс-ингибрующая активность толперизона самого по себе и в присутствии декстрометорфана. Присутствие декстрометорфана снижает IC50 толперизона почти на 80% (IC50 одного толперизона: 52,4 мкМ;IC50 толперизона в присутствии декстрометорфана: 11,4 мкМ; приближение сигмоидной кривой), то есть декстрометорфан увеличивает эффективность толперизона в 5 раз. Различие между двумя кривыми является достоверным (ANOVA, многоранговый критерий Дункана, р=0,000189). Представленные выше результаты однозначно подтверждают наличие потенциирующего фармакодинамического взаимодействия между толперизоном и декстрометорфаном. Изучение обезболивающих свойств. Крысиная модель для изучения нарушения порога болевой чувствительности (аллодиния). В наших экспериментах мы использовали модель Беннет-Хайе (G.J. Bennet, Y.-K. Xie, Pain 33: 87107; 1988) для тестирования действия комбинации лекарственных средств на невропатическую боль. Мы измеряли порог болевой реакции при использовании волосков фон Фрея (von Frey filaments), калиброванных по весу - 0,9, 1,2, 1,8, 3,6, 5,4, 6,9, 8,9, 12 и 20 г. В тех случаях, когда животное не проявляло реакции при усилии 20 г, мы принимали значение порога чувствительности равным 21 г. В этой модели для изучения нарушения порога болевой чувствительности (аллодинии) толперизон проявлял значительный обезболивающий эффект. Декстрометорфан при использовании внутрибрюшинно дозы 10 мг/кг был практически неэффективен, когда применялся один, но при комбинированном применении он значительно увеличивал эффективность действия толперизона (табл. 6). Противоболевой (обезболивающий) эффект толперизона, применяемого внутрибрюшинно, самого по себе и совместно с декстрометорфаном. Видна достоверная разница между группами в моменты времени 10 и 20 мин (тест ANOVA Kruskal-Wallis, 0 мин: р=0,9135; 10 мин: р=0,0004; 20 мин: р=0,0024). В точке максимального эффекта (10 мин) декстрометорфан не оказывает значимого действия (р=0,07; U критерий Манна-Уитни), в то время как толперизон (р=0,0059; U - критерий Манна-Уитни) и его комбинация с декстрометорфаном (р=0,00031; U - критерий Манна-Уитни) проявляют. Эффект комбинации был значительно сильней, чем при применении одного толперизона (р=0,026; U - критерий Манна-Уитни). Обсуждение фармакологических результатов. Результаты тремор-теста подтвердили, что неэффективные дозы декстрометорфана способны увеличивать тремор-ингибирующую (то есть расслабляющую мышцы, антиспастическую) активность толперизона. Декстрометорфан при совместном применении с толперизоном в пропорциях от 1:19 до 1:4 значительно увеличивал эффект толперизона. Мы получили похожие результаты в нашем рефлекс-тестеin vitro; декстрометорфан в присутствии толперизона проявлял более высокую ингибирующую рефлекс активность, чем сам по себе, и тот же потенциирующий эффект был продемонстрирован при использовании лекарственных средств при обратном режиме введения. При изучении обезболивающего действия данной комбинации в тесте с измерением нарушения порога болевой чувствительности (аллодиния) было показано, что неэффективная доза декстрометорфана значительно усиливала обезболивающий эффект толперизона. В этом случае соотношение декстрометорфана и толперизона было 1:2. Наши исследования доказали, что существует потенциирующее взаимодействие между компонентами фармацевтической комбинации декстрометорфана с толперизоном (и с эперизоном, который имеет сходные с толперизоном структуру и фармакологическое действие) в широком диапазоне доз (пропорции от 1:2 до 1:20). Этот потенциирующий эффект больше, чем аддитивный эффект, и он может иметь большое преимущество при лечении человека. Клинические исследования. Клинические исследования, проведенные с небольшим числом пациентов, указывают на потенциальную терапевтическую выгоду использования комбинации толперизон:декстрометорфан в пропорции 5:1 с фиксированной дозой для лечения различных неврологических симптомов. Наши клинические исследования были проведены на 14 пациентах с синдромом хронической боли,проявляющимся по крайней мере в течение 3 месяцев. Пациенты получали 150 мг толперизона и 30 мг декстрометорфана 3 раза в день. Продолжительность лечения варьировала от 1 до 3 недель. Комбинированное лечение привело к уменьшению боли средней и максимальной интенсивности у 12 пациентов, в то время как изменений в противоположном направлении никогда не наблюдали. Не было выявлено значительных побочных эффектов, требующих прекращения лечения. В соответствии с отчетами самих пациентов облегчение боли наступало через несколько дней после начала лечения. Этиология включала радикулопатию, митохондриальную миопатию, диабеты и паранеопластическую полиневропатию, фибромиалгию, синдром застывшего человека (stiff-man syndrome). Согласно нашему изобретению комбинация представляет следующие преимущества. Лечение некоторых нарушений, сопровождающихся болью или мышечной спастичностью, не обеспечивается в медицинской практике. Согласно полученным данным, отмеченным выше, комбинация толперизона и декстрометорфана с фиксированной дозой может привести к новой и более эффективной терапии в лечении нарушений, сопровождающихся болью или мышечной спастичностью. Фармацевтическая комбинация нашего изобретения проявляет значительный антиспастическое и обезболивающее действие в тестах на животных in vivo и in vitro, которое больше, чем сумма эффектов компонентов, измеренных по отдельности (то есть синергизм является сверх-аддитивным). Это указывает на то, что можно приготовить фармацевтические комбинации толперизон-декстрометорфан или эперизон-декстрометорфан, обладающие той же антиспастической эффективностью, но с более низкой метаболической нагрузкой (используя более низкие дозы), или более эффективные (при тех же дозах), чем толперизон или эперизон, когда они используются индивидуально. Результаты тестов на животных указывают на новое показание к применению комбинации - обез-5 007732 боливание, которое пока не входило в число показаний к применению и толперизона, и декстрометорфана. Следовательно, комбинация может быть использована не только для лечения спастических состояний, которые не могут быть вылечены при использовании монотерапии с использованием любого из двух соединений, но также для лечения болевых синдромов с различной этиологией. Пригодный диапазон соотношений двух компонентов зависит от метаболических свойств тестируемых видов. Пропорции комбинации могут находиться между 20:1 и 2:1, где толперизон и эперизон присутствуют в большем количестве. На людях мы получили обнадеживающие результаты при использовании комбинации толперизон-декстрометорфан в соотношении 5:1. Декстрометорфан и толперизон (или эперизон) не проявляют несовместимости, следовательно, может быть приготовлена фармацевтическая композиция, содержащая два активных ингредиента в определенных дозах и фармацевтически приемлемые носители. В соответствии с изобретением следующие примеры демонстрируют технологию составления нашей фармацевтической композиции. Пример 1. Мы гомогенизировали и гранулировали перечисленные в списке ингредиенты. Количество приготовленного гранулята является достаточным для приготовления 10 единиц в форме таблеток весом 1 г. Декстрометорфан 0,3 г Толперизон 1,5 г Лактоза 1,05 г Микрокристаллическая целлюлоза 0,55 гUAP (ультраамилопектин) 6,4 г Пример 2. Мы гомогенизировали и гранулировали перечисленные в списке ингредиенты. Количество приготовленного гранулята является достаточным для приготовления 10 единиц в форме таблеток весом 1 г. Декстрометорфан 0,15 г Толперизон 1,5 г Лактоза 1,05 г Микрокристаллическая целлюлоза 0,55 гUAP (ультраамилопектин) 6,55 г Пример 3. Мы гомогенизировали и гранулировали перечисленные в списке ингредиенты. Количество приготовленного гранулята является достаточным для приготовления 10 единиц в форме таблеток весом 1,5 г. Декстрометорфан 0,3 г Толперизон 3,0 г Лактоза 1,05 г Микрокристаллическая целлюлоза 0,55 гUAP (ультраамилопектин) 9,9 г Пример 4. Мы гомогенизировали и гранулировали перечисленные в списке ингредиенты. Количество приготовленного гранулята является достаточным для приготовления 10 единиц в форме таблеток весом 1 г. Декстрометорфан 0,6 г Толперизон 1,5 г Лактоза 1,05 г Микрокристаллическая целлюлоза 0,55 гUAP (ультраамилопектин) 6,1 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для лечения спастичности и/или боли, характеризующаяся тем,что композиция содержит терапевтически эффективное количество комбинации активных ингредиентов,представленной 70-95 мас.% вещества с формулой I, где R представляет собой метильную или этильную-6 007732 группу, и 5-30 мас.% декстрометорфана (химическое название: (+/-)-3-метокси-17-метилморфинан), и при необходимости фармацевтически приемлемый носитель 2. Фармацевтическая композиция по п.1, в которой вещество с формулой I, где R представляет собой метильную группу, представлено в количестве от 80 до 90 мас.%, а декстрометорфан представлен в количестве от 10 до 20 маc.%. 3. Фармацевтическая композиция по любому из предыдущих пунктов, где единица композиции содержит 150 мг толперизона и 30 мг декстрометорфана в смеси с фармацевтически приемлемыми носителями. 4. Фармацевтическая композиция по любому из пп.1-3, предназначенная для перорального применения. 5. Способ лечения и/или предотвращения спастичности и/или боли, который включает введение эффективного количества фармацевтической композиции по любому из пп.1-4.
МПК / Метки
МПК: A61P 21/02, A61K 31/4453, A61P 25/08, A61K 31/485
Метки: боли, мышечной, фармацевтическая, комбинация, лечения, спастичности
Код ссылки
<a href="https://eas.patents.su/8-7732-farmacevticheskaya-kombinaciya-dlya-lecheniya-myshechnojj-spastichnosti-i-ili-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая комбинация для лечения мышечной спастичности и/или боли</a>
Следующий патент: Способ получения сульфонамидных композиций экструдированных паст
Случайный патент: Гранулы липоевой кислоты












