С-2`гидроксил-бензил защищенный, n-карбамат защищенный(2r,3s)-3-фенилизосерин и способ его получения
Номер патента: 679
Опубликовано: 28.02.2000
Авторы: Свинделл Чарльз С., Систи Николас Дж., Чандер Мадхави С.
Формула / Реферат
1. Химическое соединение, имеющее формулу
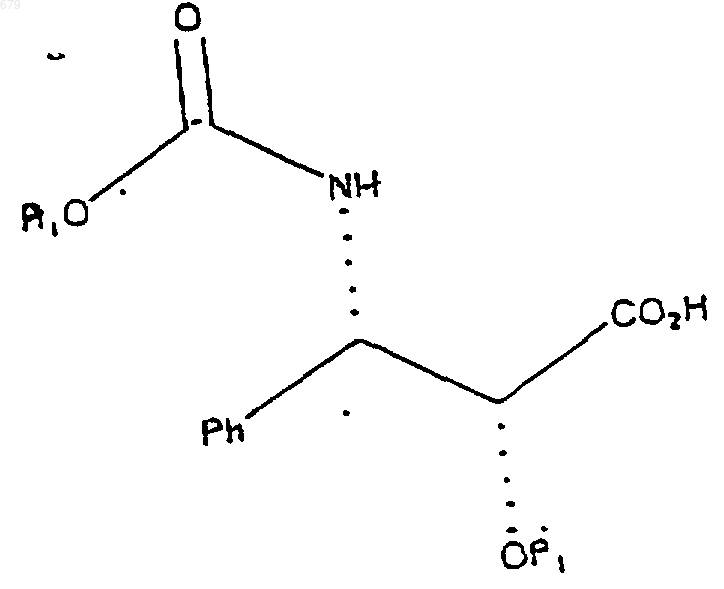
где P1 представляет собой гидрирующуюся бензильную защитную группу; a R1 представляет собой олефиновую или ароматическую группу или PhCH2.
2. Химическое соединение по п.1, в котором P1 выбран из группы, включающей бензил и бензилоксиметил.
3. Химическое соединение по п.1, имеющее формулу
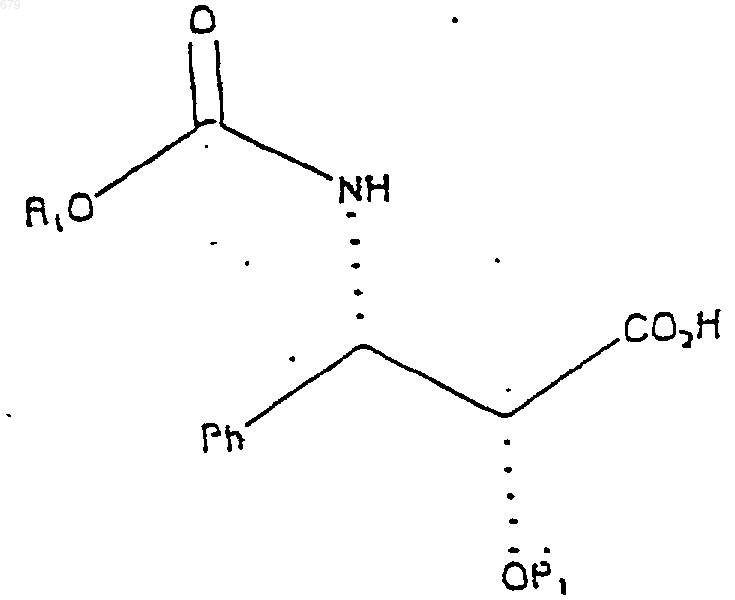
где P1 представляет собой гидрирующуюся бензильную защитную группу, а R1 представляет собой PhCH2.
4. Химическое соединение по п.3, где P1 выбран из группы, включающей бензил и бензилоксиметил.
5. Химическое соединение по п.4, в котором P1 представляет собой бензилоксиметил.
6. Способ получения бензилоксикарбонил защищенного С-2' гидроксилбензил защищенного (2R, 3S)-3-фенилизосерина, включающий следующие стадии:
а) взаимодействие этилового эфира (2R, 3S)-3-фенилизосерина с бензилхлорформиатом с получением N-бензилоксикарбонил защищенного этилового эфира (2R, 3S)-3-фенилизосерина, имеющего формулу
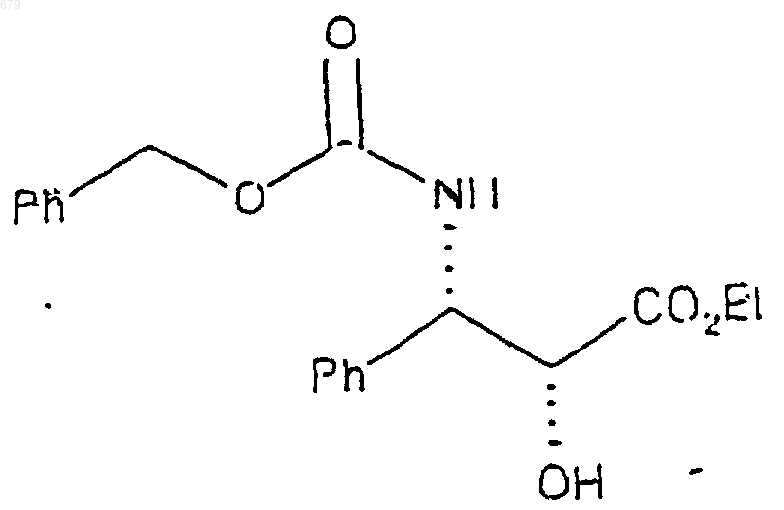
б) последующее замещение водорода у С-2' на гидрирующуюся бензильную защитную группу.
7. Способ по п.6, отличающийся тем, что гидрирующаяся бензильная защитная группа выбрана из группы, состоящей из бензила и бензилоксиметила.
8. Способ по п.6, отличающийся тем, что N-бензилоксикарбонил защищенный этиловый эфир (2R, 3S)-3-фенилизосерина вначале взаимодействует с основанием и хлоридом гидрирующейся бензильной защитной группы, где упомянутое основание выбрано из группы, состоящей из алкиллитиевых реагентов и оснований третичных аминов, с получением С-2' защищенного этилового эфира 3-фенилизосерина и последующим омылением С-2' защищенного этилового эфира гидроокисью щелочного металла.
9. Способ по п.8, отличающийся тем, что гидроокись щелочного металла представляет собой LiOH.
10. Способ по п.8, отличающийся тем, что стадию омыления С-2' защищенного этилового эфира проводят путем растворения этилового эфира С-2' защищенного 3-фенилизосерина в смеси этанола и воды и последующего добавления гидроксида щелочного металла.
11. Способ по п.8, отличающийся тем, что стадию защиты С-2' гидроксила N-бензилоксикарбонил защищенного этилового эфира (2R, 3S)-3-фенилизосерина проводят путем растворения N-бензилоксикарбонил защищенного этилового эфира (2R, 3S)-3-фенилизосерина в безводном ТГФ в атмосфере азота и последующего добавления сначала основания и затем хлорида бензильной защитной группы.
12. Способ по п.11, отличающийся тем, что стадию защиты С-2' гидроксила N-бензилоксикарбонил защищенного этилового эфира (2R, 3S)-3-фенилизосерина проводят при температуре не выше 0шС.
13. Способ по п.6, отличающийся тем, что стадию защиты С-2' гидроксила проводят путем растворения N-бензилоксикарбонил защищенного этилового эфира (2R, 3S)-3-фенилизосерина в безводном метиленхлориде и добавления к этому раствору основания и хлорида гидрирующейся бензильной защитной группы.
14. Способ по п.13, отличающийся тем, что раствор, основание и хлорид находятся в состоянии кипения.
Текст
1 Область изобретения Данное изобретение относится к полусинтезу таксола с использованием скелета защищенного баккатина III, который этерифицируют соответствующей кислотой с защищенной боковой цепью, получая промежуточный продукт, из которого после ацилирования и удаления защитных групп получают паклитаксел. Предпосылки создания изобретения Химическое соединение, известное в литературе, как таксол, и с недавних пор, как "паклитаксел", было рекомендовано для применения в химиотерапевтическом лечении некоторых различных видов опухолей, и клинические испытания показали, что паклитаксел потенциально обладает широким спектром сильных антилейкемических и ингибирующих опухоли активностей. Паклитаксел представляет собой природный таксановый дитерпеноид, имеющий формулу(Формула 1) Хотя паклитаксел обнаружен в некоторых видах тиса (род Taxus, семейство Тахасеае),концентрация данного соединения очень низка. Основой для синтеза паклитаксела служит баккатин III, и существует ряд других таксановых соединений, таких, как баккатин III, цефаломанин, 10-деацетилбаккатин III и т.д., некоторые из которых экстрагируются из тиса легче паклитаксела и с более высоким выходом. Специалисты в области органической химии затратили много усилий в попытках синтезировать молекулу паклитаксела. Для частичного синтеза паклитаксела требуется хиральная,нерацемическая боковая цепь и производные,богатый природный источник баккатина III или близко родственных дитерпеноидов и эффективный способ связывания этих двух составляющих. Этерификация этих двух фрагментов затруднена из-за труднодоступного С-13 гидроксила баккатина III, расположенного внутри вогнутой области полусферического таксанового скелета. Например, Green and GueritteVoegelein отметили только 50% превращение через 100 ч в частичном синтезе паклитаксела. J.Am. Chem. Soc., 1988, 110, 5917. Перспективный путь получения значительных количеств паклитаксела представляет собой полусинтез паклитаксела присоединением боковой цепи А-кольца к С-13 положению скелета природного баккатина III, полученного из различных таксанов, присутствующих в тисе. 2 описан частичный синтез паклитаксела из 10 деацетилбаккатина III. В U.S. Patent4929011, Denis et al, опубликованном 8 мая 1990 г., озаглавленном "Способ получения таксола", описан полусинтез паклитаксела конденсацией (2R, 3S) боковой цепи кислоты (защищенной гидроксизащитной группой у С 2') с таксаном баккатином III (защищенным гидроксизащитной группой у С 7). Затем продукт конденсации обрабатывают для удаления защитных групп. Гидроксизащитные группы скелета баккатина III представляют собой, например, триметилсилильный или триалкилсилильный радикал. Альтернативный полусинтез паклитаксела описывают в рассматриваемой одновременно заявке США S.N. 08/357,507 to Swindell et al. Эта заявка раскрывает полусинтез паклитаксела из скелета баккатина III конденсацией различных боковых цепей, где азот в СЗ' защищен в виде карбамата. По Swindell et al. желательно,чтобы защитные группы боковой цепи А-кольца представляли собой бензилоксикарбонил (БОК). После этерификации БОК защитные группы удаляли и замещали на PhCO, получая в результате паклитаксел. Этот способ позволяет получать вещество с более высоким выходом, чем вDenis et al. По Swindell et al, S.N. 08/357,507, в качестве защитных групп предпочтительно используют трихлорэтоксиметил или трихлорэтоксикарбонил. Бензилоксиметил (БОМ), однако, был упомянут, как возможная защитная группа для гидроксила боковой цепи, представляющей собой 3-фенилизосерин, но, в соответствии с описанным здесь способом, БОМ защитная группа не может быть удалена у труднодоступного С 2' гидроксила в присоединенной боковой цепи 3-фенилизосерина к части молекулы. По этой причине использование БОМ в качестве защитной группы для боковой цепи особенно не исследовалось.al, выданный 8 мая 1990 г., раскрывает способ получения производных баккатина III и 10 деацетилбаккатина III конденсацией кислоты с производными баккатинаIII или 10 деацетилбаккатина III, с последующим удалением защитных групп с помощью водорода. Некоторые синтезы TAXOTERE (Registered toRhone-Poulenc Sante) и родственных соединений описаны в Journal of Organic Chemistry: 1986, 51,46; 1990, 55, 1957; 1991, 56, 6939; 1992, 57, 4320; 1992, 57, 6387; и 993, 58, 255; а также в U.S. Patent5015744 to Holton от 14 мая 1991 г. описаны такие синтезы. Краткое описание изобретения Предметом настоящего изобретения является способ получения новой С-2' гидроксилбензил защищенной N-карбамат защищенной(2R, 3S)-3-фенилизосериновой боковой цепи,используемой в полусинтезе паклитаксела, а также способ ее получения. 3 Другим объектом настоящего изобретения является новый способ получения гидрирующейся бензилзащищенной боковой цепи Акольца, которая может быть легко присоединена к защищенному скелету баккатина III в процессе полусинтеза паклитаксела. Еще одним объектом настоящего изобретения является N-БОК защищенная С-2' гидроксил-бензил защищенная (2R, 3S)-3-фенилизосериновая боковая цепь и способ ее получения. Следующим объектом настоящего изобретения является разработка эффективного и доступного по цене способа получения N-БОК защищенной С-2' гидроксил-бензил защищенной(2R, 3S)-3-фенилизосериновой боковой цепи. В соответствии с настоящим изобретением получают химическое соединение, имеющее формулу: где P1 представляет собой гидрирующуюся бензильную защитную группу, a R1 представляет собой алкильную, олефиновую или ароматическую группу, или PhCH2, для последующего присоединения к защищенному скелету баккатина III в полусинтезе паклитаксела. В соответствии с настоящим изобретением Р 1 защитная группа в С-2' положении выбрана из группы,состоящей из бензила и бензилоксиметила. Предпочтительно Р 1 представляет собой бензилоксиметил, a R1 представляет собой PhCH2. Настоящее изобретение относится также к способу получения БОК защищенного, С-2' гидроксил-бензил защищенного(2R,3S)-3 фенилизосерина. Этот способ включает взаимодействие этилового эфира(2R,3S)-3-фенилизосерина с последующим замещением водорода у С-2' гидрирующейся бензильной защитной группой. Гидрирующаяся защитная группа выбирается из группы, состоящей из бензила и бензилоксиметила, предпочтительно бензилоксиметила. Способ получения включает взаимодействие N-БОК защищенного этилового эфира (2R,3S)-3-фенилизосерина с основанием и хлоридом гидрирующейся бензильной защитной группы либо с алкиллитиевым реагентом, либо с основанием третичного амина. Затем данный способ включает стадию омыления С-2' защищенного этилового эфира гидроокисью щелочного металла, например LiOH. Стадию омыления можно проводить растворением С-2' защищенного этилового эфира в смеси этанола и воды, после чего добавляют щелочь. 4 Далее проводят стадию защиты С-2' гидроксила N-БОК защищенного этилового эфира(2R, 3S)-3-фенилизосерина растворением соединения в безводном ТГФ и затем добавляют основание и хлорид бензильной защитной группы. Эту стадию предпочтительно проводить при температуре не выше 0 С. Альтернативно, стадию защиты С-2' гидроксила проводят растворением N-БОК защищенного этилового эфира(2R,3S)-3-фенилизосерина в безводном метиленхлориде, и затем к полученному раствору добавляют основание и хлорид гидрирующейся бензильной защитной группы. В этом случае раствор, основание и хлорид находятся в состоянии кипения. Эти и другие объекты данного изобретения станут более понятными после рассмотрения нижеследующего детального описания вариантов воплощения изобретения. Подробное описание вариантов воплощения изобретения Настоящее изобретение, в основном, относится к химическому процессу для эффективного получения паклитаксела, его промежуточных соединений и предшественников. Конкретнее,настоящее изобретение относится к полусинтезу паклитаксела этерификацией (соответствующим образом защищенных) 3-фенилизосериновых кислот, имеющих гидрирующиеся бензильные защитные группы у С-2' до С-13 гидроксила 7 О-защищенного баккатина III. В настоящем изобретении используют триэтилсилильную(ТЭС) защиту в С-7 положении. Общий способ,описанный здесь, включает получение С-7 ТЭС баккатина III, получение соответствующим образом защищенной 3-фенилизосериновой кислоты, имеющей гидрирующуюся бензильную защитную группу у С-2', конденсацию этих двух соединений, и последующее удаление защитных групп и ацилирование продукта конденсации с образованием паклитаксела. А. Получение С-7 ТЭС защищенного баккатина III В качестве исходной точки полусинтеза паклитаксела в соответствии с настоящим изобретением необходимо получение скелета баккатина III, к которому можно присоединить боковую цепь, подобную таковой у паклитаксела. Соответственно настоящему изобретению, желательно, чтобы этот скелет находился в форме основного скелета баккатина III, защищенного в С-7 положении ТЭС группой. Т.е. желательно получить промежуточный продукт реакции,имеющий формулу 5 Данное соединение далее будет упоминаться как ТЭС-защищенный баккатин III, а получение его можно осуществить различными способами, описанными в литературе. Один из этих способов описан Denis et al.,"A highly Efficient, Practical Approach to NaturalTaxol", Journal of the American Chemical Society,p. 5917 (1988). 10-Деацетилбаккатин III вначале превращают в С-7 ТЭС-защищенный 10 деацетилбаккатин III, затем его ацилируют по С-10 положению, получая С-7 ТЭС защищенный баккатин III. С-7 ТЭС защищенный 10 деацетилбаккатин III получают по следующей реакции: Реакция I 10-Деацетилбаккатин III взаимодействует с большим избытком ТЭС-С 1 и пиридина с образованиенм С-7 ТЭС защищенного 10-деацетилбаккатина III. Этот продукт затем ацилируют,используя избыток ацетил хлорида и пиридина,получая С-7 ТЭС баккатин III. Альтернативный эффективный способ получения С-7 ТЭС защищенного баккатина III описан в Kant et al., "A Chemo Selective Approach to Functionalize the C-10 Position of 10deacetylbaccatin III Synthesis and Biological Properties of Novel C-10 Taxol Analogs", Tetrahedron Letters, Vol.35,31, TP5543-5546(1994). В этой статье С-7 ТЭС защищенный С-10 гидрокси баккатин III получали по следующей реакции: Реакция 11 Здесь имидазол добавляют при перемешивании к раствору 10-диацетилбаккатина III в диметилформамиде (ДМФ) в атмосфере азота. Затем добавляют по каплям триэтилсилилхлорид (ТЭС-С 1) приблизительно в течение 5 мин. Полученный раствор перемешивают или активируют другим способом в течение 3 ч, затем реакцию останавливают водой и экстрагируют двумя порциями (объемами) либо диэтилового эфира, либо метил т-бутилового эфира, объединяют органические фазы и промывают их четырьмя порциями воды и одной порцией солевого раствора. Органический и водный слои разделяют, органический слой высушивают и упаривают в вакууме до получения неочищенного твердого вещества. Неочищенное твердое вещество затем перекристаллизовывают из смеси этилацетат/гексан и получают С-10 гидрокси С-7 ТЭС баккатин III. 6 Далее С-10 гидрокси С-7 ТЭС баккатин III ацилируют с получением С-7 ТЭС баккатина III в соответствии со следующей реакцией: Реакция III С-10 гидрокси С-7 ТЭС баккатин III растворяют в безводном тетрагидрофуране (ТГФ),и раствор охлаждают до температуры ниже -20 С в атмосфере азота. Затем по каплям добавляют н-бутил литий (1,6 М в гексане), и смесь перемешивают при пониженной температуре приблизительно в течение 5 мин. Затем по каплям добавляют ацетилхлорид, полученную смесь нагревают до 0 С в течение 5 мин и перемешивают при этой температуре приблизительно 1 ч. Реакцию останавливают водой, и смесь упаривают в вакууме, после чего остаток растворяют в этилацетате, промывают один раз водой и затем солевым раствором. Органический слой высушивают и упаривают в вакууме, остаток перекристаллизовывают из смеси этилацетат/гексан и получают С-7 ТЭС баккатин III в виде твердого вещества белого цвета. Выбранный электрофил представляет собой AcCl. Указанный в этой статье выход составляет 90%. Альтернативно, С-7 ТЭС защищенный баккатин III может быть получен непосредственно из баккатина III вместо описанного выше синтеза из 10-деацетилбаккатина III. Б. Получение N-карбамат защищенной С-2' гидроксил-бензил защищенной (2R,3S)-3 фенилизосериновой боковой цепи А-кольца Второй предшественник, необходимый для полусинтеза паклитаксела соответственно настоящему изобретению, представляет собой Nкарбамат-защищенную С-2' гидроксил-бензил защищенную Формула 3 где R1 представляет собой алкильную, олефиновую или ароматическую PhCH2 группу, а Р 1 представляет собой гидрирующуюся бензильную защитную группу. Предпочтительная гидрирующаяся бензильная защитная группа представляет собой бензилоксиметил (БОМ), хотя другие группы,включая бензил, тоже могут использоваться. Предпочтительная N-карбаматная защитная группа представляет собой бензилоксикарбонил (БОК). N-БОК защищенный этиловый эфир(2R,3S)-3-фенилизосерина получают из этилового эфира (2R,3S)-3-фенилизосерина в соответствии со следующей схемой реакции: Реакция IV Этиловый эфир (2R,3S)-3-фенилизосерина растворяли либо в смеси равных частей диэтилового эфира/воды, либо в смеси равных частей метил т-бутилового эфира/воды и раствор охлаждали до 0 С. Затем к раствору добавляли карбонат натрия и по каплям - бензилхлорформат в течение 5 мин, полученную смесь перемешивали при 0 С приблизительно 1 ч. После этого раствор выливали в воду и экстрагировали метиленхлоридом или этилацетатом. Органический слой отделяли, высушивали и упаривали в вакууме. Твердый остаток перекристаллизовывали из этилацетата:гексана и получали N-БОК защищенный этиловый эфир(2R, 3S)-3-фенилизосерина защищали с помощью гидрирующейся бензильной защитной группы различными способами. Например, один из них представлен на следующей схеме:N-БОК защищенный этиловый эфир (2R,3S)-3-фенилизосерина растворяли в безводном ТГФ в атмосфере азота и охлаждали до температуры такой как -40 С или -78 С на бане сухой лед/ацетон, затем по каплям добавляли алкиллитиевый реагент, например, н-бутиллитий,причем желательно, чтобы алкиллитиевый реагент имел алкил с неразветвленной цепью. В любом случае реакция лучше протекает при температуре не выше 0 С. Полученную смесьперемешивают около 10 мин. Затем по каплям добавляют бензилоксиметилхлорид (БОМ-Сl) в течение приблизительно 5 мин и смесь перемешивают от 2 до 5 ч при пониженной температуре. Затем раствор нагревают до 0 С и реакцию останавливают водой. Полученную смесь упаривают в вакууме, после чего остаток растворяют в этилацетате и промывают водой и солевым раствором. Органический слой высушивают, 000679 8 упаривают в вакууме, остаток перекристаллизовывают из смеси этилацетат:гексан или подвергают хроматографии, используя в качестве элюанта смесь этилацетат:гексан, и получают следующее соединение: Формула 5 Другой способ получения соединения формулы 5 включает растворение N-БОК защищенного этилового эфира(2R,3S)-3 фенилизосерина в безводном метиленхлориде. Далее добавляют основание третичного амина,например, диизопропилэтиламин, вместе с БОМ-Сl, смесь кипятят с обратным холодильником в течение 24 ч. В результате этой реакции получают N-БОК защищенный С-2' [гидроксил] защищенный этиловый эфир(2R,3S)-3 фенилизосерина, но эта реакция протекает гораздо медленнее, чем предпочтительный процесс, описанный выше. В некоторых случаях полученный защищенный этиловый эфир(2R,3S)-3 фенилизосерина формулы 5 можно легко превратить в N-БОК защищенное С-2'-O-БОМзащищенное (2R, 3S)-фенилизосерин гидрокси промежуточное соединение по следующей реакции: Реакция VI Защищенный этиловый эфир (2R,3S)-3 фенилизосерина растворяют в смеси этанол/вода (8:1). К этому раствору добавляют гидроксид лития (или другой подходящий гидроксид щелочного металла) и полученную смесь перемешивают в течение приблизительно 3 ч для омыления эфира. Затем смесь подкисляют и экстрагируют этилацетатом. Полученный органический слой отделяют, высушивают и упаривают в вакууме. Полученную кислоту затем выделяют и используют далее без дополнительной очистки. Эта кислота представляет собой боковую цепь, имеющую общую формулу: Формула 6 Бензил представляет собой еще один пример гидрирующейся бензильной защитной 9 группы, которую можно использовать вместо БОМ. Соединение формулы Формула 7 получают, как описано выше по схеме реакции Реакция VII БОК-защищенный этиловый эфир (2R, 3S)3-фенилизосерина растворяют в безводном ТГФ в атмосфере азота и охлаждают до температуры такой, как -40 С или -78 С, например, на бане со смесью сухой лед/ацетон, затем по каплям добавляют алкил литиевый реагент, такой, как н-бутил литий, причем желательно, чтобы алкиллитий имел алкил с неразветвленной углеродной цепью. Полученную смесь перемешивают около 10 минут. Затем по каплям добавляют бензил бромид (ВnВr) в течение 5 мин и смесь перемешивают в течение от 2 до 5 ч при пониженной температуре. После этого раствор нагревают до ОС и реакцию останавливают водой. Полученную смесь упаривают в вакууме,остаток растворяют в этилацетате и промывают водой и солевым раствором. Органический слой высушивают, упаривают в вакууме, остаток перекристаллизовывают из смеси этилацетат:гексан или подвергают хроматографии, используя в качестве элюента смесь этилацетат:гексан, и получают соединение формулы 10. Альтернативно соединение формулы 7 может быть получено по следующей схеме: Реакция VIII К перемешиваемому раствору NaH в безводном ДМФ в атмосфере азота в течение 5 мин добавляют соединение формулы 4, растворенное в ДМФ. Смесь перемешивают при 0 С в течение получаса. Затем в течение 5 мин по каплям добавляют бензил бромид (1,1 эквивалента), перемешивают 2 ч и реакцию останавливают водой. Затем добавляют либо диэтиловый эфир, либо метил т-бутиловый. Органический слой промывают четырьмя порциями воды, солевым раствором и затем высушивают и упаривают в вакууме, получая соединение формулы 10 10. Соединение формулы 7 может быть легко превращено в Формула 8 по реакции VI, описанной выше. В. Конденсация С-7 ТЭС защищенного баккатина III и боковой цепи Теперь можно проводить конденсацию боковой цепи, имеющей формулу 6 (или формулу 8), и С-7 ТЭС защищенного баккатина III различными способами. Например, эту конденсацию можно проводить в присутствии диизопропилкарбодиимида и диметиламинопиридина(ДМАП) в толуоле при 80 С в соответствии со следующей схемой реакции: Реакция IX С-7 ТЭС защищенный баккатин III (1 эквивалент) и боковую цепь, соответствующую формуле 9 (6 эквивалентов) растворяют в толуоле. К этой смеси добавляют ДМАП (2 эквивалента) и диизопропилкарбодиимид (6 эквивалентов), полученную смесь нагревают при 80 С в течение от 3 до 5 ч. Необходимо заметить, что диизопропилкарбодиимид можно заменять другими диалкилкарбодиимидами, например, дициклогексилкарбодиимидом (ДЦК). Затем раствор охлаждают до 0 С и оставляют при этой температуре на 24 ч. После чего реакционную смесь фильтруют, осадок промывают этиловым или метил т-бутиловым эфиром. Объединенные органические слои промывают соляной кислотой (5%), водой и солевым раствором. Органическую фазу отделяют, высушивают и упаривают в вакууме. Полученный остаток затем растворяют в смеси этилацетат:гексан и элюируют через слой силикагеля. Элюент затем упаривают в вакууме и получают следующее соединение: Формула 9 Г. Удаление защитных групп и ацилирование с получением паклитаксела 11 Соединение формулы 9 может быть превращено в паклитаксел в результате удаления БОК защитной группы и ацилирования боковой цепи, удаления ТЭС защитной группы и гидрирующейся бен-зильной защитной группы. Для осуществления этих процедур найдено несколько приемлемых способов, однако, необходимо проводить удаление ТЭС защитной группы в С 7 положении до удаления гидрирующейся бензильной группы в положении С-2'. В противном случае удаление гидрирующейся бензильной защитной группы в лучшем случае является затруднительным. В любом случае предпочтительный способ получения паклитаксела предполагает в первую очередь удаление БОК защитной группы в соответствии со следующей схемой реакции: Реакция Х Катализатор Перлмана, H2 (1 атм.),изопропанол; 2. Бензил хлорид, EtOAc, триэтиламин. Продукт конденсации формулы 9 растворяют в изопропаноле и добавляют катализатор Перлмана (Pearlman's catalyst). Полученную смесь перемешивают при давлении водорода,равном 1 атм., в течение 24 ч. Затем смесь фильтруют через диатомовую землю и упаривают в вакууме. Полученный остаток растворяют в этилацетате или толуоле и добавляют основание третичного амина, например, триэтиламин. Затем по каплям добавляют бензилхлорид, и смесь перемешивают в течение 2 ч. Полученную смесь промывают разбавленным раствором NаНСО 3, водой и солевым раствором. Полученную органическую фазу отделяют, высушивают и упаривают в вакууме, получая ацилированное соединение с удаленной БОК защитной группой, имеющее следующую формулу: 1. Формула 10 Далее в соединении формулы 10 удаляют защитную группу в С-7 положении в соответствии со следующей схемой реакции: Реакция XI Соединение формулы 10 растворяют в ацетонитриле (СН 3 СN) при 0 С, затем добавляют водный раствор фтористоводородной кислоты(40%) и перемешивают 10 ч при 0 С. Затем смесь разбавляют этилацетатом и промывают 12 насыщенным раствором NaHCO3, водой и солевым раствором. Органическую фазу отделяют,высушивают и упаривают в вакууме, получая соединение с удаленной защитной группой в С 7 положении, имеющее следующую формулу: Формула 11 И, наконец, у соединения формулы 11 удаляют гидрирующуюся бензильную (БОМ) защитную группу в С-2' положении, освобождая таким образом гидроксильную группу, и получают в результате целевой паклитаксел. Эту процедуру выполняют в соответствии со следующей схемой реакции: Реакция XII Альтернативно, соединение формулы 9 вначале растворяют в СН 3 СN при 0 С и добавляют водный раствор фтористоводородной кислоты (40%) для удаления ТЭС защитной группы в С-7 положении. В результате получают соединение, соответствующее формуле: Формула 12 Далее, БОК защитная группа может быть удалена способом, подобным описанному выше. Соединение формулы 15 растворяют в изопропаноле и добавляют катализатор Перлмана и трифторуксусную кислоту (ТРУК) (1 эквивалент). Смесь выдерживают при давлении водорода в 2,8 атм. (psi) при комнатной температуре приблизительно в течение четырех дней. В результате происходит удаление БОК защитной группы и образование С-2' БОМ защищенного паклитаксела в виде соли с трифторуксусной кислотой. Смесь фильтруют через диатомовую землю и упаривают в вакууме. Далее, к остатку добавляют основание и ацилирующий реагент. Соль С-2' БОМ защищенного паклитаксела и трифторуксусной кислоты растворяли в пиридине и добавляли либо бензил хлорид, либо ангидрид бензойной кислоты. В результате получали следующий продукт: Парра и добавляют катализатор Перлмана. Смесь гидрируют в течение 24 ч при 2,8 атм. водорода. Затем смесь фильтруют через диатомовую землю и упаривают в вакууме. Остаток затем подвергают колоночной хроматографии в соответствии с любой желаемой методикой или перекристаллизовывают из смеси этилацетат:гексан, получая целевой продукт паклитаксела. Таким образом, настоящее изобретение подробно описано в представленных выше примерах воплощения настоящего изобретения. Очевидно, что, хотя объем настоящего изобретения ограничен пунктами формулы, составленными с учетом известного уровня техники, могут быть сделаны модификации и изменения, не выходя за объем изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Химическое соединение, имеющее формулу где P1 представляет собой гидрирующуюся бензильную защитную группу; a R1 представляет собой олефиновую или ароматическую группу или PhCH2. 2. Химическое соединение по п.1, в котором P1 выбран из группы, включающей бензил и бензилоксиметил. 3. Химическое соединение по п.1, имеющее формулу где P1 представляет собой гидрирующуюся бензильную защитную группу, а R1 представляет собой PhCH2. 4. Химическое соединение по п.3, где P1 выбран из группы, включающей бензил и бензилоксиметил. 5. Химическое соединение по п.4, в котором P1 представляет собой бензилоксиметил. 6. Способ получения бензилоксикарбонил защищенного С-2' гидроксилбензил защищенного (2R, 3S)-3-фенилизосерина, включающий следующие стадии: а) взаимодействие этилового эфира (2R,3S)-3-фенилизосерина с бензилхлорформиатом с получением N-бензилоксикарбонил защищенного этилового эфира (2R,3S)-3-фенилизосерина, имеющего формулу б) последующее замещение водорода у С 2' на гидрирующуюся бензильную защитную группу. 7. Способ по п.6, отличающийся тем, что гидрирующаяся бензильная защитная группа выбрана из группы, состоящей из бензила и бензилоксиметила. 8. Способ по п.6, отличающийся тем, чтоN-бензилоксикарбонил защищенный этиловый эфир (2R, 3S)-3-фенилизосерина вначале взаимодействует с основанием и хлоридом гидрирующейся бензильной защитной группы, где упомянутое основание выбрано из группы, состоящей из алкиллитиевых реагентов и оснований третичных аминов, с получением С-2' защищенного этилового эфира 3-фенилизосерина и последующим омылением С-2' защищенного этилового эфира гидроокисью щелочного металла. 9. Способ по п.8, отличающийся тем, что гидроокись щелочного металла представляет собой LiOH. 10. Способ по п.8, отличающийся тем, что стадию омыления С-2' защищенного этилового эфира проводят путем растворения этилового эфира С-2' защищенного 3-фенилизосерина в смеси этанола и воды и последующего добавления гидроксида щелочного металла. 11. Способ по п.8, отличающийся тем, что стадию защиты С-2' гидроксила N-бензилоксикарбонил защищенного этилового эфира (2R,3S)-3-фенилизосерина проводят путем растворения N-бензилоксикарбонил защищенного этилового эфира (2R,3S)-3-фенилизосерина в безводном ТГФ в атмосфере азота и последующего добавления сначала основания и затем хлорида бензильной защитной группы. 12. Способ по п.11, отличающийся тем, что стадию защиты С-2' гидроксила N-бензилоксикарбонил защищенного этилового эфира (2R,3S)-3-фенилизосерина проводят при температуре не выше 0 С. 13. Способ по п.6, отличающийся тем, что стадию защиты С-2' гидроксила проводят путем растворения N-бензилоксикарбонил защищенного этилового эфира (2R,3S)-3-фенилизосерина в безводном метиленхлориде и добавления к этому раствору основания и хлорида гидрирующейся бензильной защитной группы. 14. Способ по п.13, отличающийся тем, что раствор, основание и хлорид находятся в состоянии кипения.
МПК / Метки
МПК: C07C 271/06
Метки: способ, с-2`гидроксил-бензил, защищенный, защищенный(2r,3s)-3-фенилизосерин, n-карбамат, получения
Код ссылки
<a href="https://eas.patents.su/8-679-s-2gidroksil-benzil-zashhishhennyjj-n-karbamat-zashhishhennyjj2r3s-3-fenilizoserin-i-sposob-ego-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">С-2`гидроксил-бензил защищенный, n-карбамат защищенный(2r,3s)-3-фенилизосерин и способ его получения</a>
Предыдущий патент: Промежуточное соединение для получения паклитаксела и способ получения промежуточного соединения
Следующий патент: Способ ингибирования меланомы.
Случайный патент: Комбинации для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом












