Гидрат гидрохлорида агомелатина и его получение
Номер патента: 22067
Опубликовано: 30.10.2015
Авторы: Чжан Пэн, Юй Сюй, Шань Ханьбинь, Чжу Сюэянь, Юань Чжэдун, Пань Хунюань
Формула / Реферат
1. Гидрат гидрохлорида агомелатина формулы (I)
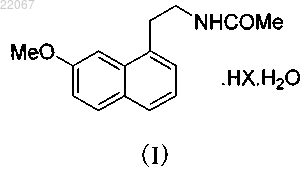
в которой X означает Cl,
в кристаллической форме, характеризующейся углом Брегга 2θ, межплоскостным расстоянием d и относительной интенсивностью в виде следующих данных:
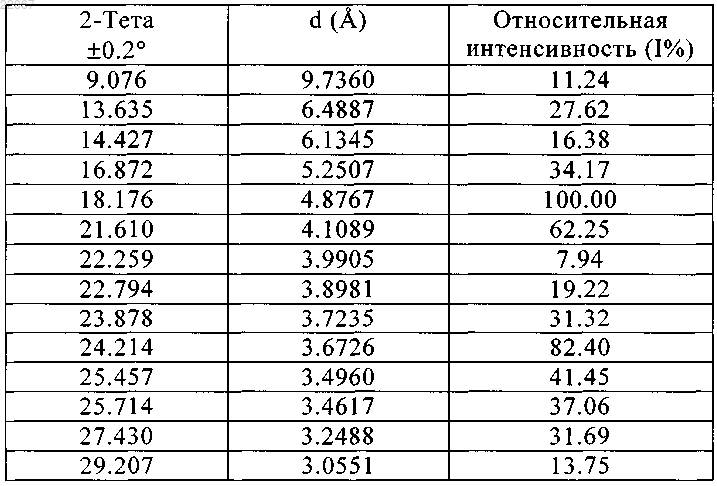
2. Способ получения гидрата гидрохлорида агомелатина по п.1, в котором агомелатин реагирует с HCl до получения гидрата гидрохлорида агомелатина.
3. Способ получения гидрата гидрохлорида агомелатина по п.2, в котором агомелатин реагирует с HCl в водном органическом растворителе до получения гидрата гидрохлорида агомелатина.
4. Способ получения гидрата гидрохлорида агомелатина по п.3, в котором агомелатин растворяют в органическом растворителе перед добавлением водного раствора HCl до осаждения кристаллического продукта.
5. Способ получения гидрата гидрохлорида агомелатина по п.4, в котором упомянутый водный раствор HCl добавляют по каплям.
6. Способ получения гидрата гидрохлорида агомелатина по п.3, в котором агомелатин добавляют к водному органическому растворителю, содержащему HCl, до осаждения кристаллического продукта.
7. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, который дополнительно включает промывание и сушку твердого вещества после кристаллизации.
8. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, в котором температура реакции составляет 0-20°C.
9. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, в котором упомянутый органический растворитель представляет собой этилацетат, метилацетат, н-бутилацетат, ацетон или ацетонитрил.
10. Способ получения гидрата гидрохлорида агомелатина по п.9, в котором упомянутый органический растворитель представляет собой этилацетат.
11. Фармацевтическая композиция, содержащая гидрат гидрохлорида агомелатина по п.1 в комплексе с фармацевтически приемлемыми вспомогательными веществами или наполнителями.
12. Применение гидрата гидрохлорида агомелатина по п.1 для лечения заболеваний мелатонинергической системы, нарушений сна, стресса, тревожности, сезонного аффективного расстройства, глубокой депрессии, сердечно-сосудистых заболеваний, заболеваний пищеварительной системы, инсомнии и усталости, вызванной нарушением суточного ритма организма, шизофрении, фобии или депрессивных болезней.
Текст
(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Изобретение относится к гидрату гидрохлорида агомелатина формулы (I), его получению и применению и к фармацевтической композиции, содержащей его. Гидрат гидрогалида агомелатина,полученный настоящим способом, обладает значительно увеличенной растворимостью по сравнению с агомелатином и таким образом является более подходящим для производства фармацевтических составов. К тому же, продукт обладает большей стабильностью и чистотой. Применяя настоящий способ, может быть получен продукт высокой чистоты простым способом без каких либо усложняющих стадий со следующей структурой формулы (I): Область изобретения Настоящее изобретение относится к гидрату гидрохлорида агомелатина, его получению и применению и к фармацевтической композиции, содержащей его. Промышленные предпосылки создания изобретения Агомелатин, или N-[2-(7-метокси-1-нафтил)этил]ацетамид, имеет структуру формулы (II). Он продается под торговым наименованием Valdoxan французкой компании Servier в качестве агониста мелатонина и антагониста рецептора 5HT2C. Он является первым антидепрессантом мелатонинового типа,предназначенным для лечения депрессии, улучшения сна и сексуальной функции. Ввиду его фармацевтической ценности важно получить соединение или его комплекс с лучшей чистотой, растворимостью и воспроизводимостью. Краткое описание изобретения Задача настоящего изобретения состоит в том, чтобы предоставить гидрат гидрохлорида агомелатина, характеризующийся превосходной растворимостью, стабильностью и чистотой, подходящими для применения в производстве фармацевтических составов, содержащих агомелатин. Когда изобретатели настоящего изобретения пытались очистить продукт агомелатина, мы неожиданно нашли, что агомелатин может образовывать физически и химически стабильный гидрат гидрохлорида агомелатина при перемешивании с соляной кислотой (HCl). Упомянутый гидрат гидрохлорида агомелатина является подходящим для производства фармацевтических составов. Когда применялись другие обычные неорганические кислоты (такие как серная кислота, фосфорическая кислота, перхлорная кислота) или органические кислоты (такие как уксусная кислота, щавелевая кислота, винная кислота,фумаровая кислота), не просто было получить гидрат или были получены гидраты с нестабильными физическими и химическими свойствами. Настоящее изобретение предоставляет гидрат гидрохлорида агомелатина со следующей структурой формулы (I): в которой X означает Cl. Настоящее изобретение также обеспечивает способ получения упомянутого гидрата гидрохлорида агомелатина, в котором агомелатин реагирует с HCl в любой форме до получения гидрата гидрохлорида агомелатина. Могут быть два процесса: агомелатин может быть растворен в водном органическом растворителе перед борбатированием через него газа HCl и осажденные кристаллы промывают и сушат или агомелатин может быть добавлен к раствору, содержащему HCl, и затем осажденные кристаллы промывают и сушат. Результаты повторяемых экспериментов показывают, что в первом способе избыточная подача HCl приводит только к низким выходам, в то время как во втором способе легче регулировать количество HCl в растворителе. Таким образом, второй способ является предпочтительным. В особенности, агомелатин также может быть добавлен к водному органическому растворителю перед тем, как добавляют по каплям растворитель, содержащий HCl, и осажденные кристаллы промывают и сушат. Альтернативно, агомелатин растворяют в органическом растворителе перед добавлением по каплям водного раствора HCl и осажденные кристаллы промывают и сушат. Температура реакции в настоящем изобретении может быть обычной температурой для таких реакций в уровне техники до тех пор, пока она ниже, чем точка кипения растворителя. Чтобы увеличить выход, предпочтительной является комнатная температура или ниже, температура ниже комнатной температуры более предпочтительная, и 0-20C наиболее предпочтительная температура. В вышеупомянутом способе получения для упомянутого гидрата гидрохлорида агомелатина органический растворитель не является в особенности ограниченным при условии, что он может растворять исходные материалы, агомелатин и HCl и в это же время предусматривает упомянутый гидрат гидрохлорида агомелатина находящимся в осадке. Подходящий растворитель, который может быть применен,включает этилацетат, метилацетат, н-бутилацетат, ацетон, ацетонитрил и подобное, и этилацетат является предпочтительным. Органические растворители с более высокой полярностью, такие как спирты (этанол и метанол и т.д.), DMF, DMSO, менее предпочтительны. Настоящее изобретение имеет преимущества в том, что изобретатели нашли, что среди такого количества обычных кислот агомелатин может реагировать с HCl, чтобы сформировать стабильный гидрат гидрохлорида агомелатина, физические свойства которого, такие как стабильность, растворимость и гигроскопичность, являются лучшими, чем таковые у продуктов агомелатина с другими обычными кислотами. Процесс также менее сложен, чем если бы применялась другая кислота. Гидрат гидрохлорида агомелатина, полученный согласно настоящему способу, обладает значительно увеличенной растворимостью по сравнению с агомелатином per se и таким образом является более подходящим для производства фармацевтических составов. Продукт обладает большей стабильностью,чистотой и растворимостью. К тому же, продукт с высокой чистотой может быть получен простым способом без каких-либо осложняющих стадий. Фармакологические тесты гидрата гидрохлорида агомелатина демонстируют, что он может быть применен для лечения заболеваний мелатонинергической системы, нарушений сна, стресса, тревожности, сезонного аффективного расстройства, глубокой депрессии, сердечно-сосудистых заболеваний, заболеваний пищеварительной системы, инсомнии и усталости, вызванной нарушением суточного ритма организма, шизофрении, фобии или депрессивных болезней. Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую гидрат гидрохлорида агомелатина изобретения в комплексе с фармацевтически приемлемыми вспомогательными веществами или наполнителями. Фармацевтическая композиция может быть составлена для различных путей введения, особенно для перорального введения или для инъекций. Подходящие дозировки могут быть приспособлены в зависимости от природы и тяжести заболеваний, которые будут лечиться, способа введения, возраста и веса больных. Дневная дозировка варьируется от 0.1 мг до 1 г и может быть введена как единственная доза или как несколько разделенных доз. Краткое описание чертежей Представительные примеры настоящего изобретения проиллюстрированы рисунками, чтобы лучше передать задачи, признаки и преимущества настоящего изобретения. Фиг. 1 показывает термограмму ТГА продукта примера 1 в настоящем изобретении. Фиг. 2 показывает порошковую рентгенограмму продукта примера 7 в настоящем изобретении. Примеры Пример 1. 1 г агомелатина добавляли к 20 мл EtOAc, 0.5 г водного раствора HCl (36%) добавляли по каплям при 10C. Смесь перемешивали на протяжении 1 ч, затем отфильтровывали и твердое вещество промывали дважды 2 мл EtOAc и сушили при 40C до получения 1 г белого твердого вещества (чистота: 99.9%; выход: 81.7%). Элементный анализ для Cl: вычисленные: Cl% (11.91 мас.%); найденные: Cl% (11.88 мас.%); Т.п.: 88-90C. Пример 2. 10 г агомелатина добавляли к 100 мл EtOAc и 4.6 г водного раствора HCl (36%) добавляли по каплям при 10C. Смесь перемешивали на протяжении 1 ч, затем отфильтровывали, твердое вещество промывали дважды 10 мл EtOAc и сушили при 40C до получения 10.2 г белого твердого вещества (чистота: 99.8%; выход: 88.7%). Элементный анализ для Cl: вычисленные: Cl% (11.91 мас.%); найденные: Cl% (11.86 мас.%); Т.п.: 88-90C. Пример 3. 1 г агомелатина растворяли в 10 мл EtOAc при перемешивании и концентрированную H2SO4 добавляли по каплям при комнатной температуре. Во время всего процесса осадок не выпал. Пример 4. 1 г агомелатина растворяли в 10 мл EtOAc при перемешивании и концентрированную H2SO4 добавляли по каплям при -10C. Во время всего процесса осадок не выпал. Пример 5. 1 г агомелатина растворяли в 10 мл EtOAc при перемешивании и по каплям добавляли ледяную уксусную кислоту при -10C. Во время всего процесса осадок не выпал. Пример 6. 1 г агомелатина растворяли в 10 мл EtOAc при перемешивании и по каплям добавляли фумаровую кислоту при -10C. Во время всего процесса осадок не выпал. Пример 7. 100 г агомелатина добавляли к 1 л EtOAc и 50 г водного раствора HCl (36%) добавляли по каплям при 10C. Смесь перемешивали на протяжении 1 ч, затем отфильтровывали, твердое вещество промывали дважды 100 мл EtOAc и сушили при 40C до получения 101 г белого твердого вещества (чистота: 99.7%; выход: 82.5%). Элементный анализ для Cl: вычисленные: Cl% (11.91 мас.%); найденные: Cl% (11.86 мас.%); Т.п.: 87-89C. Агомелатин, применяемый в вышеизложенных примерах, коммерчески доступен или может быть получен согласно способам, известным в уровне техники. Пример 8. Фармацевтическая композиция Способы детектирования и результаты. 1. Чистота образцов. Хроматографические условия: С 18 колонка; подвижная фаза: 10 ммоль/л фосфатный буфер (доведенный до pH 7.0 NaOH): ацетонитрил=2:7 (об./об.); температура колонки: 40C; длина волны детектирования: 220 нм; внутренний стандартный способ был применен на продуктах примеров 1 и 2. Растворы продуктов 1 мг/мл были приготовлены с подвижной фазой. 10 мкл каждого раствора инжектировали в жидкостную хроматографную систему и записывали хроматограммы. Результаты чистоты показаны в примерах 1 и 2. 2. Тест на стабильность. Некоторое количество продукта примера 1 помещали в термостат при 40C на 30 дней для определения его стабильности при помощи ВЭЖХ. Результаты показаны в следующей табл. 1. Таблица 1 3. Растворимость в воде. Применяя внешний стандартный способ, продукт примера 1 тестировали при помощи ВЭЖХ, сравнивая с агомелатином кристаллической формы II. Результаты показаны в следующей табл. 2. Таблица 2 Как видно, гидрат гидрохлорида агомелатина настоящего изобретения обладает лучшей растворимостью по сравнению с агомелатином per se в воде, в 0.1 N HCl, который подобен человеческой жидкости желудка, или в pH 7.0 буфере. Это означает, что образованное вещество обладает потенциалом более высокой биологической доступности, чем ранее известное вещество. 4. Анализ кристаллизационной воды. Вычисленное содержание воды в C15H17NO2HClН 2 О составляет 6.06 мас.%. 4.1. Способ Фишера (Appendix VIII М, Chinese Pharmacopoeia, 2010). Продукт примера 1 анализировали согласно упомянутому способу Фишера и найденное содержание воды было 6.15 мас.%. Продукт примера 7 анализировали согласно упомянутому способу Фишера и найденное содержание воды было 6.10 мас.%. 4.2. Термический гравитационный анализ (Appendix VIII Q, Chinese Pharmacopoeia, 2010). Продукт примера 1 анализировали согласно упомянутому способу ТГА и найденное уменьшение воды было 6.67 мас.%, что означает, что содержание кристаллизационной воды в продукте составляет 6.67 мас.%. Фиг. 1 показывает термограмму ТГА. Условия измерения для способа ТГА следующие: 5. Анализ структуры кристалла. Условия измерения для порошковой рентгенограммы продукта примера 7 в настоящем изобретении следующие. Параметры ДРА (дифракционный рентгеновский анализ) Порошковая рентгенограмма гидрата гидрохлорида агомелатина характеризуется углом Брегга 2,межплоскостным расстоянием d и относительной интенсивностью (1%) в виде следующих данных. Таблица 3 Когда кристалл настоящего изобретения измеряют рентгеновской дифракцией, могут присутствовать ошибки измерения для зарегистрированных пиков иногда из-за оборудования или примененных условий. В особенности, например, величина 2 иногда имеет ошибку приблизительно 0.2, а иногда имеет ошибку приблизительно 0.1, даже если используется очень точное техническое оборудование. Поэтому, идентифицируя структуру каждого кристалла, ошибка измерения должна быть принята во внимание. 6. Тест на стабильность гидрата гидрохлорида агомелатина. В этом тесте был применен способ для теста стабильности, как описано в Chinese Pharmacopoeia. В этом тесте было применено следующее: 1) тест действующими факторами (в открытом контейнере в течение 10 дней): высокая температура(60C), фотостабильность при сильном освещении (4500 лк), высокая влажность (92.5% ОВ при 25C); 2) ускоренные испытания (в закрытом контейнере в течение 6 месяцев): при 40C, влажность: 75% ОВ; 3) длительные испытания (в закрытом контейнере в течение 9 месяцев): при 25C, влажность: 60% ОВ. Таким образом, за исключением того, что содержание воды и содержание Cl гидрата гидрохлорида агомелатина уменьшены в очень тяжелых условиях, гидрат гидрохлорида агомелатина является стабильным при других условиях, особенно в ускоренном испытании и длительном испытании, что подходит для применения в фармацевтических составах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрат гидрохлорида агомелатина формулы (I) в которой X означает Cl,в кристаллической форме, характеризующейся углом Брегга 2, межплоскостным расстоянием d и относительной интенсивностью в виде следующих данных: 2. Способ получения гидрата гидрохлорида агомелатина по п.1, в котором агомелатин реагирует сHCl до получения гидрата гидрохлорида агомелатина. 3. Способ получения гидрата гидрохлорида агомелатина по п.2, в котором агомелатин реагирует сHCl в водном органическом растворителе до получения гидрата гидрохлорида агомелатина. 4. Способ получения гидрата гидрохлорида агомелатина по п.3, в котором агомелатин растворяют в органическом растворителе перед добавлением водного раствора HCl до осаждения кристаллического продукта. 5. Способ получения гидрата гидрохлорида агомелатина по п.4, в котором упомянутый водный раствор HCl добавляют по каплям. 6. Способ получения гидрата гидрохлорида агомелатина по п.3, в котором агомелатин добавляют к водному органическому растворителю, содержащему HCl, до осаждения кристаллического продукта. 7. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, который дополнительно включает промывание и сушку твердого вещества после кристаллизации. 8. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, в котором температура реакции составляет 0-20C. 9. Способ получения гидрата гидрохлорида агомелатина по п.4 или 6, в котором упомянутый органический растворитель представляет собой этилацетат, метилацетат, н-бутилацетат, ацетон или ацетонитрил. 10. Способ получения гидрата гидрохлорида агомелатина по п.9, в котором упомянутый органический растворитель представляет собой этилацетат. 11. Фармацевтическая композиция, содержащая гидрат гидрохлорида агомелатина по п.1 в комплексе с фармацевтически приемлемыми вспомогательными веществами или наполнителями. 12. Применение гидрата гидрохлорида агомелатина по п.1 для лечения заболеваний мелатонинергической системы, нарушений сна, стресса, тревожности, сезонного аффективного расстройства, глубокой депрессии, сердечно-сосудистых заболеваний, заболеваний пищеварительной системы, инсомнии и усталости, вызванной нарушением суточного ритма организма, шизофрении, фобии или депрессивных болезней.
МПК / Метки
МПК: A61K 31/165, A61P 25/24, C07C 231/12, C07C 233/18
Метки: агомелатина, гидрат, гидрохлорида, получение
Код ссылки
<a href="https://eas.patents.su/8-22067-gidrat-gidrohlorida-agomelatina-i-ego-poluchenie.html" rel="bookmark" title="База патентов Евразийского Союза">Гидрат гидрохлорида агомелатина и его получение</a>
Предыдущий патент: Гидрат гидробромида агомелатина и его получение
Следующий патент: Паразитицидные композиции, содержащие несколько активных агентов, способы и их применения
Случайный патент: Способ тестирования шаровых мельниц












