Промежуточные соединения для получения замещенных n-[аминоиминометил или аминометил)фенил]пропиламидов
Номер патента: 1932
Опубликовано: 22.10.2001
Авторы: Гертэн Кевин Р., Спада Альфред П., Кляйн Скотт И.
Формула / Реферат
1. Соединения, выбранные из группы
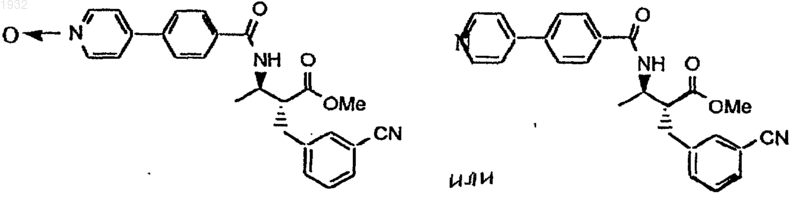
Текст
1 Настоящее изобретение относится к новым промежуточным соединениям для получения замещенных N-[(аминоиминометил или аминометил)фенил]пропиламидов, которые проявляют полезную фармакологическую активность и используются для лечения пациентов, страдающих определенными медицинскими нарушениями. Более конкретно, они являются ингибиторами фактора Ха и используются для лечения пациентов, страдающих от или подверженных состояниям, которые можно облегчить путем введения ингибитора фактора Ха. Фактор Ха является предпоследним ферментом в каскаде реакций коагуляции. Как свободный фактор Ха, так и фактор Ха, включенный в протромбиназный комплекс (фактор Ха,фактор Va, кальций и фосфолипид), оба ингибируются замещенными N-[(аминоиминометил или аминометил)фенил]-пропиламидами. Ингибирование фактора Ха достигается непосредственным комплексообразованием между ингибитором и ферментом, и поэтому не зависит от конфактора плазмы антитромбина III. Эффективного ингибирования фактора Ха достигают либо вводя соединение перорально, либо с помощью непрерывного внутривенного вливания,либо болюсного внутривенного введения, либо любым другим парэнтеральным способом, с помощью которого достигается нужный эффект предотвращения вызываемого фактором Ха образования тромбина из протромбина. Антикоагуляционная терапия показана для лечения и профилактики различных состояний,связанных с тромбозом, как венозных, так и артериальных сосудов. В артериальной системе ненормальное образование тромба, главным образом, связано с артериями коронарной, церебральной и периферической сосудистой системы. Заболевания, связанные с закупоркой тромбом этих сосудов включают, главным образом, острый инфаркт миокарда (AMI), нестабильную стенокардию, тромбоэмболию, закупорку сосудов, связанную с тромболитической терапией и чрескожной транслюминальной коронарной ангиопластикой (РТСА), преходящие ишемические приступы, перемежающаяся хромота и коронарное шунтирование (CABG) или шунтирование периферических артерий. Постоянная антикоагуляционная терапия также может быть благоприятной для предотвращения сужения просветов сосудов (рестеноз), который часто наблюдается после РТСА и CABG, а также для поддержания доступа к сосудам пациента в случае длительного гемодиализа. В отношении венозных сосудов, патологическое образование тромбов часто происходит в венах нижних конечностей после абдоминальной хирургии и операций на коленях и бедрах (тромбоз глубоких вен, DVT). Кроме того, DVT подвергает пациента дополнительному риску легочной тромбоэмболии. Системная диссеминированная внутрисосудистая коагулопатия (DIC) обычно 2 наблюдается в обеих сосудистых системах во время септического шока, при некоторых вирусных инфекциях и при раковых заболеваниях. Эти условия отличаются быстрым расходованием факторов коагуляции и их плазменных ингибиторов, что приводит к образованию закупорки микрососудов некоторых систем органов. Обсуждавшиеся ранее показания включают некоторые (но не все) возможные клинические ситуации, в которых оправдана антикоагуляционная терапия. Специалистам хорошо известны обстоятельства, требующие либо острой, антикоагуляционной терапии, либо терапии для хронической профилактики. Настоящее изобретение относится к новым соединениям которые являются промежуточными соединениями для получения замещенных N[(аминоиминометил или аминометил)фенил] пропиламидов общей формулы IR1 и R2 представляют водород, или, взятые вместе представляют =NR9;y1y2N-, где R10 представляет необязательно замещенный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, и где у 1 и у 2 независимо представляют водород или алкил; к его фармацевтически приемлемой соли,N-оксиду, гидрату или сольвату, которые используются для ингибирования выработки или физиологического влияния фактора Ха при лечении пациентов, страдающих болезненными состояниями, связанными с физиологически вредным избытком Ха фактора. Новые промежуточные соединения согласно настоящей заявке можно получить известными в этой области химии способами. Ниже приводятся способы получения заявляемых соединений. Пример 1. Соединение 1 К перемешиваемому раствору соли уксусной кислоты (R) - 3-аминомасляной кислоты 3 метилового сложного эфира (8,9 г, 50 ммолей) и триэтиламина (Et3N) (21 мл, 150 ммолей) в сухом метиленхлориде (CH2Cl2) в атмосфере азота при комнатной температуре добавляют ди-трет.бутил-карбонат (ВОС 2 О) (21,8 г, 100 ммолей) по каплям. Затем добавляют 4-диметиламинопиридин (ДМАР) (примерно 50 мг), и полученную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь промывают насыщенным раствором бикарбоната натрия(NaHCO3). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Сырой продукт очищают хроматографическиEtOAc) в гексанах) до получения соединения 197. 1 Н NMR (CDCl3, d): 4.92 (bs, 1H), 3.96 (bm,1 Н), 3.65 (s, 3H), 2.45-2.37 (m, 2H), 1.39 (s, 9 Н),1.16 (d, J=7.9 Hz, 3H). Пример 2. Соединение 2 К перемешиваемому раствору соединения 1 (2,00 г, 9,21 ммоля) в 50 мл сухого тетрагидрофурана в атмосфере азота при -78 С добавляют литийгексаметилдисилазана (LHMDS) раствор (25,8 мл 1,0 М раствор в ТГФ) по каплям. Затем полученную смесь нагревают вплоть до-20 до -25 С в течение 30 мин, а затем снова охлаждают до -78 С. Затем прикапывают раствор 3-цианобензилбромида (4,51 г, 23,0 ммоля) в сухом ТГФ, и полученному раствору дают нагреться до комнатной температуры. Через час при этой температуре смесь гасят насыщенным раствором NаНСО 3 и большую часть ТГФ удаляют в вакууме. Остаток помещают в CH2Cl2 и промывают водой. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Сырой продукт очищают хроматографически (элюент=25% этилацетат/гексаны). Полутврдый остаток тщательно растирают с 20%EtAc/гексанами, и отфильтровывают белое тврдое вещество. Полученный фильтрат концентрируют в вакууме до получения соединения 2. 1 Н NMR (CDCl3, d): 7.25-7.50 (m, 4H), 5.21 К перемешиваемому раствору соединения 2 (4,20 г, 12,7 ммоля) в 10 мл CH2Cl2 в атмосфере азота при комнатной температуре добавляют 20 мл трифторуксусной кислоты. Полученную смесь перемешивают в течение ночи при комнатной температуре, а затем концентрируют в 4 вакууме до получения 4,20 г соединения 3 в виде соли трифторуксусной кислоты. 1 Н NMR (DMSO-d6, d): 8.07 (bs, 1H), 7.737.43 (М, 4 Н), 3.50 (S, 3 Н), 3.51 (М, 1 Н), 3.05-2.82 4'-Пиридил-4-фенилкарбонилхлорид (384 мг, 1,8 ммоля) добавляют одной порцией к раствору соли ТФК соединения 3 (373 мг, 1,6 ммоля) и Et3N (0,67 мл, 4,8 ммоля) в 5,0 мл абсолютного EtOH в атмосфере азота при комнатной температуре. Полученную смесь перемешивают в течение ночи при этой температуре. Растворитель удаляют в вакууме, а сырой продукт очищают хроматографически на силикагеле (элюент=70% EtAc/гексаны) до получения целевого продукта. 1 Добавляют мета-хлорпербензойную кислоту (мСРВА) (381 мг, 2,21 ммоля) к раствору соединения, полученному в примере 4 (608 мг,1,47 ммоля) в 10 мл CH2Cl2 в атмосфере азота при комнатной температуре. Полученную смесь перемешивают в течение ночи при комнатной температуре. В этот момент смесь разбавляютCH2Cl2 и промывают 5% раствором Nа 2 СО 3. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют до получения целевого соединения. Масс-спектр: М+ + Н+ (рассчитано 430; найдено 430 (бомбардировка быстрыми атомами. Далее следуют примеры получения биологически-активных соединений исходят из соединений 4 и 5. Пример 6. Cоединение 6, описываемое общей структурной формулой I Газообразный сероводород (H2S) барботируют в раствор соединения 4 (498 мг, 1,21 ммоля) в 5,0 мл пиридина и 1,0 мл Et3N примерно в течение 2 мин. Полученную смесь перемеши 5 вают в течение ночи при комнатной температуре, а затем концентрируют досуха в потоке азота. Остаток помещают в 5 мл CH2Cl2 и добавляют 5 мл метилиодида. Полученную смесь кипятят с обратным холодильником в течение 3 ч,оставляют охладиться до комнатной температуры и концентрируют в вакууме. Остаток помещают в 5 мл сухого МеОН и добавляютNH4OAc (300 мг). Полученную смесь кипятят с обратным холодильником в течение 3 ч, а затем концентрируют в вакууме. Сырой продукт очищают с помощью ВЭЖХ с обращенной фазой(СН 3 СN/Н 2 О, 0,1% ТФК, градиент: 10% до 100% СН 3 СN), и фракции, содержащие продукт,лиофилизируют до получения соединения 6. 1 Барботируют газообразный хлористый водород (НСl) (г) в раствор соединения 5 (480 мг) в 5,0 мл сухого метанола, содержащего молекулярные сита (3) (таблетки, примерно 50 мг) в течение около 2 мин при комнатной температуре. Полученную смесь перемешивают в течение ночи при комнатной температуре, а затем концентрируют в вакууме. Добавляют раствор аммиака в МеОН (5,0 мл 7 н. раствора), и полученную смесь кипятят с обратным холодильником в течение 1 ч. Растворитель удаляют в вакууме, а сырой продукт очищают с помощью ВЭЖХ с обращенной фазой (СН 3 СN/Н 2 О, 0,1% ТФК,градиент: 10% до 100% CH3CN), и фракции,содержащие продукт, лиофилизируют до получения соединения 7. 1 Н NMR (MeOH-d4, d): 8.42 (m, 2 Н), 8.007.85 (m, 6H), 7.68-7.47 (m, 4H), 4.47 (m, 1H), 3.60 В результате обработки соединения 4 по способу примера 7, приведенного выше получают после очистки с помощью ВЭЖХ с обращенной фазой, соединение 8. К перемешиваемому раствору метоксида натрия МеОН (12,4 мл, 0,5 М раствор) добавляют гидроксиамингидрохлорид. После того, как растворяется его твердая часть, этот раствор добавляют к раствору соединения 5 (530 мг,1,24 ммоля) в 5 мл МеОН при комнатной температуре в атмосфере азота в течение ночи. В этот момент растворитель удаляют в вакууме, а полученный продукт очищают с помощью флешхроматографии (элюент=10% MeOH/CH2Cl2). Фракции, содержащие продукт, концентрируют в вакууме, а остаток затем лиофилизируют из воды, получая соединение 9. 1(m, 12H), 5,80 (bs, 1H), 4.40 (m, 1H), 4.45 (s, 3 Н),3.15-2.80 (m, 3H), 1.15 (d, J=7.9 Hz, 3 Н). Масс-спектр с бомбардировкой быстрыми атомами: M+ + Н+ рассчитано 463, найдено 463. Соединения, полученные из заявленных новых промежуточных соединений 4 и 5, как показано ниже ингибируют коагуляцию крови за счт способности ингибировать предпоследний фермент в каскаде коагуляции, скорее фактор Ха, чем тромбин. Ингибируются при этом как свободный фактор Ха, так и фактор Ха, участвующий в комплексе протромбиназы (Фактор Ха, фактор Va, кальций и фосфолипид). Ингибирование фактора Ха происходит в результате непосредственного образования комплекса между ингибитором и ферментом, и поэтому не зависит от кофактора антитромбина III плазмы. Эффективное ингибирование фактора Ха достигается за счет введения соединений перорально,непрерывными внутривенными вливаниями,внутривенными введениями болюсов, или любым другим парэнтеральным способом, который достигает нужного эффекта предотвращения образования тромбина из протромбина, вызываемого фактором Ха. Антикоагулянтная терапия предписана для лечения и профилактики различных тромботических состояний как венозной, так и артериальной сосудистой системы. В артериальной системе ненормальное тромбообразование,главным образом, связано с артериями коронарной, церебральной и периферической сосудистых систем. Заболевания, связанные с тромботической закупоркой этих сосудов включают острый инфаркт миокарда (AMI), нестабильную стенокардию, тромбоэмболию, острую закупорку сосудов, связанную с тромболитической терапией и чрескожной транслюминальной ангиопластикой (РТСА), кратковременные приступы ишемической болезни, удар, перемежающуюся хромоту и коронарное шунтирова 7 ние (CABG) или шунтирование периферических артерий. Хроническая антикоагулянтная терапия может также быть благоприятной для предотвращения сужения просветов сосудов (рестеноза), которая часто наблюдается после РТСА иCABGe и для поддержания доступа в раскрытый сосуд при длительном гемодиализе пациентов. Что касается венозной сосудистой системы,то патологическое образование тромбов часто наблюдается в венах нижних конечностей после абдоминальной хирургии или операций на колене или на бедре (глубоких вен тромбоз, DVT). Кроме того, DVT свидетельствует о предрасположенности пациента к лгочной тромбоэмболии. Системная диссеминированная внутрисосудистая коагулотерапия (DIC) обычно осуществляется в обеих сосудистых системах во время септического шока, некоторых вирусных инфекций и раковых заболеваний. Это состояние характеризуется быстрым расходованием факторов коагуляции и их плазменных ингибиторов, что приводит к образованию тромбина через микрососудистую систему систем некоторых органов. Показания, обсуждавшиеся ранее,включают некоторые (но не все) возможные клинические состояния, при которых оправдана антикоагулянтная терапия. Специалистам в этой области хорошо известны обстоятельства, при которых требуется активная или хроническая профилактическая антикоагулянтная терапия. Эти соединения можно использовать отдельно или в сочетании с другими диагностическими, антикоагулянтными, антитромбоцитными или фибролитическими агентами. Так, например, дополнительное введение ингибиторов фактора Ха со стандартным гепарином, гепарином низкого молекулярного веса, непосредственными ингибиторами тромбина (т.е. гирудином), аспирином, антагонистами рецепторов фибриногена, стрептокиназой, урокиназой и/или активатором тканевого плазминогена, может привести к высокой антитромботической или тромболитической эффективности. Описанные здесь соединения можно вводить для лечения тромботических осложнений у различных животных, например, приматов, включая человека,овец, лошадей, крупного рогатого скота, свиней,собак, крыс и мышей. Ингибирование фактора Ха полезно не только для антикоагуляционной терапии индивидуумов с тромботическими состояниями, но также полезно во всех случаях,когда требуется ингибирование коагуляции крови, например, для предотвращения коагуляции полной крови, предназначенной для хранения, и для предотвращения коагуляции в других биологических образцах для тестирования или хранения. Так, любой ингибитор фактора Ха можно добавлять к или контактировать с любой средой, содержащей или подозреваемой в содержании фактора Ха и для которой желательно ингибировать коагуляцию крови. 8 В дополнение к их использованию при антикоагуляционной терапии, ингибиторы фактора Ха могут найти применение при лечении или для предотвращения других заболеваний, при которых выработка тромбина признана как играющая патологическую роль. Так например,предполагают, что тромбин вносит вклад в патологию и смертность таких хронических и дегенеративных заболеваний как артриты, рак,атеросклероз и болезнь Альцгеймера, за счт их способности регулировать многие типы различных клеток за счт специфического расщепления и активации рецепторов тромбина поверхностных клеток. Ингибирование фактора Ха может эффективно блокировать образование тромбина и поэтому нейтрализовать любые патологические эффекты тромбина на различных типах клеток. Соединения, полученные из промежуточных соединений настоящего изобретения можно обычно вводить парэнтерально, внутривенно,подкожно, внутримышечно, через ободочную кишку, назально, внутрибрюшинно, ректально или перорально. Они могут находится в форме, обеспечивающей возможность введения большинством удобных способов, который удобен для использования в медицине или ветеринарии. Активные соединения могут входить в состав композиций,которые готовят обычными способами, используя один или более из фармацевтически приемлемых адъювантов или эксципиентов. Адъюванты включают, (наряду с другими) разбавители, стерильные водные среды и различные нетоксичные органические растворители. Композиции могут иметь форму таблеток, пилюль,гранул, порошков, водных растворов или суспензий, растворов для инъекций, эликсиров или сиропов, и могут содержать один или более из агентов, выбранных из группы, включающей подслащивающие агенты, вкусовые добавки,красители или стабилизаторы для получения фармацевтически приемлемых препаратов. Выбор носителя и содержание активного вещества в носителе обычно определяют в соответствии с растворимостью и химическими свойствами продукта, конкретным способом введения и прописями, соответствующими фармацевтической практики. Так, например, для приготовления таблеток можно использовать такие эксципиенты, как лактоза, цитрат натрия,карбонат кальции, дикальцийфосфат, и такие разрыхлители, как крахмал, альгиновые кислоты и некоторые комплексы силикатов, вместе с такими смазывающими агентами, как стеарат магния, натрийлаурилсульфат и тальк. Для приготовления капсул удобно использовать лактозу и высокомолекулярные полиэтиленгликоли. Если используют водные суспензии, они могут содержать эмульгирующие агенты, или агенты,которые облегчают суспендирование. Можно также использовать такие разбавители, как са 9 хароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин и хлороформ или их смеси. Для парэнтерального введения используют эмульсии, суспензии или растворы продуктов в соответствии с настоящим изобретением в растительном масле, например, в кунжутном масле,арахисовом масле или оливковом масле, или такие водно-органические растворы, как вода и пропиленгликоль, такие сложные органические эфиры для инъекций, как этилолеат, а также стерильные водные растворы фармацевтически приемлемых солей. Растворы солей полученных соединений особенно удобны для внутримышечных или подкожных инъекций. Водные растворы, которые также включают растворы солей в чистой дистиллированной воде, можно использовать для внутривенных введений при условии, что их рН установлен соответствующим образом и что они соответствующим образом буферированы и им придана изотоничность с помощью достаточного количества глюкозы или натрийхлорида, и что они стерилизованы с помощью нагревания, облучения или микрофильтрации. Процент активного ингредиента в композициях может меняться, причм необходимо,чтобы он был в таком количестве, чтобы была достигнута соответствующая доза. Очевидно,что несколько единичных дозовых форм можно вводить в одно и то же время. Используемую дозу должен определять врач, и она зависит от желательного терапевтического эффекта, способа введения и длительности лечения, а также от состояния пациента. Для взрослых дозы обычно составляют от около 0,01 до около 100, предпочтительно, от около 0,01 до около 10 мг/кг веса тела в день для ингаляций, от около 0,01 до около 100, предпочтительно, от около 0,1 до 70,и особенно предпочтительно от 0,5 до 10 мг/кг веса в день при пероральном приме, и от около 0,01 до около 50, предпочтительно, от около 0,01 до 10 мг/кг веса в день при внутривенном введении. В каждом конкретном случае доза определяется в соответствии с факторами, характеризующими пациента, такими как возраст,вес, общее состояние и другие характеристики,которые могут повлиять на эффективность лекарственного препарата. Некоторые пациенты могут быстро реагировать на более высокие или более низкие дозы,а могут находить подходящими гораздо более слабые поддерживающие дозы. Для других пациентов может понадобиться более длительное лечение, составляющее от 1 до 4 доз в день в соответствии с физиологическими потребностями каждого конкретного пациента. Обычно активный препарат можно вводить перорально 1-4 раза в день. При этом для других пациентов необходимо прописывать не более одной-двух доз в день. Соединения, полученные исходя из предлагаемых промежуточных, демонстрируют за 001932 10 метные фармакологические активности в соответствии с тестами, описанными в литературе и далее в описании, причм считают, что эти тесты коррелируют с фармакологическими активностями у людей и других млекопитающих. Ферментный анализ Способность соединений действовать в качестве ингибиторов фактора Ха, тромбина,трипсина, активатора тканеплазминогена (т-РА),активатора урокиназы-плазминогена (u-РА),плазмина и активированного протеина С оценивают, определяя концентрацию ингибитора,которая приводит к потере 50% активности фермента (ИК 50) при использовании очищенных ферментов. Все ферментные анализы осуществляют при комнатной температуре в 96-ячеечных микротитровальных пластинах, используя конечную концентрацию фермента 1 н. М. Концентрации фактора Ха и тромбина определяют с помощью титров активных сайтов, а концентрации всех других ферментов основаны на концентрациях протеина, поставляемого изготовителем. Соединения, полученные из соединений 4 и 5 настоящего изобретения, растворяют в ДМСО, разбавляют соответствующими буферами и анализируют при максимальной конечной концентрации ДМСО 1,25%. Разбавления соединений добавляют в ячейки, содержащие буфер и фермент и предварительно уравновешенные в течение 5-30 мин. Реакции ферментов инициируют, добавляя субстрат, и окраску, которую проявляют с помощью гидролиза пептидр-нитроанилидных субстратов, непрерывно регистрируют и течение 5 мин на 405 нм с помощью Vmax считывающего с микропластин устройства (Molecular Devices). В этих условиях во всех анализах используются менее 10% субстрата. Измеренные начальные скорости используют для расчта количества ингибитора,который приводит к 50% снижению контрольной скорости (ИК 50). Кажущиеся величины Ki определяют затем в соответствии с уравнениемCheng-Prusoff (ИK50=Ki[1+[S]/Км]), предполагая кинетики конкурирующего ингибирования. Дополнительный ин витро анализ можно использовать для оценки эффективности соединений настоящего изобретения в плазме здорового человека. Время частичного активирования тромбопластина является основанным на плазме анализом коагуляции, который основан на ин ситу выработке фактора Ха, его включений в протромбиназный комплекс и последующее образование тромбина и фибрина, что, в конечном счте, приводит к образованию сгустка, как конечного результата анализа. Этот анализ в настоящее время используют в клиниках для регистрации экс виво эффектов, обычно используемого антикоагулянтного лекарства - гепарина, а также в качестве непосредственно действующих антитромбиновых агентов, подлежащих клинической оценке. Поэтому активность в 11 этом ин витро анализе рассматривают как суррогатный маркер для ин виво антикоагуляционной активности. Анализ коагулирования, основанный на человеческой плазме Времена коагуляции частично активированного тромбопластина определяют в дубликате на приборе MLA ELECTRA 800. Объм 100 мкл собранной плазмы здорового человека, обработанной цитратом (George King Biomedical) добавляют в кювету, содержащую 100 мкл соединения настоящего изобретения в Tris/NaCl буфере (рН 7,5), и помешают в прибор. После трехминутного нагревания прибор автоматически добавляет 100 мкл активированного цефалопластинового реагента (Actin, Dade), а затем 100 мкл 0,035 М CaCl2 для инициирования реакции коагуляции. Образование сгустков определяют спектрофотометрически и оно измеряется секундами. Эффективность соединения количественно выражают как концентрацию, необходимую для удвоения времени контрольного коагулирования для человеческой плазмы без указанных соединений. Соединения можно оценить по их ин виво антитромботической активности этих соединений на моделях различных животных в качестве примеров венозного тромбоза у человека и артериального тромбоза соответственно. Экспериментальная модель венозного тромбозаin vivo на кроликах Это хорошо охарактеризованная модель венозного тромбоза с большим количеством фибрина, которая принята в литературе, и, как показано, является чувствительной к ряду антикоагулянтных препаратов, включая гепаринThrombosis and Haemostasis) 71,214-219 (1994). Эту модель используют с целью оценки способности соединений предотвращать образование венозных тромбов (сгустков) ин виво, образующихся в местах поражений и частичного стаза в яремной вене. Самцов и самок белых Новозеландских кроликов весом 1,5-2 кг анестезируют 35 мг/кг кетамина и 5 мг/кг ксилазина в объме 1 мг/кг(внутримышечно). В правую яремную вену вводят канюлю для вливания анестетика (кетамин/ксилазин 17/2,5 мг/кг/ч при скорости примерно 0,5 мл/ч) и введение тестовых соединений. В правую сонную артерию вводят канюлю для регистрации кровяного давления и отбора образцов крови. Температуру тела поддерживают при 39 С с помощью GAYMAR-T-PUMP. Левую внешнюю яремную вену изолируют и все боковые разветвления вдоль, и открытые 2-3 см сосуда перевязывают. Во внутреннюю ярем 001932 12 ную вену вводят канюлю как раз над бифуркацией общей яремной вены, и кончик канюли продвигают проксимально к этой общей яремной вене. 1 сантиметровый сегмент вены изолируют нетравматическими зажимами для сосудов, и относительный стеноз образуется в результате наложения лигатуры вокруг вены с помощью 18G иглы непосредственно ниже дистального зажима. Выделенный сегмент осторожно промывают физиологическим раствором 2-3 раза через канюлю во внутренней яремной вене. После этого изолированный сегмент заполняют 0,5 мл 0,5% полиоксиэтиленового эфира (W-1) в течение 5 мин. W-1 представляет собой детергент, который разрушат слой эндотелиальных клеток сегмента, тем самым создавая тромбогенную поверхность для инициации образования сгустка. Спустя 5 мин W-1 удаляют из сегмента и этот сегмент снова осторожно промывают физиологическим раствором 2-3 раза. Затем зажимы с сосудов удаляют, восстанавливая кровоток через эту часть сосуда. Сгустку дают образовываться и расти в течение 30 мин, после чего вену отрезают сразу под лигатурой, обеспечивающей сужения, и исследуют в отношении потока крови (отсутствие кровотока регистрируют как полную закупорку). Затем весь изолированный сегмент вены лигируют, и образовавшийся сгусток удаляют и взвешивают(вес во влажном состоянии). Влияние тестируемых агентов на окончательный вес сгустков используют как основной результат. Животных поддерживают ещ дополнительно в течение 30 мин для получения окончательных фармакодинамических измерений антикоагуляции. Введение лекарства начинают за 15 мин до поражения сосуда W-1, и продолжают во время всего периода образования сгустка и его вызревания. Для оценки параметров гемостаза отбирают три образца (по 3 мл каждый), один непосредственно перед введение W-1; второй через 30 мин после удаления зажимов сосудов, а третий по окончании эксперимента. Антитромботическую эффективность выражают как уменьшение веса конечного сгустка в препаратах, обработанных соединением по отношению к сосудам животных, обработанных контрольным препаратом. Экспериментальная модель ин виво артериального тромбоза у крыс Антитромботическую эффективность ингибиторов фактора Ха против артериального тромбоза с высоким содержанием тромбоцитов можно оценить, используя хорошо известную модель FеСl2-индуцированного тромбоза в сонной артерии крыс.and E.F. Heminger. Thrombosis Research 64, 405412 (1991). Эту модель широко используют для оценки антитромбического потенциала различных агентов, включая гепарин, и непосредственного действия ингибиторов тромбина. Крыс штамма Sprague Dawley весом 375450 г анестезируют пентобарбиталом натрия (50 мг/кг внутрибрюшинно). После достижения приемлемого уровня анестезии, внутреннюю поверхность шеи бреют и подготавливают для асептической операции. Присоединяют электроды для снятия электрокардиограммы, и второй канал регистрируют на протяжении всего эксперимента. В правую бедренную вену и артерию вводят канюлю с РЕ-50 трубочкой для введения соединения и для получения образцов крови и регистрации кровяного давления, соответственно. Осуществляют разрез посередине вентральной поверхности шеи. Открывают и интубируют РЕ-240 для доступа воздуха для животного. Правую сонную артерию изолируют, и две 4-0 шлковые нити располагают вокруг сосуда для облегчения инструментального вмешательства. Электромагнитный зонд потока(0,95-1,0 мм зазор) помещают вокруг сосуда для измерения потока крови. Дистально к зонду помещают полоску 4 х 4 мм парафильма под сосудом для изоляции его от окружающего слоя мышц. После того, как осуществляют измерения потока для получения базовой линии, полоску фильтрованной бумаги (2 х 5 мм предварительно насыщенную 35% FeCl2) помещают на верхнюю часть сосуда в прямом направлении от зонда(вниз по течению) на 10 мин, а затем удаляют. Считают, что FeCl2 диффундирует в нижележащий сегмент артерии и вызывает деэндотетиализацию, которая приводит к образованию острого тромбоза. После нанесения фильтрованной бумаги, пропитанной FeCl2, измеряют кровяное давление, поток крови в сонной артерии и частоту ударов сердца в течении периода - 60 мин. После закупорки сосуда (определяемой как достижение нулевого потока крови) или через 60 мин после нанесения фильтрованной бумаги,если потенция сохраняется, артерию лигируют проксимально и дистально по отношению к участку поражения, и сосуд иссекают. Тромб удаляют и взвешивают немедленно, и записывают как основной результат исследований. После хирургической операции отбирают контрольный образец крови (В 1). Все образцы 14 крови отбирают из артериального катетера и смешивают с цитратом натрия во избежание коагуляции. После каждого отбора образца крови катетер заполняют 0,5 мл 0,9% физиологического раствора. Соединение настоящего изобретения вводят внутривенно, начиная через 5 мин после наложения FeCl2. Время между нанесением FeCl2 и временем, когда поток крови в сонной артерии сводится к нулю, регистрируют как время окклюзии (ТТО). Для сосудов, которые не закупоривались, в течение 60 мин, ТТО принимают как величину за 60 мин. Через 5 мин после нанесения FeCl2 отбирают второй образец кровиFeCl2, фильтрованную бумагу удаляют из сосуда, и за животными наблюдают и регистрируют параметры в течение остальной части эксперимента. После достижения нулевого потока крови, отбирают третий образец крови (В 3), и сгусток удаляют и взвешивают. Измеряют время кровотечения на подушечках большого пальца ноги, и в то же время получают образцы крови. Коагуляционные профили из времени частичной активации тромбо-пластина (АРТТ) и времени для протромбина (РТ) осуществляют на всех образцах крови. В некоторых случаях соединение можно вводить перорально. Крыс фиксируют вручную, используя стандартные способы, и соединения вводят через желудочный зонд, используя 18G изогнутую иглу (объм 5 мл/кг). Через 15 мин после введения лозы в желудок, животных анестезируют и проводят инструментальные исследования как было указано ранее. Затем эксперименты осуществляют в соответствии с предоставленным ранее протоколом. В качестве примера: соединение 6 демонстрирует значение Ki в 27,0 нМ, 1,72 мкМ и 2,71 мкМ для фактора Ха, трипсина и тромбина,соответственно; соединение 9 демонстрирует значение Кi в 94,0 нМ, 129 нМ и 477 нМ для фактора Ха, трипсина и тромбина, соответственно. Настоящее изобретение возможно осуществить в других конкретных формах в рамках данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения, выбранные из группы
МПК / Метки
МПК: A61K 31/24, C07C 251/02
Метки: соединения, получения, n-[(аминоиминометил, промежуточные, аминометил)фенил]пропиламидов, замещенных
Код ссылки
<a href="https://eas.patents.su/8-1932-promezhutochnye-soedineniya-dlya-polucheniya-zameshhennyh-n-aminoiminometil-ili-aminometilfenilpropilamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Промежуточные соединения для получения замещенных n-[аминоиминометил или аминометил)фенил]пропиламидов</a>
Предыдущий патент: Применение 2-(3,4-диметоксициннамоил)аминобензойной кислоты для лечения или предотвращения рестеноза
Случайный патент: Способ управления многофазным вентильным двигателем












