18-метил-9-нор-17-прегн-4-ен-21, 17-карболактоны, а также лекарственные препараты, которые их содержат
Номер патента: 14325
Опубликовано: 29.10.2010
Авторы: Мун Ханс-Петер, Биттлер Дитер, Фритцемайер Карл-Генрих, Больманн Рольф, Кюнцер Германн, Прелле Катя, Эсперлинг Петер, Фурманн Ульрике
Формула / Реферат
1. 18-Метил-19-нор-17-прегн-4-ен-21,17-карболактоны общей формулы I
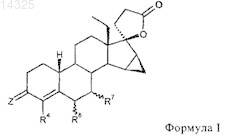
в которой
Z представляет собой атом кислорода, два атома водорода, группировку =NOR или =NNHSO2R, причем R означает атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода,
R4 означает атом водорода, атом галогена, метильную или трифторметильную группу,
R6 и/или R7может находиться в a или b положении и независимо друг от друга означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, или
R6 означает атом водорода и R7означает расположенную в a или b положении алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, или
R6 и R7вместе означают расположенную в a или b положении метиленовую группу или дополнительную связь.
2. Соединения общей формулы I по п.1, в которой Z означает атом кислорода.
3. Соединения общей формулы I по п.1, в которой Z означает группировку =NOR или =NNHSO2R и R означает атом водорода.
4. Соединения общей формулы I по п.1, в которой R4 представляет собой атом водорода.
5. Соединения общей формулы I по п.1, в которой R4 представляет собой атом хлора.
6. Соединения общей формулы I по п.1, в которой R6 означает атом водорода и R7означает метильную группу.
7. Соединения общей формулы I по п.1, в которой R6 означает атом водорода и R7означает пропильную группу.
8. Соединения общей формулы I по п.1, в которой R6 и R7вместе означают метиленовую группу.
9. Соединения общей формулы I по п.1, в которой R6 и R7вместе означают двойную связь.
10. Соединения общей формулы I по п.1, а именно
18-метил-15b,16b-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактон,
18-метил-6a,7a-15b,16b-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-6b,7b-15b,16b-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7a,18-диметил-15b,16b-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7b,18-диметил-15b,16b-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
3-гидроксиламино-18-метил-6b,7b-15b,16b-диметилен-19-нор-17-прегн-4-ен-21,17-карболактон,
4-хлор-18-метил-6b,7b-15b,16b-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7a-этил-18-метил-15b,16b-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
7b-этил-18-метил-15b,16b-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-15b,16b-метилен-3-оксо-7a-пропил-19-нор-17-прегн-4-ен-21,17-карболактон,
18-метил-15b,16b-метилен-3-оксо-7b-пропил-19-нор-17-прегн-4-ен-21,17-карболактон.
11. Лекарственные препараты, содержащие по меньшей мере одно соединение по п.1, а также фармацевтически приемлемый носитель.
12. Лекарственные препараты по п.11, которые дополнительно содержат по меньшей мере один эстроген.
13. Лекарственные препараты по п.12, которые содержат этинилэстрадиол.
14. Лекарственные препараты по п.12, которые содержат натуральный эстроген.
15. Лекарственные препараты по п.14, которые содержат эстрадиол.
16. Лекарственные препараты по п.14, которые содержат эстрадиолвалерат.
17. Лекарственные препараты по п.14, которые содержат по меньшей мере один конъюгированный эстроген.
Текст
Веселицкая И.А., Пивницкая Н.Н., Кузенкова Н.В., Веселицкий М.Б., Каксис Р.А.,Комарова О.М., Белоусов Ю.В. (RU) Настоящее изобретение касается новых 18-метил-19-нор-17-прегн-4-ен-21,17-карболактонов общей формулы I в которой Z представляет собой атом кислорода, два атома водорода, группировку =NOR или=NNHSO2R, причем R означает атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, R4 означает атом водорода, атом галогена, метильную или трифторметильную группу, R6 и/или R7 может находиться вилии независимо друг от друга означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода или R6 означает атом водорода и R7 означает расположеннуюилиалкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, или R6 и R7 вместе означают расположеннуюилиметиленовую группу или дополнительную связь. Новые соединения обладают гестагенным и антиминералокортикоидным действием и являются пригодными для получения лекарственных препаратов, например для пероральной контрацепции и для лечения пре-, пери- и постменопаузальных расстройств.(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) 014325 Настоящее изобретение относится к 18-метил-19-нор-17-прегн-4-ен-21,17-карболактонам общей формулы IZ представляет собой атом кислорода, два атома водорода, группировку =NOR или =NNHSO2R,причем R означает атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода,R4 означает атом водорода, атом галогена, метильную или трифторметильную группу,R6 и/или R7 может находиться вилиположении и независимо друг от друга означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, илиR6 означает атом водорода и R7 означает расположенную вилиположении алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, илиR6 и R7 вместе означают расположенную вилиположении метиленовую группу или дополнительную связь.Z предпочтительно означает атом кислорода. В случае, когда Z означает группировку =NOR или =NNHSO2R, то R предпочтительно означает атом водорода. В качестве алкильной группы с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, пригодными являются метильная, этильная, н-пропильная или н-бутильная группа,соответственно изо-пропильная, изо- или трет.-бутильная группа.R4 предпочтительно представляет собой атом водорода. В качестве атома галогена R4 пригодны атом фтора, хлора, брома или йода, предпочтительно хлор. В случае, когда R6 и/или R7 означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, являются пригодными метильная, этильная, н-пропильная или н-бутильная группа и соответственно изо-пропильная, изо- или трет.-бутильная группа.R6 и R7 предпочтительно означают атом водорода и метильную группу или вместе представляют собой метиленовую группу или двойную связь. Согласно изобретению указанные ниже соединения являются особенно предпочтительными: 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактон,18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,3-гидроксиламино-18-метил-6,7-15,16-диметилен-19-нор-17-прегн-4-ен-21,17-карболактон,4-хлор-18-метил-6,7-15, 16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-15,16-метилен-3-оксо-7-пропил-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-15,16-метилен-3-оксо-7 р-пропил-19-нор-17-прегн-4-ен-21,17-карболактон. Дроспиренон (6,7-15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон) является новым гестагеном, который содержится, например, в средстве для пероральной контрацепции YASMIN и в препарате ANGELIQ для лечения постменопаузальных расстройств (оба препарата компании SCHERING AG). На основании его сравнительно незначительного сродства к гестагенному рецептору и его довольно высокой дозы для подавления овуляции дроспиренон в YASMIN содержится в относительно высокой суточной дозе, составляющей 3 мг. Дроспиренон отличается тем, что вдобавок к гестагенному действию он обладает антагонистическим действием по отношению к альдостерону (антиминералокортикоидным), а также антиандрогенным действием. Эти оба свойства придают дроспиренону в его фармакологическом профиле большое сходство с натуральным гестагеном прогестероном, однако последний в отличие от дроспиренона не обладает достаточной биодоступностью при пероральном введении. Поэтому задачей настоящего изобретения является предоставить соединения, которые должны обладать более сильным связыванием с рецептором гестагена, чем дроспиренон, и таким образом иметь более высокую гестагенную эффективность, чем дроспиренон. В конечном счете, это должно проявляться в более низкой суточной дозе и приводить к более низкому расходу вещества в активном соединении. Это задача решается с помощью описанных в настоящем изобретении 18-метил-19-нор-17-прегн-4 ен-21,17-карболактонов общей формулы I. Соединения общей формулы I (и, в частности, соединение 3b,см. экспериментальную часть) необходимо рассматривать как структурные изомеры дроспиренона. Новые соединения в тесте связывания гестагенного рецептора при применении цитозоля из гомогената матки кролика и 3 Н-прогестерона, в качестве сравнительного вещества, отличаются более высоким сродством к гестагенному рецептору, чем дроспиренон и сопоставимым сродством к минералокортикоидному рецептору из гомогената печени крысы. При этом является неожиданным, что связывание с рецептором гестагена оказывается в пять раз сильнее, чем связывание с дроспиреноном. Неожиданно было обнаружено, что соединения согласно изобретению отличаются сильным гестагенным действием и очень эффективны в опыте по сохранению беременности у крыс после подкожного введения. Проведение опыта сохранения беременности у крыс: У беременных крыс отторжение желтого тела (Corpora lutea) или кастрация вызывают выкидыш. Посредством экзогенного ввода прогестинов (гестагенов) в комбинации с приемлемой дозой эстрогена удается поддержать беременность. Опыт сохранения беременности у овариэктомированных крыс служит для определения периферического гестагенного действия соединения. Ночью в период проэструса крысы совокупляются. Утром следующего дня совокупление контролируют путем исследования вагинального мазка. При этом наличие сперматозоидов расценивается как первый день начинающейся беременности. На восьмой день беременности животных, находящихся под эфирной анестезией, подвергали овариэктомии. Лечение с помощью тестируемого соединения и экзогенного эстрогена (эстрон, 5 мкг/кг/сутки) осуществляли подкожно ежедневно с 8 по 15-й день или по 21-й день беременности. Первое применение на 8-й день выполняли за 2 часа до удаления яичников. Интактные контрольные животные получали только наполнитель. Оценивание: В конце опыта (15-й или 21-й день) животных умерщвляют посредством подачи СО 2 и подсчитывают живые плоды (плоды с бьющимся сердцем) и имплантационные места (ранее рассосавшиеся и мертвые плоды, включая аутолизы и атрофические плаценты) в обоих рогах матки. Кроме того, на 22-й день плоды могут быть исследованы на наличие возможных пороков развития. В матке без плодов или без имплантационных мест определяют количество мест нидации посредством окрашивания 10%-ным раствором сульфида аммония. Процент сохранения беременности рассчитывается как частное из числа живых плодов и общего количества мест нидации (как рассосавшихся и мертвых плодов, так и мест нидации). При этом для тестируемого вещества 18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17 прегн-4-ен-21,17-карболактон (соединение 3 а, см. экспериментальную часть) была определена поддерживающая беременность доза (ED50), составляющая 120 мкг/кг/сутки. Для дроспиренона это значение составляет 3,5 мг/кг/сутки. Согласно изобретению соединения общей формулы I обладают очень сильным гестагенным действием при одновременной слабом связывании с андрогенным рецептором (диссоциация). Кроме того, было обнаружено, что соединения в соответствии с изобретением проявляют задерживающее калий, натрийуретическое (антиминералокортикоидное) действие у адреналэктомированных крыс. На основе их гестагенной эффективности новые соединения общей формулы I могут использоваться самостоятельно или в комбинации с эстрогеном в лекарственных препаратах для контрацепции. Вследствие их благоприятного действующего профиля соединения согласно изобретению являются особенно пригодными для лечения предменструальных расстройств, таких как головные боли, депрессивные расстройства, задержка воды и мастодиния. В препаратах для контрацепции дозировка соединений согласно изобретению должна составлять от 0,01 до 5 мг, предпочтительно от 0,01 до 2 мг в сутки. Суточная доза для лечения предменструальных расстройств составляет приблизительно от 0,1 до 20 мг.-2 014325 В контрацептивных препаратах гестагенные и эстрогенные действующие компоненты предпочтительно применяются совместно перорально. Предпочтительно суточная доза вводится однократно. В качестве эстрогенов пригодны синтетические эстрогены, предпочтительно этинилэстрадиол, а также и местранол. Эстроген вводится в суточной дозе, которая соответствует от 0,01 до 0,04 мг этинилэстрадиола. Новые соединения общей формулы I могут также использоваться в лекарственных препаратах для лечения пре-, пери- и постменопаузальных расстройств, а также в препаратах для гормонозаместительной терапии (ГЗТ). В таких препаратах в качестве эстрогенов в первую очередь подходят натуральные эстрогены, прежде всего эстрадиол или его сложный эфир, к примеру, эстрадиолвалерат или также конъюгированные эстрогены (CEEs = Conjugated Equine Estrogens), такие, которые содержатся, например, в препаратеPREMARIN. Приготовление лекарственных препаратов на основе новых соединений осуществляют согласно известному способу, при котором действующее вещество используют, при необходимости в комбинации с эстрогеном, с используемыми в галеновых препаратах носителями, разбавителями, при необходимости улучшителями вкуса и т.д., и переводят в желаемую форму применения. Для предпочтительного перорального применения подходят, в частности, таблетки, драже, капсулы,пилюли, суспензии или растворы. Для парентерального применения особенно пригодны масляные растворы, такие, например, как растворы в кунжутном масле, касторовом масле и масле из семян хлопчатника. Для повышения растворимости могут использоваться растворители, такие, например, как бензилбензоат или бензиловый спирт. Также вещества согласно изобретению возможно вводить в трансдермальные системы и таким образом применять их чрескожно. Новые соединения общей формулы I согласно изобретению получают, как описано ниже. В качестве исходного соединения для новых 18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17 карболактонов согласно схеме 1 используют, например, соединение 1 (DE 3402329). Введение 6-двойной связи осуществляют, например, посредством бромирования 3,5-диенамина или с помощью модифицированного бромирования простого диенолового эфира, а также последующего отделения бромистого водорода (см., например, В. J. Friend, J.A. Edwards, Organic Reactions in Steroid Схема 1. Бромирование простого диенолового эфира может происходить, например, аналогично указаниямJ.A. Zderic, Humberto Caprio, A. Bowers und Carl Djerassi in Steroids 1, 233 (1963). Отделяют бромистый водород путем нагревания 6-бром соединения с основными реактивами, такими как, например, LiBr илиLi2CO3 в апротонных растворителях типа диметилформамида при температуре от 50 до 120 С или же нагреванием 6-бром соединений в растворителе, таком как коллидин или лутидин с получением соединения 2 (пример 1). Затем соединение 2 посредством метиленирования 6-двойной связи известным способом подвергают взаимодействию, например, с метилидом диметилсульфоксония (см., например, DE-A 1183500, DEA 2922500, ЕР-А 0019690, US-A 4291029; Е. J. Corey und M. Chaykovsky, J. Am. Chem. Soc. 84, 867(1962 с получением соединения 3, причем получают смесь - и -изомеров (соединения 3a/3b) (соотношение зависит от использованных субстратов и составляет примерно 1:1), которая может быть разделена, например, хроматографией на отдельные изомеры. Введение заместителя R4 могут осуществлять, например, используя в качестве исходного соединение формулы 3, путем эпоксидирования 4-двойной связи с перекисью водорода при щелочных условиях-3 014325 и взаимодействием образованного эпоксида в приемлемом растворителе с кислотой общей формулы HR4, причем -R4 представляет собой атом галогена или псевдогалогена, или подвергают взаимодействию с каталитическими количествами минеральной кислоты и при необходимости полученные 4-бром соединения общей формулы I (причем R4 = бром) подвергают взаимодействию с 2,2-дифтор-2(фторсульфонил) сложным метиловым эфиром уксусной кислоты в диметилформамиде в присутствии йодида меди (I). Введение 6-метиленовой группы можно осуществить, например, используя в качестве исходного производное 3-амино-3,5-диена путем взаимодействия с формалином в спиртовом растворе с образованием 6-гидроскиметильной группы и последующим кислотным отделением воды, например, соляной кислотой в диоксане/воде. Отщепление воды также можно осуществить таким образом, что сначала гидроксильная группа обменивается на лучшую уходящую группу и затем отщепляется. В качестве уходящих групп пригодны, например, мезилат, тозилат или бензоат (см. DE-A 34023291, ЕР А 0150157, US-A 4584288; K. Nickisch et al., J. Med. Chem. 34, 2464 (1991. Следующая возможность получения соединений 6-метилена состоит в непосредственном взаимодействии 4(5) ненасыщенных 3-кетонов с ацеталями формальдегида в присутствии ацетата натрия с, например, оксихлоридом фосфора или пентахлоридом фосфора в приемлемых растворителях, таких как хлороформ (см., например, K. Annen, H. Hofmeister, H. Laurent und R. Wiechert, Synthesis 34(1982. Соединения 6-метилена могут использоваться для получения соединений общей формулы 1, в которых R6 означает метил и R6 и R7 вместе образуют дополнительную связь. К тому же можно, например, применить способ, описанный D. Burn et al. в Tetrahedron 21, 1 619(1965), в котором изомеризация двойной связи достигается нагреванием соединений 6-метилена в этаноле с помощью 5% катализатора палладий на угле, который предварительно обрабатывают или водородом, или нагреванием с небольшим количеством циклогексена. Также изомеризацию можно осуществить с не прошедшим предварительную обработку катализатором, если к реакционной смеси добавляют небольшое количество циклогексена. Появление незначительных частей гидрированных продуктов может быть предотвращено добавлением излишка ацетата натрия. Однако получение производных 6-метил-4,6-диен-3-она можно также осуществлять и непосредственно (см. K. Annen, H. Hofmeister, H. Laurent und R. Wiechert, Lieb. Ann. 712 (1983. Соединения, в которых R6 представляет собой -метил, могут быть получены из соединений 6 метилена посредством гидрирования при подходящих условиях. Наилучшие результаты (селективное гидрирование экзометиленовой функциональной группы) достигаются трансфер-гидрированием (Е.А.Brande, R.P. Linstead und P.W.D. Mitchell, J. Chem. Soc. 3 578 (1954. Если производные 6-метилена нагревают в приемлемом растворителе, таком как, например, этанол, в присутствии гидридного донора,например, циклогексена, то получают производные 6-метила с очень хорошим выходом. Незначительные части 6-метил соединения могут быть подвержены изомеризации в кислой среде (см., например, D.Burn, D. N. Kirk и V. Petrow, Tetrahedron 1 619 (1965. Также возможно целенаправленное получение 6-алкильных соединений. Для этого 4(5)ненасыщенные 3-кетоны подвергают взаимодействию, например, с этиленгликолем, триметилортоформиатом в дихлорметане в присутствии каталитического количества кислоты (например, птолуолсульфоновой кислоты) до получения соответствующих 3-кеталей. Во время данной кетализации двойная связь изомеризируется в положение 5(6). Селективное эпоксидирование этой 5(6)-двойной связи осуществляют, например, с применением органических перокислот, например м-хлорпероксибензойной кислоты, в приемлемом растворителе, таком как дихлорметан. Альтернативно этому эпоксидирование могут осуществлять также посредством перекиси водорода в присутствии, например, гексахлорацетона или 3-нитротрифторацетонфенона. Затем образованные 5,6-эпоксиды могут раскрываться аксиально при применении соответствующих галогенидов алкилмагния или соединений алкиллития. Таким образом, получают 5 а-гидрокси-6 алкильные соединения. Расщепление 3-кетозащитной группы может происходить с получением 5-гидроксифункции обработкой при мягких условиях в кислой среде (уксусная кислота или 4 н. соляная кислота при 0 С). Основное отщепление 5-гидрокси функциональной группы,например, разведенным водным раствором гидроксида натрия получают соединением 3-кето-4-ена с 6 алкильной группой вположении. Альтернативно этому посредством расщепления кеталя при более сильных условиях (водная соляная кислота или другая сильная кислота) получают соответствующие 6 алкильные соединения. Полученные соединения общей формулы I, в которых Z означает атом кислорода, при желании могут быть переведены посредством взаимодействия с гидроксиламиногидрохлоридом в присутствии третичного амина при температуре от -20 до +40 С в их соответствующие оксимы (общая формула I с Z в значении =NOH, причем гидроксигруппа может быть расположенной син- или анти-). Приемлемыми третичными основаниями являются, например, триметиламин, триэтиламин, пиридин, N,Nдиметиламинопиридин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN) и 1,5-диазабицикло[5.4.0]ундец-5-ен(DBU), причем предпочтительным является пиридин. Это происходит аналогично описанному в заявкеWO 98/24801 для получения соответствующих 3-оксиимино производных дроспиренона.-4 014325 Удаление 3-оксогруппы для получения конечного продукта общей формулы I с Z в значении двух атомов водорода можно осуществить, например, согласно приведенным в DE-A 2805490 указаниям посредством расщепления тиокеталя 3-кетосоединения. Следующие примеры приведены для более подробного объяснения изобретения. Пример 1. 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактон К раствору 11,0 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактона(DE3402329) в 110 мл диоксана добавляют 11 мл сложного триэтилового эфира о-муравьиной кислоты, а также 11 мл диоксана/серной кислоты (12+0,42). Получают 14,4 г 3-этокси-18-метил-15,16-метилен 19-нор-17-прегна-3,5-диен-21,17-карболактона в качестве неочищенного продукта. Его растворяют в 380 мл ацетона, смешивают с 2,3 мл пиридина, 10,3 г ацетата натрия, 28 мл воды, а также 7,6 г Nбромсукцинимида, и перемешивают в течение 0,5 ч при температуре ледяной бани. Затем подмешивают в ледяную воду, осадок отфильтровывают, промывают водой, осадок ресуспендируют в дихлорметане,промывают водой, высушивают над сульфатом натрия и конденсируют в вакууме. Получают 17 г 6 бром-18-метил-3-оксо-15,16-метилен-19-нор-17-прегн-4-ен-21,17-карболактона в качестве неочищенного продукта. Его растворяют в 170 мл диметилформамида, перемешивают с 6,65 г бромида лития, а также 7,87 г карбоната лития в течение одного часа при 100 С. Затем подмешивают в ледяную воду, осадок отфильтровывают, промывают водой, осадок ресуспендируют в дихлорметане, промывают водой,высушивают над сульфатом натрия и конденсируют в вакууме. После осуществления хроматографии на силикагеле с гексаном/ацетоном получают 6,5 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6 диен-21,17-карболактона (соединение 2 в схеме 1) с температурой плавления 187 С. Пример 2. 18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон. Раствор 5,8 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактона смешивают в 200 мл диметилсульфокида с 9,06 г йодида триметилсульфоксония и 1,613 г гидрида натрия (55%-ная суспензия в масле) и перемешивают в течение 20 ч в атмосфере аргона при комнатной температуре. Затем подмешивают в ледяную воду, помещают в слабо кислую среду, осадок отфильтровывают, промывают водой, осадок ресуспендируют в дихлорметане, промывают водой, высушивают над сульфатом натрия и конденсируют в вакууме, и хроматографируют на силикагеле с гексаном/ацетоном. После перекристаллизации фракции III из 2-пропанола/ацетона получают 0,8 г 18-метил-6,7-15,16 диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон (соединение 3 а) в виде кристаллов с температурой плавления 262 С. []D = +89,7 (метанол, с = 10,15 мг/мл) Пример 3. 18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон В соответствии с методом из примера 2 после осуществления хроматографии получают в качестве фракции IV 0,9 г 18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон(соединение 3b) в виде твердого вещества с температурой плавления 189-190 С. []D = -121,4 (хлороформ, с = 10,7 мг/мл) и []D = +137,9 (метанол, с = 10,63 мг/мл). Пример 4. 7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон. В раствор 0,4 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактона в 7 мл тетрагидофурана добавляют при комнатной температуре 12 мг хлорида меди 1 и перемешивают в течение 10 мин до охлаждения до -15 С, смешивают с 75 мг хлорида алюминия, при этой температуре перемешивают 30 мин, смешивают по каплям с 0,8 мл раствора метилмагнийбромида (3 М в простом диэтиловом эфире) и перемешивают в течение одного часа при -10 С. К составу примешивают реакционную смесь при -10 С с 4 н. соляной кислотой, перемешивают 1,5 ч при комнатной температуре, добавляют в воду, три раза экстрагируют сложным этиловым эфиром уксусной кислоты, высушивают над сульфатом натрия, конденсируют в вакууме и хроматографируют на силикагеле с гексаном/сложным этиловым эфиром уксусной кислоты. После перекристаллизации фракции I получают 182 мг 7,18 диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактона в виде кристаллов с температурой плавления 250 С. []D - 53,1 +/-0,3 (хлороформ, с = 10,3 мг/мл). Пример 5. 7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон. В соответствии с методом из примера 4 после осуществления хроматографии получают в качестве фракции II 36 мг 7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон в виде твердого вещества с температурой плавления 226 С. []D = 9,0 +/-0,5 (хлороформ, с = 10,2 мг/мл). Пример 6. 7-этил-18-метил-15, 16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон В раствор 0,5 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактона в 10 мл тетрагидрофурана добавляют при комнатной температуре 15 мг хлорида меди 1 и перемешивают в течение 10 мин до охлаждения до -15 С, смешивают с 93 мг хлорида алюминия, при этой температуре перемешивают 30 мин, смешивают по каплям с 1,0 мл раствора этилмагнийбромида (3 М в простом диэтиловом эфире) и перемешивают в течение одного часа при -10 С. К составу примешивают реакционную смесь при -10 С с 3 мл 2 н. соляной кислоты, перемешивают 0,5 ч при комнатной температуре, добавляют в воду, три раза экстрагируют сложным этиловым эфиром уксусной кислоты, высушивают над сульфатом натрия, конденсируют в вакууме, и хроматографируют на силикагеле с гексаном/сложным-5 014325 этиловым эфиром уксусной кислоты. После перекристаллизации фракции I получают 180 мг 7-этил-18 метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон в виде кристаллов с температурой плавления 205-208 С. []D = +34,4 +/-0,3 (хлороформ, с = 10,3 мг/мл) Пример 7. 7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон. В соответствии с методом из примера 6 после осуществления хроматографии получают в качестве фракции II 110 мг 7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон в виде твердого вещества с температурой плавления 169-171 С. []D = +30,8 +/-0,5 (хлороформ, с = 10,1 мг/мл). Пример 8. 18-метил-15,16-метилен-3-оксо-7 а-пропил-19-нор-17-прегн-4-ен-21,17-карболактон В раствор 0,5 г 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактона в 10 мл тетрагидрофурана добавляют при комнатной температуре 15 мг хлорида меди 1 и перемешивают в течение 10 мин до охлаждения до -15 С, смешивают с 93 мг хлорида алюминия, при этой температуре перемешивают 30 мин, смешивают по каплям с 1,5 мл раствора пропилмагнийбромида (2M В тетрагидрофурана) и перемешивают в течение одного часа при -10 С. К составу примешивают реакционную смесь при -10 С с 3 мл 2 н. соляной кислоты, перемешивают 0,5 ч при комнатной температуре, добавляют в воду, три раза экстрагируют сложным этиловым эфиром уксусной кислоты, высушивают над сульфатом натрия, конденсируют в вакууме и хроматографируют на силикагеле с гексаном/сложным этиловым эфиром уксусной кислоты. После перекристаллизации фракции I получают 177 мг 18-метил-15,16-метилен-3-оксо-7 а-пропил-19-нор-17-прегн-4-ен-21,17-карболактона в виде кристаллов с температурой плавления 167,5 С. []D = +31,2 +/-0,3 (хлороформ, с = 10,1 мг/мл). Пример 9. 18-метил-15,16-метилен-3-оксо-7-пропил-19-нор-17-прегн-4-ен-21,17-карболактон В соответствии с методом из примера 8 после осуществления хроматографии получают в качестве фракцииII 105 мг 18-метил-15,16-метилен-3-оксо-7-пропил-19-нор-17-прегн-4-ен-21,17 карболактона в виде твердого вещества с температурой плавления 90,9 С. []D = +27,4 +/-0,4 (хлороформ, с = 10,3 мг/мл). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 18-Метил-19-нор-17-прегн-4-ен-21,17-карболактоны общей формулы IZ представляет собой атом кислорода, два атома водорода, группировку =NOR или =NNHSO2R,причем R означает атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода,R4 означает атом водорода, атом галогена, метильную или трифторметильную группу,R6 и/или R7 может находиться вилиположении и независимо друг от друга означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, илиR6 означает атом водорода и R7 означает расположенную вилиположении алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 или от 3 до 4 атомов углерода, илиR6 и R7 вместе означают расположенную вилиположении метиленовую группу или дополнительную связь. 2. Соединения общей формулы I по п.1, в которой Z означает атом кислорода. 3. Соединения общей формулы I по п.1, в которой Z означает группировку =NOR или =NNHSO2R иR означает атом водорода. 4. Соединения общей формулы I по п.1, в которой R4 представляет собой атом водорода. 5. Соединения общей формулы I по п.1, в которой R4 представляет собой атом хлора. 6. Соединения общей формулы I по п.1, в которой R6 означает атом водорода и R7 означает метильную группу. 7. Соединения общей формулы I по п.1, в которой R6 означает атом водорода и R7 означает пропильную группу. 8. Соединения общей формулы I по п.1, в которой R6 и R7 вместе означают метиленовую группу. 9. Соединения общей формулы I по п.1, в которой R6 и R7 вместе означают двойную связь. 10. Соединения общей формулы I по п.1, а именно-6 014325 18-метил-15,16-метилен-3-оксо-19-нор-17-прегна-4,6-диен-21,17-карболактон,18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7,18-диметил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,3-гидроксиламино-18-метил-6,7-15,16-диметилен-19-нор-17-прегн-4-ен-21,17-карболактон,4-хлор-18-метил-6,7-15,16-диметилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,7-этил-18-метил-15,16-метилен-3-оксо-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-15,16-метилен-3-оксо-7-пропил-19-нор-17-прегн-4-ен-21,17-карболактон,18-метил-15,16-метилен-3-оксо-7-пропил-19-нор-17-прегн-4-ен-21,17-карболактон. 11. Лекарственные препараты, содержащие по меньшей мере одно соединение по п.1, а также фармацевтически приемлемый носитель. 12. Лекарственные препараты по п.11, которые дополнительно содержат по меньшей мере один эстроген. 13. Лекарственные препараты по п.12, которые содержат этинилэстрадиол. 14. Лекарственные препараты по п.12, которые содержат натуральный эстроген. 15. Лекарственные препараты по п.14, которые содержат эстрадиол. 16. Лекарственные препараты по п.14, которые содержат эстрадиолвалерат. 17. Лекарственные препараты по п.14, которые содержат по меньшей мере один конъюгированный эстроген.
МПК / Метки
МПК: C07J 53/00, A61P 5/34, A61K 31/585
Метки: 18-метил-9-нор-17-прегн-4-ен-21, 17-карболактоны, также, содержат, препараты, лекарственные, которые
Код ссылки
<a href="https://eas.patents.su/8-14325-18-metil-9-nor-17-pregn-4-en-21-17-karbolaktony-a-takzhe-lekarstvennye-preparaty-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">18-метил-9-нор-17-прегн-4-ен-21, 17-карболактоны, а также лекарственные препараты, которые их содержат</a>
Предыдущий патент: Триазолофталазины
Следующий патент: Способ получения углеводородных бензиновых фракций из синтез-газа
Случайный патент: Мускульный орнитоптер-планер












