Способ приготовления клопидогрела
Номер патента: 7907
Опубликовано: 27.02.2007
Авторы: Кастальди Грациано, Болонья Альберто, Баррека Джузеппе
Формула / Реферат
1. Способ приготовления метил[(S)-2-(2-хлорфенил)-2-(4,5,6,7-тетрагидротиено[3,2-с]-пиридил)]ацетата (1) или его фармацевтически приемлемой соли
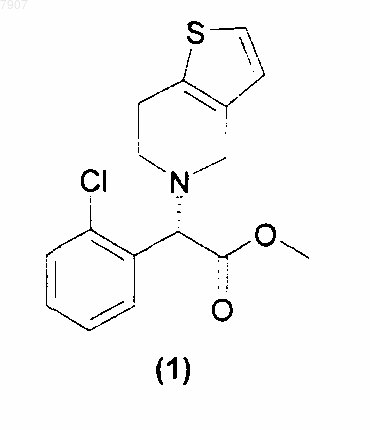
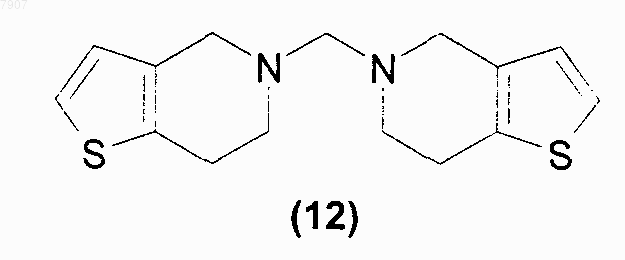
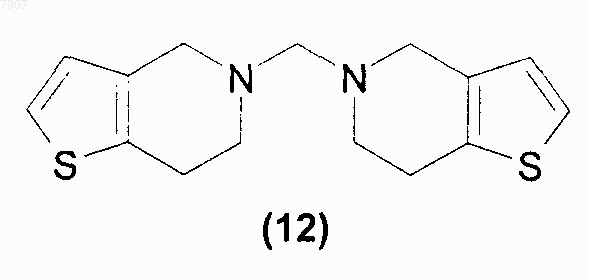
причем указанный способ включает реакцию N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридил-метана (12)
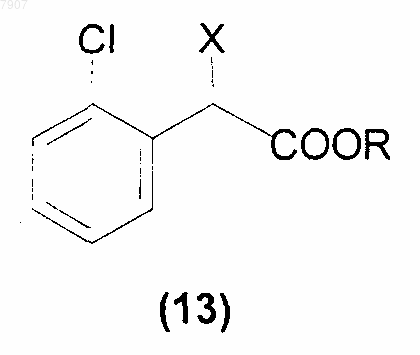
с производным (R)-2-хлорфенилуксусной кислоты, имеющим формулу (13)
в присутствии органического растворителя, где
R - метил, а
X - галоген, выбираемый из фтора, хлора, брома и йода; группа OSO2R1, где R1 - прямоцепочечная или разветвленная С1-С4 алкильная группа, возможно, замещенная одним или более атомами галогена; прямоцепочечная или разветвленная C1-C8 перфторалкильная группа, ароматический цикл, возможно, замещенный одним или более атомами галогена, прямоцепочечной или разветвленной С1-С4 алкильной группой или нитрогруппами;
сложноэфирная группировка OCOR1, где R1 имеет обозначения, указанные выше;
группа ONO2;
фосфитная группа OP(OR)2 или фосфатная группа OPO(OR)2, в которой R имеет обозначения, указанные выше; и, при необходимости, образует соли с соединением формулы (I).
2. Способ по п.1, в котором соединение формулы (13) выбирают из метилового эфира (R)-2-(2-хлорфенил)-2-(4-нитробензолсульфонилокси)уксусной кислоты и метилового эфира (R)-2-бpoм-2-(2-хлорфенил)уксусной кислоты.
3. Способ по п.1 или 2, в котором органический растворитель является протонным или апротонным, а реакцию в некоторых случаях осуществляют в присутствии основного агента.
4. Способ по любому из предшествующих пунктов, в котором молярное соотношение соединения формулы (12) к интермедиату (13) находится в диапазоне от 0,5:1 до 3:1.
5. Способ по п.3, в котором органический растворитель выбирают из кетона, спирта, ацетонитрила, ароматического углеводорода и хлорированного растворителя.
6. Способ по п.3, в котором основной агент - органическое основание, выбираемое из N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана, диизопропилэтиламина, 4-(диметиламино)пиридина, триэтиламина, 1,8-диазабицикло[5.4.0]ундец-7-ена и 1,4-диазабицикло[2.2.2]октана.
7. Способ по п.5, в котором органическое основание - N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметан.
8. Способ по п.3, в котором основной агент - неорганическое основание, выбираемое из карбоната щелочного или щелочно-земельного металла.
9. Способ по любому из предшествующих пунктов, в котором температура реакции находится в диапазоне от 0шС до температуры кипения растворителя.
10. Соединение N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметан (12)
Текст
007907 Настоящее изобретение относится к антитромбоцитарным и антитромботическим средствам, более конкретно, к способу приготовления клопидогрела (1): метил[(S)-2-(2-хлорфенил)-2-(4,5,6,7-тетрагидротиено[3,2-с]-пиридил)]ацетата Известный уровень техники Клопидогрел (1) является соединением, обладающим антитромбоцитарным и антитромботическим действием; впервые описан Aubert et al. (патенты ЕР 0099802 и US 4529596) и синтезируем по реакции между 4,5,6,7-тетрагидро[2,3-с]тиенопиридином (2) и метиловым эфиром 2-хлор-2-(2'-хлорфенил)уксусной кислоты (3) (схема 1) Схема 1 В соответствии с этим способом продукт получают в виде рацемической смеси. Разделение двух энантиомеров может быть произведено при помощи методик оптического разрешения, как описано в ЕР 0281 459, но при этом происходит значительное снижение выходов. Способ, позволяющий преодолеть указанный недостаток, был предложен в заявке WO 98/51689, в которой клопидогрел приготавливали по реакции 2-(2-тиенил)этиламина (4) с о-хлорбензальдегидом (5) и цианидом натрия. Полученный нитрил (6) превращали в соответствующий амид (7), а затем - в метиловый эфир (8). Интермедиат (8), в конфигурации, подходящей для синтеза клопидогрела, может быть получен при оптическом разделении амида (7) или сложного эфира (8) при помощи оптически активных кислот. Наконец, желаемый энантиомер сложного эфира (8) подвергали циклизации с формальдегидом в кислотной среде с образованием клопидогрела. Схема 2 В ином случае, как описано в ЕР 466569, интермедиат (8) может быть получен по реакции метил-2 амино-(2-хлорфенил)ацетата (9) с производным 2-(2-тиенил)этанола (10), в котором X - это галоген или сульфоновая группа (схема 3) Схема 3-1 007907 или по реакции метил-2-галоген-(2-хлорфенил)ацетата, например, соединения (3), с 2-(2-тиенил)этиламином (4). Наконец, в заявке WO 99/18110 описано приготовление клопидогрела по реакции тетрагидротиенопиридина (2) с сульфоновыми эфирами (R)-2-хлорминдальной кислоты (11). Схема 4 Однако недостатком этого способа все же является применение тетрагидротиенопиридина, низкоплавкого твердого вещества, который с трудом можно получить в чистом виде. Подробное описание изобретения В настоящее время обнаружено, что клопидогрел (1) или его фармацевтически приемлемая соль могут быть получены по реакции N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12)R - атом водорода, или прямоцепочечная или разветвленная С 1-С 4 алкильная группа, аR1 - прямоцепочечная или разветвленная С 1-С 4 алкильная группа, возможно, замещенная одним или более атомами галогена; прямоцепочечная или разветвленная C1-C8 перфторалкильная группа, ароматический цикл, возможно, замещенный одним или более атомами галогена, прямоцепочечной или разветвленной С 1-С 4 алкильной группой или нитрогруппами; сложноэфирная группировка OCOR1, где R1 имеет обозначения, указанные выше; группа ONO2; фосфитная группа OP(OR)2 или фосфатная группа OPO(OR)2, в которой R имеет обозначения, указанные выше; и, при необходимости, образует соли с соединением формулы (I). Если R1 - замещенная алкильная группа или ароматический цикл, то она, предпочтительно, имеет от 1 до 3 заместителей, определенных выше, которые могут быть одинаковыми или различными. Предпочтительными соединениями формулы (13) являются метиловый эфир (R)-2-(2-хлорфенил)-2(4-нитробензолсульфонилокси)уксусной кислоты (13 а) и метиловый эфир (R)-2-бром-2-(2-хлорфенил) уксусной кислоты (13b). Способ приготовления клопидогрела в соответствии с настоящим изобретением осуществляют в присутствии протонного или апротонного органического растворителя, а в некоторых случаях - и в присутствии органического или неорганического основного агента. Более конкретно, соединение формулы (13) добавляют в раствор или суспензию интермедиата (12) в подходящем органическом растворителе. Протонный или апротонный органический растворитель выбирают, например, из кетонов, предпочтительно, ацетона, метилэтилкетона и метилизобутилкетона,спиртов, предпочтительно, C1-C4 алканолов, ацетонитрила, ароматических углеводородов, предпочтительно, толуола, ксилола, и хлорированных растворителей, предпочтительно, метиленхлорида или их смесей. В соответствии с предпочтительным воплощением настоящего изобретения растворителем является ацетон, ацетонитрил или метанол. Применяют молярные соотношения соединения формулы (12) к интермедиату формулы (13), находящиеся в диапазоне от 0,5:1 до 3:1, предпочтительно, в диапазоне от 1:1 до 2:1. Если реакцию проводят в присутствии органического основного агента, такой агент, предпочтигде-2 007907 тельно, выбирают из самого соединения, имеющего формулу (12), т.е. из N,N'-бис-4,5,6,7-тетрагидро[3,2-с]-тиенопиридилметана, из диизопропилэтиламина, 4-(диметиламино)пиридина, триэтиламина, 1,8 диазабицикло[5.4.0]ундец-7-ена и 1,4-диазабицикло[2.2.2]октана. Неорганическим основным агентом, предпочтительно, является карбонат щелочного или щелочноземельного металла, например, карбонат калия. Молярные соотношения основания к соединению (13) могут находиться в диапазоне от 0,5:1 до 1,5:1, предпочтительно, в стехиометрическом соотношении. Реакцию проводят при температуре, находящейся в диапазоне от 0 С до температуры кипения растворителя, предпочтительно, от 20 до 70 С. После завершения реакции смесь охлаждают до комнатной температуры, а затем, после соответствующей обработки, полученный сырой продукт растворяют в ацетоне,получая раствор, из которого клопидогрел может быть высажен в виде соли при помощи добавления фармацевтически приемлемой кислоты, например, концентрированной серной кислоты, с образованием полусульфата клопидогрела. Аминаль N,N'-бис-4,5,6,7-тетрагидро-[3,2-c]-тиенопиридилметан, имеющий формулу (12), является новым соединением и также является объектом настоящего изобретения. Это соединение получают по реакции коммерчески доступного 2-(2-тиенил)этиламина (4) с водным раствором формальдегида или параформальдегидом, или триоксаном в среде, подкисленной минеральными или органическими кислотами (схема 5). Схема 5 Органическую кислоту предпочтительно выбирают из муравьиной, уксусной, трихлоруксусной,трифторуксусной, метансульфоновой, п-толуолсульфоновой кислоты; более предпочтительной является муравьиная кислота. Предпочтительной минеральной кислотой является соляная кислота. Если реакцию проводят в присутствии органической кислоты, то она одновременно может выполнять функцию растворителя. Если реакцию проводят в присутствии минеральной кислоты, то в качестве растворителя применяют воду. Минеральную кислоту обычно применяют в стехиометрическом количестве или в избытке; молярное соотношения минеральная кислота 2-(2-тиенил)этиламин (4), предпочтительно, находится в диапазоне от 1:1 до 3:1. Формальдегид в виде 37% водного раствора, параформальдегид или триоксан обычно применяют в соотношении к 2-(2-тиенил)этиламину (4), находящемся в диапазоне от 1:1 до 1:3, предпочтительно, в диапазоне от 1:1,5. Реакцию проводят при температуре, находящейся в диапазоне от 0 С до температуры кипения реакционной смеси, предпочтительно, от 10 до 60 С. После завершения реакции кислоту отгоняют в вакууме или, предпочтительно, переводят в соответствующую соль добавлением основания. Предпочтительными основаниями являются гидроксид натрия, гидроксид калия или гидроксид аммония. После подщелачивания, например, гидроксидом щелочного металла, интермедиат (12) выделяют фильтрованием или экстракцией подходящими органическими растворителями. Растворитель, применяемый для экстракции интермедиата (12), предпочтительно, является ароматическим углеводородом, более предпочтительно, толуолом или ксилолом, или хлорированным растворителем, более предпочтительно, метиленхлоридом. После удаления растворителя, применяемого для экстракции, интермедиат (12) очищают кристаллизацией из подходящего растворителя. Растворитель, применяемый для кристаллизации интермедиата(12), может быть выбран из кетонов, предпочтительно, ацетона и метилизобутилкетона, сложных эфиров, предпочтительно, этилацетата и бутилацетата, и из спиртов, предпочтительно, метанола, этанола и изопропанола. Преимуществом настоящего изобретения по сравнению со способами, в которых применяют 4,5,6,7-тетрагидро[2,3-с]тиенопиридин (2), т.е. низкоплавкое твердое вещество, очень хорошо растворимое в органических растворителях и, следовательно, плохо очищаемое кристаллизацией, является использование соединения (12), которое является твердым веществом и может быть перекристаллизовано. Кроме того, во время приготовления соединения (12) не образуются никакие побочные продукты, в отличие от этого при всех синтетических процедурах, используемых для приготовления 4,5,6,7 тетрагидро[2,3-с]тиенопиридина (2) и описанных в имеющейся литературе, образуются побочные продукты, которые необходимо удалять до начала приготовления клопидогрела. Настоящее изобретение более подробно описано при помощи нижеследующих примеров. Примеры Метил-(R)-2-(2-хлорфенил)-2-(4-нитробензолсульфонилокси)ацетат (13 а) приготавливают в соответствии с процедурой, изложенной в заявке WO 99/18110.-3 007907 Пример 1. Приготовление N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12). Способ 1. 2440 г безводной муравьиной кислоты (53,04 моль) поместили в круглодонную колбу, емкостью 3 л, снабженную механической мешалкой, термометром и капельной воронкой. Затем туда медленно прибавили 500 г 2-(2-тиенил)-этиламина (4) (3,94 моль); температуре при этом позволили подняться до 40 С. Полученный раствор охладили до комнатной температуры, затем через 10 мин прибавили 186,5 г 95% параформальдегида (5,91 моль). Смесь оставили на 14 ч при комнатной температуре, полученный раствор медленно вылили в 6660 г 30 мас.% раствора гидроксида натрия (50 моль); температуру при этом поддерживали ниже 30 С. Полученную суспензию перемешивали при комнатной температуре 2 ч, выпавшее твердое вещество отфильтровали, промыли водой и поместили в 550 мл метанола. Полученную суспензию перемешивали при комнатной температуре в течение 2 ч, затем твердое вещество отфильтровали, промыли метанолом и сушили в вакууме при 45 С, получая, таким образом, 462 г (1,59 моль; выход 81%) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) в виде белого кристаллического вещества. 1 Н ЯМР (CDCl3, , м.д.): 2.90 (m, 8H), 3.36 (s, 2H), 3.66 (s, 4H), 6.74 (d, 2H), 7.08 (d, 2H). Т.пл.=126,3 С. Способ 2. 50 г 2-(2-тиенил)этиламина (4) (0,394 моль) и 250 мл воды поместили в поллитровую круглодонную колбу, снабженную механической мешалкой, термометром и капельной воронкой. Затем туда медленно прибавили 48 г 36 мас.% водного раствора соляной кислоты (0,473 моль), и полученный раствор нагревали до 50 С, затем примерно через 20 мин прибавили 47,9 г 37 мас.% водного раствора формальдегида(0,591 моль). Смесь оставили на 5 ч при 50 С, полученную смесь охладили до комнатной температуры,нейтрализовали добавлением 20,8 г гранул гидроксида натрия (0,52 моль) и затем экстрагировали 130 мл толуола. Полученную органическую фазу дважды промыли 50 мл воды, затем сконцентрировали до получения остатка под уменьшенным давлением, и полученную смесь поместили в 100 мл ацетона; получили суспензию, которую перемешивали в течение 2 ч. Образованный осадок отфильтровали с отсасыванием и промыли ацетоном, получая, таким образом, 26 г N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) (89,7 моль; выход 45,5%) в виде белого кристаллического вещества. Пример 2. Приготовление метил[(S)-2-(2-хлорфенил)-2-(4,5,6,7-тетрагидротиено[3,2-с]-пиридил)] ацетата (1). Способ 1. 31,6 (0,108 моль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) и 150 мл ацетонитрила поместили в трехгорлую поллитровую круглодонную колбу, снабженную магнитной мешалкой,конденсатором и капельной воронкой. Полученную суспензию выдерживали в атмосфере азота, а затем кипятили. Затем через 1 ч 30 мин прибавляли раствор, состоящий из 40 г (0,104 моль) метил-(R)-2-(2 хлорфенил)-2-(4-нитробензолсульфонилокси)ацетата (13 а), растворенного в 150 мл ацетонитрила. Через 1 ч после окончания прибавления смесь охладили до -15 С и отфильтровали выпавший твердый осадок. Полученный прозрачный раствор анализировали при помощи высокоэффективной жидкостной хроматографии (ВЖХ) (выход по ВЖХ: 74%). Растворитель испаряли под уменьшенным давлением, остаток помещали в толуол (приблизительно 600 мл) и обрабатывали 5 мас.% водным раствором бикарбоната натрия (100 мл). Органическую фазу промывали 100 мл воды и профильтровывали через обесцвечивающий уголь. Затем растворитель испаряли под уменьшенным давлением, остаток помещали в 300 мл ацетона. К полученному прозрачному раствору прибавляли концентрированную серную кислоту до получения кислой реакции среды; температуру при этом поддерживали при 20 С. Смесь перемешивали при комнатной температуре в течение 12 ч, затем отфильтровывали выпавшее твердое вещество, промывали его свежим ацетоном, получая, таким образом, 23,92 г полусульфата клопидогрела (57,02 ммоль, выход = 55%), который идентифицировали при помощи образца сравнения. Способ 2. 7,51 (25,9 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12), 30 мл ацетонитрила и 3,57 г (25,9 ммоль) карбоната калия поместили в трехгорлую круглодонную колбу, емкостью 250 мл,снабженную магнитной мешалкой, конденсатором и капельной воронкой. Полученную суспензию выдерживали в атмосфере азота и кипятили, затем через 4 ч прибавляли раствор, состоящий из 20 г (51,8 ммоль) соединения (13 а), растворенного в 70 мл ацетонитрила. Через 16 ч после окончания прибавления смесь охладили до комнатной температуры, а еще через 1 ч отфильтровали выпавшее твердое вещество. По данным анализа ВЖХ полученный прозрачный раствор содержал 7,5 г основания клопидогрела (выход: 45%). Полученный продукт затем выделяли в виде полусульфата в соответствии с методикой, описанной в способе 1. Способ 3. 2,75 г (9,48 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) и 8 мл ацетонитрила поместили в трехгорлую круглодонную колбу, емкостью 25 мл, снабженную магнитной мешалкой,конденсатором и капельной воронкой. Полученную суспензию выдерживали в атмосфере азота и кипятили, затем через 1 ч 30 мин прибавляли раствор, состоящий из 2,5 г (9,48 ммоль) метил-(R)-2-бром-2-(2-4 007907 хлорфенил)ацетата (13b), растворенного в 8 мл ацетонитрила. Через 2 ч 30 мин после окончания прибавления смесь охладили до комнатной температуры и отфильтровали выпавшее твердое вещество. По данным анализа ВЖХ полученный прозрачный раствор содержал 1,95 г основания клопидогрела (выход: 64%). Полученный продукт затем выделяли в виде полусульфата в соответствии с методикой, описанной в способе 1. Способ 4. 3,76 (12,97 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) и 11 мл ацетона поместили в трехгорлую круглодонную колбу, емкостью 50 мл, снабженную магнитной мешалкой и капельной воронкой. К полученной суспензии через 40 мин прибавляли раствор, состоящий из 2,5 г (6,48 ммоль) соединения (13 а) в 9 мл ацетона. Через 25 ч после окончания прибавления отфильтровали выпавший твердый осадок. По данным анализа ВЖХ полученный прозрачный раствор содержал 1,81 г основания клопидогрела (выход: 87%). Растворитель испаряли под уменьшенным давлением, остаток помещали в толуол (30 мл) и полученный раствор обрабатывали обесцвечивающим углем. К полученному прозрачному раствору прибавляли воду (20 мл) и уксусную кислоту до рН 3-4. Органическую фазу отделяли, промывали водой (20 мл) и концентрировали под уменьшенным давлением до получения остатка. Полученное масло помещали в ацетон, затем клопидогрел (1) выделяли в виде полусульфата в соответствии с методикой, описанной в способе 1. Способ 5. 3,76 (12,97 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12) и 11 мл ацетона поместили в трехгорлую круглодонную колбу, емкостью 50 мл, снабженную магнитной мешалкой, конденсатором и капельной воронкой. Через 40 мин к полученной суспензии при кипячении прибавляли раствор, состоящий из 2,5 г (6,48 ммоль) соединения (13 а) в 9 мл ацетона. Через 2 ч после окончания прибавления реакционную смесь охладили до комнатной температуры, а еще через 1 ч отфильтровали выпавший твердый осадок. По данным анализа ВЖХ полученный прозрачный раствор содержал 1,75 г основания клопидогрела (выход: 84%). Клопидогрел (1) затем выделяли в виде полусульфата в соответствии с методикой, описанной в способе 4. Способ 6. 1,88 (6,48 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12), 11 мл ацетона и 0,84 г (6,48 ммоль) диизопропилэтиламина поместили в трехгорлую круглодонную колбу, емкостью 50 мл,снабженную магнитной мешалкой, конденсатором и капельной воронкой. Через 40 мин к полученной суспензии при кипячении прибавляли раствор, состоящий из 2,5 г (6,48 ммоль) соединения (13 а) в 9 мл ацетона. Полученную смесь кипятили до завершения реакции, затем охладили до комнатной температуры. По данным анализа ВЖХ полученный прозрачный раствор содержал 1,35 г основания клопидогрела(выход: 65%). Полученный продукт затем выделяли в виде полусульфата в соответствии с методикой,описанной в способе 4. Способ 7. 3,76 (12,97 ммоль) N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12), 20 мл метанола и 2,5 г (6,48 ммоль) соединения (13 а) поместили в трехгорлую круглодонную колбу, емкостью 50 мл,снабженную магнитной мешалкой, конденсатором и капельной воронкой. Полученную суспензию кипятили в течение 1 ч 30 мин. Полученную смесь охладили до комнатной температуры и выдерживали при этой температуре в течение 1 ч. Образовавшееся твердое вещество отфильтровали. По данным анализа ВЖХ полученный прозрачный раствор содержал 1,65 г основания клопидогрела (выход: 79%). Клопидогрел (1) затем выделяли в виде полусульфата в соответствии с методикой, описанной в способе 4. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ приготовления метил[(S)-2-(2-хлорфенил)-2-(4,5,6,7-тетрагидротиено[3,2-с]пиридил)]ацетата (1) или его фармацевтически приемлемой соли причем указанный способ включает реакцию N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана (12)X - галоген, выбираемый из фтора, хлора, брома и йода; группа OSO2R1, где R1 - прямоцепочечная или разветвленная С 1-С 4 алкильная группа, возможно, замещенная одним или более атомами галогена; прямоцепочечная или разветвленная C1-C8 перфторалкильная группа, ароматический цикл, возможно,замещенный одним или более атомами галогена, прямоцепочечной или разветвленной С 1-С 4 алкильной группой или нитрогруппами; сложноэфирная группировка OCOR1, где R1 имеет обозначения, указанные выше; группа ONO2; фосфитная группа OP(OR)2 или фосфатная группа OPO(OR)2, в которой R имеет обозначения, указанные выше; и, при необходимости, образует соли с соединением формулы (I). 2. Способ по п.1, в котором соединение формулы (13) выбирают из метилового эфира (R)-2-(2 хлорфенил)-2-(4-нитробензолсульфонилокси)уксусной кислоты и метилового эфира (R)-2-бpoм-2-(2 хлорфенил)уксусной кислоты. 3. Способ по п.1 или 2, в котором органический растворитель является протонным или апротонным,а реакцию в некоторых случаях осуществляют в присутствии основного агента. 4. Способ по любому из предшествующих пунктов, в котором молярное соотношение соединения формулы (12) к интермедиату (13) находится в диапазоне от 0,5:1 до 3:1. 5. Способ по п.3, в котором органический растворитель выбирают из кетона, спирта, ацетонитрила,ароматического углеводорода и хлорированного растворителя. 6. Способ по п.3, в котором основной агент - органическое основание, выбираемое из N,N'-бис 4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметана, диизопропилэтиламина, 4-(диметиламино)пиридина,триэтиламина, 1,8-диазабицикло[5.4.0]ундец-7-ена и 1,4-диазабицикло[2.2.2]октана. 7. Способ по п.5, в котором органическое основание - N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]тиенопиридилметан. 8. Способ по п.3, в котором основной агент - неорганическое основание, выбираемое из карбоната щелочного или щелочно-земельного металла. 9. Способ по любому из предшествующих пунктов, в котором температура реакции находится в диапазоне от 0 С до температуры кипения растворителя. 10. Соединение N,N'-бис-4,5,6,7-тетрагидро-[3,2-с]-тиенопиридилметан (12)
МПК / Метки
МПК: C07D 495/04, A61K 31/4365, C07D 221/00, C07D 495/00, C07D 519/00, A61P 9/00, C07D 333/00
Метки: клопидогрела, способ, приготовления
Код ссылки
<a href="https://eas.patents.su/7-7907-sposob-prigotovleniya-klopidogrela.html" rel="bookmark" title="База патентов Евразийского Союза">Способ приготовления клопидогрела</a>











