Способ получения 3,4,5-тризамещённых 1-арилпиразолов
Формула / Реферат
1. Способ получения соединения, имеющего формулу
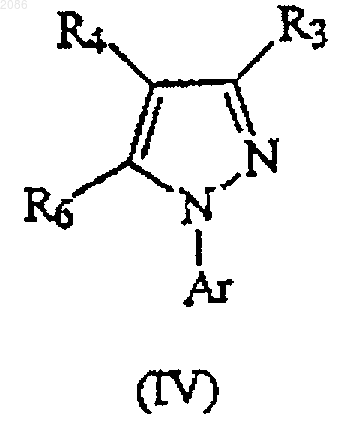
в которой
Аr представляет необязательно замещенный фенил или необязательно замещенный пиридил;
R3 представляет -C(O)R8 или -CN;
R4 представляет S(O)mR8, гдe R8 представляет C1-C6 алкил, C1-C6 галогеналкил или R9;
m равно 0, 1 или 2;
R6 представляет -NH2, -ОН или -СН3;
R8 представляет C1-C6 алкил, C1-C6 галогеналкил, R9 или Het;
Het представляет 5- или 6-членное гетероциклическое кольцо, имеющее от одного до трех кольцевых гетероатомов, которые являются одинаковыми или различными и выбраны из группы, состоящей из азота, серы и кислорода, каждый атом углерода упомянутого кольца является незамещённым или замещён галогеном, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкокси, C1-C6 галогеналкокси, циано, нитро, амино, N-(C1-C6 алкил)амино, N,N-ди(C1-C6 алкил) амино, ОН, -S(O)m(C1-C6 алкилом) или -S(O)m(C1-C6 галогеналкилом); и
R9 представляет фенил, необязательно замещенный одним или несколькими членами, выбранными из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкокси, C1-C6 галогеналкокси, циано, нитро, амино, N-(C1-C6 алкил)амино, N,N-ди(C1-C6 алкил)амино, ОН, -S(O)m(C1-C6 алкила) и -S(O)m(C1-C6 гaлогеналкила);
причём указанный способ включает
(а) взаимодействие соединения, имеющего формулу
Ar-Nу N+X- (I)
в которой Аr имеет значения, определенные выше, и Х представляет совместимый анион, с соединением, имеющим формулу
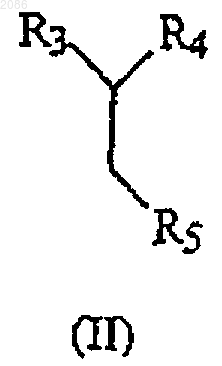
в которой R3 и R4 имеют значения, определенные выше, и R5 представляет -CN, -C(O)OR8 или -С(O)(C1-C6 алкил), с образованием соответствующего соединения, имеющего формулу
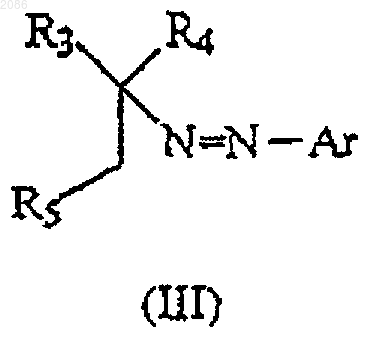
в которой R3, R4, R5 и Аr имеют значения, определенные выше; и
(b) осуществление перегруппировки полученного таким образом соединения формулы (III) в протонном или апротонном растворителе в присутствии основания с образованием соответствующего соединения формулы (IV),
причём молярное соотношение (I):(II) составляет примерно от 1:1 до 1:2.
2. Способ по п.1, в котором Аr представляет фенил, имеющий от 0 до 5 заместителей, или пиридил, имеющий от 0 до 4 заместителей, причем каждый заместитель, когда он присутствует, выбран из группы, состоящей из галогена, CN, NO2, C1-C6 галогеналкила, C1-С6 галогеналкокси, S(O)mСF3, SF5 и R10; и R10 представляет фенил, необязательно имеющий от одного до пяти заместителей, выбранных из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, циано(C1-C6 алкила), циано, нитро, амино, гидразино, C1-C6 алкокси, C1-C6 галогеналкокси, (C1-C6 галогеналкил)карбонила, формила, (C1-C6 алкил)карбонила, тиокарбамоила, карбамоила, (C1-C6 алкокси)карбонила, SF5 и R8S(O)m, причем два соседних заместителя фенила необязательно соединены вместе, образуя 1,3-бутадиенилен, метилендиокси- или галогенметилендиоксигруппу.
3. Способ по п.1 или 2, в котором Аr имеет формулу

в которой
Z представляет трехвалентный атом азота или радикал C-R7, причем другие три валентности атома углерода образуют часть ароматического кольца;
R1 и R7 представляют независимо друг от друга водород, галоген, CN или NO2; и
R2 представляет галоген, C1-C6 галогеналкил, C1-C6 галогеналкокси, S(O)mСF3, SF5 или R10.
4. Соединение, которое представляет собой 3-(4-хлорфенилсульфонил)-3-(2,6-дихлор-4-трифторметилфенилазо)-4-цианобутан-2-он или 2-(4-хлорфенилсульфонил)-2-(2,6-дихлор-4-трифторметил)фенилазосукцинонитрил.
Текст
1 Данное изобретение относится к новому способу производства пестицидно-активных материалов, а также их промежуточным продуктам. Более конкретно, данное изобретение относится к способу производства 1-арилзамещенных пиразолов. Для получения таких производных в литературе было описано много процессов производства, например в Международных патентных публикацияхWO 87/03781, WO 93/06089 иWO 94/21606; в публикациях европейских патентов 0295117, 0403300, 0385809 и 0679650; в патентах США 5232940 и 5236938 и в опубликованной заявке на патент Германии 19511269. Реакция Яппа-Клингемана, обзор которой приводится в Оrg. React., Vol. 10, стр.143-178(1959), известная в литературе с 1887, представляет собой способ, по которому фенилазосоединения получают взаимодействием диазониевых солей с активными метиленовыми соединениями. В типичном случае, фенилазосоединение не выделяют, а подвергают взаимодействию in situ с основанием, что приводит к потере уходящей группы и образованию соответствующего гидразона. Когда фенилазопромежуточный продукт надлежащим образом замещен, имеет место самопроизвольная реакция циклизации, дающая 3,5-дизамещенный 4-протиопиразол, то есть 3,5 дизамещенный, 4-незамещенный пиразол. Если нужно получить 3,4,5-тризамещенный пиразол,на последующих стадиях требуется дополнительная манипуляция. Цель данного изобретения состоит в предоставлении нового способа производства для получения производных арилпиразолов. Еще одна цель данного изобретения состоит в предоставлении простого способа производства, если возможно, более простого, чем существующий способ. Эти цели достигаются полностью или частично с помощью данного изобретения. Данное изобретение предоставляет новый и более эффективный способ непосредственного получения 3,4,5-тризамещенных 1-арил-пиразолов. Неожиданно было обнаружено, что циклизация пиразольного кольца некоторых арилазопромежуточных продуктов протекает так, что уходящая группа (обычно теряемая в реакциях этого типа) снова включается в пиразол у С-4,давая сразу доступ к 3,4,5-тризамещенным 1 арилпиразолам. Преимуществом этого является снижение числа стадий реакций, требуемых для получения целевых пестицидно активных производных 3,4,5-тризамещенных 1-арилпиразолов, что, в свою очередь, означает, что при производстве таких соединений может образовываться меньше сточных химикатов и может быть необходимо меньше энергии. Это способствует также снижению стоимости производства пестицидно активных производных 1 арилпиразолов. 2 Данное изобретение предоставляет способ получения 1-арилпиразолов формулы в которой Аr представляет необязательно замещенный фенил или необязательно замещенный пиридил;Het представляет 5- или 6-членное гетероциклическое кольцо, имеющее от одного до трех кольцевых гетероатомов, которые являются одинаковыми или различными и выбраны из группы, состоящей из азота, серы и кислорода,причем каждый атом углерода упомянутого кольца не замещен или замещен галогеном, C1 С 6 алкилом, C1-С 6 галогеналкилом, C1-С 6 алкокси, C1-С 6 галогеналкокси, циано, нитро, амино,N-(C1-С 6 алкил)амино, N,N-ди(C1-С 6 алкил) амино,ОН,-S(O)m(C1-С 6 алкилом) илиR9 представляет фенил, необязательно замещенный одним или несколькими членами,выбранными из группы, состоящей из галогена,C1-С 6 алкила, C1-С 6 галогеналкила, C1-С 6 алкокси, C1-С 6 галогеналкокси, циано, нитро, амино,N-(C1-С 6 алкил)амино, N,N-ди(C1-С 6 алкил) амино, -ОН, -S(O)m(C1-С 6 алкила) и -S(O)m(C1-С 6 галогеналкила),указанный способ включает(b) подвержение полученного таким образом соединения формулы (III) перегруппировке с получением соответствующего соединения формулы (IV). В данном описании следующие термины имеют общие значения, приведенные ниже:"алкил" представляет собой алкил с разветвленной или прямой цепью, имеющей от 1 до 6 атомов углерода;"галогеналкил" представляет собой алкил с разветвленной или прямой цепью, имеющей от 1 до 6 атомов углерода и имеющий один или несколько атомов галогена, которые являются одинаковыми или различными;"алкокси" представляет собой алкокси с разветвленной или прямой цепью, имеющей от 1 до 6 атомов углерода;"галогеналкокси" представляет собой алкокси с разветвленной или прямой цепью,имеющей от 1 до 6 атомов углерода, и имеющий один или несколько атомов галогена, которые одинаковы или различны;-CN или галоген, поскольку в вышеприведенной формуле (III) -CN или галоген не может мигрировать к соседнему атому углерода на стадии перегруппировки, дающей вышеприведенное соединение формулы (IV). Х может быть любым анионом, совместимым с преобладающими условиями реакции. Примеры подходящих групп включают (НSО 4),галоген, (BF4), (ZnCl3) и (CoCl). X предпочтительно представляет галоген или (HSO4). Когда Аr представляет фенил, он имеет от 0 до 5 заместителей. Когда Аr представляет пиридил, он имеет от 0 до 4 заместителей. Предпочтительно Аr имеет от 1 до 3 заместителей. В любом случае необязательные заместители Аr,предпочтительно выбраны из группы, состоящей из галогена, CN, NO2, галогеналкила, галогеналкокси, -S(O)mСF3, SF5 и R10, где m имеет значения, определенные выше, и R10 имеет значения, определенные выше. Аr 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-OCF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 Ph 2,6-Cl2-4-CF3 PhZ представляет трехвалентный атом азота или радикал C-R7, причем другие три валентности атома углерода образуют часть ароматического кольца;R1 и R7 представляют, независимо друг от друга, атом водорода или галогена, или CN илиR10 представляет фенил, необязательно имеющий от одного до пяти заместителей, выбранных из группы, состоящей из галогена; алкила; галогеналкила; цианоалкила; циано; нитро; амино; гидразино; алкокси; галогеналкокси; галогеналкилкарбонила; формила; алкилкарбонила; тиокарбамоила; карбамоила; алкоксикарбонила; SF5; и R8S(O)m (заместитель в положении 4, предпочтительно, представляет галоген,галогеналкил или галогеналкокси); два соседних заместителя фенила необязательно соединены вместе, образуя 1,3-бутадиенилен (-СН=СНСН=СН-), метилендиокси- (-О-СН 2-О-) или галогенметилендиокси группу (например, -O-CF2O-), так, чтобы образовалось циклическое кольцо, вицинальное к фенильному кольцу. Нижеследующее представляет собой также предпочтительные воплощения изобретения,особенно, когда Аr представляет одну из предпочтительных групп, описанных выше:R6 представляет -NH2. Следующие значения различных заместителей дают характерные соединения вышеприведенных формул (I)-(IV). В таблице, которая следует ниже, "Ph" означает фенил; "Руr" означает пиридил; "Et" означает этил. Процесс изобретения обычно проводится в две стадии, хотя он может осуществляться в виде непрерывного процесса, включающего перегруппировку in situ соединения формулы(III) с образованием соединения формулы (IV). Данный процесс in situ может быть предпочтительным, когда данный процесс образует часть производственного процесса, так как можно избежать необходимости выделения промежуточного продукта формулы (II). На первой стадии диазониевую соль (I) подвергают взаимодействию с соединением (II) в растворителе, причем предпочтительны протонные растворители, такие как метанол, этанол и уксусная кислота. Реакцию проводят, необязательно, в присутствии основания, при температуре между около 0 С и около 120 С, предпочтительно, между около 0 и около 25 С, получая азопродукт (III). Когда на данной стадии используют основание, оно может быть органическим, таким как пиридин или триэтиламин, или неорганическим, таким как карбонат калия или гидроксид натрия. Когда используют основание,его количество обычно составляет от около 1 до около 25 эквивалентов [считая на мольные эквиваленты соединения формулы (I)], причем предпочтительно количество около от 1 до 5 эквивалентов. На второй стадии последовательности реакций азосоединение (III) растворяют в подходящем растворителе и, необязательно, подвергают обработке основанием в количестве до около 20 эквивалентов, предпочтительно, до около 5 эквивалентов, получая перегруппированный пиразол формулы (IV). Температура реакции для этой стадии составляет от около 0 до около 120 С, предпочтительно, от около 0 до около 25 С. Растворитель может быть протонным, таким как метанол, этанол или уксусная кислота, или, предпочтительно, растворитель может быть апротонным, таким как дихлорметан, тетрагидрофуран или толуол. Подходящие основания могут быть органическими (такими как пиридин, триэтиламин или пиперидин), неорганическими (такими, как гидроксид натрия,карбонат калия, гидрид натрия) или металлорганическими (такими, как трет-бутоксид калия,метоксид натрия, диизопропиламид лития),причем предпочтительны органические или металлорганические основания. Соединение вышеуказанной формулы (III) обычно присутствует в молярном избытке. Предпочтительно присутствует от около 1 до около 2 моль соединения формулы (III), более предпочтительно от около 1,05 до около 1,1 моль. Соединения формулы (III), в которой Ar,R3, R4 и R5 имеют значения, определенные выше, при условии, что, когда R3 и R5, оба, представляют циано, R4 не может быть -C(O)OR8,являются новыми, и, таким образом, составляют один из признаков данного изобретения. Соединения формулы (II) можно получить по реакции соединения формулы (V)(V) где R3 и R4 имеют значения, определенные выше, с соединением формулы R5CH2L, где R5 имеет значения, определенные выше, и L представляет уходящую группу, в присутствии основания. Примеры подходящих уходящих групп включают галоген и тозилат (предпочтительно,галоген). Основание, обычно, представляет собой сильное основание (например, гидрид натрия или н-бутиллитий), и реакцию обычно проводят в апротонном растворителе (например,тетрагидрофуране) при температуре от около 7 значения, определенные выше, при условии,что, когда R3 представляет -CN, R4 не может быть -C(O)OR8, также являются новыми, и, таким образом, составляют дополнительный признак данного изобретения. Следующие неограничивающие примеры иллюстрируют изобретение. Пример 1. Получение 3-(4-хлорфенилсульфонил)-4-цианобутан-2-она. В реакционную колбу емкостью 300 мл добавляют 2,4 г (59,3 ммоль) гидрида натрия(60% дисперсия в масле) и 10 мл гексанов. Гексаны удаляют пипеткой и заменяют 60 мл сухого тетрагидрофурана (ТГФ). Суспензию охлаждают до -15 С и через воронку для добавления в течение 20 мин добавляют раствор 12,0 г (51,6 ммоль) 4-хлорфенилсульфонилацетона в 50 мл ТГФ, поддерживая температуру реакции ниже-12 С. Получаемый желтый раствор удаляют из холодной ванны и перемешивают при комнатной температуре в течение 30 мин. Раствор снова охлаждают до -5 С и через воронку по каплям добавляют 3,8 мл (54,1 ммоль) бромацетонитрила. Через 5 мин реакционную смесь удаляют из холодной ванны и перемешивают при комнатной температуре в течение ночи. Реакционную смесь гасят 1 мл насыщенного хлорида аммония и переносят вместе с 100 мл дихлорметана в делительную воронку, содержащую 100 мл рассола. Органический слой отделяют, а водный слой обратно экстрагируют один раз еще 50 мл дихлорметана. Объединенные органические слои затем сушат сульфатом натрия,фильтруют, концентрируют и хроматографируют через слой силикагеля, используя смесь 1:1 гексан:дихлорметан. Выделение дает 8,2 г (выход 59%) 3-(4-хлорфенилсульфонил)-4-цианобутан-2-она, желтого масла, которое имело чистоту 90% по данным ВЭЖХ. 1H ЯМР (CDCl3) показал желаемый продукт в качестве основного компонента: d 7,6 (м, 4 Н), 4,42 (дд, 1 Н), 2,78 (м,2 Н), 2,48 (с, 3 Н). Пример 2. Получение 3-(4-хлорфенилсульфонил)-3-[(2,6-дихлор-4-трифторметилфенил)азо]-4-цианобутан-2-она. В 250 мл реакционную колбу добавляют 2,0 г (35,7 ммоль) гранул гидроксида калия, затем 30 мл воды и 30 мл метанола. К этому раствору добавляют 6,9 г (25,5 ммоль) соединения 3-(4-хлорфенилсульфонил)-4-цианобутан-2-она. После достижения гомогенности к реакционной среде в виде одной порции добавляют 23,2 ммоль гидросульфатдиазониевой соли 2,6 дихлор-4-трифторметиланилина. После перемешивания в течение 45 мин при комнатной температуре реакционную смесь обрабатывают добавлением воды и дихлорметана. Слои разделяют и органический слой обратно экстрагируют один раз дихлорметаном (50 мл). Объединенные органические слои сушат (Na2SO4),фильтруют, концентрируют и хроматографируют через силикагель, используя смесь гек 002086 8 сан:этилацетат. Выделение дает 5,1 г (43%) указанного в заголовке соединения в виде стекловидного полутвердого вещества, которое по данным ВЭЖХ имеет чистоту 98%, и 1H ЯМР показывает, что он является целевым продуктом: d 7,6 (м, 4 Н), 7,65 (с, 2 Н), 3,3 (дд, 2 Н), 2,42(с, 3 Н). Пример 3. Получение 3-ацетил-5-амино-4(4-хлорфенил)сульфонил-1-(2,6-дихлор-4-трифторметилфенил)пиразола. Две капли триэтиламина добавляют к 0,51 г (1,0 ммоль) 3-(4-хлорфенилсульфонил)-3-(2,6 дихлор-4-трифторметилфенилазо)-4-цианобутан-2-она, растворенного в 10 мл дихлорметана. После перемешивания в течение ночи при комнатной температуре реакционную смесь обрабатывают добавлением дополнительного дихлорметана и промыванием водой. Органический слой отделяют, сушат (Na2SO4), фильтруют и концентрируют, получая 0,55 г указанного в заголовке соединения, которое имеет чистоту 94% по данным ВЭЖХ, т.пл. 158 С. Пример 4. Получение 2-(4-хлорфенилсульфонил)сукцинонитрила. В 500 мл реакционную колбу добавляют 2,0 г (51,0 ммоль) гидрида натрия (60% дисперсия в масле) и 20 мл гексанов. Гексаны удаляют пипеткой и заменяют 90 мл сухого тетрагидрофурана (ТГФ). Суспензию охлаждают до 0 С и с помощью воронки в течение 10 мин добавляют раствор 10,0 г (46,4 ммоль) 4-хлорфенилсульфонилацетонитрила в 90 мл ТГФ, поддерживая температуру реакции ниже 12 С. Получаемый раствор удаляют из холодной ванны и перемешивают при комнатной температуре в течение 40 мин. Раствор снова охлаждают до 0 С и через воронку по каплям добавляют 3,4 мл (48,7 ммоль) бромацетонитрила в 5 мл ТГФ. Спустя 5 мин, реакционную смесь удаляют из холодной ванны и перемешивают при комнатной температуре в течение двух часов. Реакционную смесь гасят 1 мл насыщенного хлорида аммония и концентрируют до масла, которое переносят с 150 мл дихлорметана в делительную воронку,содержащую 120 мл воды. Органический слой отделяют и промывают еще раз 120 мл воды и один раз 120 мл рассола. Органический слой затем сушат (Na2SO4), фильтруют, концентрируют и хроматографируют через слой силикагеля, используя смесь 85:15 гексан:этилацетат. Выделение дает 1,4 г (выход 12%) указанного в заголовке соединения в виде желтого порошка,которое имело чистоту 96% по данным ВЭЖХ,т.пл. 130-137 С. Пример 5. Получение 2-(4-хлорфенилсульфонил)-2-(2,6-дихлор-4-трифторметил)фенилазосукцинонитрила. В 50 мл реакционную колбу добавляют 0,45 г (1,77 ммоль) 2-(4-хлорфенилсульфонил) сукцинонитрила в 15 мл метанола. После достижения гомогенности к реакционной среде в виде одной порции добавляют 1,61 ммоль гид 9 росульфатдиазониевой соли 2,6-дихлор-4-трифторметиланилина. После перемешивания в течение 45 мин при комнатной температуре реакционную смесь обрабатывают добавлением рассола и дихлорметана. Слои разделяют и органический слой сушат (Na2SO4), фильтруют,концентрируют и хроматографируют через силикагель, используя смесь 90:10 гексан: этилацетат. Выделение дает 0,33 г (42%) указанного в заголовке соединения, красное кристаллическое твердое вещество, которое по данным 19F ЯМР имеет чистоту более 95%, т.пл.45-50 С. Пример 6. Получение 5-амино-3-циано-4(4-хлорфенилсульфонил)-1-(2,6-дихлор-4 трифторметилфенил)пиразола. Три капли триэтиламина добавляют к 0,3 г(0,61 ммоль) 2-(4-хлорфенилсульфонил)-2-(2,6 дихлор-4-трифторметил)фенилазосукцинонитрила в 20 мл дихлорметана. После перемешивания в течение двух часов при комнатной температуре реакционную смесь обрабатывают разбавлением дихлорметаном и распределяют с использованием воды. Слои разделяют, и водный слой обратно экстрагируют один раз дихлорметаном. Объединенные органические слои сушат (Na2SO4), фильтруют, концентрируют и хроматографируют через силикагель, элюируя смесью 90:10 гексан:этилацетат. Выделение дает 0,14 г (выход 47%) указанного в заголовке соединения, чистота 100% по данным ВЭЖХ, в виде оранжевой пены, т.пл. 90-95 С. Пример 7. Получение этил-2,3-дициано-2(2,6-дихлор-4-трифторметил)фенилазопропионата. 22,1 ммоль этилдицианопропионата в 20 мл абсолютного этанола охлаждают до 0 С и через воронку в течение 15 мин добавляют 20,9 ммоль гидросульфатдиазониевой соли 2,6 дихлор-4-трифторметиланилина. Реакционную смесь подогревают до комнатной температуры и перемешивают в течение ночи. Реакционную смесь обрабатывают добавлением воды и дихлорметана. Слои разделяют и водный слой обратно экстрагируют один раз дихлорметаном. Объединенные органические слои промывают один раз рассолом, и органический слой сушат(Na2SO4), фильтруют, концентрируют и хроматографируют через силикагель с использованием смеси 90:10 гексан:этилацетат. Выделение дает 2,7 г (33%) указанного в заголовке соединения в виде красного вязкого масла, которое содержит 82% желаемого азопродукта и 13% соответствующего гидразона. 1 Н ЯМР (CDCl3) показал целевой продукт в качестве основного компонента: d 7,70 (с, 2 Н), 4,44 (м, 2 Н), 3,58(кв., 2 Н), 1,39 (т., 3 Н). Пример 8. Получение 5-амино-3-циано-1(2,6-дихлор-4-трифторметилфенил)-4-карбоэтоксипиразола. В 100 мл реакционную колбу добавляют 0,51 г (1,30 ммоль) этил 2,3-дициано-2-(2,6 дихлор-4-трифторметил)фенилазопропионата в 10 20 мл тетрагидрофурана. Реакционную смесь охлаждают до -78 С, и в виде одной порции добавляют 0,52 г (1,30 ммоль) гидрида натрия(60% дисперсия в масле). Реакционную смесь подогревают до комнатной температуры в течение ночи. К реакционной смеси добавляют два грамма силикагеля и 40 мл этилацетата, и суспензию концентрируют и хроматографируют через силикагель, элюируя смесью 90:10 гексан:этилацетат (1 л) и 80:20 (2 л). Выделение дает 0,16 г (выход 38% в расчете на 82% чистый исходный материал) твердого вещества, которое имеет чистоту 99% по данным ВЭЖХ, т.пл. 201,5-202,5 С. Пример 9. Получение гидросульфатдиазониевой соли 2,6-дихлор-4-трифторметиланилина. В 100 мл реакционную колбу добавляют 5,3 г (23,2 ммоль) 2,6-дихлор-4-трифторметиланилина, растворенного в 45 мл ледяной уксусной кислоты. Раствор охлаждают в ванне с ледяной водой, и в виде одной порции добавляют 3,8 г (30,1 ммоль) нитрозилсерной кислоты. Реакционную смесь удаляют из ледяной ванны и перемешивают при комнатной температуре в течение двух часов. Получаемую диазониевую соль используют без очистки. Соединения формулы (IV), полученные по способу данного изобретения, полезны в качестве пестицидов. Хотя изобретение было описано в виде различных предпочтительных осуществлений,специалист в данной области понимает, что могут быть сделаны различные модификации, замены, исключения и изменения без отхода от его сущности. В соответствии с этим, предполагается, что объем данного изобретения ограничивается только объемом следующей формулы изобретения, включая ее эквиваленты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения, имеющего формулу в которой Аr представляет необязательно замещенный фенил или необязательно замещенный пиридил;Het представляет 5- или 6-членное гетероциклическое кольцо, имеющее от одного до трех кольцевых гетероатомов, которые являют 11 ся одинаковыми или различными и выбраны из группы, состоящей из азота, серы и кислорода,каждый атом углерода упомянутого кольца является незамещнным или замещн галогеном,C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкокси, C1-C6 галогеналкокси, циано, нитро, амино, N-(C1-C6 алкил)амино, N,N-ди(C1-C6 алкил) амино, ОН, -S(O)m(C1-C6 алкилом) илиR9 представляет фенил, необязательно замещенный одним или несколькими членами,выбранными из группы, состоящей из галогена,C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкокси, C1-C6 галогеналкокси, циано, нитро, амино,N-(C1-C6 алкил)амино, N,N-ди(C1-C6 алкил)амино, ОН, -S(O)m(C1-C6 алкила) и -S(O)m(C1-C6 гaлогеналкила); причм указанный способ включает(b) осуществление перегруппировки полученного таким образом соединения формулы(III) в протонном или апротонном растворителе в присутствии основания с образованием соответствующего соединения формулы (IV), 12 причм молярное соотношение (I):(II) составляет примерно от 1:1 до 1:2. 2. Способ по п.1, в котором Аr представляет фенил, имеющий от 0 до 5 заместителей, или пиридил, имеющий от 0 до 4 заместителей, причем каждый заместитель, когда он присутствует, выбран из группы, состоящей из галогена,CN, NO2, C1-C6 галогеналкила, C1-С 6 галогеналкокси, S(O)mСF3, SF5 и R10; и R10 представляет фенил, необязательно имеющий от одного до пяти заместителей, выбранных из группы, состоящей из галогена, C1-C6 алкила, C1-C6 галогеналкила, циано(C1-C6 алкила), циано, нитро,амино, гидразино, C1-C6 алкокси, C1-C6 галогеналкокси, (C1-C6 галогеналкил)карбонила, формила, (C1-C6 алкил)карбонила, тиокарбамоила,карбамоила, (C1-C6 алкокси)карбонила, SF5 иR8S(O)m, причем два соседних заместителя фенила необязательно соединены вместе, образуя 1,3-бутадиенилен, метилендиокси- или галогенметилендиоксигруппу. 3. Способ по п.1 или 2, в котором Аr имеет формулуZ представляет трехвалентный атом азота или радикал C-R7, причем другие три валентности атома углерода образуют часть ароматического кольца;R1 и R7 представляют независимо друг от друга водород, галоген, CN или NO2; иR10. 4. Соединение, которое представляет собой 3-(4-хлорфенилсульфонил)-3-(2,6-дихлор-4 трифторметилфенилазо)-4-цианобутан-2-он или 2-(4-хлорфенилсульфонил)-2-(2,6-дихлор-4 трифторметил)фенилазосукцинонитрил.
МПК / Метки
МПК: C07C 317/48, C07D 231/00
Метки: 1-арилпиразолов, способ, 3,4,5-тризамещённых, получения
Код ссылки
<a href="https://eas.patents.su/7-2086-sposob-polucheniya-345-trizameshhyonnyh-1-arilpirazolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 3,4,5-тризамещённых 1-арилпиразолов</a>
Предыдущий патент: Производные 1-арилпиразолов в качестве инсектицидов
Следующий патент: Способ введения фармацевтических препаратов и нуклеиновых кислот в скелетную мышцу
Случайный патент: Способ получения карбоксанилидов











