Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов
Номер патента: 19036
Опубликовано: 30.12.2013
Авторы: Форнаретто Мария Джойя, Ванотти Эрмес, Д'анелло Маттео, Баттистини Карло
Формула / Реферат
1. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1Н-пиррол-3-карбоксамида формулы (I) или его фармацевтически приемлемых солей
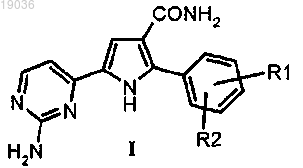
в котором R1 и R2 независимо выбирают из атома водорода, галогена или C1-C6 линейного или разветвленного алкила, включающий:
(а) взаимодействие пиррола формулы (II)
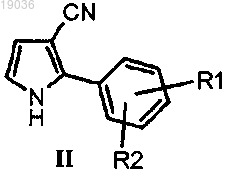
в котором R1 и R2 такие, как определено выше, с ацетилхлоридом в присутствии кислоты Льюиса;
(b) взаимодействие полученного соединения формулы (III)
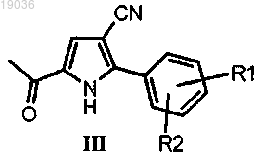
в котором R1 и R2 такие, как определено выше, с диалкилацеталем N,N-диметилформамида,
(с) взаимодействие полученного енаминона формулы (IV)
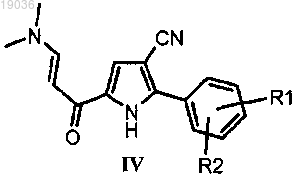
в котором R1 и R2 такие, как определено выше, с гуанидином или его солью, и затем
(d) гидролиз цианогруппы полученного соединения формулы (V)
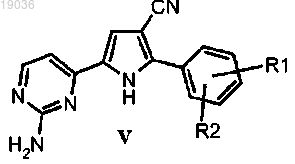
в котором R1 и R2 такие, как определено выше, в кислотных условиях, для того чтобы получить амид формулы (I), как указывалось выше, в виде соли;
и, если желательно, перевод полученной соли в свободное основание в основных условиях.
2. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1Н-пиррол-3-карбоксамида формулы (I) по п.1, включающий
гидролиз цианогруппы соединения формулы (V), определенного в п.1, в кислотных условиях и затем
перевод полученной соли амида формулы (I) в свободное основание в основных условиях.
3. Способ по п.1 или 2, где указанный способ дополнительно включает превращение карбоксамида формулы (I) в фармацевтически приемлемые соли.
4. Соединение формулы (III)
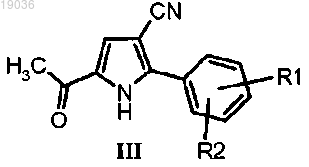
в котором R1 и R2 такие, как определено в п.1.
5. Способ получения соединения формулы (III), определенного в п.4, включающий приведение во взаимодействие пиррола формулы (II), определенного в п.1, с ацетилхлоридом в присутствии кислоты Льюиса.
6. Соединение формулы (IV)
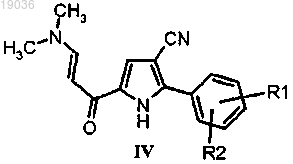
в котором R1 и R2 такие, как определено по п.1.
7. Способ получения соединения формулы (IV), определенного в п.6, включающий обработку соединения формулы (III), определенного в п.4, диалкилацеталем N,N-диметилформамида.
8. Соединение формулы (V)
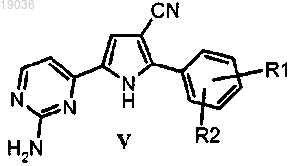
в котором R1 и R2 такие, как определено в п.1.
9. Способ получения соединения формулы (V), определенного в п.8, который включает приведение во взаимодействие соединения формулы (IV), определенного в п.6, с гуанидином или его солью.
10. Способ по п.1 или 5, отличающийся тем, что ацетилирование соединения формулы (II) для получения соединения формулы (III) проводят с ацетилхлоридом в присутствии кислоты Льюиса, такой как трихлорид алюминия или тетрахлорид титана, при охлаждении при температуре от -5 до 0°С или при комнатной температуре, в безводном органическом растворителе, таком как дихлорметан.
11. Способ по п.1 или 7, отличающийся тем, что превращение соединения формулы (III), определенного в п.4, в енаминон формулы (IV), определенного в п.6, проводят, используя диалкилацеталь, такой как диметил или диизопропилацеталь N,N-диметилформамида, при температуре между комнатной и температурой флегмы в органическом растворителе, таком как толуол, бензол, дихлорэтан или диметилформамид.
12. Способ по п.1 или 9, отличающийся тем, что превращение соединения формулы (IV), определенного в п.6, в соединение формулы (V), определенного в п.8, проводят приведением во взаимодействие гуанидина, гуанидингидрохлорида или гуанидинкарбоната при температуре от 80 до 130°С, в органическом растворителе, таком как ацетамид, N-метил-2-пирролидон или диметилформамид.
13. Способ по п.1, отличающийся тем, что гидролиз в кислотных условиях производного нитрила формулы (V), определенного в п.8, для получения карбоксамидов формулы (I), определенных в п.1, проводят в ледяной уксусной кислоте или трифторуксусной кислоте и концентрированной серной кислоте, необязательно в присутствии воды, при температуре от комнатной до 120°С.
14. Способ по п.2, отличающийся тем, что превращение в основных условиях соли карбоксамидов формулы (I), определенных в п.1, в свободное основание проводят, растворяя соль в подходящем растворителе, таком как диметилсульфоксид, и добавляя водный раствор основания, например аммиака, гидроксида натрия или гидроксида калия, перемешивая подходящий период времени и отфильтровывая свободное основание в виде осадка.
Текст
Настоящее изобретение относится к способу получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Нпиррол-3-карбоксамидов и к пригодным промежуточным соединениям данного способа. 5-(2 Аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамид описаны и заявлены в WO 2007110344,который также описывает способы их получения. Данные соединения могут быть успешно получены согласно способу, который позволяет получать желаемые продукты с высокими выходами и чистотой и с ограниченным набором стадий. Синтез начинается с производного цианопиррола и описан до финального гидролиза 5-(2-аминопиримидин-4-ил)-2-арил-1 Нпиррол-3-карбонила. Соединения, полученные в соответствии со способом по настоящему изобретению, способны ингибировать активность протеинкиназы и, в частности, Cdc7 илиCdc7/Cdks. Таким образом, данные соединения пригодны при лечении различных видов рака,клеточных пролиферативных заболеваний и заболеваний, связанных с протеинкиназами.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.р.л. (IT) Данное изобретение относится к способу получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Нпиррол-3-карбоксамидов и к пригодным промежуточным соединениям такого способа. В WO 2007110344 описаны и заявлены гетеропентациклы, способы их получения, содержащие их фармацевтические композиции и их применение в качестве терапевтических средств, особенно при лечении рака и клеточных пролиферативных заболеваний. В качестве примера приведены показательные гетеропентациклические соединения, необязательно в форме фармацевтически приемлемых солей: амид 5-(2-аминопиримидин-4-ил)-2-фенил-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-о-толил-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(4-фтор-2-метилфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,3-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,5-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2-хлорфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2-хлор-4-фторфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2-фтор-4-метилфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2,3-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты; амид 5-(2-аминопиримидин-4-ил)-2-(2-фтор-3-метоксифенил)-1 Н-пиррол-3-карбоновой кислоты и амид 5-(2-аминопиримидин-4-ил)-2-(2-фтор-4-хлорфенил)-1 Н-пиррол-3-карбоновой кислоты. Такие соединения способны ингибировать активность протеинкиназы и, в частности Cdc7Cdc7/Cdks. Более конкретно, соединения, полученные в соответствии с настоящим изобретением, пригодные для лечения различных видов рака и клеточных пролиферативных заболеваний. Данные соединения также могут быть активны в качестве ингибиторов других протеинкиназ и поэтому могут быть эффективны при лечении заболеваний, связанных с этими протеинкиназами. Эти соединения и их аналоги могут быть получены по известному химическому способу, включающему, в основном, реакцию конденсации производного карбоновой кислоты или с активированной формой аммиака, или с амином, для того чтобы получить необходимый амид. Такое производное карбоновой кислоты, в свою очередь, получают по методике, включающей сочетание галокетона с бетакетоэфиром, реакцию Ханча и гидролиз. В качестве ссылки, данный способ описан в вышеупомянутой заявке на патент WO 2007110344. В связи с этим авторы настоящего изобретения с удивлением обнаружили, что названные гетеропентациклические соединения могут быть с успехом получены способом, позволяющим получать желаемые продукты с высокими выходами и чистотой и с небольшим количеством стадий. Вследствие этого, первым объектом настоящего изобретения является способ получения 5-(2 аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамидов формулы (I) в которой R1 и R2 независимо представляют атом водорода или галогена или алкил, циклоалкил,арил, ароил, эфиры карбоновых кислот, циано или нитрогруппу, включающий:(а) приведение во взаимодействие пиррола формулы (II)(b) приведение во взаимодействие полученного соединения формулы (III) в которой R1 и R2 такие же, как определено выше, с диалкилацеталем N,N-диметилформамида,(с) приведение во взаимодействие полученного енаминона формулы (IV) в которой R1 и R2 такие же, как определено выше, с гуанидином или его солью, и затем(d) гидролиз цианогруппы полученного соединения формулы (V) в которой R1 и R2 такие же, как описано выше, в кислотных условиях, для того чтобы получить амид формулы (I), как определено выше, в виде соли; и, если желательно, перевод полученной соли в свободное основание в основных условиях. Следующим объектом настоящего изобретения является способ получения 5-(2-аминопиримидин 4-ил)-2-арил-1 Н-пиррол-3-карбоксамида формулы (I), определенной выше, данный способ включает гидролиз цианогрупп соединения формулы (V) в кислотных условиях и затем, если желательно, перевод полученной соли амида формулы (I), определенной выше, в свободное основание в основных условиях. Конечные соединения могут быть выделены и очищены при помощи стандартных методик, например хроматографией и/или кристаллизацией и образованием соли. Карбоксамиды формулы (I), определенной выше, могут быть переведены в фармацевтически приемлемые соли. Карбоксамиды формулы (I), определенной выше, или их фармацевтически приемлемые соли, могут быть затем смешаны с фармацевтически приемлемым носителем или разбавителей, для того чтобы создать фармацевтическую композицию. Более того, другим объектом настоящего изобретения является промежуточное соединение формулы III, IV или V, определенных выше, а также способы их получения. В настоящем описании термины"галоген" относится к брому, хлору, иоду или фтору, более предпочтительно хлору или фтору;"алкил" относится к линейным или разветвленным насыщенным алифатическим гидрокарбильным группам, содержащим от 1 до 6 атомов углерода; примерами данного термина являются такие группы,как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил и подобные им;"циклоалкил" относится к группам циклоалкилов, состоящим из 3-10 атомов углерода и имеющим одно циклическое кольцо или сложные циклические кольца, примерами которых являются адамантил,циклопропил, циклобутил, циклопентил, циклогексил, циклооктил и подобные им;"арил" относится к ароматической карбоциклической группе, состоящей из 6-14 атомов углерода,имеющей единственное кольцо (например, фенил) или составные конденсированные кольца (например,нафтил или антрил), чьи конденсированные кольца могут быть как ароматическими, так и неароматическими (например, 2-бензоксазолинон, 2 Н-1,4-бензоксазин-3(4 Н)-он-7-ил и подобные им), при условии,что местом присоединения служит ароматический атом углерода; предпочтительные арилы включают фенил и нафтил; в названии соединений формулы (I) арил является фенилом, замещенным R1 и R2, определенными выше;"ароил" относится к арилкарбонилу Ar-СО-, в котором арил такой же, как и определено здесь;"нитро" относится к группе -NO2. Согласно изобретению предпочтительными соединениями являются соединения, в которых R1 и R2 независимо представляют атомы водорода или галогена или алкил или алкоксигруппы, более предпочтительно метиловые группы, атомы фтора или хлора. Как указано выше, настоящее изобретение также представляет соединение формулы (III) в которой R1 и R2 такие же, как и определенные выше. Следующим объектом настоящего изобретения является способ получения соединения формулы(III), определенной выше, приведением во взаимодействие пиррола формулы (I), определенной выше, с ацетилхлоридом в присутствии кислоты Люиса. Настоящее изобретение также представляет соединение формулы (IV) в которой R1 и R2 такие же, как и определено выше. Еще одним объектом настоящего изобретения является способ получения соединения формулы(IV), определенной выше, обработкой соединения формулы (III), определенной выше, диалкилацеталемN,N-диметилформамида. Также представлено соединение формулы (V) в которой R1 и R2 такие же, как и определенные выше. Наконец, настоящее изобретение включает способ получения соединения формулы (V), определенной выше, приведением во взаимодействие соединения формулы (IV), определенной выше, с гуанидином или его солью. Ацилирование соединения формулы (II) для получения соединения формулы (III) предпочтительно проводят с ацетилхлоридом в присутствии кислоты Льюиса, например трихлорида алюминия или тетрахлорида алюминия, при охлаждении, например при температуре от -5 до 0 С, или при комнатной температуре, в безводном органическом растворителе, например дихлорметане. Похожая реакция описана в J.Het. Chem. 1983, 20, 61. Превращение соединения формулы (III) в енаминон формулы (IV) может быть проведено с использованием диалкилацеталя, например диметилацеталя или диизопропилацеталя, N,N-диметилформамида. Предпочтительно реакцию проводят при температуре между комнатной температурой и температурой флегмы, предпочтительно при температуре от 60 до 90 С в органическом растворителе, таком как, например, толуол, бензол, дихлорэтан или диметилформамид. Аналогичные превращения были описаны,например, в Heterocycles 1998, 47, 689. Превращение соединения формулы (IV) в соединение формулы (V) проводят приведением во взаимодействие с гуанидином, гуанидингидрохлоридом или гуанидинкарбонатом. Предпочтительно реакцию проводят при температуре от 80 до 130 С в органическом растворителе, таком как, например, ацетамид,N-метил-2-пирролидон, диметилформамид. Превращение подобного рода описано в научной литературе,например в J. Het. Chem. 1989, 26, 1147. Гидролиз в кислотных условиях производного нитрила формулы (V) для получения карбоксамидов формулы (I) предпочтительно проводят в ледяной уксусной кислоте или трифторуксусной кислоте и концентрированной серной кислоте, более предпочтительно в соотношениях между 1:1 или 5:1, необязательно в присутствии воды, при температуре между комнатной и 120 С, а именно при температуре от 60 до 90 С. Аналогичный гидролиз описан, например, в J. Org. Chem. 2005, 70, 1926. После базификации с концентрированным водным раствором аммиака, гидроксида натрия или гидроксида калия свободное основание отфильтровывают от осадка. Исходные соединения и реагенты, использованные в способе по настоящему изобретению, известны или могут быть получены из известных соединений при применении общеизвестных способов. В частности, исходные соединения формулы (II), определенной выше, известны или могут быть получены известными реакциями, исходя из известных соединений, см., например, соединения и их получения,описанные в ЕР 0347488; ЕР 0312723 и ЕР 0358047. Ниже представлены примеры, иллюстрирующие, но не ограничивающие изобретение. Пример 1. Стадия I. 5-Ацетил-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбонитрил (III, R1=R2=Cl) К смеси 2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбонитрила (6,00 г, 25,30 ммоль, см. ЕР 0312723) в 120 мл дихлорметана добавляли ацетилхлорид (3,18 г; 40,49 ммоль) при комнатной температуре, под азотом. Полученную смесь охлаждали до +2 С и в течение 20 мин небольшими порциями добавляли безводный трихлорид алюминия (8,10 г, 60,73 ммоль), поддерживая температуру реакции ниже 5 С. После последнего добавления смесь оставляли перемешиваться при комнатной температуре в течение 3 ч. Затем смесь медленно перелили в раствор ледяной 2 М HCl (120 мл) и изопропанола (28 мл). Водный слой отделяли и дважды экстрагировали смесью дихлорметана (120 мл) и изопропанола (28 мл). Объединенные органические экстракты концентрировали при пониженном давлении до состояния суспензии, которую обрабаты-3 019036 вали при перемешивании изопропанолом (30 мл) и разбавляли водой (60 мл) при комнатной температуре. Твердое вещество отфильтровывали и сушили под вакуумом при +50 С с получением 6,51 г продукта в виде белых, ворсистых кристаллов. Выход = 92%. 1 Н-ЯМР (ДМСО-d6),м.д.: 2,45 (с, 3H), 7,59 (м, 3H), 7,86 (дд, 1 Н), 13,05 (шс, 1 Н). К суспензии 5-ацетил-2-(2,4-дихлорфенил)-1 Н-пиррол-3-карбонитрила (6,2 г, 22,21 ммоль) в 155 мл толуола добавляли N,N-диметилформамид диизопропилацеталь (18,6 мл; 88,85 ммоль). Смесь перемешивали в течение 34 ч при 70 С. Затем добавляли дополнительное количество реагента (4,6 мл; 22,21 ммоль) и смесь нагрели до 80 С и интенсивно перемешивали еще 18 ч. После охлаждения до комнатной температуры твердое вещество фильтровали, промывали 25 мл толуола и сушили на воздухе с получением 6,8 г продукта в виде белого твердого вещества. Выход = 91%. 1 Н-ЯМР (ДМСО-d6),м.д.: 2,90 (м, 3 Н), 3,15 (шс, 3H), 5,74 (д, 1 Н), 7,37 (д, 1 Н), 7,57 (м, 2 Н), 7,69 (д,1 Н), 7,82 (дд, 1 Н), 12,64 (шс, 1 Н). К суспензии 5-(2-аминопиримидин-4-ил)-2-(2,4-дихлорфенил-1 Н-пиррол-3-карбонитрила (210 мг,0,636 ммоль) в 1,70 мл трифторуксусной кислоты последовательно добавляли при интенсивном перемешивании 0,21 мл воды и 0,42 мл 98% серной кислоты. Смесь перемешивали в течение 8 ч при 70 С и затем разбавляли, добавляя по каплям 3 мл воды в течение 10 мин. Реакционную смесь подщелочили (рН 10-12) добавлением 30% водного раствора аммиака при перемешивании и фильтровали осадок от свободного основания. Выпавшее твердое вещество фильтровали,промывали 1 мл воды и, наконец, сушили в вакуумной печи при 50 С, с получением 186 мг продукта в виде не совсем белого твердого вещества. Выход = 84%. 1 Н-ЯМР (ДМСО-d6/400 МГц),м.д.: 6,81 (шс, 1 Н), 6,95 (шс, 2 Н), 7,01 (д, J=5,73 Гц, 1 Н), 7,37 (шс,1 Н), 7,46 (д, J=2,68 Гц, 1 Н), 7,68 (дд, J=1,77, 0,55 Гц, 1 Н), 8,23 (д, J=5,73 Гц, 1 Н),12,17 (шс, 1 Н), 12,64HMRS (M+H)+ вычислено: 348,0414, найдено: 348,0415. Пример 2. Действуя, как описано на стадиях I-IV примера 1, и исходя из соответствующего замещенного пиррола формулы II (R1=R2=H; R1=CH3, R2=H; R1=R2=CH3; R1=R2=F; R1=Cl, R2=H; R1=Cl, R2=F; R1=Cl,R2=OCH3 и R1=F, R2=Cl), были получены следующие соединения: гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-фенил-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-о-толил-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(4-фтор-2-метилфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2,3-диметилфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2,3-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2,4-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2,5-дифторфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2-хлорфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2-хлор-4-фторфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2-фтор-4-метилфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2,3-дихлорфенил)-1 Н-пиррол-3-карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2-фтор-3-метоксифенил)-1 Н-пиррол-3 карбоновой кислоты; гидрохлорид амида 5-(2-аминопиримидин-4-ил)-2-(2-фтор-4-хлорфенил)-1 Н-пиррол-3-карбоновой кислоты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамида формулы (I) или его фармацевтически приемлемых солей в котором R1 и R2 независимо выбирают из атома водорода, галогена или C1-C6 линейного или разветвленного алкила, включающий:(а) взаимодействие пиррола формулы (II)(b) взаимодействие полученного соединения формулы (III) в котором R1 и R2 такие, как определено выше, с диалкилацеталем N,N-диметилформамида,(с) взаимодействие полученного енаминона формулы (IV) в котором R1 и R2 такие, как определено выше, с гуанидином или его солью, и затем(d) гидролиз цианогруппы полученного соединения формулы (V) в котором R1 и R2 такие, как определено выше, в кислотных условиях, для того чтобы получить амид формулы (I), как указывалось выше, в виде соли; и, если желательно, перевод полученной соли в свободное основание в основных условиях. 2. Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1 Н-пиррол-3-карбоксамида формулы (I) по п.1, включающий гидролиз цианогруппы соединения формулы (V), определенного в п.1, в кислотных условиях и затем перевод полученной соли амида формулы (I) в свободное основание в основных условиях. 3. Способ по п.1 или 2, где указанный способ дополнительно включает превращение карбоксамида формулы (I) в фармацевтически приемлемые соли. 4. Соединение формулы (III) в котором R1 и R2 такие, как определено в п.1. 5. Способ получения соединения формулы (III), определенного в п.4, включающий приведение во взаимодействие пиррола формулы (II), определенного в п.1, с ацетилхлоридом в присутствии кислоты в котором R1 и R2 такие, как определено по п.1. 7. Способ получения соединения формулы (IV), определенного в п.6, включающий обработку соединения формулы (III), определенного в п.4, диалкилацеталем N,N-диметилформамида. 8. Соединение формулы (V) в котором R1 и R2 такие, как определено в п.1. 9. Способ получения соединения формулы (V), определенного в п.8, который включает приведение во взаимодействие соединения формулы (IV), определенного в п.6, с гуанидином или его солью. 10. Способ по п.1 или 5, отличающийся тем, что ацетилирование соединения формулы (II) для получения соединения формулы (III) проводят с ацетилхлоридом в присутствии кислоты Льюиса, такой как трихлорид алюминия или тетрахлорид титана, при охлаждении при температуре от -5 до 0 С или при комнатной температуре, в безводном органическом растворителе, таком как дихлорметан. 11. Способ по п.1 или 7, отличающийся тем, что превращение соединения формулы (III), определенного в п.4, в енаминон формулы (IV), определенного в п.6, проводят, используя диалкилацеталь, такой как диметил или диизопропилацеталь N,N-диметилформамида, при температуре между комнатной и температурой флегмы в органическом растворителе, таком как толуол, бензол, дихлорэтан или диметилформамид. 12. Способ по п.1 или 9, отличающийся тем, что превращение соединения формулы (IV), определенного в п.6, в соединение формулы (V), определенного в п.8, проводят приведением во взаимодействие гуанидина, гуанидингидрохлорида или гуанидинкарбоната при температуре от 80 до 130 С, в органическом растворителе, таком как ацетамид, N-метил-2-пирролидон или диметилформамид. 13. Способ по п.1, отличающийся тем, что гидролиз в кислотных условиях производного нитрила формулы (V), определенного в п.8, для получения карбоксамидов формулы (I), определенных в п.1, проводят в ледяной уксусной кислоте или трифторуксусной кислоте и концентрированной серной кислоте,необязательно в присутствии воды, при температуре от комнатной до 120 С. 14. Способ по п.2, отличающийся тем, что превращение в основных условиях соли карбоксамидов формулы (I), определенных в п.1, в свободное основание проводят, растворяя соль в подходящем растворителе, таком как диметилсульфоксид, и добавляя водный раствор основания, например аммиака, гидроксида натрия или гидроксида калия, перемешивая подходящий период времени и отфильтровывая свободное основание в виде осадка.
МПК / Метки
МПК: C07D 403/04
Метки: получения, 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов, способ
Код ссылки
<a href="https://eas.patents.su/7-19036-sposob-polucheniya-5-2-aminopirimidin-4-il-2-aril-1n-pirrol-3-karboksamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 5-(2-аминопиримидин-4-ил)-2-арил-1н-пиррол-3-карбоксамидов</a>
Предыдущий патент: Обращенные силикатные жидкости для укрепления ствола скважины
Следующий патент: 5-[5-[2-[3,5-бис(трифторметил)фенил-2-метилпропаноилметиламино]-4-(4-фтор-2-метилфенил)]-2-пиридинил]-2-алкил-пролинамиды в качестве антагонистов рецептора nk1
Случайный патент: Индукционный электронагреватель











