Этанольный сольват (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси -8[4r-(3s-гидрокси-1-метил)пиперидинил]-4h-1-бензопиран-4-она
Формула / Реферат
1. Форма II (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4H-1-бензопиран-4-она, характеризующаяся следующей порошковой рентгенограммой, полученной с использованием CuK-альфа-излучения:
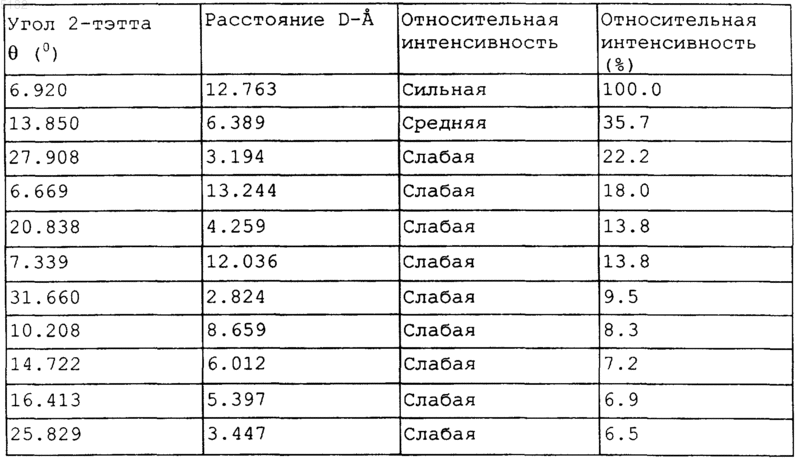
2. Способ получения формы II (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4H-1-бензопиран-4-она, включающий следующие стадии:
a) растворение достаточного количества гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4H-1-бензопиран-4-она в достаточном количестве этанола с образованием смеси;
b) нагрев смеси до температуры от около 50 до около 80шC;
c) необязательное отфильтровывание нерастворенного материала от смеси с получением раствора;
d) концентрирование раствора до удаления от около 50 до около 90% летучих компонентов;
e) охлаждение раствора и необязательное отделение полученных таким образом кристаллов гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4H-1-бензопиран-4-она;
f) необязательную сушку полученных кристаллов.
3. Способ по п.2, где охлаждение раствора осуществляют до температуры от около 0 до около 10шC.
4. Фармацевтическая композиция, содержащая терапевтически эффективное количество формы II (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4H-1-бензопиран-4-она по п.1 и фармацевтически приемлемый носитель.
5. Применение формы II по п.1, для получения фармацевтической композиции, предназначенной для лечения больного раком.
6. Применение формы II по п.1, в качестве фармацевтически активного соединения.
Текст
1 Предшествующий уровень Соединение (-)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-он или одна из его фармацевтически приемлемых солевых форм(известная как Флавопиридол) является иммуномодулятором и противовоспалительным средством (патент США 4900727) и ингибитором онкоген-кодируемых киназ или тирозинкиназ рецептора фактора роста (патент США 5284856). Флавопиридол является сильным ингибитором циклинзависимых киназ (CDKs),включающих CDK1, CDK2, CDK4, CDK6 иcdk7/циклин Н), при этом он обладает возможностью вызывать ингибирование продвижения клеточного цикла в G1 и G2 посредством множественных механизмов, связанных с ингибированием cdk. Смотри: International Journal of Oncology 9: 1143-1168 (1996). Было показано, что флавопиридол ингибирует также семейство EGF рецепторов, рецептор, связанный с семействомSRC киназ и преобразующие сигнал киназы. Эксперименты in vitro и in vivo показали, что флавопиридол способен ингибировать широкий диапазон типов опухолей человека, лейкозов и лимфом.(-)-цис-2-(2-Хлорфенил)-5,7-дигидрокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-он или его фармацевтически приемлемая соль кристаллизируется в виде множества сольватов при использовании растворителей, таких как этанол, ДМСО, метанол, ацетонитрил/изопропанол, этанол/изопропанол и изопропанол и в виде сольватных гидратов при использовании комбинаций растворителей, таких как этанол/ и изопропанол/вода. Самой подходящей сольватной формой является этанольный сольват гидрохлорида флавопиридола (далее в описании форма II). Предпочтительное использование этанола по сравнению с другими растворителями, используемыми для получения сольватов, обеспечивает преимущество, выражающееся в меньшей токсичности (по сравнению, например, с метанольными и изопропанольными сольватами). Предметом настоящего изобретения является форма II(-)-цис-2-(2-хлорфенил)-5,7-дигидрокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-она, представляющая собой сольват этанола с гидрохлоридом (-)-цис-2-(2 хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси 1-метил)пиперидинил]-4H-1-бензопиран-4-она. Данная форма II может быть описана следующим образом с помощью порошковой дифракции рентгеновских лучей на образце порошка,полученной с использованием CuK-альфаизлучения: 2 Расстояние D12.763 6.389 3.194 13.244 4.259 и более предпочтительно в виде: Расстояние D-12.763 6.389 3.194 13.244 4.259 12.036 2.824 8.659 6.012 5.397 3.447 Форма II может быть также идентифицирована следующим образом: Расстояние D- Относительная интенсивность 12.763 Сильная 6.389 Средняя 3.194 Слабая Расстояние D- Относительная интенсивность 13.244 Слабая 4.259 Слабая 12.036 Слабая 2.824 Слабая 8.659 Слабая 6.012 Слабая 5.397 Слабая 3.447 Слабая Форма II может быть, кроме того, идентифицирована следующим образом: Расстояние D- Относительная интенсивность(%) 12.763 100.0 6.389 35.7 3.194 22.2 13.244 18.0 4.259 13.8 12.036 13.8 2.824 9.5 8.659 8.3 6.012 7.2 5.397 6.9 3.447 6.5 Форма II может быть также идентифицирована, как показано в табл. 1. Угол 2- Расстояние Относительная интенсивность Сильная Средняя Слабая Слабая Слабая Относительная интенсивность Слабая Слабая Слабая Слабая Слабая Слабая Форма II может быть использована в виде фармацевтического препарата, необязательно вместе с фармацевтически приемлемыми носителями и/или наполнителями. Кроме того, она может быть использована для получения других полиморфов или псевдополиморфов (-)-цис-2(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4 она. Форма II является гигроскопичной. Она может быть использована в виде формы, не содержащей воду или в виде формы с некоторым содержанием воды. Предпочтительно ее использование в виде формы, по существу не содержащей воду. Другим предметом настоящего изобретения является способ получения формы II(-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она. Стадии способа получения формы II (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-она представляют собой:a) растворение достаточного количества гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в достаточном количестве этанола с образованием смеси;b) нагрев смеси до температуры от около 50 до около 80 С;c) необязательное фильтрование нерастворенного материала из смеси с получением раствора;d) концентрирование раствора до удаления от около 50 до около 90% летучих компонентов;e) охлаждение раствора, например до температуры от около 0 до 10 С, и необязательное выделение полученных таким образом кристаллов гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она;f) необязательную сушку кристаллов. Выражение достаточное количество гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она означает количество, достаточное для растворения и нагрева в соответствии со стадиями способа по изобретению с целью образования достаточного количества кристаллов, которые можно выделить. Выражение достаточное количество этанола аналогично означает количество, достаточное для растворения по меньшей мере части добавлен 4 ного к нему гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1 метил)пиперидинил]-4 Н-1-бензопиран-4-она. Указанные количества могут быть определены экспериментально. Выражение летучие компоненты означает вещества, которые могут быть выпарены во время нагрева, например, такие как этанол и/или вода. Настоящее изобретение также включает фармацевтическую композицию, содержащую терапевтически эффективное количество формыII и фармацевтически приемлемый носитель. Выражение фармацевтически приемлемый носитель означает вещество, которое является нетоксичным, не оказывает влияние на терапевтический профиль формы II и является подходящим для способа ведения. Форму II предпочтительно вводят внутривенно в течение периода времени, подходящего для химиотерапии рака. Форму II предпочтительно смешивают с одним или несколькими фармацевтически приемлемыми носителями. Так например, форма II может быть смешана для внутривенного введения больному с изоосмотическими жидкостями и жидкостями с регулируемыми значениями рН, такими как вода, смесь декстроза/вода или смесь солевой раствор/вода. Терапевтически эффективное количество формы II будет изменяться в зависимости от индивидуума, сопутствующей терапии, вида заболевания и других переменных факторов. Обычно указанное количество будет составлять от около 0,001 мг/кт массы тела до 100 мг/кг массы тела в день. Форма II является пригодной в качестве ингибитора протеинкиназы и ингибитора циклинзависимой киназы и является полезной при лечении различных форм рака. Синтез На стадии а) указанного способа получения одну часть (-)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она растворяют в 1030, предпочтительно 15-25, в особенности в 1921 частях этанола. Предпочтительно используется этанол, который по существу не содержит воду. (-)-Цис-2-(2-хлорфенил)-5,7-дигидрокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-он может быть получен, как указано в патенте США 5284856; предпочтительно (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-он получают, как описано ниже в примере 1. Нагрев полученной смеси осуществляется предпочтительно в течение около одного часа при температуре от 50 до 80, предпочтительно от 60 до 80 и в особенности от 70 до 79 С. Если в растворе наблюдается твердое вещество, его можно отфильтровать, предпочтительно в то время, пока раствор еще горячий. 5 Полученный раствор концентрируют способами, известными специалистам в данной области, предпочтительно перегонкой при атмосферном или пониженном давлении. Концентрирование осуществляется до тех пор, пока будет удалено от 50 до 90%, предпочтительно от 55 до 85%, в особенности от 60 до 80% летучих компонентов. Оставшуюся суспензию затем охлаждают,предпочтительно до температуры от около 0 до 10 С и полученные кристаллы удаляют из суспензии предпочтительно фильтрацией. Полученные кристаллы можно сушить,предпочтительно при пониженном давлении. Пример 1. Синтез формы II. Реактор загружают в атмосфере азота (-)цис-1-метил-4R-(2,4,6-триметоксифенил)-3Sпиперидинолом и уксусным ангидридом. При перемешивании с постоянной скоростью добавляют этерат трифторида бора и полученный раствор охлаждают до температуры 8-20 С. После завершения добавления образованную смесь перемешивают при 20-30 С в течение 3-5 ч. Реакционную смесь охлаждают до 8-12 С и при перемешивании добавляют смесь воды со льдом и затем водный раствор гидроксида натрия до достижения рН 10-11. Смесь экстрагируют этилацетатом. Этилацетатные экстракты объединяют и концентрируют в вакууме. Остаток переносят в метанол и воду. Затем добавляют гидроксид натрия (примерно 50% водный раствор). Реакционную смесь перемешивают при 20-30 С в течение 2-3 ч. Смесь выпаривают при пониженном давлении и температуре 80C. Остаток охлаждают до температуры 15-20 С и с использованием концентрированной соляной кислоты рН доводят до значения 8,5-9,5. Твердые осадки, собранные фильтрацией, промывают деминерализованной водой и сушат при пониженном давлении, при этом получают -)-цис-1-метил-4-(3-ацетил-4,6 диметокси-2-гидрокси)фенил-3-пиперидинол). Затем-)-цис-1-метил-4-(3-ацетил-4,6 диметокси-2-гидрокси)фенил-3-пиперидинол) порциями добавляют к перемешиваемой суспензии трет-бутоксида калия в сухом N,Nдиметилформамиде при такой скорости, чтобы температура не превышала 20 С. После завершения добавления образованную смесь перемешивают в течение одного часа при температуре 30 С. Метил 2-хлорбензоат добавляют с такой скоростью, чтобы температура не превышала 30 С. Образованную смесь перемешивают при 20-30 С в течение 4-6 ч. Добавляют деминерализованную воду, затем концентрированную соляную кислоту до достижения рН смеси 6-8. Смесь два раза экстрагируют, используя хлороформ. Хлороформные экстракты объединяют вместе и концентрируют при пониженном давлении. 6 После охлаждения оставшегося масла до температуры 40 С добавляют концентрированную соляную кислоту. Затем смесь перемешивают при 40 С в течение 2 ч или, когда необходимо, в течение ночи. После охлаждения реакционной смеси добавляют воду и хлороформ. Полученную смесь подщелачивают с использованием раствора гидроксида натрия(50%) до рН 8,5-10,5. Фазы разделяют. Затем водный слой экстрагируют хлороформом. Объединенные органические экстракты выпаривают при пониженном давлении с получением (-)-цис-2-(2-хлорфенил)5,7-диметокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в виде масла,которое непосредственно используют на следующей стадии без очистки. К (-)-цис-2-(2-хлорфенил)-5,7-диметокси 8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1 бензопиран-4-ону добавляют хинолин и пиридин. Образованную смесь нагревают при перемешивании до 160-190 С. Перемешивание продолжается в течение 2 ч при поддержании температуры 160-190 С. После охлаждения реакционной смеси до 90-110 С добавляют воду. Полученную смесь подщелачивают с использованием насыщенного раствора карбоната натрия до рН 7,5-8,5. Смесь этанола дважды экстрагируют смесью этанола и хлороформа. Объединенные экстракты выпаривают досуха с получением сырого (+)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8-[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в виде коричневой смолы, которую очищают следующим образом. К сырому (+)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8-[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-ону добавляют ацетон. Полученную смесь перемешивают при 55-60 С в течение 30-60 мин, затем охлаждают до 15-20 С и перемешивают в течение еще 1-2 ч. Осажденное твердое вещество отделяют фильтрацией, дважды промывают ацетоном и сушат при пониженном давлении с получением(+)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8-[4R(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в очищенной форме. Свободное основание с предыдущей стадии суспендируют в этаноле и подкисляют концентрированной соляной кислотой с такой скоростью, чтобы температура не превышала 30 С. Во время процесса все твердое вещество сначала растворяется и затем осаждается гидрохлорид. Суспензию охлаждают до 0-10 С и перемешивают в течение 1 ч при поддержании температуры. Кристаллы выделяют фильтрацией и промывают холодным этанолом с получением сырого гидрохлорида (-)-цис-2-(2-хлорфенил)5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил) пиперидинил]-4 Н-1-бензопиран-4-она. К сырому гидрохлориду (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1 7 метил)пиперидинил]-4 Н-1-бензопиран-4-она добавляют этанол. Полученную смесь нагревают до 70-79 С, перемешивают в течение 1 ч при поддержании температуры и затем фильтруют,пока она еще горячая. Фильтр промывают горячим этанолом. Фильтрат концентрируют атмосферной перегонкой до удаления от около 50% до около 90% летучих компонентов. Затем оставшуюся суспензию охлаждают до 0-10 С, выделяют фильтрацией осадок и сушат при пониженном давлении с получением очищенного этанольного сольвата гидрохлорида (-)-цис-2-(2 хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси 1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в виде желтого твердого вещества. Флавопиридол является пригодным для лечения ряда болезненных состояний или заболеваний, вследствие ингибирования протеинкиназ и в особенности, как указывалось выше,циклинзависимых киназ. Предполагается, что флавопиридол полезен для лечения широкого диапазона раковых заболеваний, включающих,например, лейкоз, мезотелиому и раки легкого(крупноклеточный, мелкоклеточный и немелкоклеточный), прямой кишки, молочной железы,яичников, меланомы простаты, почек, тела матки и центральной нервной системы. Все цитированные в данном описании статьи и патенты включены в него в качестве ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Форма II (-)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она, характеризующаяся следующей порошковой рентгенограммой, полученной с использованием СuK-альфаизлучения: 8 2. Способ получения формы II (-)-цис-2-(2 хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси 1-метил)пиперидинил]-4 Н-1-бензопиран-4-она,включающий следующие стадии:a) растворение достаточного количества гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она в достаточном количестве этанола с образованием смеси;b) нагрев смеси до температуры от около 50 до около 80 С;c) необязательное отфильтровывание нерастворенного материала от смеси с получением раствора;d) концентрирование раствора до удаления от около 50 до около 90% летучих компонентов; е) охлаждение раствора и необязательное отделение полученных таким образом кристаллов гидрохлорида (-)-цис-2-(2-хлорфенил)-5,7 дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]-4 Н-1-бензопиран-4-она;f) необязательную сушку полученных кристаллов. 3. Способ по п.2, где охлаждение раствора осуществляют до температуры от около 0 до около 10 С. 4. Фармацевтическая композиция, содержащая терапевтически эффективное количество формы II (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси-8[4R-(3S-гидрокси-1-метил)пиперидинил]4 Н-1-бензопиран-4-она по п.1 и фармацевтически приемлемый носитель. 5. Применение формы II по п.1, для получения фармацевтической композиции, предназначенной для лечения больного раком. 6. Применение формы II по п.1, в качестве фармацевтически активного соединения.
МПК / Метки
МПК: A61K 31/453, A61P 35/00, C07D 405/04
Метки: цис-2-(2-хлорфенил)-5,7-дигидрокси, сольват, 8[4r-(3s-гидрокси-1-метил)пиперидинил]-4h-1-бензопиран-4-она, этанольный
Код ссылки
<a href="https://eas.patents.su/5-5182-etanolnyjj-solvat-cis-2-2-hlorfenil-57-digidroksi-84r-3s-gidroksi-1-metilpiperidinil-4h-1-benzopiran-4-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Этанольный сольват (-)-цис-2-(2-хлорфенил)-5,7-дигидрокси -8[4r-(3s-гидрокси-1-метил)пиперидинил]-4h-1-бензопиран-4-она</a>
Предыдущий патент: Ацетиленовый генератор
Следующий патент: Производные хинолилпропилпиперидина, их получение и содержащие их композиции
Случайный патент: Способ проведения расчетов в телекоммуникационной системе









