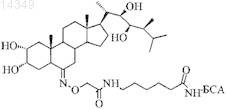
(22r,23r)-2a,3a,22,23-тетрагидрокси-26-(гемисукцинат)-в-гомо-7-окса-5a-холестан-6-он в качестве гаптена в синтезе конъюгата 28-норбрассинолида с бычьим сывороточным альбумином
Номер патента: 15276
Опубликовано: 30.06.2011
Авторы: Антончик Алексей Владимирович, Жабинский Владимир Николаевич, Литвиновская Раиса Павловна, Свиридов Олег Васильевич, Новик Татьяна Валентиновна, Матвеенцев Виталий Демидович, Прядко Андрей Георгиевич, Хрипач Владимир Александрович, Драч Светлана Васильевна
Формула / Реферат
(22R,23R)-2a,3a,22,23-Тетрагидрокси-26-(гемисукцинат)-В-гомо-7-окса-5a-холестан-6-он со структурной формулой
в качестве гаптена для получения иммуногена-конъюгата 28-норбрассинолида с бычьим сывороточным альбумином.
Текст
Изобретение относится к области биоорганической химии, а именно к новому химическому соединению (22R,23R)-2,3,22,23-тетрагидрокси-26-(гемисукцинат)-В-гомо-7-окса-5-холестан 6-ону, которое может быть использовано в качестве гаптена в синтезе иммуногена - конъюгата 28-норбрассинолида с бычьим сывороточным альбумином для получения антител, специфичных к 7-окса-6-оксобрассиностероидам. Задачей настоящего изобретения является (22R,23R)2,3,22,23-тетрагидрокси-26-(гемисукцинат)-В-гомо-7-окса-5-холестан-6-он в качестве гаптена в синтезе иммуногена (конъюгата 28-норбрассинолида с бычьим сывороточным альбумином). Поставленная задача решается заявляемым соединением в качестве гаптена, который получают по схеме, включающей взаимодействие пентаацетата (22R,23R)-2,3,22,23,26-пентагидрокси 5-холестан-6-она с трифторнадуксусной кислотой с последующим омылением защитных группировок полученного лактона гидроксидом калия и релактонизацией под действием соляной кислоты с образованием пентагидроксилактона, защитой вицинальных вторичных гидроксильных групп в виде ацетонидов, присоединением остатка янтарной кислоты по первичной гидроксильной группе образовавшегося диацетанида и гидролизом ацетонидных группировок. Хрипач Владимир Александрович, Жабинский Владимир Николаевич, Антончик Алексей Владимирович, Литвиновская Раиса Павловна, Драч Светлана Васильевна, Свиридов Олег Васильевич, Прядко Андрей Георгиевич, Новик Татьяна Валентиновна, Матвеенцев Виталий Демидович (BY)(71)(73) Заявитель и патентовладелец: ГОСУДАРСТВЕННОЕ НАУЧНОЕ УЧРЕЖДЕНИЕ "ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ НАЦИОНАЛЬНОЙ АКАДЕМИИ НАУК БЕЛАРУСИ" (BY) 015276 Изобретение относится к области биоорганической химии, а именно новому химическому соединению - (22R,23R)-2,3,22,23-тетрагидрокси-26-(гемисукцинат)-В-гомо-7-окса-5-холестан-6-он со структурной формулой 1 Заявляемое соединение может быть использовано в качестве гаптена в синтезе иммуногена - конъюгата 28-норбрассинолида с бычьим сывороточным альбумином для получения антител, специфичных к 7-окса-6-оксобрассиностероидам. Брассиностероиды (БС) - природные низкомолекулярные биорегуляторы, которые являются гормонами растений [1, 2]. Они присутствуют во всех растительных объектах и обладают ростмодулирующим и адаптогенным действием. Содержание брассиностероидов в растениях очень низко - 10-5-10-9% и менее. В очень малых концентрациях они проявляют и свое биологическое действие. Установлено, например, что при обработке различных сельскохозяйственных культур в дозах 5-20 мг на гектар посевов наблюдается заметный ростстимулирующий и адаптогенный эффект, приводящий к увеличению урожая,повышению качества продукции и устойчивости растений к неблагоприятным условиям и болезням [38]. Эти свойства брассиностероидов делают их привлекательными в качестве основы для агропрепаратов. Одним из наиболее известных в настоящее время является препарат эпин, действующим веществом которого стал фитогормон 24-эпибрассинолид. Наибольшую активность проявляют брассиностероиды, имеющие в своей структуре 7-окса-6-оксогруппировку (так называемые брассиностероидные лактоны) [1]. Низкое содержание БС в природных объектах и исчезающе малые дозы, вызывающие их эффект, делают необходимым разработку методов анализа брассиностероидов, в частности брассиностероидных лактонов. В качестве доступного метода предложен метод иммуноферментного определения 7-окса-6-оксобрассиностероидов, который, прежде всего, требует наличия соответствующего иммуногена. Брассиностероиды сами по себе не обладают иммуногенностью, поэтому для получения иммунного ответа у животных они должны быть использованы для иммунизации в виде конъюгатов с белками, которые, в свою очередь, могут быть получены через соответствующие гаптены. В настоящее время неизвестны гаптены на основе брассиностероидов, содержащие полный набор незамещенных характеристических функций в циклической части и в боковой цепи. Наиболее близок к заявляемому гаптен на основе брассинолида формулы который представляет собой эфир янтарной кислоты по С 3-гидроксильной группе брассинолида [9], являющейся одним из ключевых структурных элементов, необходимых для проявления биологической активности. Синтезированный на его основе конъюгат не позволил получить антитела, специфичные даже к исходным 24S-метилбрассиностероидам. Известны также гаптены кастастерона формулы 3 и 24-эпикастастерона формулы 4 которые предложены авторами для получения конъюгатов с белком для выработки антител, использованных в радиоиммуноанализе брассиностероидов [10] и иммунохимическом анализе 24Rбрассиностероидов [11, 12] соответственно. Однако синтезированный таким образом конъюгат 3 не позволил получить антитела, специфичные даже к группе 24S-метилбрассиностероидов, для анализа кото-1 015276 рых он был предназначен. С помощью конъюгата 4 удалось получить антитела, специфичные только к группе 24R-метилбрассиностероидов и неспособные различать особенности строения цикла В молекулы. Неизвестны гаптены и, следовательно, иммуногены на основе 28-норбрассиностероидов. Задачей настоящего изобретения является (22R,23R)-2,3,22,23-тетрагидрокси-26-(гемисукцинат)В-гомо-7-окса-5-холестан-6-он (1) в качестве гаптена в синтезе конъюгата 28-норбрассинолида с бычьим сывороточным альбумином. Поставленная задача решается заявляемым соединением в качестве гаптена, который получают по схеме 1 взаимодействием ацетата (22R,23R)-2,3,22,23,26-пентагидрокси-5-холестан-6-она 5 [13] с трифторнадуксусной кислотой с последующим омылением защитных группировок полученного лактона 6 гидроксидом калия и релактонизацией под действием соляной кислоты с образованием пентагидроксилактона 7, защитой вицинальных вторичных гидроксильных групп в виде ацетонидов, присоединением остатка янтарной кислоты по первичной гидроксильной группе образовавшегося диацетанида 8 и гидролизом ацетонидных группировок. Схема 1 Пример 1. Смесь (22R,23R)-2,3,22,23,26-пентагидрокси-5-холестан-6-он 5 (405 мг, 0,868 ммоль),Ас 2 О (6 мл, 63,6 ммоль), DMAP (39 мг, 0,319 ммоль) и пиридина (10 мл) выдерживают при температуре 65 С 24 ч. Реакционную смесь разбавляют водой и экстрагируют EtOAc (340 мл). Объединенные органические экстракты сушат над Mg2SO4, растворитель отгоняют под вакуумом, остаток хроматографируют на колонке с силикагелем. Полученный пентаацетат растворяют в CH2Cl2 (20 мл) и прибавляют при -15 С к раствору трифторнадуксусной кислоты, приготовленному из трифторуксусного ангидрида (3,0 мл) и 30% перекиси водорода (0,87 мл) в CH2Cl2 (14 мл). Реакционную смесь перемешивают при -15 С в течение 5 ч,затем разбавляют насыщенным раствором NaHSO3 и экстрагируют CH2Cl2 (340 мл). Объединенные органические экстракты сушат над Mg2SO4, растворитель отгоняют под вакуумом, остаток наносят на колонку с силикагелем и элюируют смесью петролейного эфира и этилацетата (20:15:1). Получают 400 мг (66%)(22R,23R)-2,3,22,23,26-пентаацетокси-В-гомо-7-окса-5-холестан-6-он 6. 1 Н ЯМР (500 МГц) : 0.71 (3 Н, с, 18-СН 3), 0.96 (3 Н, с, 19-СН 3), 1.98 (3 Н, с, ацетат), 2.00 (3 Н, с, ацетат), 2.02 (3 Н, с, ацетат), 2.04 (3 Н, с, ацетат), 2.09 (3 Н, с, ацетат), 2.97 (1H, дд, J= 4.6, 12.3 Гц, С 5-Н), 3.824.12 (4 Н, м, С 26-Н и С 7-Н), 4.85 (м, 1H, С 2-Н), 4.97 (1H, м, С 22-Н или С 23-Н), 5.21 (1H, м, С 22-Н или С 23-Н),5.34 (1H, м, С 3-Н). 13 С ЯМР (125 МГц) : 11.56, 12.73, 12.86, 15.40, 15.95, 18.15, 20.76, 20.81, 20.89, 20.99, 21.07, 22.21,24.65, 28.01, 28.90, 28.97, 29.26, 34.86, 37.41, 38.35, 38.84, 39.12, 39.41, 41.97, 42.46, 51.28, 52.31, 52.41,58.30, 67.88, 67.99, 68.88, 69.18, 70.33, 70.41, 71.20, 71.81, 76.31, 76.53, 169.88, 170.17, 170.31, 170.39,170.45, 170.95, 174.95. К раствору лактона 6 (95 мг) в метаноле (4 мл) прибавляют KOH (200 мг) и кипятят 1 ч, затем прибавляют уксусную кислоту (0,5 мл), выдерживают в течение 1,5 ч. К реакционной смеси прибавляют силикагель (3 мл) и упаривают. Остаток наносят на колонку с силикагелем и элюируют смесью хлороформа и метанола (15:16:1). Получают 62 мг (93%) (22R,23R)-2,3,22,23,26-пентагидрокси-В-гомо-7 окса-5-холестан-6-она 7. Т.пл. 261-263 С (CHCl3-MeOH). 1 Н ЯМР (CDCl3+CD3OD, 500 МГц) : 0.71 (3 Н, с, 18-СН 3), 0.88 (3 Н, с, 19-СН 3), 2.97 (1H, дд, J=3.9,12.3 Гц, С 5-Н), 3.28-3.61 (5 Н, м, С 2-Н, С 22-Н, С 23-Н, С 26-Н), 3.92 (1 Н, м, С 3-Н), 4.12 (2 Н, м, С 7-Н). 13 С ЯМР (CDCl3+CD3OD, 125 МГц) : 10.73, 11.00, 14.45, 15.28, 17.14, 21.54, 23.96, 26.81, 30.71,31.28, 31.76, 36.67, 36.75, 36.79, 37.48, 38.54, 39.07, 40.37, 40.43, 41.75, 50.61, 51.61, 51.66, 57.48, 65.99,67.11, 67.21, 67.49, 70.06, 70.16, 75.71, 76.16, 177.32. Смесь пентаола 7 (106 мг, 0,214 ммоль), TsOHH2O (1 мг, 5,2 мкмоль), 2,2-диметоксипропана (0,3-2 015276 мл, 2,4 ммоль), CH2Cl2 (4 мл) и МеОН (0,6 мл) перемешивают в течение 3 ч, затем к реакционной смеси прибавляют триэтиламин (0,1 мл) и упаривают. Остаток наносят на колонку с силикагелем и элюируют смесью циклогексана и этилацетата (10:12:1). Получают 79 мг (60%) (22R,23R)-2,3,22,23 бис(изопропилидендиокси)-26-гидрокси-В-гомо-7-окса-5-холестан-6-она 8. 1 Н ЯМР (500 МГц) : 0.70 (3 Н, м, 18-СН 3), 0.86 (3 Н, с, 19-СН 3), 1.29 (3 Н, с, ацетонид), 1.346 (3 Н, с,ацетонид), 1.351 (3 Н, с, ацетонид), 1.49 (3 Н, с, ацетонид), 3.27 (1 Н, дд, J=3.4, 10.7 Гц, С 5-Н), 3.38-3.86(4 Н, м), 4.07 (2 Н, м), 4.36 (2 Н, м). 13 С ЯМР (125 МГц) : 11.92, 12.64, 16.77, 18.11, 19.62, 22.91, 23.54, 24.36, 26.39, 27.02, 27.28, 27.48,27.83, 32.94, 33.35, 34.95, 35.41, 35.46, 35.82, 36.32, 38.39, 39.29, 39.51, 40.13, 43.04, 51.72, 53.04, 54.61,67.29, 68.37, 72.40, 73.01, 74.43, 76.52, 82.71, 82.83, 107.52, 107.90, 108.09, 176.64. Смесь спирта 8 (115 мг, 0,199 ммоль), янтарного ангидрида (110 мг, 1,1 ммоль), DMAP (30 мг, 0,25 ммоль) и пиридина (4 мл) выдерживают при температуре 90 С в течение суток. После этого реакционную смесь упаривают, остаток наносят на колонку с силикагелем и элюируют смесью циклогексана и этилацетата (10:11:2). Получают 120 мг (90%) (22R,23R)-2,3,22,23-бис(изопропилидендиокси)-26(гемисукцинат)-В-гомо-7-окса-5-холестан-6-она 9. 1 Н ЯМР (500 МГц) : 0.71 (3 Н, м, 18-СН 3), 0.86 (3 Н, с, 19-СН 3), 1.30 (3 Н, с, ацетонид) 1.34 (6 Н,уш.с, ацетонид), 1.49 (3 Н, с, ацетонид), 2.64 (4H, м, СО 2 СН 2 СН 2 СО 2 Н), 3.27 (1H, дд, J=3.8, 10.7 Гц, С 5-Н),3.61 (1 Н, т, J=9 Гц, С 23-Н), 3.79 (1 Н, м, С 22-Н), 3.91-4.11 (4 Н, м), 4.37 (2 Н, м). 13 С ЯМР (125 МГц) : 11.90, 11.93, 12.69, 12.76, 16.61, 17.84, 19.62, 22.93, 23.55, 24.38, 26.39, 27.01,27.33, 27.48, 27.86, 28.79, 28.84, 28.90, 30.26, 30.32, 33.37, 35.59, 35.69, 35.85, 36.77, 36.84, 39.30, 39.52,40.16, 43.07, 51.72, 53.05, 54.64, 68.97, 69.78, 71.19, 72.42, 73.02, 75.00, 75.22, 82.82, 83.01, 107.58, 107.93,107.99, 172.12, 172.15, 176.75, 176.97. Смесь диацетонида 9 (23 мг, 41,4 мкмоль), уксусной кислоты (2,5 мл) и воды (0,5 мл) выдерживают при температуре 110 С в течение 15 мин, затем упаривают, остаток наносят на колонку с силикагелем и элюируют смесью хлороформа и метанола (15:18:1). Получают 14 мг (80%) (22R,23R)-2,3,22,23 тетрагидрокси-26-(гемисукцинат)-В-гомо-7-окса-5-холестан-6-она (1). Т. пл. 225-227 С (EtOAc-МеОН). 1 Н ЯМР (CDCl3+CD3OD, 500 МГц) : 0.71 м (3 Н, 18-СН 3), 0.87 с (3 Н, 19-СН 3), 2.58 (4 Н, м,СО 2 СН 2 СН 2 СО 2 Н), 3.13 (1H, дд, J=4.4, 12.2 Гц, С 5-Н), 3.27 (1H, м), 3.57 (1H, м), 3.90-4.13 (5 Н, м). 13 С ЯМР (CDCl3+CD3OD, 125 МГц) : 10.99, 11.01, 11.12, 11.19, 14.68, 15.05, 17.68, 21.66, 24.10,26.93, 26.96, 28.32, 28.50, 28.64, 30.75, 35.78, 36.10, 36.83, 36.92, 37.63, 38.61, 39.13, 39.15, 40.47, 40.52,41.87, 50.71, 51.66, 51.68, 57.53, 67.26, 67.33, 68.00, 69.69, 67.73, 70.04, 70.19, 76.17, 76.22, 172.60, 172.62,174.16, 174.24, 177.39. Синтезированный гаптен 1 используют для получения конъюгата 28-норбрассинолида с бычьим сывороточным альбумином (БСА), что подтверждается примером конкретного выполнения. Пример 2. Растворяют 30 мг (55,7 ммоль) (22R,23R)-2,3,22,23-тетрагидрокси-26-(гемисукцинат)В-гомо-7-окса-5-холестан-6-она (1) в 6 мл абс. диоксана, добавляют 8 мг сухого N-оксисукцинимида(69,6 ммоль) и прикапывают при t=8-10 С 13 мг (63,1 ммоль) дициклогексил карбодиимида в 4 мл абс. диоксана. Перемешивают 0,5 ч при t=10 С и 6 ч при комнатной температуре. Контролируют ход реакции методом ТСХ в системе этилацетат:метанол=9:1 (Rt - (1)=0,05; Rf - (конъюгата)=0,67). Выпавшую дициклогексилмочевину отфильтровывают и раствор диоксана добавляют к раствору БСА в 0,1 М NaHCO3, pH 8,35, содержащему 60 мг белка в 10 мл буфера. Выдерживают 20 ч при комнатной температуре и избыток активированного эфира и диоксан удаляют диализом против 0,005 М раствора NaCl. Полученный конъюгат (1-БСА) лиофилизуют и хранят в замороженном виде при -18 С. Полученный конъюгат используют для получения антител, специфичных к 7-окса-6 оксобрассиностероидам, что подтверждается примером конкретного выполнения. Пример 3. Группу из шести кроликов иммунизируют конъюгатом 28-норбрассинолид-БСА с плотностью посадки 25 молекул стероида на 1 молекулу белка. Каждому кролику вводят подкожно в 10-15 точек спины по 1 мг конъюгата, предварительно растворенного в 0,5 мл фосфатно-буферного раствора поваренной соли (рН 7,4) и эмульгированного в равном объеме полного адъюванта Фрейнда. Интервалы между инъекциями составляли 4 недели. Иммунизацию продолжают в течение 6 месяцев, осуществляя периодический отбор проб крови из ушной вены животных. Полученные образцы сыворотки тестируют на наличие связывающей способности в отношении 24-норбрассинолида и определяют их титры и значения констант ассоциации (Ка). Титр определяют как рабочее разведение антисыворотки, обеспечивающее максимальную чувствительность тест-системы при таком связывании конъюгата, которое позволяет построить калибровочный график в диапазоне 2,5-0,2 ОЕ.-3 015276 Характеристики антисывороток, полученных при иммунизации животных конъюгатом 24-норбрассинолида с БСА Таким образом, определение оптимального титра антисыворотки для применения в ИФА показало,что ее разбавление в 1000000 (А 1) или 1200000 (А 2) раз позволяет обеспечить хорошие условия определения 28-норбрассинолида. Литература 1. Хрипач В.А., Лахвич Ф.А., Жабинский В.Н. Брассиностероиды. Минск: Навука i тэхшка, 1993. 288 с. 2. Khripach V.A., Zhabinskii V.N., de Groot Ae. Brassinosteroids - A New Class of Plant Hormones. SanDiego: Acad. Press. 1999, 456 p. 3. Патент РБ 2806 от 23.11.1995. Средство для снижения накопления радионуклидов растениями и способ его применения./Хрипач В.А., Жабинский В.Н., Литвиновская Р.П., Завадская М.И., Деева В.П.,Веденеев А.Н.//Оф. Бюл. Белгоспат., 2000,2 (26), с. 159. 4. Патент РБ 3488 от 4.07.1996. Способ повышения питательной ценности картофеля./Хрипач В.А., Жабинский В.Н., Литвиновская Р.П., Завадская М.И., Савельева Е.А., Карась И.И. (Беларусь), Вакуленко В.В. (Россия).//Оф. Бюл. Белгоспат., 2000,3 (27), с. 74. 5. Патент РБ 3400 от 4.07.1996. Способ защиты картофеля от фитофтороза./Хрипач В.А., Жабинский В.Н., Литвиновская Р.П., Завадская М.И., Савельева Е.А., Карась И.И., Кильчевский А.В.,Титова С.Н.//Оф. Бюл. Белгоспат., 2000,2 (25), с. 75. 6. Патент РБ 5168./Хрипач В.А., Литвиновская Р.П., Жабинский В.Н., Завадская М.И., Волынец А.П., Прохорчик Р.А., Пшеничная Л.А., Манжелесова Н.Е., Морозик Г.В.//Оф. Бюл. НЦИС РБ, 2003,2(37), с. 95. 7. Патент РБ 5212. Способ повышения урожайности льна и улучшения качества льноволокна./Воскресенская Л.Г., Хрипач В.А., Жабинский В.Н., Завадская М.И., Литвиновская Р.П.//Оф. Бюл. НЦИС РБ, 2003, 2(37), с. 93. 8. Патент РБ 5698. Способ размножения оздоровленного семенного материала картофеля./Бобрик А.О., Хрипач В.А., Жабинский В.Н., Завадская М.И., Литвиновская Р.П.//Оф. Бюл. НЦИС РБ,2003, 4(39). 9. Carl D. Schlagnhaufer, Richard N. Arteca and Allen T. Phillips. Monoclonal antibodies against brassinosteriod a new plant growth regulating compound. Plant Physiol. (Suppl.) 1988. Vol. 86. P. 113. 10. Yokota Т., Wanabe S., Ogino Y., Yamaguchi I., Takahashi N. // J Plant Growth Regul. 1990. Vol. 9. P. 151. 11. Патент РБ 10120. [(22R,23R,24R)-2,3,22,23-Тетрагидрокси-24-метил-5-холест-6 илиденамино]оксиуксусная кислота в качестве полупродукта в синтезе конъюгата 24-эпикастастерона с бычьим сывороточным альбумином.//Хрипач В.А., Свиридов О.В., Литвиновская Р.П., Прядко А.Г., Драч С.В., Жабинский В.Н., Завадская М.И. Оф. Бюл. изобрет. НЦИС, 2007,2, с. 12. 12. Хрипач В.А., Свиридов О.В., Прядко А.Г., Литвиновская Р.П., Драч С.В., Матвеенцев В.Д., Новик Т.В., Михайлопуло К.И., Жабинский В.Н., Завадская М.И., Аверькова М.А., Драченова О.А., Чащина Н.М. Иммуноферментный анализ (24R)-брассиностероидов.//Биоорг. химия. 2007, т. 33,3, с. 371-378. 13. Антончик А.В., Жабинский В.Н., Хрипач В.А. II Международная конференция Химия, структура и функция биомолекул, Минск, 2006, PR6. ФОРМУЛА ИЗОБРЕТЕНИЯ в качестве гаптена для получения иммуногена - конъюгата 28-норбрассинолида с бычьим сывороточным альбумином. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07J 73/00, G01N 33/53
Метки: сывороточным, синтезе, конъюгата, бычьим, качестве, 22r,23r)-2a,3a,22,23-тетрагидрокси-26-(гемисукцинат)-в-гомо-7-окса-5a-холестан-6-он, гаптена, альбумином, 28-норбрассинолида
Код ссылки
<a href="https://eas.patents.su/5-15276-22r23r-2a3a2223-tetragidroksi-26-gemisukcinat-v-gomo-7-oksa-5a-holestan-6-on-v-kachestve-gaptena-v-sinteze-konyugata-28-norbrassinolida-s-bychim-syvorotochnym-albuminom.html" rel="bookmark" title="База патентов Евразийского Союза">(22r,23r)-2a,3a,22,23-тетрагидрокси-26-(гемисукцинат)-в-гомо-7-окса-5a-холестан-6-он в качестве гаптена в синтезе конъюгата 28-норбрассинолида с бычьим сывороточным альбумином</a>
Предыдущий патент: Конъюгат 28-норбрассинолида с пероксидазой хрена в качестве меченого антигена для иммуноферментного определения 7-окса-6-оксобрассиностероидов
Следующий патент: Конъюгат 28-норбрассинолида с бычьим сывороточным альбумином в качестве иммуногена
Случайный патент: Электрический контактный мостик