Способ получения пиразолов
Номер патента: 10851
Опубликовано: 30.12.2008
Авторы: Тоблер Ханс, Вальтер Харальд, Корси Камилла, Эренфройнд Йозеф, Ламберт Клеменс
Формула / Реферат
1. Способ получения соединения формулы I
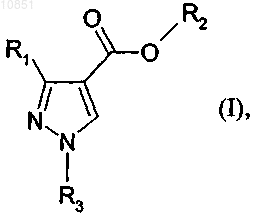
в которой R1 обозначает C1-C4галогеналкил; R2 обозначает C1-C6алкил и R3 обозначает метил или этил,
в котором соединение формулы II

в которой R1 и R2 являются такими, как определено для формулы I, вводят в реакцию с соединением формулы III
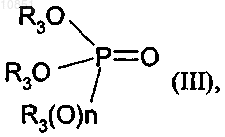
в которой R3 является таким, как определено для формулы I, и n равно 0 или 1.
2. Способ по п.1, в котором реакцию проводят без прибавления растворителя.
3. Применение соединения формулы III
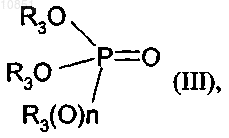
в которой R3 является таким, как определено в п.1, для региоселективного алкилирования соединения формулы II
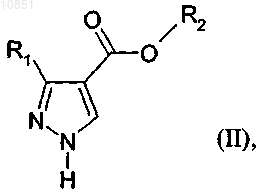
в которой R1 и R2 являются такими, как определено в п.1.
4. Способ региоселективного алкилирования соединения формулы II
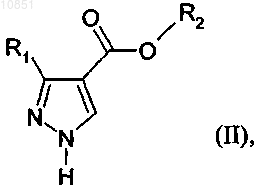
в которой R1 и R2 являются такими, как определено в п.1, в котором соединение формулы III
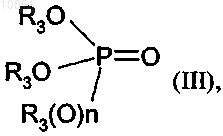
в которой R3 является таким, как определено в п.1, применяют в качестве алкилирующего реагента.
Текст
010851 Настоящее изобретение относится к способу региоселективного N-алкилирования замещенных пиразолов и к применению триалкилфосфатов или триалкилфосфонатов для региоселективного Nалкилирования замещенных пиразолов.N-Алкилированные замещенные пиразолы, например этиловый эфир 3-дифторметил-1-метил-1 Нпиразол-4-карбоновой кислоты, являются ценными промежуточными продуктами для получения фунгицидов, как это описано, например, в WO 03/074491. Согласно WO 95/25099 N-алкилированные замещенные пиразолы можно получить по реакции соответствующих замещенных пиразолов с алкилгалогенидами в щелочной среде. Однако применение алкилгалогенидов для N-алкилирования замещенных пиразолов является затруднительным вследствие их токсичности. Кроме того, эти соединения являются дорогостоящими и в дополнение к этому характеризуются лишь низкой региоселективностью по отношению к двум атомам азота пиразольного кольца. По этим причинам такой способ является совершенно неприменимым для крупномасштабного производстваN-алкилированных замещенных пиразолов. Согласно JP-2000-044541 N-алкилированные замещенные пиразолы можно получить по реакции соответствующих замещенных пиразолов с диалкиловыми эфирами карбоновой кислоты с прибавлением основания. Применение диалкиловых эфиров карбоновой кислоты нежелательно, поскольку эти соединения обладают низкой реакционной способностью и поэтому обычно необходимо повысить реакционную способность замещенных пиразолов путем прибавления основания. Кроме того, региоселективность такого N-алкилирования обычно зависит от химической природы заместителей пиразольного кольца, так что N-алкилирование с использованием диалкиловых эфиров карбоновой кислоты в некоторых случаях характеризуется неудовлетворительной региоселективностью. Поэтому задачей настоящего изобретения является разработка нового способа получения Nалкилированных замещенных пиразолов, в котором исключены недостатки известных способов, отмеченные выше, и который дает возможность получать эти соединения с высокими выходами и при хорошем качестве и экономически эффективным и простым в осуществлении путем. В соответствии с этим настоящее изобретение относится к способу получения соединений формулы I в которой R1 обозначает C1-C4 галогеналкил; R2 обозначает C1-C6 алкил и R3 обозначает метил или этил,по реакции соединения формулы II в которой заместители являются такими, как определено для формулы I,с соединением формулы III в которой R3 является таким, как определено для формулы I, и n равно 0 или 1. Алкильные группы в приведенных выше определениях заместителей могут обладать линейной или разветвленной цепью и представляют собой, например, метил, этил, н-пропил, изопропил, н-бутил, вторбутил, изобутил или трет-бутил, предпочтительно метил или этил. Галогеном обычно является фтор,хлор, бром или йод, предпочтительно фтор. C1-C4 Галогеналкильные группы образованы из указанных С 1-С 4 алкильных групп и предпочтительно обозначают дифторметил или трифторметил. Способ, предлагаемый в настоящем изобретении, предпочтительно пригоден для получения соединений формулы I, в которойR1 обозначает дифторметил или трифторметил;R2 обозначает метил или этил и/илиR3 обозначает метил. Способ, предлагаемый в настоящем изобретении, является особенно подходящим для получения соединений формулы I, в которой R1 обозначает дифторметил. Способ, предлагаемый в настоящем изобретении, является особенно подходящим для получения-1 010851 соединений формулы I, в которой R1 обозначает дифторметил; R2 обозначает этил и R3 обозначает метил. Способ, предлагаемый в настоящем изобретении, также является особенно подходящим для получения соединений формулы I, в которой R1 обозначает трифторметил; R2 обозначает этил и R3 обозначает метил. В предпочтительных способах соединения формулы II вводят в реакцию с соединениями формулыIII, в которой n равно 1. В особенно предпочтительных способах соединений формулы II вводят в реакцию с соединениями формулы III, в которой n равно 1 и R3 обозначает метил. Реакцию, предлагаемую в настоящем изобретении, предпочтительно проводить в температурном диапазоне от 100 до 200 С, предпочтительно от 150 до 200 С. Реакцию, предлагаемую в настоящем изобретении, можно проводить в безводном инертном растворителе. Подходящими растворителями являются, например, ксилол, мезитилен, трет-бутилбензол, хлорбензол, 1,2-дихлорбензол, декалин, дибутиловый эфир, дипентиловый эфир, дифениловый эфир и анизол. Реакцию, предлагаемую в настоящем изобретении, предпочтительно проводить без растворителя. В реакциях, предлагаемых в настоящем изобретении, соединения формулы III используют в эквимолярных количествах или в избытке по отношению к соединениям формулы II, предпочтительно в избытке до 30-кратного, более предпочтительно в избытке до 10-кратного, еще более предпочтительно в избытке от 2-кратного до 8-кратного. Способ, предлагаемый в настоящем изобретении, является особенно подходящим для получения соединений формулы I, в которой R1 обозначает дифторметил, R2 обозначает этил и R3 обозначает метил,по реакции соединения формулы II, в которой R1 обозначает дифторметил и R2 обозначает этил, с соединением формулы III, в которой R3 обозначает метил и n равно 1, в температурном диапазоне от 150 до 200 С, без растворителя, соединения формулы III используют в избытке от 2-кратного до 8-кратного по отношению к соединению формулы II. Соединения формулы II являются известными или их можно получить по методикам, аналогичным известным из литературы. Например, такие соединения можно получить из эфиров 3-оксокарбоновой кислоты, на которых они основаны, с помощью двустадийного синтеза по реакции с триметилортоформиатом с последующей реакцией с гидразином. Такие реакции описаны, например, в JP-2000-044541. Другой путь синтеза для получения соединений формулы II описан в JP-2001-322983, в которой, например, этиловый эфир 3-трифторметил-1H-пиразол-4-карбоновой кислоты получают, исходя из этилового эфира 3-хлор-4,4,4-трифтор-2-формил-2-бутеновой кислоты по реакции с гидразином. Соединения формулы III известны как алкилирующие реагенты и имеются в продаже. Например, Nалкилирование незамещенных азотсодержащих гетероциклов описано в публикации Journal of the Chemical Society, Perkin Transactions 1, 21, 2506-2508 (1973) и в Bulletin of the Chemical Society of Japan, 50,1510-1512 (1977). He имеется указаний на алкилирующие реагенты, проявляющие региоселективность при N-алкилировании пиразолов. Настоящее изобретение также относится к применению соединений формулы III для региоселективного алкилирования соединений формулы II. Настоящее изобретение также относится к способу региоселективного алкилирования соединений формулы II, в котором соединение формулы III применяется в качестве алкилирующего реагента. Настоящее изобретение иллюстрируется с помощью приведенных ниже примеров. Пример Р 1. Получение этилового эфира 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Смесь 5,7 г этилового эфира 3-дифторметил-1H-пиразол-4-карбоновой кислоты (30 ммоль) и 25 мл триметилфосфата (214 ммоль) перемешивают при температуре, равной 180 С, в течение 18 ч. Затем прибавляют 250 мл смеси воды со льдом. Полученный продукт реакции фильтруют, промывают водой и растворяют в 50 мл этилацетата. Органическую фазу промывают с помощью 50 мл насыщенного раствора хлорида натрия и сушат над сульфатом натрия и концентрируют выпариванием. Получают 3,9 г (64% от теоретического значения) этилового эфира 3-дифторметил-1-метил-1H-пиразол-4-карбоновой кислоты в виде кристаллов (температура плавления 59-60 С). Пример Р 2. Получение этилового эфира 3-трифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Смесь 4,16 г этилового эфира 3-трифторметил-1 Н-пиразол-4-карбоновой кислоты (20 ммоль) и 10 мл триметилфосфата (86,4 ммоль) перемешивают при температуре, равной 180 С, в течение 16 ч. Затем прибавляют 200 мл смеси воды со льдом. Полученный продукт реакции фильтруют, промывают водой и растворяют в 50 мл этилацетата. Органическую фазу дважды промывают порциями по 50 мл насыщенного раствора хлорида натрия и сушат над сульфатом натрия и концентрируют выпариванием. Получают 4,0 г (90% от теоретического значения) этилового эфира 3-трифторметил-1-метил-1H-пиразол-4 карбоновой кислоты в виде кристаллов (температура плавления 55-57 С). Пример P3. Получение этилового эфира 3-трифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Смесь 2,08 г этилового эфира 3-трифторметил-1H-пиразол-4-карбоновой кислоты (10 ммоль) и 2,3 мл триметилфосфата (20 ммоль) перемешивают при температуре, равной 180 С, в течение 16 ч. Затем прибавляют 200 мл смеси воды со льдом. Полученный продукт реакции фильтруют, промывают водой и растворяют в 50 мл этилацетата. Органическую фазу дважды промывают порциями по 50 мл насыщенно-2 010851 го раствора хлорида натрия и сушат над сульфатом натрия и концентрируют выпариванием. Получают 1,9 г (86% от теоретического значения) этилового эфира 3-трифторметил-1-метил-1H-пиразол-4 карбоновой кислоты в виде кристаллов (температура плавления 55-57 С). В соответствии с приведенными выше примерами можно получить следующие соединения формулы I: Таблица 1 Соединения формулы I В контексте настоящего изобретения замещенные пиразолы можно алкилировать регулируемым образом с высоким выходом, с высокой степенью региоселективности и при низких затратах. Другим преимуществом настоящего изобретения является то, что замещенные пиразолы можно алкилировать без прибавления оснований. Исходные вещества для способа, предлагаемого в настоящем изобретении, отличаются доступностью и легкостью в обращении, а также являются недорогостоящими. В предпочтительном варианте осуществления настоящего изобретения способ осуществляют без растворителя, такой вариант осуществления является особенно экономичным вариантом способа, предлагаемого в настоящем изобретении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I в которой R1 обозначает C1-C4 галогеналкил; R2 обозначает C1-C6 алкил и R3 обозначает метил или этил,в котором соединение формулы II в которой R1 и R2 являются такими, как определено для формулы I, вводят в реакцию с соединением формулы III в которой R3 является таким, как определено для формулы I, и n равно 0 или 1. 2. Способ по п.1, в котором реакцию проводят без прибавления растворителя. 3. Применение соединения формулы III в которой R3 является таким, как определено в п.1, для региоселективного алкилирования соединения формулы II в которой R1 и R2 являются такими, как определено в п.1. 4. Способ региоселективного алкилирования соединения формулы II в которой R1 и R2 являются такими, как определено в п.1, в котором соединение формулы III
МПК / Метки
МПК: C07D 231/14
Метки: способ, получения, пиразолов
Код ссылки
<a href="https://eas.patents.su/5-10851-sposob-polucheniya-pirazolov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения пиразолов</a>
Предыдущий патент: Вибрационный уплотнитель для производства формованных деталей способом уплотнения
Следующий патент: Пиперидиновые соединения и фармацевтические композиции, их содержащие
Случайный патент: Расширяющийся контейнер с крышкой для управления объемом свободного пространства в пищевой банке









