Лечение латентного туберкулёза
Номер патента: 9779
Опубликовано: 28.04.2008
Формула / Реферат
1. Применение соединения формулы (Ia) или (Ib) для производства лекарственного средства для лечения латентного туберкулеза, причем соединение формулы (Ia) или (Ib) представляет собой
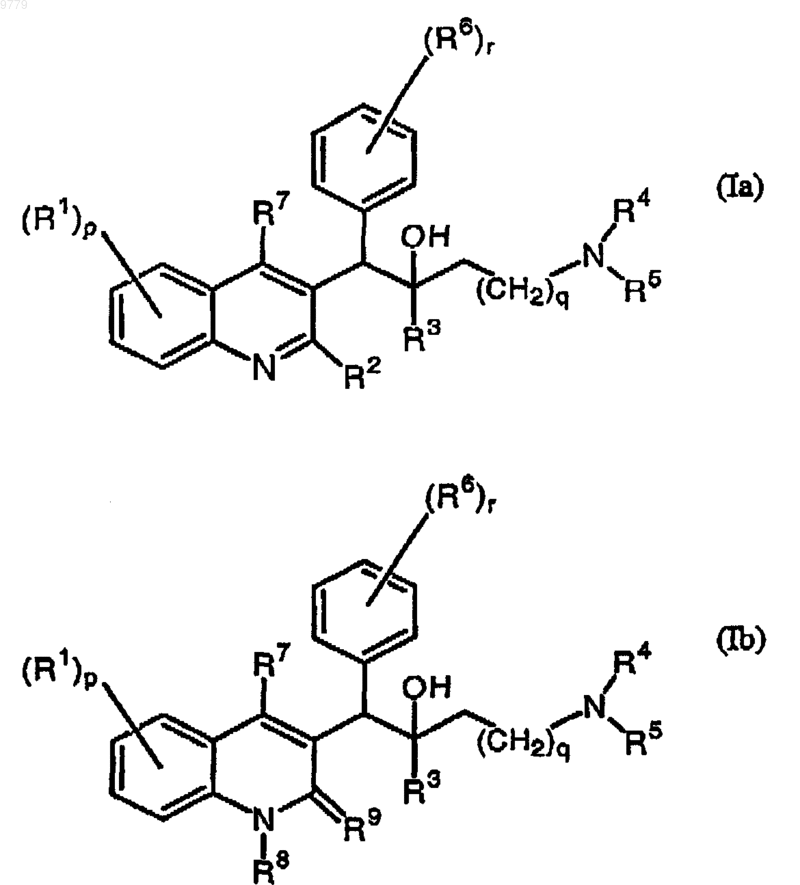
а также фармацевтически приемлемой кислотно- или основно-аддитивной соли указанного соединения, его N-оксида, его таутомерной формы или его стереохимически изомерной формы, где
R1 представляет собой водород, галоген, галогеналкил, циано, гидрокси, Ar, Het, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил;
р представляет собой целое число, равное 1, 2, 3 или 4;
R2 представляет собой водород, гидрокси, меркапто, алкокси, алкоксиалкокси, алкилтио, моно- или ди(алкил)амино или радикал формулы 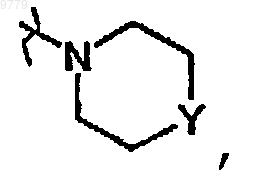 в котором Y представляет собой CH2, О, S, NH или N-алкил;
в котором Y представляет собой CH2, О, S, NH или N-алкил;
R3 представляет собой алкил, Ar, Ar-алкил, Het или Het-алкил;
q представляет собой целое число, равное 0, 1, 2, 3 или 4;
R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; или
R4 и R5, включая также N, к которому они присоединены, могут совместно образовывать радикал, выбранный из группы, состоящей из пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, необязательно замещенных алкилом, галогеном, галогеналкилом, гидрокси, алкокси, амино, моно- или диалкиламино, алкилтио, алкоксиалкилом, алкилтиоалкилом и пиримидинилом;
R6 представляет собой водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; или два вицинальных R6 радикала совместно могут образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;
r представляет собой целое число, равное 1, 2, 3, 4 или 5;
R7 представляет собой водород, алкил, Ar или Het;
R8 представляет собой водород или алкил;
R9 представляет собой оксо или
R8 и R9 вместе образуют радикал =N-CH=CH-;
алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкокси или оксогруппами;
Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из гидрокси, галогена, циано, нитро, амино, моно- или диалкиламино, алкила, галогеналкила, алкокси, галогеналкокси, карбоксила, алкоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила;
Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкила, алкокси или Ar-карбонила;
галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода; и
галогеналкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, в которых 1 или несколько атомов углерода замещены 1 или несколькими атомами галогенов.
2. Применение по п.1, в котором
R1 представляет собой водород, галоген, циано, Ar, Het, алкил и алкокси;
р представляет собой целое число, равное 1 или 2;
R2 представляет собой водород, гидрокси, алкокси, алкоксиалкокси, алкилтио или радикал формулы  в котором Y представляет собой О;
в котором Y представляет собой О;
R3 представляет собой алкил, Ar, Ar-алкил или Het;
q представляет собой целое число, равное 0, 1, 2 или 3;
R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; или
R4 и R5, а также N, к которому они присоединены, совместно могут образовывать радикал, выбранный из следующих групп: пирролидинила, имидазолила, триазолила, пиперидинила, пиперазинила, пиразинила, морфолинила и тиоморфолинила, причем каждая кольцевая система необязательно замещена алкилом или пиримидинилом;
R6 представляет собой водород, галоген или алкил; или два вицинальных радикала R6 могут вместе образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;
r представляет собой целое число, равное 1;
R7 представляет собой водород;
R8 представляет собой водород или алкил;
R9 представляет собой оксогруппу; или
R8 и R9 вместе образуют радикал =N-CH=CH-;
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном или гидроксигруппой;
Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, галогеналкила, циано, алкокси и морфолинила;
Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, фуранила, тиенила, пиридинила, пиримидинила; или бициклический гетероцикл, выбранный из группы, состоящей из бензотиенила, 2,3-дигидробензо[1,4]диоксинила, или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 алкильными или арилкарбонильными заместителями; и
галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора и брома.
3. Применение по п.1 или 2, где в формуле (Ia) или (Ib) R1 представляет собой водород, галоген, Ar, алкил или алкокси.
4. Применение по п.3, где R1 представляет собой галоген.
5. Применение по любому из предшествующих пунктов, в котором в формуле (Ia) или (Ib) р равно 1.
6. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R2 представляет собой водород, алкокси или алкилтио.
7. Применение по п.6, где R2 представляет собой алкокси.
8. Применение по любому из предшествующих пунктов, в котором в формуле (Ia) или (Ib) R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 илш 2 заместителями, выбранными из группы, состоящей из галогена и галогеналкила.
9. Применение по п.8, гле R3 представляет собой нафтил.
10. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) q равно 1.
11. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) каждый из R4 и R5 независимо представляет собой водород или алкил, либо R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, состоящей из имидазолила, триазолила, пиперидинила, пиперазинила и тиоморфолинила.
12. Применение по п.11, где в формуле (Ia) или (Ib) каждый из R4 и R5 независимо представляет собой водород или алкил.
13. Применение по п.12, где R4 и R5 представляют собой C1-4алкил.
14. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R6 представляет собой водород, алкил или галоген.
15. Применение по п.13, где R6 представляет собой водород.
16. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) r равно 1.
17. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R7 представляет собой водород.
18. Применение по п.1, где в формуле (Ia) или (Ib) R1 представляет собой водород, галоген, Ar, алкил или алкокси; р=1; R2 представляет собой водород, алкокси или алкилтио; R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из галогена и галогеналкила; q=0, 1, 2 или 3; каждый из R4 и R5 независимо представляет собой водород или алкил, или R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, состоящей из имидазолила, триазолила, пиперидинила, пиперазинила и тиоморфолинила; R6 представляет собой водород, алкил или галоген; r равен 1 и R7 представляет собой водород.
19. Применение по любому из предшествующих пунктов, где алкил представляет собой C1-С6алкил.
20. Применение по любому из предшествующих пунктов, где галогеналкил представляет собой полигалогенС1-6алкил.
21. Применение по любому из пп.1-20, где соединением является соединение формулы (Ia).
22. Применение по п.1, отличающееся тем, что соединение выбрано из группы, состоящей из
1-(6-бром-2-метоксихинолин-3-ил)-2-(3,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-2-(2,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(2-фторфенил)-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-п-толилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-метиламино-2-нафталин-1-ил-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(3-фторфенил)-1-фенилбутан-2-ола и
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-фенил-1-фенилбутан-2-ола;
а также его фармацевтически приемлемой кислотно- и основно-аддитивной соли, его N-оксида, его таутомерной формы или его стереохимически изомерной формы.
23. Применение по п.22, где соединение выбрано из группы, состоящей из
1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола;
1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола, соответствующего 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанолу; или его
фармацевтически приемлемой кислотно- и основно-аддитивной соли, его N-оксида, его таутомерной формы или его стереохимически изомерной формы.
24. Применение по п.1, где соединение представляет собой 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол, его фармацевтически приемлемую кислотно- и основно-аддитивную соль, его N-оксид или его стереохимически изомерную форму.
25. Применение по п.24, где соединение представляет собой 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол или его фармацевтически приемлемую кислотно-аддитивную соль.
26. Применение по п.24, где соединение представляет собой 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол или его стереохимически изомерную форму.
27. Применение по п.24, где соединение представляет собой 6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол или его форму N-оксида.
28. Применение по п.24, где соединение представляет собой (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол или его фармацевтически приемлемую кислотно-аддитивную соль.
29. Применение по п.28, где соединение представляет собой (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталинил-b-фенил-3-хинолинэтанол.
Текст
009779 Настоящее изобретение относится к использованию соединений формулы (Ia) или (Ib) для лечения латентного туберкулеза. Уровень техникиMicobacterium tuberculosis (туберкулезная бацилла) приводит к более чем 2 млн смертей в течение года и является ведущей причиной смертности у людей, инфицированных ВИЧ 1. Несмотря на десятилетия существования программ контроля над туберкулезом (ТВ), около 2 млрд людей инфицировано туберкулезной бациллой, хотя и бессимптомно. Около 10% из числа этих людей в течение срока их жизни подвергаются риску развития активного туберкулеза 2. Глобальная эпидемия туберкулеза вызвана инфицированием туберкулезом ВИЧ-пациентов и возникновением штаммов туберкулеза, устойчивых ко многим лекарственным препаратам (MDR-TB). Реактивация латентного туберкулеза представляет собой значительный фактор риска развития заболевания и является причиной 32% смертей ВИЧ-инфицированных людей 1. Чтобы контролировать эпидемию туберкулеза, необходимо обнаружить новые лекарственные средства, которые могут убивать латентные или находящиеся в состоянии покоя бациллы. Спящий туберкулез может быть реактивирован и может вызвать заболевание из-за нескольких факторов, как, например, из-за подавления иммунитета хозяина при использовании таких иммунодепрессивных средств,как антитела против фактора некроза опухолейили -интерферон. В случае ВИЧ-положительных пациентов единственным профилактическим лечением, имеющимся в распоряжении для латентного туберкулеза, является 2-3-месячный режим приема рифампицина пиразинамида 3,4. Эффективность режима лечения до сих пор не ясна, и, более того, продолжительность лечения является важным сдерживающим фактором в условиях ограниченных ресурсов. Следовательно, существует ярковыраженная необходимость в создании новых лекарственных средств, которые могут действовать в качестве химиопрофилактических средств в отношении людей, носящих в себе латентные туберкулезные бациллы. Туберкулезные бациллы попадают в организм здоровых людей путем вдыхания; они фагоцитируются альвеолярными макрофагами легких. Это ведет к мощному иммунному ответу и образованию гранулем, которые состоят из макрофагов, инфицированных M. tuberculosis, которые окружены Т-клетками. Через 6-8 недель иммунный ответ хозяина вызывает смерть инфицированных клеток путем некроза, а также накопление творожистого вещества с определенным количеством внеклеточных бацилл, окруженных макрофагами, эпителиоидными клетками и слоями лимфоидной ткани на периферии 5. В случае здоровых людей большая часть микобактерий в данной среде оказываются убитыми, но небольшая часть бацилл все еще выживает и, как считается, существует в нереплицируемом состоянии с пониженным обменом веществ, причем они устойчивы к уничтожению их противотуберкулезными лекарственными препаратами, такими как изониазид 6. Данные бациллы могут сохраняться в измененных физиологических средах даже в течение всего срока жизни человека без проявления каких бы то ни было клинических симптомов заболевания. Однако в 10% случаев эти латентные бациллы могут реактивироваться,вызвав заболевание. Одной из гипотез относительно развития данных стойких бактерий является патофизиологическая среда в пораженных участках человека, а именно пониженное давление кислорода, ограничение поступления питательных веществ и кислотный рН 7. Было постулировано, что эти факторы приводят данные бактерии в фенотипически устойчивое состояние по отношению к большинству антимикобактериальных лекарственных препаратов 7.WO 2004/011436 описывает производные замещенного хинолина в качестве полезных средств для лечения микобактериальных заболеваний. Упомянутый документ раскрывает антимикобактериальные свойства производных замещенного хинолина против чувствительных, восприимчивых штаммов микобактерий, но при этом документ умалчивает об их активности против латентных, устойчивых, пребывающих в состоянии покоя микобактерий. В данном изобретении заявитель обнаружил, что соединения, упомянутые в WO 2004/011436, в частности соединения формулы (Ia) и (Ib), как определено далее в данном изобретении, обладают стерилизующими свойствами; являются эффективными в уничтожении микобактерий, в частности Micobacteriumtuberculosis, находящихся в состоянии покоя, и, соответственно, могут быть использованы для лечения латентного туберкулеза. Таким образом, они значительно расширят арсенал средств для борьбы с туберкулезом. Описание чертежей Фиг. 1: действие различных лекарственных средств на M. bovis, которые находятся в состоянии покоя, определенное при помощи определения количества люциферазы (RLU: относительные единицы люминесценции) (бактерии суспендируют в свободной среде лекарственного средства в течение 5 дней после 7 дней анаэробиоза). Фиг. 2 А: действие различных лекарственных средств на M. bovis, находящихся в состоянии покоя(CFU колониеобразующие единицы) (приведены CFU, определенные через 2 дня после анаэробиоза). Фиг. 2 В: действие различных лекарственных средств на M. bovis, находящихся в состоянии покоя(CFU колониеобразующие единицы) (приведены CFU, определенные через 5 дней после анаэробиоза). Фиг. 3: действие различных лекарственных средств на M. tuberculosis, находящихся в состоянии покоя (модель Wayne). Описание изобретения Таким образом, настоящее изобретение относится к применению соединений формулы (Ia) или (Ib)-1 009779 для производства лекарственных средств для лечения латентного туберкулеза, причем соединение формулы (Ia) или (Ib) представляет собой а также их фармацевтически приемлемые кислотно- или основно-аддитивные соли указанных соединений, их N-оксиды, их таутомерные формы или их стереохимически изомерные формы, в которыхR1 представляет собой водород, галоген, галогеналкил, циано, гидрокси, Ar, Het, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; р представляет собой целое число, равное 1, 2, 3 или 4;R2 представляет собой водород, гидрокси, меркапто, алкокси, алкоксиалкокси, алкилтио, моно- или ди(ал кил)амино или радикал формулы в котором Y представляет собой СН 2, O, S, NH или N-алкил;q представляет собой целое число, равное 0, 1, 2, 3 или 4;R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; илиR4 и R5, включая также N, к которому они присоединены, могут совместно образовывать радикал,выбранный из группы, состоящей из пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила,пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, необязательно замещенных алкилом, галогеном, галогеналкилом, гидрокси,алкокси, амино, моно- или диалкиламино, алкилтио, алкоксиалкилом, алкилтиоалкилом и пиримидинилом;R6 представляет собой водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; или два вицинальных R6 радикала совместно могут образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1, 2, 3, 4 или 5;R8 представляет собой водород или алкил;R8 и R9 вместе образуют радикал =N-CH=CH-; алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному остатку, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкокси или оксогруппами;Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из гидрокси, галогена, циано, нитро, амино,моно- или диалкиламино, алкила, галогеналкила, алкокси, галогеналкокси, карбоксила, алкоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила;Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из Nфеноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила;-2 009779 или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкила, алкокси или Ar-карбонила; галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода; и галогеналкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, в которых 1 или несколько атомов углерода замещены 1 или несколькими атомами галогенов. Настоящее изобретение также относится к способу лечения пациента, включая человека, с латентным туберкулезом, причем способ включает введение пациенту терапевтически эффективного количества соединения по настоящему изобретению. Соединения формул (Ia) и (Ib) являются взаимосвязанными в том отношении, что, например, соединение формулы (Ib), в котором R9 представляет собой оксогруппу, является таутомерной формой соединения (Ia), в котором R2 представляет собой гидроксигруппу (кето-енольная таутомерия). В рамках данного приложения алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному остатку, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкокси или оксогруппами. Предпочтительно алкил представляет собой метил, этил или циклогексилметил. В рамках данного приложения Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из гидрокси, галогена,циано, нитро, амино, моно- или диалкиламино, алкила, галогеналкила, алкокси, галогеналкокси, карбоксила,алкоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила. ПредпочтительноAr представляет собой нафтил или фенил, каждый из которых необязательно замещен 1 или 2 галогенами. В рамках данного приложения Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила,фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила,бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл необязательно может быть замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкила, алкокси или Arкарбонила. Предпочтительно Het представляет собой тиенил. В рамках данного приложения галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода, а галогеналкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, в котором 1 или несколько атомов углерода замещены 1 или несколькими атомами галогенов. Предпочтительно галоген представляет собой бром, фтор или хлор, и галогеналкил предпочтительно представляет собой полигалоген C16 алкил, который определяют как моно- или полигалогензамещенный C1-6 алкил, например метил с 1 или несколькими атомами фтора, например дифторметил или трифторметил, 1,1-дифторэтил и т.п. В случае,если в рамках определения полигалоген C1-6 алкила к алкильной группе присоединено более 1 атома галогена, эти атомы могут быть одинаковыми или различными. Подразумевается, что в определение Het, а также в случае, когда R4 и R5 совместно образуют радикал, входят все возможные изомерные формы гетероциклов, например пирролил включает 1H-пирролил и 2H-пирролил.Ar или Het, перечисленные в определениях заместителей соединений формул (Ia) или (Ib) (см., например, R3), которые упомянуты выше или ниже в данном изобретении, могут быть присоединены к остатку молекулы формул (Ia) или (Ib) через любой подходящий входящий в цикл атом углерода или гетероатом, если другое не оговорено особо. Следовательно, если Het является, например, имидазолилом, он может представлять собой 1-имидазолил, 2-имидазолил, 4-имидазолил и т.п. Линии, прочерченные от заместителей внутрь циклической системы, показывают, что связь может быть присоединена к любому из подходящих атомов цикла. В случае, если два вицинальных остатка R6 совместно образуют двухвалентный радикал формулы-CH=CH-CH=CH-, это значит, что два вицинальных остатка в сочетании с фенильным кольцом, к которому они присоединены, образуют нафтил. Для терапевтического применения пригодны те соли соединений формул (Ia) или (Ib), в которых противоион является фармацевтически приемлемым. Однако соли фармацевтически неприемлемых ки-3 009779 слот и оснований тоже могут найти применение, например, в процессе получения или очистки фармацевтически приемлемого соединения. Все соли, независимо от того, являются они фармацевтически приемлемыми или нет, включены в сферу действия настоящего изобретения. Подразумевается, что фармацевтически приемлемые аддитивные соли, которые упомянуты выше или ниже в тексте настоящего изобретения, включают терапевтически активные, нетоксичные формы аддитивных солей кислот, которые могут быть образованы соединениями формул (Ia) или (Ib). Последние могут быть легко получены при обработке основной формы такими подходящими кислотами, как неорганические кислоты, например галогеноводородными кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота и т.п.; серной кислотой, азотной кислотой, фосфорной кислотой и т.п.; или органическими кислотами, например уксусной, пропионовой, оксиуксусной (гликолевой), 2 гидроксипропионовой, 2-оксопропионовой, щавелевой, малоновой, янтарной, малеиновой, фумаровой,яблочной, винной, 2-гидрокси-1,2,3-пропантрикарбоновой, метансульфоновой, этансульфоновой, бензолсульфоновой, 4-метилбензолсульфоновой, циклогексансульфаминовой, 2-гидроксибензойной, 4-амино-2 гидроксибензойной и тому подобными кислотами. Наоборот, форма соли может быть превращена в форму свободного основания при обработке щелочью. Соединения формул (Ia) или (Ib), содержащие кислотные протоны, могут быть превращены в терапевтически активные, нетоксичные формы аддитивных солей металлов или аминов путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, аммиачные соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например первичных, вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин,изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин,диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин,трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-D-глюкамин, 2-амино 2-(гидроксиметил)-1,3-пропандиол, гидрабамин, соли аминокислот, таких как, например, аргинин, лизин и т.п. Напротив, форма соли может быть превращена в форму свободной кислоты при обработке кислотой. Помимо этого, термин "аддитивные соли" также включает гидратные и сольватные формы, которые могут быть образованы соединениями формул (Ia) или (Ib). Примерами таких форм являются, в частности, гидраты, алкоголяты и т.п. Соединения любой из формул (Ia) или (Ib) и некоторые из промежуточных соединений постоянно имеют в своей структуре по меньшей мере два центра стереоизомерии, которые могут вести к образованию по крайней мере четырех стереохимически различных структур. Термин "стереохимически изомерные формы", который использован выше или ниже в тексте настоящего изобретения, определяет все возможные стереоизомерные формы, которыми могут обладать соединения формул (Ia) и (Ib), а также их N-оксиды, аддитивные соли или физиологически функциональные производные. Если не упомянуто или не показано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, причем упомянутые смеси содержат диастереомеры и энантиомеры основной молекулярной структуры. В частности, центры стереоизомерии могут иметь R- или S-конфигурацию, заместители у двухвалентных циклических (частично) насыщенных групп могут иметь либо цис-, либо транс-конфигурацию. Соединения, включающие двойные связи,могут иметь E (entgegen) или Z (zusammen) стереохимию при упомянутой двойной связи. Термины цис,транс, R, S, E и Z очень хорошо известны специалистам в данной области техники. Имеется в виду, что стереохимически изомерные формы соединений формул (Ia) и (Ib) охвачены рамками настоящего изобретения. Следуя соглашениям номенклатуры CAS (Chemical Abstract Service - реферативная служба по химии), если в молекуле присутствует два центра стереоизомерии с известной абсолютной конфигурацией,идентификатор R или S присваивают (на основе правила последовательности Кана-Ингольда-Прелога) хиральному центру с наименьшим номером, т.н. опорному центру. Конфигурацию второго центра стереоизомерии показывают, используя относительные идентификаторы [R,R] или [R,S], где R всегда определено в качестве опорного центра, [R,R] показывает центры с той же хиральностью, a [R,S] показывает центры с отличающейся хиральностью. Например, если хиральный центр в молекуле с самым низким номером имеет S-конфигурацию, второй центр - R-конфигурацию, то стереоидентификатор будет определен как S-[R,S]. Если используют символы и , положение заместителя с наивысшим приоритетом у асимметрического атома углерода в циклической системе, имеющего наиболее низкий номер в кольце, всегда произвольно считаетсяположением относительно средней плоскости, определенной циклической системой. Положение заместителя с наивысшим приоритетом у другого асимметрического атома углерода в циклической системе по отношению к положению заместителя с наивысшим приоритетом у опорного атома именуется , если он расположен на той же стороне относительно средней плоскости, определенной циклической системой, или , если он находится на другой стороне относительно средней плоскости, определенной циклической системой. Если имеется указание на отдельную стереоизомерную форму, это означает, что упомянутая форма,-4 009779 в основном, присутствует в индивидуальном состоянии, т.е. она смешана менее чем с 50%, предпочтительно менее чем с 20%, более предпочтительно менее чем с 10%, еще более предпочтительно менее чем с 5%, еще более предпочтительно менее чем с 2% и наиболее предпочтительно менее чем с 1% другого изомера (изомеров). Следовательно, когда соединение формулы (I) определено, например, как (S, R),это означает, что соединение, в основном, свободно от изомера (R, S). Соединения любой из формул (Ia) и (Ib) могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга в соответствии с известными в технике процедурами разделения. Рацемические соединения любой из формул (Ia) и (Ib) могут быть превращены в соответствующие формы диастереомерных солей при реакции с подходящим хиральным основанием. Упомянутые формы диастереомерных солей впоследствии разделяют, например, с помощью селективной или фракционной кристаллизации и энантиомеры выделяют из солей при действии щелочи. Альтернативный способ разделения энантиомерных форм соединений любой из формул (Ia) и (Ib) включает жидкостную хроматографию, использующую хиральную стационарную фазу. Упомянутые стереохимически чистые изомерные формы также могут быть получены из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что реакция проходит стереоспецифично. Если желателен определенный стереоизомер, упомянутое соединение следует синтезировать при помощи стереоспецифического способа получения. Данные способы будут выгодным образом использовать энантиомерно чистые исходные вещества. Подразумевается, что таутомерные формы соединений любой из формул (Ia) и (Ib) включают данные соединения любой из формул (Ia) и (Ib), в которых, например, енольная группа превращается в кетонную группу (кето-енольная таутомерия). Подразумевается, что формы N-оксидов соединений любой из формул (Ia) и (Ib) включают данные соединения любой из формул (Ia) и (Ib), в которых 1 или несколько третичных атомов азота окислены до т.н. N-оксидов. Соединения формул (Ia) и (Ib) могут быть превращены в соответствующие формы N-оксидов в соответствии с известными в технике процедурами превращения трехвалентного азота в форму его N-оксида. Упомянутые реакции N-окисления могут, в основном, быть выполнены при взаимодействии исходного соединения формул (Ia) и (Ib) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных и щелочно-земельных металлов, такие как пероксид натрия и пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусную кислоту, алкилгидропероксиды, например т-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогензамещенные углеводороды,например дихлорметан, а также смеси подобных растворителей. Помимо этого, изобретение включает соединения, являющиеся производными фармакологически активных соединений по настоящему изобретению (которые обычно называют "пролекарствами"), которые распадаются in vivo, образуя соединения по настоящему изобретению. Пролекарства обычно (но не всегда) отличаются более низкой эффективностью по отношению к целевому рецептору по сравнению с соединениями, до которых они разлагаются. Пролекарства являются особенно полезными в тех случаях,когда желаемое соединение обладает химическими или физическими свойствами, делающими его введение трудным или неэффективным. Например, желаемое соединение может быть недостаточно растворимым, плохо проникать через эпителий слизистой оболочки или же оно может иметь нежелательно короткое время полураспада в плазме. Дальнейшее обсуждение пролекарств может быть найдено в Stella, V.J.et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176, and Drugs, 1985, 29, pp. 455-473. Формы пролекарств фармакологически активных соединений по настоящему изобретению, в основном, являются соединениями, соответствующими любой из формул (Ia) и (Ib), их фармацевтически приемлемыми кислотно- и основно-аддитивными солями, их стереохимически изомерными формами, их таутомерными формами и формами их W-оксидов, которые имеют этерифицированную или амидированную кислотную группу. В число таких этерифицированных кислотных групп входят группы формулыCOORX, причем RX представляет собой C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы CONRYRZ, причем RY представляет собой H,C1-6 алкил, фенил или бензил и RZ представляет собой -ОН, H, C1-6 алкил, фенил или бензил. Соединения по настоящему изобретению, которые содержат аминогруппу, могут быть превращены в основание Манниха с помощью кетона или альдегида, такого как формальдегид. Данное основание гидролизуется в водном растворе с кинетикой первого порядка.-5 009779 Всякий раз, когда в настоящем изобретении используется термин "соединения формул (Ia) или(Ib)", подразумевается, что этот термин включает также фармацевтически приемлемые кислотно- и основно-аддитивные соли данных соединений, формы их W-оксидов, их таутомерные формы или их стереохимически изомерные формы. Особый интерес представляют те соединения формул (Ia) или (Ib), которые являются стереохимически чистыми. Первое вызывающее интерес воплощение настоящего изобретения относится к использованию, как определено выше, соединений формулы (Ia) или (Ib), в которыхR1 представляет собой водород, галоген, циано, Ar, Het, алкил и алкокси; р представляет собой целое число, равное 1, 2, 3 или 4, в особенности 1 или 2;R2 представляет собой водород, гидрокси, алкокси, алкоксиалкокси, алкилтио или радикал формулыq представляет собой целое число, равное 0, 1, 2 или 3;R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; или R4 и R5, а также N, к которому они присоединены, совместно могут образовывать радикал, выбранный из следующих групп: пирролидинила, имидазолила, триазолила, пиперидинила, пиперазинила, пиразинила, морфолинила и тиоморфолинила, причем каждая циклическая система необязательно замещена алкилом или пиримидинилом;R6 представляет собой водород, галоген или алкил; или два вицинальных фрагмента R6 могут вместе образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1;R8 представляет собой водород или алкил;R8 и R9 вместе образуют радикал =N-CH=CH-; алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному остатку, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном или гидроксигруппой;Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, галогеналкила, циано, алкокси и морфолинила;Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из Wфеноксипиперидинила, пиперидинила, фуранила, тиенила, пиридинила, пиримидинила; или бициклический гетероцикл, выбранный из группы, состоящей из бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 алкильными или арилкарбонильными заместителями; и галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора и брома. Во втором вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем R1 представляет собой водород, галоген, Ar, алкил или алкокси; предпочтительно R1 представляет собой галоген; более предпочтительно R1 представляет собой бром. В третьем вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем р равно 1 и R1 отличен от водорода. В четвертом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причемR2 представляет собой водород, алкокси или алкилтио; предпочтительно R2 представляет собой алкокси,в особенности C1-4 алкокси; более предпочтительно R2 представляет собой метилоксигруппу. C1-4 Алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил и т.п. В пятом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес вопло-6 009779 щения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, и эти заместители предпочтительно представляет собой галоген или галогеналкил, наиболее предпочтительно галоген; предпочтительно R3 представляет собой нафтил или фенил, каждый из которых необязательно замещен галогеном, предпочтительно фтором в положении 3; более предпочтительно R3 представляет собой нафтил или фенил; наиболее предпочтительно R3 представляет собой нафтил. В шестом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем q равно 0, 1 или 2; предпочтительно q равно 1. В седьмом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем каждый из R4 и R5 независимо представляет собой водород или алкил, в особенности водород или C1-4 алкил, более конкретно C1-4 алкил; предпочтительно водород, метил или этил; наиболее предпочтительно метил. C1-4 Алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил и т.п. В восьмом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, включающей имидазолил, триазолил, пиперидинил, пиперазинил и тиоморфолинил, необязательно замещенный алкилом, галогеном, галогеналкилом, гидрокси, алкокси, алкилтио, алкоксиалкилом или алкилтиоалкилом,предпочтительно замещенный алкилом, наиболее предпочтительно замещенный метилом или этилом. В девятом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем R6 представляет собой водород, алкил или галоген; предпочтительно R6 представляет собой водород. В десятом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем r представляет собой 1 или 2. В одиннадцатом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib),причем R7 представляет собой водород или метил; предпочтительно R7 представляет собой водород. В двенадцатом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем только для соединений, которые соответствуют формуле (Ib), R8 представляет собой алкил, предпочтительно метил, и R9 представляет собой кислород. В тринадцатом вызывающем интерес воплощении соединения формул (Ia) или (Ib) или любая подгруппа из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, представляют собой соединения, которые соответствуют любой из формул (Ia) и (Ib), причем соединение является соединением, соответствующим формуле (Ia), его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его N-оксидом, его таутомерной формой или его стереохимически изомерной формой. Вызывающей интерес группой соединений являются соединения, соответствующие формуле (Ia),их фармацевтически приемлемые кислотно- или основно-аддитивные соли, их стереохимически изомерные формы или формы их N-оксидов, в которых R1 представляет собой водород, галоген, Ar, алкил или алкокси; р=1; R2 представляет собой водород, алкокси или алкилтио; R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из галогена и галогеналкила; q=0, 1, 2 или 3; каждый из R4 и R5 независимо представляет собой водород или алкил или же R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, состоящей из имидазолила, триазолила, пиперидинила, пиперазинила и тиоморфолинила;R6 представляет собой водород, алкил или галоген; r равен 1 и R7 представляет собой водород. Предпочтительно в соединениях формул (Ia) или (Ib) или в любой подгруппе из числа данных соединений, которые были упомянуты выше в качестве вызывающего интерес воплощения, термин "алкил" означает C1-6 алкил, причем C1-6 алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил,2-метилэтил, пентил, гексил и т.п. Предпочтительно соединение выбрано из числа следующих соединений:-7 009779 1-(6-бром-2-метоксихинолин-3-ил)-2-(3,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола, соответствующего 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанолу; 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(2-фторфенил)-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-п-толилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-метиламино-2-нафталин-1-ил-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2- (3-фторфенил)-1-фенилбутан-2-ола и 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-фенил-1-фенилбутан-2-ола; а также фармацевтически приемлемых кислотно- или основно-аддитивных солей указанных соединений, их N-оксидов, их таутомерных форм или их стереохимически изомерных форм. Еще более предпочтительными являются следующие соединения: 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ол; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ол, соответствующий 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанолу; или фармацевтически приемлемые кислотно- или основно-аддитивные соли указанных соединений, ихN-оксиды, их таутомерные формы или их стереохимически изомерные формы. Другой группой вызывающих интерес соединений являются соединения 12, 71, 174, 75, 172 и 79,которые описаны ниже в табл. 1-6, в особенности соединения 12, 71, 174 и 75, в большей степени соединения 12, 71 и 174; а также фармацевтически приемлемые кислотно- или основно-аддитивные соли указанных соединений, их N-оксиды, их таутомерные формы или их стереохимически изомерные формы. Другим химическим наименованием для 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола является 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинил-фенил-3-хинолинэтанол. Упомянутое соединение также может быть представлено следующим образом: Наиболее предпочтительное соединение является одним из следующих: 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол, его фармацевтически приемлемые кислотно- или основно-аддитивные соли, его N-оксиды или его стереохимически изомерные формы; или 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол или его фармацевтически приемлемая кислотно-аддитивная соль; или 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол или его стереохимически изомерная форма; или 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол или форма его N-оксида; или смесь, в особенности рацемическая смесь (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталинилфенил-3-хинолинэтанола и (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанола, или их фармацевтически приемлемая кислотно-аддитивная соль,или их стереохимически изомерные формы; т.е. соединение 14 (диастереомер А); или (S,R)-6-бром-[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол, т.е. соединение 12, или его фармацевтически приемлемая кислотно-аддитивная соль; или (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол, т.е. соединение 12. Наиболее предпочтительным соединением является (S,R)-6-бром[2-(диметиламино)этил]-2 метокси 1-нафталинилфенил-3-хинолинэтанол, который соответствует (1R,2S)-1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-олу. Упомянутое соединение также может быть представлено следующей формулой:-8 009779 Соединения формул (Ia) и (Ib) могут быть получены в соответствии со способами, описанными вWO 2004/011436, которые включены в настоящее изобретение с помощью ссылки. В общем, соединения по настоящему изобретению могут быть получены с помощью последовательности стадий, каждая из которых известна специалисту в данной области техники. В частности, соединения, соответствующие формуле (Ia), могут быть получены реакцией промежуточного соединения формулы (II) с промежуточным соединением формулы (III) в соответствии со следующей схемой реакции (1). Схема 1 при использовании BuLi в смеси диизопропиламина и тетрагидрофурана, причем все варианты структуры молекул определены таким же образом, как и в формуле (Ia). Перемешивание может увеличивать скорость реакции. Реакция может быть легко проведена при температуре, находящейся в диапазоне от -20 до -70C. Аналогичный порядок осуществления реакции может быть использован для синтеза соединений формулы (Ib). Исходные вещества и промежуточные соединения формул (II) и (III) являются либо коммерчески доступными соединениями, либо могут быть получены в соответствии с обычными реакциями, которые,как правило, известны в технике. Например, промежуточные соединения формулы (II-а) могут быть получены в соответствии со следующей схемой реакции (2). Схема 2 в которой все варианты структуры молекул определены таким же образом, как и в формуле (Ia). Схема реакции (2) включает стадию (а), в которой соответствующим образом замещенный анилин вводят в реакцию с подходящим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензопропионилхлорид или п-хлорбензопропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего, не вступающего в реакцию растворителя, такого как дихлорметан или дихлорэтан. Реакция может легко проходить при температуре, которая находится в диапазоне от комнатной температуры до температуры кипения растворителя. На следующей стадии (b) продукт присоединения, который был получен на стадии (а), вводят в реакцию с хлорокисью фосфора (POCl3) в присутствии N,N-диметилформамида(формилирование по Вильсмейеру-Хааку с последующей циклизацией). Реакция может гладко проходить при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения. На следующей стадии (с) реакцией промежуточного соединения, полученного на стадии (b), с соединением формулы H-X-C1-6 алкил вводят определенную группу R2, причем R2 представляет собой, например, C1-6 алкокси или C1-6 алкилтиоостаток, a X представляет собой S или O. Промежуточные соединения, соответствующие формуле (II-b), могут быть получены в соответствии с нижеследующей схемой реакции (3), в которой на первой стадии (а) замещенный индол-2,3-дион вводят во взаимодействие с замещенным 3-фенилпропионовым альдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Pfitzinger), после этого на следующей стадии (b) декарбоксилируют карбоновую кислоту при высокой температуре в присутствии подходящего, не вступающего в реакцию растворителя, такого как дифениловый эфир. Очевидно, что и в предыдущих, и в последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если это необходимо, далее очищены способами, широко известными в технике, как, например, экстракцией, кристаллизацией и хроматографией. Далее, очевидно, что продукты реакции, которые существуют в виде более чем одной энантиомерной формы, могут быть выделены из их смеси по известным методикам, в частности препаративной хроматографией, такой как препаративная ВЭЖХ. Как правило, соединения формулы (I) могут быть разделены на их изомерные формы. Промежуточные соединения формулы (III) представляют собой соединения, которые либо доступны коммерчески, либо могут быть получены в соответствии с традиционными реакциями, которые, как правило, известны в технике. Например, промежуточные соединения формулы (III-а) могут быть получены в соответствии с нижеследующей схемой реакции (4), причем R3 представляет собой Ar, замещенный заместителями R10, каждый из R10 независимо выбран из группы, состоящей из гидрокси, галогена, циано,нитро, амино, моно- или ди(С 1-6 алкил)амино, C1-6 алкила, полигалоген C1-6 алкила, C1-6 алкокси, полигалогенC1-6 алкокси, карбоксила, C1-6 алкоксикарбонила, аминокарбонила, морфолинила и моно- или ди(C1-6 алкил)аминокарбонила, и s представляет собой целое число, равное 0, 1, 2 или 3. Схема 4 Схема реакции (4) включает стадию (а), в которой соответствующим образом замещенный Ar, в частности соответствующим образом замещенный фенил, вводят в реакцию Фриделя-Крафтса с подходящим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, например, такой как AlCl3, FeCl3, SnCl4, TiCl4 или ZnCl2, и соответствующего, не вступающего в реакцию, растворителя, такого как дихлорметан или дихлорэтан. Реакция может легко проходить при температуре, которая находится в диапазоне от комнатной температуры до температуры флегмации. На следующей стадии (b) реакцией промежуточного соединения, полученного на стадии (а),с первичным или вторичным амином вводят аминогруппу (-NR4R5). В отношении истолкования настоящего изобретения латентный туберкулез, туберкулез, находящийся в состоянии покоя, или стойкий туберкулез представляют собой одно и то же. Как уже утверждалось выше, соединения формул (Ia) и (Ib) могут быть применены для лечения латентного туберкулеза. Точная дозировка и частота введения данных соединений зависят от конкретного используемого соединения формул (Ia) и (Ib), конкретного состояния подвергающегося лечению, тяжести его состояния, возраста, веса, пола, рациона питания, времени введения и общего физического состояния данного пациента, помимо этого, как хорошо известно специалистам в данной области техники,могут быть приняты во внимание способ введения, а также другие виды лекарственной терапии, применяющиеся в отношении данного пациента. Более того, очевидно, что эффективное дневное количество может быть снижено или увеличено в зависимости от реакции пациента и/или в зависимости от оценки врача, назначившего соединения по настоящему изобретению. Соединения по настоящему изобретению могут вводиться в фармацевтически приемлемой форме,необязательно в фармацевтически приемлемом носителе. Фармацевтические составы могут иметь различные фармацевтические формы для целей введения. В качестве подходящих составов можно упомянуть любые составы, обычно применяемые для системно вводимых лекарственных средств. Для приготовления фармацевтических составов эффективное количество конкретного соединения, служащего действующим ингредиентом, необязательно в форме аддитив- 10009779 ной соли, добавляют в виде однородной примеси к фармацевтически приемлемому носителю, причем данный носитель может отличаться широким разнообразием форм, в зависимости от формы препарата,которая желательна для введения. Желательно, чтобы данные фармацевтические составы имелись в форме однократной дозировки, удобной, в частности, для перорального введения или для введения парентеральной инъекцией. Например, в случае приготовления состава в форме для перорального введения могут быть применены любые из обычных фармацевтических сред, например, такие как вода, гликоли,масла, спирты и т.п. в случае жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры,эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие средства, связующие средства, дезинтегрирующие средства и т.п. в случае порошков, пилюль,капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее выгодные формы одноразового перорального дозирования, и в этом случае, очевидно, применяются твердые фармацевтические носители. Носитель для парентеральных составов обычно содержит стерилизованную воду, по крайней мере, в значительной части, хотя могут быть включены и другие ингредиенты, например,для содействия растворимости. Могут быть приготовлены, например, такие инъецируемые растворы, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Также могут быть приготовлены инъецируемые суспензии, и в этом случае могут быть применены подходящие жидкие носители, суспендирующие средства и т.п. Также включены препараты в твердом состоянии, которые предназначены для превращения в жидкую форму незадолго перед применением. В зависимости от способа введения фармацевтический состав предпочтительно будет содержать действующий ингредиент в количестве от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.%, а также фармацевтически приемлемый носитель в количестве от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.%, причем все процентные соотношения даны относительно общей массы композиции. Фармацевтическая композиция может дополнительно содержать другие известные в технике разнообразные ингредиенты, например смазывающие средства, стабилизирующие средства, буферные соединения, эмульгирующие средства, средства для регулирования вязкости, поверхностно-активные вещества, консерванты, вкусовые добавки или красители. Особенно выгодно составлять упомянутые выше фармацевтические составы в виде лекарственных форм разовой дозировки в целях простоты введения и единообразия дозирования. В рамках настоящего изобретения лекарственными формами разовой дозировки именуются физически раздельные единицы,удобные в качестве единичных доз, причем каждая единица содержит предварительно определенное количество действующего ингредиента, рассчитанное на то, чтобы произвести желаемое терапевтическое действие, в сочетании с требуемым фармацевтическим носителем. Примерами подобных лекарственных форм разовой дозировки являются таблетки (включая шероховатые таблетки или таблетки, покрытые оболочкой), капсулы, пилюли, пачки порошка, тонкие пластинки, суппозитории, инъецируемые растворы или суспензии и т.п., а также отдельные множества из числа перечисленных форм. Дневная дозировка соединения по настоящему изобретению будет, несомненно, изменяться в зависимости от применяемого соединения, способа введения, желаемого лечения и выявленного микобактериального заболевания. Однако, в целом, удовлетворительные результаты получаются в тех случаях, когда дневная доза соединения по настоящему изобретению не превышает 1 или 2 г, например в диапазоне от 10 до 50 мг/кг веса тела. Экспериментальная часть Как утверждалось выше, соединения формул (Ia) и (Ib), а также их получение описаны в WO 2004/011436, и данный источник включен в настоящее изобретение с помощью ссылки. У некоторых соединений не была определена абсолютная стереохимическая конфигурация содержащегося в них ассиметрического атома (атомов) углерода. В таких случаях стереохимически изомерная форма, которая была выделена первой, обозначена как "А", а вторая как "В", без дальнейшего соотнесения с действительной стереохимической конфигурацией. Однако упомянутые изомерные формы "А" и"В" могут быть однозначно охарактеризованы специалистами в данной области техники при использовании известных в технике способов, таких как, например, дифракция рентгеновских лучей. В случае, если "А" и "В" представляют собой стереоизомерные смеси, они могут быть в дальнейшем разделены, в результате чего соответствующие первые выделенные фракции обозначены, соответственно, "А 1" и "В 1" и вторые "А 2" и "В 2" без дополнительного соотнесения с реальной стереохимической конфигурацией. Однако указанные изомерные формы "А 1, А 2" и "В 1, В 2" могут быть однозначно охарактеризованы специалистом в данной области техники при использовании известных в технике способов, таких как, например, дифракция рентгеновских лучей. Представленные соединения (см. табл. 1-6) пронумерованы в соответствии с номерами соединенийWO 2004/011436, и они могут быть получены в соответствии со способами, описанными в WO 2004/011436.Ex. Nr. (Example Nr.) в приведенных ниже таблицах относятся к номерам примеров WO 2004/011436,которые показывают, каким способом могут быть получены данные соединения. В частности, ниже подробно описано получение соединений 12, 13, 12 а, 13 а, 14 и 15. Получение промежуточных соединений Пример A1. Получение промежуточного соединения 1. Бензолпропаноилхлорид (0,488 моль) добавляют по каплям при комнатной температуре к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл), после чего смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и концентрированный NH4OH и экстрагируют CH2Cl2. Органический слой высушивают (MgSO4), фильтруют и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира. Остаток (119,67 г) растворяют в CH2Cl2 и промывают 1 н. HCl. Органический слой высушивают (MgSO4), фильтруют и растворитель выпаривают. Получают 107,67 г промежуточного соединения 1. Пример A2. Получение промежуточного соединения 2. Реакцию проводят в два этапа. POCl3 (1,225 моль) добавляют по каплям при 10 С к N,N-диметилформамиду (ДМФА) (0,525 моль). Затем при комнатной температуре добавляют 0,175 моль промежуточного соединения 1 (полученного в соответствии с A1). Смесь перемешивают в течение ночи при 80 С,выливают на лед и экстрагируют CH2Cl2. Органический слой высушивают (MgSO4), фильтруют и растворитель выпаривают. Продукт используют без дальнейшей очистки. Получают 77,62 г промежуточного соединения 2 (67%). Пример A3. Получение промежуточного соединения 3. Смесь промежуточного соединения 2 (полученного в соответствии с А 2) (0,233 моль), раствораCH3ONa (30%) в метаноле (222,32 мл) и метанола (776 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют,высушивают (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 20/80 и затем 100/0; 20-45 мкм). Собирают очищенные фракции и удаляют растворитель. Получают 25 г промежуточного соединения 3 (выход 33%, т.пл. 84 С) в виде белого порошка. Получение конечных соединений 12, 13, 12 а, 13 а, 14 и 15- 12009779 1,6M H-BuLi (0,05 моль) медленно добавляют при -20 С в токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,05 моль) в 80 мл тетрагидрофурана (ТГФ). Смесь перемешивают при -20 С в течение 15 мин,затем охлаждают до -70 С. Медленно добавляют раствор 0,046 моль промежуточного соединения 3 (полученного в соответствии с A3, как описано выше) в 150 мл ТГФ. Реакционную смесь перемешивают при -70 С в течение 30 мин. Медленно добавляют раствор 0,055 моль 3-(диметиламино)-1-(1-нафтил)-1 пропанона в 120 мл ТГФ. Смесь перемешивают при -70 С в течение 3 ч, гидролизуют ледяной водой при-30 С и экстрагируют EtOAc. Органический слой отделяют, высушивают (MgSO4), фильтруют и растворитель выпаривают. Остаток (29 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 99,5/0,5/0,1; 15-35 мкм). Собирают две фракции, удаляют растворитель и получают 3 г фракции 1 и 4,4 г фракции 2. Фракции 1 и 2 отдельно кристаллизуют из DIPE (диизопропилового эфира). Остатки отфильтровывают, высушивают и получают 2,2 г диастереомера А конечного соединения 14 (выход 9%, т.пл. 210 С) в виде белого порошка, а также 4 г диастереомера В конечного соединения 15 (выход 16%, т.пл. 244 С) в виде белого порошка. Для получения соответствующих энантиомеров диастереомер А (конечного соединения 14) очищают хиральной хроматографией на силикагеле(chiralpack AD) (элюент гексан/EtOH: 99,95/0,05). Собирают две фракции и удаляют растворитель. Получают 0,233 г энантиомера A1 (конечное соединение 12) (т.пл. 118 С, []D20=-166,98 (с=0,505 г/100 мл в ДМФА в виде белого порошка, а также 0,287 г энантиомера А 2 (конечное соединение 13) (т.пл. 120 С,[]D20=+167,60 (с=0,472 г/100 мл в ДМФА в виде белого порошка. Энантиомер A1 кристаллизуют изEtOH и получают белое твердое вещество: т.пл. 184 С, []D20=-188,71 (с=0,621 г/100 мл в ДМФА). Кристаллизация энантиомера А 2 из EtOH дает твердое вещество с т.пл. 175 С. 0,2 г диастереомера В (конечное соединение 15) очищают хиральной хроматографией на силикагеле (chiralpack AD) (элюент: EtOH/изо-PrOH/N-этилэтанамин: 50/50/0,1). Собирают две фракции и удаляют растворитель. Получают 78,2 мг энантиомера B1 и 78,8 мг энантиомера В 2. Энантиомер B1 очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH: 99/1/0,1; 15-40 мкм). Собирают одну фракцию и удаляют растворитель. Получают 57 мг энантиомера B1 (конечное соединение 12 а)([]D20=-42,56 (с=0,336 г/100 мл в ДМФА. Энантиомер В 2 очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH: 99/1/0, 1; 15-40 мкм). Собирают одну фракцию и удаляют растворитель. Получают 53 мг энантиомера В 2 (конечное соединение 13 а) ([]D20=+43,55 (с=0,349 г/100 мл в ДМФА. В табл. 1-6 приведен список соединений формул (Ia) и (Ib). Таблица 1 А. Изучение эффективности конечного соединения 12 в подавлении неактивных Mycobacterium bovis. Бактериальные штаммы и культуральная средаMycobacterium bovis BCG были получены от Tibotec Virco (ТВ 0087 - Belgium). M. bovis BCG, экспрессирующие ген люциферазы на плазмиде pSMT1 (любезный подарок Dr. Kris Huygen из Pasteur Institute,Brussles8) культивируют в среде Middlebrook 7H9 (Difco, BD271310) с 0,05% Tween-80 (Sigma) в фазе логарифмического роста в течение 3-4 дней перед началом эксперимента. Для приготовления ростовой среды растворяют 4,7 г порошка Middlebrook в 895 мл дистиллированной воды, добавляют 5 мл глицерина, 200 мкл Tween-80 и подвергают обработке в автоклаве при 121 С в течение 15 мин. Когда смесь охлаждается до 45 С, к среде асептически добавляют 100 мл обогащения Middlebrook OADC. Хранят при 4 С в течение, максимум, 1 месяца. Предварительно инкубируют все среды в течение 2 дней при 37 С для проверки на загрязнения. Добавляют 50 мкг/мл гигромицина для экспрессирования гена люциферазы (BCG-pSMT1) штаммом M. bovis BCG.I. Изучение Mycobacterium bovis BCG. Исследование в неактивном состоянии 500 мкл культуры Mycobacterium bovis BCG добавляют к 100 мл питательной среды Middlebrook 7H9 с добавками, находящейся в 250-мл стерильной склянке Duran, которая снабжена магнитной палочкой для перемешивания. Инкубирование осуществляют на электрической магнитной мешалке в течение 7 дней при 37 С (500 об./мин). 5 мл аликвоты культуры логарифмической фазы (OD600 НМ=0,5-0,8) переносят в 15-мл пробирки с завинчивающимися крышками. В отдельные пробирки добавляют различные лекарственные средства до конечной концентрации 10 мкг/мл. После добавления лекарственных препа- 23009779 ратов неплотно закрывают все пробирки и помещают внутрь анаэробного сосуда (BBL). Чтобы достичь анаэробных условий в сосуде, используют анаэробные газогенерирующие оболочки и для отслеживания анаэробных условий применяют анаэробные полоски. Добавление отдельных лекарственных средств и начало анаэробиоза в сосуде производят чрезвычайно быстро, как это было описано ранее 9. Сосуд инкубируют в течение 7 дней при 37 С. Исследование CFU (колониеобразующая единица) По прошествии 7 дней анаэробиоза находящиеся в неактивном состоянии культуры собирают с помощью центрифугирования при низкой скорости (2000 об./мин в течение 10 мин). Клетки дважды промывают средой 7 Н 9 для удаления лекарственных средств и повторно суспендируют в среде, свободной от лекарственного средства. CFU обработанных и необработанных культур определяют с помощью посева на 0, 2 и 5 день для вычисления бактериальной активности.II. Изучение Mycobacterium bovis BCG, экспрессирующих ген люциферазы на плазмиде pSMT1. Исследование в неактивном состоянии 500 мкл культуры Mycobacterium bovis BCG люцифераза (pSMT1) добавляют к 100 мл питательной среды Middlebrook 7H9 с добавками, находящейся в 250-мл стерильной склянке Duran с магнитной палочкой для перемешивания. Инкубирование осуществляют на электрической магнитной мешалке в течение 7 дней при 37 С (500 об./мин). 5 мл аликвоты культуры логарифмической фазы (OD600 НМ=0,5-0,8) переносят в 15-мл пробирки с завинчивающимися крышками. В отдельные пробирки добавляют различные лекарственные средства до конечной концентрации 10 мкг/мл. После добавления лекарственных препаратов неплотно закрывают все пробирки и очень быстро помещают внутрь анаэробного сосуда(BBL), как было описано ранее 9. Чтобы достичь анаэробных условий в сосуде, используют анаэробные газогенерирующие оболочки и для отслеживания анаэробных условий применяют анаэробные полоски. Сосуд инкубируют в течение 7 дней при 37 С. Анализ люциферазы По прошествии 7 дней анаэробиоза находящиеся в неактивном состоянии культуры собирают с помощью центрифугирования при низкой скорости (2000 об./мин в течение 10 мин). Клетки дважды промывают средой 7 Н 9 для удаления лекарственных средств и повторно суспендируют в среде, свободной от лекарственного средства. После промывания добавляют 250 мкл неактивной культуры Mycobacteriumbovis BCG люцифераза (pSMT1) на 5 различных микропланшетов (от дня 0 до дня 5). Каждый образец разбавляют средой в микропланшете (5-кратное разбавление) и повторно инкубируют при 37C от 0 до 5 дней. 40 мкл образцов и разбавленных образцов добавляют к 140 мкл PBS (phosphate-buffered saline солевой раствор, буферированный фосфатом). Добавляют 20 мкл субстрата люциферазы (1% н-дециловый альдегид в этаноле). Каждый день от 0 до 5 в течение 10 с измеряют люминисценцию, чтобы следить за ростом жизнеспособных бактерий (используют Luminoskan Ascent Labsystems с инжектором). Структура эксперимента Результаты и обсуждение Модель неактивности in vitro была разработана на основе способа создания неактивных бактерий путем уменьшения содержания кислорода Wayne'а 9,10. Согласно модели Wayne'а, поскольку микобакте- 24009779 рии погружаются на дно сосуда, они порождают кислородный градиент, создающий анаэробные условия на дне сосуда. Этот переход к низким концентрациям кислорода служит причиной перехода бактерий в неактивное состояние и таким образом ведет к повышенно регулируемой экспресии нескольких генов,включающих изоцитратлиазу и глициндегидрогеназу 7. Данные энзимы ответственны за выработку энергии в отсутствие кислорода, причем окончательными акцепторами электронов являются нитраты, сульфаты и т.д. по сравнению с молекулярным кислородом в случае аэробного дыхания. Энергия восстановленных субстратов генерирует электронный химический градиент. В данном эксперименте в экспериментальной установке была использована адаптация моделиWayne'а, включающая применение анаэробных сосудов Gaspak, в которых кислород поглощается в камере с помощью химической реакции 9. Сосуды Gaspak снабжены крышкой, содержащей катализатор. Фольговая оболочка Gaspak, которая содержит вещества, генерирующие водород и СО 2, находится в сосуде с бактериальными культурами. Оболочку открывают и пипеткой вносят в нее 10 мл водопроводной воды. Когда сосуд закрыт (крышка плотно прижата), выделяющийся водород соединяется с кислородом при действии катализатора, образуя воду. Это ведет к последовательному уменьшению содержания имеющегося в камере кислорода, и таким образом создается кислородный градиент. Более того, индикаторная полоска в сосуде содержит метиленовый синий, который становится бесцветным в отсутствие кислорода. Изменение цвета индикаторной полоски означает, что атмосфера в сосуде достигла надлежащего состояния. Для быстрого анализа действия того или иного соединения на неактивные бактерии использовалиM. bovis BCG, трансформированные с помощью конструкции люциферазы. M. bovis BCG использовали в первоначальных экспериментах в качестве заменителя, чтобы имитировать неактивное состояние микобактерий, в общем, и M. Tuberculosis, в частности 11,12. Штаммы репортера люциферазы достаточно часто используют для достижения жизнестойкости бактерий 13,14. M. bovis BCG трансформируют с помощью репортера плазмиды pSMT1, которая представляет собой "челночный" вектор, содержащий точку инициации репликации E.CoIi и микобактерий 8. Люминисцентные гены Vibro harveyi (lux А и В) находятся под управлением промотора BCG hsp60 и светятся в присутствии ATP или мононуклеотида флавина(FMNH2). Мертвые клетки не способны вырабатывать данные коферменты, что соответствует угасанию люминесценции. Активность конечного соединения 12 в данном тесте с неактивными бактериями определяют так же, как и активность остальных лекарственных средств, включая метронидазол и изониазид. Неактивные бактерии не уничтожаются изониазидом и также до некоторой степени устойчивы к рифампицину, но восприимчивы к действию метронидазола, антибиотика для анаэробных патогенов 15,16. Изониазид действует как начальное бактериальное средство, и его активность ограничена уничтожением размножающихся бацилл, но он не имеет значительной стерилизующей активности в отношении неактивных бацилл 17. После 7 дней анаэробиоза бактерии суспендируют в среде, где отсутствуют лекарства, на срок 5 дней и анализируют действие различных соединений на жизнеспособность бактерий с помощью определения количества люциферазы. Как показано на фиг. 1, изониазид не оказывает действия на данные неактивные бактерии и они имеют почти аналогичные характеристики роста по сравнению с контрольным образцом,показывающие неактивное состояние культивируемых бактерий или состояние, когда они не размножаются. Напротив, метронидазол проявляет очевидную эффективность в подавлении неактивных бацилл на протяжении указанного периода времени, демонстрируя понижение 2log10 по сравнению с контрольным образцом. Конечное соединение 12 оказывает влияние на выживаемость неактивных бактерий в зависимости от своей концентрации. При концентрации конечного соединения 12, составляющей 10 мкг/мл,имело место уменьшение выживаемости бактерий 4log10 по сравнению с необработанным контрольным образцом. При концентрации данного соединения 0,1 и 1 мкг/мл соответствующее подавление неактивных бактерий составляет приблизительно 0,5log10 и 2log10, соответственно. Для установления соответствия между действием конечного соединения 12 по уничтожению бактерий в терминах относительных единиц (RLU/мл) и колониеобразующих единиц (CFU/мл) определение количества бактерий также производят на 7 Н 10 планшетах. Сходное соотношение единиц RLU и определений количества CFU наблюдают после культивирования на 7 Н 10 планшетах в образцах 2 и 4 дней. Снижение отсчетов CFU по сравнению с необработанным контрольным образцом показало, что конечное соединение 12 при концентрациях 10, 1 и 0,1 мкг/мл снижает жизнестойкость приблизительно в 4,2,3 и 0,5 log10 на 2 день и около 6, 4,7 и 1,1 log10 на 5 день, соответственно. На фиг. 2 (А и В) приведены данные CFU. Близкую корреляцию между люминесцентными данными и данными CFU наблюдают на различных стадиях эксперимента. Интересно, что было отмечено уменьшение RLU в момент времени 0 по сравнению с определением количества CFU, в первую очередь, благодаря тому, что концентрацияATP в этих клетках является очень низкой, что, как было показано, типично для метаболического состояния неактивных бацилл 8. Активность конечного соединения 12 по отношению к неактивным (не размножающимся) микобактериям представляет собой чрезвычайно важное открытие, поскольку оно поможет в борьбе против туберкулеза путем полной ликвидации заболевания у людей, которые подвержены риску развития туберкулеза.- 25009779 В. Изучение эффективности конечного соединения 12 в подавлении неактивных Mycobacterium tuberculosis в соответствии с моделью неактивности Wayne. Бактериальные штаммы и культуральная средаMycobacterium tuberculosis (H37RV) культивируют в среде Middlebrook с 0,05% Tween-80. Для приготовления питательной среды Middlebrook 7H9 Broth (1X) (BD 271310) с добавками растворяют 4,7 г порошка Middlebrook в 895 мл дистиллированной воды, добавляют 5 мл глицерина, 200 мклTween-80 и подвергают обработке в автоклаве при 121C в течение 15 мин. Когда смесь охлаждается до 45 С, к среде асептически добавляют 100 мл обогащения Middlebrook OADC (BD 211886). Хранят при 4 С в течение, максимум, 1 месяца. Предварительно инкубируют все среды в течение 2 дней при 37 С для проверки на загрязнения.Wayne L.G. et. al.; Infection and Immunity 64 (6), 2062-2069 (1996). Изучение Mycobacterium tuberculosis (H37RV) Исследование в неактивном состоянии 1000 мкл культуры Mycobacterium tuberculosis (предыдущая культура) добавляют к 100 мл питательной среды Middlebrook 7H9 с добавками, находящейся в 250-мл стерильной склянке Duran с магнитной палочкой для перемешивания. Инкубирование осуществляют на электрической магнитной мешалке в течение 7 дней при 37 С (500 об./мин). 17 мл аликвоты культуры логарифмической фазы (рассчитанный OD600 нм=0,01) переносят в 25-мл пробирки. Пробирки плотно закрывают крышками с резиновыми мембранами и инкубируют на магнитной мешалке, чтобы создать анаэробиоз за счет уменьшения содержания кислорода. Перемешивание содержимого пробирок достигается за счет 8 мм тефлоновых стержней для перемешивания. Пробирки инкубируют в течение 22 дней при 37 С в инкубаторе с магнитной мешалкой(120 об./мин) до достижения анаэробиоза (метиленовый синий (1,5 мг/л) переходит в бесцветное состояние). Через 14 дней в отдельные пробирки добавляют различные лекарственные средства (конечная концентрация 100, 10, 1 и 0,1 мкг/мл). Метронидазол добавляют в качестве контроля для подавления неактивных бактерий (добавляют в начале). Изониазид также добавляют в качестве контроля, чтобы показать, что он не оказывает какого-либо действия на рост и жизнестойкость неактивных бактерий. Исследование CFU По прошествии 22 дней культуры собирают с помощью центрифугирования при низкой скорости(2000 об./мин в течение 10 мин). Клетки дважды промывают средой, не содержащей лекарственного средства, после чего клетки повторно суспендируют в среде, свободной от лекарственного средства, и инкубируют. Уменьшение CFU по сравнению с необработанными контрольными культурами определяют с помощью посева после анаэробиоза для вычисления бактериальной активности. Структура эксперимента Результаты и обсуждение Действие конечного соединения 12 на неактивные бактерии показано (см. фиг. 3) с использованием модели неактивности Wayne. Как уже было показано выше, она представляет собой модель уменьшения содержания кислорода in vitro, которая инициирует проявление неактивности бактерий 18-23. В моделиWayne культуры бактерий подвергают постепенному уменьшению содержания кислорода при инкубировании в закрытых пробирках с перемешиванием. При медленном переводе аэробно растущих бактерий в анаэробные условия культура становится более способной к адаптации и выживанию в условиях анаэробиоза за счет смещения вниз к состоянию анаэробной выносливости. Модель Wayne представляет собой хорошо описанную модель неактивности in vitro.- 26009779 При концентрации конечного соединения 12, равной 10 мкг/мл, наблюдалось более чем 2log10 снижение неактивных бактерий, которое было отмечено также в случае моксифлоксацина и рифампицина. Изониазид не оказал никакого воздействия на неактивные бактерии, в то время, как контрольное соединение - метронидазол - показало хорошую эффективность. Список ссылок 1. Corbett, E.L. et al. The growing burden of tuberculosis: global trends and interactions with the HIVinfections. Proc. Biol. Sci. 263, 257-263 (1996). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (Ia) или (Ib) для производства лекарственного средства для лечения латентного туберкулеза, причем соединение формулы (Ia) или (Ib) представляет собой а также фармацевтически приемлемой кислотно- или основно-аддитивной соли указанного соединения,его N-оксида, его таутомерной формы или его стереохимически изомерной формы, гдеR1 представляет собой водород, галоген, галогеналкил, циано, гидрокси, Ar, Het, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; р представляет собой целое число, равное 1, 2, 3 или 4;q представляет собой целое число, равное 0, 1, 2, 3 или 4;R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; илиR4 и R5, включая также N, к которому они присоединены, могут совместно образовывать радикал,выбранный из группы, состоящей из пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила,пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, необязательно замещенных алкилом, галогеном, галогеналкилом, гидрокси, алкокси, амино, моно- или диалкиламино, алкилтио, алкоксиалкилом, алкилтиоалкилом и пиримидинилом;R6 представляет собой водород, галоген, галогеналкил, гидрокси, Ar, алкил, алкокси, алкилтио, алкоксиалкил, алкилтиоалкил, Ar-алкил или ди(Ar)алкил; или два вицинальных R6 радикала совместно могут образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1, 2, 3, 4 или 5;R8 представляет собой водород или алкил;R9 представляет собой оксо илиR8 и R9 вместе образуют радикал =N-CH=CH-; алкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном, гидрокси, алкокси или оксогруппами;Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из гидрокси, галогена, циано, нитро, амино,моно- или диалкиламино, алкила, галогеналкила, алкокси, галогеналкокси, карбоксила, алкоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила;Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила,- 28009779 бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила,бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкила, алкокси или Ar-карбонила; галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода; и галогеналкил представляет собой линейный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный остаток, содержащий от 3 до 6 атомов углерода, в которых 1 или несколько атомов углерода замещены 1 или несколькими атомами галогенов. 2. Применение по п.1, в которомR1 представляет собой водород, галоген, циано, Ar, Het, алкил и алкокси; р представляет собой целое число, равное 1 или 2;R2 представляет собой водород, гидрокси, алкокси, алкоксиалкокси, алкилтио или радикал формулыq представляет собой целое число, равное 0, 1, 2 или 3;R4 и R5, каждый из них независимо представляет собой водород, алкил или бензил; илиR4 и R5, а также N, к которому они присоединены, совместно могут образовывать радикал, выбранный из следующих групп: пирролидинила, имидазолила, триазолила, пиперидинила, пиперазинила, пиразинила, морфолинила и тиоморфолинила, причем каждая кольцевая система необязательно замещена алкилом или пиримидинилом;R6 представляет собой водород, галоген или алкил; или два вицинальных радикала R6 могут вместе образовывать двухвалентный радикал формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1;R8 представляет собой водород или алкил;R8 и R9 вместе образуют радикал =N-CH=CH-; алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или же циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, причем каждый атом углерода может быть необязательно замещен галогеном или гидроксигруппой;Ar представляет собой гомоцикл, выбранный из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, галогеналкила, циано, алкокси и морфолинила;Het представляет собой моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, фуранила, тиенила, пиридинила, пиримидинила; или бициклический гетероцикл, выбранный из группы, состоящей из бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 алкильными или арилкарбонильными заместителями; и галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора и брома. 3. Применение по п.1 или 2, где в формуле (Ia) или (Ib) R1 представляет собой водород, галоген, Ar,алкил или алкокси. 4. Применение по п.3, где R1 представляет собой галоген. 5. Применение по любому из предшествующих пунктов, в котором в формуле (Ia) или (Ib) р равно 1. 6. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R2 представляет собой водород, алкокси или алкилтио. 7. Применение по п.6, где R2 представляет собой алкокси. 8. Применение по любому из предшествующих пунктов, в котором в формуле (Ia) или (Ib) R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из галогена и галогеналкила. 9. Применение по п.8, гле R3 представляет собой нафтил. 10. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) q равно 1. 11. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) каждый из R4- 29009779 и R5 независимо представляет собой водород или алкил, либо R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, состоящей из имидазолила, триазолила,пиперидинила, пиперазинила и тиоморфолинила. 12. Применение по п.11, где в формуле (Ia) или (Ib) каждый из R4 и R5 независимо представляет собой водород или алкил. 13. Применение по п.12, где R4 и R5 представляют собой C1-4 алкил. 14. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R6 представляет собой водород, алкил или галоген. 15. Применение по п.13, где R6 представляет собой водород. 16. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) r равно 1. 17. Применение по любому из предшествующих пунктов, где в формуле (Ia) или (Ib) R7 представляет собой водород. 18. Применение по п.1, где в формуле (Ia) или (Ib) R1 представляет собой водород, галоген, Ar, алкил или алкокси; р=1; R2 представляет собой водород, алкокси или алкилтио; R3 представляет собой нафтил, фенил или тиенил, каждый из которых необязательно замещен 1 или 2 заместителями, выбранными из группы, состоящей из галогена и галогеналкила; q=0, 1, 2 или 3; каждый из R4 и R5 независимо представляет собой водород или алкил, или R4 и R5, а также N, к которому они присоединены, совместно образуют радикал, выбранный из группы, состоящей из имидазолила, триазолила, пиперидинила, пиперазинила и тиоморфолинила; R6 представляет собой водород, алкил или галоген; r равен 1 и R7 представляет собой водород. 19. Применение по любому из предшествующих пунктов, где алкил представляет собой C1-С 6 алкил. 20. Применение по любому из предшествующих пунктов, где галогеналкил представляет собой полигалогенС 1-6 алкил. 21. Применение по любому из пп.1-20, где соединением является соединение формулы (Ia). 22. Применение по п.1, отличающееся тем, что соединение выбрано из группы, состоящей из 1-(6-бром-2-метоксихинолин-3-ил)-2-(3,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,5-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(2-фторфенил)-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-п-толилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-метиламино-2-нафталин-1-ил-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-(3-фторфенил)-1-фенилбутан-2-ола и 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-фенил-1-фенилбутан-2-ола; а также его фармацевтически приемлемой кислотно- и основно-аддитивной соли, его N-оксида, его таутомерной формы или его стереохимически изомерной формы. 23. Применение по п.22, где соединение выбрано из группы, состоящей из 1-(6-бром-2-метоксихинолин-3-ил)-2-(2,3-дифторфенил)-4-диметиламино-1-фенилбутан-2-ола; 1-(6-бром-2-метоксихинолин-3-ил)-4-диметиламино-2-нафталин-1-ил-1-фенилбутан-2-ола, соответствующего 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанолу; или его фармацевтически приемлемой кислотно- и основно-аддитивной соли, его N-оксида, его таутомерной формы или его стереохимически изомерной формы. 24. Применение по п.1, где соединение представляет собой 6-бром[2-(диметиламино)этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол, его фармацевтически приемлемую кислотно- и основно-аддитивную соль, его N-оксид или его стереохимически изомерную форму. 25. Применение по п.24, где соединение представляет собой 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталинилфенил-3-хинолинэтанол или его фармацевтически приемлемую кислотноаддитивную соль. 26. Применение по п.24, где соединение представляет собой 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталинилфенил-3-хинолинэтанол или его стереохимически изомерную форму. 27. Применение по п.24, где соединение представляет собой 6-бром[2-(диметиламино)этил]-2 метокси 1-нафталинилфенил-3-хинолинэтанол или его форму N-оксида. 28. Применение по п.24, где соединение представляет собой (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол или его фармацевтически приемлемую кислотно-аддитивную соль. 29. Применение по п.28, где соединение представляет собой (S,R)-6-бром[2-(диметиламино) этил]-2-метокси 1-нафталинилфенил-3-хинолинэтанол.
МПК / Метки
МПК: A61P 31/06, A61K 31/47
Метки: лечение, туберкулёза, латентного
Код ссылки
<a href="https://eas.patents.su/30-9779-lechenie-latentnogo-tuberkulyoza.html" rel="bookmark" title="База патентов Евразийского Союза">Лечение латентного туберкулёза</a>












