Способ получения кристаллических форм и кристаллические формы оптических энантиомеров модафинила
Номер патента: 9592
Опубликовано: 28.02.2008
Авторы: Ван Лангевельде Адриан Ян, Бессельевр Кристин, Некеброк Оливье, Кокрель Жерар, Серрюр Жиль, Курвуазье Лоран, Роз Себастьян, Граф Стефани, Лепруст Пьер, Малле Франк
Формула / Реферат
1. Способ получения кристаллических форм оптических энантиомеров модафинила, включающий в себя следующие этапы:
i) растворение одного из оптических энантиомеров модафинила в растворителе;
ii) кристаллизация энантиомера модафинила;
iii) выделение полученной кристаллической формы энантиомера модафинила.
2. Способ по п.1, в котором энантиомером модафинила является левовращающий энантиомер.
3. Способ по п.1, в котором энантиомером модафинила является правовращающий энантиомер.
4. Способ по любому из пп.1-3, в котором получаемой кристаллической формой является полиморфная форма.
5. Способ по любому из пп.1-4, в котором кристаллизация проводится в кинетических или термодинамических условиях.
6. Способ по п.5, в котором кристаллизация проводится осаждением, при необходимости, в присутствии зародышей кристаллов желаемой кристаллической формы.
7. Способ по п.5, в котором кристаллизация проводится охлаждением раствора, полученного на этапе i).
8. Способ по п.7, в котором охлаждение проводится медленно.
9. Способ по п.7, в котором охлаждение проводится быстро.
10. Способ по пп.4 и 8, в котором применяемый на этапе i) растворитель выбирают из ацетона, диоксана 1-4, этилацетата, орто-, мета- или параксилола или смеси из орто-, мета- и/или параксилола, причём полученную при этом полиморфную форму обозначают как форма I.
11. Способ по пп.4 и 9, в котором применяемый на этапе i) растворитель выбирают из метанола, воды и спирто-водных смесей, причём полученную при этом кристаллическую форму обозначают как форма I.
12. Способ по пп.4 и 9, в котором применяемым на этапе i) растворителем является изопропанол, н-пропанол, этилацетат или денатурированный толуолом этанол, причём полученную при этом полиморфную форму обозначают как форма II.
13. Способ по пп.4 и 8, в котором применяемым на этапе i) растворителем является изопропанол, причём полученную при этом полиморфную форму обозначают как форма II.
14. Способ по пп.4 и 9, в котором применяемым на этапе i) растворителем является ацетон, причём полученную при этом полиморфную форму обозначают как форма III.
15. Способ по пп.4 и 8, в котором применяемый на этапе i) растворитель выбирают из тетрагидрофурана, хлороформа, метилэтилкетона, причём полученную при этом полиморфную форму обозначают как форма IV.
16. Способ по любому из пп.1-3, в котором полученной кристаллической формой является сольват оптических энантиомеров модафинила.
17. Способ по пп.8 и 16, в котором применяемым на этапе i) растворителем является диметилкарбонат, причём полученный при этом сольват обозначают как сольват диметилкарбоната оптических энантиомеров модафинила.
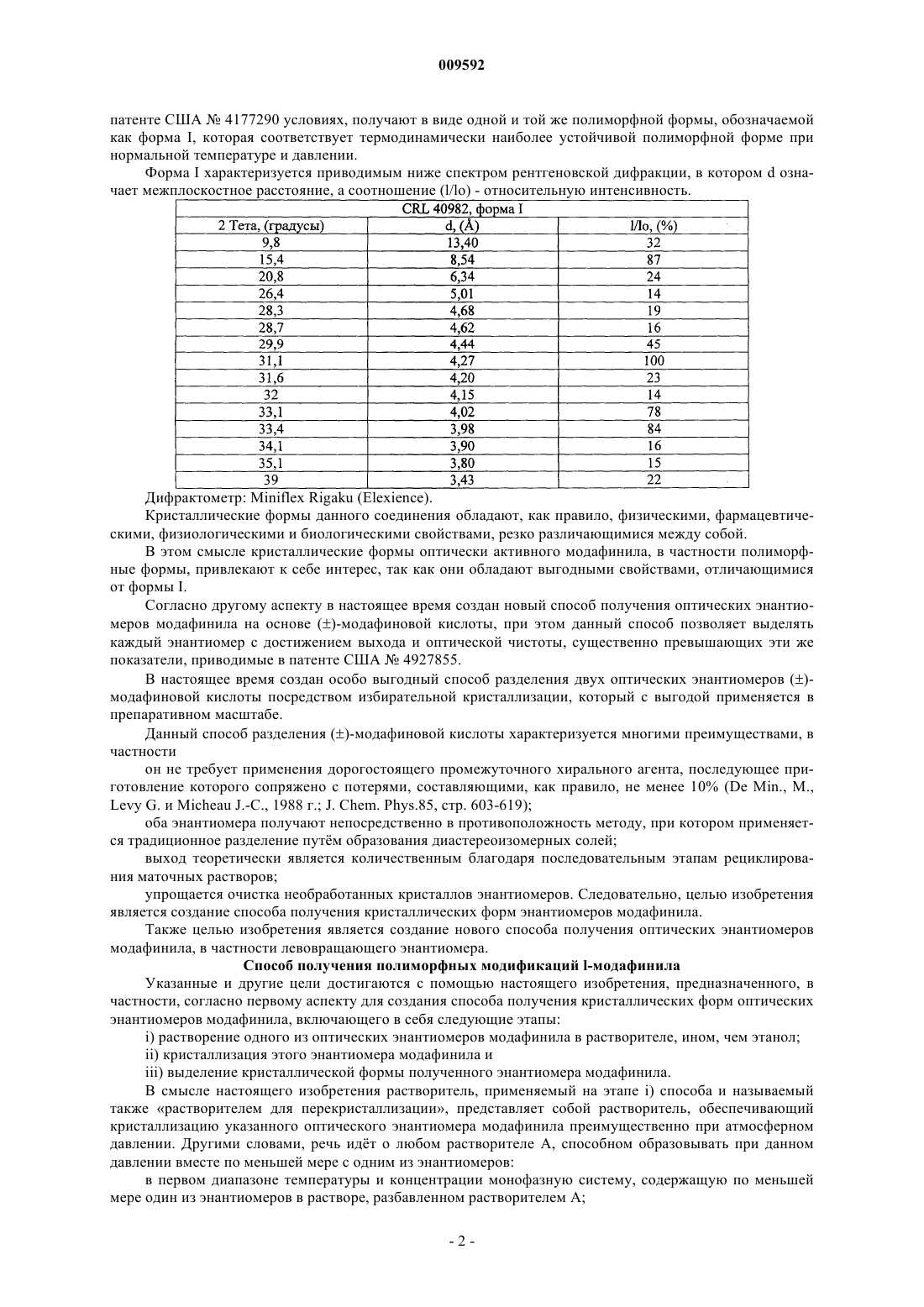
18. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма II, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 8,54; 7,57; 7,44; 4,56; 3,78; 3,71 (Е).
19. Полиморфная форма по п.18, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 11,33; 8,54; 7,57; 7,44; 5,67; 5,33; 4,83; 4,59; 4,56; 4,45; 4,05; 3,88; 3,78; 3,71; 3,34; 2,83; 2,53 (Е).
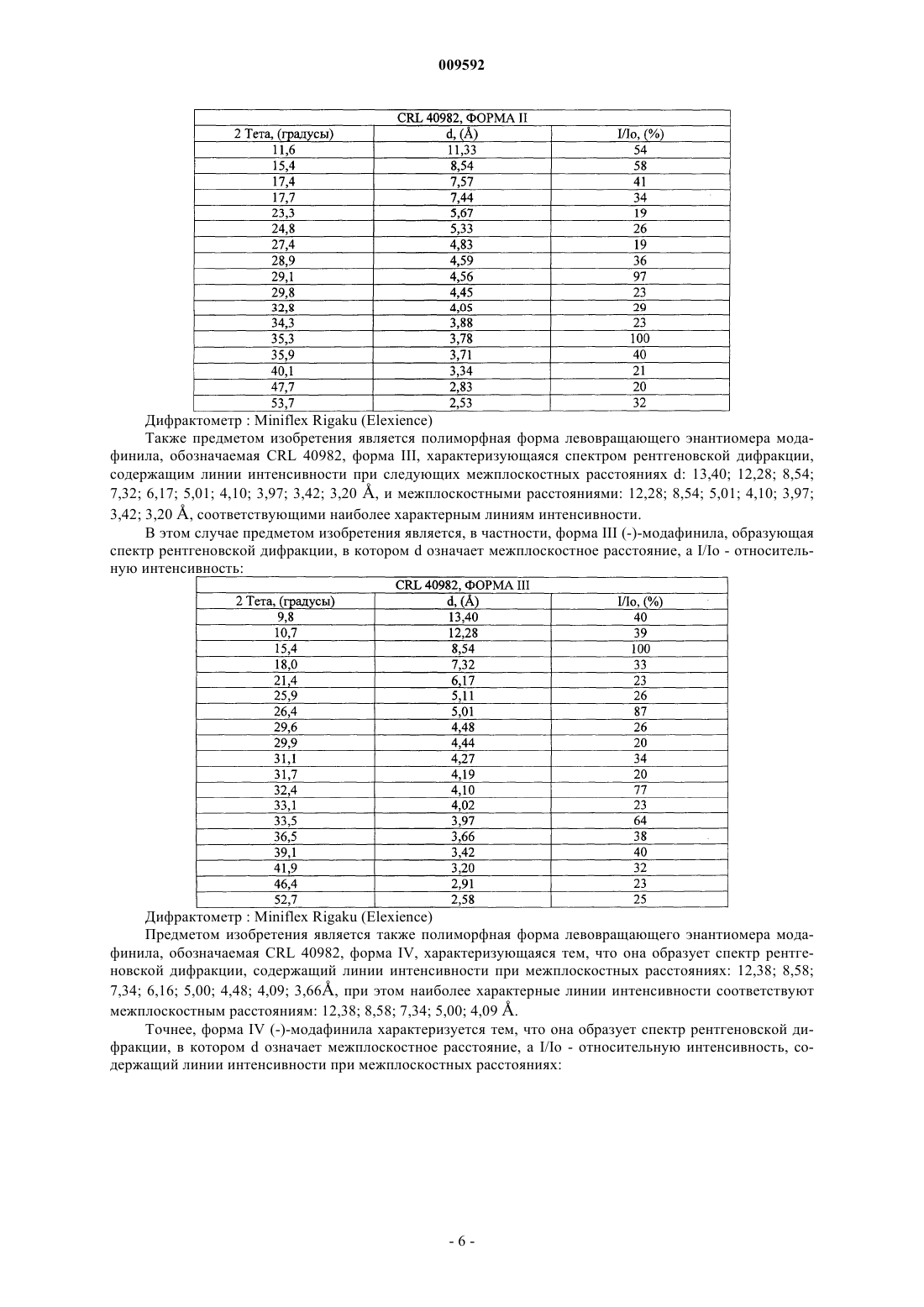
20. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма III, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 12,28; 8,54; 5,01; 4,10; 3,97; 3,20 (Е).
21. Полиморфная форма по п.20, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,40; 12,28; 8,54; 7,32; 6,17; 5,11; 5,01; 4,65; 4,60; 4,48; 4,44; 4,27; 4,19; 4,10; 4,02; 3,97; 3,83; 3,66; 3,54; 3,42; 3,20; 2,91; 2,58 (Е).
22. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма IV, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 12,38; 8,58; 7,34; 5,00; 4,09 (Е).
23. Полиморфная форма по п.22, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,88; 12,38; 10,27; 8,58; 7,34; 6,16; 5,660; 5,120; 5,00; 4,64; 4,48; 4,26; 4,18; 4,09; 3,82; 3,66; 3,53; 3,42; 3,28; 3,20 (Е).
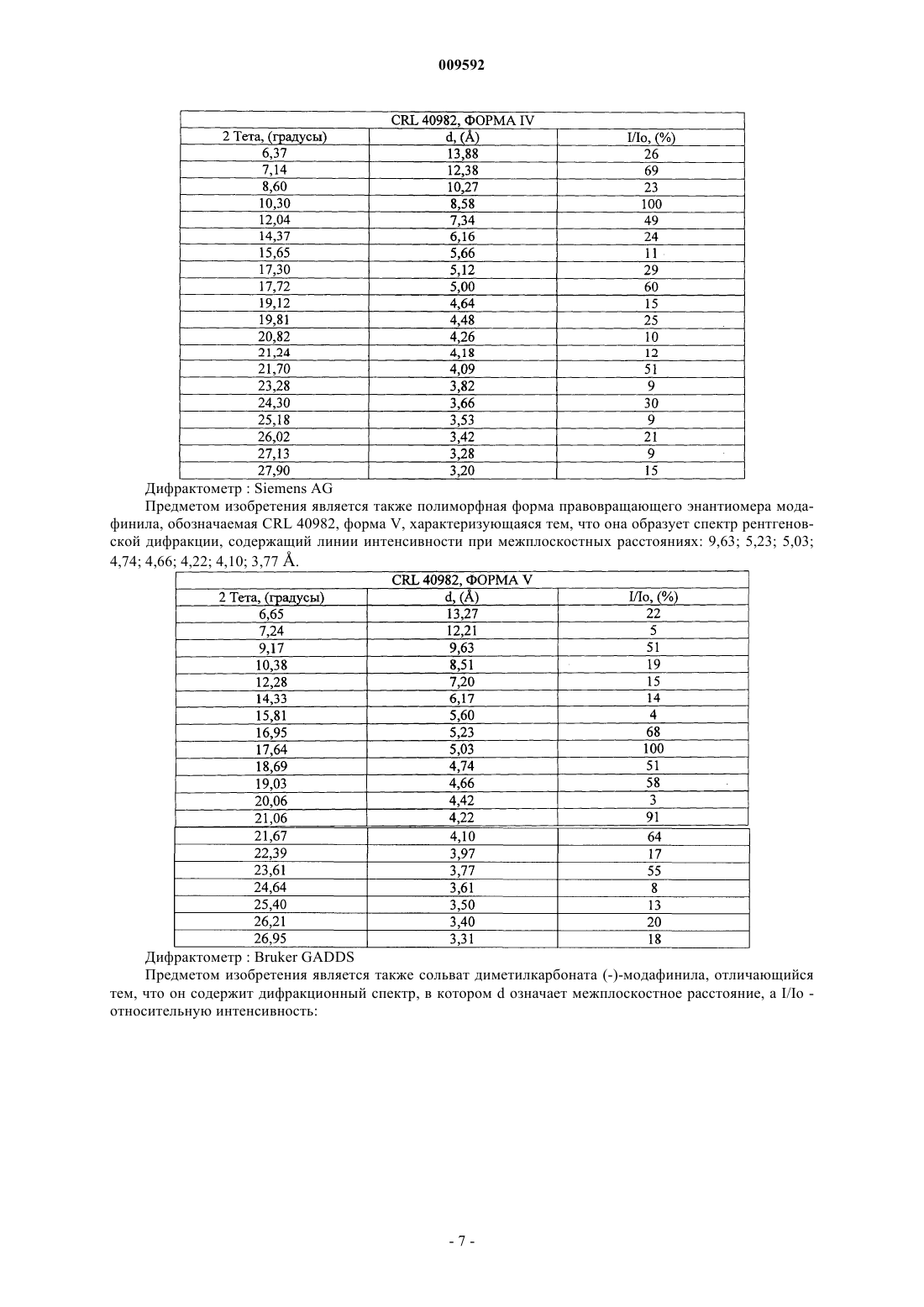
24. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма V, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 9,63; 5,23; 5,03; 4,74; 4,66; 4,22; 4,10; 3,77 (Е).
25. Полиморфная форма по п.24, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,27; 12,21; 9,63; 8,51; 7,20; 6,17; 5,60; 5,23; 5,03; 4,74; 4,66; 4,42; 4,22; 4,10; 3,97; 3,77; 3,61; 3,50; 3,40; 3,31 (Е).
26. Сольват диметилкарбоната лево- или правовращающего энантиомера модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостньгх расстояниях: 12,31; 9,69; 9,09; 8,54; 7,27; 6,21; 5,45; 5,10; 5,00; 4,83; 4,63; 4,46; 4,22; 4,13; 4,09; 3,78; 3,62; 3,53; 3,42; 3,32; 3,24; 3,21; 3,10 (Е).
27. Способ превращения первой кристаллической формы одного из энантиомеров модафинила во вторую кристаллическую форму этого энантиомера, отличающуюся от первой, причём данный способ включает в себя следующие этапы:
a) суспендирование первой кристаллической формы указанного энантиомера модафинила в соответствующем растворителе;
b) выделение полученной второй кристаллической формы.
28. Способ по п.27, в котором применяемым энантиомером является (-)-модафинил.
29. Способ по п.28, в котором первой кристаллической формой является форма I.
30. Способ по п.29, в котором применяемым на этапе ii) растворителем является ацетонитрил, в результате чего получают сольват ацетонитрила.
31. Сольват ацетонитрила энантиомера (-)-модафинила или (+)-модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостньгх расстояниях: 16,17; 14,14; 12,32; 10,66; 9,79; 9,29; 8,54; 8,15; 7,80; 7,09; 6,31; 5,83; 5,62; 5,41; 5,10; 4,90; 4,66; 4,58; 4,46; 4,33; 4,20; 4,02; 3,92; 3,835; 3,72; 3,60; 3,57; 3,45; 3,33; 3,24; 3,19; 3,09; 3,03 (Е).
32. Способ получения оптически активного модафинила на основе модафиновой кислоты, содержащий следующие этапы:
a) разделение двух оптических энантиомеров (+)-модафиновой кислоты и выделение по меньшей мере одного из энантиомеров;
b) приведение в контакт одного из двух полученных энантиомеров с низшим алкилгалоформиатом в присутствии спирта и органического основания;
c) выделение полученного продукта;
d) превращение полученного сложного эфира в амид;
e) выделение полученного на этапе iv) продукта.
33. Способ по п.32, в котором галоформиатом является низший алкилхлорформиат.
34. Способ по п.33, в котором низшим алкилхлорформиатом является метилхлорформиат.
35. Способ по любому из пп.32-34, в котором применяемое на этапе ii) основание выбирают из триэтиламина, диизопропиламина, диэтилметиламина, DBU.
36. Способ по любому из пп.32-35, в котором применяемым на этапе ii) растворителем является низший алифатический спирт, предпочтительно метанол.
37. Способ по любому из пп.32-36, в котором применяемым на этапе iv) растворителем является низший алифатический спирт, предпочтительно метанол.
38. Способ по любому из пп.32-37, в котором разделение оптических энантиомеров (+)-модафиновой кислоты на этапе i) проводят способом избирательной кристаллизации.
39. Способ по п.38, в котором способом разделения двух оптических энантиомеров (+)-модафиновой кислоты или её солей является способ внесения затравъш, причём данный способ включает в себя следующие этапы:
а) проведение при температуре TD гомогенизации системы, состоящей из рацемической смеси кристаллов в виде конгломерата, первого энантиомера модафиновой кислоты и растворителя, фигуративная точка E которой, определяемая переменными величинами "концентрация" и "температура TD", располагается в монофазной области разбавленного раствора;
b) быстрое охлаждение раствора, приготовленного на этапе а) при начальной температуре TD, до температуры TF;
c) внесение затравки в виде очень чистых зародышей первого энантиомера в приготовленный на этапе b) раствор во время охлаждения или в его конце (TF);
d) сбор кристаллов первого энантиомера;
e) введение рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов, осуществленного на этапе d), и гомогенизации новой системы нагревом до температуры TD таким образом, чтобы фигуративная точка E' была симметричной точке E по отношению к плоскости рацемической смеси систем, растворитель - антипод (-) - антипод (+), причем точка E' располагается в однофазной области разбавленного раствора;
f) быстрое охлаждение раствора, полученного на этапе е) при начальной температуре TD, до температуры TF;
g) внесение затравки в виде очень чистых зародышей второго энантиомера в полученный на этапе f) раствор;
h) сбор кристаллов второго энантиомера;
i) введение рацемической смеси в виде конгломерата кристаллов в маточные растворы, полученные в результате сбора кристаллов, осуществленного на этапе h), и гомогенизация новой системы нагревом до температуры TD для получения состава, идентичного составу системы исходной фигуративной точки E;
j) повторение этапов а), b), с), d), e), f), h), i) для последовательного получения первого и второго энантиомеров.
40. Способ по п.38, в котором способом разделения двух оптических энантиомеров (+)-модафиновой кислоты или её солей избирательной кристаллизацией служит самозатравочный способ AS3PC, причём данный способ включает в себя следующие этапы:
a) образование системы, состоящей из рацемической смеси кристаллов в виде конгломерата, первого энантиомера модафиновой кислоты и растворителя, фигуративная точка E которой, определяемая переменными величинами концентрации и температуры ТB, располагается в двухфазной области находящегося в избытке энантиомера и находится в равновесии со своим насыщенным раствором;
b) применение закона программирования охлаждения температуры приготовленной на этапе а) двухфазной смеси, причём данный закон программирования является таким, что маточные растворы сохраняют незначительное пересыщение, способствующее росту энантиомера, присутствующего в виде кристаллов, и предупреждается самопроизвольное зародышеобразование второго энантиомера, присутствующего в растворе;
c) в течение всего процесса роста кристаллов на этапе b) регулирование скорости перемешивания, незначительно возрастающей с течением времени, таким образом, чтобы в любой момент она оставалась достаточно низкой для содействия росту первого энантиомера и чтобы не возникали слишком значительные усилия сжатия, вызывающие неконтролируемое зародышеобразование, и достаточно высокой для образования однородной суспензии и быстрого обновления маточного раствора вокруг каждого кристаллита первого энантиомера;
d) сбор кристаллов первого энантиомера;
e) добавка рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов, осуществленного на этапе d), и доведение новой системы до температуры ТB в течение времени, необходимого для достижения термодинамического равновесия, таким образом, чтобы фигуративная точка E' была симметрична точке E по отношению к плоскости рацемических смесей системы растворитель - антипод (-) - антипод (+), причем точка E' располагается в двухфазной области второго, находящегося в избытке энантиомера и находится в равновесии со своим насыщенным раствором;
f) применение того же закона программирования охлаждения, что и на этапе b), в отношении двухфазной смеси, приготовленной на этапе е) и содержащей второй энантиомер, таким образом, чтобы маточные растворы оставались незначительно пересыщенными во время кристаллизации для содействия росту энантиомера, присутствующего в виде кристаллов, и для предупреждения самопроизвольного зародышеобразования первого энантиомера, присутствующего в растворе;
g) в течение всего процесса роста кристаллов на этапе f) регулирование скорости перемешивания, незначительно возрастающей с течением времени, таким образом, чтобы в любой момент она оставалась достаточно низкой для содействия росту второго энантиомера при исключении возникновения слишком значительных усилий сжатия, вызывающих неконтролируемое зародышеобразование, и достаточно высокой для получения однородной суспензии и быстрого обновления маточного раствора вокруг каждого кристаллита второго энантиомера;
h) сбор кристаллов второго энантиомера;
i) добавка рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов, осуществленного на стадии h), для получения системы, состав которой идентичен составу исходной системы E;
j) повторение этапов а), b), с), d), е), f), g), h) и i) для последовательного получения первого и затем второго из двух энантиомеров.
41. Способ по п.40, характеризующийся тем, что на этапе а) выбор растворителя или растворителей и рабочего диапазона температуры производят таким образом, чтобы одновременно получить
антиподы, образующие конгломерат, и возможный рацемат которых является метастабильным в рабочем диапазоне температур;
растворы, являющиеся достаточно концентрированными, но обладающие низкой вязкостью и малой упругостью пара;
отсутствие сольволиза и рацемизации;
стабильность сольватов в том случае, когда они находятся в состоянии равновесия и присутствуют разделяемые энантиомеры.
42. Способ по п.40 или 41, характеризующийся тем, что на этапах а) и е) температура ТВ превышает температуру TL гомогенизации рацемической смеси, содержащейся в исходной суспензии, и тем, что на основе кривой изменения ТНомо в зависимости от энантиомерного избытка и при постоянной концентрации рацемической смеси XL указанная температура ТB определяется таким образом, чтобы масса мелких кристаллов первого энантиомера на этапах а) и i) и второго энантиомера на этапе е), находящихся в равновесии с их насыщенным раствором, составляла не более 50%, предпочтительно от около 25 до 40% ожидаемого сбора.
43. Способ по любому из пп.40-42, характеризующийся тем, что на этапах b) и f) закон программирования охлаждения от температуры ТB до температуры TF, адаптированный к экспериментальной установке, задаётся таким образом, чтобы
в течение всего процесса кристаллизации обеспечивалось незначительное пересыщение энантиомера, присутствующего в виде кристаллов в начале каждого цикла, причём такое незначительное пересыщение вызывает слабые вторичные рост и зародышеобразование;
при температуре TF создавалось максимальное пересыщение второго энантиомера без первичного зародышеобразования;
на этапах d) и h) можно было собрать кристаллы, что после добавки рацемической смеси и компенсации на этапах е) и i) обеспечивает цикличность операций.
44. Способ по п.43, характеризующийся тем, что закон программирования охлаждения определяется для диапазона TL-TF охлаждением раствора с концентрацией XL от температуры TL+1шC до температуры TF, при этом TF меньше TL-(ТНомо-TL), что необходимо для получения стабильного насыщенного раствора без первичного зародышеобразования и обеспечения двойного сбора исходного избытка энантиомера, и что заъюэ программирования охлаждения определяется для своего диапазона TB-TL экстраполяцией того же закона, определенного для диапазона от TL+1шC до TF.
45. Способ по любому из пп.40-44, характеризующийся тем, что на этапах b) и f) термический эффект, сопровождающий осаждение первого и второго энантиомеров, учтён в законе программирования охлаждения.
46. Способ по любому из пп.40-45, характеризующийся тем, что на этапах е) и i) проводится компенсация растворителем.
47. Способ по любому из пп.40-46, характеризующийся тем, что на этапах а), е) и i) вводимые мелкие кристаллы рацемической смеси в виде конгломерата подвергают перед введением предварительной обработке для ускорения этапа растворения, такой как измельчение и просеивание, обработка ультразвуковыми волнами, частичная лиофилизация.
48. Способ по любому из пп.40-47, характеризующийся тем, что на этапах а), е) и i) повышают скорость перемешивания.
49. Способ по любому из пп.39 или 40-48, в котором применяемым на этапе а) растворителем является этанол, 2-метоксиэтанол или метанол.
50. Способ по п.49, в котором температура TF лежит в диапазоне 0-40шC.
51. Способ по п.49 или 50, в котором концентрация рацемической смеси на этапе а) составляет 2-50 мас.%.
52. Способ по любому из пп.49-51, в котором избыток энантиомера на этапе а) составляет 1-50 мас.%.
53. Способ по п.52, в котором температура TB составляет 25-50шC.
54. Способ по любому из пп.49-53, в котором продолжительность выдержки при температуре TB составляет 15-60 мин.
55. Способ получения одного из энантиомеров модафинила, включающий следующие этапы:
a) разделение двух оптических энантиомеров (+)-модафиновой кислоты или её солей способом избирательной кристаллизации, таким как охарактеризованный в пп.36-54;
b) превращение этого энантиомера в амид;
c) выделение полученного энантиомера модафинила.
56. Способ по п.55, в котором этап b) проводится в два приёма:
b1) превращение указанного энантиомера в сложный низший алкиловый эфир;
b2) превращение полученного на этапе b1) продукта в амид.
57. Фармацевтическая композиция, содержащая полиморфную форму (-)-модафинила или (+)-модафинила, обозначаемую как форма II, при необходимости в сочетании с фармацевтически приемлемым наполнителем.
58. Фармацевтическая композиция, содержащая полиморфную форму (-)-модафинила или (+)-модафинила, обозначаемую как форма III, при необходимости в сочетании с фармацевтически приемлемым наполнителем.
59. Фармацевтическая композиция, содержащая полиморфную форму (-)-модафинила или (+)-модафинила, обозначаемую как форма IV, при необходимости в сочетании с фармацевтически приемлемым наполнителем.
60. Фармацевтическая композиция, содержащая полиморфную форму (-)-модафинила или (+)-модафинила, обозначаемую как форма V, при необходимости в сочетании с фармацевтически приемлемым наполнителем.
61. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначаемой как форма II, для изготовления лекарственного средства, предназначенного для профилактики или лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона, защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательных функций малыми дозами.
62. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначаемой как форма III, для изготовления лекарственного средства, предназначенного для профилактики или лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона; защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательных функций малыми дозами.
63. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначаемой как форма IV, для изготовления лекарственного средства, предназначенного для профилактики или лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона, защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательных функций малыми дозами.
64. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначаемой как форма V, для изготовления лекарственного средства, предназначенного для профилактики или лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона, защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательэых функций малыми дозами.
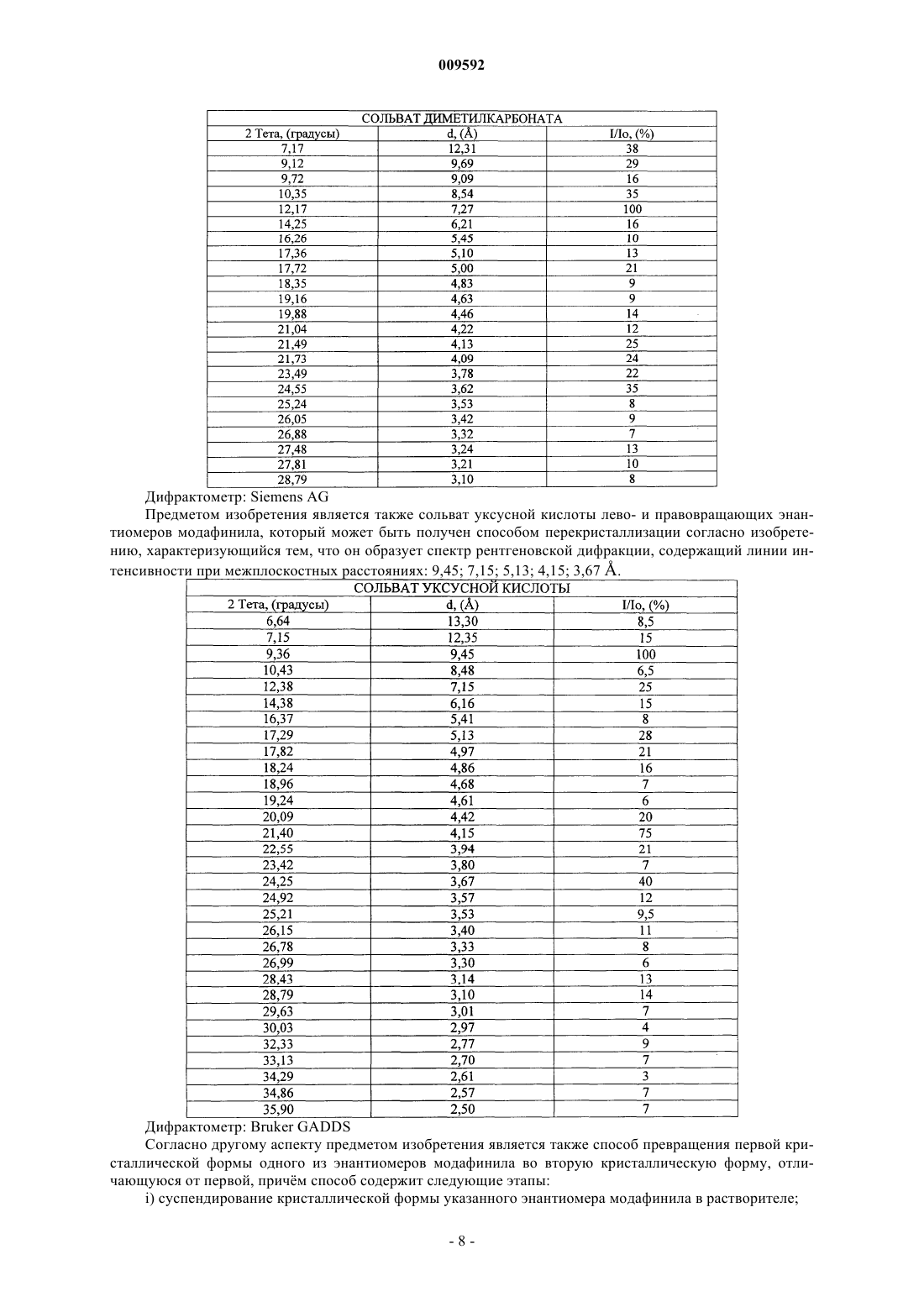
65. Сольват уксусной кислоты энантиомера (-)-модафинила или (+)-модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 9,45; 7,15; 5,13; 4,15; 3,67 (Е).
66. Сольват уксусной кислоты энантиомера (-)-модафинила или (+)-модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,30; 12,35; 9,45; 8,48; 7,15; 6,16; 5,41; 5,13; 4,97; 4,86; 4,68; 4,61; 4,42; 4,15; 3,94; 3,80; 3,67; 3,57; 3,53; 3,40; 3,33; 3,30; 3,14; 3,10 (Е).
67. Полиморфная форма энантиомера (-)-модафинила или (+)-модафинила, обозначенная как аморфная форма, которая может быть получена способом, включающим нагревание сольвата уксусной кислоты, охарактеризованного в пп.65 и 66, при 120шC в течение 3 ч.
68. Аморфная полиморфная форма левовращающего или правовращающего энантиомера модафинила.
69. Фармацевтическая композиция, включающая левовращающий или правовращающий энантиомер модафинила, охарактеризованный в п.67 или 68, вместе с фармацевтически приемлемыми эксципиентами.
70. Левовращающий или правовращающий энантиомер модафинила в полиморфной форме, обозначенной как форма I, который образует спектр рентгеновской дифракции на порошке, содержащий линии интенсивности при межплоскостных расстояниях: 8,54; 4,27; 4,02; 3,98 (Е).
71. Левовращающий или правовращающий энантиомер модафинила по п.70, где полиморфная форма образует спектр рентгеновской дифракции на порошке, дополнительно содержащий линии интенсивности при межплоскостных расстояниях: 13,40; 6,34; 5,01; 4,68; 4,62; 4,44; 4,20; 4,15; 3,90; 3,80; 3,43 (Е).
72. Левовращающий или правовращающий энантиомер модафинила в полиморфной форме, обозначенной как форма I, который образует спектр рентгеновской дифракции на порошке, содержащий рефлексы при углах 2q 15,4; 31,1; 33,1 и 33,4ш.
73. Левовращающий или правовращающий энантиомер модафинила по п.72, где полиморфная форма образует спектр рентгеновской дифракции на порошке, дополнительно содержащий рефлексы при углах 2q 9,8; 20,8; 26,4; 28,3; 28,7; 29,9; 31,6; 32, 34,1; 35,1 и 39ш.
74. Фармацевтическая композиция, содержащая левовращающий или правовращающий энантиомер модафинила по пп.70-73 вместе с фармацевтически приемлемыми эксципиентами.
75. Фармацевтическая композиция, по существу, состоящая из левовращающего или из правовращающего энантиомера модафинила по любому из пп.70-73 вместе с фармацевтически приемлемыми эксципиентами.
76. Полиморфная форма I (-)-модафинила.
77. Полиморфная форма I (+)-модафинила.
78. Фармацевтическая композиция, содержащая полиморфную форму I (-)-модафинила или полиморфную форму I (+)-модафинила по пп.76 и 77 вместе с фармацевтически приемлемыми эксципиентами.
79. Фармацевтическая композиция, по существу, состоящая из полиморфной формы I (-)-модафинила или полиморфной формы I (+)-модафинила по любому из пп.76 и 77 вместе с фармацевтически приемлемыми эксципиентами.
80. Способ получения полиморфной формы I (-)-модафинила или полиморфной формы I (+)-модафинила, включающий стадии:
a) обеспечения раствора (-)-модафинила или (+)-модафинила, растворенного в горячем растворителе;
b) быстрого охлаждения раствора со стадии а) для образования кристаллов;
c) отфильтровывания кристаллов;
d) высушивания кристаллов и
e) получения кристаллов указанной полиморфной формы I (-)-модафинила или указанной полиморфной формы I (+)-модафинила,
где растворитель на стадии а) выбирают из воды, абсолютного этанола, абсолютного этанола плюс 3% (об./об.) воды и денатурированного этанола плюс 3% (об./об. в расчете на общий объем этанола и толуола) воды.
81. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначенной как аморфная форма, по любому из пп.67 или 68 для изготовления лекарственного средства, предназначенного для профилактикиили лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона, защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательных функций малыми дозами.
82. Применение полиморфной формы (-)-модафинила или (+)-модафинила, обозначенной как форма I, по любому из пп.70-73 для изготовления лекарственного средства, предназначенного для профилактики или лечения заболевания, выбираемого из гиперсомнии, в том числе, в частности, идиопатической гиперсомнии и гиперсомнии пациентов, страдающих раком и принимающих анальгетики на основе морфина для облегчения болей; приступов апноэ во сне, чрезмерной сонливости, вызванной болезнью, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; расстройств центральной нервной системы, таких как болезнь Паркинсона, защиты ткани мозга при ишемии, нарушений сознания, в особенности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественными склерозами и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостатком солнечного облучения, шизофрении, сменного режима работы, смены часового пояса; расстройств пищевого поведения, при котором модафинил выступает стимулятором аппетита, стимуляции познавательных функций малыми дозами.
Текст
009592 Область техники, к которой относится изобретение Изобретение относится к способу получения кристаллических форм энантиомеров модафинила, а также к кристаллическим формам, получаемым этим способом. Целью изобретения является также новый способ получения оптических энантиомеров модафинила на основе -модафиновой кислоты. Уровень техники В патенте США 4177290 описан модафинил в рацемической форме, называемый также -2(бензогадрилсульфинил)ацетамидом или -2-[(ди-фенилметил)сульфинил]ацетамидом, в качестве соединения, обладающего свойствами стимулирования центральной нервной системы. В патенте США 4927855 описаны также два оптических энантиомера модафинила. В нм раскрыты, в частности, левовращающий энантиомер и его применение в качестве антидепрессанта или стимулятора при лечении гиперсомнии и нарушений, вызванных болезнью Альцгеймера. Способ получения обоих оптических энантиомеров модафинила на основе бензогидрилсульфинилуксусной кислоты, описанный в данных материалах, может быть представлен в виде следующей схемы синтеза: Данный способ состоит в разделении оптических энантиомеров -модафиновой кислоты на первом этапе посредством образования диастереоизомеров оптически активным агентом метилбензиламином. Затем (-)-бензогидрилсульфинилацетат (-)метилбензиламина превращают путм кислотного гидролиза в (-)-бензогидрилсульфинилуксусную кислоту. Последнюю этерифицируют в присутствии диметилсульфата, затем превращают в присутствии аммиака (газа). Этим способом получают энантиомер (-) или 1 (левовращающий) модафинила при общем выходе 5,7% по отношению к -модафиновой кислоте,рассчитанном на основе выхода каждого этапа. Раскрытие изобретения Термин энантиомер означает стереоизомерные молекулы, являющиеся зеркальными изображениями, не совмещаемыми друг с другом. Энантиомеры обычно обозначаются либо знаком (+) и (-), либо буквами (d) и (1), что указывает на оптическую вращательную способность хирального центра. Стереоизомерия может также обозначаться либо буквой (D) или (L), либо (R) и (S), которые являются дескрипторами абсолютной конфигурации. Ниже левовращающий энантиомер модафинила обозначается равнозначно либо как энантиомер 1,либо как энантиомер (-), при этом правовращающий энантиомер обозначается в свою очередь либо как энантиомер d, либо как энантиомер (+). В настоящее время создан способ получения различных кристаллических форм оптических энантиомеров модафинила. Особо авторы изобретения показали, что получаемая кристаллическая форма в основном зависит от типа растворителя, применяемого при перекристаллизации. Выражение кристаллическая форма означает в смысле настоящего изобретения равнозначно полиморфную форму или сольват. Под термином полиморфная форма понимается упорядоченная структура, содержащая только молекулы растворнного вещества и обладающая характеристическим кристаллическим отпечатком. Термин сольват означает упорядоченную структуру с характеристическим кристаллическим отпечатком, содержащим одновременно молекулы растворнного вещества и растворителя. Сольваты, содержащие молекулу растворнного вещества, приходящуюся на молекулу растворителя, называются истинными. Однако авторы изобретения показали, что модафинил l и модафинил d, получаемые в описанных в-1 009592 патенте США 4177290 условиях, получают в виде одной и той же полиморфной формы, обозначаемой как форма I, которая соответствует термодинамически наиболее устойчивой полиморфной форме при нормальной температуре и давлении. Форма I характеризуется приводимым ниже спектром рентгеновской дифракции, в котором d означает межплоскостное расстояние, а соотношение (l/lo) - относительную интенсивность. Дифрактометр: Miniflex Rigaku (Elexience). Кристаллические формы данного соединения обладают, как правило, физическими, фармацевтическими, физиологическими и биологическими свойствами, резко различающимися между собой. В этом смысле кристаллические формы оптически активного модафинила, в частности полиморфные формы, привлекают к себе интерес, так как они обладают выгодными свойствами, отличающимися от формы I. Согласно другому аспекту в настоящее время создан новый способ получения оптических энантиомеров модафинила на основе -модафиновой кислоты, при этом данный способ позволяет выделять каждый энантиомер с достижением выхода и оптической чистоты, существенно превышающих эти же показатели, приводимые в патенте США 4927855. В настоящее время создан особо выгодный способ разделения двух оптических энантиомеров модафиновой кислоты посредством избирательной кристаллизации, который с выгодой применяется в препаративном масштабе. Данный способ разделения -модафиновой кислоты характеризуется многими преимуществами, в частности он не требует применения дорогостоящего промежуточного хирального агента, последующее приготовление которого сопряжено с потерями, составляющими, как правило, не менее 10% (De Min., M.,Levy G. и Micheau J.-C., 1988 г.; J. Chem. Phys.85, стр. 603-619); оба энантиомера получают непосредственно в противоположность методу, при котором применяется традиционное разделение путм образования диастереоизомерных солей; выход теоретически является количественным благодаря последовательным этапам рециклирования маточных растворов; упрощается очистка необработанных кристаллов энантиомеров. Следовательно, целью изобретения является создание способа получения кристаллических форм энантиомеров модафинила. Также целью изобретения является создание нового способа получения оптических энантиомеров модафинила, в частности левовращающего энантиомера. Способ получения полиморфных модификаций l-модафинила Указанные и другие цели достигаются с помощью настоящего изобретения, предназначенного, в частности, согласно первому аспекту для создания способа получения кристаллических форм оптических энантиомеров модафинила, включающего в себя следующие этапы:i) растворение одного из оптических энантиомеров модафинила в растворителе, ином, чем этанол;ii) кристаллизация этого энантиомера модафинила иiii) выделение кристаллической формы полученного энантиомера модафинила. В смысле настоящего изобретения растворитель, применяемый на этапе i) способа и называемый также растворителем для перекристаллизации, представляет собой растворитель, обеспечивающий кристаллизацию указанного оптического энантиомера модафинила преимущественно при атмосферном давлении. Другими словами, речь идт о любом растворителе А, способном образовывать при данном давлении вместе по меньшей мере с одним из энантиомеров: в первом диапазоне температуры и концентрации монофазную систему, содержащую по меньшей мере один из энантиомеров в растворе, разбавленном растворителем А;-2 009592 во втором диапазоне температуры и концентрации, отличающемся от первого, вторую двухфазную систему, содержащую кристаллы упомянутого энантиомера в присутствии насыщенного раствора,при этом оба диапазона отделены друг от друга кривой растворимости указанного энантиомера T(С) = f (концентрация энантиомера) при данном давлении. Как правило, кристаллизация на этапе ii) заключается в переходе от монофазной системы к двухфазной при изменении температуры и концентрации. В качестве неограничивающего примера, поясняющего растворители, предназначенные для способа перекристаллизации согласно изобретению, можно, в частности, указать на спиртовые растворители,растворители на основе сложных эфиров карбоновой кислоты, эфирные растворители, хлорированные растворители, ароматические растворители и низшие алифатические кетоновые растворители. Другими растворителями служат, например, растворители на основе карбоновой кислоты, апротонные полярные растворители, алициклические углеводороды, алифатические углеводороды, карбонаты, гетероароматические вещества, вода. Из спиртовых растворителей следует указать, в частности, низшие алкильные спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, 2-метил-2-пентанол, 1,2-пропандиол, третамиловый спирт, при этом метанол, пропанол и изопропанол являются особо предпочтительными. Из растворителей типа сложных эфиров карбоновой кислоты можно назвать, в частности, алкилацетаты, такие как метилацетат, этилацетат, н-пропилацетат, изопропилацетат, н-бутилацетат, алкилформиаты, такие как этилформиат, причм этилацетат является особо предпочтительным. Пригодными в качестве эфирных растворов для перекристаллизации являются диэтиловый эфир,тетрагидрофуран, (THF) диоксан, дибутиловый эфир, изопропиловый эфир, трет-бутилметиловый эфир,тетрагидропиран, причм тетрагидрофуран является особо предпочтительным. Из хлорированных растворителей можно указать на хлорированные углеводороды, в частности, на хлороформ, 1,2-дихлорэтан, дихлорметан и хлорированные ароматические вещества, такие как хлорбензол. В качестве примеров ароматических растворителей, можно указать на орто-, мета-, пара-ксилол,или на смесь из орто-, мета- и пара-ксилола, метоксибензол, нитробензол, трифтортолуол, толуол, при этом орто-, мета- и пара-ксилол являются особо предпочтительными. Пригодными в качестве кетоновых растворителей являются растворители, такие, как ацетон, метилэтилкетон, метилизобутилкетон, бутан-2-он, циклопентанон, изобутилметилкетон, 2-пентанон, 3 пентанон. Примером растворителя на основе карбоновой кислоты может служить, в частности, уксусная кислота. В качестве примера гетероароматического растворителя можно привести, в частности, пиридин. Примерами апротонных полярных растворителей служат, в частности, ацетонитрил, пропионитрил,4-метилморфолин, N,N-диметилацетамид, нитрометан, триэтиламин, N-метил-пирролидон. Примерами алифатических углеводородов служат, в частности, гептан, 2,2-4-триметилпентан. Примерами алициклических углеводородов являются, в частности, циклопентан, циклогексан. Примерами карбонатов служат, в частности, алкилкарбонаты, такие как диметилкарбонат. В предпочтительном варианте осуществления способа согласно изобретению растворы для кристаллизации выбираются из ацетона, метанола, диоксана 1-4, этилацетата, смесей из орто-, мета-, параксилола, а также из изопропанола, н-пропанола, диметилкарбоната, тетрагидрофурана, хлороформа, метилэтилкетона, воды и водно-спиртовых смесей. Следовательно, кристаллические формы оптических энантиомеров модафинила могут быть получены перекристаллизацией энантиомеров в среде некоторых растворителей, природу которых и, при необходимости, условия кристаллизации определяет главным образом тип получаемой кристаллической формы. Благодаря своему взаимодействию с функциональными группами и составляющими в виде акцепторов электронов и доноров электронов можно в действительности содействовать некоторым порядкам расположения молекул, при которых затем возникает определнная кристаллическая форма в данных условиях кристаллизации. Как правило, раствор для перекристаллизации, применяемый на этапе i) нагревают, в частности с обратным холодильником, до полного растворения оптического энантиомера модафинила в растворителе. Если концентрация оптического энантиомера модафинила на этапе i) не является критическим фактором кристаллизации, то предпочтительно действовать при концентрации оптического энантиомера модафинила, близкой к концентрации насыщения в данном растворителе для перекристаллизации. Согласно варианту осуществления оптический энантиомер модафинила растворяют путм нагрева растворителя с обратным холодильником и затем вводят отдельньми порциями дополнительное количество упомянутого оптического энантиомера до достижения насыщения. Для достижения полного растворения может добавляться дополнительный растворитель. Согласно другому варианту осуществления оптический энантиомер модафинила переводят в суспензию в нагреваемом с обратным холодильником растворителе, затем отдельными порциями вводят-3 009592 дополнительное количество растворителя для получения гомогенного раствора и, следовательно, достижения насыщения. Процесс кристаллизации оптического энантиомера модафинила на этапе ii) может быть ускорен известными специалисту примами, в частности охлаждением раствора, частичным выпариванием растворителя, добавкой антирастворителя или введением в раствор затравки в виде кристаллов оптически активного модафинила той же кристаллической формы, что и получаемая. Наиболее часто смесь перемешивают в течение всего процесса кристаллизации с таким расчтом, чтобы получить гомогенную суспензию и быстро обновить маточный раствор вокруг каждого кристаллита. Процесс кристаллизации способом согласно изобретению может проводиться в термодинамических или кинетических условиях. В смысле настоящего описания под выражением кристаллизация в термодинамических условиях понимается кристаллизация, проводимая в условиях, в которых поддерживается равновесие между однородным раствором, с одной стороны, и насыщенным раствором в присутствии кристаллов l- или dмодафинила, с другой стороны. В качестве примера следует отметить, что термодинамическая кристаллизация может проводиться путм медленного охлаждения полученного на этапе i) раствора, как правило, до температуры окружающей среды или при применении скорости или линейной функции охлаждения меньшей или равной 0,75 С/мин, предпочтительно 0,6 С/мин и особо предпочтительно 0,5 С/мин. В смысле настоящего описания под выражением кристаллизация в кинетических условиях понимается кристаллизация, при которой равновесие между однородным раствором, с одной стороны, и насыщенным раствором в присутствии кристаллов d- или 1-модафинила, с другой стороны, резко смещается в сторону двухфазной области, т.е. в сторону образования кристаллов. Для пояснения можно отметить, что так называемая кинетическая кристаллизация может осуществляться, в частности, быстрым охлаждением, например, при применении линейной скорости охлаждения 300 С/мин, или же осаждением добавкой антирастворителя в полученный на этапе i) раствор. В качестве поясняющего и не ограничивающего примера следует отметить, что эти оба типа кристаллизации, термодинамическая и кинетическая, проводятся согласно настоящему описанию при медленном или быстром охлаждении. Само собой разумеется, что способ согласно изобретению включает в себя также любой другой прим кристаллизации, такой как выпаривание растворителя или осаждение, позволяющий перейти на кинетические и/или термодинамические условия. Таким образом, согласно отдельному варианту осуществления, кристаллизация на этапе и) может проводиться осаждением, при необходимости в присутствии зародышей кристаллов требуемой кристаллической формы. Дополнительно авторы изобретения показали, что некоторые растворители могут образовывать кристаллические формы, в частности полиморфные формы, отличающиеся между собой, в зависимости от проведения кристаллизации в кинетических или термодинамических условиях. Согласно предпочтительному варианту осуществления кристаллизация проводится охлаждением полученного на этапе i) раствора. Согласно первому варианту осуществления, в случае необходимости, охлаждение проводится быстро и состоит, как правило, в помещении полученного на этапе i) раствора в баню с температурой ниже или равной 0C, например, в баню с ледяной водой, в течение времени, достаточного для полной кристаллизации раствора, или же охлаждение проводится с линейной скоростью охлаждения, составляющей, например, от -1 до -5 С/мин. Согласно другому варианту осуществления охлаждение проводится медленно. В этом случае раствор охлаждают, как правило, от температуры флегмы растворителя до температуры окружающей среды или же раствор охлаждают с линейной скоростью охлаждения, составляющей предпочтительно от -0,1 до-0,8 С/мин, более предпочтительно около -0,5 С/мин, до температуры 15-20C. Из предпочтительных комбинаций растворители/антирастворители согласно изобретению можно указать, в частности, на комбинации вода/ацетон, ацетонитрил/вода, этанол/вода, метанол/вода,уксусная кислота/вода. Наконец, кристаллические формы оптических энантиомеров модафинила могут быть выделены традиционными способами, такими как фильтрация и центрифугирование. В качестве поясняющего и неограничивающего примера следует отметить, что способ получения согласно изобретению осуществляется, в частности, с применением левовращающего энантиомера модафинила. Согласно особому варианту осуществления кристаллическая форма, полученная указанным способом, представляет собой полиморфную форму. В этом отношении необходимо отметить, что, как правило, энантиомеры (l) и (d) данного химического соединения образуют при условии их кристаллизации в аналогичных экспериментальных условиях кристаллические формы, в частности, полиморфные, обладающие спектрами рентгеновской дифракции,идентичными полученным на порошке.-4 009592 В этом отношении следует отослать, в частности, к работе J. Bernstein, "Polymorphism in molecularcrystals", 2002, University Press, Oxford, Англия, и к публикации G. Coquerel, Enantiomer, 2000; 5(5), стр. 481-498; Gordon and Breach Science Publishers. По этой причине правовращающая форма, спектры рентгеновской дифракции кристаллических форм которой идентичны тем же спектрам левовращающей формы, о которых речь пойдт ниже, входит в состав изобретения. Ниже будет показано, что полиморфные формы, обозначаемые как формы I, II, III, IV и V, совпадают с формами CRL 40982, формы I, II, III, IV, V, полученными на основе левовращающего энантиомера,и с формами CRL 40983, формы I, II, III, IV, V, полученными на основе правовращающего энантиомера. Форма I В данном случае способ, в котором используется растворитель, выбранный из ацетона, этанола, диоксана 1-4, этилацетата и смесей из орто-, мета- и пара-ксилола, а также этап кристаллизации медленным охлаждением позволяют получить форму 1 или CRL40982, форма 1. Способ, в котором применяется растворитель, выбранный из метанола, воды или спиртоводных смесей, в частности, смесей метанол/вода и этанол/вода, а также этап кристаллизации быстрым охлаждением позволяют получить форму I или CRL 40982, форма I. Согласно другому, также предпочтительному варианту осуществления изобретения способ, использующий метанол, и этап кристаллизации осаждением путм добавки холодной воды в качестве антирастворителя метанола приводят к образованию формы I. Форма II Согласно другому варианту осуществления изобретения способ, использующий на этапе i) растворитель, выбранный из изопропанола, этилацетата, н-пропанола или этанола, денатурированного толуолом, а также этап кристаллизации быстрым охлаждением приводят к образованию полиморфной формы,обозначаемой как форма II или CRL 40982, форма II. Согласно варианту осуществления способа форма II может быть также получена медленным охлаждением в среде изопропанола. Таким образом, можно отметить, что получение формы II в среде изопропанола не зависит от условий кристаллизации (термодинамических или кинетических). Форма III В другом варианте осуществления способа согласно изобретению применяемым на этапе i) растворителем является ацетон, а этап кристаллизации H) проводится при быстром охлаждении, что очевидно приводит к получению полиморфной формы, обозначаемой как форма III или CRL 40982, форма III. Форма IV В варианте осуществления способа согласно изобретению применяемый на этапе i) растворитель выбирается из тетрагидрофурана, хлороформа и метилэтилкетона, а этап кристаллизации ii) проводится при медленном охлаждении раствора, в результате чего получают полиморфную форму, обозначаемую как форма IV или CRL 40982, форма IV. Способ кристаллизации оптических энантиомеров модафинила может привести, в зависимости от типа применяемого растворителя, к получению сольватов. Форма V В варианте осуществления способа согласно изобретению используемый на этапе i) растворитель выбирается из 2-пентанона и тетрагидрофурана, а этап кристаллизации ii) проводится при медленном охлаждении раствора в среде 2-пентанона и при быстром охлаждении в среде тетрагидрофурана, в результате чего получают полиморфную форму, обозначаемую как форма V. Сольват диметилкарбоната Таким образом, согласно особому варианту осуществления изобретения в том случае, когда применяемым на этапе i) растворителем является диметилкарбонат, а кристаллизация производится медленным охлаждением, получают сольват (-)-модафинила диметилкарбоната. Сольват уксусной кислоты Согласно другому отдельному варианту осуществления изобретения в случае, когда применяемым на этапе i) растворителей является уксусная кислота и когда кристаллизация проводится медленным или быстрым охлаждением, получают сольват уксусной кислоты. Полиморфные формы (-)-модафинила Предметом изобретения является также полиморфная форма левовращающего энантиомера модафинила, обозначаемая CRL 40982, форма II, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности с межплоскостными расстояниями: 11,33; 8,54; 7,57; 7,44; 4,56; 3,78; 3,71 , причм линии интенсивности, соответствующие межплоскостным расстояниям: 8,54; 7,57; 7,44; 4,56; 3,78; 3,71 , являются особо характеристическими. Точнее, спектр рентгеновской дифракции, в котором d означает межплоскостное расстояние, а I/Io относительную интенсивность, является следующим: Дифрактометр : Miniflex Rigaku (Elexience) Также предметом изобретения является полиморфная форма левовращающего энантиомера модафинила, обозначаемая CRL 40982, форма III, характеризующаяся спектром рентгеновской дифракции,содержащим линии интенсивности при следующих межплоскостных расстояниях d: 13,40; 12,28; 8,54; 7,32; 6,17; 5,01; 4,10; 3,97; 3,42; 3,20 , и межплоскостными расстояниями: 12,28; 8,54; 5,01; 4,10; 3,97; 3,42; 3,20 , соответствующими наиболее характерным линиям интенсивности. В этом случае предметом изобретения является, в частности, форма III (-)-модафинила, образующая спектр рентгеновской дифракции, в котором d означает межплоскостное расстояние, a I/Io - относительную интенсивность: Дифрактометр : Miniflex Rigaku (Elexience) Предметом изобретения является также полиморфная форма левовращающего энантиомера модафинила, обозначаемая CRL 40982, форма IV, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 12,38; 8,58; 7,34; 6,16; 5,00; 4,48; 4,09; 3,66, при этом наиболее характерные линии интенсивности соответствуют межплоскостным расстояниям: 12,38; 8,58; 7,34; 5,00; 4,09 . Точнее, форма IV (-)-модафинила характеризуется тем, что она образует спектр рентгеновской дифракции, в котором d означает межплоскостное расстояние, a I/Io - относительную интенсивность, содержащий линии интенсивности при межплоскостных расстояниях: Дифрактометр : Siemens AG Предметом изобретения является также полиморфная форма правовращающего энантиомера модафинила, обозначаемая CRL 40982, форма V, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 9,63; 5,23; 5,03; 4,74; 4,66; 4,22; 4,10; 3,77 . Дифрактометр : Bruker GADDS Предметом изобретения является также сольват диметилкарбоната (-)-модафинила, отличающийся тем, что он содержит дифракционный спектр, в котором d означает межплоскостное расстояние, а I/Io относительную интенсивность: Дифрактометр: Siemens AG Предметом изобретения является также сольват уксусной кислоты лево- и правовращающих энантиомеров модафинила, который может быть получен способом перекристаллизации согласно изобретению, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 9,45; 7,15; 5,13; 4,15; 3,67 . Дифрактометр: Bruker GADDS Согласно другому аспекту предметом изобретения является также способ превращения первой кристаллической формы одного из энантиомеров модафинила во вторую кристаллическую форму, отличающуюся от первой, причм способ содержит следующие этапы:i) суспендирование кристаллической формы указанного энантиомера модафинила в растворителе;ii) выделение полученной кристаллической формы. В качестве растворителей, способных применяться в данном способе, можно указать, в частности,ацетонитрил. Как правило, исходная кристаллическая форма выдерживается в суспензии при температуре ниже температуры гомогенизации в течение времени, достаточного для полного превращения исходной формы. Это время может варьировать, в частности, в зависимости от типа растворителя, исходной кристаллической формы и температуры среды. Традиционно кристаллическая форма выдерживается в суспензии в течение по меньшей мере 24 ч при комнатной температуре и атмосферном давлении, чаще всего - в течение около 72 ч. В порядке пояснения следует отметить, что данный способ применяется вместе с (-)-модафинилом. В этом случае согласно отдельному варианту осуществления изобретения в способе используется форма I в среде ацетонитрила на этапе i), в результате чего получают сольват ацетонитрила (-)модафинила. Для пояснения следует отметить, что форма I выдерживается в суспензии в течение нескольких суток, предпочтительно 3 суток, при комнатной температуре и атмосферном давлении. Предметом изобретения является также сольват ацетонитрила (-)-модафинила, который может быть получен способом перекристаллизации согласно изобретению. Он характеризуется дифракционным спектром, в котором d означает период кристаллической решетки, a I/Io - относительную интенсивность: Дифрактометр : Siemens AG Фармацевтические композиции, содержащие полиморфные формы II, III, IV и V соответственно(-)-модафинила и (+)-модафинила Предметом изобретения являются также фармацевтические композиции, содержащие, соответственно, полиморфные формы (-)-модафинила CRL 40982, форма II, CRL 40982, форма III, CRL 40982,форма IV, и CRL 40982, форма V, CRL 40983, форма II, CRL 40983, форма III, CRL 40983, форма IV, иCRL 40983, форма V, при необходимости в сочетании с фармацевтически приемлемым носителем. Эти композиции могут вводиться в организм орально, через слизистую (например, слизистую глаза,носа, лгких, желудка, кишечника, прямой кишки, влагалища или же через мочевую систему) или же парентерально (например, подкожно, внутрикожно, внутримышечно, внутривенно или внутрибрюшно). Согласно предпочтительному варианту фармацевтические композиции согласно изобретению вводятся орально в виде таблеток, пилюль, желатиновых капсул и гранул с немедленным или контролируе-9 009592 мым высвобождением, в виде порошка, капсул, суспензии в жидкости или геле, эмульсии или лиофилизированного продукта, более предпочтительно в виде таблеток, капсул, суспензии в жидкости или геле. Наполнитель может содержать в себе одно или несколько фармацевтически приемлемых эксципиентов,способных обеспечивать стабильность полиморфных форм (например, суспензия полиморфной модификации в масле). Фармацевтические композиции согласно изобретению содержат в себе полиморфные формы (-)модафинила и (+)-модафинила, соответственно II, III, IV или V, при необходимости в виде смеси одних с другими и/или вместе с одним или несколькими фармацевтически приемлемыми эксципиентами. Тврдую композицию для орального прима готовят добавкой к активному началу одного или нескольких эксципиентов, в частности, наполнителя, и при необходимости связующего, дезинтегрирующего агента, смазочного вещества, поверхностно-активного вещества, эмульгатора, солюбилизатора, красителя, заменителя сахара или вкусового корригента, и формованием смеси, например, в виде таблеток или капсул. Примерами наполнителей служат лактоза, сахароза, манит или сорбит, препараты на основе целлюлозы, такие, как, например, кукурузный, рисовый и картофельный крахмал. Примеры связующих включают в себя желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилцеллюлозу, карбоксиметилцеллюлозу натрия и/или поливинилпирролидон, повидон, коповидон,декстран, декстрин, циклодекстрин и его производные, такие как гидроксипропилциклодекстрин. Примеры заменителей сахара включают в себя аспартам, сахарин, цикламат натрия. Примеры вкусовых корригентов включают в себя порошок какао, мяту в виде травы, порошковый ароматизатор, мяту в виде масла, борнеол и порошок корицы. Примеры поверхностно-активных веществ и эмульгаторов включают в себя, в частности, полисорбат 20, 60, 80, сахарный эфир (7-11-15), полоксамер 188, 407, PEF 300, 400 и стеарат сорбитана. Примеры солюбилизирующих веществ включают в себя миглиол 810, 812, глицериды и их производные, пропиленгликоль. Примеры дезинтегрирующих веществ включают в себя, например, поливинилпирролидон, кармелозу натрия или альгиновую кислоту или е соль, такую как альгинат натрия. Примеры смазывающих веществ включают в себя стеарат магния, стеариловый фумарат магния,бегеновую кислоту и е производные. Фармацевтические композиции согласно настоящему изобретению могут также содержать другую кристаллическую форму соответственно (-)-модафинила или (+)-модафинила, форма I и/или другое активное или неактивное начало которого находится в смеси с одной или несколькими другими полиморфными формами модафинила, такими, как форма III, форма II, форма IV и форма V. В смысле настоящего изобретения выражение фармацевтически приемлемый наполнитель включает в себя понятия, такие как растворители, дисперсионные среды, противогрибковые и антибактериальные средства, изотонические средства и замедляющие абсорбцию средства. Применение таких сред и веществ для фармацевтически активных веществ специалисту хорошо известно. Предметом изобретения является, кроме того, применение форм (-)- модафинила, CRL 40982, форма II, CRL 40982, форма III, CRL 40982, форма IV, CRL 40982, форма V и форм (+)-модафинила CRL 40983, форма II, CRL 40983, форма III, CRL 40983, форма IV, CRL 40983, форма V, соответственно, для приготовления медикамента, предназначенного для профилактики и/или лечения заболевания, выбранного из гиперсомнии, в частности, идиопатической гиперсомнии и гиперсомнии раковых больных, принимающих анальгетики на основе морфина для уменьшения болей; апноэ во сне, чрезмерной сонливости, связанной с заболеванием, обструктивных приступов апноэ во сне, нарколепсии; приступов сонливости, приступов чрезмерной сонливости, приступов чрезмерной сонливости, вызванных нарколепсией; нарушений центральной нервной системы, таких как болезнь Паркинсона; защиты тканей мозга от ишемии, нарушений сознания, в частности нарушений сознания, вызванных болезнью Стейнерта, нарушений внимания, вызванных, например, гиперактивностью (ADHD); состояния усталости, в частности, вызванного множественным склерозом и другими дегенеративными заболеваниями; депрессии, депрессивного состояния, вызванного недостаточным солнечным облучением, шизофрении, сменного режима работы,смены часового пояса; расстройств пищевого поведения, при котором модафинил действует в качестве стимулятора аппетита, стимулирования познавательных функций посредством слабых доз. Способ получения оптически активного модафинила Согласно другому аспекту предметом изобретения является способ получения оптических энантиомеров модафинила на основе -модафиновой кислоты, при этом данный способ включает в себя следующие этапы:i) разделение двух оптических энантиомеров -модафиновой кислоты и выделение по меньшей мере одного энантиомера;ii) приведение в контакт одного из обоих полученных энантиомеров с низшим алкилгалоформиатом и спиртом в присутствии основания;iv) превращение полученного на этапе iii) сложного эфира в амид;v) выделение полученного на этапе iv) продукта. Предпочтительно, чтобы низший алкилгалоформиат представлял собой низший алкилхлорформиат,более предпочтительно, чтобы им был метилхлорформиат. Предпочтительно, чтобы низшие алкилгалоформиаты, в том числе, в частности, метилхлорформиат,применяемые в данном способе для этерификации модафиновой кислоты, были бы менее токсичными,чем диметилсульфат, применяемый согласно способу из уровня техники согласно патенту США 4927855, при одинаковых, даже более высоких выходах. Таким образом, способ проще в применении и он более приспособлен для промышленного использования. Предпочтительно, чтобы на этапе ii) применялось эквимолекулярное количество низшего алкилгалоформиата и основания по отношению к оптически активной модафиновой кислоте. В частности, предпочтительно применять органические основания, более предпочтительно - азотные основания. В качестве особо предпочтительного основания можно указать, в частности, триэтиламин, диизопропиламин, диэтилметиламин, диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Предпочтительно также, чтобы применяемый на этапе ii) растворитель представлял собой низший алифатический спирт, такой как метанол, этанол, пропанол, причм метанол является особо предпочтительным. Согласно особому варианту осуществления получаемый на этапе ii) сложный эфир кристаллизуется после добавки ледяной воды. Превращение сложного эфира в амид на этапе iv) проводится преимущественно посредством аммонолиза, т.е. путм обработки аммиаком. В этом случае, как правило, предпочтительно применять избыточное количество аммиака. Согласно предпочтительному варианту осуществления изобретения аммиак применяется в газообразной форме. Согласно предпочтительному варианту осуществления реакция аммонолиза проводится в полярном растворителе, преимущественно протонном, таком как низшие алифатические спирты, например, в метаноле или этаноле, причм метанол является особо предпочтительным. Выделение сложного эфира из (+) или (-) модафиновой кислоты на этапе iii) и соответственно (+)или (-)-модафинила на этапе iv) проводится традиционными, известными специалисту методами. Согласно другому аспекту предметом изобретения является способ получения оптических энантиомеров модафинила, включающий в себя следующие этапы:a. разделение двух оптических энантиомеров -модафиновой кислоты или е солей способом избирательной кристаллизации;b. превращение выделенного энантиомера в амид;c. выделение полученного энантиомера модафинила. Согласно предпочтительному варианту осуществления этап b) проводится в два прима:b1) превращение указанного энантиомера в низший алкиловый сложный эфир;b2) превращение полученного на этапе b1) продукта в амид. Согласно особо предпочтительному варианту осуществления на этапе b1) применяются в соответствии с описанными выше условиями низший алкилгалоформиат, спирт и основание. Согласно особо предпочтительному варианту в том случае, когда этап b1) проводится в присутствии метилхлорформиата, основания и спирта, а на этапе b1) проводится аммонолиз, как описано выше,то данный способ, в котором -модафиновая кислота разделяется в результате избирательной кристаллизации, характеризуется общим выходом, составляющим, как правило, порядка 25%. Следовательно,выход данного способа при получении энантиомера (-)-модафиновой кислоты значительно превышает выход способа согласно патенту США 4927855. Прим избирательной кристаллизации широко применяется в лабораториях и в промышленности. Этот метод основан на чередующейся кристаллизации двух хиральных соединений, обозначаемыхR и S, при которой образуется конгломерат в растворителе А в диапазоне температуры DT. Это означает,что в данном температурном диапазоне любая смесь - при наличии термодинамического равновесия между двумя антиподами и раствором - состоит из двух типов кристаллов, каждый из которых содержит только молекулы одной и той же конфигурации, включая или не включая в себя молекулы растворителя(сольваты). Наличие такого конгломерата при отсутствии смешиваемости в тврдом состоянии имплицитно допускается далее в описании, по меньшей мере, в интервале температуры DT и для растворителя А. Две группы факторов влияют на кристаллизацию оптических антиподов, с одной стороны, параметры, обусловленные трхфазным гетерогенным равновесием, и, с другой стороны, факторы, воздействующие на кинетику кристаллизации. Параметры, обусловленные трхфазным гетерогенным равновесием, включают в себя расположение слоев кристаллизации тврдых частиц, осаждающихся при любой температуре, и,- 11009592 более важно, степень растворимости стабильных и метастабильных фаз, рацемической смеси s и антиподов s(+) = s(-) в зависимости от температуры, а также соотношение показателей растворимости= s/s(+); размер стабильных и метастабильных областей тврдых растворов, рацемата, рацемического сольвата, активных сольватов и полиморфных модификаций кристаллических тврдых веществ. Факторы, воздействующие на кинетику кристаллизации, включают в себя внутренние факторы кристаллов с учтом связей между молекулами, которые не могут модифицироваться экспериментатором; внешние факторы, которые могут модифицироваться экспериментатором; имеется в виду природа растворителя, тип и концентрация примесей, достигнутое пересыщение в зависимости от времени, диапазона температуры DT, скорости и способа перемешивания, массы, гранулометрического состава зародышей, пристеночного эффекта и пр. Эти обе группы факторов оказывают непосредственное влияние на выход, степень чистоты получаемых фаз и протекание операций по разделению. Таким образом, осуществимость фильтрации зависит от гранулометрического спектра и габитуса кристаллов, вязкости суспензии, упругости пара растворителя, пересыщения каждого из антиподов и возможного присутствия истинного рацемата метастабильного характера. От такого выбора может также зависеть кинетика рацемизации антиподов или распада молекулы. Для каждой системы, образованной двумя антиподами (R и S) и растворителем (А), воздействующие на кинетику факторы представляют собой отдельный случай. Принципиально различают два метода избирательной кристаллизации: традиционные способы, обозначаемые SIPC (Seeded Isothermal Preferential Crystallization - затравочная изотермическая избирательная кристаллизация) и их политермические варианты, с одной стороны; способ, обозначаемый AS3PC (Auto-Seeded Polythermic Programmed Preferntial Crystallization - самозатравочная политермическая программируемая избирательная кристаллизация), с другой стороны. В способе самозатравочной избирательной кристаллизации AS3PC система помещена в условия, в которых она сама образует зародыши для получения требуемого энантиомера, в то время как в способеSIPC эти зародыши вводятся путем затравки. Подробнее оба эти способа будут описаны ниже. Для получения большего объма информации о способах разделения избирательной кристаллизацией посредством AS3PC можно отослать, в частности, к материалам G. Coquerel, M.-N. Petit и R.Hedtmann, U. Sprengard и G. Coquerel, Chemistry Letters, 2001 г.,4, стр. 364 - 365. Согласно особому варианту осуществления способом разделения оптических энантиомеров модафиновой кислоты или е солей является затравочный способ SIPC или AS3PC, причм данный способ включает в себя следующие этапы:a) гомогенизация при температуре TD системы, состоящей из рацемической смеси кристаллов в виде конгломерата, первого энантиомера модафиновой кислоты и растворителя, фигуративная точка E которой, определяемая переменными величинами концентрация и температура TD, располагается в однофазной области разбавленного раствора;b) быстрое охлаждение раствора, приготовленного на этапе а) при начальной температуре TD, до температуры EF;c) введение затравки в полученный на этапе b) раствор во время (т.е. в период между TL и TF) или в конце охлаждения (т.е. при температуре TF) В виде очень чистых зародышей первого энантиомера;d) сбор кристаллов первого энантиомера;e) введение рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов осуществленного на этапе d), и гомогенизация новой системы нагревом до температуры TD таким образом, чтобы фигуративная точка E' располагалась симметрично E по отношению к плоскости рацемической смеси системы растворитель-антипод (-), -антипод (+), причем упомянутая точка E' располагается в однофазной области разбавленного раствора;f) быстрое охлаждение полученного на этапе е) при начальной температуре TD раствора до температуры TF;g) введение затравки в виде очень чистых зародышей второго энантиомера в полученный на этапе f) раствор;h) сбор кристаллов второго энантиомера;i) введение рацемической смеси кристаллов в виде конгломерата кристаллов в маточные растворы,полученные в результате сбора кристаллов осуществляемого на этапе h), и гомогенизация новой системы нагревом до температуры TD для получения состава, аналогичного составу системы начальной фигуративной точки E;j) повторение этапов а), b), с), d), e), f), h), j) для последовательного получения первого и второго из двух энантиомеров.- 12009592 Часто обращаются к этим обоим способам, обозначаемым соответственно SIPC и AS3PC, причм последний является вариантом способа SIPC, как это будет подробно описано ниже. В смысле настоящего изобретения ниже использованы следующие обозначения:TL - температура гомогенизации рацемической смеси;TD - начальная температура, при которой исходная смесь представляет собой гомогенный раствор; антипод означает энантиомер. Предпочтительно, чтобы способом разделения двух оптических энантиомеров -модафиновой кислоты или е солей избирательной кристаллизацией служил способ самозатравки AS3PC, при этом данный способ включает в себя следующие этапы:a) получение системы, состоящей из рацемической смеси кристаллов в виде конгломерата, первого энантиомера модафиновой кислоты и растворителя, фигуративная точка E которой, определяемая переменными величинами концентрация и температура ТВ, располагается в двухфазной области находящегося в избытке энантиомера и находится в равновесии со своим насыщенным раствором;b) применение закона программирования охлаждения температуры, полученной на этапе а) двухфазной смеси, при этом закон программирования составлен так, чтобы маточные растворы сохранялись незначительно пересыщенными, что способствует росту энантиомера в виде кристаллов, при этом предупреждается самопроизвольное зародышеобразование второго энантиомера в растворе;c) в течение всего процесса роста кристаллов на этапе b) регулирование незначительно возрастающей скорости перемешивания в зависимости от времени проводится таким образом, чтобы эта скорость в любой момент была достаточно медленной, чтобы содействовать росту первого энантиомера и избегать возникновения слишком значительных усилий сжатия, вызывающих неконтролируемое зародышеобразование, но достаточно быстрой для образования гомогенной суспензии и быстрого обновления маточного раствора вокруг каждого кристаллита первого энантиомера;d) сбор кристаллов первого энантиомера;e) добавка рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов осуществленного на этапе d) и выдержка новой системы при температуре Тв в течение времени, необходимого для установления термодинамического равновесия, таким образом,чтобы фигуративная точка E' была симметрична E по отношению к плоскости рацемических смесей системы растворитель - антипод(-) - антипод(+), причем указанная точка E' располагается в двухфазной области избыточного второго энантиомера, находящегося в избытке, и находится в равновесии с насыщенным раствором;f) применение закона программирования охлаждения, аналогичного закону на этапе b), к полученной на этапе е) двухфазной смеси, содержащей второй энантиомер, таким образом, чтобы маточные растворы сохранялись слабо пересыщенными во время кристаллизации для содействия росту энантиомера в виде кристаллов, исключая при этом самопроизвольное зародышеобразование первого энантиомера,присутствующего в растворе;g) в течение всего процесса роста кристаллов на этапе f) регулирование скорости перемешивания,незначительно возрастающей с течением времени, таким образом, чтобы эта скорость в любой момент была достаточно медленной для содействия росту второго энантиомера и исключения возникновения слишком значительных усилий сжатия, вызывающих неконтролируемое зародышеобразование, но достаточно быстрой для образования гомогенной суспензии и быстрого обновления маточного раствора вокруг каждого кристаллита второго энантиомера;h) сбор кристаллов второго энантиомера;i) добавка рацемической смеси кристаллов в виде конгломерата в маточные растворы, полученные в результате сбора кристаллов, осуществленного на этапе h), для получения системы, состав которой аналогичен составу исходной системы E;j) повторение этапов а), b), с), d), е), f), g), h), i) для последовательного получения первого и затем второго из двух энантиомеров. В смысле настоящего изобретения Тномо означает температуру гомогенизации системы, образованной рацемической смесью, первым энантиомером и растворителем. Таким образом, на этапе а) способа согласно изобретению выбор растворителя или растворителей и рабочего диапазона температуры производится таким образом, чтобы одновременно можно было обеспечить антиподы, образующие конгломерат, при этом их возможный рацемат является метастабильным в рабочем диапазоне температуры; растворы, являющиеся достаточно концентрированными, но обладающие низкой вязкостью и малой упругостью пара; отсутствие сольволиза и рацемизации; стабильность сольватов, если они находятся в равновесии и если присутствуют разделяемые энантиомеры. На этапах (а) и (е) способа согласно изобретению температура ТВ превышает температуру TL гомо- 13009592 генизации рацемической смеси, содержащейся в исходной суспензии,на основе кривой изменения Тномо в зависимости от избытка энантиомера и при постоянной концентрации рацемической смеси XL указанная температура ТВ задатся таким образом, чтобы масса мелких кристаллов первого энантиомера на этапах (а) и (i) и второго энантиомера на этапе (е), находящихся в равновесии по отношению к их насыщенному раствору, составляла не более 50%, предпочтительно от около 25 до 40% от ожидаемого сбора. На этапах (b) и (f) способа согласно изобретению закон программирования охлаждения от температуры Тв до температуры TF, адаптированный к экспериментальной установке, определяется таким образом, чтобы можно было получить незначительное пересыщение во время всего процесса кристаллизации энантиомера, присутствующего в виде кристаллов в начале каждого цикла, при этом слабое пересыщение вызывает слабые вторичные рост и зародышеобразование; достигнуть при TF максимального пересыщения второго энантиомера без первичного зародышеобразования; обеспечить сбор кристаллов на этапах (d) и (h), что после добавки рацемической смеси и после компенсации на этапах (е) и (i) обеспечивает цикличность операций. Действительно каждая экспериментальная установка влияет на способность к пересыщению применяемых смесей и на эффективность перемешивания и, следовательно, закон программирования охлаждения адаптируется к условиям, в которых применяется способ. Тем не менее, температура ТВ, растворимость рацемической смеси в зависимости от температуры, кривая Тномо в зависимости от избытка энантиомера при постоянной концентрации рацемической смеси XL полностью не зависят от экспериментальной установки. Закон программирования охлаждения, являющийся функцией, связывающей температуру и время,определяется для диапазона TL-TF охлаждением раствора с концентрацией XL ОТ TL + 1C до TF, при этомTF составляет меньше TL - (Тномо - TL), ДЛЯ получения насыщенного стабильного раствора без первичного зародышеобразования, что обеспечивает двойной сбор начального избытка энантиомера, при этом упомянутый закон программирования охлаждения определяется в диапазоне ТВ - TL экстраполяцией закона,выведенного для диапазона от TL + 1 С до TF. Способ избирательной кристаллизации -модафиновой кислоты или е солей обладает и другими положительными свойствами, взятыми вместе или раздельно, а именно: на этапах (а) и (i) масса мелких кристаллов первого энантиомера, находящегося в равновесии со своим насыщенным раствором, составляет от около 25 до 40% от ожидаемого сбора кристаллов, при этом 50% являются максимальным пределом; на этапе (е) масса мелких кристаллов второго энантиомера, находящегося в равновесии со своим насыщенным раствором, составляет от около 25 до 40% от ожидаемого сбора кристаллов, при этом 50% являются максимальным пределом; на этапах (b) и (f) термический эффект, сопровождающий осаждение первого и второго энантиомеров, учитывается в законе программирования температуры; на этапах (е) и (i) проводится компенсация растворителем; на этапах (а), (е) и (i) добавляемые мелкие кристаллы рацемической смеси в виде конгломерата подвергаются перед введением предварительной обработке, ускоряющей этап растворения, такой как дробление и просеивание, ультразвуковая обработка, частичная лиофилизация; целью таких видов обработки является также получение мелких кристаллов, создающих большую поверхность для роста кристаллов; на этапах (а), (е) и (i), на которых проводится растворение, скорость перемешивания возрастает по сравнению с этапами (с) и (g). Кроме данных о гетерогенных равновесиях, необходимых для применения способа AS3PC, на операции распространяются также кинетические ограничения, в частности, закон охлаждения, которые представляют собой для каждой системы растворитель/энантиомеры отдельный случай. Согласно варианту осуществления растворителем, применяемым на этапе а) способов SIPC, S3PC или AS3PC, является абсолютированный этиловый спирт или денатурат, при необходимости в виде смеси с органическим или минеральным основанием, даже с одним или несколькими растворителями, способными повышать растворимость рацемической смеси в этаноле. В качестве варианта применяемым растворителем на этапе а) способов SIPC, S3PC или AS3PC является 2-метоксиэтанол или метанол, при необходимости в смеси с органическим или минеральным основанием, и/или один или несколько растворителей, повышающих растворимость рацемической смеси в этаноле. Согласно предпочтительному варианту осуществления растворителем, применяемым на этапе а) способа SIPC или AS3PC, является этанол, 2-метаксиэтанол или метанол. Температура фильтрации TF для -модафиновой кислоты составляет преимущественно от 0 до 40 С. В случае этанола температура EF составляет предпочтительно от 0 до 25 С, преимущественно около- 14009592 18 или 17 С. В случае 2-метаксиэтанола или метанола температура TF составляет преимущественно от 20 до 35C, в частности, около 35C. Предпочтительно, концентрация рацемической смеси на этапе а) составляет от 2 до 50 мас.%, более предпочтительно от 2 до 30 мас.%, ещ более предпочтительно около 5,96 мас.% в случае этанола,15,99% в случае 2-метоксиэтанола и 25,70% в случае метанола. В этом случае особо предпочтительно, чтобы избыток энантиомера на этапе а) составлял от 1 до 50 мас.%, более предпочтительно от 1 до 20 мас.%, наиболее предпочтительно около 11 мас.% в случае этанола, 8 мас.% в случае 2-метоксиэтанола и 10 мас.% в случае метанола. Температура TD в способах SIPC и S3PC, т.е. температура, при которой исходная смесь представляет собой гомогенный раствор, зависит от концентрации и составляет, следовательно, от 35 до 50C при орошении растворителем. Охлаждение от температуры TD до температуры TF проводится очень быстро,что необходимо для того, чтобы оставаться в монофазной области, и достигается преимущественно в течение менее 20 мин, например резким охлаждением. Согласно предпочтительному варианту способа AS3PC температура ТВ лежит в интервале температур TL и Тномо. Температура Тв может составлять, в частности, 25-50C. В качестве примера в случае этанола, в том случае, когда избыток энантиомера составляет около 11 мас.%, температура ТВ составляет преимущественно от 25 до 40 С, в частности, от 30,1 до 36,2C, предпочтительно около 33,5C или же 31,5C. В случае 2 метоксиэтанола, в том случае, когда избыток энантиомера составляет около 8 мас.%,температура ТВ составляет преимущественно от 35 до 50C, в частности, от 39,1 до 47,9C, предпочтительно около 41C. В случае метанола, в том случае, когда избыток энантиомера составляет около 10 мас.%, температура Тв составляет преимущественно от 40 до 55C, в частности, от 45,1 до 53,9C, предпочтительно около 46,5C. Особо предпочтительно, чтобы охлаждение от температуры ТВ до температуры TF на этапе b) проводилось в течение достаточно длительного времени с тем, чтобы средняя масса кристаллов требуемого энантиомера достигла значительной величины, и вместе с тем в течение достаточно короткого времени,необходимого для предотвращения кристаллизации противоэнантиомера и для получения повышенной оптической чистоты, превышающей, в частности, 85%. Следовательно, охлаждение сопровождается, как правило, поляриметрией, необходимой для определения оптимального момента фильтрации. Предпочтительно, чтобы охлаждение протекало в течение от 50 до 70 мин, преимущественно в течение 60 мин, в случае применения этанола в качестве растворителя. Также продолжительность выдержки при температуре TF в способах SIPC, AS3PC и S3PC является достаточно большой для обеспечения сбора большой массы кристаллов требуемых энантиомеров, но и не слишком большой, чтобы можно было предупредить кристаллизацию противоэнантиомера одновременно с требуемым энантиомером, и таким образом обеспечить высокую оптическую чистоту. Согласно предпочтительному варианту осуществления продолжительность выдержки при температуре TF составляет от 15 до 60 мин, предпочтительно около 60 мин. Специалист может адаптировать скорость перемешивания к типу реактора, применяемого в способах SIPC, AS3PC и S3PC. В качестве примера, для реактора мкостью от 2 до 10 л скорость перемешивания среды может составлять от 150 до 250 об./мин. Особенный интерес представляет то, что эти методы избирательной кристаллизации позволяют выделить оптические энантиомеры модифинила, в том числе, в частности, левовращающий энантиомер с выходом, существенно превосходящим выход, достигаемый при разделении хиральным агентом. Получаемые выходы составляют, как правило, порядка 90% и даже более для (+) или (-)-оптического энантиомера, что составляет порядка 45% и более для рацемической смеси. Способы AS3PC, SIPC и S3PC Ниже приводится описание способов AS3PC и SIPC. Трхфазные гетерогенные равновесия: антиподы R и S И растворитель А Например, в работе J.E. Ricci (Ed. Dover Publication Inc. New York, 1966 г., The Phase rule and Heterogeneous Equilibrium) рассматриваются в общем виде гетерогенные равновесия в тройных системах. Приводимое ниже описание ограничено отдельными аспектами тройной системы: А (ахиральный растворитель), R и S (энантиомеры, не претерпевающие рацемизации в рабочей области температуры), необходимыми для понимания разных способов избирательной кристаллизации. Для выявления особой роли растворителя данная тройная система изображается в виде прямой,прямоугольной равнобедренной призмы треугольного сечения, на которой температура откладывается по оси, проходящей перпендикулярно плоскости концентраций. Идентичность термодинамических переменных двух энантиомеров Tf, Hf, растворимость в среде ахирального растворителя и пр. обеспечивают положение, при котором изображение областей является симметричным по отношению к вертикальной плоскости A-NS-T, объединяющей оптически неактивные- 15009592 смеси, фиг. 1. Для удобства первичного описания этой системы приняты следующие упрощения: единственными кристаллизующимися фазами являются чистые составляющие в данной системе(отсутствие рацемата, сольвата и полиморфизма для антиподов); в тврдом состоянии смешиваемость отдельных составляющих равна нулю; растворитель имеет точку плавления, которая находится существенно ниже точки плавления антиподов; в рабочей области температуры на растворимость антипода не влияет присутствие второго антипода в растворе (соблюдение закона Мейерхоффера), что выражается через величину соотношения:= 2). Представление трхфазных равновесий в зависимости от температуры. На фиг. 1 представлены следующие фазовые области: монофазная область разбавленного раствора (Ф = 1); три поверхности кристаллизации составляющих, ограничивающих двухфазные области (Ф = 2). Поверхность осаждения растворителя примыкает к А, так как точка плавления этой составляющей лежит значительно ниже точки плавления других составляющих, согласно упомянутым выше условиям; три одновариантных кривых (Ф = 3) или эвтектические минимумы, образованные бинарными эвтектическими точками; тройная эвтектическая инвариантная величина при Т (Ф = 4), ниже которой кристаллизуются три составляющих. На фиг. 2 показаны в наложенном друг на друга положении при TD И TF два изотермических профиля тройного равновесия, изображнного на фиг. 1. При каждой температуре профиль содержит четыре области, как это подробно приведено в нижеследующей таблице. Профиль изоплеты RYT На фиг. 3 показан профиль изоплеты R-Y-T, который имеет основополагающее значение для понимания механизма кристаллизации, вызываемой охлаждением тройных растворов при термодинамическом квазиравновесии. Этот профиль необходим также для последующего изложения неравновесных способов, SIPC, вариантов и способа AS3PC. Данная плоскость представляет собой геометрическое место точек, контролирующих соотношение: ХА/XS = (1-Y) / Y = константа,где ХА и XS - массовые фракции растворителя и антиподов S. На основании фиг. 3 можно выделить монофазную область тройного раствора; ликвидус антипода R,при этом данная кривая представляет собой пересечение плоскости R - Y на фиг. 2 с поверхностью кристаллизации данной составляющей. Эта кривая устойчивого равновесия образуется при плавлении антипода R (не показан) и ограничена в направлении низких температур точкой L, относящейся к тройному эвтектическому минимуму рацемических смесей. Данная кривая и след коноида при TL (горизонтальный сегмент при TL) очерчивают двухфазную область: насыщенный раствор + кристаллы R; она продолжена в лежащую ниже двухфазную область с помощью кривой растворимости метастабильного характера того же антипода R (показано штрихлинией); трхфазная область: кристаллы R и S плюс насыщенный раствор. Вверху эта область ограничена горизонтальным следом коноида R, внизу - следом инвариантной плоскости тройной эвтектики, слева следом Lm одного из относящихся к антиподу S коноидов; след KL поверхности кристаллизации антипода S, ограничивающий двухфазную область в верхней- 16009592 части: насыщенный раствор плюс кристаллы S. В своей нижней части эта область ограничена следами двух коноидов S: gm и Lm. О локализации этого второго следа Lm коноида S по отношению к кривой метастабильной растворимости R продолжения EL речь пойдт ниже в связи с относительным положением Fl и F в зависимости от отношения показателей растворимости ; тройной инвариант при температуре Т, ниже которого располагаются три закристаллизовавшихся составляющих A, R, S. Изменение тройных растворов с незначительным избыточным содержанием энантиомеров во время охлаждения и термодинамического квазиравновесия Ниже будет показано, что точка системы в целом (т.е. точка, изображающая валовый состав смеси) располагается на вертикальной линии, проходящей через точку E на фиг. 2 и 3, е точное положение определяется температурой (или аппликатой). Рассматривается только следующий температурный диапазон:TD - температура, при которой исходная смесь представляет собой гомогенный раствор, иTF - конечная температура кристаллизации и фильтрации, лежащая в трхфазной области. Этот валовый состав E соответствует рацемическому раствору, незначительно обогащенному массой M антипода R и обеспечивающему общую массу Mt (избыточное количество энантиомера R - S/R + S составляет, как правило, 4-9%). Равновесные условия достигаются очень медленным охлаждением и затравкой тврдой фазой (тврдыми фазами) в момент, когда фигуративная точка системы E смеси оказывается в области, в которой эта фаза (фазы) находится в равновесном состоянии. При начальной температуре TD раствор является гомогенным. Во время охлаждения последовательно отмечаются: кристаллизация только антипода R при температуре от Тномо до TL, одновременно точка раствора смещается по кривой растворимости антипода R, а именно от точки E в сторону аппликаты Тномо, к точкеL внутри профиля изоплеты R-Y. В точке L масса M кристаллов R, находящихся в равновесном состоянии с насыщенным раствором, выражена через Mt (XE - XL/1 - XL) = M и соответствует избытку энантиомера, присутствующему в исходном растворе (фиг. 3); абсциссы точек L, E, R соответствуют составам и 1 (фиг. 3); начиная с TL, точка раствора смещается от L к IF на моновариантной кривой, содержащей растворы рацемического состава, изображнной на фиг. 2 и таким образом выходящей из профиля изоплеты R-Y на фиг. 3; следовательно, кристаллы R И S осаждаются одновременно и в одинаковом количестве. В условиях равновесия, при температурах ниже TL разделение не может быть осуществлено. Изменение точки раствора во время разделения традиционной фракционной кристаллизацией по способу SIPC Кристаллизация первого антипода, находящегося в избытке Предыдущий раствор E гомогенизируют при температуре TD (фиг. 4 и 5). Для его насыщения раствор быстро охлаждают до температуры TF так, чтобы не произошла кристаллизация. В данный раствор,находящийся вне термодинамического равновесия, затем вводят затравку в виде очень чистых зародышей антипода R той же хиральности, что и хиральность антипода, находящегося в избытке. Происходит изотермическая кристаллизация антипода R, и точка, изображающая состояние раствора, смещается внутри профиля R-Y-T от E к аппликате TF, с которой она сначала сливается, и достигает F, при которой быстро происходит фильтрация. Выделенная масса антипода R составляет 2 М или равна Mt (ХЕ - XF /1 XF). Кристаллизация второго антипода, цикличность операций В результате предшествующей основной операции был получен раствор F, обогащенный антиподами S. При добавке массы 2 М рацемической смеси (равной массе выделенного антипода) и после нагрева этой смеси до температуры TD получают гомогенный раствор E', симметричный E по отношению к вертикальной плоскости A-(RS)-T. Процесс получения массы 2 М антипода S можно представить в виде протекания предыдущего процесса, симметричного по отношению к средней плоскости. Следовательно,проводятся следующие операции: раствор E', гомогенный при температуре TD, сначала охлаждают до температуры TF,проводится затравка очень чистыми зародышами антипода S; рост этого антипода вызывает смещение точки, изображающей состояние раствора, по горизонтальному сегменту E'F' (к аппликате TF); после слияния точки раствора с F' раствор фильтруют и получают массу 2 М антипода S; после повторной добавки массы 2 М рацемической смеси и нового нагрева до TD снова получают гомогенный раствор, изображающая его состояние точка совмещается с исходной точкой E на аппликатеTD; продолжение процесса приводит к простому воспроизведению данного цикла операций. Варианты способа SIPC Литературные источники (Amiard, G., 1956 г., Bull. Soc. Chim. Fr., стр. 447; Collet, A., Brienne, M.,Jacques, J., 1980 г., Chemical reviews 80, 3, стр. 215 - 230; Noguchi Institut, 1980 г., патент Англии 1197809) основаны на предыдущей общей схеме; основные изменения, появившиеся в литературе, могут- 17009592 быть сгруппированы следующим образом:a) Самопроизвольное первичное зародышеобразование антипода, находящегося в избытке. Во время разделениятреонина (Amiard G., 1956 г., Bull. Soc. Chim. Fr. 447) первичное зародышеобразование находящегося в избытке антипода самопроизвольно происходит в пересыщенном гомогенном растворе. Такое первичное зародышеобразование протекает в тот момент, когда точка E, изображающая состав системы, располагается в трхфазной области и когда не проводится перемешивания раствора (Collet, A., Brienne, MJ., Jacques, J., 1980 г., Chemical Reviews 80, 3, стр. 215 -230).b) Введение затравки во время охлаждения (S3PC) Этот протокол наиболее часто встречается в литературе (Noguchi Institut, 1968 г., патент Англии 1197809) в том случае, когда способ отличается от способа SIPC. Среди перечисленных операций встречаются отличия; тем не менее можно отметить следующие существенные общие черты: охлаждение гомогенного раствора от TD до температуры, лежащей ниже TL, НО превышающей TF; затравка зародышами той же хиральности, что и хиральность находящегося в избытке антипода,пересыщенного гомогенного раствора, находящегося в трхфазной области; охлаждение до TF. В отдельных случаях этот этап контролируется точным программированием температуры (Noguchi Institut, 1968 г., патент Англии 1197809). Данные протоколы объединены под тем же названием "S3PC" (Seeded polythermic programmed preferential crystallization), хотя программирование температуры не является достаточным или ограничено второй фазой охлаждения. Изменение положения точки раствора при разделении запрограммированной и самозатравочной фракционной кристаллизацией по способу согласно изобретению AS3PC. С целью более тщательного сравнения традиционных способов и способа AS3PC между собой начальная точка E выбрана на фигурах 6 и 7 произвольно и аналогично предыдущему случаю; однако, как это будет показано ниже в примерах, способ AS3PC позволяет использовать точку E, более удалнную от плоскости A-(RS)-T и, следовательно, при более значительном избытке энантиомера, и увеличить сбор кристаллов на каждой операции. Кристаллизация первого находящегося в избытке антипода В начале процесса - в противоположность традиционным протоколам - система, т.е. кристаллы и раствор, не является более гомогенизированным, но доведн до температуры ТВ. Таким образом, исходный раствор находится в равновесии с кристаллами энантиомеров, находящимися в избытке (например,R на фиг. 7). Следовательно, фигуративные точки раствора (SE) и системы (E) в начале процесса не совмещаются. Такая двухфазная смесь подвергается программированному закону снижения температуры без введения кристаллических зародышей. Точка, изображающая состояние раствора, описывает кривуюSEF В плоскости R-Y-T, зависящую от кинетики охлаждения (фиг. 7). При условии правильно заданной кинетики вначале обеспечивается рост кристаллов находящегося в избытке энантиомера, затем кристаллизация развивается в направлении режима одновременного роста и вторичного зародышеобразования. После достижения точкой, изображающей состояние раствора, точки F проводится фильтрация для отделения массы 2 М кристаллов антипода R. Кристаллизация второго антипода, цикличность операций От точки F, соответствующей предыдущему маточному раствору, переходят к точке E', симметричной E по отношению к вертикальной плоскости A-(RS)-T, введением массы 2 М рацемической смеси и нагреванием до температуры ТВ. Избыток энантиомера используется для смещения в двухфазную область, содержащую насыщенный раствор и кристаллы находящегося в избытке антипода. Предварительно рацемическую смесь, вводимую во время перехода от F к E' (как и от F' к E), измельчают и просеивают для ускорения этапа растворения обоих антиподов, в частности, находящегося в недостатке антипода и таким образом обеспечивают образование значительного количества кристаллов находящегося в избытке антипода, играющих роль зародышей в традиционных способах. Для насыщенного раствора S'E, симметричного SE ПО отношению к плоскости A-(RS)-T, применяется тот же закон охлаждения. Присутствующие в начале охлаждения кристаллы увеличиваются в размере и участвуют в двойном механизме рост + вторичное зародышеобразование. Как и при первой кристаллизации затравка не требуется. В течение этого времени точка, отображающая состояние раствора, перемещается по кривой SE'F', находящейся в плоскости профиля изоплеты S-Y'-T, симметричной к биссектральной плоскости A-(RS)-T. Как только раствор достигнет точки, отображающей его состояние, лежащей в F', приступают к фильтрации для сбора массы 2 М измельчнной и просеянной рацемической смеси, повышают температуру до ТВ и возвращают двухфазную смесь в исходное равновесное состояние. Продолжение этого процесса приводит к повторению цикла операций, при которых попеременно получают кристаллы антиподов R и S. Условия применения способа AS3PCa) Эквимолярная смесь оптических антиподов образует в среде используемого растворителя в температурном интервале ТВ - TF конгломерат (чистые антиподы или сольваты); однако наличие метастабильного рацемата не создат помех.b) Разделяемые молекулы остаются устойчивыми в растворителе в диапазоне применяемых температур ТВ-TF.c) Необходимо проводить определение температур тройного равновесия TL и Тномо. Температура TL представляет собой температуру растворения рацемической смеси при отсутствии любого избыточного количества энантиомера в растворе. Поскольку значение TL определено, то температура Тномо будет соответствовать температуре гомогенизации раствора. Она зависит от избытка исходного энантиомера и от соотношения а между растворимостями рацемической смеси и антипода при TL. Необходимо также знание способности растворов к пересыщению в интервале между TL и TF в зависимости от кинетики охлаждения, режима перемешивания, типа мкости и гранулометрического состава кристаллов находящегося в избытке антипода. В первом приближении время появления кристаллов в результате первичного зародышеобразования в гомогенном рацемическом растворе L, охлажднном от температуры, незначительно превышающей температуру TL, при той же кинетике, служит указанием на способность к пересыщению,допускаемую конгломератом в таких экспериментальных условиях. Этот порядок действий учтн в примерах.d) Знание кинетики растворения определнной массы рацемической смеси (данного гранулометрического состава), диспергированной в растворе при температуре ТВ. Несколько опытов оказываются достаточными для определения этой продолжительности. В порядке иллюстрации и без ограничения настоящего изобретения ниже приводятся примеры и фигуры. Фигуры На фиг. 1 в перспективе изображены тройная система растворитель А - антипод R - антипод S в зависимости от температуры и поверхности кристаллизации каждой составляющей, а также приведены составы двойных насыщенных растворов (моновариантные кривые); на этой же фигуре показаны изотермы при температурах TD И TF И плоскость тройной эвтектики при температуре Т с содержанием четырх фаз. На фиг. 2 показана проекция равновесных состояний при TD и TF на плоскость концентраций, а также изображн след профиля изоплеты RY, на котором точка E отображает состав исходной смеси, незначительно обогащенной антиподом R и предназначенной для осаждения этого антипода. На фиг. 3 показан вертикальный профиль изоплеты RY фиг. 2, содержащий точки состава антипода, находящегося в избытке, и антипода в исходном растворе E, на этом профиле показано перемещение точки раствора для смеси состава XE (жирной линией) в состоянии равновесия и при охлаждении. При TTL точка раствора более не относится к этому профилю. На фиг. 4 показана проекция движения точки раствора (жирная линия) на плоскость концентрации во время чередующегося разделения путем изотермической фракционной кристаллизации при температуре TF и введения затравки по методу SIPC. На фиг. 5 показан вертикальный профиль изоплеты, содержащий прямую RY фиг. 4 и изображающий перемещение точки раствора (жирная линия) от E до F во время изотермической фракционной кристаллизации (при TF) и введение затравки по методу SIPC. На фиг. 6 показана проекция перемещения точки раствора (жирная линия) на плоскость концентраций во время разделения программируемым, самозатравочным политермическим способом (AS3PC). На фиг. 7 показан вертикальный профиль изоплеты, содержащий прямую RY фиг. 6 и иллюстрирующий перемещение точки раствора (жирная линия) от SE до F во время разделения программируемым самозатравочным политермическим способом (AS3PC). На фиг. 8 показана проекция перемещения точки раствора (жирная линия) на плоскость концентраций во время разделения программируемым, самозатравочным политермическим способом (AS3PC),контролирующим соотношение s 2-. Любые профили изотерм и изоплет, изображнные на указанных фигурах, имеют переменные составы, выраженные в массовых долях. На фиг. 9 изображн спектр рентгеновской дифракции, полученный на порошке, соответствующем форме II лево- и правовращающего энантиомера модафинила (дифрактометр: Miniflex Rigaku (Elexience). На фиг. 10 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего форме III лево- и правовращающего энантиомера модафинила (дифрактометр : Miniflex Rigaku (Elexience). На фиг. 11 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего форме IV лево- и правовращающего энантиомера модафинила (дифрактометр: Siemens AG). На фиг. 12 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего сольвату диметилкарбоната лево- и правовращающего энантиомера модафинила (дифрактометр:Siemens AG). На фиг. 13 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего сольвату ацетонитрила лево- и правовращающего энантиомера модафинила (дифрактометр: Siemens AG).- 19009592 На фиг. 14 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего форме V левовращающего энантиомера модафинила (диффрактометр: Bruker GADDS). На фиг. 15 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего сольвату уксусной кислоты лево- и правовращающего энантиомера модафинила (дифрактометр:Bruker GADDS). На фиг. 16 изображн спектр рентгеновской дифракции, полученный для порошка, соответствующего аморфной форме лево- и правовращающего энантиомера модафинила (дифрактометр: BrukerGADDS). Примеры Получение кристаллических форм энантиомера (-)-модафинила и (+)-модафинила, соответственно Общие сведения Новые кристаллические формы энантиомеров модафинила определяли соответственно спектроскопией дифракции рентгеновских лучей на порошке, которая позволила получить уникальный отпечаток пальцев, характерный для исследуемой кристаллической формы, и отличить е от аморфных энантиомеров модафинила и любой другой кристаллической формы энантиомеров модафинила. Данные дифракции рентгеновских лучей получили, в частности,использованием системы D5005 в качестве порошкового рентгеновского дифрактометра (SiemensAG, г. Карлсруэ, Германия, метод анализа данных Eva 5.0) при излучении меди, фильтрованном никелем,при= 1,540(при скорости ускорителя 40 кВ, ток в трубках - 40 мА), при вращении образца во время измерения (угол : 3 - 40 [2 тета]) со скоростью 0,04 [2 тета]с-1, при этом шаг составил 0,04, образец приготовлен с предпочтительной ориентацией); использованием системы Miniflex Rugaku (Elexience) в качестве порошкового рентгеновского дифрактометра при излучении хрома, скорость ускорителя составила 30 кВ, ток в трубках - 15 мА, образец вращался во время измерения (угол: 3 - 80 [2 тета]) со скоростью 0,05 [2 тета]с-1 шаг составил 0,1,образец приготовлен с предпочтительной ориентацией); использованием системы GADDS в качестве порошкового рентгеновского дифрактометра (Bruker,Нидерланды), оборудованного детектором "Hi-Star area" и предназначенного для анализа планшеток с 96 лунками. Анализы проводились при температуре окружающей среды с применением излучения медиCuKalpha в области углов 2 тета, составлявших 3 - 42. Дифракционный спектр по каждой лунке определяли между двумя областями с угловым значением 2 тета (32 тета 21 и 192 тета 42 ), время экспозиции составило от 50 до 250 с. Само собой разумеется, что значения интенсивности могут меняться в зависимости от способа приготовления образца, монтажной схемы и измерительной аппаратуры. На результат измерения при 2 тета могут отрицательно влиять изменения, вызываемые измерительной аппаратурой, так что соответствующие пики могут меняться от 0,04 до 0,2 в зависимости от аппаратуры. Поэтому специалист предпочитает пользоваться межплоскостными расстояниями, являющимися основными данными дифракционных спектров. Межплоскостные расстояния рассчитываются по уравнению Брэгга [(2d sin тета - n, где d - межплоскостное расстояние ,длина волны излучения меди, тета - угол вращения кристалла (в градусах)], когда это уравнение верно. Примеры 1-10. Приготовление формы 1 (-)-модафинила или (+)-модафинила, соответственно Пример 1. а) Энантиомер I модафинила растворили с обратным холодильником в полярных растворителях: метанол, абсолютированный этанол, абсолютированный этанол с содержанием 3% воды, этанол, денатурированный толуолом (2,5%) и содержащий 3% воды и вода в соответствии с экспериментальными условиями, подробно приведнными в табл. 1. Таблица 1 После быстрого охлаждения погружением в ванну, содержавшую воду и лд, на 30 мин среду фильтровали и сушили в сушильном шкафу при температуре 35. Кристаллический продукт идентифицировали как полиморфную модификацию формы I 1-энантиомера модафинила по его спектру рентгеновской дифракции на порошке.b) Энантиомер d модафинила (555 г), обработанный в экспериментальных условиях, аналогичных условиям примера 1a, в смеси из денатурированного толуолом этанола (2 л) и воды (0,1 л), кристаллизовался в виде полиморфной формы I, как было идентифицировано по его спектру рентгеновской дифракции на порошке, с выходом 91%. Пример 2. Перекристаллизация в ацетоне а) 2 г (-)-модафинила суспендировали в ацетоне (20 мл) в трхгорлой колбе, снабжнной холодильником, термометром и мешалкой. Смесь нагревали с обратным холодильником. Реакционную смесь перемешивали в течение 30 мин при около 56 до полного растворения (-)-модафинила. Затем раствор медленно охлаждали при скорости -0,5 С/мин до 10C при перемешивании. Реакционную смесь фильтровали, полученное тврдое вещество сушили для получения формы I (-)-модафинила, идентифицированного по его спектру рентгеновской дифракции. Выход составил 62%.b) B аналогичных экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 3. Перекристаллизация в метанолеa) 1 г (-)-модафинила добавили в 7 мл метанола и нагревали с обратным холодильником до полного растворения. Реакционную смесь осаждали добавкой 6 мл воды при 1C. Суспензию выдерживали при перемешивании в течение 1 мин и затем фильтровали через пористое стекло ( 3). Выделенное тврдое вещество сушили для получения формы I (-)-модафинила, идентифицированного по его спектру рентгеновской дифракции. Выход составил 55%.b) B аналогичных экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 4. Перекристаллизация в метаноле (2-й пример)a) 2,5 г (-)-модафинила добавили в 90 мл метанола и нагревали с обратным холодильником до его полного растворения. Прозрачный раствор влили в 200 мл воды при 1C и без перемешивания выдержали в течение 10 мин. Реакционную смесь фильтровали, выделенное тврдое вещество сушили для получения формы I (-)-модафинила, который идентифицировали по его спектру рентгеновской дифракции. Выход составил 78%;b) B аналогичных экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 5. Перекристаллизация в диоксане 1-4a) В колбу мкостью 50 мл поместили 20 мл диоксана 1-4 и довели до образования флегмы. Добавили 2 г (-)-модафинила для достижения насыщения; перемешивали магнитной мешалкой (300 об./мин). Систему охладили после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин до 20 С. Полученные кристаллы профильтровали через пористое стекло и идентифицировали как форму I по е спектру рентгеновской дифракции. Выход составил 51%.b) B аналогичных экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 6. Перекристаллизация в смеси из орто-, мета- и параксилолаa) В колбу мкостью 250 мл поместили 180 мл смеси из орто-, мета- и параксилена и довели до образования флегмы. Добавили 0,5 г (-)-модафинила для достижения насыщения; перемешивание проводилось магнитной мешалкой (300 об./мин). Систему охладили после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин до 15C. Полученные кристаллы профильтровали через пористое стекло и идентифицировали как форму I по е спектру рентгеновской дифракции. Выход составил 26%.b) В аналогичных экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 7. Перекристаллизация в этилацетатеa) В колбу мкостью 250 мл ввели 100 мл этилацетата и доводили до образования флегмы. Добавили 2 г (-)-модафинила для достижения насыщения; перемешивание производилось магнитной мешалкой(300 об./мин). Систему охладили после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин до 20C. Полученные кристаллы профильтровали через пористое стекло и идентифицировали как форму I по е спектру рентгеновской дифракции. Выход составил 66%.b) (+)-модафинил (3 г) растворили с обратным холодильником в этилацетате (100 мл). После охлаждения погружением в ванну с водой и льдом на 30 мин среду фильтровали и сушили в сушильном шкафу при 50C в вакууме. Кристаллический продукт идентифицировали как полиморфную модификацию формы I (+)-модафинила по его спектру рентгеновской дифракции на порошке. Пример 8. Перекристаллизация на основе других полиморфных форм а) При нагреве CRL 40982, форма IV (0,5 г), и CRL 40982, форма II (0,5 г), до 100C они образуют форму I. Кроме того, чистая форма I (-)-модафинила может быть получена посредством повторного сгущения смеси из (-)-модафинила формы I (0,5 г), формы II (0,5 г) и формы III (0,5 г), в ацетоне (20 мл) в те- 21009592 чение времени, необходимого для полного превращения (3 суток). В результате двух операций идентифицировали форму I по е спектру рентгеновской дифракции,полученному на порошке.b) Применение (+)-модафинила (CRL 40983) в тех же условиях привело к аналогичным результатам. Пример 9. Перекристаллизация на основе сольвата ацетонитрилаa) 1 г сольвата ацетонитрила (-)-модафинила, который нагревали до 100C в течение 8 ч, превращается в тврдое вещество белого цвета, идентифицированное как (-)-модафинил, форма I, по его спектру рентгеновской дифракции на порошке.b) Применение (+)-модафинила (CRL 40983) в тех же условиях приводило к аналогичным результатам. Пример 10. Перекристаллизация на основе сольвата монодиметилакарбонатаa) 1 г сольвата монодиметилкарбоната (-)-модафинила, который нагревали до 110C в течение 16 ч,превращается в тврдое вещество белого цвета, идентифицированное как (-)-модафинил, форма I, по его спектру рентгеновской дифракции на порошке.b) Применение (+)-модафинила (CRL 40983) в тех же условиях приводило к аналогичным результатам. Примеры 11, 12. Получение формы II соответственно (-)- модафинила (CRL 40982, форма II) и (+)модафинила (CRL 40983, форма II) Пример 11. Получение быстрым охлаждением а) Энантиомер I модафинила растворили с обратным холодильником в растворителях: этилацетат,изопропанол, н-пропанол, денатурированный толуолом (2,5%) этанол, в экспериментальных условиях,приведнных в табл. 2. Таблица 2 После охлаждения погружением в ванну с водой и льдом в течение 30 мин среду фильтровали и сушили в сушильном шкафу при 30C. При каждой экспериментальной операции кристаллический продукт идентифицировали в как полиморфную модификацию формы II (CRL 40982, форма II) 1 энантиомера модафинила по его спектру рентгеновской дифракции на порошке.b) Энантиомер d-модафинила (3,02 г) растворили в 100 мл изопропанола с обратным холодильником и охлаждали в ванне с водой и льдом в течение 30 мин, затем фильтровали и сушили в вакууме в сушильном шкафу при 50C. В этих экспериментальных условиях (+)-модафинил кристаллизовался в виде полиморфной формы II (CRL 40983, форма II), которую идентифицировали по е спектру рентгеновской дифракции на порошке. Пример 12. Перекристаллизация охлаждением в изопропанолеa) В колбу мкостью 250 мл поместили 100 мл изопропанола и доводили до образования флегмы,затем добавили 3 г (-)-модафинила для достижения насыщения, смесь перемешивали магнитной мешалкой (300 об./мин). После полного растворения (-)-модафинила раствор медленно охладили до 20C при линейной скорости охлаждения -0,5 С/мин. Полученные кристаллы фильтровали через пористое стекло. Кристаллический продукт идентифицировали как полиморфную модификацию формы II (CRL 40982,форма II) 1-энантиомера модафинила по его спектру рентгеновской дифракции на порошке. Выход составил 42%.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 13. Получение формы III соответственно (-)-модафинила (CRL 40982, форма III) и (+)модафинила (CRL 40983, форма III) Пример 13. Получение медленным охлаждением в ацетонаa) Энантиомер l-модафинила (5 г) растворили с обратным холодильником в 90 мл ацетона. После быстрого охлаждения погружением в ванну с водой и льдом на 30 мин среду фильтровали и сушили в сушильном шкафу при 35C. Кристаллический продукт идентифицировали как полиморфную модификации формы III l-энантиомера модафинила их его спектру рентгеновской дифракции на порошке. Выход составил 61%.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции.a) В колбу мкостью 50 мл поместили 20 мл хлороформа и доводили до образования флегмы. Добавили 1,5 г (-)-модафинила для достижения насыщения, смесь перемешивали магнитной мешалкой (300 об./мин). Систему медленно охлаждали после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин до 20 С. Полученные кристаллы фильтровали через пористое стекло и идентифицировали как (-)-модафинил, форма IV, по его спектру рентгеновской дифракции на порошке.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 15. Перекристаллизация в метилэтилкетонеa) В колбу мкостью 250 мл поместили 100 мл метилэтилкетона и доводили до образования флегмы. Добавили 2 г (-)-модафинила для достижения насыщения, смесь перемешивали магнитной мешалкой(300 об./мин). Систему медленно охлаждали после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин до 20 С. Полученные кристаллы фильтровали через пористое стекло и идентифицировали как (-)-модафинил, форма IV, по его спектру рентгеновской дифракции на порошке.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 16. Перекристаллизация в тетрагидрофуране а) В колбу мкостью 50 мл поместили 20 мл тетрагидрофурана и доводили до образования флегмы. Добавили 1 г (-)-модафинила для достижения насыщения, перемешивание проводили магнитной мешалкой (300 об./мин.). Систему медленно охлаждали после полного растворения (-)-модафинила при линейной скорости охлаждения -0,5 С/мин. до 10C. Полученные кристаллы фильтровали через пористое стекло и идентифицировали как (-)-модафинил, форма IV, по его спектру рентгеновской дифракции на порошке. Примеры 17-17 бис. Получение формы V соответственно (-)-модафинила (CRL 40982, форма V) и(+)-модафинила (CRL 40983, форма V) Методика, использованная в примерах 17-17 бис Раствор энантиомера d модафинила в метаноле (150 мг/мл) нанесли на планшетку с 96 лунками, после чего выпарили метанол в неглубоком вакууме и добавили 25 мкл разных растворителей (концентрация = 3,75 мг/25 мкл растворителя) при комнатной температуре. Планшетки с множественными лунками выполнены из нержавеющей стали (316 L), при этом каждая герметичная лунка имела общий объм 50 мкл. Планшетку нагрели до начальной температуры 60C при температурном градиенте 4,8 С/мин. Через 30 мин е медленно (-0,6 С/мин) или быстро (-300 С/мин) охладили до конечной температуры 3 С, затем выдерживали при этой температуре в течение не менее 1 ч и не более 48 ч. Растворитель выпаривали в вакууме (в атмосфере азота) и анализировали кристаллический продукт. Пример 17. Перекристаллизация в 2-пропанонеd-модафинил подвергли кристаллизации в 2-пропаноне в указанных выше технологических условиях, проводили медленное охлаждение (-0,6 С/мин) и поддерживали температуру 3C в течение 1 ч. Кристаллы идентифицировали как (+)-модафинил, форма V (CRL 40983, форма V), по его спектру рентгеновской дифракции на порошке. Пример 17 бис. Перекристаллизация в тетрагидрофуранеd-модафинил подвергли кристаллизации в тетрагидрофуране в указанных выше технологических условиях, проводили быстрое охлаждение (-300 С/мин) и поддерживали температуру 3C в течение 1 ч. Кристаллы идентифицировали как (+)-модафинил, форма V (CRL 40983, форма V), по его спектру рентгеновской дифракции на порошке. Примеры 18, 19. Получение сольватов (-)-модафинила и (+)-модафинила Пример 18. Получение сольвата диметилкарбоната (-)-модафинилаa) 2 г (-)-модафинила добавили в 20 мл диметилкарбоната и нагревали с обратным холодильником. Реакционную смесь перемешивали в течение 10 мин до полного растворения (-)-модафинила. Раствор медленно (-0,5 С/мин) охлаждали до 10C при перемешивании. Затем реакционную смесь фильтровали через пористое стекло ( 3). Анализ сольвата диметилкарбонатмодафинила показал наличие массы в количестве около 24% в диапазоне от около 50 до 100C. Стехиометрия сольвата диметилкарбоната составила 1-1. Следовательно, речь шла о подлинном сольвате, идентифицированном как сольват диметилкарбоната (-)-модафинила по его спектру рентгеновской дифракции на порошке. Выход составил 88%.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 19. Получение сольвата ацетонитрила (-)-модафинилаa) Кристаллы (-)-модафинила полиморфной формы I суспендировали в ацетонитриле в течение 3 суток при 20C. Выделенное тврдое вещество идентифицировали как сольват ацетонитрила по рентгеновской дифракции. Сольват соответствовал подлинному сольвату со стехиометрией 1-1, идентифициро- 23009592 ванному как сольват ацетонитрила (-)-модафинила по его спектру рентгеновской дифракции на порошке. Выход составил 92%.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 20. Получение сольвата уксусной кислотыa) 75 г d- или l-модафинила перевели в суспензию в уксусной кислоте в реакторах Minimax для получения концентрации 15% (вес./об.). При постоянном перемешивании среду для кристаллизации нагревали до начальной температуры 60-80C при температурном градиенте 3 С/мин. Через 30 мин среду медленно (-0,6 С/мин) или быстро (-300 С/мин) охладили до достижения конечной температуры 3C, затем при этой конечной температуре выдерживали в течение не менее 1 ч и не более 48 ч. В таких экспериментальных условиях получили сольват уксусной кислоты, который идентифицировали по его спектру рентгеновской дифракции на порошке.b) При тех же экспериментальных условиях, применнных для (+)-модафинила, получили идентичный спектр рентгеновской дифракции. Пример 21. Получение аморфной формы (-)-модафинила и (+)-модафинила Полученный в примере 20 сольват (-)- или (+)-модафинила превратили в аморфную форму нагреванием до 120C в течение 3 ч. Полученный на порошке спектр рентгеновской дифракции приведн на фиг. 16. Примеры 22-29. Разделение -модафиновой кислоты избирательной кристаллизацией Разделение методом AS3PC в этаноле Условия, созданные при равновесиях: растворимость рацемической смеси в этаноле: растворимость чистого антипода (+) = 1,99% при 20C, соотношение= 2,06; координаты точки L - концентрация: 5,96%, температура: 30C. Изменение Тномо в зависимости от избытка энантиомера = (рацемическая смесь/(растворитель + рацемическая смесь) = 5,96% = константа. Условия, созданные кинетикой. Задавая показатель ТВ более близким к значению TL, можно получить в начале эксперимента около 40% от конечного сбора мелких кристаллов, следовательно, остатся не более 60% ожидаемой конечной массы. Эту операцию легко проводить в том случае, когда соотношение Z достаточно высокое (превышает или равно 0,8 от процентного содержания избыточного энантиомера). В случае модафиновой кислоты кристаллизация протекала надлежащим образом. Температура TB1 = 33,5C, Тв 2 = 31,5C. Температура TF = 17C. Закон охлаждения = T = f(t). Закон охлаждения типа 1: Закон охлаждения типа 2: В обоих, показанных на фигуре случаях, начиная с TBl или ТВ 2, закон охлаждения представляет собой линейный сегмент, T1 = 33,5-0,275 t (1-й тип), T2 = 31,5 - 0,24167 t (2-й тип), сопровождаемый появлением плато при 17 С. Пример 22. Разделение -модафиновой кислоты методом AS3PC в масштабе 35 мл в этаноле Исходные условия: Избыток энантиомера: 11% Продолжительность выдержки при TВ 1 или ТB2: 30 мин. Скорость перемешивания: 200 об./мин Средняя масса кристаллов чистого антипода: 0,66 г Средняя оптическая чистота: 90,6%. Пример 23. Разделение -модафиновой кислоты методом AS3PC в масштабе 400 мл в метаноле Исходные условия Начальный избыток энантиомера: 11% Средняя масса кристаллов чистого антипода: 8,55 г Средняя оптическая чистота: 89,63%. Пример 24. Разделение -модафиновой кислоты методом AS3PC в масштабе 2 л в этаноле Исходные условия: Начальный избыток энантиомера: 11,1% Средняя масса кристаллов чистого антипода: 32,6 г Средняя оптическая чистота: 90,3%. Пример 25. Разделение -модафиновой кислоты методом AS3PC в масштабе 10 л в этаноле Исходные условия; Исходный избыток энантиомера: 11,7% Скорость перемешивания: 200 об./мин в течение всего процесса перемешивания передвижной мешалкой Impeller Результаты Средняя масса кристаллов чистого антипода: 130,8 г Средняя оптическая чистота: 89,9%.- 25009592 Разделение методом AS3PC в 2-метоксиэтаноле Условия, созданные при равновесиях: растворимость рацемической смеси в 2-метоксиэтаноле: растворимость чистого антипода (+): 4% при 20C, соотношение : 2,53; координаты точки L - концентрация : 16%, температура : 39,4C. Изменение показателя Тномо в зависимости от избытка энантиомера = (рацемическая смесь/(растворитель + рацемическая смесь) =16%, константа. Пример 26. Разделение -модафиновой кислоты методом AS3PC в масштабе 10 л в 2 метоксиэтаноле Исходные условия Избыток энантиомера: 10% Начальная температура TB: 41 С Температура при фильтрации TF: 30C Линейная скорость изменения температуры: снижение от 41 до 30C за 1 ч Средняя масса кристаллов чистого антипода: 422,4 г Средняя оптическая чистота: 98,2%. Разделение методом AS3PC в метаноле Условия, созданные при равновесиях: - растворимость рацемической смеси в метаноле: растворимость чистого антипода (+): 4,9% при 20C, соотношение : 2,53; координаты точки L - концентрация : 25,6%, температура : 46,5C. Изменение показателя Тномо в зависимости от избытка энантиомера= (рацемическая смесь/(растворитель + рацемическая смесь) = 25,7%, константа. Пример 27. Разделение -модафиновой кислоты методом AS3PC в масштабе 2 л в метаноле Экспериментальные условия Избыток энантиомера: 10% Начальная температура TB: 46,5C Температура при фильтрации TF: 30C Температурный градиент: линейный, снижение от 39,4 до 18C за 1 ч Средняя масса кристаллов чистого антипода: 108 г Средняя оптическая чистота: 87,5%. Разделение методом SIPC в этаноле Условия, созданные при равновесиях (см. метод AS3PC). Пример 28. Разделение -модафиновой кислоты методом SIPC в масштабе 2 л с внесением затравки в конце охлаждения в этаноле Исходные условия: Начальный избыток энантиомера: 11,8% Температура, при которой исходная смесь представляет собой гомогенный раствор TD: 40C Время (выдержка) при TF перед введением зародышей: 0 мин Масса зародышей: 1%,Время кристаллизации: максимально быстрое охлаждение погружением,Скорость перемешивания: 200 об./мин на протяжении всего процесса передвижной мешалкой Impeller. Результаты Средняя масса кристаллов чистого антипода: 31,28 г Средняя оптическая чистота: 91%. Пример 29. Разделение -модафиновой кислоты методом S3PC в масштабе 2 л с внесением затравки во время охлаждения в этаноле Начальный избыток энантиомера: 11,14% Температура внесения затравки: 29C Масса зародышей: 1% Время кристаллизации: максимально быстрое охлаждение погружением Скорость перемешивания: 200 об./мин в течение всего процесса передвижной мешалкой Impeller. Результаты Средняя масса кристаллов чистых антиподов: 25,2 г Средняя оптическая чистота: 85,2%. Примеры 30-32. Превращение оптических энантиомеров модафиновой кислоты в сложный алкиловый эфир Данный этап поясняется использованием (-)-модафиновой кислоты. Примеры 30-31. Этерификация (-)-модафиновой кислоты Пример 30. Этерификация в присутствии диметилсульфата В колбу мкостью 10 л поместили 3,3 л ацетона, 0,6 л воды, 349 г Na2CO3 (3,29 моля), 451 г (-)модафиновой кислоты (1,64 моля) и нагревали до образования флегмы. В течение полчаса влили 330 мл(3,29 моля) диметилсульфата. Продолжили образование флегмы в течение 1 ч и затем охлаждали до комнатной температуры в течение 20 ч. Среду вылили на 6,6 кг льда. Немедленно произошла кристаллизация и через 3 ч дополнительного перемешивания фильтрацией получили осадок белого цвета, который промыли в 6 л воды. Этот продукт повторно перевели в пастообразное состояние добавкой 6 л воды и снова профильтровали. Осадок сушили в вакууме при 35C и получили 436,3 г метилового сложного эфира (выход: 92,3%). Пример 31. Этерификация в присутствии метилхлорформиата В 450 мл метанола ввели 100 г (0,36 моля) (-)-модафиновой кислоты и 21,6 мл (0,36 моля) триэтиламина. В раствор, полученный после растворения соли, постепенно вливали 30 мл (0,36 моля) метилхлорформиата. Вливание производилось в течение 15 мин с повышением температуры от 28 до 35C (выделялся СО 2). Перемешивали в течение 2 ч и вылили на измельчнный лд + вода (500 г / 500 мл). Сложный эфир закристаллизовался; после фильтрации и сушки получили 94,5 г сложного эфира.(Выход: 90,1%). Пример 32. Аммонолиз сложного алкилового эфира оптически активной модафиновой кислоты В реактор с двойной стенкой мкостью 4 л ввели 1,63 л денатурированного толуолом метанола, 0,1 л воды и 425,1 г (1,474 моля) сложного метилового эфира. Температуру довели до 30C и провели барботирование аммиаком, регулируя указанную температуру. Операция длилась 1 ч 45 мин, введнная масса аммиака составила 200 г. Перемешивание производилось в течение 21 ч 30 мин, после чего охлаждали при уставке 0 С. Среду фильтровали через пористое стекло 3 и получили 57,2 г первого продукта и фильтрат, который выпаривали до сухого остатка. Осадок снова развели 1,2 л этанола, денатурированного толуолом,и после фильтрации получили второй продукт в количестве 308,6 г. Первая кристаллизация: Оба продукта объединили и подвергли перекристаллизации в 1,83 л денатурированного толуолом этанола. После горячей фильтрации получили фильтрат, который при охлаждении дал продукт, который фильтровали и сушили в вакууме при 30 С. Получили 162,2 г продукта белого цвета. Вторая кристаллизация: Указанные 162,2 г смешали с 810 мл денатурированного толуолом этанола и нагревали с обратным холодильником до полного растворения. Затем производили кристаллизацию замораживанием и фильтровали через пористое стекло 4, сушили в вакууме при 30C. Получили 147,3 г (-)модафинила (CRL 40982). Выход: 36,6%.- 28009592 Свойства: вращательная способность: -18,6 (4,9% раствор в метаноле),точка плавления: 163C. Примеры 33, 34. Кристаллическая структура Пример 33. Структура модафиновой кислоты Кристаллы модафинила получали в ацетоне. Эта фаза имела следующие характеристики: гексагональная P31 или Р 32 в зависимости от энантиомера, следовательно, модафинил представлял собой конгломерат ; а = 9,55;b = 9,55;с=13,14.= 90.000,= 90.000, = 120.000 Дифракционные интенсивности измеряли автоматическим дифрактометром SMART APEX (Bruker) при 20C. Структуру разрешали с помощью серии программ Saintplus, Sadabs, Shelxs. Следует подчеркнуть необычный характер такой пространственной группы для органических хиральных молекул. В кристаллической рештке элементарная ячейка повторяется трижды, т. е. Z = 1. Такие молекулы соединены между собой водородными связями через кислотную и сульфооксидную функциональные группы. Необходимо отметить, что наиболее интенсивные взаимодействия (водородные связи) происходят вокруг третичной геликоидальной оси в кристаллографическом направлении z. Пример 34. Структура (-)- и (+)-модафинила, форма I Была определена кристаллическая структура (+)-модафинила формы I, идентифицированная как идентичная структуре (-)-модафинила, форма I. Она обладает следующими свойствами: кристаллическая система: моноклинная; пространственная группа: P21; а = 5.6938, b = 26.5024, с = 9.3346 ;= 105.970 Показатели дифракционной интенсивности измеряли автоматическим дифрактометром SMARTAPEX (Bruker) при 20C. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кристаллических форм оптических энантиомеров модафинила, включающий в себя следующие этапы:i) растворение одного из оптических энантиомеров модафинила в растворителе;iii) выделение полученной кристаллической формы энантиомера модафинила. 2. Способ по п.1, в котором энантиомером модафинила является левовращающий энантиомер. 3. Способ по п.1, в котором энантиомером модафинила является правовращающий энантиомер. 4. Способ по любому из пп.1-3, в котором получаемой кристаллической формой является полиморфная форма. 5. Способ по любому из пп.1-4, в котором кристаллизация проводится в кинетических или термодинамических условиях. 6. Способ по п.5, в котором кристаллизация проводится осаждением, при необходимости, в присутствии зародышей кристаллов желаемой кристаллической формы. 7. Способ по п.5, в котором кристаллизация проводится охлаждением раствора, полученного на этапе i). 8. Способ по п.7, в котором охлаждение проводится медленно. 9. Способ по п.7, в котором охлаждение проводится быстро. 10. Способ по пп.4 и 8, в котором применяемый на этапе i) растворитель выбирают из ацетона, диоксана 1-4, этилацетата, орто-, мета- или параксилола или смеси из орто-, мета- и/или параксилола, причм полученную при этом полиморфную форму обозначают как форма I. 11. Способ по пп.4 и 9, в котором применяемый на этапе i) растворитель выбирают из метанола, воды и спирто-водных смесей, причм полученную при этом кристаллическую форму обозначают как форма I. 12. Способ по пп.4 и 9, в котором применяемым на этапе i) растворителем является изопропанол, нпропанол, этилацетат или денатурированный толуолом этанол, причм полученную при этом полиморфную форму обозначают как форма II. 13. Способ по пп.4 и 8, в котором применяемым на этапе i) растворителем является изопропанол,причм полученную при этом полиморфную форму обозначают как форма II. 14. Способ по пп.4 и 9, в котором применяемым на этапе i) растворителем является ацетон, причм полученную при этом полиморфную форму обозначают как форма III. 15. Способ по пп.4 и 8, в котором применяемый на этапе i) растворитель выбирают из тетрагидро- 29009592 фурана, хлороформа, метилэтилкетона, причм полученную при этом полиморфную форму обозначают как форма IV. 16. Способ по любому из пп.1-3, в котором полученной кристаллической формой является сольват оптических энантиомеров модафинила. 17. Способ по пп.8 и 16, в котором применяемым на этапе i) растворителем является диметилкарбонат, причм полученный при этом сольват обозначают как сольват диметилкарбоната оптических энантиомеров модафинила. 18. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма II, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 8,54; 7,57; 7,44; 4,56; 3,78; 3,71 . 19. Полиморфная форма по п.18, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 11,33; 8,54; 7,57; 7,44; 5,67; 5,33; 4,83; 4,59; 4,56; 4,45; 4,05; 3,88; 3,78; 3,71; 3,34; 2,83; 2,53 . 20. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма III, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 12,28; 8,54; 5,01; 4,10; 3,97; 3,20 . 21. Полиморфная форма по п.20, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,40; 12,28; 8,54; 7,32; 6,17; 5,11; 5,01; 4,65; 4,60; 4,48; 4,44; 4,27; 4,19; 4,10; 4,02; 3,97; 3,83; 3,66; 3,54; 3,42; 3,20; 2,91; 2,58. 22. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма IV, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 12,38; 8,58; 7,34; 5,00; 4,09 . 23. Полиморфная форма по п.22, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,88; 12,38; 10,27; 8,58; 7,34; 6,16; 5,660; 5,120; 5,00; 4,64; 4,48; 4,26; 4,18; 4,09; 3,82; 3,66; 3,53; 3,42; 3,28; 3,20 . 24. Полиморфная форма лево- или правовращающего энантиомера модафинила, обозначаемая как форма V, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 9,63; 5,23; 5,03; 4,74; 4,66; 4,22; 4,10; 3,77 . 25. Полиморфная форма по п.24, характеризующаяся тем, что она образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостных расстояниях: 13,27; 12,21; 9,63; 8,51; 7,20; 6,17; 5,60; 5,23; 5,03; 4,74; 4,66; 4,42; 4,22; 4,10; 3,97; 3,77; 3,61; 3,50; 3,40; 3,31 . 26. Сольват диметилкарбоната лево- или правовращающего энантиомера модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостньгх расстояниях: 12,31; 9,69; 9,09; 8,54; 7,27; 6,21; 5,45; 5,10; 5,00; 4,83; 4,63; 4,46; 4,22; 4,13; 4,09; 3,78; 3,62; 3,53; 3,42; 3,32; 3,24; 3,21; 3,10 . 27. Способ превращения первой кристаллической формы одного из энантиомеров модафинила во вторую кристаллическую форму этого энантиомера, отличающуюся от первой, причм данный способ включает в себя следующие этапы:a) суспендирование первой кристаллической формы указанного энантиомера модафинила в соответствующем растворителе;b) выделение полученной второй кристаллической формы. 28. Способ по п.27, в котором применяемым энантиомером является (-)-модафинил. 29. Способ по п.28, в котором первой кристаллической формой является форма I. 30. Способ по п.29, в котором применяемым на этапе ii) растворителем является ацетонитрил, в результате чего получают сольват ацетонитрила. 31. Сольват ацетонитрила энантиомера (-)-модафинила или (+)-модафинила, характеризующийся тем, что он образует спектр рентгеновской дифракции, содержащий линии интенсивности при межплоскостньгх расстояниях: 16,17; 14,14; 12,32; 10,66; 9,79; 9,29; 8,54; 8,15; 7,80; 7,09; 6,31; 5,83; 5,62; 5,41; 5,10; 4,90; 4,66; 4,58; 4,46; 4,33; 4,20; 4,02; 3,92; 3,835; 3,72; 3,60; 3,57; 3,45; 3,33; 3,24; 3,19; 3,09; 3,03 . 32. Способ получения оптически активного модафинила на основе модафиновой кислоты, содержащий следующие этапы:a) разделение двух оптических энантиомеров -модафиновой кислоты и выделение по меньшей мере одного из энантиомеров;b) приведение в контакт одного из двух полученных энантиомеров с низшим алкилгалоформиатом в присутствии спирта и органического основания;d) превращение полученного сложного эфира в амид;e) выделение полученного на этапе iv) продукта. 33. Способ по п.32, в котором галоформиатом является низший алкилхлорформиат.
МПК / Метки
МПК: C07C 317/50, A61K 31/165, C07C 315/06, A61P 25/00
Метки: кристаллических, получения, способ, энантиомеров, форм, кристаллические, оптических, формы, модафинила
Код ссылки
<a href="https://eas.patents.su/30-9592-sposob-polucheniya-kristallicheskih-form-i-kristallicheskie-formy-opticheskih-enantiomerov-modafinila.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения кристаллических форм и кристаллические формы оптических энантиомеров модафинила</a>
Предыдущий патент: Производные пиридо[2, 1 - а]изохинолина в качестве ингибиторов dpp – iv
Следующий патент: Терапевтические средства для лечения боли
Случайный патент: Многоконтурный реактор для полимеризации олефинов