Композиции и способы увеличения активности теломеразы
Номер патента: 9442
Опубликовано: 28.12.2007
Авторы: Акама Тсутому, Харлей Келвин Б., Вонг Юнг-Ху, Миллер-Мартини Дэвид М., Чин Эллисон С., Ип Нэнси Юк-Ю
Формула / Реферат
1. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным, и контактирование указанной клетки или ткани с соединением формулы I
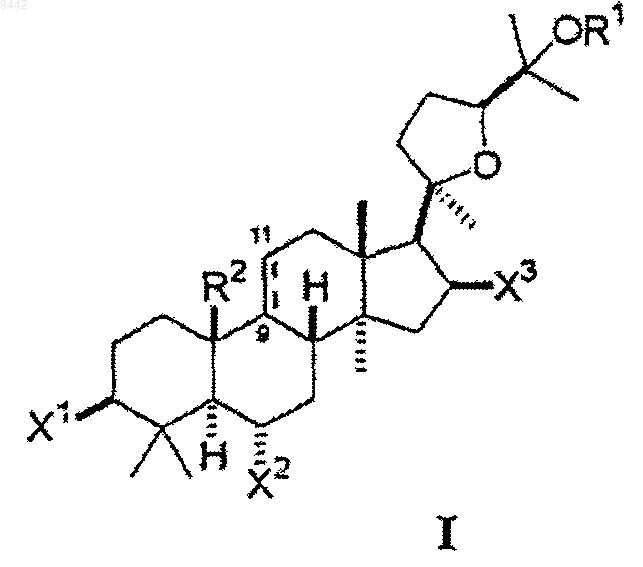
где каждый из X1, X2, и X3 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида;
OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; и
R2 представляет собой метил и ---- представляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
2. Способ по п.1, отличающийся тем, что указанное соединение включает 0 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом.
3. Способ по п.1, отличающийся тем, что R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
4. Способ по п.1, отличающийся тем, что X1 представляет собой OH или гликозид, каждый из X2 и OR1 представляет собой независимо OH или гликозид и X3 представляет собой OH или кето.
5. Способ по п.1, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6-b-D-глюкопиранозида и циклоастрагенол 3-b-D-ксилопиранозида.
6. Способ по п.5, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола и астрагалозид IV 16-она.
7. Способ по п.6, отличающийся тем, что указанное соединение представляет собой астрагалозид IV.
8. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным и контактирование указанной клетки или ткани с соединением формулы II
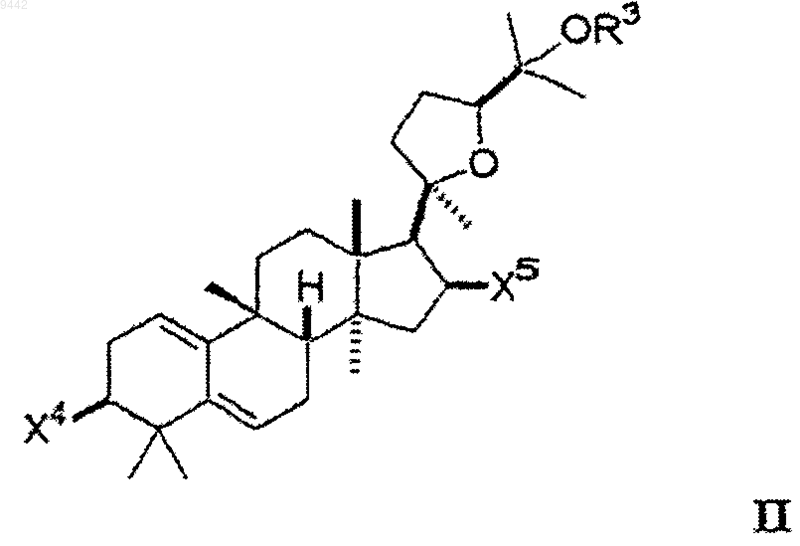
где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и
OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида.
9. Способ по п.8, отличающийся тем, что каждый X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O).
10. Способ по п.8, отличающийся тем, что X4 представляет собой OH или гликозид и каждый из X5 и OR3 представляет собой OH.
11. Способ по п.10, отличающийся тем, что X4 представляет собой OH.
12. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным, и контактирование указанной клетки или ткани с соединением формулы III
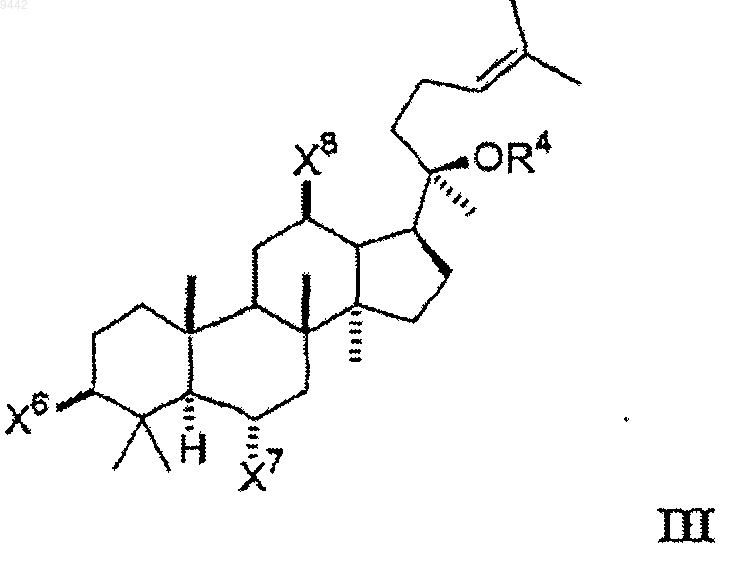
где каждый из X6, X7 и X8 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида, и
OR4 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида.
13. Способ по п.12, отличающийся тем, что каждый из X6, X7, X8 и OR4 независимо выбран из гидроксигруппы и гликозида.
14. Способ по п.13, отличающийся тем, что каждый OR4, X6 и X8 представляет собой OH и X7 представляет собой гликозид.
15. Способ по п.14, отличающийся тем, что соединение представляет собой гинсенозид RH1.
16. Способ лечения состояния пациента путем увеличения активности теломеразы в клетках или ткани пациента, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I по п.1, или формулы II по п.8, или формулы III по п.12.
17. Способ по п.16, отличающийся тем, что соединение имеет формулу I или формулу II.
18. Способ по п.16, отличающийся тем, что указанное состояние представляет собой ВИЧ-инфекцию или дегенеративное заболевание.
19. Способ по п.18, отличающийся тем, что дегенеративное заболевание выбрано из группы, включающей нейродегенеративное заболевание, дегенеративное заболевание костей или суставов, дистрофию жёлтого пятна сетчатки, атеросклероз и анемию.
20. Способ по п.16, отличающийся тем, что указанное состояние представляет собой рану или другое острое или хроническое состояние эпидермиса.
21. Фармацевтическая композиция, содержащая соединение формулы I в фармацевтически приемлемом носителе
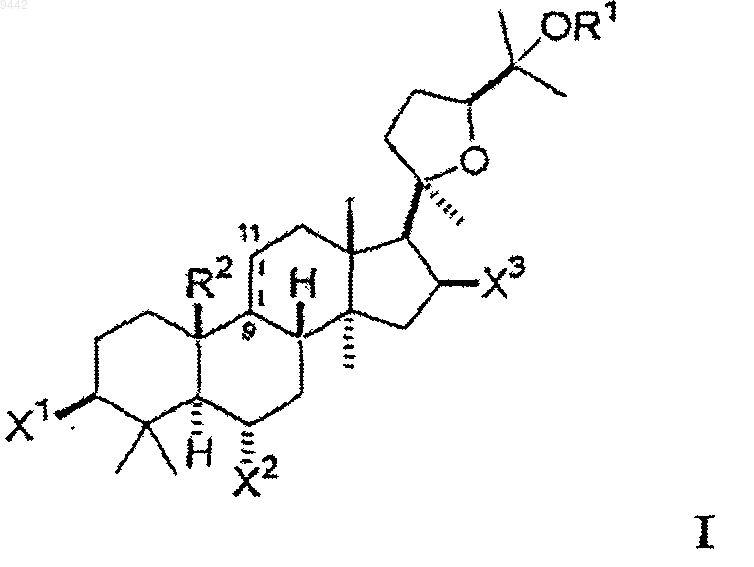
где каждый из X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида;
X3 представляет собой кето;
OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; и
R2 представляет собой метил и ---- представляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
22. Композиция по п.21, отличающаяся тем, что R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
23. Композиция по п.21, отличающаяся тем, что X1 представляет собой OH или гликозид и каждый из X2 и OR1 представляет собой независимо OH или гликозид.
24. Композиция по п.21, отличающаяся тем, что соединение представляет собой астрагалозид IV 16-он.
25. Фармацевтическая композиция, содержащая соединение формулы I в фармацевтически приемлемом носителе
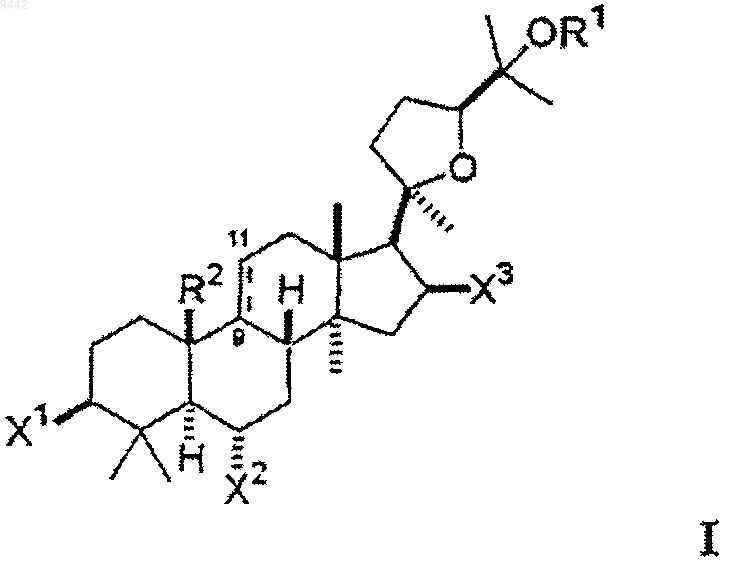
где один из X1 и X2 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, и кето, а другой представляет собой гликозид и
каждый из X3 и OR1 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; и
R2 представляет собой метил и ---- представляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
26. Композиция по п.25, отличающаяся тем, что соединение включает 1 гликозид, который не замещен дополнительным гликозидом.
27. Композиция по п.25, отличающаяся тем, чтю R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и ---- представляет собой простую связь между 9 и 11 атомами углерода.
28. Композиция по п.25, отличающаяся тем, что соединение выбрано из циклоастрагенол 6-b-D-глюкопиранозида и циклоастрагенол 3-b-D-ксилопиранозида.
29. Фармацевтическая композиция, содержащая соединение формулы II в фармацевтически приемлемом носителе
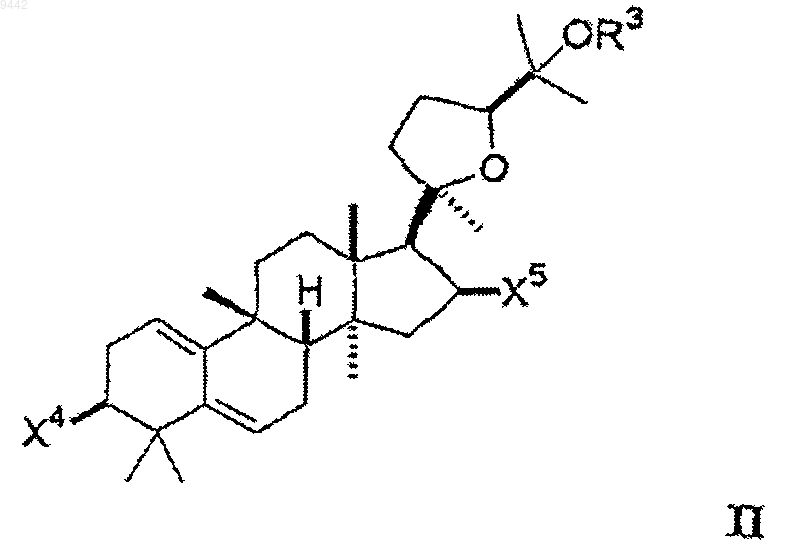
где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида, и
OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида.
30. Композиция по п.29, отличающаяся тем, что каждый из X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O).
31. Композиция по п.30, отличающаяся тем, что X4 представляет собой OH или гликозид и каждый из X5 и OR3 представляет собой OH.
32. Способ лечения острого или хронического состояния эпидермиса, включающий контактирование эпидермальных клеток с наносимым местно составом выделенного соединения формулы I по п.1, или формулы II по п.8, или формулы III по п.12.
33. Способ по п.32, отличающийся тем, что соединение имеет формулу I или формулу II.
34. Способ по п.32, отличающийся тем, что указанное острое или хроническое состояние выбрано из группы, включающей рану, ожог, ссадину, надрез, имплантацию, повреждение, вызванное инфекционным агентом, хроническую венозную язву, диабетическую язву, компрессионную язву, рану от сдавления, язву слизистой оболочки и келоидное образование.
35. Фармацевтическая композиция, содержащая наносимый местно состав выделенного соединения формулы I по п.1, или формулы II по п.8, или формулы III по п.12.
36. Композиция по п.35, отличающаяся тем, что соединение имеет формулу I или формулу II.
37. Композиция по п.35, отличающаяся тем, что соединение присутствует в составе в концентрации по крайней мере 0,1% (вес./об.).
38. Применение соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 для изготовления лекарственного средства для лечения заболевания путем увеличения активности теломеразы в клетке или ткани.
39. Применение по п.38, отличающееся тем, что заболевание представляет собой ВИЧ-инфекцию или дегенеративное заболевание.
40. Применение по п.39, отличающееся тем, что заболевание представляет собой ВИЧ.
41. Применение по п.39, отличающееся тем, что дегенеративное заболевание выбрано из группы, включающей нейродегенеративное заболевание, дегенеративное заболевание костей или суставов, дистрофию жёлтого пятна сетчатки, атеросклероз и анемию.
42. Применение соединения формулы I по п.1, формулы II по п. 8 или формулы III по п.12 для изготовления лекарственного средства для лечения хронических или острых состояний эпидермиса.
43. Применение по п.42, отличающееся тем, что острое или хроническое состояние выбрано из группы, включающей рану, ожог, ссадину, надрез, имплантацию, повреждение, вызванное инфекционным агентом, хроническую венозную язву, диабетическую язву, компрессионную язву, рану от сдавления, язву слизистой оболочки и келоидное образование.
44. Применение по п.38 или 42, отличающееся тем, что соединение имеет формулу I или формулу II.
45. Способ повышения репликативной способности клеток in vitro или ex vivo, включающий контактирование клеток с соединением формулы I по п.1, формулы II по п.8 или формулы III по п.12, взятым в количестве, эффективном для увеличения активности теломеразы в указанных клетках.
46. Способ по п.45, отличающийся тем, что соединение имеет формулу I или формулу II.
47. Способ по п.45, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6-b-D-глюкопиранозида, циклоастрагенол 3-b-В-ксилопиранозида и 20R, 24S-эпокси-3b,16b,25-тригидрокси-9b-метил-19-норланост-1,5-диена.
48. Способ по п.45, отличающийся тем, что указанные клетки представляют собой эксплантантные клетки, полученные от пациента.
49. Способ по п.45, отличающийся тем, что указанные клетки представляют собой стволовые клетки.
50. Способ по п.45, отличающийся тем, что указанные клетки представляют собой ВИЧ-рестриктированные CD8+ клетки.
51. Способ выбора соединения, эффективного для увеличения активности теломеразы в клетке, включающий тестирование производного соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 на способность увеличения активности теломеразы в кератиноцитах или фибробластах в TRAP-тестах и выбор производного, если оно является эффективным, с точки зрения увеличения уровня активности теломеразы в кератиноцитах или фибробластах, при концентрации 1 мкг/мл в растворителе по крайней мере на 50% выше по сравнению с измеренной в указанных клетках, обработанных растворителем.
52. Способ по п.51, отличающийся тем, что указанное производное выбирают по эффективности повышать уровень активности теломеразы в кератиноцитах или фибробластах в TRAP-тестах при концентрации 1 мкг/мл в растворителе по крайней мере на 100% выше по сравнению измеренной в указанных клетках, обработанных указанным растворителем.
53. Способ выбора агента для лечения острых или хронических состояний эпидермиса, включающий тестирование производного соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 для повышения активности заживления раны, в тесте с царапиной на кератиноцитах или фибробластах, и выбор производного, обладающего активностью заживления раны, при концентрации 1 мкг/мл по крайней мере на 50% выше, чем у контроля с растворителем.
54. Способ по п.53, отличающийся тем, что указанное производное выбирается, если оно обладает активностью заживления раны, как установлено в тестах с царапиной, при концентрации 1 мкг/мл по крайней мере на 100% выше, чем у контроля с растворителем.
55. Композиция биологически активной добавки, содержащая биологически активный состав соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12.
56. Композиция по п.55, отличающаяся тем, что соединение имеет формулу I или формулу II.
57. Композиция по п.56, отличающаяся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6-b-D-глюкопиранозида, циклоастрагенол 3-b-D-ксилопиранозида и 20R,24S-эпокси-3b,16b,25-тригидрокси-9b-метил-19-норланост-1,5-диена.
58. Композиция по п.55, отличающаяся тем, что состав биологически активной добавки содержит дополнительно к соединению биологически активную добавку травяного экстракта.
59. Соединение формулы II
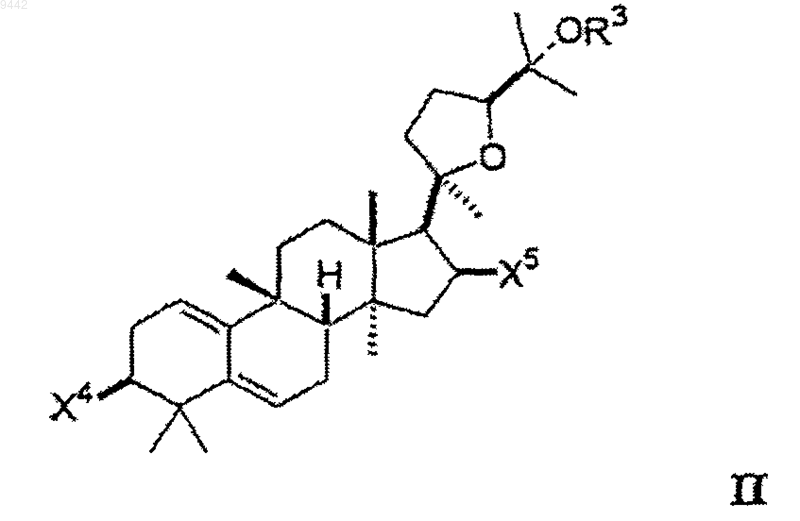
где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и
OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида;
где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом.
60. Соединение по п.59, отличающееся тем, что каждый из X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилоксш ш гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O).
61. Соединение по п.59, отличающееся тем, что X4 представляет собой OH или гликозид и каждый из X5 и OR3 представляет собой OH.
62. Соединение по п.61, отличающееся тем, что X4 представляет собой OH.
Текст
009442 Область изобретения Настоящее изобретение относится к способам и композициям для индуцирования активности теломеразы в клетках. Предшествующий уровень техники Теломераза Теломераза является рибонуклеопротеином, который катализирует присоединение теломерных повторов к концам теломеры. Теломеры - это длинные участки повторяющихся последовательностей, которые покрывают концы хромосом и, как предполагается, стабилизируют хромосому. У человека теломеры обычно имеют длину 7-10 килобаз и содержат множественные повторы последовательности -TTAGGG-. Теломераза не экспрессируется в большинстве зрелых клеток, и длина теломера уменьшается при последовательных циклах репликации. После некоторого числа циклов репликации прогрессивное укорочение теломеров приводит к тому, что клетка вступает в стадию теломерного кризиса, что, в свою очередь, ведет к старению клетки. Ряд заболеваний связан с быстрой потерей теломеров, проявляющейся преждевременным старением клеток. Экспрессия гена, кодирующего белок теломеразы человека в клетках человека, как было показано, приводит к появлению бессмертного фенотипа, предположительно, за счет избежания естественных механизмов старения клетки. Кроме того, экспрессия гена теломеразы в зрелых клетках с укороченными теломерами, как было показано, приводит к увеличению длины теломера и восстановлению фенотипа, обычно присущего более молодым клеткам. Соматические клетки, в отличие от опухолевых клеток и ряда стволовых клеток, демонстрируют низкую активность теломеразы или ее отсутствие и прекращают делиться, когда теломеры укорачиваются,по крайней мере, в некоторых хромосомах до критического уровня, что приводит к запрограммированному клеточному старению (гибели клетки). Так как потеря теломерических повторов в соматических клетках,приводящая к старению, усиливается из-за низкой активности теломеразы, индукция активности теломеразы, которая способствует добавлению множества теломерных повторов к теломерам, тем самым наделяет смертные соматические клетки увеличенной репликативной способностью, а стареющие клетки способностью пролиферировать и выходить из клеточного цикла после восстановления поврежденной ткани. Потенциальный терапевтический эффект от увеличения активности теломеразы в соматических клетках включает, например, лечение СПИДа, который характеризуется ранним старением цитотоксических Т-лимфоцитов (CD8+ клетки), которые ответственны за уничтожение зараженных CD4+ клеток (см.,например, Dagarag et al., 2003); нейропротективное действие у страдающих болезнью Альцгеймера (см.,например, Mattson, 2000); заживление ран и поддержание эксплантированных клеток, таких как клетки коры надпочечников (см., например, Thomas et al., 2000) или клетки костного мозга, стромальные/мезенхимальные клетки трансплантата (см., например, Simonsen et al., 2002). Рассмотрены и другие характеристики теломеразы в таких работах, какshorting and replicative senescence in human osteoblasts, J. Bosle and Mineral Res. 16 (8): 1453-1464 (2001). Способы увеличения активности теломеразы терапевтически были исследованы, например, Bodnar(1997), White (2000), Hannon et al. (1999; 2000), Franzese et al. (2001), and Yudoh et al. (2001) (все приведены выше). В этих работах активность теломеразы обычно увеличивается благодаря сверхэкспрессииhTRT, кодирования генного компонента белка человеческой теломеразы, или экспрессии белков, которые являются промежуточной сборкой теломеразы, например белки теплового шока (белые). Franzese etal. сообщили, что сакунавир, ингибитор протеазы, предназначен для лечения ВИЧ-инфекции, наблюдалась увеличенная активность теломеразы в одноядерных клетках периферической крови; Vasa et al. описали активацию теломеразы и получающейся задержки эндотелиального старения путем введения предшественника окиси азота (NO). Астрагалозиды и гинзенозиды Как сообщают, соединения семейств астрагалозидов и гинзенозидов имеют различные биологические действия. Исследования биологической активности астрагалозидов и гинзенозидов включают, в том числеinischemic rats, Acta Pharmacol. Sin. 23 (10): 898-904 (Oct. 2002). Сущность изобретения Настоящее изобретение, в целом, относится к способам увеличения активности теломеразы в клетках и композициях для применения в таких способах. Такие способы и композиции могут быть использованы в клеточной культуре, то есть in vitro, или ex vivo, или in vivo, такой как выращивание клеток в тканях субъекта, включая людей и нечеловекоподобных животных, в особенности нечеловекоподобных млекопитающих. В особых воплощениях композиции содержат соединение формул I, II или III, как описано ниже. Аспекты изобретения включают составы таких соединений для использования в косметике, в качестве биологически активных добавок (БАД) и для фармацевтических применений, в особенности для применений, где повышение активности теломеразы в клетках должно присутствовать или, как ожидается, будет полезным. Способы использования соединения и его составов для таких применений также обеспечиваются, включая способы нанесения или введения таких составов после того, как была определена необходимость или польза от увеличения активности теломеразы в клетках или тканях. Настоящее изобретение включает, в первом аспекте, способ увеличения активности теломеразы в клетке или ткани. Способ включает контактирование клетки или ткани с составом выделенного соединения формулы I, формулы II или формулы III, представленных ниже. В предпочтительных воплощениях соединения являются соединениями, имеющими формулу I или II, представленные ниже. Способ может,кроме того, включать предварительную стадию идентифицирования клетки или ткани, в которых увеличение активности теломеразы является желательным. В соединениях формулы I каждый из X1, X2 и X3 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида;OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода; или, в предпочтительных воплощениях, R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. Предпочтительно соединение включает 0, 1 или 2, более предпочтительно 0 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом. Предпочтительно гликозиды имеют D (природную) конфигурацию. В выбранных воплощениях в соединениях формулы I каждый X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и X выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида. В дополнительных воплощениях X представляет собой ОН или гликозид, каждый из X2 и OR1 представляет собой независимо ОН или гликозид и X3 представляет собой ОН или кето. Примеры соединений формулы I включают астрагалозид IV, циклоастрагенол, астрагенол, астрагалозид IV 16-он, циклоастрагенол 6D-глюкопиранозид и циклоастрагенол 3D-ксилопиранозид. В выбранных воплощениях соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола и астрагалозид IV 16-она. В одном из воплощений соединение представляет собой астрагалозид IV. В соединениях формулы II каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и OR4 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида, где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом,низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида. Предпочтительно соединение включает 0, 1 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом; гликозиды предпочтительно находятся в D конфигурации. В выбранных воплощениях в соединениях формулы II каждый X4 и OR3 выбран из гидроксигруппы,низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето (=О). В дополнительных воплощениях X4 представляет собой ОН или гликозид и каждый X5 и OR3 представляет собой ОН. В одном из воплощений X4 представляет собой ОН. В соединениях формулы III каждый из X6, X7 и X8 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и OR4 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида,-4 009442 где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида. Предпочтительно соединение включает 0, 1 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом; гликозиды предпочтительно находятся в D-конфигурации. В выбранных воплощениях в соединениях формулы III каждый из X6, X7, X8 и OR4 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и предпочтительно выбран из гидроксигруппы и гликозида. В дополнительных воплощениях каждый X8 и OR4 представляет собой ОН и каждый X6 и X7 независимо выбран из гидроксигруппы и гликозида. Еще в одних дополнительных воплощениях каждый из OR4, X6 и X8 представляет собой ОН и X7 представляет собой гликозид. Примером соединения формулы III является гинсенозид RH1. Предпочтительные соединения формул I, II или III, указанные выше, являются эффективными в случаях, если они входят в состав в растворителе при концентрации 1 мкг/мл или меньше, с точки зрения увеличения уровня активности теломеразы в кератиноцитах или фибробластах, как установлено в TRAPтестах, по крайней мере на 50% выше, чем уровень в указанных клетках, обработанных указанным растворителем, как установлено в TRAP-тестах, описанных в настоящем изобретении. В дополнительных предпочтительных воплощениях соединение является эффективным, с точки зрения увеличения уровня активности теломеразы в кератиноцитах или фибробластах, как установлено в TRAP-тестах, по крайней мере на 100% выше, чем уровень в указанных клетках, обработанных указанным растворителем, как установлено в TRAP-тестах, описанных в настоящем изобретении. Примеры соединений формул I-III включают те, которые представлены на фиг. 1 и обозначены в настоящем изобретении как 1 (астрагалозид IV), 2 (циклоастрагенол), 3 (астрагенол), 4 (астрагалозид IV 16-он), 5 (20R,24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диен), 6 (циклоастрагенол 6D-глюкопиранозид), 7 (циклоастрагенол 3D-ксилопиранозид) и 8 (гинсенозид RH1). В выбранных воплощениях соединение выбрано из тех, которое обозначено в настоящем изобретении как 1 (астрагалозид IV), 2 (циклоастрагенол), 3 (астрагенол), 4 (астрагалозид IV 16-он), 5 (20R,24S-эпокси-3,16,25 тригидрокси-9-метил-19-норланост-1,5-диен), 6 (циклоастрагенол 6D-глюкопиранозид) и 7 (циклоастрагенол 3D-ксилопиранозид). В дополнительных воплощениях соединение выбрано из тех, которые обозначены в настоящем изобретении как 1, 2, 3, 4 и 5. В одном из воплощений соединение представляет собой астрагалозид IV (1) или циклоастрагенол (2). Способ контактирования состава выделенного соединения формул I, II или III с клеткой или тканью может включать перед указанным контактированием идентификацию клетки или ткани, в которых увеличение активности теломеразы желательно. Польза, которая может быть получена от повышения активности теломеразы в клетке или ткани, заключается, например, в увеличении репликативной способности и/или продолжительности жизни указанной клетки или клеток в указанной ткани. Способ может включать диагностику состояния субъекта так, что повышение активности теломеразы в клетках или ткани субъекта является желательным и состав вводят субъекту. Субъект является предпочтительно млекопитающим, таким как человек или пациент. Такие состояния могут включать,например, ВИЧ-инфекцию, различные дегенеративные заболевания, такие как нейродегенеративное заболевание, дегенеративное заболевание костей или суставов, дистрофию желтого пятна (сетчатки), атеросклерозы и анемию. Такие состояния также включают наличие раны или другие острые или хронические состояния эпидермиса, такие как, например, ожог, ссадина, надрез, имплантация, повреждение, вызванное инфекционным агентом, хроническая венозная язва, диабетическая язва, компрессионная язва,рана от сдавления, язва слизистой оболочки и келоидное образование. Соответственно, изобретение обеспечивает способы лечения состояний пациента, таких как описанные выше, путем увеличения активности теломеразы в клетках или ткани пациента, заключающиеся во введении пациенту, нуждающемуся в таком лечении, состава выделенного соединения формулы I,формулы II или формулы III, как определено выше. Композиции могут быть введены различными путями, например орально, местно или парентерально. Изобретение, кроме того, обеспечивает способ диагностирования у субъекта состояния заболевания для лечения путем увеличения активности теломеразы в клетке или ткани субъекта за счет введения соединения формул I, II или III, как описано выше, предпочтительно соединения формулы I или II, в фармацевтическом носителе субъекту, нуждающемуся в таком лечении. Дополнительный аспект изобретения обеспечивает способ лечения острого или хронического состояния эпидермиса, включающий контактирование эпидермальных клеток с составом для местного нанесения, выделенного соединения формулы I, формулы II или формулы III, как определено выше. В предпочтительных воплощениях соединение имеет формулу I или формулу II. В дополнительных воплощениях соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16 она, циклоастрагенол 6D-глюкопиранозида, циклоастрагенол 3D-ксилопиранозида и 20R,24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диена (обозначен в настоящем изобретении как соединение 5).-5 009442 Клетки, с которыми составы контактируют, могут также включать эксплантат клеток, который взаимодействует ex vivo, например, для терапий, основанных на клетке, или других клеток в культуре. Соответственно, изобретение обеспечивает способ повышения репликативной способности клетокin vitro или ex vivo, включающий контактирование указанных клеток с эффективным количеством композиции, содержащей соединение формулы I, формулы II или формулы III, как определено выше, включая выбранные воплощения соединений, как определено выше. В предпочтительных воплощениях соединение имеет формулу I или формулу II, включая выбранные воплощения соединений, как определено выше. В целом, клетки относятся к нетрансформируемым клеткам млекопитающих; в выбранных воплощениях клетки представляют собой стволовые клетки, такие как стволовые клетки костного мозга,стромальные клетки костного мозга, молодые или ранние фибробласты кожи, ответственные за прохождение, предшественники инсулоцитов, нейросферические клетки, адренокортикальные клетки, мышечные, насыщенные сателлитные клетки, остеопластические, ретинальные пигментированные эпителиальные клетки и ВИЧ-ограниченные CD8+ клетки. В родственном аспекте изобретение охватывает фармацевтическую композицию, содержащую в фармацевтически приемлемом носителе соединение формулы I, как изображено выше, где каждый из X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида;OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода; или в предпочтительных воплощениях R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. Предпочтительно соединение включает 0, 1 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом, и гликозиды находятся в D-конфигурации. В выбранных воплощениях композиции X1 представляет собой ОН или гликозид и каждый из X2 и 1OR независимо представляет собой ОН или гликозид. В одном из воплощений соединение представляет собой астрагалозид IV 16-он (обозначен в настоящем изобретении как соединение 4). Альтернативно, композиция содержит в фармацевтически приемлемом носителе соединение формулы I, как представлено выше, где один из X1 и X2 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето, а другой представляет собой гликозид; и каждый из X3 и OR1 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода; или в предпочтительных воплощениях R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. Предпочтительно соединение включает 1 гликозид, который не является замещенным дополнительным гликозидом и который находится в D-конфигурации. В одном из воплощений соединение выбрано из циклоастрагенол 6D-глюкопиранозида (обозначен в настоящем изобретении как 6) и циклоастрагенол 3D-ксилопиранозида (обозначен в настоящем изобретении как соединение 7). Альтернативно, фармацевтическая композиция содержит в фармацевтически приемлемом носителе соединение формулы II, как определено выше. Выбранные воплощения соединения также определены выше. В одном из воплощений соединение является тем, которое обозначено в настоящем описании как соединение 5. Изобретение также включает в себя соединения формулы II, как определено выше, включая выбранные воплощения, как определено выше. В одном из воплощений соединение является тем, которое обозначено в настоящем описании как соединение 5. В родственном аспекте изобретение включает фармацевтические составы для местного нанесения выделенного соединения формулы I, формулы II или формулы III, как определено выше. Выбранные воплощения соединения также определены выше. В предпочтительных воплощениях соединение имеет формулу I или формулу II. В дополнительных воплощениях соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6D-глюкопиранозида, циклоастрагенол 3D-ксилопиранозида и 20R,24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диена (обозначен в настоящем изобретении как соединение 5). Обычно состав для местного нанесения содержит один или большее количество компонентов, выбранных из группы, содержащей эмульгатор, загуститель и смягчитель кожи.-6 009442 Такие композиции могут быть использованы для лечения ран или других острых или хронических состояний эпидермиса. Еще в одном родственном аспекте изобретение охватывает БАД-композиции, содержащие БАДсоставы выделенного соединения формулы I, формулы II или формулы III, как определено выше. Выбранные воплощения соединений также определены выше. В предпочтительных воплощениях соединение имеет формулу I или II, включая выбранные воплощения, как определено выше. В дополнительных воплощениях соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6D-глюкопиранозида, циклоастрагенол 3D-ксилопиранозида и 20R,24Sэпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диена (обозначен в настоящем изобретении как соединение 5). В дополнительных воплощениях БАД-составы содержат, в добавление к выделенному соединению формул I, II или III, БАД травяного экстракта, который может быть экстрактом Astragalusmembranaceus. Выделенное соединение формул I, II или III, как определено выше, включая выбранные воплощения, как описано выше, может также быть применено для получения лекарственного средства для лечения заболевания за счет увеличения активности теломеразы в клетке или ткани. Примеры таких заболеваний рассмотрены более детально ниже. Аналогично, выделенное соединение формул I, II или III, как определено выше, включая выбранные воплощения, как описано выше, может также быть применено для получения лекарственного средства для лечения хронического или острого состояния эпидермиса. В предпочтительных воплощениях таких применений выделенное соединение имеет формулу I или II,включая выбранные воплощения формулы I или II, как описано выше. Также предложен способ отбора соединения, эффективного для увеличения активности теломеразы в клетке. В соответствии с этим способом производное соединения формулы I, формулы II, формулы III,как определено выше, проверяют на его способность увеличивать активность теломеразы в кератиноцитах или фибробластах, как установлено в TRAP-тестах, описанных в настоящем изобретении. Производное выбирают таким образом, что его вводят в растворитель при концентрации 1 мкг/мл или меньше, оно является эффективным, поскольку обеспечивает уровень активности теломеразы в кератиноцитах или фибробластах, как установлено в TRAP-тестах, по крайней мере на 50% выше и предпочтительно по крайней мере на 100% выше, чем тот, который измерен в указанных клетках, обработанных указанным растворителем. Производное может затем быть составлено с фармацевтическим или БАД-носителем для местного нанесения. Также предлагается в родственном аспекте способ выбора агента для лечения острых или хронических состояний эпидермиса. В соответствии с этим способом производное соединения формулы I, формулы II, формулы III, как определено выше, проверяют на активность при заживлении раны в кератиноцитах или фибробластах в тестах с царапиной, описанных в настоящем изобретении. Производное выбирают, если оно имеет активность при заживлении раны, как установлено в тестах с царапиной, при концентрации 1 мкг/мл по крайней мере на 50% выше, чем с контрольным растворителем, предпочтительно по крайней мере на 100% выше, чем с контролем с растворителем. Производное может затем быть составлено с носителем для местного нанесения. Эти и другие объекты и особенности изобретения станут полностью очевидными в последующем подробном описании изобретения с сопроводительными фигурами. Краткое описание фигур Фиг. 1 А-Н демонстрируют структуры конкретных соединений для применения в способах и композициях, описанных в настоящем изобретении. Фиг. 2 демонстрирует увеличение активности теломеразы в неонатальных кератиноцитах при обработке их с помощью соединения 2 (циклоастрагенол), как установлено в TRAP-тестах. Фиг. 3 демонстрирует увеличение активности теломеразы в неонатальных кератиноцитах при обработке с помощью соединения 1 (астрагалозид IV) по сравнению с EGF (10 нМ) и контролем при обработке растворителем, как установлено в TRAP-тестах. Фиг. 4 представляет собой серию полученных на компьютере изображений, демонстрирующих активность соединения 1 (астрагалозид IV) при заживлении раны в созревших взрослых кератиноцитах,как установлено в тестах с царапиной. Фиг. 5 представляет собой серию полученных на компьютере изображений, демонстрирующих активность соединения 1 (астрагалозид IV) и соединения 2 (циклоастрагенол) при заживлении раны в молодых неонатальных кератиноцитах. Фиг. 6 представляет собой серию полученных на компьютере изображений, демонстрирующих активность соединения 1 (астрагалозид IV) при заживлении раны в созревших кератиноцитах, самих по себе и в присутствии теломеразы, ингибирующей олигонуклеотид (GRN163) или контрольный олигонуклеотид (GRN137227). Фиг. 7 представляет собой график активности соединения 1 (астрагалозид IV) при заживлении раны в созревших неонатальных кератиноцитах в присутствии и в отсутствие ингибитора теломеразы GRN163 и по сравнению с 2 нМ PDGF (фактор роста тромбоцитпроизводного).I. Определения. Следующие термины, используемые в настоящем изобретении, имеют значение, представленное ниже, если иное не заявлено. Общий атом углерода для нумерации схемы, используемый для номенклатуры соединений, описан ниже. (Следует заметить, что соединения структуры II не имеют углерод под номером 19, а соединения структуры III не имеют углерод под номером 18, показанный на этой схеме. Таким образом, схема с проставленными номерами атомов не подразумевает ограничения композиций по изобретению.) Термин алкил относится к полностью насыщенному ациклическому моновалентному радикалу,содержащему атомы углерода и водорода, который может иметь разветвленную или линейную структуру. Примеры алкильных групп включают метил, этил, н-бутил, трет-бутил, н-гептил и изопропил. Алкокси относится к группе формулы OR, где R представляет собой алкил, как определено выше. Ацилокси относится к группе формулы -OC(=O)R, где R представляет собой алкил, как определено выше. Таким образом, ацил относится к группе -C(=O)R. Термин низший алкил (или низший алкокси, или низший ацилоки) относится к таким группам,которые имеют от 1 до 6 атомов углерода; в выбранных воплощениях такие группы включают от 1 до 4 атомов углерода, 1 или 2 атома углерода или 1 атом углерода (то есть метил, метокси, ацетилокси). Термин стволовые клетки относится к относительно недифференцированным клеткам, имеющим общее происхождение, которые сохраняют способность к делению и прохождению циклов в течение всей постнатальной жизни, чтобы обеспечить клетки, которые могут в дальнейшем отличаться и становиться специализированными (например, стволовые клетки в нижнем слое кожи или в кроветворной ткани,такие как простейшие клетки в костном мозге, из которого получают все различные виды клеток крови). Термин эффективное для повышения активности теломеразы в клетке со ссылкой на соединение обозначает, что композиция, содержащая соединение в концентрации 1 мкг/мл или меньше, является эффективной для обеспечения уровня активности теломеразы в клетке кератиноцита или фибробласта, как установлено в TRAP-тестах, описанных в настоящем изобретении, который является выше на порядок, по крайней мере равный 1,5 (то есть по крайней мере на 50% выше), чем уровень, достигаемый с помощью аналогичного состава, не содержащего соединение, как установлено в TRAP-тестах. В предпочтительных воплощениях соединение является эффективным при концентрации 1 мкг/мл или меньше для достижения уровня активности теломеразы в такой клетке, как установлено в TRAP-тестах, описанных в настоящем изобретении, который является более высоким на порядок, по крайней мере равный 2 (то есть по крайней мере на 100% выше), чем уровень, получаемый с помощью аналогичного состава, не содержащего соединения. При ссылке, касающейся введения соединения пациенту, термин в эффективном количестве относится к количеству, эффективному для повышения активности теломеразы в клетках или ткани пациента, такому, которое приводит к желаемому терапевтическому результату. При ссылке, касающейся обработки клеток in vitro или ex vivo, термин эффективное количество относится к количеству, эффективному для повышения активности теломеразы в клетках, что тем самым увеличивает репликативную способность и/или отрезок жизни клеток. Концентрации выражены в настоящем описании как % (вес/об.), 100% (вес/об.), что соответствует 1 г раствора/мл растворителя. Например, 0,1% (вес/об.)=1 мг/мл. Термин состав выделенного соединения относится к составу, полученному путем комбинирования выделенного соединения с одним или большим количеством других ингредиентов (которые могут быть активными или пассивными ингредиентами), что приводит к получению указанного состава. Если соединение непосредственно очищают из природного источника, определение выделенное соединение предполагает, что соединение (до образования состава) было очищено не менее чем в кратность 100 раз по сравнению с чистотой соединения в природном источнике. Если соединение не очищают непосредственно из природного источника, определение выделенное соединение относится к соединению, которое (до образования состава) получают с помощью способа, включающего одну или большее количество химических стадий синтеза, заканчивающихся в приготовлении соединения, чистота которого не менее чем 5% (вес/вес).II. Способы и композиции для увеличения активности теломеразы. В соответствии с настоящим изобретением обеспечиваются композиции и способы для увеличения активности теломеразы в клетке. В соответствии со способом клетка или ткань контактирует с составом-8 009442 выделенного соединения формул I, II или III, как раскрыто в настоящем изобретении, взятом в количестве, эффективном для повышения активности теломеразы в клетке или ткани, относительно уровня активности теломеразы в клетке или ткани при отсутствии соединения. Способ может также включать предварительную стадию идентифицирования клетки или ткани, для которого ожидается повышение активности теломеразы. В одном из воплощений соединение представлено формулой I В формуле I каждый из X1, X2, и X3 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида, а группа OR1 выбрана из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида. В выбранных воплощениях каждый из X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида. В выбранных воплощениях в соединениях формулы I R2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода, как представлено. В других воплощениях R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода, как показано например, в соединении 1 (см. фиг. 1). Термин гликозид, как используют в настоящем изобретении, относится к любому соединению формул I, II или III (или их производным) и обозначает один из известных гликозидов (то есть рибозид,арабинозид, ксилозид, ликсоозид, альтрозид, глюкозид, маннозид, гулозид, идозид, галактозид и талозид). Гликозид обычно находится в форме шестичленного кольца (пиранозы), например глюкопиранозида или маннопиранозида. В выбранных воплощениях гликозид представляет собой D-гликозид; такой,который имеет конфигурацию, встречающуюся в природных моносахаридах. Конкретные примеры включают D-рибопиранозид, D-арабинопиранозид, D-ксилопиранозид, D-глюкопиранозид, маннопиранозид и D-галактопиранозид. Предпочтительные гликозиды включают D-глюкопиранозид и D-ксилопиранозид. В дополнительных воплощениях связь имеет -конфигурацию; например -D-глюкопиранозид. Любые свободные гидроксильные группы на гликозидном кольце, находящиеся в соединениях по изобретению формул I, II или III (или их производных), могут быть, кроме того, замещены с помощью дополнительного гликозида, низшего алкила или низшегом ацила, например метокси или ацетилокси. Предпочтительно по крайней мере одна такая гидроксильная группа замещена дополнительным гликозидом. Более предпочтительно ни одна такая гидроксильная группа не замещена дополнительным гликозидом; то есть замещение осуществляется низшим ацилом, таким как ацетил, или низшим алкилом,таким как метил. В одном из воплощений все гидроксильные группы на гликозиде(ах) незамещен(а)ы. Предпочтительно соединение по изобретению формул I, II или III (или их производные) включает,максимум, 3 гликозида, более предпочтительно, максимум, 2 гликозида. В выбранных воплощениях соединение включает 0, 1 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом. В последующих выбранных воплощениях, в особенности, что касается соединения формулы I, соединение включает 0 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом. В выбранных воплощениях в соединении формулы I каждый из X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, глюкопиранозида и ксилопиранозида и X3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето, глюкопиранозида и ксилопиранозида, предпочтительно из гидроксигруппы, низшего алкокси, низшего ацилокси и кето. В дополнительных воплощениях в соединении формулы I X1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и -D-ксилопиранозида; X2 выбран из гидроксигруппы, низшего алкокси,низшего ацилокси и -D-глюкопиранозида; X3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето (=О); и OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и -D-глюкопиранозида. В последующих выбранных воплощениях в соединении формулы I X1 представляет собой ОН или гликозид, каждый из X2 и OR1 независимо представляет собой ОН или гликозид и X3 представляет собой ОН или кето. В дополнительных воплощениях каждый из X1 и X2 представляет собой ОН или гликозид,OR1 представляет собой ОН и X3 представляет собой ОН. Еще в одних дополнительных воплощениях X1 представляет собой -D-ксилопиранозид, X2 представляет собой -D-глюкопиранозид, OR1 представляет-9 009442 собой ОН и X3 представляет собой ОН. В другом воплощении каждый из X1, X2, X3 и OR1 представляет собой ОН. Для каждого из этих описанных воплощений последующие воплощения включают соединения, в которых R2 представляет собой метил ипредставляет собой двойную связь, и другие воплощения, в целом предпочтительно, включают соединения, в которых R2 образует с 9 атомом углерода конденсированное циклопропильное кольцо. Примеры соединений структуры I для применения в способах по изобретению включают те, которые показаны на фиг. 1, и обозначены в настоящем изобретении как 1 (астрагалозид IV), 2 (циклоастрагенол), 3 (астрагенол), 4 (астрагалозид [V 16-он), 6 (циклоастрагенол 6D-глюкопиранозид) и 7 (циклоастрагенол 3D-ксилопиранозид). Другие соединения, имеющие структуру основной цепи циклоастрагенола (2), замещенную 3Dглюкопиранозидом, также рассмотрены с точки зрения применения в способах изобретения. Предпочтительно соединение включает общее количество из 1 или 2 гликозидов, присоединенных к отдельным атомами углерода структуры остова (то есть 1 гликозид неприсоединен к дополнительному гликозиду). Примеры включают природные соединения, такие как астрагалозиды А, 1, 2, и 7, так же, как и астраверруцины I и II (которые могут быть выделены из Astragalus verrucosus). Изобретение также обеспечивает фармацевтические композиции, содержащие один или большее количество соединений формулы I, где один из X1 и X2 выбран из гидроксигруппы, низшего алкокси,низшего ацилокси и кето, а другой представляет собой гликозид. В дополнительных воплощениях соединения выбраны из тех, которые обозначены 6 и 7. В других воплощениях фармацевтическая композиция включает соединение формулы I, в которой X3 представляет собой кето; в одном из воплощений соединение представляет собой соединение, обозначенное как 4. В другом аспекте изобретение обеспечивает фармацевтические композиции, содержащие соединения, представленные формулой II В формуле II каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где гликозид и его различные воплощения описаны выше. Как отмечено выше, соединение включает, максимум, 3 гликозида, более предпочтительно, максимум, 2 гликозида. В выбранных воплощениях соединение включает 0, 1 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом. В выбранных воплощениях в соединениях формулы II X4 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида. В дополнительных воплощениях каждый из X4, X5, и OR3 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, глюкопиранозида и ксилопиранозида. В дополнительных воплощениях в соединении формулы II каждый из X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида, предпочтительно D-ксилопиранозида или Dглюкопиранозида, и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето (=О). Предпочтительно в этих воплощениях, OR3 выбран из гидроксигруппы, низшего алкокси и низшего ацилокси и более предпочтительно из гидроксигруппы. В дополнительных воплощениях в соединении формулы II каждый из X4, X5, и OR3 представляет собой независимо ОН или гликозид, например D-ксилопиранозид или D-глюкопиранозид. Еще в одних дополнительных воплощениях X4 представляет собой ОН или гликозид и каждый из X5 и OR3 представляет собой ОН. В одном из воплощений каждый из X4, X5 и OR3 представляет собой ОН. Это соединение(формально названное 20R,24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диен) обозначено в настоящем описании как 5. Изобретение также обеспечивает соединения формулы II, приведенные выше, где каждый из X4 и 5X независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида, где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом. В выбранных воплощениях соединение содержит 0, 1 или 2 гликозида. Предпочтительно каждый указанный гликозид, если он присутствует, находится в D-конфигурации. В дополнительных воплощениях каждый из X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и- 10009442 гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето (=О). Еще в одних дополнительных воплощениях X4 представляет собой ОН или гликозид и каждый из X5 и OR3 представляет собой ОН. В одном из воплощений каждый из X4, X5, и OR3 представляет собой ОН; то есть соединение обозначено в настоящем описании как 5. Дополнительный аспект изобретения обеспечивает способ увеличения теломеразы в клетке или ткани при контакте клетки или ткани с составом выделенного соединения формулы III. Кроме того, способ может включать стадии идентифицирования клетки или ткани, для которых повышение активности теломеразы является желательным. В формуле III каждый из X6, X7, X8 и OR4 независимо выбран из гидроксигруппы, низшего алкокси,низшего ацилокси, кето и гликозида, где гликозид и его воплощения определены выше. Предпочтительно соединение включает, максимум, 2 гликозида, более предпочтительно, максимум, 1 гликозид, ни один из которых не замещен дополнительным гликозидом. Предпочтительно гликозиды включают Dглюкопиранозид и D-ксилопиранозид. В выбранных воплощениях структуры III каждый из X6, X7, X8 и OR4 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и предпочтительно выбран из гидроксигруппы и гликозида. В дополнительных воплощениях структуры III каждый из X8 и OR4 представляет собой ОН и каждый из X6 и X7 независимо выбран из гидроксигруппы и гликозида, например -D-глюкопиранозида. В дополнительных воплощениях OR4 представляет собой ОН. Предпочтительно каждый из X6 и X8 представляет собой также ОН и X7 представляет собой гликозид. Типичным соединением структуры III является гинсенозид RH1, обозначенный в настоящем описании как 8.III. Источники и синтез соединений формул I-III. Соединения формулул I, II и III могут, как правило, быть выделены или синтезированы из природных продуктов. Например, астрагалозиды I-VII могут быть выделены из корня Astragalus membranaceus,как описано, например, у A. Kadota et al., JP Kokai No. 62012791 A2 (1987). Как сообщается в указанной ссылке, корневую ткань полезной травы (8 кг), которая является коммерчески доступной из различных источников, нагревают при температуре кипения с обратным холодильником с МеОН и концентрированный экстракт (200 г) повторно растворяют в MeOH и разделяют на фракции с помощью хроматографии на колонке с силикагелем, используя смесь CHCl3/MeOH/Н 2 О в качестве элюантов. Каждую фракцию обрабатывают с помощью реверсивной хроматографии на силикагеле, используя аналогичные смеси растворителей, что дает затем приблизительные количества выделенных соединений: ацетиластрагалозид I (0,2 г), астрагалозид I (3,5 г), изоастрагалозид I (0,3 г), астрагалозид II (2,3 г), астрагалозид III (1,0 г),астрагалозид IV (0,8 г), астрагалозид V (0,1 г), астрагалозид VI (0,3 г) и астрагалозид VII (0,1 г). См. также Kitagawa et al., Chem. Phare. Bull. 31 (2): 698-708 (1983b). Астрагалозид IV (обозначенный в настоящем описании как 1) также получают в соответствии с описанием у Ai Chunmei, Chengdu 610041, P.R. China. Циклоастрагенол (2) может быть получен путем обработки астрагалозида IV (1) метанольным раствором HCl с последующей нейтрализацией, обычной обработкой и очисткой с помощью хроматографии, как описано в экспериментальной части ниже (пример 1). Циклоастрагенол может также быть получен с помощью окислительного разрушения (обработка кислородом и элементарным натрием) бутанольного экстракта Astragalus membranaceus, как описано у Р.-Н. Wang et al., J. Chinese Chem. Soc. 49: 103-6 (2002). Астрагенол (3) и циклоастрагенол (2) могут также быть получены в соответствии с методикой, описанной у Kitagawa et al., Chez. Pharm. Bull. 31 (2): 689697 (1983a). Соединения, обозначенные в настоящем описании как 6 (циклоастрагенол 6D-глюкопиранозид) и 7 (циклоастрагенол 3D-ксилопиранозид), получают нагреванием до температуры кипения с обратным холодильником раствора астрагалозида IV (1) и серной кислоты в метаноле с последующей обычной обработкой и хроматографией с силикагелем, как описано в экспериментальной части ниже (пример 2). Также получают перегруппированный продукт 5 и агликон, то есть циклоастрагенол (2). 16-Кето-соединение 4 получают путем ацетилирования гликозидных гидроксильных групп астрагалозида IV с последующем окислением хлорхроматом пиридиния 16-гидроксила и восстановлением гликозидных гидроксилов обработкой боргидридом натрия (см. Kitagawa et al., 1983b, приведен выше).- 11009442 Различные воплощения соединений формул I-III, например соединений, имеющих различные степени алкилирования или ацилирования, или кетогрупп, могут быть получены в соответствии с известными способами органического синтеза с использованием природных и/или коммерчески доступных исходных продуктов, таких как циклоастрагенол, астрагенол, астрагалозиды, или астраверруцины, или панаксатриол, с отделением продуктов при необходимости. Некоторые примеры приведены в экспериментальной части ниже. Например, менее стерически затруднены 3-, 6-, и/или 16-гидроксильные группы,которые могут, в общем, быть селективно модифицированы, например, путем ацилирования. При необходимости непрореагировавшие гидроксильные группы могут затем быть отдельно модифицированы,например, путем алкилирования с последующим необязательным удалением ацильных групп. Соединения формулы I, имеющие конденсированное циклопропильное кольцо (например, циклоастрагенолы),могут быть превращены в соединения, имеющие 19-метильную группу и 9-11 двойную связь (например,астрагенолы) обработкой серной кислотой. Эти реакции могут сопровождаться дегликозилированием,как показано в реакциях соединений по примерам 9 В и 10 В ниже.IV. Определение биологической активности. А. Протокол теста TRAP. Способность соединения увеличивать активность теломеразы в клетках может быть определена с помощью TRAP (Telomeric Repeat Amplification Protocol - протокол амплификации теломерических повторов) теста, известного специалистам данной области (например, Kim et al., U.S. 5629154; Harley et al.,U.S. 5891639). Фраза теломеразная активность, измеренная в TRAP-тесте означает, что теломеразная активность измерялась в кератиноцитах или фибробластах в соответствии со следующим протоколом. Эта активность обычно сравнивается с активностью, измеренной таким же образом в контрольном тесте на таких же клетках (например, теломеразная активность на 50% выше, чем наблюдаемая в контроле с растворителем). Клеточные линии, подходящие для использования в тесте, предпочтительно нормальные фибробласты человека (NHF) или нормальные кератиноциты человека (NHK) могут быть получены в коммерческих фирмах, таких как Cascade Biologies, Portland, OR или 4 С Biotech, Seneffe, Belgium или из АТСС(American Type Culture Collection). АТСС нормальные фибробласты человека, которые могут быть найдены на web-сайте АТСС, включают, например, CCL135, CCL137 и CCL151. Клетки высевали в количестве приблизительно 5000 клеток на лунку в среду для роста (например,Epi-Life Medium + Keratinocyte Growth Factor Supplement + 60 мМ CaCl2, поставляемые Cascade Biologies,Inc.) на 2 дня. Тестируемые соединения в подходящем растворителе, таком как 95% этанол или ДМСО,добавляли в выбранные лунки в разных концентрациях и инкубировали 16-24 ч. Приведенные здесь данные получены с использованием в качестве растворителя ДМСО. Лизирующий клетки раствор изготавливали добавлением 3,0 мл Nonidet P40, 1,0 мл CHAPS лизис буфера (см. ниже) и 1,0 мл 10 х TRAP буфера (см. ниже) к 5,0 мл воды, свободной от ДНКазы и РНКазы. Вода, свободная от ДНКазы и РНКазы, может быть получена путем обработки DEPC (диэтилпирокарбонатом) или приобретена у коммерческих фирм, таких как Sigma). Морфология обработанных клеток вначале изучается под микроскопом, чтобы подтвердить, что нет визуальных признаков нерегулярного роста. Среду удаляли из лунок, клетки ополаскивали дважды в PBS(без ионов кальция и магния). Лабораторную посуду охлаждали, предпочтительно на льду, затем к клеткам добавляли лизис буфер (см. ниже) (приблизительно 100 мкл в каждую лунку) и пипетировали. Затем клетки инкубировали на льду в течение 1 ч.CHAPS детергент добавляли непосредственно перед применением лизис-буфера. Кроме того,AEBSF (4-(2-аминоэтил)-бензолсульфонилфторид HCl) добавляли в лизис-буфер непосредственно перед экстракцией. Следующие компоненты смешивали для получения основной PCR смеси. Из расчета конечного объема 40 мкл PCR смеси и 10 мкл лизата клеток = 50 мкл.PCR смесь включает следующие компоненты: праймер Cy5-TS, 5'-Су 5-меченый олигонуклеотид,имеющий последовательность 5'-ААТ CCG TCG AGC AGA GTT-3' (SEQ ID NO: 1), которая является субстратом теломеразы. В зависимости от активности теломеразы в среде теломерные повторы (имеющие последовательность AGGGTT) будут добавляться к субстрату до образования удлиненных теломеразных продуктов, также называемых теломеразными продуктами или TRAP-продуктами. Праймер АСХ, имеющий последовательность 5'-GCG CGG СТТ АСС СТТ АСС СТТ АСС СТА ACC-3' (SEQ IDNO: 2), является якорным обратным праймером, который гибридизируется с удлиненными теломеразными продуктами. Внутренний стандарт TSU2 - олигонуклеотид, имеющий последовательность 5'-ААТ CCG TCGAGC AGA GTT AAA AGG CCG AGA AGC GAT-3' (SEQ ID NO: 3), расширение последовательности праймера TS, добавляли в небольшом контролируемом количестве с целью количественного анализа. Праймер U2, имеющий последовательность 5'-АТС GCT TCT CGG CCT TTT (SEQ ID NO: 4), является обратным праймером, предназначенным для гибридизации с 3'-областью внутреннего стандарта. Образец лизата клеток (10 мкл) добавляли к 40 мкл этой PCR-смеси в реакционную пробирку, полученную смесь инкубировали при комнатной температуре (30C) в течение 30 мин. PCR осуществляли путем инкубирования смеси в следующем температурном режиме: 94C/30 с, 60C/30 с и 72C/30 с, повторяя такие трехэтапные циклы до выполнения 20-30, предпочтительно 31 цикла. Добавляли загрузочный краситель, содержащий, например, бромфенол синий и цианолксилол, образцы подвергали 10-15% неденатурирующему PAGE в 0,6 х ТВЕ до того, как бромфенол синий выделится из геля. Получившийся продукт оценивается, например, с помощью фторопределителя для определения CYS-меченных теломеразных продуктов (максимальное возбуждение при 650 нм; максимальная эмиссия при 670 нм). Конечное количество внутреннего стандарта TSU2 после амплификации 5-10 amol на 50 мкл смеси реакции. Такой внутренний контроль дает специфичный 36-членный продукт PCR амплификации, который проявляется как отдельная полоска на геле ниже продукта первого добавления теломера (т.е. продукта одного добавления теломера к TS олигонуклеотиду, последовавшего за амплификацией с обратным праймером АСХ). Эта полоска внутреннего контроля может быть использована для стандартизации- 13009442 Относительное число молекул теломеразных продуктов (ТМ), полученных в ходе теста, определяется в соответствии с нижеприведенной формулой: ТМ=(TTRAP-продукты-ТBKD1)/(TInt Std-TBKD2) где TTRAP-продукты - это общая интенсивность, измеренная в геле для всех теломеразных продуктов, TBKD1 фоновая интенсивность, измеренная на чистой дорожке для площади, равной по размеру площади, занятой теломеразными продуктами, TInt Std - интенсивность полоски внутреннего стандарта, TBKD2 - фоновая интенсивность, измеренная на чистой дорожке для площади, равной по размеру площади, занятой полоской внутреннего стандарта. Итоговое число - это количество молекул теломеразных продуктов, полученных за заданное инкубационное время, которое с целью определения ТМ в данном примере принято за 30 мин. Предпочтительные соединения формул I, II и III, как описано выше, способны обеспечивать при концентрации 1 мкг/мл или ниже уровень активности теломеразы в фибробластах и кератиноцитах по крайней мере на 25% выше, чем уровень активности в контроле с растворителем. Более предпочтительно это соединение способно обеспечивать при концентрации 1 мкг/мл или ниже уровень активности теломеразы по меньшей мере на 50% выше, чем активность в контроле с растворителем. Более выраженные активности могут быть выявлены при некоторых видах применений, таких как соединения, которые обеспечивают активность теломеразы по меньшей мере на 75, 100 или 500% выше, чем этот уровень в контроле с растворителем, что измеряется в описанном TRAP-тесте, при концентрации 1 мкг/мл или ниже. В. Пример результатов TRAP-теста. Эффективность повышения активности теломеразы оценивали для соединений формулы I в различных концентрациях. Тест проводили на клетках HEKneoP (неонатальные кератиноциты) в соответствии с описанным выше протоколом. Значения концентраций находились в пределах от примерно 0,03 до 10 мкМ в ДМСО. Как показано на фиг. 2 для композиций, содержащих соединение 1 (астрогалозид IV), с увеличением концентрации увеличивается теломеразная активность до примерно 360% от контроля при 1,0 мкМ,затем активность снижается по мере дальнейшего увеличения концентрации до 10 мкМ. Как показано на фиг. 2, для композиций, содержащих соединение 2 (циклоастрогенол), теломеразная активность возрастает до примерно 300% от контроля при концентрации 0,1 мкМ (для сравнения, в клетках, обработанных 10 нМ EGF (эпидермальным фактором роста), это значение равно 200%), затем при дальнейшем увеличении концентрации активность снижается. Для композиций, содержащих каждое из соединений, показанных на фиг. 1A-G, в табл. 1 приведена минимально эффективная концентрация (МЕС) соединения, обеспечивающего уровень активности теломеразы в 2 раза больший, чем таковой в контроле с ДМСО (т.е. выше на 100%). Таблица 1 С. Протокол теста заживления ран. Соединения формул I-III могут быть использованы для ускорения заживления ран, ожогов, ссадин или других острых или хронических поражений эпидермиса, которые описаны в дальнейшем. В данном тексте фраза активность заживления раны по измерению в тесте с царапиной означает, что активность измерялась на кератиноцитах и фибробластах в соответствии с нижеследующим протоколом, и выражается она как уровень WH (wound healing - заживление раны) по приведенной ниже формуле.- 14009442 Клетки помещали во флаконы (5x105 клеток на флакон) и культивировали в течение 2 дней во влажной камере в 5% СО 2 при 37C. Для моделирования раны 2 мл пластиковой пипеткой аккуратно проводили по пласту клеток, нанося царапину. Идеальная рана была приблизительно 2-3 мм шириной и 50 мм длиной (вдоль длинной оси флакона с тканевой культурой). Клетки повторно обрабатывали средой, содержащей или наполнитель (ДМСО, контрольный образец), или тестируемые соединения в разных концентрациях. Через 3-4 дня культивирования клеток находили раневую поверхность, помечали флакон и документировали появление клеток при помощи фотосъемки. Объем закрытия раны определяли путем измерения ширины раны в образцах, обработанных соединением, относительно обработанных наполнителем или других контрольных образцов с клетками. Измерения производили по фотографиям, сделанным для каждого образца на 1-й день (непосредственно после нанесения царапины), а также на 2-й, 3-й и 4-й дни. Процент заживления раны (также называемый активность заживления раны) подсчитывался по следующей формуле:WH=100-[100xWn/W0] где Wn - это ширина раны на n-й день, a W0 - это ширина раны в 1-й день (т.е. непосредственно после нанесения царапины). Предпочтительные соединения формул I-III, как описано выше, способны обеспечивать при концентрации 1 мкг/мл или ниже величину закрытия раны (активность заживления раны) в тесте с царапиной на кератиноцитах или фибробластах по вышеописанной методике, которая по меньшей мере на 25% больше, чем таковая в необработанных или контрольных клетках. Еще более выраженная активность может быть достигнута в некоторых случаях, когда соединения обеспечивают при концентрации 1 мкг/мл или ниже величину закрытия раны в тесте с царапиной на кератиноцитах или фибробластах, которая по меньшей мере на 50 или 100% выше, чем в необработанных и контрольных клетках.D. Пример результатов теста с царапиной. Активность заживления раны соединения 1 (астрагалозид IV) и соединения 2 (циклоастрагенол) настоящего изобретения была оценена на примере стареющих кератиноцитов посредством теста с царапиной, описанного выше. Результаты типичного теста продемонстрированы на фиг. 4, где верхний ряд рисунков отображает контрольные клетки (обработанные растворителем, ДМСО), а нижний ряд отображает клетки, обработанные 0,1 мкг/мл (около 0,13 мкМ) соединения 1 в том же растворителе. Обработанные клетки смыкались на 4-й день в отличие от контрольных клеток, в которых на 4-й день оставалась рана заметного размера. Сходные результаты были получены с этой композицией и с 0,01 мкМ соединения 2 (циклоастрагенол) в молодых кератиноцитах, как показано на фиг. 5. Фиг. 6 демонстрирует активность заживления раны композиции, содержащей соединение 1 (астрагалозид IV), в стареющих зрелых кератиноцитах по измерениям в схожем тесте в присутствии и в отсутствие ингибирующего теломеразу олигонуклеотида (GRN163) и контрольного олигонуклеотида(GRN137227). Было показано, что ингибирующий теломеразу олигонуклеотид GRN163 блокирует ранозаживляющие эффекты соединения 1; эффект контрольного олигонуклеотида GRN137226 минимален.(Мишенью GRN163 - ингибирующего теломеразу олигонуклеотида - является матричная область РНК компонента теломеразы. Точнее, GRN163 является 13-членным N3'Р 5'тиофосфорамидат олигонуклеотидом, описан детально в РСТ Pubn. No. WO 01/18015. GRN137227 является 13-членным N3'Р 5'тиофосфорамидат контрольным олигонуклеотидом, имеющим ошибочную последовательность). В нижеприведенной табл. 2 представлены значения WH (активности заживления раны) для соединений 1 и 2, полученные в тестах царапиной, показанных на фиг. 5 и 6, основанные на результатах этих тестов с использованием указанной выше формулы. Таблица 2 Фиг. 7 графически иллюстрирует закрытие раны в процентах от контроля для соединения 1 изобретения (астрагалозид IV) в зрелых неонатальных кератиноцитах в присутствии и в отсутствие ингибитора теломеразы (GRN163) при сравнении с 50 нг/мл (приблизительно 2 мл) PDGF (вторичный тромбоцитарный фактор роста). Было показано, что эффективность соединения 1 сравнима с таковой PDGF и также блокируется добавлением GRN163.V. Выбор дополнительных соединений. Изобретение также охватывает способы выбора дополнительных соединений, эффективно увеличивающих активность теломеразы, путем скрининга производных соединений формул I, II или III в TRAP- 15009442 тесте по описанной методике. Термин производное подразумевает соединение, полученное путем модификации соединения формулы I, II или III одним или более из указанных способов: замена гидроксильной группы на низший алкилкарбамат, галоген, тиол, низший алкилтиоэфир, аминогруппу, низший алкиламино, низший алкиламид, альдегид или кетогруппу; добавление низшего алкила к таким группам, как альдегидная и кетогруппа, или к существующей кетогруппе (например, алкилирование с образованием в дальнейшем гидроксильной группы); добавление галогена, гидроксильной группы и/или атомов водорода к двойной связи между атомами углерода; удаление гидроксильной группы (т.е. замена атомом водорода); и инверсия стереоструктуры в одном или более хиральных центрах, предпочтительно кислородсодержащем хиральном центре. Используемый здесь термин производное относится к любому веществу,полученному путем такой модификации, исключая сами соединения формул I, II и III, как они определены выше. Все эти модификации могут быть выполнены посредством стандартных способов синтеза с использованием хорошо известных реакций по синтезу, таких как нуклеофильное замещение, которое может включать превращение гидроксильной группы в более легко уходящую, такую как тозилат; этерификация; алкилирование; окисление; восстановление; галогенирование; гидратация; гидрирование и т.п. Производное соединения формулы I, II или III, приготовленное в подходящей среде растворителя в разных концентрациях, оценивается в TRAP-тесте на кератиноцитах или фибробластах по вышеописанной методике. Предпочтительно, чтобы производные для выбора включали соединения, эффективные при изготовлении с растворителем в концентрации 1 мкг/мл или ниже, для обеспечения уровня активности теломеразы в кератиноцитах или фибробластах (по измерениям TRAP-теста) по меньшей мере на 50% выше, чем активность в указанных клетках на фоне применения только растворителя. Альтернативно или в дополнение, производные соединения формул I, II и III, изготовленные в подходящей среде растворителя в разных концентрациях, оцениваются по активности заживления раны в тесте с царапиной по вышеописанной методике. Предпочтительны для выбора производные соединения,включающие те, которые обладают активностью заживления раны в концентрации 1 мкг/мл или ниже по меньшей мере на 25% больше, более предпочтительно на 50% выше, чем активность в контроле.VI. Показания и способы лечения. Настоящее изобретение охватывает способы увеличения активности теломеразы в клетках путем контактирования клетки или ткани с составом выделенного соединения формулы I, II или III, как раскрыто выше в разделе II, в количестве, эффективном для увеличения активности теломеразы клетки. Способ может включать предварительный этап идентификации клетки или ткани, в которых требуется увеличение активности теломеразы. Клетка может находиться в культуре, т.е. быть in vitro или ex vivo, а также в организме in vivo. Преимущества, ожидаемые от увеличения активности теломеразы в клетке или ткани, включают,например, усиление репликативной способности и/или продолжительности жизни обработанных клеток. Этот способ может также включать диагностику заболевания субъекта или пациента, при котором требуется увеличение активности теломеразы в клетках или ткани пациента; например, диагностику заболевания, являющегося показанием к лечению путем увеличения активности теломеразы в клетках или ткани. Соответственно, данное изобретение охватывает способы лечения заболеваний пациента путем увеличения активности теломеразы в клетках и тканях этого пациента, способ, включающий введение субъекту(при необходимости такого лечения) эффективного количества соединений формул I, II или III, раскрытых выше в разделе П. Термин эффективное количество означает количество, эффективно повышающее активность теломеразы в клетках и ткани пациента, при условии достижения лечебного результата. Такие заболевания могут включать, например, заболевания, связанные с клеточным старением или повышенным уровнем пролиферации клеток в отсутствие теломеразы, что приводит к ускоренной потере теломерных повторов. Под повышенным уровнем пролиферации подразумевается более высокая скорость деления клеток в сравнении с нормальными клетками этого типа или в сравнении с нормальными клетками этого типа другого индивида. Старение этих клеток и ненормально раннее созревание могут со временем приводить к болезни (см. West et al., U.S.6007989). Существуют разнообразные болезненные состояния, при которых увеличение активности теломеразы в клетках некоторых типов может оказаться полезным. Соответственно, это изобретение охватывает способы лечения у пациента заболевания, выбранного из нижеследующих, посредством увеличения активности теломеразы в клетках пациента, включающие введение субъекту, нуждающемуся в подобном лечении, эффективного количества соединения формулы I, II или III по вышеописанной методике. В некоторых случаях заболевание может быть также целью клеточной терапии ex vivo, как это описано ниже,с вовлечением соответствующих типов клеток (указанных в круглых скобках).(a) Болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона и инсульт (клетки центральной нервной системы, включая нейроны, глиальные клетки, например астроциты, эндотелиальные клетки,фибробласты),(b) возрастные заболевания кожи, такие как атрофия и истончение дермы, эластолиз и морщинистость кожи, гиперплазия или гипоплазия сальных желез, сенильное лентиго и другие пигментные нарушения, поседение волос и прорежение или выпадение волос, хронические кожные язвы (фибробласты,- 16009442 сальные кожные железы, меланоциты, кератиноциты, клетки Лангерганса, эндотелиальные клетки микрососудистого русла, клетки волосяных фолликулов),(c) дегенеративные заболевания суставов (клетки суставного хряща, такие как хондроциты и лакунарные и синовиальные фибробласты),(d) остеопороз и другие дегенеративные заболевания костной системы (клетки костной системы,такие как остеобласты, стромальные и мезенхимальные клетки костного мозга, костные клетки-предшественники),(e) обусловленные стрессом и возрастом заболевания сердечно-сосудистой системы, включая атеросклероз, кальцификацию, тромбоз и аневризмы (клетки сердечно-сосудистой системы, включая эндотелиальные клетки, гладкомышечные клетки и фибробласты адвентиции),(f) возрастная макулярная дегенерация (клетки глаза, такие как пигментный эпителий и эндотелиальные клетки сосудов),(g) СПИД (ВИЧ-рестриктированные CD8+ клетки),(h) обусловленные стрессом и возрастом нарушения иммунной системы, включая нарушение обновления тканей, которое происходит при естественном старении, раке, лечении рака, острых или хронических инфекциях или при генетических нарушениях, вызывающих ускоренное обновление клеток,связанных анемиях и других дегенеративных заболеваниях (клетки иммунной системы, включая клетки лимфоидного, миелоидного и эритроидного ростков, таких как В- и Т- лимфоциты, моноциты, циркулирующие и специализированные тканевые макрофаги, нейтрофилы, эозинофилы, базофилы, NK-клетки и их соответствующие предшественники. Кроме указанных выше типов, следующие типы клеток, в которых увеличение активности теломеразы может оказывать лечебный эффект, включают (но не ограничиваются ими) клетки печени, эндокринных и экзокринных желез, гладкой мускулатуры и скелетной мускулатуры. В качестве примера, у ВИЧ-инфицированных пациентов обновление CD8+ клеток возрастает, поскольку эти клетки стремятся сдержать уровень ВИЧ-инфицированных CD4+ клеток. При СПИДе (вышеуказанный пункт (g болезнь предположительно вызвана ранним старением пораженных вирусом клеток CD8+. Старение этих клеток объясняется не просто ненормально большими потерями теломерных последовательностей при делении клеток, но еще и увеличенным уровнем репликации клеток, так что истощение теломер в этих клетках выше нормального. Таким образом, изобретение обеспечивает способы лечения ВИЧ-инфицированного субъекта, а конкретно - снижение раннего старения ВИЧ-рестриктированных клеток CD8+ у ВИЧ-инфицированных пациентов путем введения субъекту, нуждающемуся в подобном лечении, эффективного количества соединения формулы I, II или III, как раскрыто выше в разделе II. Увеличение активности теломеразы может благотворно влиять на неделящиеся клетки, так же, как и на пролиферирующие, например, при состояниях, связанных с риском клеточной гибели из-за повышенной чувствительности к стрессу, такому как ишемия при сердечной недостаточности или при инсульте (см., например, Oh and Schneider, J. Mol. Cell. Cardiol. 34 (7): 717-24; Mattson, Exp. Gerontol. 35 (4): 489-502). Таким образом, это изобретение охватывает способы снижения клеточной смерти, вызванной стрессом или повреждением ДНК у субъектов, таких как субъекты, пребывающие в условиях ишемии тканей, обусловленной сердечной недостаточностью или инсультом, путем повышения активности теломеразы в клетках субъекта, включающие введение субъекту, нуждающемуся в подобном лечении, эффективного количества соединения формулы I, II или III, раскрытых выше в разделе II. Как упомянуто выше, способ может включать предварительный этап диагностики у субъекта указанного заболевания. С другой стороны, композиции могут быть использованы для лечения индивидов, у которых ограничено число клеток одного или более типов и жизнь которых может быть продлена за счет продления способности этих клеток делиться или противостоять клеточной смерти, обусловленной стрессом. Одним из примеров такой группы клеток являются лимфоциты у пациентов с синдромом Дауна. Таким образом, изобретение охватывает способ улучшения репликативной способности и/или продолжительности жизни лимфоцитов у больных синдромом Дауна путем увеличения активности теломеразы в указанных клетках, включающий введение таким пациентам эффективного количества соединения формулы I, II или III, раскрытых выше в разделе II. Эти композиции могут быть также использованы для усиления резистентности к клеточной смерти, обусловленной стрессом, наблюдаемой при нормальном старении. С другой стороны, повышение активности теломеразы эффективно для обеспечения заживления ран, ожогов, ссадин и других острых или хронических поражений эпидермиса. Таким образом, данное изобретение охватывают способ лечения острых и хронических поражений эпидермиса путем введения пациенту, нуждающемуся в подобном лечении, предпочтительно при местном нанесении на пораженную область эффективного количества одного из соединений формул I, II или III, раскрытых выше в разделе II. Упоминаемые в данном описании острые и хронические поражения эпидермиса включают острые поражения, такие как повреждения при травме, ожоги, ссадины, хирургические разрезы, места забора донорского материала, а также повреждения, вызванные инфекционными агентами, и хронические поражения, такие как хроническая венозная язва, диабетическая язва, компрессионная язва, рана от сдавления, а также язвы и раны слизистых оболочек. Также к ним относятся повреждения кожи и эпители- 17009442 альных поверхностей, вызванные персистирующим воспалительным заболеванием или инфекцией, или генетический дефект (такой, как келоидное образование или нарушения свертывания крови). См., например, РСТ Pubn. No. WO 02/91999. Полезные эффекты повышения активности теломеразы в ходе такого лечения включают пролиферацию или миграцию клеток в месте приложения лечения, эпителизацию поверхности, закрытие раны(если имеется) или восстановление нормальной физиологической функции. Под терминами эпителизация и реэпителизация в месте приложения лечения подразумевается увеличение плотности эпителиальных клеток в этом месте в результате применения терапии. Способ может быть также применен для улучшения роста пересаженных клеток. Желаемые эффекты увеличения активности теломеразы при таком лечении включают покрытие клетками места приложения лечения, выживание пересаженных клеток, отсутствие иммунного отторжения, закрытие раны (если имеется) или восстановление нормальной физиологической функции. Пересаженные клетки могут участвовать в закрытии раны или путем участия непосредственно в процессе заживления (например, становясь частью восстановленной ткани), или путем покрывания раны, таким образом обеспечивая условия,ускоряющие заживление за счет клеток хозяина. Изобретение также рассматривает манипуляции на коже и коррекцию любых дефектов кожной поверхности с другими целями, такими как косметический эффект. С другой стороны, способы и композиции изобретения могут быть также использованы для увеличения репликативной способности и/или увеличения продолжительности жизни клеток в культуре, например, при клеточной терапии ех vivo или в производстве моноклональных антител путем увеличения активности теломеразы в клетках. Увеличение активности теломеразы повышает репликативную способность таких клеток путем замедления потери теломерных повторов и/или повышает резистентность к клеточной смерти, обусловленной стрессом, во время пролиферации клетки. В случае применения ex vivo эффективное количество соединения формул I, II или III, описанных выше, добавляют к эксплантированным клеткам, взятым у субъекта. Под эффективным количеством понимают количество, эффективное для увеличения активности теломеразы в клетках и повышения репликативной способности и/или продолжительности жизни клеток. Эксплантированные клетки могут включать, например, стволовые клетки, такие как стволовые клетки костного мозга (U.S. 6007989), стромальные клетки костного мозга (Simonsen et al., Nat. Biotechnol. 20 (6): 592-6,2002) или клетки коры надпочечников (Thomas et al., Nat. Biotechnol. 18 (1): 39-42,2000). Болезненные состояния, такие как указанные выше в пп.(a)-(g), могут быть также целью клеточной терапии ex vivo. Примеры включают использование мышечных клеток-спутников для лечения мышечной дистрофии, остеобластов для лечения остеопороза, пигментированных эпителиальных клеток сетчатки при возрастной макулярной дегенерации, хондроцитов при остеоартрите и т.д. Например, понимание того, что у больных СПИДом недостаточно функционирующих клеток CD8+ для сдерживания роста зараженных клеток CD4+, позволило разработать терапевтический протокол, по которому ВИЧ-рестриктированные CD8+ клетки забирают у пациента на ранней стадии ВИЧ-инфекции,при первом выявлении СПИДа, сохраняют в банке, а затем снова вводят больному на более поздней стадии, когда у него уже не хватает необходимого количества CD8+ клеток. Таким образом, жизнь пациента может быть продлена за счет продолжительного введения недостающих клеток в соответствующем временном режиме. Этот режим может быть определен по старению клеток CD8+ или путем измерения длины теломер в этих клетках как признака старения этих клеток. В соответствии с изобретением хранящиеся клетки могут увеличиваться в количестве в присутствии вещества, замедляющего потерю теломерных повторов, т.е. соединения формулы I, II или III, как раскрыто выше в разделе II. Соответственно, изобретение охватывает способы клеточной терапии ex vivo, которая включает забор популяции клеток у субъекта, увеличение клеточной популяции ex vivo, за счет воздействия на популяцию соединения формулы I, II или III, как раскрыто выше в разделе II, в количестве, эффективном для повышения активности теломеразы и увеличения репликативной способности и/или продолжительности жизни клеточной популяции. Способ обычно включает выявление у субъекта заболевания (такого,как перечисленные выше), которое может быть подвержено клеточной терапией ex vivo. В другом воплощении изобретение обеспечивает способ пролиферации стволовых клеток, при котором популяция стволовых клеток обрабатывается соединением формулы I, II или III, как раскрыто выше в разделе II, в количестве, эффективном для повышения активности теломеразы и увеличения репликативной способности и/или продолжительности жизни клеточной популяции.VII. Лекарственные формы и способы введения. Изобретение охватывает способы получения фармацевтических композиций, пригодных для увеличения активности теломеразы в клетке и/или обеспечения заживления раны. Соответственно, выделенное соединение формулы I, II или III, раскрытое выше в разделе II, комбинируют с фармацевтическим наполнителем и возможно с другими лечебными веществами, адъювантами и подобными агентами, которые могут включать активные и неактивные ингредиенты. Композиции могут быть представлены твердыми, полутвердыми, лиофилизированными порошками или жидкими дозированными формами, такими как, например, таблетки, капсулы, порошки, препараты длительного высвобождения, растворы, суспен- 18009442 зии, эмульсии, суппозитории, кремы, мази, лосьоны, аэрозоли или им подобные. Лекарственные формы могут быть представлены дозированными препаратами, подходящими для простого введения точного количества соединения. Выделенное соединение формулы I, II или III может быть также изготовлено в виде пищевой добавки для применения внутрь. Для изготовления пищевой добавки или фармацевтического перорального состава подходят следующие наполнители фармацевтической категории: маннитол, лактоза, глюкоза,сахароза, крахмал, целлюлоза, желатин, стеарат магния, сахарин натрия и/или магния карбонат. Для использования в виде жидкой лекарственной формы композиция может быть изготовлена в форме раствора, суспензии, эмульсии или сиропа и может выпускаться либо в твердой, либо в жидкой форме, пригодной для гидратации в водном носителе, таком как, например, водный раствор соли, водный раствор декстрозы, глицерин или этанол, предпочтительно вода или физиологический раствор. При необходимости композиция может также содержать малые количества нетоксичных вспомогательных веществ, таких как смачивающие вещества, эмульгаторы или буферы. Выделенное соединение формулы I, II или III также может быть включено в существующую пищевую добавку, легко доступную, которая может также включать экстракт травы, такой как экстракт Astragalus membranaceus. При использовании для заживления ран или лечения других острых или хронических поражений эпидермиса соединение формулы I, II или III изготавливается для местного нанесения. Носитель для местного применения может быть представлен различными формами, например в виде лосьона, крема, геля, мази, карандаша, спрея или пасты. Эти лекарственные формы могут быть изготовлены в соответствии с хорошо известными методиками. Они могут содержать различные виды наполнителей, включая (но не ограничиваясь ими) растворы, аэрозоли, эмульсии, гели и липосомы. Наполнитель может быть изготовлен,например, в виде эмульсии на основе масло-в-воде или вода-в-масле. Подходящие гидрофобные (масляные) компоненты, применяемые в эмульсиях, включают, например, растительные масла, животные жиры и масла, синтетические углеводороды, их сложные эфиры и спирты, включая полиэфиры, а также полиорганосилоксановые масла. Такие эмульсии также включают эмульгатор и/или поверхностно-активное вещество, например неионное поверхностно-активное вещество, которое хорошо известно специалисту в данной области, для диспергирования и суспендирования дисперсной фазы в непрерывную фазу. Лекарственная форма для местного применения обычно содержит один или более компонентов,выбранных из следующего списка: структурирующее вещество, загуститель или желатинирующее вещество, смягчающее или смазывающее вещество. Часто применяемые структурирующие вещества включают длинноцепочечные спирты, такие как стеариновый спирт, простые и сложные эфиры глицерина и олиго(этиленоксид)эфиры или их сложные эфиры. Загустители и желатинирующие вещества включают,например, полимеры акриловой или метакриловой кислот и их сложные эфиры, полиакриламиды и природные загустители, такие как агар-агар, каррагенан, желатин и гуаровая смола. Примеры смягчающих веществ включают сложные эфиры триглицерида, амиды и сложные эфиры жирных кислот, воски, такие как пчелиный воск, спермацет или карнубский воск, фосфолипиды, такие как лецитин и их стерины и сложные эфиры с жирными кислотами. Лекарственные формы для местного нанесения могут также включать другие компоненты, известные специалисту в данной области, например вяжущие средства, ароматизаторы, пигменты, улучшающие проникновение через кожу средства, солнцезащитные вещества и т.п. Фармацевтические композиции могут быть также изготовлены для парентерального, трансдермального или ингаляционного введения. Композиции для инъекций обычно содержат активное соединение в подходящем растворе, таком как стерильный физиологический раствор. Композиция может быть также изготовлена в виде суспензии в липиде или фосфолипиде, в виде липосомальной суспензии или в виде водной эмульсии. Для ингаляционного введения активное соединение изготавливается в виде твердых или жидких аэрозольных частиц. Такая лекарственная форма может также включать сжатую жидкость в аэрозольном баллончике и/или диспергатор, такой как лактоза, для обеспечения образования аэрозоля. Для трансдермального введения активное соединение предпочтительно включено в состав трансдермального пластыря, который обеспечивает медленное попадание соединения на выбранную область кожи и который может также содержать вещества, улучшающие проницаемость кожи, такие как алифатические спирты или глицерин. Способы для изготовления таких лекарственных форм известны или очевидны специалисту в данной области; например, см. Remington's Pharmaceutical Sciences (19th Ed., WilliamsWilkins, 1995). Композиция должна содержать количество выбранного соединения в фармацевтически безопасном и эффективном количестве для увеличения активности теломеразы в клетках или ткани, выбранных в качестве мишени. Предпочтительно фармацевтическая композиция или пищевая добавка содержит по меньшей мере 0,1% (масса/объем) соединения формулы I, II или III, описанного выше, предпочтительно больше чем 0,1%, до примерно 10%, предпочтительно до примерно 5%, еще более предпочтительно до примерно 1%(масса/объем). Выбор необходимой концентрации зависит от таких факторов, как требуемая доза, частота и способ введения активного вещества. Для лечения субъекта или пациента, например млекопитающего или человека, дозировка определяется на основе таких факторов, как вес, общее состояние здоровья субъекта, вид заболевания, тяжесть- 19009442 симптомов и т.п. Дозировку и концентрации определяют по наступлению желаемого благоприятного действия, в то же время избегая развития нежелательных побочных эффектов. Обычные дозы соединений находятся в пределах от примерно 0,5 до 500 мг/день для человека, предпочтительно около 1-100 мг/день. Например, режимы с более высокими дозами включают 50-100, 75-100 или 50-75 мг/день, а режимы с более низкими дозами включают 1-50, 25-50 или 1-25 мг/день. В особых воплощениях, например, соединение, обозначенное в данном описании под номером 2 (циклоастрагенол), вводится на уровне по меньшей мере 1 мг/день, предпочтительно по меньшей мере 5 мг/день; а соединение, обозначенное в данном описании под номером 1 (астрагалозид IV), вводится на уровне по меньшей мере 50 мг/день, предпочтительно по меньшей мере 100 мг/день. Исследования в сфере изобретения показали, что соединения формулы I-III имеют отличную биодоступность и низкую токсичность. Например, показательное соединение, циклоастрагенол (2), оказалось отрицательным в Ames-тесте бактериального мутагенного потенциала, на примере SalmonellaTyphimurium tester strains TA98,TA100, TA1535, ТА 1537 и Е. coli tester strain WP2uvrA, при уровне до 5000 LE/планшет. Оно оказалось хорошо переносимым крысами Sprague-Dawley после однократных внутривенных инъекций до 10 мг/кг. Не было отмечено значимых дозозависимых изменений у самцов и самок в поведении (питание, питье), весе целиком и отдельных органов (сердце, легкое, печень, почки,надпочечники, селезенка), гематологических или биохимических показателях. Примеры Пример 1. Превращение астрагалозида IV (1) в циклоастрагенол (2). К астрагалозиду IV (1) (5,00 г, ммоль) добавляют HCl-MeOH 10 (TCl America) (500 мл) и смесь перемешивают при комнатной температуре в течение 7 дней. Реакционную смесь концентрируют примерно до половины объема при пониженном давлении при температуре 20C (нагревание отсутствует). Смесь распределяют между водным раствором бикарбоната натрия и этилацетатом. Водный слой повторно экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке (смесь хлороформ/метанол 20:114:1). Для того, чтобы заместить остаток растворителя этанолом, очищенный продукт растворяют в этаноле и растворитель удаляют при пониженном давлении, что дает 2 (2,1 г, 64%). 1 Н ЯМР (CDCl3)(ч./млн) 0,34 (д, J=4,7 Гц, 1 Н), 0,48 (д, J=4,3 Гц, 1 Н), 0,92 (с, 3H), 0,93 (с, 3H), 1,01,8 (м, 13 Н), 1,11 (с, 3H), 1,19 (с, 3H), 1,22 (с, 6 Н), 1,27 (с, 3H), 1,9-2,0 (м, 4 Н), 2,30 (д, J=7,8 Гц, 1 Н), 2,54(кв, J=11,8 Гц, 1 Н), 3,27 (м, 1H), 3,50 (м, 1 Н), 3,72 (т, J=7,4 Гц, 1 Н), 4,65 (кв, J=7,4 Гц, 1 Н). ESI-MS м/е положительный 491 (М+Н)+, отрицательный 549 (М+АсО)-. TLC (Merck, Kieselgel 60) Rf=0,33 (смесь хлороформ/метанол 6:1). Пример 2. Получение соединений 5, 6 и 7 из астрагалозида IV (1): удаление гликозидов из астрагалозида IV (1) с и без сопутствующей перегруппировки.(0,4 мл) и смесь нагревают при температуре кипения в течение 1,5 ч. После охлаждения до комнатной- 20009442 температуры смесь выливают в этилацетат и воду. Органический слой промывают рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь хлороформ/метанол 20:110:17:1), что дает продукт перегруппировки 5 (24 мг, 4,0%), моноглюкозиды 6 (172 мг, 21%) и 7 (29 мг, 3,6%) и агликон,циклоастрагенол (2) (326 мг, 52%).GRN140726: ESI-MS м/е 473 (М+Н)+ С 30 Н 48 О 4=472. 1 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,72, 0,85, 0,95, 1,05, 1,11, 1,17, 1,18 и 1,25 (с, 3H каждый), 0,92,1 (м, 13 Н), 2,20 (д, J=7,4 Гц, 1 Н), 2,4-2,6 (м, 2 Н), 3,42 (м, 1 Н), 3,70 (дд, J=7,8, 5,9 Гц, 1 Н), 4,63 (кв, J=7,4 Гц, 1H), 5,45 (уширенный с, 1 Н), 5,57 (уширенный с, 1H). Пример 3. Ацетилирование 1: получение 16-кетона 10. Соединения 9 и 10, представленные ниже, получены в соответствии со способом Kitagawa 1983b,приведенным выше. Кратко, ацетилирование астрагалозида IV (1) обеспечивает соединение 9 совместно с небольшим количеством побочного 16-ацетата. Окисление с помощью хлорхромата пиридиния 9 дает 10. Пример 4. Получение 4 (см. фиг. 1 ) путем деацилирования 10. К раствору 10, полученному выше (10 мг, 0,0093 ммоль), в метаноле добавляют боргидрид натрия(10 мг, 0,26 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют хлороформом (3 мл) и непосредственно подвергают хроматографии на колонке с силикагелем (3:1 смесь хлороформ/метанол), что дает соединение 4 (8,0 мг, квант.). ESI-MS м/е 783 (М+Н)+ С 41 Н 66 О 14=782. Пример 5. Получение триона 11 из циклоастрагенола 2. 3,6,16-Трионовое производное циклоастрагенола 11 получают с помощью окисления соединения 2CrO3 в соответствии со способом Kitagawa et al., Chem. Pharm. Bull. 31 (2): 689-697 (1983a).(0,030 мл, 0,22 ммоль) и пивалоилхлорид (0,014 мл, 0,12 ммоль) и смесь перемешивают при температуре 0C в течение ночи. Затем смесь непосредственно подвергают хроматографии на колонке с силикагелем(смесь гексан/этилацетат 1:11:2), что дает соединение 12 (17 мг, 30%) и 13 (3,3 мг, 2,9%). Соединение 12: ESI-MS м/е 575 (М+Н)+ С 35 Н 58 О 6=574.(м, 17 Н), 1,03 (с, 3H), 1,09 (с, 3H), 1,12 (с, 3H), 1,17 (с, 9 Н), 1,21 (с, 3H), 1,24 (с, 3H), 1,28 (с, 3H), 2,29 (д,J=7,8 Гц, 1 Н), 2,53 (м, 1 Н), 3,50 (м, 1H), 3,73 (т, J=7,2 Гц, 1 Н), 4,50 (дд, J=10,9, 4,3 Гц, 1 Н), 4,65 (м, 1H). Пример 7 А. Ацетилирование вторичных гидроксилов циклоастрагенола (2). Эту реакцию осуществляют в соответствии со способом по Kitagawa 1983a, приведенным выше. Кратко, ацетилирование смесью уксусный ангидрид/пиридин дает смесь соединений 14 (основной продукт) и 15 (второстепенный продукт).(0,75 мл, 12 ммоль) и гидрид натрия (60% дисперсионное масло, 40 мг, 1,0 ммоль) при температуре 0C в атмосфере азота и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 4:1), что дает соединение 16 (29 мг, 92%).(с, 3H), 2,3-2,4 (м, 2 Н), 3,05 (с, 3H), 3,23 (с, 3H), 3,81 (дд, J=9,0, 6,6 Гц, 1H), 3,95 (тд, J=7,8, 5,1 Гц, 1 Н),4,54 (дд, J=10,9, 4,7 Гц, 1 Н), 4,70 (тд, J=9,4, 4,3 Гц, 1H). Пример 7C. Получение 16,25-диметоксициклоастрагенола 17: удаление ацетильных групп из соединения 16. Смесь соединения 16 (28 мг, 0,046 ммоль) и метилата натрия (0,5 моль/л в метаноле, 6 мл) перемешивают при комнатной температуре в течение 48 ч. Затем добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 2:3), что дает диметоксидиольное соединение 17 (23 мг, 96%). К раствору соединения 14 (109 мг, 0.190 ммоль) в дихлорметане (10 мл) добавляют диизопропилэтиламин (1,0 мл) и хлорметилметиловый эфир (0,5 мл) и смесь перемешивают при комнатной температуре в течение 24 ч. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (3:1 смесь гексан/этилацетат), что дает соединение 18 (114 мг, 90%). 1 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,31 (д, J=5,1 Гц, 1 Н), 0,56 (д, J=4,7 Гц, 1 Н), 0,80 (с, 3H), 0,88(с, 3H), 2,28 (д, J=8,2 Гц, 1H), 3,30 (с, 3H), 3,33 (с, 3H), 3,81 (т, J=7,2 Гц, 1H), 4,17 (м, 1H), 4,5-4,6 (м, 3H),4,7-4,8 (м, 3H). Пример 7 Е. Удаление ацетильных групп из соединения 18. Смесь соединения 18, указанного выше, (3,6-диацетил-16,25-ди(метоксиметил)эфирное производное циклоастрагенола) (102 мг, 0,150 ммоль) и метилат натрия (0,5 моль/л в метаноле, 10 мл) перемешивают при комнатной температуре в течение 48 ч. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 1:1), что дает ди(метоксиметил) или соединение 19 (80 мг, 92%).(с, 3H), 1,1-2,0 (м, 18 Н), 1,15 (с, 3H), 1,17 (с, 3H), 1,22 (с, 3H), 1,29 (с, 3H), 1,34 (с, 3H), 2,29 (д, J=8,6 Гц,1H), 3,28 (м, 1H), 3,30 (с, 3H), 3,33 (с, 3H), 3,53 (м, 1H), 3,81 (т, J=7,2 Гц, 1H), 4,18 (тд, J=7,8, 5,5 Гц, 1H),4,50 (д, J=6,6 Гц, 1H), 4,54 (д, J=6,2 Гц, 1H), 4,71 (д, J=7,0 Гц, 1 Н), 4,76 (д, J=7,4 Гц, 1 Н). Пример 8. Алкилирование триацетилциклоастрагенола 15 с последующим удалением ацетильных групп.(0,75 мл, 12 ммоль) и гидрид натрия (60% дисперсионное масло, 40 мг, 1,0 ммоль) при температуре 0C в атмосфере азота и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении. К остатку добавляют метилат натрия в метаноле (0,5 моль/л, 6 мл) и смесь перемешивают при комнатной температуре в течение ночи. Добавляют 10% раствор соляной кислоты и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 1:2), что дает соединение 20 (23 мг, 93%).ESI-MS м/е 505 (М+Н)+ C31H52O5=504. 1 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,33 (д, J=4,3 Гц, 1 Н), 0,48 (д, J=4,3 Гц, 1H), 0,8-2,1 (м, 17 Н),0,91 (с, 3H), 0,93 (с, 3H), 1,04 (с, 3H), 1,14 (с, 3H), 1,20 (с, 3H), 1,22 (с, 3H), 1,23 (с, 3H), 2,28 (д, J=7,8 Гц,1H), 2,60 (кв, J=10,9 Гц, 1H), 3,17 (с, 3H), 3,27 (м, 1H), 3,51 (тд, J=9,8, 3,5 Гц, 1H), 3,72 (дд, J=9,0, 5,5 Гц,1H), 4,62 (м, 1H). Пример 9 А. Алкилирование свободных гидроксилов циклоастрагенолмоногликозида 6.(1,0 мл, 16 ммоль) и гидрид натрия (60% дисперсионное масло, 60 мг, 1,5 ммоль) при температуре 0C в атмосфере азота и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 3:1), что дает перметоксисоединение 21 (33 мг, 57%).ESI-MS м/е 751 (М+Н)+ С 43 Н 74 О 10=750. 1 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,21 (д, J=4,7 Гц, 1H), 0,47 (д, J=4,3 Гц, 1H), 0,8-2,0 (м, 17 Н),0,87 (с, 3H), 0,89 (с, 3H), 1,05 (с, 3H), 1,13 (с, 3H), 1,17 (с, 3H), 1,22 (с, 3H), 2,3-2,4 (м, 2 Н), 2,67 (дд,J=11,0, 4,1 Гц, 1H), 2,92 (т, J=8,2 Гц, 1 Н), 3,06 (с, 3H), 3,1-3,6 (м, 6 Н), 3,22 (с, 3H), 3,32 (с, 3H), 3,35 (с,3H), 3,48 (с, 3H), 3,49 (с, 3H), 3,59 (с, 3H), 3,80 (дд, J=9,0, 6,6 Гц, 1H), 3,94 (м, 1 Н), 4,24 (д, J=7,4 Гц, 1 Н). Пример 9 В. Получение 3,16,25-триметоксиастрагенола, 22: удаление гликозида из перметоксисоединения 21 с сопутствующей перегруппировкой. К раствору соединения 21 (30 мг, 0,040 ммоль) в метаноле (10 мл) добавляют серную кислоту (0,2 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 10 ч. Добавляют воду и смесь экстрагируют этил ацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем (смесь гексан/этилацетат 4:1), что дает соединение 22 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,73 (с, 3H), 0,8-2,0 (м, 18 Н), 0,85 (с, 3H), 1,00 (с, 3H), 1,03 (с,3H), 1,06 (с, 3H), 1,14 (с, 3H), 1,24 (с, 3H), 1,25 (с, 3H), 2,3-2,4 (м, 2 Н), 2,58 (дд, J=10,9, 3,9 Гц, 1H), 3,09 (с,3H), 3,24 (с, 3H), 3,34 (с, 3H), 3,80 (дд, J=9,4, 6,6 Гц, 1H), 3,98 (м, 1 Н), 5,25 (уширенный д, J=5,5 Гц, 1H). Пример 10 А. Алкилирование свободных гидроксилов циклоастрагенолмоногликозида 7. Соединение 23 (18 мг, 53%) получают из соединения 7 (30 мг) в соответствии с методикой, применяемой для получения соединения 21, указанного выше. Соединение 24 (7,1 мг, 56%) получают из соединения 23 (17 мг) в соответствии с методикой, применяемой для получения соединения 22, указанного выше.(0,75 мл, 12 ммоль) и гидрид натрия (60% дисперсионное масло, 40 мг, 1,0 ммоль) при температуре 0C в атмосфере азота и смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении. К этому остатку добавляют тетрагидрофуран (5 мл) и 10% раствор соляной кислоты (1 мл) и смесь перемешивают при комнатной температуре в течение ночи, затем при температуре кипения в течение часа. Добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают водой и рассолом и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и остаток очищают с помощью хро- 25009442 матографии на колонке с силикагелем (смесь гексан/этилацетат 3:1-1:1), что дает соединение 25 (13 мг,48%) и небольшое количество (7,4 мг, 25%) 3,6-диметокси-16-(метоксиметил) или соединение 26. Соединение 25: ESI-MS м/е 563 (М+Н)+ С 34 Н 58 О 6=562. 1 Н ЯМР (400 МГц, CDCl3)(ч./млн) 0,19 (д, J=4,7 Гц, 1 Н), 0,45 (J=4,3 Гц, 1H), 0,8-2,3 (м, 18 Н), 0,86H ЯМР (400 МГц, CDCl3)(ч./млн) 0,21 (д, J=4,3 Гц, 1 Н), 0,45 (д, J=4,3 Гц, 1H), 0,8-2,0 (м, 17 Н),0,86 (с, 3H), 0,93 (с, 3H), 1,06 (с, 3H), 1,12 (с, 3H), 1,20 (с, 3H), 1,21 (с, 3H), 1,28 (с, 3H), 2,30 (д, J=7,8 Гц,1 Н), 2,54 (кв, J=10,2 Гц, 1H), 2,69 (дд, J=11,3, 4,3 Гц, 1H), 2,89 (тд, J=8,2, 4,3 Гц, 1 Н), 3,19 (с, 3H), 3,32 (с,3H), 3,72 (т, J=7,2 Гц, 1H), 4,66 (м, 1H). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным, и контактирование указанной клетки или ткани с соединением формулы I где каждый из X1, X2, и X3 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси,кето и гликозида;OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и представляет собой простую связь между 9 и 11 атомами углерода. 2. Способ по п.1, отличающийся тем, что указанное соединение включает 0 или 2 гликозида, ни один из которых не замещен дополнительным гликозидом. 3. Способ по п.1, отличающийся тем, что R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. 4. Способ по п.1, отличающийся тем, что X1 представляет собой OH или гликозид, каждый из X2 и 1OR представляет собой независимо OH или гликозид и X3 представляет собой OH или кето. 5. Способ по п.1, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6D-глюкопиранозида и циклоастрагенол 3D-ксилопиранозида. 6. Способ по п.5, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола и астрагалозид IV 16-она. 7. Способ по п.6, отличающийся тем, что указанное соединение представляет собой астрагалозид IV. 8. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным и контактирование указанной клетки или ткани с соединением формулы II где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида иOR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида. 9. Способ по п.8, отличающийся тем, что каждый X4 и OR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O). 10. Способ по п.8, отличающийся тем, что X4 представляет собой OH или гликозид и каждый из X5 3 и OR представляет собой OH. 11. Способ по п.10, отличающийся тем, что X4 представляет собой OH. 12. Способ увеличения активности теломеразы в клетке или ткани, включающий идентифицирование клетки или ткани, в которых увеличение активности теломеразы является желательным, и контактирование указанной клетки или ткани с соединением формулы III где каждый из X6, X7 и X8 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси,кето и гликозида, иOR4 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксильных групп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида. 13. Способ по п.12, отличающийся тем, что каждый из X6, X7, X8 и OR4 независимо выбран из гидроксигруппы и гликозида. 14. Способ по п.13, отличающийся тем, что каждый OR4, X6 и X8 представляет собой OH и X7 представляет собой гликозид. 15. Способ по п.14, отличающийся тем, что соединение представляет собой гинсенозид RH1. 16. Способ лечения состояния пациента путем увеличения активности теломеразы в клетках или ткани пациента, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I по п.1, или формулы II по п.8, или формулы III по п.12. 17. Способ по п.16, отличающийся тем, что соединение имеет формулу I или формулу II. 18. Способ по п.16, отличающийся тем, что указанное состояние представляет собой ВИЧ-инфекцию или дегенеративное заболевание. 19. Способ по п.18, отличающийся тем, что дегенеративное заболевание выбрано из группы, включающей нейродегенеративное заболевание, дегенеративное заболевание костей или суставов, дистрофию жлтого пятна сетчатки, атеросклероз и анемию. 20. Способ по п.16, отличающийся тем, что указанное состояние представляет собой рану или другое острое или хроническое состояние эпидермиса. 21. Фармацевтическая композиция, содержащая соединение формулы I в фармацевтически приемлемом носителе где каждый из X1 и X2 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида;OR1 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и представляет собой простую связь между 9 и 11 атомами углерода. 22. Композиция по п.21, отличающаяся тем, что R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. 23. Композиция по п.21, отличающаяся тем, что X1 представляет собой OH или гликозид и каждый 2 из X и OR1 представляет собой независимо OH или гликозид. 24. Композиция по п.21, отличающаяся тем, что соединение представляет собой астрагалозид IV 16-он. 25. Фармацевтическая композиция, содержащая соединение формулы I в фармацевтически приемлемом носителе где один из X1 и X2 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, и кето, а другой представляет собой гликозид и каждый из X3 и OR1 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида; иR2 представляет собой метил ипредставляет собой двойную связь между 9 и 11 атомами углерода или R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо и представляет собой простую связь между 9 и 11 атомами углерода. 26. Композиция по п.25, отличающаяся тем, что соединение включает 1 гликозид, который не замещен дополнительным гликозидом. 27. Композиция по п.25, отличающаяся тем, что R2 образует совместно с 9 атомом углерода конденсированное циклопропильное кольцо ипредставляет собой простую связь между 9 и 11 атомами углерода. 28. Композиция по п.25, отличающаяся тем, что соединение выбрано из циклоастрагенол 6Dглюкопиранозида и циклоастрагенол 3D-ксилопиранозида. 29. Фармацевтическая композиция, содержащая соединение формулы II в фармацевтически приемлемом носителе где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида, иOR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом так, что соединение включает, максимум, 3 гликозида. 30. Композиция по п.29, отличающаяся тем, что каждый из X4 и OR3 выбран из гидроксигруппы,низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O). 31. Композиция по п.30, отличающаяся тем, что X4 представляет собой OH или гликозид и каждый 5 из X и OR3 представляет собой OH. 32. Способ лечения острого или хронического состояния эпидермиса, включающий контактирование эпидермальных клеток с наносимым местно составом выделенного соединения формулы I по п.1,или формулы II по п.8, или формулы III по п.12. 33. Способ по п.32, отличающийся тем, что соединение имеет формулу I или формулу II.- 28009442 34. Способ по п.32, отличающийся тем, что указанное острое или хроническое состояние выбрано из группы, включающей рану, ожог, ссадину, надрез, имплантацию, повреждение, вызванное инфекционным агентом, хроническую венозную язву, диабетическую язву, компрессионную язву, рану от сдавления, язву слизистой оболочки и келоидное образование. 35. Фармацевтическая композиция, содержащая наносимый местно состав выделенного соединения формулы I по п.1, или формулы II по п.8, или формулы III по п.12. 36. Композиция по п.35, отличающаяся тем, что соединение имеет формулу I или формулу II. 37. Композиция по п.35, отличающаяся тем, что соединение присутствует в составе в концентрации по крайней мере 0,1% (вес./об.). 38. Применение соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 для изготовления лекарственного средства для лечения заболевания путем увеличения активности теломеразы в клетке или ткани. 39. Применение по п.38, отличающееся тем, что заболевание представляет собой ВИЧ-инфекцию или дегенеративное заболевание. 40. Применение по п.39, отличающееся тем, что заболевание представляет собой ВИЧ. 41. Применение по п.39, отличающееся тем, что дегенеративное заболевание выбрано из группы,включающей нейродегенеративное заболевание, дегенеративное заболевание костей или суставов, дистрофию жлтого пятна сетчатки, атеросклероз и анемию. 42. Применение соединения формулы I по п.1, формулы II по п. 8 или формулы III по п.12 для изготовления лекарственного средства для лечения хронических или острых состояний эпидермиса. 43. Применение по п.42, отличающееся тем, что острое или хроническое состояние выбрано из группы, включающей рану, ожог, ссадину, надрез, имплантацию, повреждение, вызванное инфекционным агентом, хроническую венозную язву, диабетическую язву, компрессионную язву, рану от сдавления, язву слизистой оболочки и келоидное образование. 44. Применение по п.38 или 42, отличающееся тем, что соединение имеет формулу I или формулу II. 45. Способ повышения репликативной способности клеток in vitro или ex vivo, включающий контактирование клеток с соединением формулы I по п.1, формулы II по п.8 или формулы III по п.12, взятым в количестве, эффективном для увеличения активности теломеразы в указанных клетках. 46. Способ по п.45, отличающийся тем, что соединение имеет формулу I или формулу II. 47. Способ по п.45, отличающийся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6D-глюкопиранозида, циклоастрагенол 3 В-ксилопиранозида и 20R, 24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диена. 48. Способ по п.45, отличающийся тем, что указанные клетки представляют собой эксплантантные клетки, полученные от пациента. 49. Способ по п.45, отличающийся тем, что указанные клетки представляют собой стволовые клетки. 50. Способ по п.45, отличающийся тем, что указанные клетки представляют собой ВИЧ-рестриктированные CD8+ клетки. 51. Способ выбора соединения, эффективного для увеличения активности теломеразы в клетке,включающий тестирование производного соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 на способность увеличения активности теломеразы в кератиноцитах или фибробластах в TRAPтестах и выбор производного, если оно является эффективным, с точки зрения увеличения уровня активности теломеразы в кератиноцитах или фибробластах, при концентрации 1 мкг/мл в растворителе по крайней мере на 50% выше по сравнению с измеренной в указанных клетках, обработанных растворителем. 52. Способ по п.51, отличающийся тем, что указанное производное выбирают по эффективности повышать уровень активности теломеразы в кератиноцитах или фибробластах в TRAP-тестах при концентрации 1 мкг/мл в растворителе по крайней мере на 100% выше по сравнению измеренной в указанных клетках, обработанных указанным растворителем. 53. Способ выбора агента для лечения острых или хронических состояний эпидермиса, включающий тестирование производного соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12 для повышения активности заживления раны, в тесте с царапиной на кератиноцитах или фибробластах, и выбор производного, обладающего активностью заживления раны, при концентрации 1 мкг/мл по крайней мере на 50% выше, чем у контроля с растворителем. 54. Способ по п.53, отличающийся тем, что указанное производное выбирается, если оно обладает активностью заживления раны, как установлено в тестах с царапиной, при концентрации 1 мкг/мл по крайней мере на 100% выше, чем у контроля с растворителем. 55. Композиция биологически активной добавки, содержащая биологически активный состав соединения формулы I по п.1, формулы II по п.8 или формулы III по п.12. 56. Композиция по п.55, отличающаяся тем, что соединение имеет формулу I или формулу II. 57. Композиция по п.56, отличающаяся тем, что соединение выбрано из астрагалозида IV, циклоастрагенола, астрагенола, астрагалозид IV 16-она, циклоастрагенол 6D-глюкопиранозида, циклоастрагенол 3D-ксилопиранозида и 20R,24S-эпокси-3,16,25-тригидрокси-9-метил-19-норланост-1,5-диена.- 29009442 58. Композиция по п.55, отличающаяся тем, что состав биологически активной добавки содержит дополнительно к соединению биологически активную добавку травяного экстракта. 59. Соединение формулы II где каждый из X4 и X5 независимо выбран из гидроксигруппы, низшего алкокси, низшего ацилокси, кето и гликозида иOR3 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и гликозида; где любая из гидроксигрупп на указанном гликозиде может быть замещена дополнительным гликозидом, низшим алкилом или низшим ацилом. 60. Соединение по п.59, отличающееся тем, что каждый из X4 и OR3 выбран из гидроксигруппы,низшего алкокси, низшего ацилокси и гликозида и X5 выбран из гидроксигруппы, низшего алкокси, низшего ацилокси и кето(=O). 61. Соединение по п.59, отличающееся тем, что X4 представляет собой OH или гликозид и каждый 5 из X и OR3 представляет собой OH. 62. Соединение по п.61, отличающееся тем, что X4 представляет собой OH.
МПК / Метки
МПК: C07J 1/00, A61K 31/70
Метки: способы, активности, теломеразы, увеличения, композиции
Код ссылки
<a href="https://eas.patents.su/30-9442-kompozicii-i-sposoby-uvelicheniya-aktivnosti-telomerazy.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции и способы увеличения активности теломеразы</a>
Предыдущий патент: Пиразолпиридины и способы их получения и применения
Следующий патент: Получение рекомбинантных генов в saccharomyces cerevisiae
Случайный патент: Катализаторы фишера-тропша