Гидрофильные, реакционные в отношении тиол-группы цианиновые красители, и их коньюгаты с биомолекулами для флюоресцентной диагностики
Формула / Реферат
1. Индотрикарбоцианиновый краситель формулы (I)
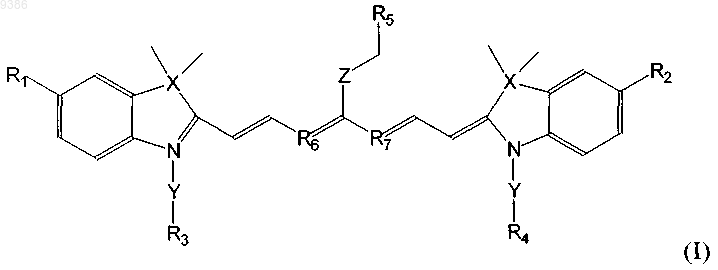
в которой
X обозначает С, который замещен в двух положениях метильной группой, Y обозначает СН2-СН2,
Z обозначает С1-5алкил, при этом атомы углерода необязательно замещены О, или обозначает группу
R1-R4 независимо друг от друга обозначают SO3H, R5 обозначает -CO-NH-R8-R9 или СООН, где R8 обозначает неразветвленный С2-13алкил, в котором С атомы необязательно замещены О, а R9 выбирают из
или
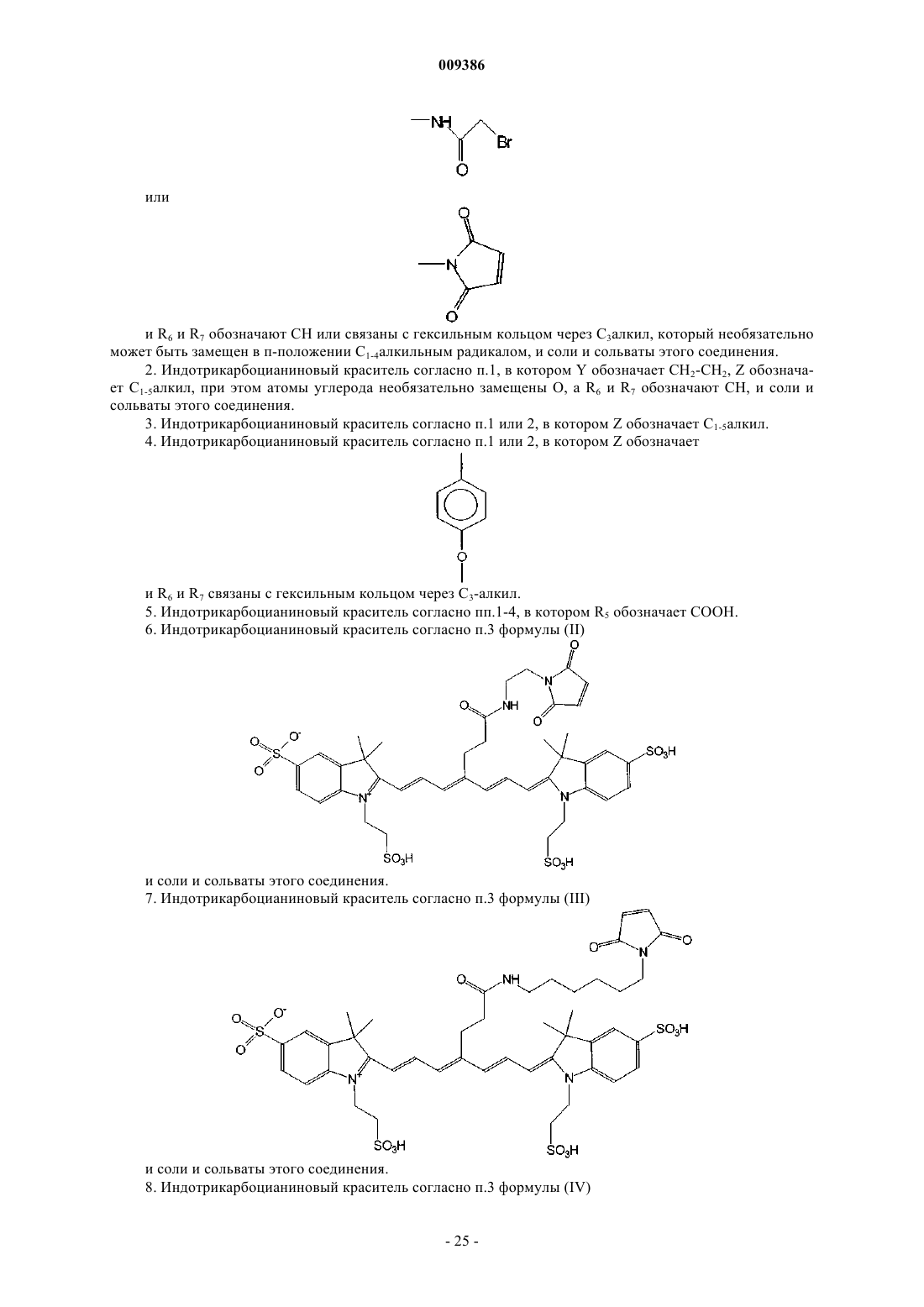
и R6 и R7 обозначают СН или связаны с гексильным кольцом через С3алкил, который необязательно может быть замещен в п-положении С1-4алкильным радикалом, и соли и сольваты этого соединения.
2. Индотрикарбоцианиновый краситель согласно п.1, в котором Y обозначает СН2-СН2, Z обозначает С1-5алкил, при этом атомы углерода необязательно замещены О, а R6 и R7 обозначают СН, и соли и сольваты этого соединения.
3. Индотрикарбоцианиновый краситель согласно п.1 или 2, в котором Z обозначает С1-5алкил.
4. Индотрикарбоцианиновый краситель согласно п.1 или 2, в котором Z обозначает
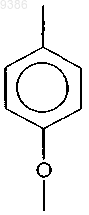
и R6 и R7 связаны с гексильным кольцом через С3-алкил.
5. Индотрикарбоцианиновый краситель согласно пп.1-4, в котором R5 обозначает СООН.
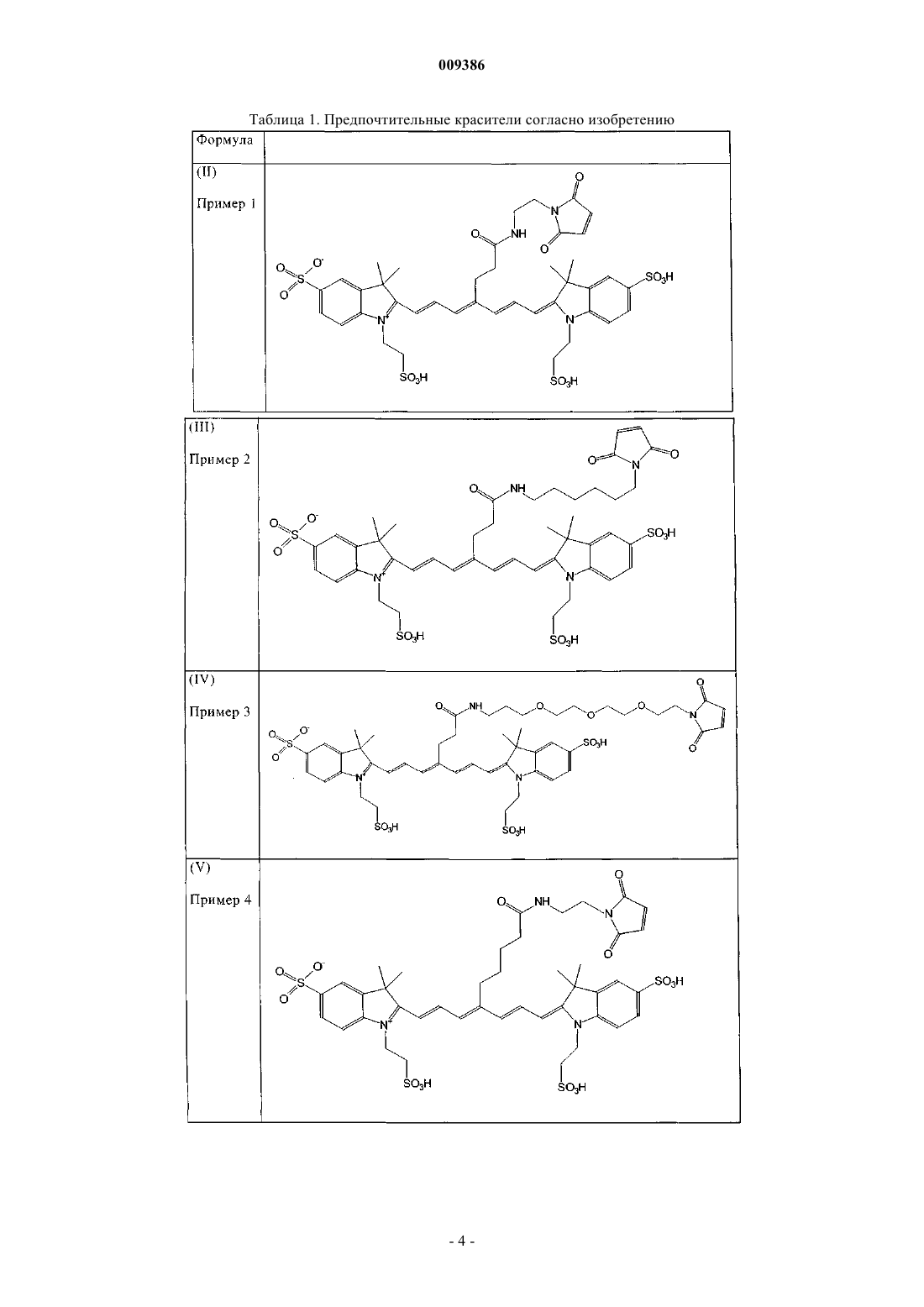
6. Индотрикарбоцианиновый краситель согласно п.3 формулы (II)
и соли и сольваты этого соединения.
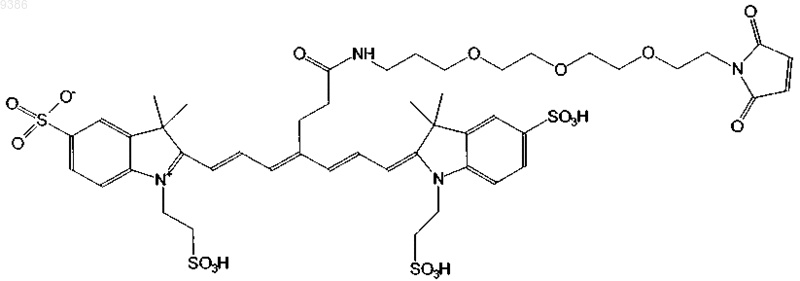
7. Индотрикарбоцианиновый краситель согласно п.3 формулы (III)
и соли и сольваты этого соединения.
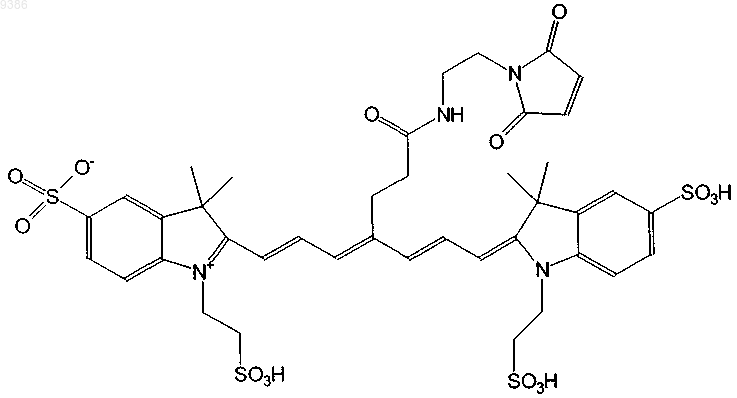
8. Индотрикарбоцианиновый краситель согласно п.3 формулы (IV)
и соли и сольваты этого соединения.
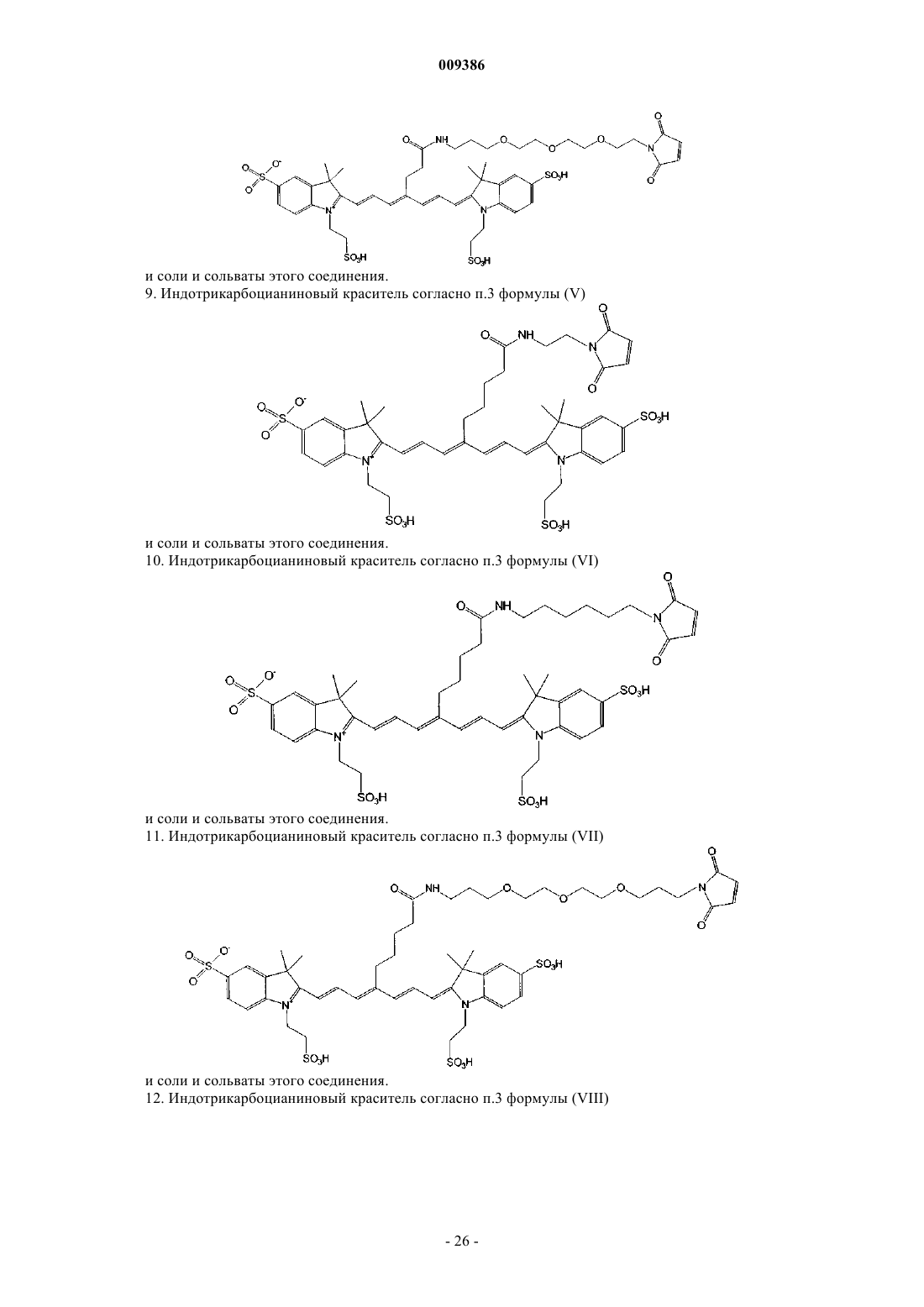
9. Индотрикарбоцианиновый краситель согласно п.3 формулы (V)

и соли и сольваты этого соединения.
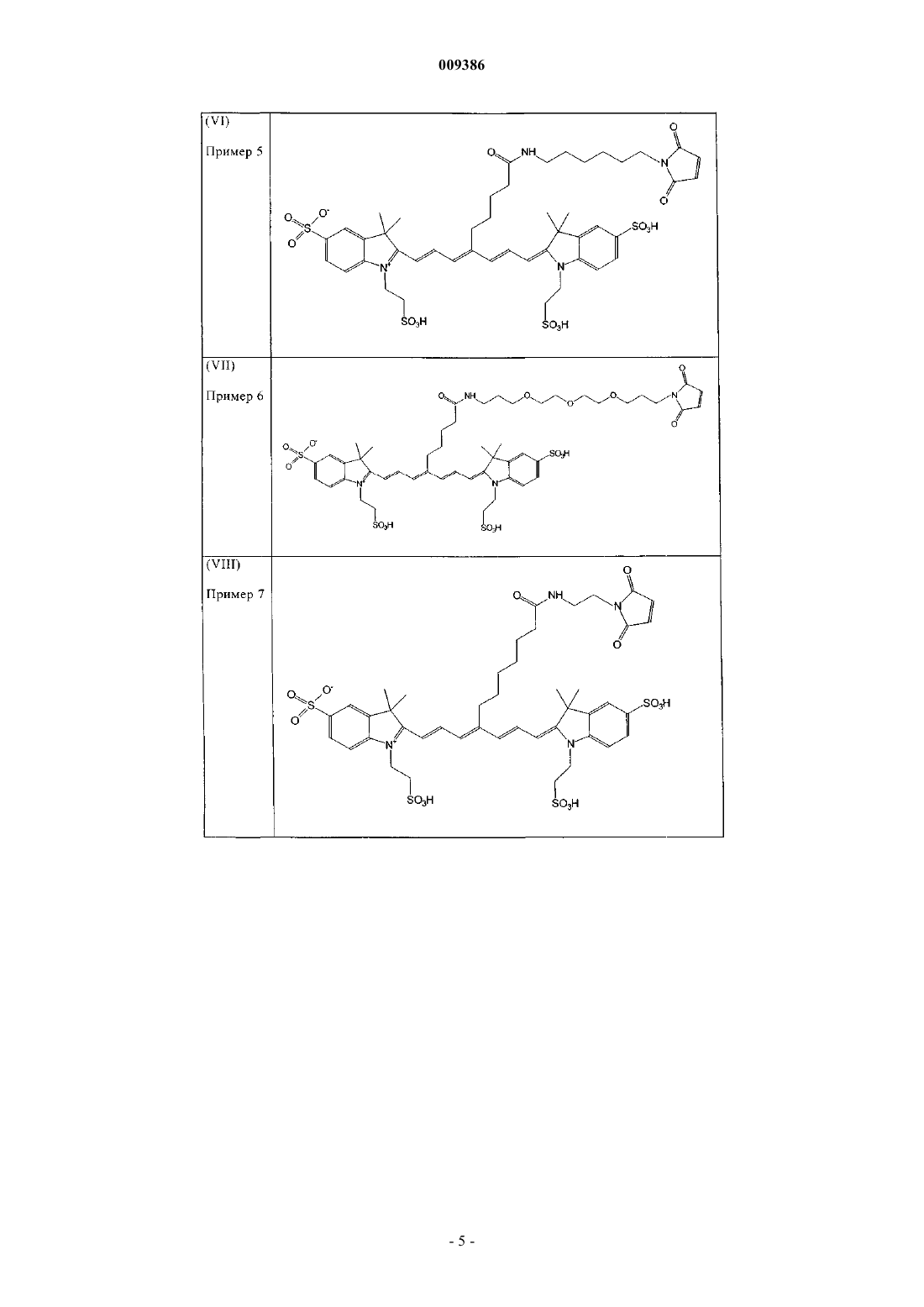
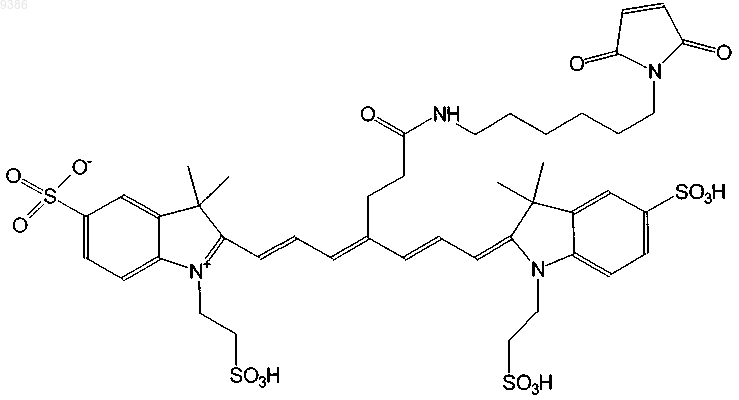
10. Индотрикарбоцианиновый краситель согласно п.3 формулы (VI)
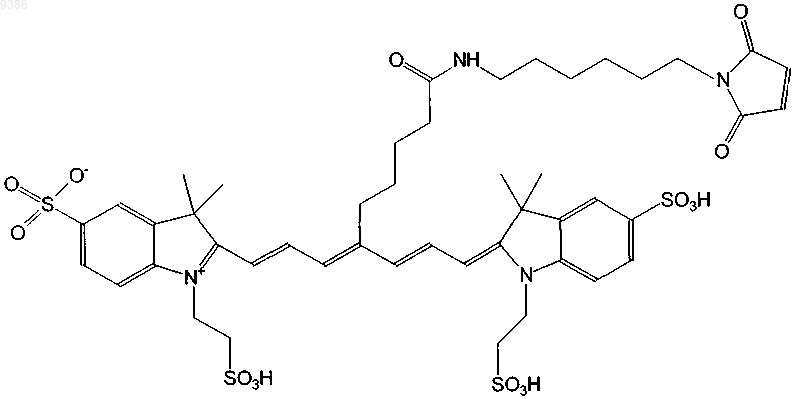
и соли и сольваты этого соединения.
11. Индотрикарбоцианиновый краситель согласно п.3 формулы (VII)
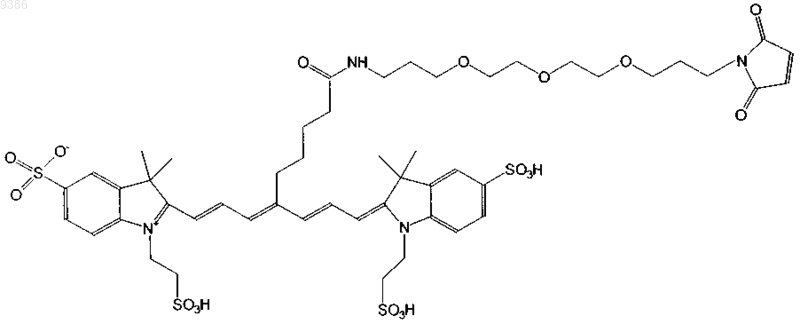
и соли и сольваты этого соединения.
12. Индотрикарбоцианиновый краситель согласно п.3 формулы (VIII)

и соли и сольваты этого соединения.
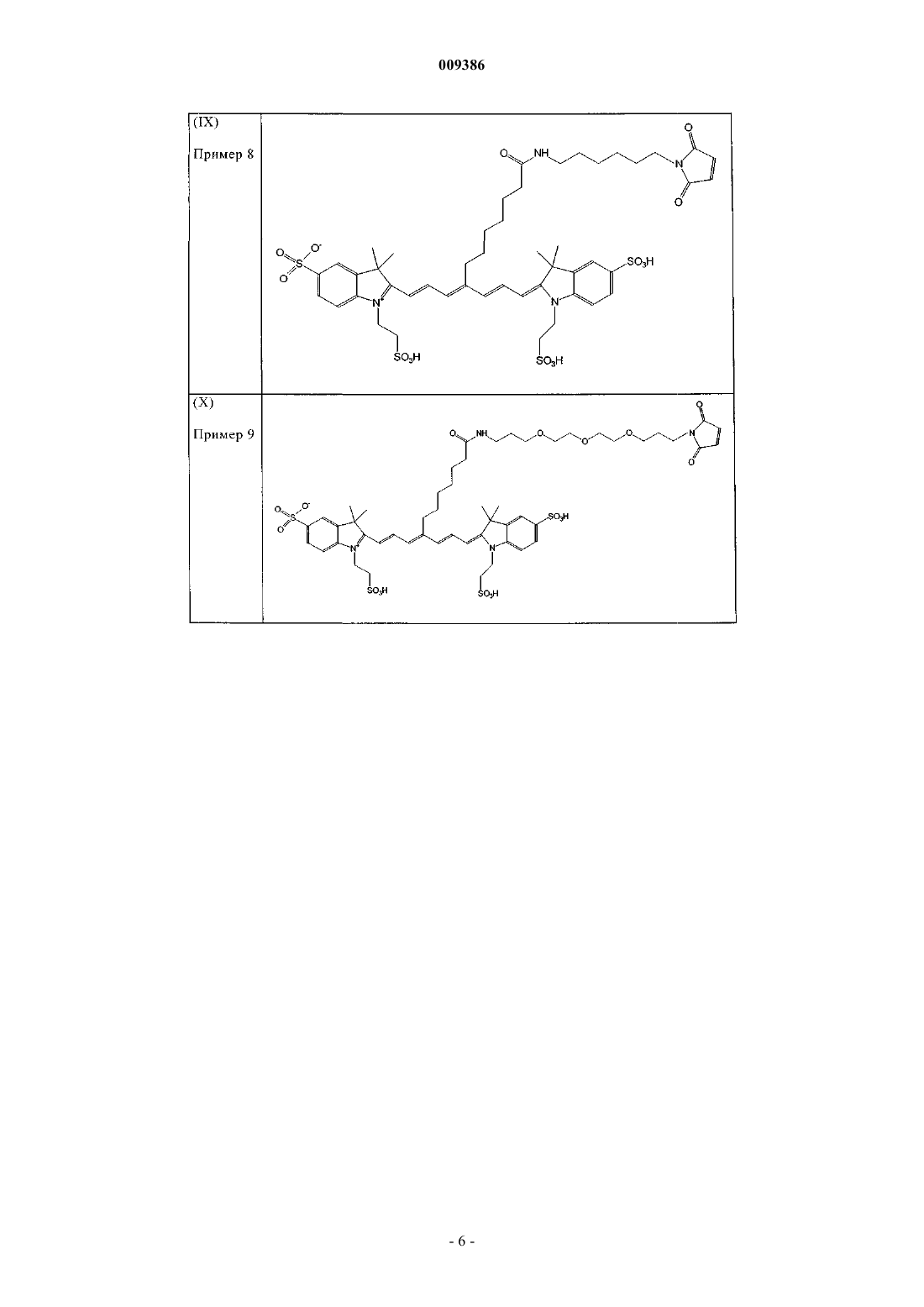
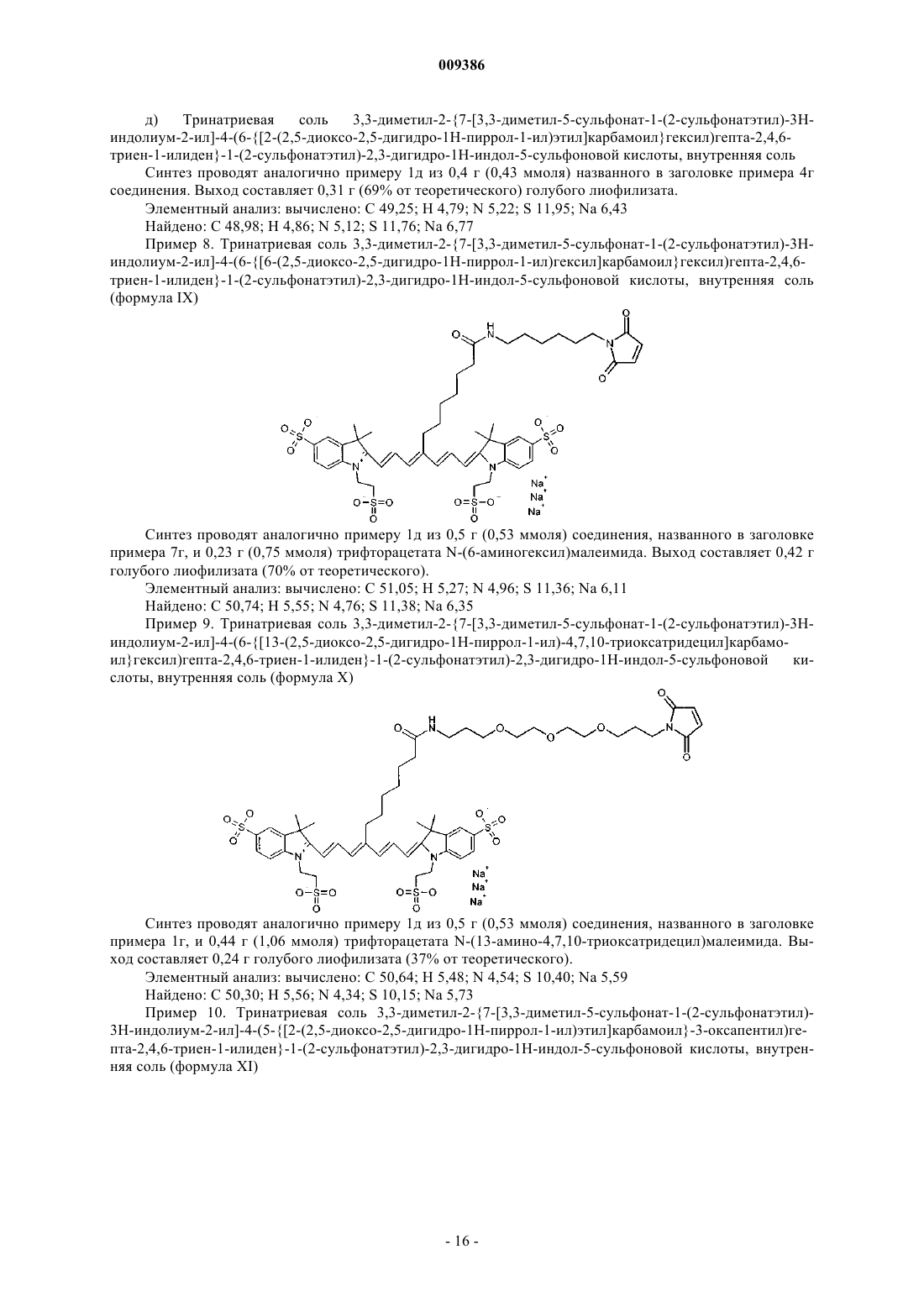
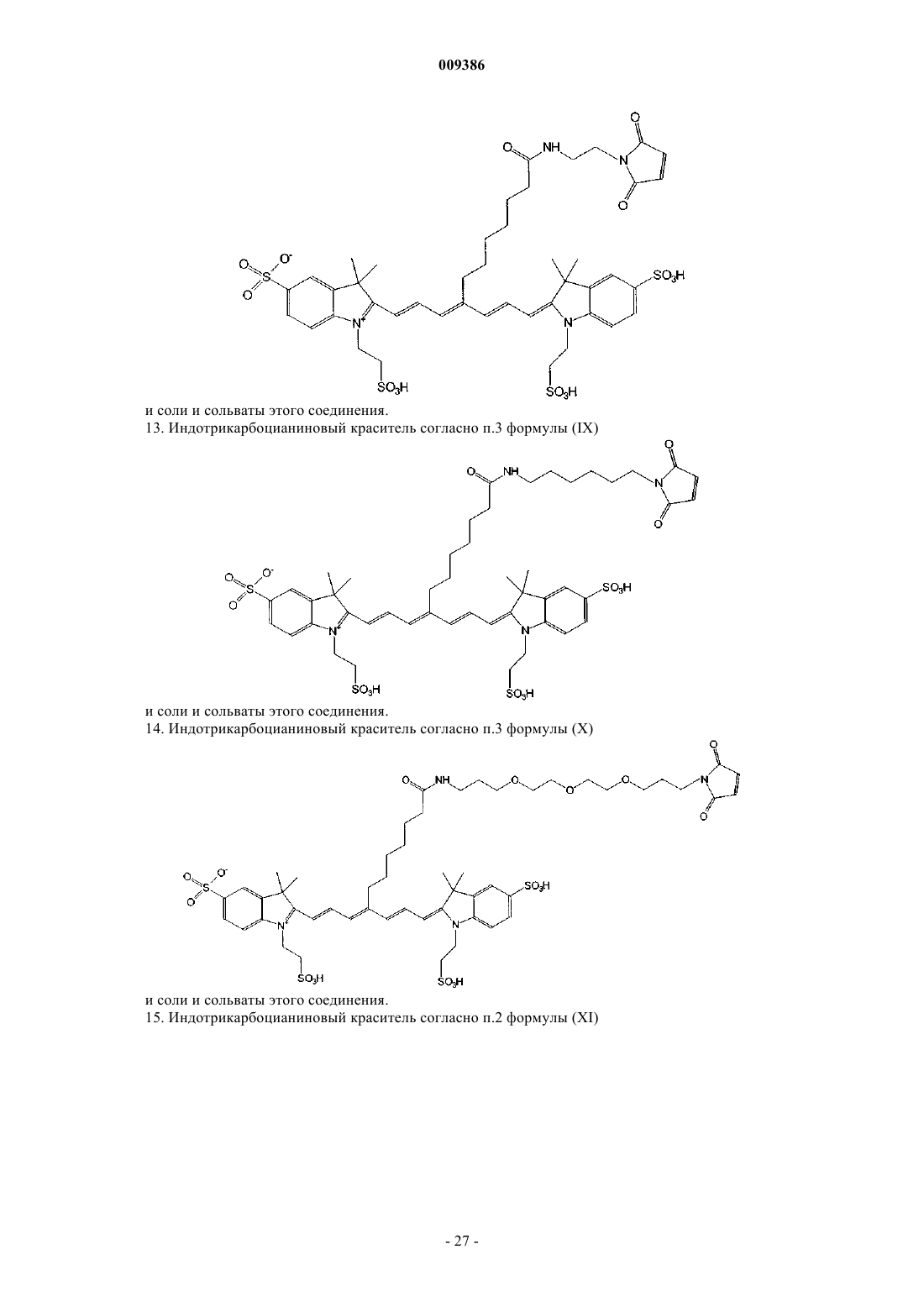
13. Индотрикарбоцианиновый краситель согласно п.3 формулы (IX)
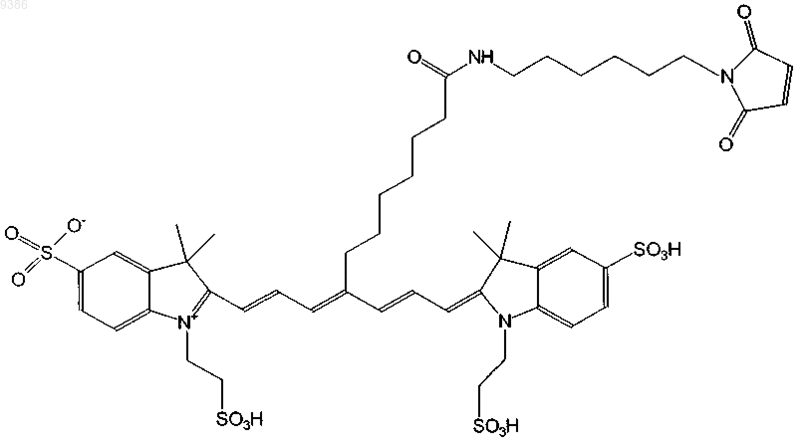
и соли и сольваты этого соединения.
14. Индотрикарбоцианиновый краситель согласно п.3 формулы (X)
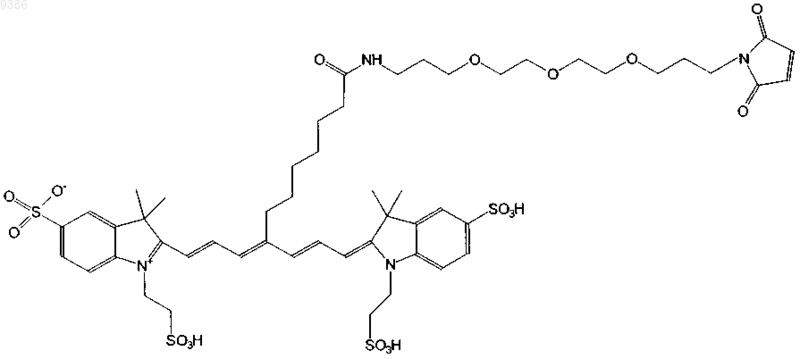
и соли и сольваты этого соединения.
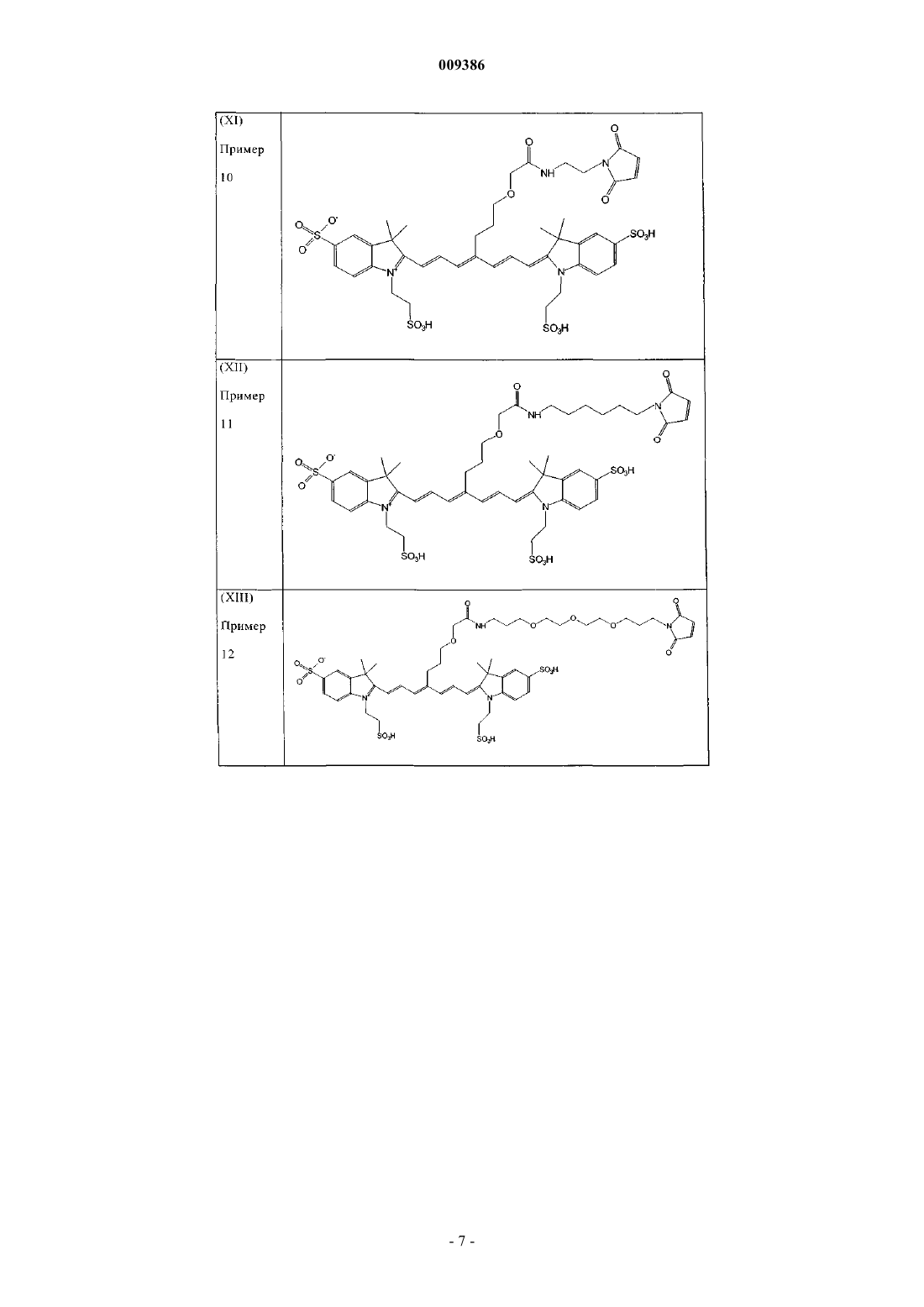
15. Индотрикарбоцианиновый краситель согласно п.2 формулы (XI)
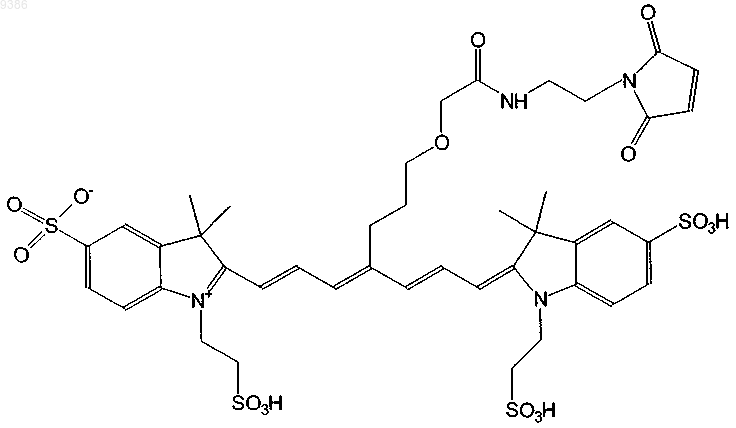
и соли и сольваты этого соединения.
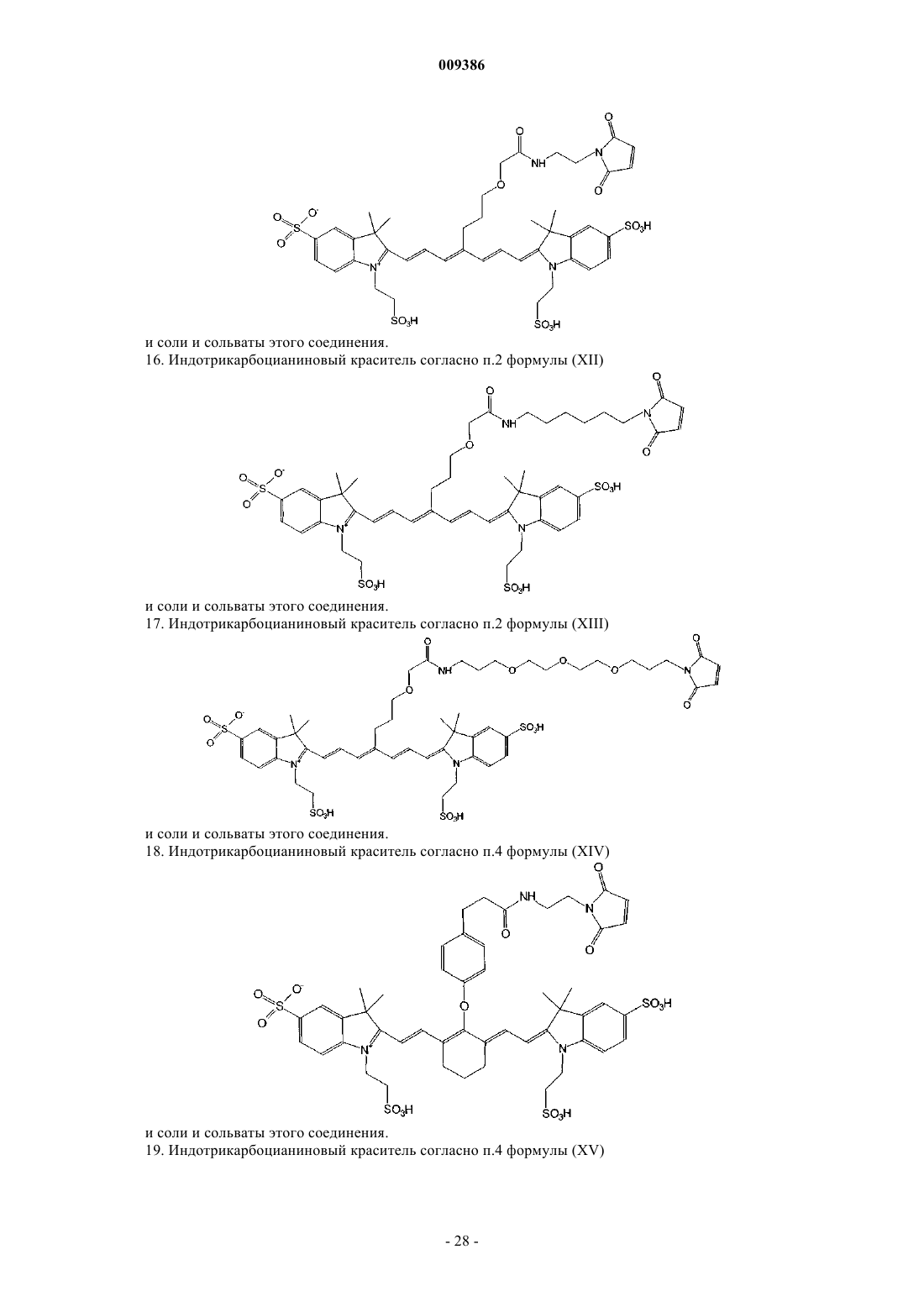
16. Индотрикарбоцианиновый краситель согласно п.2 формулы (XII)
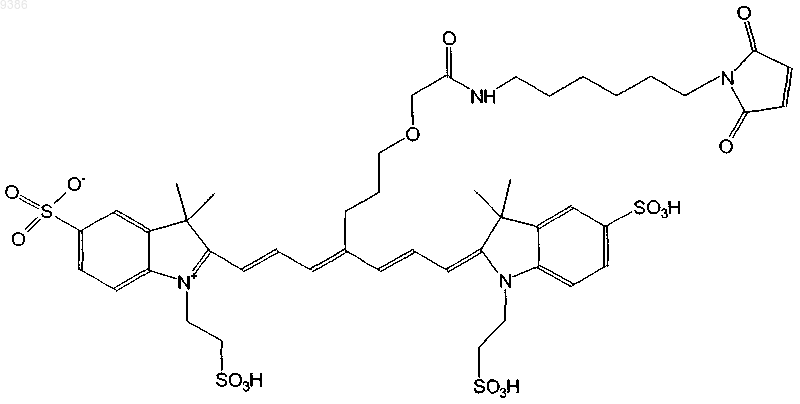
и соли и сольваты этого соединения.
17. Индотрикарбоцианиновый краситель согласно п.2 формулы (XIII)
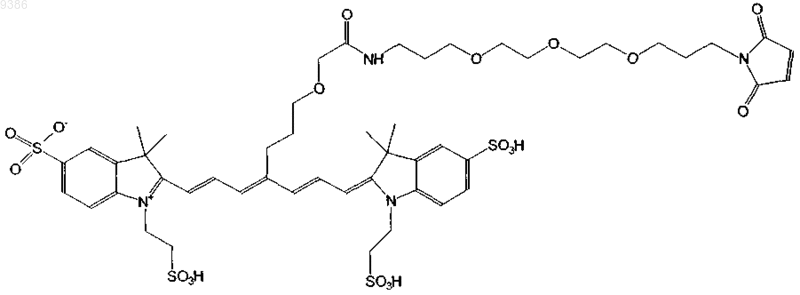
и соли и сольваты этого соединения.
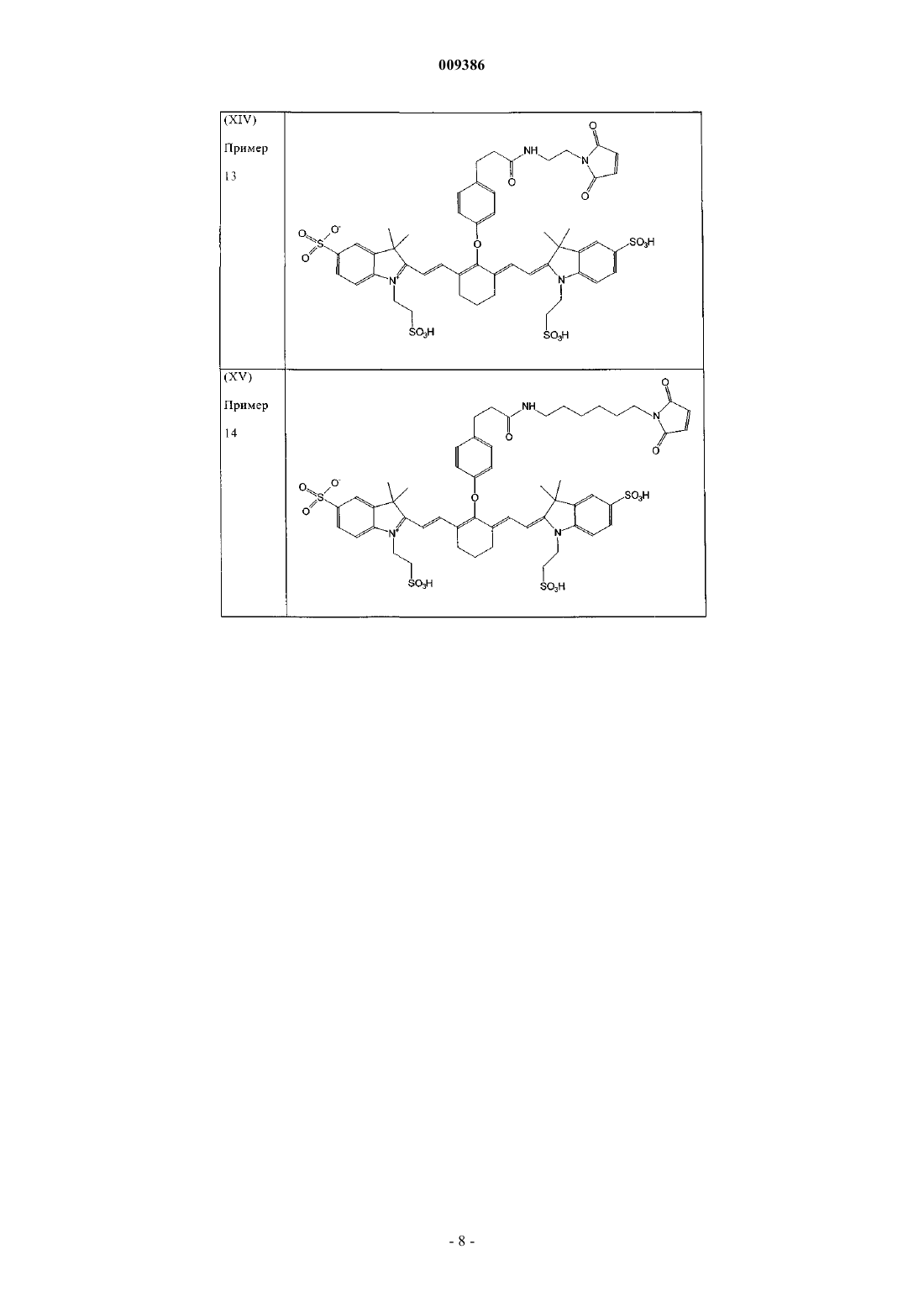
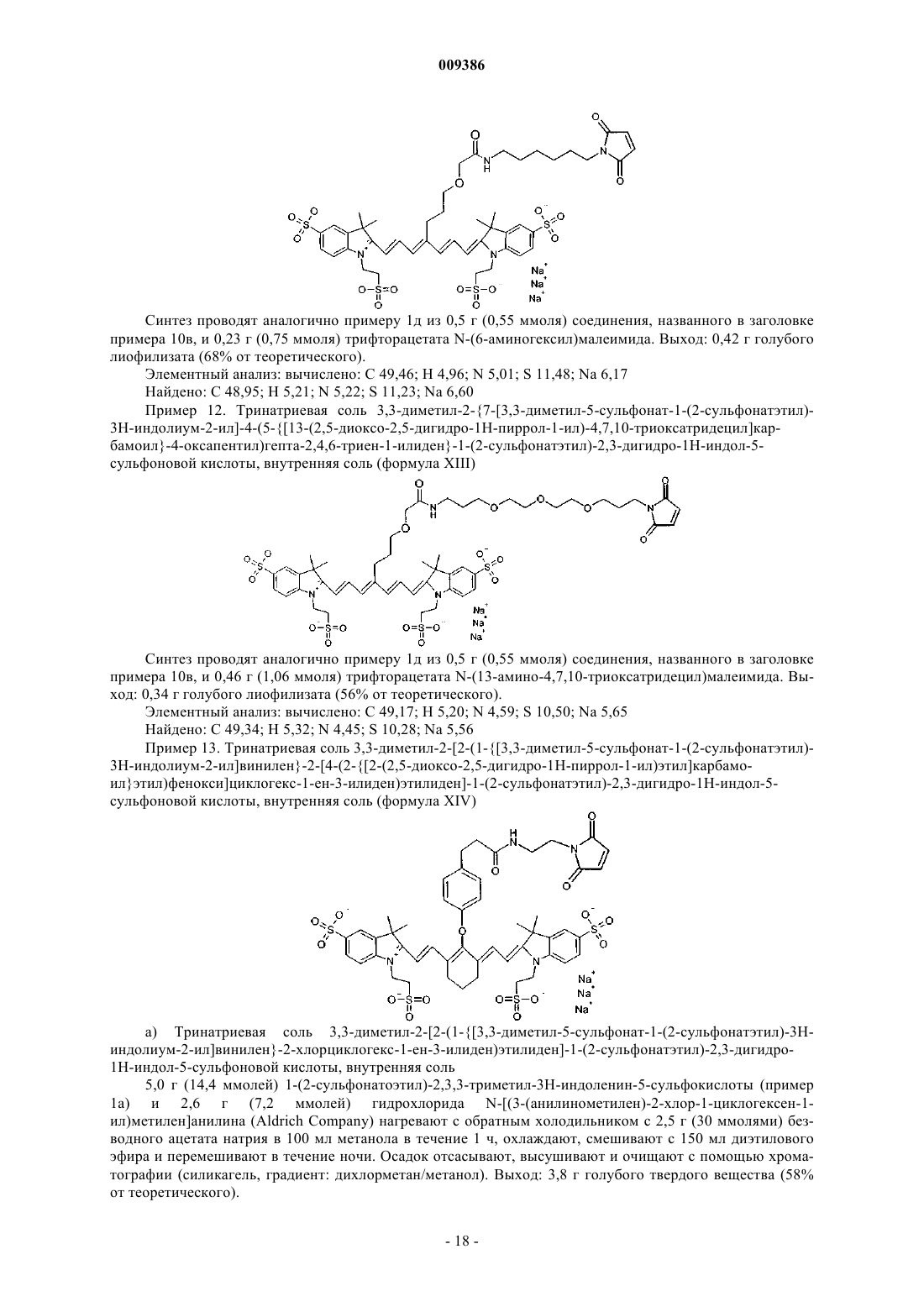
18. Индотрикарбоцианиновый краситель согласно п.4 формулы (XIV)
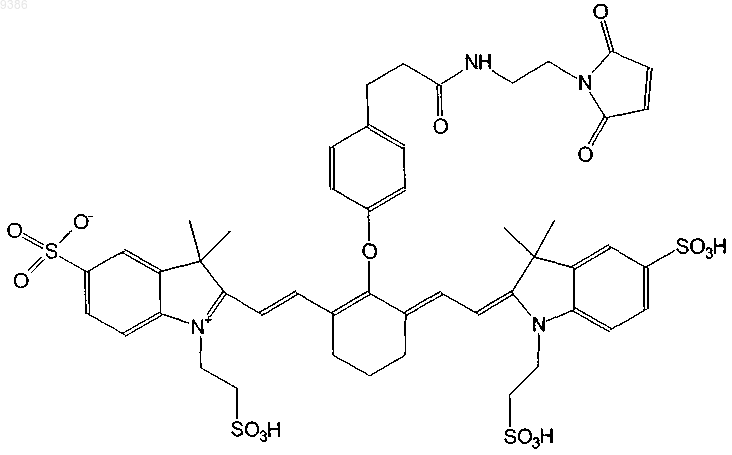
и соли и сольваты этого соединения.
19. Индотрикарбоцианиновый краситель согласно п.4 формулы (XV)

и соли и сольваты этого соединения.
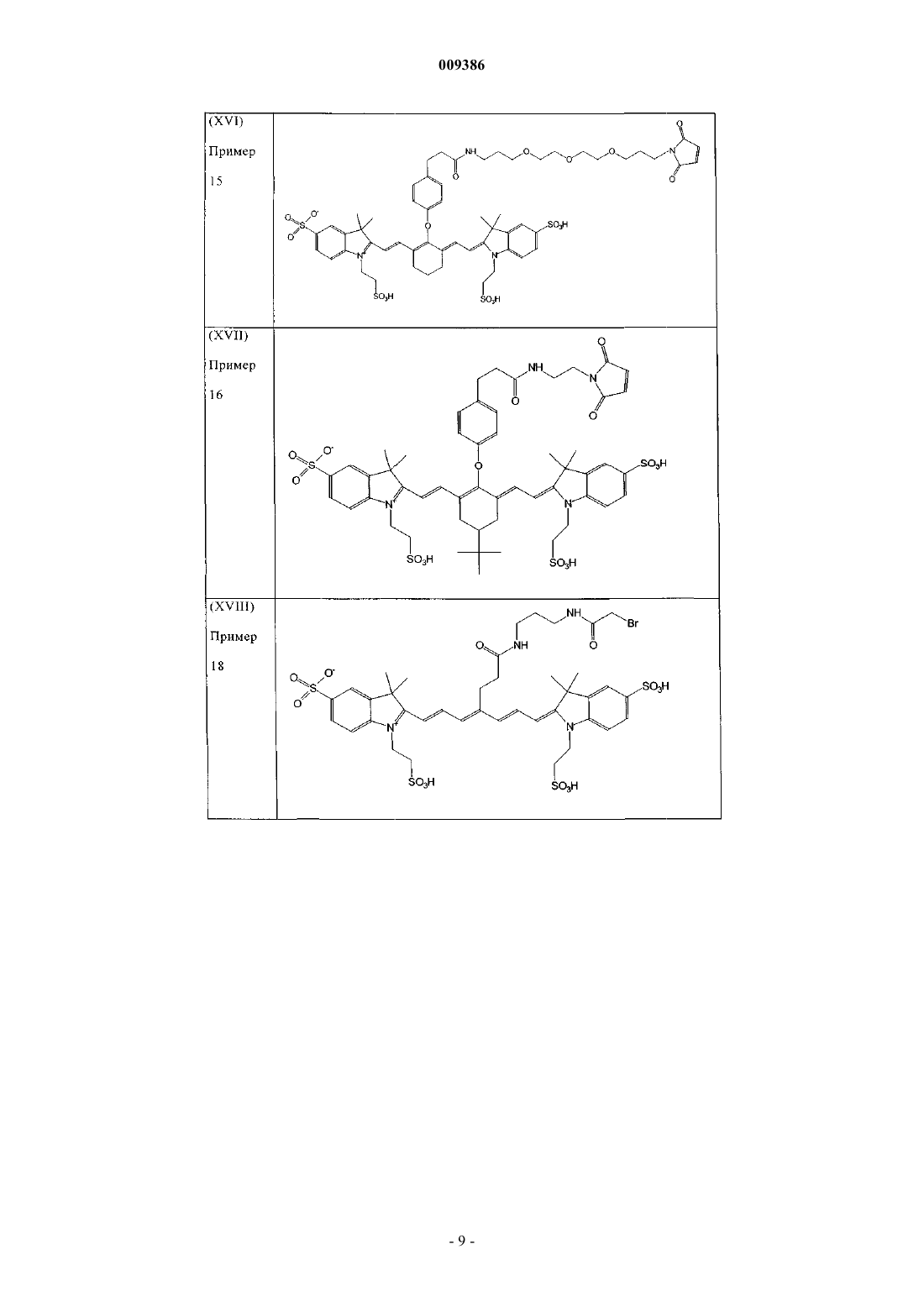
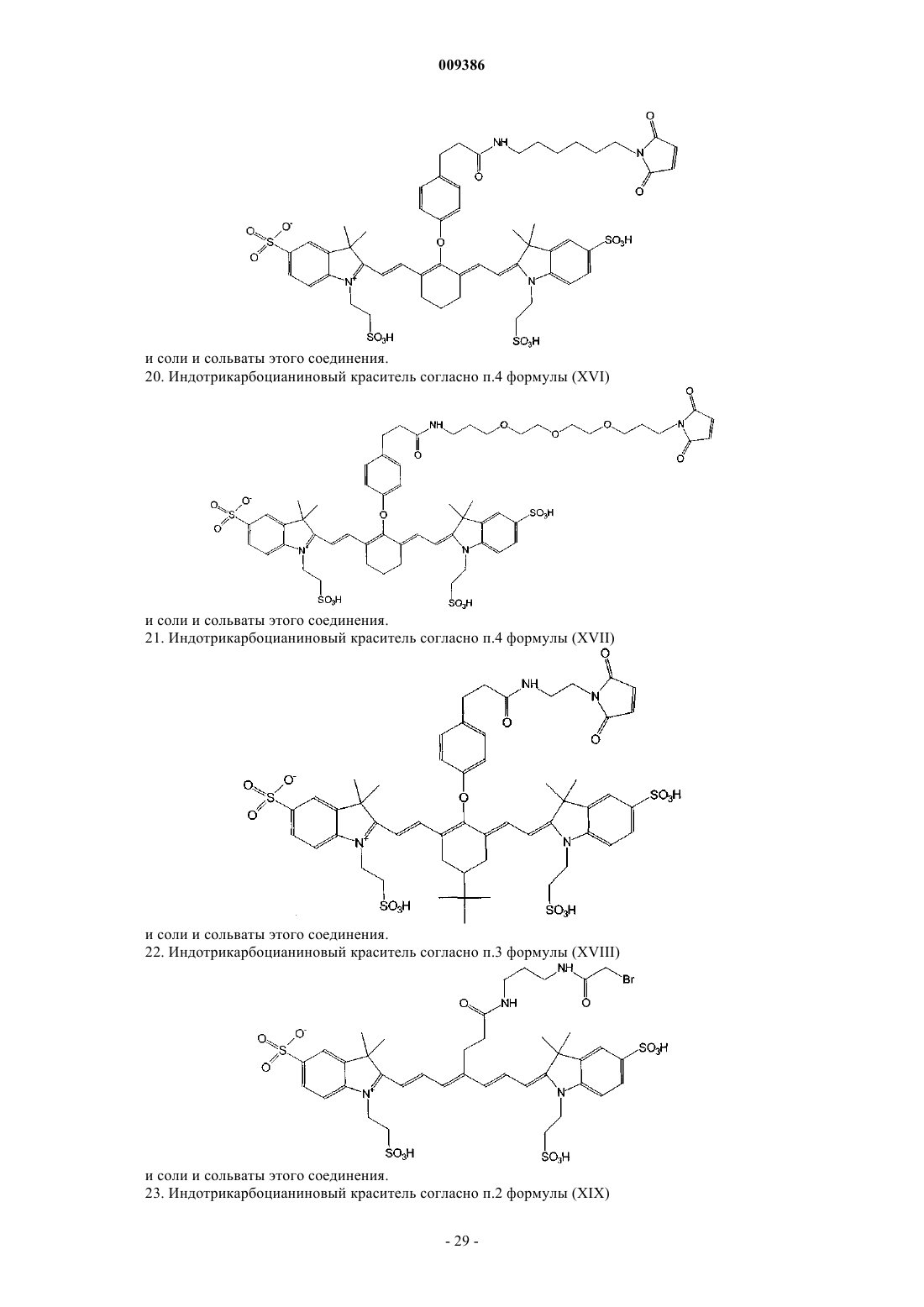
20. Индотрикарбоцианиновый краситель согласно п.4 формулы (XVI)
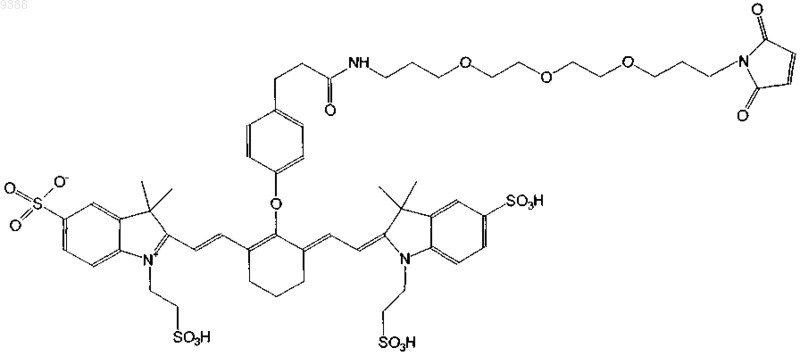
и соли и сольваты этого соединения.
21. Индотрикарбоцианиновый краситель согласно п.4 формулы (XVII)
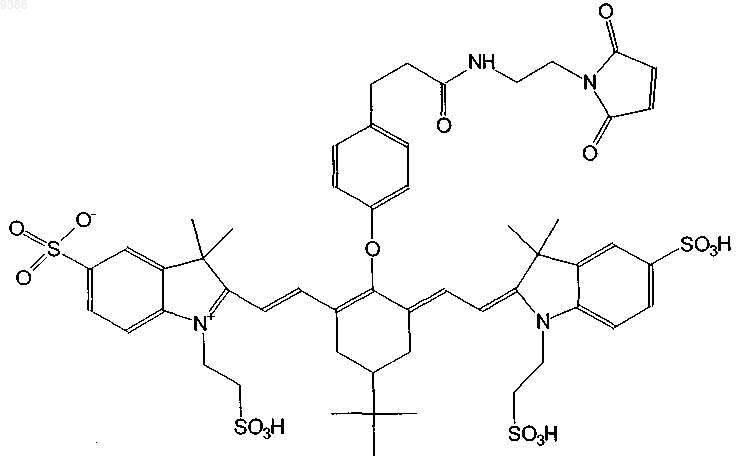
и соли и сольваты этого соединения.
22. Индотрикарбоцианиновый краситель согласно п.3 формулы (XVIII)
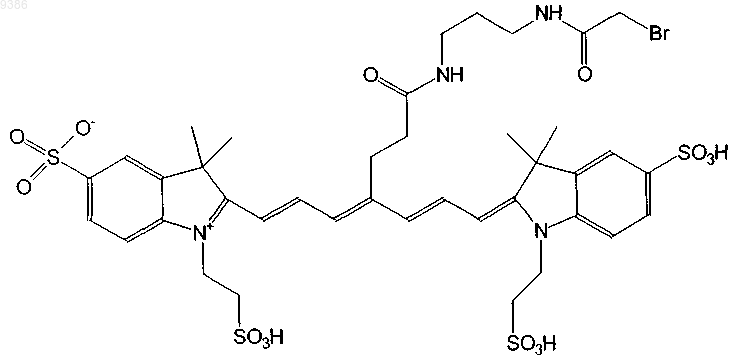
и соли и сольваты этого соединения.
23. Индотрикарбоцианиновый краситель согласно п.2 формулы (XIX)
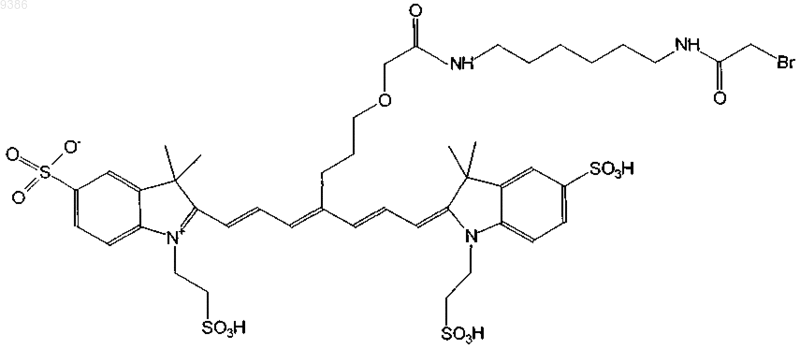
и соли и сольваты этого соединения.
24. Индотрикарбоцианиновый краситель согласно п.4 формулы (XX)
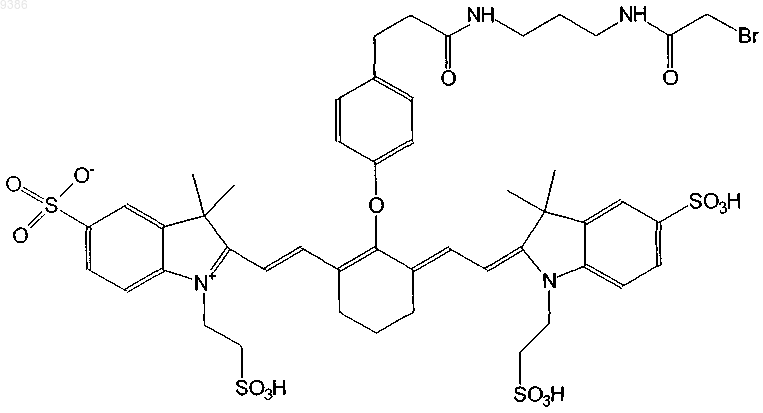
и соли и сольваты этого соединения.
25. Способ получения индотрикарбоцианинового красителя формулы (I) по одному из пп.1-24, включающий:
а) получение соответствующего 4-замещенного пиридина,
б) превращение 4-замещенного пиридина посредством реакции Цинке-Кёнига в соответствующий мезозамещенный глутакональдегиддианилид, который является предшественником цианинового красителя, и
в) превращение мезозамещенного глутакональдегиддианилида в соответствующий индотрикарбоцианиновый краситель формулы (I).
26. Способ получения коньюгатов, включающий присоединение индотрикарбоцианинового красителя согласно одному из пп.1-24 к биомолекуле.
27. Коньюгат индотрикарбоцианинового красителя с биомолекулой, полученный согласно п.26.
28. Коньюгат согласно п.27, характеризующийся тем, что в качестве биомолекулы включает по крайней мере одну биомолекулу, выбранную из пептидов, белков, липопротеинов, антител или фрагментов антител, нуклеиновой кислоты, такой как, например, олиго- или полинуклеотиды из ДНК или РНК, аптамеров, РНК и Сахаров, таких как, например, моно-, ди-, три-, олиго- и полисахариды.
29. Коньюгат согласно п.28, где белок выбран из группы структурных белков или растворимых белков организма.
30. Коньюгат согласно п.28 или 29, где растворимый белок является сывороточным белком, таким как, например, HSA, BSA, яичный альбумин, ферментом, как, например, пероксидаза, или антителом, scFv фрагментом или F(ab).
31. Коньюгат согласно одному из пп.27-30, где растворимый белок имеет сродство по отношению к ED-B-фибронектину.
32. Коньюгат согласно одному из пп.27-31, где индотрикарбоцианиновый краситель присоединен к биомолекуле через SH-группу, в частности, через SH-группу к цистеину.
33. Диагностический набор, включающий индотрикарбоцианиновый краситель согласно одному из пп.1-24 и/или коньюгат согласно одному из пп.27-31, вместе с дополнительными адъювантами для осуществления диагностики в условиях in vivo, в частности, опухолей.
34. Применение коньюгата согласно одному из пп.27-31 в качестве флюоресцентной контрастной среды для in vivo диагностики опухолей.
Текст
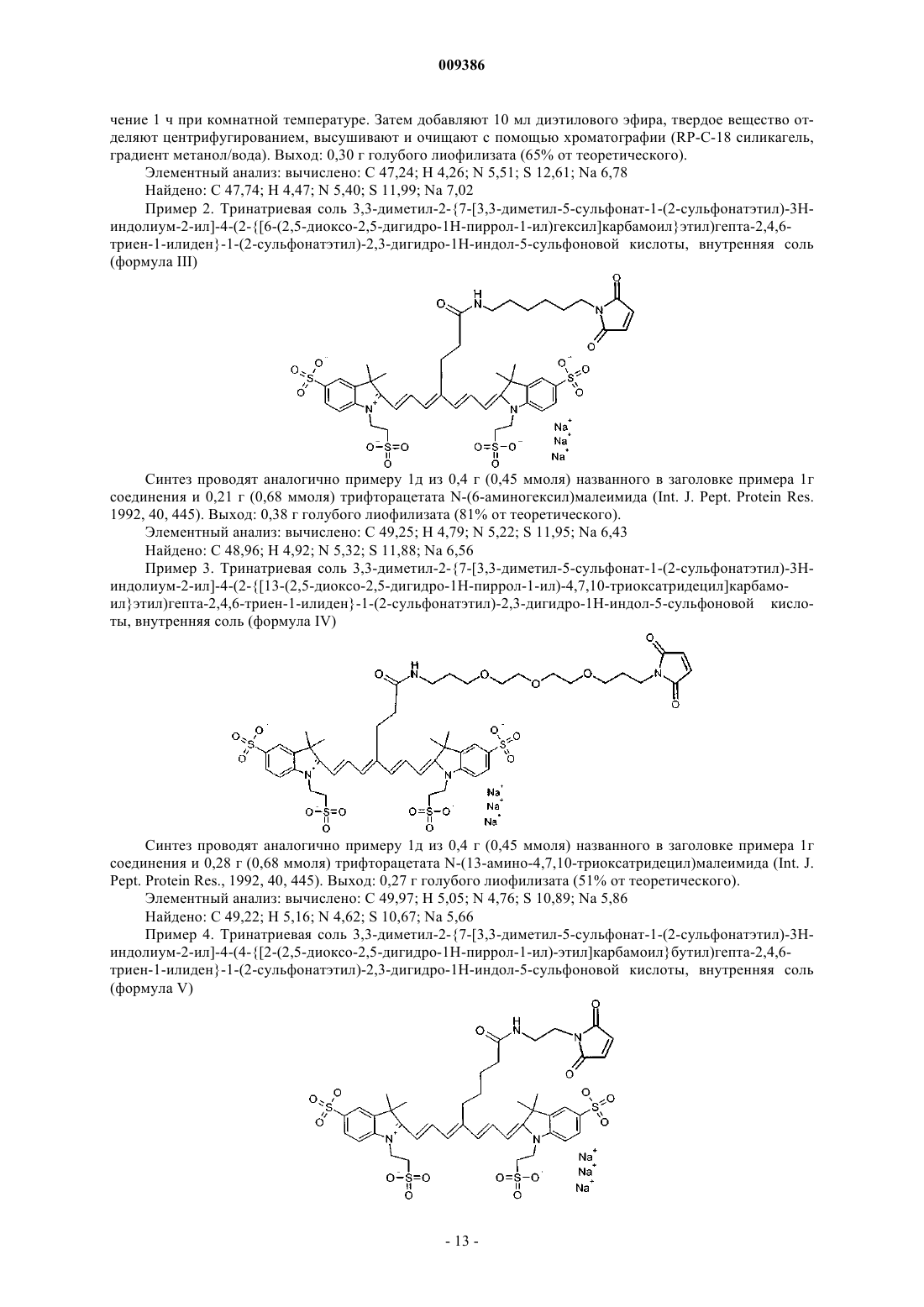
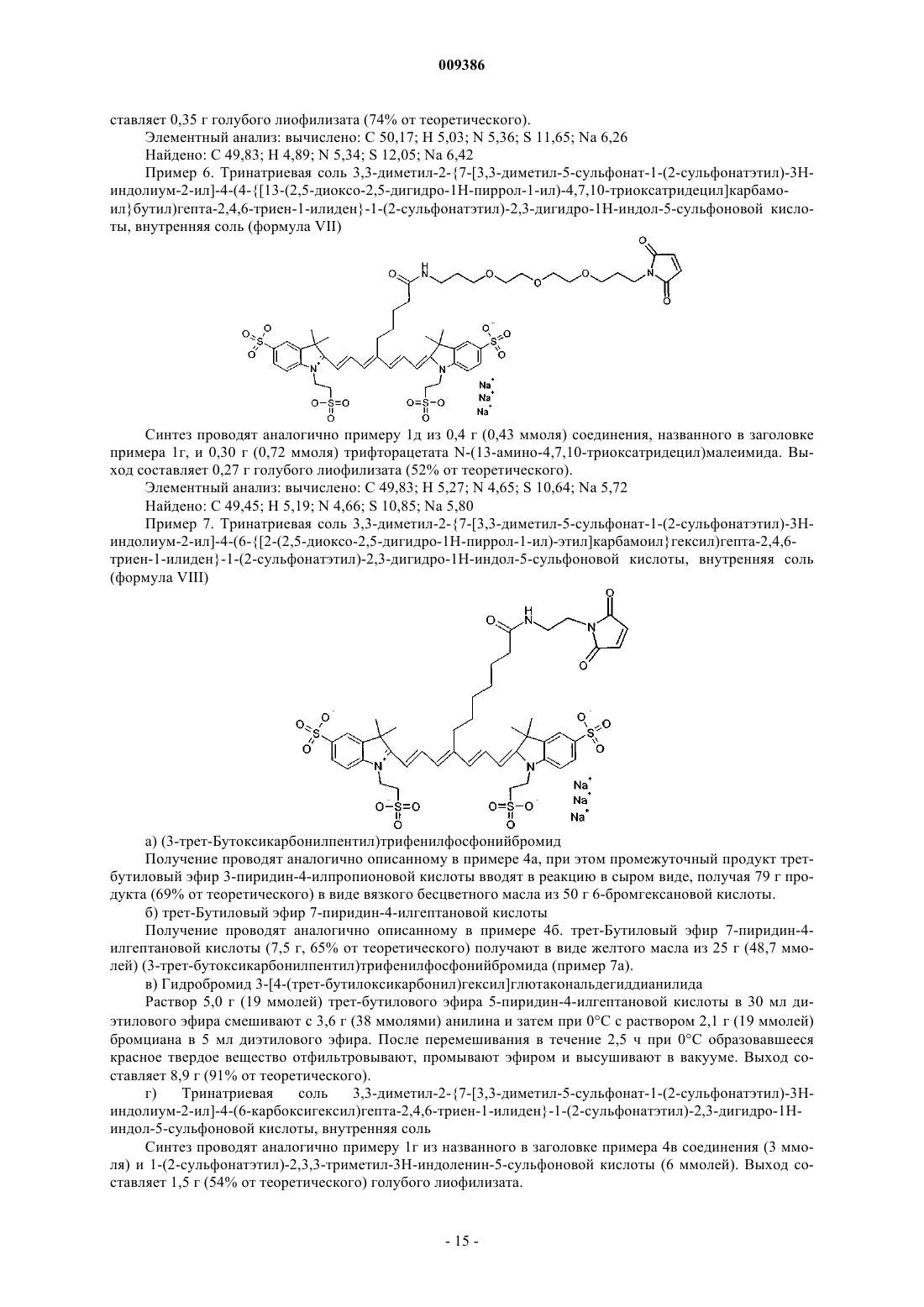
009386 Настоящее изобретение относится к новым флюоресцентным красителям из класса цианиновых красителей, в частности индотрикарбоцианинам с абсорбционным и флюоресцентным максимумом в спектральной области от 700 до 900 нм, с реакционной группой, специфической в отношении тиолгруппы, и тремя, предпочтительно четырьмя, сульфонатными группами, к увеличению растворимости в воде, а также к получению красителей. Настоящее изобретение относится также к коньюгатам этих красителей с биомолекулами и их применению. Предпосылки изобретения В последнее время приобрело значение использование света в медицинской диагностике (см., например, Biomedical Photonics Handbook (Editor: T. Vo-Dinh), CRC Press). При проведении экспериментальных исследований разработано большое количество разнообразных диагностических методов для применения в различных медицинских областях, например эндоскопии, маммографии, хирургии и гинекологии. Базирующиеся на применении света процессы имеют высокую инструментальную чувствительность и делают возможным молекулярное обнаружение и визуализацию малейших количеств хромофоров и/или флюорофоров (Weissleder et al. (2001) Molecular Imaging, Radiology 219, 316-333). Красители, которые вводят в ткани в качестве экзогенных контрастных сред с целью флюоресцентной диагностики и визуализации, в особенности флюоресцентные красители с абсорбционным и флюоресцентным максимумом в спектральной области 700-900 нм (диагностическое окно тканей), представляют особый интерес для применения в условиях in vivo. Протоны этих длин волн сравнительно мало абсорбируются тканями и могут поэтому проникать в ткани на несколько сантиметров перед тем, как абсорбционный процесс (главным образом, посредством действия оксигемоглобина и деоксигемоглобина) остановит перемещение света. Абсорбция может происходить, кроме того, с помощью флюоресцентных красителей, которые вводятся в ткань, но которые излучают абсорбированную энергию в виде более длинноволнового флюоресцентного излучения. Флюоресцентная радиация может быть обнаружена спектрально и делает возможной локализацию красителей и корреляцию с молекулярными структурами, к которым краситель присоединен (см. в связи с этим Licha, K. (2002) Contrast Agents for Optical Imaging(Review). B: Topics in Current Chemistry - Contrast Agents II (Editor: W. Krause), Volume 222, Springer Heidelberg, стр. 1-31). Чтобы достичь диагностически существенного различия между болезненными структурами и здоровыми тканями, вводимый краситель должен приводить к высокой, насколько это возможно, разнице концентраций между тканями. Это может быть осуществлено, исходя из физиологических свойств опухоли (кровоснабжение, кинетика локализации, позднее удаление). Для молекулярного маркирования болезненно-специфических структур могут быть использованы коньюгаты, состоящие из флюоресцентных красителей с биомолекулами, родственными мишеням, такими как белки, пептиды и антитела. После инъекции определенная часть этих коньюгатов связывается с такими структурами молекулярной мишени, как рецепторы или матричные белки, в то время как несвязанная часть выводится из организма. Таким образом, при осуществлении флюоресцентной диагностики более высокая концентрационная разница приводит к большей визуальной контрастности. Флюоресцентные красители класса цианиновых красителей попадают в категорию перспективных представителей и были синтезированы с использованием многих различных структур. В частности, карбоцианины с индокарбоцианиновыми, индодикарбоцианиновыми и индотрикарбоцианиновыми структурами имеют высокие коэффициенты экстинкции и хорошие флюоресцентные квантовые выходы [Licha,K. (2002) Contrast Agents for Optical Imaging (Review). B: Topics in Current Chemistry -Contrast Agents II(Editor: W. Krause), Volume 222, Springer Heidelberg, стр. 1-31, и приведенные в них ссылки]. В заявке WO 96/17628 описан диагностический процесс, проводимый в условиях in vivo, посредством использования ближнего инфракрасного излучения. В этом случае водорастворимые красители и их биомолекулярные аддукты со специфическими фотофизическими и фармакохимическими свойствами являются контрастными средами для флюоресцентной и трансиллюминационной диагностики. Синтез цианиновых красителей с индокарбоцианиновыми, индодикарбоцианиновыми и индотрикарбоцианиновыми структурами хорошо известен из уровня техники. Связанная с этим соответствующая литература представлена, например, в: Bioconjugate Chem. 4, 105-111, 1993; Bioconjugate Chem. 7, 356-62,1996; Bioconjugate Chem. 8, 751-56, 1997; Cytometry 10, 11-19, 1989 и 11, 418-30, 1990; J. Heterocycl.Chem. 33, 1871-6, 1996; J. Org. Chem. 60, 2391-5, 1995; Dyes and Pigments 17, 19-27, 1991, Dyes and Pigments 21, 227-34, 1993; J. Fluoresc. 3, 153-155, 1993; и Anal. Biochem. 217, 197-204, 1994. Дополнительные методы описаны в патентных публикациях: US 4981977; US 5688966; US 5808044;WO 97/42976; WO 97/42978; WO 98/22146; WO 98/26077 и ЕР 0800831. Кроме того, индотрикарбоцианины с другими заместителями синтезированы и присоединены к биомолекулам (описаны, например, в Photochem. Photobiol. 72, 234, 2000; Bioconjugate Chem. 12, 44,2001; Nature Biotechnol. 19, 237, 2001; J. Biomed. Optics 6, 122, 2001; J. Med. Chem. 45, 2003, 2002). Другие примеры можно найти, в частности, в публикациях: WO 00/61194 ("Short-Chain Peptide Dye Conjugates as Contrast Agents for Optical Diagnostics"), WO 00/71162, WO 01/52746, WO 01/52743 и WO 01/62156. Однако известные индотрикарбоцианины, используемые ранее специалистами в области техники,-1 009386 имеют недостатки, которые ухудшают их эффективное применение. Низкие флюоресцентные квантовые выходы индотрикарбоцианинов всегда возникают после присоединения к биомолекуле. Так, Gruber и др. (Bioconjugate Chemn. 11, 696-704, 2000) отмечают, что для коммерчески доступного красителя Су 7 потеря флюоресцентной эффективности имеет место после присоединения к биомолекуле. Becker и др. (Photochem. Photobiol. 72, 234, 2000) описывают коньюгаты индотрикарбоцианина с HAS и трансферрином с флюоресцентными квантовыми выходами 2,9% или 2,8% и деформированным абсорбционным спектром в физиологической среде. Кроме того, коньюгаты красителей имеют тенденцию к аггрегации. Becker и др. (Photochem. Photobiol. 72, 234, 2000) для коньюгатов индотрикарбоцианина с HAS и трансферрином и Licha и др. (Bioconjugate Chem. 12, 44-50, 2001) для рецептор-связывающих пептидов описали их, как имеющие деформированный абсорбционный спектр в физиологической среде. Эти деформации указывают на образование аггрегаций и флюоресцентную экстинкцию, которые является результатом этого. Подобная проблема существует и в случае неадекватной водной растворимости красителей. Что касается реакционных групп, всегда существует также проблема неэффективного доступа к производным. Так, Gruber и др. (Bioconjugate Chemn. 11, 696-704, 2000) описывают использование Су 7 бифункциональных HAS-эфиров с двумя реакционными группами, которые потенциально могут приводить к образованию поперечных связей между двумя биомолекулами. Однако, при наличии двух карбоксильных групп в молекуле, синтетический доступ к производным затруднен только с одной реакционной группой и приводит к побочным продуктам (например, к содержанию порции монореакционных HASэфиров Су 7 неактивированной и вдвойне-активированной молекулы Су 7). Таким образом, существует постоянная потребность в эффективных и легко получаемых цианиновых красителях для флюоресцентной диагностики, у которых снижены или вовсе отсутствуют упомянутые выше недостатки. Кроме того, эти красители должны быть в достаточной мере пригодными для получения коньюгатов с биомолекулами. Первым объектом по изобретению является индотрикарбоцианиновый краситель общей формулы (I) в которой X обозначает О, S или С, то есть замещен в двух местах, при этом заместители могут быть выбраны из метил, этил, пропил, изопропил и/или бутил; Y обозначает СН 2-СН 2 или CH2-CH2-CH2; Z обозначает С 1-С 5 алкил, при этом С атомы необязательно замещены О или S, или независимо друг от друга обозначают SO3H или Н, при условии, что по крайней мере три из R1-R4 обозначают SO3H, R5 обозначает -CO-NH-R8-R9, -NH-CS-NH-R8-R9 или -NH-CO-R8-R9, где R8 выбран из группы, которая содержит неразветвленный С 2-С 13 алкил, в котором атомы углерода необязательно замещены О или S, и R9 выбран из или ацетихлорида, ацетилбромида, ацетилйодида, хлорацетамидогруппы, йодацетамидогруппы, хлорал-2 009386 кила, бромалкила, йодалкила, пиридилдисульфида и винилсульфоамида, и в которой R6 и R7 обозначают СН или связаны с радикалами от С 3 алкила до гексильного кольца, которое необязательно может быть замещено в п-положении С 1-С 4 алкильным радикалом, и соли, и сольваты этого соединения. Предпочтительным является индотрикарбоцианиновый краситель по настоящему изобретению, в котором Y обозначает СН 2-СН 2; Z обозначает С 1-С 4 алкил, при этом атомы углерода необязательно замещены О или S, и в котором R6 и R7 обозначают СН, и соли, и сольваты этого соединения. Наиболее предпочтительным является индотрикарбоцианиновый краситель по настоящему изобретению, в котором Z обозначает С 1-С 5 алкил. Еще более предпочтительным является индотрикарбоцианиновый краситель по настоящему изобретению, в котором Z обозначает и R6 и R7 связаны с гексильным кольцом через С 3 алкил. Флюоресцентные красители из класса цианиновых красителей, в частности индотрикарбоцианины с абсорбционным и флюоресцентным максимумом в спектральной области от 700 до 900 нм, реакционной группой, специфической по отношению к тиолгруппе и тремя, предпочтительно четырьмя, сульфонатными группами, являются, таким образом, объектами по настоящему изобретению. Последние используются для увеличения растворимости в воде. Неожиданно недавно было найдено, что индотрикарбоцианины согласно изобретению с вышеупомянутой структурой (компактное положение 3-4 сульфонатных групп с сульфонатэтильными радикалами) имеют высокий флюоресцентный квантовый выход 15%, и что флюоресцентный квантовый выход после присоединения к биомолекулам остается практически неизменным (максимальная потеря составляет около 10%). Кроме того, абсорбционные спектры коньюгатов не обнаруживают никакой деформации в ближней инфракрасной области около 750 нм. Таким образом, получены красители с хорошей гидрофильностью, пониженной аггрегацией и увеличенным флюоресцентным квантовым выходом по сравнению со стандартными индотрикарбоцианинами или Су 7 производными с менее чем тремя сульфонатными группами, в частности в случае Су 7 и других известных структур. Другой ценный аспект в получении цианиновых красителей для флюоресцентной диагностики согласно изобретению относится к производным, которые имеют реакционные функциональные группы,дающие возможность ковалентного соединения со специфическими в отношении мишеней биомолекулами. Подходящими производными являются, например, NHS эфиры и изотиоцианаты (BioconjugateChem. 13, 387-391, 2002; Bioconjugate Chem. 11, 161-166, 2000), реагирующие с тиольными группами. Другие бифункциональные линкеры (связывающие промежуточные группы) могут происходить из группы, которая содержит арилендиизотиоцианаты, алкилендиизотиоцианаты, бис-N-гидроксисукцинимидилэфиры, гексаметилендиизоцианат и эфир N-(-малеинимидобутирилокси)сукцинимида. В заявке WO 01/77229 описаны цианиновые красители с комбинацией сульфоарильных групп, алкильных заместителей в мезо-положении метиновой цепи и по крайней мере одной реакционной группой, которая дает возможность присоединения к биомолекулам. Однако, варианты осуществления относятся к индодикарбоцианинам (полиметиновая цепь которых состоит из 5 атомов углерода) и соединениям, не имеющим реакционных групп в мезо-положении. В заявке WO 00/16810 ("Near-Infrared Fluorescent Contrast Agent and Fluorescence Imaging") описаны индотрикарбоцианины, например, с заместителями в мезо-положении С 7-полиметиновой цепи. Не указано, однако, каким образом могут быть введены или получены реакционные группы. Другой аспект настоящего изобретения относится к индотрикарбоцианиновому красителю, в котором R5 обозначает СООН или NH2. Опубликованные производные базируются, главным образом, на Су 3-, Су 5-, Су 5,5- и Су 7-базисных структурах (коммерчески доступны от Amersham Pharmacia Biotech; US 5268486; Су 3 = индокарбоцианин, Су 5 = индодикарбоцианин, Су 7 = индотрикарбоцианин). Производные с реакционной группой по отношению к тиольной представляют особый интерес, так как делают возможным непосредственное соединение с биотехнологичными цистеинами, которые занимают специфическое положение среди биомолекул. Уровень техники сейчас концентрируется главным образом на Су 3 и Су 5 производных. Особенно предпочтительные индотрикарбоцианиновые красители согласно изобретению выбраны из красителей с формулами от (II) до (XX), которые представлены ниже в табл. 1.-3 009386 Таблица 1. Предпочтительные красители согласно изобретению Другой аспект настоящего изобретения относится к способу получения индотрикарбоцианинового красителя по настоящему изобретению. В этом случае был найден простой доступ через 4-замещенные пиридины. Как ни странно, различные 4-замещенные пиридины с высокими выходами могут быть превращены посредством реакции Цинке (реакция Zincke-Konig, см. Rompps Chemie Lexikon [RomppsChemical Dictionary], 10th Edition, стр. 5067) в мезо-замещенный глутакональдегид-дианилид (предшественник цианинового красителя). Кроме того, простой и эффективный синтез 4-замещенных пиридинов, симметричные структуры красителей по этому изобретению, открывает возможность определенной дериватизации реакционной группы, селективной по отношению к тиольной группе, в симметричном мезо-положении молекулы. Таким образом была проведена дальнейшая дериватизация до соединений с реакционной группой по отношению к тиольной. Функциональными реакционными группами по отношению к тиольной являются, например, малеинимидная (малеимидная), хлорацетильная, бромацетильная, йодацетильная, хлорацетамидная, бромацетамидная, йодацетамидная, хлоралкильная, бромалкильная, йодалкильная, пиридилдисульфидная и винилсульфонамидная группы. Еще один аспект настоящего изобретения относится к способу получения коньюгатов, который включает присоединение индотрикарбоцианинового красителя по настоящему изобретению к биомолекуле. В объеме этого изобретения под термином биомолекула следует понимать любую молекулу органического происхождения, обладающую биологической активностью, в частности ферментативной активностью, или связывающую вещества синтетического или биологического происхождения такие, как например, фармацевтические агенты, пептиды, белки, рецепторы или нуклеиновые кислоты. В свою очередь, предпочтительными биомолекулами являются белки, как например, ферменты, пептиды, антитела и фрагменты антител (такие как, например, одиночная цепь, Fab, F(ab)2, диатела и т.п.), липопротеины,нуклеиновые кислоты, такие как, например, олигонуклеотиды или полинуклеотиды из ДНК или РНК,аптамеры, РНК, и сахара, такие как, например, моно-, ди-, три-, олиго- и полисахариды. Синтез и биологическая характеристика коньюгатов цианиновых красителей с биомолекулами, такими как пептиды, антитела и их фрагменты и белки для флюоресцентной диагностики опухолей в условиях in vivo описаны ранее во многих публикациях. В этом случае преимущественно были использованы упомянутые выше Су 3, Су 5, Су 5,5 и Су 7 (см. в связи с этим, например, Nature Biotechnol. 15, 1271, 1997;Cancer Detect. Prev. 22, 251, 1998; J. Immunol. Meth. 231, 239, 1999; Nature Biotechnol. 17, 375, 1999; Nature Medicine 7, 743, 2001). Другой аспект настоящего изобретения связан с полученным согласно способу по изобретению коньюгатом индотрикарбоцианинового красителя с биомолекулой. Этот коньюгат может быть охарактеризован тем, что он включает биомолекулу, как определено выше, причем в качестве биомолекулы по крайней мере одна биомолекула, выбранная из пептидов, белков, липопротеинов, антител или фрагментов антител, нуклеиновых кислот таких как, например, олигонуклеотиды или полинуклеотиды ДНК или РНК, аптамеров, РНК и сахаров, таких как, например, моно-, ди-, три-, олиго- и полисахариды, является- 10009386 наиболее предпочтительной. Присоединенный белок может быть охарактеризован тем, что он выбран из группы структурных белков или растворимых белков организма. Абсолютно предпочтительными являются сывороточные белки (например, ЧСА), антитела/фрагменты антител, как, например, scFv-фрагмент или F(ab), а также пептиды, БСА, яичный альбумин или полученная из них пероксидаза. Так, из уровня техники известны, например, антитела, которые направлены против молекул, которые интенсивно экспрессируют в ангиогенетически активной ткани и только на очень низком уровне в примыкающей ткани (см. WO 96/01653). Особый интерес представляют антитела рецепторов факторов сосудистого роста, рецепторов с эндотелиальными клетками, с которыми связаны медиаторы воспаления, и матричных белков, которые особенно экспрессируют при формировании новых сосудов. Предпочтительными являются другие антитела и фрагменты антител, которые противостоят матричному белкуEDB-фибронектину и его коньюгатам согласно изобретению. EDB-фибронектин, известный также в качестве онкофетального фибронектина, является вариантом сплайсинга фибронектина, который формируется, в частности, вокруг вновь образуемых сосудов в процессе ангиогенезиса. Особенно предпочтительными являются антитела L19, Е 8, АР 38 и АР 39 против EDB-фибронектина (Cancer Res 1999, 59, 347; JImmunol Meth 1999, 231, 239; Protein Expr Purif 2001, 21, 156). Предпочтительным является коньюгат согласно изобретению, который характеризуется тем, что индотрикарбоцианиновый краситель присоединен к биомолекуле через SH-группу, в частности черезSH-группу к цистеину. Необязательно даже более предпочтительно получаемыми из них являются такие антитела и их фрагменты, которые получают с помощью рекомбинантной технологии так, что на С- илиN-концах (в пределах 1-10 крайних аминокислот) они содержат цистеин, который не образует никаких внутримолекулярных S-S-мостиков, и поэтому могут быть использованы для присоединения к красителям согласно изобретению. Другой аспект настоящего изобретения относится к диагностическому комплекту, который включает индотрикарбоцианиновый краситель по настоящему изобретению и/или коньюгат по настоящему изобретению. Кроме того, набор может содержать дополнительные адъюванты для осуществления диагностики, в частности опухолей, в условиях in vivo. Эти адъюванты представляют собой, например, подходящие буферы, сосуды, реагенты для обнаружения или инструкции для применения. Набор предпочтительно содержит все материалы для внутривенного введения красителей согласно изобретению. Специальное содержание таких наборов согласно изобретению является, например, следующим. Первый сосуд содержит антитело (биомолекулу) со свободной SH-группой и стандартными буфером/добавками в виде раствора или лиофилизированного материала. Другой сосуд содержит красители согласно изобретению в виде раствора (обычные добавки) или лиофилизированный материал в молярном соотношении 0,1:1 (10-кратный дефицит в эквимолярном количестве). Краситель, содержащийся в сосуде, необязательно смешан с буфером или дистиллированной водой и добавляется к биомолекуле, содержащейся в другом сосуде, инкубируется в течение 1-10 мин, и используется как инъекционный раствор. В другом варианте набор представляет собой 2-х-камерную систему (например, шприц), в которой одна камера, содержащая раствор антитела, физически отделена разрушаемой перегородкой от второй камеры, содержащей краситель в виде раствора или твердого вещества. После слома перегородки происходит смешивание и образование инъекционного раствора. Последний аспект настоящего изобретения касается применения коньюгата по изобретению в качестве флюоресцентной контрастной среды для диагностирования опухолей в условиях in vivo. Абсорбционный максимум Су 7 в связи с этим лежит в области 745 нм и является поэтому особенно подходящим для обнаружения флюоресценции в условиях in vivo в более глубоких слоях тканей (см. выше). Однако Су 7 производные с реакционными группами, селективными по отношению к тиольной группе, еще не описаны. Кроме того, использование коньюгатов с антителами для обнаружения границ распространения опухоли уже описаны в WO 01/23005 (Antibody Dye Conjugates for Binding to Target Structures of Angiogenesis in Order to Intraoperatively Depict Tumor Peripheries), но без применения перспективных красителей по изобретению. Изобретение описано далее в терминах следующих примеров и фигур, однако, не ограничивающих его. На фиг. 1 представлены стандартизированные абсорбционные и флюоресцентные спектры коньюгата К 11 (А) и К 15 (Б) (см. табл. 2) в ФБР (физиологический раствор с фосфатным буфером). На фиг. 2 показаны результаты визуализованных свойств коньюгатов примера 24 по изобретению: вещество: коньюгат К 15,опухоль: F9 тератокарцинома в правом нижнем боку мыши,доза: 50 нмол/кг массы тела (данные относятся к красителю),возбуждение: 740 нм (диодный лазер),обнаружение: CCD-камера (Hamamatsu) с 802,55 нм и полосно-пропускным фильтром,время: перед инъекцией, 1, 6 и 24 ч после инъекции. Положение опухоли указано стрелками.- 11009386 Примеры Примеры 1-16: Синтез индотрикарбоцианиновых красителей с малеимидными группами Пример 1. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3 Ниндолиум-2-ил]-4-(2-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилэтил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя сольBiochem. 1994, 217, 197. б) Трет-бутиловый эфир 3-пиридин-4-илпропионовой кислоты 20 г (89 ммолей) трет-бутил-Р,Р-диметилфосфонацетата в 50 мл ТГФ добавляют по каплям при 0 С к суспензии 3,9 г (98 ммоля) гидрида натрия (60%-ная суспензия в минеральном масле) в 250 мл ТГФ. После перемешивания в течение 1 ч при 0 С, добавляют по каплям раствор 10 г (93 ммоля) пиридинкарбальдегида в 50 мл ТГФ, и перемешивают реакционную смесь в течение 1 ч при 0 С и в течение 18 ч при комнатной температуре. Выпавшее твердое вещество удаляют фильтрованием и раствор концентрируют выпариванием. Остаток при нагревании растворяют в изопропаноле, нерастворимую часть отфильтровывают, а раствор охлаждают до 0 С для кристаллизации. Твердое вещество отфильтровывают, перемешивают с гексаном, отфильтровывают гексан и высушивают. Промежуточный продукт (15,3 г) гидрируют в 150 мл этанола с 0,15 г 10%-ного палладия на активированном угле в течение 6 ч. Катализатор отфильтровывают, раствор концентрируют выпариванием, а остаток фильтруют на силикагеле (подвижная фаза диэтиловый эфир), получая 13,0 г слегка желтого масла (выход 71% от теоретического). в) Гидробромид 3-[2-(трет-бутилоксикарбонил)этил]глутакональдегиддианилида Раствор 10 г (48 ммолей) трет-бутилового эфира 3-пиридин-4-илпропионовой кислоты в 150 мл диэтилового эфира перемешивают с 8,9 г (96 ммолями) анилина и затем перемешивают при 0 С с раствором 5,4 г (48 ммолями) бромциана в 2 мл диэтилового эфира. После 3 ч перемешивания при 0 С отфильтровывают образовавшееся красное твердое вещество, промывают эфиром и высушивают в вакууме. Выход: 20,3 г (92% от теоретического). г) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(2-карбоксиэтил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Ниндол-5-сульфоновой кислоты, внутренняя соль Суспензию 1,0 г(2,2 ммоля) гидробромида 3-[2-(трет-бутилоксикарбонил)этил]глутакональдегиддианилида (пример 1 в) и 1,5 г (4,4 ммоля) 1-(2-сульфонатэтил)-2,3,3-триметил-3Hиндоленин-5-сульфокислоты (пример 1 а) в 20 мл ангидрида уксусной кислоты и 5 мл уксусной кислоты смешивают с 0,75 г (9,1 ммоля) ацетата натрия и перемешивают в течение 1 ч при 120 С. После охлаждения реакционную смесь перемешивают с диэтиловым эфиром, выпавшее в осадок твердое вещество отфильтровывают, очищают хроматографически (RP-С 18-силикагель, подвижная фаза вода/метанол) и лиофилизируют (0,5 г). Отщепление защитной группы проводят посредством перемешивания промежуточного продукта в 4 мл дихлорметана/1 мл трифторуксусной кислоты в течение 1 ч. После концентрирования выпариванием и хроматографической очистки (RP-С 18-силикагель, подвижная фаза вода/метанол), получают 0,45 г (23% от теоретического) голубого лиофилизата. д) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(2-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилэтил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль 0,4 г (0,45 ммоля) соединения, названного в заголовке примера 1 г, и 45 мг (0,45 ммоля) триэтиламина растворяют в 10 мл ДМФ, смешивают при 0 С с 0,15 г (0,45 ммоля) TBTU и перемешивают в течение 10 мин. Затем добавляют раствор 0,17 г (0,68 ммоля) трифторацетата N-(2-аминоэтил)малеимида (Int. J.Pept. Protein Res. 1992, 40, 445) и 68 мг (0,68 ммоля) триэтиламина в 0,5 мл ДМФ, и перемешивают в те- 12009386 чение 1 ч при комнатной температуре. Затем добавляют 10 мл диэтилового эфира, твердое вещество отделяют центрифугированием, высушивают и очищают с помощью хроматографии (RP-С-18 силикагель,градиент метанол/вода). Выход: 0,30 г голубого лиофилизата (65% от теоретического). Элементный анализ: вычислено: С 47,24; Н 4,26; N 5,51; S 12,61; Na 6,78 Найдено: С 47,74; Н 4,47; N 5,40; S 11,99; Na 7,02 Пример 2. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(2-[6-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)гексил]карбамоилэтил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,4 г (0,45 ммоля) названного в заголовке примера 1 г соединения и 0,21 г (0,68 ммоля) трифторацетата N-(6-аминогексил)малеимида (Int. J. Pept. Protein Res. 1992, 40, 445). Выход: 0,38 г голубого лиофилизата (81% от теоретического). Элементный анализ: вычислено: С 49,25; Н 4,79; N 5,22; S 11,95; Na 6,43 Найдено: С 48,96; Н 4,92; N 5,32; S 11,88; Na 6,56 Пример 3. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(2-[13-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-4,7,10-триоксатридецил]карбамоилэтил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула IV) Синтез проводят аналогично примеру 1 д из 0,4 г (0,45 ммоля) названного в заголовке примера 1 г соединения и 0,28 г (0,68 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида (Int. J.- 13009386 а) (3-трет-Бутоксикарбонилпропил)трифенилфосфонийбромид 50 г (0,30 моля) 4-броммасляной кислоты по каплям смешивают в 400 мл ТГФ при -40 С с 187 г(0,89 моля) ангидрида трифторуксусной кислоты. После 30 мин перемешивания при -40 С, добавляют по каплям 400 мл смеси трет-бутанол/30 мл ТГФ в течение 1 ч. После 16 ч перемешивания при комнатной температуре реакционную смесь переносят в охлажденный льдом раствор карбоната натрия, водную фазу трижды экстрагируют диэтиловым эфиром, органическую фазу высушивают над сульфатом натрия и концентрируют выпариванием. Остаток перегоняют в вакууме (температура кипения 72 С/0,9 мбар; выход: 41 г). Для образования соли фосфония реакцию проводят, нагревая с обратным холодильником 41 г(0,18 моля) промежуточного продукта, 44,6 г (0,17 моля) трифенилфосфина и 32,5 г (0,36 моля) бикарбоната натрия в 250 мл ацетонитрила в течение 20 ч. Реакционную смесь фильтруют, концентрируют выпариванием и остаток для кристаллизации перемешивают с диэтиловым эфиром. Выход белого твердого вещества составляет 58,5 г (40% от теоретического относительно 4-броммасляной кислоты). б) трет-Бутиловый эфир 5-пиридин-4-илпентановой кислоты Раствор 14 г (28 ммолей) (3-трет-бутоксикарбонилпропил)трифенилфосфонийбромида (пример 4 а) в 100 мл безводного ТГФ смешивают при -40 С в вакууме в течение 20 мин с 17,5 мл (28 ммолей) бутиллития (1,6-молярный раствор в гексане) и перемешивают в течение 1 ч при -40 С. К реакционной смеси добавляют по каплям раствор 2,78 г (26 ммолей) 4-пиридинкарбальдегида в 20 мл ТГФ и перемешивают в течение 16 ч при комнатной температуре, затем переносят в ледяную воду, водную фазу трижды экстрагируют диэтиловым эфиром, органические фазы высушивают над сульфатом натрия и концентрируют выпариванием. После хроматографической очистки (силикагель, подвижная фаза гексан/этилацетат) получают продукт в виде E,Z-смеси (4:1 по данным ЯМР; 5,0 г). Для гидрирования двойной связи промежуточный продукт растворяют в 200 мл метанола и перемешивают со 100 мг PtO2 катализатора при комнатной температуре в атмосфере водорода. После фильтрования и концентрирования выпариванием получают желтое масло. Выход: 4,9 г (74% от теоретического). в) Гидробромид 3-[4-(трет-бутилоксикарбонил)бутил]глютакональдегиддианилида Раствор 4,0 г (17 ммолей) трет-бутилового эфира 5-пиридин-4-илпентановой кислоты в 35 мл диэтилового эфира смешивают с 3,2 г (34 ммолей) анилина и затем при 0 С с раствором 1,9 г (17 ммолей) бромциана в 8 мл диэтилового эфира. После перемешивания в течение 3 ч при 0 С образовавшееся красное твердое вещество отфильтровывают, промывают эфиром и высушивают в вакууме. Выход: 7,8 г(95% от теоретического). г) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(4-карбоксибутил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Ниндол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 г из соединения, названного в заголовке примера 4 в (2,5 ммолей), и 1-(2-сульфонатэтил)-2,3,3-триметил-3H-индоленин-5-сульфоновой кислоты (5 ммолей). Выход составляет 0,85 г (37% от теоретического) голубого лиофилизата. д) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(4-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилбутил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,4 г (0,43 ммоля) соединения, названного в заголовке примера 4 г. Выход составляет 0,31 г (69% от теоретического) голубого лиофилизата. Элементный анализ: вычислено: С 48,27; Н 4,53; N 5,36; S 12,27; Na 6,60 Найдено: С 48,01; Н 4,44; N 5,56; S 12,10; Na 6,81 Пример 5. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(4-[6-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)гексил]карбамоилбутил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,4 г (0,43 ммоля) соединения, названного в заголовке примера 1 г, и 0,20 г (0,66 ммоля) N-(6-аминогексил)малеимида трифторуксусной кислоты. Выход со- 14009386 ставляет 0,35 г голубого лиофилизата (74% от теоретического). Элементный анализ: вычислено: С 50,17; Н 5,03; N 5,36; S 11,65; Na 6,26 Найдено: С 49,83; Н 4,89; N 5,34; S 12,05; Na 6,42 Пример 6. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(4-[13-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-4,7,10-триоксатридецил]карбамоилбутил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула VII) Синтез проводят аналогично примеру 1 д из 0,4 г (0,43 ммоля) соединения, названного в заголовке примера 1 г, и 0,30 г (0,72 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида. Выход составляет 0,27 г голубого лиофилизата (52% от теоретического). Элементный анализ: вычислено: С 49,83; Н 5,27; N 4,65; S 10,64; Na 5,72 Найдено: С 49,45; Н 5,19; N 4,66; S 10,85; Na 5,80 Пример 7. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-этил]карбамоилгексил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль а) (3-трет-Бутоксикарбонилпентил)трифенилфосфонийбромид Получение проводят аналогично описанному в примере 4 а, при этом промежуточный продукт третбутиловый эфир 3-пиридин-4-илпропионовой кислоты вводят в реакцию в сыром виде, получая 79 г продукта (69% от теоретического) в виде вязкого бесцветного масла из 50 г 6-бромгексановой кислоты. б) трет-Бутиловый эфир 7-пиридин-4-илгептановой кислоты Получение проводят аналогично описанному в примере 4 б. трет-Бутиловый эфир 7-пиридин-4 илгептановой кислоты (7,5 г, 65% от теоретического) получают в виде желтого масла из 25 г (48,7 ммолей) (3-трет-бутоксикарбонилпентил)трифенилфосфонийбромида (пример 7 а). в) Гидробромид 3-[4-(трет-бутилоксикарбонил)гексил]глютакональдегиддианилида Раствор 5,0 г (19 ммолей) трет-бутилового эфира 5-пиридин-4-илгептановой кислоты в 30 мл диэтилового эфира смешивают с 3,6 г (38 ммолями) анилина и затем при 0 С с раствором 2,1 г (19 ммолей) бромциана в 5 мл диэтилового эфира. После перемешивания в течение 2,5 ч при 0 С образовавшееся красное твердое вещество отфильтровывают, промывают эфиром и высушивают в вакууме. Выход составляет 8,9 г (91% от теоретического). г) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-карбоксигексил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Ниндол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 г из названного в заголовке примера 4 в соединения (3 ммоля) и 1-(2-сульфонатэтил)-2,3,3-триметил-3H-индоленин-5-сульфоновой кислоты (6 ммолей). Выход составляет 1,5 г (54% от теоретического) голубого лиофилизата.- 15009386 д) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилгексил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,4 г (0,43 ммоля) названного в заголовке примера 4 г соединения. Выход составляет 0,31 г (69% от теоретического) голубого лиофилизата. Элементный анализ: вычислено: С 49,25; Н 4,79; N 5,22; S 11,95; Na 6,43 Найдено: С 48,98; Н 4,86; N 5,12; S 11,76; Na 6,77 Пример 8. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-[6-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)гексил]карбамоилгексил)гепта-2,4,6 триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,5 г (0,53 ммоля) соединения, названного в заголовке примера 7 г, и 0,23 г (0,75 ммоля) трифторацетата N-(6-аминогексил)малеимида. Выход составляет 0,42 г голубого лиофилизата (70% от теоретического). Элементный анализ: вычислено: С 51,05; Н 5,27; N 4,96; S 11,36; Na 6,11 Найдено: С 50,74; Н 5,55; N 4,76; S 11,38; Na 6,35 Пример 9. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-[13-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-4,7,10-триоксатридецил]карбамоилгексил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула X) Синтез проводят аналогично примеру 1 д из 0,5 г (0,53 ммоля) соединения, названного в заголовке примера 1 г, и 0,44 г (1,06 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида. Выход составляет 0,24 г голубого лиофилизата (37% от теоретического). Элементный анализ: вычислено: С 50,64; Н 5,48; N 4,54; S 10,40; Na 5,59 Найдено: С 50,30; Н 5,56; N 4,34; S 10,15; Na 5,73 Пример 10. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)3H-индолиум-2-ил]-4-(5-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоил-3-оксапентил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула XI) а) трет-Бутиловый эфир 3-окса-6-(4-пиридинил)гексановой кислоты Раствор 75 г (0,4 моля) 3-(4-пиридинил)-1-пропанола в 400 мл толуола/50 мл ТГФ смешивают с 10 г сульфата тетрабутиламмония и 350 мл 32%-ного раствора гидроксида натрия. Затем по каплям прибавляют 123 г (0,68 моля) трет-бутилового эфира бромуксусной кислоты и перемешивают в течение 18 ч при комнатной температуре. Органическую фазу отделяют, водную фазу трижды экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают раствором NaCl, высушивают над сульфатом натрия и концентрируют выпариванием. После хроматографической очистки (силикагель, подвижная фаза: раствор гексан:этилацетат) получают 56 г продукта в виде коричневатого масла (41% от теоретического). б) Гидробромид 3-[4-окса-5-(трет-бутилоксикарбонил)пентил]глютакональдегиддианилида Раствор 5,0 г (20 ммолей) трет-бутилового эфира 3-окса-6-(4-пиридинил)гексановой кислоты в 60 мл диэтилового эфира смешивают с 3,7 г (40 ммолей) анилина и затем при 0 С с раствором 2,2 г (20 ммолей) бромциана в 8 мл диэтилового эфира. После перемешивания в течение 1 ч при 0 С образовавшееся твердое вещество отфильтровывают, промывают эфиром и высушивают в вакууме. Выход составляет 8,5 г (85% от теоретического) твердого вещества фиолетового цвета. в) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(6-карбокси-4-оксагексил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3 дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Суспензию 3,0 г (6 ммолей) гидробромида 3-[2-(трет-бутилоксикарбонил)этил]глутакональдегиддианилида (пример 106) и 4,2 г (12 ммолей) 1-(2-сульфонатэтил)-2,3,3-триметил-3H-индоленин-5 сульфоновой кислоты (пример 1 а) в 50 мл ангидрида уксусной кислоты и 10 мл уксусной кислоты смешивают с 2,5 г (30 ммолей) ацетата натрия и перемешивают в течение 50 мин при 120 С. После охлаждения перемешивают с диэтиловым эфиром, выпавшее в осадок твердое вещество отфильтровывают, осаждают в ацетоне и высушивают в высоком вакууме. После хроматографической очистки (RP-С 18 силикагель, подвижная фаза вода/метанол) удаляют метанол в вакууме и лиофилизируют (0,5 г). После концентрирования выпариванием и хроматографической очистки (RP-C18-силикагель, подвижная фаза вода/метанол), сразу получают названное в заголовке соединение. Выход: 2,3 г (41% от теоретического) голубого лиофилизата. г) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]-4-(5-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоил-3-оксапентил)гепта 2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 в из 1,0 г (1,1 ммоля) соединения, названного в заголовке примера 10 в. Выход: 0,85 г голубого лиофилизата (73% от теоретического). Элементный анализ: вычислено: С 47,54; Н 4,46; N 5,28; S 12,09; Na 6,50 Найдено: С 47, 97; Н 4,65; N 5,10; S 12,02; Na 6,68 Пример 11. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)3H-индолиум-2-ил]-4-(5-[6-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-гексил]карбамоил-3-оксапентил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты,внутренняя соль (формула XII) Синтез проводят аналогично примеру 1 д из 0,5 г (0,55 ммоля) соединения, названного в заголовке примера 10 в, и 0,23 г (0,75 ммоля) трифторацетата N-(6-аминогексил)малеимида. Выход: 0,42 г голубого лиофилизата (68% от теоретического). Элементный анализ: вычислено: С 49,46; Н 4,96; N 5,01; S 11,48; Na 6,17 Найдено: С 48,95; Н 5,21; N 5,22; S 11,23; Na 6,60 Пример 12. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)3H-индолиум-2-ил]-4-(5-[13-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-4,7,10-триоксатридецил]карбамоил-4-оксапентил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5 сульфоновой кислоты, внутренняя соль (формула XIII) Синтез проводят аналогично примеру 1 д из 0,5 г (0,55 ммоля) соединения, названного в заголовке примера 10 в, и 0,46 г (1,06 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида. Выход: 0,34 г голубого лиофилизата (56% от теоретического). Элементный анализ: вычислено: С 49,17; Н 5,20; N 4,59; S 10,50; Na 5,65 Найдено: С 49,34; Н 5,32; N 4,45; S 10,28; Na 5,56 Пример 13. Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)3H-индолиум-2-ил]винилен-2-[4-(2-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилэтил)фенокси]циклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5 сульфоновой кислоты, внутренняя соль (формула XIV) а) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]винилен-2-хлорциклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатэтил)-2,3-дигидро 1 Н-индол-5-сульфоновой кислоты, внутренняя соль 5,0 г (14,4 ммолей) 1-(2-сульфонатоэтил)-2,3,3-триметил-3H-индоленин-5-сульфокислоты (пример 1 а) и 2,6 г (7,2 ммолей) гидрохлорида N-[(3-(анилинометилен)-2-хлор-1-циклогексен-1 ил)метилен]анилина (Aldrich Company) нагревают с обратным холодильником с 2,5 г (30 ммолями) безводного ацетата натрия в 100 мл метанола в течение 1 ч, охлаждают, смешивают с 150 мл диэтилового эфира и перемешивают в течение ночи. Осадок отсасывают, высушивают и очищают с помощью хроматографии (силикагель, градиент: дихлорметан/метанол). Выход: 3,8 г голубого твердого вещества (58% от теоретического).- 18009386 б) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]-винилен-2-[4-(2-карбоксиэтил)фенокси]циклогекс-1-ен-3-илиден)этилиден]-1-(2 сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль 0,37 г (2,2 ммоля) 3-(4-гидроксифенил)пропионовой кислоты в 30 мл ДМФ смешивают с 0,18 г (4,5 ммоля) гидрида натрия (60%-ная минеральная дисперсия). После перемешивания при комнатной температуре в течение 30 мин смесь охлаждают до 0 С, добавляют по каплям раствор 2,0 г (2,2 ммоля) названного в заголовке примера 12 а соединения в 100 мл ДМФ и перемешивают в течение 2 ч при комнатной температуре. Смесь гасят сухим льдом и растворитель удаляют в вакууме. Остаток растворяют в метаноле, перемешивают с 200 мл эфира и твердый осадок отфильтровывают, после чего проводят хроматографическую очистку (силикагель, градиент: этилацетат/метанол). Выход: 1,9 г голубого твердого вещества(83% от теоретического). в) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)-3Hиндолиум-2-ил]винилен-2-[4-(2-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)этил]карбамоилэтил)фенокси]циклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль 0,1 мг (0,10 ммоля) названного в заголовке примера 126 соединения вводят в реакцию с TBTU и трифторацетатом N-(2-аминоэтил)малеимида в присутствии триэтиламина и полученный продукт очищают хроматографически. Выход: 93 мг голубого лиофилизата (81% от теоретического). Элементный анализ: вычислено: С 51,21; Н 4,47; N 4,88; S 11,16; Na 6,00 Найдено: С 51,50; Н 4,55; N 4,95; S 10,93; Na 6,15 Пример 14. Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатэтил)3H-индолиум-2-ил]винилен-2-[4-(2-[6-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)гексил]карбамоилэтил)фенокси]циклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5 сульфоновой кислоты, внутренняя соль (формула XV) Синтез проводят аналогично примеру 1 д из 0,7 г (0,68 ммоля) соединения, названного в заголовке примера 14 а, и 0,53 г (1,22 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида. Выход: 0,56 г голубого лиофилизата (68% от теоретического). Элементный анализ: вычислено: С 48,27; Н 4,53; N 5,36; S 12,27; Na 6,60 Найдено: С 48,01; Н 4,44; N 5,56; S 12,10; Na 6,81 Пример 15. Тринатриевая соль 3,3-диметил-2-(2-(1-[3,3-диметил-5-сульфонат-1-(2 сульфонатоэтил)-3H-индолиум-2-ил]винилен-2-[4-(2-[3-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)4,7,10-триоксатридецил]карбамоилэтил)фенокси]циклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула XVI) Синтез проводят аналогично примеру 1 д из 0,7 г (0,68 ммоля) соединения, названного в заголовке примера 14 а, и 0,59 г (1,36 ммоля) трифторацетата N-(13-амино-4,7,10-триоксатридецил)малеимида. После проведения двух хроматографических очисток выход составляет 0,67 г голубого лиофилизата (75% от теоретического). а) Гидрохлорид N-[(3-(анилинометилен)-2-хлор-5-трет-бутил-1-циклогексен-1-ил)метилен]анилина 6,7 мл (73,4 ммолей) оксихлорида фосфора добавляют по каплям при 0 С к 8 мл ДМФ. Затем добавляют по каплям раствор 5,0 г (32,4 ммоля) 4-трет-бутилциклогексанона в 30 мл дихлорметана, и реакционную смесь перемешивают при нагревании с обратным холодильником в течение 3 ч. После охлаждения до 0 С медленно по каплям прибавляют 6 г (64,8 ммоля) анилина в 5,5 мл этанола, смесь переносят в 200 г льда и при перемешивании добавляют 5 мл конц. хлористо-водородной кислоты. Выпавшее в осадок твердое вещество отфильтровывают, промывают эфиром и высушивают. Выход: 6,8 г (50% от теоретического) красного твердого вещества. б) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]винилен-2-хлор-5-трет-бутилциклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль 5,0 г (14,4 ммолей) 1-(2-сульфонатоэтил)-2,3,3-триметил-3H-индоленин-5-сульфокислоты (пример 1 а) и 3,0 г (7,2 ммоля) гидрохлорида N-[(3-(анилинометилен)-2-хлор-5-трет-бутил-1-циклогексен-1 ил)метилен]анилина (пример 16 а) нагревают с обратным холодильником с 2,5 г (30 ммолями) безводного ацетата натрия в 100 мл метанола в течение 1,5 ч, охлаждают, смешивают с 150 мл диэтилового эфира и перемешивают в течение ночи. Осадок отсасывают, высушивают и очищают с помощью хроматографии(силикагель, градиент: дихлорметан/метанол). Выход: 4,7 г голубого твердого вещества (68% от теоретического). в) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]винилен-2[4-(2-карбоксиэтил)фенокси]-5-трет-бутил-циклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Реакцию проводят с 2,0 г (2,1 ммоля) названного в заголовке примера 166 соединения, как описано в примере 136. Выход: 1,5 г (66% от теоретического). г) Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонат-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]винилен-2-[4-(2-[2-(2,5-диоксо-2,5-дигидро-1 Н-пиррол-1-ил)-этил]карбамоилэтил)фенокси]-5-трет-бутилциклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5 сульфоновой кислоты, внутренняя соль Реакцию проводят с 1,0 г (0,92 ммоля) названного в заголовке примера 16 в соединения, как описано в примере 13 в. Дважды проводят хроматографическую очистку, используя RP-C18-силикагель, (подвижная фаза ацетонитрил/вода). Выход: 0,24 г (22% от теоретического). Элементный анализ: вычислено: С 52,82; Н 4,93; N 4,65; S 10,64; Na 5,72 Найдено: С 52,23; Н 5,20; N 4,31; S 10,30; Na 6,15 Примеры 17-19. Синтез индотрикарбоцианиновых красителей с бромацетиламидными группами Пример 17. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)3H-индолиум-2-ил]-4-(5-[6-(бромацетиламино)гексил]карбамоил-4-оксапентил)гепта-2,4,6-триен-1 илиден-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула XIX) а) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]-4-(5-(6-аминогексилгексил)карбамоил-4-оксапентил)гепта-2,4,6-триен-1-илиден-1-(2 сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль Синтез проводят аналогично примеру 1 д из 0,5 г (0,55 ммоля) названного в заголовке примера 10 в соединения и 0,15 г (0,70 ммоля) N-бок-гександиамина (Fluka). Реакционный продукт очищают с помощью хроматографии (RP-С 18-хроматография, градиент метанол/вода) и после лиофилизации перемешивают при охлаждении льдом в смеси 2 мл трифторуксусной кислоты/8 мл дихлорметана в течение 15 мин. После центрифугирования в вакууме остаток растворяют в метаноле, осаждают диэтиловым эфиром и выделяют. Выход: 0,26 г голубого твердого вещества (22% от теоретического). б) Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)-3Hиндолиум-2-ил]-4-(5-[6-(бромацетиламино)гексил]карбамоил-4-оксапентил)гепта-2,4,6-триен-1-илиден-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль 0,26 г (0,23 ммоля) названного в заголовке примера 18 а соединения охлаждают в 5 мл ДМФ до -20 С,смешивают с 28 мг (0,28 ммоля) триэтиламина и раствором 0,10 г (0,46 ммоля) бромацетилбромида в 0,2 мл диметилформамида. После перемешивания в течение 5 ч при максимальной температуре 0 С осаждают продукт добавлением диэтилового эфира и получают после переосаждения из смеси диметилформамид/диэтиловый эфир и высушивания 0,23 г голубого твердого вещества (86% от теоретического). Элементный анализ: вычислено: С 45,63; Н 4,87; N 4,84; S 11,07; Na 5,96 Найдено: С 45,13; Н 4,66; N 4,67; S 10,83; Na не определяли Пример 18. Тринатриевая соль 3,3-диметил-2-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)3H-индолиум-2-ил]-4-(3-[3-(бромацетиламино)пропил]карбамоилэтил)гепта-2,4,6-триен-1-илиден-1(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфоновой кислоты, внутренняя соль (формула XVIII) Синтез проводят из названного в заголовке примера 1 г соединения (0,5 г; 0,56 ммоля) и N-бокпропилендиамина аналогично примеру 17. Выход по всем стадиям: 0,22 г (37% от теоретического). Элементный анализ: вычислено: С 43,70; Н 4,33; N 5,23; S 11,96; Na 5,96 Найдено: С 43,21; Н 4,14; N 5,53; S 10,89; Na не определяли Пример 19. Тринатриевая соль 3,3-диметил-2-[2-(1-[3,3-диметил-5-сульфонато-1-(2 сульфонатоэтил)-3H-индолиум-2-ил]винилен-2-(4-[3-(бромацетиламино)пропил]карбамоилэтил)феноксициклогекс-1-ен-3-илиден)этилиден]-1-(2-сульфонатоэтил)-2,3-дигидро-1H-индол-5-сульфоновой кислоты, внутренняя соль (формула XX) Синтез проводят из названного в заголовке примера 136 соединения (0,5 г; 0,49 ммоля) и N-бокпропилендиамина аналогично примеру 17. Выход по всем стадиям: 0,31 г (53% от теоретического). Элементный анализ: вычислено: С 47,88; Н 4,52; N 4,65; S 10,65; Na 5,73 Найдено: С 48,04; Н 4,43; N 4,69; S 10,72; Na 5,84 Примеры 20-23. Синтез коньюгатов с биомолекулами и фотофизическая характеристика коньюгатов Пример 20. Маркирование БСА (альбумин бычьей сыворотки) соединениями, названными в заголовках примеров 1-16 Общие инструкции: Раствор 5 мг (0,074 мкмоля) БСА (Sigma Company) в 5 мл фосфатного буфера (0,1-молярныйNa2HPO4/NaH2PO4, pH 6,8) смешивают в каждом случае с 0,74 мкмолями соединений, названных в заголовках примеров 1-16 (исходные растворы для разведения 0,5 мг/мл в ФБР (физиологический раствор с фосфатным буфером), и инкубируют в течение 30 мин при 25 С. Очистку коньюгатов проводят посредством гель-хроматографии (колонка: Sephadex G50, диаметр 1,5 см, Pharmacia, элюент: ФБР). Пример 21. Маркирование БСА соединениями, названными в заголовках примеров 17-19 Общие инструкции: Раствор 5 мг (0,074 мкмоля) БСА (от фирмы Sigma Company) в 5 мл фосфатного буфера (0,1-молярный боратный буфер, рН 8,5) смешивают в каждом случае с 1,10 мкмолями соединений, названных в заголовках примеров 17-19 (исходные растворы для разведения 0,5 мг/мл в ФБР), и инкубируют в течение 5 ч при 25 С. Очистку коньюгатов проводят посредством гель-хроматографии(колонка: Sephadex G50, диаметр 1,5 см, Pharmacia, элюент: ФБР). Пример 22. Маркирование scFv антитела АР 39 (фрагмент одиночной цепи) к ED-B-фибронектину соединениями, названными в заголовках примеров 1-16 АР 39 является scFv с С-концевым цистеином и присутствует в виде S-S-димера с молярной массой около 56 000 г/мол (Curr. Opin. Drug Discov. Devel. 2002 Mar; 5(2): 204-13). При восстановлении дисульфидных мостиков образуются два мономера с доступными SH-группами (молярная масса 28000 г/мол). Общие инструкции: 0,3 мл раствора АР 39 в ФБР (концентрация 0,93 мг димера/мл) смешивают с 60 мкл раствора трис(карбоксиэтил)фосфина (ТСЕР) в ФБР (2,8 мг/мл) и инкубируют в атмосфере азота в течение 1 ч при 25 С. Избыток ТСЕР отделяют посредством гель-фильтрации на NAP-5 колонке (элюент: ФБР). Количество полученного АР 39-мономера (OD280HM = 1,4), определенное с помощью фотометрии,составляет 230-250 мкг (объемы 0,5-0,6 мл). Раствор смешивают с 0,03 мкмоля соединений, названных в заголовках примеров 1-16, (исходные растворы для разведения 0,5 мг/мл в ФБР), и инкубируют в течение 30 мин при 25 С. Коньюгат очищают с помощью гель-хроматографии на NAP-5 колонке (элюент: ФБР/10% глицерин). Иммунореактивность раствора коньюгата определяют с помощью афинной хроматографии (ED-B-фибронектиновая смола) (J. Immunol. Meth., 1999, 231, 239). Иммунореактивность полученных коньюгатов составляет 80% (АР 39 перед коньюгацией 95%). Пример 23. Маркирование scFv антитела АР 39 (фрагмент одиночной цепи) к ED-B-фибронектину соединениями, названными в заголовках примеров 17-19 Общие инструкции: 0,3 мл раствора АР 39 в ФБР (концентрация 0,93 мг димера/мл) смешивают с 60 мкл раствора трис(карбоксиэтил)фосфина (ТСЕР) в ФБР (2,8 мг/мл) и инкубируют в атмосфере азота в течение 1 ч при 25 С. Избыток ТСЕР отделяют посредством гель-фильтрации на NAP-5 колонке (элюент: 50 ммолей боратного буфера, рН 8,5). Количество полученного АР 39-мономера (OD280HM = 1,4), определенное с помощью фотометрии, составляет 230-250 мкг (объемы 0,5-0,6 мл). Раствор смешивают с 0,06 мкмолей соединений, названных в заголовках примеров 1-16, (исходные растворы для разведения 0,5 мг/мл в ФБР), и инкубируют в течение 4 ч при 25 С. Коньюгат очищают с помощью гель-хроматографии наNAP-5 колонке (элюэнт: ФБР/10% глицерин). Иммунореактивность раствора коньюгата определяют с помощью афинной хроматографии (ED-B-фибронектиновая смола) (J. Immunol. Meth., 1999, 231, 239). Иммунореактивность полученных коньюгатов составляет 75% (АР 39 перед коньюгацией 95%). Фотофизическая характеристика краситель-БСА-коньюгатов примеров 21 и 22 и коньюгатов краситель-scFv антитело примеров 23 и 24. Степень концентрации (молярное соотношение краситель/антитело) определяют фотометрически,- 22009386 основываясь на коэффициенте экстинкции 75000 л мол-1 см-1 в коротковолновом плече спектральной линии (около 690-710 нм); абсорбцию антитела (АР 39) определяют с OD280HM 1,4; и/или абсорбцию белка(БСА) определяют с OD277HM 0,58. Флюоресцентный квантовый выход определяют с помощью SPEXfluorolog (зависимая от длины волны чувствительность калибруется лампой и детектором) относительно индоцианинового зеленого (Q = 0,13 в ДМСО, J. Chem. Eng. Data, 1977, 22, 379, Bioconjugate Chem.,2001, 12, 44). Таблица 2. Свойства коньюгатов согласно изобретению Пример 24. Визуализационные свойства коньюгатов согласно изобретению исследуют в условиях in vivo после инъекции безволосой мыши, имеющей опухоль. С этой целью коньюгаты вводят внутривенно и за концентрацией в области расположения опухоли наблюдают в течение 24 ч после введения. Флюоресценцию субстанций возбуждают на участке облучения животных посредством близкого инфракрасного света с длиной волны 740 нм, который получают с помощью диодного лазера (0,5 W выход). Флюоресцентную радиацию обнаруживают с помощью усиленной CCD камеры, а флюоресцентные изображения сохраняют в цифровом виде. Эффективность в условиях in vivo коньюгатов красителей изображена на фиг. 2, основанном на примере. Можно полагать, что любой специалист в области техники без дальнейшей разработки, применяя предшествующее описание, может использовать настоящее изобретение в полнейшей степени. Поэтому следующие предпочтительные специфические варианты следует истолковывать только как иллюстративные и совсем не лимитирующие любым путем остальной объем изобретения. Полное описание(я) всех заявок, патентов и публикаций, цитированных при этом, включены в данное описание посредством ссылок. Предшествующие примеры могут быть повторены с подобным успехом при замене общих или специфически описанных регентов или технических условий по настоящему изобретению для их применения в предшествующих примерах. Из приведенного выше описания любой специалист в данной области техники может легко установить существенные характеристики по настоящему изобретению и, без отклонения от его сущности и объема, может произвести различные изменения и модификации изобретения, чтобы адаптировать его к различным вариантам применения и условиям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Индотрикарбоцианиновый краситель формулы (I)X обозначает С, который замещен в двух положениях метильной группой, Y обозначает СН 2-СН 2,Z обозначает С 1-5 алкил, при этом атомы углерода необязательно замещены О, или обозначает групR1-R4 независимо друг от друга обозначают SO3H, R5 обозначает -CO-NH-R8-R9 или СООН, где R8 обозначает неразветвленный С 2-13 алкил, в котором С атомы необязательно замещены О, а R9 выбирают из и R6 и R7 обозначают СН или связаны с гексильным кольцом через С 3 алкил, который необязательно может быть замещен в п-положении С 1-4 алкильным радикалом, и соли и сольваты этого соединения. 2. Индотрикарбоцианиновый краситель согласно п.1, в котором Y обозначает СН 2-СН 2, Z обозначает С 1-5 алкил, при этом атомы углерода необязательно замещены О, а R6 и R7 обозначают СН, и соли и сольваты этого соединения. 3. Индотрикарбоцианиновый краситель согласно п.1 или 2, в котором Z обозначает С 1-5 алкил. 4. Индотрикарбоцианиновый краситель согласно п.1 или 2, в котором Z обозначает и R6 и R7 связаны с гексильным кольцом через С 3-алкил. 5. Индотрикарбоцианиновый краситель согласно пп.1-4, в котором R5 обозначает СООН. 6. Индотрикарбоцианиновый краситель согласно п.3 формулы (II) и соли и сольваты этого соединения. 7. Индотрикарбоцианиновый краситель согласно п.3 формулы (III) и соли и сольваты этого соединения. 8. Индотрикарбоцианиновый краситель согласно п.3 формулы (IV) и соли и сольваты этого соединения. 9. Индотрикарбоцианиновый краситель согласно п.3 формулы (V) и соли и сольваты этого соединения. 10. Индотрикарбоцианиновый краситель согласно п.3 формулы (VI) и соли и сольваты этого соединения. 11. Индотрикарбоцианиновый краситель согласно п.3 формулы (VII) и соли и сольваты этого соединения. 12. Индотрикарбоцианиновый краситель согласно п.3 формулы (VIII) и соли и сольваты этого соединения. 13. Индотрикарбоцианиновый краситель согласно п.3 формулы (IX) и соли и сольваты этого соединения. 14. Индотрикарбоцианиновый краситель согласно п.3 формулы (X) и соли и сольваты этого соединения. 15. Индотрикарбоцианиновый краситель согласно п.2 формулы (XI) и соли и сольваты этого соединения. 16. Индотрикарбоцианиновый краситель согласно п.2 формулы (XII) и соли и сольваты этого соединения. 17. Индотрикарбоцианиновый краситель согласно п.2 формулы (XIII) и соли и сольваты этого соединения. 18. Индотрикарбоцианиновый краситель согласно п.4 формулы (XIV) и соли и сольваты этого соединения. 19. Индотрикарбоцианиновый краситель согласно п.4 формулы (XV) и соли и сольваты этого соединения. 20. Индотрикарбоцианиновый краситель согласно п.4 формулы (XVI) и соли и сольваты этого соединения. 21. Индотрикарбоцианиновый краситель согласно п.4 формулы (XVII) и соли и сольваты этого соединения. 22. Индотрикарбоцианиновый краситель согласно п.3 формулы (XVIII) и соли и сольваты этого соединения. 23. Индотрикарбоцианиновый краситель согласно п.2 формулы (XIX) и соли и сольваты этого соединения. 24. Индотрикарбоцианиновый краситель согласно п.4 формулы (XX) и соли и сольваты этого соединения. 25. Способ получения индотрикарбоцианинового красителя формулы (I) по одному из пп.1-24,включающий: а) получение соответствующего 4-замещенного пиридина,б) превращение 4-замещенного пиридина посредством реакции Цинке-Книга в соответствующий мезозамещенный глутакональдегиддианилид, который является предшественником цианинового красителя, и в) превращение мезозамещенного глутакональдегиддианилида в соответствующий индотрикарбоцианиновый краситель формулы (I). 26. Способ получения коньюгатов, включающий присоединение индотрикарбоцианинового красителя согласно одному из пп.1-24 к биомолекуле. 27. Коньюгат индотрикарбоцианинового красителя с биомолекулой, полученный согласно п.26. 28. Коньюгат согласно п.27, характеризующийся тем, что в качестве биомолекулы включает по крайней мере одну биомолекулу, выбранную из пептидов, белков, липопротеинов, антител или фрагментов антител, нуклеиновой кислоты, такой как, например, олиго- или полинуклеотиды из ДНК или РНК,аптамеров, РНК и Сахаров, таких как, например, моно-, ди-, три-, олиго- и полисахариды. 29. Коньюгат согласно п.28, где белок выбран из группы структурных белков или растворимых белков организма. 30. Коньюгат согласно п.28 или 29, где растворимый белок является сывороточным белком, таким как, например, HSA, BSA, яичный альбумин, ферментом, как, например, пероксидаза, или антителом,scFv фрагментом или F(ab). 31. Коньюгат согласно одному из пп.27-30, где растворимый белок имеет сродство по отношению кED-B-фибронектину. 32. Коньюгат согласно одному из пп.27-31, где индотрикарбоцианиновый краситель присоединен к биомолекуле через SH-группу, в частности, через SH-группу к цистеину. 33. Диагностический набор, включающий индотрикарбоцианиновый краситель согласно одному из пп.1-24 и/или коньюгат согласно одному из пп.27-31, вместе с дополнительными адъювантами для осуществления диагностики в условиях in vivo, в частности, опухолей. 34. Применение коньюгата согласно одному из пп.27-31 в качестве флюоресцентной контрастной среды для in vivo диагностики опухолей.
МПК / Метки
МПК: G01N 33/58, C09B 23/00, G01N 33/533, C09B 23/08
Метки: отношении, гидрофильные, тиол-группы, красители, реакционные, цианиновые, биомолекулами, диагностики, флюоресцентной, конъюгаты
Код ссылки
<a href="https://eas.patents.su/30-9386-gidrofilnye-reakcionnye-v-otnoshenii-tiol-gruppy-cianinovye-krasiteli-i-ih-konyugaty-s-biomolekulami-dlya-flyuorescentnojj-diagnostiki.html" rel="bookmark" title="База патентов Евразийского Союза">Гидрофильные, реакционные в отношении тиол-группы цианиновые красители, и их коньюгаты с биомолекулами для флюоресцентной диагностики</a>
Предыдущий патент: Способ энантиоселективного синтеза отдельных энантиомеров модафинила ассиметричным окислением
Следующий патент: Азабициклические производные в качестве антагонистов мускаринового рецептора
Случайный патент: Способ осуществления электрохимической реакции