Производные 16-галогенэпотилона и их фармацевтическое использование
Номер патента: 9206
Опубликовано: 28.12.2007
Авторы: Бухман Бернд, Скубалла Вернер, Шведе Вольфганг, Клар Ульрих, Ширнер Михаэль
Формула / Реферат
1. Производные эпотилона общей формулы I
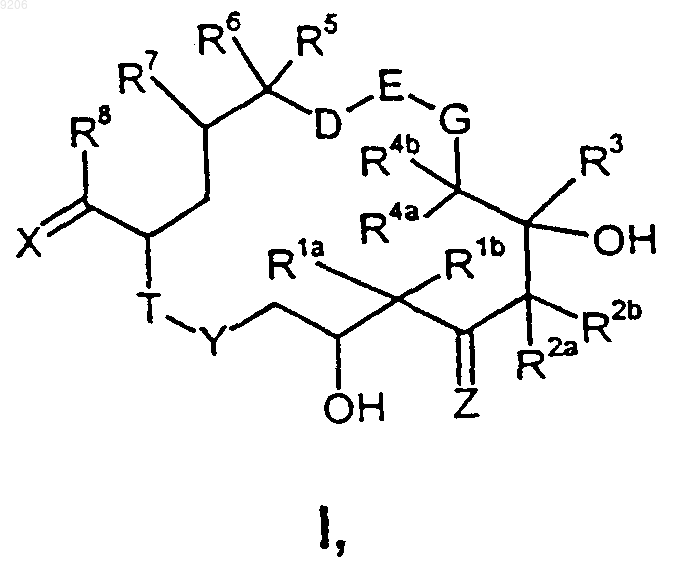
в которой
Rla и R1b имеют идентичные или разные значения и обозначают водород, C1-С10алкил или оба вместе образуют -(СН2)m-группу, где m = 2, 3, 4 или 5;
R2a и R2b имеют идентичные или разные значения и обозначают водород, C1-С10алкил или оба вместе образуют -(СН2)n-группу, где n = 2, 3, 4 или 5;
R3 обозначает водород, C1-С10алкил;
G обозначает атом кислорода или группу -CH2-;
R4a и R4b имеют идентичные или разные значения и обозначают водород, C1-С10алкил или оба вместе образуют -(СН2)p-группу, где р = 2, 3, 4 или 5;
D-E представляет собой группу CH2-CH2-;
R5 обозначает водород, C1-С10алкил, CO2H, CO2-алкил, CH2OH, CH2O-алкил, CH2O-ацил, CN, CH2NH2, CH2N(алкил, ацил)1.2, CH2Hal;
R6 и R7 каждый обозначает атом водорода, а оба вместе обозначают дополнительную связь или атом кислорода;
R8 обозначает атом галогена;
X обозначает группировку CR10R11, где один из R10 и R11 обозначает атом водорода, а другой обозначает 2-метилтиазолил, 2-гидроксиметилтиазолил, 2-пиридил или 2-пиридил-N-оксид, 2-метилоксазолил, 2-гидроксиметилоксазолил;
T-Y представляет собой группу O-С(=O) или NR24-C(=O), где R24 обозначает водород или C1-С10алкил;
Z обозначает атом кислорода.
2. Соединения по п.1, где R8 представляет собой атом фтора.
3. Соединения по п.1, где R8 представляет собой атом хлора.
4. Соединения по п.1, где R2a представляет собой метильную, этильную или пропильную группу.
5. Соединения по п.2, где R2a представляет собой метильную, этильную или пропильную группу.
6. Соединения по п.3, где R2a представляет собой метильную, этильную или пропильную группу.
7. Соединения по п.1, где R1a и R1b оба вместе представляют собой триметиленовую группу.
8. Соединения по п.2, где R1a и R1b оба вместе представляют собой триметиленовую группу.
9. Соединения по п.3, где R1a и R1b оба вместе представляют собой триметиленовую группу.
10. Соединения по п.1, где R1a и R1b каждый обозначает метильную группу.
11. Соединения по п.2, где R1a и R1b каждый обозначает метильную группу.
12. Соединения по п.3, где R1a и R1b каждый обозначает метильную группу.
13. Соединения по п.1, где R10/R11 обозначают 2-пиридил/водород.
14. Соединения по п.2, где R10/R11 обозначают 2-пиридил/водород.
15. Соединения по п.3, где R10/R11 обозначают 2-пиридил/водород.
16. Соединения по п.1, где R10/R11 обозначают 2-метил-4-тиазолил/водород.
17. Соединения по п.2, где R10/R11 обозначают 2-метил-4-тиазолил/водород.
18. Соединения по п.3, где R10/R11 обозначают 2-метил-4-тиазолил/водород.
19. Соединения по п.1, где R10/R11 обозначают 2-гидроксиметил-4-тиазолил/водород или 2-метил-4-оксазолил/водород или 2-гидроксиметил-4-оксазолил/водород.
20. Соединения по п.2, где R10/R11 обозначают 2-гидроксиметил-4-тиазолил/водород или 2-метил-4-оксазолил/водород или 2-гидроксиметил-4-оксазолил/водород.
21. Соединения по п.3, где R10/R11 обозначают 2-гидроксиметил-4-тиазолил/водород или 2-метил-4-оксазолил/водород или 2-гидроксиметил-4-оксазолил/водород.
22. Соединения по п.1, где T-Y представляет собой группу O-С(=O).
23. Соединения по п.2, где T-Y представляет собой группу O-С(=O).
24. Соединения по п.3, где T-Y представляет собой группу O-С(=O).
25. Соединения по п.1, где T-Y представляет собой группу NR24-C(=O), где R24 имеет значения, указанные выше.
26. Соединения по п.2, где T-Y представляет собой группу NR24-C(=O), где R24 имеет значения, указанные выше.
27. Соединения по п.3, где T-Y представляет собой группу NR24-C(=O), где R24 имеет значения, указанные выше.
28. Соединения по п.1, где G представляет собой метиленовую группу.
29. Соединения по п.2, где G представляет собой метиленовую группу.
30. Соединения по п.3, где G представляет собой метиленовую группу.
31. Соединения по п.1, где R3 представляет собой атом водорода.
32. Соединения по п.2, где R3 представляет собой атом водорода.
33. Соединения по п.3, где R3 представляет собой атом водорода.
34. Соединения по п.1, где R4a/R4b обозначают Н/СН3.
35. Соединения по п.2, где R4a/R4b обозначают Н/СН3.
36. Соединения по п.3, где R4a/R4b обозначают Н/СН3.
37. Соединения по п.2, где R2a/R2b обозначают метил или этил/водород.
38. Соединения по п.3, где R2a/R2b обозначают метил или этил/водород.
39. Соединения по п.8, где R2a/R2b обозначают метил или этил/водород.
40. Соединения по п.9, где R2a/R2a обозначают метил или этил/водород.
41. Соединения по п.8, где R10/R11 обозначают 2-пиридил/водород, или 2-метил-4-тиазолил/водород, или 2-гидроксиметил-4-тиазолил/водород, или 2-метил-4-оксазолил/водород, или 2-гидроксиметил-4-оксазолил/водород.
42. Соединения по п.9, где R10/R11 обозначают 2-пиридил/водород, или 2-метил-4-тиазолил/водород, или 2-гидроксиметил-4-тиазолил/водород, или 2-метил-4-оксазолил/водород, или 2-гидроксиметил-4-оксазолил/водород.
43. Соединения по п.11, где R10/R11 обозначают 2-пиридил/водород, или 2-метил-4-тиазолил/водород, или 2-гидроксиметил-4-тиазолил/водород, или 2-метил-4-оксазолил/водород, или 2-гидроксиметил-4-оксазолил/водород.
44. Соединения по п.12, где R10/R11 обозначают 2-пиридил/водород, или 2-метил-4-тиазолил/водород, или 2-гидроксиметил-4-тиазолил/водород, или 2-метил-4-оксазолил/водород, или 2-гидроксиметил-4-оксазолил/водород.
45. Соединения по п.41, где R2a/R2b обозначают метил или этил/водород.
46. Соединения по п.42, где R2a/R2b обозначают метил или этил/водород.
47. Соединения по п.43, где R2a/R2b обозначают метил или этил/водород.
48. Соединения по п.44, где R2a/R2b обозначают метил или этил/водород.
49. Соединения общей формулы I, выбранные из группы, включающей
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-1-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-1-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-16-(l-фтор-2-(2-метилоксазол-4-ил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E), 16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E), 16S(Z))-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-оксо-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-7,9,13-триметил-5,5-(1,3-триметил)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0] гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-7,9,13-триметил-5,5-(1,3-триметилен) циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или E),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-димитил-10-этил-3-(1-хлор-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,
(4S,7R,8S,9S,13(Z или Е),16S(Z))-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-пиридил)
этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,
(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-пиридил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион.
50. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая в своем составе по меньшей мере одно соединение общей формулы I по любому из пп.1-49, а также фармацевтически приемлемый носитель.
51. Применение соединений общей формулы I по любому из пп.1-49 для получения фармацевтической композиции, обладающей противоопухолевой активностью.
52. Промежуточные продукты общей формулы С
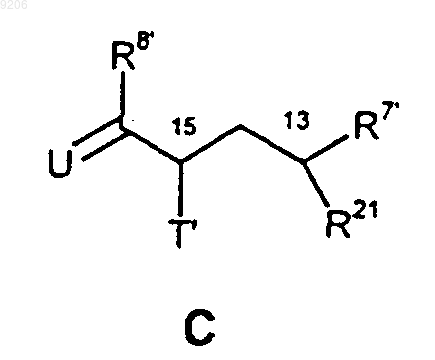
в которой
R8' обозначает атом галогена;
R7' обозначает атом водорода;
T' обозначает группу OR20, где R20 представляет собой атом водорода или защитную группу PG2, атом галогена, предпочтительно атом брома либо иода, азидогруппу либо защищенную аминогруппу;
R21 обозначает гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, группу галогенид фосфония PPh3+Hal- (Ph означает фенил, Hal означает F, Cl, Br, I), фосфонатную группу P(O)(OQ)2 (Q означает C1-С10алкил или фенил) или фосфиноксидную группу P(O)Ph2 (Ph означает фенил);
U обозначает группировку CR10R11, где один из R10 и R11 обозначает атом водорода, а другой обозначает 2-метилтиазолил, 2-гидроксиметилтиазолил, 2-пиридил или 2-пиридил-N-оксид, 2-метилоксазолил, 2-гидроксиметилоксазолил.
53. Промежуточные продукты общей формулы ВС
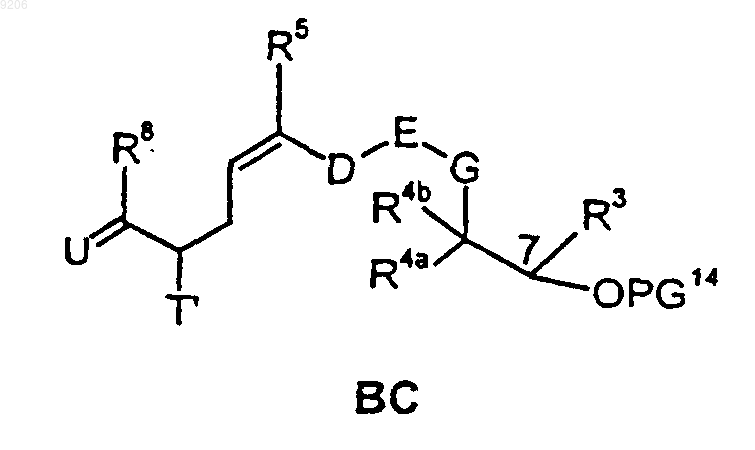
в которой R3, R4a, R4b, R5, R8, D, E и G имеют значения, определенные в п.1;
T' обозначает группу OR20, где R20 представляет собой атом водорода или защитную группу PG2, атом галогена, предпочтительно атом брома либо иода, азидогруппу либо защищенную аминогруппу;
U обозначает группировку CR10R11, где один из R10 и R11 обозначает атом водорода, а другой обозначает 2-метилтиазолил, 2-гидроксиметилтиазолил, 2-пиридил или 2-пиридил-N-оксид, 2-метилоксазолил, 2-гидроксиметилоксазолил; а
PG14 представляет собой атом водорода или защитную группу PG.
54. Промежуточные продукты общей формулы ABC
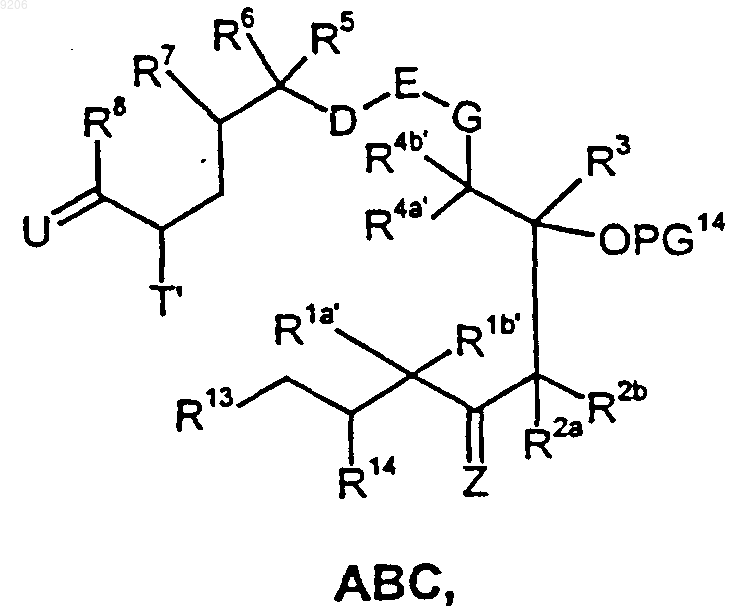
в которой Rla', Rlb', R2a', R2b', R3, R4a', R4b', R5, R6, R7, R8, D, E, G и Z имеют значения, определенные в п.1;
T' обозначает группу OR20, где R20 представляет собой атом водорода или защитную группу PG2, атом галогена, предпочтительно атом брома либо иода, азидогруппу либо защищенную аминогруппу;
U обозначает группировку CR10R11, где один из R10 и R11 обозначает атом водорода, а другой обозначает 2-метилтиазолил, 2-гидроксиметилтиазолил, 2-пиридил или 2-пиридил-N-оксид, 2-метилоксазолил, 2-гидроксиметилоксазолил; и
R13 обозначает CH2OR13a, CH2-Hal, CHO, CO2R13b, COHal,
R14 обозначает водород, OR14a, Hal, OSO2R14b, где
R13a и Rl4a обозначают водород, SO2-алкил, SO2-арил, SO2-аралкил либо оба вместе образуют
-(СН2)o-группу или CR15aR15b-группу;
R13b и R14b обозначают водород, С1-С20алкил, арил, С7-С20аралкил;
R15a и R15b имеют идентичные или разные значения и обозначают водорюф, C1-С20алкил, арил, С7-С20аралкил либо оба вместе образуют -(CH2)q-группу,
о обозначает 2-4,
q обозначает 3-6.
Текст
009206 Цитотоксичность природных веществ эпотилона A (R означает водород) и эпотилона В (R означает метил) описана, например, Hfle и др. в Angew. Chem. 108 (1996), стр. 1671-1673. эпотилон A (R означает Н), эпотилон В (R означает СН 3) Благодаря их in-vitro-селективности по отношению к клеточным линиям груди и кишечника и их в сравнении с таксолом значительно более высокой активности по отношению к образующим Pгликопротеид, мультирезистентным раковым линиям, а также более эффективным в сравнении с таксолом физическим свойствам, например, превосходящей в 30 раз водорастворимости, этот класс веществ нового типа представляет особый интерес для создания лекарственного средства, которое можно было бы применять при терапии злокачественных опухолей. Указанные природные вещества характеризуются недостаточной как с химической, так и с метаболической точек зрения стабильностью, что делает проблематичной их использование при разработке соответствующих лекарственных средств. Для устранения этих недостатков необходимы модификации природного вещества. Получить такие модификации можно только путем общего синтеза, который обеспечит широкие возможности модифицировать природный материал. Целью этих структурных изменений является также расширение терапевтического спектра. Достичь этого можно за счет улучшения избирательности действия, и/или повышения эффективности, и/или снижения нежелательных токсичных побочных эффектов, описанных в Proc. Natl. Acad. Sci. USA 95 (1998), стр. 9642-9647. Общий синтез эпотилона А описан у Schinzer и др. в Chem. Eur. Journ. 2,11 (1996), стр. 14771482 и в Angew. Chem. 109,5 (1997), 543-544. Производные эпотилона уже были описаны у Hfle и др. в заявке WO 97/19086. Эти производные получают, исходя из природных эпотилона А и В. В качестве возможных исходных продуктов для этих целей описаны также эпотилон С и эпотилон D (двойная связь между атомами углерода 12 и 13: эпотилон С = дезоксиэпотилон А; эпотилон D = дезоксиэпотилон В). Еще одна возможность синтезировать эпотилон и производные эпотилона описана у Nicolaou и др. в Angew. Chem. 109,1/2 (1997), стр. 170-172. Синтез эпотилона А и В, а также некоторых аналогов эпотилона описан этими же авторами в Nature, т. 387 (1997), стр. 268-272, синтез эпотилона А и его производных в Journ. Am. Chem. Soc, т. 119,34 (1997), стр. 7960-7973, и синтез эпотилона А и В и некоторых аналогов эпотилона в Journ. Am. Chem. Soc, т. 119,34 (1997), стр. 7974-7991. У Nicolaou и др. вAngew. Chem. 109,19 (1997), стр. 2181-2187 описывается также получение аналогов эпотилона А путем комбинированного синтеза в твердой фазе. В этой публикации имеется также описание некоторых аналогов эпотилона В. Производные эпотилона, в том числе частично эпотилон C и D, описаны, кроме того, в заявках WO 99/07692, WO 99/02514, WO 99/01124, WO 99/67252, WO 98/25929, WO 97/19086, WO 98/38192, WO 99/22461 и WO 99/58534. Однако в известных на сегодняшний день производных эпотилона у атома углерода 16 в эпотилоновом скелете ни в одном случае не может находиться атом галогена. Содержание приоритетных по отношению к настоящей заявке документов DE 19908765.2 и DE 19954230.9, равно как и заявка авторов настоящего изобретения WO 99/07692 включены в настоящее описание в качестве ссылки. В основу настоящего изобретения была положена задача получить новые производные эпотилона,которые как в химическом, так и метаболическом отношении были бы достаточно стабильными для их использования при создании соответствующих лекарственных средств и которые по их терапевтическому спектру, по избирательности их действия и/или по минимуму нежелательных токсичных побочных эффектов, и/или по их эффективности превосходили бы природные производные. Настоящее изобретение относится к новым производным эпотилона общей формулы I в которой R1a и R1b имеют идентичные или разные значения и обозначают водород, С 1-С 10 алкил, арил,-1 009206 С 7-С 20 аралкил или оба вместе образуют -(СН 2)m-группу, где m=2, 3, 4 или 5,R2a И R2b имеют идентичные или разные значения и обозначают водород, С 1-С 10 алкил, арил, С 7 С 20 аралкил или оба вместе образуют -(CH2)n-группу, где n=2, 3, 4 или 5,R3 обозначает водород, С 1-С 10 алкил, арил, С 7-С 20 аралкил,G обозначает атом кислорода или группу -CH2,R4a и R4b имеют идентичные или разные значения и обозначают водород, С 1-С 10 алкил, арил, С 7 С 20 аралкил или оба вместе образуют -(CH2)p-группу, где р=2, 3, 4 или 5,D-E представляет собой группуR5 обозначает водород, С 1-С 10 алкил, арил, С 7-С 20 аралкил, CO2H, CO2-алкил, CH2OH, CH2O-алкил,CH2O-ацил, CN, CH2NH2, CH2N (алкил,ацил)1.2, CH2Hal,R6 и R7 каждый обозначает атом водорода, а оба вместе обозначают дополнительную связь или атом кислорода,R8 обозначает атом галогена или цианогруппу,X обозначает атом кислорода, две алкоксигруппы OR23, С 2-С 10 алкилен-,-диоксигруппу, которая может быть прямоцепочечной либо разветвленной, H/OR9 или группировку CR10 R11, при этомR23 представляет собой С 1-С 20 алкильный остаток,R9 представляет собой атом водорода или защитную группу PGX,R10 и R11 имеют идентичные или разные значения и обозначают водород, С 7-С 20 алкильный, арильный, С 7-С 20 аралкильный остаток либоR10 и R11 оба вместе с углеродным атомом метилена образуют 5-7-членное карбоциклическое кольцо,T-Y представляет собой группу O-С(=O), O-CH2, СН 2 С(=O), NR24-C(=O), NR24-SO2, гдеR24 обозначает водород или С 1-С 10 алкил,Z обозначает атом кислорода или H/OR12, гдеR12 представляет собой водород или защитную группу PGZ. Атомом галогена R8 может быть атом фтора, хлора, брома либо иода, предпочтительными из которых являются фтор, хлор и бром, а из них в первую очередь фтор и хлор.R2a обозначает предпочтительно метильную, этильную, пропильную или бутильную группу. Заместители R1a и R1b оба вместе представляют собой предпочтительно триметиленовую группу или каждый из них обозначает метильную группу.R10/R11 в группе X представляют собой предпочтительно 2-пиридил/водород, либо 2-метил-4 тиазолил/водород, либо 2-гидроксиметил-4-тиазолил/водород, либо 2-метил-4-оксазолил/водород, либо 2-гидроксиметил-4-оксазолил/водород.T-Y представляет собой предпочтительно группу O-С(= O) или группу NR24-C(= O),Z обозначает в первую очередь атом кислорода. Между атомами углерода 10 и 11 в предпочтительных соединениях общей формулы I имеется простая связь, то есть -D-E- представляет собой этиленовую группу. Кроме того, в соединениях по изобретению R3 обычно обозначает атом водорода. Оба заместителя R4a и R4b вместе представляют собой комбинацию Н/СН 3. Согласно одному из вариантов выполнения изобретения предусматриваются такие соединения общей формулы I, где R8 обозначает атом фтора либо хлора, а R1a и R1b вместе образуют триметиленовую группу. Согласно другому варианту изобретение относится к таким соединениям общей формулы I, где R8 обозначает атом фтора либо хлора, a R10/R11 представляют собой 2-пиридил/водород. Согласно еще одному варианту предусматриваются такие соединения общей формулы I, где R8 обозначает атом фтора либо хлора, a R2a/R2b представляют собой этил/водород. В другом варианте выполнения изобретения предусматриваются такие соединения общей формулыI, где R8 обозначает атом фтора либо хлора, R1a и R1b оба вместе образуют триметиленовую группу, aR2a/R2b представляют собой этил/водород. Кроме того, следует назвать и такой вариант получения соединений по изобретению, согласно которому R8 обозначает атом фтора либо хлора, R2a/R2b представляют собой этил/водород, a R10/R11 обозначают 2-пиридил/водород. Другие варианты выполнения настоящего изобретения характеризуются признаками, указанными в зависимых пунктах формулы изобретения. Получение новых производных эпотилона основано на соединении (связи) трех фрагментов А, В и С. Этот способ касается получения производных эпотилона, содержащих в качестве R8 вместо предлагаемого в настоящем изобретении атома галогена, например, метильную или имеющую более длинную цепь алкильную группу, и он описан в заявке DE 19751200.3, дата подачи 13.11.1997, и в соответствую-2 009206 щей заявке WO 99/07692. Места присоединения названных фрагментов указаны в общей формуле I' А обозначает C1-C6 фрагмент (система нумерации атомов молекулы эпотилона) общей формулы в которой R1a', R1b', R2a' и R2b' имеют значения, указанные выше для R1a, R1b, R2a и R2b, аR13 обозначает CH2OR13a, CH2-Hal, CHO, CO2R13b, COHal,R14 обозначает водород, OR14a, Hal, OSO2R14b,R13a и R14a обозначают водород, SO2-алкил, SO2-арил, SO2-аралкил либо оба вместе образуют-(СН 2)o-группу или CR15a R15b-группу,R13b и R14b обозначают водород, C1-С 20 алкил, арил, С 7-С 20 аралкил,R15a и R15b имеют идентичные или разные значения и обозначают водород, C1-С 10 алкил, арил, С 7 С 20 аралкил либо оба вместе образуют -(CH2)q-группу,Hal обозначает галоген (F, Cl, Br, I),о обозначает 2-4,q обозначает 3-6,включая все стереоизомеры, а также их смеси, при этом свободные гидроксильные группы в R13 и R14 могут быть этерифицированы либо эстерифицированы, свободные карбонильные группы в А и R13 могут быть кетализированы, переведены в простой енольный эфир или восстановлены, а свободные кислотные группы в А могут переводиться в их соли с основаниями. В обозначает С 7-С 12 фрагмент (система нумерации атомов молекулы эпотилона) общей формулы в которой R3', R4a', R4b' и R5' имеют значения, указанные выше для R3, R4a, R4b и R5,D, E и G имеют значения, указанные в общей формуле I, аV обозначает атом кислорода, две алкоксигруппы OR17, С 2-С 10 алкилен-,-диоксигруппу, которая может быть прямоцепочечной либо разветвленной, или H/OR 16,W обозначает атом кислорода, две алкоксигруппы OR19, C2-C10 алкилен-,-диоксигруппу, которая может быть прямоцепочечной либо разветвленной, или H/OR18,R16 и R18, каждый независимо друг от друга, обозначает водород или защитную группу PG1,R17 и R19, каждый независимо друг от друга, обозначает С 1-С 20 алкил. С обозначает С 13-С 16 фрагмент (система нумерации атомов молекулы эпотилона) общей формулы в которой R8' имеет значение, указанное выше для R8 в общей формуле I, аR7' обозначает атом водорода,T' обозначает группу OR20, где R20 представляет собой атом водорода или защитную группу PG2,атом галогена, предпочтительно атом брома либо иода, азидогруппу или защищенную аминогруппу,R21 обозначает гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, фосфониевогалоге-3 009206 нидный остаток PPh3+ Hal- (где Ph означает фенил; Hal означает F, Cl, Br, I), фосфонатный остатокP(O)(OQ)2 (где Q означает С 1-С 10 алкил или фенил) или фосфиноксидный остаток P(O)Ph2 (где Ph означает фенил),U обозначает атом кислорода, две алкоксигруппы OR23, C2-C10 алкилен-,-диоксигруппу, которая может быть прямоцепочечной либо разветвленной, H/OR9 или группировку CR10R11, гдеR23 обозначает C1-С 20 алкильный остаток,R9 обозначает водород или защитную группу PG3,R10 И R11 имеют идентичные или разные значения и обозначают водород, C1-С 20 алкил, арил, С 7 С 20 аралкил либо оба вместе с углеродным атомом метилена образуют 5-7-членное карбоциклическое кольцо. В качестве алкильных групп Rla, Rlb, R2a, R2b, R3, R4, R5, R9, R10, R11, R12, R13b, R14b, R15a, R15b, R17 и R23 подразумеваются прямоцепочечные либо разветвленные алкильные группы с 1-20 атомами углерода,например, такие как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил,неопентил, гептил, гексил и децил. Эти алкильные группы R1a, R1b, R2a, R2b, R3, R4, R5, R9, R10, R11, R12,R13b, R14b, R15a, R15b, R17 и R23 могут быть перфорированы или замещены 1-5 атомами галогена, гидроксигруппами, С 1-С 4 алкоксигруппами, C6-С 12 арильными группами (которые в свою очередь могут быть замещены 1-3 атомами галогена). Под арильным остатком Rla, Rlb, R2a, R2b, R3, R4, R5, R9, R10, R11, R12, R13b, R14b, R15a и R15b подразумеваются замещенные и незамещенные карбоциклические либо гетероциклические остатки с одним или несколькими гетероатомами, например, такие как фенил, нафтил, фурил, тиенил, пиридил, пиразолил,пиримидинил, оксазолил, пиридазинил, пиразинил, хинолил, тиазолил, которые могут быть одно- или многозамещенными галогеном, ОН, O-алкилом, CO2H, CO2-алкилом, -NH2, -NO2, -N3, -CN, C1 С 20 алкилом, C1-С 20 ацилом и C 1-С 20 ацилоксигруппами. Гетероатомы в гетероарильных остатках могут быть оксидированы; так, в частности, тиазольное кольцо может быть представлено в виде N-оксида. Если не указано иное, то понятие "арил" во всех случаях включает также "гетероарил". Аралкильные группы в Rla, Rlb, R2a, R2b, R3, R4, R5, R9, R10, R11, R12, R13b, R14b, R15a и R15b могут содержать в кольце вплоть до 14 С-атомов, предпочтительно 6-10, а в алкильной цепи - 1-8, предпочтительно 1-4 атома. В качестве аралкильных остатков могут рассматриваться, например, бензил, фенилэтил, нафтилметил, нафтилэтил, фурилметил, тиенилэтил и пиридилпропил. Кольца могут быть одно- или многозамещенными галогеном, ОН, О-алкилом, CO2H, CO2-алкилом, -NO2, -N3, -CN, С 1-С 20 алкилом, C1 С 20 ацилом и C 1-С 20 ацилоксигруппами. Присутствующие в X в общей формуле I алкоксигруппы должны содержать соответственно каждая 1-20 атомов углерода, предпочтительны при этом метокси-, этокси-, пропокси-, изопропокси- и третбутилоксигруппы. В качестве представителей защитных групп PG можно назвать замещенный алкилом и/или арилом силил, С 1-С 20 алкил, С 4-С 7 циклоалкил, который может дополнительно содержать в кольце атом кислорода, арил, С 7-С 20 аралкил, C1-С 20 ацил, а также ароил. В качестве алкильных, силильных и ацильных групп для защитных групп PG приемлемы известные специалистам группы. Предпочтительными являются легко отщепляемые из соответствующих алкиловых и силиловых эфиров алкильные, соответственно силильные остатки, как, например, метоксиметил,метоксиэтил, этоксиэтил, тетрагидропиранил, тетрагидрофуранил, триметилсилил, триэтилсилил, третбутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, триизопропилсилил, бензил, паранитробензил, параметоксибензил, а также алкилсульфонильные и арилсульфонильные остатки. В качестве ацильных групп могут рассматриваться среди прочих формил, ацетил, пропионил, изопропионил, пивалил, бутирил или бензоил, которые могут быть замещены амино- и/или гидроксигруппами. Ацильные группы PGX, соответственно PGZ в R9 и R12 могут содержать 1-20 атомов углерода, предпочтительны при этом формильные, ацетильные, пропионильные, изопропионильные и пивалильные группы. В качестве аминозащитных групп приемлемы таковые, которые известны специалистам. В качестве примеров можно назвать такие группы, как Boc, Z, бензил, f-Moc, Troc, стабаза или бензостабаза. Индекс m в образованной из R1a и R1b алкиленовой группе обозначает предпочтительно 2, 3 или 4. Возможная для X С 2-С 10 алкилен-,-диоксигруппа представляет собой предпочтительно этиленкетальную или неопентилкетальную группу. Настоящее изобретение относится прежде всего к группе соединений, включающей(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-(фтор-2-(2-метил-4-тиазолил)этенил)8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метил-4-тиазолил)эте-4 009206 нил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метилоксазол-4 ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-5,5,7,9,13 пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-8,8,10,12,16 пентаметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-окса 5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-пиридил)этенил)8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-аза 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-5,5,7,9,13 пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-8,8,10,12,16 пентаметил-4-аза-17-оксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-аза 5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-фтор-2-(2-пиридил)этенил)8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-окса 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5,5,7,9,13 пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-8,8,10,12,16 пентаметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5 009206 5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-пиридил)этенил)8,8,12,16-тетраметил-4,17-диоксабицикло[14.1.0]гепта-декан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)-1-аза 5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метилоксазол-4-ил)этенил)8,8,10,12,16-пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-метилоксазол-4-ил)этенил)1-аза-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-метилоксазол-4 ил)этенил)-8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-5,5,7,9,13 пентаметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-8,8,10,12,16 пентаметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-аза 5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-10-этил-3-(1-хлор-2-(2-пиридил)этенил)8,8,12,16-тетраметил-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса 7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил-4 тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил-4 тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-аза 7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил-4 тиазолил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил-4 тиазолил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-окса 7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-метил-4 тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-метил-4 тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1-аза 7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-метил-4 тиазолил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-метил-4 тиазолил)этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-7,9,13 триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-10,12,16-6 009206 триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-пиридил) этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-7,9,13 триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-фтор-2-(2-пиридил)этенил)-10,12,16 триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-пиридил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-пиридил) этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-7,9,13 триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-10,12,16 триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-пиридил)этенил) -8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-7,9,13 триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-3-(1-хлор-2-(2-пиридил)этенил)-10,12,16 триметил-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадека-5,9-дион,(4S,7R,8S,9S,13(Z или Е),16S(Z-4,8-дигидрокси-9,13-диметил-7-этил-16-(1-хлор-2-(2-пиридил)этенил)-1-аза-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион,(1RS,3S(Z),7S,10R,11S,12S,16RS)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-хлор-2-(2-пиридил) этенил)-8,8-(1,3-триметилен)-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион. Получение фрагментов А и В Фрагменты (структурные элементы синтеза) общих формул А и В могут быть получены по технологии, описанной в заявке DE 19751200.3 или в соответствующей заявке WO 99/07692. Получение фрагментов С Фрагменты формулы С по изобретению, в которых R8' обозначает атом фтора, можно получать по приведенной ниже схеме согласно получению предлагаемых соединений в примерах 1-4. За счет соответствующего выбора (гетеро)арильного остатка в исходном продукте на стадии а) (в рассматриваемом случае таким остатком является 2-метил-4-тиазолил) получают соответствующим образом замещенные структурные элементы формулы С в конечном счете - соединения формулы I. Получение фрагментов формулы С, в которых R8' обозначает атом хлора, описано в примере 5. Если 8' же R обозначает атом брома, то его вводят аналогично атому хлора во фрагментах С. Схема, поясняющая примеры 1-4 Пример 1.-9 009206 Настоящее изобретение наряду с соединениями общей формулы I относится также к новым C13C16 структурным элементам эпотилона общей формулы С в качестве промежуточных продуктов.R7' обозначает атом водорода,T' обозначает группу OR20, где R20 представляет собой атом водорода или защитную группу PG2,атом галогена, предпочтительно атом брома либо иода, азидогруппу либо защищенную аминогруппу,R21 обозначает гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, группу галогенид фосфония PPh3 +Hal- (Ph означает фенил; Hal означает F, Cl, Br, I), фосфонатную группу P(O)(OQ)2 (Q означает С 1-С 10 алкил или фенил) или фосфиноксидную группу P(O)Ph2 (Ph означает фенил),U обозначает атом кислорода, две алкоксигруппы OR23, С 2-С 10 алкилен-,-диоксигруппу, которая может быть прямоцепочечной либо разветвленной, H/OR9 или группировку CR10R11, при этомR23 представляет собой C 1-С 20 алкильный остаток,R9 представляет собой атом водорода или защитную группу PG3,R10 и R11 имеют идентичные или разные значения и обозначают атом водорода, C 1-С 20 алкил, арил,С 7-С 20 аралкил либо R10 и R11 оба вместе с углеродным атомом метилена образуют 5-7-членное карбоциклическое кольцо. Согласно изобретению к предпочтительным относятся такие соединения общей формулы С, гдеR8' представляет собой атом фтора, хлора либо брома и/илиU представляет собой атом кислорода и/или являющийся одним из значений R10 и/или R11 арил представляет собой фенил, необязательно замещенный 1-3 остатками, выбранными из группы заместителей, включающей галоген, свободную гидроксигруппу либо защищенную гидроксигруппу OPG5, CO2H,CO2-алкил, С 1-С 4 алкил, азидо, нитро, нитрил, амино(NH2), или представляет собой 5- либо 6-членный гетероарил, необязательно замещенный 1-2 C1-С 4 алкильными остатками, прежде всего заместителем,выбранным из группы, включающей 2-, 3-фуранил, 2-, 3-, 4-пиридинил, 2-, 4-, 5-тиазолил, 2-, 4- и 5 имидазолил, необязательно замещенный 1 либо 2 С 1-С 4 алкильными остатками, и/илиPG2 и PG3 выбраны из группы заместителей, включающей метоксиметил, метоксиэтил, этоксиэтил,тетрагидропиранил, триметилсилил, триэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил,трибензилсилил, триизопропилсилил, бензил, паранитробензил, параметоксибензил, ацетил, пропионил,бутирил и бензоил, прежде всего PG2 представляет собой трет-бутилдиметилсилил, ацетил, бензоил, бензил или тетрагидропиранил. В качестве защитных групп PG4 и PG5 приемлемы все защитные группы, указанные выше для PG2 и 3PG . Настоящее изобретение относится, кроме того, к фрагментам общей формулы ВС в которой R3, R4a, R4b, R5, R8, D, E, G, T' и U имеют указанные выше значения, a PG14 представляет собой атом водорода или защитную группу PG. Настоящее изобретение относится далее к фрагментам общей формулы ABC- 10009206 в которой R1a', R1b', R2a', R2b', R3, R4a', R4b', R5, R6, R7, R8, R13, R14, D, E, G, T', U и Z имеют указанные выше значения. Получение фрагментов ABC и их циклизация с образованием соединений формулы I. Получение и циклизцию также осуществляют по технологии, описанной в заявке DE 19751200.3 или в соответствующей заявке WO 99/07692, при этом, однако, фрагмент С содержит в качестве заместителя R8' прежде всего атом фтора, хлора либо брома. Фрагменты общей формулы AB в которой R1a', R1b', R2a', R2b', R3, R4a', R4b', R5, R13, R14, D, E, G, V и Z имеют указанные выше значения, aPG представляет собой атом водорода или защитную группу PG, получают из вышеописанных фрагментов А и В по способу, представленному на схеме 1. Схема 1 Стадия а (А+ВAB). Соединение В, где W обозначает атом кислорода, а для необязательно присутствующих дополнительных карбонильных групп предусматривается соответствующая защита, алкилируют енолятом карбонильного соединения общей формулы А. Этот енолят получают под действием сильных оснований, таких, например, как диизопропиламид лития или гексаметилдисилазан лития, при низких температурах. Фрагменты общей формулы ABC в которой R1a', R1b', R2a', R2b', R3, R4a', R4b', R5, R6, R7, R8, R13, R14, D, E, G, T', U и Z имеют указанные выше значения, получают из вышеописанных фрагментов AB и С по способу, представленному на схеме 2. Схема 2- 11009206 Стадия б (AB+СABC). Соединение С, в котором R21 представляет собой соль, получаемую по реакции Виттига, а для необязательно присутствующих дополнительных карбонильных групп предусматривается соответствующая защита, депротонируют с помощью пригодного для этих целей основания, такого как н-бутиллитий,диизопропиламид лития, трет-бутанолят калия, гексаметилдисилазид натрия или лития, и подвергают взаимодействию с соединением AB, где V обозначает атом кислорода. Стадия в (ABCсоединения формулы I). Соединения ABC, в которых R13 представляет собой карбоновую кислоту CO2H, T' обозначает OR20,20a R представляет собой атом водорода, по известным специалистам методам образования крупных макролидов превращают в соединения формулы I, в которых T-Y обозначает O-С(=O). Предпочтительно при этом использовать метод, описанный в "Reagents for Organic Synthesis, т. 16, стр. 353, с использованием хлорангидрида 2,4,6-трихлорбензойной кислоты и соответствующих оснований, таких как триэтиламин,4-диметиламинопиридин или гидрид натрия. Стадия г (ABCсоединения формулы I). Соединения ABC, в которых R13 представляет собой группу CH2OH, a R20 представляет собой атом водорода, можно предпочтительно с использованием трифенилфосфина и сложных азодиэфиров, например, таких как диэтиловый эфир азодикарбоновой кислоты, превращать в соединения формулы I, в которых T-Y обозначает O-CH2. Соединения ABC, в которых R13 представляет собой группу CH2OSO2-алкил или CH2OSO2-арил илиCH2OSO2-аралкил, a R20 представляет собой атом водорода, можно после депротонирования с помощью соответствующих оснований, таких как гидрид натрия, н-бутиллитий, 4-диметиламинопиридин, основание Хюнига, алкилгексаметилдисилазаны, циклизовать с образованием соединений формулы I, в которых T-Y обозначает O-CH2. Альтернативой описанной является возможность получения фрагментов общей формулы ВС в которой R3, R4a, R 4b, R5, R8, D, E, T' и U имеют указанные выше значения, а PG14 представляет собой атом водорода или защитную группу PG, из вышеописанных фрагментов В и С с помощью способа согласно схеме 3. Схема 3 Для введения азотной функциональной группы у С-15 можно по выбору на стадии С' (фрагмент С,где T' означает OR20) или ВС (фрагмент ВС, где T' означает OR20) в положении 15 кислородную функциональную группу либо непосредственно (C"', соответственно ВС"', где T' = Nf = азид или защищенный амин), либо через промежуточную стадию атома галогена превращать в азотную функциональную группу. Если R20 представляет собой водород, то гидроксильную группу по методам, известным специалистам, можно переводить в атом галогена, предпочтительно в атом хлора, брома или иода, который затем переводят в азотную функцию Nf, при этом Nf предпочтительно представляет собой азид или защищенный амин. Другая возможность состоит в том, что гидроксильную группу у С-15 (R20 обозначает водород) переводят в уходящую группу, предпочтительно в алкил- либо аралкилсульфонат, который затем замещают азотным нуклеофилом Nf. Фрагменты общей формулы ABC в которой R1a', R1b', R2a', R2b', R3, R4a', R4b', R5, R6, R7, R8, R13, R14 , D, E, G, T', U и Z имеют указанные выше значения, получают из вышеописанных фрагментов ВС и А с помощью способа, представленного на схеме 4. Схема 4 Вводить азотную функциональную группу у С-15 можно аналогично тому, как указано для С'", соответственно ВС'", а также на стадии ABC.- 13009206 Гибкость функционализации описанных структурных элементов А, В и С позволяет также варьировать отличную от вышеописанного способа последовательность их соединения, которая равным образом приводит к образованию структурных элементов ABC. Эти варианты способа представлены в нижеследующей таблице. Согласно приведенным вариантам способа структурные элементы А, В и С можно соединять согласно схеме 5. Схема 5 Возможны и иные варианты функционализации, а именно, свободные гидроксильные группы в I, I,А, В, С, AB, ABC - путем этерификации или эстерификации, свободные карбонильные группы - путем кетализирования, образования простых енольных эфиров или восстановления. Настоящее изобретение относится ко всем стереоизомерам описанных предлагаемых соединений,равно как и к их смесям.- 14009206 Биологическое действие и области применения новых производных Новые соединения формулы I являются ценными фармакологическими средствами. Они взаимодействуют с тубулином, стабилизируя образующиеся микротрубочки, и тем самым они способны оказывать влияние на деление клетки в его фазовой специфичности. Сказанное относится прежде всего к быстро растущим, неопластическим клеткам, на рост которых межклеточный механизм регуляции не оказывает практически никакого воздействия. Биологически активные вещества указанного типа в принципе пригодны для лечения злокачественных опухолей. В качестве области применения этих веществ можно назвать, например, терапию карциномы яичников, желудка, толстого кишечника, аденокарциномы, карциномы груди, легких, карциномы головы и затылочной части, злокачественной меланомы, острого лимфоцитарного и миелоцитарного лейкоза. Предлагаемые в изобретении соединения благодаря их свойствам в принципе могут применяться при терапии против ангиогенеза, а также для лечения хронических воспалительных заболеваний, таких как псориаз и артрит. Во избежание неконтролируемого разрастания клеток, а также для лучшей совместимости медицинских имплантатов новые соединения в принципе можно наносить на используемые в указанных целях полимерные материалы или заделывать в эти материалы. Соединения по изобретению могут применяться индивидуально, а для достижения дополнительного или синергического эффекта возможно их применение в комбинации с другими классами веществ, используемыми в терапии опухолей. В качестве примеров можно назвать их комбинированное применение с платиновыми комплексами, такими, например, как цисплатин и карбоплатин,интеркалирующими веществами, например, из класса антрациклинов, такими как доксорубицин,или из класса антрапиразолов, как, например, CI-941,веществами, взаимодействующими с тубулином, например, из класса винкаалкалоидов, такими как винкристин, винбластин, или из класса таксанов, как, например, таксол, таксотер, или из класса макролидов, как, например, ризоксин, или другими соединениями, как, например, колхицин и комбретастатин А-4,ингибиторами ДНК-топоизомеразы, например, такими как камптотецин, этопозид, топотекан и тенипозид,антиметаболитами фолата или пиримидина, например, такими как лометрексол и гемцитубин,ДНК алкилирующими соединениями, например, такими как адоцелезин и дистамицин А,ингибиторами факторов роста [например PDGF (тромбоцитарный фактор роста), EGF (эпидермальный фактор роста), TGFb (фактор b роста T-клеток)], например, такими как соматостатин, сурамин, антагонисты бомбезина,ингибиторами протеинтирозинкиназы или протеинкиназ А либо С, например, такими как эрбстатин, генистеин, стауроспорин, илмофозин и 8-Cl-цАМФ,антигормонами из класса антигестагенов, например, такими как мифепристон, онапристон, или из класса антиэстрогенов, например, такими как тамоксифен, или из класса антиандрогенов, например, такими как ципротерона ацетат,соединениями, ингибирующими метастазы, например, из класса эйкозаноидов, такими как PGl2,PGE1, 6-оксо-PGE1, а также их стабильными производными (как, например, илопрост, цикапрост и мизопростол),ингибиторами онкогенных RAS-протеинов, которые оказывают воздействие на митотическую трансдукцию сигналов, например, такими как ингибиторы фарнезил-протеин-трансферазы,природными или полученными искусственным путем антителами, предназначенными для противодействия факторам, соответственно их рецепторам, способствующим росту опухолей, например, такими как erbB2-антитела. Активность in vitro производных эпотилона на линиях опухолевых клеток человекаa) IC50 значения (нМ), характеризующие подавление опухолевых клеток линии MCF-7 груди и устойчивых ко множеству лекарственных препаратов опухолевых клеток линии NCI/ADR человека, производных эпотилона с использованием 13Z-олефина в исследованиях с помощью кристаллического фиолетового в сравнении с эпотилоном D. Таблица 1 Соединения из примеров 1, 9, 13 и 17 обладают заметно более высокой эффективностью по сравнению с имеющим сходную структуру эталонным соединением эпотилоном D. Все соединения в отличие от таксола проявляют свое действие по отношению к клеточной линии NCI/ADR, устойчивой ко множеству лекарственных препаратов. б) IC50 значения (нМ), характеризующие подавление опухолевых клеток линии MCF-7 груди и устойчивых ко множеству лекарственных препаратов опухолевых клеток линии NCI/ADR человека, производных эпотилона с использованием 13,14 эпоксида в исследованиях с помощью кристаллического фиолетового в сравнении с эпотилоном В. Таблица 2 Соединения из примеров 3 Б, 14 А и 20A обладают такой же или заметно более высокой эффективностью по сравнению с имеющим сходную структуру эталонным соединением эпотилоном В. Все соединения в отличие от таксола проявляют свое действие по отношению к клеточной линии NCI/ADR. Соединения из примеров 3 Б и 10A проявляют более высокую степень селективности по отношению к клеточной линии NCI/ADR, устойчивой ко множеству лекарственных препаратов, в сравнении с эталонным соединением эпотилоном В. Изобретение относится также к лекарственным средствам на основе фармацевтически приемлемых,т.е. не обладающих токсичностью в применяемых дозах, соединений общей формулы I, при необходимости вместе с обычными вспомогательными веществами и носителями. Из предлагаемых в изобретении соединений по известным методам галеники могут изготавливаться фармацевтические препараты для энтерального, парентерального, чрескожного или местного применения. Эти препараты могут вводиться в виде таблеток, драже, гелевых капсул, гранулятов, суппозиториев, имплантатов, инъецируемых стерильных водных либо масляных растворов, суспензий или эмульсий, мазей, кремов и гелей. Активное(ые) вещество(-а) можно смешивать при этом с обычно используемыми в галенике вспомогательными веществами, такими, например, как гуммиарабик, тальк, крахмал, маннит, метилцеллюлоза, лактоза, поверхностно-активные вещества, такие как твины или Myrj, стеарат магния, водные или неводные носители, производные парафина, смачиватели, диспергаторы, эмульгаторы, консерванты и ароматизаторы в качестве вкусовых добавок (например, эфирные масла). Предлагаемые в изобретении соединения могут быть представлены в форме -, - либо циклодекстринклатратов или могут быть инкапсулированы в липосомы. В соответствии с этим изобретение относится также к фармацевтическим композициям, содержащим в своем составе в качестве активного вещества по меньшей мере одно соединение по изобретению. Одна унифицированная доза содержит примерно 0,1-100 мг активного(ых) вещества(веществ). Суточную дозу предлагаемых соединений для человека предпочтительно назначать в количестве порядка от 0,1 до 1000 мг. Ниже изобретение более подробно поясняется на примерах, которые никоим образом не ограничивают его объем. Примеры получения предлагаемых в изобретении соединений общей формулы I Пример 1. (4S,7R,8S,9S,13(Z),16S(Z-4,8-Дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. Из соли фосфония, полученной согласно примеру 1 к, аналогично описанному в DE 19751200.3 методу получают 36,5 мг указанного в заголовке соединения в виде желтоватого масла.H-ЯМР (ДМСО-d6):= 0,93 (3H), 0,94 (3H), 1,10 (3H), 0,8-1,4 (6H), 1,21 (3H), 1,62 (1H), 1,66 (3H) 1,87 (1H), 2,24 (1H), 2,3-2,6 (3H), 2,64 (3H), 2,73 (1H), 3,13 (1H), 3,53 (1H), 4,22 (1H), 5,16 (1H), 5,36 (1H),6,22 (1H), 7,46 (1H) ч./млн. Пример 1a. 2-Метилтиазол-4-карбальдегид. К раствору 60 г этилового эфира 2-метилтиазол-4-карбоновой кислоты в 1070 мл метиленхлорида при -75C в атмосфере азота по каплям медленно добавляют 476 мл 1,2-молярного раствора диизобутилалюминийгидрида (ДИБАГ) в толуоле. После этого перемешивают в течение 2 ч. Далее по каплям медленно добавляют 150 мл изопропанола, а затем 230 мл воды, после чего удаляют баню из охлаждающей смеси и интенсивно перемешивают при 25C в течение 2 ч. Образовавшийся осадок отделяют вакуумфильтрацией и после этого промывают уксусным эфиром. Фильтрат концентрируют в вакууме и полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/простого эфира (1:1) получают 35,6 г указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 2,8 (3H), 8,05 (1H), 10,0 (1H) ч./млн. Пример 1 б. Этиловый эфир (2Z)-3-(2-метилтиазол-4-ил)-2-фтор-2-пропеновой кислоты. К суспензии 9,64 г гидрида натрия (60% суспензия в минеральном масле) в 120 мл диметоксиэтана при 0C добавляют раствор 58,7 г триэтилового эфира фосфонофторуксусной кислоты в 120 мл диметоксиэтана. После этого перемешивают в течение 40 мин и затем по каплям добавляют раствор 15,4 г полученного согласно примеру 1a альдегида в 120 мл диметоксиэтана, после чего перемешивают в течение 2 ч при 24 С в атмосфере аргона. После смешения с водным раствором хлорида аммония трижды экстрагируют уксусным эфиром, органическую фазу промывают разбавленным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. Смесь олефинов с Z- и E-конфигурацией разделяют колоночной хроматографией на силикагеле. С использованием гексана/уксусного эфира (в соотношении от 4:6 до 3:7) наряду с 3,9 г смешанной фракции получают 7,5 г этилового эфира (2 Е)-3-(2-метилтиазол-4 ил)-2-фтор-2-пропеновой кислоты и 7,3 г указанного в заголовке соединения в виде бесцветных масел. 1H-ЯМР (CDCl3):= 1,36 (3H), 2,73 (3H), 4,33 (2H), 7,20 (1H), 7,67 (1H) ч./млн. Пример 1 в. (2Z)-3-(2-Метилтиазол-4-ил)-2-фтор-2-пропен-1-ол. К раствору 18,8 г полученного на предыдущей стадии сложного эфира в 260 мл толуола при -70C в атмосфере азота по каплям добавляют 136 мл 1,2-молярного раствора ДИБАГ в толуоле. Через час по каплям медленно добавляют 55 мл изопропанола, а затем 68 мл воды, после чего интенсивно перемешивают в течение 2 ч. Образовавшийся осадок отделяют вакуум-фильтрацией и тщательно промывают уксусным эфиром. Фильтрат концентрируют в вакууме и полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-70% уксусного эфира получают 13,4 г указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР(CDCl3):= 2,69 (3H), 3,71 (1H), 4,27 (2H), 6,18 (1H), 7,35 (1H) ч./млн. Пример 1 г. (2Z)-3-(2-Метилтиазол-4-ил)-2-фтор-2-пропеналь. К раствору 13,28 г полученного на предыдущей стадии спирта в 200 мл толуола порциями добавляют в общей сложности 53,3 г пиролюзита, после чего интенсивно перемешивают в течение 4 ч в атмосфере азота. Пиролюзит отделяют вакуум-фильтрацией через целит, тщательно промывают уксусным эфиром и фильтрат концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-30% уксусного эфира получают 9,93 г указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 2,77 (3H), 6,95 (1H), 7,88 (1H), 9,36 (1H) ч./млн. Пример 1 д. (3S,4Z)-5-(2-Метилтиазол-4-ил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3 ил]-3-гидрокси-4-фтор-4-пентен-1-он. 17,6 г безводного хлорида хрома(II) вводят в 210 мл ТГФ в атмосфере аргона и смешивают с 766 мг иодида лития. Затем по каплям добавляют раствор 9,8 г полученного на предыдущей стадии альдегида и 18,8 г (4S,5R)-3-(бромацетил)-4-метил-5-фенилоксазолидин-2-она в 38 мл ТГФ. Далее смесь перемешивают в течение 3 ч. После этого добавляют 150 мл насыщенного раствора хлорида натрия, перемешивают в течение 30 мин и разделяют фазы. Водную фазу дважды экстрагируют уксусным эфиром и затем объединенные органические фазы однократно экстрагируют водой и однократно насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия, отфильтровывают и фильтрат концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-60% уксусного эфира получают 11,22 г указанного в заголовке соединения, а также 9,53 г смешанной фракции и 1,8 г соответствующего диастереомерного указанного в заголовке соединения в виде светлых масел. 1(6H) ч./млн. Пример 1e. (3S,4Z)-5-(2-Метилтиазол-4-ил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3 ил]-3-(трет-бутилдиметилсилилокси)-4-фтор-4-пентен-1-он. К раствору 11,2 г полученного на предыдущей стадии и указанного в заголовке предшествующего- 17009206 примера соединения в 86 мл метиленхлорида по каплям при -70C в атмосфере азота добавляют 4,68 мл лутидина и после этого перемешивают в течение 5 мин. Затем по каплям медленно добавляют 8,56 мл трет-бутилдиметилсилилтрифторметансульфоната. Через час смешивают с насыщенным раствором хлорида аммония и реакционной смеси дают нагреться до 25C. Далее разбавляют простым эфиром, однократно промывают водой и однократно насыщенным раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/простого эфира (1:1) получают 9,3 г указанного в заголовке соединения в виде бесцветного масла. 1(1H), 5,66 (1H), 6,15 (1H), 7,26-7,50 (6H) ч./млн. Пример 1 ж. Этиловый эфир (3S,4Z)-5-(2-метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4 фтор-4-пентеновой кислоты. К раствору 15,5 г полученного на предыдущей стадии и указанного в заголовке предшествующего примера соединения в 70 мл этанола добавляют 2,8 мл этилата титана(IV) и в течение 4 ч кипятят с обратным холодильником в атмосфере азота. После этого реакционный раствор концентрируют в вакууме,остаток растворяют в 70 мл уксусного эфира, смешивают с водой и перемешивают в течение 20 мин. Далее оксид титана отделяют вакуум-фильтрацией, тщательно промывают уксусным эфиром и фильтрат концентрируют в вакууме. Остаток смешивают с гексаном, кристаллы отделяют вакуум-фильтрацией и дважды промывают гексаном. Фильтрат концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-50% уксусного эфира получают 11,9 г указанного в заголовке соединения в виде бесцветного масла. 1(1H), 7,37 (1H) ч./млн. Пример 1 з. (3S,4Z)-5-(2-Метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4-фтор-4-пентен-1-ол. К раствору 10,5 г полученного на предыдущей стадии и указанного в заголовке предшествующего примера соединения в 250 мл толуола в атмосфере азота по каплям при -70C медленно добавляют 58,6 мл 1,2-молярного раствора ДИБАГ в толуоле и перемешивают в течение часа при -30C. После этого по каплям при -70 С медленно добавляют 10 мл изопропанола, а затем 22 мл воды и интенсивно перемешивают при 25 С в течение 2 ч. Осадок отделяют вакуум-фильтрацией, тщательно промывают уксусным эфиром и фильтрат концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-70% уксусного эфира получают 7,73 г указанного в заголовке соединения в виде желтого масла. 1(3S,4Z)-5-(2-Метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-1-иод-4-фтор-4 пентен. К раствору 7,31 г трифенилфосфина в 106 мл метиленхлорида добавляют 1,90 г имидазола. К этому раствору добавляют 7,07 г иода, перемешивают в течение 10 мин и затем по каплям добавляют раствор 7,7 г полученного на предыдущей стадии и указанного в заголовке предшествующего примера соединения в 28 мл метиленхлорида и перемешивают в течение 30 мин. Далее реакционную смесь фильтруют,тщательно промывают простым эфиром и фильтрат концентрируют в вакууме. Полученный таким путем остаток очищают хроматографией на силикагеле. С использованием гексана/0-10% уксусного эфира получают 8,2 г указанного в заголовке соединения в виде бесцветного масла. 1(1H), 7,36 (1H) ч./млн. Пример 1 к. Иодид (3S,4Z)-5-(2-метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4-фтор-4 пентентрифенилфосфония. 8,16 г полученного на предыдущей стадии и указанного в заголовке предшествующего примера соединения смешивают с 5,33 г трифенилфосфина и перемешивают в атмосфере азота при 100 С в течение 2 ч. После охлаждения твердый остаток дважды растирают с простым эфиром и небольшим количеством уксусного эфира, при этом надосадочный раствор удаляют пипеткой. После этого остаток растворяют в метаноле и концентрируют в вакууме. Твердое пенистое вещество снова растворяют в небольшом количестве метанола, смешивают с толуолом и вновь концентрируют в вакууме. Эту процедуру повторяют дважды, после чего остаток сушат в глубоком вакууме. Таким путем получают 12,4 г указанного в заголовке соединения в виде твердого вещества.tпл 70-72C. Пример 2. (4S,7R,8S,9S,13(E),16S(Z-4,8-Дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. Аналогично примеру 1 из полученной согласно примеру 1 к соли фосфония получают 41,5 мг указанного в заголовке соединения в виде желтоватого масла. 1(1S,3S(Z),7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16 пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение Б). К 15 мг полученного согласно примеру 1 и указанного в заголовке этого примера соединения в 0,3 мл ацетонитрила при 0C в атмосфере аргона добавляют 0,172 мл ЭДТК (этилендиаминтетерауксусная кислота) и 0,288 мл 1,1,1-трифторацетона, а затем смесь из 35,0 мг оксона и 20,2 мг гидрокарбоната натрия. Далее смесь перемешивают в течение 3,5 ч при 0C. После этого смешивают с 2 мл раствора тиосульфата натрия, перемешивают в течение 5 мин и разбавляют 80 мл уксусного эфира. Органическую фазу однократно промывают полуконцентрированным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. Полученный таким путем остаток дважды очищают препаративной толстослойной хроматографией (ПТХ). С использованием метиленхлорида/уксусного эфира (2:8) (1-я ПТХ), соответственно метиленхлорида/метанола (98:2) (2-я ПТХ) получают 2,5 мг указанного в заголовке соединения А в качестве неполярного компонента и 6 мг указанного в заголовке соединения Б в качестве полярного компонента в виде бесцветных масел. 1 Н-ЯМР (MeOH-d4) соединения А:= 0,99 (3H), 1,04 (3H), 0,8-1,9 (11H), 1,30 (3H), 1,41 (3H), 2,17(1S,3S(Z),7S,10R,11S,12S,16S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16 пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение Б). Аналогично примеру 3 из 38 мг полученного согласно примеру 2 и указанного в заголовке этого примера соединения получают 8,8 мг указанного в заголовке соединения А в качестве неполярного компонента и 9,0 мг указанного в заголовке соединения Б в качестве полярного компонента в виде бесцветных масел. 1(1H), 6,21 (1H), 7,51 (1H) ч./млн. Пример 5. (4S,7R,8S,9S,13(Z),16S(Z-4,8-Дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. Пример 5 а. 2-Метилтиазол-4-карбальдегид. 50 г этил-2-метилтиазол-4-карбоксилата растворяют в 700 мл метиленхлорида, охлаждают до -70C и осторожно смешивают с 390 мл диизобутилалюминийгидрида (1,2-молярный раствор в толуоле). По истечении 1 ч превращение еще не завершилось полностью, и поэтому повторно по каплям добавляют 40 мл диизобутилалюминийгидрида. Еще через 40 мин реакционную смесь осторожно смешивают с 100 мл изопропанола и перемешивают в течение 15 мин. После этого по каплям добавляют 215 мл воды и охлаждающую баню удаляют. Через 2 ч кристаллический осадок отделяют вакуум-фильтрацией через фритту, промывают уксусным эфиром и фильтрат упаривают в вакууме. Таким путем получают 36,1 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 2,8 (3H), 8,06 (1H), 9,99 (1H) ч./млн. Пример 5 б. Этиловый эфир (2Z)-3-(2-метилтиазол-4-ил)-2-хлор-2-пропеновой кислоты. К суспензии 9 г гидрида натрия (60% суспензия в минеральном масле) в 165 мл диметоксиэтана в течение 15 мин при 0C в атмосфере азота добавляют раствор 97 г триэтил-2-хлор-2-фосфоноацетата в 165 мл диметоксиэтана. После этого перемешивают в течение 45 мин при 24C и затем по каплям добавляют раствор 31,8 г полученного согласно примеру 5 а соединения в 165 мл диметоксиэтана и перемешивают в течение 1 ч. После смешения с водным раствором хлорида аммония трижды экстрагируют уксусным эфиром, органическую фазу промывают разбавленным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. Смесь олефинов с Z- и E-конфигурацией разделяют колоночной хроматографией на силикагеле. После колоночной хроматографии с использованием гексана/10-30% уксусного эфира и поледующей кристаллизации из гексана получают 32 г указанного в заголовке соединения (tпл 61-62C). 1- 19009206 Пример 5 в. (2Z)-3-(2-Метилтиазол-4-ил)-2-хлор-2-пропен-1-ол. Аналогично примеру 1 в из 32 г полученного согласно примеру 5 б сложного эфира в толуоле в качестве растворителя получают 22,8 г указанного в заголовке соединения. Пример 5 г. (2Z)-3-(2-Метилтиазол-4-ил)-2-хлор-2-пропеналь. 9,8 г полученного согласно примеру 1 в спирта растворяют в 500 мл метиленхлорида и смешивают с 26,14 мл триэтиламина. Далее добавляют 16,14 г комплекса SO3-пиридин и перемешивают в течение 1 ч при 24 С. После этого смешивают с раствором хлорида аммония, экстрагируют уксусным эфиром, органическую фазу промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После упаривания в вакууме получают 10,03 г указанного в заголовке соединения. Пример 5 д. (3S,4Z)-5-(2-Метилтиазол-4-ил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3 ил]-3-гидрокси-4-хлор-4-пентен-1-он. Аналогично примеру 1 д 3,3 г полученного согласно примеру 5 г альдегида получают 1,4 г указанного в заголовке соединения. 1 Н-ЯМР (CDCl3):= 0,95 (3H), 2,7 (3H), 3,38 (1H), 3,45-3,55 (1H), 3,56 (1H), 4,8 (1H), 4,89 (1H), 5,7(1H), 7,18 (1H), 7,28-7,48 (5H), 7,83 (1H) ч./млн. Пример 5 е. (3S,4Z)-5-(2-Метилтиазол-4-ил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3 ил]-3-(трет-бутилдиметилсилилокси)-4-хлор-4-пентен-1-он. Аналогично примеру 1e из 1,4 г полученного согласно примеру 5 д спирта получают 580 мг указанного в заголовке соединения. 1(1H), 4,99 (1H), 5,64 (1H), 7,05 (1H), 7,25-7,46 (5H), 7,83 (1H) ч./млн. Пример 5 ж. Этиловый эфир (3S,4Z)-5-(2-метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4 хлор-4-пентеновой кислоты. Аналогично примеру 1 ж из 12,5 г полученного согласно примеру 5 е силилового эфира получают 9,1 г указанного в заголовке соединения. 1(1H), 7,04 (1H), 7,8 (1H) ч./млн. Пример 5 з. (3S,4Z) -5-(2-Метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4-хлор-4-пентен-1-ол. Аналогично примеру 1 з из 9,1 г полученного согласно примеру 5 ж этилового эфира получают 7,5 г указанного в заголовке соединения. 1(3S,4Z)-5-(2-Метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-1-иод-4-хлор-4 пентен. Аналогично примеру 1 и из 1,7 г полученного согласно примеру 5 з спирта получают 2,02 г указанного в заголовке соединения. 1(1H), 7,82 (1H) ч./млн. Пример 5 к. Иодид (3S,4Z)-5-(2-метилтиазол-4-ил)-3-(трет-бутилдиметилсилилокси)-4-хлор-4 пентентрифенилфосфония. Аналогично примеру 1 к из 9,6 г полученного согласно примеру 5 и иодида получают 14,8 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,1 (3H), 0,18 (3H), 0,9 (9H), 2,07 (2H), 2,69 (3H), 3,47-3,63 (1H), 3,68-3,85 (1H),4,99 (1H), 7,21 (1H), 7,67-7,87 (16H) ч. /млн. Пример 5 л. (2S,6 Е/Z,9S,10Z)-10-Хлор-9-диметил(1,1-диметилэтил)силил]окси]-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диенолтетрагидропиран-2-иловый эфир. К раствору 8 г полученной согласно примеру 5 к соли фосфония в 22 мл тетрагидрофурана при 0 С в атмосфере азота по каплям осторожно добавляют 6,94 мл бутиллития (1,6-молярный раствор в гексане) и перемешивают в течение 20 мин (темно-красный раствор). Затем к реакционной смеси по каплям добавляют 1,69 г (6S)-6-метил-7-(тетрагидро-2 Н-пиран-2-ил(окси)гептан-2-она, растворенного в 11 мл тетрагидрофурана. После этого реакционную смесь перемешивают в течение 30 мин и затем смешивают с 11 мл насыщенного раствора хлорида аммония. Еще через 5 мин реакционную смесь разбавляют уксусным эфиром, однократно промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. После колоночной хроматографии с использованием гексана/0-50% простого эфира получают 4,8 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,05-0,1 (6H), 0,85-0,95 (12H), 1,0-2,52 (14H), 1,6 (3H), 2,7 (3H), 3,07-3,27 (1H),3,42-3,54 (3H), 3,86 (1H), 4,26 (1H), 4,56 (1H), 5,12 (1H), 6,97 (1H), 7,81 (1H) ч./млн. Пример 5 м. (2S,6 Е/Z,9S,10Z)-10-Хлор-9-диметил(1,1-диметилэтил)силил]окси]-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диенол. К раствору 2,9 г полученного согласно примеру 5 л олефина в 40 мл этанола добавляют 134,38 мг птолуолсульфоната пиридиния и перемешивают в течение 6 ч при 55 С в атмосфере азота. После этого- 20009206 упаривают в вакууме. После колоночной хроматографии с использованием гексана/0-30% уксусного эфира получают 1,73 г указанного в заголовке соединения. 1(2H), 2,23-2,52 (3H), 2,72 (3H), 4,27 (1), 5,15 (1H), 6,95/6,98 (1H), 7,81 (1H), 9,54/9,6 (1H) ч./млн. Пример 5 н. (2S,6E/Z,9S,10Z)-10-Хлор-9-диметил(1,1-диметилэтил)силил]окси]-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диеналь. К раствору 1,5 г полученного согласно примеру 5 м спирта в 32,7 мл метиленхлорида и 11 мл диметилсульфоксида при комнатной температуре в атмосфере азота добавляют 2,28 мл триэтиламина. Затем реакционную смесь смешивают с 1,042 г комплекса SO3-пиридин и перемешивают в течение 35 мин. После добавления насыщенного раствора хлорида аммония перемешивают в течение 5 мин, разбавляют простым эфиром, промывают полуконцентрированным раствором хлорида натрия, органическую фазу сушат над сульфатом натрия и упаривают в вакууме. Таким путем получают 216 мг указанного в заголовке соединения. Пример 5 о.(3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Хлор-17-(2-метил-4-тиазолил)-5-оксо-1,3,15-трис диметил(1,1-диметилэтил)силил]окси]-4,4,6,8,12-пентаметилгептадека-12,16-диен-7-ол. 3,3 мл бутиллития (1,6-молярный раствор в гексане) охлаждают до 0 С и осторожно смешивают с раствором 535 мг диизопропиламина в 12 мл тетрагидрофурана. После этого реакционную смесь охлаждают до -70C и по каплям добавляют раствор 1,78 г (3S)-1,3-бисдиметил(1,1-диметилэтил)силил]окси]4,4-диметилгептан-5-она в 12 мл тетрагидрофурана. Затем перемешивают в течение 1 ч при неизменной температуре. Далее к реакционной смеси по каплям добавляют раствор 1,34 г полученного согласно примеру 5 н альдегида в 9,7 мл тетрагидрофурана и перемешивают еще в течение 1,5 ч. После этого смешивают с насыщенным раствором хлорида аммония, разбавляют простым эфиром, двукратно промывают полуконцентрированным раствором хлорида натрия, органическую фазу сушат над сульфатом натрия и концентрируют в вакууме. После колоночной хроматографии с использованием гексана/25% уксусного эфира получают 2,52 г указанного в заголовке соединения. 1(1H), 5,11 (1H), 6,92 (1H), 7,79 (1H) ч./млн. Пример 5 п. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Хлор-17-(2-метил-4-тиазолил)-5-оксо-1,3,7,15-тетракис диметил(1,1-диметилэтил)силил]окси]-4,4,6,8,12-пентаметилгептадека-12,16-диен. К раствору 1,52 г полученного согласно примеру 5 о спирта, растворенного в 21,3 мл метиленхлорида, при 0C в атмосфере азота по каплям добавляют 722 мкл лутидина. Через 5 мин к реакционной смеси добавляют 813 мкл трет-бутилдиметилсилилтрифлата и затем перемешивают в течение 1,5 ч. После этого разбавляют простым эфиром, однократно промывают 1 н. соляной кислотой и двукратно насыщенным раствором хлорида натрия, органическую фазу сушат над сульфатом натрия и упаривают в вакууме. После колоночной хроматографии с использованием гексана/0-20% простого эфира получают 221 мг указанного в заголовке соединения. Пример 5 р.(3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Хлор-17-(2-метил-4-тиазолил)-5-оксо-3,7,15-трис диметил(1,1-диметилэтил)силил]окси]-4,4,6,8,12-пентаметилгептадека-12,16-диен-1-ол. К раствору 1,9 г полученного согласно примеру 5 п силилового эфира в 15 мл метиленхлорида и 15 мл метанола при 0 С в атмосфере азота добавляют 453,45 мг камфор-10-сульфоновой кислоты и затем перемешивают в течение 2 ч. После этого смешивают с 13 мл триэтиламина, через 5 мин реакционную смесь сливают в насыщеный раствор гидрокарбоната натрия, разбавляют метиленхлоридом, органическую фазу однократно промывают насыщеным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. Таким путем получают 1,41 г указанного в заголовке соединения. 1(3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Хлор-17-(2-метил-4-тиазолил)-5-оксо-3,7,15-трис диметил(1,1-диметилэтил)силил]окси]-4,4,6,8,12-пентаметилгептадека-12,16-диеналь. К раствору 1,4 г полученного согласно примеру 5 р спирта в 19 мл метиленхлорида и 4,5 мл диметилсульфоксида при комнатной температуре в атмосфере азота добавляют 1,14 мл триэтиламина. После этого реакционную смесь смешивают с 520 мг комплекса SO3-пиридин и перемешивают в течение 2 ч. После добавления насыщенного раствора хлорида аммония перемешивают в течение 5 мин, разбавляют простым эфиром, двукратно промывают полуконцентрированным раствором хлорида натрия, органическую фазу сушат над сульфатом натрия и упаривают в вакууме. Таким путем получают 1,44 г указанного в заголовке соединения. Пример 5 т.(3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Хлор-17-(2-метил-4-тиазолил)-5-оксо-3,7,15-трис диметил(1,1-диметилэтил)силил]окси]-4,4,6,8,12-пентаметилгептадека-12,16-диеновая кислота. К раствору 1,44 г полученного согласно примеру 5 с альдегида в 35 мл ацетона при -30C в атмосфере азота добавляют 1,89 мл реактива Джонса. Через 45 мин реакционную смесь смешивают с 1,3 мл- 21009206 изопропанола, перемешивают в течение 10 мин, разбавляют простым эфиром, трехкратно промывают полуконцентрированным раствором хлорида натрия, органическую фазу сушат над сульфатом натрия и упаривают в вакууме. После очистки сырого продукта препаративной тонкослойной хроматографией с использованием гексана/50% простого эфира (трехкратный прогон) получают 202 мг указанного в заголовке соединения. 1(1,1-диметилэтил)силил]окси]-15-гидрокси-4,4,6,8,12-пентаметилгептадека-12,16-диеновая кислота. К раствору 22 мг полученной согласно 5 т карбоновой кислоты в 4,3 мл тетрагидрофурана при комнатной температуре в атмосфере азота добавляют 433,7 мг фторида тетрабутиламмония и затем перемешивают в течение 1,5 ч. После этого разбавляют уксусным эфиром, однократно промывают 0,5 н. соляной кислотой и двукратно полуконцентрированным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. После колоночной хроматографии с использованием гексана/50% уксусного эфира получают 43 мг указанного в заголовке соединения. 1(4S,7R,8S,9S,13(Z),16S(Z-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-хлор-2-(2 метил-4-тиазолил)этенил)-1-окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. К раствору 180 мг полученного согласно примеру 5 у спирта в 3,4 мл тетрагидрофурана при 0C в атмосфере азота добавляют 72,7 мкл триэтиламина. После этого добавляют 48,2 мкл 2,4,6 трихлорбензоилхлорида и перемешивают в течение 1 ч. Далее эту суспензию в течение 3 ч добавляют по каплям с помощью дозирующего насоса к раствору 289,91 мг 4-N,N-диметиламинопиридина в 25,4 мл толуола и перемешивают в течение 1 ч. Затем реакционную смесь упаривают в вакууме. После колоночной хроматографии с использованием гексана/20% уксусного эфира и последующей очистки с помощью препаративной тонкослойной хроматографии с использованием метиленхлоридаа/0,5% метанола получают 32 мг (соединение с E-конфигурацией) указанного в заголовке соединения А и 81 мг (соединение с(3H), 1,27 (3H), 1,57 (3H), 2,71 (3H), 3,04 (1H), 3,9 (1H), 4,03 (1H), 5,13 (1H), 5,19 (1H), 7,06 (1H), 7,83 (1H) ч./млн. Пример 5. (4S,7R,8S,9S,13(Z),16S(Z-4,8-Дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. К раствору 80 мг полученного согласно примеру 5 ф соединения Б в 314 мкл метиленхлорида при-20C в атмосфере азота добавляют 702 мкл 20% раствора трифторуксусной кислоты в метиленхлориде и затем перемешивают в течение 5,5 ч при 0C. После этого реакционную смесь упаривают в вакууме. После колоночной хроматографии с использованием гексана/50% уксусного эфира получают 43,8 мг указанного в заголовке соединения. 1H-ЯМР (ДМСО-d6, 100C):= 0,94 (3H), 0,82-3,3 (14H), 1,11 (3H), 1,23 (6H), 1,67 (3H), 2,64 (3H),3,58 (1H), 4,27 (1H), 5,16 (1H), 5,39 (1H), 7,06 (1H), 7,77 (1H) ч./млн. Пример 6. (4S,7R,8S,9S,13(Е),16S(Z-4,8-Дигидрокси-16-(1-хлор-2-(2-метил-4-тиазолил)этенил)-1 окса-5,5,7,9,13-пентаметилциклогексадец-13-ен-2,6-дион. К раствору 45 мг полученного согласно примеру 5 ф соединения А в 177 мкл метиленхлорида при-20C в атмосфере азота добавляют 395 мкл 20% раствора трифторуксусной кислоты в метиленхлориде и затем перемешивают в течение 5,5 ч при 0C. После этого реакционную смесь упаривают в вакууме. После колоночной хроматографии с использованием гексана/50% уксусного эфира получают 27 мг указанного в заголовке соединения. 1(Б) (1R,3S(Z),7S,10R,11S,12S,16S)-7,11-Дигидрокси-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион. К раствору 14 мг полученного согласно примеру 5 D-производного эпотилона в 0,3 мл ацетонитрила при 0C в атмосфере азота добавляют 154,8 мкг двунатриевой соли этилендиаминтетрауксусной кислоты и 324,73 мкг 1,1,1-трифторацетона. После этого к реакционной смеси добавляют 34,65 мкг оксона- 22009206 и 17,74 мкг гидрокарбоната натрия и перемешивают в течение 4 ч. Далее смешивают с 2 мл раствора тиосульфата натрия, разбавляют 100 мл уксусного эфира, промывают полуконцентрированным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. После очистки сырого продукта препаративной тонкослойной хроматографией с использованием метиленхлорида/20% метанола получают 3,8 мг указанного в заголовке соединения А (полярный компонент) и 2,5 мг указанного в заголовке соединения Б (неполярный компонент).(Б) (1R,3S(Z),7S,10R,11S,12S,16R)-7,11-Дигидрокси-3-(1-хлор-2-(2-метил-4-тиазолил)этенил)-8,8,10,12,16-пентаметил-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион. К раствору 14 мг полученного согласно примеру 6 D-производного эпотилона в 0,3 мл ацетонитрила при 0C в атмосфере азота добавляют 154,8 мкг двунатриевой соли этилендиаминтетрауксусной кислоты и 324,73 мкг 1,1,1-трифторацетона. После этого к реакционной смеси добавляют 34,65 мкг оксона и 17,74 мкг гидрокарбоната натрия и перемешивают в течение 4 ч. Далее смешивают с 2 мл раствора тиосульфата натрия, разбавляют 100 мл уксусного эфира, промывают полуконцентрированным раствором хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме. После очистки сырого продукта препаративной тонкослойной хроматографией с использованием метиленхлорида/20% метанола получают 6,8 мг указанного в заголовке соединения А (полярный компонент) и 3,4 мг указанного в заголовке соединения Б (неполярный компонент). Пример 9. (4S,7R,8S,9S,13(Z),16S(Z-4,8-Дигидрокси-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1 окса-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион. Аналогично примеру 5 из 431 мг (0,585 ммоля) описанного в примере 9 к соединения А получают 235 мг указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 1,00 (3H), 1,27 (3H), 1,66 (3H), 2,70 (3H), 2,75-3,04 (3H), 3,43 (1H), 3,68 (1H),4,42 (1H), 5,13 (1H), 5,37-5,46 (1H), 6,15-6,29 (1H), 7,36 (1H) ч./млн. Пример 9 а. (2S,6E/Z,9S,10Z)-9-Диметил(1,1-диметилэтил)силил]окси]-10-фтор-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диенолтетрагидропиран-2-иловый эфир. Аналогично примеру 5 л из 2,47 г (10,8 ммоль) 6(S)-6-метил-7-(тетрагидро-2 Н-пиран-2 ил(оксигептан-2-она (получение см. DE 19751200.3) и 11,4 г (16,2 ммоль) полученного согласно примеру 1 к соединения получают 3,52 г указанного в заголовке соединения. 1(1H), 3,45-3,65 (2H), 3,82-3,92 (1H), 4,13-4,26 (1H), 4,57 (1H), 5,14 (1H), 5,98-6,12 (1H), 7,33 (1H) ч./млн. Пример 9 б. (2S,6E/Z,9S,10Z)-9-Диметил(1,1-диметилэтил)силил]окси]-10-фтор-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диенол. Из 3,52 г (6,70 ммоль) полученного согласно примеру 9 а соединения аналогично примеру 5 м получают 2,81 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,09 (6H), 0,87 (3H), 0,91 (9H), 1,58+1,69 (3H), 1,95-2,05 (2H), 2,35-2,52 (2H),2,70 (3H), 3,38-3,55 (2H), 4,32 (1H), 5,14 (1H), 5,95-6,12 (1H), 7,34 (1H) ч./млн. Пример 9 в. (2S,6E/Z,9S,10Z)-9-Диметил(1,1-диметилэтил)силил]окси]-10-фтор-11-(2-метил-4 тиазолил)-2,6-диметилундека-6,10-диеналь. Из 2,81 г (6,37 ммоль) полученного согласно примеру 9 б соединения аналогично примеру 5 н получают 2,80 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,08 (6H), 0,90 (9H), 1,03-1,10 (3H), 1,58+1,67 (3H), 1,86 (1H), 1,95-2,11 (2H),2,24-2,51 (3H), 2,70 (3H), 3,75 (1H), 4,15-4,27 (1H), 5,18 (1H), 5,97-6,14 (1H), 7,34 (1H), 9,55+9,59 (1H) ч./млн. Пример 9 г. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Фтор-17-(2-метил-4-тиазолил)-5-оксо-6,8,12-триметил 4,4-(1,3-триметилен)-1,3,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диен-7-ол. Из 2,77 г (6,68 ммоль) (S)-1-(1,3-бисдиметил(1,1-диметилэтил)силил]оксипропил]циклобутил)пропан-1-она (получение см. DE 19751200.3) и 1,65 г (3,75 ммоль) полученного согласно примеру 9 в соединения аналогично примеру 5 о получают 2,18 г указанного в заголовке соединения. 1(2H), 4,08-4,25 (2H), 5,14 (1H), 5,98-6,13 (1H), 7,33 (1H) ч./млн. Пример 9 д. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Фтор-17-(2-метил-4-тиазолил)-5-оксо-1,3,7,15-тетракис диметил(1,1-диметилэтил)силил]окси]-6,8,12-триметил-4,4-(1,3-триметилен)гептадека-12,16-диен. Из 2,18 г (2,55 ммоль) полученного согласно примеру 9 г соединения аналогично примеру 5 п получают 2,47 г указанного в заголовке соединения. 1(3H), 3,08 (1H), 3,59 (2H), 3,78 (1H), 4,10 (1H), 4,14-4,25 (1H), 5,15 (1H), 6,00-6,13 (1H), 7,35 (1H) ч./млн. Пример 9 е. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Фтор-17-(2-метил-4-тиазолил)-5-оксо-6,8,12-триметил 4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диен-1-ол. Из 2,47 г (2,55 ммоль) полученного согласно примеру 9 д соединения аналогично примеру 5 р получают 1,626 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,03-0,13 (12H), 0,04-0,20 (6H), 0,86-1,03 (30 Н), 1,08 (3H), 1,59+1,68 (3H), 1,702,50 (10 Н), 2,72 (3H), 3,12 (1H), 3,64 (2H), 3,81 (1H), 4,08 (1H), 4,13-4,27 (1H), 5,15 (1H), 6,00-6,17 (1H),7,35 (1H) ч./млн. Пример 9 ж. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Фтор-17-(2-метил-4-тиазолил)-5-оксо-6,8,12-триметил 4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диеналь. Из 1,626 г (1,91 ммоль) полученного согласно примеру 9 е соединения аналогично примеру 5 с получают 1,628 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,02-0,12 (15H), 0,18 (3H), 0,85-1,00 (30H), 1,05-1,10 (3H), 1,59+1,68 (3H), 1,702,55 (10H), 2,71 (3H), 3,75 (1H), 4,12-4,25 (1H), 4,53 (1H), 5,17 (1H), 6,00-6,15 (1H), 7,33 (1H), 9,75 (1H) ч./млн. Пример 9 з. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-16-Фтор-17-(2-метил-4-тиазолил)-5-оксо-6,8,12-триметил-4,4(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диеновая кислота. Из 1,628 г (1,91 ммоль) полученного согласно примеру 9 ж соединения аналогично примеру 5 т получают 1,161 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,02-0,15 (15H), 0,19 (3H), 0,84-1,00 (30 Н), 1,10-1,07 (3H), 1,56+1,69 (3H), 2,102,55 (10 Н), 2,70 (3H), 2,97-3,14 (1H), 3,78 (1H), 3,84 (1H), 4,09-4,27 (2H), 4,41+4,48 (1H), 5,10-5,23 (1H),6,10+6,31 (1H), 7,37 (1H) ч./млн. Пример 9 и. (3S,6R,7S,8S,12E/Z,15S,16Z)-3,7-бисДиметил(1,1-диметилэтил)силил]окси]-16-фтор 15-гидрокси-17-(2-метил-4-тиазолил)-5-оксо-6,8,12-триметил-4,4-(1,3-триметилен)гептадека-12,16 диеновая кислота. Из 1,161 г (1,34 ммоль) полученного согласно примеру 9 з соединения аналогично примеру 5 у получают 1,01 г указанного в заголовке соединения. 1(соединение Б). Из 1,01 г (1,34 ммоль) полученного согласно примеру 9 и соединения аналогично примеру 5 ф получают 434 мг указанного в заголовке соединения А и 395 мг указанного в заголовке соединения Б. 1(1H), 5,10 (1H), 5,42 (1H), 6,09-6,23 (1H), 7,36 (1H) ч./млн. Пример 10. (1S,3S(Z),7S,10R,11S,12S,16R)-7,11-Дигидрокси-3-1-фтор)-2-(2-метил-4-тиазолил) этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион (соединение А) и (1S,3S(Z),7S,10R,11S,12S,16S)-7,11-дигидрокси-3-1-фтор)-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион (соединение Б). Из 50 мг (0,098 ммоль) полученного согласно примеру 9 соединения аналогично примеру 7 получают 31 мг указанного в заголовке соединения А и 7 мг указанного в заголовке соединения Б. 1H-ЯМР (CDCl3) соединения Б:= 0,92 (3H), 1,20 (3H), 1,38 (3H), 2,75 (3H), 3,00 (1H), 3,11 (1H),3,86 (1H), 4,42 (1H), 5,29 (1H), 6,26-6,39 (1H), 7,41 (1H) ч./млн. Пример 11. (4S,7R,8S,9S,13(Z),16S(Z-4,8-Дигидрокси-16-1-фтор-2-(2-метил-4-тиазолил)этенил)1-окса-7,9,13-триметил-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион. Из 395 мг (0,54 ммоль) полученного согласно примеру 9 к соединения Б аналогично примеру 5 ф получают 200 мг указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 1,00 (3H), 1,25 (3H), 1,54 (3H), 2,69 (1H), 2,97-3,08 (1H), 3,63 (1H), 4,44 (1H),5,09 (1H), 5,54-5,63 (1H), 6,11-6,25 (1H), 7,38 (1H) ч./млн. Пример 12. (1S,3S(Z),7S,10R,11S,12S,16S)-7,11-Дигидрокси-3-1-фтор)-2-(2-метил-4-тиазолил) этенил)-10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион (соедине- 24009206 ние А) и (1R,3S(Z),7S,10R,11S,12S,16R)-7,11-дигидрокси-3-1-фтор)-2-(2-метил-4-тиазолил)этенил)10,12,16-триметил-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадека-5,9-дион (соединение Б). Из 100 мг (0,197 ммоль) полученного согласно примеру 11 соединения аналогично примеру 7 получают 41 мг указанного в заголовке соединения А и 36 мг указанного в заголовке соединения Б. 1(1H), 3,67 (1H), 3,85 (1H), 4,40 (1H), 5,68-5,77 (1H), 6,22-6,36 (1H), 7,41 (1H) ч./млн. Пример 13. (4S,7R,8S,9S,13(Е),16S(Z-4,8-Дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил 4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион. Аналогично примеру 5 из 400 мг (0,534 ммоля) полученного согласно примеру 13 ж соединения получают 181 мг указанного в заголовке соединения. 1(S)-1-(1,3-бисдиметил(1,1-диметилэтил)силил]оксипропил] циклобутил)бутан-1-она (получение см. DE 19751200.3) и 1,695 г (3,854 ммоль) полученного согласно примеру 9 в соединения аналогично примеру 5 о получают 2,042 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,01-0,20 (18H), 0,84-1,00 (33H), 1,60+1,69 (3H), 2,69 (3H), 3,11 (1H), 3,22 (1H),3,40 (1H), 3,62 (2H), 4,06-4,25 (2H), 5,97-6,12 (1H), 7,34 (1H) ч./млн. Пример 13 б. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-8,12-Диметил-6-этил-16-фтор-17-(2-метил-4-тиазолил)-5 оксо-1,3,7,15-тетракисдиметил(1,1-диметилэтил)силил]окси]-4,4-(1,3-триметилен)гептадека-12,16-диен. Из 2,042 г (2,351 ммоль) полученного согласно примеру 13 а соединения аналогично примеру 5 п получают 2,311 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,00-0,20 (24H), 0,80-0,99 (42H), 1,60+1,68 (3H), 2,70 (3H), 3,02 (1H), 3,60 (2H),3,86 (1H), 4,04-4,25 (2H), 5,97-6,13 (1H), 7,32 (1H) ч./млн. Пример 13 в. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-8,12-Диметил-6-этил-16-фтор-17-(2-метил-4-тиазолил)-5 оксо-4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диен-1-ол. Из 2,311 г (2,351 ммоль) полученного согласно примеру 13 б соединения аналогично примеру 5 р получают 1,593 г указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,02-0,19 (18H), 0,80-0,99 (33H), 1,57 (3H)+1,67 (3H), 2,70 (3H), 3,04 (1H), 3,603,71 (2H), 3,87 (1H), 4,04-4,25 (2H), 5,13 (1H), 5,95-6,11 (1H), 7,33 (1H) ч./млн. Пример 13 г. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-8,12-Диметил-6-этил-16-фтор-17-(2-метил-4-тиазолил)-5 оксо-4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диеналь. Из 1,593 г (1,834 ммоль) полученного согласно примеру 13 в соединения аналогично примеру 5 с получают 1,589 г указанного в заголовке соединения. 1(1H), 4,19 (1H), 4,55 (1H), 5,17 (1H), 5,98-6,12 (1H), 7,33 (1H), 9,79 (1H) ч./млн. Пример 13 д. (3S,6R,7S,8S,12Z,15S,16Z)-8,12-Диметил-6-этил-16-фтор-17-(2-метил-4-тиазолил)-5 оксо-4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека-12,16-диеновая кислота (соединение А) и (3S,6R,7S,8S,12 Е,15S,16Z)-8,12-диметил-6-этил-16-фтор-17-(2-метил-4 тиазолил)-5-оксо-4,4-(1,3-триметилен)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]гептадека 12,16-диеновая кислота (соединение Б). Из 1,589 г (1,834 ммоль) полученного согласно примеру 13 г соединения аналогично примеру 5 т получают 664 мг указанного в заголовке соединения А, а также 566 мг указанного в заголовке соединения Б. 1(3S,6R,7S,8S,12Z,15S,16Z)-3,7-бисДиметил(1,1-диметилэтил)силил]окси]-8,12 диметил-6-этил-16-фтор-15-гидрокси-17-(2-метил-4-тиазолил)-5-оксо-4,4-(1,3-триметилен)гептадека 12,16-диеновая кислота. Из 663 мг (0,752 ммоль) полученного согласно примеру 13 д соединения А аналогично примеру 5 у получают 578 мг указанного в заголовке соединения. 1- 25009206 Из 578 мг (0,752 ммоль) полученного согласно примеру 13 е соединения аналогично примеру 5 ф получают 400 мг указанного в заголовке соединения. 1H-ЯМР (CDCl3):= -0,09 (3H), 0,09 (3H), 0,15 (3H), 0,17 (3H), 0,80-0,97 (21H), 1,00 (3H), 1,68 (3H),2,70 (3H), 2,75-2,88 (1H), 2,98 (1H), 4,04 (1H), 4,42 (1H), 5,17 (3H), 6,07-6,20 (1H), 7,37 (1H) ч./млн. Пример 14. (1S,3S(Z),7S,10R,11S,12S,16R)-7,11-Дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2 метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение А) и (1R,3S(Z),7S,10R,11S,12S,16S)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил 4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение Б). Из 40 мг (0,0767 ммоль) полученного согласно примеру 13 соединения аналогично примеру 7 получают 26 мг указанного в заголовке соединения А и 6 мг указанного в заголовке соединения Б. 1(1H), 3,73 (1H), 4,48 (1H), 5,73 (1H), 6,22-6,35 (1H), 7,40 (1H) ч./млн. Пример 15. (4S,7R,8S,9S,13(Е),16S(Z-4,8-Дигидрокси-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил 4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен-2,6-дион. Аналогично примеру 5 из 433 мг (0,5778 ммоля) полученного согласно примеру 15 б соединения получают 214 мг указанного в заголовке соединения. 1(3S,6R,7S,8S,12E,15S,16Z)-3,7-бисдиметил(1,1-диметилэтил)силил]окси]-8,12 диметил-6-этил-16-фтор-15-гидрокси-17-(2-метил-4-тиазолил)-5-оксо-4,4-(1,3-триметилен)гептадека 12,16-диеновая кислота. Из 566 мг (0,642 ммоль) полученного согласно примеру 13 д соединения Б аналогично примеру 5 у получают 493 мг указанного в заголовке соединения. 1H-ЯМР (CDCl3):=0,01 (3H), 0,04 (3H), 0,09 (3H), 0,17 (3H), 0,82-0,95 (24H), 1,62 (3H), 2,68 (3H),2,95 (3H), 3,82 (1H), 4,17-4,30 (1H), 4,40 (1H), 5,15 (1H), 6,15-6,28 (1H), 7,37 (1H) ч./млн. Пример 15 б. 4S,7R,8S,9S,13(Е),16S(Z)-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-9,13-диметил-7-этил-16-(1-фтор-2-(2-метил-4-тиазолил)этенил)-1-окса-5,5-(1,3-триметилен)циклогексадец-13-ен 2,6-дион. Из 493 мг (0,642 ммоль) полученного согласно примеру 15 а соединения аналогично примеру 5 ф получают 433 мг указанного в заголовке соединения. 1H-ЯМР (CDCl3):= 0,07 (3H), 0,10 (3H), 0,12 (3H), 0,15 (3H), 0,85-1,04 (24H), 2,71 (3H), 2,92 (1H),4,06 (1H), 5,15 (1H), 5,36-5,47 (1H), 6,10-6,23 (1H), 7,37 (1H) ч./млн. Пример 16. (1S,3S(Z),7S,10R,11S,12S,16S)-7,11-Дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2 метил-4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение А) и (1R,3S(Z),7S,10R,11S,12S,16R)-7,11-дигидрокси-12,16-диметил-10-этил-3-(1-фтор-2-(2-метил 4-тиазолил)этенил)-8,8-(1,3-триметилен)-4,17-диоксабицикло[14.1.0]гептадекан-5,9-дион (соединение Б). Из 100 мг (0,1917 ммоль) полученного согласно примеру 15 соединения аналогично примеру 7 получают 40 мг указанного в заголовке соединения А и 39 мг указанного в заголовке соединения Б. 1(1H), 3,68-3,81 (2H), 4,46 (1H), 5,68 (1H), 6,19-6,32 (1H), 7,38 (1H) ч./млн. Пример 17. (4S,7R,8S,9S,13Z,16S(Z-4,8-Дигидрокси-16-(1-фтор-2-(2-пиридил)этенил)-7-этил-1 окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион. Пример 17 а. 2-Пиридилкарбальдегид. Раствор 50 мл (370 ммоль) этилового эфира 2-пиколиновой кислоты в 1 л безводного дихлорметана охлаждают в атмосфере сухого аргона до -78 С, смешивают с 500 мл 1,2-молярного раствора диизобутилалюминийгидрида в толуоле и перемешивают в течение еще 1 ч. Далее смешивают с 152 мл изопропанола и 253 мл воды, дают нагреться до 23 С и перемешивают до тех пор, пока не образуется мелкозернистый осадок. После фильтрации и отгонки растворителя выделяют 32,6 г (304 ммоль, 82%) указанного в заголовке соединения в виде бледно-желтого масла. 1H-ЯМР (CDCl3):= 7,52 (1H), 7,89 (1H), 7,99 (1H), 8,80 (1H), 10,10 (1H) ч./млн. Пример 17 б. Этиловый эфир (2 Е/Z)-3-(2-пиридил)-2-фтор-2-пропеновой кислоты. К 20,7 г 55% дисперсии гидрида натрия в 230 мл безводного диметилового эфира этиленгликоля по каплям в атмосфере сухого аргона при 0C добавляют раствор 115 г триэтилового эфира 2-фтор-2 фосфоноуксусной кислоты в 230 мл диметилового эфира этиленгликоля и затем перемешивают в течение 1 ч. После этого смешивают с раствором 27,6 г (258 ммоль) полученного согласно примеру 17 а соединения в 230 мл диметилового эфира этиленгликоля и дают нагреться в течение 1 ч до 23C. Затем смесь сливают в насыщенный раствор хлорида аммония, несколько раз экстрагируют этилацетатом, объеди- 26009206 ненные органические экстракты промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток очищают вакуумной перегонкой. Таким путем выделяют 33,7 г (173 ммоль, 67%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 1,22+1,39 (3H), 4,25+4,37 (2H), 6,90+7,13 (1H), 7,23+7,26 (1H), 7,56+7,90 (1H),7,67+7,76 (1H), 8,59+8,67 (1H) ч./млн. Пример 17 в. Этиловый эфир (2Z)-3-(2-пиридил)-2-фтор-2-пропеновой кислоты. Раствор 29,2 г (149 ммоль) полученной согласно примеру 17 б смеси E/Z-изомеров в 280 мл безводного толуола смешивают в атмосфере сухого аргона с 2,0 г иода и в течение 7 дней выдерживают с нагреванием при 100C. Охлажденный раствор промывают насыщенным раствором тиосульфата натрия и сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток очищают хроматографией примерно на 1 л тонкоизмельченного силикагеля с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 26,3 гH-ЯМР (CDCl3):= 1,39 (3H), 4,37 (2H), 7,13 (1H), 7,26 (1H), 7,76 (1H), 7,90 (1H), 8,67 (1H) ч./млн. Пример 17 г. (2Z)-3-(2-Пиридил)-2-фтор-2-пропен-1-ол. Раствор 26,3 г (135 ммоль) полученного согласно примеру 17 в соединения в 800 мл безводного тетрагидрофурана охлаждают в атмосфере сухого аргона до -78 С, смешивают с 80 г три-третбутоксиалюмогидрида лития, дают нагреться до 23C и перемешивают в течение 16 ч. После этого смешивают с водой, несколько раз экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток очищают хроматографией примерно на 1,5 л тонкоизмельченного силикагеля с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 17,3 г (113 ммоль, 84%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 1,93 (1H), 4,32 (2H), 6,19 (1H), 7,16 (1H), 7,69 (1H), 7,77 (1H), 8,52 (1H) ч./млн. Пример 17 д. (2Z)-3-(2-Пиридил)-2-фтор-2-пропеналь. Раствор 17,3 г (113 ммоль) полученного согласно примеру 17 г соединения в 2,5 л безводного толуола смешивают с 100 г пиролюзита и перемешивают в течение 16 ч при 23C. После этого фильтруют через целит, выделяя в результате 13,8 г (91 ммоль, 81%) указанного в заголовке соединения в виде бледножелтого масла. 1(3S,4Z)-5-(2-Пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3-ил]-3 гидрокси-4-фтор-4-пентен-1-он (соединение А) и (3R,4Z)-5-(2-пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3 оксазолидин-2-он-3-ил]-3-гидрокси-4-фтор-4-пентен-1-он (соединение Б). К раствору 16,8 мл диизопропиламина в 800 мл безводного тетрагидрофурана при -30 С в атмосфере сухого аргона по каплям добавляют 50 мл 2,4-молярного раствора н-бутиллития в н-гексане, перемешивают в течение 20 мин, охлаждают до -70C и смешивают в течение 4 ч с раствором 23,6 г (4S,5R)-3 ацетил-4-метил-5-фенилоксазолидин-2-она в 800 мл тетрагидрофурана. Через 1 ч по каплям в течение 2 ч добавляют раствор 10,3 г (68 ммоль) полученного согласно примеру 17 д соединения в 390 мл тетрагидрофурана и перемешивают в течение 16 ч при -70C. После этого смесь сливают в насыщенный раствор хлорида аммония, несколько раз экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток разделяют повторной хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном, этилацетатом и этанолом в качестве системы растворителей. Таким путем выделяют 8,60 г (23,2 ммоль, 34%) указанного в заголовке соединения А в виде кристаллического твердого вещества, а также 5,04 г (13,6 ммоль, 20%) указанного в заголовке соединения Б в виде бесцветного пенистого вещества. 1H-ЯМР (CDCl3) соединения Б:= 0,94 (3H), 3,47 (2H), 4,19 (1H), 4,81 (1H), 4,89 (1H), 5,72 (1H),6,29 (1H), 7,16 (1H), 7,22-7,49 (5H), 7,69 (1H), 7,76 (1H), 8,59 (1H) ч./млн. Пример 17 ж. (4Z)-5-(2-Пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3-ил]-4-фтор-4 пентен-1,3-дион. 3,54 г (9,56 ммоль) полученного согласно примеру 17 е соединения Б подвергают превращению аналогично примеру 17 д и после переработки выделяют 3,01 г (8,17 ммоль, 85%) указанного в заголовке соединения в виде кристаллического твердого вещества. 1(3S,4Z)-5-(2-Пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3-ил]-3 гидрокси-4-фтор-4-пентен-1-он (соединение А) и (3R,4Z)-5-(2-пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3- 27009206 оксазолидин-2-он-3-ил]-3-гидрокси-4-фтор-4-пентен-1-он (соединение Б). Раствор 12,2 г (33,1 ммоль) полученного согласно примеру 17 ж соединения в смеси, содержащей 610 мл безводного дихлорметана и 65 мл безводного метанола, смешивают в атмосфере сухого аргона при -40C с 732 мг борогидрида натрия и перемешивают в течение 1 ч. После этого смесь сливают в насыщенный раствор гидрокарбоната натрия, несколько раз экстрагируют дихлорметаном и объединенные органические экстракты сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток разделяют хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования дихлорметаном и этанолом в качестве системы растворителей. Таким путем наряду с исходным материалом выделяют 3,46 г (9,3 ммоль, 28%) указанного в заголовке соединения А, а также 3,38 г (9,1 ммоль, 28%) указанного в заголовке соединения Б, каждое из которых идентично соответствующему соединению, описанному в примере 17 е. Пример 17 и. (3S,4Z)-5-(2-Пиридил)-1-[(4S,5R)-4-метил-5-фенил-1,3-оксазолидин-2-он-3-ил]-3 диметил(1,1-диметилэтил)силил]окси]-4-фтор-4-пентен-1-он. Раствор 9,96 г (26,89 ммоль) полученного согласно примеру 17 е и/или 1 з соединения А в 85 мл безводного дихлорметана охлаждают в атмосфере сухого аргона до -70C, смешивают с 7 мл 2,6-лутидина и 12,4 мл трет-бутилдиметилсилилового эфира трифторметансульфоновой кислоты и перемешивают в течение 2 ч. После этого смесь сливают в насыщенный раствор гидрокарбоната натрия, несколько раз экстрагируют дихлорметаном, объединенные органические экстракты промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Полученный после фильтрации и отгонки растворителя остаток разделяют хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном, этилацетатом и этанолом в качестве системы растворителей. Таким путем выделяют 12,9 г (26,6 ммоль, 99%) указанного в заголовке соединения в виде бесцветного масла. 1(1H), 7,13 (1H), 7,24-7,47 (5H), 7,68 (1H), 7,76 (1H), 8,58 (1H) ч./млн. Пример 17 к. Этиловый эфир (3S,4Z)-5-(2-пиридил)-3-диметил(1,1-диметилэтил)силил]окси]-4 фтор-4-пентеновой кислоты. Раствор 12,8 г (26,5 ммоль) полученного согласно примеру 17 и соединения в 130 мл безводного этанола смешивают при 23 С в атмосфере сухого аргона с 6,7 мл тетраэтилата титана и выдерживают с нагреванием в течение 2 ч при 85 С. После этого смесь концентрируют и остаток очищают хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 9,3 г (26,3 ммоль, 99%) указанного в заголовке соединения в виде бесцветного масла. 1(1H), 7,68 (1H), 7,73 (1H), 8,59 (1H) ч./млн. Пример 17 л. (3S,4Z)-5-(2-Пиридил)-3-диметил(1,1-диметилэтил)силил]окси]-4-фтор-4-пентен-1-ол. 9,7 г (27,4 ммоль) полученного согласно примеру 17 к соединения подвергают превращению аналогично примеру 17 а и после переработки и очистки выделяют 6,8 г (21,8 ммоль, 80%) указанного в заголовке соединения в виде бесцветного масла. 1(1H), 6,09 (1H), 7,12 (1H), 7,65 (1H), 7,72 (1H), 8,57 (1H) ч./млн. Пример 17 м. (3S,4Z)-5-(2-Пиридил)-3-диметил(1,1-диметилэтил)силил]окси]-1-иод-4-фтор-4 пентен. Раствор 6,75 г трифенилфосфина в 120 мл безводного дихлорметана смешивают при 23C в атмосфере сухого аргона с 1,78 г имидазола и 6,47 г иода и по каплям при охлаждении добавляют раствор 6,8 г (21,8 ммоль) полученного согласно примеру 17 л соединения в 40 мл дихлорметана. После этого перемешивают в течение 1 ч и затем непосредственно очищают хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 6,7 г (15,9 ммоль, 73%) указанного в заголовке соединения в виде бесцветного масла. 1(1H), 7,69 (1H), 7,75 (1H), 8,58 (1H) ч./млн. Пример 17 н. Иодид (3S,4Z)-5-(2-пиридил)-3-диметил(1,1-диметилэтил)силил]окси]-4-фтор-4 пентен-1-трифенилфосфония. 6,7 г (15,9 ммоль) полученного согласно примеру 17 м соединения смешивают с 8,4 мл этилдиизопропиламина и 50,3 г трифенилфосфина и в течение 4 ч выдерживают с нагреванием при 85 С. Маслянистый остаток очищают хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 8,9 г (13,0 ммоль, 82%) указанного в заголовке соединения в виде кристаллического твердого вещества. 1(тетрагидропиран-2-илокси)-2,6-диметилундека-6,10-диен. Суспензию 3,32 г (4,86 ммоль) полученного согласно примеру 17 н соединения в 22 мл безводного тетрагидрофурана смешивают при 0 С в атмосфере сухого аргона с 4,86 мл 1-молярного раствора бис(триметилсилил)амида натрия в тетрагидрофуране. К красному раствору по каплям медленно добавляют раствор 753 мг (3,30 ммоль) (2S)-2-метил-6-оксогептан-1-(тетрагидропиран-2-илокси), полученного аналогично описанному в DE 19751200.3 методу, в 22 мл тетрагидрофурана, после чего перемешивают в течение 3 ч, сливают в насыщенный раствор хлорида аммония и несколько раз экстрагируют этилацетатом. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют в вакууме. После колоночной хроматографии на силикагеле с использованием градиентного элюирования нгексаном и этилацетатом в качестве системы растворителей получают 1,30 г (2,57 ммоль, 78%) указанного в заголовке соединения в виде бесцветного пенистого вещества. 1H-ЯМР (CDCl3):= 0,10 (6H), 0,83-0,96 (12H), 1,10 (1H), 1,20-2,07 (12H), 1,60+1,68 (3H), 2,43 (2H),3,04-3,27 (1H), 3,42-3,63 (2H), 3,85 (1H), 4,22 (1H), 4,57 (1H), 5,19 (1H), 6,04 (1H), 7,13 (1H), 7,68 (1H),7,76 (1H), 8,57 (1H) ч./млн. Пример 17 п. (2S,6E/Z,9S,10Z)-9-Диметил(1,1-диметилэтил)силил]окси]-10-фтор-11-(2-пиридил)-1 гидрокси-2,6-диметилундека-6,10-диен. К раствору 1,30 г (2,57 ммоль) полученного согласно примеру 17 о соединения в 50 мл этанола добавляют 700 мг п-толуолсульфоната пиридиния и затем перемешивают в течение 3 ч при 23C. После этого смесь концентрируют в вакууме и полученный таким путем остаток очищают хроматографией на силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 832 мг (1,97 ммоль, 77%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 0,11 (6H), 0,88+0,91 (3H), 0,95 (9H), 1,07 (1H), 1,24-1,71 (5H), 1,60+1,69 (3H),1,92-2,11 (2H), 2,34-2,58 (2H), 3,34-3,54 (2H), 4,24 (1H), 5,19 (1H), 6,00+6,02 (1H), 7,12 (1H), 7,66 (1H),7,75 (1H), 8,56 (1H) ч./млн. Пример 17 р. (2S,6E/Z,9S,10Z)-9-Диметил(1,1-диметилэтил)силил]окси]-10-фтор-11-(2-пиридил)2,6-диметилундека-6,10-диеналь. К 598 мкл оксалилхлорида, растворенного в 25 мл дихлорметана, в атмосфере азота при -70C по каплям осторожно добавляют 971 мкл диметилсульфоксида и затем перемешивают в течение 10 мин при этой температуре. После этого по каплям добавляют раствор 1,45 г (3,44 ммоль) полученного согласно примеру 17 п спирта в 25 мл дихлорметана и перемешивают в течение 0,5 ч при температуре в интервале от -60 до -70 С. Далее добавляют 2,84 мл триэтиламина и после 1-часового перемешивания при -60C реакционный раствор сливают в 30 мл воды. После разделения фаз водную фазу несколько раз экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия. После сушки над сульфатом натрия и фильтрации концентрируют в вакууме. Остаток очищают хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования нгексаном и этилацетатом в качестве системы растворителей. Таким путем получают 1,31 г (3,12 ммоль,91%) указанного в заголовке соединения в виде бесцветного масла. Пример 17 с. (4S(4R,5S,6S,10E/Z,13S,14Z-4-(13-(1,1-Диметилэтил)диметилсилил]окси]-4-этил-14 фтор-15-(2-пиридил)-3-оксо-5-гидрокси-2,6,10-триметилпентадека-10,14-диен-2-ил)-2,2-диметил[1,3] диоксан (соединение А) и (4S(4S,5R,6S,10E/Z,13S,14Z-4-(13-(1,1-диметилэтил)диметилсилил]окси]-4 этил-14-фтор-15-(2-пиридил)-3-оксо-5-гидрокси-2,6,10-триметилпентадека-10,14-диен-2-ил)-2,2-диметил[1,3]диоксан (соединение Б). Раствор 1,57 мл диизопропиламина в 40 мл безводного тетрагидрофурана охлаждают в атмосфере сухого аргона до -30C, смешивают с 4,72 мл 2,4-молярного раствора н-бутиллития в н-гексане и перемешивают в течение 30 мин. Затем при -78C по каплям добавляют раствор 1,31 г (3,12 ммоль) полученного согласно примеру 17 р соединения в 40 мл тетрагидрофурана и дают прореагировать в течение 1 ч. После этого смешивают с раствором 2,36 г (10,3 ммоль) (4S)-4-(2-метил-3-оксогекс-2-ил)-2,2-диметил[1,3]диоксана, полученного по описанному в DE 19751200.3 методу, в 40 мл тетрагидрофурана и через 60 мин сливают в насыщенный раствор хлорида аммония. Далее разбавляют водой, несколько раз экстрагируют этилацетатом, объединенные органические экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют в вакууме. После колоночной хроматографии на силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей наряду с исходным материалом получают 1,56 г (2,41 ммоль, 77%) указанного в заголовке соединения А, а также 287 мг (0,44 ммоль, 14%) указанного в заголовке соединения Б. 1- 29009206 Раствор 1,45 г (2,24 ммоль) полученного согласно примеру 17 с соединения в 36 мл безводного этанола смешивают в атмосфере сухого аргона с 1,06 г п-толуолсульфоната пиридиния и затем перемешивают в течение 4 ч при 23 С. После отгонки растворителя остаток хроматографируют на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 1,36 г (2,24 ммоль, 93%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 0,10 (6H), 0,78-0,90 (6H), 0,92 (9H), 0,99-2,12 (11H), 1,08 (3H), 1,26 (3H),1,58+1,68 (3H), 2,32-2,53 (2H), 2,79-3,03 (2H), 3,19 (1H), 3,41 (1H), 3,73-3,93 (3H), 4,06-4,25 (2H),5,13+5,21 (1H), 5,93 (1H), 7,13 (1H), 7,67 (1H), 7,77 (1H), 8,58 (1H) ч./млн. Пример 17 у. (3S,6R,7S,8S,12E/Z,15S,16Z)-6-Этил-l,3,7,15-тетраксис(1,1-диметилэтил)диметилсилил]окси]-16-фтор-4,4,8,12-тетраметил-17-(2-пиридил)гептадека-12,16-диен-5-он. Раствор 1,36 г (2,24 ммоль) полученного согласно примеру 17 т соединения в мл безводного дихлорметана охлаждают в атмосфере сухого аргона до -78C, смешивают с 3,45 мл 2,6-лутидина и 3,36 мл трет-бутилдиметилсилилового эфира трифторметансульфоновой кислоты, после чего смеси в течение 2 ч дают нагреться до 0 С и затем перемешивают еще в течение 2 ч. Далее смесь сливают в насыщенный раствор гидрокарбоната натрия и несколько раз экстрагируют дихлорметаном. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют в вакууме. После колоночной хроматографии на силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей выделяют 1,83 г (1,92 ммоль, 86%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 0,00-0,12 (24H), 0,83 (3H), 0,85-0,98 (39H), 1,00-1,82 (9H), 1,03 (3H), 1,21 (3H),1,61+1,68 (3H), 1,98 (2H), 2,42 (2H), 3,01 (1H), 3,47-3,73 (2H), 3,82 (1H), 3,91 (1H), 4,21 (1H), 5,19 (1H),6,01 (1H), 7,12 (1H), 7,65 (1H), 7,73 (1H), 8,58 (1H) ч./млн. Пример 17 ф. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-6-Этил-3,7,15-трис(1,1-диметилэтил)диметилсилил] окси]-1-гидрокси-16-фтор-4,4,8,12-тетраметил-17-(2-пиридил)гептадека-12,16-диен-5-он. Раствор 1,83 г (1,92 ммоль) полученного согласно примеру 17 у соединения в смеси, содержащей 20 мл дихлорметана и 20 мл метанола, смешивают при 23 С в атмосфере сухого аргона с 446 мг камфор-10 сульфоновой кислоты и перемешивают в течение 2 ч. Далее смесь сливают в насыщенный раствор гидрокарбоната натрия и несколько раз экстрагируют дихлорметаном. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют в вакууме. После колоночной хроматографии на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей выделяют 1,40 г (1,67 ммоль, 87%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР (CDCl3):= 0,02-0,14 (18H), 0,85 (3H), 0,88-0,97 (30 Н), 1,03-1,80 (9H), 1,08 (3H), 1,20 (3H),1,60+1,68 (3H), 1,90-2,06 (3H), 2,42 (2H), 3,01 (1H), 3,68 (2H), 3,83 (1H), 4,08 (1H), 4,21 (1H), 5,18 (1H),6,01 (1H), 7,12 (1H), 7,63 (1H), 7,72 (1H), 8,56 (1H) ч./млн. Пример 17 х. (3S,6R,7S,8S,12 Е/Z,15S,16Z)-6-Этил-3,7,15-трис(1,1-диметилэтил)диметилсилил] окси]-16-фтор-5-оксо-4,4,8,12-тетраметил-17-(2-пиридил)гептадека-12,16-диеналь. Раствор 400 мкл оксалилхлорида в 16 мл безводного дихлорметана охлаждают в атмосфере сухого аргона до -70C, после чего смешивают с 650 мкл диметилсульфоксида и с раствором 1,51 г (1,81 ммоль) полученного согласно примеру 17 ф соединения в 16 мл безводного дихлорметана и перемешивают в течение 0,5 ч. После этого смешивают с 2 мл триэтиламина, дают прореагировать в течение 1 ч при -30C и смешивают с н-гексаном и насыщенным раствором гидрокарбоната натрия. Органическую фазу отделяют, а водную фазу дополнительно несколько раз экстрагируют н-гексаном, после чего объединенные органические экстракты промывают водой и сушат над сульфатом магния. Полученный после фильтрации и отгонки растворителя остаток очищают хроматографией на тонкоизмельченном силикагеле с использованием градиентного элюирования н-гексаном и этилацетатом в качестве системы растворителей. Таким путем выделяют 1,48 г (1,77 ммоль, 98%) указанного в заголовке соединения в виде бледножелтого масла. 1(3S,6R,7S,8S,12 Е,15S,16Z)-6-этил-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-16-фтор-5-оксо 4,4,8,12-тетраметил-17-(2-пиридил)гептадека-12,16-диеновая кислота (соединение Б). Раствор 1,48 г (1,77 ммоль) полученного согласно примеру 17 х соединения в 54 мл трет-бутанола смешивают с 50 мл 2-молярного раствора 2-метил-2-бутена в тетрагидрофуране, после чего охлаждают до 2C, смешивают с 14 мл воды, 731 мг дигидрофосфата натрия и 1,24 г хлорита натрия, смеси дают нагреться до 15C и перемешивают в течение 2 ч. Далее смесь сливают в насыщенный раствор тиосуль- 30
МПК / Метки
МПК: C07D 493/04, C07D 417/06, A61P 35/00, A61K 31/427, C07D 405/06, A61K 31/4427
Метки: 16-галогенэпотилона, использование, фармацевтическое, производные
Код ссылки
<a href="https://eas.patents.su/30-9206-proizvodnye-16-galogenepotilona-i-ih-farmacevticheskoe-ispolzovanie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 16-галогенэпотилона и их фармацевтическое использование</a>
Предыдущий патент: Добавка для борьбы с поглощением бурового раствора
Следующий патент: Получение диоксида титана
Случайный патент: Способ и установка для получения расплава минерального материала












