Аминокислоты с аффинностью к α2δ-белку
Номер патента: 8709
Опубликовано: 29.06.2007
Авторы: Шварц Джейкоб Брэдли, Торп Эндрю Джон, Вустроу Девид Юрген, Барта Нэнси Сью
Формула / Реферат
1. Соединение формулы IA

или его фармацевтически приемлемая соль,
где
R1 представляет собой водород или (C1-С3)алкил, необязательно замещенный от 1 до 5 атомами фтора;
R2 представляет собой водород или (C1-С3)алкил, необязательно замещенный от 1 до 5 атомами фтора; и
R3 представляет собой (C1-С6)алкил, (C3-С6)циклоалкил, (С3-С6)циклоалкил-(C1-С3)алкил, фенил, фенил-(C1-С3)алкил или фенил-N(H)-, где каждый алкил необязательно замещен от 1 до 5 атомами фтора и каждый фенил необязательно замещен от 1 до 3 заместителями, независимо выбранными из хлора, фтора, амино, нитро, циано, (C1-С3)алкиламино, (C1-С3)алкила, необязательно замещенного от 1 до 3 атомами фтора, и (C1-С3)алкокси, необязательно замещенного от 1 до 3 атомами фтора;
при условии, что, когда R1 представляет собой водород, R2 не является водородом.
2. Соединение по п.1 формулы IA-1

или его фармацевтически приемлемая соль,
где
R3 представляет собой (C1-С6)алкил, (C3-С6)циклоалкил, (C3-С6)циклоалкил-(C1-С3)алкил, фенил, фенил-(C1-С3)алкил или фенил-N(Н)-, где каждый алкил необязательно замещен от 1 до 5 атомами фтора и каждый фенил необязательно замещен от 1 до 3 заместителями, независимо выбранными из хлора, фтора, амино, нитро, циано, (C1-С3)алкиламино, (C1-С3)алкила, необязательно замещенного от 1 до 3 атомами фтора, и (C1-С3)алкокси, необязательно замещенного от 1 до 3 атомами фтора.
3. Соединение по п.1 формулы IA-2
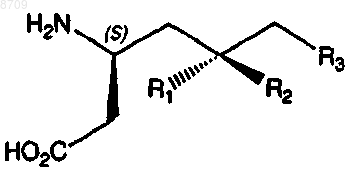
IA-2
где
R1 представляет собой водород или (C1-С3)алкил, необязательно замещенный от 1 до 5 атомами фтора;
R2 представляет собой водород или (C1-С3)алкил, необязательно замещенный от 1 до 5 атомами фтора; и
R3 представляет собой (C1-С6)алкил, (C3-С6)циклоалкил, (С3-С6)циклоалкил-(C1-С3)алкил, фенил, фенил-(C1-С3)алкил или фенил-N(H)-, где каждый алкил необязательно замещен от 1 до 5 атомами фтора и каждый фенил необязательно замещен от 1 до 3 заместителями, независимо выбранными из хлора, фтора, амино, нитро, циано, (C1-С3)алкиламино, (C1-С3)алкила, необязательно замещенного от 1 до 3 атомами фтора, и (C1-С3)алкокси, необязательно замещенного от 1 до 3 атомами фтора;
при условии, что, когда R1 представляет собой водород, R2 не является водородом,
или его фармацевтически приемлемая соль.
4. Соединение, выбранное из следующих соединений и их фармацевтически приемлемых солей:
3-амино-5-метилоктановая кислота;
3-амино-5-метилнонановая кислота;
(3S,5R)-3-амино-5-метилгептановая кислота;
(3S,5R)-3-амино-5-метилоктановая кислота;
(3S,5R)-3-амино-5-метилнонановая кислота;
3-амино-7-циклопентил-5-метилгептановая кислота;
3-амино-7-циклогексил-5-метилгептановая кислота;
(3S,5R)-3-амино-7-циклопентил-5-метилгептановая кислота;
(3S,5R)-3-амино-7-циклогексил-5-метилгептановая кислота;
3-амино-5-метил-7-фенилгептановая кислота;
3-амино-5-метил-7-(2,4-дифторфенил)гептановая кислота;
3-амино-8-(2,3-дифторфенил)-5-метилоктановая кислота;
3-амино-8-(2,4-дифторфенил)-5-метилоктановая кислота;
3-амино-5-метилгептановая кислота.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
6. Соединение, выбранное из 3-амино-5-метилоктановой кислоты или ее фармацевтически приемлемой соли.
7. Фармацевтическая композиция, содержащая терапевтически эффективное количество 3-амино-5-метилоктановой кислоты по п.6 или ее фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
8. Соединение, выбранное из (3S,5R)-3-амино-5-метилоктановой кислоты или ее фармацевтически приемлемой соли.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество (3S,5R)-3-амино-5-метилоктановой кислоты по п.8 или ее фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
10. Способ лечения расстройства или состояния у млекопитающих, включая человека, выбранного из обморочного состояния, фибромиалгии, гипокинезии, черепно-мозговых расстройств, приступов прилива, эссенциального тремора, зависимости и пристрастия к синтетическим препаратам, включая зависимость или пристрастие к алкоголю, амфетаминам или к амфетаминподобным веществам, кофеину, марихуане, кокаину, героину, галлюциногенам, табаку, ингаляторным и аэрозольным пропеллентам, никотину, опиоидам, производным фенилглицидина, седативным препаратам, гипнотическим средствам, бензодиазепинам и другим анксиолитикам, и синдромов отмены, связанных с такой зависимостью или пристрастием; поведения человека, подверженного пагубным привычкам, включая азартные игры; мигрени, спастичности, артрита, синдрома раздраженной кишки (IBS), хронической боли, острой боли, нейропатической боли, сосудистой головной боли, синусной головной боли, воспалительных заболеваний, включая ревматоидный артрит, остеоартрит, псориаз; диуреза, предменструального синдрома, предменструального дистрофического расстройства, шума в ушах и желудочных заболеваний, заключающийся во введении млекопитающему, при необходимости такого лечения, терапевтически эффективного количества соединения по любому из пп.1-4, 6, 8 или его фармацевтически приемлемой соли.
11. Способ лечения расстройства или состояния у млекопитающих, включая человека, выбранного из группы, включающей делириум, деменцию, амнезию и другие когнитивные или нейродегенеративные расстройства, такие как болезнь Паркинсона (PD), болезнь Гентингтона (HD), болезнь Альцгеймера, старческое слабоумие, деменция по типу болезни Альцгеймера, расстройства памяти, сосудистая деменция и другие деменции, такие как деменция при болезни, вызванной вирусом иммунодефицита человека (ВИЧ), деменция в связи с травмой головы, деменция при болезни Паркинсона, деменция при болезни Гентингтона, деменция при болезни Пика, деменция при болезни Крейтцфельдта-Якоба, деменция множественной этиологии; двигательные расстройства, такие как акинезия, дискинезия, включая семейную пароксизмальную дискинезию, спастичность, синдром Туретта, синдром Скотта, PALSYS и ригидно-акинетический синдром; экстрапирамидальные двигательные расстройства, включая расстройства движения, вызванные лекарственными препаратами, такие как паркинсонизм, вызванный приемом нейролептиков, нейролептический злокачественный синдром, острая дистония, вызванная приемом нейролептиков, острая акатизия, вызванная приемом нейролептиков, поздняя дискинезия, вызванная приемом нейролептиков, и постуральный тремор, вызванный приемом лекарственных препаратов; синдром Дауна; димиелинизирующие заболевания, такие как рассеянный склероз (MS) и боковой амиотрофический склероз (ALS), периферическая нейропатия, такая как нейропатия при диабете и химиотерапии, и постгерпетическая невралгия, невралгия тройничного нерва, межреберная невралгия или невралгия с сегментарными вегетативными расстройствами и другие невралгии; и цереброваскулярные заболевания при остром или хроническом цереброваскулярном нарушении, таком как инфаркт мозга, субарахноидальное кровоизлияние или отек мозга, заключающийся во введении указаннюьу млекопитающему соединения по любому из пп.1-4, 6, 8 или его фармацевтически приемлемой соли в количестве, которое эффективно для лечения такого расстройства или состояния.
12. Способ лечения расстройства или состояния у млекопитающих, включая человека, выбранного из группы, включающей нарушения сна, включая инсомнию, бессонницу, связанную с приемом лекарственных препаратов, нарушение пародоксального REM-сна, повышенную сонливость, нарколепсию, нарушения цикла сна, синдром апноэ во сне, парасомнию и нарушения сна, связанные со сменной работой и нерегулярными часами работы, заключающийся во введении указанному млекопитающему соединения по любому из пп.1-4, 6, 8 или его фармацевтически приемлемой соли в количестве, которое эффективно для лечения такого расстройства или состояния.
13. Способ лечения расстройства или состояния у млекопитающих, включая человека, выбранного из аффективных расстройств, таких как депрессия или депрессивные расстройства, включая единичный депрессивный эпизод или реккурентное депрессивное расстройство, дистимические расстройства, депрессивный невроз и невротическую депрессию, депрессию по меланхолическому типу, включая анорексию, потерю веса, инсомнию, раннее просыпание и психомоторную заторможенность, атипическую депрессию (или реактивную депрессию), включая повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность, сезонное аффективное расстройство и депрессию у детей; биполярные аффективные расстройства или маниакальную депрессию, включая биполярное расстройства I типа, биполярное расстройство II типа и циклотимические расстройства; расстройства личности и поведения; тревожные расстройства, такие как паническое расстройство с агорафобией или без агорафобии, агорафобия с паническим расстройством в анамнезе, специфические фобии, например боязнь животных, социальную тревогу, социальные фобии, обсессивно-компульсивное расстройство, стрессовые расстройства, включая посттравматическое стрессовое расстройство, острую реакцию на стресс, и генерализованные тревожные расстройства; пограничное расстройство личности; шизофрению и другие психотические расстройства, например шизофреноподобные расстройства, шизоаффективные расстройства, бредовые расстройства, кратковременные психотические расстройства, психотические смешанные расстройства, психотические расстройства с бредом или галлюцинациями, психотические эпизоды тревоги, тревогу, связанную с психозом, психотические расстройства настроения, включая депрессивный эпизод тяжелой степени; аффективные расстройства, связанные с психотическими расстройствами, включая острую манию и депрессию, связанные с биполярным расстройством, аффективные расстройства, связанные с шизофренией; расстройства поведения, связанные с задержкой умственного развития, аутизм, и сопутствующего расстройства, заключающийся во введении указанному млекопитающему соединения по любому из пп.1-4, 6, 8 или его фармацевтически приемлемой соли в количестве, которое эффективно для лечения такого расстройства или состояния.
Текст
008709 Предпосылки изобретения Данное изобретение относится к некоторым -аминокислотам, которые связываются с субъединицей альфа-2-дельта (2) кальциевого канала. Эти соединения и их фармацевтически приемлемые соли могут использоваться для лечения различных психических, болевых и других расстройств. Краткое описание изобретения Данное изобретение относится к соединениям формулы IR1 представляет собой водород или (C1-С 6)алкил, необязательно замещенный от 1 до 5 атомами фтора;R2 представляет собой водород или (C1-С 6)алкил, необязательно замещенный от 1 до 5 атомами фтора; илиR3 представляет собой (C1-C6)алкил, (С 3-С 6)циклоалкил, (С 3-С 6)циклоалкил(C1-C3)алкил, фенил, фенил(C1-C3)алкил, пиридил, пиридил(C1-C3)алкил, фенил-N(Н)- или пиридил-N(Н)-, где каждая вышеуказанная алкильная группа может быть необязательно замещена от 1 до 5 атомами фтора, предпочтительно от 0 до 3 атомами фтора, и где указанный фенил и указанный пиридил и фенильные и пиридильные группы указанного фенил(C1-C3)алкила и указанного пиридил(C1-C3)алкила, соответственно, могут быть необязательно замещены от 1 до 3 заместителями, предпочтительно от 0 до 2 заместителями, независимо выбранными из хлора, фтора, амино, нитро, циано, (C1-С 3)алкиламино, (C1-С 3)алкила, необязательно замещенного от 1 до 3 атомами фтора, и (C1-C3)алкокси, необязательно замещенного от 1 до 3 атомами фтора;R4 представляет собой водород или (C1-С 6)алкил, необязательно замещенный от 1 до 5 атомами фтора;R5 представляет собой водород или (C1-C6)алкил, необязательно замещенный от 1 до 5 атомами фтора; иR6 представляет собой водород или (C1-С 6)алкил; и к фармацевтически приемлемым солям этих соединений. Конкретные воплощения данного изобретения включают в себя следующие соединения формулы I и их фармацевтически приемлемые соли: 3-амино-5,8-диметилнонановую кислоту; 3-амино-5,5,7-триметилоктановую кислоту; 3-амино-5,5,8-триметилнонановую кислоту; 3-амино-5,5,6-триметилгептановую кислоту;(3S)-3-амино-5,5,9-триметилдекановую кислоту. Другими примерами конкретных воплощений данного изобретения являются следующие соединения формулы I и их фармацевтически приемлемые соли: 3-амино-6-циклобутил-5-метилгексановая кислота; 3-амино-7-циклопропил-5-метилгептановая кислота; 3-амино-7-циклобутил-5-метилгептановая кислота; 3-амино-7-циклопентил-5-метилгептановая кислота; 3-амино-7-циклогексил-5-метилгептановая кислота; 3-амино-8-циклопропил-5-метилоктановая кислота; 3-амино-8-циклобутил-5-метилоктановая кислота; 3-амино-8-циклопентил-5-метилоктановая кислота; 3-амино-8-циклогексил-5-метилоктановая кислота; 3-амино-6-циклопропил-5,5-диметилгексановая кислота; 3-амино-6-циклобутил-5,5-диметилгексановая кислота; 3-амино-6-циклопентил-5,5-диметилгексановая кислота; 3-амино-6-циклогексил-5,5-диметилгексановая кислота; 3-амино-7-циклопропил-5,5-диметилгептановая кислота; 3-амино-7-циклобутил-5,5-диметилгептановая кислота; 3-амино-7-циклопентил-5,5-диметилгептановая кислота; 3-амино-7-циклогексил-5,5-диметилгептановая кислота;(3S)-3-амино-7-циклогексил-5,5-диметилгептановая кислота. Другими примерами конкретных воплощений данного изобретения являются следующие соединения формулы I и их фармацевтически приемлемые соли: 3-амино-5-метилгептановая кислота; 3-амино-5-метилоктановая кислота; 3-амино-5-метилнонановая кислота; 3-амино-5,5-диметилнонановая кислота; 3-амино-5,5-диметилдекановая кислота;(3S)-3-амино-5,5-диметилдекановая кислота. Данное изобретение также относится к соединениям формулы IAR1 представляет собой водород или (C1-C3)алкил, необязательно замещенный от 1 до 5 атомами фтора;R2 представляет собой водород или (C1-C3)алкил, необязательно замещенный от 1 до 5 атомами фтора; илиR3 представляет собой (C1-C6)алкил, (С 3-С 6)циклоалкил, (С 3-С 6)циклоалкил(С 1-С 3)алкил, фенил, фенил(C1-C3)алкил, пиридил, пиридил(С 1-С 3)алкил, фенил-N(Н)- или пиридил-N(Н)-, где каждая вышеуказанная алкильная группа может быть необязательно замещена от 1 до 5 атомами фтора, предпочтительно от 0 до 3 атомами фтора, и где указанный фенил и указанный пиридил и фенильная и пиридильная группы указанного фенил(C1-C3)алкила и указанного пиридил(C1-C3)алкила, соответственно, могут быть необязательно замещены от 1 до 3 заместителями, предпочтительно от 0 до 2 заместителями, независимо выбранными из хлора, фтора, амино, нитро, циано, (С 1-С 3)алкиламино, (C1-C3)алкила, необязательно замещенного от 1 до 3 атомами фтора, и (C1-C3)алкокси, необязательно замещенного от 1 до 3 атомами фтора; при условии, что, если R1 представляет собой водород, R2 не является водородом; и к фармацевтически приемлемым солям этих соединений. Данное изобретение также относится к соединениям формулы IA-1 где R3 такой, как определено для формулы I выше, и к фармацевтически приемлемым солям этих соединений.-2 008709 Другие конкретные воплощения данного изобретения включают в себя следующие соединения формулы IA и их фармацевтически приемлемые соли: 3-амино-5-метил-8-фениламинооктановую кислоту; 3-амино-5-метил-7-фениламиногептановую кислоту; 3-амино-5-метил-6-фениламиногексановую кислоту;(3S,5S)-3-амино-8-(2,6-дифторфенил)-5-метилоктановую кислоту. Предпочтительные соединения по данному изобретению включают в себя соединения формулы IA-2-3 008709 где R1, R2 и R3 такие, как определено для формулы I выше. Примерами более предпочтительных соединений по данному изобретению являются соединения формулы IA-2, где R1 представляет собой водород, R2 представляет собой метил и R3 такой, как определено для формулы I выше. Примерами конкретных воплощений данного изобретения являются следующие соединения формулы IA-2 и их фармацевтически приемлемые соли:(3S,5R)-3-амино-5-метилнонановая кислота. Данное изобретение также относится к соединениям формулы IB и к их фармацевтически приемлемым солям, где R3 такой, как определено выше, и где указанные соединения выбраны из следующих соединений и их фармацевтически приемлемых солей: 3-амино-4,5-диметилгексановой кислоты; 3-амино-4,6-диметилгептановой кислоты; 3-амино-4,7-диметилоктановой кислоты; 3-амино-4,8-диметилнонановой кислоты; 3-амино-4,9-диметилдекановой кислоты; 3-амино-4-циклопропилпентановой кислоты; 3-амино-4-циклобутилпентановой кислоты; 3-амино-4-циклопентилпентановой кислоты; 3-амино-4-циклогексилпентановой кислоты; 3-амино-5-циклопропил-4-метилпентановой кислоты; 3-амино-5-циклобутил-4-метилпентановой кислоты; 3-амино-5-циклопентил-4-метилпентановой кислоты; 3-амино-5-циклогексил-4-метилпентановой кислоты; 3-амино-6-циклопропил-4-метилгексановой кислоты; 3-амино-6-циклобутил-4-метилгексановой кислоты; 3-амино-6-циклопентил-4-метилгексановой кислоты; 3-амино-6-циклогексил-4-метилгексановой кислоты; 3-амино-7-циклопропил-4-метилгептановой кислоты; 3-амино-7-циклобутил-4-метилгептановой кислоты; 3-амино-7-циклопентил-4-метилгептановой кислоты; 3-амино-7-циклогексил-4-метилгептановой кислоты; 3-амино-8-циклопропил-4-метилоктановой кислоты; 3-амино-8-циклобутил-4-метилоктановой кислоты; 3-амино-8-циклопентил-4-метилоктановой кислоты; 3-амино-8-циклогексил-4-метилоктановой кислоты; 3-амино-9-циклопропил-4-метилнонановой кислоты; 3-амино-9-циклобутил-4-метилнонановой кислоты; 3-амино-9-циклопентил-4-метилнонановой кислоты; 3-амино-9-циклогексил-4-метилнонановой кислоты; 3-амино-4-метилоктановой кислоты; 3-амино-4-метилнонановой кислоты; 3-амино-4-метилдекановой кислоты;(3R,4S)-3-амино-4-метилдекановой кислоты. Данное изобретение также относится к соединениям формулы IС и к их фармацевтически приемлемым солям, где R3 такой, как определено выше, и где указанные соединения выбраны из следующих соединений и их фармацевтически приемлемых солей: 3-амино-6-метилдекановой кислоты; 3-амино-6-циклопропилгептановой кислоты; 3-амино-6-циклобутилгептановой кислоты;(3S,6S)-3-амино-6,9-диметилдекановой кислоты. Данное изобретение также относится к соединениям формулы II где R1, R2 и R3 такие, как определено для формулы I выше, и к фармацевтически приемлемым солям этих соединений. Примерами конкретных воплощений данного изобретения является следующее соединение формулы IV и его фармацевтически приемлемая соль: 2-аминометил-4-пропилгептановая кислота. Данное изобретение также относится к соединениям формулы IIА где R3 такой, как определено для формулы I выше, и к фармацевтически приемлемым солям этих соединений. Другие конкретные воплощения данного изобретения включают в себя следующие соединения формулы IIА и их фармацевтически приемлемые соли: 2-аминометил-4-метил-7-фенилгептановую кислоту; 2-аминометил-4-метил-6-фенилгексановую кислоту; 2-аминометил-7-(4-фторфенил)-4-метилгептановую кислоту; 2-аминометил-7-(3-фторфенил)-4-метилгептановую кислоту; 2-аминометил-7-(2-фторфенил)-4-метилгептановую кислоту; 2-аминометил-7-(2,4-дифторфенил)-4-метилгептановую кислоту; 2-аминометил-7-(3,4-дифторфенил)-4-метилгептановую кислоту; 2-аминометил-4-метил-7-(2-трифторметилфенил)гептановую кислоту; 2-аминометил-4-метил-7-(3-трифторметилфенил)гептановую кислоту; 2-аминометил-4-метил-7-(4-трифторметилфенил)гептановую кислоту; 2-аминометил-4-метил-6-фениламиногексановую кислоту; 2-аминометил-4-метил-7-фениламиногептановую кислоту; 2-аминометил-4-метил-8-фениламинооктановую кислоту;(2R,4S)-2-аминометил-6-циклопропил-4-этилгексановую кислоту. Другие конкретные воплощения данного изобретения включают в себя следующие соединения формулы IIА и их фармацевтически приемлемые соли: 2-аминометил-4-метилгексановую кислоту;-9 008709 Данное изобретение также относится к соединениям формулы III и к их фармацевтически приемлемым солям, где R3 такой, как определено выше для формулы I. Данное изобретение также относится к соединениям формулы IV и к их фармацевтически приемлемым солям, где R1 и R3 такие, как определено выше для соединений формулы I. Другие конкретные воплощения данного изобретения включают в себя следующие соединения формулы IV и их фармацевтически приемлемые соли: 2-аминометил-6-циклопропил-5-метилгексановую кислоту; 2-аминометил-6-циклобутил-5-метилгексановую кислоту; 2-аминометил-6-циклопентил-5-метилгексановую кислоту; 2-аминометил-6-циклогексил-5-метилгексановую кислоту; 2-аминометил-7-циклопропил-5-метилгептановую кислоту; 2-аминометил-7-циклобутил-5-метилгептановую кислоту; 2-аминометил-7-циклопентил-5-метилгептановую кислоту; 2-аминометил-7-циклогексил-5-метилгептановую кислоту; 2-аминометил-8-циклопропил-5-метилоктановую кислоту; 2-аминометил-8-циклобутил-5-метилоктановую кислоту; 2-аминометил-8-циклопентил-5-метилоктановую кислоту; 2-аминометил-8-циклогексил-5-метилоктановую кислоту; 2-аминометил-5-метилгептановую кислоту; 2-аминометил-5-метилоктановую кислоту; 2-аминометил-5-метилгептановую кислоту; 2-аминометил-5-метилнонановую кислоту;(2R,6R)-2-аминометил-5-метилнонановую кислоту. Данное изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III или IV или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения расстройств или состояний, выбранных из эпилепсии, обморочного состояния, фибромиалгии, гипокинезии, черепно-мозговых расстройств, приступов прилива, эссенциального тремора, зависимости и пристрастия к синтетическим препаратам (например, зависимость или пристрастие к алкоголю, амфетаминам (или к амфетаминподобным веществам),кофеину, марихуане, кокаину, героину, галлюциногенам, табаку, ингаляторным и аэрозольным пропеллентам, никотину, опиоидам, производным фенилглицидина, седативным препаратам, гипнотическим средствам, бензодиазепинам и другим анксиолитикам) и синдромов отмены, связанных с такой зависимостью или пристрастием, поведения человека, подверженного пагубным привычкам, таким как азартные игры, мигрени, спастичности, артрита, синдрома раздраженной кишки (IBS), хронической боли, острой боли, нейропатической боли, сосудистой головной боли, синусной головной боли, воспалительных заболеваний (например, ревматоидный артрит, остеоартрит, псориаз), диуреза, предменструального синдрома, предменструального дистрофического расстройства, шума в ушах и желудочных заболеваний у млекопитающих, включая человека, который заключается во введении млекопитающему, при необходимости его лечения, терапевтически эффективного количества соединения формул I, IA, IA-1, IA-2, IB, IС,II, IIА, III или IV или его фармацевтически приемлемой соли. Настоящее изобретение также относится к лечению нейродегенеративных расстройств с термином острый мозговой синдром. Он включает в себя, но ими не ограничивается, инсульт, травму головного мозга и асфиксию. Инсульт относится к заболеванию сосудов мозга и также может называться острым повреждением сосудов мозга (CVA) и включать в себя острый тромбоэмболический инсульт. Инсульт включает в себя как очаговую, так и обширную ишемию. Также к нему относятся кратковременные ишемические атаки и другие нарушения кровообращения мозга, сопровождающие ишемию мозга, например такие, как бывают у пациентов, подвергающихся эндартерэктомии сонных артерий или другим хирургическим вмешательствам на сосуде или сосудах мозга, или при диагностических процедурах на сосудах, включая ангиографию мозга и т.п. Соединения формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III и IV также могут быть эффективны для лечения травмы головного мозга, травмы спинного мозга или повреждения при общем кислородном голодании, гипоксии, гипогликемии, гипотензии, а также сходных повреждений, наблюдаемых при эмболии,гиперфузии и гипоксии. Также они могут быть эффективны для профилактики повреждения нейронов,которое встречается при коронарном шунтировании, геморрагическом инсульте, перенатальной асфиксии, остановке сердца и эпилептическом статусе. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из группы, включающей в себя делириум, деменцию и амнезию, и других когнетивных или нейродегенеративных расстройств, таких как болезнь Паркинсона (PD), болезнь Гентингтона (HD), болезнь Альцгеймера, старческое слабоумие, деменция при болезни Альцгеймера, расстройства памяти, сосудистая деменция и другие деменции, например деменция при болезни, вызванной вирусом иммунодефицита человека (ВИЧ), деменция в связи с травмой головного мозга, деменция при болезни Паркинсона, деменция при болезни Гентингтона, деменция при болезни Пика, деменция при болезни Крейтцфельдта-Якоба,деменция в связи со смешанными заболеваниями; двигательные расстройства, такие как акинезия, дискинезия, включая семейную пароксизмальную дискинезию, спастичность, синдром Туретта, синдром Скота, PALSYS и ригидно-акинетический синдром; экстрапирамидальные расстройства движения, такие как расстройства движения, вызванные лекарственными препаратами, например паркинсонизм, вызванный длительным приемом нейролептиков, нейролептический злокачественный синдром, острая дистония, вызванная приемом нейролептиков, острая акатезия, вызванная приемом нейролептиков, поздняя дискинезия, вызванная приемом нейролептиков, и постуральный тремор, вызванный приемом лекарственных препаратов; синдром Дауна; димиелинизирующие заболевания, такие как рассеянный склероз(MS) и боковой амиотрофический склероз (ALS), периферическая нейропатия, например нейропатия при диабете и химиотерапии, и постгерпетическая невралгия, невралгия тройничного нерва, межреберная невралгия или невралгия с сегментарными вегетативными расстройствами и другие невралгии; и цереброваскулярные заболевания при остром или хроническом цереброваскулярном нарушении, таком как инфаркт мозга, субарахноидальное кровоизлияние или отек мозга у млекопитающих, включая человека,который заключается во введении указанному млекопитающему количества соединения формул I, IA,IA-1, IA-2, IB, IС, II, IIА, III или IV или его фармацевтически приемлемой соли, эффективного для лечения таких расстройств или состояний. Боль относится к острой, а также хронической боли. Острая боль обычно кратковременна и связана с гиперактивностью симпатической нервной системы. Примерами являются послеоперационная боль и аллодиния. Хроническая боль обычно определяется как боль, продолжающаяся от 3 до 6 месяцев, и- 11008709 включает в себя соматогенную и психогенную боль. Другие виды боли являются ноцептивными. Примеры типов боли, лечение которых может осуществляться с помощью соединений формул I, IA,IA-1, IA-2, IB, IС, II, IIА, III и IV по настоящему изобретению и их фармацевтически приемлемых солей,включают в себя боль при повреждении мягких тканей и при периферическом повреждении, такую как острая травма, боль, связанную с остеоартритом и ревматоидным артритом, скелетно-мышечную боль,такую как боль, испытываемую после травмы; боль в спине, зубную боль, синдромы миофасциальной боли, боль при эпизиотомии и боль в результате ожога; глубокую и висцеральную боль, такую как сердечная боль, мышечная боль, глазная боль, ротолицевая боль, например зубная боль, абдоминальная боль, гинекологическая боль, например дисменорея, родовые схватки и боль при эндометриозе; боль,связанную с поражением нервов и корешков, такую как боль, связанная с периферическими нервными расстройствами, например сдавливание нерва и авульсия плечевого сплетения, ампутация, периферическая нейропатия, прозопалгия, атипическая лицевая боль, повреждение корешка нерва, невралгия тройничного нерва, нейропатия нижней части спины, неврологическая боль при ВИЧ, нейропатическая боль при раке, нейропатическая боль при диабете и арахноидит; нейропатическую и ненейропатическую боль,связанную с карциномой, часто называемую раковая боль; боль в центральной нервной системе, такую как боль, обусловленная повреждением спинного мозга или ствола головного мозга; боль нижней части спины; ишиас; фантомную боль конечности, головную боль, включая мигрень и другие головные боли сосудистого генеза, острую или хроническую головную боль напряжения, кластерную головную боль,височно-нижнечелюструю боль и боль, связанную с гайморовыми пазухами; боль в результате анкилозирующего спондилита и подагры; боль, вызванную повышенным сокращением мочевого пузыря; послеоперационную боль; боль шрама; и хроническую ненейропатическую боль, такую как боль, связанная с фибромиалгией, ВИЧ, ревматоидным и остеоартритом, болью в суставах и миалгией, вывихом, растяжением и травмой, такой как перелом кости; и послеоперационную боль. Кроме того, при повреждении или инфекции периферических чувствительных нервов возникает другой тип боли. Он включает в себя, но этим не ограничивается, боль при травме периферического нерва, герпесной вирусной инфекции, сахарном диабете, фибромиалгию, каузалгию, боль при авульсии нервного сплетения, нейроме, ампутации конечности и васкулите. Причиной нейропатической боли также служит поражение нервов при хроническом алкоголизме, инфекции, вызванной вирусом иммунодефицита человека, гипотироидизме, уремии или витаминной недостаточности. Нейропатическая боль включает в себя, но этим не ограничивается, боль, вызванную поражением нерва, как, например, боль при диабете. Психогенной болью является боль, которая не имеет органического происхождения, такая как боль нижней части спины, атипическая лицевая боль и хроническая головная боль. К другим типам боли относятся боль при воспалении, боль при остеоартрите, невралгия тройничного нерва, боль при раке, диабетическая нейропатия, синдром беспокойных ног, острая герпетическая и постгерпетическая невралгия, каузалгия, авульсия плечевого сплетения, затылочная невралгия, подагра,фантомные боли конечностей, боль при ожоге и другие формы невралгии, нейропатический и идиопатический болевой синдром. Соединения по данному изобретению также эффективны для лечения депрессии. Депрессия может возникать в результате органического заболевания, вторично при стрессе, связанном с потерей близкого,или идиопатически. Существует тесная связь с наследственным происхождением некоторых форм депрессий, что предполагает механистическую причину, по крайней мере, некоторых форм депрессии. Первичная диагностика депрессии основывается на количественной оценке изменений настроения пациента. Эти оценки настроения обычно осуществляются врачом или оцениваются нейропсихиатром с использованием утвержденной шкалы оценок, такой как шкала оценки депрессии по Гамильтону или краткая шкала оценок психиатра. Было разработано большое количество других шкал для определения и измерения степени изменения настроения у пациентов с депрессией, такой как инсомния, трудности сосредоточения, снижение энергии, чувство никчемности и вины. Стандарты для диагностики депрессии, а также психиатрические диагностики собраны в Diagnostic and Statistical Manual of Mental Disorders (FourthEdition), называемом руководство DSM-IV-R, опубликованном American Psychiatric Association, 1994. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из группы, включающей аффективные расстройства, такие как депрессия, или более конкретно такие как депрессивные расстройства, например единичный депрессивный эпизод или реккурентное депрессивное расстройство, дистимические расстройства, депрессивный невроз и невротическая депрессия, депрессия по меланхолическому типу, включая анорексию, потерю веса, инсомнию, раннее просыпание и психомоторное отставание в развитии, атипическую депрессию (или реактивную депрессию), включая повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность, сезонное аффективное расстройство и депрессию у детей; или биполярные аффективные расстройства или маниакальная депрессия, например биполярное расстройства I типа, биполярное расстройство II типа и циклотимические расстройства; расстройства личности и поведения; тревожные расстройства, такие как паническое расстройство с агрофобией или без агрофобии, агрофобия с паническим расстройством в анамнезе, например специфические фобии, например боязнь животных, социальная тревога, социальная фобия, обсес- 12008709 сивно-компульсивное расстройство, стрессовые расстройства, включая посттравматическое стрессовое расстройство и острую реакцию на стресс, и генерализованные тревожные расстройства; пограничное расстройство личности; шизофрения и другие психотические расстройства, например шизофреноподобные расстройства, шизоаффективные расстройства, бредовые расстройства, кратковременные психотические расстройства, психотические смешанные расстройства, психотические расстройства с бредом или галлюцинациями, психотические эпизоды тревоги, тревога, связанная с психозом, психотические расстройства настроения, такие как депрессивный эпизод тяжелой степени; аффективные расстройства, связанные с психотическими расстройствами, такие как острая мания и депрессия, связанная с биполярным расстройством, аффективные расстройства, связанные с шизофренией; расстройства поведения, связанные с задержкой умственного развития, аутизм и сопутствующие расстройства у млекопитающих, включая человека, который включает в себя введение указанному млекопитающему количества соединения формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III или IV или его фармацевтически приемлемой соли, которое эффективно для лечения такого расстройства или состояния. Соединения по данному изобретению также эффективны для лечения расстройств сна. Расстройствами сна являются нарушения, которые влияют на способность засыпать и/или спать, которые включают в себя слишком долгий сон или которые возникают в результате ненормального поведения, связанного со сном. Расстройства включают в себя, например, инсомнию, бессонницу, вызванную приемом лекарственных препаратов, гиперсомнию, нарколепсию, синдром апноэ во сне и парасомнию. Данное изобретение также относится к способу лечения расстройств или состояний, выбранных из группы, включающей в себя нарушения сна (например, инсомния, бессонница, связанная с приемом лекарственных препаратов, нарушение REM-сна, гиперсомния, нарколепсия, нарушение цикла сна, синдром апноэ во сне, парасомнии и нарушения сна, связанные со сменной работой и нерегулярными часами работы) у млекопитающих, включая человека, который включает в себя введение указанному млекопитающему количества соединения формул I, IA, IA-1, IA-2, IB, IС, II, IIA, III или IV или его фармацевтически приемлемой соли, которое эффективно для лечения такого расстройства или состояния. Соединения формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III, и IV содержат по крайней мере один хиральный центр и, таким образом, могут существовать в различных энантиомерных и диастереомерных формах. Данное изобретение относится ко всем оптическим изомерам и всем стереоизомерам соединений формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III и IV как в виде рацемических смесей, так и в виде отдельных энантиомеров и диастереомеров таких соединений и их смесям и ко всем фармацевтическим композициям и способам лечения, определенным выше, их содержащим или используемым, соответственно. Отдельные изомеры могут быть необязательно получены известными способами, такими как оптическое разделение, оптически селективное взаимодействие или хроматографическое разделение при получении конечного продукта или его промежуточного соединения. Отдельные энантиомеры соединений по данному изобретению могут иметь преимущества по сравнению с рацемическими смесями этих соединений при лечении различных расстройств или состояний. Настоящее изобретение также включает в себя меченные изотопами соединения, которые идентичные соединениям, указанным в формулах I, IA, IA-1, IA-2, IB, IС, II, IIА, III и IV, но фактически один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть введены в соединения по настоящему изобретению, включают в себя изотопы водорода, углерода, азота,кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 11 С, 14 С, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36 Сl, соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеуказанные изотопы и/или другие изотопы других атомов, находятся в рамках настоящего изобретения. Определенные соединения по настоящему изобретению, меченные изотопами, например соединения, в которыe введены радиоактивные изотопы, такие как 3 Н и 14 С, эффективны в качестве лекарственного препарата и/или анализа тканевой дифференцировки субстрата. Изотопы трития, то есть 3 Н, и углерода-14, то есть 14 С, являются особенно предпочтительными изза простоты своего получения и обнаружения. Кроме того, замещение тяжелыми изотопами, такими как дейтерий, то есть 2 Н, может давать определенные терапевтические выгоды из-за большей метаболической стабильности, например повышенного in vivo периода полураспада, или сниженных доз, необходимых для введения, и поэтому могут быть в некоторых случаях предпочтительными. Соединения, меченные изотопами, формулы I по данному изобретению и их пролекарства обычно могут быть получены способами, описанными в схемах и/или в примерах и получении, описанных ниже, заменяя реагент, немеченный изотопом, на легко доступный реагент, меченный изотопом. Использующийся здесь термин алкил, если не указано иного, включает в себя замещенные моновалентные углеводородные радикалы с прямыми, разветвленными или циклическими группами или их сочетаниями. Примеры алкильных групп включают в себя, но ими не ограничиваются, метил, этил,пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил, циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, норборнил и т.п. Использующийся здесь термин алкокси, если не указано иного, обозначает алкил-О-, где ал- 13008709 кил такой, как определено выше. Примеры алкокси групп включают в себя, но ими не ограничиваются, метокси, этокси, пропокси, бутокси и пентокси. Использующийся здесь термин лечение относится к реверсированию, облегчению, ингибированию развития или профилактики расстройства или состояния, к которому относится такой термин, или профилактике одного или нескольких симптомов таких состояния или расстройства. Использующийся здесь термин лечение относится к акту лечения, такому как лечение, непосредственно определенное выше. Так как аминокислоты являются амфотерными, фармакологически совместимые соли могут быть солями таких соответствующих неорганических или органических кислот, например хлористо-водородной, серной, фосфорной, уксусной, щавелевой, молочной, лимонной, яблочной, салициловой, малоновой,малеиновой, янтарной и аскорбиновой. Начиная с соответствующих гидроксидов или карбонатов, образуются соли щелочных металлов или щелочно-земельных металлов, например натрия, калия, магния или кальция. Соли с ионами четвертичного аммония также могут быть получены, например, с ионом тетраметиламмония. Эффективность перорального введения препарата зависит от эффективности транспорта лекарственного препарата через слизисто-эпителиальную оболочку и его эффективности в кишечно-печеночной циркуляции. Лекарственные препараты, которые эффективны после парентерального введения, но менее активны при пероральном, или те, чей период полураспада в плазме считается слишком коротким, могут быть химически модифицированы в пролекарственную форму. Пролекарство представляет собой лекарственный препарат, который может быть химически модифицирован и может быть биологически неактивным с позиции его действия, но который может быть деградирован или модифицирован одним или несколькими ферментативными или другими процессами invivo до родительской биоактивной формы. Это химически модифицированное лекарственное средство, или пролекарство, может иметь другие фармакокинетические характеристики, чем родительское лекарственное средство, что делает возможным его более легкую абсорбцию через слизисто-эпителиальную оболочку, лучше образует соль и/или более растворимо, улучшенную системную стабильность (для увеличения периода полураспада в плазме, например). Этими химическими модификациями могут быть: 1) производные сложного эфира или амида, который может расщепляться с помощью, например,эстеразы или липазы. В случае производных сложного эфира сложный эфир может быть получен из группы карбоновой кислоты молекулы лекарственного препарата известными способами. В случае амидных производных амид может быть получен из группы карбоновой кислоты или аминогруппы молекулы лекарственного препарата известными способами; 2) пептиды, которые могут быть распознаны специфическими или неспецифическими протеиназами. Пептид может быть присоединен к молекуле лекарственного препарата посредством образования амидной связи с группой аминокислоты или карбоновой кислоты молекулы лекарственного препарата известными способами; 3) производные, которые накапливаются в области действия вследствие мембранной селекции пролекарственной формы или модифицированной пролекарственной формы; 4) любые сочетания 1-3. Последние исследования в экспериментах на животных показали, что пероральная абсорбция определенных препаратов может увеличиваться за счет препаратов мягких четвертичных солей. Четвертичная соль называется мягкой четвертичной солью, так как, в отличие от нормальных четвертичных солей, например R-N+(CH3)3, она может высвобождать активный лекарственный препарат при гидролизе. Мягкие четвертичные соли имеют эффективные физические свойства по сравнению с основным лекарственным препаратом или его солями. Растворимость в воде может увеличиваться по сравнению с другими солями, такими как гидрохлорид, но, более важно, лекарственный препарат может лучше абсорбироваться из кишечника. Повышенная абсорбция, возможно, обусловлена тем фактом, что мягкая четвертичная соль имеет свойства поверхностно-активного вещества и способна образовывать мицеллы и неионизированные ионные пары с желчными кислотами и т.д., которые способны более эффективно проникать сквозь кишечный эпителий. Пролекарство после абсорбции быстро гидролизируется с высвобождением активного родительского лекарственного препарата. Пролекарства соединений формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III и IV входят в рамки данного изобретения. Пролекарства и мягкие препараты известны в данной области (Palomino E., Drugs of the Future,1990; 15(4): 361-368). Последние две цитаты приведены здесь в качестве ссылки. Определенные соединения по настоящему изобретению могут существовать в нерастворимых формах, таких как сольватированные формы, включая гидратированные формы. Обычно сольватированные формы, включая гидратированные формы, эквивалентны нерастворимым формам и входят в рамки настоящего изобретения. Подробное описание изобретения Соединения по данному изобретению могут быть получены, как описано ниже. В схемах реакций и следующем за ними обсуждении структурные формулы I, IA, IA-1, IA-2, IB, IС, II, IIА, III и IV и радикалы R1, R2, R3, R4, R5 и R6, если не указано иного, такие, как определено выше.- 14008709 Существуют разнообразные способы получения хиральных и рацемических -аминокислот. Такие способы могут быть найдены в Enantioselective Synthesis of -Amino Acids, Juaristi, Eusebio; Editor.USA, 1997, Wiley-VCH, New York, N.Y. Способы, описанные ниже, иллюстрируют способы, которые могут быть использованы для получения таких соединений, но не ограничивают рамки изобретения. Способ А В соответствии со способом Lzr, et al., Synth. Commun., 1998, 28(2), 219-224, соединения формулыIA могут быть получены путем кипячения с обратным холодильником соединений формулы 1 в спиртовом растворителе, таком как этанол, в присуствтии малоновой кислоты и ацетата аммония. Альдегиды формулы 1 могут быть получены из коммерчески доступных веществ в способах, хорошо известных специалисту в данной области. Соединения, которые могут быть получены вышеуказанными способами, включают в себя, но ими не ограничиваются, следующие соединения: 3-амино-6-циклопропил-5-метилгексановую кислоту; 3-амино-6-циклобутил-5-метилгексановую кислоту; 3-амино-6-циклопентил-5-метилгексановую кислоту; 3-амино-6-циклогексил-5-метилгексановую кислоту; 3-амино-7-циклопропил-5-метилгептановую кислоту; 3-амино-7-циклобутил-5-метилгептановую кислоту; 3-амино-7-циклопентил-5-метилгептановую кислоту; 3-амино-7-циклогексил-5-метилгептановую кислоту; 3-амино-8-циклопропил-5-метилоктановую кислоту; 3-амино-8-циклобутил-5-метилоктановую кислоту; 3-амино-8-циклопентил-5-метилоктановую кислоту; 3-амино-8-циклогексил-5-метилоктановую кислоту; 3-амино-6-циклопропил-5,5-диметилгексановую кислоту; 3-амино-6-циклобутил-5,5-диметилгексановую кислоту; 3-амино-6-циклопентил-5,5-диметилгексановую кислоту; 3-амино-6-циклогексил-5,5-диметилгексановую кислоту; 3-амино-7-циклопропил-5,5-диметилгептановую кислоту; 3-амино-7-циклобутил-5,5-диметилгептановую кислоту; 3-амино-7-циклопентил-5,5-диметилгептановую кислоту; и 3-амино-7-циклогексил-5,5-диметилгептановую кислоту. Способ В- 15008709 Использование добавления хирального амина к ,-ненасыщенным системам в качестве синтетического метода получения -аминокислот, как показано на схеме способа В выше, было описано ранее(смотри, например, S.G. Davies et al., J. Chem. Soc. Chem. Commun, 1153, 1993; S.G. Davies, Synlett., 1994,117; Ishikawa et al., Synlett., 1998, 1291; Hawkins, J. Org. Chem., 1985, 51, 2820). Ссылаясь на способ В выше, соединения формулы IA могут быть получены из соответствующих соединений формулы 7, гдеPG представляет собой подходящую сложноэфирную защитную группу, которая может быть удалена гидролизом или гидрированием, в условиях, хорошо известных специалисту в данной области. (Смотри Т.W. Greene и P.G.M. Wuts., Protective groups in organic synthesis, Wiley, 1991 для подробного описания введения и удаления подходящих защитных групп.) Например, это взаимодействие может осуществляться в условиях гидролиза путем обработки подходящей кислотой, такой как соляная кислота или серная кислота, при температуре между приблизительно комнатной температурой и температурой кипячения реакционной смеси с обратным холодильником, предпочтительно при температуре кипячения с обратным холодильником, или путем обработки соответствующим неорганическим основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития, предпочтительно гидроксид натрия, при температуре между приблизительно комнатной температурой и температурой кипячения с обратным холодильником, предпочтительно при комнатной температуре. Эту реакцию предпочтительно осуществляли,используя соляную кислоту при температуре кипячении с обратным холодильником. Однако если PG является трет-бутилом, то реакцию предпочтительно осуществляют в трифторуксусной кислоте (ТФУ). Если PG является основной группой, то гидролиз может быть осуществлен в кислых условиях с использованием способов, хорошо известных специалисту в данной области, например с использованием гидроксида натрия или калия. Соединения формулы 7 могут быть получены из соответствующих соединений формулы 6 в условиях гидрирования, которые хорошо известны специалисту в данной области. Например, эту реакцию можно проводить путем обработки соединений формулы 6 в присутствии катализатора на основе металла палладия, такого как, например, гидроксид палладия на угле, или палладий на угле, или никель Ренея,в растворителе, таком как, например, метанол, этанол или тетрагидрофуран, в атмосфере водорода (с давлением между приблизительно 1 и 5 атм) с получением желаемого соединения формулы 7. Предпочтительно реакцию проводили, используя палладий на угле в этаноле в атмосфере водорода при давлении приблизительно 1 атм. Соединения формулы 6 могут быть получены обработкой соответствующих соединений формулы 4 соответствующими аминами, такими как (R)-(+)-N-бензилметилбензиламин, (S)-(-)-N-бензилметилбензиламин, с предварительной обработкой соответствующим основанием, таким как диизопропиламид лития, н-бутил лития или бис(триметилсилил)амид лития или калия, в растворителе, таком как этиловый эфир или предпочтительно тетрагидрофуран (ТГФ), при температуре от около -80 до около 25 С и с последующим добавлением соответствующего соединения формулы 4. Стереохимия окружения атома азота амина будет определять стереохимию окружения атома окончательного продукта. Предпочтительно эту реакцию проводят, используя либо (R)-(+)-N-бензилметилбензиламин, либо (S)-(-)-N-бензил-метилбензиламин, с предварительным удалением протона н-бутил-литием в тетрагидрофуране, при комнатной температуре около -78 С в соответствии со способом, описанным Bull, Steven D.; Davies, StephenG.; и Smith, Andrew D., J. Chem. Soc., Perkin Trans. 1, 2001, 22, 2931-2938. Предпочтительно эту реакцию проводят, используя либо (R)-(+)-N-бензилметилбензиламин, либо (S)-(-)-N-бензилметилбензиламин, с предварительным удалением протона н-бутил-литием в тетрагидрофуране, при температуре около -78 С в соответствии со способом, описанным Bull, Steven D.; Davies, Stephen G.; and Smith, AndrewD., J. Chem. Soc., Perkin Trans. 1, 2001, 22, 2931-2938. Соединения формулы 4 могут быть получены из соответствующих соединений формулы 3 обработкой их соответствующим фосфонатным эфиром в присутствии подходящего основания, такого как гидрид натрия, диизопропиламид лития или триэтиламин, и либо хлорида лития, либо бромида лития в растворителе, таком как простой эфир или ТГФ. Предпочтительно соединение формулы 3 подвергают взаимодействию с эфиром фосфоновой кислоты (ALK = метил, этил, изопропил, бензил или т.п.) в присутствии бромида лития и триэтиламина в тетрагидрофуране при приблизительно комнатной температуре. Соединения формулы 3 могут быть получены из коммерчески доступных веществ с использованием способов, хорошо известных специалисту в данной области. Необходимо принять во внимание, что соединения формулы 3 могут обладать одним или несколькими стерическими центрами. Используя способы,описанные выше, могут быть получены соединения конкретных стерических конфигураций. Соединения, которые могут быть получены в соответствии со способом, включают в себя, но ими не ограничиваются, следующие соединения: Диастереоалкилирование имидов, таких как имиды формулы 10, с получением хиральных сукцинатных аналогов, таких как аналоги формулы 11, ранее было описано как метод, используемый при получении -аминокислоты (смотри, например, Evans et al., J. Org. Chem., 1999, 64, 6411; Sibi andDeshpande, J. Chem. Soc. Perkin Trans. 1, 2000, 1461; Arvanitis et al., J. Chem. Soc. Perkin Trans. 1, 1998, 521). Соединения структуры 11 могут быть получены из соединений структуры 10 в присутствии подходящего соответствующим образом модифицированного сложного эфира (PG, как определено выше, LG = Вr, или I, или Сl), такого как, например, трет-бутил бромацетат, бензил бромацетат, с органометалличе- 17008709 ским основанием, таким как, например, диизопропиламид лития, или бис(триметилсилил)амид лития,или бис(триметилсилил)амид натрия и т.п., в растворителе, таком как, например, тетрагидрофуран, простой эфир и т.п. Реакция может быть осуществлена с использованием бис(триметилсилил)амида натрия в тетрагидрофуране при -78 С и обработкой полученного промежуточного соединения трет-бутил бромацетатом при -78 до -30 С. Соединения формулы 12 могут быть получены гидролизом соответствующих соединений формулы 11 в присутствии гидроксида лития и перекиси водорода в растворителе, таком как вода или ТГФ, при температуре от около 0 С до приблизительно комнатной температуры. Предпочтительно эту реакцию осуществляли, используя перекись водорода и гидроксид лития в водном тетрагидрофуране при около 0 С в соответствии со способом, описанным в литературе (смотри, Yuen P.-W., Kanter G.D., Taylor С.P.,and Vartanian M.G., Bioorganic and Medicinal Chem. Lett., 1994; 4(6): 823-826). Обработка соединения формулы 12 дифенилфосфорилазидом в присутствии подходящего спирта,такого как трет-бутанол, бензиловый спирт или п-метоксибензиловый спирт, в подходящем растворителе, таком как толуол, бензол или ТГФ, при температуре от около 50 С до около температуры кипячения реакционной смеси с обратным холодильником давала соответствующее соединение формулы 13, где R5 представляет собой метил, этил, трет-бутил, бензил или п-метоксибензил. R5 зависит от выбора используемого спирта. Предпочтительно эту реакцию осуществляли, используя растворитель толуол в присутствии п-метоксибензилового спирта в условиях кипячения с обратным холодильником. Соединения формулы 13 могут быть преобразованы в желаемые соединения формулы IA путем гидролиза или гидрирования в условиях, хорошо известных специалисту в данной области (cмотри Т.W.Greene и P.G.M. Wuts., Protective groups in organic synthesis, Wiley, 1991, для подробного описания получения и удаления подходящих защитных групп). Например, эту реакцию можно проводить в гидролитических условиях обработкой соответствующей кислотой, такой как соляная кислота или серная кислота, при температуре от приблизительно комнатной температуры до температуры кипячения реакционной смеси с обратным холодильником, предпочтительно при температуре кипячения с обратным холодильником, или обработкой соответствующим неорганическим основанием, таким как гидроксид натрия,гидроксид калия или гидроксид лития, предпочтительно гидроксид натрия, при температуре от приблизительно комнатной температуры до температуры кипячения с обратным холодильником, предпочтительно при приблизительно комнатной температуре. Эту реакцию предпочтительно осуществляли, используя соляную кислоту при температуре кипячения с обратным холодильником. Однако если PG представляет собой трет-бутил, то реакцию предпочтительно проводили в трифторуксусной кислоте (ТФУ). Если PG представляет собой основную группу, гидролиз можно проводить в основных условиях, используя способы, хорошо известные специалисту в данной области, например, используя гидроксид натрия или калия. Соединения формулы 10 могут быть получены обработкой соответствующих соединений формулы 8 аминооснованием, таким как триэтиламин, в присутствии триметилацетилхлорида в легколетучем растворителе, таком как ТГФ, и затем обработкой промежуточных соединений, образующихся в этой реакции [in situ] хиральным оксазолидиноном формулы 9. Примерами других оксазолидинонов, которые могут быть использованы в этом способе, являются (4S)-(-)-4-изопропил-2-оксазолидинон; (S)-(-)-4-бензил 2-оксазолидинон; (4S,5R)-(-)-4-метил-5-фенил-2-оксазолидинон; (R)-(+)-4-бензил-2-оксазолидинон, (S)(+)-4-фенил-2-оксазолидинон; (R)-(-)-4-фенил-2-оксазолидинон; (R)-4-изопропил-2-оксазолидинон; и(4R,5S)-(+)-4-метил-5-фенил-2-оксазолидинон) и хлорид лития. Предпочтительно это взаимодействие осуществляли обработкой кислоты формулы 8 триметилацетилхлоридом и триэтиламином в тетрагидрофуране при около -20 С, а затем обработкой полученного в этой реакции промежуточного соединения оксазолидиноном формулы 9 и хлоридом лития при приблизительно комнатной температуре в соответствии со способами, описанными в литературе (cмотри Но G.-J. and Mathre D.J., J. Org. Chem., 1995; 60: 2271-2273). Альтернативно, соединения формулы 10 могут быть получены обработкой соответствующих соединений формулы 9 хлорангидридом кислоты, полученным при обработке соответствующего соединения формулы 8 оксалилхлоридом, в растворителе, таком как дихлорметан, в присутствии диметилформамида (ДМФ). Кислоты формулы 8 могут быть получены из коммерчески доступных соединений с использованием способов, хорошо известных специалисту в данной области. Эти кислоты могут иметь один или несколько хиральных центров. Использование цитронеллилбромида и цитронеллола в синтезе таких кислот описано в примерах 1, 2 и 3 данной заявки. Соединения, которые могут быть получены в соответствии с вышеуказанным способом С, включают в себя, но ими не ограничиваются, следующие соединения:(3S,5S)-3-амино-7-циклогексил-5-метилгептановую кислоту. Альтернативно, как показано на реакционной схеме (способ D) ниже, соединения формулы 11 могут быть обработаны соотвествующей кислотой (например, трифторуксусной кислотой (ТФУ), если используется трет-бутиловый эфир) с получением соответствующих соединений формулы 14, которые затем могут подвергаться перегруппировке Курциуса (где R5 такой, как указано выше) с получением соответствующих соединений формулы 15 (детальное описание этого метода смотри в Arvanitis et al., J.Chem. Soc. Perkin Trans. 1, 1998, 521). Последующий гидролиз имидной группы (с выходом соответствующих соединений формулы 16) и карбаматной группы дает желаемые -аминокислоты формулы II. Соединение 16 может быть получено из соединения 15, как описано выше для преобразования соединений формулы 11 в соединения формулы 12. Соединения формулы 17 могут быть получены из соответствующих соединений формулы 16 путем обработки сильной кислотой, такой как соляная кислота или т.п., или сильным основанием, таким как гидроксид натрия или калия, или если R5 представляет собой бензил или п-метоксибензил, в условиях гидрирования с использованием палладия на угле в этаноле или ТГФ в атмосфере водорода. Этот метод, который сохраняет стереохимию вокруг хирального центра соединений формулы 11, который также имеется в продукте формулы II, описан в примере 4 данной заявки. Способ D Соединения, которые могут быть получены в соответствии с данным способом, включают в себя,но ими не ограничиваются:(2R,4S)-2-аминометил-6-циклогексил-4-метилгексановую кислоту; Другие альтернативные методы синтеза -замещенных -аминокислот, которые могут быть использованы для получения соединений по данному изобретению, включают в себя методы, описанные Juaristial., J. Chem. Soc. Perkin Trans. 1, 1998, 521, как показано на схеме способа Е ниже. Способ Е Способ F ниже иллюстрирует альтернативный способ получения соединений формулы II. Способ F В соответствии со способом, описанным Hoffmann-La Roche (FR 1377736 19641106), соединения формулы 3 могут быть получены из ненасыщенных цианоэфиров формулы 2 путем восстановления и гидролиза. В свою очередь, цианоэфиры формулы 2 могут быть получены путем конденсации по Кновенагелю альдегидов 1 с эфирами цианоуксусной кислоты (например, Paine, J.В.; Woodward, R.В.; Dolphin,D., J. Org. Chem. 1976, 41, 2826). Альдегиды формулы 1 могут быть получены из коммерчески доступных соединений способами, известными специалисту в данной области. Соединения формул III и IV могут быть получены с использованием способов, аналогичных способам в способе F, что очевидно для специалиста в данной области. Если синтезируется соединение формулы III, то исходный продукт может быть соединением, сходным с соединением формулы 1 способа F,но где водород, присоединенный к карбонильной группе в формуле 1, заменен на метильную группу. Использование хиральных иминов для получения -аминокислот, показанное в способе G ниже,- 20008709 было описано ранее (смотри, например, Tang, Т.P.; Ellman, J.A., J. Org. Chem. 1999, 64, 12-13). Способ G Конечной стадией в вышеуказанной схеме является гидролиз как группы сульфонамида, так и группы сложного эфира. Это взаимодействие обычно проводят, используя сильную кислоту, такую как хлористо-водородная кислота, бромисто-водородная кислота или серная кислота, в растворителе, таком как вода или диоксан или смесь воды и диоксана, при температуре от около 20 до около 50 С, предпочтительно при приблизительно комнатной температуре. Получение соединений по данному изобретению, которое конкретно не описано в вышеуказанной экспериментальной части, может осуществляться при использовании сочетаний взаимодействий, описанных выше, что очевидно специалисту в данной области. При каждом взаимодействии, описанном или проиллюстрированном выше, давление не является важным критерием, если не указано иного. Обычно приемлемым давлением является давление от около 0,5 до около 5 атм, и, с точки зрения удобства, нормальное давление, т.е. около 1 атм, является предпочтительным. Соединения формулы 1, и группа А соединений, и промежуточные вещества, показанные в вышеуказанных схемах, могут быть выделены и очищены обычными способами, такими как перекристаллизация или хроматографическое разделение. Способность соединений по настоящему изобретению связываться с субъединицей 2 кальциевых каналов может быть определена с помощью следующих анализов связывания. Использовали анализ связывания радиолигандов, использующий [3 Н]-габапентин и 2-субъединицу, полученную из головного мозга свиньи (смотри Gee, Nicolas S. et al. The novel anticonvulsant drug,gabapentin (Neurontin), binds to the 2 subunit of a calcium channel. J. Biol. Chem. (1996), 271(10), 576876). Соединения по данному изобретению связывается в наномолярных концентрациях с микромолярной аффинностью с 2 белком. Например, R-3-амино-5,9-диметилдекановая кислота связывается с 527 нМ аффинностью с 2 белком, (3S,5S)-3-амино-5-метилоктановая кислота связывается с 1 мкМ аффинностью, (2R,4R)-2-аминометил-4-метилгептановая кислота связывается с 29 нМ аффинностью, 2-аминометил-4,4-диметилгептановая кислота связывается с 83 нМ аффинностью. Активность in vivo соединений по данному изобретению может быть определена на моделях гиперальгезии (смотри Sluka, К., et al. 2001, Unilateral Intramuscular Injections Of Acidic Saline Produce A Bilateral,Long-Lasting Hyperalgesia, Muscle Nerve 24: 37-46; Dixon, W., 1980, Efficient analysis of experimentalD.E., A Simple and Reliable Conflict Procedure For Testing Anti-Anxiety Agents, Psychopharmacologia 21:1-7, 1971) у животных. Соединения по настоящему изобретению и их фармацевтически приемлемые соли могут вводиться млекопитающим либо перорально, либо парентерально (например, подкожно, внутривенно, внутримышечно, интрастернально и методами инфузии), ректально, защечно или интраназально. Новые соединения по настоящему изобретению могут вводиться самостоятельно или в сочетании с фармацевтически приемлемыми носителями или разбавителями любым ранее указанным путем, и такое введение может осуществляться одной или несколькими дозами. Более конкретно, новые терапевтические агенты по данному изобретению могут вводиться в различных лекарственных формах, т.е. они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, твердых конфет, суппозиториев, желе, гелей, паст, мазей, водных- 21008709 суспензий, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают в себя твердые разбавители или наполнители, стерильные водные среды и различные нетоксические органические растворители и т.д. Кроме того, пероральные фармацевтические композиции могут подходящим образом быть подслащены и/или ароматизированы. Обычно массовое отношение новых соединений по данному изобретению и фармацевтически приемлемого носителя находится в области от около 1:6 до около 2:1 и предпочтительно от около 1:4 до около 1:1. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат дикальция и глицин, могут использоваться вместе с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный крахмал или крахмал из тапиоки), альгиновая кислота и некоторые сложные силикаты, вместе с гранулирующими связующими агентами, такими как поливинилпирролидон, сахароза, желатин и гуммарабик. Дополнительно, в таблетках часто очень эффективно использовать смачивающие агенты,такие как стеарат магния, лаурил сульфат натрия и тальк. Твердые композиции такого типа могут также использоваться как наполнители в желатиновых капсулах; в этой связи, предпочтительные вещества включают в себя лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Если для перорального применения желательны водные суспензии и/или эликсиры, активный ингредиент может сочетаться с различными подсластителями или вкусовыми добавками, окрашивающими агентами или красителями и, если желательно, также с эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные их сочетания. Для парентерального введения могут использоваться растворы соединения по настоящему изобретению либо в кунжутном, либо в арахисовом масле или в водном пропиленгликоле. Водные растворы могут быть подходящим образом забуферены (предпочтительно рН больше 8), если необходимо, и жидкому разбавителю сначала придают изотоничность. Эти водные растворы подходят для внутривенных инъекций. Масляные растворы подходят для внутрисуставных, внутримышечных и подкожных инъекций. Получение всех этих растворов в стерильных условиях легко осуществимо стандартными фармацевтическими способами, хорошо известными специалистам в данной области. Для интраназального введения или введения ингаляцией новые соединения по данному изобретению удобно вводить в форме раствора или суспензии из контейнера для разбрызгивания с помощью насоса, который сдавливается или откачивается пациентом, или в виде аэрозольного спрея, подающегося из аэрозольной упаковки или распылителя, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, стандартная доза может определяться путем оснащения клапаном для доставки дозированного количества. Аэрозольная тара или распылитель могут содержать раствор или суспензию активного соединения. Капсулы и картриджи (сделанные, например, из желатина) для использования в ингаляторе или вдувателе могут быть в виде смеси порошковой смеси соединения по данному изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Композиции активного соединения по данному изобретению для лечения состояний, указанных выше, у взрослого человека средней массы предпочтительно составлены так, чтобы каждая доза или пшик аэрозоля содержали от 20 до 1000 мкг активного соединение. Суммарная дневная доза аэрозоля может находиться в области от 100 мкг до 10 мг. Введение может осуществляться несколько раз в день, например 2, 3, 4 или 8 раз, с получением каждый раз, например, 1, 2 или 3 доз. Соединения по настоящему изобретению могут быть получены и вводиться в виде большого разнообразия пероральных и парентеральных лекарственных форм. Таким образом, соединения по настоящему изобретению могут вводиться путем инъекции, которая может быть внутривенной, внутримышечной,внутрикожной, подкожной, интрадуоденальной или внутрибрюшинной. Также соединения по настоящему изобретению могут вводиться с помощью ингаляции, например, интраназально. Кроме того, соединения по настоящему изобретению могут вводиться чрескожно. Специалисту в данной области понятно,что перечисленные ниже лекарственные формы могут содержать в качестве активногокомпонента либо соединение формул I, IA, IA-1, IA-2, IB, IС, II, IIА, III или IV, либо соответствующую фармацевтически приемлемую соль такого соединения. Для получения фармацевтических композиций из соединений по настоящему изобретению фармацевтически приемлемый носитель может быть либо жидким, либо твердым. Твердые формы препаратов включают в себя порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может быть одним или несколькими веществами, которые также действуют как разбавители, вкусовые агенты, связующие агенты, консерванты, разрыхляющие таблетку агенты или инкапсулирующий материал. В порошках носитель представляет собой мелкоизмельченное твердое вещество, которое находится в смеси с мелкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми свойствами связывания, в подходящих пропорциях и сжатым в желаемую форму и размер. Порошки и таблетки предпочтительно содержат от 5 или 10 до около 17% активного соединения. Подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия, низкоплавящие- 22008709 ся воска, масло какао и т.п. Термин препарат включает в себя композиции активного соединения с инкапсулированным материалом в качестве носителя, образующего капсулу, где активный компонент вместе с другими носителями или сам по себе окружен носителем, который с ним объединен таким образом. Таким же образом заключены облатки и лепешки. Таблетки, порошки, капсулы, пилюли, облатки и лепешки могут использоваться в виде твердых лекарственных форм, подходящих для перорального применения. Для получения суппозиториев, плавящихся при низких температурах воска, таких как смесь глицеридов жирных кислот или масла какао, сначала расплавляют и активный компонент гомогенно в нем диспергируют, например, перемешиванием. Расплавленную гомогенную смесь затем выливают в формы подходящего размера, оставляют охлаждаться и, следовательно, застывать. Жидкие формы препаратов включают в себя растворы, суспензии и эмульсии, например водные растворы или водные пропиленгликолевые растворы. Для парентеральной инъекции жидкие препараты могут быть получены в виде раствора в водном полиэтиленгликолевом растворе. Водные растворы, подходящие для перорального использования, могут быть получены растворением активного компонента в воде и добавлением подходящих красителей, ароматизаторов, стабилизаторов и загустителей, если желательно. Водные суспензии, подходящие для перорального использования, могут быть получены путем диспергирования мелкоизмельченного активного компонента в воде с вязким веществом, таким как природные или синтетические смолистые вещества, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и другие, хорошо известные суспендирующие агенты. Также сюда входит твердая лекарственная форма, предназначенная для преобразования, незадолго до использования, в жидкую лекарственную форму для перорального введения. Такие жидкие формы включают в себя растворы, суспензии и эмульсии. Эти препараты могут содержать, кроме активного компонента, красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизаторы и т.п. Фармацевтический препарат находится предпочтительно в виде стандартной лекарственной формы. В такой форме препарат разделяется на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может быть упакованным препаратом, упаковкой, содержащей дискретные количества препарата, такие как упакованные таблетки, капсулы и порошки в бутылочках или ампулах. Также стандартная лекарственная форма сама по себе может быть капсулами, таблеткой, облаткой или лепешкой, или соответствующее число любых из них может быть в упакованной форме. Количество активного компонента в стандартной лекарственной дозе может различаться или быть равным от 0,01 мг до 1 г в соответствии с конкретным применением и эффективностью активного компонента. В медицинской практике лекарство может вводиться 3 раза в день, как, например, капсулы по 100 или 300 мг. Композиция может, если желательно, также содержать другие совместимые терапевтические агенты. При терапевтическом применении соединения, применяемые в фармацевтическом способе по данному изобретению, вводят с начальной дозой от около 0,1 мг до около 1 г ежедневно. Дозы, однако, могут изменяться в зависимости от нужд пациента, серьезности состояния, на которое направлено лечение,и применяемого соединения. Определение надлежащей дозы для конкретной ситуации известно специалисту в данной области. Обычно лечение начинается с малых доз, которые ниже оптимальной дозы соединения. Затем, в зависимости от обстоятельств, дозу постепенно увеличивают до достижения оптимального эффекта. Для удобства, если желательно, общая суточная доза может быть разделена и вводиться порциями в течение дня. Нижеследующие примеры иллюстрируют получение соединений по настоящему изобретению. Они не предназначены для ограничения границ изобретения. Точки плавления не уточнялись. Данные ЯМР представлены в миллионных долях и относительно пикового сигнала дейтерия из образца растворителя. Примеры Пример 1. Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты.(R)-2,6-Диметил-нон-2-ен. К (S)-цитронеллилбромиду (50 г, 0,228 моль) в ТГФ (800 мл) при 0 С добавляли LiCl (4,3 г), а затем СuСl2 (6,8 г). Через 30 мин добавляли хлорид метилмагния (152 мл 3 М раствора в ТГФ, Aldrich) и раствор нагревали до комнатной температуры. Через 10 ч раствор охлаждали до 0 С и осторожно добавляли насыщенный водный раствор хлорида аммония. Два полученных слоя разделяли и водную фазу экстрагировали простым эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали с получением (R)-2,6-диметил-нон-2-ена; 32,6 г; 93%. Использовали без дополнительной очистки. 1 Н ЯМР(R)-4-Метилгептановая кислота. К (R)-2,6-диметил-нон-2-ену (20 г, 0,13 моль) в ацетоне (433 мл) добавляли раствор СrО 3 (39 г,0,39 моль) в H2SO4 (33 мл)/Н 2 О (146 мл) в течение 50 мин. Через 6 ч добавляли дополнительное количе- 23008709 ство СrО 3 (26 г, 0,26 моль) в H2SO4 (22 мл)/Н 2 О (100 мл). Через 12 ч раствор разбавляли насыщенным солевым раствором, раствор экстрагировали простым эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (градиент от 6:1 до 2:1 гексан/EtOAc) давала (R)4-метилгептановую кислоту в виде масла; 12,1 г; 65%. МS, m/z (относительная интенсивность): 143 [МН, 100%]. 1H ЯМР (400 МГц; CDCl3):2,35 (м, 2 Н), 1,6 (м, 1 Н), 1,4 (м, 1 Н), 1,3 (м, 4 Н), 1,1 (м, 1 Н), 0,85(4R,5S)-4-Метил-3-R)-4-метилгептаноил)-5-фенилоксазолидин-2-он. К (R)-4-метилгептановой кислоте (19 г, 0,132 моль) и триэтиламину (49,9 г, 0,494 моль) в ТГФ (500 мл) при 0 С добавляли триметилацетилхлорид (20 г, 0,17 моль). Через 1 ч добавляли LiCl (7,1 г, 0,17 моль),затем (4R,5S)-(+)-4-метил-5-фенил-2-оксазолидинон) (30 г, 0,17 моль). Смесь нагревали до комнатной температуры, и через 16 ч фильтрат удаляли фильтрацией, и раствор концентрировали при пониженном давлении. Флэш-хроматография (7:1 гексан/EtOAc) давала (4R,5S)-4-метил-3-R)-4-метилгептаноил)-5 фенилоксазолидин-2-он в виде масла; 31,5 г; 79%. []D=+5,5 (с 1 в СНСl3). МS, m/z (относительная интенсивность): 304 [М+Н, 100%]. 1 Н ЯМР (400 МГц; CDCl3):7,4-7,2 (м, 5 Н), 5,6 (д, J=7,32 Гц, 1 Н), 4,75(200 мл) при -50 С добавляли бис(триметилсилил)амид натрия (48 мл 1 М раствора в ТГФ). Через 30 мин добавляли трет-бутилбромацетат (15,6 г, 0,08 моль). Раствор перемешивали в течение 4 ч при -50 С и затем нагревали до комнатной температуры. Через 16 ч добавляли насыщенный водный раствор хлорида аммония и два слоя разделяли. Водную фазу экстрагировали простым эфиром и объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (9:1 гексан/EtOAc) давала трет-бутиловый эфир (3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты в виде белого твердого продукта; 12 г; 72%. []D=+30,2 (с 1 в СНСl3). 13 С ЯМР (100 МГц; CDCl3):176,47, 171,24, 152,72, 133,63, 128,87, 125,86, 80,85, 78,88, 55,34, 39,98, 38,77, 38,15, 37,58, 30,60, 28,23,20,38, 20,13, 14,50, 14,28. 4-трет-Бутиловый эфир (S)-2-R)-2-метилпентил)янтарной кислоты. К трет-бутиловому эфиру (3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты (10,8 г, 0,025 моль) в Н 2 О (73 мл) и ТГФ (244 мл) при 0 С добавляли предварительно перемешанный раствор LiOH (51,2 мл 0,8 М раствора) и Н 2 О 2 (14,6 мл 30% раствора). Через 4 ч дополнительно добавляли 12,8 мл LiOH (0,8 М раствор) и 3,65 мл Н 2 О 2 (30% раствор). Через 30 мин добавляли бисульфат натрия (7 г), сульфат натрия (13 г) и воду (60 мл), а затем гексан (100 мл) и простой эфир (100 мл). Два слоя разделяли и водный слой экстрагировали простым эфиром. Объединенные органические фазы концентрировали до масла, которое растворяли в гептане (300 мл). Полученное твердое соединение отфильтровывали и фильтрат сушили (MgSO4) и концентрировали с получением 4-третбутилового эфира (S)-2-R)-2-метилпентил)янтарной кислоты (6 г, 93%), который немедленно использовали без дополнительной очистки. МS, m/z (относительная интенсивность): 257 [М+Н, 100%]. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты. Раствор 4-трет-бутилового эфира (S)-2-R)-2-метилпентил)янтарной кислоты (6,0 г, 23,22 ммоль) и триэтиламина (3,64 мл, 26,19 ммоль) в толуоле (200 мл) обрабатывали дифенилфосфорил азидом (5,0 мл,23,22 мл) и перемешивали при комнатной температуры в течение 0,5 ч. После того, как реакционную смесь затем кипятили с обратным холодильником в течение 3 ч и быстро охлаждали, добавляли бензиловый спирт (7,2 мл, 69,7 ммоль) и раствор нагревали еще 3 ч. После того, как реакционную смесь оставляли охлаждаться, ее разбавляли этиловым эфиром (200 мл) и объединенный органический слой последовательно промывали насыщенным NaHCO3 и насыщенным солевым раствором и сушили (Na2SO4). Концентрированную органическую часть очищали хроматографией (MPLC), элюируя 8:1 гексаном/этилацетатом с получением трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты (6,4 г, 75,8%). МS: М+1=364,2, 308,2. 1 Н ЯМР (400 МГц, CDCl3):0,83(т, 3 Н, J=6,59 Гц), 0,87 (д,3 Н, J=6,59 Гц), 1,08-1,34 (м, 6 Н), 1,39 (с, 9 Н), 1,41-1,52 (м, 2 Н), 2,39 (м, 2 Н), 4,02 (м, 1 Н), 5,05 (с, 2 Н), 5,09(2,14 г, 5,88 ммоль) в ТГФ (50 мл) обрабатывали Pd/C (0,2 г) и Н 2 при 50 фунт/кв.дюйм в течение 2 ч. Реакционную смесь затем фильтровали и концентрировали до масла в вакууме с получением трет-бутилового эфира (3S,5R)-3-амино-5-метилоктановой кислоты с количественным выходом. МS: М+1=230,2,174,1. 1 Н ЯМР (400 МГц, CDCl3):0,85-0,86 (перекрывающиеся т и д, 6 Н), 1,13-1,40 (м, 6 Н), 1,44 (с, 9 Н),1,60 (м, 1 Н), 2,31 (дд, 1 Н, J=7,81 и 15,86 Гц), 2,38 (дд, 1 Н, J=5,13 и 15,86 Гц), 3,31 (м, 1 Н) и 3,45 (шир.с,2 Н) ч./млн.- 24008709 Гидрохлорид (3S,5R)-3-амино-5-метилоктановой кислоты. Взвесь трет-бутилового эфира (3S,5R)-амино-5-метилоктановой кислоты (2,59 г, 11,3 ммоль) в 6 н. НСl (100 мл) кипятили с обратным холодильником в течение 18 ч, охлаждали и фильтровали через целит. Фильтрат концентрировали в вакууме до 25 мл и полученные кристаллы собирали и сушили с получением гидрохлорида (3S,5R)-3-амино-5-метилоктановой кислоты, т.пл. 142,5-142,7 С (1,2 г, 50,56%). Из фильтрата получали второй выход (0,91 г). Для C9H19NO2 НСl: вычислено: С 51,55, Н 9,61, N 6,68, Сl 16,91; найдено: С 51,69, Н 9,72, N 6,56, Сl 16,63. МS: М+1=174,1. 1H ЯMP (CD3OD):0,89 (т, 3 Н, J=7,32 Гц),0,92 (д, 3 Н, J=6,35 Гц), 1,12-1,18 (м, 1 Н), 1,25-1,35 (м, 2 Н), 1,35-1,42 (м, 2 Н), 1,54-1,64 (м, 2 Н), 2,50 (дд,1 Н, J=7,81 и 17,33 Гц), 2,65 (дд, 1 Н, J=4,64 и 17,32 Гц) и 3,52 (м, 1 Н) ч./млн. Пример 2. (3S,5R)-Амино-5-метилгептановая кислота.(S)-3,7-Диметил-окт-6-ениловый эфир метансульфоновой кислоты. К S-(-)-цитронеллолу (42,8 г, 0,274 моль) и триэтиламину (91 мл, 0,657 моль) в СН 2 Сl2 (800 мл) при 0 С добавляли метансульфонил хлорид (26 мл, 0,329 моль) в CH2Cl2 (200 мл). Через 2 ч при 0 С раствор промывали 1 н. НСl, затем насыщенным солевым раствором. Органическую фазу сушили (MgSO4) и концентрировали с получением соединения, указанного в заголовке, в виде масла (60,5 г, 94%), которое затем использовали без дополнительной очистки. МS, m/z (относительная интенсивность): 139 [100%], 143(R)-2,6-Диметилокт-2-ен. К (S)-3,7-диметил-окт-6-ениловому эфиру метансульфоновой кислоты (60 г, 0,256 моль) в ТГФ (1 л) при 0 С добавляли алюмогидрид лития (3,8 г, 0,128 моль). Через 7 ч добавляли еще 3,8 г алюмогидрида лития и раствор нагревали до комнатной температуры. Через 18 ч добавляли еще 3,8 г алюмогидрида лития. Еще через 21 ч реакцию аккуратно гасили с помощью 1 н. лимонной кислоты и раствор дополнительно разбавляли насыщенным солевым раствором. Две полученные фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали с получением соединения, указанного в заголовке, в виде масла, которое использовали без дополнительно очистки. МS, m/z (относительная интенсивность): 139(R)-4-Метилгексановая кислота. Использовали способ, аналогичный способу синтеза (R)-4-метилгептановой кислоты, с получением кислоты в виде масла (9,3 г, 56%). ИК (пленка): 2963, 2931, 2877, 2675, 1107, 1461, 1414 см-1. МS, m/z(4R,5S)-4-Метил-3-R)-4-метилгексаноил)-5-фенилоксазолидин-2-он. Использовали способ, аналогичный способу синтеза (4R,5S)-4-метил-3-R)-4-метилгептаноил)-5 фенилоксазолидин-2-она, с получением соединения, указанного в заголовке, в виде масла (35,7 г, 95%). МS, m/z (относительная интенсивность): 290 [М+Н, 100%]. 1 Н ЯМР (400 МГц, CDCl3):7,4-7,25 (м, 5 Н),5,6 (д, J=7,32 Гц, 1 Н), 4,75 (м, 1 Н), 2,97 (м, 1 Н), 2,85 (м, 1 Н), 1,68 (м, 1 Н), 1,43 (м, 2 Н), 1,12 (м, 2 Н), 0,87(м, 9 Н). 13 С ЯМР (100 МГц; CDCl3):173,71, 153,24, 133,56, 128,94, 128,90, 125,83, 79,14, 54,95, 34,22,33,72, 31,07, 29,45, 27,20, 26,52, 19,19, 19,15, 14,77, 14,53, 11,54. трет-Бутиловый эфир (3S,5R)-5-метил-3-[1-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-ил)метаноил]гептановой кислоты. Использовали способ, аналогичный способу синтеза трет-бутилового эфира (3S,5R)-5-метил-3-4R,5S)4-метил-2-оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты, с получением соединения, указанного в заголовке, в виде масла (7,48 г; 31%). ИК (пленка): 2967, 2934, 1770, 1716, 1696, 1344, 1148, 1121, 1068,1037, 947 см-1. МS, m/z (относительная интенсивность): 178 [100%], 169 [100%]; []D=+21,6 (c 1 в СНСl3). 4-трет-Бутиловый эфир (S)-2-R)-2-метилбутил)янтарной кислоты. трет-Бутиловый эфир (3S,5R)-5-метил-3-[1-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-ил)метаноил]гептановой кислоты (7,26 г, 0,018 моль) в Н 2 О (53 мл) и ТГФ (176 мл) при 0 С добавляли к заранее перемешанному раствору LiOH (37 мл 0,8 М раствора) и Н 2 О 2 (10,57 мл 30% раствора) и раствор нагревали до комнатной температуры. Через 2 ч добавляли бисульфат натрия (7 г), сульфат натрия (13 г) и воду(60 мл), и два слоя разделяли, и водный слой экстрагировали простым эфиром. Объединенные органические фазы концентрировали до масла, которое растворяли в гептане (200 мл). Полученное твердое соединение отфильтровывали и фильтрат сушили (MgSO4) и концентрировали с получением соединения,указанного в заголовке, в виде масла (4,4 г), которое использовали без дополнительно очистки. МS, m/z(м, 1 Н), 1,65 (м, 1 Н), 1,41 (с, 9 Н), 1,20 (м, 4 Н), 0,84 (м, 6 Н). трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилгептановой кислоты. Это соединение получали, как описано выше, используя в качестве исходного продукта 4-третбутиловый эфир (S)-2-R)-2-метилбутил)янтарной кислоты с получением трет-бутилового эфира(400 МГц, CDCl3):0,84 (т, 3 Н, J=7,33 Гц), 0,89 (д, 3 Н, J=6,60 Гц), 1,12-1,38 (м, 4 Н), 1,41 (с, 9 Н), 1,431,59 (м, 2 Н), 2,42 (м, 2 Н), 4,05 (м, 1 Н), 5,07 (т, 2 Н, J=12,95 Гц) и 7,28-7,34 (м, 5 Н). трет-Бутиловый эфир (3S,5R)-амино-5-метилгептановой кислоты. Это соединение получали, как описано выше, используя в качестве исходного продукта трет-бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилгептановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты с получением соединения, указанного в заголовке. 1 Н ЯМР (400 МГц, CDCl3):0,84 (перекрывающиеся т и д, 6 Н), 1,08-1,16 (м, 2 Н),1,27-1,30 (м, 2 Н), 1,42 (с, 9 Н), 1,62 (шир.с, 2 Н), 2,15 (дд, 1 Н, J=8,54 и 15,62 Гц), 2,29 (дд, 1 Н, J=4,15 и 15,37 Гц), и 3,20 (шир.с, 2 Н). Гидрохлорид (3S,5R)-амино-5-метилгептановая кислоты. Взвесь трет-бутилового эфира (3S,5R)-амино-5-метилгептановой кислоты (1,44 г, 6,69 ммоль) в 3 н. НСl кипятили с обратным холодильником в течение 3 ч, горячим фильтровали через целит и досуха концентрировали. Растирание в порошок полученного твердого вещества с этиловым эфиром давало гидрохлорид (3S,5R)-3-амино-5-метилгептановой кислоты (0,95 г, 85%), т.пл. 126,3-128,3 С. 1 Н ЯМР (400 МГц,CD3OD):0,92 (т, 3 Н, J=7,32 Гц), 0,92 (д, 3 Н, J=6,35 Гц), 1,15-1,24 (м, 1 Н), 1,33-1,43 (м, 2 Н), 1,44-1,52 (м,1 Н), 1,60-1,67 (м, 1 Н), 2,57 (ддд, 1 Н, J=7,32, 17,67 и 5,12 Гц), 2,69 (ддд, 1 Н, J=0,97, 4,88 и 17,32 Гц) и 3,28(R)-4-Метилоктановая кислота. Литийхлорид (0,39 г, 9,12 ммоль) и хлорид меди (I) (0,61 г, 4,56 ммоль) объединяли в 45 мл ТГФ при комнатной температуре и перемешивали 15 мин, затем охлаждали до 0 С, в это время добавляя этилмагнийбромид (1 М раствор в ТГФ, 45 мл, 45 ммоль). По каплям добавляли (S)-цитронеллилбромид(5,0 г, 22,8 ммоль) и раствор оставляли медленно нагреваться до комнатной температуры, перемешивая в течение ночи. Реакцию гасили, осторожно добавляя насыщ. NH4Cl (водн.), и перемешивали с Et2O и насыщ. NH4Cl (водн.) в течение 30 мин. Фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Сырой (R)-2,6-диметил-дец-2-ен использовали без очистки. К раствору (R)-2,6-диметил-дец 2-ена (3,8 г, 22,8 ммоль) в 50 мл ацетона при 0 С добавляли реагент Джонса (2,7 М в H2SO4 (водн.), 40 мл,108 ммоль) и раствор оставляли медленно нагреваться до комнатной температуры при перемешивании в течение ночи. Смесь разделяли между Et2O и Н 2 О, фазы разделяли и органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Остаток очищали флэш-хроматографией (8:1 гексаны/EtOАс) с получением 2,14 г (59%) соединения, указанного в заголовке, в виде бесцветного масла: LRMS (мacc-спектор низкого разрешения): m/z 156,9 (М+). 1 Н ЯМР (400 МГц, CDCl3):2,33 (м, 2 Н), 1,66 (м, 1 Н), 1,43 (м, 2 Н), 1,23 (м, 5 Н), 1,10 (м, 1 Н), 0,86 (м, 6 Н). Реагент Джонса получали как 2,7 М раствор, объединяя 26,7 г СrО 3, 23 мл H2SO4 и разбавляя до 100 мл с помощью Н 2 О.(4R,5S)-4-Метил-3-R)-4-метилоктаноил)-5-фенилоксалидин-2-он. К (R)-4-метилоктановой кислоте (2,14 г, 13,5 ммоль) в 25 мл СН 2 Сl2 при 0 С добавляли 3 капли ДМФ, а затем оксалил хлорид (1,42 мл, 16,2 ммоль) с получением сильного выход газа. Раствор сразу нагревали до комнатной температуры, перемешивали 30 мин и концентрировали. Тем временем к раствору оксазолидинона (2,64 г, 14,9 ммоль) в 40 мл ТГФ при -78 С по каплям добавляли н-бутиллитий(1,6 М раствор в гексане, 9,3 мл, 14,9 ммоль). Смесь перемешивали в течение 10 мин, в это время по каплям добавляя хлорангидрид кислоты в 10 мл ТГФ. Реакционную смесь перемешивали 30 мин при -78 С,затем сразу нагревали до комнатной температуры и гасили насыщ. NH4Cl. Смесь разделяли между Et2O и насыщ. NH4Cl (водн.), фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали с получением 3,2 г соединения, указанного в заголовке, в виде бесцветного масла. LRMS: m/z 318,2 (М+). 1 Н ЯМР (400 МГц, CDCl3):7,34 (м, 5 Н), 5,64 (д, J=7,3 Гц, 1 Н), 4,73 (квинтет, J=6,8 Гц, 1 Н), 2,96 (м, 1 Н),2,86 (м, 1 Н), 1,66 (м, 1 Н), 1,47 (м, 2 Н), 1,26 (м, 5 Н), 1,13 (м, 1 Н), 0,88 (м, 9 Н). Сырой продукт использовали без очистки. трет-Бутиловый эфир (3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин-3-карбонил) нонановой кислоты. К раствору диизопропиламина (1,8 мл, 12,6 ммоль) в 30 мл ТГФ при -78 С добавляли н-бутиллитий(1,6 М раствор в гексане, 7,6 мл, 12,1 ммоль) и смесь перемешивали 10 мин, в это время по каплям добавляя (4R,5S)-4-метил-3-R)-4-метилоктаноил)-5-фенилоксазолидин-2-он (3,2 г, 10,1 ммоль) в 10 мл ТГФ. Раствор перемешивали в течение 30 мин, быстро по каплям добавляли трет-бутилбромацетат (1,8 мл,12,1 ммоль) при -50 С и смесь оставляли медленно нагреваться до 10 С в течение 3 ч. Смесь разделяли между Et2O и насыщ. NH4Cl (водн.), фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Осадок очищали флэш-хроматографией (от 16:1 до 8:1 гексаны/ЕtОАс) с получением 2,65 г(61%) соединения, указанного в заголовке, в виде бесцветного кристаллического твердого продукта,т.пл.=84-86 С. []D23=+17,1 (с=1,00, СНСl3). 1 Н ЯМР (400 МГц, CDCl3):7,34 (м, 5 Н), 5,62 (д, J=7,3 Гц,1 Н), 4,73 (квинтет, J=6,8 Гц, 1 Н), 4,29 (м, 1 Н), 2,67 (дд, J=9,8, 16,4 Гц, 1 Н), 2,40 (дд, J=5,1, 16,4 Гц, 1 Н),1,69 (м, 1 Н), 1,38 (с, 9 Н), 1,28 (м, 7 Н), 1,08 (м, 1 Н), 0,88 (м, 9 Н). 13 С ЯМР (400 МГц; CDCl3):176,45,- 26008709 171,22, 152,71, 133,64, 128,86, 125,86, 80,83, 78,87, 55,33, 40,02, 38,21, 37,59, 36,31, 30,86, 29,29, 28,22,23,14, 20,41, 14,36, 14,26. Для C25H37NO5: вычислено: С 69,58; Н 8,64; N 3,25; найдено: С 69,37; Н 8,68; N 3,05. 4-трет-Бутиловый эфир (S)-2-R)-2-метилгексил)янтарной кислоты. К раствору трет-бутилового эфира (3S,5R)-5-метил-3-4R,5S)-4-метил-2-оксо-5-фенилоксазолидин 3-карбонил)нонановой кислоты (2,65 г, 6,14 ммоль) в 20 мл ТГФ при 0 С добавляли заранее охлажденный (0 С) раствор моногидрата LiOH (1,0 г, 23,8 ммоль) и пероксид водорода (30 мас.% водный раствор,5,0 мл) в 10 мл Н 2 О. Смесь энергично перемешивали в течение 90 мин, затем нагревали до комнатной температуры и перемешивали 90 мин. Реакцию гасили при 0 С, добавляя 100 мл 10% NaHSO3 (водн.), затем экстрагировали Et2O. Фазы разделяли и органическую фазу промывали насыщенным солевым раствором,сушили (MgSO4) и концентрировали. Соединение, указанное в заголовке, использовали без очистки. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилнонановой кислоты. Это соединение получали аналогично способу получения, описанному выше, используя в качестве исходного продукта 4-трет-бутиловый эфир (S)-2-R)-2-метилгексил)янтарной кислоты вместо 4-третбутилового эфира (S)-2-R)-2-метилпентил)янтарной кислоты, с получением соединения, указанного в заголовке, в виде масла (71,6% выход). 1 Н ЯМР (400 МГц, CDCl3):0,81 (т, 3 Н, J=4,40 Гц), 0,85 (д, 3 Н,J=6,55 Гц), 1,06-1,20 (м, 7 Н), 1,36 (с, 9 Н), 1,38-1,50 (м, 2 Н), 2,36 (м, 2 Н), 3,99 (м, 1 Н), 5,02 (м+с, 3 Н) и 7,28-7,28 (м, 5 Н). трет-Бутиловый эфир (3S,5R)-3-амино-5-метилнонановой кислоты. Это соединение получали, как описано выше, используя в качестве исходного продукта трет-бутиловый эфир (3S,5R)-бензилоксикарбониламино-5-метилнонановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метилоктановой кислоты. Выход=97%. 1 Н ЯМР (400 МГц,CDCl3):0,82 (перекрывающиеся д и т, 6 Н), 1,02-1,08 (м, 1 Н), 1,09-1,36 (м, 6 Н), 1,39 (с, 9 Н), 1,47 (шир.с,1 Н), 1,80 (с, 2 Н), 2,13 (дд, 1 Н, J=8,54 и 15,61 Гц) и 2,27 (дд, 1 Н, J=4,15 и 15,38 Гц). Гидрохлорид (3S,5R)-3-амино-5-метилнонановой кислоты. Смесь трет-бутилового эфира (3S,5R)-3-амино-5-метилнонановой кислоты (1,50 г, 6,16 ммоль) в 3 н. НСl (100 мл) кипятили с обратным холодильником в течение 3 ч, горячим фильтровали через целит и концентрировали до 30 мл в вакууме. Полученные кристаллы собирали, промывали дополнительной порцией 3 н. НСl и сушили с получением соединения, указанного в заголовке, т.пл. 142,5-143,3 С. Дополнительные выходы получали из фильтрата с получением 1,03 г (70,4%). 1H ЯМР (400 МГц, CD3OD):0,91 (т, 3 Н, J=6,84 Гц), 0,92 (д, 3 Н, J=6,35 Гц), 1,16-1,26 (м, 1 Н), 1,27-1,35 (м, 4 Н), 1,38-1,45 (м, 1 Н), 1,61MS: M+1=188,1. Пример 4. (2R,4R)-2-Аминометил-4-метилгептановая кислота. 5R-Meтил-3R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)октановая кислота. Раствор трет-бутилового эфира (3R,5R)-5-метил-3-4S,5R)-4-метил-2-оксо-5-фенилоксазолидин-3 карбонил)октановой кислоты (3,9 г, 9,34 ммоль) в дихлорметане (150 мл) обрабатывали трифторуксусной кислотой (7,21 мл, 93,4 мл) и перемешивали 18 ч при комнатной температуре. После удаления в вакууме растворителей и реагента полученный осадок растирали в порошок в 100 мл гексана с получением 3,38 г соединения, указанного в заголовке (100%), т.пл. 142-143 С. МS: М+1=362,1. 1 Н ЯМР (400 МГц, CDCl3):0,85 (2 т, 6 Н, J=7,1 Гц), 0,93 (д, 3 Н, J=6,1 Гц), 1,14 (м, 1 Н), 1,2-1,49 (м, 6 Н), 2,56 (дд, 1 Н, J=4,15 и 17,57 Гц),2,81 (дд, 1 Н, J=17,33 и 10,74 Гц), 4,28 (м, 1 Н), 4,74 (квинтет, 1 Н, J=6,84 Гц), 5,64 (д, 1 Н, J=7,32 ГЦ), 7,297,43 (м, 5 Н). Бензиловый эфир [4R-метил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептил]карбаминовой кислоты. Раствор 5R-метил-3R-(4S-мeтил-2-oкco-5R-фeнилoкcaзoлидин-3-карбонил)октановой кислоты (1,98 г,5,48 ммоль) и триэтиламина (0,92 мл, 6,57 ммоль) обрабатывали дифенилфосфорилазидом (1,2 мл, 5,48 ммоль),перемешивали 30 мин при комнатной температуре, затем кипятили с обратным холодильником в течение 3 ч. После быстрого охлаждения реакционную смесь обрабатывали бензиловым спиртом (2,8 мл, 27,4 ммоль) и кипятили с обратным холодильником еще 3 ч. Реакционную смесь охлаждали, разбавляли этиловым эфиром (150 мл), последовательно промывали насыщ. NaHCO3 и насыщенным солевым раствором, сушили(400 МГц, CDCl3):0,86 (2 т, 6 Н, J=7,1 Гц), 0,93 (д, 3 Н, J=5,9 Гц), 1,14 (м, 1 Н), 1,09-1,36 (м, 6 Н), 1,50 (д,1 Н, J=5,2 Гц), 3,49 (т, 1 Н, J=6,1 Гц), 4,10 (м, 1 Н), 4,71 (квинтет, 1 Н, J=6,61 Гц), 5,06 (д, 2 Н, J=3,42 Гц),5,20 (т, 1 Н, J=5,61 Гц), 5,64 (д, 1 Н, J=7,08 Гц), 7,29-7,43 (м, 10 Н). 2R-(Бензилоксикарбониламинометил)-4R-метилгептановая кислота. Раствор бензилового эфира 4S-метил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептилкарбаминовой кислоты (4,12 г, 8,83 ммоль) в 3:1 ТГФ:воде (100 мл) охлаждали до 0 С и обрабатывали смесью 0,8 н. LiOH (17,5 мл, 14 ммоль) и 30% Н 2O2 (4,94 мл, 44 ммоль). После того, как реакционную- 27008709 смесь перемешивали на холоде в течение 3 ч, ее гасили взвесью NaHSO3 (2,37 г) и Na2SO3 (4,53 г) в воде(30 мл) и перемешивали 1 ч. Реакционную смесь разбавляли этиловым эфиром (200 мл), разделяли и органический слой промывали насыщенным солевым раствором и сушили (MgSO4). Концентрированный органический экстракт хроматографировали (MPLC), элюируя этилацетатом с получением 1,25 г 2R(бензилоксикарбониламинометил)-4R-метилгептановой кислоты (46%). МS: М+1=308,1. 1 Н ЯМР (400 МГц,CDCl3):0,83 (т, 3 Н, J=6,84 Гц), 0,87 (т, 3 Н, J=6,35 Гц), 1,14 (м, 1 Н), 1,06-1,54 (м, 7 Н), 2,7 (шир.с, 1 Н),3,30 (м, 2 Н), 5,05 (кв, 2 Н, J=12,2 Гц), 5,14 (т, 1 Н, J=5,61 Гц), 7,30 (шир.с, 5 Н). Гидрохлорид (2R,4R)-2-амино-4-метилгептановой кислоты. Смесь 2R-(бензилоксикарбониламинометил)-4R-мeтилгeптaнoвoй кислоты (1,25 г, 4,07 ммоль) иPd/C (20%, 0,11 г) в метаноле (50 мл) гидрировали при 50 фунт/кв.дюйм в течение 18 ч. После удаления катализатора путем фильтрации растворитель удаляли в вакууме и полученное твердое вещество растирали в порошок с эфиром с получением гидрохлорида (2S,4R)-2-амино-4-метилгептановой кислоты (0,28 г,40%), т.пл. 226,3-228,0 С. МS: М+1=174,0. 1 Н ЯМР (400 МГц, CD3OD):0,89 (т+д, 6 Н, J=6,35 Гц), 1,11(м, 1 Н), 1,25-1,40 (м, 4 Н), 1,47-1,62 (м, 2 Н), 2,48 (шир.с, 1 Н), 2,93 (м, 2 Н). Для C9H19NO20,1 Н 2O: вычислено: С 61,75, Н 11,06, N 8,00; найдено: С 61,85, Н 10,83, N 8,01. Пример 5. Гидрохлорид 2-аминометил-4,4-диметилгептановой кислоты. Этиловый эфир 2-циано-4,4-диметилгепта-2,6-диеновой кислоты. Раствор 2,2-диметилпент-4-енала (5,0 г, 44 ммоль), этилового эфира цианоуксусной кислоты (5,12 мл,48 ммоль), пиперидина (1,3 мл, 14 ммоль) и уксусной кислоты (4,52 мл, 80 ммоль) в 170 мл толуола кипятили с обратным холодильником в течение 18 ч в колбе, снабженной ловушкой Дина-Старка (DeanStark). Несколько миллилитров воды улавливали ловушкой. Реакционную смесь охлаждали и последовательно промывали 1 н. НСl, NaHCO3 и насыщенным солевым раствором. Органические слои сушили надNa2SO4 и концентрировали до масла. Это масло хроматографировали, элюируя 20% EtOAc в гексане с получением сочетания двух фракций, всего 8,3 г (91%). 1 Н ЯМР (400 МГц, CDCl3): 1,28 (с, 6 Н), 1,32 (т,3 Н, J=7 Гц), 2,26 (д, 2 Н, J=7,6 Гц), 4,27 (кв, 2 Н, J=7,2 Гц), 5,08 (д, 1 Н, J=12 Гц), 5,10 (д, 1 Н, J=4 Гц), 5,72(м, 1 Н). Гидрохлорид 2-аминометил-4,4-диметилгептановой кислоты. Этиловый эфир 2-циано-4,4-диметилгепта-2,6-диеновой кислоты (5,88 г, 28 ммоль) растворяли в смеси 91 мл этанола и 6 мл НСl и обрабатывали 0,4 г PtO2. Взаимодействие проводили под давлением водорода 100 фунт/кв.дюйм при комнатной температуре в течение 15 ч. Катализатор фильтровали и фильтрат концентрировали с получением 3,8 г желаемого продукта этилового эфира 2-аминометил-4,4 диметилгептановой кислоты в виде масла. МS (APCI): 216,2 (М+1)+. Это масло кипятили с обратным холодильником в 75 мл 6 н. НСl в течение 18 ч. При охлаждении реакционной смеси образовывался осадок. Твердый продукт фильтровали, промывали дополнительной порцией раствора НСl и растирали в порошок простым эфиром с получением чистого соединения, указанного в заголовке. МS (APCI): 188,1(М+1)+, 186,1 (М-1)+. 1 Н ЯМР (400 МГц, CD3OD): 0,91 (9 Н, м), 1,30 (5 Н, м), 1,81 (дд, 1 Н, J=7,2 Гц, 14,4 Гц),2,72 (1 Н, м), 3,04 (2 Н, м). Для C10H21NO2 НСl: вычислено: С 53,68, Н 9,91, N 6,26, Сl 15,85; найдено: С 53,83, Н 10,15, N 6,22, Сl 15,40. Т.пл.: 229,5-231,0 С. Пример 6. (S)-3-Амино-5,5-диметилоктановая кислота. 3-(4,4-Диметилгептаноил)-(R)-4-метил-(S)-5-фенилоксазолидин-2-он. Раствор 4,4-диметилгептановой кислоты (1,58 г, 10 ммоль) и триэтиламина (4,6 мл) в 50 мл ТГФ охлаждали до 0 С и обрабатывали 2,2-диметилпропионил хлоридом (1,36 мл). Через 1 ч добавляли 4 Нметил-53-фенилоксазолидин-2-он (1,95 г, 11 ммоль) и литийхлорид (0,47 г, 11 ммоль) и смесь перемешивали в течение 18 ч. Осадок фильтровали и тщательно промывали дополнительной порцией ТГФ. Фильтрат концентрировали в вакууме с получением маслянистого твердого продукта. Этот маслянистый твердый продукт растворяли в 200 мл Et2O, последовательно промывали насыщенным NаНСО 3, 0,5 н. НСl и насыщенным NaCl, сушили (MgSO4) и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде масла (3,0 г, 95%). 1 Н ЯМР (400 МГц, CDCl3): 0,73-0,84 (м, 12 Н), 1,10-1,22 (м, 4 Н),1,46-1,54 (м, 2 Н), 2,75-2,87 (м, 2 Н), 4,70 (м, 1 Н, J=7 Гц), 5,59 (д, 1 Н, J=7 Гц), 7,22-7,37 (м, 5 Н). трет-Бутиловый эфир 5,5-диметил-(S)-3-R)-4-метил-2-оксо-(S)-5-фенилоксазолидин-3-карбонил) октановой кислоты. В соответствии с примером 1 5,07 г (16 ммоль) 3-(4,4-диметилгептаноил)-4-метил-5-фенилоксазолидин-2-она, 18 мл (1 н., 18 ммоль) раствора NaHMDS и 4,72 мл (32 ммоль) трет-бутилового эфира бромуксусной кислоты давали 3,40 г (49,3%) соединения, указанного в заголовке, в виде кристаллического твердого продукта. 1 Н ЯМР (400 МГц, CDCl3): 0,85-0,89 (м, 12 Н), 1,18-1,32 (м, 6 Н), 1,41 (с, 9 Н), 1,88 (дд,1 Н, J=6 Гц, 8,4 Гц), 2,41 (дд, 1 Н, J=6 Гц, 16 Гц), 2,62 (дд, 1 Н, J=8,4 Гц, 16 Гц), 4,30-4,40 (м, 1 Н), 4,72 (м,1 Н), 5,62 (д, 1 Н, J=7 Гц), 7,30-7,40 (м, 5 Н). Т.пл.: 83-85 С. 4-трет-Бутиловый эфир (S)-2-(2,2-диметилпентил)янтарной кислоты. В соответствии с примером 1 3,4 г (7,9 ммоль) трет-бутилового эфира 5,5-диметил-3-(4-метил-2 оксо-5-фенилоксазолидин-3-карбонил)октановой кислоты, 16 мл (12,8 ммоль) 0,8 н. LiOH и 4,5 мл 30% Н 2 О 2 давали 2,42 г (100%) соединения, указанного в заголовке, в виде масла. 1 Н ЯМР (400 МГц, CDCl3):(APCI), m/z 188,1 (М+1)+, 186,1 (М-1)+. Для C10H21NO2HCl0,12H2O: вычислено: С 53,17, Н 9,92, N 6,20,Сl 15,69; найдено: С 53,19, Н 10,00, N 6,08, Сl 15,25. =+20 (МеОН). Т.пл.: 194,2-195,2 С. Пример 7. 2-Аминометил-3-(1-метилциклопропил)пропионовая кислота. Этиловый эфир 2-циано-3-(1-метилциклопропил)акриловой кислоты. К 1-метилциклопропанметанолу (Aldrich, 1,13 мл, 11,6 ммоль) в 50 мл СН 2 Сl2 добавляли нейтральную окись алюминия (2,5 г) и затем РСС (2,5 г, 11,6 ммоль) и смесь перемешивали 3 ч при комнатной температуре. Смесь фильтровали через 1 см плаг из силикагеля в вакууме и промывали Et2O. Фильтрат концентрировали до приблизительно 5 мл общего объема. К осадку добавляли ТГФ (10 мл), этилцианоацетат (1,2 мл, 11,3 ммоль), пиперидин (5 капель) и, наконец, уксусную кислоту (5 капель). Все это перемешивали при комнатной температуре в течение ночи, затем разделяли между Et2O и насыщенным водным NaHCO3. Фазы разделяли и органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Флэш-хроматография осадка (1015% EtOAc/гексан) давала 0,53 г(25%) сложного эфира в виде бесцветного масла, которое кристаллизовалось при отстаивании, т.пл. 3537 С. 1 Н ЯМР (СDСl3):6,99 (с, 1 Н), 4,27 (кв, J=7,3 Гц, 2 Н), 1,55 (с, 3 Н), 1,32 (т, J=7,3 Гц, 3 Н), 1,14 (с,2 Н), 1,07 (с, 2 Н). 13 С ЯМР:170,44, 162,90, 115,17, 103,69, 62,52, 21,24, 21,07 (2 С), 20,71, 14,35. ДляC10H13NO2: вычислено: С 67,02, Н 7,31, N 7,82; найдено: С 66,86, Н 7,47, N 7,70. Этиловый эфир 2-аминометил-3-(1-метилциклопропил)пропионовой кислоты. К этиловому эфиру 2-циано-3-(1-метилциклопропил)акриловой кислоты (0,45 г, 2,51 ммоль) в 16 мл ЕtОН:ТТФ (1:1) добавляли RaNi (0,4 г) и смесь гидрировали в шейкере Парра (Parr) при 48 фунт/кв.дюйм в течение 15,5 ч. Затем добавляли катализатор Перлмана (Pearlman) (0,5 г) и гидрирование продолжали в течение дополнительных 15 ч. Смесь фильтровали и концентрировали. Флэш-хроматография осадка 234568% МеОН/СН 2 Сl2 давала 0,25 г (54%) аминоэфира в виде бесцветного масла. 1 Н ЯМР(СDСl3):3,97 (м, 2 Н), 2,67 (м, 2 Н), 2,46 (м, 1 Н), 1,28 (д, J=7,3 Гц, 2 Н), 1,19 (ушир.с, 2 Н), 1,09 (т, J=7,3 Гц,3 Н), 0,85 (с, 3 Н), 0,04 (м, 4 Н). LRMS: m/z 186,1 (М+1). 2-Аминометил-3-(1-метилциклопропил)пропионовая кислота. К раствору этилового эфира 2-аминометил-3-(1-метилциклопропил)пропионовой кислоты (0,25 г,1,35 ммоль) в 10 мл метанола при 0 С добавляли 10% водн. NaOH (10 мл). Смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали для удаления метанола. Осадок охлаждали до 0 С и подкисляли до рН 2 с помощью конц. НСl. После этого смесь оставляли нагреваться до комнатной температуры, затем помещали на ионно-обменную смолу DOWEX-50WX8-100 и элюировали Н 2 О до нейтрального показателя лакмуса. Элюирование продолжали 5% водн. NH4OH (100 мл) и щелочные фракции концентрировали с получением 0,15 г (71%) аминоэфира в виде бесцветного твердого продукта. 1 Н ЯMP (CDCl3):2,72 (м, 2 Н), 2,42 (м, 1 Н), 1,34 (дд, J=8,5, 13,9 Гц, 1 Н), 1,19 (дд, J=6,1, 13,9 Гц,1 Н), 0,82 (с, 3 Н), 0,05 (м, 4 Н). LRMS: m/z 158,0 (М+1). Пример 8. (3S,5R)-3-Амино-5-метилоктановая кислота. трет-Бутиловый эфир (5S)-5-метилокта-2,6-диеновой кислоты. К раствору этилового эфира (S)-3-метилгекс-4-еновой кислоты (этиловый эфир (S)-3-метилгекс-4 еновой кислоты получали из (S)-транс-3-пентен-2-ола [Liang, J.; Hoard, D.W.; Van Khau, V.; Martinelli,M.J.; Moher, E.D.; Moore, R.E.; Tius, M.A., J. Org. Chem., 1999, 64, 1459] с помощью перестановки Джонсон-Клайзен (Johnson-Claisen) с триэтилортоацетатом в соответствии со способом, описанным в литературе [Hill, R.К.; Soman, R.; Sawada, S., J. Org. Chem., 1972, 37, 3737]) (1,0 г, 6,4 ммоль) в 30 мл толуола при -78 С по каплям добавляли DIBAH (1,0 М в ТГФ, 6,4 мл) в течение 5 мин. Смесь перемешивали при-78 С в течение 45 мин, в течение которых добавляли 5 капель метанола, что приводило к активному выходу Н 2. Добавляли метанол до тех пор, пока не выходил весь газ (приблизительно 5 мл). В это время- 29008709 холодную баню удаляли и добавляли приблизительно 5 мл насыщенного водного Na+K+ тартрата. Когда смесь нагревалась до комнатной температуры, добавляли дополнительную порцию насыщ. водн. Na+K+ тартрата и Et2O и перемешивание продолжали до тех пор, пока фазы не становились максимально прозрачными (приблизительно 1 ч). Фазы разделяли и органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали до приблизительно 10 мл суммарного объема из-за летучести. Сырую смесь объединяли с дополнительной порцией альдегида, полученного из 10 ммоль сложного эфира способом, описанным выше, и все использовали без очистки. К суспензии гидрида натрия(60% дисперсия в минеральном масле) в 25 мл ТГФ по каплям добавляли трет-бутил-Р,Р-диметилфосфоноацетат (3,0 мл, 15 ммоль) в течение 1 ч, чтобы контролировать выход Н 2. После завершения добавления быстро добавляли сырой альдегид в толуоле (приблизительно 20 мл суммарный объем) и смесь перемешивали при комнатной температуре в течение ночи. Смесь разделляи между Et2O и насыщ. водн.NH4Cl, фазы разделяли, органическую фазу промывали насыщенным солевым раствором, сушили(MgSO4) и концентрировали. Флэш-хроматография остатка (035% EtOAc/гексан) давала 1,0 г (29%,две стадии) ненасыщенного сложного эфира в виде светло-желтого масла. 1 Н ЯМР (СDСl3):6,75 (м,1 Н), 5,66 (м, 1 Н), 5,30 (м,2 Н), 2,03-2,29 (м, 3 Н), 1,58 (д, J=6,1 Гц, 3 Н), 1,41 (с, 9 Н), 0,91 (д, J=6,6 Гц, 3 Н). трет-Бутиловый эфир (3R,5S)-3-[бензил-(1-фенилэтил)амино]-5-метилокт-6-еновой кислоты. К раствору (S)-(-)-N-бензилметилбензиламина (0,60 мл, 2,85 ммоль) в 9,0 мл ТГФ при -78 С быстро по каплям добавляли н-бутиллитий (1,6 М в гексане, 1,6 мл) с получением темно-розового цвета. Смесь перемешивали при -78 С в течение 30 мин, в это время медленно по каплям добавляли трет-бутиловый эфир (5S)-5-метилокта-2,6-диеновой кислоты (0,5 г, 2,38 ммоль) в 1,0 мл ТГФ с получением светло-коричневого цвета, который темнел в течение 3 ч. Смесь перемешивали 3 ч при -78 С, затем гасили насыщ. водн. NH4Cl. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи, затем разделяли между EtOAc и насыщ. водн. NH4Cl. Фазы концентрировали и органическую фазу сушили (MgSO4) и концентрировали. Флэш-хроматография осадка (35% EtOAc/гексан) давала 0,52 г(3S,5R)-3-Амино-5-метилоктановая кислота. К раствору трет-бутилового эфира (3R,5S)-3-[бензил(1-фенилэтил)амино]-5-метилокт-6-еновой кислоты (0,92 г, 2,18 ммоль) в 50 мл МеОН добавляли 20% Pd/C (0,20 г) и смесь гидрогенировали в шейкере Парра при 48 фунт/кв.дюйм в течение 23 ч. Смесь фильтровали и концентрировали. К сырому аминоэфиру в 10 мл СН 2 Сl2 добавляли 1,0 мл трифторуксусной кислоты и раствор перемешивали при комнатной температуре в течение ночи. Смесь концентрировали и осадок растворяли в минимальном количестве Н 2 О и помещали на ионно-обменную смолу DOWEX-50WX8-100. Колонку элюировали Н 2 О до нейтрального показателя на лакмусе, затем концентрировали 5% водн. NH4OH (100 мл). Щелочные фракции концентрировали с получением 0,25 г (66%, две стадии) аминокислоты в виде не совсем твердого продукта. 1 Н HMP (CD3OD):3,41 (м, 1 Н), 2,36 (дд, J=5,1, 16,6 Гц, 1 Н), 2,25 (дд, J=8,1, 16,6 Гц, 1 Н), 1,42 (м,2 Н), 1,24 (м, 1 Н), 1,12 (м, 2 Н), 1,00 (м, 1 Н), 0,73 (д, J=6,4 Гц, 3 Н), 0,68 (т, J=6,8 Гц, 3 Н). LRMS: m/z 172,1(М-1). Пример 9. 2-Аминометил-8-метилнонановая кислота. 2-Аминометил-8-метил-нонановую кислоту получали из 6-метил-1-гептанола способом, аналогичным способу получения 2-аминометил-4,4,8-триметилнонановой кислоты, m/z 202,1 (М+). 2-Аминометил-4,8-диметилнонановая кислота.(R)-2,6-диметил гептанол-1-ол. Стружки магния (2,04 г, 84 ммоль) и кристаллический йод суспендировали в 5 мл ТГФ, затем добавляли 1-бром-3-метилбутан (0,3 мл, чистый). Смесь нагревали для инициализации реакции Гриньяра. Оставшийся 1-бром-3-метилбутан (8,63 мл, 72 ммоль) разбавляли в ТГФ(60 мл) и по каплям добавляли. Смесь перемешивали при комнатной температуре в течение 2 ч и охлаждали до -5 С. По каплям добавляли раствор хлорида меди (1,21 г, 9 ммоль) и LiCl (0,76 г, 18 ммоль) в ТГФ (50 мл), поддерживая температуру ниже 0 С. Полученную смесь перемешивали в течение 20 мин и по каплям добавляли (R)-3-бром-2-метилпропанол в ТГФ (20 мл), поддерживая температуру ниже 0 С. Смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакционную смесь гасили гидроксидом аммония и водой. Смесь разбавляли EtOAc и экстрагировали 3x20 мл EtOAc. Органические слои промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаточное масло очищали хроматографией на силикагеле (90:10 гексан/EtOAc) с получением 2,67 г (R)-2,6-диметилгептан-1-ола.(R)-1-Йод-2,6-диметилгептан. К смеси трифенилфосфина (6,55 г, 19,67 ммоль) в СН 2 Сl2 при 0 С добавляли йод (4,99 г, 19,67 ммоль) и имидазол (1,33 г, 19,67 ммоль). Смесь нагревали при комнатной температуре, перемешивали в течение 1 ч и охлаждали до 0 С, затем по каплям добавляли (R)-2,6-диметилгептан-1-ол в CH2Cl2 (5 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч, в течение которого смесь фильтровали через пад из целлита и твердые продукты промывали
МПК / Метки
МПК: C07C 229/28, A61P 25/00, A61P 1/00, A61K 31/195, C07C 229/08
Метки: аминокислоты, alpha;2δ-белку, аффинностью
Код ссылки
<a href="https://eas.patents.su/30-8709-aminokisloty-s-affinnostyu-k-alpha2delta-belku.html" rel="bookmark" title="База патентов Евразийского Союза">Аминокислоты с аффинностью к α2δ-белку</a>












