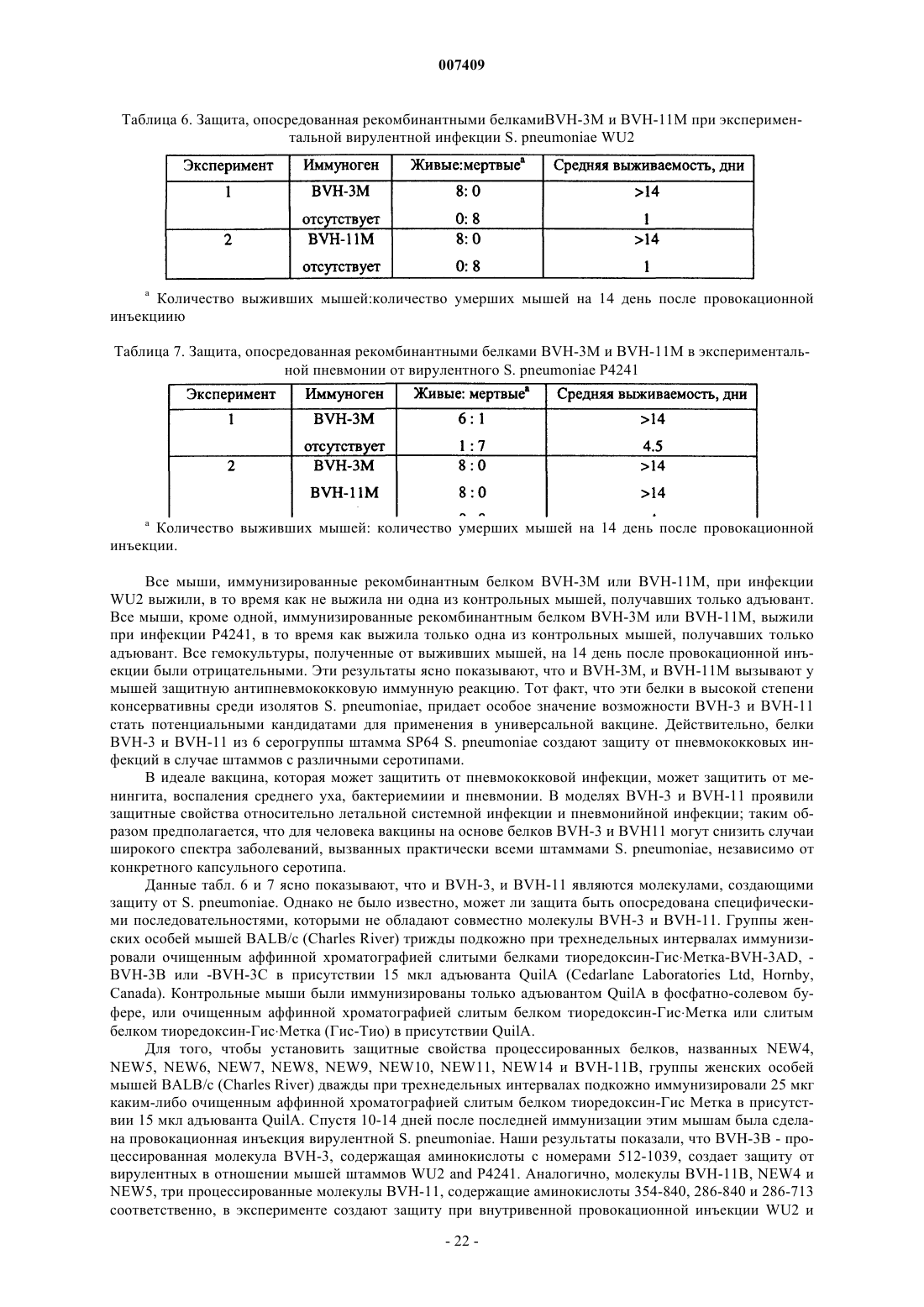
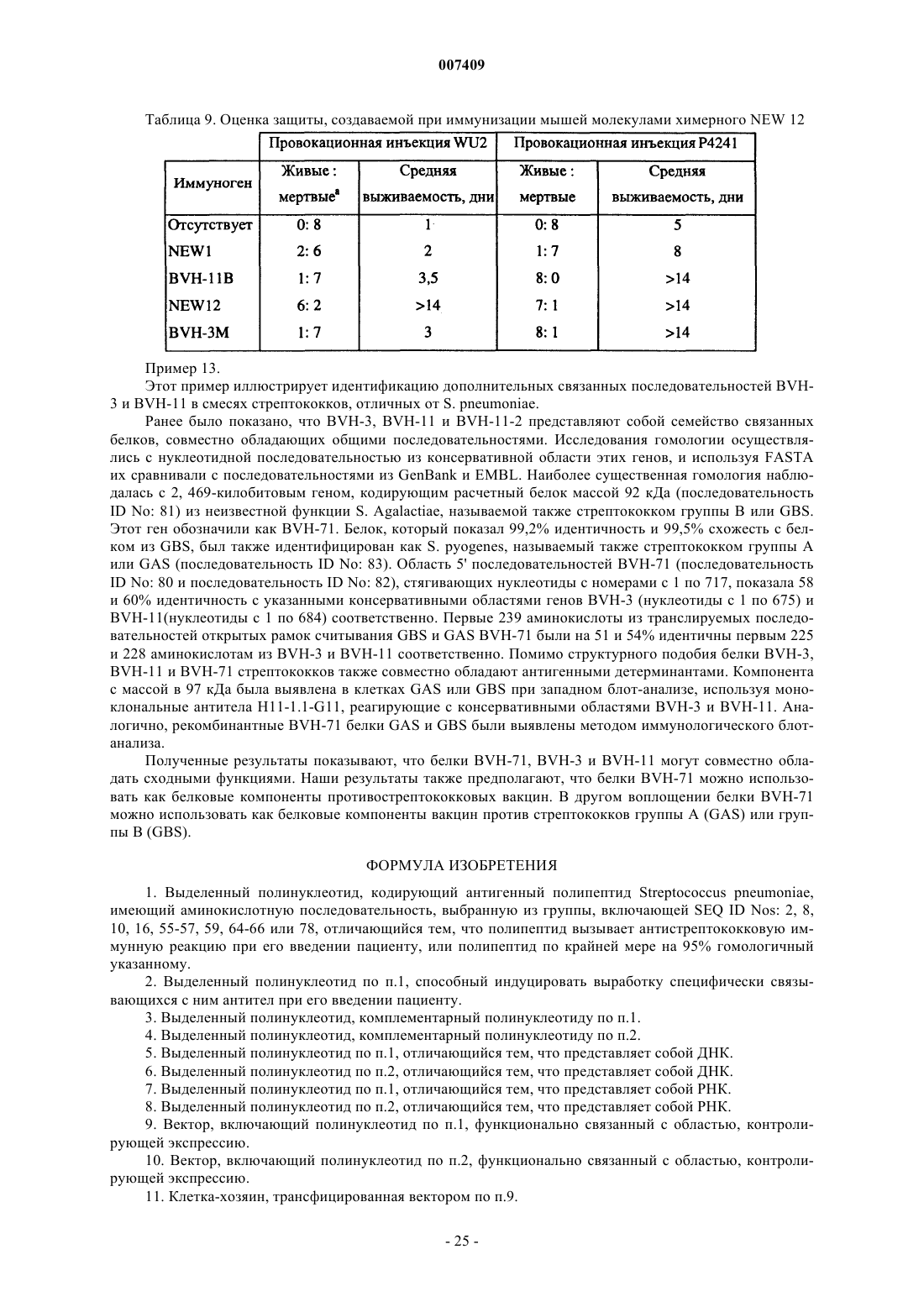
Антигенные полипептиды стрептококков, способы их получения и применения
Номер патента: 7409
Опубликовано: 27.10.2006
Авторы: Пинеау Изабель, Риоукс Клемент, Хамел Джози, Чарлэнд Натали, Бродеур Бернард Р., Мартин Денис
Формула / Реферат
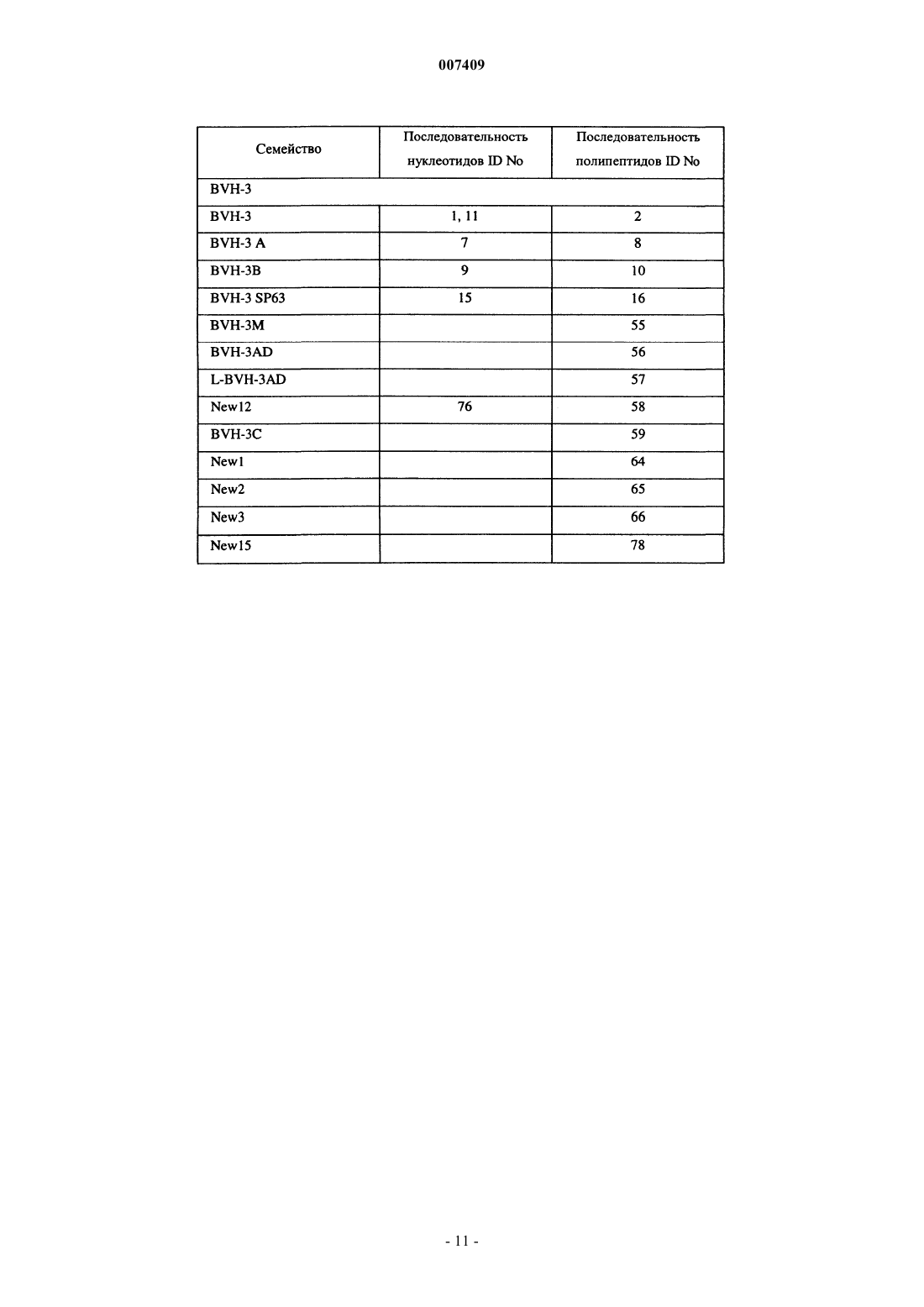
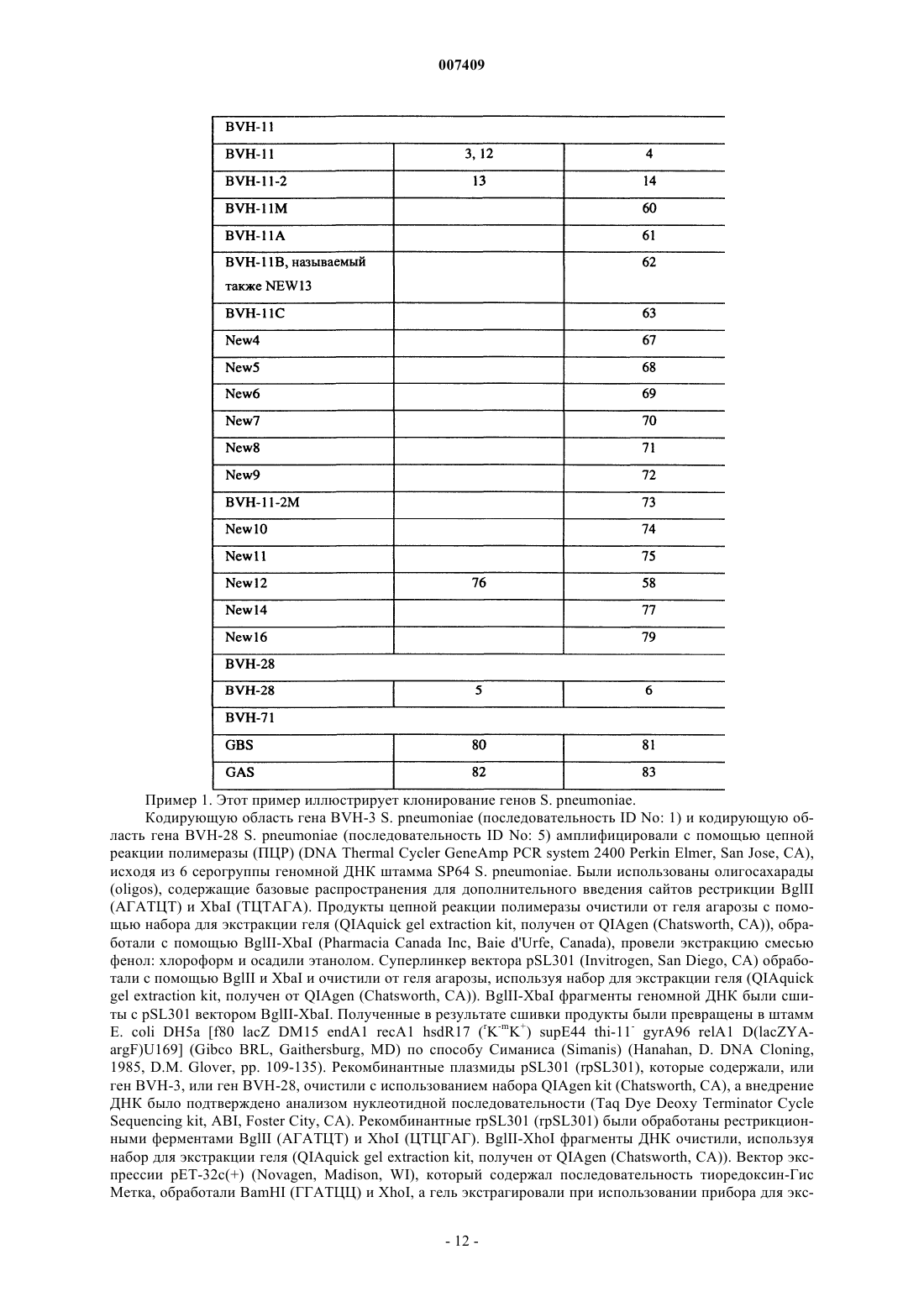
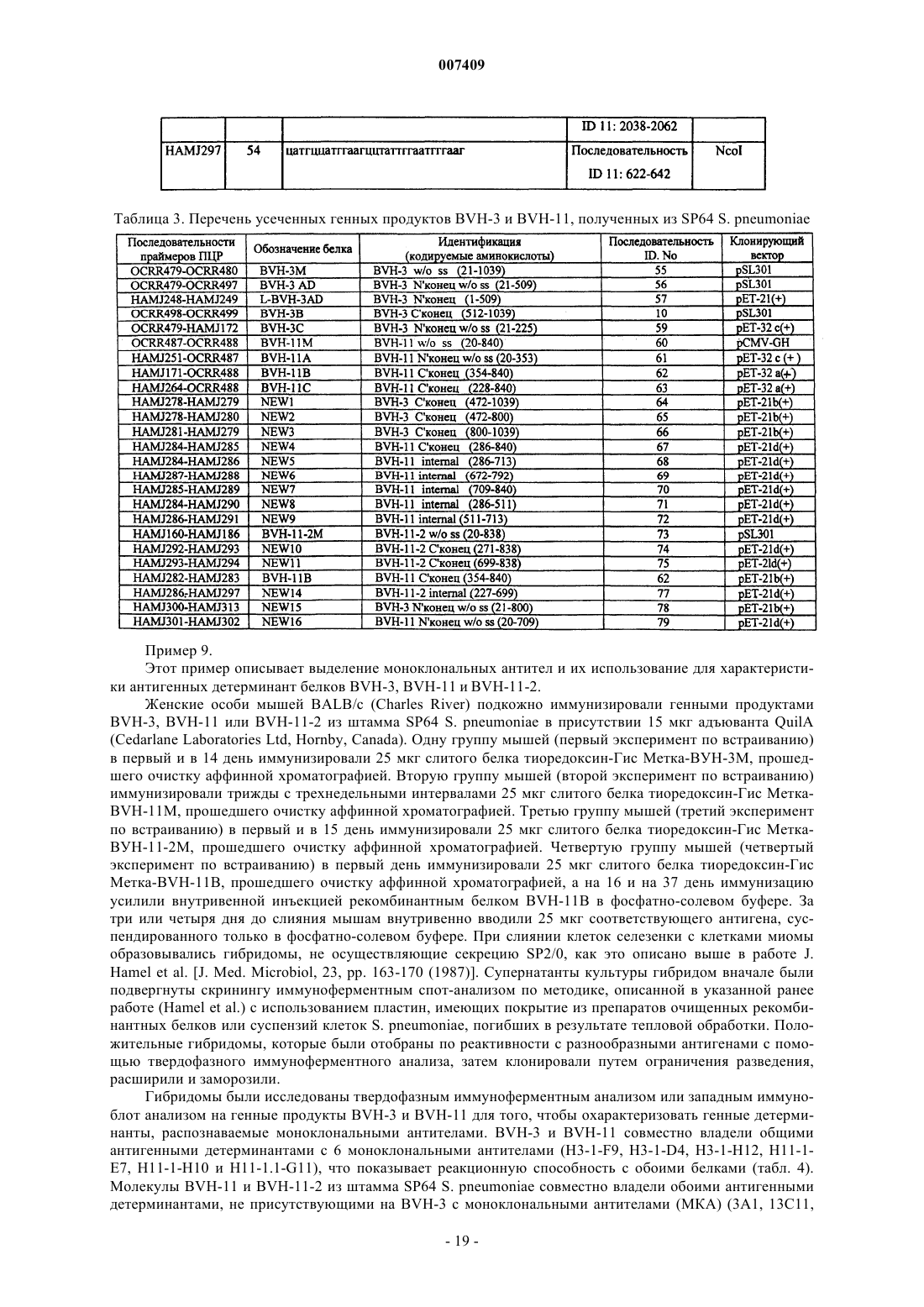
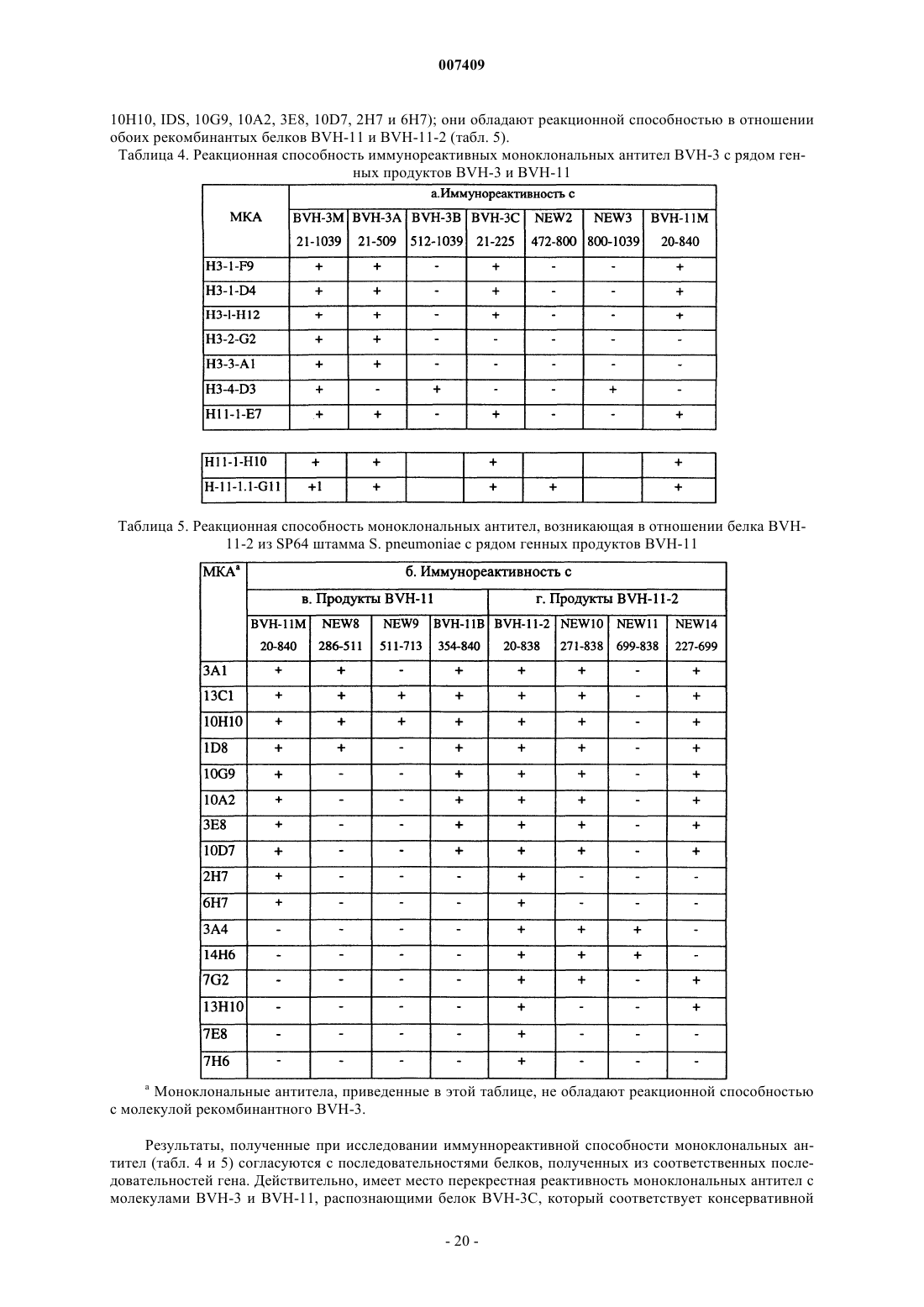
1. Выделенный полинуклеотид, кодирующий антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78, отличающийся тем, что полипептид вызывает антистрептококковую иммунную реакцию при его введении пациенту, или полипептид по крайней мере на 95% гомологичный указанному.
2. Выделенный полинуклеотид по п.1, способный индуцировать выработку специфически связывающихся с ним антител при его введении пациенту.
3. Выделенный полинуклеотид, комплементарный полинуклеотиду по п.1.
4. Выделенный полинуклеотид, комплементарный полинуклеотиду по п.2.
5. Выделенный полинуклеотид по п.1, отличающийся тем, что представляет собой ДНК.
6. Выделенный полинуклеотид по п.2, отличающийся тем, что представляет собой ДНК.
7. Выделенный полинуклеотид по п.1, отличающийся тем, что представляет собой РНК.
8. Выделенный полинуклеотид по п.2, отличающийся тем, что представляет собой РНК.
9. Вектор, включающий полинуклеотид по п.1, функционально связанный с областью, контролирующей экспрессию.
10. Вектор, включающий полинуклеотид по п.2, функционально связанный с областью, контролирующей экспрессию.
11. Клетка-хозяин, трансфицированная вектором по п.9.
12. Клетка-хозяин, трансфицированная вектором по п.10.
13. Способ получения полипептида, кодируемого полинуклеотидом по п.1, включающий культивирование клетки-хозяина по п.11 в условиях, обеспечивающих экспрессию указанного полипептида.
14. Способ получения полипептида, кодируемого полинуклеотидом по п.2, включающий культивирование клетки-хозяина по п.12 в условиях, обеспечивающих экспрессию указанного полипептида.
15. Выделенный антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID No: 2, 8, 10, 16, 55-57, 59, 64-66 или 78, способный вызывать антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по крайней мере на 95% гомологичный указанному.
16. Выделенный полипептид по п.15, способный индуцировать выработку специфически связывающихся с ним антител при его введении пациенту.
17. Выделенный полипептид по пп.15 и 16, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78.
18. Выделенный полипептид по п.15, отличающийся тем, что N-терминальный остаток метионина претерпел делецию.
19. Выделенный полипептид по п.16, отличающийся тем, что секреторная последовательность аминокислот претерпела делецию.
20. Химерный полипептид, содержащий два или более полипептидов по любому из пп.15 и 16 при условии, что они связаны таким образом, чтобы образовался химерный полипептид.
21. Химерный полипептид по п.20, содержащий полипептиды, имеющие аминокислотные последовательности SEQ ID No: 10 и SEQ ID No: 64, при условии, что они связаны таким образом, чтобы образовался химерный полипептид.
22. Химерный полипептид, имеющий формулу (I)
А - (В)m - (С)n - D, (I)
в которой m равно 0 или 1;
n равно 0 или 1;
А выбрано из полипептида по любому из пп.15 и 16;
В выбрано из полипептида по любому из пп.15 и 16;
С выбрано из полипептида по любому из пп.15, 16 и
D выбрано из полипептида по любому из пп.15 и 16.
23. Химерный полипептид по п.22, отличающийся тем, что
А выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 или SEQ ID No: 64;
В выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 или SEQ ID No: 64;
С выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 или SEQ ID No: 64; и
D выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 или SEQ ID No:64.
24. Вакцинная композиция, включающая полипептид по любому из пп.15-23 и фармацевтически приемлемый носитель, разбавитель или адъювант.
25. Способ профилактического или терапевтического лечения менингита, воспаления среднего уха, инфекции, бактериемии или пневмонии, вызванных стрептококками или сопутствующих стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по п.24.
26. Способ профилактического или терапевтического лечения стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по п.24.
27. Способ по любому из пп.25 и 26, отличающийся тем, что пациент является млекопитающим.
28. Способ по п.27, отличающийся тем, что пациент является человеком.
29. Способ по любому из пп.25 и 26, отличающийся тем, что указанная бактериальная инфекция представляет собой инфекцию, вызванную S. pneumoniae, S. pyogenes, S. agalactiae, S. dysgalactiae, S. uberis, Nocardia или Staphylococcus aureus.
30. Способ по п.29, отличающийся тем, что указанная бактериальная инфекция вызвана S. pneumoniae.
31. Применение вакцинной композиции по п.24 для профилактического или терапевтического лечения стрептококковой инфекции у животного, восприимчивого к ней или инфицированного стрептококками.
Текст
007409 Настоящее изобретение касается антигенов, в частности белковых антигенов пневмопатогенных стрептококков, полезных в качестве компонентов вакцины для терапии и/или профилактики. Предпосылки настоящего изобретенияS. pneumoniae - представляет собой существенный фактор заболеваний человека, в особенности детей, лиц старшего возраста и лиц с нарушенным иммунитетом. Эти бактерии часто выделяют от пациентов с инвазивными заболеваниями (такими, как бактериемия/септицимия, пневмония, менингит), которые широко распространены во всем мире и дают высокую смертность. Даже при применении адекватной терапии антибиотиками, пневмококковые инфекции все еще остаются причиной многих смертей. Хотя появление противомикробных средств снизило общую смертность от пневмококковой инфекции, во всем мире в настоящее время стало главной проблемой присутствие вызванной в результате пневмококковой микрофлоры. Эффективные пневмококковые вакцины могут оказать существенное воздействие на заболеваемость и смертность при инфекциях, связанных с S. pneumoniae. Такие вакцины могут также быть потенциально использованы для предотвращения среды возникновения отита у младенцев и детей раннего возраста. Усилия, связанные с разработкой пневмококковой вакцины, в основном были сконцентрированы на создании иммунной реакции на пневмококковый капсульный полисахарид. На основе антигенного различия было проидентифицировано более чем 80 пневмококковых капсульных серотипов. Доступная в настоящее время пневмококковая вакцина, которая включает 23 капсульных полисахарида, наиболее часто вызывающих заболевание, имеет существенные недостатки. Они в первую очередь относятся к слабой иммуногенности некоторых капсульных полисахаридов,многообразию серотипов и различиям в распределении серотипов по времени, географическому месту и возрастным группам. В частности, недостатком существующих вакцин и разрабатываемых в настоящее время капсульных конъюгатных вакцин является невозможность защиты детей младшего возраста от возникновения у всех серотипов других компонентов S. pneumoniae шпор (сегмента дуги преципитации, образующийся в случае иммуннохимической идентичности двух антигенов). Несмотря на то, что иммуногенность капсульных полисахаридов можно увеличить, специфичность серотипа все равно представляет собой главное ограничение для вакцин на основе полисахаридов. Использование антигена иммуногенного пневмококкового белка с антигенной консервативностью или в чистом виде, или в сочетании с другими компонентами, предполагает возможность существования пневмококковой вакцины на белковой основе. В опубликованной 7 мая 1998 г. заявке РСТ WO/18930 под названием "Streptococcus Pneumoniae antigens and vaccines" описаны определенные полипептиды, антигенность которых заявляется. Однако не сообщается о наличии у них какой-либо биологической активности. Поэтому сохраняется потребность в стрептококковых антигенах, которые могут быть использованы как компоненты вакцины для профилактики и/или терапии стрептококковой инфекции. Краткое изложение настоящего изобретения В основу изобретения положена задача создания антигенных полипептидов стрептококков, которые могут быть использованы в качестве компонентов вакцины для терапии и/или профилактики стрептококковой инфекции, а также разработка способов их получения и применения. Задача решена тем, что заявляется выделенный полинуклеотид, кодирующий антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы,включающей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78, при этом согласно изобретению полипептид вызывает антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по меньшей мере на 95% гомологичный указанному. Выделенный полинуклеотид характеризуется способностью индуцировать выработку специфически связывающихся с ним антител при его введении пациенту. Выделенный полинуклеотид, комплементарный указанному полинуклеотиду. Выделенный полинуклеотид представляет собой как ДНК, так и РНК. Изобретением также являются вектора, включающие указанные полинуклеотиды, функционально связанные с областью, контролирующей экспрессию, и клетки-хозяина, которые подвергнуты трансфекции указанными векторами. Другим аспектом изобретения являются способы продуцирования полипептидов, включающие культивирование указанных клеток-хозяина в условиях, обеспечивающих экспрессию указанного полипептида. Еще одним аспектом изобретения является выделенный антигенный полипептид StreptococcusID Nos. 2, 8, 10, 16, 55-57, 59, 64-66 или 78, способный вызывать антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по меньшей мере на 95% гомологичный указанному. Выделенный полипептид способен индуцировать выработку специфически связывающихся с ним антител при его введении пациенту.-1 007409 Указанные выделенные полипептиды имеют аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID Nos. 2, 8, 10, 16, 55-57, 59, 64-66 или 78. В одном варианте выделенный полипептид характеризуется тем, что N-терминальный остаток метионина претерпел делецию. В другом варианте выделенный полипептид характеризуется тем, что секреторная последовательность аминокислот претерпела делецию. Аспектом изобретения также является химерный полипептид, содержащий два или более упомянутых полипептидов при условии, что они связаны таким образом, чтобы образовался химерный полипептид. Аспектом изобретения является химерный полипептид, который содержит полипептиды, имеющие аминокислотные последовательности SEQ ID No. 10 и SEQ ID No. 64, при условии, что они связаны таким образом, чтобы образовался химерный полипептид. Согласно изобретению, химерный полипептид имеет формулу (I): А - (В)m - (С)n - Dn равно 0 или 1; А выбрано из упомянутого полипептида; В выбрано из упомянутого полипептида; С выбрано из упомянутого полипептида иD выбрано из упомянутого полипептида. Аспектом изобретения является химерный полипептид характеризующийся тем, что А выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 или SEQ ID 64; В выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиSEQ ID 64; С выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиD выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиSEQ ID 64. Еще одним аспектом данного изобретения является вакцинная композиция, включающая любой из указанных полипептидов и фармацевтически приемлемый носитель, разбавитель или адъювант. Другим аспектом изобретения является способ профилактического или терапевтического лечения менингита, воспаления среднего уха, инфекции бактериемии или пневмонии, вызванных стрептококками или сопутствующих стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества указанной вакцинной композиции. Более предпочтительным является способ профилактического или терапевтического лечения стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества указанной вакцинной композиции. Пациентом указанных способов являются млекопитающие, может быть и человек. Способ находит применение в случаях, когда бактериальная инфекция вызвана S. pneumoniae, S.pyogenes, S. agalactiae, S. dysgalactiae, S. uberis, Nocardia или Staphylococcus aureus, наиболее предпочтительно при бактериальной инфекции, вызванной S. pneumoniae. Применяют указанную вакцинную композицию для профилактического или терапевтического лечения стрептококковой инфекции у животного, восприимчивого к ней или инфицированного стрептококками. Краткое описание чертежей Фиг. 1 представляет собой последовательность ДНК гена BVH-3; последовательность SEQ ID No: l. Фиг. 2 - последовательность аминокислот белка BVH-3; последовательность SEQ ID No: 2. Фиг. 3 - последовательность ДНК гена BVH-11; последовательность SEQ ID No: 3. Фиг. 4 - последовательность аминокислот BVH-11 белка; последовательность SEQ ID No: 4. Фиг. 5 - последовательность ДНК гена BVH-28; последовательность SEQ ID No: 5. Фиг. 6 - последовательность аминокислот белка BVH-28; последовательность SEQ ID No: 6. Фиг. 7 - последовательность ДНК гена BVH-3A, которая соответствует 5'-концу BVH-3; последовательность SEQ ID No: 7. Фиг. 8 - последовательность аминокислот белка BVH-3A; последовательность SEQ ID No: 8. Фиг. 9 - ДНК последовательность гена BVH-3B, которая соответствует 3'-концу BVH-3; последовательность SEQ ID No: 9. Фиг. 10 - последовательность аминокислот белка BVH-3B; последовательность SEQ ID No: 10. На фиг. 11 приведено сравнение предсказанных последовательностей аминокислот открытых рамок считывания BVH-3 из штаммов S. pneumoniae: WU2, Rx1, JNR.7/87, SP64, Р 4241 и А 66, которое проводили с использованием программы Clustal W из серии MacVector компьютерных программ по секвенированию (версия 6.5). Внизу приведенного ряда имеется общая линия, в которой знакии . указывают на идентичные и одинаковые аминокислотные остатки соответственно.-2 007409 На фиг. 12 приведено сравнение предсказанных последовательностей аминокислот открытых рамок считывания BVH-3 из штаммов S. pneumoniae: WU2, Rxl, JNR.7/87, SP64, Р 4241, А 66 и SP63, которое проводили с использованием программы Clustal W из серии MacVector компьютерных программ по секвенированию (версия 6.5). Внизу приведенного ряда имеется общая линия, в которой знакии . указывают на идентичные и одинаковые аминокислотные остатки соответственно. На фиг. 13 приведено сравнение предсказанных последовательностей аминокислот белков BVH-11 из разных штаммов S. pneumoniae. Степень идентичности (I) и тождественности (S) определяли с использованием программы Clustal W из серии MacVector компьютерных программ по секвенированию(версия 6.5). Фиг. 14 представляет собой последовательность ДНК, которая включает целиком ген BVH-3 (открытая рамка считывания ORF у нуклеотидов с номерами с 1777 по 4896); последовательность SEQ IDNo: 11. Фиг. 15 представляет собой последовательность ДНК, которая включает целиком ген BVH-11 (открытая рамка считывания у нуклеотидов с номерами с 45 по 2567); последовательность SEQ ID No: 12. Фиг. 16 представляет собой ДНК последовательность, которая включает целиком ген BVH-11-2(открытая рамка считывания у нуклеотидов с номерами 114 по 2630); последовательность SEQ ID No: 13. Фиг. 17 представляет собой последовательность аминокислот BVH-11-2 белка; последовательностьSEQ ID No: 14. Фиг. 18 представляет собой последовательность ДНК гена SP63 BVH-3; последовательность SEQID No: 15. Фиг. 19 представляет собой последовательность аминокислот белка SP63 BVH-3; последовательность SEQ ID No: 16. Фиг. 20 представляет собой последовательность аминокислот белка BVH-3M; последовательностьSEQ ID No: 55. Фиг 21 представляет собой последовательность аминокислот белка BVH-3AD; последовательностьSEQ ID No: 56. Фиг. 22 представляет собой последовательность аминокислот белка L-BVH-3-AD; последовательность SEQ ID No: 57. Фиг. 23 представляет собой последовательность аминокислот белка NEW12; последовательностьSEQ ID No: 58. Фиг. 24 представляет собой последовательность аминокислот белка BVH-3C; последовательностьSEQ ID No: 59. Фиг. 25 представляет собой последовательность аминокислот белка BVH-11M; последовательностьSEQ ID No: 60. Фиг. 26 представляет собой последовательность аминокислот белка BVH-11A; последовательностьSEQ ID No: 61. Фиг. 27 представляет собой последовательность аминокислот белка BVH-11B (называемого также белком New 13); последовательность SEQ ID No: 62. Фиг. 28 представляет собой последовательность аминокислот белка BVH-11 С; последовательностьSEQ ID No: 63. Фиг. 29 представляет собой последовательность аминокислот белка NEW1; последовательностьSEQ ID No: 64. Фиг. 30 представляет собой последовательность аминокислот белка NEW2; последовательностьSEQ ID No: 65. Фиг. 31 представляет собой последовательность аминокислот белка NEW3; последовательностьSEQ ID No: 66. Фиг. 32 представляет собой последовательность аминокислот белка NEW4; последовательностьSEQ ID No: 67. Фиг. 33 представляет собой последовательность аминокислот белка NEW5; последовательностьSEQ ID No: 68. Фиг. 34 представляет собой последовательность аминокислот белка NEW6; последовательностьSEQ ID No: 69. Фиг. 35 представляет собой последовательность аминокислот белка NEW7; последовательностьSEQ ID No: 70. Фиг. 36 представляет собой последовательность аминокислот белка NEW8; последовательностьSEQ ID No: 71. Фиг. 37 представляет собой последовательность аминокислот белка NEW9; последовательностьSEQ ID No: 72. Фиг. 38 представляет собой последовательность аминокислот белка BVH-11-2M; последовательность SEQ ID No: 73. Фиг. 39 представляет собой последовательность аминокислот белка NEW10; последовательность-3 007409 Фиг. 40 представляет собой последовательность аминокислот белка NEW11; последовательностьSEQ ID No: 75. Фиг. 41 представляет собой последовательность ДНК гена NEW12; последовательность SEQ ID No: 76. Фиг. 42 представляет собой последовательность аминокислот белка NEW14; последовательностьSEQ ID No: 77. Фиг. 43 представляет собой последовательность аминокислот белка NEW15; последовательностьSEQ ID No: 78. Фиг. 44 представляет собой последовательность аминокислот белка NEW16; последовательностьSEQ ID No: 79. Фиг. 45 представляет собой последовательность ДНК гена GBS BVH-71; последовательность SEQID No: 80. Фиг. 46 представляет собой последовательность аминокислот белка GBS BVH-71; последовательность SEQ ID No: 81. Фиг. 47 представляет собой последовательность ДНК гена GAS BVH-71; последовательность SEQID No: 82. Фиг. 48 представляет собой последовательность аминокислот белка GAS BVH-71; последовательность SEQ ID No: 83. Подробное описание настоящего изобретения Согласно одному аспекту настоящее изобретение обеспечивает выделенный полинуклеотид, кодирующий антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78, характеризующийся тем, что полипептид вызывает антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по меньшей мере на 95% гомологичный указанному. Выделенный полинуклеотид способен индуцировать выработку специфически связывающихся с ним антител при его введении пациенту. Выделенный полинуклеотид, комплементарный указанному полинуклеотиду. Выделенный полинуклеотид представляет собой как ДНК, так и РНК. Согласно другим аспектам обеспечиваются вектора, содержащие полинуклеотиды по настоящему изобретению, действительно связанные с областью, контролирующей экспрессию, и клетки-хозяина,которые подвергнуты трансфекции указанными векторами, а также способы продуцирования полипептидов, включающие культивирование указанных клеток-хозяина в условиях, подходящих для экспрессии. Согласно еще одному своему аспекту обеспечиваются новые полипептиды, которые кодируются полинуклеотидами по настоящему изобретению. Согласно одному своему аспекту обеспечивается по настоящему изобретению выделенный антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID Nos. 2, 8, 10, 16, 55-57, 59, 64-66 или 78, способный вызывать антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по меньшей мере на 95% гомологичный указанному. Выделенный полипептид способен индуцировать выработку специфически связывающихся с ним антител при его введении пациенту. Указанные выделенные полипептиды имеют аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID Nos. 2, 8, 10, 16, 55-57, 59, 64-66 или 78. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, выбранной из последовательностей SEQ ID Nos: 2, 8, 10 или их фрагментов, аналогов или производных. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, выбранной из SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66, 78 или их фрагментов, аналогов или производных. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, выбранной из последовательностей SEQ ID Nos: 2, 10, 16, с 55 по 57, 59, 64-66, 78 или их фрагментов, аналогов или производных. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, выбранной из последовательностей SEQ ID Nos: 2, 10, 16 или их фрагментов, аналогов или производных. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, включающую последовательность SEQ ID No: 2 или ее фрагменты, аналоги или производные. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, включающую последовательность SEQ ID No: 10 или ее фрагменты, аналоги или производные. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризую-4 007409 щихся последовательностью аминокислот, включающую последовательность SEQ ID No: 16 или ее фрагменты, аналоги или производные. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, выбранной из последовательностей SEQ ID Nos: 10, 55-57, 59,64-66, 78 или их фрагментов, аналогов или производных. Согласно одному своему аспекту настоящее изобретение касается полипептидов, характеризующихся последовательностью аминокислот, включающую последовательность SEQ ID No: 64 или ее фрагменты, аналоги или производные. По еще одному своему воплощению настоящее изобретение касается также химерных полипептидов, которые включают один или более полипептидов или их фрагментов, аналогов или производных,описанных в настоящем изобретении. По другому своему воплощению настоящее изобретение касается также химерных полипептидов,которые включают один или более полипептидов или их фрагментов, аналогов или производных, приведенных на фигурах к настоящему изобретению. В еще одном своем воплощении настоящее изобретение касается также химерных полипептидов,которые включают два или более полипептидов, выбранных из последовательностей SEQ ID Nos: 2, 8,10, 16, 55-57, 59, 64-66 или 78 или их фрагментов, аналогов или производных; при условии, что указанные полипептиды или их фрагменты, аналоги или производные связаны таким образом, чтобы образовался химерный полипептид. Согласно еще одному воплощению указанный химерный полипептид должен содержать от 2 до 5 полипептидов. Согласно еще одному воплощению указанный химерный полипептид должен содержать от 2 до 4 полипептидов. Согласно еще одному воплощению указанный химерный полипептид должен содержать от 2 до 3 полипептидов. Согласно еще одному воплощению указанный химерный полипептид должен содержать 2 полипептида. По другому воплощению обеспечивается химерный полипептид формулы (I)n равно 0 или 1; А выбирают из последовательностей SEQ ID Nos: 2, 8, 10, 16,55-57, 59, 64-66 или 78; В выбирают из последовательностей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78; С выбирают из последовательностей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78 иD выбирают из последовательностей SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78. По одному из воплощений химерные полипептиды по настоящему изобретению содержат такие полипептиды, в которых содержатся приведенные далее воплощения, или независимо друг от друга, или при их сочетании. В еще одном воплощении А представляет собой последовательность SEQ ID No: 10 или ее фрагменты, аналоги или производные. В еще одном воплощении А представляет собой последовательность SEQ ID No: 64 или ее фрагменты, аналоги или производные. В другом воплощении В представляет собой последовательность SEQ ID No: 10 или ее фрагменты,аналоги или производные. В другом воплощении В представляет собой последовательность SEQ ID No: 64 или ее фрагменты,аналоги или производные. В еще одном воплощении С представляет собой последовательность SEQ ID No: 10 или ее фрагменты, аналоги или производные. В еще одном воплощении С представляет собой последовательность SEQ ID No: 64 или ее фрагменты, аналоги или производные. В другом воплощении D представляет собой последовательность ID SEQ No: 10 или их фрагменты,аналоги или производные. В другом воплощении D представляет собой последовательность ID SEQ No: 64 или их фрагменты,аналоги или производные. По другому воплощению m равно 0. По другому воплощению n равно 0. В еще одном воплощении m и n равны 0. В соответствии с настоящим изобретением все нуклеотиды, кодирующие полипептиды и химерные полипептиды, входят в границы настоящего изобретения. По другому воплощению указанные полипептиды или химерные полипептиды в соответствии с настоящим изобретением являются антигенными.-5 007409 По другому воплощению указанные полипептиды или химерные полипептиды в соответствии с настоящим изобретением могут вызвать у индивидуума иммунную реакцию. Согласно другому воплощению настоящее изобретение касается также полипептидов, способных сформировать антитела, обладающих специфическим связыванием с указанными и описанными выше полипептидами или химерными полипептидами по настоящему изобретению. Антитело, которое обладает специфическим связыванием представляет собой антитело, которое распознает выбранный полипептид и связывается с ним, но в значительной степени не распознает другие молекулы в образце (например, в биологическом образце, который реально включает выбранный пептид) и не связывается с ним. Специфическое связывание можно оценить с помощью метода твердофазного иммуноферментного анализа, в котором выбранный полипептид используется в качестве антигена. Если иного не оговорено, то все используемые здесь технические и научные термины имеют те же значения, которые общеприняты у людей, квалифицированных в той области, к которой относится настоящее изобретение. На все публикации, патентные заявки, патенты и другие упоминаемые здесь источники, приведены полные ссылки. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения. Используемые здесь термины фрагменты, производные или аналоги полипептидов по настоящему изобретению включают такие полипептиды, в которых один или более аминокислотных остатков замещены на консервативный или на неконсервативный аминокислотный остаток (предпочтительно,на консервативный остаток), и он может быть природным или неприродным. По одному воплощению производные и аналоги полипептидов по настоящему изобретению должны иметь приблизительно 70% идентичность с теми последовательностями, которые приведены на фигурах, или с их фрагментами. То есть, 70% указанных остатков одинаковы. По другому воплощению полипептиды должны обладать более чем 75% гомологией. Согласно другому воплощению полипептиды должны обладать более чем 85% гомологией. По еще одному воплощению полипептиды должны обладать более чем 80% гомологией. По другому воплощению полипептиды должны обладать более чем 85% гомологией. По другому воплощению полипептиды должны обладать более чем 90% гомологией. По другому воплощению полипептиды должны обладать более чем 95% гомологией. По другому воплощению полипептиды должны обладать более чем 99% гомологией. Согласно другому воплощению производные и аналоги полипептидов по настоящему изобретению должны иметь менее чем приблизительно 20 замещений, модификаций или делеций аминокислотных остатков, а более предпочтительно - менее чем 10. Предпочтительными замещениями являются такие, которые в данной области технологии известны как консервативные, а именно, указанные замещенные остатки наделены физическими или химическими свойствами, такими, как размер, заряд или функциональные группы. В соответствии с настоящим изобретением полипептиды по настоящему изобретению включают и полипептиды, и химерные полипептиды. Включены также полипептиды, слитые с другими соединениями, меняющими биологические или фармацевтические свойства полипептидов, а именно, с полиэтиленгликолем для увеличения периода полураспада; с лидерной или секреторной последовательностью аминокислот для облегчения очистки; препро- и пропоследовательностями; и (поли)сахаридами. Кроме того, в тех случаях, когда обнаружено, что области аминокислот полиморфные, то для более эффективного соответствия различным антигенным детерминантам разных стрептококковых штаммов,может быть желательным изменить одну и/или более специфических аминокислот. Более того, полипептиды по настоящему изобретению могут быть модифицированы терминальным-NH2 ацилированием (например, ацилированием, или амидированием тиогликолевой кислотой, амидированием по терминальной карбоксигруппе, например с помощью аммиака или метиламина) для того, чтобы обеспечить стабильность, повышенную гидрофобность в целях сцепления или связывания химической связью с подложкой или с другой молекулой. Рассматриваются также гетеро- и гомопептидные мультимеры полипептидных фрагментов, аналогов и производных. Эти полимерные формы включают, например, один или более полипептидов, сшитых с перекрестно-сшивающими агентами, такими как авидин/биотин, глутаровый альдегид или диметилперимидат. Такие полимерные формы также включают полипептиды, содержащие две или более последовательно соединенные последовательности или инвертные заменимые последовательности, продуцированные из мультицистронных матричных РНК (мРНК) методом генной инженерии. Предпочтительно, чтобы фрагмент, аналог или производное полипептида по настоящему изобретению содержал по меньшей мере одну антигенную область, т.е. по меньшей мере одну антигенную детерминанту. Для того, чтобы обеспечить образование антигенных полимеров (т. е. синтетических мультимеров) могут быть использованы полипептиды, содержащие бис-галоацетиловые группы, нитроарилгалогениды или им подобные, в которых эти реагенты являются специфичными для тиогруппы. Следовательно, сцепление двух меркаптогрупп различных пептидов может представлять собой-6 007409 простую одинарную химическую связь или оно может быть образовано группой химического связывания, содержащей по крайней мере 4, но не более 16 атомов углерода (а обычно - не более чем около 14 атомов). Согласно частному воплощению полипептидные фрагменты, аналоги или производные по настоящему изобретению не содержат начального метионинового остатка. Предпочтительно, чтобы полипептиды не содержали лидерной или секреторной последовательности (сигнальной последовательности). Сигнальный участок полипептида по настоящему изобретению можно определить по известной методике молекулярной биологии. Обычно искомый полипептид может быть выделен из культуры стрептококков, а затем секвенирован, чтобы определить начальный (первый) остаток в зрелом белке и таким образом установить последовательность указанного зрелого полипептида. Согласно другому аспекту обеспечиваются составы вакцин, содержащие один или более полипептидов стрептококка по настоящему изобретению в смеси с фармацевтически приемлемым носителем или адъювантом. Подходящие адъюванты включают масла, а именно полный или неполный адъювант Френда (Freund); соли, а именно AlK(SO4)2, AlNa(SO4)2, AlNH4(SO4)2, кремнезем, каолин; углеродный полинуклеотид, а именно poly IС и poly AU. Предпочтительные адъюванты включают QuilA и Alhydrogel. Вакцины по настоящему изобретению можно ввести парентерально, используя инъекцию, быструю инфузию, метод назофарингеальной абсорбции, дермоабсорбции, а также буккальным или оральным путем. Фармацевтически приемлемые носители включают также анатоксин столбняка. Составы вакцин по настоящему изобретению используются для лечения или профилактики стрептококковых инфекций и/или заболеваний, а также симптомов, сопутствующих стрептококковой инфекции, как это описано в работе P.R. Murray (Ed, in chief), E.J. Baron, M.A. Pfaller, F.C. Tenover and R.H.Yolken. Manual of Clinical Microbiology, ASM Press, Washington, D. C. sixth edition, 1995, 1482 p, на которую здесь приведена ссылка. По одному воплощению составы вакцин по настоящему изобретению используются для лечения или профилактики менингита, воспаления среднего уха, бактериемии или пневмонии. Согласно одному воплощению составы вакцин по настоящему изобретению используются для лечения или профилактики стрептококковых инфекций и/или заболеваний, а также симптомов, сопутствующих стрептококковой инфекции, в частности S. pneumoniae, стрептококковая инфекция группы A (S.pyogenes), стрептококковая инфекция группы В (GBS или S. agalactiae), S. disgalactiae, S.uberis, Nocardia наравне с золотистым стафилококком (Staphyloccocus aureus). В еще одном воплощении указанной стрептококовой инфекцией является S. pneumoniae. В отдельном воплощении вакцины вводят тем особям, у которых имеется риск стрептококковой инфекции, таким как, например, особи младшего возраста, особи старшего возраста и особи с нарушенным иммунитетом. Термин особи, используемый в настоящем описании, включает млекопитающих. Согласно еще одному воплощению таким млекопитающим является человек. Составы вакцин предпочтительно представляют собой единичную дозировку, составляющую приблизительно от 0,001 до 100 мкг/кг (антиген/масса тела), более предпочтительно от 0,01 до 10 мкг/кг, а наиболее предпочтительно от 0,1 до 1 мкг/кг. Эту дозировку используют 1-3 раза с интервалом между иммунизациями, составляющим приблизительно 1-6 недель. Согласно другому воплощению настоящего изобретения обеспечиваются полинуклеотиды, кодирующие полипептиды, характеризующиеся тем, что последовательность их аминокислот выбрана из последовательностей SEQ ID Nos: 2, 4, 6, 8, 10, 14, 16, с 55 по 75, с 77 по 79, 81, 83 или из фрагментов, аналогов или производных. В одном воплощении полинуклеотидами являются такие, которые изображены в последовательностях SEQ ID No: l, 3, 5, 7, 9, 11, 12, 13, 15, 76, 80, 82, которые могут включать открытые рамки считывания (ORF), кодирующие полипептиды по настоящему изобретению. Следует принять во внимание, что последовательности полинуклеотидов, изображенные на приведенных чертежах, могут быть изменены вырожденным кодоном, кодирующим полипептиды по настоящему изобретению. Следовательно, настоящее изобретение обеспечивает, помимо этого полинуклеотиды, которые гибридизируются с описанными выше последовательностями полинуклеотидов (или их комплементарными последовательностями), при этом идентичность этих последовательностей составляет 50%. В одном воплощении идентичность последовательностей составляет по меньшей мере 70%. В одном воплощении идентичность последовательностей составляет по крайней мере 75%. В одном воплощении идентичность последовательностей составляет по крайней мере 80%. В одном воплощении идентичность последовательностей составляет по меньшей мере 85%. В одном воплощении идентичность последовательностей составляет по крайней мере 90%. В еще одном воплощении настоящего изобретения полинуклеотиды способны к гибридизации в жестких условиях, т.е. при наличии по крайней мере 95% идентичности.-7 007409 В другом воплощении идентичность составляет более 97%. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательностях SEQ ID Nos: l, 3, 7, 9, 11, 12, 13, 15, 76, 80, 82 , кодирующих полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: l, 3, 9, 11, 12, 13, 15, 76, 80, 82, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: l, 3, 9, 11, 26 12, 13, 15, 76, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: l, 3, 7, 9, 11, 12, 13, 15, 76, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: l, 7, 9, 11, 15, 76, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: 1,9, 11, 15, 76, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: l, 7, 9, 11, которые могут включать открытые рамки считывания, кодирующие полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: l, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 7, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 9, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 11, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 15, кодирующей полипептиды по настоящему изобретению. В другом воплощении полинуклеотидами являются такие, которые показаны в последовательностяхSEQ ID Nos: 3, 12, 13, 76, кодирующих полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 3, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 12, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 13, кодирующей полипептиды по настоящему изобретению. По другому воплощению полинуклеотидами являются такие, которые показаны в последовательности SEQ ID No: 76, кодирующей полипептиды по настоящему изобретению. Как легко будет понято квалифицированными в данной технологии людьми, полинуклеотиды включают и ДНК, и РНК. Настоящее изобретение также включает полинуклеотиды, комплементарные полинуклеотидам,описанным в настоящей заявке. В другом воплощении полинуклеотиды, кодирующие полипептиды по настоящему изобретению,или их фрагменты, аналоги или производные могут быть использованы в способе иммунизации ДНК. То есть, они могут быть включены в вектор, который при инъекции способен к репликации и экспрессии,продуцируя таким образом антигенный полипептид in vivo. Например, полинуклеотиды могут быть включены в вектор плазмиды под контролем промотора цитомегаловируса, являющегося функциональным для клеток эукариот. Предпочтительно этот вектор вводится внутримышечной инъекцией. Согласно другому аспекту обеспечивается процесс продуцирования полипептидов по настоящему изобретению методом генной инженерии путем экспрессии полинуклеотида, кодирующего указанный полипептид в клетке-хозяина, и выделения полученного в результате экспрессии полипептидного продукта. Или же, указанные полипептиды могут быть продуцированы согласно разработанной технологии химического синтеза, а именно синтезом в жидкой фазе или твердофазным синтезом олигопептидов, которые сшивают для получения полипептида целиком (блочная сшивка). Основные способы получения и расшифровки полинуклеотидов и полипептидов описаны в приведенных далее работах: Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed, Cold SpringB.A., Humana Press, Totowa, New Jersey, 1997, 490 pages; Protein Purification, Principles and Practices,Scopes R.K., Springer-Verlag, New York, 3rd Edition, 1993, 380 pages; Current Protocols in Immunology, Edited by Coligan J.E. et al., John WileySons Inc., New York; на которые мы ссылаемся. Чтобы получить рекомбинант клетки, хозяина подвергают трансфекции вместе с векторами, кодирующими указанный полипептид, а затем культивируют в питательной среде, которую изменили в целях активирования промоторов, выбора трансформантов или амплификации генов. Подходящими векторами являются такие, которые жизнеспособны, а также способны к репликации в выбранной клетке-хозяине, и которые включают хромосомальные, нехромосомальные и синтетические последовательности ДНК (например, плазмиды бактерий, ДНК-содержащий фаг, бакуловирус, плазмиды дрожжей, векторы, полученные комбинацией плазмид ДНК и ДНК-содержащего фага). Последовательность полипептида можно включить в вектор у определенного сайта при использовании рестрикционного фермента таким образом, чтобы она была реально сцеплена с зоной контролируемой экспрессии, содержащей промотор, связывающий участок рибосомы (участок с общим типичным элементом структуры или последовательность Shine-Dalgarno), и, необязательно, оператор (контролирующий элемент). Отдельные компоненты зоны контролируемой экспрессии, подходящие для данной клетки-хозяина и вектора, можно подобрать в соответствии с установленными принципами молекулярной биологии (SambrookMolecular Biology, Edited by Ausubel P.M. et al., John Wiley and Sons, Inc. New York; упомянуто здесь в виде ссылки). Подходящие промоторы включают (но ими не ограничены) промотор LTR (промотор длинного концевого повтора) или промотор SV40, промоторы E.coli lac, tac или trp и Pt - промотор фага(lambda). Векторы предпочтительно следует включать в начале репликации (также, как и маркеры отбора, а именно резистентный ампициллину ген). Подходящие бактериальные вектора включают рЕТ,pQE70, pQE60, pQE-9, pbs, pD10 phagescript, psiX174, pbluescript SK, pbsks, pNH8A, pNH16A, pNH18A,pNH46A, ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5 и вектора эукариот: pBlueBacIII, pWLNEO,pSV2CAT, pOG44, pXT1, pSG, pSVK3, pBPV, pMSG и pSVL. Клетки-хозяина могут представлять собой бактериальные клетки, а именно: E.coli, Bacillus subtilis, Streptomyces; клетки грибков, а именно: Aspergillus niger, Asperaillus nidulins: клетки дрожжей, а именно: Saccharomvces или клетки эукариот, а именно: СНО, COS. При экспрессии указанного полипептида в культуру, клетки обычно собирают центрифугированием, потом их разрушают физическими или химическими средствами (если подвергшийся экспрессии полипептид не выделяется в эту среду), а получившийся в результате неочищенный (сырой) экстракт сохраняют для выделения целевого полипептида. Очистка указанного полипептида от культуральной среды или лизата может быть проведена по разработанной технологии, учитывая свойства самого полипептида (а именно, используя осаждение сульфатом аммония или этанолом, экстракцию кислотой, анионную или катионную ионообменную хроматографию, фосфоцеллюлозную хроматографию, гидрофобную хроматографию, гидроксиапатитную хроматографию и хроматографию лектином). Окончательную очистку можно провести при использовании жидкостной хроматографии высокого разрешения (ВЭЖХ). Полипептид может быть подвергнут экспрессии вместе с лидерной или секреционной последовательностью или без них. В первом случае лидерную последовательность можно удалить с использованием пост-трансляционной обработки (см. заявки США 4,431,739; 4,425,437; и US 4,338,397, на которые здесь приведены ссылки), или путем химического удаления, проведенного после очистки указанного прошедшего экспрессию полипептида. Согласно другому аспекту стрептококковые полипептиды по настоящему изобретению можно использовать в тестах на стрептококковую инфекцию, в частности на инфекцию S. pneumoniae. Возможно несколько диагностических способов, например способы выявления стрептококкового организма в биологическом образце; они могут быть проведены по следующей методике: а) получение от пациента биологического образца; б) инкубирование антитела или реакционноспособного фрагмента со стрептококковым полипептидом по настоящему изобретению вместе с указанным биологическим образцом для образования их смеси; и в) выявление специфически связанного антитела или фрагмента в указанной смеси, что указывает на присутствие стрептококков. Или же, выявление антитела, специфичного к антигену стрептококка в биологическом образце, содержащем указанное антитело или в образце с предполагаемым его содержанием, можно осуществить следующим образом: а) получение от пациента биологического образца; б) инкубирование одного или более стрептококковых полипептидов по настоящему изобретению или их фрагментов вместе с указанным биологическим образцом для образования их смеси; и в) выявление специфически связанного антитела или фрагмента в указанной смеси, что указывает на присутствие стрептококков. Квалифицированный в этой технологии человек легко поймет, что такой диагностический тест может принимать разные формы, включая иммунологический тест (типа твердофазного иммуноферментно-9 007409 го анализа), радиоиммунологический анализ или латексный анализ, которые важны для определения того факта, присутствуют ли в организме антитела, специфичные для данного белка. Последовательности ДНК, кодирующие полипепид по настоящему изобретению могут быть также использованы для создания ДНК-зондов для их применения в целях выявления стрептококков в биологическом образце, в котором предполагается присутствие этих бактерий. Способ выявления по настоящему изобретению включает: а) получение от пациента биологического образца; б) инкубирование одного или более ДНК-зондов, имеющих последовательность ДНК, кодирующей полипептид по настоящему изобретению или его фрагменты, вместе с указанным биологическим образцом для образования их смеси; и в) выявление специфически связанного ДНК-зонда в указанной смеси, что указывает на присутствие стрептококков. ДНК-зонды по настоящему изобретению можно также использовать для выявления в образце циркулирующих стрептококков, а именно нуклеиновых кислот S. pneumoniae, при использовании, например,цепной реакции полимеразы как метода диагностики стрептококковых инфекций. Указанный зонд также можно синтезировать используя общепринятую технологию, и его можно иммобилизировать на твердой фазе или можно нанести метку выявляемым маркером. Предпочтительным для такого применения в качестве ДНК-зонда является олигомер, имеющий последовательность, комплементарную по крайней мере шести соприкасающимся нуклеотидам полипептидов стрептококкока S. pneumoniae по настоящему изобретению. Другой способ выявления стрептококков у пациента включает: а) нанесение выявляемым маркером на химически активное антитело и полипептид по настоящему изобретению или его фрагмент метки; б) введение пациенту указанного имеющего метку антитела или имеющего метку фрагмента; и в) выявление у пациента специфически связанного и имеющего метку антитела или имеющего метку фрагмента, что указывает на присутствие стрептококков. Другим аспектом настоящего изобретения является использование стрептококковых полипептидов по настоящему изобретению в качестве иммуногенов в целях продуцирования специфических антител для диагностики, и, в частности, для лечения стрептококковой инфекции. Подходящие антитела можно выявить, используя соответствующие методы скрининга, например измеряя способность конкретного антитела пассивно осуществлять защиту от стрептококковой инфекции в исследуемой модели. Одним из примеров модели на животных является описанная здесь для примера модель мыши. Указанное антитело может представлять собой полное (двухвалентное) антитело или его антигенсвязанный фрагмент, и оно может принадлежать любому классу иммуноглобулинов. Указанное антитело или фрагмент могут иметь животное происхождение, в частности млекопитающего, а более конкретно, крысы, мыши, или человека. Это может быть природное антитело или его фрагмент, или, если это желательно, рекомбинантное антитело или фрагмент. Термин рекомбинантное антитело или фрагмент антитела означает, что антитело или его фрагмент продуцирован методом генной инженерии. Указанное антитело или фрагменты антитела могут быть поликлональными, или предпочтительно - моноклональными. Оно может быть специфичным для ряда антигенных детерминант, связанных с полипептидами стрептококковой пневмонии, но предпочтительно, если оно специфично для единственной антигенной детерминанты. Настоящее изобретение касается также (не ограничивая его) новых антигенов, имеющих обозначения BVH-3, BVH-11, BVH-11-2, BVH-28 и BVH-71. Настоящее изобретение касается также усеченных полипептидов, включающих фрагменты указанных новых антигенов, обозначенных BVH-3, BVH-11,BVH-11-2, BVH-28 и BVH-71. Настоящее изобретение касается также химерных полипептидов, включающих фрагменты указанных новых антигенов, обозначенных BVH-3, BVH-11, BVH-11-2, BVH-28 иBVH-71. Ниже приведена таблица, суммирующая взаимосвязь между антигенами по настоящему изобретению. Пример 1. Этот пример иллюстрирует клонирование генов S. pneumoniae. Кодирующую область гена BVH-3 S. pneumoniae (последовательность ID No: 1) и кодирующую область гена BVH-28 S. pneumoniae (последовательность ID No: 5) амплифицировали с помощью цепной реакции полимеразы (ПЦР) (DNA Thermal Cycler GeneAmp PCR system 2400 Perkin Elmer, San Jose, CA),исходя из 6 серогруппы геномной ДНК штамма SP64 S. pneumoniae. Были использованы олигосахарады(oligos), содержащие базовые распространения для дополнительного введения сайтов рестрикции BglII(АГАТЦТ) и XbaI (ТЦТАГА). Продукты цепной реакции полимеразы очистили от геля агарозы с помощью набора для экстракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA, обработали с помощью BglII-XbaI (Pharmacia Canada Inc, Baie d'Urfe, Canada), провели экстракцию смесью фенол: хлороформ и осадили этанолом. Суперлинкер вектора pSL301 (Invitrogen, San Diego, СА) обработали с помощью BglII и XbaI и очистили от геля агарозы, используя набор для экстракции геля (QIAquickgel extraction kit, получен от QIAgen (Chatsworth, CA. BglII-XbaI фрагменты геномной ДНК были сшиты с pSL301 вектором BglII-XbaI. Полученные в результате сшивки продукты были превращены в штамм Е. coli DH5a [f80 lacZ DM15 endA1 recA1 hsdR17 (rK-mK+) supE44 thi-11- gyrA96 relA1 D(lacZYAargF)U169] (Gibco BRL, Gaithersburg, MD) пo способу Симаниса (Simanis) (Hanahan, D. DNA Cloning,1985, D.M. Glover, pp. 109-135). Рекомбинантные плазмиды pSL301 (rpSL301), которые содержали, или ген BVH-3, или ген BVH-28, очистили с использованием набора QIAgen kit (Chatsworth, CA), а внедрение ДНК было подтверждено анализом нуклеотидной последовательности (Taq Dye Deoxy Terminator CycleSequencing kit, ABI, Foster City, CA). Рекомбинантные rpSL301 (rpSL301) были обработаны рестрикционными ферментами BglII (АГАТЦТ) и XhoI (ЦТЦГАГ). BglII-XhoI фрагменты ДНК очистили, используя набор для экстракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA. Вектор экспрессии pET-32c(+) (Novagen, Madison, WI), который содержал последовательность тиоредоксин-Гис Метка, обработали BamHI (ГГАТЦЦ) и XhoI, а гель экстрагировали при использовании прибора для экс- 12007409 тракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA. Bg1II-XhoI фрагменты ДНК были сшиты с рЕТ-32 с(+) вектором BamHI-XhoI, чтобы для слитого белка тиоредоксин-Гис МеткаBVH-3 или тиоредоксин-Гис Meтка-BVH-28 создать кодирующую последовательность. Полученные в результате сшивки продукты были превращены в штамм Е. coli DH5a [f80 lacZ DM15 endA1 recA1hsdR17 (rK-mK+) supE44 thi-11- gyrA96 relAl D(lacZYA-argF)U169] (Gibco BRL, Gaithersburg, 5 MD) по способу Симаниса (Simanis), (Hanahan, D. DNA Cloning, 1985, D.M. Glover (ред.), pp. 109-135). Рекомбинантные плазмиды pET-32c(+) очистили при использовании набора QIAgen kit (Chatsworth, CA), а нуклеотидные последовательности у сайтов слияния тиоредоксин-Гис Метка, а также внедрение ДНК были подтверждены секвенированием ДНК (Taq Dye Deoxy Terminator Cycle Sequencing kit, ABI, Foster City,CA). Пример 2. Этот пример иллюстрирует клонирование белковых генов S. pneumoniae в плазмиде цитомегаловируса pCMV-GH. Кодирующий участок ДНК белка S. pneumoniae внедрили в фазу ниже гена гормона роста человека(hGH), который находится под транскрипциональным контролем промотора гена цитомегамовируса(CMV), в плазмиду вектора pCMV-GH (Tang et al., Nature, 1992, 356:152). Указанный промотор цитомегаловируса является нефункциональной плазмидой в клетках Е. coli , но он активен при введении этой плазмиды в клетки эукариот. Указанный вектор также является частью резистентного к ампициллину гена. Кодирующий участок гена BVH-3 (последовательность ID No: 1) и гена BVH-28 (последовательность ID No: 5) получили из rpSL301 (см. пример 1) при использовании рестрикционных ферментов BglII(АГАТЦТ) and XbaI (ТЦТАГА). Обработанные продукты очистили от геля агарозы при использовании набора для экстракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA. Содержащий гормон роста человека вектор pCMV-GH (Laboratory of Dr. Stephen A. Johnston, Department of Biochemistry, The University of Texas, Dallas, Texas) для создания слитых белков подвергли обработке с помощью BglII и XbaI и очистили от геля агарозы при использовании набора для экстракции геля(QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA. BglII-XbaI фрагменты ДНК сшили с вектором BglII-XbaI pCMV-GH, чтобы под контролем промотора цитомегаловируса получить слитые белки hGH-BVH-3 и hGH-BVH-28. Сшитые продукты превратили в штамм Е. coli DH5a[f80 lacZ DM15endA1 recA1 hsdR17 (rK-mK+) supE44 thi-11- gyrA96 relAl D(lacZYA-argF)Ul69] (Gibco BRL, Gaithersburg,MD), действуя согласно способу Симаниса (Simanis), (Hanahan, D. DNA Cloning, 1985, D.M. Glover (ред.),pp. 109-135). Рекомбинантные плазмиды pCMV были очищены с помощью набора QIAgen kit (QIAgen,Chatsworth, CA). Кодирующую область гена BVH-11 (последовательность ID No: 3) амплифицировали с помощью цепной реакции полимеразы (DNA Thermal Cycler GeneAmp PCR system 2400 Perkin Elmer, San Jose, CA) исходя из 6 серогруппы геномной ДНК штамма SP64 S. pneumoniae при использовании олигосахаридов(oligos), содержащих базовые распространения для дополнительного введения сайтов рестрикции BglII(АГАТЦТ) и HindIII (ААГЦТТ). Продукты цепной реакции полимеразы очистили от геля агарозы с помощью набора для экстракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA,обработали ректрикционным ферментом BglII-XbaI (Pharmacia Canada Inc, Baie d'Urfe, Canada), экстрагировали смесью фенол:хлороформ и осадили этанолом. Вектор pCMV-GH (Laboratory of Dr. Stephen A.Johnston, Department of Biochemistry, The University of Texas, Dallas, Texas) обработали с помощью BglII и XbaI и очистили от геля агарозы, используя набор для экстракции геля (QIAquick gel extraction kit, получен от QIAgen (Chatsworth, CA. BglII-XbaI фрагмент ДНК под контролем промотора цитомегаловируса (CMV) был сшит с вектором BglII-XbaI pCMV-GH для получения слитого белка hGH-BVH-11. Полученные в результате сшивки продукты были превращены в штамм Е. coli РН 5 а[f80 lacZ DM15 endA1recA1 hsdR17 (rK-mK+) supE44 thi-11- gyrA96 relAl D(lacZYA-argF)U169] (Gibco BRL, Gaithersburg, MD) по способу Симаниса (Simanis, Hanahan, D. DNA Cloning, 1985, D.M. Glover (ed), pp. 109-135). Рекомбинантную плазмиду pCMV очистили с помощью набора QIAgen kit (Chatsworth, CA), а нуклеотидная последовательность внедренной ДНК была подтверждена секвенированием ДНК. Пример 3. Этот пример иллюстрирует применение ДНК для создания иммунной реакции на антигены S.pneumoniae. Группу из 8 женских особей мышей BALB/c (Charles River, St-Constant, Quebec, Canada) трижды в сутки с интервалами в две или три недели иммунизировали внутримышечной инъекцией по 50 мкл каждая; при этом вводили 100 мкг рекомбинантной pCMV-GH, кодирующей ген BVH-3, BVH-11 или генBVH-28. Процесс проводили в присутствии 50 мкг колониестимулирующего фактора для гранулоцитов и макрофагов (GM-CSF) с экспрессией плазмиды pCMV-GH-GM-CSF (Laboratory of Dr. Stephen A. Johnston, Department of Biochemistry, The University of Texas, Dallas, Texas). В качестве контроля группе мышей делали 100 мкг инъекцию pCMV-GH в присутствии 50 мкг pCMV-GH-GM-CSF. Образцы крови собирали с глазницы перед проведением каждой из иммунизации и спустя 7 суток после третьей инъекции реакцию сывороточных антител определяли методом твердофазного иммуноферментного анализа при- 13007409 использовании в качестве покровного антигена слитый белок тиоредоксин-ГисМетка-S. pneumoniae. Иммунизация ДНК вместе с рекомбинантной плазмидой pCMV-GH, кодирующей белок BVH-3, BVH-11 или BVH-28 S. pneumoniae, создала антитела, реакционноспособные относительно соответствующего рекомбинантного белка. Взаимные титры антител (определяемые как самое высокое разведение сыворотки, при котором величина поглощения на 0,1 выше фона) составили приблизительно 4 х 103. Пример 4. Этот пример иллюстрирует продуцирование белков рекомбинанта S. pneumoniae и их очистку. Рекомбинантные плазмиды рЕТ, содержащие ген BVH-3, BVH-11 или ген BVH-28, соответствующие последовательности ID No: 1, последовательности ID No: 3, или последовательности ID No: 5, соответственно, были трансформированы электропорацией (Gene Pulser II apparatus, BIO-RAD Labs, Mississauga, Canada) в Е. coli штамм AD494 (DE3) (Dara- leu7697 DlacX74 DphoA PvuII phoR DmalF3F'[lac+(lacIq) pro] trxBKan) (Novagen, Madison, WI). В указанном штамме E. coli. промотор Т 7, контролирующий экспрессию слитых белков, был распознан Т 7 РНК-полимеразой (присутствующей на профагеIDE3); ее ген контролируется промотором лактозы, способным индуцировать изопропилd-тиогалактопиранозид (IPTG). Трансформант AD494(DE3)/rpET выращивали при 37 С с перемешиванием при 250 об/мин в LB бульоне (пептон 10 г/л, экстракт дрожжей 5 г/л, NaCl 10 г/л), в 1 мл содержалось которого 100 мкг ампициллина (Sigma-Aldrich Canada Ltd., Oakville, Canada); процесс проводили до тех пор, пока величина А 600 не стала равной 0,6. Для того чтобы вызвать продуцирование слитого белка тиоредоксин-Гис Метка-BVH-3, тиоредоксин-Гис Tag-BVH-11 или тиоредоксин-Гис Метка-ВVН-28, клетки инкубировали в течение дополнительных 2 ч в присутствии изопропилd-тиогалактопиранозида (IPTG) при конечной концентрации в 1 мМ. Клетки, полученные из 100 мл культуры, осадили центрифугированием и заморозили при -70 С. Очистку слитых белков от растворимой цитоплазмической фракции индуцированного изопропил-d-тио-галактопиранозидом (IPTG), трансформанта AD494(DE3)/rpET осуществляли методом аффинной хроматографии на основе свойства последовательности Гис Метка (6 следующих друг за другом гистидиновых остатка) связываться с двухвалентными катионами (Ni2+), иммобилизованными на хелатообразующем комплексе металлизированной смолы (His-Bind metal chelation resin). Короче говоря, клетки,полученные при осаждении центрифугированием из 100 мл культуры, индуцированной изопропилdтио-галактопиранозидом (IPTG), повторно суспендировали в смеси фосфатно-солевой буфер: 500 мМNaCl (pH 7,1), обработали ультразвуком и для удаления отходов вращали в течение 20 мин при 20,000 хg. Полученный супернатант отфильтровали (мембрана с 0,22 мкм порами) и поместили в 1 мл готовую к использованию и предварительно заполненную хелатной добавкой колонку HiTrap (Pharmacia Biotech,Baie d'Urfe, Canada). Полученный слитый белок тиоредоксин-Гис Метка-S. pneumoniae элюировали смесью 1 М имидазол-500 мМ NaCl-фосфатно-солевой буфер (рН 7,1). Удаление образовавшейся соли и имидазола из образца проводили диализом фосфатно-солевого буфера при 4 С. Получившееся из растворимой фракции Е. coli количество слитого белка оценили с помощью MicroBCA (Pierce, Rockford, Illinois). Пример 5. Этот пример иллюстрирует защиту мышей от фатальной пнемококковой инфекции с помощью их иммунизации. Группы из 8 женских особей мышей BALB/c (Charles River) были подвергнуты подкожной иммунизации, которую проводили трижды с трехнедельными интервалами или используя 25 мкг очищенного аффинной хроматографией слитого белка тиоредоксин-Гис Метка-ВVН-3 в присутствии 15 мкг адъюванта Qui1A (Cedarlane Laboratories Ltd, Hornby, Canada) или, для контроля - чистый адъювант QuilA в фосфатно-солевом буфере. Образцы крови собирали из глазничного синуса за 1, 22 и 43 сутки до каждой иммунизации и на 7 (50) сутки после третьей иммунизации. Спустя неделю была сделана провокационная инъекция (приблизительно 106 колониеобразующих единиц типа 3 штамма WU2 S. pneumoniae). Образцы инокулята провокационной инъекции S. pneumoniae поместили на пластины кровяного агара, чтобы определить колониеобразующие единицы и проверить дозу провокационной инъекции. Гибель мышей регистрировалась на протяжении 14 суток, а на 14 сутки после инъекции оставшиеся в живых мыши были умерщвлены и образцы их крови проанализированы на присутствие S. pneumoniae. Данные по выживаемости приведены в табл. 1. Перед проведением провокационной прививки сыворотка была проанализирована на наличие антител, реагирующих с S. pneumoniae: для этого использовались стандартные иммунологические методики. Твердофазный иммуноферментный анализ и иммуно-блот анализ выявили, что в Е. coli иммунизация рекомбинантным белком S. pneumoniae вызывает возникновение антител, реагирующих как с рекомбинантным, так и с нативным пневмококковым белком.- 14007409 Таблица 1. Защита, опосредованная рекомбинантным белком ВVH-3 Все мыши, иммунизированные рекомбинантным белком BVH-3, перенесли инфекцию, в то время как ни одна из мышей контрольной группы, получавших только адъювант, ее не перенесли. Имелась также существенная разница по выживаемости между двумя этими группами мышей (Р 0,0001, логарифмический ранговый критерий для непараметрического анализа кривых выживания; Р=0,0002, точный критерий Фишера). Все гемокультуры, полученные от выживших мышей на 14 день после провокационной инъекции, были отрицательными. Пример 6. Этот пример описывает клонирование генов BVH-3 и ВVН-11, исходя из различных штаммов S.pneumoniae и молекулярную сохранность этих генов. Молекулярный анализ хромосомной ДНК от различных изолятов S. pneumoniae с помощью ДНКзондов, охватывающих различные участки BVH-3 или BVH-11, выявил наличие одной копии гена BVH-3 и двух копий гена BVH-11. Указанные две копии гена ВVН-11 не были идентичными, и эти гены были произвольно обозначены как ВVН-11 (последователность ID No: 12; открытая рамка считывания у нуклеотидов с 45 по 2567) и BVH-11-2 (последовательность ID No: 13; открытая рамка считывания у нуклеотидов со 114 по 2630). Первые аминокислоты кодирующих участков BVH-3 и ВVH-11 имеют характеристики лидерных последовательностей, известных также как сигнальные пептиды. В этих последовательностях присутствовал общий сигнальный липопротеиновый сайт расщепления пептидазы L-X-X-C из сайтов модификации/обработки липопротеина. Зрелые белки BVH-3, BVH-11 и BVH-11-2 из SP64 S. pneumoniae содержат, соответственно, 1019, 821 и 819 аминокислот. Кодирующие области генов S. pneumoniae для зрелого BVH-3, названного BVH-3M, (нуклеотиды 1837 - 4896; последовательность ID. No: 11), BVH-11M(нуклеотиды 102-2567; последовательность ID. No: 12) и BVH-11-2M (нуклеотиды 171-2630; последовательность ID. No: 13) амплифицировали с помощью цепной реакции полимеразы (DNA Thermal CyclerGeneAmp PCR system 2400 Perkin Elmer, San Jose, CA) из геномной ДНК 6 или 7 штаммов S. pneumoniae. Серогруппу 6 штамма SP64 S. pneumoniae и серогруппу 9 штамма SP63 клинических изолятов получили из лаборатории Квебека (the laboratoire de la sante publique du Quebec, Sainte-Anne-de-Bellevue); серотип 4 штамма JNR.7/87 был получен от Andrew Camilli, Tufts University School of Medicine, Boston; штамм Rxl,неинкапсулированное производное типа 2 штамма D39 и типа 3 штаммов А 66 и WU2 были получены отde recherche en infectiologie du centre hospitalier de 1 universite Laval, Sainte-Foy. Серии олигонуклеотидных праймеров OCRR479-OCRR480; HAMJ160-OCRR488 и HAMJ160-HAMJ186, содержащие базовые расширения для дополнительного введения сайтов рестрикции, использовались в целях амплификации генов BVH-3. ВVН-11 и ВVН-11-2 соответственно, за исключением гена ВVН-11 из штамма SP64, который амплифицировали, используя серию праймеров, включающих HAMJ487 и OCRR488. Последовательности праймеров приведены ниже (табл. 2). Продукты цепной реакции полимеразы очистили от геля агарозы при использовании QIAquick набора для экстракции геля QIAgen (Chatsworth, CA) и обработали с помощью BglII-XbaI или BglII-HindIII (Pharmacia Canada Inc, Baie d'Urfe, Canada). Полученные продукты очистили с помощью набора для очистки (QIAquick PCR purification kit from QIAgen; (Chatsworth,CA). Полученные продукты цепной реакции полимеразы сшили с вектором BglII-XbaI или BglII-HindIIIpSL301. Сшитые продукты были превращены в штамм Е. coli DH5 [ф 80 lacZ AMIS endA1 recA1hsdR17(rK-mK+) supE44 thi-1 gyrA96 relAl A(lacZYA-argF)U169] (Gibco BRL, Gaithersburg, MD) по методу Симаниса (Hanahan, D. DNA Cloning, 1985, D.M. Glover (ed), pp. 109-135). Рекомбинантные плазмидыpSL301 (rpSL301), содержащие BVH-3, BVH-11 или BVH11-2, очищали при использовании набораQIAgen (Chatsworth, CA), а внедренные ДНК были секвенированы (Taq Dye Deoxy Terminator Cycle Sequencing kit, ABI, Foster City, CA). Фиг. 11 и 12 представляют обобщающую типичную последовательность нуклеотидов, которую установили соответственно исходя из логически выстроенных аминокислотных последовательностей BVH-3 и BVH-11. Сравнение белковых последовательностей BVH-3 всех штаммов выявило 99-100% идентичность последовательностей, за исключением того, что последовательность BVH-3 из серогруппы 9 штамма SP63 (последовательность ID No: 15 и последовательность IDNo: 16) потеряла участок из 177 аминокислот, соответствующий остаткам с номерами с 244 по 420 из белковой последовательности BVH-3' SP64 S. pneumoniae. Анализ последовательностей штаммов дополнительной 9 серогруппы выявил, что в 3 из 4 штаммов молекула BVH-3 имеет такую же делецию, это- 15007409 дает возможность предположить, что указанные три штамма являются членами клона 9 серогруппы S.pneumoniae. Сравнение тринадцати нуклеотидных последовательностей, полученных из 7 штаммов S. pneumoniae, показало, что эти нуклеотидные последовательности очень схожи. Компьютерный анализ (MacVector, Clustal W1.4) с использованием множественного выравнивания предсказанной белковой последовательности BVH-11 выявил, что эти последовательности на 75% идентичны и на 82% гомологичны по длине в 834 аминокислоты. Попарное выравнивание выявило 80-100% идентичность (фиг. 13). Эти последовательности показали высокую степень идентичности по всей структуре в целом. Изменяемость главной последовательности этих белков в основном ограничена последними 125 аминокислотами их Сконцевых участков. Этот участок образует домен. Непосредственное изучение этого домена выявило две группы последовательностей. Первые 9 последовательностей с фиг. 13 принадлежат к одной группе, в то время как последние 4 - к другой. При сравнении последовательностей домена в указанных 13 белках была получена их 39% идентичность (MacVector, Clustal W 1.4). При сравнении последовательностей,принадлежащих к одной и той же группе, степень идентичности увеличивалась более чем до 92%. Пример 7. Этот пример иллюстрирует гомологию участков генов BVH-3 и BVH-11. Молекулярный анализ с помощью ДНК-зондов, полученных от генов BVH-3 и BVH-11, показал,что BVH-3 и ВVН-11 родственны. При исследовании дот-блот гибридизации ДНК-зонды, состоящие из последовательности или гена BVH-3, или гена BVH-11, гибридизировались с обоими генами BVH-3 иBVH-11, это указывает на то, что эти гены совместно обладают гомологичными последовательностями. Сравнение последовательностей выявило, что открытые рамки считывания и указанные белки идентичны, соответственно, на 43 и 33%. Более подробное изучение выявило, что указанная область, соответствующая в BVH-3 аминокислотам с номерами с 1 по 225, а в BVH-11 - аминокислотам с номерами 1 по 228, были идентичны по концентрации ДНК и по концентрации белка на 73 и на 75% соответственно. Напротив, участки 3', соответствующие в BVH-3 аминокислотам с номерами с 226 по 1039, а в BVH-11 аминокислотам с номерами с 229 по 840, были идентичными по уровню ДНК и белка только на 34 и на 22% соответственно. Таким образом 5'-концы генов BVH-3 и BVH-1, как оказалось, содержат в высокой степени консервативные последовательности, в то время как остальные участки генов являются в высокой степени дивергентными. Эти результаты предполагают, что BVH-3 и ВVH-11 могут совместно обладать схожими функциональными группами, которые опосредованы последовательностями, находящимися в указанной консервативной области, в то время как специфические функции BVH-3- и BVH-11 могут быть опосредованы последовательностями из указанной дивергентной области. Пример 8. Этот пример описывает клонирование усеченных генов BVH-3, ВVН-11 и BVH-11-2 при использовании цепной реакции полимеразы и экспрессии усеченных молекул BVH-3 и BVH-11. Фрагменты генов амплифицировали с помощью цепной реакции полимеразы используя пары олигонуклеотида, разработанных для амплификации фрагментов, стягивающих ген BVH-3 (последовательность ID No: 1 и последовательность ID No: 11), BVH-11 (последовательность ID No:3 и последовательность ID No: 12) или BVH-11-2 (последовательность ID No: 13) из SP64 штамма S. pneumoniae. Каждый из этих праймеров у 5'-конца имел сайт рестрикции эндонуклеазы, что допускает возможность направленного рамочного (в рамку генетического кода) клонирования амплифицированного продукта в обработанный вектор плазмиды (табл. 2 и 3). Амплифицированные продукты цепной реакции полимеразы обработали рестрикционной эндонуклеазой и сшивали или с линеаризованной плазмидой pSL301 (см. пример 1), pCMV-GH (см. пример 2), или с вектором экспрессии рЕТ 5 (Novagen, Madison, WI), обработанным подобным образом, или с помощью ферментов, продуцирующих совместимые липкие концы ДНК. Рекомбинантную плазмиду pSL301 и рекомбинантную плазмиду pCMV-GH подвергли обработке рестриктиционными ферментами для рамочного клонирования в вектор экспрессии рЕТ. Клоны вначале стабилизировали в Е. coli DH5 перед тем, как осуществить введение в E. coli BL21(,DE3) иAD494 (DЕЗ) в целях экспрессии усеченных молекул BVH-3 или BVH-11. Каждая из полученных структур плазмид была подтверждена методом нуклеотидного секвенирования. Рекомбинантные белки были подвергнуты экспрессии вместе с тиоредоксином и Гис-метка в качестве N-концевых слитых белков или вместе с Гис-метка в качестве С-концевых слитых белков. Полученные в результате экспрессии рекомбинантные протеины были очищены от супернатантных фракций, полученных при центрифугировании обработанных ультразвуком культур Е. coli. индуцированых изопропилd-тиогалактопиранозидом (IPTG) при использовании хелатообразующего комплекса металлизированной смолы (His-Bind metal chelation resin; QIAgen, Chatsworth, CA). Полученные генные продукты приведены в табл. 3. Генные продукты, соответствующие N-терминальной области, включая сигнальную последовательность, обозначены как липоидные белки или липопротенины (L-протеины). Генные продукты, соответствующие N-концевой области и не имеющие сигнальной последовательности, обозначены как белки без сигнальной последовательности (w/o ss).- 16007409 Таблица 2. Перечень праймеров олигонуклеотидов, полученных по цепной реакции полимеразы Таблица 3. Перечень усеченных генных продуктов BVH-3 и BVH-11, полученных из SP64 S. pneumoniae Пример 9. Этот пример описывает выделение моноклональных антител и их использование для характеристики антигенных детерминант белков BVH-3, BVH-11 и BVH-11-2. Женские особи мышей BALB/c (Charles River) подкожно иммунизировали генными продуктами(Cedarlane Laboratories Ltd, Hornby, Canada). Одну группу мышей (первый эксперимент по встраиванию) в первый и в 14 день иммунизировали 25 мкг слитого белка тиоредоксин-Гис Метка-ВУН-3 М, прошедшего очистку аффинной хроматографией. Вторую группу мышей (второй эксперимент по встраиванию) иммунизировали трижды с трехнедельными интервалами 25 мкг слитого белка тиоредоксин-Гис МеткаBVH-11M, прошедшего очистку аффинной хроматографией. Третью группу мышей (третий эксперимент по встраиванию) в первый и в 15 день иммунизировали 25 мкг слитого белка тиоредоксин-Гис МеткаВУН-11-2 М, прошедшего очистку аффинной хроматографией. Четвертую группу мышей (четвертый эксперимент по встраиванию) в первый день иммунизировали 25 мкг слитого белка тиоредоксин-Гис Метка-BVH-11B, прошедшего очистку аффинной хроматографией, а на 16 и на 37 день иммунизацию усилили внутривенной инъекцией рекомбинантным белком BVH-11B в фосфатно-солевом буфере. За три или четыря дня до слияния мышам внутривенно вводили 25 мкг соответствующего антигена, суспендированного только в фосфатно-солевом буфере. При слиянии клеток селезенки с клетками миомы образовывались гибридомы, не осуществляющие секрецию SP2/0, как это описано выше в работе J.Hamel et al. [J. Med. Microbiol, 23, pp. 163-170 (1987)]. Супернатанты культуры гибридом вначале были подвергнуты скринингу иммуноферментным спот-анализом по методике, описанной в указанной ранее работе (Hamel et al.) с использованием пластин, имеющих покрытие из препаратов очищенных рекомбинантных белков или суспензий клеток S. pneumoniae, погибших в результате тепловой обработки. Положительные гибридомы, которые были отобраны по реактивности с разнообразными антигенами с помощью твердофазного иммуноферментного анализа, затем клонировали путем ограничения разведения,расширили и заморозили. Гибридомы были исследованы твердофазным иммуноферментным анализом или западным иммуноблот анализом на генные продукты BVH-3 и ВVН-11 для того, чтобы охарактеризовать генные детерминанты, распознаваемые моноклональными антителами. BVH-3 и BVH-11 совместно владели общими антигенными детерминантами с 6 моноклональными антителами (H3-1-F9, H3-1-D4, Н 3-1-Н 12, Н 11-1 Е 7, Н 11-1-Н 10 и Н 11-1.1-G11), что показывает реакционную способность с обоими белками (табл. 4). Молекулы BVH-11 и BVH-11-2 из штамма SP64 S. pneumoniae совместно владели обоими антигенными детерминантами, не присутствующими на BVH-3 с моноклональными антителами (МКА) (3 А 1, 13 С 11,- 19007409 10 Н 10, IDS, 10G9, 10 А 2, 3 Е 8, 10D7, 2 Н 7 и 6 Н 7); они обладают реакционной способностью в отношении обоих рекомбинантых белков BVH-11 и BVH-11-2 (табл. 5). Таблица 4. Реакционная способность иммунореактивных моноклональных антител ВVН-3 с рядом генных продуктов BVH-3 и ВVН-11 Таблица 5. Реакционная способность моноклональных антител, возникающая в отношении белка ВVН 11-2 из SР 64 штамма S. pneumoniae с рядом генных продуктов BVH-11 Моноклональные антитела, приведенные в этой таблице, не обладают реакционной способностью с молекулой рекомбинантного ВVН-3. Результаты, полученные при исследовании иммуннореактивной способности моноклональных антител (табл. 4 и 5) согласуются с последовательностями белков, полученных из соответственных последовательностей гена. Действительно, имеет место перекрестная реактивность моноклональных антител с молекулами BVH-3 и BVH-11, распознающими белок BVH-3C, который соответствует консервативной- 20007409 области, а специфические моноклональные антитела BVH-11 и BVH-11-2 обладали реакционной способностью в отношении антигенных детерминант, расположенных на вариабельных участках этих молекул.BVH-3 и BVH-11, а также BVH-11 и BVH-11-2 можно распознать по их реакционной способности с моноклональными антителами. Пример 10. Этот пример иллюстрирует одновременную экспрессию генных продуктов BVH-3 и ВVН-11 с помощью S. pneumoniae. Для того чтобы изучить, произошла ли экспрессия генов BVH-3 и BVH-11 в S. pneumoniae, была использована стандартная западная технология блот-анализа. Штаммы SP64 и SP63 S. pneumoniae выращивали в течение ночи при 37 С в 5% СО 2 на пластинах с кровяным агаром, бактерии суспендировали в фосфатно-солевом буфере, а потом их уничтожили термоообработкой в течение 20 мин при 56 С. Для приготовления антигенов суспензии S. pneumoniae обрабатывали буфером, содержащим додецилсульфат натрия (SDS) и 2-меркаптоэтанол, процесс проводили в течение 5 мин при 100 С. Антигены белка пневмококка пептизировали электрофорезом додецилсульфата натрия в полиакриламидном геле (SDS-PAGE) по методу Лаеммли (Laemmli), [Nature, 227, pp. 680-685 (1970)]. После такого электрофореза указанные белки из геля электрофоретически были перемещены на нитроцеллюлозную бумагу согласно метода Таубина (Towbin), [Proc. Natl. Acad. Sci. USA, 76, pp. 4350-4354 (1979)] и проверены иммунной антисывороткой мышей или моноклональными антителами. Выявления антигенов, реагирующих с указанными антителами, проводили косвенным иммуноферментым анализом, используя конъюгированные антимышиные иммуноглобулины и красящий субстрат. Когда антисыворотка достигла рекомбинанта, то BVH-3 протестировали на наличие антигенов к штамму SP64 S. pneumoniae; было выявлено два реакционноспособных диска хромосомы с кажущейся молекулярной массой в 127 и 99 кДа. Диски хромосомы, имеющие такие же кажущиеся молекулярные массы, также были выявлены, когда в качестве иммунологических зондов использовали только моноклональные антитела H3-1-F9, H3-1-D4, Н 3-1-Н 12, Н 11-1-Е 7, Н 111-Н 10 и H11-1.1-G11. Напротив, моноклональные антитела, специфичные для молекулы BVH-3, выявили только 127 кДа диск хромосомы, а моноклональные антитела, специфичные для BVH-11, выявили только 99 кДа диск хромосомы; таким образом подтверждается идентичность дисков хромосомы массой в 127 и 99 кДа, также как и идентичность BVH-3 и ВVH-11 соответственно. Эти исследования дают доказательство того, что белки BVH-3 и BVH-11 одновременно присутствуют на S. pneumoniae. Кроме того, полученные результаты согласуются с нашими предыдущими наблюдениями относительно того, что BVH-3 иBVH-11 имеют антигенные детерминанты, общие для обоих белков, а также антигенные детерминанты,принадлежащие исключительно одному из этих двух белков. В SP64 S. pneumoniae зрелые белки BVH-3, BVH-11 и BVH-11-2 представляют собой белки, содержащие 1019, 821 и 819 аминокислот и предсказанную молекулярную массу в 112,5, 92,4, и 91,7 кДа соответственно. Хотя и имеется различие между молекулярной массой, предсказанной исходя из конкретной последовательности, и молекулярной массой, вычисленной электрофоретическим способом на SDSPAGE, но BVH-3 можно отличить от BVH-11 по его более высокой молекулярной массе. Кроме того,молекулы BVH-3 из SP63 штамма S. pneumoniae согласно электрофоретическому методу (SDS-PAGE) имеют кажущуюся молекулярную массу в 112 кДа, а эта величина для BVH-3 из штамма SP64 составила 127 кДа. Полученные данные согласуются с фактом делеции участка в 177 аминокислотных остаткаBVH-3 из SP63 штамма S. pneumoniae. Пример 11. Этот пример описывает защиту вакцинированных рекомбинантными генными продуктами BVH-3 или ВVН-11 мышей от инфекции в эксперименте. Группы из 7 или 8 женских особей мышей BALB/c (Charles River) трижды подкожно при трехнедельных интервалах иммунизировали или очищенным аффинной хроматографией слитым белком тиоредоксин-Гис Метка-ВVН-3 М, или очищенным аффинной хроматографией слитым белком тиоредоксин-Гис Метка-BVH11M, или, для контроля - только адъювантом QuilA в фосфатно-солевом буфере. 12-14 дней после третьей иммунизации этим мышами была сделана провокационная внутривенная инъекция штаммом WU2 S. pneumoniae или проведено интраназальное введение штамма Р 4241. Образцы инокулята после провокационной инъекции S. pneumoniae поместили на пластины кровяного агара для того, чтобы установить количество колониеобразующих единиц и проверить дозу провокационной инъекции. Она составила приблизительно 106 колониеобразующих единиц. Гибель мышей регистрировалась на протяжении 14 суток, а на 14 сутки после инъекции оставшиеся в живых мыши были умерщвлены, и образцы их крови проанализированы на присутствие S. pneumoniae. Данные по выживаемости приведены в табл. 6 и 7.- 21007409 Таблица 6. Защита, опосредованная рекомбинантными белкамиВVН-3 М и BVH-11M при экспериментальной вирулентной инфекции S. pneumoniae WU2 Количество выживших мышей:количество умерших мышей на 14 день после провокационной инъекциию Таблица 7. Защита, опосредованная рекомбинантными белками ВVH-3M и BVH-11M в экспериментальной пневмонии от вирулентного S. pneumoniae P4241 Количество выживших мышей: количество умерших мышей на 14 день после провокационной инъекции. Все мыши, иммунизированные рекомбинантным белком BVH-3M или BVH-11M, при инфекцииWU2 выжили, в то время как не выжила ни одна из контрольных мышей, получавших только адъювант. Все мыши, кроме одной, иммунизированные рекомбинантным белком BVH-3M или BVH-11M, выжили при инфекции Р 4241, в то время как выжила только одна из контрольных мышей, получавших только адъювант. Все гемокультуры, полученные от выживших мышей, на 14 день после провокационной инъекции были отрицательными. Эти результаты ясно показывают, что и BVH-3M, и BVH-11M вызывают у мышей защитную антипневмококковую иммунную реакцию. Тот факт, что эти белки в высокой степени консервативны среди изолятов S. pneumoniae, придает особое значение возможности BVH-3 и BVH-11 стать потенциальными кандидатами для применения в универсальной вакцине. Действительно, белкиBVH-3 и BVH-11 из 6 серогруппы штамма SP64 S. pneumoniae создают защиту от пневмококковых инфекций в случае штаммов с различными серотипами. В идеале вакцина, которая может защитить от пневмококковой инфекции, может защитить от менингита, воспаления среднего уха, бактериемиии и пневмонии. В моделях BVH-3 и ВVH-11 проявили защитные свойства относительно летальной системной инфекции и пневмонийной инфекции; таким образом предполагается, что для человека вакцины на основе белков BVH-3 и BVH11 могут снизить случаи широкого спектра заболеваний, вызванных практически всеми штаммами S. pneumoniae, независимо от конкретного капсульного серотипа. Данные табл. 6 и 7 ясно показывают, что и BVH-3, и BVH-11 являются молекулами, создающими защиту от S. pneumoniae. Однако не было известно, может ли защита быть опосредована специфическими последовательностями, которыми не обладают совместно молекулы BVH-3 и BVH-11. Группы женских особей мышей BALB/c (Charles River) трижды подкожно при трехнедельных интервалах иммунизировали очищенным аффинной хроматографией слитыми белками тиоредоксин-ГисМетка-BVH-3AD, BVH-3B или -BVH-3C в присутствии 15 мкл адъюванта QuilA (Cedarlane Laboratories Ltd, Hornby,Canada). Контрольные мыши были иммунизированы только адъювантом QuilA в фосфатно-солевом буфере, или очищенным аффинной хроматографией слитым белком тиоредоксин-ГисМетка или слитым белком тиоредоксин-ГисМетка (Гис-Тио) в присутствии QuilA. Для того, чтобы установить защитные свойства процессированных белков, названных NEW4,NEW5, NEW6, NEW7, NEW8, NEW9, NEW10, NEW11, NEW14 и BVH-11B, группы женских особей мышей BALB/c (Charles River) дважды при трехнедельных интервалах подкожно иммунизировали 25 мкг каким-либо очищенным аффинной хроматографией слитым белком тиоредоксин-Гис Метка в присутствии 15 мкл адъюванта QuilA. Спустя 10-14 дней после последней иммунизации этим мышам была сделана провокационная инъекция вирулентной S. pneumoniae. Наши результаты показали, что BVH-3B - процессированная молекула BVH-3, содержащая аминокислоты с номерами 512-1039, создает защиту от вирулентных в отношении мышей штаммов WU2 and P4241. Аналогично, молекулы BVH-11B, NEW4 иNEW5, три процессированные молекулы BVH-11, содержащие аминокислоты 354-840, 286-840 и 286-713 соответственно, в эксперименте создают защиту при внутривенной провокационной инъекции WU2 и- 22007409 внутриназальном провокационном введении Р 4241. Более того, вакцинация NEW10 и NEW14, содержащими аминокислоты с номерами 272-838 и аминокислоты с номерами 227-699 из молекулы BVH-11-2,также обеспечивает защиту от гибели от пневмококковых штаммов. Это означает, что указанная область,содержащая 428 аминокислот и распространяющаяся на аминокислоты с номерами 286-713 и 272-699 в последовательностях белков BVH-11 и BVH-11-2 соответственно из SP64 S. pneumoniae, содержит защитные антигенные детерминанты. Эта область является в высокой степени консервативной, и имеет общую 91% идентичность и 94% гомологичность с 13 последовательностями белка BVH-11. Таблица 8. Оценка защиты, создаваемой при вакцинации мышей генными продуктами BVH-3 и ВVН-11 Количество выживших мышей:количество умерших мышей на 14 день после провокационной инъекции.b Провокационная доза WU2 составила 105 колониеобразующих единиц с Мышам, прожившим более 14 дней после провокационной инъекции, приписали выживаемость в 14 дней в целях определения усредненных величин Пример 12. Этот пример описывает клонирование и экспрессию химерного гена, кодирующего химерный полипепид, соответствующий карбокситерминальной области BVH-3 при слиянии у С-конца с карбокситерминальной областью BVH-11, а также дополнительные защитные свойства, наблюдаемые после вакцинации химерным полипептидом. Из исследований, описанных выше, ясно, что BVH-3 и BVH-11 являются серологически различи- 23007409 мыми молекулами, одновременно присутствующими в S. pneumoniae. Результаты иммунологического изучения на примере мышей показали, что оба белка являются хорошими кандидатами для вакцины. Эти белки могут обеспечить защиту против всех пневмококков независимо от их серотипа. Даже несмотря на то, что эти два белка совместно владеют антигенными детерминантами и последовательностями, они обладают разными характеристиками, и могут выполнять различные биологические функции. Таким образом, иммунизация в отношении этих двух белков может обеспечить более высокий уровень защиты,чем тот уровень, который дает каждый из этих белков в отдельности. Для того чтобы исследовать это,можно изучить несколько средств, в которые в сочетании или конъюгации вводятся непроцессированный или процессированный белок BVH-3 и BVH-11. Здесь описана генная инженерия слитого гена и белка BVH-3-BVH-11, названного NEW12 (последовательность ID NO: 76 и последовательность ID NO: 58 соответственно), а также потенциальное использование белка NEW12 в качестве вакцины. Фрагменты генов BVH-3 и BVH-11, соответствующие 3'-концу этих генов, амплифицировали по цепной реакции полимеразы, используя пары олигонуклеотидов, выстроенные для амплификации фрагментов стягивающих нуклеотиды с 1414 по 3117 (последовательность ID No: 1) и нуклеотиды с 1060 по 2520 (Последовательность ID No: 3) из генов BVH-3 и BVH-11 соответственно штамма SP64 S. pneumoniae. У используемых праймеров - HAMJ278 и HAMJ279; HAMJ282 и HAMJ283 рестрикционный сайт эндонуклеазы находился у 5'-конца, что позволяет направленное рамочное клонирование амплифицированного продукта в обработанную плазмиду вектора рЕТ 21b(+) (табл. 2). Амплифицированные продукты цепной реакции полимеразы обработали рестрикционными эндонуклеазами и сшили с линеаризированным вектором плазмиды рЕТ 21b(+), обработанным подобным образом. Полученную в результате структуру плазмиды подтвердили анализом нуклеотидной последовательности. Рекомбинантную плазмиду рЕТ 21b(+), содержащую продукт цепной реакции полимеразы - NdeI-HindIII BVH-3, линеаризировали обработкой рестрикционными ферментами HindIII и NotI с целью рамочного клонирования указанного фрагмента ДНК HindIII-NotI, полученного из рекомбинантного вектора рЕТ 21(+), содержащего генный фрагмент BVH-11. Клоны вначале стабилизировали в Е. coli DH5 перед введением в Е. coli ВL2(DE3) для экспрессии молекулы химерного белка пневмококка. Рекомбинантный химерный полипептид, названный NEW12, подвергли экспрессии как С-терминальный белок, слитый с Гис-метка. Прошедший экспрессию рекомбинантный белок NEW12 очистили от фракций супернатанта, полученных при центрифугировании обработанных ультразвуком и индуцированных изопропилd-тиогалактопиранозидом (IPTG) культур Е. Coli; процесс проводили с помощью хелатообразующего комплекса металлизированной смолы (His-Bind metal chelation resin) (QIAgen, Chatsworth, CA). Согласно такой же, как и описанная выше методика, можно сконструировать другие химерные полипептиды, как результат одновременной экспрессии New 1 и New 4, New 1 и New 5, New 1 и New 10,или New 1 и New 14. Указанная конструкция может включать New 1 выше или ниже (от избранного участка цепи ДНК) New 4, New 5, New 10, BVH-11B или New 14. Можно также сконструировать другие химерные полипептиды, что является результатом одновременной экспрессии более чем двух фрагментов или генов BVH-3, BVH-11 или BVH-11-2. Группы из 8 женских особей мышей BALB/c (Charles River) дважды подкожно при трехнедельных интервалах иммунизировали 25 мкг или очищенным аффинной хроматографией слитым белком Гис Метка-NEWl, BVH-11B или NEW12 в присутствии 15 мкг адъюванта QuilA. 10-14 дней после последней иммунизации этим мышами была сделана провокационная внутривенная инъекция вирулентной S.pneumoniae. Как было показано выше, молекулы NEW1 и BVH-11B, содержащие аминокислоты с номерами с 472 по 1039 из белка BVH-3 и аминокислоты с номерами 354-840 из белка BVH-11 соответственно, соответствуют областям в этих белках, способных вызвать защитную иммунную реакцию. Для того чтобы определить, будут ли химерные полипептиды существенно увеличивать защиту по сравнению с защитой, демонстрируемой отдельными копиями, провокационная доза инъекции была подобрана таким образом, чтобы защита не предполагалась от молекул NEW1 и BVH-11B. Интересно, что химерный белок NEW12 создает защиту против вирулентных в отношении мышей штаммов WU2 и Р 4241. Семь из 8 мышей, иммунизированных NEW12, все еще оставались в живых 10 дней после провокационной инъекции, в то время как 28 из 32 мышей, иммунизированных NEW1, BVH-11B, BVH-3M или только адъювантом, к 5 дню после провокационной инъекции погибли. Таким образом, вакцинация мышей NEW 2 обеспечивает самую высокую степень защиты от провокационной инъекции WU2. Полученные результаты показывают, что иммунизация химерным полипептидом, и возможно, комбинацией генных продуктов BVH-3 и BVH-11 может дать дополнительную защиту, помимо защиты, обеспечиваемой введением только антигенов BVH-3 или BVH-11.- 24007409 Таблица 9. Оценка защиты, создаваемой при иммунизации мышей молекулами химерного NEW 12 Пример 13. Этот пример иллюстрирует идентификацию дополнительных связанных последовательностей BVH3 и ВVН-11 в смесях стрептококков, отличных от S. pneumoniae. Ранее было показано, что BVH-3, BVH-11 и BVH-11-2 представляют собой семейство связанных белков, совместно обладающих общими последовательностями. Исследования гомологии осуществлялись с нуклеотидной последовательностью из консервативной области этих генов, и используя FASTA их сравнивали с последовательностями из GenBank и EMBL. Наиболее существенная гомология наблюдалась с 2, 469-килобитовым геном, кодирующим расчетный белок массой 92 кДа (последовательностьID No: 81) из неизвестной функции S. Agalactiae, называемой также стрептококком группы В или GBS. Этот ген обозначили как BVH-71. Белок, который показал 99,2% идентичность и 99,5% схожесть с белком из GBS, был также идентифицирован как S. pyogenes, называемый также стрептококком группы А или GAS (последовательность ID No: 83). Область 5' последовательностей BVH-71 (последовательностьID No: 80 и последовательность ID No: 82), стягивающих нуклеотиды с номерами с 1 по 717, показала 58 и 60% идентичность с указанными консервативными областями генов BVH-3 (нуклеотиды с 1 по 675) и ВVН-11(нуклеотиды с 1 по 684) соответственно. Первые 239 аминокислоты из транслируемых последовательностей открытых рамок считывания GBS и GAS BVH-71 были на 51 и 54% идентичны первым 225 и 228 аминокислотам из BVH-3 и BVH-11 соответственно. Помимо структурного подобия белки BVH-3,BVH-11 и BVH-71 стрептококков также совместно обладают антигенными детерминантами. Компонента с массой в 97 кДа была выявлена в клетках GAS или GBS при западном блот-анализе, используя моноклональные антитела H11-1.1-G11, реагирующие с консервативными областями BVH-3 и BVH-11. Аналогично, рекомбинантные BVH-71 белки GAS и GBS были выявлены методом иммунологического блотанализа. Полученные результаты показывают, что белки BVH-71, BVH-3 и BVH-11 могут совместно обладать сходными функциями. Наши результаты также предполагают, что белки BVH-71 можно использовать как белковые компоненты противострептококковых вакцин. В другом воплощении белки BVH-71 можно использовать как белковые компоненты вакцин против стрептококков группы A (GAS) или группы В (GBS). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный полинуклеотид, кодирующий антигенный полипептид Streptococcus pneumoniae,имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID Nos: 2, 8,10, 16, 55-57, 59, 64-66 или 78, отличающийся тем, что полипептид вызывает антистрептококковую иммунную реакцию при его введении пациенту, или полипептид по крайней мере на 95% гомологичный указанному. 2. Выделенный полинуклеотид по п.1, способный индуцировать выработку специфически связывающихся с ним антител при его введении пациенту. 3. Выделенный полинуклеотид, комплементарный полинуклеотиду по п.1. 4. Выделенный полинуклеотид, комплементарный полинуклеотиду по п.2. 5. Выделенный полинуклеотид по п.1, отличающийся тем, что представляет собой ДНК. 6. Выделенный полинуклеотид по п.2, отличающийся тем, что представляет собой ДНК. 7. Выделенный полинуклеотид по п.1, отличающийся тем, что представляет собой РНК. 8. Выделенный полинуклеотид по п.2, отличающийся тем, что представляет собой РНК. 9. Вектор, включающий полинуклеотид по п.1, функционально связанный с областью, контролирующей экспрессию. 10. Вектор, включающий полинуклеотид по п.2, функционально связанный с областью, контролирующей экспрессию. 11. Клетка-хозяин, трансфицированная вектором по п.9.- 25007409 12. Клетка-хозяин, трансфицированная вектором по п.10. 13. Способ получения полипептида, кодируемого полинуклеотидом по п.1, включающий культивирование клетки-хозяина по п.11 в условиях, обеспечивающих экспрессию указанного полипептида. 14. Способ получения полипептида, кодируемого полинуклеотидом по п.2, включающий культивирование клетки-хозяина по п.12 в условиях, обеспечивающих экспрессию указанного полипептида. 15. Выделенный антигенный полипептид Streptococcus pneumoniae, имеющий аминокислотную последовательность, выбранную из группы, включающей SEQ ID No: 2, 8, 10, 16, 55-57, 59, 64-66 или 78,способный вызывать антистрептококковую иммунную реакцию при его введении пациенту, или полипептид, по крайней мере на 95% гомологичный указанному. 16. Выделенный полипептид по п.15, способный индуцировать выработку специфически связывающихся с ним антител при его введении пациенту. 17. Выделенный полипептид по пп.15 и 16, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID Nos: 2, 8, 10, 16, 55-57, 59, 64-66 или 78. 18. Выделенный полипептид по п.15, отличающийся тем, что N-терминальный остаток метионина претерпел делецию. 19. Выделенный полипептид по п.16, отличающийся тем, что секреторная последовательность аминокислот претерпела делецию. 20. Химерный полипептид, содержащий два или более полипептидов по любому из пп.15 и 16 при условии, что они связаны таким образом, чтобы образовался химерный полипептид. 21. Химерный полипептид по п.20, содержащий полипептиды, имеющие аминокислотные последовательности SEQ ID No: 10 и SEQ ID No: 64, при условии, что они связаны таким образом, чтобы образовался химерный полипептид. 22. Химерный полипептид, имеющий формулу (I) А - (В)m - (С)n - D,(I) в которой m равно 0 или 1;n равно 0 или 1; А выбрано из полипептида по любому из пп.15 и 16; В выбрано из полипептида по любому из пп.15 и 16; С выбрано из полипептида по любому из пп.15, 16 иD выбрано из полипептида по любому из пп.15 и 16. 23. Химерный полипептид по п.22, отличающийся тем, что А выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиSEQ ID No: 64; В выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиSEQ ID No: 64; С выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиD выбрано из полипептида, имеющего аминокислотную последовательность SEQ ID No: 10 илиSEQ ID No:64. 24. Вакцинная композиция, включающая полипептид по любому из пп.15-23 и фармацевтически приемлемый носитель, разбавитель или адъювант. 25. Способ профилактического или терапевтического лечения менингита, воспаления среднего уха,инфекции, бактериемии или пневмонии, вызванных стрептококками или сопутствующих стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по п.24. 26. Способ профилактического или терапевтического лечения стрептококковой инфекции, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по п.24. 27. Способ по любому из пп.25 и 26, отличающийся тем, что пациент является млекопитающим. 28. Способ по п.27, отличающийся тем, что пациент является человеком. 29. Способ по любому из пп.25 и 26, отличающийся тем, что указанная бактериальная инфекция представляет собой инфекцию, вызванную S. pneumoniae, S. pyogenes, S. agalactiae, S. dysgalactiae, S.uberis, Nocardia или Staphylococcus aureus. 30. Способ по п.29, отличающийся тем, что указанная бактериальная инфекция вызвана S. pneumoniae. 31. Применение вакцинной композиции по п.24 для профилактического или терапевтического лечения стрептококковой инфекции у животного, восприимчивого к ней или инфицированного стрептококками.
МПК / Метки
МПК: C12N 15/62, A61K 39/09, C12N 15/31, C07K 14/315, A61P 31/04
Метки: применения, стрептококков, антигенные, полипептиды, способы, получения
Код ссылки
<a href="https://eas.patents.su/30-7409-antigennye-polipeptidy-streptokokkov-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антигенные полипептиды стрептококков, способы их получения и применения</a>
Предыдущий патент: Легочное введение химически модифицированного инсулина
Следующий патент: N-аминоацетилпирролидин-2-карбонитрилы и их применение в качестве ингибиторов ddp-iv
Случайный патент: Способ просмотра в поисках дефектов диска для записи и записывающее устройство для записи информации на носитель записи, имеющий форму диска