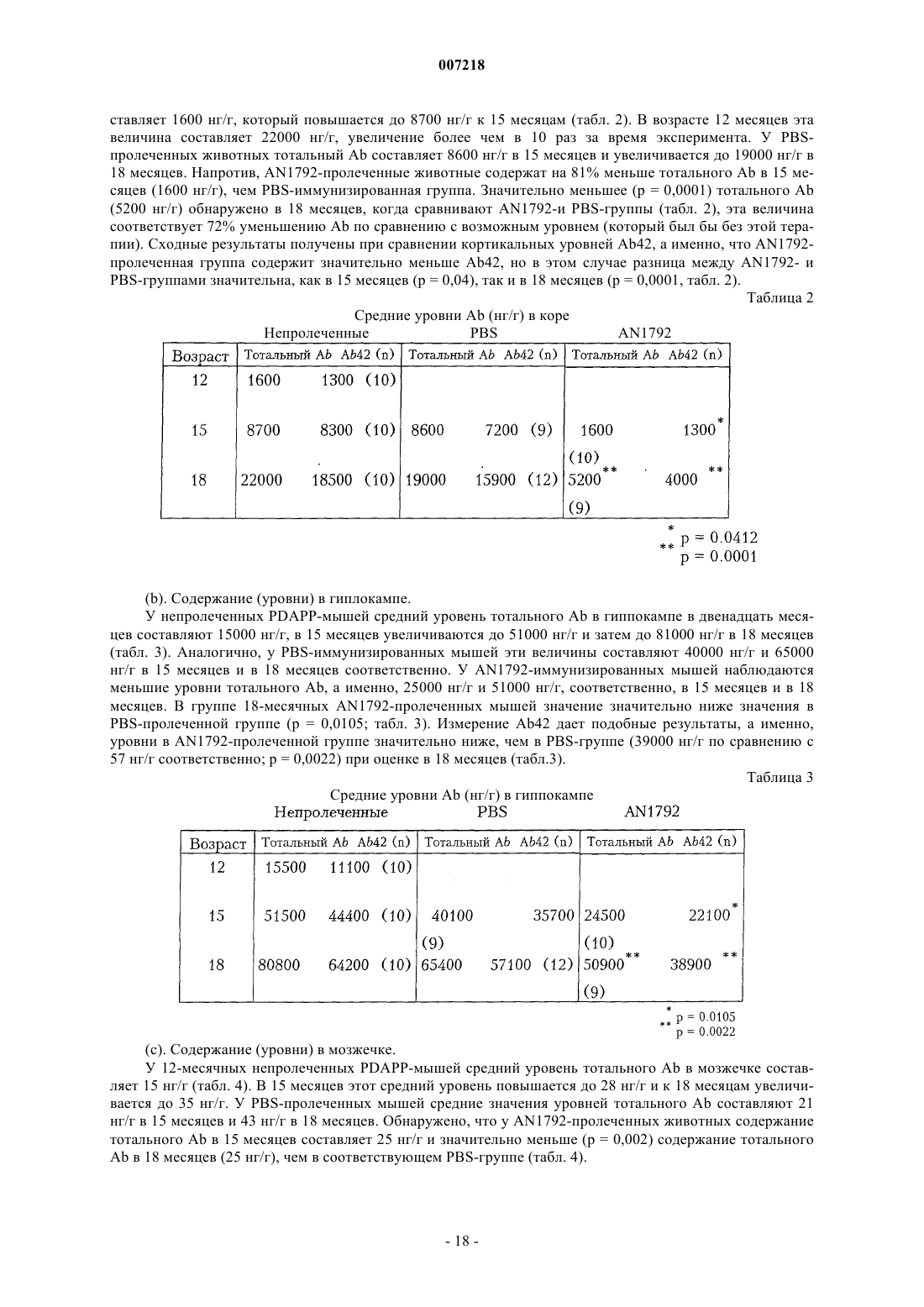
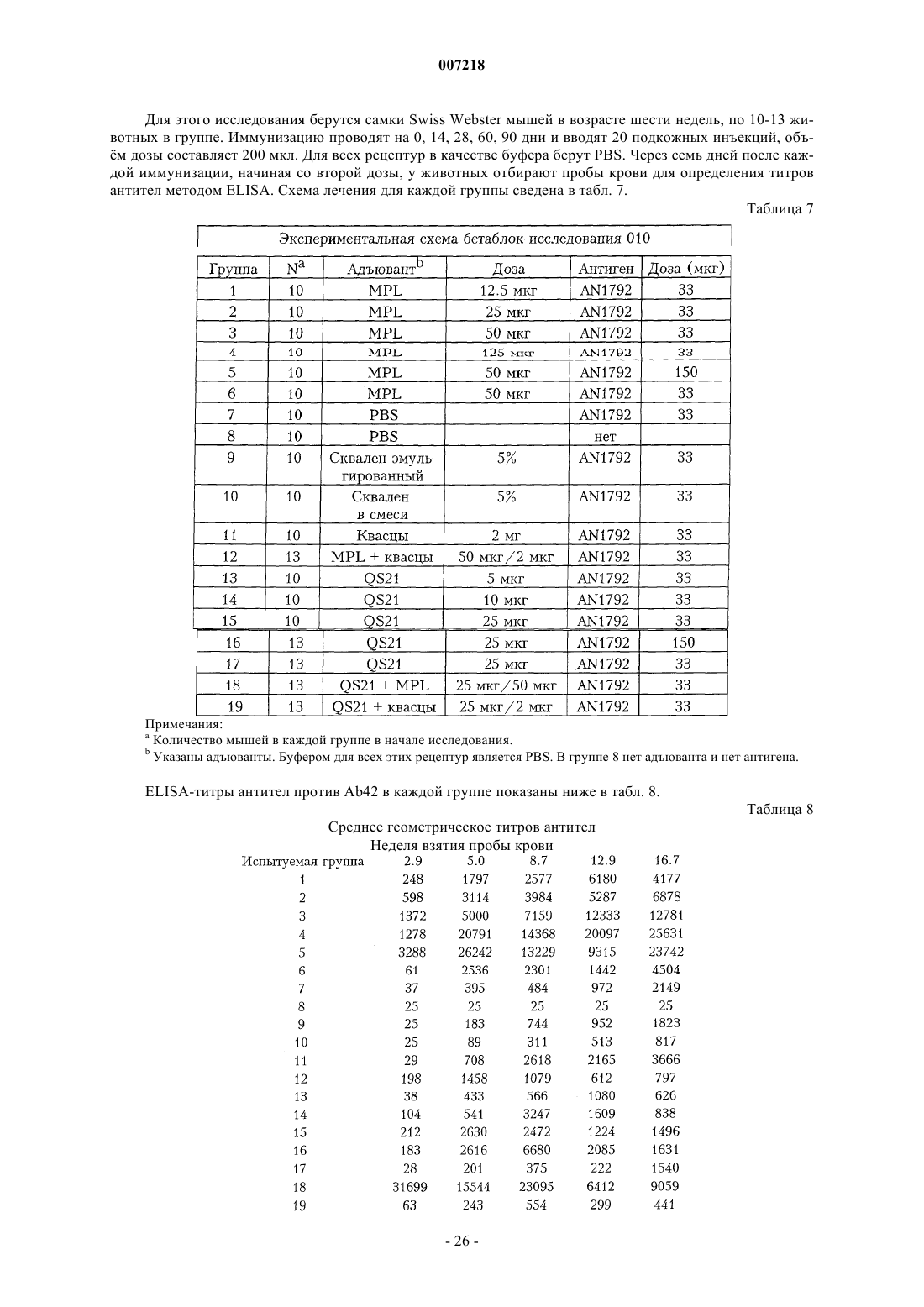
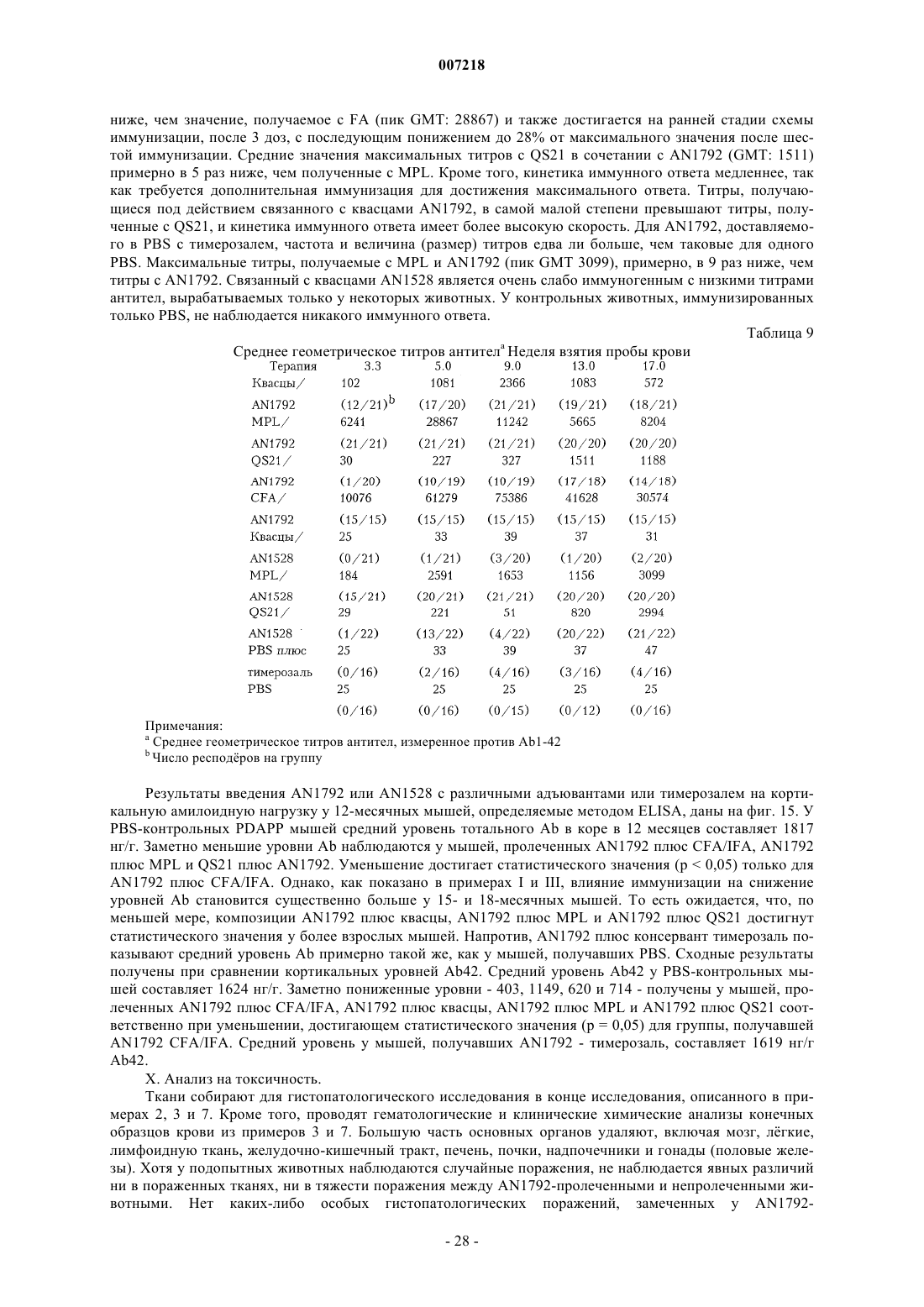
Предотвращение и лечение амилоидогенного заболевания
Формула / Реферат
1. Фармацевтическая композиция, содержащая иммуногенный агент, эффективно индуцирующий иммунный ответ, представляющий собой антитела против Ab пептида больного, и фармацевтически приемлемый адъювант, причём адъювант повышает иммунный ответ на Ab пептид.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что адъювант представляет собой StimulonTM QS.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что агент инкапсулирован в частицу.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что частица представляет собой частицу сополимера полилактид-полигликолида (PLPG).
5. Фармацевтическая композиция по любому из пп.1-4, отличающаяся тем, что агент представляет собой Ab пептид.
6. Фармацевтическая композиция по п.5, содержащая по меньшей мере 20 мкг Ab пептида.
7. Фармацевтическая композиция по любому из пп.1-4, отличающаяся тем, что агент представляет собой иммуногенный фрагмент Ab пептида.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что иммуногенный фрагмент Ab пептида представляет собой фрагмент N-концевой половины Ab пептида.
9. Фармацевтическая композиция по п.7, отличающаяся тем, что иммуногенный фрагмент Ab пептида выбирают из группы, состоящей из Аb1-5, Аb1-6, Аb1-12, Аb13-28, Ab17-28, Аb25-35, Аb33-42, Аb35-40 и Аb35-42.
10. Применение иммуногенного агента, эффективно вызывающего иммунный ответ, представляющий собой антитела к Ab пептиду, для изготовления лекарственного препарата для лечения или предупреждения заболевания, характеризующегося амилоидными отложениями в организме больного.
11. Применение по п.10, отличающееся тем, что лекарственный препарат дополнительно содержит фармацевтически приемлемый адъювант, который повышает иммунный ответ на Ab пептид.
12. Применение по п.10, отличающееся тем, что адъювант представляет собой StimulonT QS.
13. Применение по любому из пп.10-12, отличающееся тем, что агент инкапсулируют в частицу.
14. Применение по любому из пп.10-13, отличающееся тем, что агент представляет собой Аb пептид.
15. Применение по любому из пп.10-13, отличающееся тем, что агент представляет собой иммуногенный фрагмент Ab пептида.
16. Применение по п.15, отличающееся тем, что иммуногенный фрагмент Abпептида представляет собой фрагмент N-концевой половины Ab пептида.
17. Применение по п.15, отличающееся тем, что иммуногенный фрагмент Ab пептида выбирают из группы, состоящей из Ab1-5, Ab1-6, Ab1-12, Ab13-28, Ab17-28, Ab25-35, Ab33-42, Ab35-40 и Ab35-42.
18. Композиция, содержащая Ab пептид или его иммуногенный фрагмент, связанный с молекулой носителя с образованием конъюгата.
19. Композиция по п.18, отличающаяся тем, что молекула носителя представляет собой молекулу холерогена.
20. Композиция по п.18, отличающаяся тем, что молекула носителя представляет собой молекулу иммуноглобулина.
21. Композиция по п.18, отличающаяся тем, что молекула носителя представляет собой молекулу дифтерийного токсина.
22. Композиция по п.21, отличающаяся тем, что дифтерийный токсин представляет собой CRM 197.
23. Композиция по п.18, отличающаяся тем, что молекула носителя представляет собой молекулу столбнячного токсина.
24. Композиция по любому из пп.18-23, дополнительно содержащая адъювант.
25. Композиция по п.24, отличающаяся тем, что адъювант представляет собой StimulonT QS-21.
26. Композиция по любому из пп.18-25, отличающаяся тем, что агент представляет собой Ab пептид.
27. Композиция по любому из пп.18-25, отличающаяся тем, что агент представляет собой иммуногенный фрагмент Ab пептида.
28. Композиция по п.27, отличающаяся тем, что иммуногенный фрагмент Ab пептида представляет собой фрагмент N-концевой половины Ab пептида.
29. Композиция по любому из пп.18-28, дополнительно содержащая фармацевтически приемлемый носитель.
30. Фармацевтическая композиция по любому из пп.1-9, отличающаяся тем, что композиция не содержит полный адъювант Фрейнда.
31. Применение Ab пептида или его иммуногенного фрагмента, связанного с молекулой носителя с образованием конъюгата, для изготовления лекарственного препарата для лечения или предупреждения заболевания, характеризующегося амилоидными отложениями у больного.
32. Применение по п.31, отличающееся тем, что молекула носителя представляет собой молекулу холерогена.
33. Применение по п.31, отличающееся тем, что молекула носителя представляет собой молекулу иммуноглобулина.
34. Применение по п.31, отличающееся тем, что молекула носителя представляет собой молекулу дифтерийного токсина.
35. Применение по п.34, отличающееся тем, что дифтерийный токсин представляет собой CRM 197.
36. Применение по п.31, отличающееся тем, что молекула носителя представляет собой молекулу столбнячного токсина.
37. Применение по любому из пп.31-36, отличающееся тем, что лекарственный препарат дополнительно содержит адъювант.
38. Применение по п.37, отличающееся тем, что адъювант представляет собой StimulonTQS-21.
39. Применение по любому из пп.31-38, отличающееся тем, что агент представляет собой Ab пептид.
40. Применение по любому из пп.31-38, отличающееся тем, что агент представляет собой иммуногенный фрагмент Ab пептида.
41. Применение по п.40, отличающееся тем, что иммуногенный фрагмент Ab пептида представляет собой фрагмент N-концевой половины Ab пептида.
42. Применение по любому из пп.31-41, отличающееся тем, что лекарственный препарат дополнительно содержит фармацевтически приемлемый носитель.
43. Композиция, содержащая вирусный вектор, кодирующий Ab пептид или его фрагмент, эффективно индуцирующий иммунный ответ, представляющий собой антитела против Ab пептида.
44. Применение вирусного вектора, кодирующего Ab пептид или его фрагмент, эффективно индуцирующий иммунный ответ, представляющий собой антитела против Ab пептида, для изготовления медицинского препарата для лечения или предупреждения заболевания.
45. Способ оценки эффективности метода лечения болезни Альцгеймера у больного, заключающийся в определении базового количества (исходного уровня) антитела, специфичного к Ab пептиду, в тканевом образце больного перед лечением агентом, сравнении количества антитела, специфичного к Ab пептиду, в тканевом образце больного после лечения агентом с исходным уровнем Ab пептид-специфичного антитела, причем увеличеэшх количества Ab пептид-специфичного антитела, измеренного после лечения, по сравнению с исходным уровнем Ab пептид-специфичного антитела указывает на положительный результат лечения.
46. Способ оценки эффективности метода лечения болезни Альцгеймера у больного, заключающийся в определении базового количества (исходного уровня) антитела, специфичного к Ab пептиду, в тканевом образце больного перед лечением агентом, сравнении количества антитела, специфичного к Ab пептиду, в тканевом образце субъекта после лечения агентом с исходным уровнем Ab пептид-специфичного антитела, причем уменьшение количества Ab пептид-специфичного антитела, измеренного после лечения, по сравнению с исходным уровнем Ab пептид-специфичного антитела или отсутствие заметной разницы между этими значениями указывает на отрицательный результат лечения.
47. Способ оценки эффективности метода лечения болезни Альцгеймера у больного, заключающийся в определении контрольного количества антитела, специфичного к Ab пептиду, в тканевых образцах контрольной популяции, сравнении количества антитела, специфичного к Ab пептиду, в тканевом образце больного после введения агента с контрольным количеством Ab пептид-специфичного антитела, причем увеличение количества Ab пептид-специфичного антитела, измеренного после лечения, в сравнении с контрольным количеством Ab пептид-специфичного антитела указывает на положительный результат лечения.
48. Способ оценки эффективности метода лечения болезни Альцгеймера у больного, заключающийся в определении контрольного количества антитела, специфичного к Ab пептиду, в тканевых образцах контрольной популяции, сравнении количества антитела, специфичного к Ab пептиду, в тканевом образце больного после введения агента с указанным контрольным количеством Ab пептид-специфичного антитела, причем отсутствие заметной разницы между количеством Ab пептид-специфичного антитела, измеренным после начала указанного лечения, по сравнению с контрольным количеством Ab пептид-специфичного антитела указывает на отрицательный результат лечения.
49. Способ мониторинга болезни Альцгеймера или восприимчивости к ней у больного, заключающийся в обнаружении иммунного ответа против Ab пептида в образце, взятом у больного.
50. Способ оценки эффективности метода лечения болезни Альцгеймера у больного, заключающийся в определении значения количества антитела, специфичного к Ab пептиду, в тканевом образце больного, которого лечили агентом; сравнении этого значения с контрольным значением, определенным для популяции больных, почувствовавших уменьшение интенсивности или исчезновение симптомов болезни Альцгеймера в результате лечения агентом; причем значение показателя у больного, по меньшей мере, равное контрольному значению, указывает на положительный результат лечения.
51. Фармацевтическая композиция, содержащая человеческое химерное или гуманизированное антитело, специфически связывающееся с Ab пептидом, и фармацевтически приемлемый носитель.
52. Композиция по п.51, отличающаяся тем, что антитело является моноклональным антителом.
53. Фармацевтическая композиция, содержащая антитело, специфически связывающееся с Ab пептидом, и фармацевтически приемлемый носитель, отличающаяся тем, что изотип указанного антитела представляет собой человеческий IgGl.
54. Композиция по п.53, отличающаяся тем, что антитело является моноклональным антителом.
55. Применение химерного или гуманизированного антитела, специфически связывающегося с Ab пептидом, для изготовления лекарственного препарата для лечения или предупреждения заболевания, характеризующегося амилоидными отложениями в организме больного.
56. Применение по п.55, отличающееся тем, что антитело является моноклональным антителом.
57. Применение антитела, специфически связывающегося с Ab пептидом, отличающееся тем, что изотип указанного антитела представляет собой человеческий IgGl для изготовления лекарственного препарата для лечения или предупреждения заболевания, характеризующегося амилоидными отложениями в организме больного.
58. Применение по п.57, отличающееся тем, что антитело является моноклональным антителом.
59. Применение по любому из пп.10-17, 31-42, 44 или 55-58, отличающееся тем, что амилоидные отложения представляют собой агрегированную форму Ab пептида.
60. Применение по любому из пп.10-17, 31-42, 44 или 55-58, отличающееся тем, что заболевание представляет собой болезнь Альцгеймера.
61. Применение по любому из пп.10-17, 31-42, 44 или 55-58, отличающееся тем, что больной является бессимптомным больным.
62. Применение по п.14, отличающееся тем, что Ab пептид представляет собой агрегированную форму.
63. Применение по любому из пп.10-13, отличающееся тем, что агент представляет собой химерное или гуманизированное антитело к Ab пептиду, которое вызывает иммунный ответ, связываясь с Ab пептидом в организме больного.
64. Применение по п.63, отличающееся тем, что антитело является моноклональным антителом.
65. Применение по любому из пп.10-13, отличающееся тем, что агент является антителом к Ab пептиду, которое вызывает иммунный ответ, связываясь с Ab в организме больного, причём изотип антитела представляет собой человеческий IgG1.
66. Применение по п.65, отличающееся тем, что антитело является моноклональным антителом.
67. Применение по любому из пп.10-13, отличающееся тем, что агент представляет собой эффективную дозу нуклеиновой кислоты, кодирующей Аb пептид или его активный фрагмент, при этом нуклеиновая кислота экспрессируется в организме больного, продуцируя Ab пептид или его активный фрагмент, который вызывает иммунный ответ.
Текст
007218 Область техники, к которой относится изобретение Изобретение относится к области иммунологии и медицины. Предпосылки создания изобретения Болезнь Альцгеймера (AD, БА) является прогрессирующим заболеванием, приводящим к старческому слабоумию (пресенильная деменция). См. в целом Selkoe, TINS 16, 403-409 (1993); Hardy et al.,WO 92/13069; Selkoe, J. Neuropathol. Exp. Neurol. 53, 438-447 (1994); Duff et al., Nature 373, 476-477(1995); Games et al., Nature 373, 523 (1995). Вообще говоря, заболевание бывает двух видов: позднее, возникающее в старости (в 65 лет и старше) и раннее, развивающееся ранее старческого (сенильного) возраста, т.е. между 35 и 60 годами. В обоих видах заболевания патология та же самая, но в случае начала заболевания в более раннем возрасте имеется тенденция к более тяжлым и обширным нарушениям. Заболевание характеризуется двумя типами патологических изменений мозга, старческими бляшками и нейрофибриллярными узлами. Старческие бляшки представляют собой участки дезорганизованных (разрушенных) нейропилей до 150 мкм в поперечнике с внеклеточными амилоидными отложениями в центре, видимыми при изучении под микроскопом разрывов ткани мозга. Нейрофибриллярные узлы представляют собой внутриклеточные отложения тау-белка, состоящим из двух филаментов, попарно скрученных вместе. Основной составляющей бляшек является пептид, называемый Ab или b-амилоидный пептид. Аbпептид представляет собой внутренний фрагмент 39-43 аминокислот белка-предшественника, называемого амилоидным белком-предшественником (APP, АБП). Некоторые мутации в АРР-белке коррелировались с наличием болезни Альцгеймера. См., например, Goate et al., Nature 349, 704) (1991) (валин 717 в изолейцин); Chartier Harlan et al., Nature 353, 844 (1991) (валин 717 в глицин); Murrell et al., Science 254, 97(1991) (валин 717 в фенилаланин); Mullan et al., Nature Genet. 1, 345 (1992) (двойная замена лизин 595 метионин 596 в аспарагин 595-лейцин 596). Полагают, что такие мутации вызывают болезнь Альцгеймера за счет усиленного или изменнного процессинга APP в Ab, в частности процессинга APP в повышенные количества. протяжнной формы Ab (т.е. Аb1-42 и Аb1-43). Как полагают, мутации в других генах, таких как гены презенилина, PS1 и PS2, косвенно воздействуют на процессинг APP, генерируя повышенные количества протяженной формы Ab (см. Hardy, TINS 20, 154 (1997. Эти наблюдения показывают, чтоAb, и в частности его протяжнная форма, является причинным (каузальным) элементом болезни Альцгеймера.McMichael в tвропейском патенте 526511 предлагает введение гомеопатических доз (менее или равных 10-2 мг/день) Ab больным с предварительно установленной AD (БА - болезнь Альцгеймера). У обычного человека с примерно 5 л плазмы, как полагают, даже верхний предел этой дозы создат концентрацию не более 2 пг/мл. Нормальная концентрация Ab в плазме человека обычно находится в интервале 50-200 пг/мл (Seubert et al., Nature 359, 325-327 (1992. Так как предлагаемая в tвропейском патентеEP 526511 дозировка мало отличается от Ab во внутреннем кровотоке и так как EP 526511 не рекомендует применение адъюванта, кажется маловероятным, что достигается какое-либо преимущество при лечении. Напротив, данное изобретение направлено, среди прочего, на терапию болезни Альцгеймера и других амилоидогенных заболеваний путем введения больному Ab или другого иммуногена в условиях, которые вызывают у больного благоприятный иммунный ответ. Таким образом, изобретение удовлетворяет давнюю потребность в программе (схеме) лечения с целью предотвращения или уменьшения интенсивности невропатологии болезни Альцгеймера. Сущность изобретения В одном аспекте изобретение включает методы предотвращения или терапии заболевания, характеризующегося амилоидными отложениями у больного. Такие методы вызывают у больного индуцирование иммунного ответа на пептидный компонент амилоидного отложения. Такая индукция может быть активной за счт введения иммуногена или пассивной, при введении антитела или активного фрагмента антитела или производного антитела. У некоторых больных амилоидное отложение представляет собой сгруппированный (агрегированный) Аb-пептид, а заболевание является болезнью Альцгеймера. В некоторых методах болезнь протекает бессимптомно. В некоторых методах больной имеет наследственные факторы риска, указывающие на восприимчивость к болезни Альцгеймера. Такие факторы риска включают аллельные варианты в гене презенилина PS1 или PS2 и вариантные формы APP. В других методах у больного нет известных факторов риска относительно болезни Альцгеймера. Для лечения больных, страдающих болезнью Альцгеймера, одна терапевтическая схема предлагает введение больному дозы Ab-пептида с целью вызвать иммунный ответ. В некоторых методах Аb-пептид вводят с адъювантом, который усиливает иммунный ответ на Аb-пептид. В некоторых методах адъювант представляет собой квасцы. В некоторых методах адъювантом является MPL (МФЛ). Доза Аb-пептида,назначаемая больному, как правило составляет по меньшей мере 1 или 10 мгк при введении с адъювантом и по меньшей мере 50 мкг при введении без адъюванта. В некоторых методах доза составляет по меньшей мере 100 мкг. В некоторых методах Аb-пептид представляет собой Ab1-42. B некоторых методах Аb-пептид вводят в форме агрегации. В других методах Аb-пептид вводят в диссоциированной форме. В некоторых-1 007218 методах терапевтический агент представляет собой взятую в эффективной дозе нуклеиновую кислоту,кодирующую Ab или его активный фрагмент или его производное. Нуклеиновая кислота, кодирующаяAb или его активный фрагмент, экспрессирует в организме больного, продуцируя Ab или его активный фрагмент, который вызывает иммунный ответ. В некоторых из этих методов нуклеиновую кислоту вводят через кожу, при необходимости через накладку. В некоторых методах терапевтический агент определяют скринингом библиотеки соединений с целью установить соединение, реакционноспособное относительно антител к Ab, и введением соединения больному, чтобы вызвать иммунный ответ. В некоторых методах иммунный ответ направлен на агрегированный Аb-пептид, и не направлен на диссоциированный Аb-пептид. Например, иммунный ответ может содержать антитела, которые связываются с агрегированным Аb-пептидом, не связываясь с диссоциированным Ab-пептидом. В некоторых методах иммунный ответ содержит Т-клетки, которые связываются с Ab, образующим комплекс с MCHI или MCHII на клетках CD8 или CD4. В других способах иммунный ответ индуцирует введение больному антитела к Ab. В ряде способов иммунный ответ индуцирует взятие у больного Т-клеток, контактирование Т-клеток с Ab-пептидом в условиях, при которых осуществляется примирование Т-клетки, и возвращение Т-клеток больному. Терапевтический агент обычно вводят перорально, назально, интрадермально (внутрикожно), подкожно, внутримышечно, местно или внутривенно. В некоторых методах больного постоянно контролируют (мониторинг) после введения для оценки иммунного ответа. Если мониторинг показывает (затихание) ослабление иммунного ответа со временем, больному можно дать одну или более дополнительных доз агента. В другом аспекте изобретение включает фармацевтические композиции, содержащие Ab, и эксципиент, пригодный для перорального и других способов введения. Изобретение также охватывает фармацевтические композиции, содержащие агент, эффективный для того, чтобы вызвать иммуногенный ответ на Ab у больного, и фармацевтически приемлемый адъювант. В некоторых подобных композициях агент представляет собой Ab или его активный фрагмент. В некоторых композициях адъювант представляет собой квасцы. В некоторых композициях адъювант представляет собой эмульсию масла в воде. В некоторых композициях Ab или его активный фрагмент является компонентом сополимера полилактида с полигликолидом (PLPG) или другой частицы. Изобретение дополнительно предлагает композиции, содержащие Ab или его активный фрагмент,связанный с молекулой конъюгата, которая способствует доставке Ab в кровоток больного и/или стимулирует иммунный ответ на Ab. Например, конъюгат может стимулировать иммунный ответ на Ab. В некоторых композициях конъюгат представляет собой холероген. В некоторых композициях конъюгат представляет собой иммуноглобулин. В некоторых композициях конъюгат представляет собой ослабленный токсин дифтерии CRM 197 (Gupta, Vaccine 15, 1341-3 91997. Изобретение также включает фармацевтические композиции, содержащие агент, который вызывает у больного иммуногенный ответ на Ab при условии, что композиция не содержит полный адъювант Фрейнда. Изобретение также предлагает композиции, содержащие вирусный вектор, кодирующий Ab или его активный фрагмент, эффективно индуцирующий иммунный ответ на Ab. Сответствующие вирусные векторы включают вирус герпеса, аденоассоциированный вирус, ретровирус, Синдбис-вирус,вирус леса семлики, вирус коровьей оспы или оспы птиц. Изобретение дополнительно предлагает способы предотвращения или терапии болезни Альцгеймера. В соответствии с этими методами больному назначают эффективную дозу Аb-пептида. Далее изобретение обеспечивает применение Ab или антитела к нему в производстве лекарственного препарата для предотвращения или терапии болезни Альцгеймера. В другом аспекте изобретение заключается в способах оценки эффективности метода терапии болезни Альцгеймера. В соответствии с этими способами в образце ткани больного, перед лечением агентом определяют базовое количество антитела, специфически связывающегося с Аb-пептидом. Количество антитела, специфически связывающегося с Аb-пептидом, в образце ткани больного после лечения агентом сравнивают с базовым количеством антитела, специфически связывающегося с Аb-пептидом. Количество Аb-пептид-специфического антитела, измеренное после лечения, значительно превышающее базовое количество Аb-пептид-специфического антитела, указывает на положительный результат лечения. В других способах оценки эффективности метода терапии болезни Альцгеймера определяют базовое количество антитела, специфического к Аb-пептиду в образце ткани больного, перед лечением агентом. Количество антитела, специфического к Аb-пептиду в образце ткани больного после терапии с помощью агента сравнивают с базовым количеством Аb-пептид-специфического антитела. Уменьшение или отсутствие разницы между количеством Аb-пептид-специфического антитела, измеренным после лечения, по сравнению с базовым количеством Аb-пептид-специфического антитела указывает на отрицательный результат лечения. В других способах оценки эффективности метода лечения болезни Альцгеймера определяют контрольное количество антитела, специфически связывающегося с Аb-пептидом, в образце ткани контрольной популяции. Количество антитела, специфически связывающегося с Аb-пептидом, в образце-2 007218 ткани больного после введения агента сравнивают с контрольным количеством Аb-пептидспецифического антитела. Количество Аb-пептид-специфического антитела, измеренное после лечения,значительно превышающее контрольное количество Аb-пептид-специфического антитела, характеризует положительный результат лечения. В других способах оценки эффективности метода лечения больного болезнью Альцгеймера определяют контрольное количество антитела, специфического к Аb-пептиду, в образцах ткани контрольной популяции. Количество антитела, специфического к Аb-пептиду, в образце ткани больного после введения агента сравнивают с контрольным количеством Аb-пептид-специфического антитела. Отсутствие значительной разницы между количеством Аb-пептид-специфического антитела, измеренным после начала указанного лечения, по сравнению с контрольным количеством Аb-пептид-специфического антитела указывает на отрицательный результат лечения. Другие способы мониторинга болезни Альцгеймера или чувствительности к ней больного включают обнаружение иммунного ответа на Аb-пептид в образце, взятом у больного. В ряде подобных методов больному вводили агент, действующий как средство, лечащее или предотвращающее болезнь Альцгеймера, и уровень (степень) ответа определяет будущий режим лечения больного. В других способах оценки эффективности метода лечения больного болезнью Альцгеймера определяют величину количества антитела, специфически связывающегося с Аb-пептидом в образце ткани больного, пролеченного агентом. Значения сравнивают с контрольной величиной, определнной для группы больных, испытавших улучшение или исчезновение симптомов болезни Альцгеймера в результате терапии с помощью агента. Величина (количество антитела) у больного, по меньшей мере, равная контрольной величине, указывает на положительную реакцию на терапию. Объектом настоящего изобретения являются также диагностические наборы для осуществления вышеописанных способов. Такие наборы, как правило, включают реагент, который специфически связывается с антителами к Ab или стимулирует пролиферацию Т-клеток, реакционноспособных по отношению к Ab. Краткое описание фигур Фиг. 1 - титр антител после инъекции Ab1-42 трансгенным мышам; фиг. 2 - амилоидная нагрузка в гиппокампе. Площадь (в %) участка гиппокампа, занимаемая амилоидными плашками, определяемая реактивностью в отношении Аb-специфического mAb 3D6, устанавливается с помощью количественного компьютерного анализа изображения иммунореактивных участков мозга. Даны значения для отдельных мышей, классифицированные по группам терапии (опытным группам). Горизонтальная линия для каждого группирования показывает среднюю величину распределения; фиг. 3 - невритная дистрофия в гиппокампе. Процент площади участка гиппокампа, пораженной дистрофическим невритом, определяемый е реактивностью относительно человеческого АРРспецифического mAb 8E5, устанавливали количественным компьютерным анализом изображения иммунореактивных участков мозга. Значения (величины) для отдельных мышей даны для группы, пролеченной AN1792, и пролеченной PBS (ЗФР) контрольной группы. Горизонтальная линия для каждого группирования показывает среднюю величину распределения; фиг. 4 - астроцитоз в ретросплениальной коре. Процентное содержание площади кортикального участка, занимаемого глиальным фибриллярным кислым белком (GFAP) - положительными астроцитами, определяли количественным компьютерным анализом изображения иммунореактивных участков мозга. Значения для отдельных мышей распределяются (классифицируются) в зависимости от обрабатываемой группы и средние групповые значения указаны горизонтальными линиями; фиг. 5 - среднее геометрическое титров антитела к Аb1-42 после иммунизации серией из восьми дозAN1792, содержащих 0,14, 0,4, 1,2, 3,7, 11, 33, 100 или 300 мкг; фиг. 6 - кинетика гуморального иммунного ответа (антителогенеза) на АN1792-иммунизацию. Титры выражаются как средние геометрические значения для 6 животных в каждой группе; фиг. 7 - количественный анализ изображения кортикального амилоида (нагрузки) у мышей, получавших PBS (ЗФР) и AN1792; фиг. 8 - количественный анализ изображения нейритных бляшек (нагрузки) у мышей, получавшихPBS (ЗФР) и AN1792; фиг. 9 - количественный анализ изображения процентного содержания ретросплениальной коры,занимаемой астроцитами, у мышей, получавших PBS (ЗФР) и AN1792; фиг. 10 - анализ пролиферации лимфоцитов в клетках селезнки принимавших AN1792 (вверху) или PBS (ЗФР) (внизу) мышей; фиг. 11 - уровни тотального Ab в коре. График разброса профилей индивидуальных Ab у мышей,иммунизированных Ab- или АРР-производными в соединении с адъювантом Фрейнда; фиг. 12 - содержание амилоида в коре определяли количественным анализом изображения иммунореактивных участков мозга для мышей, иммунизированных Аb-пептидными конъюгатами Ab1-5, Аb1-12 и Ab13-18, получавших агрегации непроцессированного Ab AN1792 (Аb1-42) и AN1528 (Аb1-40) и PBS(ЗФР) (контрольная группа); фиг. 13 - среднее геометрическое титров Аb-специфического антитела для групп мышей, иммуни-3 007218 зированных производными Ab или APP вместе с адъювантом Фрейнда; фиг. 14 - среднее геометрическое титров Аb-специфического антитела для групп морских свинок,иммунизированных AN1792 или его пальмитоильным производным в соединении с различными адъювантами; фиг. 15 - уровни Ab в коре мышей PDAPP в возрасте десяти месяцев, получавших AN1792 илиAN1528 с различными адъювантами. Определения Термин "практическая идентичность" означает, что две пептидные последовательности, будучи оптимально совмещены, например, с помощью программ GAP или BESTFIT, заполняя разрывы (гэпы) по умолчанию, имеют по меньшей мере 65%-ную идентичность последовательностей, предпочтительно по меньшей мере 80 или 90%-ную идентичность последовательностей, более предпочтительно по меньшей мере 95%-ную идентичность последовательностей или более (например, 99%-ную идентичность последовательностей или выше). Предпочтительно, чтобы неидентичные остатки отличались консервативными аминокислотными заменами. Для сравнения последовательностей, обычно одна последовательность выступает в роли эталонной последовательности, с которой сравниваются испытуемые последовательности. При применении алгоритма сравнения последовательностей испытуемую и эталонную последовательности вводят в компьютер, если необходимо, устанавливают координаты последовательностей и определяют параметры программы алгоритма последовательностей. Алгоритм сравнения последовательностей позволяет рассчитать затем процент идентичности последовательностей для испытуемой(-ых) последовательности(-ей) по сравнению с эталонной последовательностью, исходя из установленных программных параметров. Оптимальное совмещение последовательностей с целью сравнения можно проводить, например, с помощью алгоритма локальной гомологии Смита и Уотермана (Smith and Waterman), Adv. Appl. Math. 2:482 (1981); алгоритма совмещения гомологий Нидльмана и Вунша (Needlman and Wunsch, J. Mol. Biol. 48:443 (1970); методом подобия Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 (1988); с помощью компьютерных разработок этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin(в целом Ausubel et al., см. выше). Одним из примеров алгоритма, пригодного для определения процента идентичности последовательностей и подобия последовательностей, является алгоритм BLAST, описанный Altschul et al., J. Mol. Biol. 215:403-410 (1990). Программное обеспечение для осуществленияBLAST-анализа является общедоступным через National Center for Biotechnology Information (национальный центр информации по биотехнологии) (http://www.ncbi.nlm.nih.gov/). Как правило, для проведения сравнения последовательностей можно применять параметры программы, принимающие значение по умолчанию, хотя также можно использовать специально разработанные (заказные) параметры. Для аминокислотных последовательностей программа BLASTP использует в качестве значений по умолчанию длину слова (разрядность, W) 3, ожидание (E) 10 и оценочную матрицу BLOSUM62 (см. Henikoff andHenikoff, Proc. Natl. Acad. Sci. USA 89, 10915 (1989. С целью классификации аминокислотных замен как консервативных, так и неконсервативных, аминокислоты группируют следующим образом. Группа I (гидрофобные боковые цепи): норлейцин, met, ala,val, leu, ile; группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; группа III (кислые боковые цепи): asp, glu; группа IV (основные боковые цепи): asn, gln, his, lys, arg; группа V (остатки, влияющие на ориентацию цепи): gly, pro; и группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замены включают обмен между кислотами того же класса. Неконсервативные замены представляют собой обмен члена одного из этих классов на члена другого класса. Терапевтические агенты по изобретению обычно являются практически чистыми. Это означает, что чистота агента обычно составляет по меньшей мере 50 вес.% (вес/вес), а также что агент практически не содержит вредных (мешающих) белков и загрязнений. Иногда агенты имеют чистоту по меньшей мере около 80 вес.%, более предпочтительна чистота по меньшей мере 90 или около 95 вес.%. Однако при применении соответствующих методов очистки белков можно получить по меньшей мере 99 вес.%-ные гомогенные пептиды. Специфическое связывание между двумя объектами означает аффинность (сродство) по меньшей мере 106, 107, 108, 109 M-1 или 1010 M-1.Предпочтительно сродство выше 108 M-1. Термин "антитело" включает интактные антитела и их связывающие фрагменты. Обычно фрагменты конкурируют с интактным антителом, из которого они происходят, в специфическом связывании с антигеном. При необходимости антитела или их связывающие фрагменты могут химически конъюгироваться с белками, слитыми с другими белками, или экспрессировать в виде них.APP695, APP751 и APP770 относится соответственно к 695, 751 и 770 протяженным полипептидам из аминокислотных остатков, кодируемым человеческим геном APP. См. Kang et al., Nature 325, 773 (1987);Ponte et al., Nature 331, 525 (1988); и Kitaguchi et al., Nature 331, 530 (1988). Аминокислоты в человеческом амилоидном предшественнике белка (APP) обозначены номерами в соответствии с последовательностями изоформы АРР 770. Термины, такие, например, как Аb39, Ab40, Аb41, Аb42 и Аb43 относятся к Аb-пептиду, содержащему аминокислотные остатки 1-39, 1-40, 1-41, 1-42 и 1-43.-4 007218 Термин "эпитоп" или "антигенная детерминанта" относится к сайту на поверхности антигена, на который отвечают В и/или Т-клетки. В-клеточные эпитопы могут образовываться как из прилегающих (соседних) аминокислот, так и не из прилегающих аминокислот, накладывающихся друг на друга за счт третичной укладки (складчатости) белка. Эпитопы, образованные из прилегающих аминокислот, обычно сохраняются при действии денатурирующих растворителей, тогда как эпитопы, образованные за счт третичной структуры (укладки), обычно утрачиваются при обработке денатурирующими растворителями. Эпитопы обычно содержат по меньшей мере 3 и более, обычно по меньшей мере 5 или 8-10 аминокислот в единичной пространственной конформации. Способы определения пространственной конформации эпитопов включают, например, рентгеновскую кристаллографию и двухмерный ядерный магнитный резонанс. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, Glenn E.Morris, Ed. (1996). Антитела, которые распознают тот же эпитоп, можно идентифицировать простым иммуноанализом, показывающим способность одного антитела блокировать связывание другого антитела с целевым антигеном. Т-клетки распознают секвенциальные эпитопы, примерно из девяти аминокислот в случае СD8-клеток и примерно из 13-15 аминокислот в случае клеток CD4. Т-клетки, которые распознают эпитоп, могут быть идентифицированы in vitro анализами, которые определяют антигензависимую пролиферацию, как определяемая включением 3 Н-тимидина в примированные Т-клетки в ответ на эпитоп (Burke et al., J. Inf. Dis. 170, 1110-19 (1994, антигензависимым киллингом (T-лимфоцитотоксический тест, Tigges et al., J. Immunol. 156, 3901-3910) или секрецией цитокинов. Термин "иммунологический" или "иммунный" ответ раскрывает благотворный (полезный) гуморальный (опосредуемый антителом) и/или клеточный (опосредуемый антиген-специфическими Тклетками или продуктами их секреции) ответ на амилоидный пептид у больного реципиента. Такой ответ может быть активным ответом, стимулированным введением иммуногена, или пассивным ответом, индицированным введением антитела или примированных Т-клеток. Реакция клеточного иммунитета выявляется презентацией полипептидных эпитопов в ассоциации с молекулами MHC класса I и класса II для активации антиген-специфических CD4+ Т-хелперных клеток и/или CD8+ цитотоксических Т-клеток. Ответ может также включать активацию моноцитов, макрофагов, NK-клеток, базофилов, дендритных клеток, астроцитов, микроглии, эозинофилов или других компонентов врожднного иммунитета. Наличие опосредуемого клетками иммунологического ответа можно определить анализами пролиферации(CD4+ Т-клеток) или CTL (T-лимфоцитотоксическими) анализами (Burke, см. выше; Tigges, см. выше). Относительный вклад антительной и клеточной реакции в защитный или лечебный эффект иммуногена можно различить, выделяя по отдельности IgG и Т-клетки иммунизированного сингенного животного и определяя защитный или терапевтический эффект у второго субъекта."Иммуногенный агент" или "иммуноген" способен стимулировать аутоиммунологический ответ при введении больному при необходимости в сочетании с адъювантом. Термин "голый полинуклеотид" относится к полинуклеотиду, не дающему комплекс с коллоидным материалом. Голые полинуклеотиды иногда клонируют в плазмидный вектор. Термин "адъювант" относится к соединению, которое при введении совместно с антигеном усиливает иммунный ответ на антиген, но будучи введено отдельно, не вызывает иммунный ответ на антиген. Адъюванты могут усиливать иммунный ответ по нескольким механизмам, включая рекрутмент лимфоцитов, стимуляцию В и/или Т-клеток и стимуляцию макрофагов. Термин "больной" включает человека или другое млекопитающее, которое получает профилактическое или терапевтическое лечение. Дезагрегированный (диссоциированный) или мономерный Ab означает растворимые, мономерные пептидные единицы Ab. Один метод приготовления мономерного Ab представляет собой растворение лиофилизированного пептида в чистом ДМСО под действием ультразвука. Полученный раствор центрифугируют для удаления нерастворимых (макро)частиц. Агрегированный Ab представляет собой смесь олигомеров, в которой мономерные единицы удерживаются вместе нековалентными связями. Композиции или методы, "содержащие" один или более описанных элементов, могут включать другие элементы, которые конкретно не описаны. Например, композиция, которая содержит Аb-пептид, охватывает как изолированный Ab-пептид, так и Аb-пептид в качестве компонента большей полипептидной последовательности. Подробное описание изобретенияI. Общие сведения. Изобретение предоставляет фармацевтические композиции и методы профилактического и терапевтического лечения заболеваний, характеризующихся скоплением амилоидных отложений. Амилоидные отложения содержат пептид, соединнный (собранный) в нерастворимую массу. Природа пептида меняется в различных заболеваниях, но в большинстве случаев агрегация имеет b-складчатую структуру и окрашивается конго красным. Заболевания, характеризующиеся амилоидными отложениями, включают болезнь Альцгеймера (AD) как поздний, так и ранний случай. При обоих заболеваниях амилоидное отложение содержит пептид, называемый Ab, который аккумулируется в мозгу страдающих болезнью людей. Примерами некоторых других заболеваний, характеризующихся амилоидными отложениями,являются SAA амилоидоз, наследственный исландский синдром, множественная миелома и губковидные-5 007218 формы энцефалопатии, включая коровье бешенство, болезнь Якоба Кройцфельда, почесуха овец и губчатая энцефалопатия норок (см. Weissmann et al., Сurr. Opin. Neurobiol. 7, 695-700 (1997); Smits et al.,Veterinary Quarterly 19, 101-105 91997); Nathanson et al., Am. J. Epidemiol. 145, 959-969 (1997. Пептиды,образующие агрегации при этих заболеваниях, суть сывороточный амилоид А, цистантин С, лгкая цепь каппа IgG, соответственно, в случае первых трх, и белок прион в остальных случаях.II. Терапевтические агенты. 1. Болезнь Альцгеймера. Терапевтические агенты для применения по данному изобретению стимулируют иммунный ответ на Аb-пептид. Эти агенты включают сам Аb-пептид и его варианты, аналоги и миметики Аb-пептида,которые стимулируют антитела к Аb-пептиду и/или перекрестную реакцию с ними, и антитела или Тклетки, реакционноспособные в отношении Аb-пептида. Стимуляция (индукция) иммунного ответа может быть активной, как в том случае, когда вводят иммуноген для стимуляции антител или Т-клеток,реактивных в отношении Ab в организме больного, или пассивным, когда вводят антитело, которое само связывается с Ab в организме больного.Ab, также известный как b-амилоидный пептид, или А 4-пептид (см. патент США 4666829; Glennerand Wong, Biochem. Biophys. Res. Commun. 120, 1131 (1984, представляет собой пептид из 39-43 аминокислот, который является основным компонентом бляшек, характеристичных для болезни Альцгеймера.Ab образуется при процессинге большего (по размеру) белка APP под действием двух ферментов, называемых b- и g-секретазы (см. Hardy, TINS 20, 154 (1997. Известные мутации в APP, обусловленные болезнью Альцгеймера, происходят непосредственно близ сайта распознавания b- и g-секретазы, или внутри Ab. Например, положение 717 является ближайшим к сайту расщепления g-секретазой APP при его процессинге в Ab, а положения 670/671 являются ближайшими к сайту расщепления под действием bсекретазы. Полагают, что мутации вызывают AD-болезнь за счт происходящих таким образом реакций расщепления, при которых образуется Ab, что получается повышенное количество 42/43 аминокислотных форм.Ab обладает необычным свойством, он может фиксировать и активизировать как классический, так и альтернативный пути активации комплемента. В частности, он связывается с Clg и, в конечном счте, с С 3bi. Эта ассоциация облегчает связывание с макрофагами, приводящее к активации В-клеток. Кроме того, С 3bi распадается дальше, а затем связывается с CR2 на В-клетках зависящим от T-клеток образом,10000-кратно активирующим эти клетки. Этот механизм заставляет Ab вырабатывать иммунный ответ более сильный, нежели иммунный ответ других антигенов. Терапевтический агент, применяемый в заявляемых методах, может быть любым из природных форм Ab-пептида, и в особенности, человеческими формами Ab-пептида (т.е. Аb39, Ab40, Ab41, Аb42 или Аb43). Последовательности этих пептидов и их родство с предшествеником-АРР иллюстрируется фиг. 1 в Hardy et al., TINS 20, 155-158 (1997). Например, Аb42 имеет последовательностьAb41, Ab40 и Аb39 отличаются от Ab42 тем, что на С-конце отсутствуют соответственно Ala, AlaIle и Ala-Ile-Val. Аb43 отличается от Аb42 наличием остатка треонина на С-конце. Терапевтический агент может также представлять собой активный фрагмент или аналог природного Аb-пептида, который содержит эпитоп, стимулирующий подобный защитный или терапевтический иммунный ответ при введении человеку. Иммуногенные фрагменты обычно имеют последовательность по меньшей мере из 3, 5,6, 10 или 20 прилегающих (соседних) аминокислот природного пептида. Иммуногенные фрагменты включают Ab1-5, 1-6, 1-12, 13-28, 17-28, 25-25, 35-40 и 35-42. В некоторых методах предпочтительными являются фрагменты N-терминальной части Ab. Аналоги включают аллельные, видовые и индуцированные варианты. Аналоги обычно отличаются от природных пептидов в одном или двух положениях, часто вследствие консервативных замен. Обычно идентичность последовательностей аналогов и природных пептидов составляет по меньшей мере 80 или 90%. Некоторые аналоги также включают неприродные аминокислоты или модификации N- или С-концевых аминокислот. Примерами неприродных аминокислот являются ,-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота, 4 гидроксипролин, g-карбоксиглутамат, e-N,N,N-триметиллизин, e-N-ацетиллизин, О-фосфосерин, Nацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, w-N-метиларгинин. Можно проводить скрининг фрагментов и аналогов на эффективность профилактического или терапевтического действия на моделях трансгенных животных, как описано ниже.Ab, его фрагменты, аналоги и другие амилоидогенные пептиды можно синтезировать реакцией твердофазного пептидного синтеза или рекомбинантной экспрессией, или их можно получать из природных источников. Автоматические синтезаторы пептидов в промышленности выпускаются множеством поставщиков, таких как, например, Applied Biosystems, Foster City, California. Рекомбинантную экспрессию можно осуществлять в бактериях, таких, например, как E. coli, дрожжах, клетках насекомых или-6 007218 клетках млекопитающих. Методики рекомбинантной экспрессии описаны Sambrook et al., MolecularResearch, Inc. Napa, CA). Терапевтические агенты также включают более протяжнные полипептиды, к которым относятся,например, Аb-пептид, активный фрагмент или аналог вместе с другими аминокислотами. Например, Аbпептид может присутствовать в виде интактного АРР-белка или его сегмента, такого, например, как фрагмент C-100, который начинается с N-конца Ab и продолжается до конца APP. Можно проводить скрининг таких полипептидов на профилактическую и терапевтическую эффективность на животных моделях, как описано ниже. Ab-пептид, аналог, активный фрагмент или другой полипептид можно вводить в агрегированной форме (т.е. в виде амилоидного пептида) или в диссоциированной форме. Терапевтические агенты также включают мультимерные или мономерные иммуногенные агенты. В других вариантах иммуногенный пептид, например, такой как Ab, может присутствовать в виде вирусной или бактериальной вакцины. Нуклеиновая кислота, кодирующая иммуногенный пептид,встраивается в геном или в эписому вируса или бактерии. При необходимости нуклеиновая кислота встраивается таким образом, что иммуногенный пептид экспрессирует в виде секретируемого белка или слитого белка с поверхностным белком вируса или трансмембранным белком бактерий так, что пептид воспроизводится. Вирусы или бактерии, применяемые в таких методах, должны быть непатогенными или ослабленными. Соответствующие (пригодные) вирусы включают аденовирус, HSV (вирус простого герпеса), вирус коровьей оспы или оспы птиц. Слияние иммуногенного пептида с HBsAg HBV является особенно пригодным. Терапевтические агенты также включают пептиды и другие соединения, которые не обязательно имеют значительное сходство аминокислотных последовательностей с последовательностью Ab, но, тем не менее, работают как миметики Аb и индуцируют сходный иммунный ответ. Например, можно проводить скрининг на пригодность любых пептидов или белков, образующих b-складки. Также можно применять антиидиотипические антитела против моноклональных антител к Ab или другим амилоидогенным пептидам. Такие анти-Id антитела имитируют антиген и вырабатывают иммунный ответ на него (см. Essential Immunology (Roit ed., Blackwell Scientific Publications, Palo Alto, 6th ed.), p. 181). Также можно проводить скрининг на пригодность произвольных библиотек пептидов или других соединений. Можно получать комбинаторные библиотеки для многих типов соединений, которые можно синтезировать поэтапно (постепенно). Такие соединения включают полипептиды, миметики с бетаповоротом, полисахариды, фосфолипиды, гормоны, простагландины, стероиды, ароматические соединения, гетероциклические соединения, бензодиазепины, олигомерные N-замещнные глицины и олигокарбаматы. Большие комбинаторные библиотеки можно создать методом кодируемых синтетических библиотек (ESL), описанным Affymax, международная заявка WO 95/12608, Affymax, WO 93/06121,Columbia University, WO 95/08051, Pharmacopeia, WO 95/35503 и Scripps, WO 95/30642 (каждая из которых вводится ссылкой). Пептидные библиотеки также можно создать, отбирая нужные фаги из библиотеки фагов. См., например, Devlin, WO 91/18980. Комбинаторные библиотеки и другие соединения сначала подвергают скринингу на пригодность,определяя их способность связываться с антителами или лимфоцитами (В или T), известными своей специфичностью к Ab или другим амилоидогенным пептидам. Например, можно проводить начальный скрининг любых поликлональных сывороток или моноклонального антитела к Ab или другому амилоидогенному пептиду. Соединения, идентифицируемые таким скринингом, затем дополнительно анализируют на способность индуцировать антитела к Ab или реакционноспособные относительно Ab или другого амилоидогенного пептида лимфоциты. Например, многократные разведения сывороток можно проверять на микропланшетах с предварительно нанеснным Аb-пептидом, а для проверки реакционноспособного к Ab антитела можно применять стандартный метод ELISA. Затем соединения можно испытать на профилактическую и терапевтическую эффективность на трансгенных животных, предрасположенных к амилоидогенному заболеванию, как описано в примерах. Такие животные включают, например,мышей, несущих 717-мутацию APP, описанных см. выше, и мышей, несущих Шведскую (Swedish) мутацию APP, как это описано McConlogue патент США 5612486 и Hsiao et al., Science 274, 99 (1996);Sci. USA 94, 13287-13292 (1997); Borchelt et al., Neuron 19, 939-945 (1997. Тот же метод скрининга можно применить для других потенциальных агентов, таких, например, как фрагменты Ab, аналоги Ab и более протяжнные пептиды, включая Ab, описанные выше. Терапевтические агенты по изобретению также включают антитела, которые специфически связываются с Ab. Такие антитела могут быть моноклональными или поликлональными. Некоторые такие антитела специфически связываются с агрегированной формой Ab, не связываясь с диссоциированной формой. Некоторые связываются с диссоциированной формой и не связываются с агрегированной формой. Некоторые связываются как с агрегированной, так и с диссоциированной формой. Получение нечеловеческих моноклональных антител, например, антител мышей или крыс, можно осуществлять, например, иммунизацией животного Ab. См. Harlow and Lane, Antibodies, A Laboratory Manual (CSHP NY,-7 007218 1988) (вводится ссылкой). Такой иммуноген можно получать из природного источника, пептидным синтезом или рекомбинантной экспрессией."Гуманизированные" формы мышиных антител можно получать, связывая CDR-участки нечеловеческих антител с константными областями человеческих антител методами рекомбинантной ДНК. См. Queen et al., Proc. Natl. Acad. Sci. USA 86, 10029-10033 (1989) и WO 90/07861 (вводимый ссылкой). Человеческие антитела можно получать фаг-дисплей методом (получение и анализ фагов, экспрессирующих или содержащих нужные гены). См., например, Dower et al., WO 91/17271; McCafferty et al.,WO 92/01047. В этих методах получают библиотеки фагов, которые (фаги) обнаруживают различные антитела на своей внешней поверхности. Антитела обычно выявляются в виде фрагментов Fv или Fab. Фаги, выявляющие (демонстрирующие) антитела с заданной специфичностью, выбираются исходя из повышенного сродства (из увеличения сродства) к Ab или его фрагментам. Ab также можно получить из трансгенных млекопитающих (не человека), имеющих трансгены, кодирующие, по меньшей мере, сегмент локуса человеческого иммуноглобулина и локус инактивированного эндогенного иммуноглобулина. См., например, международные заявки Lonberg et al., WO 93/12227 (1993); Kucherlapati, WO 91/10741(1991) (каждая из которых вводится ссылкой во всей полноте). Человеческие антитела можно выбрать в экспериментах по конкурентному связыванию, или другим способом, чтобы иметь ту же самую специфичность эпитопа, что и определнное антитело мыши. По-видимому, такие антитела в особенности имеют общие с антителами мыши полезные функциональные свойства. Человеческие поликлональные антитела также могут предоставляться в виде сыворотки людей, иммунизированных иммуногенным агентом. При необходимости, такие поликлональные антитела можно концентрировать аффинной очисткой с Ab или другим амилоидным пептидом в качестве аффинного реагента. Можно создать человеческие или "гуманизированные" антитела, содержащие константную областьIgG, IgD, IgA и IgE и любой изотип, включая IgG1, IgG2, IgG3 и IgG4. Антитела могут экспрессировать в виде тетрамеров, содержащих две лгких и две тяжлых цепи, в виде отдельных тяжлых цепей, лгких цепей, в виде Fab, Fab' F(ab')2 и Fv или в виде одноцепочечных антител, в которых вариабельные области тяжлой и лгкой цепей связаны через спейсер. Терапевтические агенты для применения в данных методах также включают T-клетки, которые связываются с Аb-пептидом. Например, T-клетки могут активироваться против Аb-пептида с помощью экспрессии человеческого гена MHC класса I и человеческого гена b-2-микроглобулина линией клеток насекомых, вследствие чего комплекс образуется на поверхности клеток и может связываться с Аb-пептидом. Т-клетки, контактировавшие с клеточной линией, становятся специфически активированными против пептида. См. Peterson et al., US 5314813. Линии клеток насекомых, экспрессирующие антиген MHC классII, можно таким же образом использовать для активации CD4 Т-клеток. 2. Другие заболевания. Те же самые или аналогичные принципы определяют получение терапевтических агентов для лечения других амилоидогенных заболеваний. Вообще агенты, отмеченные выше, как применяющиеся для лечения болезни Альцгеймера, могут также применяться для лечения раннего случая болезни Альцгеймера, связанного с (обусловленного) синдромом Дауна. При бешенстве коров прион-пептид, активные фрагменты, аналоги и антитела к прион-пептиду используют вместо Аb-пептида, активных фрагментов,аналогов и антител к Ab-пептиду, используемых при лечении болезни Альцгеймера. При лечении множественной миеломы используют лгкую цепь IgG и аналоги и антитела к нему, и так далее при других заболеваниях. 3. Белки-носители. Некоторые агенты для индуцирования иммунного ответа содержат подходящий эпитоп для стимулирования иммунного ответа против амилоидных отложений, но они слишком малы, чтобы быть иммуногенными. В этой ситуации пептидный иммуноген может быть связан с соответствующим носителем для того, чтобы выявить иммунный ответ. Соответствующие (пригодные) носители включают сывороточные альбумины, гемоцианин лимфы улитки, молекулы иммуноглобулина, тироглобулин, овальбумин,столбнячный токсин или анатоксины других патогенных бактерий, например, таких как дифтерия, E.coli, холера или H. pylori, или ослабленное производное токсина. Другие носители для стимулирования или усиления иммунного ответа включают цитокины, например, такие как IL-1, IL-1 а- и b-пептиды, IL2, gINF, IL-10, GM-CSF M1P1a и b и RANTES. Иммуногенные агенты могут также быть связаны с пептидами, которые усиливают транспорт через ткани, как описано в O'Mahony, WO 97/17613 и WO 97/17614. Иммуногенные агенты могут связываться с носителями за счт перекрстного сшивания. Методики связывания иммуногена с носителем включают образование дисульфидных связей с применением Nсукцинимидил-3-(2-пиридил-тио)пропионата (SPDP) и сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC) (если в пептиде отсутствует сульфгидрильная группа, е можно ввести добавлением цистеинового остатка). Эти реагенты образуют дисульфидную связь между собой и пептидными цистеиновыми остатками на одном белке и амидную связь за счт e-аминогруппы в лизине или другой свободной аминогруппы в других аминокислотах. Множество таких дисульфид/амидообразующих агентов описано в Immun. Rev. 62, 185 (1982). Другие бифункциональные связы-8 007218 вающие агенты образуют скорее тиоэфирную, нежели дисульфидную связь. Многие из этих тиоэфиробразующих агентов выпускаются промышленностью и включают реакционноспособные эфиры 6 малеинимидокапроновой кислоты, 2-бромуксусной кислоты и 2-иодуксусной кислоты, 4-(N-малеинимидометил)циклогексан-1-карбоновой кислоты. Карбоксильные группы можно активировать за счт их соединения с сукцинимидом или натриевой солью 1-гидроксил-2-нитро-4-сульфоновой кислоты. Иммуногенные пептиды могут также экспрессировать в виде слитых белков с носителями. Иммуногенный пептид может связываться с носителем по аминному концу, по карбоксильному концу или внутренней частью молекулы. При необходимости, в слитом белке могут присутствовать множественные повторы иммуногенного пептида. 4. Нуклеиновая кислота, кодирующая иммуногены. Иммунный ответ на амилоидные отложения может индуцироваться также введением нуклеиновой кислоты, кодирующей Аb-пептид или другие пептидные иммуногены. Такие нуклеиновые кислоты могут представлять собой ДНК или РНК. Сегмент нуклеиновой кислоты, кодирующий иммуноген, обычно связывается с регуляторными элементами, такими как промотор и энхансер, которые дают возможность экспрессировать ДНК-сегмент в заданных клетках-мишенях больного. Для экспрессии в клетках крови,что желательно для стимуляции иммунного ответа, промоторные и энхансерные элементы лгкой или тяжлой цепи генов иммуноглобулина или ранний промотор и энхансер главного посредника CMV пригодны для прямой экспрессии. Связанные регуляторные элементы и кодирующие последовательности часто клонируют в вектор. Пригоден ряд вирусных векторных систем, включая ретровирусные системы (см., например, Lawrieal., J. Virol. 67, 5911 (1993; аденоассоциированные вирусные векторы (см., например, Zhou et al., J. Exp.Med. 179, 1867 (1994, вирусные векторы семейства оспы (рох), включая вирус коровьей оспы и вирусы оспы птиц, вирусные векторы из рода альфа вирусов, такие, например, как образованные из Синдбисвируса и вируса лесов Семлики (см., например, Dubensky et al., J. Virol. 70, 508-519 (1996, и вирусы папилломы (Ohe et al., Human Gene Therapy 6, 325-333 (1995); Woo et al., WO 94/12629 и Xiao and Brandsma,Nucleic Acids. Res. 24, 2630-2622 (1996. ДНК, кодирующая иммуноген, или вектор, содержащий таковую, могут быть упакованы в липосомы. Пригодные липиды и родственные аналоги описаны в патентах США 5208036, 5264618, 5279833 и 5283185. Векторы и ДНК, кодирующие иммуноген, также могут абсорбироваться носителями в форме(макро)частиц или связываться с ними, примеры макрочастиц включают полиметилметакрилат и полилактиды и поли(лактид-со-гликолиды), см., например, McGee et al., J. Micro Encap. (1996). Векторы или "оголнная" ДНК для генной терапии могут доставляться in vivo при введении больному, обычно при системном введении (например, путем внутривенного, внутрибрюшинного, назального, желудочного или внутричерепного вливания), или при местном применении (см., например, патент США 5339346). ДНК также можно вводить, применяя генное ружь. Xiao and Brandsma, см. выше. ДНК,кодирующую иммуноген, осаждают на поверхности из микроскопических металлических гранул (бусин). Микроснаряды ускоряются за счт ударной волны или расширения гелия и проникают в ткани на глубину нескольких слоев клеток. Например, пригоден AccelФ Gene Delivery Device, производимый Agacetus,Inc. Middleton WI. Или же "оголнная" ДНК может поступать через кожу в кровоток просто при наложении ДНК (накладка) на кожу с химическим или механическим раздражением (см. WO 95/05853). В дополнительном варианте изобретения, векторы, кодирующие иммуноген, могут доставляться к клеткам ex vivo, к таким клеткам, как клетки эксплантата отдельного больного (например, лимфоциты,костный мозг, биопсия тканей) или универсальные донорские гемопоэтические стволовые клетки, с последующей реплантацией клеток больному, обычно после отбора по клеткам, которые ассимилировали вектор.III. Больные, подлежащие лечению. В число больных, подлежащих лечению, входят люди с повышенным риском заболевания, но не проявляющие симптомов, а также больные с симптомами заболевания. В случае болезни Альцгеймера фактически любой человек рискует заболеть болезнью Альцгеймера, если он или она живт достаточно долго. Следовательно, данные методы можно назначать профилактически целой популяции без какойлибо оценки риска у подвергаемого (лечению) больного. Данные методы особенно пригодны для тех людей, которые имеют известный генетический риск заболевания болезнью Альцгеймера. К таким людям относятся люди, имеющие родственников с этим заболеванием, и те, риск которых обнаружен анализом генетических или биохимических маркров. Генетические маркры риска в отношении болезни Альцгеймера включают мутации в гене APP, особенно мутации в положении 717 и положениях 670 и 671, называемые мутации Харди и Шведская соответственно (Hardy, TINS, см. выше). Другими маркрами риска являются мутации в генах пресенилина PS1 и PS2, и АроЕ 4, семейный анамнез относительноAD, холестеринемии или атеросклероза. Людей, в данное время страдающих болезнью Альцгеймера,можно узнать по характерному слабоумию, а также по наличию описанных выше факторов риска. Кроме того, для определения людей с AD применим ряд диагностических тестов. Они включают определение уровней CSF тау и Аb42. Повышенный уровень тау и пониженный уровень Ab42 означают наличие AD.-9 007218 Людей, страдающих болезнью Альцгеймера, также можно диагностировать с помощью критериевMMSE или ADRDA, как описано в примерах. Лечение больных с бессимптомным течением болезни можно начинать в любом возрасте (например, в 10, 20, 30 лет). Обычно, однако, нет необходимости начинать лечение до достижения больным возраста 40, 50, 60 или 70 лет. Лечение обычно требует многократных доз в течение времени. Лечение можно постоянно контролировать, анализируя антительные (иммунные) ответы, реакции активированных Т-клеток и В-клеток на терапевтический агент (например, Аb-пептид) во времени. Если реакция ослабляется, назначается (показана) бустерная доза. В случае больных с потенциальным синдромом Дауна,лечение можно начинать антенатально, вводя терапевтический агент матери, или вскоре после рождения.IV. Схемы лечения. При применении для профилактики фармацевтические композиции или лекарственные препараты вводят больному, чувствительному или, иначе, с повышенным риском, к конкретному заболеванию в количестве, достаточном для исчезновения или снижения степени риска или для отсрочки начала заболевания. При терапевтическом применении композиции или лекарственные препараты вводят больному с подозрением на наличие этой болезни либо уже страдающему этой болезнью в количестве, достаточном для лечения, или, по меньшей мере, частичного подавления симптомов заболевания и его осложнений. Количество, достаточное для выполнения этого, определяется как терапевтически или фармацевтически эффективная доза. Как при профилактической, так и при терапевтической схемах лечения агенты обычно вводят в виде нескольких дозировок до тех пор, пока не будет достигнут достаточный иммунный ответ. Обычно иммунный ответ контролируют и, если иммунный ответ начинает постепенно затихать, дают повторные дозы. Эффективные дозы композиций по данному изобретению для лечения вышеописанных состояний варьируются в зависимости от множества различных факторов, включая способы введения, нужное место (введения), физиологическое состояние больного, является ли больной человеком или животным,другие вводимые препараты, и является ли лечение профилактическим или терапевтическим. Обычно больным является человек, но при некоторых заболеваниях, например, таких, как коровье бешенство,больным может быть другое млекопитающее, такое как корова. Лечебные дозы нужно титровать, чтобы достичь оптимальной безопасности и эффективности. Количество иммуногена зависит от того, вводится ли также адъювант, причем в отсутствие адъюванта требуются более высокие дозы. Количество иммуногена для введения иногда варьируется от 1 до 500 мкг одному больному и более обычно от 5 до 500 мкг на инъекцию при введении человеку. Иногда применяют более высокую дозу, 1-2 мг на одну инъекцию. Как правило, на каждую инъекцию человеку применяют 10, 20, 50 или 100 мкг. Частота инъекций может варьироваться значительно от одного раза в день до одного раза в год и одного раза в десять лет. В любой день прима дозы, доза составляет более 1 мкг/больной и обычно более 10 мкг/больной, если также вводится адъювант, и более 10 мкг/больной, а обычно более 100 мкг/больной в отсутствие адъюванта. Типичная схема представляет собой иммунизацию с послующими бустер-инъекциями с 6-недельными интервалами. Другая схема представляет собой иммунизацию с последующими бустер-инъекциями через 1, 2 и 12 месяцев. По другой схеме требуется инъекция каждые два месяца в течение жизни. Или же бустер-инъекции можно делать нерегулярно, по показаниям мониторинга иммунного ответа. Для пассивной иммунизации с помощью антитела вводят дозы в интервале от 0,0001 до 1 мг/кг и более обычно 0,01-5 мг/кг веса тела хозяина. Дозы нуклеиновых кислот, кодирующих иммуногены, составляют интервалы примерно 10 нг - 1 г, 100 нг - 100 мг, 1 мкг - 10 мг или 30-300 мкг ДНК на одного больного. Дозы инфекционных вирусных векторов варьируются от 10 до 109 или более вирионов на дозу. Агенты для индуцирования иммунного ответа можно вводить парентерально, местно, внутривенно,перорально, подкожно, внутрибрюшинно, назально, внутримышечно для профилактического и терапевтического лечения. Наиболее типичным способом введения является подкожный, хотя другие способы могут быть столь же эффективны. Следующим наиболее общим способом является внутримышечная инъекция. Такую инъекцию наиболее часто делают в мышцы рук или ног. Внутривенные инъекции, так же как внутрибрюшинные, внутриартериальные, внутричерепные или внутрикожные инъекции также эффективно вызывают иммунный ответ. В некоторых методах агенты вводят с помощью инъекции непосредственно в конкретную ткань, где аккумулируются отложения. Агенты по изобретению можно, при необходимости, вводить в сочетании с другими агентами, которые, по меньшей мере, частично эффективны при лечении амилоидогенного заболевания. В случае синдромов Альцгеймера и Дауна, при которых амилоидные отложения происходят в мозге, агенты по изобретению можно также вводить с другими агентами, которые улучшают прохождение агентов по изобретению через гематоэнцефалический барьер. Иммуногенные агенты по изобретению, например, такие как пептиды, иногда вводят в сочетании с адъювантом. Множество адъювантов может применяться в сочетании с пептидом, например, Ab для выявления иммунного ответа. Предпочтительные адъюванты усиливают истинный ответ на иммуноген, не вызывая коформационных изменений в иммуногене, которые влияют на качественную форму ответа. Предпочтительные адъюванты включают квасцы, 3-Де-О-ацетилированный монофосфорильный липид A(MPL,MФJI) (см. английский патент 2220211). QS21 представляет собой тритерпеновый гликозид, или- 10007218 сапонини, выделенный из коры дерева Quillaja Saponaria Molina, растущего в Южной Америке (см.Kensil et al., в Vaccine Design: The Subunit and Ajuvant Approach (eds. Powell and Newman, Plenum Press,NY, 1995); патент США 5057540). Другие адъюванты являются эмульсиями масла (такого как сквален или арахисового масла) в воде, при необходимости в сочетании с иммуностимуляторами, такими как монофосфорильный липид А (см. Stoute et al., N. Engl. J. Med. 336, 86-91 (1997. Другим адъювантом является CpG (Bioworld Today, Nov. 15, 1998). Или же Ab может быть связан с адъювантом. Например,липопептидный вариант Ab можно получить, связывая пальмитиновую кислоту или другие липиды непосредственно с N-концом Ab, как описано для антигенной вакцины при гепатите В (Livingston, J.Immunol. 159, 1383-1392 (1997. Однако такое связывание практически не должно менять конформациюAb так, чтобы влиять на природу иммунного ответа на него. Адъюванты могут вводиться в качестве компонента терапевтической композиции с активным агентом или могут вводиться самостоятельно (отдельно) перед введением терапевтического агента, одновременно с ним или после. Предпочтительным классом адъювантов являются соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия. Такие адъюванты могут применяться с или без других специфических иммуностимулирующих агентов, таких как MPL (МФЛ) или 3-ДМЗ, QS21, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин. Другими классами адъювантов являются рецептуры эмульсий масло-в-воде. Такие адъюванты могут применяться с или без других специфических иммуностимулирующих агентов, таких, например, как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-snглицеро-3-гидроксифосфорилокси)этиламин (MTP-PE), N-ацетилглюксаминил-N-aцeтилмypaмил-L-AlD-isoglu-L-Ala-дипaльмитoкcи пропиламид (DTP-DPP) терамидФ), или другие компоненты оболочек бактериальных клеток. Водомасляные эмульсии включают (a) MF59 (международная заявка WO 90/14837,содержащую 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (при необходимости, содержащую различные количества MTP-PE), приготовленную в виде мельчайших частиц с применением микрофлюидизатора,например, такого как микрофлюидизатор модели HOY (Microfluidics, Newton MA), (b) SAF, содержащую 10% сквалана, 0,4% Tween 80, 5% Pluronic блок-полимера L121, и thr-MDP, либо микрофлюидизированную в тончайшую эмульсию, либо встряхиваемую с целью получить более крупнодисперсную эмульсию,(с) RibiФ - адъювантную систему (RAS), (Ribi Immunochem, Hamilton, MT), содержащую 2% сквалена,0,2% Tween 80 и один или более компонентов оболочек бактериальных клеток из группы, состоящей из монофосфориллипида A (MPL, МФЛ), димиколята трегалозы (TDM) и скелета клеточных оболочек(CWS), предпочтительно MPL (МФЛ) + CWS (DetoxФ). Другим классом предпочтительных адъювантов являются сапониновые адъюванты, например, такие как StimulonФ (QS21, Aquila, Worcester, MA) или порошки, получаемые из него, такие как ISCOM (иммуностимулирующие комплексы) и ISCOMATRIX. Другие адъюванты включают полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда. Другие адъюванты включают цитокины, такие как интерлейкины (IL-I, IL-2 и IL-12), макрофагальный колониестимулирующий фактор (M-CFS), фактор некроза опухолевых клеток (TNF). Адъювант можно вводить вместе с иммуногеном в виде единой композиции или можно вводить перед, одновременно или после введения иммуногена. Иммуноген и адъювант могут упаковываться и поставляться в одной и той же ампуле или в отдельных ампулах и смешиваться перед употреблением. Иммуноген и адъювант обычно упаковывают с этикеткой (вкладышем), где указывается предполагаемое терапевтическое применение. Если иммуноген и адъювант упакованы по отдельности, упаковка обычно содержит инструкции по смешению перед употреблением. Выбор адъюванта и/или носителя зависит от устойчивости вакцины, содержащей адъювант, способа введения, схемы применения, эффективности адъюванта в отношении вида организма, подлежащего вакцинации, и, если это человек, фармацевтически приемлемым адъювантом является такой, который был одобрен или заслуживает одобрения для введения человеку соответствующими органами власти. Например, полный адъювант Фрейнда не пригоден для введения человеку. Квасцы, MPL (МФЛ) и QS21 являются предпочтительными. При необходимости могут одновременно применяться два или более различных адъювантов. Предпочтительные комбинации включают квасцы с MPL, квасцы с QS21, MPL с QS21 и квасцы, QS21 и MPL вместе. Также можно применять неполный адъювант Фрейнда (Chang et al., Advanced Drug Delivery Reviews 32, 173-186 (1998,при необходимости, в сочетании с любым из квасцов, QS21 и MPL и всеми их сочетаниями. Агенты по изобретению часто вводят в виде фармацевтических композиций, содержащих активный терапевтический и ряд других фармацевтически приемлемых компонентов. См. Remington'sPharmaceutical Science (15th ed., Mack Publishing Company, Easton, Pennsylvania, 1980). Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Композиции могут также включать, в зависимости от нужной рецептуры, фармацевтически приемлемые нетоксические носители или разбавители, которые называются наполнители, обычно применяемые при приготовлении фармацевтических композиций для введения человеку или животным. Разбавитель (растворитель) выбирают так, чтобы не повлиять на биологическую активность комбинации. Примерами таких растворителей являются дистиллированная вода, забуференный фосфатом физиологический раствор, растворы Рингера, раствор декстрозы и раствор Хэнка (Hank). Кроме того, фармацевтическая композиция или препа- 11007218 рат (состав) может также содержать другие носители, адъюванты или нетоксические, нетерапевтические,неиммуногенные стабилизаторы и тому подобное. Однако некоторые реагенты, пригодные для введения животным, такие, например, как полный адъювант Фрейнда, обычно не включается в композиции, применяемые для людей. Фармацевтические композиции также могут содержать большие, медленно преобразующиеся в ходе обмена веществ макромолеклы, например, такие как белки, полисахариды, полимолочные кислоты,полигликолевые кислоты и сополимеры (такие как латексная функционализированная сефароза, агароза,целлюлоза и тому подобное), полимерные аминокислоты, сополимеры аминокислот и агрегации липидов(такие как масляные капли или липосомы). Кроме того, эти носители могут действовать как иммуностимуляторы (т.е. адъюванты). Для парентерального введения агенты по изобретению могут вводиться в виде вводимых в качестве инъекций доз раствора или суспензии вещества в физиологически приемлемом растворителе с фармацевтическим носителем, который может быть стерильной жидкостью, такой как водные масла, физиологический раствор, глицерин или этанол. Кроме того, в композициях могут присутствовать вспомогательные вещества, такие как увлажнители или эмульгаторы, поверхностно-активные вещества (сурфактанты), рНбуферирующие вещества и т.п. Другими компонентами фармацевтических композиций являются продукты переработки нефти, продукты животного, растительного происхождения или синтетические продукты, например, арахисовое масло, соевое масло или минеральное масло. Вообще говоря, гликоли, такие, например, как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, особенно для вводимых в качестве инъекций растворов. Как правило, композиции готовят в виде инъецируемых, либо в качестве жидких растворов, либо суспензий; также можно готовить тврдые формы, пригодные для растворения или суспендирования в жидких носителях перед инъекцией. Препарат также можно эмульгировать или поместить в липосом или микрочастицы, такие как полиактид, полигликолид или сополимер, с целью усиления действия адъюванта, как обсуждалось выше (см. Langer, Science 249, 1527 (1990) и Hanes, Advanced Drug Delivery Reviews 28, 97-119 (1997. Агенты по этому изобретению можно вводить в форме "depot"-инъекции, обеспечивающей замедленное всасывание, или имплантировать препарат, который можно готовить таким образом, чтобы обеспечить пролонгированное или пульсирующее высвобождение активного ингредиента. Дополнительные рецептуры, пригодные для других способов введения, включают пероральные, интраназальные и лгочные рецептуры, суппозитории и трансдермальные аппликации. В случае суппозиториев связующие и носители содержат, например, полиалкиленгликоли или триглицериды; такие суппозитории можно получать из смесей, содержащих активный ингредиент в нитервале 0,5-10%, предпочтительно 1-2%. Пероральные рецептуры содержат эксципиенты, например, такие как маннит, лактоза, крахмал, стеарат магния, натрийсахарин, целлюлоза и карбонат магния, фармацевтической степени чистоты. Эти композиции бывают в виде растворов, суспензий, таблеток, пилюль,капсул, препаратов пролонгированного действия или порошков и содержат 10-95% активного ингредиента, предпочтительно 25-70%. Местные аппликации могут обеспечить трансдермальную или интрадермальную (внутрикожную) доставку. Местному введению может способствовать совместное введение агента с холерогеном или производным с пониженной токсичностью, или их субъединицами, или другими подобными бактериальными токсинами (см. Glenn et al., Nature 391, 851 (1998. Совместное введение можно осуществлять,применяя компоненты в виде смеси или в виде связанных молекул, полученных химическим перекрстным сшиванием, или экспрессией в виде слитого белка. Или же трансдермальную доставку можно осуществлять, используя путь через кожу ("skin path" "кожный путь") или с помощью трансферосом (Paul et al., Eur. J. Immunol. 25, 3521-24 (1995); Cevc et al.,Biochem. Biophys. Acta 1368, 201-15 (1998.V. Методы диагностики. Изобретение предлагает методы выявления иммунного ответа на Аb-пептид у больного, страдающего болезнью Альцгеймера, или восприимчивого к ней. Методы особенно применимы для мониторинга курса лечения, назначаемого больному. Методы можно применять для контроля как терапевтического лечения больных с симптомами заболевания, так и профилактического лечения больных с бессимптомным течением болезни. Некотрые методы требуют определения базового значения иммунного ответа у больного перед введением дозы агента и сравнения этого базового значения с величиной иммунного ответа после лечения. Значительное увеличение (т.е. более обычной ошибки опыта при повторных измерениях одного и того же образца, выраженной как одно стандартное отклонение от среднего из таких измерений) величины иммунного ответа говорит о положительном результате лечения (т.е., что введение агента достигло результата или стимулировало иммунный ответ). Если величина иммунного ответа не изменяется значительно или уменьшается, это указывает на отрицательный результат лечения. В целом, ожидается, что у больных, проходящих начальный курс лечения агентом, при последующих дозах усилится иммунный ответ, который в конечном счте стабилизируется. Введение агента обычно продолжают, пока иммунный ответ увеличивается. Достижение постоянного значения (стабилизация) является показателем того, что- 12007218 лечение можно прекратить или уменьшить дозу или частоту введения. В других методах контрольное значение (т.е. среднее и стандартное отклонение) иммунного ответа определяют для контрольной популяции. Обычно отдельные представители контрольной популяции не получали предварительного лечения. Величины иммунного ответа у больного, измеренные после введения терапевтического агента, сравнивают затем с контрольным значением. Значительное увеличение в сравнении с контрольным значением (например, большее, нежели одно стандартное отклонение от среднего) говорит о положительном результате лечения. Отсутствие заметного увеличения или снижение говорит об отрицательном результате лечения. Введение агента обычно продолжают, пока иммунный ответ увеличивается по сравнению с контрольным значением. Как и ранее, прекращение роста по сравнению с контрольным значением является показателем того, что лечение можно прекратить или уменьшить дозу или частоту. В других методах контрольное значение иммунного ответа (например, среднее и стандартное отклонение) определяют у контрольной популяции отдельных представителей, которых подвергали лечению терапевтическим агентом и у которых иммунный ответ при лечении был постоянным. Измеренные величины иммунного ответа у больного сравнивают с контрольным значением. Если уровень, измеренный у больного, незначительно отличается (например, более одного стандартного отклонения) от контрольного значения, лечение можно прекратить. Если уровень у больного значительно ниже контрольного значения, оправдано продолжение введения агента. Если уровень у больного удерживается ниже контрольного значения, показано изменение схемы лечения, например, применение другого адъюванта. В других методах больного, который в настоящее время не получает лечения, но проходил курс лечения ранее, проверяют иммунный ответ для того, чтобы определить, требуется ли возобновить лечение. Значение иммунного ответа, измеренное у больного, можно сравнить с величиной иммунного ответа,ранее достигавшегося у больного после предыдущего курса лечения. Значительное снижение по сравнению с предыдущим измерением (т.е. более обычной ошибки опыта в повторных измерениях того же образца) является показателем того, что лечение можно возобновить. Или же значение, измеренное у больного, можно сравнить с контрольным значением (среднее плюс стандартное отклонение), определнным для популяции больных после прохождения ими курса лечения. Или же измеренное у пациента значение можно сравнить с контрольным значением для популяции профилактически пролеченных больных, у которых продолжают отсутствовать симптомы заболевания, или для популяции терапевтически пролеченных больных, у которых наблюдается улучшение показателей болезни. Во всех этих случаях значительное уменьшение по сравнению с контрольным уровнем (т.е. более стандартного отклонения) является показателем того, что лечение больного следует возобновить. Образцом ткани для анализа, как правило, является кровь, плазма, сыворотка, слизь или цереброспинальная жидкость больного. Образцы анализируют на признаки иммунного ответа на любую форму Аb-пептида, как правило, Аb42. Иммунный ответ можно определять по наличию, например, антител илиT-клеток, которые специфически связываются с Аb-пептидом. ELISA-методы обнаружения антител, специфических к Ab, описаны в разделе "Примеры". Способы обнаружения реактивных Т-клеток описаны выше (см. Определения). Изобретение дополнительно предоставляет диагностические наборы для описанных выше методов диагностики. Как правило, такие наборы содержат агент, который специфически связывается с антителами к Ab или реагирует с T-клетками, специфическими относительно Ab. Набор также может содержать метку. Для обнаружения антител к Ab метка обычно находится в виде меченых антиидиотипических антител. Для обнаружения антител агент можно поставлять в предварительно связанном с тврдой фазой виде, как например, связанным с лунками микропланшета. Для обнаружения реактивных Т-клеток метка может вводиться в 3 Н-тимидин для измерения пролиферативного ответа. Наборы также обычно содержат описания по пользованию набором. Описания также могут содержать схему или другие соответствующие указания, величины коррелирующие значения измеренных уровней с уровнями антител к Ab или Tклеток, реактивных в отношении Ab. Термин "описания", "ярлыки", "этикетки" относятся к любому написанному или зафиксированному материалу, который относится к набору или иным образом сопровождает набор вс время в процессе производства, транспортировки, продажи или использования. Например,термин "описания" охватывает рекламные листовки и брошюры, упаковочные материалы, инструкции,аудио и видеокассеты, компьютерные диски, а также описания, напечатанные непосредственно на наборах. ПримерыI. Профилактическая эффективность Ab против AD. Эти примеры описывают введение пептида Ab42 трансгенным мышам, характеризующимся сверхпродукцией APP с мутацией в положении 717 (APP717VF), что делает их предрасположенными к проявлению Альцгеймероподобной нейропатологии. Получение и характеристики этих мышей (PDAPPмышей) описано в Games et al., Nature, см. выше. У этих животных, в их гетерозиготной форме, начинают появляться отложения Ab в шестимесячном возрасте. К пятнадцати месяцам уровни отложений Ab у них эквивалентны уровню отложений, наблюдаемому при болезни Альцгеймера. Мышам PDAPP вводили агрегации Ab42 (агрегированные Аb42) или забуференный фосфатом фи- 13007218 зиологический раствор. Агрегированный Ab42 выбран вследствие своей способности индуцировать антитела к множественным эпитопам Ab. А. Методы. 1. Источник мышей. Тридцать самок гетерогенных мышей PDAPP произвольно делят на следующие группы: 10 мышам вводят агрегации Аb42 (одна умерла при перемещении), 5 мышам вводят PBS/адъювант или PBS и 10 контрольных не получают ничего. Пяти мышам вводят сывороточный амилоидный белок (SAP). 2. Приготовление иммуногенов. Приготовление ассоциированного Аb42: 2 мг Аb42 (US Peptides Inc. lot K-42-12) растворяют в 0,9 мл воды и доводят до 1 мл, добавляяя 0,1 мл 10PBS. Вс стряхивают и перемешивают и термостатируют в течение ночи при 37 С в условиях агрегации пептида. Весь не использованный Ab хранят в виде сухого лиофилизированного порошка при -20 С до следующей инъекции. 3. Приготовление инъекций. 100 мг агрегированного Аb42 в PBS на одну мышь эмульгируют в соотношении 1:1 с полным адъювантом Фрейнда (CFA) с конечным объмом эмульсии 400 мкл для первой иммунизации, с последующей добавочной инъекцией такого же количества иммуногена в неполном адъюванте Фрейнда (IFA) через 2 недели. Две дополнительные дозы в IFA дают с месячными интервалами. Последующие иммунизации проводят с месячными интервалами в 500 мкл PBS. Инъекции делают внутрибрюшинно (i.p.). Инъекции PBS осуществляют по такому же графику и мышам вводят смесь 1:1 PBS/адъювант в количестве 400 мкл на мышь или 500 мкл PBS на мышь. Инъекции SAP делают по тому же расписанию,используя дозу 100 мкг на инъекцию. 4. Титрование образцов крови мышей, подготовка тканей и иммуногистохимия. Вышеназванные методы описаны в Общих материалах и методах. В. Результаты. Мышам PDAPP вводят либо агрегации Аb42 (ассоциированные Аb42), SAP-пептиды, либо забуференный фосфатом физиологический раствор. Группу мышей PDAPP оставляют без инъекций, в качестве позитивного контроля. Титры мышей на агрегации Аb42 контролируют каждый следующий месяц с четвртого бустера до тех пор, пока мышам исполнится год. Мышей умерщвляют в 13 месяцев. Во всех изученных временных точках восемь из девяти инъецированных агрегациями Аb42 мышей имеют высокий титр антивирусных антител, который остается высоким в серии инъекций (титры выше 1/10000). У девятой мыши низкий, но поддающийся измерению титр примерно 1/1000 (фиг. 1, табл. 1). Титр SAPPинъецированных мышей составляет титры от 1:1000 до 1:30000 для этого иммуногена, за единственным исключением: мышь с титром 1:100000. В случае мышей, инъецированных PBS, титрование проводят против агрегированного Аb42 через шесть, десять и двенадцать месяцев. При разбавлении 1/100 в группе "PBS-инъецированные мыши" при титровании против ассоциированного Аb42 титры превышают фон более чем в 4 раза только в одной точке, в других случаях они превышают фон менее чем в 4 раза во всех временных точках (табл.1). SAPспецифический ответ незначителен во всех временных точках, значения всех титров менее 300. У семи из девяти мышей в "ассоциированной Ab1-42" группе не обнаружен амилоид в мозге. Напротив, ткань мозга мышей в SAP- и PBS-группах содержит множественные 3D6-положительные амилоидные отложения в гиппокампе, а также в лобной и поясной коре. Характер отложения подобен отложениям у контрольных животных с типичным поражением восприимчивых подобластей, таких как внешний молекулярный слой зубчатой извилины гиппокампа. Одна мышь из Аb1-42-инъецированной группы имеет значительно уменьшенную амилоидную нагрузку, ограниченную гиппокампом. Изолированную(отдельную) бляшку идентифицируют у другой Ab1-42-обработанной мыши. Количественный анализ изображения амилоидного отложения (нагрузки) в гиппокампе подтверждает резкое уменьшение (его) у животных, получавших AN1792 (фиг. 2). Средние значения амилоидной нагрузки для "PBS-группы" (2,22%) и для необработанной контрольной группы (2,65%) значительно больше значений для группы, иммунизированной AN1792 (0,00%, р = 0,0005). Напротив, среднее значение для группы, иммунизированной SAP-пептидами (SAPP), составляет 5,74%. Ткань мозга необработанных контрольных мышей содержит множественные Аb-амилоидные отложения, визуализированные с помощью Аb-специфического моноклонального антитела (mAb) 3D6 в гиппокампе, а также в ретросплениальной коре. Такие же особенности амилоидного отложения наблюдаются у мышей, иммунизированных SAPP или PBS (фиг. 2). Кроме того, в этих последних трх группах наблюдается характерное поражение восприимчивых подобластей мозга, типичных для AD, например, таких как внешний молекулярный слой зубчатой извилины гиппокампа, во всех трх из этих групп. Мозг, не содержащий Аb-отложений, не имеет также нейритных бляшек, которые обычно визуализируются у PDAPP-мышей с помощью антитела 8 Е 5 к человеческому APP. Мозг всех животных оставшихся групп (SAP-инъецированных, PBS и неинъецированных мышей) содержит множественные нейритные бляшки, типичные для непролеченных мышей PDAPP. Малое число нейритных бляшек имелось у одной мыши, получавшей AN1792, и единственное скопление дистрофических нейритов обнаружено у второй мыши, пролеченной AN1792. Анализ изображения гиппокампа, как изображено на фиг. 3, пока- 14007218 зывает действительное исчезновение дистрофических нейритов у AN1792-пролеченных мышей (в среднем 0,00%) по сравнению с PBS-реципиентами (среднее 0,28%, р = 0,0005). Астроцитоз, характерный для ассоциированного с бляшками воспаления, также отсутствует в мозге Аb1-42-инъецированной группы. Мозг мышей в других группах содержит обильные и составляющие скопления GFAP-позитивные астроциты, типичные для ассоциированного с Аb-бляшками глиоза. Препараты субпопуляции, взаимодействующие с GFAP, контрастно окрашивают тиофлавином S, чтобы локализовать Аb-отложения. GFAP-позитивные астроциты дают ассоциаты с Аb-бляшками у SAP-, PBS- и непролеченных контрольных мышей. Такой ассоциации не обнаружено у бляшко-негативных Аb1-42 пролеченных мышей, хотя минимальный обусловленный бляшками глиоз найден у одной мыши, пролеченной AN1792. Анализ изображения, показанный на фиг. 4 для ретросплениальной коры, подтверждает, что уменьшение астроцитоза является значительным со средним значением 1,56 для мышей, пролеченныхAN1792, по сравнению со средними значениями более 6% для групп, иммунизированных SAPпептидами, PBS или непролеченных (р = 0,0017). Данные, полученные для субпопуляции Ab1-42- и PBS-инъецированных мышей, показывают, что обусловленная бляшками MHC II иммунореактивность отсутствует у Аb1-42-инъецированных мышей,что согласуется с отсутствием связанной с Ab воспалительной реакцией. Срезы мозга также реагировали с mАb, специфически связывающимся с MAC-1, белков поверхности клеток. MAC-1 (CD11b) является членом семейства интегринов и существует в качестве гетеродимера с CD18. Комплекс CD11/CD18 находится в (на поверхности) моноцитах, макрофагах, нейтрофилах и природных клетках-киллерах (Mac and Simard). Резидентным MAC-1-реактивным типом клеток мозга является, по-видимому, микроглия, на основании сходной (подобной) фенотипической морфологии вMAC-1 иммунореактивных срезах. Обусловленное бляшками МАС-1-мечение ниже в мозге мышей, пролеченных AN1792, по сравнению с PBS контрольной группой, это открытие согласуется с отсутствием Аb-индуцированной воспалительной реакции. С. Выводы. Отсутствие Аb-бляшек и реактивных нейронных и глиотических изменений мозга Аb1-42 инъецируемых мышей указывает, что в их мозгу либо совсем не откладывается, либо откладывается чрезвычайно мало амилоидных отложений, и патологические последствия, такие, например, как глиоз и невритическая (невритная) патология, отсутствуют. У PDAPP-мышей, пролеченных Ab1-42, наблюдается практически такое же отсутствие патологии, как у контрольных нетрансгенных мышей. Следовательно,Аb1-42-инъекции являются высокоэффективными для предотвращения отложения или для удаления человеческого Ab из тканей мозга и ликвидации последующих нейронных и воспалительных дегенеративных изменений. Т.е. введение Аb-пептида оказывает благоприятное терапевтическое действие при предотвращении AD.II. Изучение эффекта дозы. Группы самок мышей Swiss Webster в возрасте пяти недель (N = 6 в группе) иммунизируют с помощью 300, 100, 33, 11, 3,7, 1,2, 0,4 или 0,13 мкг Ab в виде рецептуры с CFA/IFA, вводимой внутрибрюшинно. Вводят три дозы с двухнедельными интервалами с последующей через один месяц четвртой дозой. Первую дозу эмульгируют в CFA, а остальные дозы эмульгируют с IFA. У животных берут кровь через 4-7 дней после каждой иммунизации, начиная со второй дозы, для определения титров антител. У животных субпопуляции из трх групп, иммунизированных с помощью 11, 33 или 300 мкг антигена, дополнительно отбирают пробу крови примерно с месячными интервалами в течение четырх месяцев после четвртой иммунизации для котроля за ослаблением иммунного ответа в интервале доз для вакцинации. Последнюю, пятую иммунизацию этих животных проводят через семь месяцев после начала исследования. Их умерщвляют через неделю после этого с целью измерения гуморального иммунного ответа на ANB1792 и для проведения токсикологических анализов. Убывающий эффект дозы наблюдают от 300 к 3,7 мкг или отсутствие эффекта в случае двух самых низких доз. Средние титры антител составляют примерно 1:1000 после 3 доз и примерно 1:10 000 после 4 доз по 11-300 мкг антигена (см. фиг. 5). Титры антител резко возрастают во всех случаях, за исключением группы с самыми низкими дозами, после третьей иммунизации с увеличением GMT в 5-25-кратном интервале. Низкий (слабый) гуморальный иммунный ответ затем наблюдают даже у 0,4 мкг - реципиентов. У групп, получавших 1,2 и 3,7 мкг, титры сравнимы с GMT примерно 1000, а самые высокие четыре дозы ассоциируются с GMT, примерно, 25000, за исключением группы, получавшей дозу 33 мкг, с более низким GMT 3000. При последующих четырех иммунизациях увеличение титра более умеренное для большинства групп. Наблюдается чткий эффект дозы в группах с более низкой дозой антигена от 0,14 мкг до 11 мкг в интервале от неразличимого антитела для 0,14 мкг-реципиентов до GMT 36000 для реципиентов 11 мкг. И снова титры для четырех групп с наиболее высокими дозами от 11 до 300 мкг соответствовали друг другу. Так, после двух иммунизаций титр антител зависит от дозы антигена в широком интервале от 0,4 до 300 мкг. При третьей иммунизации титры для всех четырех групп с наиболее высокими дозами сопоставимы и остаются постоянными после дополнительной иммунизации.- 15007218 Через месяц после четвертой иммунизации в группе с дозой 300 мкг титры в 2-3 раза выше, чем титры, измеренные в крови, взятой через пять дней после иммунизации (фиг. 6). Это наблюдение подтверждает, что максимальный анамнестический гуморальный иммунный ответ возникает позднее 5 дней после иммунизации. Более умеренное (50%) увеличение наблюдают в это время в группе, получавшей дозу 33 мкг. В группе, получавшей дозу 300 мкг, через два месяца после последней дозы значения GMT резко понижаются примерно на 70%. Ещ через месяц падение менее резкое, 45% (100 мкг) и около 14% для доз 33 и 11 мкг. Следовательно, скорость уменьшения титров циркулирующих антител после прекращения иммунизации, по-видимому, имеет две фазы с резким падением в первый месяц после максимального (пика) ответа с последующей более умеренной скоростью уменьшения впоследствии. Титры антител и кинетика иммунного ответа этих мышей Swiss Webster подобны титрам антител и кинетике иммунного ответа молодых гетерозиготных трансгенных PDAPP-мышей, иммунизированных аналогичным образом. Дозировки, эффективные для того, чтобы индуцировать иммунный ответ у человека, обычно сходны с дозировками, эффективными в случае мышей.III. Скрининг на терапевтическую активность в отношении установленной AD (болезни Альцгеймера). Этот анализ проводят для того, чтобы испытать иммуногенный агент на активность по угнетению или реверсии нейропатологических характеристик AD у животных. Иммунизацию с помощью Ab протяженостью 42 аминокислоты (AN1792) начинают в той временной точке, когда амилоидные бляшки уже присутствуют в мозгу PDAPP-мышей. По истечении периода лечения, применяемого в данном исследовании, у непролеченных PDAPPмышей наблюдается ряд нейродегенеративных изменений, которые напоминают изменения при ADAb в виде амилоидных бляшек ассоциируется с дегенеративной нейронной реакцией, представляющей собой аберрантные (неправильные) аксоны и дендриты, называемые дистрофическими нейритами. Амилоидные отложения, окружнные дистрофическими нейритами и содержащие их, называются нейритными бляшками. Как у AD-, так и у PDAPP-мыши, дистрофические нейриты имеют определнную глобулярную структуру, иммунореактивны в отношении антител, распознающих APP и цитоскелетные компоненты, и демонстрируют комплексные субклеточные дегенеративные изменения на ультраструктурном уровне. Эти особенности позволяют делать необходимые в случае заболевания селективные и воспроизводимые измерения образования нейритных бляшек в мозгу PDAPP-мыши. Дистрофическая нейронная компонента PDAPP нейритных бляшек легко визуализируется с помощью антитела, специфического к человеческому APP (mAb 8E5), и легко определима с помощью компьютерного анализа изображения. Следовательно, помимо измерения влияния AN1792 на образование амилоидных бляшек мы контролируем влияние этого лечения на развитие нейритной дистрофии. Астроциты и микроглия не-нейронными клетками, которые отвечают на нейронное повреждение и отражают степень нейронного повреждения. GFAP-позитивные астроциты и микроглия MHC II степени обычно наблюдаются при AD, и их активация повышается с тяжестью заболевания. Следовательно, мы также контролируем развитие реактивных астроцитов и микроглиоза у пролеченных АN1792 пролеченных мышей. А. Материалы и методы. Сорок восемь гетерогенных самок PDAPP-мышей, в возрасте 11-11,5 месяцев, полученных отChales River, произвольно делят на две группы: 24 мышей иммунизируют с помощью 100 мкг AN1792 и 24 мышей иммунизируют PBS, во всех случаях вместе с адъювантом Фрейнда. Группы AN1792 и PBS снова делят по достижении 15 мес. В возрасте 15 мес. примерно половину каждой группы AN1792- иPBS-пролеченных мышей умерщвляют (эвтаназия) (n=10 и 9 соответственно), иммунизацию остальных продолжают до окончания в возрасте 18 мес. (n=9 и 12 соответственно). В целом 8 мышей (5 AN1792, 3PBS) (сами) умерли во время исследования. Помимо иммунизированных животных для сравнения были включены непролеченные PDAPP-мыши - в возрасте одного года (n=10), 15 месяцев (n=10) и 18 месяцев(n=10) - в ELISA для измерения Ab и АРР-уровней в мозге; животные в возрасте одного года также участвуют в иммуногистохимических анализах. Методология такая же, как в примере 1, если не указано иначе. Для приготовления антигена для шести иммунизаций до достижения мышами 15-месячного вораста применяют AN1792 - US Peptide лот 12 и California Peptides лот МЕ 0339. California Peptides лоты МЕ 0339 и МЕ 0439 применяют для трх дополнительных иммунизаций от 15 до 18 мес. Для иммунизации 100 мкг AN1792 в 200 мкл PBS или один PBS эмульгируют в соотношении 1:1(по объму) с полным адъювантом Фрейнда (CFA) или неполным адъювантом Фрейнда (IFA) или PBS в конечном объме 400 мкл. Первую иммунизацию проводят с CFA в качестве адъюванта, следующие четыре дозы делают с IFA и конечные четыре дозы с одним PBS без добавления адъюванта. Всего проводят девять иммунизаций за семь месяцев с двухнедельным интервалом для первых трх доз, с последующим четырхнедельным интервалом для остальных инъекций. Группа мышей, пролеченная в течение четырх месяцев, умерщвленная в возрасте 15 мес., получает только первые 6 иммунизаций. В. Результаты.- 16007218 1. Действие АN1792-терапии на амилоидную нагрузку. Результаты АN1792-терапии на кортикальную амилоидную нагрузку, определнные количественным анализом изображения, показаны на фиг. 7. Среднее значение кортикальной амилоидной нагрузки 0,28% в группе непролеченных PDAPP-мышей 12-месячного возраста, типичная величина нагрузки бляшек у мышей в начале исследования. В возрасте 18 мес. амилоидная нагрузка увеличивается более чем в 17 раз до 4,87% у PBS-пролеченных мышей, тогда как у АN1792-пролеченных мышей амилоидная нагрузка значительно снижена и составляет лишь 0,01%, заметно меньше, чем у 12-месячных непролеченных и в обоих 15- и 18-месячных PBS-обработанных группах. Амилоидная нагрузка значительно снижена у АN1792-реципиентов как в случае 15 (96%-ное снижение; р = 0,003), так и 18 (99% снижение; р = 0,0002) месяцев. Обычно кортикальное амилоидное отложение у PDAPP-мышей начинается во фронтальной и ретросплениальной области коркового вещества (RSC) и прогрессирует в направлении вентральнолатеральной области (ЕС). Мало амилоида или совсем его не обнаружено в ЕС 12-месячных мышей,примерный возраст, при котором начинают вводить AN1792. Через 4 месяца лечения AN1792 амилоидное отложение значительно уменьшается в RSC-области, и прогрессивное воспаление ЕС совершенно исчезает при AN1792-терапии. Последнее наблюдение показывает, что AN1792 полностью останавливает прогрессирование амилоида, который при естественном течении занял бы височную и брюшную (темпоральную и вентральную) области коркового вещества, а также прекращает или, возможно, ревертирует отложение в RSC. Глубокое воздействие АМ 1792-терапии на развитие кортикальной амилоидной нагрузки у PDAPPмышей дополнительно демонстрируется на примере 18-месячной группы, которую лечили семь месяцев. У AN1792-пролеченных мышей обнаружено почти полное отсутствие кортикального амилоида при полном исчезновении диффузных бляшек, а также уменьшение плотных отложений. 2. Цитологические и морфологические измерения, обусловленные AN1792-терапией. Популяция Аb-позитивных клеток обнаружена в тех областях мозга, в которых как правило наблюдаются амилоидные отложения. Удивительно то, что в мозге нескольких AN1792-реципиентов обнаружено очень мало или совсем не обнаружено экстрацеллюлярных кортикальных амилоидных бляшек. Повидимому, большая часть Аb-иммунореактивности сосредоточена в клетках с большой дольчатой или агглютинированной сомой. Фенотипически эти клетки похожи на активированные микроглию или моноциты. Они являются иммунореактивными в отношении антител, распознающих лиганды, экспрессируемые активированными моноцитами или микроглией (MHC II и CD116), и в редких случаях (случайно) ассоциируются со стенкой или полостью кровеносных сосудов. Сравнение почти примыкающих (почти сопредельных) срезов, меченых Ab, и MHC II-специфических антител показывает, что сходные особенности этих клеток распознаются обоими классами антител. Детальное изучение AN1792-пролеченного мозга показывает, что MHC II-позитивные клетки ограничены близостью органических остатков амилоида у этих животных. В применяемых условиях фиксации клетки не являются иммунореактивными в отношении антител, которые распознают T-клеточные (CD3, CD3e) или В-клеточные (CD45RA,CD45RB) лиганды или общий лейкоцитарный антиген (CD45), но являются реактивными в отношении антитела, распознающего лейкозиалин (CD43), который перекрстно реагирует с моноцитами. Такие клетки не обнаружены ни у одной из PBS-пролеченных мышей. У PDAPP-мышей обнаруживается плотное амилоидное отложение во внешнем молекулярном слое зубчатой извилины гиппокампа. Отложение образует четкую полосу внутриперфорантного пути, подобласти, в которой традиционно находятся амилоидные плашки при AD. Характерное появление этих отложений у PBS-пролеченных мышей напоминает таковое, ранее характеризовавшее непролеченныхPDAPP-мышей. Амилоидное отложение состоит как из диффузных, так и из плотных (компактных) бляшек в виде непрерывной полосы (кромки). Напротив, эта структура в мозгу ряда AN-пролеченных мышей резко изменяется. Амилоидное отложение в гиппокампе более не содержит диффузного амилоида, а слитая (в виде полосы) структура полностью разрушается. Вместо этого имеется ряд необычных точечных структур, реактивных в отношении анти-Аb антител, некоторые из которых, по-видимому, являются амилоидсодержащими клетками.MHC II-позитивные клетки часто наблюдаются вблизи от экстрацеллюлярного амилоида у AN1792 пролеченных животных. Характер ассоциации Аb-позитивных клеток с амилоидом в мозгу нескольких АN1792-пролеченных мышей очень похож. Распространение этих моноцитарных клеток ограничивается близостью амилоидного отложения и совершенно в других областях мозга, не содержащих Аb-бляшек. Количественный анализ изображения MHC II и MAC 1-меченых срезов показывает тенденцию к повышенной иммунореактивности в RSC и гиппокампе AN1792-пролеченных мышей по сравнению сPBS-группой, которая становится значимой при измерении MAC 1-реактивности в гиппокампе. Эти результаты указывают на активное, опосредуемое клетками удаление амилоида в содержащих бляшки участках мозга. 3. Влияние AN1792 на уровень Ab: определение с помощью ELISA.(а). Содержание (уровни) в коре. У непролеченных PDAPP-мышей средний уровень тотального Ab в коре в возрасте 12 месяцев со- 17007218 ставляет 1600 нг/г, который повышается до 8700 нг/г к 15 месяцам (табл. 2). В возрасте 12 месяцев эта величина составляет 22000 нг/г, увеличение более чем в 10 раз за время эксперимента. У PBSпролеченных животных тотальный Ab составляет 8600 нг/г в 15 месяцев и увеличивается до 19000 нг/г в 18 месяцев. Напротив, AN1792-пролеченные животные содержат на 81% меньше тотального Ab в 15 месяцев (1600 нг/г), чем PBS-иммунизированная группа. Значительно меньшее (р = 0,0001) тотального Ab(5200 нг/г) обнаружено в 18 месяцев, когда сравнивают AN1792-и PBS-группы (табл. 2), эта величина соответствует 72% уменьшению Ab по сравнению с возможным уровнем (который был бы без этой терапии). Сходные результаты получены при сравнении кортикальных уровней Аb42, а именно, что АN1792 пролеченная группа содержит значительно меньше Аb42, но в этом случае разница между AN1792- и(b). Содержание (уровни) в гиплокампе. У непролеченных PDAPP-мышей средний уровень тотального Ab в гиппокампе в двенадцать месяцев составляют 15000 нг/г, в 15 месяцев увеличиваются до 51000 нг/г и затем до 81000 нг/г в 18 месяцев(табл. 3). Аналогично, у PBS-иммунизированных мышей эти величины составляют 40000 нг/г и 65000 нг/г в 15 месяцев и в 18 месяцев соответственно. У AN1792-иммунизированных мышей наблюдаются меньшие уровни тотального Ab, а именно, 25000 нг/г и 51000 нг/г, соответственно, в 15 месяцев и в 18 месяцев. В группе 18-месячных AN1792-пролеченных мышей значение значительно ниже значения в(с). Содержание (уровни) в мозжечке. У 12-месячных непролеченных PDAPP-мышей средний уровень тотального Ab в мозжечке составляет 15 нг/г (табл. 4). В 15 месяцев этот средний уровень повышается до 28 нг/г и к 18 месяцам увеличивается до 35 нг/г. У PBS-пролеченных мышей средние значения уровней тотального Ab составляют 21 нг/г в 15 месяцев и 43 нг/г в 18 месяцев. Обнаружено, что у AN1792-пролеченных животных содержание тотального Ab в 15 месяцев составляет 25 нг/г и значительно меньше (р = 0,002) содержание тотального 4. Эффект AN1792-тepaпии на уровни APP. Обе молекулы - АРР- и непроцессированного APP - содержат всю или часть последовательности и, следовательно, потенциально, на них может влиять возникновение АN1792-направленного иммунного ответа. В современных исследованиях было отмечено слабое повышение уровней APP по мере увеличения невропатологии у PDAPP-мышей. В коре уровни либо APP-/FL (непроцессированный), либо АРРпрактически не изменяются при лечении, за исключением того, что уровень АРР- снижен на 19% в 18 месяцев у AN1792-пролеченных по сравнению с PBS-пролеченной группой. Значения APP у 18 месячных AN1792-пролеченных мышей незначительно отличаются от значений в группах 12-месячных непролеченных и 15-месячных PBS. Во всех случаях значения APP остаются в интервалах значений,обычно обнаруживаемых у PDAPP-мышей. 5. Эффект АМ 1792-терапии на нейродегенеративную и глиотическую патологию. Нейритные бляшки значительно уменьшаются во фронтальной области коры головного мозга уAN1792-пролеченных мышей по сравнению с PBS-группой как в 15- (84%; р = 0,03), так и в 18-месячном(55%; р = 0,01) возрасте (фиг. 8). Средняя величина нагрузки - нейритных бляшек - увеличивается от 0,32 до 0,49% в PBS-группе между 15 и 18 месяцами. Это противоположно значительному замедлению роста нейритных бляшек в AN1792-группе со средним значением нагрузки - нейритных бляшек - равным 0,05 и 0,22% в 15- и 18-месячных группах соответственно. По-видимому, иммунизация AN1792 хорошо переносится, и реактивный астроцитоз также значительно уменьшается в RSC AN1792-пролеченных мышей по сравнению с PBS-группой как в возрасте 15(56%; р = 0,011), так и в возрасте 18 (39%; р = 0,028) месяцев (фиг. 9). Средние значения (в процентах) астроцитоза в RSC-группе увеличивается между 15 и 18 месяцами от 4,26 до 5,21%. AN1792-терапия подавляет развитие астроцитоза в обеих временных точках до 1,89 и 3,2% соответсвенно. Это подтверждает, что нейрофил не нарушается в процессе клиренса. 7. Гуморальный (антительный) иммунный ответ. Как описано выше, одиннадцатимесячные гетерозиготные PDAPP-мыши (N = 24) получают серию из 5 иммунизаций по 100 мкг AN1792, эмульгированного с адъювантом Фрейнда, и вводимого внутрибрюшинно в 0, 2, 4, 8 и 12 недели, и шестой иммунизации одним PBS (без адъюванта Фрейнда) на 16 неделе. В качестве негативного контроля аналогичная группа из 24 трансгенных мышей того же возраста подвергают иммунизации PBS, эмульгированным с теми же адъювантами и даваемым по той же схеме. У животных берут кровь на анализ через три-семь дней после каждой иммунизации, начиная со второй дозы. Гуморальный иммунный ответ на AN1792 определяют методом ELISA. Геометрические средние титры (GMT) для животных, иммунизированных AN1792, равны, примерно, 1900, 7600 и 45000 после второй, третьей и последней (шестой) доз соответственно. Никакого Аb-специфического антигена не найдено у контрольных животных после шестой иммунизации. Примерно половину животных пролечивают ещ в течение трх месяцев, иммунизируя их, примерно, на 20, 24 и 27 неделе. Каждую из этих доз дают в одном носителе PBS без адъюванта Фрейнда. Средние титры антител остаются постоянными в течение этого времени. В действительности титры антител,по-видимому, постоянны с четвртого до восьмой пробы крови, соответствующих периоду, охватывающему с пятой до девятой инъекции. Чтобы определить, ассоциируются ли Аb-специфические антитела, выявляемые иммунизацией, обнаруженные в сыворотке AN1792-пролеченных мышей, также с амилоидными отложениями в мозге,проверяют реакцию серии срезов AN1792-и PBS-пролеченных мышей с антителом, специфическим относительно мышиного IgG. В противоположность PBS-группе, Аb-бляшки мозга животных, пролеченных AN1792, покрыты эндогенным IgG. Это различие двух групп наблюдается как в 15-, так и в 18 месячных группах. Особенно удивительно отсутствие лечения в PBS-группе, несмотря на наличие плотной амилоидной нагрузки у этих мышей. Эти результаты показывают, что иммунизация синтетическим Аb-белком генерирует антитела, которые распознают и связываются in vivo с Ab в амилоидных бляшках. 7. Опосредуемый клетками иммунный ответ. Через 7 дней после девятой иммунизации у девяти АN1792-иммунизированных и 12 PBSиммунизированных 18-месячных PDAPP-мышей удаляют селезнку. Спленоциты отделяют и культиви- 19007218 руют в течение 72 ч в присутствии Аb40, Аb42 или Аb40-1 (белок с обратным порядком аминокислотных остатков). В качестве позитивного контроля служит митоген Con A. Оптимальные ответы получены с белком 1,7 мкМ. В ответ как на белок Ab1-40, так и на белок Ab1-42 происходит пролиферация клеток всех девяти AN1792-пролеченных животных, с равными уровнями включения обоих белков (фиг. 10,верхний рисунок). Не наблюдается ответа на Аb40-1-обратый белок. Клетки котрольных животных не отвечают ни на один из Аb-белков (фиг. 10, нижний рисунок). С. Выводы. Результаты этого исследования показывают, что АN1792-иммунизация PDAPP-мышей с имеющимися амилоидными отложениями замедляет и предотвращает амилоидное отложение и задерживает последующие не невропатологические изменения мозга у старых PDAPP-мышей. Иммунизация с помощьюAN1792 практически прекращает рост структур, которые в нормальных условиях подверглись бы амилоидозу. Следовательно, введение Аb-пептида оказывает терапевтическое действие при лечении AD.Ab для определения, какие эпитопы передают иммунный ответ. 9 различных иммуногенов и один контрольный вводят i.p. (интраперитонеально, внутрибрюшинно), как описано выше. Иммуногены включают четыре конъюгата человеческого Аb-пептида 1-12, 13-28, 32-42, 1-5, все связанные с антителом овцы к IgG мыши через цистеиновую связь; APP-полипептид аа 592-695, ассоциированный (агрегация) человеческий Ab1-40, и ассоциированный человеческий Ab 25-35 и ассоциированный Аb42 грызунов. Агрегация Аb42 и PBS использовались в качестве контрольных. В группу для терапии берут десять мышей. Титры контролируют как указано выше и мышей умерщвляют по окончании 4 месяцев инъецирования. Гистохимические анализы, определение Аb-уровней и токсикологические анализы проводят после умерщвления (post mortem). А. Материалы и методы. 1. Приготовление иммуногенов. Получение связанных Аb-пептидов: четыре конъюгата человеческого Аb-пептида (аминокислотные остатки 1-5, 1-12, 13-28, и 33-42, каждый конъюгирован с антителом овцы к IgG мыши) получают связыванием через синтетический цистеин, присоединенный к Аb-пептиду с применением перекрстно связывающего реагента сульфо-EMCS. Производные Аb-пептида синтезируют с помощью следующих конечных аминокислотных последовательностей. В каждом случае местоположение цистеиновой вставки указано подчркиванием. Производное Ab13-28-пептида также содержит два остатка глицина, присоединенных перед цистеином на карбоксильном конце, как указано. Аb1-12 пептид NH2-DAEFRHDSGYEVC COOHAb13-28 пептид Ac-NH-HHQKLVFFAEDVGSNKGGC-COOH Для приготовления к реакции связывания десять мг антител овцы к IgG мыши (JacksonImmunoResearch Laboratories) подвергают диализу в течение ночи против 10 мМ натрийборатного буфера, рН 8,5. Антитело после диализа концентрируют до объма 2 мл, используя пробирку AmiconCentriprep. Десять мг сульфо-EMCS [N-(e-малеимидокупроилокси)сукцинимида] (Molecular Sciences Co.) растворяют в одном мл деионизированной воды. К антителу овцы к IgG мыши при перемешивании по каплям прибавляют 40-кратный молярный избыток сульфо-EMCS, а затем раствор перемешивают ещ десять минут. Активированное антитело овцы против IgG мыши очищают и осуществляют буферный обмен, пропуская через 10 мл-овую колонку для гель-фильтрации (Pierce Presto Column, поставляетсяPierce Chemicals), уравновешенную 0,1 M NaPO4, 5 мМ EDTA, рН 6.5. Фракции, содержащие антитело,идентифицируют с помощью поглощения при 280 нм, объединяют и разбавляют до концентрации примерно 1 мг/мл, используя 1,4 мг на OD в качестве коэффициента экстинции. 40-кратный молярный избыток Аb-пептида растворяют в 20 мл 10 мМ NaPO4, рН 8,0, за исключением Ab33-42-пептида, 10 мг которого сначала растворяют в 0,5 мл ДМСО, а затем разбавляют до 20 мл 10 мМ NaPO4 буфером. Каждый раствор пептида добавляют к 10 мл активированного антитела овцы к IgG мыши и встряхивают при комнатной температуре в течение 4 ч. Образующиеся конъюгаты концентрируют до конечного объма менее 10 мл, применяя пробирку Amicon Centriprep, а затем подвергают диализу против PBS, чтобы провести буферный обмен и удалить свободный пептид. Конъюгаты пропускают через фильтры с размером пор 0,22 мк для стерилизации, а затем готовят аликвоты-фракции по 1 мг и хранят в замороженном виде при-20 С. Концентрации конъюгатов определяют BCA-белковым анализом (Pierce Chemicals) с лошадинымIgG для стандартной кривой. Конъюгация подтверждается увеличением молекулярного веса конъюгированных пептидов по сравнению с молекулярным весом активированного антитела овцы к IgG мыши. Конъюгат Ab1-5 с антителом овцы к IgG мыши является пулом двух конъюгатов, остальные представляют собой единичный препарат. 2. Препарат агрегаций (ассоциированных) Аb-пептидов. Человеческий 1-40 (AN1528; California Peptides Inc., лот МЕ 0541), человеческий 1-42 (AN1792;Inc., лот МЕ 0218) пептиды солюбилизируют непосредственно перед приготовлением каждого набора инъекций, используя лиофилизированные порошки, хранящиеся в сухом виде при -20 С. Для этой цели 2 мг пептида добавляют к 0,9 мл деионизированной воды и смесь встряхивают и перемешивают до получения сравнительно однородного раствора или суспензии. Из четырх только AN1528-пептид растворим на этой стадии. Добавляют затем аликвоту - 100 мкл 10 Х PBS (1X PBS: 0,15 M NaCl, 0,01 M фосфата натрия, рН 7,5) и в этот момент AN1528 начинает выпадать. Суспензию встряхивают и перемешивают снова и термостатируют в течение ночи при 37 С для использования на следующий день. Получение рВх 6-белка: плазмида экспресс, кодирующая рВх 6, слитой белок, состоящий из Nконцевой лидерной последовательности полимеразы 100-аминокислотного бактериофага MS2 с последующими аминокислотами 592-695 белка APP (bАРР) конструируют, как описано Oltersdorf et al., J. Biol.Chem. 265, 4492-4497 (1990). Плазмиду трансфицируют в E. coli и белок экспрессирует после индукции промотора. Бактерии лизируют в 8 M мочевине и рВх 6 частично очищают препаративным SDS PAGE. Фракции, содержащие рВх 6, идентифицируют вестерн-блоттингом, используя кроличье поликлональное антитело к рВх 6, объединяют, концентрируют, с применением пробирки Amicon Centriprep и подвергают диализу против PBS. Чистота препарата, оцениваемая окрашиванием SDS PAGE с помощью Кумасси синего, составляет примерно 5-10%. В. Результаты и обсуждение. 1. Порядок исследования. Сто мужских и женских особей 9-11-месячных гетерозиготных трансгенных PDAPP-мышей получены из лабораторий Charles River и Taconic. Мышей делят на десять групп для иммунизации различными участками Ab или APP вместе с адъювантом Фрейнда. Животных делят так, чтобы внутри группы они как можно более соответствовали друг другу по полу, возрасту, родословной и источнику. Иммуногены включают четыре Аb-пептида, полученных из последовательности человеческого белка, 1-5, 1-12,13-28 и 33-42, каждый в виде конъюгата с антителом овцы к IgG мыши; четыре агрегации Аb-пептидов,человеческого 1-40 (AN1528), человеческого 1-42 (AN1792), человеческого 25-35 и 1-42 грызунов; и слитой полипептид, обозначенный рВх 6, содержащий аминокислотные остатки 592-695 белка APP. Десятую группу в качестве контрольной иммунизируют PBS в сочетании с адъювантом Фрейнда. Для каждой иммунизации 100 мкг каждого Аb-пептида в 200 мкл PBS или 200 мкг АРРпроизводного рВх 6 в том же объме PBS или один PBS эмульгируют в объмном соотношении 1:1 с полным адъювантом Фрейнда (CFA) с конечным объмом 400 мкл для первой иммунизации с последующей бустер-иммунизацией тем же количеством иммуногена в неполном адъюванте Фрейнда (IFA) для последующих четырх доз и PBS для конечной дозы. Иммунизацию осуществляют внутрибрюшинно по двухнедельному графику для первых трх доз, затем с месячным интервалом. Пробы крови животных берут через четыре-семь дней после каждой иммунизации, начиная со второй дозы, для измерения титров антител. Животных умерщвляют примерно через неделю после конечной дозы. 2. Уровни Ab и APP в мозге. После примерно четырх месяцев иммунизации различными Аb-пептидами или производным APP,мозг удаляют из находящихся в физиологическом растворе животных. Одно полушарие готовят для иммуногистохимического анализа, а второе используют для количественного определения Ab- и АРРуровней. Для измерения концентрации различных форм амилоидного пептида и амилоидного белкапредшественника полушарие рассекают и готовят гомогенаты области гиппокампа, коры и мозжечка в 5M гуанидине. Эти гомогенаты разбавляют и уровень амилоида или APP определяют количественно,сравнивая с серией разведений стандартного Аb-пептида или APP с известными концентрациями в формате ELISA. Средняя концентрация тотального Ab для контрольной группы, иммунизированной PBS, в 5,8 раз выше в гиппокампе, чем в коре (в среднем 24318 нг/г в ткани гиппокампа по сравнению с 4221 нг/г в коре). Средний уровень в мозжечке в контрольной группе (23,4 нг/г ткани) примерно в 1000 раз ниже, чем в гиппокампе. Эти уровни подобны уровням для гетерозиготных PDAPP-трансгенных мышей того же возраста, о которых мы сообщали ранее (Johnson-Woods et al., 1997, см. выше). В коре субпопуляции из пролеченных групп средние уровни тотального Ab и Аb1-42 значительно отличаются от уровней контрольной группы (р 0,05), причем этим животным дают AN1792, Ab1-42 грызунов или конъюгат Ab1-5-пептида, как показано на фиг. 11. Средние уровни тотального Ab понижены на 75, 79 и 61% соответственно по сравнению с контрольными для этих подопытных групп. Нет заметной корреляции между титрами Аb-специфических антител и уровнями Ab в области коры головного мозга ни в одной из групп. В гиппокампе среднее уменьшение тотального Ab, обусловленное AN1792 терапией (46%, р = 0,0543) не так велико, как в коре (75%, р = 0,0021). Однако величина уменьшения значительно больше в гиппокампе, чем в коре: общее уменьшение 11186 нг/г ткани в гиппокампе по сравнению с 3171 нг/г ткани в коре. В группах животных, получавших Ab1-42 грызунов или Ab1-5,средние уровни тотального Ab понижаются на 36 и 26% соответственно. Однако если принимать во внимание малые размеры групп и то, что уровни амилоидного пептида очень сильно изменяются от животного к животному внутри обеих групп, это уменьшение является незначительным. Когда измеряют уровни Ab1-42 в гиппокампе, ни одно индуцированное лечением снижение не достигает значимой величины.- 21007218 Следовательно, из-за меньшей Аb-нагрузки в коре измерения на этом участке является более чувствительным индикатором эффекта терапии. Изменения уровней Ab в коре, определенные методом ELISA,подобны, но не идентичны результатам иммуногистохимического анализа (см. ниже). Тотальный Ab измеряют также в мозжечке, обычно не пораженной при AD-патологии области. Ни одна из средних концентраций Ab ни в одной из групп, иммунизированных различными Аb-пептидами или АРР-производным, не отличается от концентрации в контрольной группе в этой области мозга. Этот результат подтверждает, что на непатологическом уровне Ab не подвергается воздействию терапии. Концентрацию APP также определяют методом ELISA в коре и мозжечке пролеченных и контрольных мышей. Применяют два различных метода анализа APP. Первый, называемый APP-/FL, распознает как АРР- (, секретируемая форма APP, в котором происходит расщепление Ab-последовательности),так и непроцессированные формы (FL) APP, тогда как второй распознает только АРР-. В противоположность обусловленному терапией уменьшению количества Ab в субпопуляции испытуемых групп уровни APP не изменяются у всех испытуемых животных по сравнению с контрольными. Эти результаты показывают, что иммунизация Аb-пептидами не сокращает количество APP; скорее терапевтический эффект является специфическим относительно Ab. В целом, уровни тотального Ab и Ab1-42 значительно снижаются при терапии с помощью AN1792,Аb1-42 грызунов или конъюгата Аb1-5. В гиппокампе уровень тотального Ab значительно снижается только при АN1792-терапии. Никакие другие обусловленные лечением изменения уровней Ab или APP в гиппокампе, коре или мозжечке не являются значительными. 2. Гистохимические анализы. Мозг субпопуляции из шести групп готовят для иммуногистохимического анализа: три группы,иммунизированные Аb-пептидными конъюгатами Аb1-5, Ab1-12 и Ab13-18; две группы, иммунизированные агрегациями непроцессированного (полной длины) Ab AN1792 и AN1528, и пролеченная PBS контрольная группа. Результаты анализа изображения ("создания образа") амилоидной нагрузки в срезах мозга животных этих групп показаны на фиг. 12. Имеется значителное уменьшение амилоидной нагрузки в области коры головного мозга у животных трх испытуемых групп по сравнению с контрольными. Наибольшее уменьшение амилоидной нагрузки наблюдается в группе, получающей AN1792, где среднее значение снизилось на 97% (р = 0,001). Значительное уменьшение наблюдается также у животных, пролеченных AN1528 (95%, р = 0,005) и конъюгатом Аb1-5-пептида (67%, р = 0,02). Результаты, полученные при количественном определении тотального Ab или Ab1-42 методомELISA и амилоидной нагрузки методом анализа изображения, до некоторой степени различаются. Лечение с помощью AN1528 оказывает значительное воздействие на уровень кортикальной амилоидной нагрузки, определенной методом количественного анализа изображения, но не на концентрацию тотального Ab в той же области, определяемой методом ELISA. Разница между этитми двумя результатами, повидимому, связана со спецификой этих методов. Методом анализа изображения измеряют только нерастворимый Ab, скапливающийся в виде бляшек. Напротив, методом ELISA определяют все формы Ab как растворимые, так и нерастворимые, мономерные и ассоциированные (агрегации). В связи с тем, что, как полагают, патология заболевания обусловлена нерастворимой, связанной с бляшками формой Ab, техника анализа изображения должна быть более чувствительной для того, чтобы обнаружить терапевтический эффект. Однако так как ELISA является более быстрым и более легким методом анализа, он полезен для целей скрининга. Более того, он может обнаружить, что обусловленное терапией уменьшение уровня Ab больше для связанного бляшками, чем тотального Ab. Чтобы определить, регулируют ли Аb-специфические антитела, выявляемые иммунизацией в испытуемых животных, с отложенным в мозгу амилоида, "субпопуляция" срезов испытуемых животных и контрольных мышей реагирует с антителом, специфическим к мышиному IgG. В противоположностьPBS-группе, Аb-содержащие бляшки покрыты эндогенным IgG для животных, иммунизированных Аbпептидными конъюгатами Ab1-5, Аb1-12 и Ab13-28; и агрегациями непроцессированного Ab AN1792 иAN1528. Мозг животных, иммунизированных другими Аb-пептидами или АРР-пептидом рВх 6, не анализировался этим методом. 3. Определение титров антител. У мышей берут пробу крови через четыре-семь дней после каждой иммунизации, начиная со второй иммунизации, всего пять проб (раз). Титры антител измеряют как титры Ab1-42-связывающего антитела,применяя сэндвич-ELISA с пластиковыми планшетами, покрытыми Аb1-42. Как показано на фиг. 13,максимальные титры антител обнаружены после четвертой дозы в случае тех четырх вакцин, которые связывают наиболее высокие титры AN1792-специфических антител: AN1792 (пик GMT: 94647),AN1528 (пик GMT: 88231), Аb1-42-конъюгат (пик GMT: 47216) и Аb1-42 грызунов (пик GMT: 10766). Титры для этих групп несколько уменьшаются после пятой и шестой доз. В случае остальных пяти иммуногенов максимальные титры достигаются после пятой или шестой доз и величина этих титров значительно ниже величины для четырх групп с наиболее высокими титрами: Аb1-15-конъюгат (пик GMT: 2356), рВх 6 (пик GMT: 1986), Аb13-18-конъюгат (пик GMT: 1183), Аb33-42-конъюгат (пик GMT: 658),Аb25-35 (пик GMT: 125). Также измеряют титры антител против гомологичных пептидов, применяя тот- 22007218 же ELISA-сэндвич формат для субпопуляции иммуногенов, при этом группы иммунизируют Ab1-15,Ab13-28, Аb25-35, Аb33-42 или Ab1-42 грызунов. Эти титры практически такие же, как титры, найденные против Ab1-42, за исключением иммуногена Аb1-42 грызунов, при применении которого титры против гомологичного иммуногена, примерно, вдвое выше. Величина титра AN1792-специфического антитела индивидуальных животных или средние значения испытуемых групп не коррелируются с эффективностью, измеряемой снижением уровней Ab в коре головного мозга. 4. Лимфопролиферативный иммунный ответ. Аb-Зависимую лимфопролиферацию определяют, используя клетки селезнки, собираемые примерно через неделю после конечной, шестой, иммунизации. Свежесобранные клетки, 105 на лунку, культивируют в течение 5 дней в присутствии Ab1-40 с концентрацией 5 мкМ для стимуляции. Клетки субпопуляции семи из десяти групп также культивируют в присутствии обратного пептида, Ab1-40. В качестве позитивного контроля дополнительные клетки культивируют с Т-клеточным митогеном, PHA и в качестве негативного контроля клетки культивируют без добавления пептида. В ответ на PHA происходит пролиферация лимфоцитов большинства животных. Заметной реакции нет на Аb40-1-обратный пептид. Клетки животных, иммунизированных большими по размеру ассоциированными Аb-пептидами, AN1792, Ab1-42 грызунов и AN1528, устойчиво пролиферируют после стимуляции Аb1-40 с высочайшим срm (числом импульсов в минуту) у реципиентов AN1792. У одного животного в каждой группе, иммунизированной конъюгатом Аb1-12, конъюгатом Аb13-28 и Аb25-35, наблюдается пролиферация в ответ на Ab1-40. В остальных группах, получающих Аb1-5-конъюгат, Ab3342-конъюгат, рВх 6 или PBS, нет ни одного животного с Аb-стимулированным иммунным ответом. Эти результаты сведены в табл. 5, см. ниже. Таблица 5 Эти результаты показывают, что AN1792 и AN1528 стимулируют сильной T-клеточной иммунной реакцией, наиболее вероятно, CD4+ фенотипа. Отсутствие Аb-специфической Т-клеточной иммунной реакции у животных, иммунизированных Ab1-5, не является неожиданным, так как эпитопы пептидов,распознаваемые CD4+ Т-клетками, имеют обычно протяжнность около 15 аминокислот, хотя более короткие пептиды могут иногда работать с меньшей эффективностью. То есть большинство эпитопов хелперных Т-клеток четырх пептидных конъюгатов, по-видимому, находящихся в IgG партнре конъюгата,расположены не в области Аb. Эта гипотеза подтверждается очень малым числом случаев пролиферативного ответва у животных в каждой из этих подопытных групп. Так как конъюгат Ab1-5 действительно значительно снижает уровень Ab мозга при явном отсутствии Аb-специфических Т-клеток, то, повидимому, ключевым действующим началом иммунного ответа, индуцированного иммунизацией этим пептидом, является антитело. Отсутствие Т-клеточной иммунной реакции и слабый гуморальный иммунный ответ на введение слитого пептида рВх 6, охватывающий аминокислоты 592-695 APP, включая все Аb-остатки, возможно,вызван слабой иммунологичностью этого конкретного препарата. Слабая иммуногенность агрегации Аb25-35, по-видимому, вызвана тем, что пептид слишком мал, чтобы содержать хороший T-клеточных эпитоп, который бы помог индуцировать гуморальный иммунный ответ. Если этот пептид был бы конъюгирован с белком-носителем, он, возможно, был бы более иммуногенным.V. Препарат поликлональных антител для пассивного иммунитета. 20 нетрансгенных мышей иммунизируют с помощью Ab или другого иммуногена, при необходимости, плюс адъювант и умерщвляют в 4-5 месяцев. Кровь иммунизированных животных собирают. При необходимости, IgG отделяют от других компонентов крови. Антитело, специфическое к иммуногену,можно частично очистить аффинной хроматографией. В среднем на одну мышь получают около 0,5-1 мг иммуноген-специфического антитела, что в общем дает 5-10 мг.VI. Пассивная иммунизация антителами к Ab. Группы из 7-9-месячных PDAPP-мышей инъецируют 0,5 мг поликлональных антител к Ab или спе- 23007218 цифических моноклональных антител к Ab в PBS, как показано ниже. Все препараты антител очищают так, чтобы у них были низкие уровни эндотоксинов. Можно приготовить моноклональные антитела против фрагмента инъекцией мыши фрагмента или более протяжнной формы Ab, получением гибридом и скринингом гибридом на антитело, связывающееся с заданным фрагментом Ab без связывания с другими неперекрывающимися фрагментами Ab. Таблица 6 Мышам вводят инъекции i.p. (в.б. - внутрибрюшинно), при необходимости, в течение 4 месяцев,чтобы поддержать концентрацию циркулирующего антитела, измеряемую титром ELISA, более высоким, чем 1/1000, найденный методом ELISA к Аb42 или другому иммуногену. Титры контролируют, как указано выше, и мышей умерщвляют по окончании 4 месяцев инъекций. Анализы: гистохимический, Аbуровней и токсикологический - проводят после вскрытия. В группу входит десять мышей.VII. Сравнение различных адъювантов. В этих примерах сравнивают CFA (полный адъювант Фрейнда), квасцы, водомасляную эмульсию иMPL (МФЛ) по способности стимулировать иммунный ответ. А. Материалы и методы. 1. Порядок исследования. Сто самок шестимесячных морских свинок линии Хартлин (Hartley), полученных от Elm Hill, делят на десять групп для иммунизации AN1792 или его пальмитоильным производным в сочетании с различными адъювантами. Семи группам делают инъекции AN1792 (33 мкг, если не уакзано иначе) в сочетании с a) PBS (ЗФР), b) адъювантом Фрейнда, с) MPL (МФЛ), d) скваленом, е) MPL/сквален, f) малой дозой квасцов или g) высокой дозой квасцов (300 мкг AN1792). Двум группам вводят инъекции пальмитоильного производного AN1792 (33 мкг) в сочетании с a) PBS или b) скваленом. Последней, десятой группе дают только PBS без антигена или дополнительного адъюванта. Для группы, получающей адъювант Фрейнда, первую дозу эмульгируют с CFA (полный адъювант Фрейнда), а остальные четыре дозы - с IFA(неполный адъювант Фрейнда). Доза вводимого антигена составляет 33 мкг для всех групп, кроме группы, получающей высокую дозу квасцов, которой дают 300 мкг AN1792. Инъекции вводят внутрибрюшинно в случае CFA/IFA и внутримышечно в четырхглавную мышцу задней конечности или же в правый или левый бок для всех других групп. Первые три дозы дают по двухнедельному графику, а затем две дозы с месячным интервалом. Пробы крови берут через шесть-семь дней после каждой иммунизации, начиная со второй дозы, для определения титров антител. 2. Получение иммуногенов. 2 мг Аb42 (California Peptide, лот МЕ 0339) добавляют к 0,9 мл деионизированной воды и смесь встряхивают и перемешивают для получения сравнительно однородной суспензии. Добавляют 100 мкл аликвоту 10 Х PBS (1X PBS, 0,15 M NaCl, 0,01 M фосфата натрия, рН 7,5). Суспензию снова встряхивают и перемешивают и термостатируют в течение ночи при 37 С с целью использования на следующий день. Неиспользованный Ab1-42 хранят с осушителем в виде лиофилизированного порошка при -20 С. Пальмитоильное производное AN1792 получают присоединением пальмитинового ангидрида, растворенного в диметилформамиде, к концевой аминогруппе AN1792 и выделением получающегося пептида из смолы обработкой фтористоводородной кислотой. Чтобы приготовить дозы вакцины с полным адъювантом Фрейнда (CFA) (группа 2), 33 мкг AN1792 в 200 мкл PBS эмульгируют в соотношении 1:1 (по объему) с CFA с конечным объемом 400 мкл для первой иммунизации. Для последующих иммунизаций антиген аналогично эмульгируют с неполным адъювантом Фрейнда (IFA). Для приготовления доз вакцины с MPL (МФЛ) для групп 5 и 8, лиофилизированный порошок (RibiImmunoChem Research, Inc., Hamilton, MT) добавляют к 0,2% водному триэтиламину до конечной концентрации 1 мг/мл и встряхивают при перемешивании. Смесь нагревают до 65-70 С в течение 30 с до получения слегка мутной однородной суспензии из мицелл. Раствор готовят заново перед каждой серией инъекций. Для каждой инъекции в группе 5 33 мкг AN1792 в 16,5 мкл PBS, 50 мкг MPL (50 мкл) и 162 мкл PBS смешивают в пробирке из боросиликатного стекла непосредственно перед употреблением. Для приготовления доз вакцины с низким содержанием водомасляной эмульсии AN1792 в PBS добавляют к 5% сквалена, 0,5% Tween 80, 0,5% Span 85 в PBS так, чтобы достичь конечной концентрации однократной дозы 33 мкг AN1792 в 250 мкл (группа 6). Смесь эмульгируют, пропуская через портатив- 24007218 ное двухкамерное устройство 15-20 раз до тех пор, пока капельки эмульсии не станут примерно равными 1,0 мкм, диаметру сфер стандартного латекса, если рассматривать их под микроскопом. Образующаяся суспензия является опалесцирующей, молочно-белой. Эмульсию готовят непосредственно перед каждой серией инъекций. Для группы 8 добавляют MPL в 0,2% триэтиламине с концентрацией 50 мкг на дозу к сквалену и смеси детергентов для эмульгирования, как описано выше. Для пальмитоильного производного (группа 7) к сквалену добавляют 33 мкг на дозу пальмитоил-NН-Аb1-42 и перемешивают при встряхивании. Затем добавляют при перемешивании Tween 80 и Span 85. Эту смесь добавляют к PBS до достижения конечной концентрации 5% сквалена, 0,5% Tween 80, 0,5% Span 85 и смесь эмульгируют,как описано выше. Чтобы приготовить дозы вакцины с квасцами (группы 9 и 10), AN1792 в PBS добавляют кAlhydrogel (гель гидроокиси алюминия, Accurate, Westbury, NY) до достижения концентрации 33 мкг(низкая доза, группа 9) или 300 мкг (высокая доза, группа 10) AN1792 на 5 мг квасцов в конечном объеме дозы 250 мкл. Суспензию осторожно перемешивают в течение 4 ч при комнатной температуре. 3. Измерение титров антител. У морских свинок берут пробу крови через шесть-семь дней после иммунизации, начиная со второй иммунизации, всего четыре раза. Титры антител к Аb42 измеряют методом ELISA, как описано в Общих материалах и Методах. 4. Подготовка ткани. Через примерно 14 недель всем морским свинкам дают CO2. Цереброспинальную жидкость собирают и мозг удаляют и три участка мозга (гиппокамп, кору и мозжечок) разделяют и используют для измерения концентрации тотального Аb-белка методом ELISA. В. Результаты. 1. Гуморальный ("антительный") иммунный ответ. Эффективность различных адъювантов, измеряемая как гуморальный иммунный ответ на иммунизацию AN1792, находится в широком интервале. Как показано на фиг. 14, когда AN1792 вводится в PBS,никаких антител не обнаружено после двух или трх иммунизаций и незначительный иммунный ответ наблюдается после четвертой и пятой доз со средними геометрическими титров (GMT) только около 45. Водомасляная (м/в) эмульсия приводит к умеренным значениям титров после третьей дозы (GMT 255),которые сохраняются после четвертой дозы (GMT 301) и падают с конечной дозой (GMT 54). Наблюдается четкий эффект дозы антигена, т.к. AN1792, связанный с квасцами с концентрацией 300 мкг, является более иммуногенным, чем при 33 мкг, во всех временных точках. При максимальном значении иммунного ответа (пик) разница между двумя дозами составляет 43% при значениях GMT примерно 1940 (33 мкг) и 3400 (300 мкг). Гуморальный иммунный ответ на 33 мкг AN1792 плюс MPL очень похож на ответ, вызываемый почти десятикратной дозой антигена (300 мкг), связанного с квасцами. Добавление MPL к м/в эмульсии снижает иммуногенность вакцины относительно иммуногенности с MPL в качестве единственного адъюванта на 75%. Пальмитоильное производное AN1792 является полностью неиммуногенным при введении в PBS и дает умеренные титры в м/в эмульсии с GMT 340 и 105 для третьей и четвертой проб крови. Наивысшие титры антител достигнуты с адъювантом Фрейнда с пиком GMT примерно 87000, величина почти в 30 раз большая, чем GMT следующих двух наиболее иммуногенных вакцин, сMPL и с высокой дозой AN1792/квасцы. Самыми многообещающими адъювантами в этом исследовании являются MPL и квасцы. Из этих двух MPL, по-видимому, является предпочтительным, потому что для того, чтобы вызвать такой же гуморальный иммунный ответ, как и в случае квасцов, требуется в 10 раз меньшая доза антигена. Иммунный ответ увеличивается при повышении дозы антигена и/или адъюванта и при оптимизации схемы иммунизации. М/в эмульсия является очень слабым адъювантом для AN1792 и добавление м/в эмульсии к адъюванту MPL снижает свойственную самому MPL адъювантную активность. 2. Уровни Ab в головном мозге. Примерно через 14 недель морских свинок усыпляют, цереброспинальную жидкость (CSF) отбирают и мозг удаляют из животных субпопуляции групп, иммунизированных адъювантом Фрейнда (группа 2), MPL (группа 5), квасцами с высокой дозой, 300 мкг, AN1792 (группа 10) и иммунизированной PBS контрольной группы (группа 3). Чтобы определить уровень Аb-пептида одно полушарие мозга отсекают и готовят гомогенаты гиппокампа, кортикального и мозжечкового участков мозга в 5 M гуанидине. Эти гомогенаты разводят и количественно определяют сравнением с серией разведений стандартного Аbбелка известной концентрации в формате ELISA. Уровни Ab-белка в гиппокампе, коре и мозжечке очень похожи во всех группах, несмотря на очень широкий интервал гуморального иммунного ответа на Ab,выявляемого этими вакцинами. Средние Аb-уровни, примерно, 25 нг/г ткани, определяют в гиппокампе,21 нг/г в коре и 12 нг/г в мозжечке. Следовательно, присутствие циркулирующего антитела к Ab с высоким титром в течение почти трх месяцев у некоторых из этих животных не изменяет уровней тотального Ab в головном мозге. Уровни Ab в CSF также совершенно аналогичны в группах. Отсутствие значительного влияния AN1792-иммунизации на эндогенный Ab указывает, что иммунный ответ сосредоточен на патологических образованиях Ab.VIII. Иммунный ответ на различные адъюванты у мышей.- 25007218 Для этого исследования берутся самки Swiss Webster мышей в возрасте шести недель, по 10-13 животных в группе. Иммунизацию проводят на 0, 14, 28, 60, 90 дни и вводят 20 подкожных инъекций, объм дозы составляет 200 мкл. Для всех рецептур в качестве буфера берут PBS. Через семь дней после каждой иммунизации, начиная со второй дозы, у животных отбирают пробы крови для определения титров антител методом ELISA. Схема лечения для каждой группы сведена в табл. 7. Таблица 7b Указаны адъюванты. Буфером для всех этих рецептур является PBS. В группе 8 нет адъюванта и нет антигена.ELISA-титры антител против Аb42 в каждой группе показаны ниже в табл. 8. Таблица 8 Среднее геометрическое титров антител Неделя взятия пробы крови- 26007218 Таблица показывает, что наиболее высокие титры получены для групп 4, 5 и 18, в которых адъювантами являются 125 мкг MPL, 50 мкг MPL и QS21 плюс MPL.IX. Терапевтическая эффективность различных адъювантов. Изучение терапевтической эффективности проводят на PDAPP трансгенных мышах с набором адъювантов, пригодных к применению на людях, с целью определения их способности потенциировать иммунный ответ на Ab и стимулировать иммунно-опосредуемый клиренс амилоидных отложений мозга. Сто восемьдесят самцов и самок 7,5-8,5-месячных гетерозиготных PDAPP-трансгенных мышей получают из лабораторий Charles River. Мышей делят на девять групп по 15-25 животных в группе, которых иммунизируют AN1792 или AN1528 в сочетании с различными адъювантами. Животных распределяют в максимально близком соответствии с полом, возрастом, происхождением. Адъюванты включают квасцы, MPL и QS21, каждый в сочетании с обоими антигенами, и адъювант Фрейнда (FA) в сочетании только с AN1792. Дополнительную группу иммунизируют AN1792 в рецептуре с PBS-буфером плюс консервант тимерозаль (thimerosal) без адъюванта. Девятую группу иммунизируют одним PBS в качестве негативного контроля. Получение агрегации Аb-пептидов: человеческий Ab1-40 (AN1528; California Peptides Inc., Napa,CA; лот МЕ 0541) и человеческий Аb1-42 (AN1792; California Peptides Inc., лот МЕ 0439) пептиды солюбилизируют непосредственно перед приготовлением набора (серии) инъекций лиофилизированных порошков, которые хранятся в сухом виде при -20 С. Для этой цели два мг пептида добавляют к 0,9 мл деионизированной воды и смесь встряхивают и перемешивают для получения относительно однородного раствора или суспензии. AN1528 растворяется на этой стадии в отличие от AN1792. Затем добавляют 100 мкл аликвоту 10 Х PBS (1X PBS, 0,15 M NaCl, 0,01 M фосфата натрия, рН 7,5); при этом AN1528 начинает выпадать. Суспензии снова перемешивают и встряхивают и термостатируют в течение ночи при 37 С, чтобы использовать на следующий день. Для приготовления доз вакцины с квасцами (группы 1 и 5) Аb-пептид в PBS добавляют к Alhydrogel(двухпроцентный водный гель гидроокиси алюминия, Sargeant, Inc., Clifton, NY) до получения концентрации 100 мкг Аb-пептида на 1 мг квасцов. 10 Х PBS добавляют к объему конечной дозы 200 мкл в 1XPBS. Затем суспензию осторожно перемешивают в течение 4 ч при комнатной температуре перед инъекцией. Для приготовления доз вакцины с MPL (группы 2 и 6) лиофилизированный порошок (RibiImmunoChem Research, Inc., Hamilton, MT; лот 67039-ЕО 896 В) добавляют к 0,2% водному триэтиламину до конечной концентрации 1 мг/мл и перемешивают при встряхивании. Смесь нагревают до 65-70 С в течение 30 с до получения слегка мутной однородной суспензии из мицелл. Раствор хранят при 4 С. Для каждой серии инъекций 100 мкг пептида на дозу в 50 мкл PBS, 50 мкл MPL на дозу (50 мкл) и 100 мклPBS на дозу смешивают в пробирке из боросиликатного стекла непосредственно перед употреблением. Для приготовления доз вакцины с QS21 (группы 3 и 7) лиофилизированный порошок (Aquila,Framingham, MA; лот A7018R) добавляют к PBS, рН 6,6-6,7 до конечной концентрации 1 мг/мл и перемешивают при встряхивании. Раствор хранят при -20 С. Для каждой серии инъекций 100 мкг пептида на дозу в 50 мкл PBS, 25 мкл QS21 на дозу в 25 мкл PBS и 125 мкл PBS на дозу смешивают в пробирке из боросиликатного стекла непосредственно перед употреблением. Для приготовления доз вакцины с адъювантом Фрейнда (группа 4), 100 мкг AN1792 в 200 мкл PBS эмульгируют в объемном соотношении 1:1 с полным адъювантом Фрейнда (CFA) с конечным объемом 400 мкл для первой иммунизации. Для последующих иммунизаций антиген аналогично эмульгируют с неполным адъювантом Фрейнда (IFA). Для вакцин, содержащих адъюванты: квасцы, MPL или QS21, 100 мкг на дозу AN1792 или AN1528 объединяют с квасцами (1 мг на дозу) или MPL (50 мкг на дозу) илиQS21 (25 мкг на дозу) с конечным объемом 200 мкл PBS и вводят с помощью подкожной иммунизации в спину между лопатками. Для группы, получающей FA, 100 мкг AN1792 эмульгируют в объемном соотношении 1:1 с полным адъювантом Фрейнда (CFA) с конечным объемом 400 мкл и вводят внутрибрюшинно для первой иммунизации, с последующим повторным (бустер) введением того же количества иммуногена в неполном адъюванте Фрейнда (IFA) в последующих пяти дозах. Для группы, получающейAN1792 без адъюванта, 10 мкг AN1792 объединяют с 5 мкг тимерозаля в конечном объеме 50 мкл PBS и вводят подкожно. Девятая, контрольная группа получает только 200 мкл PBS, вводимого подкожно. Иммунизацию проводят по двухнедельной схеме для первых трх доз, затем по месячной схеме в дни 0, 16,28, 56, 85 и 112. У животных берут пробу крови на шестой-седьмой день после каждой иммунизации,начиная со второй дозы для измерения титров антител. Животных умерщвляют, примерно, через неделю после конечной дозы. Результаты определяют методом ELISA-анализа уровней Ab и APP в мозге и с помощью иммуногистохимической оценки присутствия амилоидных бляшек на участках мозга. Кроме того, определяют титры Аb-специфических антител, Ab-зависимые пролиферативный ответ и реакцию цитокинов. В табл. 9 показано, что самые высокие титры антител на Ab1-42 выявляются с FA и AN1792, титры,достигающие пика после четвертой иммунизации (пик GMT: 75386), а затем снижается на 59% после последней, шестой иммунизации. Максимальное значение титра, получаемое с MPL с AN1792, на 62%- 27007218 ниже, чем значение, получаемое с FA (пик GMT: 28867) и также достигается на ранней стадии схемы иммунизации, после 3 доз, с последующим понижением до 28% от максимального значения после шестой иммунизации. Средние значения максимальных титров с QS21 в сочетании с AN1792 (GMT: 1511) примерно в 5 раз ниже, чем полученные с MPL. Кроме того, кинетика иммунного ответа медленнее, так как требуется дополнительная иммунизация для достижения максимального ответа. Титры, получающиеся под действием связанного с квасцами AN1792, в самой малой степени превышают титры, полученные с QS21, и кинетика иммунного ответа имеет более высокую скорость. Для AN1792, доставляемого в PBS с тимерозалем, частота и величина (размер) титров едва ли больше, чем таковые для одногоPBS. Максимальные титры, получаемые с MPL и AN1792 (пик GMT 3099), примерно, в 9 раз ниже, чем титры с AN1792. Связанный с квасцами AN1528 является очень слабо иммуногенным с низкими титрами антител, вырабатываемых только у некоторых животных. У контрольных животных, иммунизированных только PBS, не наблюдается никакого иммунного ответа. Таблица 9 Среднее геометрическое титров антитела Неделя взятия пробы крови Примечания: а Среднее геометрическое титров антител, измеренное против Ab1-42b Число респодров на группу Результаты введения AN1792 или AN1528 с различными адъювантами или тимерозалем на кортикальную амилоидную нагрузку у 12-месячных мышей, определяемые методом ELISA, даны на фиг. 15. УPBS-контрольных PDAPP мышей средний уровень тотального Ab в коре в 12 месяцев составляет 1817 нг/г. Заметно меньшие уровни Ab наблюдаются у мышей, пролеченных AN1792 плюс CFA/IFA, AN1792 плюс MPL и QS21 плюс AN1792. Уменьшение достигает статистического значения (р 0,05) только дляAN1792 плюс CFA/IFA. Однако, как показано в примерах I и III, влияние иммунизации на снижение уровней Ab становится существенно больше у 15- и 18-месячных мышей. То есть ожидается, что, по меньшей мере, композиции AN1792 плюс квасцы, AN1792 плюс MPL и AN1792 плюс QS21 достигнут статистического значения у более взрослых мышей. Напротив, AN1792 плюс консервант тимерозаль показывают средний уровень Ab примерно такой же, как у мышей, получавших PBS. Сходные результаты получены при сравнении кортикальных уровней Аb42. Средний уровень Аb42 у PBS-контрольных мышей составляет 1624 нг/г. Заметно пониженные уровни - 403, 1149, 620 и 714 - получены у мышей, пролеченных AN1792 плюс CFA/IFA, AN1792 плюс квасцы, AN1792 плюс MPL и AN1792 плюс QS21 соответственно при уменьшении, достигающем статистического значения (р = 0,05) для группы, получавшейX. Анализ на токсичность. Ткани собирают для гистопатологического исследования в конце исследования, описанного в примерах 2, 3 и 7. Кроме того, проводят гематологические и клинические химические анализы конечных образцов крови из примеров 3 и 7. Большую часть основных органов удаляют, включая мозг, лгкие,лимфоидную ткань, желудочно-кишечный тракт, печень, почки, надпочечники и гонады (половые железы). Хотя у подопытных животных наблюдаются случайные поражения, не наблюдается явных различий ни в пораженных тканях, ни в тяжести поражения между AN1792-пролеченными и непролеченными животными. Нет каких-либо особых гистопатологических поражений, замеченных у AN1792- 28007218 иммунизированных животных по сравнению с PBS-пролеченными или непролеченными животными. Нет также различий клинических химических показателей между группами животных с адъювантами и сPBS в примере 7. Хотя наблюдается значительное повышение некоторых гематологических параметров у животных, получавших AN1792 и адъювант Фрейнда в примере 7 по сравнению с получавшими PBS животными, такого рода эффекты ожидают от введения адъюванта Фрейнда и сопутствующего перитонита и не это указывает на какие-либо побочные эффекты AN1792-терапии. Не являясь частью токсикологических анализов, тем не менее патология мозга мышей PDAPP серьзно изучается как часть показателей эффективности. Не было отмечено никаких признаков вредного влияния лечения на морфологию мозга ни в одном из исследований. Эти результаты показывают, что введение AN1792 хорошо переносится и, по меньшей мере, практически свободно от побочных эффектов.XI. Профилактика и терапия людей. Для определения безопасности проводят стадию I опыта с введением однократной дозы. Различным больным вводят терапевтический агент с увеличением дозы, начиная, примерно, от 0,01 уровня предполагаемой эффективности и увеличивая с коэффициентом 3 до достижения 10-кратной эффективности на мышах. Стадию II опыта проводят, чтобы определить терапевтическую эффективность. Выбирают больных с болезнью Альцгеймера - от ранней до средней - определение, употребляемое по критериям Ассоциации"Болезнь Альцгеймера и родственные заболевания" (ADRDA) для возможных AD. Соответствующих больных оценивают в интервале 12-26 по шкале умственной неполноценности - Mini-Mental State Exam(MMSE). Другой критерий отбора это - больные, которые перенесли продолжительное исследование и не имеют осложняющих проблем, таких как применение существующих лекарственных препаратов, которые могут нанести вред. Оценки базовой линии функции больных делают, используя классические психометрические определения, такие, например, как MMSE и ADAS, которые представляют собой полную(исчерпывающую) шкалу оценки больных со статусом "Болезнь Альцгеймера" и е специфическими свойствами. Эти психометрические тесты обеспечивают измерение прогрессирования болезни Альцгеймера. Для мониторинга лечения можно также применять соответствующие качественные методы оценки. Прогрессирование заболевания также можно контролировать методом ЯМР. Показатели крови больных можно также контролировать, включая анализы иммуноген-специфических антител и Т-клеточный иммунный ответ. После определения базовой линии больные начинают принимать лечение. Их произвольно делят и лечат либо терапевтическим агентом, либо плацебо "вслепую". Больных проверяют по меньшей мере каждые шесть месяцев. Эффективность определяется заметным уменьшением (замедлением) прогрессирования пролеченной группы по сравнению с "плацебогруппой". Вторую фазу II испытания осуществляют, чтобы оценить переход больных от болезни, не являющихся болезнью Альцгеймера - ранней потери памяти, иногда называемой связанным с возрастом ослаблением памяти (AAMI) - вероятной болезни Альцгеймера, как она определяется критериями ADRDA. Больных с высокой степенью риска превращения в больных болезнью Альцгеймера выбирают из "неклинической" популяции скринингом референтной группы (популяции) на ранние признаки потери памяти или других затруднений, связанных с пре-Альцгеймеровой симптоматологией, семейным анамнезом болезни Альцгеймера, генетическими факторами риска, возрастом, полом и другими особенностями,по которым можно предвидеть высокую степень риска заболевания болезнью Альцгеймера. Суммируют основные оценки в соответствующих измерениях (метриках) включая MMSE и ADAS, вместе с другими измерениями (метриками), позволяющие оценить более нормальную популяцию. Эти популяции больных делят на соответствующие группы для сравнения плацебо с альтернативой - агентом. Эти популяции больных с интервалами, примерно, шесть месяцев, и конечный результат для каждого больного - это перейдет ли он или она в состояние вероятной болезни Альцгеймера по шкале ADRDA в конце наблюдения.XII. Общие материалы и методы. 1. Определение титров антител. У мышей берут пробу крови, делая небольшой надрез хвостовой вены и отбирая около 200 мкл крови в пробирку для микроцентрифуги. У морских свинок пробу крови берут, сначала выбривая поверхность заднего скакательного сустава, а затем, используя иглу N 18 для вскрытия (разреза) плюсневой вены и отбирая кровь в микроцентрифужные пробирки. Процесс свертывания крови проводят в течение одного часа при комнатной температуре (RT), е перемешивают и встряхивают, затем центрифугируют при 14000 об/мин в течение 10 мин, чтобы отделить коагулянт от сыворотки. Сыворотку затем переносят в чистую микроцентрифужную пробирку и хранят при 4 С до титрования. Титры антител определяют методом ELISA. 96-луночные микропланшеты (планшеты Costar EIA) покрывают 100 мкл раствора, содержащего либо 10 мкг/мл Аb42 или SAPP, либо другие антигены, как указано в каждом отдельном сообщении, в буфере для сенсибилизации планшетов (0,1 M фосфата натрия, рН 8,5, 0,1% азида натрия) и выдерживают в течение ночти при RT. После аспирации лунок в них добавляют сыворотку, начиная с разбавления 1/100 в разбавителе образцов (0,014 M фосфата натрия, рН 7,4, 0,15 M NaCl, 0,6% бычьего сывороточного альбумина, 0,05%- 29007218 тимерозаля). Непосредственно в планшетах проводят семь серийных (в три раза) разведений образцов до достижения конечного разведения 1/218700. Разведения термостатируют в сенсибилизированных лунках планшетов в течение одного часа при RT. Затем планшеты отмывают четыре раза PBS, содержащим 0,05% Tween 20. Второе антитело, козье антитело к мышиному Ig, конъюгированное с пероксидазой хрена (получено от Boehringer Mannheim), добавляют в лунки в виде 100 мкл разведения 1/3000 в разбавителе образцов и термостатируют один час при RT. Планшеты снова отмывают четыре раза в PBS, Tween 20. Чтобы получить хромоген, в каждую лунку добавляют 100 мкл медленного (Slow) TMB (3,3',5,5'тетраметилбензидин, получен от Pierce Chemicals) и термостатируют в течение 15 мин при RT. Реакцию прекращают, добавляя 25 мкл 2 M H2SO4. Интенсивность цвета читают затем на молекулярных устройствах Vmax при (450-650 нм). Титры определяют как обратную величину разведения сыворотки, дающей половину максимальнойOD (оптической плотности). Максимальную OD обычно берут из начального разведения 1/100, за исключением случаев с очень высокими титрами, и тогда требуется более высокое начальное разведение для установления максимальной OD. Если точка 50% попадает между двумя разведениями, для расчта конечного титра делают линейную экстраполяцию. Чтобы рассчитать среднее геометрическое титров антитела, произвольно берут значение титров менее 100 равным 25. 2. Анализ пролиферации лимфоцитов. Мышей усыпляют изофлюраном. Селезенки удаляют и дважды промывают 5 мл PBS, содержащего 10% термоинактивированной фетальной бычьей сыворотки (PBS-FBS), и затем гомогенизируют в устройстве 50 мк Centricon (Dako A/S, Denmark) в 1,5 мл PBS-FBS в течение 10 с при 100 об./мин вMedimachine (Dako) с последующим фильтрованием через нейлоновое сито с размером пор 100 мк. Спленоциты отмывают один раз 15-мл PBS-FBS, затем высаживают при центрифугировании при 200 об./мин в течение 5 мин. Эритроциты лизируют, повторно суспендируя осадок в 5 мл буфера, содержащего 0,15 M NH4Cl, 1 M KHCO3, 0,1 M NaEDTA, рН 7,4 в течение 5 мин при RT. Затем лейкоциты отмывают, как описано выше. Свежеизолированные клетки селезнки (105 клеток на лунку) культивируют в трх ячейках (трижды) в 96-луночных микрокультуральных планшетах с U-образным дном (Corning,Cambridge, MA) в среде RPMI1640 (JRH Biosciences, Lenexa, KS), дополненной 2,05 мМL-глутамина, 1% пенициллина/стрептомицина и 10% термоинактивированного FBS, в течение 96 ч при 37 С. Также добавляют различные Аb-пептиды, Ab1-16, Ab1-40, Ab1-42 или белок с обратной последовательностью Аb40-1 в дозах в интервале 5-0,18 мкМ в четыре стадии. Клетки в контрольных лунках культивируют с конканавалином A (Con A) (Sigma, cat.С-5274, при 1 мкг/мл) без добавления белка. Клетки выдерживают в пульсовом режиме последние 24 ч с Н-тимидином (мкки/лунка, получен от Amersham Corp.,Arlington Heights IL). Клетки собирают на пластины UniFilter и считают с помощью сцинтилляционного счтчика для микропланшетов Top Count Microplate Scintillation Counter (Packard Instruments, DownersGrove, IL). Результаты выражены как число импульсов радиоактивности, введенной в нерастворимые макромолекулы, в минуту (срm). 4. Подготовка ткани головного мозга. После усыпления головной мозг удаляют и одно полушарие готовят для иммуногистохимического анализа, тогда как три участка мозга (гиппокамп, кора и мозжечок) отсекают от второго полушария и используют для определения концентрации различных Аb-белков и АРР-форм, применяя специфический метод ELISA (Johnson-Wood et al., см. выше). Ткани, предназначенные для анализа ELISA, гомогенизируют в 10 объмах охлажднного на льду(ледяного) буфера гуанидина (5,0 M гуанидин-НСl, 50 мМ Трис-HCl, рН 8,0). Гомогенат осторожно перемешивают в нутаторе Адамса (Fisher) от 3 до 5 ч при RT, затем хранят при -20 С до количественных измерений Ab и APP. Предварительные эксперименты показали, что аналиты устойчивы при таких условиях хранения и что синтетический Аb-белок (Bachem) можно количественно регенерировать при впрыскивании (введении) в гомогенаты контролируемой ткани головного мозга мышиного помта (JohnsonWood et al., см. выше). 5. Измерение уровней Ab. Гомогенаты головного мозга разводят 1:10 ледяным казеиновым разбавителем (0,25% казеина, PBS,0,05% азида натрия, 20 мкг/мл апротинина, 5 мМ EDTA рН 8,0, 10 мкг/мл лейпептина) и затем центрифугируют при 16000 об./мин в течение 20 мин при 4 С. Готовят стандарты синтетических Аb-белков (1-42 аминокислоты) и АРР-стандарты, включающие в конечный состав 0,5 M гуанидина и 0,1% бычьего сывороточного альбумина (BSA). Сэндвич-ELISA "тотального" Ab использует моноклональное антитело(mАb) 266, специфическое относительно аминокислот 13-28 белка Ab (Seubert et al.,) в качестве иммобилизованного антитела, и биотинилированное mАb 3D6, специфическое в отношении аминокислот 1-5 Ab(JohnsonrWood et al.) в качестве антитела-репортра. 3D6 mАb не распознает секретируемые APP или непроцессированные APP, но обнаруживает только вид Ab с аспарагиновой кислотой на N-конце. Этот анализ имеет нижний предел чувствительности 50 нг/мл (11 пМ) и не проявляет перекрстной реактивности относительно эндогенного мышиного Аb-белка при концентрации вплоть до 1 нг/мл (JohnsonWood et al., см. выше).
МПК / Метки
МПК: A61P 25/28, A61K 38/00, A61K 9/26
Метки: амилоидогенного, лечение, предотвращение, заболевания
Код ссылки
<a href="https://eas.patents.su/30-7218-predotvrashhenie-i-lechenie-amiloidogennogo-zabolevaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Предотвращение и лечение амилоидогенного заболевания</a>
Предыдущий патент: Пептиды, полученные из казеина, и их применение в терапии
Следующий патент: Производные 3-гетероарил-3, 5-дигидро-4-оксо-4н-пиридазино[4,5-b]индол-1-ацетамида, их получение и применение в качестве лекарств
Случайный патент: Перфорируемое закупоривающее устройство для ёмкости, форма и способ для его изготовления