Пентациклическое соединение
Номер патента: 701
Опубликовано: 28.02.2000
Авторы: Терасава Хирофуми, Сога Тсунехико, Исияма Такаси
Формула / Реферат
1. Соединение, представленное следующей общей формулой (I), или его соль

где R1 представляет собой фенильную группу, которая может иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, алкильной группы и алкоксильной группы;
R2 представляет собой алкильную группу, алкенильную группу, алкинильную группу, циклоалкильную группу или алкоксильную группу, в которых эти алкильная, алкенильная, алкинильная, циклоалкильная и алкоксильная группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкоксильной группы, арилоксигруппы, фенильной группы, аминогруппы, алкиламиногруппы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы;
R3 представляет собой атом водорода, гидроксильную группу, атом галогена, алкоксильную группу, группу -O-R31, ацилоксигруппу или группу -O-CO-R31, в которых алкоксильная и ацилоксигруппы могут иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, циклоалкильной группы, алкоксильной группы, арильной группы, арилоксигруппы, аминогруппы, алкиламиногруппы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы, ацилоксигруппы и гетероциклической группы (гетероциклическая группа может содержать одну или несколько алкильных групп на атомах, составляющих ее кольцо),
где R31 представляет собой алкиламиногруппу, алкенильную группу, алкинильнуго группу, циклоалкильную группу, арильную группу или гетероциклическую группу, в которых эти алкиламино, алкенильная, алкинильная, циклоалкильная, арильная и гетероциклическая группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, арилоксигруппы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы, ацилоксигруппы и азотсодержащей гетероциклической группы, имеющей размер трех- - восьмичленного кольца (азотсодержащая гетероциклическая группа может иметь одну или несколько алкильных групп на атомах, составляющих ее кольцо), или
R3 может образовывать трехчленное кольцо вместе с метильной группой, связанной с углеродным атомом, соседним с атомом углерода, к которому присоединен R3;
каждый из R4 и R5 представляет собой атом водорода, алкильную группу, алкенильную группу, алкинильную группу, арильную группу или гетероциклическую группу, в которой эти алкильная, алкенильная, алкинильная, арильная группа или гетероциклическая группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из алкоксильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы и азотсодержащей насыщенной гетероциклической группы, имеющей размер пяти- или шестичленного кольца, представленного следующей формулой
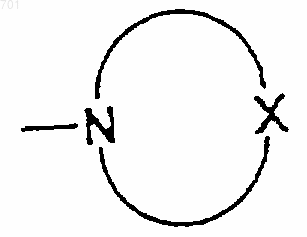
где Х представляет собой атом кислорода, атом серы, СН2, CH-Y, NH или N-Y, в которых Y представляет собой алкильную группу,
(указанная гетероциклическая группа может иметь одну или несколько алкильных групп на углеродном атоме, являющемся составным атомом ее кольца),
или R4 и R5 могут образовывать тиокарбонильную группу или карбонильную группу вместе со связанным с ними углеродным атомом;
Z1 представляет собой атом водорода, гидроксильную группу, атом галогена или алкильную группу;
Z2 представляет собой атом водорода, гидроксильную группу, атом галогена или алкильную группу;
Z3 представляет собой алкильную группу, алкенильную группу, алкинильную группу, циклоалкильную группу, арильную группу или гетероциклическую группу, в которых эти алкильная, алкенильная, алкинильная, циклоалкильная, арильная и гетероциклическая группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы;
а Z4 представляет собой алкильную группу, арильную группу или алкоксильную группу, в которых эти алкильная, арильная и алкоксильная группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы;
при условии, что пунктирная линия в следующем радикале:

обозначает тот факт, что соответствующая связь в таком радикале может представлять собой двойную связь, но в этом случае R3 не является гидроксильной группой.
2. Соединение или его соль по п.1, отличающееся тем, что Z1 и Z2 представляют собой атом фтора.
3. Соединение или его соль по п.1, отличающееся тем, что Z1 представляет собой гидроксильную группу, а Z2 обозначает атом водорода.
4. Соединение или его соль по п.1, отличающееся тем, что Z1 представляет собой гидроксильную группу, а Z2 обозначает метильную группу.
5. Соединение или его соль по п.1, отличающееся тем, что Z4 представляет собой фенильную группу.
6. Соединение или его соль по п.1, отличающееся тем, что Z4 представляет собой трет-бутоксигруппу.
7. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой фенильную группу.
8. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой гетероциклическую группу, имеющую размер моноциклического пяти- или шестичленного кольца.
9. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой гетероциклическую группу, имеющую размер моноциклического пяти- или шестичленного кольца и содержащую один атом кислорода, азота или серы в качестве составляющего атома кольцевой структуры.
10. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой ненасыщенную гетероциклическую группу, имеющую размер моноциклического пяти- или шестичленного кольца и содержащую один атом кислорода, азота или серы в качестве составляющего атома кольцевой структуры.
11. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой фурильную группу, пирролильную группу или пиридильную группу.
12. Соединение или его соль по п.1, отличающееся тем, что Z3 представляет собой 2-метил-1-пропенильную группу.
13. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой алкильную группу.
14. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой метильную группу, этильную группу или пропильную группу.
15. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой алкоксильную группу.
16. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой метоксигруппу или этоксигруппу.
17. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой циклоалкильную группу.
18. Соединение или его соль по п.1, отличающееся тем, что R2 представляет собой циклопропильную группу.
19. Соединение или его соль по п.1, отличающееся тем, что R4 или R5 представляет собой алкильную группу или атом водорода.
20. Соединение или его соль по п.1, отличающееся тем, что R4 или R5 представляет собой алкильную группу, алкенильную группу или фенильную группу, в которых эти указанные алкильная, алкенильная или фенильная группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из карбоксила, алкоксила, арилокси, алкоксикарбонила, арилоксикарбонила, циано, гидроксила, амино, алкиламино, ацила, ациламино, ацилокси, алкоксикарбониламино, алкилтио, алкилсульфинила, алкилсульфонила и азотсодержащей насыщенной гетероциклической группы, имеющей размер пяти- или шестичленного кольца, представленного следующей формулой

где Х представляет собой атом кислорода, атом серы, СН2, CH-Y, NH или N-Y, где Y представляет собой алкильную группу (указанная гетероциклическая группа может содержать одну или несколько алкильных групп науглеродном атоме, являющемся составным атомом ее кольца).
21. Соединение или его соль по п.20, отличающееся тем, что заместитель указанной алкильной, алкенильной или фенильной группы R4 или R5 представляет собой аминогруппу, алкиламиногруппу или азотсодержащую насыщенную гетероциклическую группу, имеющую размер пяти- или шестичленного кольца, представленного следующей формулой
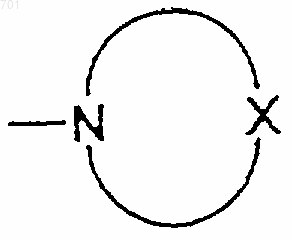
где Х представляет собой атом кислорода, атом серы, СН2, CH-Y, NH или N-Y, где Y представляет собой алкильную группу (указанная гетероциклическая группа может содержать одну или несколько алкильных групп на углеродном атоме, являющемся составным элементом ее кольца).
22. Соединение или его соль по п.21, отличающееся тем, что указанная азотсодержащая насыщенная гетероциклическая группа, имеющая размер пяти- или шестичленного кольца, представляет собой группу, производную морфолина, тиоморфолина, пиперазина или 4-алкилпиперазина.
23. Соединение или его соль по п.1, отличающееся тем, что R3 представляет собой гидроксильную группу, атом водорода или атом фтора.
24. Соединение или его соль по п.1, отличающееся тем, что R3 образует трехчленное кольцо вместе с метильной группой, связанной с углеродным атомом, соседним с атомом углерода, к которому присоединен R3.
Текст
1 Область техники Настоящее изобретение относится к новому производному таксола, обладающему противоопухолевой активностью. Описание уровня техники Таксол представляет собой природное соединение, имеющее следующую химическую структуру, которое может быть получено в небольших количествах из ствола и других частей Известно, что таксол обладает противоопухолевой активностью и что механизм его действия основан на деполимеризационноингибирующем действии микротрубочек в процессе деления клеток, вследствие чего можно предполагать в нем противоопухолевое средство, которое отличается от обычных противоопухолевых средств. Хотя таксол может быть получен из природного источника в чрезвычайно небольшом количестве, недавно опубликовано сообщение о синтезе производных таксола с использованием в качестве исходного продукта 10-Oдеацетилбаккатина III, представленного следующей структурной формулой:(1) который является предшественником таксола и может быть получен в относительно большом количестве из листьев и т.п. таксаковых (taxaceous) деревьев ( см. JP-A-3-505725; используемое в тексте сокращение "JР-А" обозначает"не прошедшую экспертизу опубликованную заявку на патент Японии"). Среди таких производных особое внимание было обращено на соединение (Taxotere), представленное следующей структурной формулой:(2) как на соединение, которое обладает аналогичной или более высокой противоопухолевой ак 000701 2 тивностью, чем таксол, и это соединение в настоящее время находится на стадии разработки противоопухолевого средства на его основе. Хотя таксол и Taxotere являются многообещающими соединениями в качестве противоопухолевых средств, при их клинических испытаниях было обнаружено, что они обладают низкой эффективностью в отношении раковых заболеваний пищеварительных органов, особенно раковых заболеваний толстой кишки,вследствие чего очень большой интерес вызывают работы, направленные на создание производного, обладающего более сильными противоопухолевыми эффектами. Сущность изобретения В положении 9 производных таксола обычно находится кетогруппа, однако, также известны некоторые производные, в которых это положение восстановлено. Соединение, содержащее гидроксильную группу в положении 9, находящуюся в -конфигурации, было получено из природного источника, и имеются сообщения о различных производных с гидроксильной группой в положении 9, полученных химической модификацией такого соединения (см., например, J. Med. Chem., 37, 2655(1994. Известно также, что соединение,имеющее гидроксильную группу в положении 9,находящуюся в -конфигурации, может быть химически синтезировано путем восстановления 10-O-деацетил-баккатина III с использованием восстанавливающего агента, и имеются сообщения о различных производных такого типа, содержащих -гидроксильную группу в положении 9, полученных химической модификацией такого соединения (см., например, WO 94/20088). В результате широкого исследования авторы настоящего изобретения обнаружили, что противоопухолевая активность указанных выше производных таксола с -гидроксильной группой в положении 9 резко увеличивается, когда гидроксильную группу в положении 9 и гидроксильную группу в положении 10 преобразуют в циклическую ацетальную группу. Настоящее изобретение сделано на основе такого открытия. В соответствии с этим, настоящее изобретение относится к соединению, представленному следующей общей формулой (I), или его соли:R1 представляет фенильную группу, которая может иметь один или несколько заместителей, выбранных из группы, состоящей из атома галогена, алкильной группы и алкоксильной группы;R2 представляет собой алкильную группу,алкенильную группу, алкинильную группу,циклоалкильную группу или алкоксильную группу, в которых эти алкильная, алкенильная,алкинильная, циклоалкильная и алкоксильная группы могут содержать один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкоксильной группы, арилоксигруппы, фенильной группы, аминогруппы,алкиламиногруппы,алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы;R3 представляет собой атом водорода, гидроксильную группу, атом галогена, алкоксильную группу, группу -O-R31, ацилоксигруппу или группу -O-CO-R31, в которых алкоксильная и ацилоксигруппы могут содержать один или несколько заместителей, выбранных из группы,состоящей из атома галогена, гидроксильной группы, карбоксильной группы, циклоалкильной группы, алкоксильной группы, арильной группы, арилоксигруппы, аминогруппы, алкиламиногруппы, алкоксикарбонильной группы,арилоксикарбонильной группы, ацильной группы, ациламиногруппы, ацилоксигруппы и гетероциклической группы (гетероциклическая группа может содержать одну или несколько алкильных групп на атомах, составляющих ее кольцо),где R31 представляет собой алкиламиногруппу, алкенильную группу, алкинильную группу, циклоалкильную группу, арильную группу или гетероциклическую группу, в которых эти алкиламино, алкенильная, алкинильная,циклоалкильная, арильная и гетероциклическая группы могут содержать один или несколько заместителей, выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, арилоксигруппы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы, ацилоксигруппы и азотсодержащей гетероциклической группы, которая имеет размер в интервале от трех- до восьмичленного кольца (такая азотсодержащая гетероциклическая группа может содержать одну или несколько алкильных групп на атомах, составляющих ее кольцо),или R3 может образовывать трехчленное кольцо вместе с метильной группой, связанной с атомом углерода, соседним с углеродным атомом, с которым связан R3;R4 и R5, каждый, представляют собой атом водорода, алкильную группу, алкенильную группу, алкинильную группу, арильную группу или гетероциклическую группу, в которых эти алкильная, алкенильная, алкинильная, арильная и гетероциклическая группы могут иметь один или несколько заместителей, выбранных из группы, состоящей из алкоксильной группы,аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы и азотсодержащей насыщенной гетероциклической группы, имеющей размер пяти- или шестичленного кольца, представленного следующей формулой: где Х представляет собой атом кислорода, атом серы, CH2, CH-Y, NH или N-Y, в котором Y представляет собой алкильную группу, (гетероциклическая группа может иметь одну или несколько алкильных групп на атоме углерода,являющемся составным атомом ее кольца),или R4 и R5 могут образовывать тиокарбонильную группу или карбонильную группу вместе с присоединенным атомом углерода;Z1 представляет собой атом водорода, гидроксильную группу, атом галогена или алкильную группу;Z2 представляет собой атом водорода, гидроксильную группу, атом галогена или алкильную группу;Z3 представляет собой алкильную группу,алкенильную группу, алкинильную группу,циклоалкильную группу, арильную группу или гетероциклическую группу, в которых эти алкильная, алкенильная, алкинильная, циклоалкильная, арильная и гетероциклическая группы могут иметь один или несколько заместителей,выбранных из группы, состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы, алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы; аZ4 представляет собой алкильную группу,арильную группу или алкоксильную группу, в которых эти алкильная, арильная и алкоксильная группы могут иметь один или несколько заместителей, выбранных из группы,состоящей из атома галогена, гидроксильной группы, карбоксильной группы, алкильной группы, алкоксильной группы, фенильной группы, аминогруппы, алкиламиногруппы, аминоалкильной группы, алкиламиноалкильной группы,алкоксикарбонильной группы, арилоксикарбонильной группы, ацильной группы, ациламиногруппы и ацилоксигруппы; 5 при условии, что пунктирная линия в следующем радикале: обозначает, что соответствующая связь в радикале может представлять собой двойную связь,но в таком случае R3 не является гидроксильной группой. Кроме этого, настоящее изобретение относится к соединению, имеющему конфигурацию,представленную следующей общей формулой"C1-C6" обозначает 1-6 углеродных атомов, например, определение "C2-C6 алкенильная группа" обозначает алкенильную группу, содержащую 2-6 углеродных атомов. Каждый из терминов "алкильная группа","алкенильная группа" и "алкинильная группа" может обозначать группу с прямой или разветвленной цепью, предпочтительно, содержащую от 1 углеродного (2 углеродных атома в случае алкенильной и алкинильной групп) до 6 атомов углерода. Термин "алкоксильная группа" обозначает группу, в которой алкильная группа связана с-О-, причем алкильная группа может быть замещена такой фенильной группой (которая может иметь заместитель), как бензилокси, фенетилокси, п-метоксибензилокси и аналогичные группы. Предпочтительной является алкильная группа, содержащая 1-6 углеродных атомов. Термин "алкоксикарбонильная группа" обозначает группу, в которой алкильная группа связана с атомом кислорода группы -СОО-, и алкильная группа может быть замещена фенильной группой (которая может иметь заместитель), такой как бензилоксикарбонил, фенетилоксикарбонил, п-метоксибензил-оксикарбонил и аналогичными группами. Предпочтительной является алкильная группа, содержащая 1-6 углеродных атомов. Термин "арильная группа" обозначает моновалентную группу, в которой атом водорода удален из ядра ароматического углеводорода,такую как фенил, толил, бифенил, нафтил и аналогичные группы. В "аминоалкильной группе" аминогруппа может быть присоединена по любому положе 000701 6 нию алкильной группы, и алкильная группа,предпочтительно, содержит 1-6 углеродных атомов. Термин "алкиламиногруппа" обозначает группу, в которой аминогруппа замещена одной алкильной группой, или группу, в которой аминогруппа замещена двумя алкильными группами (две алкильные группы могут иметь одинаковые или различные значения). Предпочтительно, такая алкильная группа содержит 1-6 углеродных атомов. Термин "ацильная группа" обозначает группу, в которой атом водорода, алкильная группа или арильная группа связаны с карбонильной группой (-СО-) таких групп, как формил, ацетил, пропаноил, бензоил и аналогичные группы. В этом случае связываемая алкильная группа, предпочтительно, содержит 1-6 углеродных атомов, а предпочтительной связываемой арильной группой является фенильная группа. Термин "гетероциклическая группа" обозначает заместитель, содержащий один или ряд из, по крайней мере, одного атома, выбранного из группы, состоящей из атома кислорода, атома азота и атома серы, и такая группа является производной моноциклического или бициклического, насыщенного или ненасыщенного, гетероциклического соединения, причем такие гетероциклические группы могут быть присоединены по любому положению заместителя. Примерами моноциклической гетероциклической группы могут служить заместители, являющиеся производными таких моноциклических гетероциклических соединений, как пиррол, фуран, тиофен, пирролидин, тетрагидрофуран, тетрагидротиофен, имидазол, пиразол,имидазолидин, пиразолидин, оксазол, тиазол,оксадиазол, тиадиазол, пиридин, дигидропиридин, тетрагидропиран, пиперидин, пиридазин,пиримидин, пиразин, пиперазин, диоксан, пиран, морфолин и т. п. Примеры бициклической гетероциклической группы включают заместители, являющиеся производными таких бицик Термин "азотсодержащая гетероциклическая группа" обозначает заместитель, являющийся производным насыщенного или ненасыщенного гетероциклического соединения, которое всегда содержит один атом азота в качестве атома в составе гетероциклической группы и может также содержать один или ряд атомов,выбранных из атома кислорода, атома азота и атома серы в качестве других составляющих атомов. Примерами такой группы могут служить пиррол, пирролидин, имидазол, пиразол,имидазолидин, пиразолидин, оксазол, тиазол,оксадиазол, тиадиазол, пиридин, дигидропири 7 дин, пиперидин, пиридазин, пиримидин, пиразин, пиперазин, морфолин, тиоморфолин и т. п. Фраза "азотсодержащая насыщенная гетероциклическая группа, имеющая размер пятиили шестичленного кольца, представленного следующей формулой: где Х представляет собой атом кислорода, атом серы, СН 2, CH-Y, NH или N-Y, в котором Y представляет собой алкильную группу (гетероциклическая группа может содержать одну или несколько алкильных групп на углеродных атомах, являющихся составляющими атомами ее кольца)", означает заместитель, являющийся производным насыщенного гетероциклического соединения, которое всегда содержит один атом азота в составе гетероциклической группы и имеет размер пяти- или шестичленного кольца,и примерами такого соединения могут служить пирролидин, имидазолидин, пиразолидин, оксазолидин, тиазолидин, изооксазолидин, изотиазолидин, пиперидин, пиперазин, морфолин,тиоморфолин и т. п. Фраза "R3 может образовывать трехчленное кольцо вместе с метильной группой, связанной с углеродным атомом, соседним с атомом углерода, к которому присоединен R3", означает, что радикалы в положениях 7- и 8- образуют следующую структуру: Далее приводится описание каждого заместителя для общей формулы (I). Предпочтительными примерами "алкильной группы" и "алкоксильной группы" в качестве заместителей фенильной группы в R1 являются группы, содержащие 1-3 углеродных атомов. Число заместителей фенильной группы вR1, предпочтительно, равно 1 или 2, и такой заместитель, предпочтительно, находится в метаположении. Предпочтительно, когда R1 представляет собой незамещенную фенильную группу. Также предпочтительной является фенильная группа,содержащая 1 или 2 атома фтора, атома хлора,метильных групп или метоксигрупп, замещенная в мета-положении. Предпочтительными значениями R2 являются алкильная группа, алкоксильная группа и циклоалкильная группа. В качестве "алкильной группы" для R2 предпочтительной является C1-C6 алкильная группа, и особенно предпочтительными являются метильная группа, этильная группа и пропильная группа. В качестве "алкоксильной группы" для R2 предпочтительной является C1-С 6 алкоксильная 8 группа, и особенно предпочтительными являются метоксигруппа и этоксигруппа. В качестве "циклоалкильной группы" дляR2 предпочтительной является С 3-С 6 циклоалкильная группа, и особенно предпочтительной является циклопропильная группа. Особенно предпочтительными значениямиR2 являются метильная группа, этильная группа,пропильная группа, метоксигруппа, этоксигруппа или циклопропильная группа. Предпочтительным значением "атома галогена" в определении для R3 является атом фтора. Особенно предпочтительными значениямиR3 являются атом водорода, атом фтора или гидроксильная группа. Также предпочтительным значением R3 является группа, в которой трехчленное кольцо образуется вместе с метильной группой, связанной с атомом углерода(положение 8), находящимся по соседству с углеродным атомом (положение 7), к которому присоединен R3, а именно, группа, в которой 7 и 8-фрагменты имеют следующую структуру: Предпочтительными значениями алкильных групп для R4 и R5 являются группы, содержащие 1-6 углеродных атомов, и особенно предпочтительными являются метильная группа, этильная группа и пропильная группа. Предпочтительными значениями алкенильных групп для R4 и R5 являются группы,содержащие 2-6 углеродных атомов, и особенно предпочтительной является аллильная группа. В качестве заместителей алкильной, алкенильной или фенильной групп для R4 и R5 предпочтительными являются аминогруппа, алкиламиногруппа или азотсодержащая насыщенная гетероциклическая группа, имеющая размер пяти- или шестичленного кольца, представленного следующей формулой: где Х представляет собой атом кислорода, атом серы, СН 2, CH-Y, NН или N-Y, в котором Y представляет собой алкильную группу (гетероциклическая группа может иметь одну или несколько алкильных групп на атоме углерода,являющемся составляющим атомом ее кольца). Алкильный радикал алкиламиногруппы,предпочтительно, представляет собой C1-С 3 алкильную группу, и он может быть диалкилзамещенным (в случае диалкилзамещения две такие алкильные группы могут иметь одинаковые или различные значения). В качестве азотсодержащей насыщенной гетероциклической группы, имеющей размер пяти- или шестичленного кольца, представленного следующей формулой:(гетероциклическая группа может содержать одну или несколько алкильных групп на углеродном атоме, являющемся атомом, составляющим ее кольцо), особенно предпочтительными являются группы, являющиеся производными пиперазина, морфолина, тиоморфолина, 4-C1-C3 алкилпиперазина. Метильная группа является предпочтительным примером алкильной группы, подлежащей замещению на атоме углерода, являющемся атомом в составе ядра гетероциклической группы. Предпочтительным примером R4 и R5 является сочетание, в котором один радикал представляет собой атом водорода или алкильную группу, а другой - алкильную группу, алкенильную группу или фенильную группу. Предпочтительными примерами "атома галогена" в определении для Z1 и Z2 являются атом фтора, атом хлора и атом брома. Предпочтительными примерами "алкильной группы" в определении для Z1 и Z2 являются метильная группа, этильная группа и пропильная группа. Предпочтительными значениями для Z1 являются атом галогена и гидроксильная группа и особенно предпочтительным атомом галогена является атом фтора. Предпочтительными значениями для Z2 являются атом галогена, атом водорода или алкильная группа, причем особенно предпочтительным значением атома галогена является атом фтора, а особенно предпочтительным значением алкильной группы является метильная группа. Самые предпочтительные примеры Z1 и Z2 включают сочетание, в котором Z1 представляет собой атом фтора, и Z2 атом фтора, сочетание, в котором Z1 представляет собой гидроксильную группу, а Z2 атом водорода, и сочетание, в котором Z1 представляет собой гидроксильную группу, а Z2 метильную группу. Предпочтительными примерами Z3 могут служить арильная группа, гетероциклическая группа и алкенильная группа. Предпочтительным значением "арильной группы" в определении для Z3 является фенильная группа. Предпочтительным примером "алкенильной группы" в определении для Z3 является 2 метил-1-пропенил. Предпочтительным примером гетероциклической группы для Z3 является моноциклическая гетероциклическая группа, более предпочтительно, моноциклическая пяти- или шестичленная гетероциклическая группа, такая как пиррол, фуран, тиофен, пирролидин, тетрагидрофуран, тетрагидротиофен, имидазол, пиразол, 000701 10 имидазолидин, пиразолидин, оксазол, тиазол,оксадиазол, тиадиазол, пиридин, дигидропиридин, тетрагидропиран, пиперидин, пиридазин,пиримидин, пиразин, пипераэин, диоксан, пиран, морфолин и т. п. Среди гетероциклических групп, входящих в определение для Z3, более предпочтительной является моноциклическая гетероциклическая группа с пяти- или шестичленным кольцом, содержащая один атом кислорода, атом азота или атом серы в качестве атома, входящего в состав кольцевой структуры, и примеры такой группы включают группы, являющиеся производными пиррола, фурана, тиофена, пирролидина, тетрагидрофурана, тетрагидротиофена, пиридина,дигидропиридина, тетрагидропирана, пиперидина, пирана и т. п. Среди гетероциклических групп, входящих в определение для Z3, наиболее предпочтительной является моноциклическая ненасыщенная гетероциклическая группа с пяти- или шестичленным кольцом, содержащая один атом кислорода, атом азота или атом серы в качестве атома, входящего в состав кольцевой структуры,и примеры такой группы включают группы,являющиеся производными фурана, пиридина и пиррола. Особенно предпочтительными значениямиZ3 являются 2-метил-1-пропенильная группа,фенильная группа, фурильная группа, пиридильная группа и пирролильная группа. Предпочтительными значениями Z4 являются арильная группа или алкоксильная группа. Предпочтительным примером "арильной группы" в определении для Z4 является фенильная группа. Предпочтительной "алкоксильной группой" для Z4 является трет-бутоксигруппа. Особенно предпочтительными значениямиZ4 являются фенильная группа и третбутоксигруппа. Предпочтительно, соединение настоящего изобретения может иметь следующую конфигурацию: Конфигурация 3'-положения, к которому присоединен заместитель Z3, может быть любой из двух конфигураций, но, предпочтительно,она является такой же, что у природного таксола. Положение 7 также может иметь - или конфигурацию. 11 Производное таксола согласно настоящему изобретению может быть в свободном состоянии, а также в виде соли присоединения кислот или соли карбоновых кислот. Примерами соли присоединения кислот могут служить такие соли неорганических кислот, как гидрохлорид,сульфат, нитрат, гидробромат, гидроиодат,фосфат и т. п., а также такие соли органических кислот, как ацетат, метансульфонат, бензолсульфонат, толуолсульфонат, цитрат, малеат,фумарат, лактат и т. п. Примерами солей карбоновых кислот могут служить как неорганические соли, так и органические соли, включающие такие соли щелочных металлов, как литиевую соль, натриевую соль, калиевую соль и т. п., такие соли щелочноземельных металлов, как соль магния,соль кальция и т. п., а также аммониевую соль,соль триэтиламина, соль N-метилглюкамина,соль трис(гидроксиметил)аминометана и т. п. Далее описывается способ получения соединения настоящего изобретения. При практической реализации реакции заместители, если это желательно, могут быть защищены с помощью защитных групп, причем последовательность преобразования каждого заместителя не имеет решающего значения. В приведенной выше схеме реакций R13 обозначает радикал R3 как таковой, или R3, защищенный с помощью защитной группы (в том случае, когда R3 замещен гидроксильной группой, аминогруппой и т. п., или когда R3 представляет собой гидроксильную группу);R14 обозначает R4, как таковой, или R4, защищенный защитной группой (в том случае,когда R4 замещен аминогруппой или т. п.);R15 обозначает R5, как таковой, или R5, защищенный защитной группой (в том случае,когда R5 замещен аминогруппой или аналогичными группами);Z11 обозначает Z1, как таковой, или Z1, защищенный защитной группой (в том случае,когда 21 представляет собой гидроксильную группу);Z21 обозначает Z2, как таковой, или Z2, защищенный защитной группой (в том случае,когда Z2 представляет собой гидроксильную группу);Z31 обозначает Z3, как таковой, или Z3, защищенный защитной группой (в том случае,когда Z3 замещен гидроксильной группой, аминогруппой или т. п.); иZ41 обозначает Z4, как таковой, или Z4, защищенный защитной группой (в том случае,когда Z4 замещен гидроксильной группой, аминогруппой или т. п.). Радикалы R8 и R9, независимо друг от друга, представляют собой атом водорода, алкильную группу, арильную группу и т. п. и, в предпочтительном сочетании, оба радикала являются метильными группами или один из них представляет собой п-метоксифенильную группу, а другой - атом водорода. Радикалы R10 и R11 представляют собой защитные группы гидроксильной группы. Соединение (3) получают взаимодействием соединения (2), являющегося производным 10-O-деацетилбаккатина III (соединение (1, с альдегидом или кетоном, представленным формулой R14C(=O)R15, или с ацеталем, представленным формулой R14R15C(OR45)2 (R45 представляет собой метил или любую алкильную группу) в присутствии такого кислотного катализатора, как 10-камфорсульфокислота, п-толуолсульфокислота или т. п. Далее, соединение (4) получают конденсацией гидроксильной группы в положении 13 соединения (3) с соединением(А), (В) или (С), в соответствии с приемлемым обычным способом, известным из литературы. Известен способ осуществления реакции конденсации с соединением (А) или (В), согласно которому такой агент, активирующий карбоновую кислоту, как ди(2-пиридил)карбонат или дициклогексилкарбодиимид, используют в присутствии 4-диметиламинопиридина или аналогичного основного катализатора. В этой связи следует отметить, что при использовании соединения (А), Z11 и Z21 становятся сочетанием атома водорода и гидроксильной группы. Известен способ осуществления реакции конденсации с соединением (С), согласно которому используют гексаметилдисилазид натрия или аналогичное основание. В некоторых случаях на этой стадии реакции соединение (А), (В) или (С) будет реагировать с гидроксильной группой в положении 7 соединения (3). В таких случаях целевой продукт может быть выделен и очищен методом хроматографии на колонке с силикагелем или с помощью аналогичных приемов. С другой стороны, поскольку соединение (5), в которое защитная группа введена селективно в положение 13 7 соединения (3), может быть получено путем выбора подходящей защитной группы и условий проведения реакции (особенно высокая селективность достигается в. случае использования защитной группы карбаматного типа, например, положение 7 может быть селективно защищено 2,2,2-трихлорэтоксикарбонильной группой при проведении реакции с 2,2,2 трихлорэтоксикарбонил хлоридом в среде пиридина при 0 С), соединение (4) может быть синтезировано конденсацией гидроксильной группы в положении 13 такого соединения (5) с соединением (А), (В) или (С), которую проводят тем же способом, что описан выше. Соединение(5) может быть также получено другим способом, согласно которому гидроксильную группу в положении 13 соединения (3) преобразуют в кетонную группу, с использованием диоксида марганца или аналогичного ему окисляющего агента, защитную группу вводят в гидроксильную группу, находящуюся в положении 7 полученного в результате соединения, с получением соединения (6), после чего кетонную группу в положении 13 снова восстанавливают в гидроксильную группу с использованием боргидрида натрия или аналогичного восстанавливающего агента. После введения или снятия защитной группы с каждой замещающей группы полученного таким образом соединения (4), в зависимости от обстоятельств, целевое соединение (1) может быть получено путем преобразования бензоильной группы в положении 2 в COR1,ацетильной группы в положении 4 в COR2, гидроксильной группы в положении 7 в R3 и R14,R15, Z11, Z21, Z31 и Z41 в R4, R5, Z1, Z2, Z3 и Z4,соответственно. Такое преобразование и снятие защитной группы могут осуществляться с использованием общих методов органической химии, описанных в следующих ниже примерах. Преобразование бензоильной группы в положении 2 в COR1 может осуществляться, например, в соответствии со способом, описанным в литературе (Tetrahedron Letter, 35, 8931(1994, согласно которому сложноэфирная связь в положении 2 подвергается селективному гидролизу и затем ацилируется, в результате чего получают соединение, в котором R1 не является фенильной группой и имеет другие значения. Преобразование ацетильной группы в положении 4 в группу COR2 может осуществляться, например, в соответствии со способом, в котором взаимодействие с соединением, представленным формулой R21-X (где R21 представляет собой алкильную группу, алкенильную группу или арильную группу, а Х представляет собой такой атом галогена, как атом иода, атом брома и т. п., или такую уходящую группу, как метансульфонильная группа, п-толуолсульфонильная группа и т. п.), проводят в присутствии гексаметилдисилазида натрия или аналогичного 14 основания, при температуре в интервале от 100 С до комнатной температуры, в результате чего получают соединение, в котором R2 имеет значение, отличное от метильной группы. Соединение, в котором R2 имеет значение,отличное от метильной группы, может быть также получено взаимодействием соединения(6) с соединением, отвечающим формуле R21-X,в присутствии гексаметилдисилазида натрия или аналогичного основания с получением соединения, в котором ацетильная группа в положении 4 преобразована в COR2, с последующим восстановлением гидроксильной группы в положении 13 и в заключение, проведением реакции конденсации с соединением (А), (В) или(С). Преобразование гидроксильной группы в положении 7 в группу R3 может быть осуществлено различными методами в зависимости от типа R3. Соединение, в котором R3 представляет собой водород, может быть получено удалением гидроксильной группы в положении 7 с помощью известного способа (см., например, J. Org.R3 представляет собой -OC(=O)R31, может быть получено ацилированием гидроксильной группы в положении 7 с использованием карбоновой кислоты или хлорангидрида, основываясь на общих методах органической химии. Соединение, в котором R3 представляет собой-OC(=O)NQ1Q2 (где Q1 и Q2, независимо друг от друга, представляют собой атом водорода или алкильную группу), может быть получено с помощью способа, в котором осуществляют взаимодействие гидроксильной группы в положении 7 с соединением, представленным формулойClC(=O)OR32 (в которой R32 представляет собой п-нитрофенильную или аналогичную арильную группу), и затем с амином, с фосгеном в присутствии амина, с соединением, отвечающим формуле ClC(=O)NQ1Q2 (в которой Q1 и Q2, независимо друг от друга, представляют собой атом водорода или алкильную группу), или с изоцианатом формулы R31N=C=O. Преобразование в целевой радикал R3 может быть также осуществлено путем преобразования гидроксильной группы в положении 7 с последующей органохимической конверсией, проводимой в несколько стадий. Согласно другому способу, соединение (9) получают путем защиты гидроксильной группы в положении 13 соединения (5) с помощью защитной группы R11, которая может отличаться от защитной группы R10, удаления R10 с получением соединения (8), преобразования гидроксильной группы в положении 7 соединения (8) в R13, которое осуществляют тем же способом,что описан выше, и последующего удаления защитной группы R11. Затем гидроксильную группу в положении 13 соединения (9) конденсируют с соединением (А), (В) или (С) и затем осуществляют преобразование и снятие защит 15 ной группы с различных замещающих групп с получением целевого соединения (1). В этой связи следует отметить, что соединение (8) может быть синтезировано непосредственно из соединения (3) путем выбора подходящей защитной группы R11 и условий проведения реакции, а соединение (9) может быть также синтезировано непосредственно из соединения (3) путем преобразования гидроксильной группы в положении 7. Целевое соединение, в котором R3 представляет собой атом галогена, например, соединение, в котором R3 - атом фтора, может быть получено путем обработки соединения с гидроксильной группой в положении 7 трифторидом диэтиламиносеры в среде тетрагидрофурана,метиленхлорида, этилового эфира, толуола, 1,1 диметоксиэтана или смеси таких растворителей. Соединение (8) может быть также синтезировано из соединения (D), которое получают из соединения (1). Так, например, гидроксильную группу в положении 13 соединения (D) защищают с помощью защитной группы R11, которая может отличаться от 2,2,2-трихлорэтоксикарбонильной группы, 2,2,2-трихлорэтоксикарбонильные группы в положениях 7 и 10 удаляют и затем полученное таким образом соединение обрабатывают таким восстанавливающим агентом, как боргидрид тетрабутиламмония или аналогичное соединение, с целью преобразования кетонной группы в положении 9 в гидроксильную группу, и проводят реакцию с альдегидом, кетоном или ацеталем тем же способом,что описан выше, в результате чего получают соединение (8). Следующие ниже соединения в качестве исходных продуктов могут быть синтезированы в соответствии с известными из литературы методами. Соединение (2): WO 94/20088 и другие методы. Соединение (D): Tetrahedron, 42, 4451(1986) и другие методы. Соединение (А): Tetrahedron Letter, 33,5185 (1992) и другие методы. Соединение (В): J. Am. Сhem, Soc., 110,5917 (1988) и другие методы. Соединение (С): Tetrahedron Letter, 34,4149 (1993) и другие методы. В указанных выше методах синтеза, в основном, получают соединения, в которых положение 7 имеет -конфигурацию. Поскольку известно, что конфигурация гидроксильной группы в положении 7 изомеризуется извв том случае, когда производное таксола, в котором положение 9 является кетогруппой, а положение 7 незащищено, обрабатывают основанием, соединение, имеющее -конфигурацию в положении 7, может быть синтезировано путем восстановления кетогруппы в положении 9 в гидроксильную группу после изомеризации. 16 Соединения настоящего изобретения могут применяться для лечения различных раковых заболеваний, таких как рак легких, рак пищеварительных органов, рак яичников, рак матки,рак молочной железы, рак печени, рак головы и шеи, рак крови, рак почек, тестикулярные опухоли и т.п. Соединения настоящего изобретения могут использоваться путем различных внутривенных,внутримышечных, подкожных и т.п. инъекций или различными другими путями, например,перорально, подкожной абсорбцией и т. п. Из этих применений желательно использовать внутривенную инъекцию растворами и пероральное применение. Такие растворы могут быть получены на основе кислоты с использованием фармакологически приемлемой кислоты,или соли щелочного металла на основе натрия и т. п. В случае перорального применения соединение может использоваться в свободном виде,или в виде соли. Приемлемый фармацевтический препарат выбирают в соответствии с каждым методом применения, и его готовят с использованием общепринятых препаративных методов. Примерами дозированных форм противоопухолевого средства по настоящему изобретению, предназначенных для перорального применения, могут служить таблетки, порошки, гранулы, капсулы,растворы, сиропы, эликсиры, масляные или водные суспензии и т. п. В случае инъекций в таком препарате могут использоваться стабилизирующие агенты, антисептики, растворяющие агенты и т. п. Препараты для инъекций, которые могут содержать такие вспомогательные агенты,можно распределять по контейнерам и переводить в твердую форму путем сушки замораживанием или с помощью аналогичных методов с тем, чтобы их можно было снова растворять перед применением. Жидкие препараты включают растворы,суспензии, эмульсии и т. п. и при приготовлении таких препаратов в качестве добавок могут использоваться суспендирующие агенты, эмульгирующие агенты и т. п. Соединение по настоящему изобретению может использоваться для лечения раковых заболеваний у млекопитающих, особенно у человека. В случае применения на людях предпочтительно применять препарат один раз в день с повторением приема через определенные промежутки времени. Препарат может применяться с дозировкой 0,5-50 мг, предпочтительно, 1-20 мг, на 1 м 2 площади поверхности тела. Описание предпочтительной реализации Далее настоящее изобретение иллюстрируется более подробно с помощью справочных примеров и примеров, но следует иметь в виду,что настоящее изобретение не ограничивается этими примерами. Стадия 1. 9-10-Деацеаил-9-дигидробаккатин III. 6,98 г 10-Деацетилбаккатина III растворяли в смешанном растворителе, состоящем из 200 мл сухого метиленхлорида и 200 мл сухого 1,4 диоксана, и к полученному в результате раствору добавляли при комнатной температуре 12,89 г боргидрида тетрабутиламмония, после чего раствор перемешивали в течение 19 ч при этой же температуре. Реакционный раствор охлаждали до 0 С и нейтрализовали постепенным прибавлением по каплям 1 н. соляной кислоты. Этот раствор концентрировали при пониженном давлении с целью выпаривания большей части органических растворителей. Полученный в результате остаток смешивали с этилацетатом и водой и встряхивали для отделения органического слоя, после чего водный слой экстрагировали этилацетатом. Все органические слои промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; хлороформ:ацетон = 5:1 (об./об. с получением 4,794 г целевого соединения в виде белого твердого вещества.FAB Масс-спектр: 546 (М+) Стадия 2. 9-10-Деацетил-9-дигидро-9,10 О-изопропилиденбаккатин III. 0,4825 г Соединения, полученного на описанной выше стадии 1, растворяли в 4,8 мл сухого метиленхлорида и 4,8 мл сухого 1,4 диоксана и к полученному в результате раствору добавляли 0,54 мл 2,2-диметоксипропана и 19,9 мг камфорсульфокислоты при комнатной температуре и смесь выдерживали в течение 1 ч. Полученный раствор охлаждали до 0 С и путем добавления триэтиламина устанавливали рН 7 г после чего растворитель выпаривали в вакууме. Затем полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; хлороформ:ацетон = 5:1 (об./об. с получением 0,2949 г целевого соединения в виде белого твердого вещества.= 4,9 Гц), 7,49 (2 Н, т, J = 7,3 Гц), 7,59 (1 Н, т, J = 7,3 Гц), 8,13 (2 Н, д, J = 7,3 Гц). Стадия 3. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-(триизопропилсилилокси)пропионил]-10-деацетил-9-дигидро-9,10-О-изопропилиденбаккатин III. 49,8 мг Соединения, полученного выше на стадии 2, и 49,0 мг (3R,4R)-1-(третбутоксикарбонил)-4-(2-фурил)-3-(триизопропилсилилокси)азетидин-2-она растворяли в 3,4 мл сухого тетрагидрофурана, к которому затем прибавляли по каплям 1 н. гексаметилдисилазид натрия (тетрагидрофурановый раствор) при-58 С. Через 30 мин полученный в результате раствор смешивали с насыщенным водным раствором хлористого аммония при -50 С и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле= 4:1 (об./об. с получением 15,6 мг целевого соединения в виде бесцветного прозрачного сиропа.(1 Н, м), 4,31 (1H, д, J = 8,3 Гц), 4,39 (1H, д, J = 8,3 Гц), 4,68 (1H, шир. д, J = 6,8 Гц), 4,99 (1H, с),5,12 (1H, с), 5,23 - 5,34 (2 Н, м), 5,53 (1H, д, J = 7,3 Гц), 6,02 (1H, д, J = 4,9 Гц), 6,10 (1H, шир. т,J = 8,0 Гц), 6,25 (1H, J = 3,4 Гц), 6,34 (1H, дд, J = 3,4 Гц, 1,9 Гц), 7,37 (1H, д, J = 1,9 Гц), 7,48 (2 Н,т, J = 7,3 Гц), 7,59 (1H, т, J = 7,3 Гц), 8,12 (2 Н, д,J = 7,3 Гц). Стадия 4. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-гидроксипропионил]-10-деацетил-9-дигидро-9,10-O-изопропилиденбаккатин III. 44,3 мг Соединения, полученного на описанной выше стадии 3, растворяли в 2,21 мл сухого пиридина и полученный раствор перемешивали с 0,44 мл смеси гидрофторидпиридин при 0 С, системе давали нагреваться до комнатной температуры и затем перемешивали в течение 14 ч. Полученный в результате раствор смешивали с водой, охлажденной до 0 С, после чего проводили экстракцию этилацетатом. Органический слой промывали 1 н. соляной кислотой, насыщенным водным раствором 19 бикарбоната натрия и насыщенным раствором соли, в указанном порядке, и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле= 6:1 (об./об. с получением 33,9 мг целевого соединения в виде бесцветного прозрачного сиропа. Стадия 1. 9-10-Деацетил-9-дигидро-9,10 О-(4-метокси-бензилиден)баккатин III. Используя соединение, полученное на стадии 1 примера изобретения 1, проводили ту же реакцию, что описана для стадии 2 примера изобретения 1, за исключением того, что вместо 2,2-диметоксипропана использовали диметилацеталь 4-метоксибензальдегида, в результате чего получали целевое соединение в виде бесцветного прозрачного сиропа. 20 Используя в качестве исходного вещества соединение, полученное выше на стадии 1, тем же способом, что описан для стадии 3 примера 1, осуществляли взаимодействие указанного соединения с (3R,4R)-1-(трет-бутоксикарбонил)4-(2-фурил)-3-(триизопропилсилилокси)азетидин-2-оном, в результате чего получали целевое соединение в виде бесцветного прозрачного сиропообразного вещества.(1H, д, J = 2,0 Гц), 7,43 - 7,53 (4 Н, м), 7,59 (1H, т,J = 7,9 Гц), 8,02 (2 Н, д, J = 7,9 Гц). Стадия 3. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-гидроксипропионил]-10-деацетил-9-дигидро-9,10-О-(4-метоксибензилиден) баккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 2, осуществляли взаимодействие, следуя методике, описанной для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-13-O-Аллилоксикарбонил-10 деацетил-9-дигидро-9,10-O-изопропилиденбаккатин III. 98,6 мг Соединения, полученного на стадии 2 примера изобретения 1, растворяли в 4,0 мл тетрагидрофурана, к полученному в результате раствору при -78 С прибавляли по каплям 1,64 н. н-бутиллитий (гексановый раствор, 0,31 мл) и через 5 мин добавляли 0,025 мл аллилоксикарбонилхлорида. Через 30 мин полученный в результате раствор смешивали с насыщенным водным раствором хлористого аммония и смесь экстрагировали этилацетатом. Органические слои промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; гексан: этилацетат = 5:4 (об./об. с получением 52,8 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.= 4,8 Гц), 3,90 (1 Н, д, J = 7,8 Гц), 4,01 - 4,09 (1 Н,м), 4,26 (1H, д типа АВ, J = 8,3 Гц), 4,39 (1 Н, д типа АВ, J = 8,3 Гц), 4,56 (1H, д, J = 6,8 Гц),4,33-4,76 (2 Н, м), 5,11 (1 Н, м), 5,28 - 5,44 (2 Н,м), 5,56 (1H, д, J = 7,8 Гц), 5,85 - 6,05 (1H, м),6,00 (1H, д, J = 4,8 Гц), 7,47 (2 Н, т, J = 7,8 Гц),7,59 (1H, Т, J = 7,8 Гц), 8,11 (2 Н, д, J = 7,8 Гц). Стадия 2. 9-13-O-Аллилоксикарбонил-10 деацетил-9-дигидро-9,10-О-изопропилиден-7-Отриэтилсилилбаккатин III. 52,8 мг Соединения, полученного на описанной выше стадии 1, растворяли в 2,2 мл сухого метиленхлорида, к которому затем добавляли 0,036 мл 2,6-лутидина при комнатной температуре. После охлаждения до -40 С прибавляли по каплям 0,062 мл триэтилсилилтрифторметансульфоната, после чего смесь перемешивали в течение 25 мин. Полученный раствор перемешивали при -40C с насыщенным водным раствором бикарбоната натрия и смесь экстрагировали хлороформом. Органические слои промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; гексан: этилацетат = 4:1 (об./об. с получением 34,1 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.III. 32,1 мг Соединения, полученного выше на стадии 2, растворяли в 1,0 мл тетрагидрофурана и раствор смешивали с 0,005 мл метанола и 4,3 мг тетракистрифенилфосфина палладия и полученную смесь перемешивали в течение 1 ч в атмосфере азота. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; гексан: этилацетат = 5:3(об./об. с получением 17,1 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(1 Н, д типа АВ, J = 7,8 Гц), 4,73 - 4,88 (2 Н, м),5,51 (1H, д, J = 7,8 Гц), 5,91 (1H, д, J = 5,3 Гц),7,48 (2 Н, т, J = 7,3 Гц), 7,59 (1H, т, J = 7,3 Гц),8,14 (2 Н, д, J = 7,3 Гц). Стадия 4. 9-13-O-[3-(трет-Бутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)3-(4-пиридил)пропионил]-10-деацетил-9-дигидро-9,10-О-изопропилиден-7-О-триэтилсилилбаккатин III. Используя в качестве исходного продукта соединение, полученное выше на стадии 3,взаимодействие его с цис-1-(трет-бутоксикарбонил)-3-(трет-бутилдиметилсилилокси)-4-(4 пиридил) азетидин-2-оном осуществляли тем же способом, что описан для стадии 3 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества, представляющего собой смесь двух диастереоизомеров, в которой конфигурация 2'и 3'-положений имеет трео(син)форму.(м), 8,11 (2 Н, д, J = 7,3 Гц), 8,52 - 8,70 (м). Стадия 5. 9-13-0-[3-(трет-Бутоксикарбониламино)-2-гидрокси-3-(4-пиридил)пропионил]-10-деацетил-9-дигидро-9,10-O-изопропилиденбаккатин III. 27,1 мг Соединения, полученного на описанной выше стадии 4, растворяли в 1,35 мл пиридина и к полученной смеси при 0 С прибавляли по каплям 0,27 мл системы гидрофторид-пиридин, после чего смесь перемешивали в течение 6 ч при комнатной температуре. После добавления воды, охлажденной до 0 С, полученный в результате раствор экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле(хлороформ: метанол =12:1 (об./об с получением низкополярного изомера А и высокополярного изомера В из двух диастереоизомеров целевого соединения, в которых относительная конфигурация 2'- и 3'-положений имеет трео(син)форму, причем каждое соединение получали в виде бесцветного прозрачного сиропообразного вещества. Изомер А. Стадия 1. 9-10-Деацетил-9-дигидро-9,10O-(2-пропенилиден)баккатин III. Используя в качестве исходного продукта соединение, полученное на стадии 1 примера изобретения 1, повторяли методику проведения реакции, описанную для стадии 2 примера изобретения 1, за исключением того, что вместо 2,2-диметоксипропана использовали диэтилацеталь акролеина, с получением целевого соединения.(1H, шир. KB, J = 6,8 Гц), 5,07 (1H, с), 5,22 (1H,д, J = 6,3 Гц), 5,30 (1H, д, J = 6,8 Гц), 5,45 (1 Н, д,J = 10,3 Гц), 5,56 (1H, д, J = 17,6 Гц), 6,04 (1H, д,J = 4,4 Гц), 5,96 - 6,11 (1H, м), 7,48 (2 Н, т, J = 7,3 Гц), 7,60 (1H, т, J = 7,3 Гц), 8,13 (2 Н, д, J = 7,3 Гц). Стадия 2. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-(триизопропилсилилокси)пропионил]-10-деацетил-9 дигидро-9,10-О-(2-пропенилиден)баккатин III. Используя в качестве исходного продукта соединение, полученное выше на стадии 1, повторяли методику проведения реакции, описанную для стадии 3 примера изобретения 1, с получением целевого соединения.(1H, д, J = 6,4 Гц), 5,24 (1H, д, J = 6,9 Гц), 5,22 5,34 (2 Н, м), 5,45 (1H, д, J = 10,3 Гц), 5,57 (1H, д,J = 17,5 Гц), 5,94- 6,15 (2 Н, м), 6,05 (1H, д, J = 4,9 Гц), 6,25 (1H, д, J = 2,9 Гц), 6,34 (1H, дд, J = 2,9 Гц, 1,9 Гц), 7,37 (1H, д, J = 1,9 Гц), 7,47 (2 Н,т, J = 7,8 Гц), 7,59 (1H, т, J = 7,8 Гц), 8,12 (2 Н, д,J = 7,8 Гц). Стадия 3. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-гидроксипропионил]-10-деацетил-9-дигидро-9,10-О-(2-пропенилиден)баккатин III. Используя в качестве исходного продукта соединение, полученное на стадии 2, повторяли методику проведения реакции, описанную для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-7-O-Аллил-13-O-[(2R, 3R)-3(трет-бутоксикарбониламино)-3-(2-фурил)-2(триизопропилсилилокси)пропионил]-10 деацетил-9-дигидро-9,10-O-изопропилиден) баккатин III. 34,4 мг Соединения, полученного на стадии 3 примера изобретения 1, растворяли в 1,4 мл тетрагидрофурана и затем при -50 С прибавляли по каплям 1 н. гексаметилдисилазид натрия(тетрагидрофурановый раствор, 0,14 мл). Через пять минут при той же температуре полученный в результате раствор смешивали с 0,020 мл йодистого аллила и смесь перемешивали в течение 1,5 ч, после чего смесь снова смешивали с 0,020 26 мл йодистого аллила при -42 С и перемешивали в течение 1,5 ч. Такой смешанный раствор смешивали с насыщенным водным раствором хлористого аммония при -40 С и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; гексан: этилацетат = 5:1 (об./об. с получением с участка геля с Rf = 0,12 2,6 мг бесцветного прозрачного сиропа целевого соединения, в котором гидроксильная группа в положении 7 находится в этерифицированном состоянии. Кроме этого, участок геля с Rf = 0,27 давал 4,2 мг соединения, в котором ацетильная группа в положении 4 была преобразована в аллильную группу.= 5,8 Гц), 5,82 - 5,98 (1 Н, м), 6,14 (1H, шир. т, J = 8,4 Гц), 6,24 (1 Н, д, J = 2,9 Гц), 6,34 (1H, дд, J = 2,9 Гц, 1,0 Гц), 7,37 (1H, д,J = 1,0 Гц), 7,47 (2 Н,т, J = 7,8 Гц), 7,56 (1H, т, J = 7,8 Гц), 8,10 (2 Н, д,J = 7,8 Гц). Стадия 2. 9-7-O-Аллил-13-O-[(2R,3R)-3(трет-бутоксикарбониламино)-3-(2-фурил)-2 гидроксипропионил]-10-деацетил-9-дигидро 9,10-O-изопропилиденбаккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 1, повторяли методику проведения реакции, описанную для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-13-O-[(2R,3R)-3-(трет-Бутоксикарбониламино)-3-(2-фурил)-2-(триизопропилсилилокси)пропионил]-4,10-дидеацетил-9 дигидро-9,10-О-изопропилиден-4-O-(4-пентеноил)баккатин III. Следуя методике, описанной для стадии 1 примера изобретения 5, с участка геля с Rf = 0,27 получали 4,2 мг целевого соединения, в котором ацетильная группа в положении 4 была преобразована в аллильную группу.III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 1, повторяли методику проведения реакции, описанную для стадии 4 примера изобретения 1, с получением целевого соединения. Стадия 1. 9-13-O-[(2R,3S)-3-(третБутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)-3-фенилпропионил]-10-деацетил-9 дигидро-9,10-O-(2-пропенилиден)баккатин III. Используя в качестве исходного продукта соединение, полученное на стадии 1 примера изобретения 4, проводили его взаимодействие с(3R,4S)-1-(трет-бутоксикарбонил)-3-(третбутилдиметилсилилокси)-4-фенилазетидин-2 оном, используя тот же способ, что описан для стадии 3 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного соединения.= 4,9 Гц), 6,20 (1H, т, J = 8,8 Гц), 7,18 - 7,41 (5 Н,м), 7,48 (2 Н, т, J = 7,8 Гц), 7,60 (1H, т, J = 7,8 Гц), 8,13 (2 Н, д, J = 7,8 Гц). Стадия 2. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-О-(2-пропенилиден)баккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше 29 стадии 1, повторяли методику проведения реакции, описанную для стадии 4 примера изобретения 1, с получением целевого соединения. Стадия 1. 9-13-O-[(2R,3R)-3-(третБутоксикарбониламино)-3-(2-фурил)-2-гидроксипропионил]-10-деацетил-9-дигидро-9,10-O(2,3-дигидроксипропилиден)баккатин III. 35,1 мг Соединения, полученного на стадии 3 примера изобретения 4, растворяли в 1,1 мл тетрагидрофурана и 0,35 мл дистиллированной воды и полученный раствор смешивали с 26,8 мг N-морфолин-N-оксида и 4,8 мг тетраоксида осмия при комнатной температуре. Через 21 ч полученную систему смешивали с водным раствором сульфита натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силика-геле(проявляющий растворитель; хлороформ: метанол = 10:1 (об./об. с получением 14,1 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(2 Н, м). Стадия 2. 9-13-O-[(2R,3R)-3-(третБутоксикарбониламино)-3-(2-фурил)-2-гидроксипропионил]-10-деацетил-9-дигидро-9,10-О(2-морфолиноэтилиден)баккатин III. 14,1 мг Соединения, полученного на описанной выше стадии 1, растворяли в смешанном растворителе тетрагидрофуран-вода-метанол(1:1:1 (об./об. и полученный раствор смешивали с 19,7 мг метапериодата натрия при комнатной температуре и смесь перемешивали в течение 30 мин. Этот раствор охлаждали до 0 С,смешивали с раствором соли и экстрагировали этилацетатом. После промывания полученного таким образом экстракта насыщенным раствором соли и последующей сушки над безводным сульфатом натрия растворитель выпаривали при пониженном давлении. Полученный в результате остаток сушили в вакууме и растворяли в 1,3 мл этанола и полученный в результате раствор смешивали с 0,10 мл уксусной кислоты, 0,14 мл морфолина и 13,9 мг цианборгидрида натрия при комнатной температуре и перемешивали в течение 1 ч. Реакционный раствор смешивали с насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и полученную смесь экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: метанол = 12:1 (об./об. с получением 10,4 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-10-Деацетил-9-дигидро-9,10O-(2-пропенилиден)-7-O-(2,2,2-трихлорэтоксикарбонил)баккатин III. 100,4 мг Соединения, полученного на стадии 1 примера изобретения 4, растворяли в 3,0 мл пиридина, к которому затем при 0 С прибавляли по каплям 0,025 мл 2,2,2-трихлорэтоксикарбонилхлорида. Через 30 мин добавляли воду, охлажденную до 0 С, и полученный в результате раствор экстрагировали этилацетатом. Полученный таким образом экстракт промывали 1 н. соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, в указанном порядке,и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; хлороформ: ацетон = 6:1 (об./об. с получением 116,7 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(1H, д типа АВ, 3 = 8,3 Гц), 4,66 (1H, д типа АВ,J = 11,7 Гц), 4,83 (1H, д типа АВ, J = 11,7 Гц),4,76 - 4,89 (2 Н, м), 5,15 (1H, дд, J = 5,3 Гц, 3,4 Гц), 5,19 (1H, д, J = 5,9 Гц), 5,34 (1H, д, J = 7,3 Гц), 5,46 (1H, д, J = 10,3 Гц), 5,57 (1H, д J = 17,5 Гц), 5,98 (1H, д, 3 = 4,9 Гц), 6,04 (1H, ддд, J = 17,5 Гц, 10,3 Гц, 5,9 Гц), 7,48 (2 Н, т, J = 7,4 Гц),7,59 (1H, т, 3 = 7,4 Гц), 8,13 (2 Н, д, J = 7,4 Гц). Стадия 2. 9-13-О-[3-(трет-Бутоксикарбониламино)-2,2-дифтор-3-(2-фурил)пропионил]10-деацетил-9-дигидро-9,10-О-(2-пропенилиден)-7-О-(2,2,2-трихлорэтоксикарбонил)баккатин III. 0,2041 г 3- (трет-Бутоксикарбониламино)2,2-дифтор-3-(2-фурил)пропионовой кислоты растворяли в 4,0 мл толуола и полученный раствор смешивали с 0,1516 г ди-2-пиридилкарбоната при комнатной температуре. Через 20 32 мин в систему добавляли 2,0 мл толуольной суспензии, содержащей 0,1167 г соединения,полученного на описанной выше стадии 1, дополнительно добавляли 39,9 мг 4 диметиламинопиридина и полученную смесь перемешивали в течение 16 ч при 65 С. После охлаждения до комнатной температуры реакционный раствор смешивали с водой и экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; хлороформ: ацетон = 20:1 (об./об. с получением 75,5 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.- 6,46 (2 Н, М), 7,38 - 7,51 (3H, м), 7,60 (1H, т, J = 7,4 Гц), 8,06 - 8,14 (2 Н, м). Стадия 3. 9-13-О-[3-(трет-Бутоксикарбониламино)-2,2-дифтор-3-(2-фурил)пропионил]-10-деацетил-9-дигидро-9,10-O-(2-пропенилиден)баккатин III. 75,5 мг Соединения, полученного на описанной выше стадии 2, растворяли в 6,0 мл смешанного растворителя уксусная кислотаметанол (1:1 (об.,об. и полученный раствор смешивали с 0,1728 г порошкообразного цинка при комнатной температуре, после чего смесь перемешивали в течение 30 мин при 62 С. Твердое вещество отфильтровывали. Полученный в результате фильтрат концентрировали при пониженном давлении, разбавляли этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: ацетон = 7:1(об./об. с получением 14,7 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-10-Деацетил-9-дигидро-9,10 О-изопропилиден-7-О-(2,2,2-трихлорэтоксикарбонил) баккатин III. Используя в качестве исходного продукта соединение, полученное на стадии 2 gримера изобретения 1, повторяли методику проведения реакции, описанную для стадии 1 gримера изобретения 9, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(1H, д, J = 7,3 Гц), 4,28 (1H, д типа АВ, J = 7,8 Гц), 4,51 (1H, д типа АВ, J = 7,8 Гц), 4,65 (1H,д типа АВ, J = 11,7 Гц), 4,80 (1H, д типа АВ, J = 11,7 Гц), 4,75 -4,86 (2 Н, м), 5,08 - 5,13 (1H, м),5,60 (1H, д, J = 7,3 Гц), 5,96 (1H, д, J = 4,9 Гц),7,48 (2 Н, т, J = 7,3 Гц), 7,60 (1H, Т, J = 7,3 Гц),8,15 (2 Н, д, J = 7,3 Гц). Стадия 2. 9-10-Деацетил-9-дигидро-9,10 О-изопропилиден-7-О-(2,2,2-трихлорэтоксикарбонил)-13-O-триэтилсилилбаккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 1, повторяли методику проведения реакции, описанную для стадии 2 примера изобрете 000701 34 ния 3, с получением целевого соединения в виде бесцветных прозрачных кристаллов.III. Используя соединение, полученное на описанной выше стадии 2, повторяли методику проведения реакции, описанную для стадии 3 примера изобретения 9, с получением целевого соединения в виде белой пены.= 7,9 Гц), 3,99 - 4,07 (1 Н, м), 4,28 (1H, д типа АВ, J = 8,3 Гц), 4,38 (1H, д типа АВ, J = 8,3 Гц),4,61 (1H, д, J = 7,3 Гц), 4,97 (1H, т, J = 8,8 Гц),5,10 (1H, т, J = 3,4 Гц), 5,52 (1H, д, J = 7,9 Гц),5,95 (1H, д, J = 4,9 Гц), 7,47 (2 Н, т, J = 7,8 Гц),7,59 (1 Н, д, J = 7,8 Гц), 8,12 (2 Н, д, J = 7,8 Гц). Стадия 4. 9-7-O-Аллил-10-деацетил-9 дигидро-9,10-O-изопропилиден-13-О-триэтилсилилбаккатин III. 0,2400 г Соединения, полученного на описанной выше стадии 3, растворяли в 7,2 мл сухого тетрагидрофурана, к которому затем прибавляли по каплям 1,64 н. бутиллитий (гексановый раствор, 0,315 мл) при -50 С. После 17 мин прибавления по каплям полученный в результате раствор смешивали с йодистым аллилом (0,15 мл), растворенным в диметил-сульфоксиде (1,80 мл) и полученную смесь перемешивали в течение 1,5 ч при 0 С. Полученный раствор смешивали с насыщенным водным раствором хлористого аммония при 0 С и смесь экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом хроматографии на колонке с силикагелем (проявляющий растворитель; гексан:этилацетат = 10:3 (об./об. с получением 35 0,1358 г целевого соединения в виде белого твердого вещества.(2 Н, д, J = 7,3 Гц). Стадия 5. 9-7-О-Аллил-10-деацетил-9 дигидро-9,10-O-изопропилиденбаккатин III. Используя соединение, полученное выше на стадии 4, повторяли реакцию, следуя методике, описанной для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.III. Используя соединение, полученное на описанной выше стадии 5, его взаимодействие с 1-(трет-бутоксикарбонил)-3-(трет-бутилдиметилсилилокси)-4-фенилазетидин-2-оном осуществляли в соответствии с методикой, описанной для стадии 3 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(1H, м), 6,22 (1H, т, J = 8,8 Гц), 7,19 - 7,42 (5 Н,м), 7,47 (2 Н, т, J = 7,3 Гц), 7,57 (1H, т, J = 7,3 Гц), 8,11 (2 Н, д, J = 7,3 Гц). Стадия 7. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)-3-фенилпропионил]-10-деацетил-9 дигидро-7-O-(2,3-дигидроксипропил)-9,10-Oизопропилиден-баккатин III. Используя соединение, полученное на описанной выше стадии 6, повторяли методику проведения реакции, описанную для стадии 1 примера изобретения 8, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(м. д.), -0,32 (3H, с), -0,11 (3H, с), 0,74 (9 Н, с),1,31 (3H, с), 1,37 (9 Н, с), 1,39 (3H, с), 1,52 (3H,с), 1,57 (3H, с), 1,60 (3H, с), 1,74 (3H, с), 1,94 2,42 (м), 2,53 (3H, с), 3,03 и 3,06 (оба 1 Н, каждый д, J = 4,9 Гц), 3,45 - 3,81 (м), 3,88 - 4,02 (м),4,21 - 4,38 (м), 4,47 (д, J = 7,7 Гц), 4,50 - 4,58 (м),4,90 -5,01 (м), 5,23 - 5,36 (м), 5,40 - 5,54 (м), 5,92 и 5,94 (оба 1 Н, каждый д, J = 4,9 Гц), 5,94 (д, J = 4,9 Гц), 7,21 - 7,40 (5 Н, м), 7,48 (2 Н, т, J = 7,8 Гц), 7,59 (1 Н, т, J = 7,8 Гц), 8,13 (2 Н, д, J = 7,8 Гц). Стадия 8. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)-3-фенилпропионил]-10-деацетил-9 дигидро-7-O-(2-морфолиноэтил)-9,10-О-изопропилиденбаккатин III. Используя соединение, полученное на описанной выше стадии 7, повторяли методику проведения реакции, описанную для стадии 2 примера изобретения 8, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(5 Н, м), 7,48 (2 Н, т, J = 7,8 Гц), 7,58 (1 Н, т, J = 7,8 Гц), 8,11 (2 Н, д, J = 7,8 Гц). Стадия 9. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропи 37 онил]-10-деацетил-9-дигидро-7-O-(2-морфолиноэтил)-9,10-О-изопропилиденбаккатин III. Используя соединение, полученное выше на стадии 8, повторяли методику проведения реакции, описанную для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества. Стадия 1. 9-13-O-[(2R,3S)-N-(третБутоксикарбонил)-N,O-(4-метоксибензилиден)3-фенилизосеринил]-10-деацетил-9-дигидро 9,10-О-(2-пропенилиден)-7-O-(2,2,2-трихлорэтоксикарбонил) баккатин III. 70,1 мг (2R,3S)-N-(трет-Бутоксикарбонил)N,О-(4-метоксибензилиден)-3-фенилизосерина растворяли в смешанном растворителе, состоящем из 2,1 мл сухого метиленхлорида и 2,1 мл сухого толуола и полученный раствор перемешивали с 34,0 мг дициклогексилкарбодиимида при 0 С. Через 12 мин перемешивания прибавляли по каплям 2,5 мл сухого метиленхлоридного раствора, содержащего 78,1 мг соединения,полученного на стадии 1 примера изобретения 9, после чего добавляли 4,2 мг 4-диметиламинопиридина и полученную смесь перемешивали в течение 2 ч при комнатной температуре. После охлаждения до 0 С реакционную смесь отфильтровывали и отфильтрованный продукт промывали толуолом. Полученный в результате фильтрат разбавляли хлороформом, промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном дав 000701 38 лении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: ацетон = 20:1 (об./об. с получением 68,9 мг целевого соединения в виде белого стеклообразного вещества.(2 Н, д, J = 7,3 Гц). Стадия 2. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10,O-пропилиден)-7-O-(2,2,2-трихлорэтоксикарбонил)баккатин III. 68,9 мг Соединения, полученного на описанной выше стадии 1, растворяли в 3,4 мл этанола и полученный раствор смешивали с 8,6 мг 10% гидроксида палладия при комнатной температуре и перемешивали в течение 5 ч в атмосфере водорода. Затем полученный в результате раствор снова смешивали с 8,6 мг 10% гидроксида палладия и перемешивали в течение 2 ч. Атмосферу реакционной смеси заменяли на азот и реакционный раствор отфильтровывали. После промывания отфильтрованного продукта этилацетатом растворитель, содержащийся в фильтрате, выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: ацетон = 20:1 (об.,об. с получением 28,4 мг целевого соединения в виде белого стеклообразного вещества. 39 4,9 Гц), 6,09 (1 Н, т, J = 7,8 Гц), 7,20 - 7,46 (5 Н,м), 7,47 (2 Н, д, J = 7,3 Гц), 7,60 (1 Н, т, J = 7,3 Гц), 8,12 (2 Н, д, J = 7,3 Гц). Стадия 3. 9-13-О-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10,О-пропилиденбаккатин III. 28,4 мг Соединения, полученного на описанной выше стадии 2, растворяли в 2,8 мл смешанного растворителя диоксан-метанолуксусная кислота (1:1:1 (об./об. и полученный раствор смешивали с 66,2 мг порошкообразного цинка и перемешивали в течение 5 ч при комнатной температуре и затем в течение 16 ч при 55 С. Реакционную смесь фильтровали, отфильтрованный продукт промывали хлороформом и затем растворитель, содержащийся в фильтрате, выпаривали при пониженном давлении. Полученный таким образом остаток разбавляли этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: ацетон = 10:1 (об./об. с получением 10,8 мг целевого соединения в виде белого стеклообразного вещества. Rf = 0,18 (хлороформ: ацетон 40 70 мг Соединения, полученного на стадии 2 примера изобретения 1, растворяли в 2 мл сухого тетрагидрофурана и охлаждали до -78 С. Затем в раствор прибавляли по каплям 0,16 мл н-бутиллития (раствор в гексане с концентрацией 1,64 мол/мл) при той же температуре. После завершения прибавления по каплям смесь перемешивали в течение 10 мин при той же температуре. Затем в смесь прибавляли по каплям 1 мл тетрагидрофуранового раствора, содержащего 29 мг 4-нитрофенилхлорформиата, при той же температуре. Через 1 ч перемешивания реакционный раствор постепенно нагревали до 0 С и перемешивали в течение 2 ч. Реакционный раствор смешивали с насыщенным водным раствором хлористого аммония, после чего раствор разбавляли и экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле(1H, J = 8 Гц), 4,25 (1H, 8 Гц), 4,78 - 4,89 (1H, м),4,83 - 4,88 (1H, м), 5,13 - 5,17 (1H, м), 5,63 (1H,д, J = 7 Гц), 5,94 (1H, д, J = 5 Гц), 7,31 (2 Н, д, J = 9 Гц), 7,49 (2 Н, т, J = 8 Гц), 7,55 - 7,60 (1 Н, м),8,12 (2 Н, д, J = 7 Гц), 8,21 (2 Н, д, J = 9 Гц). Стадия 2. 9-10-Деацетил-9-дигидро-9,10O-изопропилиден-7-O-[(4-метилпиперазин-1-ил) карбонил]баккатин III. 37 мг Соединения, полученного на описанной выше стадии 1, растворяли в 2 мл ацетонитрила, к которому затем прибавляли по каплям 50 мг N-метилпиперазина при комнатной температуре. Через 5 ч перемешивания при такой же температуре растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: метанол = 95:5 Стадия 3. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)-3-фенилпропионил]-10-деацетил-9 дигидро-9,10-O-изопропилиден-7-O-[(4-метилпиперазин-1-ил)карбонил]баккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 2, его взаимодействие с 1-(третбутоксикарбонил)-3-(трет-бутилдиметилсилилокси)-4-фенилазетидин-2-оном осуществляли в соответствии с методикой, описанной для стадии 3 примера изобретения 1, с получением целевого соединения в виде белого аморфного продукта. Спектр 1H-ЯМР (CDCl3/TMC)(м. д.),-0,33 (3H, с), -0,12 (3H, с), 0,74 (9 Н, с), 1,25 (3H,с), 1,28 (3H, с), 1,33 (6 Н, с), 1,36 (3H, с), 1,53(2 Н, д, J = 8 Гц). Стадия 4. 9-13-0-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-O-изопропилиден-7-О-[(4-метилпиперазин-1-ил)карбонил]баккатин III. 13 мг Соединения, полученного на описанной выше стадии 3, растворяли в 1 мл перегнанного пиридина, к которому затем прибавляли по каплям 0,2 мл смеси гидрофторидпиридин при 0 С. После завершения прибавления по каплям полученный раствор нагревали до комнатной температуры и перемешивали в течение ночи. Реакционный раствор разбавляли водой и затем экстрагировли этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле Стадия 1. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-(трет-бутиддиметилсилилокси)-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-O-изопропилиден-7-О-(2-диметиламиноэтил)баккатин III. Используя в качестве исходного продукта соединение, полученное на стадии 7 примера изобретения 10, повторяли методику проведения реакции, описанную для стадии 2 примера изобретения 8, за исключением того, что вместо морфолина использовали диметиламин, в результате чего получали целевое соединение в виде белого стеклообразного твердого вещества.-5,36 (1H, м), 5,38 - 5,52 (2 Н, м), 5,88 (1H, д, J = 5,3 Гц), 6,21 (1H, т, J = 8,5 Гц), 7,19 - 7,41 (5 Н,м), 7,50 (2 Н, т, J = 7,4 Гц), 7,59 (1H, т, J = 7,4 Гц), 8,11 (2 Н, д, J = 7,4 Гц). Стадия 2. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-O-изопропилиден-7-O-(2-диметиламиноэтил)баккатин III. Используя соединение, полученное на описанной выше стадии I, повторяли методику проведения реакции, описанную для стадии 5 примера изобретения 3, с получением целевого соединения в виде белого стеклообразного твердого вещества. Стадия 1. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-(трет-бутилдиметилсилилокси)-3-фенилпропионил]-10-деацетил-9 дигидро-7-O-карбоксиметил-9,10-O-изопропилиденбаккатин III. 67,2 мг Соединения, полученного на стадии 7 примера изобретения 10, растворяли в 3 мл смешанного растворителя тетрагидрофуранметанол-вода (1:1:1 (об./об. и полученный раствор смешивали с 55,3 мг метапериодата натрия при комнатной температуре и смесь перемешивали в течение 1 ч. Полученный раствор смешивали с водой, охлажденной до 0 С, и экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и 22,0 мг из 48,0 мг полученного таким образом остатка растворяли в 1,65 мл диоксана и 0,55 мл воды, смешивали с 5,6 мг сульфаминовой кислоты и 5,3 мг хлористого натрия при комнатной температуре и перемешивали в течение 30 мин. Реакционный раствор смешивали с водой и экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Затем растворитель выпаривали при пониженном давлении и полученный в результате остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ: метанол = 15:1 (об./об. с получением 21,3 мг целевого соединения в виде белого твердого вещества. 44 7,42 (5 Н, м), 7,49 (2 Н, т, J= 7,9 Гц), 7,60 (1H, т,J= 7,9 Гц), 8,12 (2 Н, д, J= 7,9 Гц). Стадия 2. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-7-О-карбоксиметил-9,10-O-изопропилиденбаккатин III. Используя в качестве исходного продукта соединение, полученное на описанной выше стадии 1, повторяли методику проведения реакции, описанную для стадии 5 примера изобретения 3, с получением целевого соединения в виде белого стеклообразного твердого вещества.III. Используя в качестве исходного продукта соединение, полученное на стадии 3 примера изобретения 3, его взаимодействие с цис-1(трет-бутоксикарбонил)-3-метил-4-фенил-3(триэтилсилилокси)азетидин-2-оном осуществляли в соответствии с методикой, описанной для стадии 3 примера изобретения 1, с получением целевого соединения в виде бесцветного стеклообразного твердого продукта. Спектр 1H-ЯМР (400 МГц, CDCl3/TMC)(1 Н, д, J = 10 Гц), 5,42 (1 Н, д, J = 9 Гц), 5,52 (1 Н,д, J = 10 Гц), 5,91 (1 Н, д, J = 5,5 Гц), 6,28 (1 Н, т,J = 9 Гц), 7,27 - 7,36 (10 Н, м), 7,48 (2 Н, т, J = 7,5 Гц), 7,58 (1 Н, Т, J = 7,5 Гц), 8,15 (2 Н, д, J = 7,5 Гц). Стадия 2. 9-13-O-[-3-(трет-Бутоксикарбониламино)-2-гидрокси-2-метил-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-Оизопропилиденбаккатин III. Реакцию соединения, полученного на описанной выше стадии 1, проводили тем же способом, что описан для стадии 4 примера изобретения 1, с получением целевого соединения в виде бесцветного стеклообразного твердого вещества. Температура плавления: 180-182 С (лиофилизован из диоксана). Спектр 1 Н-ЯМР (400 МГц, СDСl3/ТМС) Стадия 1. 9-13-O-[(2R,3S)-N-(трет-Бутоксикарбонил)-N,O-(4-метоксибензилиден)-3 фенилизосеринил]-10-деацетил-9-дигидро-9,10O-(пропенилиден)баккатин III. Используя в качестве исходного продукта соединение,. полученное на стадии 1 примера изобретения 11, повторяли методику проведения реакции, описанную для стадии 3 примера изобретения 11, с получением целевого соединения в виде стеклообразного твердого вещества. 46 м), 4,22 (1H, д,J = 8,3 Гц), 4,32 (1H, д, J = 8,3 Гц),4,48 (1H, д, J = 7,4 Гц), 4,58 (1H, д, J = 5,4 Гц),4,98 (1H, с-подобный), 5,17 (2 Н, д, J = 5,9 Гц),5,32 - 5,49 (1H, шир.), 5,44 (1H, д, J = 10,8 Гц),5,55 (1H, д, J = 17,8 Гц), 5,90 - 6,12 (3H, м), 6,22 6,47 (1H, шир.), 6,90 (2 Н, д, J = 8,8 Гц), 7,31 7,50 (9 Н, м), 7,59 (1H, т, 3 = 7,4 Гц), 8,03 (2 Н, д,J = 7,4 Гц). Стадия 2. 9-13-0-[(2R,3S)-N-(трет-Бутоксикарбонил)-N,О-(4-метоксибензилиден)-3 фенилизосеринил]-10-деацетил-9-дигидро-9,10O-(2-N-морфолиноэтилиден)баккатин III. 149,4 мг Соединения, полученного на описанной выше стадии 1, растворяли в смешанном растворителе, состоящем из 4,48 мл тетрагидрофурана и 1,49 мл воды, и полученный раствор смешивали с 87,2 мг N-метилморфолин-Nоксида и 7,8 мг тетраоксида осмия при комнатной температуре и перемешивали в темноте в течение 8 ч, после чего дополнительно добавляли 3,6 мг тетраоксида осмия и смесь перемешивали в течение 16 ч. Полученный раствор смешивали с водным раствором сульфита натрия,перемешивали при комнатной температуре в течение 10 мин и затем экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, после чего растворитель выпаривали при пониженном давлении. Полученный в результате остаток растворяли в 4,1 мл смешанного растворителя тет-рагидрофуран-вода-метанол (1:1:1 (об./об. и полученный раствор смешивали со 118, 6 мг метапериодата натрия при комнатной температуре и перемешивали в течение 40 мин. Полученный в результате раствор охлаждали до 0 С,смешивали с холодной водой и насыщенным раствором соли и затем экстрагировали этилацетатом. Полученный таким образом экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и 65,2 мг из 126,2 мг полученного таким образом остатка растворяли в 4 мл этанола, смешивали с 0,04 мл уксусной кислоты, 0,059 мл морфолина и 14,0 мг 10% гидроксида палладия при комнатной температуре и затем перемешивали в течение 5 ч в атмосфере водорода. Затем атмосферу в реакционной системе заменяли на азот, содержимое системы отфильтровывали, полученный в результате фильтрат выпаривали при пониженном давлении и полученный таким образом остаток очищали методом тонкослойной хроматографии на силикагеле (проявляющий растворитель; хлороформ:ацетон = 5:1 (об./об. с получением 18,4 мг целевого соединения в виде бесцветного прозрачного сиропообразного вещества.(1 Н, шир.), 6,20 - 6,48 (1 Н, шир.), 6,90 (2 Н, д, J = 8,8 Гц), 7,31 - 7,51 (9 Н, м), 7,60 (1 Н, т, J = 7,3 Гц), 8,03 (2 Н, д, J = 7,3 Гц). Стадия 3. 9-13-O-[(2R,3S)-3-(трет-Бутоксикарбониламино)-2-гидрокси-3-фенилпропионил]-10-деацетил-9-дигидро-9,10-O-(2-морфолиноэтилиден)баккатин III. Используя соединение, полученное на описанной выше стадии 2, повторяли методику проведения реакции, описанную для стадии 2 примера изобретения 11, с получением целевого соединения в виде бесцветного прозрачного сиропообразного вещества.= 8,3 Гц), 5,02 (1H, т, J = 3,9 Гц), 5,10 (1H, сподобный), 5,19 (1H, д-подобный, J = 6,9 Гц),5,29 (1H, д, J = 10,0 Гц), 5,61 (1H, д, J = 10,0 Гц),6,00 - 6,13 (2 Н, м), 7,19 - 7,53 (7 Н, м), 7,59 (1H,т, J = 7,3 Гц), 8,11 (2 Н, д, J = 7,3 Гц). FAB массспектр: 921 (М+). Аналогичным способом синтезировали следующие ниже соединения.
МПК / Метки
МПК: C07D 493/08
Метки: пентациклическое, соединение
Код ссылки
<a href="https://eas.patents.su/30-701-pentaciklicheskoe-soedinenie.html" rel="bookmark" title="База патентов Евразийского Союза">Пентациклическое соединение</a>


































