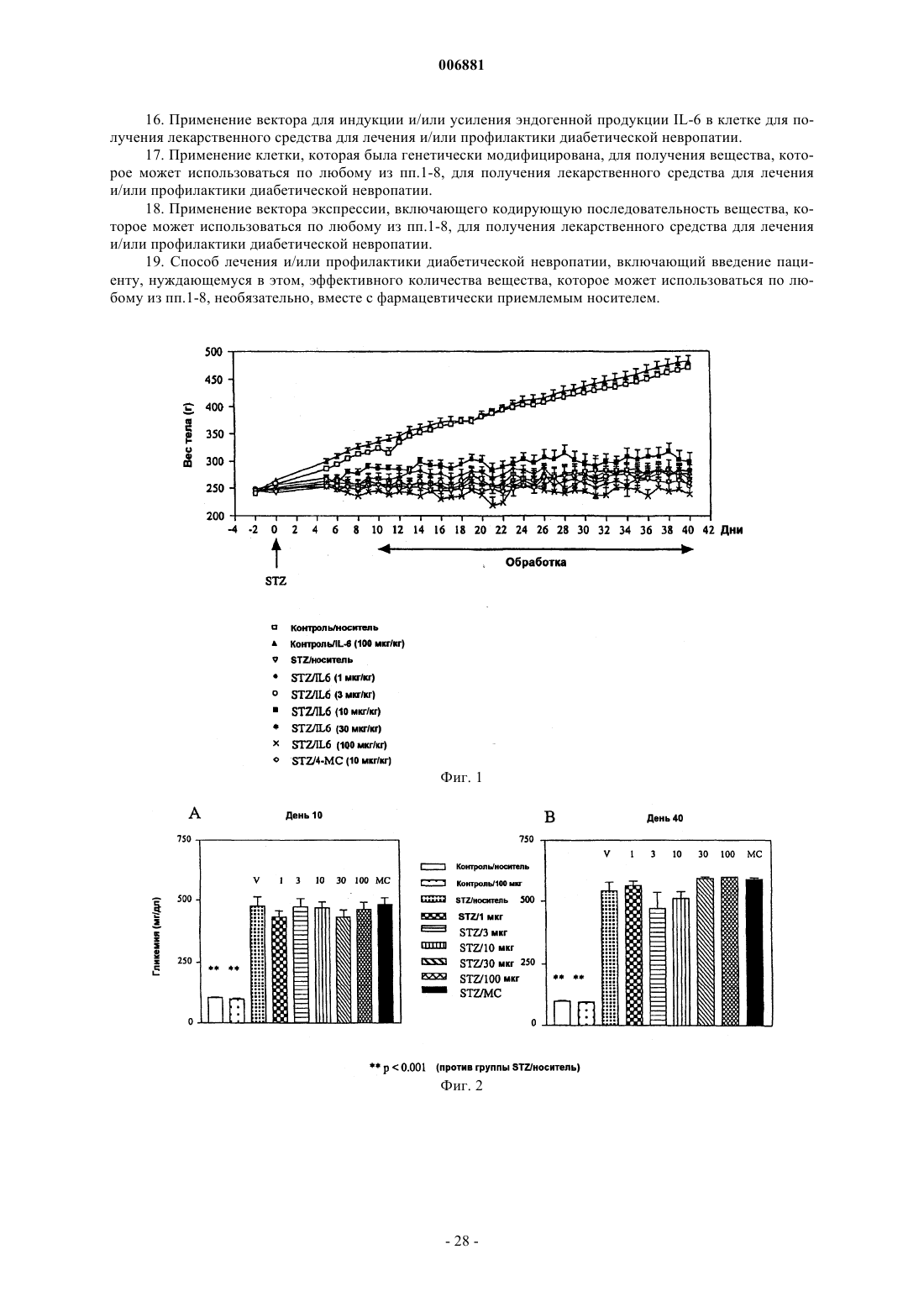
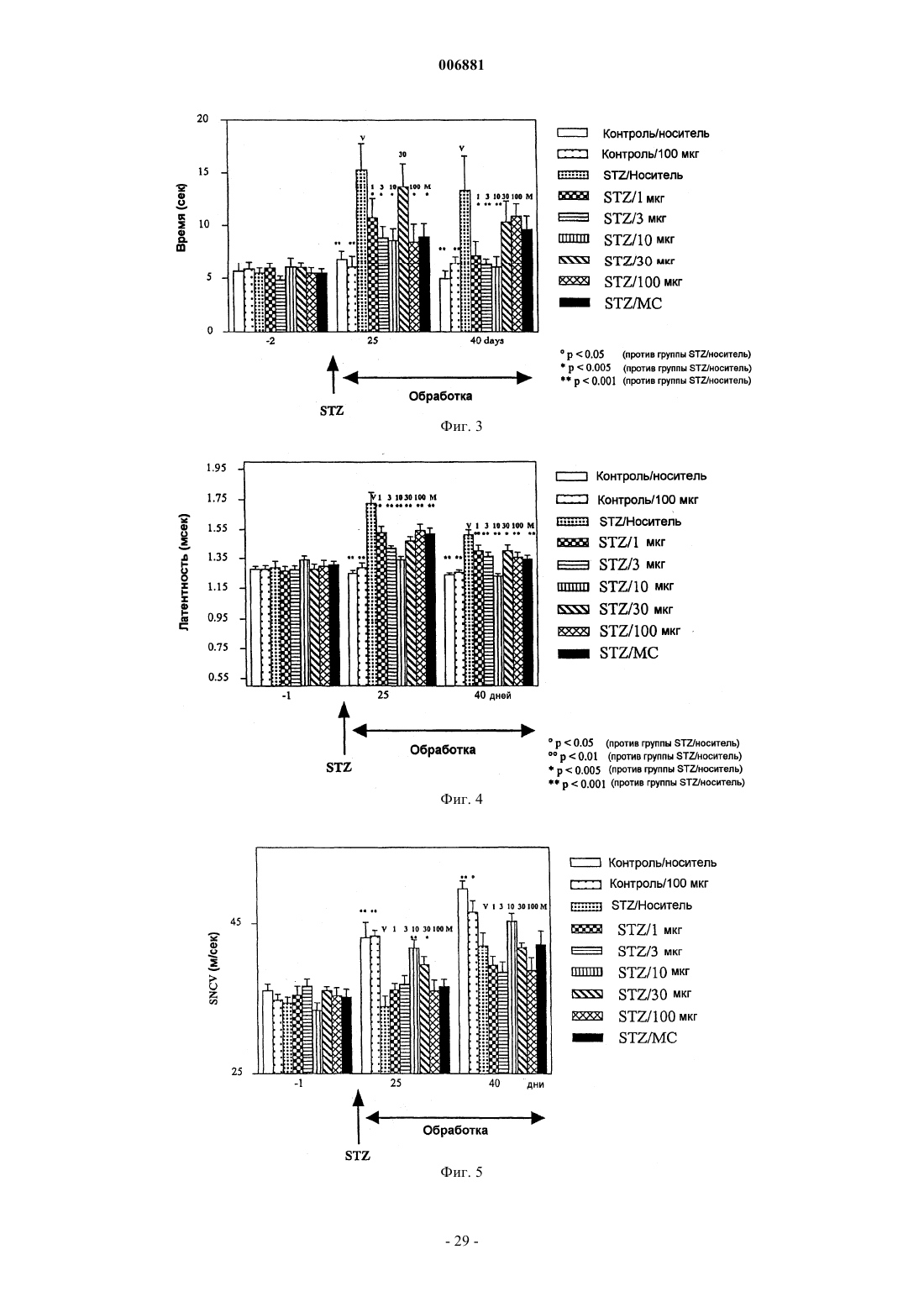
Применение активаторов gp130 при диабетической невропатии
Формула / Реферат
1. Применение вещества, передающего сигналы через gp130, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии, где указанное вещество представляет собой:
a) IL-6;
b) фрагмент а), который связывается с gp80 и инициирует передачу сигнала через gp130;
c) вариант а) или b), который по меньшей мере на 70% идентичен последовательности а) или b) и который инициирует передачу сигнала через gp130;
d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей а) или b) в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; или
e) соль, слитый белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130.
2. Применение по п.1, где диабетическая невропатия представляет собой полиневропатию.
3. Применение по п.1, где диабетическая невропатия представляет собой мононевропатию.
4. Применение по п.1, где IL-6 представляет собой рекомбинантный IL-6.
5. Применение по любому из пп.1-3, где вещество представляет собой:
a) химеру IL-6R/IL-6;
b) фрагмент а), который связывается и инициирует передачу сигнала через gp130;
c) вариант а) или b), который по меньшей мере на 70% идентичен последовательности а) или b) и который инициирует передачу сигнала через gp130;
d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности ДНК, кодирующей а) или b), в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; или
е) соль, слитый белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130.
6. Применение по любому из предшествующих пунктов, где указанное вещество является гликозилированным по одному или нескольким сайтам.
7. Применение по любому из пп.1-6, где указанное вещество не является гликозилированным.
8. Применение по любому из пп.1-7, где слитый белок слит с иммуноглобулином (Ig).
9. Применение по любому из пп.1-8, где функциональное производное включает по меньшей мере одну составляющую, присоединенную к одной или нескольким функциональным группам, присутствующим в виде одной или нескольких боковых цепей на аминокислотных остатках.
10. Применение по п.9, где указанная составляющая представляет собой полиэтиленовую составляющую.
11. Применение по любому из предшествующих пунктов, где вещество, передающее сигналы через gp130, используют в количестве в пределах от около 0,1 до 1000 мкг/кг или от около 1 до 500 мкг/кг или меньше чем около 100 мкг/кг.
12. Применение по п.11, где вещество, передающее сигналы через gp130, используют в количестве от около 1, или 3, или 10, или 30 мкг/кг.
13. Применение по любому из предшествующих пунктов, где вещество, передающее сигналы через gp130, вводят ежедневно.
14. Применение по любому из пп.1-12, где вещество, передающее сигналы через gp130, вводят три раза в неделю.
15. Применение по любому из пп.1-12, где вещество, передающее сигналы через gp130, вводят раз в неделю.
16. Применение вектора для индукции и/или усиления эндогенной продукции IL-6 в клетке для получения лекарственного средства для лечения и/или профилактики диабетической невропатии.
17. Применение клетки, которая была генетически модифицирована, для получения вещества, которое может использоваться по любому из пп.1-8, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии.
18. Применение вектора экспрессии, включающего кодирующую последовательность вещества, которое может использоваться по любому из пп.1-8, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии.
19. Способ лечения и/или профилактики диабетической невропатии, включающий введение пациенту, нуждающемуся в этом, эффективного количества вещества, которое может использоваться по любому из пп.1-8, необязательно, вместе с фармацевтически приемлемым носителем.
Текст
006881 Область изобретения Настоящее изобретение относится к области сахарного диабета и расстройств периферической нервной системы. В частности, оно относится к использованию веществ, передающих сигналы черезgp130, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Для этого специфического медицинского показания предпочтительно используют IL-6 или химеруIL-6R/IL-6. Предпосылки изобретения Сахарный диабет представляет собой расстройство углеводного обмена, т.е. синдром, характеризующийся гипергликемией, являющейся результатом абсолютного или относительного ухудшения секреции инсулина и/или действия инсулина. Классификация сахарного диабета основана на классификации, принятой National Diabetes DataGroup и ВОЗ. Ранее эта классификация была основана на возрасте возникновения, длительности и осложнений этого заболевания. Гестационный сахарный диабет представляет собой непереносимость углеводов разной степени тяжести, которая наступает с первыми признаками текущей беременности. У пациентов с сахарным диабетом типа I (СД), также известным как инсулинозависимый СД (ИЗСД) или юношеский диабет, может развиться диабетический кетоацидоз (ДКА). У пациентов с сахарным диабетом типа II, также известным как инсулинонезависимый СД (ИНЗСД), может развиться некетозная гипергликемическая гиперосмолярная кома (НКГГК). Обычные поздние микрососудистые осложнения включают ретинопатию, нефропатию и периферическую и автономную невропатию. Макрососудистые осложнения включают атеросклеротические заболевания коронарных и периферических артерий. Сахарный диабет типа I. Хотя он может возникнуть в любом возрасте, сахарный диабет типа I наиболее часто развивается в детском возрасте или в период полового созревания и является доминирующим типом СД, диагностируемым в возрасте до 30 лет. Такой тип диабета составляет от 10 до 15% всех случаев СД и характеризуется такими клиническими проявлениями, как гипергликемия и предрасположенностью к диабетическому кетоацидозу. Поджелудочная железа выделяет малое количество или совсем не выделяет инсулин. Около 80% пациентов с СД типа I имеют специфические HLA-фенотипы, ассоциируемые с детектируемыми сывороточными антителами к цитоплазме и к поверхности островковых клеток (антитела к декарбоксилазе глутаминовой кислоты и к инсулину были обнаружены в равном числе случаев). У таких пациентов СД типа I возникает в результате генетически восприимчивой, иммуноопосредованной селективной деструкции 90% их секретирующих инсулин клеток. Их панкреатические островки обнаруживают инсулит, который характеризуется инфильтрацией Т-лимфоцитами в сочетании с макрофагами и В-лимфоцитами и потерей большинства бета-клеток без поражения при этом глюкагонсекретирующих альфа-клеток. Антитела, присутствующие при диагностировании, обычно становятся неопределяемыми через несколько лет. Они могут быть, прежде всего, ответом на деструкцию бетаклеток, но некоторые являются цитотоксическими для бета-клеток и могут способствовать их утрате. Клиническое начало СД типа I может иметь место у некоторых пациентов через несколько лет после незаметного возникновения лежащего в основе этого заболевания аутоиммунного процесса. Скрининговый анализ на наличие таких антител включен в проводимые в настоящее время многочисленные профилактические обследования. Сахарный диабет типа II. СД типа II обычно представляет собой тип диабета, диагностируемого у пациентов старше 30 лет,но также может возникнуть у детей и в период полового созревания. Клинически он характеризуется гипергликемией и инсулинорезистентностью. Диабетический кетоацидоз встречается редко. Хотя большинство пациентов лечат при помощи диеты, упражнений и пероральных лекарственных средств, для некоторых пациентов время от времени или постоянно требуется инсулин для контроля симптоматической гипергликемии и профилактики некетозной гипергликемической гиперосмолярной комы. Степень совпадений СД типа II у однояйцевых близнецов составляет 90%. СД типа II обычно связывают с ожирением, особенно верхней части тела (висцеральной/абдоминальной), и он часто имеет место после периода прибавки в весе. Нарушенная толерантность к глюкозе, являющаяся возрастным явлением, близко коррелирует с типичным ожирением. Пациенты с СД типа II с висцеральным/абдоминальным ожирением могут иметь нормальные уровни глюкозы в крови после похудения. СД типа II представляет собой гетерогенную группу расстройств, в которых гипергликемия является результатом как нарушенной ответной реакции секреции инсулина на глюкозу, так и пониженной эффективности инсулина в стимулировании поглощения глюкозы скелетными мышцами и ограничении продуцирования глюкозы печенью (инсулинорезистентность). Однако инсулинорезистентность является обычным явлением, и у большинства пациентов с инсулинорезистентностью не возникает диабет, поскольку организм компенсирует это адекватно увеличивающейся секрецией инсулина. Инсулинорезистентность в обычных видах СД типа II не является результатом генетических изменений в инсулиновых рецепторах или транспорте глюкозы. Однако генетически определяемые пострецепторные внутриклеточные дефекты, вероятно, играют роль. Возникающая в результате гиперинсулинемия может привести к-1 006881 другим типичным состояниям, таким как ожирение (абдоминальное), гипертензия, гиперлипидемия и заболевание коронарных сосудов (синдром инсулинорезистентности). По-видимому, генетические факторы являются основными определяющими для развития СД типаII, хотя никакой связи между СД типа II и специфическими HLA-фенотипами или антителами к цитоплазме островковых клеток не было продемонстрировано. Исключение составляет подгруппа не страдающих ожирением взрослых людей с детектируемыми антителами к цитоплазме островковых клеток,являющихся носителями HLA-фенотипов и у которых в результате может развиться СД типа I. До развития у них диабета пациенты обычно утрачивают раннюю ответную реакцию секреции инсулина на глюкозу и могут секретировать сравнительно большие количества проинсулина. При установленном диабете, хотя уровни инсулина в плазме натощак могут быть в норме или даже повышенными у пациентов с СД типа II, стимулируемая глюкозой секреция инсулина явно понижена. Пониженные уровни инсулина снижают опосредованное инсулином поглощение глюкозы и не могут ограничивать продуцирование глюкозы печенью. Гипергликемия может быть не только следствием, но также и причиной дальнейшего ухудшения толерантности к глюкозе у диабетических пациентов (токсичность к глюкозе), поскольку гипергликемия снижает чувствительность к инсулину и повышает продуцирование глюкозы печенью. После улучшения контроля метаболизма у пациента дозу инсулина или гипогликемического средства обычно снижают. В некоторых случаях СД типа II возникает у молодых, не страдающих ожирением людей в период полового созревания (возникающий при половом созревании юношеский диабет [MODY]) с аутосомной доминантой наследственностью. Многие семьи с MODY имеют мутацию в гене глюкокиназы. У таких пациентов было выявлено ухудшение секреции инсулина и регуляции печеночной глюкозы. Редкими случаями при СД являются инсулинопатии, имеющие клинические признаки СД типа II,которые являются результатом гетерозиготного наследования дефектного гена, что ведет к секреции инсулина, который не связывается нормальным образом с рецептором инсулина. У таких пациентов сильно повышено содержание в плазме иммунореактивного инсулина, что связано с нормальной ответной реакцией содержания глюкозы в плазме на экзогенный инсулин. Диабет можно также отнести к панкреатическим заболеваниям: хронический панкреатит, в частности у страдающих алкоголизмом, часто связан с диабетом. Такие пациенты утрачивают как секретирующие инсулин, так и секретирующие глюкагон островки. Поэтому они могут быть умеренно гликемическими и чувствительными к низким дозам инсулина. При недостатке эффективной противорегуляции(экзогенный инсулин, которому не противостоит глюкагон), они часто страдают от быстрого наступления гипогликемии. В странах Азии, Африки и Карибского бассейна СД обычно наблюдается у молодых,плохо питающихся людей, в организме которых имеется большой дефицит белка, и которые страдают заболеванием поджелудочной железы; такие пациенты не склонны к диабетическому кетоацидозу, но могут нуждаться в инсулине. Диагностика сахарного диабета. У асимптоматических пациентов СД устанавливают, когда наблюдается соответствие диагностическому критерию гипергликемии при голодании: уровень глюкозы в плазме (или сыворотке) составляет 140 мг/дл (7,77 ммоль/л) после голодания в течение ночи в двух случаях у взрослых или детей. Пероральный тест на переносимость глюкозы может быть полезным при диагностике СД типа II у пациентов, имеющих уровень глюкозы при голодании от 115 до 140 мг/дл (6,38 и 7,77 ммоль/л), и у пациентов, клиническое состояние которых можно отнести к недиагностированному СД (например, полиневропатия, ретинопатия). Лечение сахарного диабета. Гипергликемия является причиной большинства длительных микрососудистых осложнений диабета. Была продемонстрирована линейная зависимость между уровнями Hb A1c (см. ниже) и скоростью, с которой развиваются осложнения. На основании других исследований было сделано предположение, чтоHb A1c 8% является пороговым значением, ниже которого большинство осложнений можно предотвратить. Таким образом, при терапевтическом лечении СД типа I необходимо предпринимать усилия по интенсификации контроля метаболизма для снижения Hb A1c, избегая при этом гипогликемических явлений. Однако лечение должно быть индивидуализированным и должно включать изменения, когда при определенных обстоятельствах какой-либо риск возникновения гипогликемии является неприемлемым(например, у пациентов с прогнозируемой короткой продолжительностью жизни и у пациентов с цереброваскулярными и кардиологическими заболеваниями), или при увеличении риска гипогликемии у пациента (например, у ненадежных пациентов и у пациентов с автономной невропатией). Диета для снижения веса наиболее важна для пациентов с избыточным весом, страдающих СД типаII. Если улучшение гипергликемии не достигается путем диеты, необходимо начать пробное введение пероральных лекарственных средств. Пациентов необходимо регулярно проверять на наличие симптомов или признаков осложнений,включая проверку ног и пульса и чувствительности стоп и ног, а также исследование мочи на наличие альбумина. Периодические лабораторные исследования включают липидный профиль, BUN (азот моче-2 006881 вины крови) и уровни сывороточного креатинина, ECG и полное ежегодное офтальмологическое обследование. Гиперхолестеринемия или гипертензия увеличивает риск специфических поздних осложнений и требует специального внимания и соответствующего лечения. Хотя -блокаторы бета-адренергических рецепторов (такие как пропранолол) можно безопасно использовать для большинства пациентов с диабетом, они могут маскировать -адренергические симптомы индуцированной инсулином гипогликемии и ухудшать нормальный противорегуляторный ответ. Таким образом, часто выбирают такие лекарственные средства как ингибиторы АСЕ и антагонисты кальция. Отслеживание уровня глюкозы в плазме должно осуществляться всеми пациентами, и принимающих инсулин пациентов необходимо обучать соответственно регулировать дозы инсулина. Уровни глюкозы можно проверять при помощи простого домашнего анализа, используя каплю крови, взятую из кончика пальца. Для взятия крови из кончика пальца рекомендуется использовать пружинный ланцет. Частота анализов определяется индивидуально. Принимающие инсулин диабетические пациенты должны, идеально, проверять содержание глюкозы в плазме ежедневно перед едой, через 1-2 часа после еды и перед сном. Большинство лечащих врачей периодически определяют гликозилированный гемоглобин (Hb A1c) для оценки контроля содержания глюкозы в плазме в течение предшествующих 1-3 месяцев. Hb A1c является стабильным продуктом неферментативного гликозилирования Hb содержащейся в плазме глюкозой, и образуется со скоростью, которая увеличивается с увеличением уровня содержания глюкозы в плазме. В большинстве лабораторий нормальный уровень Hb A1c составляет около 6%; у плохо контролируемых диабетических пациентов этот уровень составляет от 9 до 12%. Hb A1c не является специфическим тестом для диагностики диабета; однако повышенный Hb А 1 с часто указывает на наличие диабета. Еще один тест используют для определения уровня фруктозамина. Фруктозамин образуется в результате химической реакции глюкозы с белком плазмы и является отражением контроля глюкозы в предшествующие 1-3 недели. Поэтому этот анализ может показывать изменения в контроле до Hb A1c и часто является полезным при применении интенсивного лечения и в краткосрочных клинических испытаниях. Что касается лечения инсулином, человеческий инсулин часто является предпочтительным при начале лечения инсулином, поскольку он является менее антигенным, чем виды инсулина, полученные от животных. Однако определяемые уровни антител к инсулину, обычно очень низкие, появляются у большинства принимающих инсулин пациентов, включая и тех, кто принимает препараты человеческого инсулина. Инсулин обычно предоставляется в виде препаратов, содержащих 100 Ед/мл (U-100 инсулин), и его вводят путем подкожной инъекции с использованием одноразовых инсулиновых шприцев. 1/2-мл шприцы обычно предпочтительны для пациентов, обычно вводящих дозы 50 Ед, поскольку являются более наглядными для дозирования и обеспечивают точный отмер более низких доз. Устройство для многократных инъекций инсулина (NovolinPen), обычно называемое инсулиновой ручкой, рассчитано на использование картриджа, содержащего несколько суточных доз. Инсулин следует охлаждать, но ни в коем случае не замораживать; однако большинство инсулиновых препаратов стабильны при комнатной температуре в течение нескольких месяцев, что способствует их применению на работе и во время путешествий. Диабет может быть связан с другими эндокринными заболеваниями. СД типа II может быть вторичным при синдроме Кушинга, акромегалии, феохромоцитоме, глюкагономе, первичном альдостеронизме или соматостатиноме. Большинство из этих заболеваний связаны с периферической или гепатической инсулинорезистентностью. Многие пациенты становятся диабетическими, поскольку секреция инсулина также снижается. Распространенность СД типа I увеличивается у пациентов с некоторыми аутоиммунными эндокринными заболеваниями, такими как болезнь Грейвса, тиреоидит Хасимото и идиопатическая болезнь Аддисона. Диабет может также быть вызван бета-клеточными токсинами. Например, стрептозотоцин может индуцировать экспериментальный диабет у крыс, но редко вызывает диабет у человека. Поздние осложнения диабета возникают через несколько лет плохо контролируемой гипергликемии. Уровни глюкозы повышаются во всех клетках, за исключением тех, где имеет место опосредованное инсулином усвоение глюкозы (в основном в мышцах), что приводит к повышению гликозилирования и активности других путей метаболизма, которые могут быть вызваны осложнениями. Большинство микрососудистых осложнений можно замедлить, предотвратить или даже обратить при тщательном гликемическом контроле, т.е. при достижении близких к норме уровней глюкозы при голодании и после приема пищи, отражением которых является близкий к норме гликозилированный гемоглобин (Hb A1c). Макрососудистые заболевания, такие как атеросклероз, могут привести к симптоматическим заболеваниям коронарных артерий, хромоте, гниению кожи и инфекциям. Хотя гипергликемия может ускорить атеросклероз, многие годы гиперинсулинемии, предшествующие возникновению диабета (с инсулинорезистентностью), могут играть основную инициирующую роль. Ампутация нижних конечностей при не-3 006881 которых периферических сосудистых заболеваниях, перемежающаяся хромота и гангрена остаются обычным явлением. Базальная ретинопатия (начальные изменения сетчатки, наблюдаемые при офтальмоскопическом обследовании или на снимках сетчатки) не оказывает сильного влияния на зрение, но может привести к развитию отека соска зрительного нерва или к пролиферативной ретинопатии с отслойкой сетчатки или кровоизлиянием, что может привести к слепоте. У около 85% диабетиков в результате до некоторой степени развивается ретинопатия. Диабетическая нефропатия обычно бывает бессимптомной вплоть до развития заболевания почек, являющегося ее конечной стадией, но она может вызвать нефротический синдром. Диабетическая невропатия является еще одним осложнением диабета, но она также представляет собой обычное явление при некоторых других заболеваниях. Множественная мононевропатия обычно является вторичной при коллагеновых сосудистых заболеваниях (таких как узелковый полиартериит, системная красная волчанка (SLE), синдром Шегрена, ревматоидный артрит (RA, саркоидозе, метаболических заболеваниях (таких как диабет, амилоидоз) или инфекционных заболеваниях (таких как болезнь Лайма, ВИЧ-инфекция). Микроорганизмы могут вызвать множественную мононевропатию путем прямой инвазии нерва(например, при проказе). Полиневропатия при острых лихорадках может возникнуть из-за токсина (например, при дифтерии) или аутоиммунной реакции (например, при синдроме Гийена-Барре); полиневропатия, являющаяся в некоторых случаях следствием иммунизации, возможно, также является аутоиммунной. Токсические вещества обычно вызывают полиневропатию, но иногда мононевропатию. Они включают эметин, гексобарбитал, барбитал, хлорбутанол, сульфонамиды, фенитоин, нитрофурантоин, алкалоиды барвинка, тяжелые металлы, оксид углерода, триортокрезилфосфат, ортодинитрофенол, многие растворители, другие промышленные отравляющие вещества и некоторые лекарственные средства против СПИДа (такие как зальцитабин, диданозин). Недостаток питательных веществ и метаболические расстройства могут привести к полиневропатии. Дефицит витамина В часто является причиной этого (например, при алкоголизме, алиментарном полиневрите, пернициозной анемии, изониазид-индуцированном дефиците пиридоксина, синдромах недостаточности всасывания и при неукротимой рвоте беременных женщин). Полиневропатия также возникает при гипотиреозе, порфирии, саркоидозе, амилоидозе и уремии. Злокачественные заболевания могут вызвать полиневропатию через моноклональную гаммопатию(множественная миелома, лимфома), амилоидную инвазию или недостаток питательных веществ или как паранеопластический синдром. Полиневропатия в результате метаболических расстройств, таких как сахарный диабет или почечная недостаточность, развивается медленно, часто в течение месяцев или лет. Она часто начинается с сенсорных отклонений в нижних конечностях, которые часто более сильные на концах, чем на менее удаленных участках. Часто явно ощущаются покалывание, онемение, жгучая боль или недостаточная проприоцепция в суставах и ощущение дрожания в конечностях. Боль часто усиливается ночью, и она может усиливаться при касании пораженного участка или при изменениях температуры. В тяжелых случаях наблюдаются объективные признаки потери ощущений, типично при снимании/надевании чулок и перчаток. Пяточные или другие рефлексы глубоких сухожилий понижены или отсутствуют. При значительной потери сенсорных ощущений могут развиться безболезненные язвы на пальцах или суставах Шарко. Сенсорный или проприоцептивный дефицит может привести к изменениям в походке. Нарушения двигательной функции приводят к дистальной мышечной слабости и атрофии. Может быть также или селективно затронута вегетативная нервная система, что влечет ночную диарею, недержание мочи и кала, импотенцию или постуральную гипотензию. Вазомоторные симптомы очень различны. Кожа может быть более бледной или сухой, чем обычно, иногда с темноватым обесцвечиванием; потоотделение может быть чрезмерно сильным. Трофические изменения (гладкая и блестящая кожа, неровная или ребристая структура ногтей, остеопороз) представляют собой обычные явления в тяжелых длительных случаях. Лечение системных расстройств (например, сахарного диабета, почечной недостаточности, множественной миеломы, опухолей) может задержать развитие и ослабить симптомы, но выздоровление проходит медленно. Для сдерживания невропатий могут потребоваться инъекции кортикостероидов или хирургическая декомпрессия. Физическая терапия и накладывание шин уменьшают вероятность или тяжесть контрактур. Сахарный диабет может вызывать сенсорномоторную дистальную полинвропатию (наиболее часто встречающуюся), множественную мононевропатию и очаговую мононевропатию (например, глазодвигательного или отводящего краниального нервов). Полиневропатия обычно возникает как дистальная,симметрическая, преимущественно сенсорная полиневропатия, которая вызывает сенсорные недостатки,которые начинаются и обычно замечаются при надевании/снимании чулок, перчаток. Обычно периферическую невропатию определяют как синдром потери ощущений, мышечной слабости и атрофии, пониженных рефлексов глубоких сухожилий и вазомоторных симптомов, отдельно или в сочетании. Заболевание может поражать отдельный нерв (мононевропатия), два или более нервов в-4 006881 отдельных областях (множественная мононевропатия) или большое количество нервов одновременно(полиневропатия). Прежде всего, может поражаться аксон (как, например, при сахарном диабете, болезни Лайма или уремии или в случае токсических веществ), или миелиновая оболочка, или шванновская клетка (как, например, при острой или хронической воспалительной полиневропатии, лейкодистрофиях или синдроме Гийена-Барре). Повреждение небольших немиелинизированных и миелинизированных волокон в основном ведет к утрате температурных и болевых ощущений; повреждение больших миелинизированных волокон ведет к двигательным или проприоцептивным нарушениям. При некоторых видах невропатии (например, из-за отравления свинцом, применения дапсона, укуса клещей, порфирии или синдрома Гийена-Барре) прежде всего поражаются двигательные волокна; при других (например, из-за заднекорешкового ганглионита при раке, проказе, СПИДе, сахарном диабете или хронической пиридоксиновой интоксикации), в основном, поражается заднекорешковый ганглий или сенсорные волокна, приводя к возникновению сенсорных симптомов. В некоторых случаях также поражаются краниальные нервы (например, при синдроме Гийена-Барре, болезни Лайма, сахарном диабете и дифтерии). Травма является наиболее частой причиной локализованного повреждения отдельного нерва. Слишком большая мышечная активность или сильное растяжение сустава могут вызвать фокальную невропатию, также как и повторяющиеся небольшие травмы (например, сильное сжимание небольших инструментов, слишком сильная вибрация от отбойных молотков). Паралич от сдавливания или ущемления нерва обычно поражает поверхностные нервы (локтевой, лучевой, перонеальный) на выступах костей (например, при глубоком сне или при анестезии у худых или страдающих кахексией субъектов, или часто у страдающих алкоголизмом субъектов) или в узких каналах (например, при синдроме канала запястья). Паралич от сдавливания может появляться в результате опухолей, гиперостоза костей, протезов,костылей или при длительных положениях, вызывающих судороги (например, при садоводческих работах). Кровоизлияние в нерв и воздействие холода или радиации также могут вызвать невропатию. Мононевропатия также может быть результатом непосредственной опухолевой инвазии. Диабетическая полиневропатия может вызывать онемение, покалывание и парез конечностей и, реже, изнуряющую, острую глубокую боль и гиперестезию. Ахиллов рефлекс обычно понижен или отсутствует. Другие проявления полиневропатии исключаются. Острая, болезненная мононевропатия, поражающая 3-й, 4-й или 6-й краниальные нервы, а также другие нервы, такие как бедренный, может самопроизвольно улучшиться в течение недель-месяцев, она возникает большей частью у пожилых диабетиков и ее относят к инфарктам нервов. Вегетативная невропатия возникает в основном у диабетиков,страдающих полиневропатией, и может вызвать постуральную гипотензию, нарушенное потоотделение,импотенцию и ухудшение эякуляции у мужчин, нарушение функции мочевого пузыря, замедленное опорожнение желудка (иногда с демпинг-синдромом), дисфункцию пищевода, запор или диарею и ночную диарею. Снижение реакции частоты сердечных сокращений на пробу Вальсальвы или на изменение позы или неизменяющаяся частота сердечных сокращений при глубоком вдохе являются показателями вегетативной невропатии у диабетиков. Диабетическая полиневропатия является основной причиной язв стопы и проблем с суставами, которые представляют собой частые случаи при сахарном диабете. При диабетической полиневропатии сенсорная денервация ухудшает ощущение травмы от таких обычных причин, как плохо подобранная обувь или мелкие камни. Изменения в проприоцепции ведут к изменениям в осанке и распределении веса, а иногда к развитию суставов Шарко. Пациенты с инфицированными язвами стопы часто не чувствуют боли из-за невропатии и не имеют системных симптомов до тех пор, когда уже упущены возможности лечения. Глубокие язвы и особенно язвы, связанные с любым обнаруживаемым целлюлитом, требуют немедленной госпитализации, поскольку есть угроза развития системной токсичности и перманентной потери трудоспособности. Ранняя хирургическая обработка раны является главной частью лечения, но иногда необходима ампутация. Интерлейкин-6 (IL-6) представляет собой многофункциональный цитокин, продуцируемый и секретируемый несколькими разными типами клеток. Этот плейотропный цитокин играет центральную роль в механизме клеточной защиты, включая иммунный ответ, реакцию острой фазы и гемопоэз. IL-6 представляет собой гликопротеин с М.м. 20-26 кДа, состоящий из 185 аминокислот, который был ранее клонирован (May et al., (1986); Zilberstein et al., (1986); Hirano et al., (1986. IL-6 раньше называли фактором 2 стимуляции В-клеток (BSF-2), интерферон-бета 2 и фактором стимуляции гепатоцитов. IL-6 секретируется рядом различных тканей, включая печень, селезенку и костный мозг, и различными типами клеток,включая моноциты, фибробласты, эндотелиальные клетки, В- и Т-клетки. IL-6 активируется на уровне транскрипции различными сигналами, включая вирусы, двухцепочечную РНК, бактерии и бактериальные липополисахариды и воспалительные цитокины, такие как IL-1 и TNF (ФИО).IL-6 участвует в патогенезе воспалительных заболеваний ЦНС человека. Например, пациенты с рассеянным склерозом демонстрируют повышенные уровни IL-6 в плазме и цереброспинальной жидкости (Frei et al., (1991. Проведенные недавно эксперименты по определению действия IL-6 на клетки центральной и периферической нервной системы показывают, что IL-6 может оказывать защитное действие на нервные клетки, также как и некоторое воздействие на воспалительные нейродегенеративные процессы (Gadientand Otten, 1997, Mendel et al., 1998). Было обнаружено, что IL-6 предотвращает индуцированную глутаматом гибель клеток нейронов гиппокампа (Yamada et al., 1994), а также полосатого тела (Toulmond etal., 1992). У трансгенных мышей, экспрессирующих высокие уровни как IL-6 человека, так и растворимого IL-6R (sIL-6-R) человека, наблюдали ускоренную регенерацию нервов после повреждения подъязычного нерва, как показано при помощи ретроградного мечения ядер клеток подъязычного нерва в мозге (Hirota et al., 1996). Кроме того, существуют некоторые свидетельства того, что IL-6 вовлечен в неврологическое заболевание, представляющее собой такое расстройство в виде демиелинизации, как рассеянный склероз (MS) (Mendel et al., 1998). Мыши, у которых отсутствует ген IL-6, были резистентными к экспериментальной индукции этого заболевания. С другой стороны, были сообщения, показывающие,что IL-6 оказывает негативное действие на выживание нейронов в ранней посттравматической фазе после повреждения нерва (Fisher et al., 2001). Биологическая активность IL-6 опосредована системой мембранных рецепторов, включающей два различных белка, один из которых называется IL-6-рецептором, или gp80, а другойgp130 (обзор Hiranoet al., 1994). gp130 представляет собой трансмембранный гликопротеин из 918 аминокислот, включая внутриклеточный домен, состоящий из 277 аминокислот, и является субъединичной составляющей нескольких цитокиновых рецепторов, включая рецепторы для IL-6, IL-11, LIF, онкостатина М, CNTF (силиальный нейротрофический фактор), СТ-1. При этом IL-6 является прототипом цитокинов, действующих через gp130, такое семейство цитокинов также называют "цитокинами IL-6 типа".gp130 принимает участие в образовании высокоаффинных рецепторов для этих цитокинов путем связывания с низкоаффинными цепями рецепторов. Следовательно, gp130 также был назван "преобразователем аффинности". Связывание лиганда с цитокиновым рецептором ведет к димеризации gp130 (показанной для IL-6-рецептора) или гетеродимеризации (показанной для рецепторов LIF, онкостатина М иCNTF) со связанным с gp130 белком, известным как LIFRбета-субъединица. Связывание с соответствующими лигандами связано с активацией/ассоциацией семейства тирозинкиназ, известных как киназыJanus (JAK), как первая стадия внутриклеточной трансдукции сигнала. Процессы внутриклеточной передачи сигнала включают фосфорилирование тирозина и факторы активации, называемые STAT (трансдуктор сигнала и активатор транскрипции). Оказалось, что генный продукт gp130 человека является гомологичным двум разным хромосомным локусам на хромосомах 5 и 17. Присутствие двух разных последовательностей гена gp130 ограничено приматами и не обнаружено у других позвоночных. Было показано, что активность передачи сигнала IL-6, IL-11, CNTF, онкостатина М и LIF может быть специфически блокирована разными моноклональными антителами, направленными против gp130. В дополнение к этому были обнаружены моноклональные антитела, непосредственно активирующиеgp130 независимо от присутствия цитокинов или их рецепторов. Другие моноклональные антитела, направленные против gp130, как было показано, ингибируют IL6-опосредованные функции. Растворимые формы gp130 (sgp130), имеющие молекулярную массу 90 и 110 кДа, были обнаружены в сыворотке человека. Они могут ингибировать биологические функций тех цитокинов, которые используют системы рецепторов с gp130 в качестве компонента. Растворимые формы IL-6R gp80 (SIL-6R), соответствующие внеклеточному домену gp80, являются естественными продуктами организма человека, обнаруженными в виде гликопротеинов в крови и моче(Novick et al., 1990, 1992). Исключительным свойством молекул SIL-6R является то, что они действуют как сильные агонисты IL-6 на многих типах клеток, включая клетки человека (Taga et al., 1989; Novick etal., 1992). Даже без внутрицитоплазматического домена gp80, SIL-6R еще способны запускать димеризацию gp130 в ответ на IL-6, которая, в свою очередь, опосредует последующий IL-6-специфический сигнал трансдукции и биологические эффекты (Murakami et al., 1993). SIL-6R имеет два типа взаимодействия с gp130, оба являющиеся важными для IL-6-специфической биологической активности (Halimi et al.,1995), и были сделаны предположения о гексамерной структуре активного IL-6-рецепторного комплекса,образованной двумя цепями gp130, двумя IL-6R и двумя IL-6-лигандами (Ward et al., 1994; Paonessa et al.,1995). Были описаны химерные молекулы, связывающие вместе растворимый рецептор IL-6 и IL-6 (Chebath et al., 1997, Fisher et al., 1997, WO 99/02552 и WO 97/32891). Они были обозначены как химера IL6R/IL-6 и Hyper-IL-6, соответственно, и далее будут называться IL-6R/IL-6. Химера IL-6R/IL-6 была образована слиянием полных кодирующих областей кДНК, кодирующих растворимый рецептор IL-6 (sIL6R) и IL-6 (Fisher et al., 1997; Chebath et al., 1997). Рекомбинантная химера IL-6R/IL-6 была продуцирована в клетках СНО (Chebath et al., 1997, WO 99/02552). Химера IL-6R/IL-6 связывается с gp130 цепью invitro с более высокой эффективностью, чем смесь IL-6 и sIL-6R (Kollet et al., 1999). Краткое описание изобретения В соответствии с настоящим изобретением, было обнаружено, что введение веществ, передающих сигналы через gp130, обеспечивало существенный благоприятный эффект в общепринятой модели диабетической невропатии животного. Взятые в качестве образца для испытаний вещества представляли собой IL-6 и химеру IL-6R/IL-6. Оба вещества показали статистически значимое благоприятное действие-6 006881 при диабетической невропатии, как показывает улучшение некоторых параметров, относящихся к жизнеспособности нервов. Изобретение, поэтому, относится к использованию вещества, передающего сигналы через gp130,для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Использование клеток, экспрессирующих вещества, передающие сигналы через gp130, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии является следующим объектом настоящего изобретения. Кроме того, в соответствии с настоящим изобретением векторы, включающие кодирующие последовательности для веществ, передающих сигналы через gp130,используют для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Краткое описание рисунков Фиг. 1 показывает изменение веса тела у экспериментальных животных. Фиг. 2 показывает степень гликемии на день 10(A) и день 40(B) после индукции диабета у группы экспериментальных животных при интраперитонеальном введении. Фиг. 3 показывает время в секундах, которое требовалось животным, получавшим интраперитонеальное введение, для отдергивания хвоста, помещенного на горячий источник. Фиг. 4 показывает потенциал мышечного действия соединения (СМАР) у животных, получавших интраперитонеальное введение, выраженный в латентности, в секундах. Фиг. 5 показывает скорость проводимости сенсорного нерва (SNVC) (м/с) у экспериментальных животных, получавших интраперитонеальное введение. Фиг. 6 показывает диаметр аксона (мкм) у экспериментальных животных, получавших интраперитонеальное введение. Фиг. 7 показывает диаметр волокна (мкм) у экспериментальных животных, получавших интраперитонеальное введение. Фиг. 8 показывает толщину миелина (мкм) у экспериментальных животных, получавших интраперитонеальное введение. Фиг. 9 показывает количество миелинизированных волокон в поле зрения микроскопа у экспериментальных животных, получавших интраперитонеальное введение. Фиг. 10 представляет собой схематическое изображение химерной структуры IL-6R/IL-6. Фиг. 11 показывает изменение веса тела у экспериментальных животных группы А, которые получали подкожное введение. Фиг. 12 показывает степень гликемии на день 10 и день 41 после индукции диабета у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 13 показывает время в секундах, которое требовалось экспериментальным животным группы А для отдергивания хвоста, помещенного на горячий источник, для животных, получавших подкожное введение. Фиг. 14 показывает количество пересеченных квадратов (А) и подъемов на задние лапы (В) для экспериментальных животных группы А, которые получали подкожное введение. Фиг. 15 показывает потенциал мышечного действия соединения (СМАР), выраженный в латентности в секунду, у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 16 показывает скорость проводимости сенсорного нерва (SNVC) (м/с) у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 17 показывает диаметр волокна (мкм) у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 18 показывает диаметр аксона (мкм) у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 19 показывает толщину миелина (мкм) у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 20 показывает процент дегенерации волокон у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 21 показывает процентное содержание миелинизированных волокон у экспериментальных животных группы А, для животных, получавших подкожное введение. Фиг. 22 показывает изменение веса тела у экспериментальных животных группы В, которые получали подкожное введение. Фиг. 23 показывает степень гликемии на день 10 и день 40 после индукции диабета у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 24 показывает время в секундах, которое требовалось экспериментальным животным группы В, для отдергивания хвоста, помещенного на горячий источник, для животных, получавших подкожное введение. Фиг. 25 показывает количество пересеченных квадратов (А) и подъемов на задние лапы (В) у экспериментальных животных группы В, для животных, получавших подкожное введение.-7 006881 Фиг. 26 показывает потенциал мышечного действия соединения (СМАР), выраженный в латентности, в секунду, у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 27 показывает скорость проводимости сенсорного нерва (SNVC) (м/с) у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 28 показывает диаметр волокна (мкм) у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 29 показывает диаметр аксона (мкм) у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 30 показывает толщину миелина (мкм) у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 31 показывает процент дегенерированных волокон у экспериментальных животных группы В,для животных, получавших подкожное введение. Фиг. 32 показывает процентное содержание миелинизированных волокон у экспериментальных животных группы В, для животных, получавших подкожное введение. Фиг. 33 показывает изменение веса тела у экспериментальных животных группы С, которые получали подкожное введение. Фиг. 34 показывает степень гликемии на день 10 и день 40 после индукции диабета у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 35 показывает время в секундах, которое требовалось для отдергивания хвоста, помещенного на горячий источник, экспериментальными животными группы С, для животных, получавших подкожное введение. Фиг. 36 показывает количество пересеченных квадратов (А) и подъемов на задние лапы (В) у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 37 показывает потенциал мышечного действия соединения (СМАР), выраженный в латентности, в секунду, у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 38 показывает скорость проводимости сенсорного нерва (SNVC) (м/с) у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 39 показывает диаметр волокна (мкм) у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 40 показывает диаметр аксона (мкм) у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 41 показывает толщину миелина (мкм) у экспериментальных животных группы С, для животных, получавших подкожное введение. Фиг. 42 показывает процент дегенерированных волокон у экспериментальных животных группы С,для животных, получавших подкожное введение. Фиг. 43 показывает процентное содержание миелинизированных волокон у экспериментальных животных группы С, для животных, получавших подкожное введение. Подробное описание изобретения Настоящее изобретение основано на открытии, что введение веществ, передающих сигналы черезgp130, приводит к значительному антиноцицептивному и нервно-регенеративному эффекту в установленной модели диабетической невропатии животного. Поэтому настоящее изобретение относится к использованию вещества, инициирующего передачу сигнала через рецептор интерлейкина-6 (IL-6) человека gp130 для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Как используется в данном описании, "вещество, передающее сигналы через gp130," представляет собой любую молекулу, активирующую путь передачи сигнала через gp130, т.е. любой агонист, стимулятор или активатор gp130-части рецепторного комплекса IL-6. Стимуляция может быть прямой, т.е. механизм активации может запускаться непосредственным связыванием с gp130. Примером такого непосредственного активатора является химера IL-6R/IL-6. Стимуляция может также быть косвенной, путем связывания с другим рецептором клеточной поверхности, который образует комплекс с gp130, таким образом, активируя его. IL-6 является примером такого косвенного активатора gp130. Другие примеры веществ, передающих сигналы через gp130, включают IL-11, LIF, онкостатин М (OSM), CNTF (цилиарный невротрофический фактор) и кардиотропин-1 (СТ-1), которые представляют собой так называемые "цитокины IL-6-типа". Такие цитокины запускают JAK/STAT путь, первым событием которого является индуцированная, лигандом гомо- или гетеродимеризация передающих сигнал рецепторных субъединиц. Все цитокины IL-6-типа рекрутируют gp130 в свои рецепторные комплексы. Они либо передают сигнал только через gp130, либо в комбинации с LIFR или OSMR, которые все способны активировать Jak и рекрутировать белки STAT. IL-6 индуцирует gp130-гомодимеризацию, тогда как CNTF, LIF и СТ-1 передают сигналы через гетеродимеризацию gp130 и LIFR.-8 006881 Термины "лечение" и "профилактика", как они используются в данном описании, необходимо понимать как предотвращение, ингибирование, уменьшение, облегчение или реверсию одного или нескольких симптомов или причины (причин) диабетической невропатии, а также симптомов, заболеваний или осложнений, сопровождающих диабетическую невропатию. При "лечении" диабетической невропатии, вещества по настоящему изобретению вводят после наступления заболевания, "профилактика" относится к введению веществ до того, как у пациента были отмечены какие-либо признаки заболевания. Профилактическое введение особенно полезно для пациентов с высоким риском, таких как пациенты,уже в течение длительного времени страдающие сахарным диабетом. Термин "диабетическая невропатия" относится к любой форме диабетической невропатии или к одному или нескольким симптомам или заболеваниям, которые сопровождают или которые вызваны диабетической невропатией, или осложнениям диабета, поражающим нервы, как подробно описано во вступительной части выше. В предпочтительном варианте осуществления изобретения диабетическая невропатия представляет собой полиневропатию. При диабетической полиневропатии одновременно поражаются многие нервы. Еще в одном предпочтительном варианте осуществления изобретения диабетическая невропатия представляет собой мононевропатию. При фокальной мононевропатии болезнь поражает отдельный нерв, такой как глазодвигательный или отводящий краниальный нерв. Заболевание называют множественной мононевропатией, когда поражены два или более нервов на отдельных участках. Предпочтительно, вещество представляет собой:b) фрагмент а), который связывается с gp80 и инициирует передачу сигнала через gp130;c) вариант а) или b), который имеет по меньшей мере 70%-ную идентичность последовательности с а) или b) и который инициирует передачу сигнала через gp130;d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей а) или b), в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; илиe) соль, гибридный белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130. Применение IL-6, как такового, особенно предпочтительно в соответствии с настоящим изобретением. IL-6 может быть нативным IL-6, т.е. IL-6, выделенным из природного источника, или рекомбинантно полученным IL-6. В соответствии с настоящим изобретением рекомбинантный IL-6 является особенно предпочтительным. В еще одном предпочтительном варианте осуществления изобретения вещество представляет собой:b) фрагмент а), который инициирует передачу сигнала через gp130;c) вариант а) или b) , который имеет по меньшей мере 70%-ную идентичность последовательности с а) или b) и который инициирует передачу сигнала через gp130;d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности ДНК, кодирующей а) или b), в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; илиe) соль, гибридный белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130."Химера IL-6R/IL-6" (также называемая " IL-6R/IL-6" или "IL-6-химера"), как этот термин используется в настоящем описании, представляет собой химерную молекулу, включающую растворимую часть gp130, слитую со всем или с биологически активной частью интерлейкина-6. Фрагменты химерного белка могут быть непосредственно слиты друг с другом или они могут быть связаны при помощи любого подходящего линкера, такого как дисульфидный мостик или полипептидный линкер. Линкер может быть коротким линкерным пептидом, длина которого может составлять всего 1-3 аминокислотных остатка, или длиннее, например, 13 или 18 аминокислотных остатков в длину. Такой линкер может представлять собой, например, трипептид, имеющий последовательность E-F-M (Glu-Phe-Met), или линкерную последовательность из 13 аминокислот, включающую Glu-Phe-Gly-Ala-Gly-Leu-Val-Leu-Gly-GlyGln-Phe-Met, введенную между аминокислотной последовательностью растворимого IL-6-рецептораgp130 и последовательностью IL-6. Примеры химеры IL-6R/IL-6 известны из уровня техники и подробно описаны, например, в WO 99/02552 или WO 97/32891. Пример химерной молекулы IL-6R/IL-6, которую можно использовать в соответствии с настоящим изобретением, схематически представлен на фиг. 2. Как он используется в настоящем описании, термин "вариант" относится в аналогам IL-6 или IL6R/IL-6-химеры, в которых один или несколько аминокислотных остатков природных компонентов IL6R/IL-6 заменены другими аминокислотными остатками, или делетированы, или один или несколько аминокислотных остатков добавлены к исходной последовательности IL-6 или IL-6R/IL-6 без существенного изменения активности полученных продуктов по сравнению с исходными IL-6 или IL-6R/IL-6-9 006881 химерой. Такие варианты получают известным методом синтеза и/или сайт-направленного мутагенеза или любым другим известным, подходящим для этого методом. Варианты в соответствии с настоящим изобретением включают белки, кодируемые нуклеиновыми кислотами, такими как ДНК или РНК, которые гибридизуются с комплементом ДНК или РНК, кодирующей IL-6 или IL-6R/IL-6 в умеренно жестких или жестких условиях. Термин "жесткие условия" относится к условиям гибридизации и последующей отмывки, которые специалисты обычно называют "жесткими". См. Ausubel et al., Current Protocols in Molecular Biology, supra, Interscience, N.Y., 6.3 and 6.4Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Без ограничения, примеры жестких условий включают условия отмывки на 12-20 С ниже расчетной Тm исследуемого гибрида, например, в 2 х SSC и 0,5% SDS в течение 5 мин, 2 х SSC и 0,1% SDS в течение 15 мин; 0,1 х SSC и 0,5% SDS при 37 С в течение 30-60 мин и затем 0,1 х SSC и 0,5% SDS при 68 С в течение 30-60 мин. Специалисты в данной области понимают, что жесткость условий также зависит от длины последовательностей ДНК, олигонуклеотидных зондов (например, 10-40 оснований) или смешанных олигонуклеотидных зондов. При использовании смешанных зондов, предпочтительно использовать хлоридтетраметиламмония (ТМАС) вместо SSC, см. Ausubel, выше. "Умеренно жесткие условия" относятся к условиям отмывки при более низких температурах, более низких концентрациях соли или детергента, таким как 0,2 х SSC/0,1% SDS при 42 С (Ausubel et al., 1989 выше). Любой такой вариант предпочтительно имеет последовательность аминокислот, в достаточной степени дублирующую последовательность IL-6 или IL-6R/IL-6, и, таким образом, имеет, по существу, такую же, или даже улучшенную, активность по сравнению с IL-6 или IL-6R/IL-6. Характерной активностью IL-6 является его способность к связыванию с gp80-частью IL-6 рецептора, и характерной активностью IL-6R/IL-6-химеры является ее способность к связыванию сgp130. Анализ типа ELISA для измерения связывания IL-6R/IL-6-химеры с gp130 был подробно описан в примере 7 на стр. 39 WO 99/02552, который полностью включен в данную заявку в качестве ссылки. Специалисту в данной области должно быть понятно, что аналогичный анализ ELISA можно применить и при определении связывания IL-6 с gp80. Если вариант обладает существенной активностью связывания с его соответствующей областью связывания gp80 или gp130, можно считать, что он обладает, по существу, такой же активностью как IL-6 или IL-6R/IL-6-химера. Таким образом, обладает ли данный вариант, по меньшей мере, существенно такой же активностью как IL-6 или IL-6R/IL-6, можно определить при помощи рутинного экспериментирования, включающего применение такого варианта, например, в простом сэндвич-анализе связывания для определения, связывается он или не связывается с иммобилизованным gp80 или gp130, как описано в примере 7 WO 99/02552. В предпочтительном варианте осуществления изобретения любой такой вариант имеет по меньшей мере 40% идентичность или гомологию с последовательностью зрелого IL-6 или IL-6R/IL-6-химерной молекулы, охватываемых WO 99/02552. Более предпочтительно, он имеет по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или наиболее предпочтительно по меньшей мере 90%-ную идентичность или гомологию с этой последовательностью. Идентичность отражает взаимоотношение между двумя или более полипептидными последовательностями или двумя или более нуклеотидными последовательностями, определяемую путем сравнения последовательностей. Как правило, под идентичностью подразумевают точное соответствие нуклеотида с нуклеотидом или аминокислоты с аминокислотой в двух нуклеотидных или двух полипептидных последовательностях, соответственно, по длине при сравнении по всей длине последовательностей. Для последовательностей, где нет точного соответствия, можно определить "% идентичности". Как правило, две сравниваемые последовательности выравнивают для получения максимального соответствия между последовательностями. Данный процесс может включать добавление "гэпов" либо в одну,либо в обе последовательности для повышения степени выравнивания. % идентичности может быть определен по всей длине каждой сравниваемой последовательности (так называемое глобальное выравнивание), что является особенно подходящим для последовательностей одинаковой или почти одинаковой длины, или по более коротким, определенным длинам (так называемое локальное выравнивание), что является более подходящим для последовательностей неравной длины. Методы сравнения идентичности и гомологии двух или более последовательностей хорошо известны из уровня техники. Так, например, для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии между двумя полипептидными последовательностями можно использовать, например, программы, имеющиеся в Wisconsin Sequence Analysis Package, version 9.1 (Devereux Jet al. 1984), например программы BESTFIT и GAP. BESTFIT использует алгоритм "локальной гомологии" Smith and Waterman (1981) и выявляет одну лучшую область сходства между двумя последовательностями. Другие программы для определения идентичности и/или сходства между последовательностями также известны из уровня техники, например семейство программ BLAST (Altschul S. F. et al., 1990,Altschul S. F. et al., 1997, доступные на сайте NCBI www.ncbi.nlm.nih,gov) и FASTA (Pearson W. R., 1990;- 10006881 Варианты IL-6 или IL-6R/IL-6-химеры, которые могут быть использованы в соответствии с настоящим изобретением, или кодирующие их нуклеиновые кислоты, включают ограниченный набор по существу соответствующих последовательностей в виде замещающих пептидов или полинуклеотидов, которые могут быть получены специалистом в данной области рутинным путем, без чрезмерного экспериментирования, на основании указаний и руководства, представленных в данной заявке. Предпочтительные изменения для вариантов в соответствии с настоящим изобретением включают такие, которые известны как "консервативные" замены. Консервативные аминокислотные замены IL-6 или IL-6R/IL-6-химеры могут включать синонимические аминокислоты в пределах группы, обладающие,по существу, одинаковыми физико-химическими свойствами, поэтому замена между членами группы будет сохранять биологическую функцию молекулы (Grantham, 1974). Понятно, что также можно осуществлять вставки и делеции аминокислот в указанных выше последовательностях, не изменяя при этом их функции, особенно, если вставки и делеции только охватывают несколько аминокислот, например менее тридцати и предпочтительно менее десяти, и при этом не удаляются и не замещаются аминокислоты,являющиеся критическими для функциональной конформации, например цистеиновые остатки. Белки и их варианты, полученные путем таких делеции и/или вставок, охватываются настоящим изобретением. Предпочтительно, группы синонимических аминокислот представляют собой группы, определенные в табл. 1. Более предпочтительно, группы синонимических аминокислот представляют собой группы, определенные в табл. 2; и наиболее предпочтительно, группы синонимических аминокислот представляют собой группы, определенные в табл. 3. Таблица 1. Предпочтительные группы синонимических аминокислот- 11006881 Таблица 2. Более предпочтительные группы синонимических аминокислот Таблица 3. Наиболее предпочтительные группы синонимических аминокислот Примеры осуществления замен аминокислот в белках, которые можно использовать для получения мутеинов IL-6 или IL-6R/IL-6-химеры, для использования в настоящем изобретении, включают стадии любых известных методов, такие как описанные в патентах США 4959314, 4588585 и 4737462, выданных Mark et al.; 5116943, выданном Koths et al.; 4965195, выданном Namen et al.; 4879111, выданном- 12006881 Конкретные варианты IL-6, являющиеся полезными в связи с настоящим изобретением, были описаны (WO 9403492A1). Кроме того, ЕР 667872 В 1 описывает мутантный IL-6 с улучшенной биологической активностью по сравнению с IL-6 дикого типа. В дополнение к этому, ЕР 656117 В 1 описывает способы выделения суперагонистов IL-6. Мутанты или суперагонисты могут использоваться в соответствии с настоящим изобретением. Термин "гибридный белок" относится к полипептиду, включающему IL-6 или IL-6R/IL-6-химеру,или его(ее) варианту или фрагменту, слитому с другим белком, который, например, имеет более длительное время пребывания в жидкостях организма. IL-6 или IL-6R/IL-6-химера могут, таким образом,быть слитыми с другим белком, полипептидом и т.п., например иммуноглобулином или его фрагментом. Термин "функциональные производные", как он используется в данном описании, охватывает производные IL-6 или IL-6R/IL-6-химеры и их варианты и гибридные белки, которые могут быть получены из функциональных групп, присутствующих в виде боковых цепей на остатках или N- или С-концевых групп, способами, известными из уровня техники, и включены в данное изобретение при условии, что они остаются фармацевтически приемлемыми, т.е. не разрушают активность белка, по существу, сходную с активностью IL-6 или IL-6R/IL-6, и не придают токсических свойств содержащим их композициям. Такие производные могут, например, включать полиэтиленгликолевые боковые цепи, которые могут маскировать антигенные сайты и продлевать время присутствия IL-6R/IL-6 в жидкостях организма. Другие производные включают алифатические сложные эфиры карбоксильных групп, амиды карбоксильных групп, образованные реакцией с аммиаком или с первичными или вторичными аминами, Nацильные производные свободных аминогрупп аминокислотных остатков, образованные с ацильными составляющими (например, алканоильными или карбоциклическими ароильными группами), или Оацильные производные свободных гидроксильных групп (например, групп сериновых или треониновых остатков), образованные с ацильными составляющими."Фрагмент" в соответствии с настоящим изобретением может, например, представлять собой активную часть IL-6 или IL-6R/IL-6. Термин фрагмент относится к любому подтипу данной молекулы, т.е. более короткому пептиду, который сохраняет желаемую биологическую активность, например, который обладает агонистической активностью gp130. Фрагменты можно легко получить путем удаления аминокислот с любого конца молекулы IL-6 или IL-6R/IL-6 и испытания полученного фрагмента на его свойства связывания с gp80 или gp130, соответственно. Протеазы для удаления одной аминокислоты за один раз либо с N-конца, либо с С-конца полипептида, известны из уровня техники, и таким образом, определение фрагментов, которые сохраняют желаемую биологическую активность, требует чисто рутинного экспериментирования. В виде фрагментов IL-6 или IL-6R/IL-6-химеры, их вариантов и гибридных белков, настоящим изобретением, кроме того, охватывается любой фрагмент или предшественники полипептидной цепи молекулы белка, отдельно или вместе со связанными молекулами или со связанными с ними остатками, такими как остатки сахаров или фосфатные остатки, или агрегаты белковой молекулы или остатков сахаров,как таковые, при условии, что указанный фрагмент обладает агонистической активностью в отношенииgp130, и особенно в отношении gp130. Термин "соли", как он использован в данном описании, относится как к солям карбоксильных групп, так и к кислотно-аддитивным солям аминогрупп молекулы IL-6 или IL-6R/IL-6 или их аналогов. Соли карбоксильных групп могут быть образованы способами, известными из уровня техники, и включают неорганические соли, например соли натрия, кальция, аммония, железа или цинка и т.п., и соли с органическими основаниями, например соли, образованные с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и т.д. Кислотно-аддитивные соли включают, например, соли с минеральными кислотами, такими как, например, хлористо-водородная кислота или серная кислота, и соли с органическими кислотами, такими как, например, уксусная кислота и щавелевая кислота. Конечно, любая такая соль должна сохранять биологическую активность IL-6 или IL-6R/IL-6-химеры, т.е. способность активировать передачу сигнала через gp130. В предпочтительном варианте осуществления настоящего изобретения вещество по настоящему изобретению является гликозилированным по одному или нескольким сайтам. Гликозилированная форма IL-6R/IL-6-химеры была описана в WO 99/02552 (PCT/IL98/00321), которая представляет собой химерную молекулу, являющуюся особенно предпочтительной в соответствии с настоящим изобретением. IL-6R/IL-6-химера, описанная в указанной заявке, представляет собой рекомбинантный гликопротеин, полученный путем слияния полной кодирующей последовательности природного растворимого IL-6-рецептора 6-Val (Novick et al., 1990) с полной кодирующей последовательностью зрелого природного IL-6, оба человеческого происхождения. Специалисту в данной области должно быть понятно, что гликозилированный IL-6 можно получить также рекомбинантными способами, т.е. путем экспрессии в эукариотических системах экспрессии. В соответствии с настоящим изобретением агонист может продуцироваться в любом соответствующем типе эукариотических или прокариотических клеток, таком как клетки дрожжей, клетки насекомых, бактерии и т.п. Предпочтительно, когда он продуцирован в клетках млекопитающих, наиболее- 13006881 предпочтительно в клетках СНО, полученных методами генной инженерии, как описано для IL-6R/IL-6 вWO 99/02552. Поскольку белок человеческого происхождения является предпочтительным, специалисту в данной области должно быть понятно, что в соответствии с настоящим изобретением можно использовать аналогичный гибридный белок любого другого происхождения, при условии, что он сохраняет биологическую активность, указанную в настоящей заявке. В следующем варианте воплощения настоящего изобретения вещество по настоящему изобретению не является гликозилированным. В этом случае химерная молекула предпочтительно может быть продуцирована в бактериальных клетках, которые не способны синтезировать гликозильные остатки, но обычно обеспечивают высокий выход продуцируемого рекомбинантного белка. Продукция негликозилированного IL-6 была подробно описана, например, в ЕР 504751 В 1. В еще одном варианте воплощения настоящего изобретения вещество по настоящему изобретению включает слияние с иммуноглобулином, т.е. молекулы в соответствии с настоящим изобретением слиты со всем или с частью иммуноглобулина и, в частности, с Fc-фрагментом иммуноглобулина. Способы получения слитых с иммуноглобулином белков хорошо известны из уровня техники, например способы,описанные в WO 01/03737. Специалисту в данной области должно быть понятно, что гибридный белок,полученный в соответствии с настоящим изобретением, сохраняет биологическую активность IL-6 илиIL-6R/IL-6-химеры, т.е. стимуляцию передачи сигнала gp130. Полученный гибридный белок в идеале обладает улучшенными свойствами, такими как более длительное время присутствия в жидкостях организма (время полужизни), повышенная специфическая активность, повышенный уровень экспрессии или более легкая очистка гибридного белка. Предпочтительно вещество по настоящему изобретению сливают с константной областью молекулы Ig. Оно может быть слитым с областями тяжелой цепи, такими как, например, СН 2- и СН 3-домены человеческого IgGl. Другие изоформы молекул Ig также являются подходящими для образования гибридных белков в соответствии с настоящим изобретением, например изоформы IgG2 или IgG4, или другие классы Ig, такие как, например, IgM или IgA. Гибридные белки могут, таким образом, быть мономерными или мультимерными, гетеро- или гомомультимерными. Функциональные производные вещества по настоящему изобретению могут быть конъюгированы с полимерами в целях улучшения свойств белка, таких как стабильность, время полужизни, биодоступность, переносимость организмом человека или иммуногенность. Поэтому предпочтительный вариант воплощения настоящего изобретения относится к функциональному производному вещества по настоящему изобретению, включающему по меньшей мере одну составляющую, связанную с одной или несколькими функциональными группами, присутствующими в виде одной или нескольких боковых цепей на аминокислотных остатках. Особенно предпочтительный вариант воплощения изобретения относится к веществу по настоящему изобретению, связанному с полиэтиленгликолем (ПЭГ). ПЭГилирование можно осуществлять известными способами, такими как способы, описанные, например, в WO 92/13095. Предпочтительно вещество, передающее сигналы через gp130, используют в количестве примерно от 0,1 до 1000 мкг/кг, или примерно от 1 до 500 мкг/кг, или меньше чем около 100 мкг/кг. Кроме того,предпочтительно использовать вещество, передающее сигналы через gp130, в количестве около 1 мкг/кг,или 3 мкг/кг, или 10 мкг/кг, или 30 мкг/кг. В предпочтительном варианте воплощения настоящего изобретения вещество, передающее сигнал через gp130, вводят ежедневно. В еще одном предпочтительном варианте воплощения настоящего изобретения вещество, передающее сигнал через gp130, вводят три раза в неделю. И в еще одном предпочтительном варианте воплощения настоящего изобретения вещество, передающее сигнал через gp130,вводят раз в неделю. Вещество по настоящему изобретению можно вводить любым подходящим для этого путем. Особенно предпочтительным в соответствии с настоящим изобретением является подкожный путь введения. Вещество по настоящему изобретению может быть доставлено к участку его действия в любой подходящей для этого форме. Предпочтительно, оно может быть доставлено в форме клеток, экспрессирующих и/или секретирующих IL-6, IL-6R/IL-6-химеру, их вариант, гибридный белок или активную часть. Как показано в приведенных ниже примерах, клетки, экспрессирующие и секретирующие IL6R/IL-6-химеру в достаточных количествах, были получены путем трансфекции клетки с использованием подходящего вектора экспрессии. Настоящее изобретение поэтому относится к использованию клетки, экспрессирующей вещество по настоящему изобретению, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Клетки можно вводить в любой подходящей форме. Однако инкапсулированные полимером, экспрессирующие и предпочтительно секретирующие IL-6 или IL-6R/IL-6-химеру клетки являются особенно предпочтительным способом доставки IL-6R/IL-6-химеры. Процедура инкапсулирования подробно описана, например, Emerich et al. (1994) или в US5853385. Подходящие линии клеток и системы стабильной экспрессии хорошо известны из уровня техники. Доставку вещества по настоящему изобретению также можно осуществлять с использованием вектора, такого как вектор экспрессии, включающий кодирующую последовательность IL-6, IL-6R/IL-6- 14006881 химеры, варианта, гибридного белка или его фрагмента. Вектор включает все регуляторные последовательности, необходимые для экспрессии желаемого белка в организме человека, и предпочтительно в периферических нервных клетках. Регуляторные последовательности для векторов экспрессии известны специалистам в данной области. Изобретение, таким образом, также относится к использованию вектора,включающего кодирующую последовательность вещества по настоящему изобретению, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. Любой известный из уровня техники вектор экспрессии можно использовать в соответствии с настоящим изобретением. Однако использование полученного на основе вируса генно-терапевтического вектора является особенно предпочтительным. Вещество по настоящему изобретению предпочтительно вводят в организм человека в виде фармацевтической композиции. Фармацевтическая композиция по настоящему изобретению может включать полипептид как таковой или клетки, экспрессирующие указанный полипептид, или вектор экспрессии, в частности лентивирусный генно-терапевтический вектор, включающий кодирующую последовательность IL-6, IL-6R/IL-6-химеры или его варианта, гибридного белка или активного фрагмента, необязательно вместе с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами, для лечения и/или профилактики диабетической невропатии. Определение "фармацевтически приемлемый" охватывает любой носитель, который не влияет на эффективность биологической активности активного ингредиента и который не является токсичным для хозяина, которому его вводят. Например, для парентерального введения, активный компонент может быть сформулирован в лекарственную форму для инъекций в таких носителях, как физиологический раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Активный компонент можно вводить пациенту различными путями. Пути введения включают внутрикожный, чрескожный (например, в композициях медленного высвобождения), внутримышечный,внутрибрюшинный, внутривенный, подкожный, пероральный, эпидуральный, местный и интраназальный пути. Можно использовать любой другой терапевтически эффективный путь введения, например абсорбцию через эпителиальную или эндотелиальную ткани или путем генной терапии, при которой пациенту вводят молекулу ДНК (например, через посредство вектора), что вызывает in vivo экспрессию и секретирование активного полипептида. Кроме того, активную молекулу можно вводить вместе с другими компонентами биологически активных веществ, таких как фармацевтически приемлемые поверхностно-активные вещества, эксципиенты, носители, разбавители и наполнители. Для парентерального (например, внутривенного, подкожного, внутримышечного) введения активный компонент может быть сформулирован в виде раствора, суспензии, эмульсии или лиофилизированного порошка вместе с фармацевтически приемлемым парентеральным носителем (например, вода, физиологический раствор, раствор декстрозы) и добавками для поддержания изотоничности (например,маннит) или химической стабильности (например, консерванты и буферы). Композицию стерилизуют обычно используемыми методами. Следующей целью настоящего изобретения является обеспечение способа лечения и/или профилактики диабетической невропатии, включающего введение пациенту, нуждающемуся в этом, эффективного количества вещества, инициирующего передачу сигнала через рецептор gp130 человека, необязательно вместе с фармацевтически приемлемым носителем."Эффективное количество" относится к количеству активных ингредиентов, достаточному для воздействия на ход и тяжесть заболеваний, описанных выше, приводящему к уменьшению или ремиссии такой патологии. Эффективное количество зависит от пути введения и состояния пациента. Вводимая пациенту доза, в виде единичной или множественной доз, варьирует в зависимости от различных факторов, включающих фармакокинетические свойства, путь введения, состояние пациента и его характеристики (пол, возраст, вес тела, состояние здоровья, размер), продолжительности симптомов,сопутствующего лечения, частоты принимаемого лечения и ожидаемого эффекта. Регулирование доз и манипулирование в установленных пределах находится в компетенции специалиста. Способ лечения диабетической невропатии, включающий введение пациенту, нуждающемуся в этом, эффективного количества клеток, экспрессирующих IL-6 или IL-6R/IL-6-химеру, или его (ее) вариант, гибридный белок, активную фракцию, также рассматривается настоящим изобретением. Способ лечения диабетической невропатии, включающий введение пациенту, нуждающемуся в этом, вектора экспрессии, включающего кодирующую последовательность IL-6 или IL-6R/IL-6-химеры, его (ее) варианта,гибридного белка или активной фракции, является еще одним объектом настоящего изобретения. В предпочтительном варианте осуществления настоящего изобретения вектор экспрессии представляет собой генно-терапевтический вектор. Использование вектора на основе вируса, в частности лентивирусного вектора, является особенно предпочтительным. Далее настоящее изобретение описывается более подробно при помощи не ограничивающих его примеров и сопроводительных чертежей. Имея полное описание настоящего изобретения, специалисту должно быть понятно, что то же самое можно осуществить в широких пределах эквивалентных параметров, концентраций и условий, без отступления от сути и объема настоящего изобретения и без чрезмерного экспериментирования.- 15006881 Поскольку настоящее изобретение было описано в связи с конкретными вариантами его осуществления, должно быть понятно, что возможны дополнительные модификации. Настоящая заявка предназначена для охвата любых вариантов, применений или адаптации данного изобретения, следуя, в основном, принципам изобретения и включая такие отступления от настоящего раскрытия, которые находятся в рамках обычно применяемой практики, известной в области техники, к которой относится настоящее изобретение, и которые можно отнести к существенным признакам, указанным выше, как следует из объема прилагаемой формулы изобретения. Все ссылки, указанные в данном описании, включая журнальные статьи или рефераты, опубликованные или неопубликованные заявки на патенты США или других стран, выданные патенты США или других стран или какие-либо другие ссылки, включены в данное описание во всей их полноте посредством ссылки, включая все данные, таблицы, рисунки и текст, представленные в цитируемых ссылочных документах. Кроме того, указанные в них ссылочные документы также включены во всей их полноте в данную заявку посредством ссылки. Ссылки на известные стадии способов, традиционные стадии способов, известные способы или традиционные способы ни в коем случае не являются признанием того, что какой-либо аспект, описание или вариант воплощения настоящего изобретения раскрыт, указан или был предложен в соответствующем уровне техники. Представленное выше описание конкретных вариантов осуществления так полно раскрывает общий характер данного изобретения, что специалист, обладающий сведениями, известными из уровня техники(включая содержание указанных в данном описании ссылочных документов), может легко модифицировать и/или адаптировать для различных применений такие специфические варианты воплощения настоящего изобретения, без чрезмерного экспериментирования, без отступления от общей концепции настоящего изобретения. Поэтому такие адаптации и модификации должны рассматриваться в рамках эквивалентов раскрытых вариантов воплощения настоящего изобретения на основании содержащихся в данном описании указаний и руководства. Должно быть понятно, что фразеология или терминология,используемые в данном описании, используются в целях описания, а не для ограничения, таким образом,фразеология или терминология данного описания должны интерпретироваться специалистом в свете указаний и руководства, представленных в данном описании, в сочетании со знаниями специалиста в данной области. ПРИМЕРЫ Пример 1. Продуцирование IL-6 и IL-6R/IL-6-химеры в клетках СНО IL-6R/IL-6-химера. Последовательности кДНК, кодирующие растворимый рецептор IL-6 (природная форма sIL-6R, обнаруженная в моче, Oh et al., 1997), были слиты с последовательностями, кодирующими зрелый IL-6. Присутствовали также последовательности для 3 образующих мостик аминокислот (EFM). Слитый ген вставляли в вектор экспрессии под контроль CMV промотора и вводили в клетки СНО. После осуществления процесса продуцирования полученный рекомбинантный белок очищали методом иммуноочистки с использованием моноклонального антитела против IL-6R. Было показано, что IL-6-химера является гликозилированной и имеет кажущуюся ММ 85000. На фиг. 10 схематически показана композиция IL-6R/IL-6-химеры. Зрелый белок включает 524 аминокислоты. Белок, полученный и очищенный, как указано выше, является подходящим для введения в соответствии с настоящим изобретением.IL-6 Рекомбинантный IL-6 человека (r-hIL-6) продуцируется в полученных методом генной инженерии клетках яичников китайского хомячка (СНО). Процесс продуцирования начинается с роста и размножения клеток из рабочего банка клеток (WCB) и продолжается в условиях, в которых r-hIL-6 секретируется в культуральную среду. Собранную, содержащую r-hIL-6 культуральную среду очищают методом иммунохроматографии с использованием специфического моноклонального антитела против IL-6 (mAB). Дальнейшие стадии очистки используют для выхода продукта с очень высокой степенью чистоты.r-hIL-6 поставляют в виде стерильного лиофилизированного препарата, содержащего подходящие эксципиенты. Он доступен в 2 разных количествах, 35 и 350 мкг, и его реструктурируют для применения водой для инъекций. Объем для восстановления в расчете на один флакон конечного сформулированного продукта обычно составляет 0,5 мл воды. Конечный продукт необходимо хранить в его исходном контейнере при температуре ниже 25 С. Структуру r-hIL-6 подтверждали методами масс-спектроскопии с бомбардировкой быстрыми атомами (FAB-MS), триптического картирования и аминокислотного секвенирования. Методы FAB спектроскопии и спектроскопии с использованием электроспрея использовали для определения композиции и структуры углеводных составляющих IL-6. Остаток аспарагин-46 идентифицировали как сайт Nгликозилирования, и предварительный анализ N-связанного углевода показал, что доминирующие виды представляют собой моносиалилфукозил-биантеннарную и дисиалилфукозил-биантеннарную структуры. Сайт О-гликозилирования был идентифицирован либо как треонин-138, либо как треонин-139.- 16006881 Пример 2. Эффект IL-6 в модели стрептозотозин-индуцированной диабетической невропатии при интраперитонеальном введении. Материалы и методы Животные Самцов крыс Sprague Dawley, возраста шести недель (Janvier, Le Genest-St-Isle, France) распределяли на 9 экспериментальных групп (n=10) в соответствии с таблицей рандомизации: (а) контрольная группа, получавшая носитель, которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02% (мас./об.); (b) контрольная группа, состоящая из животных, которым путем инъекции вводили IL-6 в дозе 100 мкг/кг, растворенный в стерильном растворе физиологический раствор-BSA 0,02% (масс./об.); (с) подвергнутая воздействию токсина - стрептозотоцина (STZ) группа, которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02% (мас./об.); (d) 5 обработанных, подвергнутых воздействию STZ-токсина групп, состоящих из животных, которым инъецировали соединение IL-6 в 5 различных дозах; 1, 3, 10, 30 и 100 мкг/кг; (е) подвергнутая воздействию STZтоксина группа и обработанная сравнительным соединением: 4-метилпирокатехин (4-МС) в дозе 10 мкг/кг. Животных по группам распределяли в клетки (по 2 животных в клетке) и содержали в помещении с контролируемой температурой (21-22 С) и с циклом свет/темнота (12 ч/12 ч) с неограниченным доступом к пище и воде. Все эксперименты осуществляли в соответствии с руководящими указаниями. Индукция диабета и фармакологическая обработка Диабет индуцировали инъекцией забуференного раствора стерптозотоцина (Sigma, L'Isle d'AbeauChesnes, France) в хирургически обнаженную левую большую вену ноги, в дозе 55 мг/кг веса тела. Лекарственное средство растворяли непосредственно перед инъекцией в 0,1 моль/л цитратном буфере с рН 4,5. День STZ-инъецирования считали как День (D) 0. Через неделю, в D 10, брали кровь из хвостовой вены для анализа на гликемию у каждого отдельного животного с использованием глюкометра (Glucotrend test, Roche, Mannheim, Germany). Животные,показавшие значение ниже 260 мг/дл, были исключены из исследования. Проверку на гликемию осуществляли на D 40 в конце эксперимента.IP обработку (носитель, IL-6 и 4-МС) осуществляли ежедневно с D 11 по D 40. Планирование экспериментов Вес тела и показатель выживания записывали ежедневно. Испытания отдергивания хвоста и ЭМГ проводили раз в неделю по следующей схеме:D 0: индукция диабета инъекцией STZD 40: контроль гликемии, испытания ЭМГ и отдергивания хвоста, извлечение седалищного нерва Тест на чувствительность: отдергивание хвоста Хвост крысы помещали под лампу с регулирующим экраном, используемую в качестве источника нагревания (Bioseb, Paris, France). Регистрировали период латентного состояния до отдергивания крысой хвоста от горячего источника. Сенсорные изменения увеличивают период латентности при отдергивании. Проводили два испытания и рассчитывали среднее значение, которое принимали за характеристическое значение. Электромиография Записи электрофизиологических исследований осуществляли с использованием электромиографического устройства Neuromatic 2000 М (EMG) (Dantec, Les Ulis, France). Крыс анестезировали интраперитонеальной инъекцией 60 мг/кг кетамина хлоргидрата (Imalgene 500, Rhne Mrieux, Lyon, France). Нормальную температуру тела поддерживали при 30 С при помощи нагревательной лампы и контролировали при помощи контактного термометра (Quick, Bioblock Scientific, Illkirch, France), размещенного на поверхности хвоста. Потенциал действия соединения на мышцы (СМАР) регистрировали в мышце, соединяющей брюшную полость с большой берцовой костью, после стимуляции седалищного нерва. Контрольный электрод и активную иглу вводили в заднюю лапу. Иглу заземления вводили в нижнюю часть спины крысы. Седалищный нерв стимулировали единичным импульсом 0,2 мс при сверхмаксимальной интенсивности. Скорость двигательной волны регистрировали и выражали в мс. Регистрировали также скорость проводимости эффективности нерва (SNCV). Электроды, вводимые в кожу хвоста, размещали следующим образом: контрольную иглу вставляли в основание хвоста, а иглу анода размещали на расстоянии 30 мм от контрольной иглы в направлении к концу хвоста. Иглу электрода заземления вставляли между иглой анода и контрольной иглой. Хвостовой нерв стимулировали серией из 20 импульсов (продолжительностью 0,2 мс) при интенсивности 12,8 мА. Скорость выражали в м/с. Морфометрический анализ Морфометрический анализ осуществляли в конце испытания (D 40) . Животных анестезировали и/п инъекцией 100 мг/кг Imalgene 500. 5 мм-сегмент седалищного нерва вырезали для гистологии. Ткань фиксировали в течение ночи 4% раствором глутаральдегида (Sigma, L'Isle d'Abeau-Chesnes, France) в растворе фосфатного буфера (рН=7,4) и сохраняли в 30% растворе сахарозы при +4 С до использования. Образец нерва фиксировали в 2% растворе тетроксида осмия (Sigma, L'Isle d'Abeau-Chesnes, France) в растворе фосфатного буфера в течение 2 ч, дегидратировали в серийном спиртовом растворе и погружали в Epon. Погруженные ткани затем выдерживали при +70 С в течение 3 дней полимеризации. Поперечные срезы 1,5 мкм вырезали при помощи микротома, окрашивали 1% раствором толуидина синего(Sigma, L'Isle d'Abeau-Chesnes, France) в течение 2 мин, дегидратировали и гистологический срез заключали в Eukitt. Исследовали двадцать срезов на образец при помощи оптического микроскопа (Nikon, Tokyo, Japan) и 6 произвольно выбранных срезов анализировали с использованием полуавтоматической цифровой программы анализа изображения (Biocorn, France). Исследовали два произвольно выбранных поля зрения микроскопа на срез. Рассчитывали следующие параметры: (а)диаметр волокон, (b)диаметр аксона, (с)толщина миелина (см. ниже). Для подсчета общего количества волокон на сечение нерва произвольно отбирали 3 среза на образец и анализировали 2 поля зрения микроскопа на срез. Анализ данных Общий анализ данных осуществляли с использованием однофакторного дисперсионного анализа или дисперсионного анализа с повторными измерениями (ANOVA) и одностороннего ANOVA. Когда анализ ANOVA показывал значительные расхождения, использовали критерий Dunnett. Никаких post-hoc анализов не осуществляли. Уровень значимости устанавливали р 0,05. Результаты выражали как среднее значениестандартная ошибка среднего значения (s.e.m.). РЕЗУЛЬТАТЫ Вес животного Как показано на фиг. 1, в этом исследовании была отмечена значительная разница в изменении веса тела между группами [f (8, 296)=19,47 и р 0,001; ANOVA с повторными измерениями]. С D 5 по D 40 подвергнутые воздействию STZ-токсина/IL-6-обработанные животные показали значительное снижение веса тела (р 0,05; односторонний ANOVA и р 0,05 контроль против (vs) STZ; контроль/IL-6 (100 мкг/кг)vs STZ; контроль vs STZ + IL-6 и контроль/IL-6 (100 мкг/кг) vs STZ + IL-6; критерий Dunnett). Диабетические животные, обработанные IL-6 в дозе 10 мкг/кг, показывали значительно больший вес тела по сравнению с животными, обработанными другими дозами IL-6 [f (5, 185)=1,16 и р=0,08;ANOVA с повторными измерениями]. Можно заметить, что подвергнутые воздействию STZ-токсина/обработанные IL-6 в дозе 100 мкг/кг животные показали снижение веса тела на протяжении всего периода исследования (начиная от начала обработки). Гликемия Фиг. 2 а показывает, что на D 10 контрольные животные демонстрировали значение гликемии, равное уровню 100 мг/дл. С другой стороны, подвергнутые воздействию STZ-токсина крысы показывали уровень глюкозы в плазме выше, чем 260 мг/дл, и их считали диабетическими животными. Фиг. 2b показывает, что подвергнутые воздействию STZ-токсина крысы оставались диабетическими вплоть до D 40. Тест на чувствительность: отдергивание хвоста Наблюдали значительную разницу между группами в эволюции поведения в испытании отдергивания хвоста [f (8, 16)=2,07 и р=0,013; ANOVA с повторными измерениями] (фиг. 3). Латентность перед тем как крысы отдергивали свой хвост от горячего источника значительно увеличивалась у диабетических, не обработанных животных (контроль/носитель vs STZ/носитель р 0,001; критерий Dunnett). На D 25 и D 40 время реакции не увеличивалось у животных, обработанных IL-6 при дозах 1, 3, 10 и 100 мкг/кг и обработанных 4-МС при дозе 10 мкг/кг. Действительно, не было обнаружено никакой разницы между этими группами (р 0,05; критерий Dunnett). Электрофизиологические измерения Латентность потенциала мышечного действия соединения Наблюдали значительную разницу между группами в латентности СМАР на протяжении всего исследования [f (8, 16)=5,901 и р=0,001; ANOVA с повторными измерениями]. Латентность значительно увеличивалась у диабетических необработанных крыс (на день 25 и день 40: р 0,001; одностороннийANOVA). Это увеличение было менее значительным у IL-6-обработанных групп; особенно для IL-6 (10 мкг/кг)-обработанной группы, которая на день 25 и день 40 не показала никакого значительного отличия в значении латентности от группы контроль/носитель (фиг. 4). Более того, на день 25 каждая из IL-6-обработанных/STZ групп показала значительно более короткую латентность СМАР, чем латентность СМАР у группы носитель/STZ (р=0,001, критерий Dunnett). На день 40 было сделано такое же заключение.- 18006881 Значительную разницу наблюдали между IL-6-обработанными/STZ животными (10 мкг/кг) и 4 другими IL-6-обработанными группами (1, 3, 10, 30 и 100 мкг/кг) (D 25 : р=0,002, D 40 : р=0,003; односторонний анализ ANOVA). Животные, обработанные дозой 3 мкг/кг и 10 мкг/кг, показали значительно более низкую латентность, чем STZ-группы, обработанные 1, 30 и 100 мкг/кг IL-6 (р 0,05; критерий Dunnett) на день 25, а также на день 40. Скорость проводимости сенсорного нерва Значительную разницу отмечали между группами в скорости проводимости сенсорного нерва(SNCV) на протяжении всего периода исследования [f (8, 16)=5,518 и р=0,001; ANOVA с повторными измерениями] (фиг. 5). Диабетические крысы показали значительное снижение SNCV (на дни 25 и 40 : р 0,001; односторонний ANOVA) в отличие от группы контроль/носитель. Более того, на день 25 не было отмечено никакой значительной разницы между группой контроль/носитель и IL-6-обработанной группой при дозе 10 мкг/кг (р=0,426; критерий Dunnett), тогда как между остальными группами наблюдали значительную разницу. На день 25 только группы 10 и 30 мкг/кг показывали значительную разницу с группойDunnett). На день 40 животные, обработанные 10 мкг/кг, не показали никакого значительного отличия от животных группы STZ/носитель, однако SNCV-значение для этой группы было выше, чем у другихSTZ/IL-6-обработанных животных. Можно заметить, что SNCV постепенно увеличивалась на протяжении периода исследования у животных группы контроль/носитель из-за нормального созревания структуры периферических нервов(Gao et al., 1995, Malone et al., 1996). Морфометрический анализ Диаметр аксона Была обнаружена значительная разница между группами в диаметре аксона (р 0,001; односторонний ANOVA) (фиг. 6). Животные группы носитель/STZ показывали значительное уменьшение диаметра аксона по сравнению с контрольными крысами (р=0,08; критерий Dunnett). Обработка IL-6 обращала в обратную сторону это уменьшение диаметра аксона, начиная с дозы 3 мкг/кг (IL-6-обработанные крысыvs STZ/носитель р 0,001; критерий Dunnett). Более того, значительную разницу отмечали между контрольной группой и группой контроль/IL-6 (100 мкг/кг) (р 0,001; критерий Dunnett). He было обнаружено никакой значительной разницы между группой контроль/носитель и 4-МС-обработанной группой(р=0,657; критерий Dunnett). Диаметр волокон На фиг. 7 показано, что нет значительной разницы между 9 группами в диаметре волокон (р 0,001,односторонний ANOVA). Введение STZ ведет к значительному уменьшению диаметра волокон (контроль/носитель vs STZ/носитель р=0,005; критерий Dunnett). Значительную разницу наблюдали между крысами группы носитель/STZ и IL-6-обработанными/STZ крысами (р 0,005; критерий Dunnett). IL-6 обработанные животные демонстрировали больший диаметр волокон, чем животные группы носитель/STZ. Более того, была обнаружена значительная разница между контрольной группой и группой контроль/IL-6 (100 мкг/кг) (р 0,001; критерий Dunnett). Животные, обработанные 4-МС при дозе 10 мкг/кг, не показали никакого значительного отличия от группы контроль/носитель (р=0,628; критерийDunnett). Толщина миелина Сравнение толщины миелина обнаружило значительную разницу между 9 группами (р 0,001; односторонний AN0VA) (фиг. 8). Толщина миелина была значительно меньше у животных группы носитель/STZ, чем у группы контроль/носитель и у IL-6-обработанных животных (3, 10, 30 и 100 мкг/кг)(р 0,01; критерий Dunnett). Следует отметить, что все IL-6-обработанные/STZ животные демонстрировали значительно большую толщину миелина, чем животные группы носитель/STZ. Более того, была отмечена значительная разница между группами контроль/носитель и контроль/IL-6 (100 мкг/кг) (р 0,001; критерий Dunnett). Общее количество миелинизированных волокон Как показано на фиг. 9, существует значительная разница между группами в общем количестве миелинизированных волокон (р 0,001; односторонний ANOVA). Животные группы носитель/STZ показали меньшее количество волокон, чем контрольные животные (р 0,001; критерий Dunnett). В отличие от этого, IL-6-обработанные/STZ животные имели большее количество волокон по сравнению с животными группы носитель/STZ (р 0,001; критерий Dunnett). Подвергнутые воздействию STZ-токсина животные,обработанные 4-МС, имели такое же общее количество волокон, что и у контрольных животных. Более того, не было отмечено никакой значительной разницы между группой контроль/носитель и группой контроль/IL-6 (100 мкг/кг). ЗАКЛЮЧЕНИЕ В данном исследовании животные, подвергнутые воздействию токсина-стрептозотоцина и у которых через несколько дней развился диабет, были использованы в качестве модели индуцированной невропатии. Животные становились диабетическими через 3-4 дня после индукции.- 19006881 Диабетических животных обрабатывали различными дозами IL-6 (1, 3, 10, 30 и 100 мкг/кг) постоянно в течение 30 дней. Лекарство вводили интраперитонеально ежедневно, начиная спустя 10 дней после индукции вплоть до умерщвления животных через 40 дней после STZ-индукции. Такую обработку можно считать лечебной обработкой, поскольку IL-6 вводили после первых молекулярных повреждений; вызванных продолжительной гипергликемией. Настоящий протокол показывает, что обработка IL-6 в течение 30 дней индуцирует нейрозащиту против диабетической невропатии. Поведенческие анализы с отдергиванием хвоста и EMG-анализ (сенсорные и двигательные скорости) показывает нейрозащитный эффект IL-6, особенно при дозах 3 и 10 мкг/кг. Более низкие дозы, также как и более высокие концентрации показывали нейрозащитный эффект. Действительно, чем больше повышались дозы, тем менее значимым был нейрозащитный эффект. Более того, при самой высокой дозе (100 мкг/кг) не наблюдался какой-либо выраженный эффект, и повидимому, эта доза оказывала токсический эффект на общее поведение STZ-животных. Контрольные животные (не обработанные STZ), обработанные IL-6 при дозе 100 мкг/кг были более возбудимыми, чем контрольные животные, получавшие носитель, или STZ-крысы, обработанные более низкими концентрациями IL-6. Более того, эти животные (IL-6 100 мкг/кг) представляли трудности для экспериментатора при манипулировании ими. То же самое наблюдали и в группе STZ/IL-6 100 мкг/кг. Тем не менее, эти животные казались менее возбудимыми (возможно из-за их слабости от большой потери веса тела). Нейрозащитный эффект сфокусирован на сенсорных волокнах, а также на двигательных волокнах(скорость СМАР не изменялась при обработке IL-6). С учетом морфологического анализа, нейрозащита, индуцированная обработкой IL-6, определенно имеет место при всех исследуемых дозах. В волокнах у животных группы STZ/носитель наблюдалось уменьшение миелиновой оболочки и изменение аксона, что в результате вызывает дегенерацию волокон(что демонстрируется уменьшением общего количества волокон). В данном исследовании было продемонстрировано, что обработка IL-6 (особенно 10 мкг/кг) защищала миелиновую оболочку и от дегенерации аксонов. Следует отметить, что высокая доза IL-6 (100 мкг/кг) оказывает неблагоприятное действие на волокна у здоровых животных. Действительно, кажется, что волокна страдают, нет потери волокон, но оболочка и общий внешний вид волокон изменяются. В то же время такой эффект не был отмечен у диабетических животных, обработанных такой большой дозой IL-6 (токсический эффект в основном фокусировался на общем поведении животного, характеризующемся большой потерей веса тела). В заключение, IL-6 индуцирует явный нейрозащитный эффект после последовательной обработки в течение 30 дней, воздействуя скорее на сенсорные, чем на двигательные волокна, вероятно действуя путем непосредственного эффекта на волокна и уменьшая воспалительные процессы нейродегенерации. Пример 3. Эффект IL-6 в модели стрептозотозин-индуцированной диабетической невропатии при подкожном введении. Целью этого исследования было определение эффекта IL-6, вводимого подкожным путем, при различных дозах и времени введения в той же самой модели невропатии. Животные Исследование А Самцов крыс Sprague Dawley, возраста шести недель (Janvier, Le Genest-St-Isle, France) распределяли на 6 экспериментальных групп в соответствии с таблицей рандомизации: (а) контрольная группа(n=4), получавшая носитель, которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02% (мас./об.); (b) подвергнутая воздействию токсина - стрептозотоцина (STZ) группа(n=10), которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02%(мас./об.); (с) 4 обрабатываемые, подвергнутые воздействию STZ-токсина группы (n=10), состоящие из животных, принимавших п/к инъекции соединения IL-6 в 4 различных дозах: 1, 3, 10 и 30 мкг/кг. Животных по группам распределяли в клетки (по 2 животных в клетке) и содержали в помещении с контролируемой температурой (21-22 С) и с циклом свет/темнота (12 ч/12 ч) с неограниченным доступом к пище и воде. Все эксперименты осуществляли в соответствии с руководящими указаниями. Исследование В Самцов крыс Sprague Dawley, возраста шести недель (Janvier, Le Genest-St-Isle, France) распределяли на 7 экспериментальных групп в соответствии с таблицей рандомизации: (а) контрольная группа, получавшая носитель (n=4), которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02% (мас./об.); (b) подвергнутая воздействию токсина - стрептозотоцина (STZ) группа(n=10), которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02%- 20006881 Животных по группам распределяли в клетки (по 2 животных в клетке) и содержали в помещении с контролируемой температурой (21-22 С) и с циклом свет/темнота (12 ч/12 ч) с неограниченным доступом к пище и воде. Все эксперименты осуществляли в соответствии с руководящими указаниями. Исследование С Самцов крыс Sprague Dawley, возраста шести недель (Janvier, Le Genest-St-Isle, France) распределяли на 6 экспериментальных групп в соответствии с таблицей рандомизации: (а) контрольная группа, получавшая носитель (n=4), которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02% (мас./об.); (b) подвергнутая воздействию токсина - стрептозотоцина (STZ) группа(n=10), которой вводили путем инъекции стерильный раствор физиологический раствор-BSA 0,02%(мас./об.); (с) 4 обрабатываемые, подвергнутые воздействию STZ-токсина группы (n=10), состоящие из животных, которым п/к инъецировали соединение IL-6 раз в неделю в 4 различных дозах: 1, 3, 10 и 30 мкг/кг. Животных по группам распределяли в клетки (по 2 животных в клетке) и содержали в помещении с контролируемой температурой (21-22 С) и с циклом свет/темнота (12 ч/12 ч) с неограниченным доступом к пище и воде. Все эксперименты осуществляли в соответствии с руководящими указаниями. Индукция диабета и фармакологическая обработка Диабет индуцировали инъекцией забуференного раствора стерптозотоцина (Sigma, L'Isle d'AbeauChesnes, France) в хирургически обнаженную левую большую вену ноги, в дозе 55 мг/кг веса тела. Лекарственное средство растворяли непосредственно перед инъекцией в 0,1 моль/л цитратном буфере с рН 4,5. День STZ инъецирования считали как День (D) 0. Через неделю, в D 10, брали кровь из хвостовой вены для анализа на гликемию у каждого отдельного животного с использованием глюкометра (Glucotrend test, Roche, Mannheim, Germany). Животные,показавшие значение ниже 260 мг/дл, были исключены из исследования. Проверку на гликемию осуществляли на D 40 в конце эксперимента. Обработку (носитель и IL-6) осуществляли в период с D 11 по D 40. Планирование экспериментов Вес тела и показатель выживания записывали ежедневно. Испытания отдергивания хвоста и ЭМГ проводили раз в неделю по следующей схеме:D 0: индукция диабета инъекцией STZD 24: испытание на отдергивание хвостаD 38: испытание на отдергивание хвостаD 40: контроль гликемии, ЭМГ - исследования, извлечение седалищного нерва Тест на чувствительность: отдергивание хвоста Хвост крысы помещали под лампу с регулирующим экраном, используемую в качестве источника нагревания (Bioseb, Paris, France). Регистрировали период латентного состояния до отдергивания крысой хвоста от горячего источника. Сенсорные изменения увеличивают период латентности при отдергивании. Проводили два испытания и рассчитывали среднее значение, которое принимали за характеристическое значение. Локомоторная активность в "открытом поле" Животное помещали в "открытое поле" (OF) из Plexiglas (80 х 80 х 40 см). Пол был разделен на 16 равных квадратов. Для каждого животного в течение 10-минутного периода вели записи спонтанной локомоторной активности и количества подъемов на задние лапы. Электромиография Записи электрофизиологических исследований осуществляли с использованием электромиографического устройства Neuromatic 2000 М (EMG) (Dantec, Les Ulis, France). Крыс анестезировали интраперитонеальной инъекцией 60 мг/кг кетамина хлоргидрата (Imalgene 500, Rhne Mrieux, Lyon, France). Нормальную температуру тела поддерживали при 30 С при помощи нагревательной лампы и контролировали при помощи контактного термометра (Quick, Bioblock Scientific, Illkirch, France), размещенного на поверхности хвоста. Потенциал мышечного действия соединения (СМАР) регистрировали в мышце, соединяющей брюшную полость с большой берцовой костью, после стимуляции седалищного нерва. Контрольный электрод и активную иглу вводили в заднюю лапу. Иглу заземления вводили в нижнюю часть спины крысы. Седалищный нерв стимулировали одиночным импульсом 0,2 мс сверхмаксимальной интенсивности. Скорость двигательной волны регистрировали и выражали в м/с. Регистрировали также скорость проводимости афферентного нерва (SNCV). Электроды, вводимые в кожу хвоста, размещали следующим образом: контрольную иглу вставляли в основание хвоста, а иглу- 21006881 анода размещали на расстоянии 30 мм от контрольной иглы в направлении к концу хвоста. Иглу электрода заземления вставляли между иглой анода и контрольной иглой. Хвостовой нерв стимулировали серией из 20 импульсов (в течение 0,2 мс) при интенсивности 12,8 мА. Скорость выражали в м/с. Морфометрический анализ Морфометрический анализ осуществляли в конце испытания (D 40). Животных анестезировали и/п инъекцией 100 мг/кг Imalgene 500. 5 мм-сегмент седалищного нерва вырезали для гистологии. Ткань фиксировали в течение ночи 4% раствором глутаральдегида (Sigma, L'Isle d'Abeau-Chesnes, France) в растворе фосфатного буфера (рН=7,4) и сохраняли в 30% растворе сахарозы при +4 С до использования. Образец нерва фиксировали в 2% растворе тетроксида осмия (Sigma, L'Isle d'Abeau-Chesnes, France) в растворе фосфатного буфера в течение 2 ч, дегидратировали в серийном спиртовом растворе и погружали в Epon. Погруженные ткани затем выдерживали при +70 С в течение 3 дней полимеризации. Поперечные срезы 1,5 мкм вырезали при помощи микротома, окрашивали 1% раствором толуидина синего(Sigma, L'Isle d'Abeau-Chesnes, France) в течение 2 мин, дегидратировали и гистологический срез заключали в Eukitt. Исследовали двадцать срезов на образец при помощи оптического микроскопа (Nikon, Tokyo, Japan) и 6 произвольно выбранных срезов анализировали с использованием полуавтоматической цифровой программы анализа изображения (Biocorn, France). Исследовали два произвольно выбранных поля зрения микроскопа на срез. Рассчитывали следующие параметры: (а) диаметр волокон, (b) диаметр аксона, (с) толщина миелина. Для подсчета общего количества волокон на сечение нерва, произвольно отбирали 3 среза на образец и анализировали 2 поля зрения микроскопа на срез. Анализ данных Общий анализ данных осуществляли с использованием однофакторного дисперсионного анализа или дисперсионного анализа с повторными измерениями (ANOVA) и одномерного ANOVA. Когда анализ ANOVA показывал значительные расхождения, использовали критерий Dunnett. Никаких post-hoc анализов не осуществляли. Уровень значимости устанавливали р 0,05. Результаты выражали как среднее значениестандартная ошибка среднего значения (s.e.m.). РЕЗУЛЬТАТЫ Исследование А Вес животного Как показано на фиг. 11, в этом исследовании была отмечена значительная разница в изменении веса тела между группами [f (5, 185)=9,20 и р 0,001; ANOVA с повторными измерениями]. С D 5 по D 40 подвергнутые воздействию STZ-токсина/IL-6-обработанные животные показали значительное снижение веса тела (р 0,05; односторонний ANOVA и р 0,05 контроль против (vs) STZ; контроль vs STZ + IL-6; критерий Dunnett). Диабетические животные, обработанные IL-6 в дозе 10 мкг/кг, показывали значительно больший вес тела по сравнению с животными, обработанными другими дозами IL-6 [f (4, 148)=2,93 и р=0,001;ANOVA с повторными измерениями]. Гликемия Фиг. 12 показывает, что на D 10 контрольные животные демонстрировали значение гликемии, равное уровню 120 мг/дл. С другой стороны, подвергнутые воздействию STZ-токсина крысы показывали уровень глюкозы в плазме выше чем 260 мг/дл, и их считали диабетическими животными. Отмечалось, что подвергнутые воздействию STZ-токсина крысы оставались диабетическими вплоть до D 41 (крыса 2 из группы STZ/IL-6 (10 мкг/кг) была исключена из исследования, т.к. имела гликемию ниже 260 мг/дл). Тест на чувствительность: отдергивание хвоста Не наблюдали какую-либо значительную разницу между группами в эволюции поведения в испытании отдергивания хвоста [f (5, 10)=1,81 и р=0,072; ANOVA с повторными измерениями] (фиг. 13). Тем не менее, латентность перед тем как крысы отдергивали свой хвост от горячего источника увеличивалась у диабетических, необработанных животных и животных, обработанных более высокими дозами IL-6. НаD 38 время реакции не увеличивалось у животных, обработанных IL-6 в дозах 1 и 3 мкг/кг. Действительно, не было обнаружено никакой значительной разницы между этими группами (р 0,05; критерий Dunnett). Локомоторная активность в OF Как показано на фиг. 14 А и 14 В, наблюдали существенную разницу между группами в количестве пересеченных квадратов и подъемов на задние лапы в течение всего периода исследования [соответственно, F (5, 10)=5,99 с р 0,001 и F (5, 10)=4,22 с р 0,001; ANOVA с повторными измерениями]. На день 25 и 40 диабетические, обработанные или необработанные, животные показывали более низкую локомоторную активность, которая характеризовалась значительным снижением количества пересеченных квадратов и подъемов на задние лапы (контроль vs STZ/носитель и контроль vs STZ/IL-6 р 0,01; критерий Dunnett).- 22006881 Нужно отметить, что животные, обработанные дозами 1 и 3 мкг/кг, демонстрировали более высокую локомоторную активность, чем крысы группы STZ/носитель. Электрофизиологические измерения Латентность потенциала мышечного действия соединения Наблюдали значительную разницу между группами в латентности СМАР на протяжении всего исследования [f (5, 10)=5,71 и р=0,001; ANOVA с повторными измерениями]. Латентность значительно увеличивалась у диабетических необработанных крыс (на день 26 и день 41: р 0,01; одностороннийANOVA). Более того, это увеличение было менее значительным в каждой IL-6-обработанной группе(фиг. 15). На день 26 и 41 каждая из STZ/IL-6-обработанных групп показала значительно более короткую латентность СМАР, чем латентность СМАР у группы STZ/носитель (р=0,05, критерий Dunnett). Скорость проводимости сенсорного нерва Значительную разницу отмечали между группами в скорости проводимости сенсорного нерва(SNCV) на протяжении всего периода исследования [f (5, 10)=3,78 и р=0,001; ANOVA с повторными измерениями] (фиг. 16). Диабетические крысы показали значительное снижение SNCV (в дни 26 и 41 : р 0,01; односторонний ANOVA) в отличие от группы контроль/носитель. На дни 26 и 41 все IL-6-обработанные животные показывали значительную разницу с группойSTZ/носитель (р 0,05, критерий Dunnett). Более того, на день 41 не наблюдали никакой значительной разницы между группой контроль/носитель и группами, обработанными 3 и 30 мкг/кг IL-6 (соответственно, р=0,054 и р=0,184; критерий Dunnett), тогда как между остальными группами наблюдалась значительная разница. Морфометрический анализ Диаметр волокон На фиг. 17 показано, что наблюдали значительную разницу между группами в диаметре волокон(р 0,001, односторонний ANOVA). Уменьшение диаметра волокон наблюдали у диабетических крыс по сравнению с группой контроль/носитель (р=0,001; критерий Dunnett). Более того, IL-6 обработка при всех испытываемых дозах значительно предохраняла против уменьшения этого диаметра (группаSTZ/носитель vs STZ/IL-6-обработанная группа : р 0,05; критерий Dunnett). Диаметр аксона Была обнаружена значительная разница между группами в диаметре аксона (р 0,001; односторонний ANOVA) (фиг. 18). Животные группы STZ/носитель показывали значительное уменьшение диаметра аксона (группа контроль/носитель vs группа STZ/носитель : р 0,001; критерий Dunnett). Животные, обработанные IL-6, при всех испытываемых дозах демонстрировали гораздо больший диаметр аксона, чем у диабетических необработанных крыс (р 0,05; критерий Dunnett). Толщина миелина Сравнение толщины миелина обнаружило значительную разницу между группами (р 0,001; односторонний ANOVA) (фиг. 19). Значительное уменьшение толщины миелина наблюдали у диабетических крыс по сравнению с животными группы контроль/носитель (р 0,001; критерий Dunnett). Более того, это уменьшение было менее значительным в IL-6-обработанных группах (р 0,05; критерий Dunnett). Процент дегенерированных волокон Как показано на фиг. 20 и 21, диабетические и необработанные крысы показывали значительное уменьшение миелинизированных волокон (р 0,001; односторонний ANOVA). Обработка IL-6 в дозах 3,10 и 30 мкг/кг ежедневно значительно снижала процент дегенерированных волокон по сравнению с группой STZ/носитель (р 0,001; критерий Dunnett). Исследование В Вес животного Была отмечена значительная разница в изменении веса тела между группами [f (6, 168)=9,24 и р 0,001; ANOVA с повторными измерениями] (фиг. 22). С D 5 по D 40 подвергнутые воздействию STZтоксина животные показали значительное снижение веса тела (р 0,05; односторонний ANOVA и р 0,001 контроль/носитель vs STZ; контроль/носитель vs STZ-IL-6-обработанных групп; критерий Dunnett). Не было обнаружено никакой значительной разницы в весе тела между STZ/IL-6-обработанными группами с D 5 по D 40 [f (5, 125)=1,08 и р=0,26; ANOVA с повторными измерениями]. Гликемия Фиг. 23 показывает, что на D 10 подвергнутые воздействию STZ-токсина крысы показывали уровень глюкозы в плазме выше, чем 260 мг/дл, тогда как контрольные животные показывали значение гликемии около 100 мг/дл. Более того, на D 40 подвергнутые воздействию STZ-токсина крысы все еще оставались диабетическими, имея гликемию на уровне 500 мг/дл. Тест на чувствительность: отдергивание хвоста Наблюдалась значительная разница между группами в эволюции поведения в испытании отдергивания хвоста [f (6, 12)=2,13 и р=0,02; ANOVA с повторными измерениями] (фиг. 24). На D 24 и 38 диабе- 23006881 тические и необработанные крысы показывали значительное увеличение времени реакции по сравнению с контроль/носитель и STZ/IL-6-обработанными группами (р 0,05; критерий Dunnett). Более того, время реакции меньше увеличивалось у животных, обработанных IL-6 в дозах 10 и 30 мкг/кг. Локомоторная активность в OF Как показано на фиг. 25 А и 25 В, существует значительная разница между группами в количестве пересеченных квадратов и подъемов на задние лапы в течение всего периода исследования [соответственно, F (5, 10)= с р 0,001 и F (5, 10)= с р 0,001; ANOVA с повторными измерениями]. На день 25 и 40 диабетические, обработанные или необработанные, животные показывали более низкую локомоторную активность, которая характеризовалась значительным снижением количества пересеченных квадратов и подъемов на задние лапы (контроль vs STZ/носитель и контроль vs STZ/IL-6 р 0,05; критерий Dunnett). Электрофизиологические измерения Латентность потенциала мышечного действия соединения Как показано на фиг. 26, наблюдали значительную разницу между группами в латентности СМАР на протяжении всего исследования [f (6, 12)=3,97 и р 0,001; ANOVA с повторными измерениями]. На день 26 и день 40 значительное увеличение латентности наблюдали у диабетических необработанных крыс и у животных, обработанных низкими дозами IL-6 (р 0,001; односторонний ANOVA). Более того,не обнаружено никакой значительной разницы между группами контроль/носитель и STZ/IL-6 обработки(10 и 30 мкг/кг) (р 0,05; односторонний ANOVA). Скорость проводимости сенсорного нерва Значительную разницу отмечали между группами в скорости проводимости сенсорного нерва(SNCV) на протяжении всего периода исследования [f (6, 12)=3,38 и р 0,001; ANOVA с повторными измерениями] (фиг. 27). Начиная с D 26 диабетические и обработанные или необработанные крысы показали снижение SNCV (D 26 : р 0,001 и D 40: р 0,001; односторонний ANOVA). На D 26 животные группы контроль/носитель и STZ/IL-6-обработанные животные показывалиSNCV, значительно более высокую, чем у крыс группы STZ/носитель (р 0,05, критерий Dunnett). На D 40 крысы, обработанные IL-6, при более высоких дозах, показывали более значительнуюSNCV, чем у группы STZ/носитель. Морфометрический анализ Диаметр волокон На фиг. 28 показано, что наблюдали значительную разницу между группами в диаметре волокон(р=0,045, односторонний ANOVA). Значительное уменьшение диаметра волокон наблюдали у подвергнутых воздействию STZ-токсина животных по сравнению с группой контроль/носитель (р 0,05; критерий Dunnett). Ежедневная и/п обработка IL-6 значительно предохраняла против уменьшения этого диаметра (группа STZ/носитель vs STZ/IL-6-обработанная группа : р 0,026; критерий Dunnett). Диаметр аксона Была обнаружена значительная разница между группами в диаметре аксона (р=0,034; односторонний ANOVA) (фиг. 29). Подвергнутые воздействию STZ-токсина животные показывали значительное уменьшение диаметра аксона (р 0,05; критерий Dunnett). Крысы, обработанные IL-6 при и/п в дозе 10 мкг/кг, демонстрировали значительное отличие от группы животных STZ/носитель (р=0,045; критерийDunnett). Толщина миелина Сравнение толщины миелина обнаружило значительную разницу между группами (р=0,05; односторонний ANOVA) (фиг. 30). Значительное уменьшение толщины миелина наблюдали у подвергнутых воздействию STZ-токсина животных (р 0,05; критерий Dunnett). Ежедневная и/п обработка IL-6 предохраняла от такого уменьшения толщины миелина (STZ/носитель vs STZ/IL-6 и/п : р 0,005; критерийDunnett). Процент дегенерированных волокон Как показано на фиг. 31 и 32, была обнаружена значительная разница между группами в проценте дегенерированных волокон (р 0,001; односторонний ANOVA). Этот процент был существенно выше в группе STZ/носитель, чем в группе контроль/носитель (р 0,001; критерий Dunnett). Процент был значительно ниже у IL-6-обработанных животных (STZ/носитель vs STZ/IL-6 : р 0,001; критерий Dunnett). Исследование С Вес животного Как показано на фиг. 33, на протяжении всего периода исследования наблюдалась значительная разница в изменении веса тела между группами [f (5, 145)=15,46 и р 0,001; ANOVA с повторными измерениями]. С D 5 по D 40 подвергнутые воздействию STZ-токсина животные показали значительное снижение веса тела (р 0,001; односторонний ANOVA и р 0,001 контроль/носитель vs STZ; контроль/носитель vs STZ-IL-6-обработанные группы; критерий Dunnett). Более того, животные, обработанные IL-6 в дозе 30 мкг/кг, показывали значительно меньшее снижение веса тела, чем другие IL-6-обработанные группы [f (4, 104)=2,17 и р 0,001; ANOVA с повторными измерениями].- 24006881 Гликемия Фиг. 34 показывает, что группа контроль/носитель демонстрировала значение гликемии 120 мг/дл на D 10 и D 40. С другой стороны, подвергнутые воздействию STZ-токсина крысы показывали уровень глюкозы в плазме выше, чем 260 мг/дл, таким образом, они считались диабетическими на D 10 и D 40. Тест на чувствительность: отдергивание хвоста На протяжении всего периода исследования наблюдалась значительная разница между группами во времени реакции [f (5, 10)=2,30 и р=0,02; ANOVA с повторными измерениями] (фиг. 35). Латентность до того, как крысы отдергивали свой хвост от горячего источника, значительно увеличивалась у животных группы STZ/носитель (на D 24 и D 38: р 0,005; односторонний ANOVA). На D 24 не наблюдалось никакой существенной разницы в латентности реакции между группами контроль/носитель и STZ/IL-6 (30 мкг/кг) (р=0,31; критерий Dunnett). На D 38 крысы, обработанные IL-6 в дозах 10 и 30 мкг/кг, показывали такое же время реакции, как и у контрольной группы (р=0,3; критерий Dunnett). Локомоторная активность в OF На день 25 и D 39 (фиг. 36 А и 36 В) подвергнутые воздействию STZ-токсина, обработанные и необработанные животные показывали более низкую локомоторную активность по сравнению с контрольными крысами (р 0,05; критерий Dunnett). Такую разницу отмечали в среднем количестве пересеченных квадратов и количестве подъемов на задние лапы на протяжении всего периода ведения записей исследований. Несмотря на это, группа животных, обработанных IL-6 в дозе 30 мкг/кг, демонстрировала лучшую локомоторную активность по сравнению с группой STZ/носитель. Электрофизиологические измерения Латентность потенциала мышечного действия соединения Не наблюдали никакой существенной разницы между группами в латентности СМАР на протяжении всего периода исследования [f (5, 10)=1,33 и р=0,23; ANOVA с повторными измерениями] (фиг. 37). Тем не менее, на день 26 и день 40 наблюдали значительную разницу между группами (р 0,05; одностороннийANOVA). Подвергнутые воздействию STZ-токсина крысы показывали увеличение латентности по сравнению с группой контроль/носитель. Более того, это увеличение было менее значительным в группах, обработанных более высокими дозами IL-6, действительно значительная разница была отмечена между группамиSTZ/носитель vs STZ/IL-6 при дозе 30 мкг/кг : р 0,005; критерий Dunnett). Скорость проводимости сенсорного нерва Как показано на фиг. 38, отмечали значительную разницу между группами в скорости проводимости сенсорного нерва на протяжении всего периода исследования [f (5, 10)=2,18 и р=0,025; ANOVA с повторными измерениями]. Значительное снижение скорости наблюдали у подвергнутых воздействиюDunnett). Кроме того, обработка IL-6 в дозах 10 и 30 мкг/кг приводила к менее значимой потери скорости у диабетических животных (на D 26, STZ/IL-6 при дозах 10 и 30 мкг/кг vs STZ/носитель: р 0,05; критерий Dunnett). Морфометрический анализ Диаметр волокон На фиг. 39 показано, что наблюдали значительную разницу между группами в диаметре волокон(р 0,001, односторонний ANOVA). Значительное уменьшение диаметра волокон наблюдали у подвергнутых воздействию STZ-токсина животных по сравнению с крысами группы контроль/носитель(р 0,005; критерий Dunnett). Обработанные IL-6 животные (при любых дозах) показывали значительно больший диаметр волокон по сравнению с крысами группы STZ/носитель (р 0,05; критерий Dunnett). Диаметр аксона Была обнаружена значительная разница между группами в диаметре аксона (р 0,001; односторонний ANOVA) (фиг. 40). Значительное уменьшение диаметра аксона наблюдали у подвергнутых воздействию STZ-токсина животных (р 0,01; критерий Dunnett). Крысы, обработанные IL-6 в дозе 1, 3, 10 и 30 мкг/кг, демонстрировали значительное отличие от группы животных STZ/носитель (р 0,05; критерийDunnett). Толщина миелина Сравнение толщины миелина обнаружило значительную разницу между группами (р 0,001; односторонний ANOVA) (фиг. 41). Значительное уменьшение толщины миелина наблюдали у подвергнутых воздействию STZ-токсина животных (р 0,001; критерий Dunnett). Ежедневная п/к обработка IL-6 предохраняла от такого уменьшения толщины миелина (STZ/носитель vs STZ/IL-6 1 и 30 мкг/кг: р 0,005; критерий Dunnett). Процент дегенерированных волокон Как показано на фиг. 42 и 43, была обнаружена значительная разница между группами в проценте функциональных миелинизированных волокон (р 0,001; односторонний ANOVA). Этот процент был существенно ниже в группе STZ/носитель, чем в группе контроль/носитель (р 0,001; критерий Dunnett). Процент был значительно выше у группы, получавшей IL-6 в дозах 3, 10 и 30 мкг/кг (р 0,001; критерий- 25006881 ЗАКЛЮЧЕНИЕ В данном исследовании животные, подвергнутые воздействию стрептозотоцина и у которых через несколько дней развился диабет, были использованы в качестве модели индуцированной невропатии. Диабетических животных обрабатывали различными дозами IL-6 (1, 3, 10 и 30 мкг/кг) постоянно в течение 30 дней. Лекарство вводили подкожно ежедневно (исследование А), 3 раза в неделю (исследование В) и раз в неделю (исследование С), начиная через 10 дней после индукции вплоть до умерщвления животных через 40 дней после STZ-индукции. Такую обработку можно считать лечебной обработкой,поскольку IL-6 вводили после первых молекулярных повреждений, вызванных продолжительной гипергликемией. Настоящий протокол показывает, что обработка IL-6 в течение 30 дней, независимо от схемы введения, индуцирует нейрозащиту против диабетической невропатии. Поведенческие анализы с отдергиванием хвоста и EMG-анализ (сенсорные и двигательные скорости) показывают нейрозащитный эффектIL-6 при подкожном введении. Нейрозащитный эффект сфокусирован на сенсорных волокнах, а также на двигательных волокнах(скорость СМАР не изменялась при обработке животных IL-6). Это соединение предотвращает потерю волокнами миелиновой оболочки и их дегенерацию. По сравнению с ежедневной и/п обработкой (см. предыдущее исследование, осуществленное в Neurofit, August 2001) ежедневное введение IL-6 подкожным путем оказывается столь же эффективным, как и интраперитонеальная обработка (см. пример 2) при всех испытанных дозах. Кроме того, более низкая доза при введении IL-6 раз или три раза в неделю не приводила к уменьшению нейрозащитного эффекта соединения. Очевидно, что обработка 3 раза в неделю показала лучший нейрозащитный эффект (особенно при дозах 10 и 30 мкг/кг) без какого-либо побочного эффекта на общее поведение STZ-животных. ЛИТЕРАТУРА 1. Altschul S. F. et al., J Mol Biol, 215, 403-410, 1990. 2. Altschul S. F. et al., Nucleic Acids Res., 25:389-3402, 1997. 3. Britland S.T., Young R.T., Sharma AK, and Clarke BF. Diabetes, 39, 898-908, (1990). 4. Breighton, В. and Hayden, M.R.: S. Afr. Med. J. 1981 Feb 21; 59(8): 250. 5. Chebath, J., Fischer, D., Kumar, A., Oh, J.W., Kollet, O., Lapidot, Т., Fischer, M., Rose-John, S.,Nagler, A., Slavin, S. and Revel, M. Eur. Cytokine Netw. 1997 8,359-365. 6. Devereux J et al, Nucleic Acids Res, 12, 387-395, 1984. 7. Emerich D.F., Cain CK, Greco C., Saydoff J.A., Hu Z.Y., Liu H., Lindner M.D. Cell Transplant. 1997affinity interleukin-6 receptor is a hexameric complex consisting of two molecules each of interleukin-6, interleukin-6 receptor and gp130. J. Biol. Chem. 1994, 269: 23286-23289. 36. Yamada, M., and Hatanaka, H.: Brain Res 1994, 643, 173-80. 37. Zilberstein et al., EMBO J 5:2529 (1986). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение вещества, передающего сигналы через gp130, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии, где указанное вещество представляет собой:b) фрагмент а), который связывается с gp80 и инициирует передачу сигнала через gp130;c) вариант а) или b), который по меньшей мере на 70% идентичен последовательности а) или b) и который инициирует передачу сигнала через gp130;d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом нативной последовательности ДНК, кодирующей а) или b) в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; илиe) соль, слитый белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130. 2. Применение по п.1, где диабетическая невропатия представляет собой полиневропатию. 3. Применение по п.1, где диабетическая невропатия представляет собой мононевропатию. 4. Применение по п.1, где IL-6 представляет собой рекомбинантный IL-6. 5. Применение по любому из пп.1-3, где вещество представляет собой:b) фрагмент а), который связывается и инициирует передачу сигнала через gp130;c) вариант а) или b), который по меньшей мере на 70% идентичен последовательности а) или b) и который инициирует передачу сигнала через gp130;d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности ДНК, кодирующей а) или b), в умеренно жестких условиях, и который инициирует передачу сигнала через gp130; или е) соль, слитый белок или функциональное производное а), b), с) или d), которые инициируют передачу сигнала через gp130. 6. Применение по любому из предшествующих пунктов, где указанное вещество является гликозилированным по одному или нескольким сайтам. 7. Применение по любому из пп.1-6, где указанное вещество не является гликозилированным. 8. Применение по любому из пп.1-7, где слитый белок слит с иммуноглобулином (Ig). 9. Применение по любому из пп.1-8, где функциональное производное включает по меньшей мере одну составляющую, присоединенную к одной или нескольким функциональным группам, присутствующим в виде одной или нескольких боковых цепей на аминокислотных остатках. 10. Применение по п.9, где указанная составляющая представляет собой полиэтиленовую составляющую. 11. Применение по любому из предшествующих пунктов, где вещество, передающее сигналы черезgp130, используют в количестве в пределах от около 0,1 до 1000 мкг/кг или от около 1 до 500 мкг/кг или меньше чем около 100 мкг/кг. 12. Применение по п.11, где вещество, передающее сигналы через gp130, используют в количестве от около 1, или 3, или 10, или 30 мкг/кг. 13. Применение по любому из предшествующих пунктов, где вещество, передающее сигналы черезgp130, вводят ежедневно. 14. Применение по любому из пп.1-12, где вещество, передающее сигналы через gp130, вводят три раза в неделю. 15. Применение по любому из пп.1-12, где вещество, передающее сигналы через gp130, вводят раз в неделю.- 27006881 16. Применение вектора для индукции и/или усиления эндогенной продукции IL-6 в клетке для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. 17. Применение клетки, которая была генетически модифицирована, для получения вещества, которое может использоваться по любому из пп.1-8, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. 18. Применение вектора экспрессии, включающего кодирующую последовательность вещества, которое может использоваться по любому из пп.1-8, для получения лекарственного средства для лечения и/или профилактики диабетической невропатии. 19. Способ лечения и/или профилактики диабетической невропатии, включающий введение пациенту, нуждающемуся в этом, эффективного количества вещества, которое может использоваться по любому из пп.1-8, необязательно, вместе с фармацевтически приемлемым носителем.
МПК / Метки
МПК: A61K 38/17, A61K 38/20, A61K 48/00, A61K 47/48, A61K 35/12, A61K 31/7088, A61P 25/02, C07K 19/00
Метки: невропатии, активаторов, gp130, применение, диабетической
Код ссылки
<a href="https://eas.patents.su/30-6881-primenenie-aktivatorov-gp130-pri-diabeticheskojj-nevropatii.html" rel="bookmark" title="База патентов Евразийского Союза">Применение активаторов gp130 при диабетической невропатии</a>
Предыдущий патент: Композиции, содержащие поксвирус, и способ изготовления устойчивых композиций, содержащих поксвирус
Следующий патент: Расклиненная трещина с высокоэффективной площадью поверхности
Случайный патент: Способ заполнения водой и удаления воздуха из главного первого контура ядерного энергоблока и крышка для осуществления этого способа