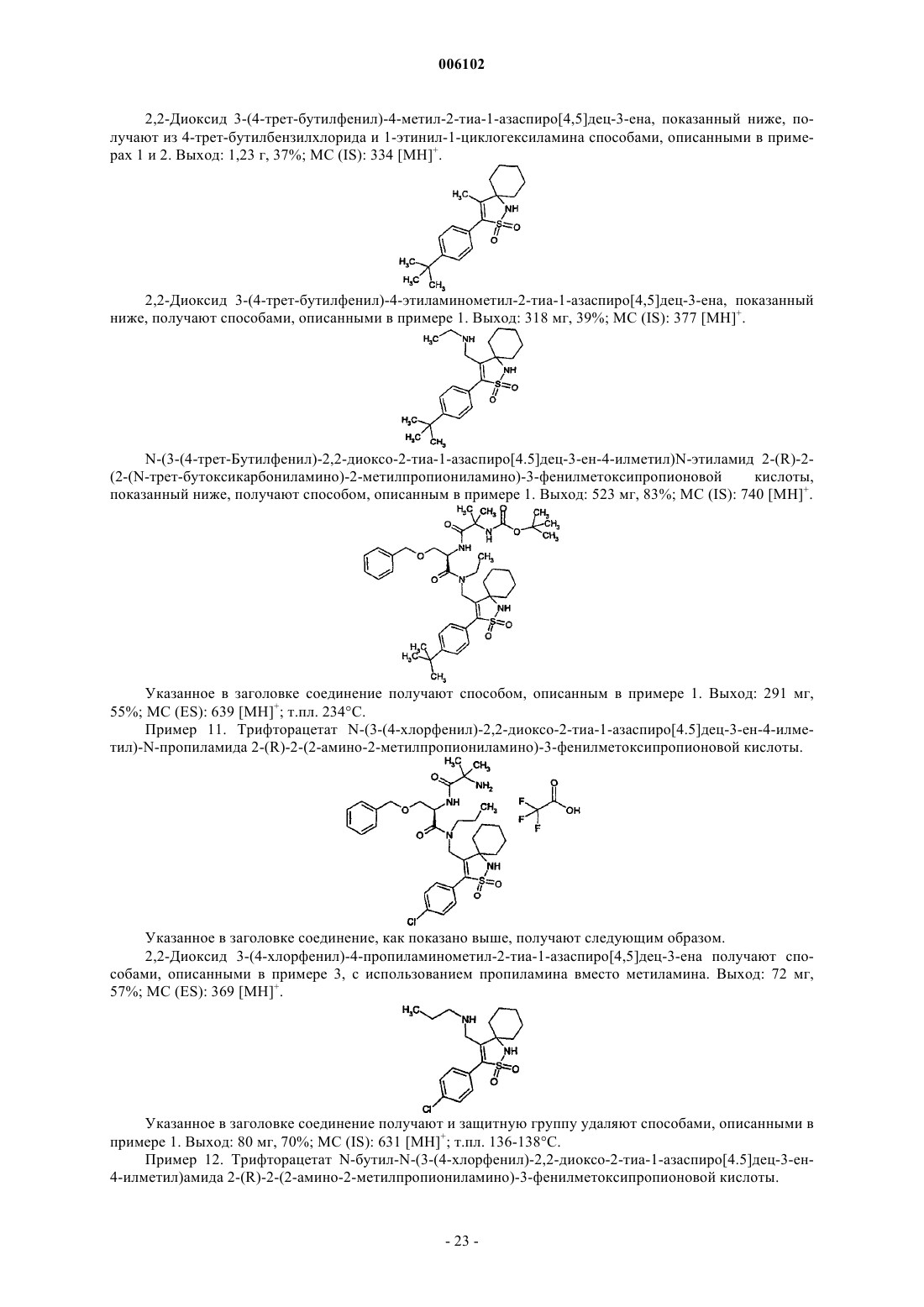
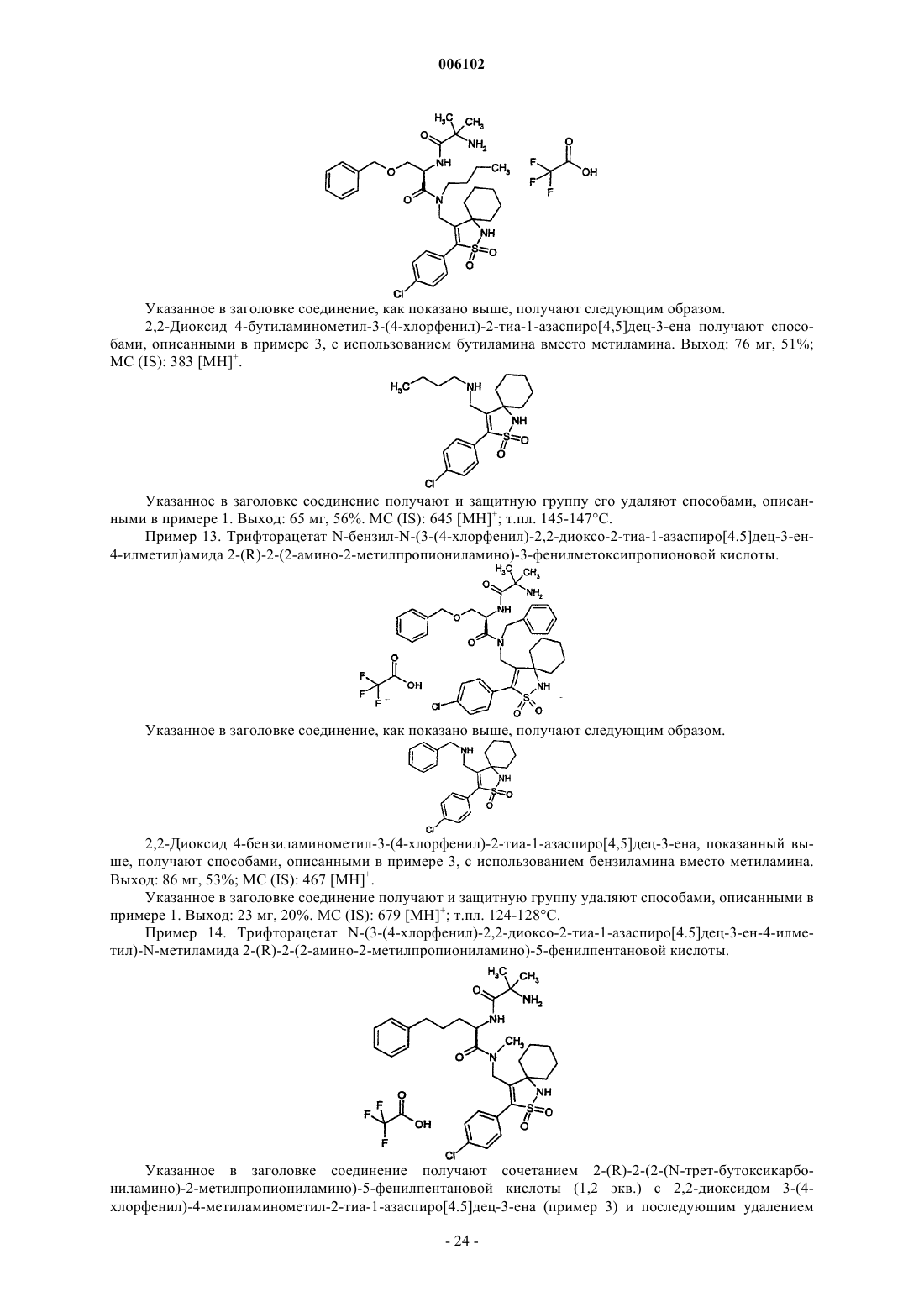
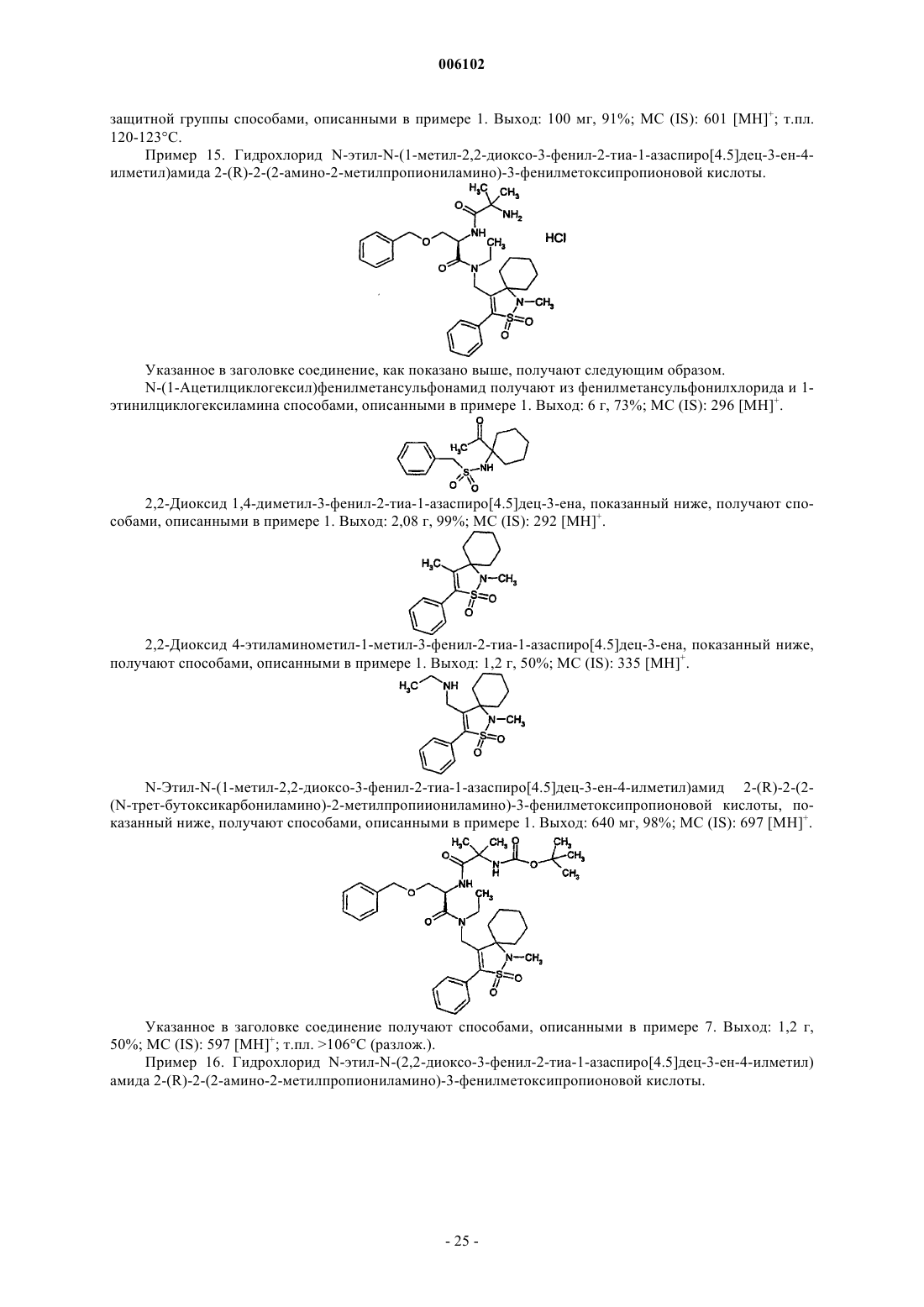
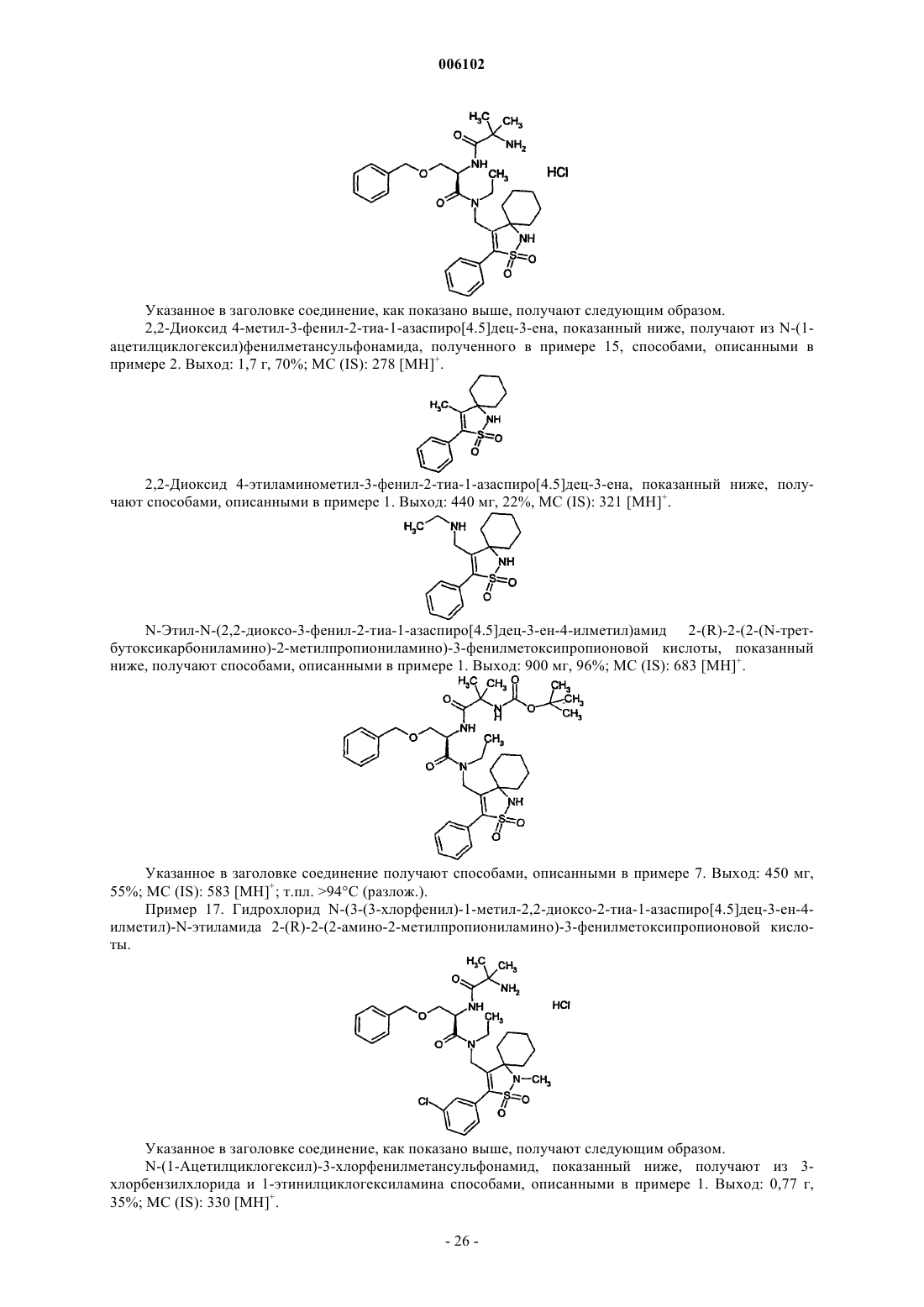
Замещенные дипептиды в качестве средств, усиливающих секрецию гормона роста
Номер патента: 6102
Опубликовано: 25.08.2005
Авторы: Рютер Герд, Юнгхайм Луис Николаус, Трэшер Кеннет Джефф, Мюль Брайан Стефен, Эверс Бритта, Додж Джеффри Алан
Формула / Реферат
1. Соединение формулы I
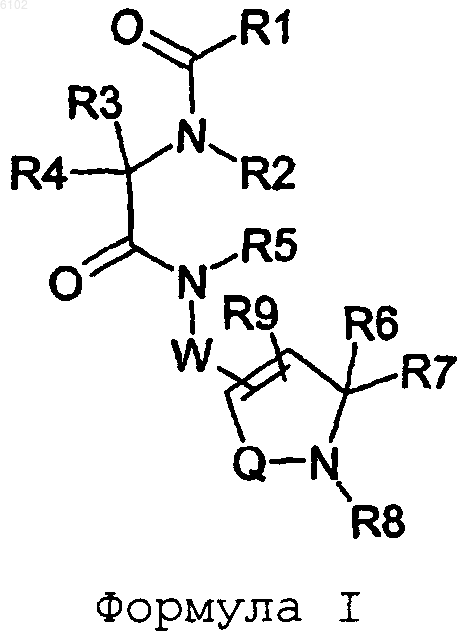
где R1 представляет NHR10 или C1-C6алкилNHR10;
R10 выбран из группы, состоящей из водорода, C1-C6алкила, C1-C6алкил(OH), C1-C6алкилиденил(OH)R11 и аминозащитной группы;
R11 выбран из группы, состоящей из C1-C6алкила, C2-C6алкенила, C1-C6алкил(O)C1-C6алкила, C(O)O-C1-C6алкила, арила и C1-C6алкиларила;
R2 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
R3 выбран из группы, состоящей из необязательно замещенного арила, C1-C6алкиларила, C1-C6алкил(O)-C1-C6алкиларила, C3-C8циклоалкила, (C1-C6алкил)-C3-C8циклоалкила, индолила, индолинила, (C1-C6алкил)индолила;
R4 представляет водород, C1-C6алкил, арил, C1-C6алкиларил,C2-C6алкенил;
R5 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
W представляет -CH2C6H4- или -(CH2)m-, где m равно числу, выбранному из 1-4;
R6 и R7 выбраны независимо из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила или R6 и R7 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным;
R8 выбран из группы, состоящей из водорода, C1-C6алкила, арила и C1-C6алкиларила;
R9 выбран из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C8 циклоалкила, C3-C8циклоалкенила, циано, необязательно замещенного арила, необязательно замещенного -O-арила, необязательно замещенного -N-арила, необязательно замещенного -S-арила, -ариларил-(K1)(K2), -O-ариларил-(K1)(K2), -N-ариларил-(K1)(K2), -S-ариларил-(K1)(K2),
-O-C1-C6алкила и C1-C6алкиларила, где K1 представляет галоген или
-CF3 и K2 представляет водород, галоген или -CF3, и Q представляет -S(O)2- или -C(O)-;
где арил представляет 5-7-членное моноциклическое или 7-10-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода и необязательно содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, где R3 выбран из группы, состоящей из арила, C1-C6алкиларила, C1-C6алкил (O)-C1-C6алкиларила, C3-C8циклоалкила, (C1-C6алкил)-C3-C8циклоалкила, индолила, индолинила, (C1-C6алкил)индолила, и R9 выбран из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C8циклоалкила, C3-C8циклоалкенила, необязательно замещенного арила, необязательно замещенного -O-арила, необязательно замещенного -N-арила, необязательно замещенного -S-арила, -O-C1-C6алкила и C1-C6алкиларила или его фармацевтически приемлемая соль или сольват.
3. Соединение по п.1 или 2, где Q представляет SO2.
4. Соединение по п.1 или 2, где Q представляет -C(O)-.
5. Соединение по любому одному из пп.1-4, где R3 представляет
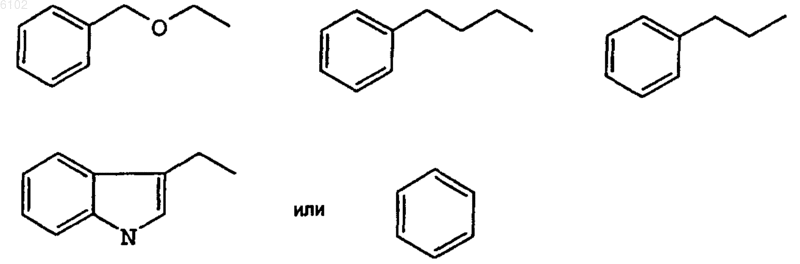
6. Соединение по любому одному из пп.1-5, где R1 представляет
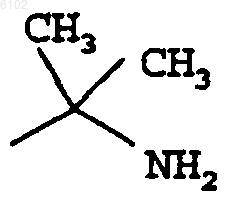
7. Соединение по любому одному из пп.1-6, где R6 и R7 образуют карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным.
8. Соединение по любому одному из пп.1-6, где R6 и R7 представляют, каждый, C1-3алкил.
9. Соединение по любому одному из пп.1-6, где R6 и R7, каждый независимо, выбран из группы, состоящей из водорода, C1-6алкила и C2-6алкенила.
10. Соединение по любому одному из пп.1-9, где W представляет (CH2)m и R2 представляет водород.
11. Соединение по любому одному из пп.1-10, где R4 представляет водород.
12. Соединение по любому одному из пп.1-11, где R5 представляет водород, метил или этил.
13. Соединение по любому одному из пп.1-12, где R9 выбран из группы, состоящей из необязательно замещенного тиенила, нафтила, O-фенила и фенила; где заместители, каждый независимо, выбраны из группы, состоящей из C1-C6алкила, C1-C6алкокси, галоген (C1-C6алкила), галоген (C1-C6алкокси), O-арила, CONH2, CONH(C1-C6алкила), NHCO(C1-C6алкила), SO2NH2, SO2NH(C1-C6алкила), NHSO2(C1-C6 алкила), COOH, COO(C1-C6алкила), гидрокси, нитро, галогена, SO2(C1-C6алкила) и циано.
14. Соединение по любому одному из пп.1-13, где R8 представляет водород, метил или этил.
15. Соединение по любому одному из пп.1-14, где W представляет (CH2)m и m равно 1 или 2.
16. Соединение по любому одному из пп.1-15, где R9 представляет карбоциклический арил, представляющий 5-7-членное моноциклическое или 7-10-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода.
17. Соединение по п.1 формулы
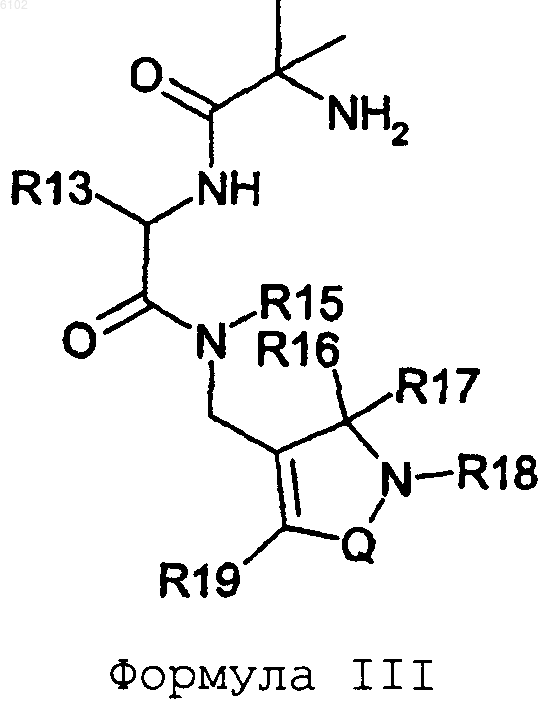
или его фармацевтически приемлемая соль или сольват, где
R13 представляет 3-фенилпропил, фенилметоксиметил, 3-индолилметил или циклогексилметил;
R15 представляет водород, метил, этил или н-пропил;
R16 и R17 представляют оба метил или этил, или вместе с атомом углерода, к которому они присоединены, образуют кольцо циклопентана или циклогексана;
R18 выбран из водорода, метила или этила;
R19 представляет тиенил, нафтил, тиазолил, оксазолил, пиридинил, O-фенил или фенил, который необязательно замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из C1-C6алкила, C1-C6алкокси, CONH2, CONH(C1-C6алкила), NHCO(C1-C6алкила), SO2NH2, SO2NH(C1-C6алкила), NHSO2(C1-C6алкила), COOH, COO(C1-C6алкила), гидрокси, нитро, галогена, SO2(C1-C6алкила) и циано, и
Q представляет -S(O)2- или -C(O)-.
18. Соединение по п.17, где Q представляет -S(O)2-.
19. Соединение по п.17, где Q представляет -C(O)-.
20. Соединение по любому одному из пп.17-19, где R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют кольцо циклопентана или циклогексана.
21. Соединение по любому одному из пп.17-19, где R16 и R17, оба, представляют метил или этил.
22. Соединение по п.1, выбранное из группы, состоящей из
N-(3-(4-хлорфенил)-2,2-диоксо-1-метил-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспирю[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-метиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-(3-индолил)пропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
N-(3-(4-трет-бутилфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-пропиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-метиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
N-этил-N-(1-метил-2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(3-хлорфенил)-1-метил-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(2-хлорфенил)-1-метил-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(1-метил-2,2-диоксо-3-(4-трифторметилфенил)-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(1-метил-3-(4-нитрофенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(4-бромфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(2,2-диоксо-3-(4-метилфенил)-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(1-этил-2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(2,2-диоксо-3-(3-феноксифенил)-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(3-бромфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
N-этил-N-(3-(4-фторфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-этил-N-(3-(4-фторфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
N-(3-(2-бромфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты,
N-(3-(2-бромфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
N-(3-(2-бромфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
2-амино-N-{2-бензилокси-1-[(3,3-диметил-1,1-диоксо-5-фенил-2,3-дигидро-1H-1g6-изотиазол-4-илметил)этилкарбамоил]этил}-2-метилпропионамида,
(3,3-диметил-1,1-диоксо-5-фенил-2,3-дигидро-1H-1g6-изотиазол-4-илметил)этиламида 2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
2-амино-N-{2-бензилокси-1-[(2,2-диоксо-3-фенил-2l6-тиа-1-азаспиро[4.4]нон-3-ен-4-илметил)этилкарбамоил]этил}-2-метилпропионамида,
[5-(4-хлорфенил)-3,3-диметил-1,1-диоксо-2,3-дигидро-1H-1g6-изотиазол-4-илметил]этиламида 2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
(2,2-диоксо-3-фенил-2l6-тиа-1-азаспиро[4.4]нон-3-ен-4-илметил)этиламида 2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты,
2-амино-N-(2-бензилокси-1-{[3-(4-хлорфенил)-2,2-диоксо-2l6-тиа-1-азаспиро[4.4]нон-3-ен-4-илметил]этилкарбамоил}этил)-2-метилпропионамида и
N-этил-N-(2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]ден-3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты
или их фармацевтически приемлемых солей.
23. Соединение по п.1, где указанное соединение представляет собой N-этил-N-(1-метил-2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]ден-3-ен-4-илметил)амид 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты или его фармацевтически приемлемую соль.
24. Соединение по п.1, где указанное соединение представляет собой N-(5-(4-хлорфенил)-3,3-диметил-1,1-диоксо-2,3-дигидроизотиазол-4-илметил)-N-этиламид 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты или его фармацевтически приемлемую соль.
25. Соединение по п.23 или 24, где указанная фармацевтически приемлемая соль является гидрохлоридной солью.
26. Фармацевтическая композиция, включающая одно или несколько соединений по любому одному из предыдущих пп.1-25 вместе с одним или несколькими их фармацевтически приемлемыми разбавителями или носителями.
27. Фармацевтическая композиция по п.26, где композиция включает соединение по любому одному из предыдущих пп.1-25 и одно или несколько соединений, усиливающих секрецию гормона роста, и/или агент против резорбции костей.
28. Способ получения соединения формулы I
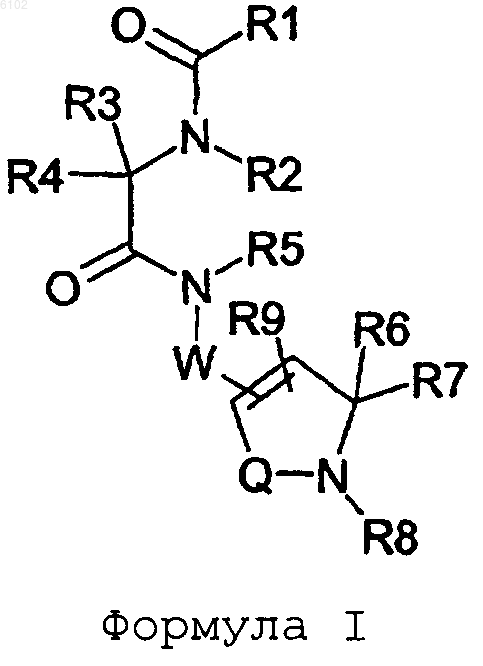
где R1 представляет NHR10 или C1-C6алкилNHR10;
R10 выбран из группы, состоящей из водорода, C1-C6алкила, C1-C6алкил(OH), C1-C6алкилиденил (OH)R11 и аминозащитной группы;
R11 выбран из группы, состоящей из C1-C6алкила, C2-C6алкенила, C1-C6алкил(O)C1-C6алкила, C(O)O-C1-C6алкила, арила и C1-C6алкиларила;
R2 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
R3 выбран из группы, состоящей из необязательно замещенного арила, C1-C6алкиларила, C1-C6 алкил (O)-C1-C6алкиларила, C3-C8циклоалкила, (C1-C6алкил)-C3-C8циклоалкила, индолила, индолинила, (C1-C6алкил)индолила;
R4 представляет водород, C1-C6алкил, арил, C1-C6алкиларил, C2-C6алкенил;
R5 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
W представляет -CH2C6H4- или -(CH2)m-, где m равно числу, выбранному из 1-4;
R6 и R7 выбраны независимо из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, или R6 и R7 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным;
R8 выбран из группы, состоящей из водорода, C1-C6алкила, арилр ш C1-C6алкиларила;
R9 выбран из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C8 циклоалкила, C3-C8циклоалкенила, циано, необязательно замещенного арила, необязательно замещенного -O-арила, необязательно замещенного -N-арила, необязательно замещенного -S-арила, -ариларил-(K1)(K2), -O-ариларил-(K1)(K2), -N-ариларил-(K1)(K2), -S-ариларил-(K1)(K2), -O-C1-C6алкила и C1-C6 алкиларила, где K1 представляет галоген или -CF3 и K2 представляет водород, галоген или -CF3, и Q представляет -S(O)2- или -C(O)-;
где арил представляет 5-7-членное моноциклическое или 7-10-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода и необязательно содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы;
включающий сочетание соединения формулы IX'

с соединением формулы XI'

29. Способ получения соединения формулы

где R1 представляет NHR10 или C1-C6алкилNHR10;
R10 выбран из группы, состоящей из водорода, C1-C6алкила, C1-C6алкил(OH), C1-C6алкилиденил (OH)R11 и аминозащитной группы;
R11 выбран из группы, состоящей из C1-C6алкила, C2-C6алкенила, C1-C6алкил(O)C1-C6алкила, C(O)O-C1-C6алкила, арила и C1-C6алкиларила;
R2 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
R3 выбран из группы, состоящей из необязательно замещенного арила, C1-C6алкиларила, C1-C6алкил(O)-C1-C6алкиларила, C3-C8циклоалкила, (C1-C6алкил)-C3-C8циклоалкила, индолила, индолинила, (C1-C6алкил)индолила;
R4 представляет водород, C1-C6алкил, арил, C1-C6алкиларил, C2-C6алкенил;
R5 выбран из водорода, C1-C6алкила, арила и C1-C6алкиларила;
W представляет -CH2C6H4- или -(CH2)m-, где m равно числу, выбранному из 1-4;
R6 и R7 выбраны независимо из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, или R6 и R7 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным;
R8 выбран из группы, состоящей из водорода, C1-C6алкила, арила и C1-C6алкиларила;
R9 выбран из группы, состоящей из водорода, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C3-C8циклоалкила, C3-C8циклоалкенила, циано, необязательно замещенного арила, необязательно замещенного -O-арила, необязательно замещенного -N-арила, необязательно замещенного -S-арила, -ариларил-(K1)(K2), -O-ариларил-(K1)(K2), -N-ариларил-(K1)(K2), -S-ариларил-(K1)(K2), -O-C1-C6алкила и C1-C6алкиларила, где K1 представляет галоген или -CF3 и K2 представляет водород, галоген или -CF3, и Q представляет -S(O)2- или -C(O)-;
где арил представляет 5-7-членное моноциклическое или 7-10-членное бициклическое ароматическое кольцо, которое состоит из атомов углерода и необязательно содержит 1-4 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы;
включающий удаление защитной группы у соединения формулы Ia'
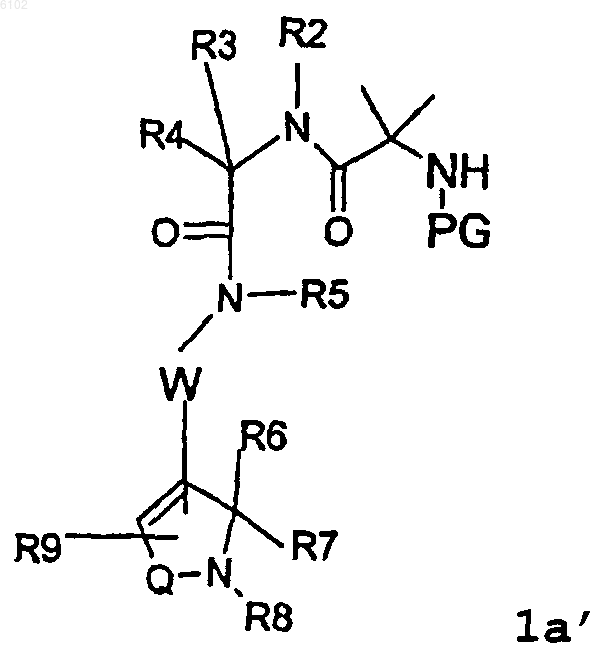
где PG представляет аминозащитную группу.
30. Применение соединения по любому одному из предыдущих пп.1-25 при получении лекарственного средства для лечения физиологического состояния, которое можно модулировать повышением уровня эндогенного гормона роста.
31. Применение соединения по п.1 для лечения физиологического состояния, которое можно модулировать повышением уровня эндогенного гормона роста, включающее введение животному, нуждающемуся в таком лечении, эффективного количества соединения формулы 1.
32. Способ лечения физиологического состояния, которое можно модулировать повышением уровня эндогенного гормона роста, включающий введение животному, нуждающемуся в таком лечении, эффективного количества соединения формулы I.
Текст
006102 Гормон роста, который секретируется гипофизом, обладает широким действием на развитие организма. Показано, что искусственное изменение уровней гормона роста приносит значительную терапевтическую пользу. Показано, что пополнение гормона роста человека является эффективным лечением при дефиците гормона роста человека и относящихся к нему патологических состояниях у людей. Помимо этого применения исследованиями были обнаружены новые и существенные свойства гормона роста, которые придают дополнительное значение возможности регулировать уровни гормона роста. Например, клинические исследования показали, что пополнение гормона роста может быть полезным для борьбы со старческими заболеваниями у людей. Обнаружено, что повышенные уровни гормона роста у животных приводят к повышению мышечной массы у худых животных. Одно применение указанного последнего наблюдения может привести к увеличению производства постных мясных продуктов или получению животных большего размера и/или более сильных животных. Хотя гормон роста в природе продуцируется гипофизом, секреция гормона роста в кровоток регулируется вторым белком, фактором, высвобождающим гормон роста (GRF). Этот гормон широко известен также в данной области как соматокринин, гормон, высвобождающий гормон роста (GHRH) и высвобождающий ростовой гормон (GRH). Имеются два подхода к проблеме повышения циркулирующих уровней гормона роста: (1) повышение уровня гормона роста человека в организме непосредственно или (2) повышение природной склонности организма к продуцированию гормона роста. Последнюю стратегию можно осуществить пополнением организма GRF. Показано, что GRF повышает циркулирующие уровни гормона роста in vivo(Rivier, et al., Nature (London), 300:276 (1982. Влияние GFR, включая его структурные аналоги, на продуцирование гормона роста было широко исследовано. Основным препятствием к использованию GRF в качестве прямой добавки является его короткая продолжительность существования in vivo. L.A. Frohman,et al., Journal of Clinical Investigation, 78:906 (1986). Следовательно, для разработки эффективных терапевтических агентов для людей или эффективных агентов для животноводства желательны более сильнодействующие и/или более продолжительно действующие молекулы GRF. Структуру GRF модифицировали многочисленными путями, что приводило к получению более продолжительно действующих и/или более сильнодействующих аналогов GRF. Показано, что первые 29 аминокислот от N-конца достаточны для сохранения полной активности GRF. Speiss, et al., Biochemistry,21:6037 (1982). Одной стратегией модификации было включение новых D-аминокислотных остатков в различные области молекулы GRF. V.A. Lance, et al., Biochemical and Biophysical Research Communications, 119:265 (1984); D.H. Coy, et al., Peptides, 8 (suppl. 1):49 (1986). Другой стратегией было модифицирование пептидного скелета GRF включением изостер пептидных связей в N-концевую область. D.(1990). Ряд очень активных аналогов GHRH описан в ЕР 511003, опубликованном 28 октября 1992. Известно, что кроме действий GHRH имеются различные пути высвобождения гормона роста. Например, химические соединения, такие как аргинин, L-3,4-дигидроксифенилаланин (L-DOPA), глюкагон,вазопрессин и индуцированная инсулином гипогликемия, а также явления жизнедеятельности, такие как сон и тренировка, косвенным образом вызывают высвобождение гормона роста из гипофиза действием некоторым образом на гипоталамус, возможно, либо для снижения секреции соматостатина, либо для повышения секреции GHRH. В случаях, когда желательны повышенные уровни гормона роста, проблему обычно разрешают обеспечением экзогенного гормона роста или введением GHRH или родственного пептидильного соединения, которое стимулирует продуцирование или высвобождение гормона роста. В любом случае пептидильная природа соединения делает необходимым введение его инъекцией. Разработаны другие соединения, которые стимулируют высвобождение эндогенного гормона роста,такие как аналогичные пептидильные соединения, родственные GHRH. Эти пептиды, хотя они и являются значительно меньшими молекулами, чем молекулы гормона роста, они все же обладают метаболической нестабильностью. Введение гексапептидного пептида-6, высвобождающего гормон роста (GHRP-6), приводит к секреции гормона роста у многих видов, включая людей. Этот пептид является одним из ряда синтетических пептидов, структуры которых основаны на структуре пентапептида Met-энкефалина. Показано, чтоGHRP специфически связывается с гипофизом, хотя связывание не включает рецепторы опиоидов,GHRH или соматостатина. В последние годы значительные усилия были направлены на разработку непептидильных аналогов этого ряда соединений. Такие соединения, названные средствами, усиливающими секрецию гормона роста, должны быть биологически доступными при пероральном введении, должны индуцировать продуцирование или высвобождение гормона роста и действовать одновременно или синергически с GHRH. Эти соединения являются непептидильными по природе и, следовательно, являются метаболически более стабильными, чем гормон роста, гормон, высвобождающий гормон роста, или аналоги любого из этих белков. Соединения данного изобретения особенно желательны вследствие повышенной in vivo фармацевтической активности этих соединений.-1 006102 Настоящее изобретение относится к соединениям формулы IR3 выбран из группы, состоящей из необязательно замещенного арила, C1-C6 алкиларила, С 1-C6 алкил(O)-C1-С 6 алкиларила, С 3-С 8 циклоалкила, (C1-C6 алкил)-С 3-С 8 циклоалкила, индолила, индолинила, (C1 С 6 алкил)индолила;R6 и R7 выбраны независимо из группы, состоящей из водорода, C1-C6 алкила, С 2-C6 алкенила, илиR6 и R7 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным;Q представляет -S(O)2- или -С(O)-; или их фармацевтически приемлемым солям или сольватам. Настоящее изобретение далее относится к фармацевтическим композициям, содержащим соединения формулы I, как таковые или в комбинации с другими соединениями, усиливающими секрецию гормона роста, и/или в комбинации с подходящими агентами против резорбции костей, и использованию указанных соединений и/или композиций, по меньшей мере, для повышения эндогенных уровней гормона роста у млекопитающего. Настоящее изобретение далее относится к способам лечения или профилактики физиологического состояния, которое можно модулировать повышением эндогенного гормона роста, данный способ включает введение животному, нуждающемуся в таком лечении, эффективного количества соединения формулы I. Альтернативным вариантом осуществления изобретения является соединение формулы I, где R3 выбран из группы, состоящей из арила, C1-C6 алкиларила, C1-C6 алкил (О)-C1-C6 алкиларила, С 3-С 8 циклоалкила, (C1-С 6 алкил)-С 3-С 8 циклоалкила, индолила, индолинила, (C1-C6 алкил)индолила, и R9 выбран из группы, состоящей из водорода, C1-C6 алкила, С 2-C6 алкенила, С 2-C6 алкинила, С 3-С 8 циклоалкила, С 3-С 8 циклоалкенила, необязательно замещенного арила, необязательно замещенного -O-арила, необязательно замещенного -N-арила, необязательно замещенного -S-арила, -O-C1-C6 алкила и C1-C6 алкиларила; или его фармацевтически приемлемая соль или сольват. Предпочтительным вариантом осуществления изобретения является соединение формулы IIR6 и R7 выбраны независимо из группы, состоящей из водорода, C1-C6 алкила, С 2-С 6 алкенила, илиR6 и R7 вместе с атомом углерода, к которому они присоединены, могут образовывать карбоциклическое кольцо с числом атомов до 8, которое является необязательно частично ненасыщенным;R9 выбран из группы, состоящей из водорода, C1-C6 алкила, C2-C6 алкенила, С 2-C6 алкинила, С 3-С 8 циклоалкила, С 3-С 8 циклоалкенила, необязательно замещенного арила, необязательно замещенного -Oарила, необязательно замещенного N-арила, необязательно замещенного -S-арила, -ариларил-(K1)(K2),-O-ариларил-(K1)(K2), -N-ариларил-(K1)(K2), -S-ариларил-(K1)(K2), -O-C1-C6 алкила и C1-С 6 алкиларила,где K1 представляет галоген или -СF3 и K2 представляет водород, галоген или -СF3, иm равно числу, выбранному от 1 до 2; или его фармацевтически приемлемая соль или сольват. Следующим предпочтительным вариантом осуществления изобретения является соединение формулы III или его фармацевтически приемлемая соль или сольват,гдеR16 и R17 представляют оба метил или этил, или вместе с атомом углерода, к которому они присоединены, образуют кольцо циклопентана или циклогексана;R19 представляет тиенил, нафтил, тиазолил, оксазолил, пиридинил, O-фенил или фенил, который необязательно замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из C1-С 6 алкила, C1-C6 алкокси, CONH2, СОNН(С 1-C6 алкила), NHCO(C1-С 6 алкила), SO2NH2,SO2NH(С 1-С 6 алкила), NHSO2(C1-C6 алкила), СООН, СОО(C1-С 6 алкила), гидрокси, нитро, галогена,SO2(C1-С 6 алкила) и циано, иQ представляет -S(O)2- или -С(О)-. Настоящее изобретение дополнительно относится к соединениям формулы IV, у которых радикалы от R13 до R19 имеют такие же значения, как в формуле III-3 006102 Настоящее изобретение далее относится к соединениям формулы IVA, которые соответствуют соединениям формулы IV, за исключением того, что R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют кольцо циклопентана или циклогексана. Настоящее изобретение далее относится к соединениям формулы V, у которых радикалы от R13 доR19 имеют такие же значения, как указаны в формуле III Настоящее изобретение далее относится к соединениям формулы VA, которые соответствуют соединениям формулы V, за исключением того, что R16 и R17 вместе с атомом углерода, к которому они присоединены, образуют кольцо циклопентана или циклогексана. Настоящее изобретение далее относится к способам получения соединений формулы I. Термины и сокращения, используемые в настоящих примерах, имеют их обычные значения, если не указывается особо. Например, С относится к градусам Цельсия, н относится к нормальному или нормальности, ммоль относится к миллимолю или миллимолям; г относится к грамму или граммам; мл означает миллилитр или миллилитры; М относится к молярному или молярности; МС относится к масс-спектрометрии, FDMC относится к масс-спектрометрии с полевой десорбцией; IS относится к ионизации ионным распылением; EI относится к электронной ударной ионизации, УФ относится к ультрафиолетовой спектроскопии; ИК относится к инфракрасной спектроскопии и ЯМР относится к спектроскопии ядерного магнитного резонанса. Используемый термин C1-C6 алкил относится к неразветвленным или разветвленным, одновалентным, насыщенным алифатическим цепям с 1-6 атомами углерода и включает, но не ограничивается ими, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил и гексил. ТерминC1-С 6 алкил включает в свое определение термин С 1-С 4 алкил. Используемый термин циклоалкил относится к циклизованным цепям с 3-6 атомами углерода и включает, но не ограничивается ими, циклопропил, циклобутил, циклопентил и циклогексил. Термин галоген означает хлор, фтор, бром или иод. Галоген может быть, наиболее предпочтительно, хлором или бромом.C1-C6 алкокси представляет неразветвленную или разветвленную алкильную цепь, имеющую от одного до шести атомов углерода и присоединенную к атому кислорода. Типичные C1-C6 алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, пентокси и тому подобное. Термин C1-C6 алкокси включает в свое определение термин С 1-С 4 алкокси. С 2-C6 алканоил представляет собой неразветвленную или разветвленную алкильную цепь, имеющую от одного до пяти атомов углерода и присоединенную через карбонильную группу. Типичные C2-C6 алканоильные группы включают этаноил (называемый также ацетилом), пропаноил, изопропаноил, бутаноил, трет-бутаноил, пентаноил, гексаноил и тому подобное.C1-C6 алкилиденил относится к неразветвленной или разветвленной, двухвалентной насыщенной алифатической цепи с числом атомов углерода от одного до шести и включает, но не ограничивается ими, метиленил, этиленил, пропиленил, изопропиленил, бутиленил, изобутиленил, трет-бутиленил, пентиленил, изопентиленил, гексиленил и тому подобное. Термин арил представляет ароматическое кольцо или кольца и ароматические остатки 5-7 членных моно- или бициклических колец с 1-4 гетероатомами (гетероарил), включающие, но не ограничивающиеся такими группами, как фенил, нафтил, бифенил, тиофенил, бензотиофенил, фуранил, бензофуранил и тому подобное. Термин карбоциклический арил означает, что арильное кольцо не содержит каких либо гетероатомов (кольцо не является гетероарилом). Термин необязательно замещенный арил, необязательно замещенный N-арил и необязательно замещенный S-арил означает, что каждая из соответствующих арильных групп (арильная группа может содержать гетероатомы, как указано выше) необязательно замещено от одного до четырех заместителями, независимо выбранными из группы, состоящей из C1-C6 алкила, -O-C1-C6 алкила, -ОСF3, амида, арила,арилокси, SO2(C1-C6 алкила), NH-амида, карбоксамила, сульфонамида, NH-сульфонамида, имида, гидрокси, карбокси, нитро, галогена, три(хлор или фтор)метила и циано. Ароматическое кольцо может быть присоединено у любого атома углерода или гетероатома, который образует стабильную структуру. Группа 3,4-метилендиоксифенил включена в данное определение.-4 006102 Термин -O-арил означает арилоксизаместитель, который связан с основной молекулой через группу О. Термин необязательно замещенный -O-арил означает, что арильная группа O-арильного заместителя необязательно замещена от одного до четырех заместителями, независимо выбранными из группы, состоящей из C1-C6 алкила, -O-C1-C6 алкила, -ОСF3, амида, арила, арилокси, SO2(C1-C6 алкила),NH-амида, карбоксамида, сульфонамида, NH-сульфонамида, имида, гидрокси, карбокси, нитро, галогена,три(хлор или фтор)метила и циано. Термин -ариларил-(K1)(K2) относится к арильной группе, замещенной дополнительной арильной группой, причем указанная дополнительная арильная группа является дизамещенной K1 и K2. Определение K1 включает галоген и -СF3, и определение K2 включает водород, галоген и -СF3. Аналогично,термины -O-ариларил-(K1)(K2), N-ариларил-(K1)(K2) и -S-ариларил-(K1)(K2) определены таким же образом. Например, термин -O-ариларил-(K1)(K2) означает арилоксизаместитель, как указано выше, который замещен дополнительной арильной группой, причем указанная дополнительная арильная группа дизамещена K1 и K2. K1 и K2 имеют значения, только что указанные выше. Используемый термин защитная группа карбоксила относится к заместителям карбоксигруппы,обычно применяемым для блокирования или защиты карбоксильной функциональной группы при взаимодействии других функциональных групп соединения. Примеры таких защитных групп включают метил, этил, п-нитробензил, п-метилбензил, п-метоксибензил, 3,4-диметоксибензил, 2,4-диметоксибензил,2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2', 4,4'-тетраметоксибензгидрил, трет-бутил, трет-амил, тритил, 4 метокситритил, 4,4'-диметокситритил, 4, 4', 4-триметокситритил, 2-фенилпроп-2-ил, триметилсилил,трет-бутилдиметилсилил, фенацил, 2,2,2-трихлорэтил, 2-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4-нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-ен-3-ил и тому подобное. Предпочтительной защитной группой карбоксила для практического применения настоящего изобретения является метил или этил. Следующие примеры таких групп можно найти у Е.Haslam, см. выше, в главе 5 и T.W. Greene, et al., см. выше, в главе 5. Используемый термин аминозащитная группа относится к заместителям аминогруппы, обычно применяемым для блокирования или защиты функциональной аминогруппы при взаимодействии других функциональных групп соединения. Примеры таких аминозащитных групп можно найти у T.W. Greene,et al., см. выше. Примеры таких аминозащитных групп включают, но не ограничивается ими, формил, тритил, фталимидо, трихлорацетил, хлорацетил, бромацетил, иодацетил и блокирующие группы типа уретанов, такие как бензилоксикарбонил, 4-фенилбензилоксикарбонил, 2-метилбензилоксикарбонил, 4-метоксибензилоксикарбонил, 4-фторбензилоксикарбонил, 4-хлорбензилоксикарбонил, 3-хлорбензилоксикарбонил, 2-хлорбензилоксикарбонил, 2,4-дихлорбензилоксикарбонил, 4-бромбензилоксикарбонил, 3 бромбензилоксикарбонил, 4-нитробензилоксикарбонил, 4-цианобензилоксикарбонил, н-бутоксикарбонил, (NBoc) трет-бутоксикарбонил, 1,1-дифенилэт-1-илоксикарбонил, 1,1-дифенилпроп-1 илоксикарбонил,2-фенилпроп-2-илоксикарбонил, 2-(п-толуил)проп-2-илоксикарбонил, циклопентанилоксикарбонил, 1-метилциклопентанилоксикарбонил, циклогексанилоксикарбонил, 1-метилциклогексанилоксикарбонил, 2-метилциклогексанилоксикарбонил, 2-(4-толуилсульфонил)этоксикарбонил, 2(метилсульфонил)этоксикарбонил, 2-(трифенилфосфино)этоксикарбонил, флуоренилметоксикарбонил(FMOC), 2-(триметилсилил)этоксикарбонил, аллилоксикарбонил, 1-(триметилсилилметил)проп-1 енилоксикарбонил, 5-бензизоксазолилметоксикарбонил, 4-ацетоксибензилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил, циклопропилметоксикарбонил, 4-(децилокси)бензилоксикарбонил, изоборнилоксикарбонил, 1-пиперидилоксикарбонил и тому подобное; бензоилметилсульфонильную группу, 2-нитрофенилсульфенил, оксид дифенилфосфина и подобные аминозащитные группы. Используемая аминозащитная группа обычно не является критической, пока превращенная в производное аминогруппа является стабильной в условиях последующих реакций в других положениях промежуточной молекулы и может быть селективно удалена в подходящей точке синтеза без разрушения остальной части молекулы, включая любые другие аминозащитные группы. Предпочтительной аминозащитной группой для практического применения настоящего изобретения является третбутоксикарбонил (NBoc). Следующие примеры групп, относящихся к указанным выше терминам, описаны Е. Haslam, Protective Groups in Organic Chemistry, (J.G.W. McOmie, ed., 1973), at Chapter 2; and T.W.Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis (1991), at Chapter 7. Используемый термин активирующая группа относится к уходящей группе, которая, взятая с карбонильной (-С=O) группой, к которой она присоединена, наиболее вероятно, примет участие в реакции ацилирования, в отличие от того, как это может быть в случае, если такая группа не присутствует,как в свободной кислоте. Такие активирующие группы хорошо известны специалистам в данной области и могут представлять собой, например, сукцинимидокси, фталимидокси, бензотриазолилокси, азидо или-O-СО-(С 4-С 7 алкил). Термин гетероцикл представляет стабильное 5-7-членное моноциклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое является насыщенным или ненасыщенным и которое-5 006102 состоит из атомов углерода и 1-4 гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, и где гетероатомы азот и сера могут быть необязательно окислены и гетероатом азот может быть необязательно кватернизирован, и включает бициклическую группу, в которой любое из определенных выше гетероциклических колец конденсировано с кольцом бензола. Гетероциклическое кольцо может быть присоединено у любого гетероатома или атома углерода, который образует стабильную структуру,и может быть необязательно замещено одним или несколькими заместителями, выбранными из группы,состоящей из C1-C6 алкила, -O-C1-C6 алкила, гидрокси, нитро, галогена и три(галоген)метила. Соединения настоящего изобретения можно получить различными путями, многие из которых известны специалисту в данной области. Конкретный порядок стадий, который используют в синтезе соединений формулы I, зависит от соединения, которое синтезируют, используемого исходного вещества и относительной лабильности различных замещенных групп. Во время любой из следующих синтетических последовательностей может быть необходимо или желательно защитить чувствительные или реакционноспособные группы в любой из рассматриваемых молекул. Этого можно достичь использованием общепринятых защитных групп, как описано выше. Соединения, используемые в способе настоящего изобретения, могут иметь один или несколько асимметричных центров. Вследствие наличия таких хиральных центров соединения настоящего изобретения существуют в виде рацематов, смесей энантиомеров и в виде индивидуальных энантиомеров, а также диастереомеров и смесей диастереомеров. Все асимметричные формы, индивидуальные изомеры и их комбинации входят в объем настоящего изобретения. Термины R и S используют в данном описании, как обычно используют в органической химии,для обозначения определенной конфигурации хирального центра. Термин R (rectus) относится к конфигурации хирального центра с зависимостью приоритета групп по часовой стрелке (от наивысшей до второй самой низшей) при рассмотрении в направлении связи к группе с наименьшим приоритетом. Термин S (sinister) относится к такой конфигурации хирального центра с зависимостью приоритета групп против часовой стрелки (от наивысшей до второй самой низшей) при рассмотрении в направлении связи к группе с наименьшим приоритетом. Приоритет групп основан на их атомном номере (в порядке уменьшения атомного номера). Неполный список приоритетов и обсуждение стереохимии содержится вNomenclature of Organic Compounds: Principles and Practice, (J.H. Fletcger, et al., eds., 1974) at pages 103120. Кроме системы (R)-(S), в данном описании используют также более раннюю систему D-L для обозначения абсолютной конфигурации, особенно в отношении аминокислот. В этой системе проекционное изображение пространственной структурной формулы Фишера ориентировано так, чтобы атом с числом 1 основной цепи находился в верхней части. Приставку D используют для обозначения абсолютной конфигурации изомера, у которого функциональная (определяющая) группа находится на правой стороне атома углерода у хирального центра, и L для обозначения абсолютной конфигурации изомера, у которого она находится на левой стороне. Для предпочтительного получения одного оптического изомера по сравнению с его энантиомером пригоден ряд путей. В качестве примера, можно получить смесь энантиомеров и затем два энантиомера можно разделить. Обычно используемым способом разделения рацемической смеси (или смеси энантиомеров) на индивидуальные энантиомеры является сначала превращение энантиомеров в диастереомеры образованием соли с оптически активной кислотой или основанием. Эти диастереомеры можно затем разделить с использованием различной растворимости, фракционной кристаллизации, хроматографии или тому подобное. Дополнительные подробности, относящиеся к разделению энантиомерных смесей,можно найти у J. Jacques, et al., Enantiomers, Racemates and Resolutions, (1991). Типичным исходным веществом для данного синтеза является соединение формулы VIa, которое можно сочетать с этинилциклогексиламином формулы VII с использованием активирующих агентов для реакций N-ацилирования, известных в данной области, подобных НОВТ, DCC, EDC, оксалилхлориду,TBTU или другим реагентам сочетания, известным специалисту в данной области, что приводит к образованию соединения формулы VIIIa. Предпочтительным агентом для практического использования настоящего изобретения является TBTU. Промежуточные продукты формулы VIa и VII являются коммерчески доступными или их можно получить способами, известными в данной области. Альтернативно,соединение формулы VIa' можно подвергнуть взаимодействию с соединением формулы VII способами,известными в данной области, с получением соединения формулы VIIIa. Промежуточные продукты формулы VIa' можно получить из коммерчески доступных соединений стандартными способами, как описано в Tetrahedron Lett. 25 (1984), 4553-4556. Соединение формулы VIIIa можно гидрировать стандартными способами с получением соединения формулы VIIIb и затем циклизовать обработкой депротонирующим агентом, таким как гидрид натрия,необязательно, в присутствии алкилирующего агента, с получением соединения формулы VIIIc. Обработка образовавшегося соединения реагентом бромирования, таким как N-бромсукцинимид, дает соединение формулы VIII. Взаимодействие с амином дает соединения формулы IX, в которой m = 1. Типичные реакции представлены ниже на схеме А. Пример соединения формулы VIIIc, где Q представляет SO2, R8 представляет водород и R9 представляет 4-хлорфенил, описан в Pestic. Sci. 39 (1993), 185-192.-6 006102 Соединения формулы IX, исходным веществом формулы VII которых является коммерчески доступный 1,1-диэтилпропаргиламин или 1,1-диметилпропаргиламин, можно также получить путем, описанным на схеме А. Схема А Схема А' представляет альтернативный синтез для ацетилсодержащих промежуточных продуктов формулы VIIIb: Схема А'-7 006102 Эфиры аминокислот формулы VIIb, предпочтительно, метиловые или этиловые эфиры, сочетают с производными карбоновых кислот или сульфоновых кислот формулы VIa способами, описанными на схеме А, получая промежуточные продукты формулы VIIId. Эфиры гидролизуют стандартными способами с получением карбоновых кислот формулы VIIIe. Их обрабатывают металлорганическими, метилсодержащими соединениями, получая ацетилсодержащие промежуточные продукты формулы VIIIb. Предпочтительными металлорганическими реагентами являются метилсодержащие реактивы Гриньяра(М = MgCl, MgBr или MgI) или метиллитий (М = Li), более предпочтительным является метиллитий. Примеры такой реакции известны из литературных источников, например, J. Org. Chem. 58 (1993), 4758;J. Org. Chem. 62 (1997), 6862; Tetrahedron Lett. 35 (1994), 3745. В предпочтительном способе раствор карбоновой кислоты в растворителе, подобном ТГФ или DME, обрабатывают избытком метиллития в диэтиловом эфире при температуре ниже -60 С с последующим нагреванием до комнатной температуры. Соединения формулы I, у которых W представляет -СН 2 СН 2-, можно получить, как показано ниже на схеме В. Схема В Соединение формулы Х получают обработкой защищенного метиламина депротонирующим агентом, подобным бутиллитию, как описано, например, в Tetrahedron Lett. 35(24), 1994, 4067-70. Используемый на схеме В заместитель PG означает защитную группу, которая известна специалисту в данной области, и все другие заместители имеют значения, указанные в данном описании для формулы I. Одной предпочтительной защитной группой является ВОС-группа или другая N-защитная группа, известная в данной области и стабильная в условиях реакции. Соединение формулы VIII обрабатывают соединением формулы X, получая соединение формулы IХа. Должно быть понятно, что на месте брома в соединении формулы VIII может быть в действительности любая подходящая уходящая группа, как указано в данном описании. Термин уходящая группа относится к группе атомов, которая вытесняется у атома углерода воздействием нуклеофила в реакции нуклеофильного замещения. Удобные уходящие группы включают бром, хлор и иод, бензолсульфонилокси, метансульфонилокси и толуолсульфонилокси. Термин уходящая группа включает активирующие группы. Вторая часть полного синтеза соединений формулы I представлена ниже на схеме С. Типичным исходным веществом для данного синтеза является соединение формулы ХIа, которое является химически защищенной формой аминокислоты O-серина. Химически защищенная аминокислота означает, что функциональные как амино-, так и карбоксигруппы подходящим образом защищены для облегчения дальнейших реакций с данной молекулой. Такие реакции защиты известны специалисту в данной области, и их можно применять для других подходящих исходных веществ. Промежуточные продукты формулы ХIа являются коммерчески доступными или их можно получить стандартными синтезами аминокислот. Такие синтезы хорошо известны обычным специалистам в данной области, они описаны, например, в Chemistry and Biochemistry of Amino Acids (G.C. Chapman ed., 1985). Защищенную аминогруппу можно специфически освободить от защитной группы с использованием трифторуксусной кислоты и метиленхлорида для проведения дальнейших реакций с данной функциональной аминогруппой. Такая реакция удаления защитной группы дает соединение формулы XIb. Соединение формулы XIb можно затем N-ацилировать аминозащищенным соединением формулыXII с получением соединения формулы ХIс. Подходящие активирующие агенты для данной реакции Nацилирования известны в данной области и включают DCC, НОВТ, EDC и оксалилхлорид. Предпочтительным агентом для практического применения настоящего изобретения является НОВТ. Соединения формулы XII являются коммерчески доступными или их легко получают из подходящих, доступных исходных веществ. Защищенную карбоксигруппу в соединении формулы ХIc затем селективно освобождают от защитной группы, обычно с использованием гидроксида лития, получая соединение формулыXI. Соединения формулы XI, исходным веществом ХIа которых является метиловый эфир 2-Nboc-амино 5-фенилпентановой кислоты или метиловый эфир 2-Nboc-амино-3-(3-индолил)пропионовой кислоты,можно также получить путем, описанным на схеме С. Соединение формулы XI затем сочетают с соединением формулы IX и затем удаляют защитную группу, получая соединение формулы Iа. И в этом случае типичные реагенты для такого N-ацилирования известны в данной области, они включают DCC и НОВТ, которые обеспечивают предпочтительный спо-8 006102 соб сочетания, применяемый на практике настоящего изобретения. Соединения формулы Iа включены в состав соединений формулы I и являются фармацевтически активными. Предпочтительный диапазон температур реакции, используемый в данных реакциях, находится между -40 и 150 С, и наиболее предпочтительный диапазон находится между 10 и 40 С. Данные реакции можно удобно проводить in situ, без выделения конкретного соединения после его получения. Типичные реакции представлены ниже на схеме С. Схема С Соединения настоящего изобретения могут быть полезными для модуляции секреции гормона роста и в качестве аналитических средств. Некоторые соединения и условия в пределах объема данного изобретения являются предпочтительными. Следующие условия, варианты осуществления изобретения и характеристики соединений, перечисленные в табличной форме, можно независимо объединить для получения предпочтительных соединений и условий способа. Следующий перечень вариантов осуществления данного изобретения не предназначается никоим образом для ограничения объема данного изобретения. Некоторыми предпочтительными характеристиками соединений формулы I являются: а) R3 представляетh) R6 и R7 каждый независимо выбран из группы, состоящей из метила и этила;l) R3 представляет фенилметоксиметил или 3-фенилпропил;n) R6 и R7 представляют, каждый, метил или этил; о) R9 представляет тиенил, нафтил, O-фенил или фенил, который необязательно замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из C1-C6 алкила, C1-C6 алкокси, галоген (C1-С 6 алкила), галоген(C1-C6 алкокси), O-арила, CONH2, CONH(C1-C6 алкила), NHCO(C1 С 6 алкила), SO2NH2, SO2NH(C1-C6 алкила), NHSO2(C1-C6 алкила), СООН, COO(C1-C6 алкила), гидрокси,нитро, галогена, SO2(C1-C6 алкила) и циано; р) R9 представляет тиенил, нафтил, O-фенил или фенил;u) R6 и R7 вместе образуют циклопентильное кольцо;v) R6 и R7 вместе образуют циклогексильное кольцо иw) соединение формулы I является фармацевтически приемлемой солью. Частные соединения изобретения включают:N-этил-N-(2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]ден-3-ен-4-илметил)амид 2-(R)-2-(2-амино-2 метилпропиониламино)-3-фенилметоксипропионовой кислоты; или их фармацевтически приемлемые соли. Соединения формулы I можно подходящим образом подвергнуть скринингу на активность средства, усиливающего секрецию гормона роста. В типичном анализе можно использовать клетки гипофиза,выращиваемые в культуре, с последующим воздействием различных соединений формулы I и в соответствии с этим определением уровней гормона роста. Уровни гормона роста можно вычислить с использованием различных способов радиоиммуноанализов, известных специалисту в данной области. Скрининг соединений на активность в качестве средства, усиливающего секрецию гормона роста, может быть подходящим образом увеличен в масштабе до достижения сплошного скрининга. Изобретение далее включает способы, использующие фармацевтически приемлемые соли соединений, определяемых формулой I. Хотя соединение данного изобретения обычно является нейтральным,оно может обладать достаточно кислотными, достаточно основными или обеими функциональными группами и соответственно может реагировать с любым числом неорганических оснований и неорганических и органических кислот с образованием фармацевтически приемлемой соли. Термин фармацевтически приемлемая соль, используемый в данном описании, относится к солям соединений формулы I, которые являются по существу нетоксичными для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные взаимодействием соединений настоящего изобретения с фармацевтически приемлемой минеральной или органической кислотой или неорганическим основанием. Такие соли известны как кислотно-аддитивные соли и основно-аддитивные соли. Кислоты, обычно используемые для образования кислотно-аддитивных солей, являются неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и тому подобное, и органическими кислотами,такими как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, пбромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и тому подобное. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат,метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат,- 11006102 малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат, манделат, мезилат и тому подобное. Предпочтительными фармацевтически приемлемыми кислотно-аддитивными солями являются соли, образованные с минеральными кислотами, такими как хлористоводородная кислота и бромистоводородная кислота, и соли,образованные с органическими кислотами, такими как малеиновая кислота и метансульфоновая кислота. Соли аминогрупп могут включать также четвертичные аммониевые соли, в которых азот аминогруппы содержит подходящую органическую группу, такую как алкильная, алкенильная, алкинильная или аралкильная группа. Основно-аддитивные соли включают соли, полученные из неорганических оснований, таких как гидроксиды, карбонаты, бикарбонаты аммония или щелочных или щелочноземельных металлов и тому подобное. Таким образом, основания, пригодные для получения солей данного изобретения включают гидроксид натрия, гидроксид калия, гидроксид аммония, карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция, карбонат кальция и тому подобное. Особенно предпочтительными являются формы калиевых и натриевых солей. Следует признать, что конкретная, образующая противоион, часть любой соли данного изобретения не является критической по природе, пока соль в целом является фармакологически приемлемой и пока противоион не придает нежелательные свойства соли в целом. Данное изобретение далее включает применение фармацевтически приемлемых сольватов соединений формулы I. Многие из соединений формулы I можно смешивать с растворителями, такими как вода,метанол и этанол, с образованием фармацевтически приемлемых сольватов, таких как соответствующий гидрат, метанолат и этанолат. Данное изобретение включает также применение фармацевтически приемлемых пролекарств соединений формулы I. Пролекарство представляет собой лекарство, которое химически модифицировано и может быть биологически неактивным в месте его действия, но которое может разлагаться или модифицироваться одним или несколькими ферментативными или другими процессами in vivo с превращением в исходную биоактивную форму. Такое пролекарство должно иметь фармакокинетический профиль,отличающийся от профиля исходного (родительского) соединения, что позволяет ему легче проникать через эпителий слизистой оболочки, лучше образовывать соль или иметь лучшую растворимость, или иметь повышенную системную стабильность (например, повышение полупериода существования его в плазме). В типичном случае такие химические модификации включают: 1) эфирные или амидные производные, которые можно расщепить эстеразами или липазами; 2) пептиды, которые могут распознаваться специфическими или неспецифическими протеазами,или 3) производные, которые аккумулируются у места действия посредством мембранного отбора пролекарственной формы или модифицированной пролекарственной формы, или любую комбинацию соединений пунктов 1-3, выше. Общепринятые процедуры для отбора и получения подходящих пролекарственных производных описаны, например, Н. Bundgaard, в Design of Prodrugs, (1985). Используемый термин эффективное количество означает количество соединения настоящего изобретения, которое способно тормозить, облегчать, уменьшать интенсивность, лечить или предотвращать другие симптомы у млекопитающих, в том числе у людей, которые могут быть обусловлены пониженными уровнями эндогенного гормона роста. Термин фармацевтически приемлемая композиция означает, что носитель, разбавитель, эксципиенты и соль должны быть совместимыми с активным ингредиентом (соединением формулы I) композиции и не являются вредными для их реципиента. Фармацевтические композиции можно получить способами, известными в данной области. Например, соединения данного изобретения можно изготовить с обычными эксципиентами, разбавителями или носителями и формовать в таблетки, капсулы и тому подобное. Примеры эксципиентов, разбавителей и носителей, которые являются подходящими для таких композиций, включают следующие ингредиенты: наполнители и сухие разбавители, такие как крахмал,сахара, маннит и кремниевые производные; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; смачивающие агенты,такие как глицерин; дезинтегрирующие агенты, такие как агар-агар, карбонат кальция и бикарбонат натрия; агенты для замедления растворения, такие как парафин; ускорители ресорбции, такие как четвертичные аммониевые соединения; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонит, и смазывающие вещества,такие как тальк, стеарат кальция и магния и твердые полиэтиленгликоли. Конечные фармацевтические формы могут быть в виде пилюль, таблеток, порошков, лепешек, сиропов, аэрозолей, саше, каше, эликсиров, суспензий, эмульсий, мазей, суппозиториев, стерильных инъецируемых растворов или стерильных упакованных порошков и тому подобное, в зависимости от типа используемого эксципиента.- 12006102 Кроме того, соединения данного изобретения являются хорошо подходящими для изготовления в виде лекарственных форм пролонгированного действия. Композиции можно также составить так, чтобы они высвобождали активный ингредиент только или, предпочтительно, в определенной части кишечника, возможно на протяжении какого-либо периода времени. Такие композиции включают покрытия, оболочки или защитные матрицы, которые могут быть изготовлены из полимерных веществ или восков. Конкретная доза соединения, требуемая для лечения, подавления или профилактики симптомов и/или заболевания, застойной сердечной недостаточности у млекопитающего, включая людей, по данному изобретению будет зависеть от конкретного заболевания, симптомов и серьезности заболевания. Дозировка, пути введения и частота введения дозы лучше всего выбирается штатным врачом больницы. Обычно приемлемые и эффективные дозы бывают от 15 до 1000 мг и, более типично, от 15 до 80 мг. Такие дозы будут вводить пациенту, нуждающемуся в лечении, от одного до трех раз в день или так часто,как требуется для эффективного лечения. Кроме того, соединения, ускоряющие секрецию гормона роста, как описано в данном описании,можно вводить пациенту, нуждающемуся в лечении, в сочетании с другим ускорителем секреции гормона роста, известным в данной области, и/или с подходящим агентом или агентами против резорбции костей для профилактики или лечения остеопороза и/или потери мышечной силы. Указанные подходящие агенты против резорбции костей включают селективные модуляторы рецепторов эстрогена, бисфосфонаты, кальцитонин и терапевтические агенты гормональной заместительной терапии. Кроме того, РНТ можно ввести в комбинации с указанными средствами, усиливающими секрецию гормона роста. Указанную комбинационную терапию можно проводить одновременно или последовательно. Композиции, предпочтительно, изготавливают в виде единичной дозированной формы, причем каждая доза содержит приблизительно от 0,01 до приблизительно 500 мг, обычно, более приблизительно от 0,5 до приблизительно 200 мг активного ингредиента. Однако должно быть понятно, что вводимая терапевтическая доза будет определяться врачом в свете относящихся к данному случаю обстоятельств,включая состояние, которое лечат, выбор соединения, которое нужно ввести, и выбранный путь введения, и, следовательно, указанные выше диапазоны доз никоим образом не предназначаются для ограничения объема изобретения. Соединения можно ввести различными путями, включая пероральный, ректальный, трансдермальный, подкожный, местный, внутривенный, внутримышечный или интраназальный пути. Для всех показаний типичная суточная доза будет составлять приблизительно от 0,01 мг/кг до приблизительно 20 мг/кг активного соединения данного изобретения. Предпочтительные суточные дозы будут составлять приблизительно от 0,1 до приблизительно 10 мг/кг, идеально, приблизительно от 0,1 до приблизительно 5 мг/кг. Однако для местного введения типичная доза составляет приблизительно от 1 до приблизительно 500 мг соединения на см 2 пораженной ткани. Наносимое количество соединения,предпочтительно, будет составлять приблизительно от 30 до приблизительно 300 мг/см 2, более предпочтительно, приблизительно от 50 до приблизительно 200 мг/см 2 и, наиболее предпочтительно, приблизительно от 60 до приблизительно 100 мг/см 2. Подходящие диапазоны доз соединений формулы I включают от 0,01 мг/кгдень до 60 мг/кгдень. Типичные фармацевтические композиции, содержащие соединения формулы I-IV, приведены ниже. Приведенные ниже композиции приводятся в целях иллюстрации и никоим образом не предназначаются для ограничения данного изобретения. Содержание общих активных ингредиентов в таких композициях составляет от 0,1% до 99,9 мас.% всей композиции. Термин активный ингредиент означает соединение формулы I, включая, но не ограничиваясь ими, соединения формул II, III, IV и V. Композиция 1. Получают твердые желатиновые капсулы, содержащие следующие ингредиенты. Указанные выше ингредиенты смешивают и твердые желатиновые капсулы заполняют смесью в количестве 340 мг. Композиция 2. Композицию в виде таблеток получают с использованием ингредиентов, указанных ниже. Компоненты смешивают и прессуют с образованием таблеток, каждая из которых весит 240 мг. Композиция 3. Получают композицию в виде ингалятора с сухим порошком, содержащим следующие компоненты. Активную смесь смешивают с лактозой и смесь добавляют в устройство для ингаляции сухого порошка. Композиция 4. Таблетки, каждая из которых содержит 30 мг активного ингредиента, получают, как показано ниже. Активный ингредиент, крахмал и целлюлозу пропускают через сито 20 (стандарт США) и энергично перемешивают. С полученными порошками смешивают раствор поливинилпирролидона и затем смесь пропускают через сито 16 (стандарт США). Таким образом полученные гранулы сушат при 5060 С и пропускают через сито 16 (стандарт США). Натрий карбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 30 (стандарт США), затем добавляют к гранулам, которые после перемешивания прессуют на таблеточной машине, получая таблетки, каждая из которых весит 120 мг. Композиция 5. Капсулы, каждая из которых содержит 40 мг лекарственного средства, получают следующим образом. Активный ингредиент, крахмал и стеарат магния смешивают, смесь пропускают через сито 20(стандарт США) и твердые желатиновые капсулы заполняют смесью в количестве 150 мг. Композиция 6. Суппозитории, каждый из которых содержит 25 мг активного ингредиента, получают следующим образом: Активный ингредиент пропускают через сито 60 (стандарт США) и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием минимального необходимого тепла. Смесь затем заливают в форму для суппозитория номинальной емкости 2,0 г и оставляют для охлаждения. Композиция 7. Суспензии, каждая из которых содержит 50 мг лекарственного средства на дозу 5,0 мл, получают следующим образом. Лекарственное средство, сахарозу, ксантановую камедь смешивают, пропускают через сито 10(стандарт США) и затем смешивают с предварительно приготовленным раствором микрокристаллической целлюлозы и натрий карбоксиметилцеллюлозы в воде. Бензоат натрия, корригент и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют количество воды, достаточное для получения требуемого объема. Композиция 8. Капсулы, каждая из которых содержит 15 мг лекарственного средства, получают следующим образом. Активный ингредиент, крахмал и стеарат магния смешивают, смесь пропускают через сито 20(стандарт США) и твердые желатиновые капсулы заполняют смесью в количестве 425 мг. Композиция 9 Внутривенную композицию можно получить следующим образом: Композиция 10 Композицию для местного применения можно получить следующим образом: Белый мягкий парафин нагревают до тех пор, пока он не расплавится. Вводят жидкий парафин и эмульгируемый воск и перемешивают до тех пор, пока они не растворятся. Добавляют активный ингредиент и перемешивание продолжают до тех пор, пока он не диспергируется. Смесь затем охлаждают до получения твердой массы. Композиция 11. Сублингвальные таблетки или таблетки для медленного растворения в щечном кармане, каждая их которых содержит 10 мг активного ингредиента, можно получить следующим образом. Глицерин, воду, цитрат натрия, поливиниловый спирт и поливинилпирролидон смешивают вместе при непрерывном перемешивании и поддержании температуры приблизительно 90 С. Когда полимеры перейдут в раствор, раствор охлаждают приблизительно до 50-55 С и медленно смешивают с лекарственным средством. Гомогенную смесь выливают в формы, изготовленные из инертного материала, для получения содержащей лекарственное средство диффузионной матрицы, имеющей толщину приблизительно 2-4 мм. Диффузионную матрицу затем нарезают на отдельные таблетки, имеющие подходящий размер. В другой композиции, применяемой в способах настоящего изобретения, используют устройства для чрескожной доставки или пластыри. Такие чрескожные пластыри можно использовать для обеспечения непрерывной или периодической инфузии соединений настоящего изобретения в регулируемых количествах. Конструкция и использование чрескожных пластырей для доставки фармацевтических агентов хорошо известны в настоящей области. См., например, патент США 5023252, описание которого включено в данное описание в качестве ссылки. Такие пластыри можно конструировать для непрерывной, пульсирующей или другой требуемой доставки фармацевтических агентов. Часто может быть желательно или необходимо вводить фармацевтическую композицию в головной мозг, либо непосредственно, либо непрямым способом. Непосредственные способы обычно заключаются в размещении катетера для доставки лекарственного средства в вентрикулярной системе хозяина для обхода гематоэнцефалического барьера. Одна такая имплантируемая система доставки, используемая для переноса биологических факторов к определенным анатомическим областям тела, описана в патенте США 5011472, описание которого включено в данное описание в качестве ссылки. Непрямые способы, которые обычно являются предпочтительными, обычно заключаются в изготовлении композиций для обеспечения лекарственного средства в латентном состоянии превращением гидрофильных лекарственных средств в липидрастворимые лекарственные средства или пролекарства. Латентного состояния обычно достигают блокированием гидрокси, карбонильных, сульфатных и первичных аминогрупп, присутствующих в лекарственном средстве, для придания лекарственному средству большей липидной растворимости и способности перемещаться через гематоэнцефалический барьер. Альтернативно, доставку гидрофильных лекарственных средств можно повысить внутриартериальной- 15006102 инфузией гипертонических растворов, которые могут временно открывать гематоэнцефалический барьер. Следующие примеры и получения являются иллюстративными для используемых способов при синтезе соединений настоящего изобретения. Как должно быть понятно специалистам в данной области,для получения соединений настоящего изобретения можно использовать другие синтетические схемы. Пример 1. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-1-метил-2-тиа-1-азаспиро[4.5]дец-3-ен-4 илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. 4-Хлорбензилхлорид (30 г, 0,186 моль) и Na2SO4 (47 г, 2 экв.) кипятят с обратным холодильником в течение нескольких часов в 150 мл воды. Можно добавить агент межфазного переноса, подобный хлориду триоктилметиламмония, как описано в Tetrahedron Lett. 1984, 25(40), 4553-6. После охлаждения до комнатной температуры раствор экстрагируют этилацетатом, водный слой выпаривают и остаток суспендируют в этаноле. Смесь фильтруют, фильтрат концентрируют и твердое вещество сушат при 50 С в вакууме. Получают 4-хлорфенилметансульфонат (23,5 г, 55%, МС (EI): 205 [М]+). РОСl3 (20 мл) охлаждают до 0 С, добавляют 4-хлорфенилметансульфонат (15,9 г, 69,5 ммоль) и PCl5 (20,3 г, 1,4 экв.). Смесь перемешивают на протяжении ночи при комнатной температуре и выпаривают в вакууме. Остаток суспендируют в этилацетате и фильтруют. После концентрирования фильтрата получают 12 г (75%) кристаллического 4-хлорфенилметансульфонилхлорида, показанного ниже. МС (EI): 125 [ClC6H4CH2]+, 224(0,9 мл, 6,6 ммоль) в течение нескольких часов при комнатной температуре. Смесь разбавляют этилацетатом, промывают водой, сушат (Na2SO4) и выпаривают. Перекристаллизация из этанола дает 4-хлорфенил-N-(1-этинилциклогексил)метансульфонамид (1,5 г, 80%) в виде твердого вещества. Это соединение суспендируют в этиленгликоле (25 мл). Добавляют 2 мл воды, 100 мг НgО и 5 капель конц. серной кислоты и смесь нагревают при 175 С в течение 1 ч, охлаждают до комнатной температуры, разбавляют дихлорметаном, промывают водой, сушат (Na2SO4) и выпаривают, получая N-(1 ацетилциклогексил)-4-хлорфенилметансульфонамид в виде твердого вещества (1,5 г, 95%). МС (IS): 330N-(1-Ацетилциклогексил)-4-хлорфенилметансульфонамид (1,02 г, 3,1 ммоль) растворяют в безводном ДМФА (10 мл) в атмосфере Аr. Добавляют NaH (60%, 2,2 экв.) и иодметан (2 экв.) и смесь перемешивают на протяжении ночи при 120 С. После разбавления водой раствор экстрагируют этилацетатом. Органический слой промывают раствором NaCl и водой, сушат (Na2SO4) и концентрируют, получая 696 мг (69%) 2,2-диоксида 3-(4-хлорфенил)-1,4-диметил-2-тиа-1-азаспиро[4.5]дец-3-ена, показанного ниже, в виде твердого вещества. МС (IS) : 326 [MH]+.- 16006102 2,2-Диоксид 3-(4-хлорфенил)-1,4-диметил-2-тиа-1-азаспиро[4.5]дец-3-ена (0,63 г, 1,93 ммоль) и Nбромсукцинимид (1 экв.) перемешивают в 60 мл ССl4 с каталитическим количеством бензоилпероксида в течение 3 ч при 85 С. После охлаждения до комнатной температуры смесь разбавляют СН 2 Сl2, промывают водой, сушат (Na2SO4) и выпаривают, получая 2,2-диоксид 4-бромметил-3-(4-хлорфенил)-2-метил 2-тиа-1-азаспиро[4,5]дец-3-ена в виде сиропа. Без дальнейшей очистки продукт растворяют в этаноле(100 мл), добавляют этиламин (70% раствор в воде, 20 мл) и смесь перемешивают на протяжении ночи при комнатной температуре. После концентрирования остаток растворяют в СН 2 Сl2, промывают водой и экстрагируют 0,5 М НСl. После добавления NaOH и экстракции СН 2 Сl2 органический слой сушат(1,1 экв.) и добавляют 1-гидрокси-7-азабензотриазол (1,1 экв.), 2,2-диоксид 3-(4-хлорфенил)-4-этиламинометил-1-метил-2-тиа-1-азаспиро[4.5]дец-3-ен (306 мг, 0,83 ммоль) в СН 2 Сl2 (8 мл) и смесь перемешивают на протяжении ночи при комнатной температуре. После фильтрования фильтрат разбавляют этилацетатом, промывают 0,1 М лимонной кислотой, насыщенным NaHCO3 и органический слой сушатN-(3-(4-Хлорфенил)-1-метил-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламид 2(R)-2-(2-N-трет-бутоксикарбониламино)-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты (593 мг, 0,81 ммоль) растворяют в дихлорметане (5 мл) и трифторуксусной кислоте (5 мл) и перемешивают на протяжении ночи. Смесь выливают в безводный этиловый эфир (200 мл). Осадок отфильтровывают и сушат при 50 С в вакууме, получая указанное в заголовке соединение (520 мг, 86%) в виде твердого вещества. МС (IS): 631 [МН]+; т.пл. 95-120 С. Пример 2. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. К N-(1-ацетилциклогексил)-(4-хлорфенил)метансульфонамиду (612 мг, 1,86 ммоль) из примера 1 в безводном ДМФА (6 мл) добавляют NaH (60%, 2,2 экв.) в атмосфере Аr. Смесь перемешивают на протя- 17006102 жении ночи при 120 С, добавляют воду и раствор экстрагируют этилацетатом. Органический слой промывают раствором NaCl и водой, сушат (Na2SO4) и концентрируют. Перекристаллизация из этилацетата дает 0,37 г (64%) 2,2-диоксида 3-(4-хлорфенил)-4-метил-2-тиа-1-азаспиро[4,5]дец-3-ена, показанного ниже, в виде твердого вещества. МС (IS): 312 [МН]+. Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 930 мг, 83%; МС (IS): 617 [МН]+; т.пл. 125-135 С. Пример 3. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-метиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. 2,2-Диоксид 4-бромметил-3-(4-хлорфенил)-2-тиа-1-азаспиро[4.5]дец-3-ена, полученный, как описано в примере 2 (270 мг, 0,69 ммоль), растворяют в этаноле (30 мл). Добавляют метиламин (70% раствор в воде, 8 мл) и смесь перемешивают на протяжении ночи при комнатной температуре и концентрируют. Остаток растворяют в СН 2 Сl2, промывают водой и экстрагируют 0,5 М НСl. После добавления NaOH и экстракции CH2Cl2 органический слой сушат (Na2SO4) и выпаривают, получая 80 мг (34%) 2,2-диоксида 3-(4-хлорфенил)-4-метиламинометил-2-тиа-1-азаспиро[4.5]дец-3-ена в виде твердого вещества. МС (IS): 341 [МН]+. Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 120 мг, 91%. МС (IS): 603 [МН]+; т.пл. 143-145 С. Пример 4. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-(3-индолил)пропионовой кислоты. Указанное в заголовке соединение, показанное выше, получают сочетанием 2-(R)-2-(2-(N-третбутоксикарбониламино)-2-метилпропиониламино)-3-(3-индолил)пропионовой кислоты (1,2 экв.) с 2,2 диоксидом 3-(4-хлорфенил)-4-этиламинометил-2-тиа-1-азаспиро[4.5]дец-3-ена, как описано в примере 2,и последующим снятием защиты способами, описанными в примере 1. Выход: 68 мг, 60%; МС (IS): 626 Указанное в заголовке соединение, показанное выше, получают сочетанием 2-(R)-2-(2-(N-третбутоксикарбониламино)-2-метилпропиониламино)-5-фенилпентановой кислоты (1,2 экв.) с 2,2-диоксидом 3-(4-хлорфенил)-4-этиламинометил-2-тиа-1-азаспиро[4.5]дец-3-ена, как описано в примере 2, и последующим снятием защиты способами, описанными в примере 1. Выход: 78 мг, 70%; MC (IS): 615 Указанное в заголовке соединение, как показано выше, получают следующим образом. Раствор 2,2-диоксида 4-бромметил-3-(4-хлорфенил)-2-тиа-1-азаспиро[4,5]дец-3-ена, синтезированного, как описано в примере 2 (154 мг, 0,40 ммоль), и фталимида калия (2 экв.) в ДМФА (15 мл) перемешивают при 80 С в течение 17 ч, после охлаждения до комнатной температуры разбавляют СН 2 Сl2 и промывают водой и раствором NаНСО 3. Органический слой сушат (Na2SO4) и выпаривают, получая 180 мг (100%) 2,2-диоксида 3-(4-хлорфенил)-4-(N-фталимидо)метил-2-тиа-1-азаспиро[4,5]дец-3-ена, как показано ниже, в виде белого твердого вещества. MC (IS): 457 [MH]+.- 19006102 2,2-Диоксид 3-(4-хлорфенил)-4-(N-фталимидо)метил-2-тиа-1-азаспиро[4,5]дец-3-ена (159 мг, 0,35 ммоль) и этилендиамин (4,5 мл) растворяют в безводном н-бутаноле (25 мл) и перемешивают на протяжении ночи при 90 С. Смесь затем разбавляют этилацетатом, промывают раствором NaCl и водой и экстрагируют 0,5 М HCl. После добавления NaOH и экстракции этилацетатом органический слой сушат Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 66 мг, 61%; МС (IS): 589 [МН]+; т.пл. 110 С (разлож.). Пример 7. Гидрохлорид N-(5-(4-хлорфенил)-3,3-диэтил-2-метил-1,1-диоксо-2,3-дигидроизотиазол 4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты.N-(5-(4-Хлорфенил)-3,3-диэтил-2-метил-1,1-диоксо-2,3-дигидроизотиазол-4-илметил)-N-этиламид 2-(R)-2-(2-(N-трет-бутоксикарбониламино)-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты (258 мг, 0,36 ммоль) растворяют в этаноле, насыщенном HCl (15 мл), и перемешивают на протяжении ночи при комнатной температуре. Раствор концентрируют до объема 3 мл и выливают в безводный диэтиловый эфир (100 мл). Указанное в заголовке соединение в виде осадка отфильтровывают и сушат при 50 С в вакууме. Выход: 95 мг, 43%; МС (IS): 619 [МН]+; т.пл. 111-118 С. Пример 8. Гидрохлорид N-(5-(4-хлорфенил)-3,3-диметил-1,1-диоксо-2,3-дигидроизотиазол-4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 370 мг,41%; МС (ES): 579 [МН]+; т.пл. 107-113 С. Пример 9. Трифторацетат N-(2-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-ил) этил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. К раствору тетраметилэтилендиамина (5 экв.) в ТГФ (60 мл) в атмосфере Аr добавляют при -75 С втор-бутиллитий (5 экв., в гексане) и N-трет-бутоксикарбонилэтилметиламин (5 экв.). Смесь перемешивают в течение 7 часов при -75 С, добавляют 2,2-диоксид 4-бромметил-3-(4-хлорфенил)-2-тиа-1 азаспиро[4,5]дец-3-ена (870 мг, 2,23 ммоль) в ТГФ (15 мл) и смесь перемешивают на протяжении ночи при комнатной температуре. После добавления уксусной кислоты и насыщенного NaHCO3 раствор экстрагируют этилацетатом. Органический слой сушат (Na2SO4) и выпаривают. Остаток растворяют в СН 2 Сl2(3 мл) и трифторуксусной кислоте (3 мл), перемешивают в течение 2 часов и после нейтрализации NaHCO3 экстрагируют этилацетатом. Органический слой сушат (Na2SO4) и концентрируют. После добавления диэтилового эфира 2,2-диоксид 3-(4-хлорфенил)-4-(2-этиламино)этил-2-тиа-1-азаспиро[4,5]дец-3 ена, показанный ниже, получают в виде белых кристаллов. Выход: 52 мг, 6,3%; МС (IS): 369 [МН]+. Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 70 мг, 69%; МС (IS): 631 [МН]+; т.пл. 90 С (разлож.). Пример 10. Трифторацетат N-(3-(4-трет-бутилфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4 илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способом, описанным в примере 1. Выход: 291 мг,55%; МС (ES): 639 [МН]+; т.пл. 234 С. Пример 11. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-пропиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. 2,2-Диоксид 3-(4-хлорфенил)-4-пропиламинометил-2-тиа-1-азаспиро[4,5]дец-3-ена получают способами, описанными в примере 3, с использованием пропиламина вместо метиламина. Выход: 72 мг,57%; МС (ES): 369 [MH]+. Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 80 мг, 70%; МС (IS): 631 [МН]+; т.пл. 136-138 С. Пример 12. Трифторацетат N-бутил-N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен 4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение, как показано выше, получают следующим образом. 2,2-Диоксид 4-бутиламинометил-3-(4-хлорфенил)-2-тиа-1-азаспиро[4,5]дец-3-ена получают способами, описанными в примере 3, с использованием бутиламина вместо метиламина. Выход: 76 мг, 51%; МС (IS): 383 [МН]+. Указанное в заголовке соединение получают и защитную группу его удаляют способами, описанными в примере 1. Выход: 65 мг, 56%. MC (IS): 645 [МН]+; т.пл. 145-147 С. Пример 13. Трифторацетат N-бензил-N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен 4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. 2,2-Диоксид 4-бензиламинометил-3-(4-хлорфенил)-2-тиа-1-азаспиро[4,5]дец-3-ена, показанный выше, получают способами, описанными в примере 3, с использованием бензиламина вместо метиламина. Выход: 86 мг, 53%; MC (IS): 467 [МН]+. Указанное в заголовке соединение получают и защитную группу удаляют способами, описанными в примере 1. Выход: 23 мг, 20%. MC (IS): 679 [МН]+; т.пл. 124-128 С. Пример 14. Трифторацетат N-(3-(4-хлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил)-N-метиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-5-фенилпентановой кислоты. Указанное в заголовке соединение получают сочетанием 2-(R)-2-(2-(N-трет-бутоксикарбониламино)-2-метилпропиониламино)-5-фенилпентановой кислоты (1,2 экв.) с 2,2-диоксидом 3-(4 хлорфенил)-4-метиламинометил-2-тиа-1-азаспиро[4.5]дец-3-ена (пример 3) и последующим удалениемN-(1-Ацетилциклогексил)фенилметансульфонамид получают из фенилметансульфонилхлорида и 1 этинилциклогексиламина способами, описанными в примере 1. Выход: 6 г, 73%; МС (IS): 296 [MH]+. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 1,2 г,50%; МС (IS): 597 [MH]+; т.пл. 106 С (разлож.). Пример 16. Гидрохлорид N-этил-N-(2,2-диоксо-3-фенил-2-тиа-1-азаспиро[4.5]дец-3-ен-4-илметил) амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 450 мг,55%; МС (IS): 583 [MH]+; т.пл. 94 С (разлож.). Пример 17. Гидрохлорид N-(3-(3-хлорфенил)-1-метил-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4 илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 340 мг,89%; МС (IS): 631 [МН]+; т.пл. 128 С (разлож.). Пример 18. Гидрохлорид N-N-(3-(2-хлорфенил)-1-метил-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен 4-илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 310 мг,81%; МС (IS): 631 [МН]+; т.пл. 130 С (разлож.). Пример 19. Гидрохлорид N-этил-N-1-метил-2,2-диоксо-3-(4-трифторметилфенил)-2-тиа-1-азаспиро Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 160 мг,56%; МС (IS): 665 [МН]+; т.пл. 110 С (разлож.). Пример 20. Гидрохлорид N-этил-N-(1-метил-3-(4-нитрофенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец 3-ен-4-илметил)амида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты. Указанное в заголовке соединение получают способами, описанными в примере 7. Выход: 160 мг,76%; МС (IS): 642 [МН]+; т.пл. 131-135 С. Пример 21. Гидрохлорид N-(3-(4-бромхлорфенил)-2,2-диоксо-2-тиа-1-азаспиро[4.5]дец-3-ен-4 илметил)-N-этиламида 2-(R)-2-(2-амино-2-метилпропиониламино)-3-фенилметоксипропионовой кислоты.
МПК / Метки
МПК: A61P 5/06, C07K 5/06, C07D 275/06, A61K 31/425
Метки: замещенные, гормона, усиливающих, дипептиды, качестве, средств, роста, секрецию
Код ссылки
<a href="https://eas.patents.su/30-6102-zameshhennye-dipeptidy-v-kachestve-sredstv-usilivayushhih-sekreciyu-gormona-rosta.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные дипептиды в качестве средств, усиливающих секрецию гормона роста</a>
Предыдущий патент: Бифенилкарбоксамиды, полезные в качестве снижающих содержание липидов агентов
Следующий патент: Лекарственная форма парацетамола
Случайный патент: Газогенераторный отопительный котёл для сжигания твёрдого топлива, в особенности кип соломы, с оптимизированными параметрами отработавших газов