Антитело, взаимодействующее с доменом ed-b (+) фибронектина, и способы его применения
Номер патента: 5685
Опубликовано: 28.04.2005
Авторы: Нери Дарио, Вити Франческа, Тарли Лоренцо, Бирхлер Манфред
Формула / Реферат
1. Выделенное антитело, представляющее собой антитело L19 или его функционально эквивалентную вариантную форму, которое распознает характерный эпитоп ED-(B)+ домена фибронектина со специфичной аффинностью и обладает константой диссоциации (Kd) в отношении указанного домена фибронектина менее 1 x 10-9 M, или фрагмент указанного антитела.
2. Антитело или его фрагмент по п.1, отличающееся тем, что Kd составляет 5,4 x 10-11 M.
3. Антитело или его фрагмент по п.1, отличающееся тем, что содержит вариабельный домен фрагмента scFv антитела L19, имеющий следующую аминокислотную последовательность:

4. Антитело или его фрагмент по п.3, отличающееся тем, что содержит домен VH, имеющий последовательность SEQ ID NO: 19.
5. Антитело или его фрагмент по п.3 или 4, отличающееся тем, что содержит домен VL, имеющий последовательность SEQ ID NO: 21.
6. Фрагмент по любому из пп.1-5, отличающийся тем, что представляет собой scFv.
7. Антитело или его фрагмент по любому из пп.1-6, меченные радиоактивным изотопом.
8. Антитело или его фрагмент по любому из пп.1-6, меченные радиоактивным йодом.
9. Применение антитела или его фрагмента по любому из пп.1-8 в качестве агента нацеливания на маркеры ангиогенеза или пролиферации сосудов.
10. Применение по п.9 для иммуносцинтиграфического выявления ангиогенеза.
11. Применение по п.10 для выявления ангиогенеза, связанного с диабетической ретинопатией, возрастной дегенерацией желтого пятна сетчатки или опухолями.
12. Диагностический набор, содержащий антитело или его фрагмент по любому из пп.1-8 и один или несколько реагентов, необходимых для выявления ангиогенеза.
13. Применение антитела или его фрагмента по любому из пп.1-8 для производства диагностического средства для диагностики опухолей или заболевания, характеризующегося пролиферацией сосудов.
14. Применение антитела или его фрагмента по любому из пп.1-8 для производства лекарственного средства для лечения опухолей или заболевания, характеризующегося пролиферацией сосудов.
15. Конъюгат, содержащий антитело или его фрагмент по любому из пп.1-8 и соединение, способное индуцировать свертывание крови и окклюзию кровеносных сосудов.
16. Конъюгат по п.15, отличающийся тем, что соединение, способное индуцировать свертывание крови и окклюзию кровеносных сосудов, представляет собой фотоактивное соединение.
17. Конъюгат по п.16, отличающийся тем, что фотоактивное соединение представляет собой фотосенсибилизатор.
18. Конъюгат по п.17, отличающийся тем, что фотосенсибилизатор поглощает свет с длиной волны свыше 600 нм.
19. Конъюгат по п.18, отличающийся тем, что фотосенсибилизатор представляет собой производное хлорина e6 олова (IV).
20. Применение конъюгата по любому из пп.15-19 для получения инъецируемой композиции для лечения патологического состояния, связанного с ангиогенезом.
21. Применение по п.20, отличающееся тем, что патологическое состояние, связанное с ангиогенезом, вызвано или связано с ангиогенезом глаза.
Текст
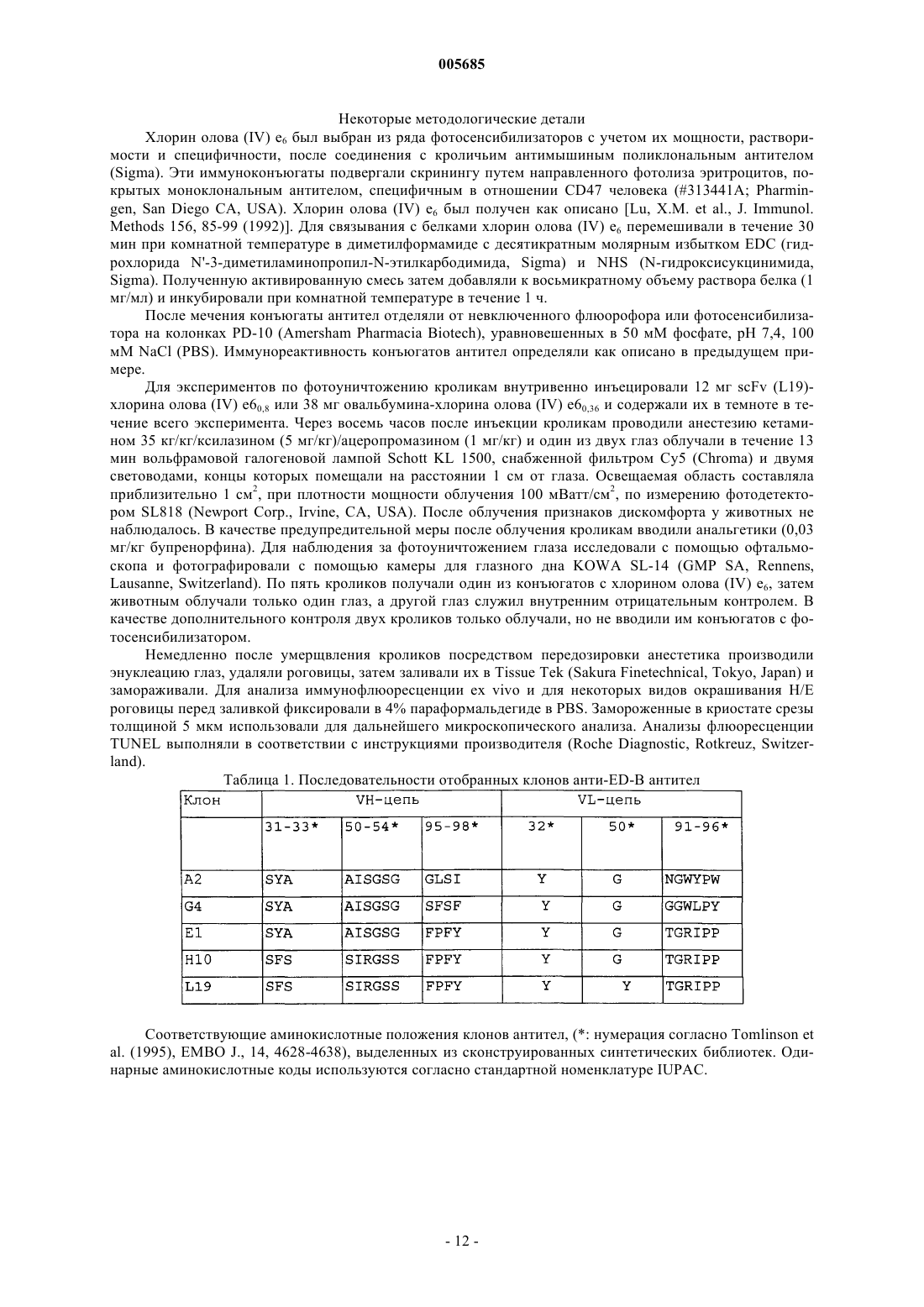
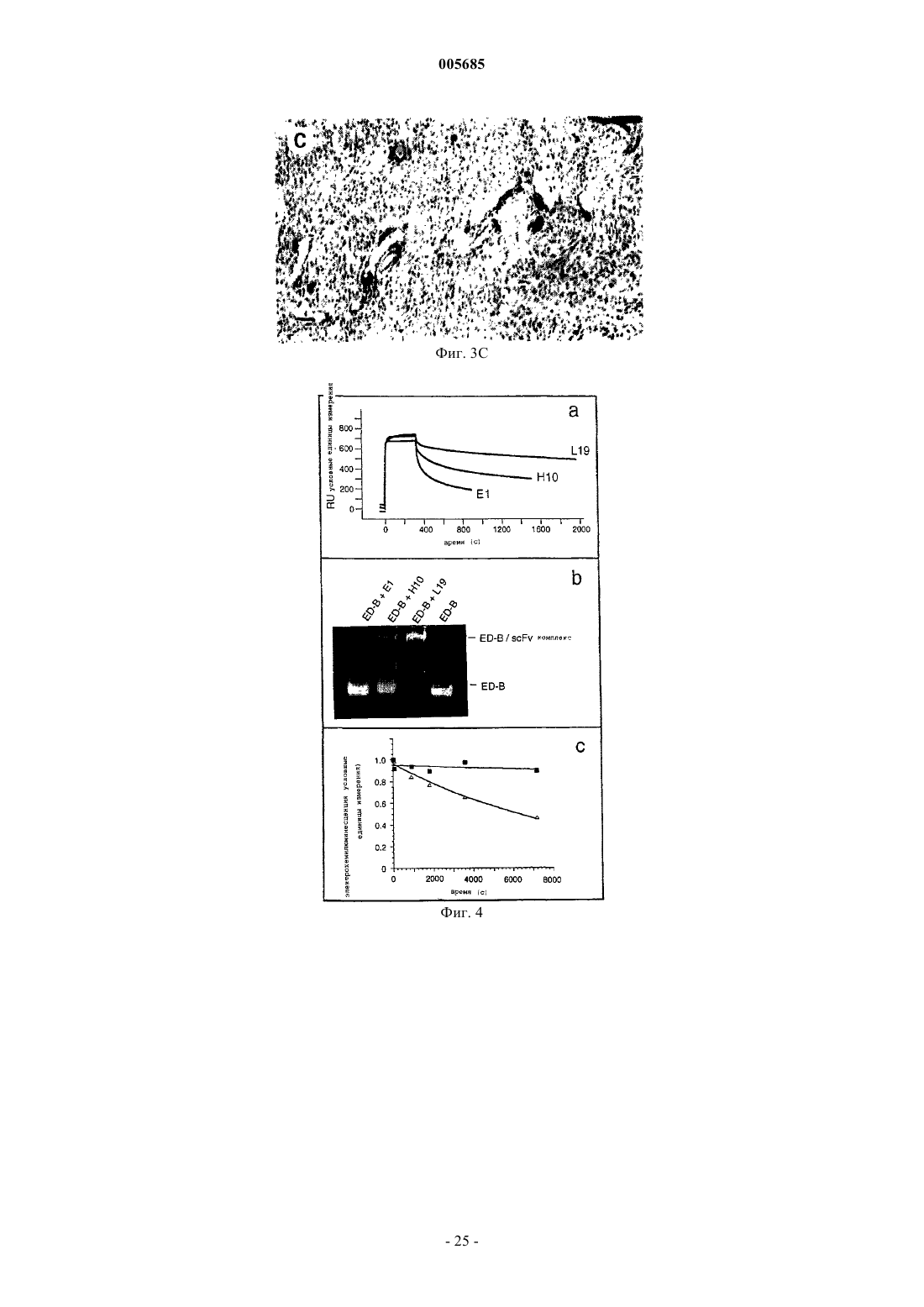
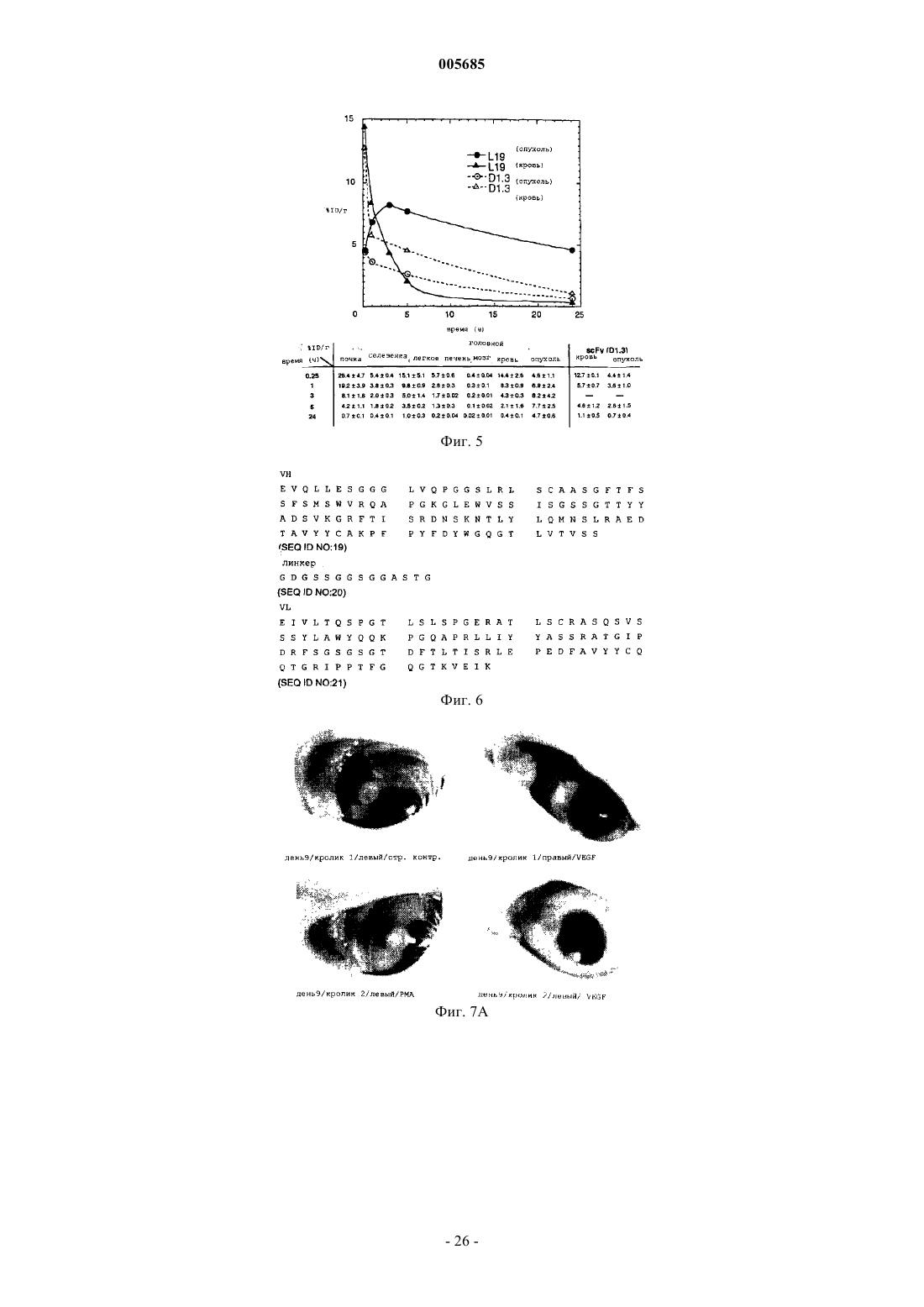
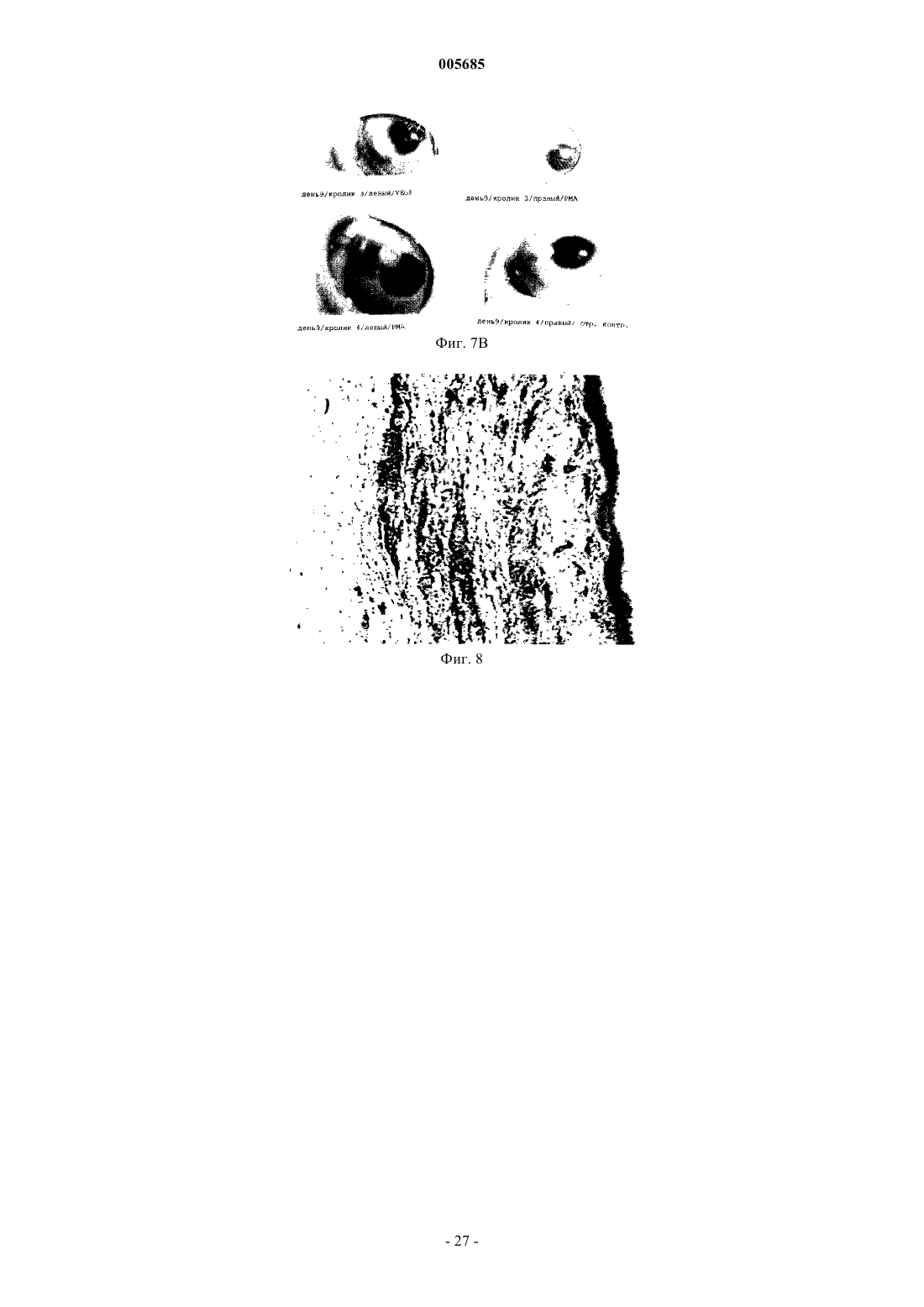
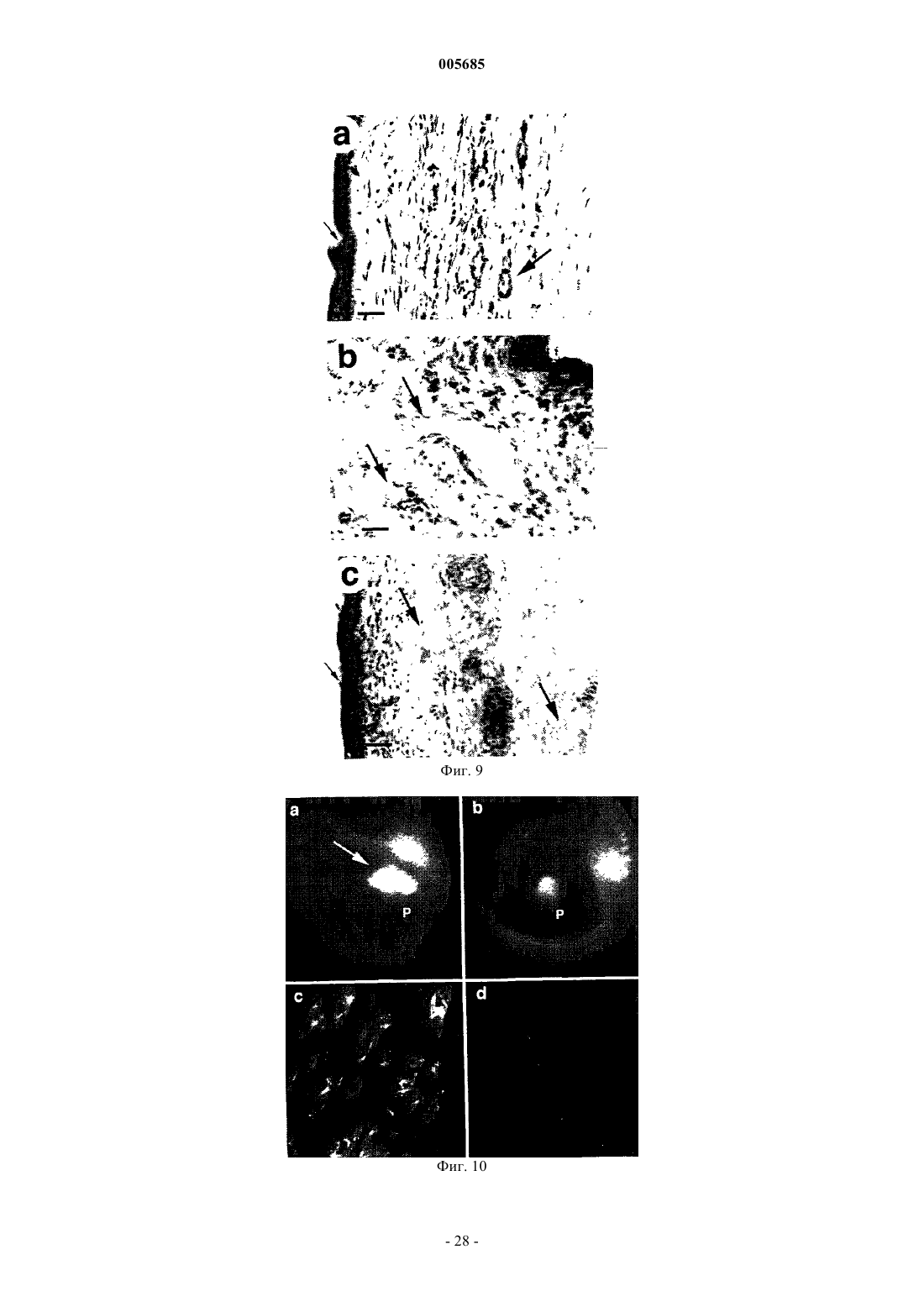
005685 Область изобретения Настоящее изобретение относится к антителам с субнаномолярной аффинностью, специфичным в отношении характерного эпитопа ED-B-домена фибронектина, маркера ангиогенеза. Оно относится также к применению меченных радиоактивным изотопом высокоаффинных анти-ED-B антител для обнаружения вновь образующихся кровеносных сосудов in vivo и к диагностическому набору, включающему указанные антитела. Помимо этого, настоящее изобретения относится к конъюгатам, включающим указанные выше антитела и подходящую фотоактивную молекулу (например, фотосенсибилизатор), и к их применению для обнаружения и/или коагуляции новообразованных кровеносных сосудов. Предпосылки к созданию изобретения Опухоли не способны расти свыше определенной массы без образования новых кровеносных сосудов (ангиогенеза), и для целого ряда опухолей сообщается о корреляции между плотностью микрососудов и инвазивностью опухоли (Folkman (1995), Nature Med., 1, 27-31). Помимо этого, ангиогенез лежит в основе большинства глазных болезней, которые приводят к потере зрения [Lee et al., Surv. Ophtalmol. 43,245-269 (1998); Friedlander, M. et al., Proc. Natl. Acad. Sci. USA 93, 9764-9769 (1996)]. Молекулы, способные селективно нацеливаться на маркеры ангиогенеза, должны создать клинические возможности диагностики и терапии опухолей, а также других заболеваний, которые характеризуются сосудистой пролиферацией, таких как диабетическая ретинопатия и возрастная дегенерация желтого пятна сетчатки. Маркеры ангиогенеза экспрессируются большинством агрессивных солидных опухолей и должны быть легко доступными для специфичных связывающих агентов, инъецируемых внутривенно (Pasqualini et al.,(1997), Nature Biotechnol., 15, 542-546; Neri et al. (1997), Nature Biotechnol., 15, 1271-1275). Прицельная окклюзия новообразованной сосудистой сети может привести к инфаркту и коллапсу опухоли (O'Reilly etED-B-домен фибронектина, последовательность из 91 аминокислоты, идентичная у мышей, крыс и людей, которая вставлена путем альтернативного сплайсинга в молекулу фибронектина, специфичным образом накапливается вокруг неоваскулярных структур (Castellani et al. (1994), Int. J. Cancer 59, 612-618) и может служить мишенью для молекулярного внедрения. Действительно, авторы настоящего изобретения недавно показали с помощью флюоресцентной методики, что одноцепочечные Fv-фрагменты антиED-B антител (scFv) селективно накапливаются в кровеносных сосудах опухолей у мышей, и что аффинность антител, как представляется, определяет механизм нацеливания (Neri et al. (1997), NatureGB96/10967.3). Нацеливание на опухоль определяли через 24 ч после инъекции или позднее. Известно о различных попытках получить антитела против ED-В-домена, чтобы использовать их для нацеливания на опухоли.Peters et al. (Cell Adhesion and Communication 1995, 3:67-89) раскрывают поликлональные антитела,полученные к антигенам, не содержащим никакой другой последовательности FN, кроме интактного EDB-домена, и показывают, что они специфично и непосредственно связываются с этим доменом. Однако реагенты, полученные Peters et al., имеют ряд недостатков: антисыворотки Peters et al. распознают ED-B(+)-FN только после обработки N-гликаназой. Это делает указанные реагенты непригодными для такого использования, как нацеливание на опухоли, визуализация и лечение, поскольку дегликозилирование нельзя осуществить in vivo. Авторы отдают себе отчет в том, что их антитела не распознают полноразмерный ED-B(+)-FN, вырабатываемый клетками млекопитающих. Они также признают тот факт, что получение моноклональных антител, специфичных в отношении ED-B-домена фибронектина было невозможно, несмотря на то, что антитела против других доменов фибронектина (таких какED-A) были получены. Специалистам хорошо известно, что поликлональные антисыворотки неприемлемы для указанного выше использования. Даже спустя годы интенсивных исследований в этой области моноклональные антитела, распознающие ED-B-домен фибронектина без обработки N-гликаназой, можно получить только с помощью метода дисплея на фаге, который использовался в настоящем изобретении.Zang et al. (Matrix Biology 1994, 14: 623-633) раскрывают поликлональную антисыворотку, полученную против ED-B-домена собаки. Эти авторы предусматривают возможность перекрестного реагирования с ED-FN человека, хотя такой тест проведен не был. Однако эти авторы осознают трудность получения моноклональных антител, непосредственно распознающих ED-B-домен фибронектина (стр. 631). Эта антисыворотка распознает ED-B(+)-FN в анализе вестерн-блоттинга только после обработки Nгликаназой. Как было упомянуто выше, необходимость обработки N-гликаназой делает эти реагенты непригодными для применения по настоящему изобретению. Распознавание ED-B(+)-FN в анализе ELISA происходит без необходимости дегликозилирования,но только на хряще, экстрагированном денатурирующим агентом (4 М мочевиной) и фиксированным на пластике с помощью желатина. Авторы отмечают, что связывание молекулы FN с желатином, прикрепленным к пластиковой поверхности на планшете для анализа ELISA, может каким-то образом экспонировать эти эпитопы в такой степени, которая достаточна для того, чтобы их могла распознавать антисы-1 005685 воротка. Поскольку при использовании in vivo FN нельзя денатурировать и связать с желатином, моноклональные связывающие агенты по настоящему изобретению имеют явное преимущество. Японские патенты JP02076598 и JP04169195 относятся к анти-ED-B антителам. Из этих документов не ясно, моноклональные ли анти ED-B антитела описаны. Помимо этого, представляется невозможным,что одно антитело (такое как антитело, описанное в JP02076598) имеет антигенную детерминанту в аминокислотной последовательности формул (1), (2) или (3):-(3) NGGESAPTTLTQQT на основе следующих данных:i) Моноклональное антитело должно распознавать четко определенный эпитоп.(ii) Трехмерная структура ED-B-домена фибронектина определена посредством ЯМРспектроскопии. Сегменты (1), (2) и (3) лежат на противоположных плоскостях ED-B-структуры и не могут одновременно связываться одним моноклональным антителом. Помимо этого, с целью показать полезность антител должна быть продемонстрирована их локализации в опухолях, а также данные, свидетельствующие об окрашивании структур ED-B(+)-FN в биологических образцах без обработки разрушающими структуру реагентами. Антитело ВС 1, описанное Carnemolla et al. 1992, J. Bioi. Chem. 267, 24689-24692, распознает эпитоп на 7 домене FN, но не на ED-B-домене, который является латентным в присутствии ED-B-домена фибронектина. Оно строго специфично для человека. Таким образом, антитело ВС 1 и антитела по настоящему изобретению демонстрируют разную реактивность. Более того, антитело ВС 1 распознает 7 домен отдельно и 7-8 домен фибронектина в отсутствии ED-B-домена (Carnemolla et al. 1992, J. Biol. Chem. 267,24689-24692). Такие эпитопы могут вырабатываться in vivo путем протеолитического расщепления молекул FN. Преимущество реагентов по настоящему изобретению заключается в том, что они могут локализоваться на молекулах или фрагментах FN только если они содержат ED-B-домен. Для диагностики рака и, более конкретно, для визуализации первичных и вторичных опухолевых поражений, иммуносцинтиграфия представляет собой методику выбора. При этой методике пациентам проводят томографию с помощью подходящего устройства (например, гамма-камеры), после того, как им инъецировали соединение, меченное радиоактивными изотопами (например, радионуклидом, связанным с подходящим носителем). Для применения при сцинтиграфии обычно используют короткоживущие гамма-излучатели, такие как технеций-99m, иод-123 или индий-111, с целью свести к минимуму воздействие ионизирующего облучения на пациента. Наиболее часто применяемым в радиологических отделениях радионуклидом является технеций 99m (99mTc), гамма-излучатели с периодом полураспада шесть часов. Пациентам, которым ввели радиоизотопные фармацевтические средства на основе 99mTc, можно проводить томографию вплоть до 12-24 ч после инъекции; однако, желательна аккумуляция нуклида в области поражения, представляющего интерес, в более ранние сроки. Помимо этого, если будут получены антитела, способные быстро и избирательно локализоваться в новообразованных кровеносных сосудах, исследователи будут иметь стимул для поиска других подходящих молекул для конъюгации с этими антителами, с целью получения диагностических и/или терапевтических преимуществ. Краткое описание сущности изобретения С учетом потребности медицинской радиологии в радиоизотопных препаратах, способных локализоваться в опухолевых поражениях через несколько часов после инъекции, а также информации о том,что аффинность антител, как представляется, оказывает влияние на их действие по нацеливанию в область ангиогенеза, целью настоящего изобретения является получение антител, специфичных в отношении ED-B-домена фибронектина, с субнаномолярной константой диссоциации (см. обзор литературы по определением и измерениям аффинности антитело-антиген, Neri et al. (1996, Trends in Biotechnol. 14,465-470). Еще одной целью настоящего изобретения является получение меченных радиоактивными изотопами антител в удобном виде, направленных против ED-B-домена фибронектина, которые выявляют опухолевые поражения уже через несколько часов после инъекции. Одной особенностью настоящего изобретения является то, что указанные цели достигаются с помощью антитела, обладающего специфичной аффинностью к характерному эпитопу ED-B-домена фибронектина и улучшенной аффинностью к указанному эпитопу ED-B. Еще одной особенностью настоящего изобретения является то, что описанное выше антитело используется для быстрого нацеливания на маркеры ангиогенеза. Еще одной особенностью настоящего изобретения является диагностический набор, включающий указанное антитело и один или более реагентов для выявления ангиогенеза. Еще одной особенностью настоящего изобретения является применение указанного антитела для диагностики и лечения опухолей и заболеваний, которые характеризуются пролиферацией кровеносных сосудов.-2 005685 И наконец, важную особенность настоящего изобретения представляют конъюгаты, включающие указанные антитела и подходящие фотоактивные молекулы (например, разумно подобранный фотосенсибилизатор), и их применение для избирательной светоопосредованной окклюзии новообразованных кровеносных сосудов. Терминология В настоящем изобретении используется несколько технических выражений, объяснения которых приводятся ниже.- Антитело Описывается иммуноглобулин, как естественный, так и частично или полностью синтезированный. Этот термин также относится к любому полипептиду или белку, имеющему домен связывания, который представляет собой домен связывания антитела, или гомологичен такому домену. Они могут быть получены из естественных источников или частично или полностью синтезироваться. Примерами антител являются изотипы иммуноглобулинов и их изотипические подклассы; фрагменты, которые включают антиген-связывающий домен, такие как Fab, scFv, Fv, dAb, Fd; и диательца. Можно использовать моноклональные и другие антитела и с помощью методик рекомбинантной ДНК получать другие антитела или химерные молекулы, которые сохраняют специфичность оригинального антитела. Такие методики могут включать встраивание ДНК, кодирующей вариабельную область иммуноглобулина или гипервариабельные участки (CDR), одного антитела в константные области или в константные области плюс каркасные области другого иммуноглобулина. См., например, ЕР-А-184187, GB 2188638A или ЕР-А 239400. Гибридому или другую клетку, вырабатывающую антитело, можно подвергнуть генетической мутации или другим изменениям, которые могут изменять или не изменять специфичность связывания вырабатываемых антител. Поскольку антитела можно модифицировать с помощью целого ряда способов, термин "антитело" следует истолковывать как включающий любой специфично связывающийся член или вещество, имеющие домен связывания нужной специфичности. Таким образом, этот термин охватывает фрагменты, производные, функциональные эквиваленты и гомологи антител, включая любой полипептид, содержащий домен связывания иммуноглобулина, как натуральный, так и полностью или частично синтетический. Таким образом, сюда относятся также химерные молекулы, включающие домен связывания иммуноглобулина, или эквивалент, слитый с другим полипептидом. Клонирование и экспрессирование химерных антител описаны в ЕР-А-0120694 и ЕР-А-0125023. Было показано, что фрагменты целого антитела могут выполнять функцию связывания антигенов. Примерами связывающих фрагментов являются: (i) Fab-фрагмент, состоящий из VL-, VH-, CL- и CHl-доменов; (ii) Fd-фрагмент,состоящий из VH- и CHl-доменов; (iii) Fv-фрагмент, состоящий из VL- и VH-доменов одного антитела;CDR-участки; (vi) F(ab')2-фрагменты, бивалентный фрагмент, включающий два связанных между собойFab-фрагмента; (vii) одноцепочечные молекулы Fv (scFv), в которых VH-домен и VL-домен связаны полипептидным линкером, который позволяет этим двум доменам ассоциировать с образованием антигенсвязывающего участка (Bird et al. (1988) Science, 242, 423-426; Huston et al. (1988) Proc. Natl. Acad. Sci."диательца", поливалентные или полиспецифичные фрагменты, построенные путем слияния генов(WO94/13804; Holliber et al. (1993) Proc. Natl. Acad. Sci. USA, 90, 6444-6448). Диательца представляют собой мультимеры полипептидов, каждый из которых включает первый домен, включающий участок связывания легкой цепи иммуноглобулина, и второй домен, включающий участок связывания тяжелой цепи иммуноглобулина; причем оба эти домена связаны друг с другом (например, посредством пептидного линкера), но не способны связываться друг с другом с образованием антигенсвязывающего участка; антиген-связывающие участки образуются путем связывания первого домена одного полипептида в мультимере со вторым доменом другого полипептида в этом же мультимере (WO94/13804). В случае,если необходимо использовать антитела с двойной специфичностью, то они могут представлять собой обычные антитела с двойной специфичностью, которые можно изготовить различными способами (Holliger and Winter (1993), Curr. Opin. Biotech., 4, 446-449), например, получить химические путем или с помощью гибридных гибридом, или они могут представлять собой любые фрагменты антител с двойной специфичностью, упомянутые выше. Использование димеров scFv или диателец может быть более предпочтительным, чем использование целых антител. Диательца и scFv можно изготовить без Fc-области, с использованием только вариабельных доменов, что потенциально уменьшает эффекты антиидиотипической реакции. Другие формы антител с двойной специфичностью включают одноцепочечные CRAb,описанные Nori et al. 1995), J. Mol. Biol., 246, 367-373).- Гипервариабельные участки Традиционно, гипервариабельные участки (CDR) вариабельных доменов антитела идентифицируются как гипервариабельные последовательности антитела, содержащие остатки, необходимые для специфичного распознавания антигенов. В этом документе авторы ссылаются на определение и нумерацию- функционально эквивалентная вариантная форма-3 005685 Этот термин относится к молекуле (варианту), которая, хотя и имеет структурные различия с другой молекулой (родительской), но сохраняет определенную значительную гомологичность, а также по крайней мере часть биологической функции родительской молекулы, например, способность связываться с определенным антигеном или эпитопом. Варианты могут быть в форме фрагментов, производных или мутантов. Вариант, производное или мутант можно получить посредством модификации родительской молекулы, путем добавления, делеции, замещения или вставки одной или более аминокислот, или путем образования связи с другой молекулой. Эти изменения можно осуществлять на уровне нуклеотида или белка. Например, закодированный полипептид может представлять собой Fab-фрагмент, который затем присоединяют к Fc-хвост из другого источника. Альтернативно, можно присоединять маркер, такой как фермент, флюоресцеин и т.п. Например, функционально эквивалентная вариантная форма антитела "А" против характерного эпитопа ED-B-домена фибронектина могла бы представлять собой антитело "В" с другой последовательностью гипервариабельных участков, но распознающее тот же эпитоп, что и антитело "А". Авторы настоящего изобретения выделили рекомбинантные антитела в scFv-формате, которые являются специфичными в отношении ED-B-домена фибронектина и распознают ED-B(+)-фибронектин в срезах тканей, из банка фагового дисплея антител. Одно из этих антител, Е 1, подвергали аффинному созреванию, с получением антител Н 10 и L19, с улучшенной аффинностью. Антитело L19 имеет константу диссоциации для ED-B-домена фибронектина в пределах субнаномолярных концентраций. Высокоаффинные антитела L19 и D1.3 (антитело, специфичное в отношении постороннего антигена, лизоцима куриного яйца) метили радиоактивным изотопом и инъецировали мышам, имеющим опухоли. Через различные промежутки времени получали данные по биораспределению в опухоли, крови и органах, и выражали их в проценте инъецированной дозы на грамм ткани (%ID/г). Уже через 3 ч после инъекции %ID/г (опухоль) был лучше чем %ID/г (кровь) для L19, но не для отрицательного контроляD1.3. Соотношения опухоль:кровь возрастали позднее. Это наводит на мысль о том, что высокоаффинное антитело L19 может служить подходящим агентом для нацеливания на опухоль, например, для иммуносцинтиграфического выявления ангиогенеза.- Фотосенсибилизатор Фотосенсибилизатор можно определить как молекулу, которая после облучения и в присутствии воды и/или кислорода, будет генерировать токсические виды молекул (например, атомарный кислород),способные реагировать с биомолекулами, потенциально вызывая, таким образом, повреждение биологических мишеней, таких как клетки, ткани и жидкости организма. Фотосенсибилизаторы особенно полезны, когда они поглощают длины волн свыше 600 нм. На самом деле, проникновение света в ткани и жидкости организма является максимальным в пределах длин волн 600-900 нм [Wan et al. (1981), Photochem. Photobiol. 34, 679-681]. Прицельная доставка фотосенсибилизаторов, за которой следует облучение, представляет собой привлекательный подход к терапии заболеваний, связанных с ангиогенезом [Yarmush, M.L. et al., Antibody targeted photolysis, Crit. Rev. Therap. Drug Carrier Systems 10, 197-252 (1993); Rowe, P.M., Lancet 351,1496 (1998); Levy, J. Trends Biotechnol. 13, 14-18 (1995)], особенно для избирательного удаления новообразованных кровеносных сосудов глаза. Использование имеющихся терапевтических способов, таких как лазерная фотокоагуляция, как непосредственная, так и после введения фотосенсибилизирующих агентов,ограничено отсутствием избирательности и обычно приводит к повреждению здоровых тканей и сосудовRes. 16, 83-90 (1997); Schmidt-Erfurth, U. et al.; Graefes Arch. Clin. Exp. Ophthalmol. 236, 364-374 (1998)]. Принимая во внимание аргументы, представленные выше, можно видеть, что открытие новых путей улучшения избирательности и специфичности фотосенсибилизаторов является крайне важным, например, путем конъюгирования их с подходящей молекулой-носителем. Очевидно, разработка молекулносителей хорошего качества окажется нетривиальной задачей. Более того, возможно, что не все фотосенсибилизаторы будут пригодны для поставки носителем в область, представляющую интерес, in vivo. Такие факторы как химическое строение, растворимость, липофильность, надежность связи с носителем и мощность фотосенсибилизатора, вероятно, будут коренным образом влиять на "меткость" и эффективность конъюгатов фотосенсибилизатора. Авторы в настоящем документе показывают, что высокоаффинное антитело L19, специфичное в отношении ED-B-домена фибронектина, после системного введения избирательно локализуется в новообразованных кровеносных сосудах в экспериментах на кроликах с ангиогенезом глаз. Антитело L19,химически соединенное с фотосенсибилизирующим агентом хлорином олова (IV) е 6 и облученное красным светом, опосредовало избирательную окклюзию новообразованных кровеносных сосудов глаза и способствовало апоптозу соответствующих эндотелиальных клеток. Эти результаты показывают, что новообразованные кровеносные сосуды глаза можно отличать от ранее существовавших сосудов с помощью иммунохимических методов in vivo, и настоятельно предполагают, что прицельная доставка фотосенсибилизаторов с последующим облучением может быть эффективной при лечении глазных болезней, приводящих к слепоте, и, возможно, при лечении других заболеваний, связанных с ангиогенезом.-4 005685 Краткое описание чертежей Варианты осуществления настоящего изобретения иллюстрируются следующими чертежами: фиг. 1 показывает схему библиотеки фагового дисплея антител; фиг. 2 - 2D гели и вестерн-блоттинг лизата клеток COLO-38 меланомы человека; фиг. 3 А, 3 В, 3 С - иммунохимические эксперименты на полиформной глиобластоме; фиг. 4 - анализ стабильности комплексов антитело-(ED-B); фиг. 5 - биораспределение мышей с опухолями, которым инъецировали фрагменты антител, меченные радиоактивным изотопом; фиг. 6 показывает аминокислотную последовательность L19; фиг. 7 А и 7 В - глаза кролика с импланитированной гранулой; фиг. 8 - иммуногистохимический анализ срезов роговицы глаза кролика; фиг. 9 - иммуногистохимический анализ срезов глазных структур кроликов (роговицы, радужной оболочки и конъюнктивы) с использованием красного субстрата щелочной фосфатазы и гематоксилина; фиг. 10 показывает локализацию антител с флюоресцентной меткой в новообразованных кровеносных сосудах глаза; фиг. 11 - макроскопически вид глаз кроликов, которым инъецировали белки, связанные с фотосенсибилизаторами, до и после облучения; фиг. 12 - микроскопический анализ срезов глазных структур кроликов, которым инъецировали белки, связанные с фотосенсибилизаторами, и облучали красным светом. Подробное описание чертежей Фиг. 1 показывает: Схема библиотеки фагового дисплея антитела.(а) Фрагменты антитела размещаются на фаге как слияние pIII, как изображено схематически. В участке связывания антитела (общий вид антигенов) каркас Vk CDR обозначен желтым цветом, каркасVH CDR обозначен синим цветом. Остатками, подверженными случайным мутациям, являются положение Vk CDR3 91, 93, 94 и 96 (желтый цвет) и положение VH CDR3 95, 96, 97 и 98 (синий цвет). Атомы углерода этих боковых цепей показаны более темными цветами. Показаны также (серым цветом) остаткиCDR1 и CDR2, которые можно подвергать мутациям для улучшения аффинности антитела. С помощью компьютерной программы RasMol (http://www.chemistry.ucsc.edu/wipke/teaching/rasmol.html), была смоделирована структура scFv из pdb файла ligm (Brookhaven Protein Data Bank; http://www2.ebi.ac.uk/pcserv/pdfcKib.htm).(b) ПЦР-амплификация и стратегия клонирования библиотек. Микробные линейные матрицы DP47 и DPK22 были модифицированы (см. текст) для генерации мутаций в CDR3-областях. Гены обозначены прямоугольниками, а CDR - пронумерованными квадратами внутри прямоугольника. Затем осуществили сборку VH- и VL-сегментов и клонировали в фагемидный вектор pDN332. Праймеры (от SEQ ID NO:11 до SEQ ID NO:18), использованные в амплификации и сборке перечислены в нижней части листа. Фиг. 2 показывает электрофорез в полиакриламидном геле 2D и вестерн-блоттинг (а) Окрашивание серебром после 2D-PAGE лизата клеток COLO-38 меланомы человека, к которым был добавлен рекомбинантный ED-B-содержащий 7 В 89. Два 7 В 89 пятна (кружок) образовались в результате частичного протеолиза His-метки, использованной для очистки белка, (b) Иммуноблоттинг геля, идентичный таковому, изображенному на фиг. 2 а, с использованием анти-ED-B Е 1 (табл. 1) и М 2 анти-FLAG антител в качестве реагента-детектора. Были выявлены только пятна 7 В 89, что подтверждает специфичность рекомбинантного антитела, выделенного из гелевого пятна. Фиг. 3 А-3 С показывают: Иммуногистохимические эксперименты на серийных срезах полиформной глиобластомы, демонстрирующие типичные клубочкоподобные сосудистые структуры, окрашенные с помощью scFv El (A), А 2(В) и G4 (С). Толщина срезов: 20 мкм. Фиг. 4 показывает: Стабильность комплексов антитело-(ED-B). Анализ связывания scFv Е 1, Н 10 и L19 с ED-Bдоменом фибронектина. (а) Сенсограммы BIAcore, показывающие улучшенные показатели диссоциации,полученные после аффинного созревания антител. (b) Нативный электрофорез в геле комплексов scFv(ED-B). Только высокоаффинное антитело L19 может образовывать стабильный комплекс с антигеном,меченным флюоресцентной меткой. Определение флюоресценции было выполнено как описывают (Neri(с) Конкуренция комплекса scFv-(ED-B-биотин) со 100-кратным молярным избытком небиотинилированного ED-B, которую наблюдали с помощью электрохемилюминесценции с использованием аппарата Origen. Можно наблюдать продолжительный период полужизни комплекса L19-(ED-B). Черные квадраты: L19; незакрашенные треугольники: Н 10. Фиг. 5 показывает: Биораспределение мышей с опухолями, которым инъецировали фрагменты антител, меченные радиоактивным изотопом.-5 005685 Данные по биораспределению в опухоли и крови, выраженные как процент инъецированной дозы на грамм, нанесены на график в зависимости от времени. Приведены также данные по относительному биораспределению в органах. Фиг. 6 показывает аминокислотную последовательность антитела L19, включающего тяжелую цепь(VH), линкер и легкую цепь (VL). Фиг. 7 А и 7 В показывают глаза кролика с имплантированными полимерными гранулами, пропитанными ангиогенными веществами. Фиг. 8 показывает иммуногистохимический анализ срезов роговицы глаза кролика с новообразованными кровеносными сосудами, окрашенными антителом L19. Фиг. 9 показывает иммуногистохимическое исследование глазных структур с использованием антитела L19. Наблюдалось специфическое красное окрашивание вокруг новообразованных кровеносных структур в роговице (а), но не вокруг кровеносных сосудов радужной оболочки (b) и конъюнктивы (с). Маленькие стрелки: роговичный эпителий. Кровеносные сосуды, о которых идет речь, обозначены большими стрелками. Толщина срезов 50 мкм. Фиг. 10 показывает иммунофотодетекцию антител с флюоресцентной меткой, нацеленных на ангиогенез глазных структур. Сильно выраженное новообразование кровеносных сосудов в роговице (обозначенное стрелкой) наблюдалось у кроликов, которым инъецировали конъюгат антитела L19-Cy5 (а),специфичного в отношении ED-B-домена FN, и не наблюдалось при инъекции антитела HyHEL-10-Cy5(b). Иммунофлюоресцентная микроскопия срезов роговицы подтвердила, что именно L19-Cy5 (с), а неHyHEL-lQ-Cy5 (d) локализуется вокруг новообразованных кровеносных структур в во-роговице. Изображения (а,b) были получены спустя 8 ч после инъекции антитела; (c,d) были получены с использованием срезов роговицы, выделенных от кроликов спустя 24 ч после инъекции антитела. Р, гранула. Фиг. 11 показывает макроскопические изображения глаз кроликов, которым инъецировали конъюгаты с фотосенсибилизаторами. Глаз кролика, которому инъецировали L19-PS до (а) и спустя 16 ч после облучения красным светом (b). Стрелка указывает коагулированные новообразованные сосуды, что подтверждается как гипофлюоресцентная область на Су 5 флюороангиограмме панели (с) спустя 16 ч после облучения. Нужно отметить, что в других сосудистых структурах коагуляции не наблюдается, например,в расширенных сосудах конъюнктивы. Для сравнения показана Су 5 флюороангиограмма с гиперфлюоресценцией просачиваемых сосудов и соответствующая цветная фотография не меченный глаз кролика на (d) и (h). Изображения (е, f, g) аналогичны (а, b, с), но принадлежат кролику, которому инъецировали овальбумин-РS и которого облучали красным светом. Коагуляции не наблюдается, а ангиограмма демонстрирует гиперфлюоресценцию просачиваемых сосудов. Глаза кролика на ранней стадии ангиогенеза,которому инъецировали L19-PS, показаны на (i-1). Изображения до (i) и спустя 16 ч после облучения красным светом (j) выявляют обширную и избирательную индуцированную светом внутрисосудистую коагуляцию (стрелка). Окклюзия сосудов (стрелка) особенно очевидна в облученном глазе (1) кролика немедленно после умерщвления и не обнаруживается в необлученном глазе (k) того же кролика. Р, гранула. Острия стрелок указывают край роговицы (лимб). На всех рисунках над лимбом видны ранее существовавшие расширенные конъюнктивальные сосуды, в то время как можно наблюдать рост новообразованных сосудов роговицы из лимба по направлению к грануле (Р). Фиг. 12 показывает микроскопический анализ избирательной окклюзии кровеносных сосудов. Н/Е срезы роговицы (а, е, b, f: нефиксированные; i, j: фиксированные параформальдегидом) кроликов, которым инъецировали овальбумин-РS (а, е, i) или L19-PS (b, f, j) и которых облучали. Большие стрелки указывают показательные примеры неповрежденных (е, i) или полностью окклюзированных (f, j) кровеносных сосудов. В противоположность избирательной окклюзии новообразованных сосудов роговицы и ограниченному периваскулярному повреждению (эозиновилии), опосредованным L19-PS, после облучения (b, f, j), сосуды конъюнктивы (k) и радужной оболочки (1) у того же кролика не имеют признаков повреждения. Флюоресцентный анализ TUNEL выявляет различное количество апоптотических клеток в срезах от облученных кроликов, которым инъецировали L19-PS (с, g) или овальбумин-РS (d, h). Большие стрелки указывают некоторые сосудистые структуры, о которых идет речь. Маленькие стрелка указывают эпителий роговицы. Толщина срезов: 100 мкм (a-d) и 25 мкм (е-1). Настоящее изобретение более подробно описывается в следующих примерах. Пример 1. Выделение scFv-фрагментов антител человека, специфичных в отношении ED-B-домена фибронектина, из библиотеки фагового дисплея антител. Библиотеку антител человека клонировали с использованием VH (DP47; Tomlinson et al. (1992), J.Mol. Biol., 227, 776-798) и Vk (DPK22; Cox et al. (1994), Eur. J. Immunol., 24, 827-836) микробных линейных генов (см. фиг. 1, на которой отображена стратегия клонирования и амплификации). VH-компонент библиотеки был создан с использованием частично вырожденных праймеров (фиг. 1) (SEQ ID NO: 11 SEQ ID NO: 18) в методике на основе ПЦР, с внесением случайных мутаций на позициях 95-98 CDR3.VL-компонент библиотеки генерировали таким же способом, путем внесения случайных мутаций на позициях 91, 93, 94 и 96 CDR3. ПЦР-реакции выполняли как описано (Marks et al. (1991), J. Mol. Biol., 222,581-597). VH-VL scFv-фрагменты конструировали посредством ПЦР-сборки (фиг. 1; Clackson et al.(1991), Nature, 352, 624-628), из очищенных посредством электрофореза в геле VH- и VL-сегментов. 30-6 005685 мкг очищенных VH-VL scFv-фрагментов дважды подвергали ферментативному расщеплению с помощью 300 единиц Ncol и Notl, затем вшивали в 15 мкг обработанного Notl/Ncol фагемидного вектораpDN332. pDN332 является производным фагемиды pHENI (Hoogenboom et al. (1991), Nucl. Acids Res., 19,4133-4137), в котором последовательность между сайтом Notl и янтарь-кодоном, предшествующая генуIII, была замещена следующей последовательностью, кодирующей метку D3SD3-FLAG-His6 (Neri et al. Трансформации в штамм E.coli TG1 выполняли согласно Marks et al. (1991, J. Mol. Biol., 222, 581597), а фаги получали согласно стандартным методикам (Nissim et al. (1994), J. Mol. Biol., 222, 581-597). Пять клонов отбирали случайным образом и секвенировали на предмет отсутствия первазивной контаминации. Рекомбинантные ED-B- и 7 В 89-фрагменты фибронектика, содержащие один и четыре гомологичных повторностей типа III, соответственно, экспрессировали из экспрессирующих векторов на основеpQE12 (Qiagen, Chatsworth, CA, USA), как описано (Carnemolla et al. (1996), Int. J. Cancer, 68, 397-405). Селекцию против рекомбинантного ED-B-домена фибронектина (Carnemolla et al. (1996), Int. J.Cancer, 68, 397-405, Zardi et al. (1987), EMBO J., 6, 2337-2342) осуществляли в концентрации 10 нМ, с использованием антигена, биотинилированного с помощью N-гидроксисукцинимидного эфира дисульфида биотина реагент В-4531; Sigma, Buchs, Switzerland; 10) и элюированного из 2D геля и ловушки Dynabeads со стрептавидиновым покрытием (Dynal, Oslo, Norway). Для каждого цикла пэннинга использовали 1013 фагов, в 1 мл реакции. Фаги инкубировали с антигеном в 2% молочной среде в физиологическом растворе с фосфатным буфером (MPBS) в течение 10 мин. К этому раствору добавляли 100 мкл Dynabeads (10 мг/мл; Dynal, Oslo, Norway), предварительно блокированных в MPBS. После 5-минутного перемешивания гранулы выделяли из раствора с помощью магнита и семь раз промывали физиологическим раствором с фосфатным буфером и 0,1% Твином-20 (PBST) и трижды - физиологическим раствором с фосфатным буфером. Элюцию осуществляли путем инкубации в течение 2 мин с 500 мкл 50 мМ дитиотреитола (DTT), для восстановления дисульфидного мостика между антигеном и биотином. Гранулы вновь отделяли и полученный раствор использовали для инфицирования клеток E.coli TG1 в стадии экспоненциального роста. После трех циклов пэннинга элюированный фаг использовали для инфицирования клеток E.coli НВ 2151 в стадии экспоненциального роста и засевали на планшеты с (2xTY + 1% глюкоза + 100 мкг/мл ампициллина) - 1,5% агаром. Отдельные колонии выращивали на 2xTY + 0,1% глюкоза + 100 мкг/мл ампициллина, и индуцировали в течение ночи при 30 1 мМ IPTG для достижения экспрессии антител. Полученные надосадочные жидкости подвергали скринингу посредством ELISA с использованием микротитрационных планшетов со стрептавидиновым покрытием, обработанных 10 нМ биотинилированным ED-B и анти-FLAG M2 антителом (IBI Kodak, New Haven, CT) в качестве реагентадетектора. 32% прошедших скрининг клонов в этом исследовании были положительными, и три из них,которые показали наиболее сильный сигнал в анализе ELISA (E1, A2 и G4), секвенировали и далее охарактеризовывали. Анализы ELISA выполняли с использованием биотинилированного ED-B, выделенного из гелевого пятна, биотинилированного ED-В, который не был денатурирован, ED-B, связанного со смежными доменами фибронектина (рекомбинантный белок, содержащий 7 В 89-домены) и ряда посторонних антигенов. Антитела El, A2 и G4 мощно и специфично реагировали со всеми тремя ED-B-содержащими белками. Этот факт, а также тот факт, что эти три рекомбинантных антитела могут быть очищены из бактериальных супернатантов на колонке с иммобилизованным ED-B, настоятельно наводят на мысль о том, что они распознают эпитоп, имеющийся в нативной конформации ED-B. С фрагментами фибронектина, которые не содержали ED-B-домен, реакция отсутствовала (данные не представлены). С целью проверить, обладают ли антитела, выделенные против гелевого пятна, хорошей аффинностью в отношении нативного антигена, был выполнен анализ взаимодействия в условиях реального времени с использованием резонанса поверхностного плазмона с использованием инструмента BIAcore, как описано (Neri et al. (1997), Nature Biotechnol., 15, 1271-1275). Мономерные фракции scFv-фрагментов E1,A2 и G4 связываются с ED-B с аффинностью в пределах 107-108 М-1 (табл. 1). В качестве дополнительного испытания специфичности и пригодности антител был выполнен анализ 2D-PAGE иммуноблоттинга, с пропусканием через гель лизата клеточной линии COLO-38 меланомы человека, к которому были добавлены минутные количества ED-B-содержащего рекомбинантного белка 7 В 89 (фиг. 2). scFv(E1) сильно и специфично окрашивали только пятно 7 В 89. Антитела El, A2 и G4 использовали для иммунной локализации ED-B-содержащего фибронектина(B-FN) в замороженных срезах полиформной глиобластомы, агрессивной опухоли головного мозга чело-7 005685 века с выраженными процессами ангиогенеза. Фиг. 3 показывает серийные срезы полиформной глиобластомы, с типичными клубочкоподобными сосудистыми структурами, окрашенными в красный цвет этими тремя антителами. Иммунное окрашивание срезов образцов полиформной глиобластомы, замороженных в жидком азоте немедленно после хирургического удаления, выполняли, как описано (Carnemolla etal. (1996), Int. J. Cancer, 68, 397-405, Castellani et al. (1994), Int. J. Cancer, 59, 612-638). Вкратце, иммунное окрашивание выполняли с использованием М 2-анти-FLAG антитела (IBI Kodak), биотинилированных антимышиных поликлональных антител (Sigma), набора для окрашивания с комплексами стрептавидинбиотина и щелочной фосфатазы (BioSpa, Milan, Italy) и нафтол-АS-МХ-фосфата и быстрого красного TR(Sigma). Гематоксилин Гилла использовали как противокраску, с последующей заливкой в глицергель(Dako, Carpenteria, CA), как сообщалось ранее (Castellani et al. (1994), Int. J. Cancer, 59, 612-618). Используя сходную методику и антитело L19 (см. следующий пример), авторы настоящего изобретения смогли также специфично окрасить новообразованные кровеносные сосуды, индуцированные имплантированием в роговицу глаза кролика полимерных гранул, пропитанных ангиогенными веществами,такими как сосудистый эндотелиальный фактор роста или сложные эфиры форбола. Пример 2. Выделение scFv-фрагментов антител человека, связывающихся с ED-B с субнаномолярной аффинностью.scFv(El) выбрали для тестирования возможности улучшения его аффинности с ограниченным числом мутаций остатков CDR, расположенных на периферии антигенсвязывающего участка (фиг. А). Авторы настоящего изобретения комбинационно мутировали остатки 31-33, 50, 52 и 54 VH антитела, и распределяли соответствующий спектр на нитчатом фаге. Установлено, что эти остатки часто контактируют с антигеном в известных трехмерных структурах комплексов антитело-антиген. Полученный спектр из 4 х 108 клонов отбирали на предмет связывания с ED-B-доменом фибронектина. После двух циклов пэннинга и скрининга 96 отдельных клонов было выделено антитело с улучшенной в 27 раз аффинностью(Н 10; табл. 1 и 2). В полном соответствии с тем, что наблюдали другие исследователи, изучавшие аффинное созревание антител, улучшенная аффинность была обусловлена скорее более медленной диссоциацией от антигена, чем улучшенными значениями kon (Schier et al. (1996), Gene, 169, 147-155, Ito(1995), J. Mol. Biol., 248, 729-732). Распространено мнение, что легкая цепь антитела вносит меньший вклад в антигенсвязывающую аффинность, что подтверждается тем фактом, что как натуральные, так и искусственные антитела, лишенные легкой цепи, все же могут связываться с антигеном (Ward et al.(1989), Nature, 341, 544-546, Hamers-Casterman et al. (1993), Nature, 363, 446-448). По этой причине авторы настоящего изобретения предпочли рандомизировать только два остатка (32 и 50) VL-домена, которые расположены в центре антигенсвязывающего участка (фиг. 1 а) и, как часто обнаруживают, контактируют с антигеном в пространственных структурах. Полученную библиотеку, содержавшую 400 клонов, распределяли на фаге и отбирали на предмет связывания с антигеном. По результатам анализа параметров диссоциации с использованием анализа взаимодействия в условиях реального времени с помощью инструмента BIAcore (Jonsson et al. (1991), BoiTechniques, 11, 620-627) и измерений величин koff с помощью конкурентных экспериментов с электрохемилюминесцентным обнаружением, был идентифицирован клон (L19), который связывался с ED-B-доменом фибронектина с величиной Kd = 54 пМ (табл. 1 и 2). Эксперименты по аффинному созреванию были выполнены следующим образом. Ген scFv(El) подвергали ПЦР-амплификации с использованием праймеров LMBlbis (5'-GCG GCC CAG CCG GCCNNM NNGCTA AAG GTG AAT CCA GAG GCT G-3 ') (SEQ ID NO: 2) для внесения случайных мутаций в положения 31-33 в CDR1 VH (для нумерации: 28) и праймеров DP47CDR1back (5'-ATG AGC TGG GTCACC MNN AAT MNN TGA GAC CCA CTC CAG CCC CTT-3 ' ) (SEQ ID NO: 4) для внесения случайных мутаций в положения 50, 52, 54 в CDR2 VH. Оставшийся фрагмент гена scFv, покрывающий 3 -часть гена VH, пептидный линкер и ген VL, амплифицировали с использованием праймеров DP47CDR2backGGC CGC ТТТ GAT TTC САС СТТ GGT CCC TTG GCC GAA CG-3') (SEQ ID NO: 6) (94 С 1 мин, 60 С 1 мин, 72 С 1 мин). Три полученные ПЦР-продукта очищали на гелевой колонке и осуществляли сборку с помощью ПЦР (21) с использованием праймеров LMBlbis и JforNot 94 С 1 мин, 60 С 1 мин, 72 С 1 мин). Полученный один ПЦР-продукт очищали от ПЦР-примесей, дважды подвергали ферментативному расщеплению с помощью Notl/Ncol и вшивали в обработанный Notl/Ncol вектор pDN332. Приблизительно 9 мкг вектора и 3 мкг вставки использовали в смеси для лигирования, которую очищали путем фенолизации и осаждения этанолом, ресуспендировали в 50 мкл стерильной воды и элекропорировали в электрокомпетентные клетки E.coli TGI. Полученная библиотека аффинного созревания содержала 4 х 108 клонов. Частицы антитело-фаг, полученные, как описано (Nissim et al. (1994), EMBO J., 13, 692-698), использовали для первого цикла отбора на пробирках для иммунного анализа с покрытием 7 В 89 (Carnemolla et al. (1996 , Int. J. Cancer, 68, 397-405). Отобранные фаги использовали для второго цикла пэннинга, выполненного с биотинилированным ED-B, с последующим захватом магнитными гранулами со стрептавидиновым покрытием (Dynal, Oslo, Norway; см. предыдущий абзац). После селекции приблизительно 25% клонов оказались положительными в растворимом ELISA (см. протокол эксперимента в пре-8 005685 дыдущей главе). Из кандидатов, положительных по результатам ELISA, авторы настоящего изобретения далее идентифицировали один (Н 10; табл. 1) с наиболее низкой величиной koff с помощью анализа BIAcore (Jonsson et al. (1991), BoiTechniques, 11, 620-627). Ген scFv(H10) был подвергнут ПЦР-амплификации с использованием праймеров LMBlbis и(SEQ ID NO: 7) для внесения случайных мутаций в положения 32 в CDR1 VL (для нумерации: ChothiaGAT GAG GAG CCT GGG AGC C-3') (SEQ ID NO: 9) для внесения случайной мутации в положения 50 вCDR2 VL. Оставшуюся часть гена scFv амплифицировали с использованием олигонуклеотидовDPKCDR2back (5'-GCA TCC AGC AGG GCC ACT GGC-3') (SEQ ID NO:10) и JforNot (94C 1 мин, 60 С 1 мин, 72 С 1 мин). Три полученные продукта собирали, расщепляли и клонировали в pDN332, как описано выше для мутагенеза тяжелой цепи. Полученную библиотеку инкубировали с биотинилированнымED-B в 3% BSA (бычий сывороточный альбумин) в течение 30 мин, с последующим захватом на микротитрационном планшете со стрептавидиновым покрытием (Boehringer Mannheim GmbH, Germany) в течение 10 мин. Фаги элюировали с использованием 20 мМ раствора DTT (1,4-дитио-DL-треитол, Fluka) и использовали для инфицирования клеток TG1 в стадии экспоненциального роста. Анализ связыванияL19. scFv-фрагменты анти-ED-B E1, G4, А 2, Н 10 и L19 антител избирательно окрашивают новообразованные кровеносные сосуды в срезах агрессивных опухолей (фиг. 3). Упомянутые выше фрагменты анти-ED-B антител затем получали путем инокулирования одной свежей колонии в 1 л среды 2xTY, как было описано ранее Pini et al. 1997), J. Immunol. Meth., 206, 171182) и аффинной очистки на колонке с сефарозой, активированной CNBr (Pharmacia, Uppsala, Sweden),которую связывали с 10 мг ED-B-содержащего рекомбинантного белка 7 В 89 (Саrnеmolla et al. (1996), Int.J. Cancer, 68, 397-405). После загрузки колонку промывали 50 мл уравновешивающего буфера (PBS, 1 мМ EDTA, 0,5 М NaCl). Фрагменты антител затем элюировали 100 мМ триэтиламином, немедленно нейтрализовали 1 М Hepes, pH 7, и диализировали против PBS. Определение аффинности посредством BIAcore выполняли с очищенными антителами, как описано (Neri et al. (1997), Nature Biotechnol., 15, 12711275 [фиг. 4]. Анализ сдвига полос выполняли, как описано (Neri et al. (1996), Nature Biotechnology, 14,385-390), с использованием рекомбинантного ED-B с флюоресцентной меткой на N-конце (Carnemolla etal. (1996), Int. J. Cancer, 68, 397-405, Neri et al. (1597), Nature Biotechnol., 15, 1271-1275) инфракрасным флюорофором Су 5 (Amersham) [фиг. 4]. Анализ BIAcore не всегда позволяет точно определить кинетические параметры реакций медленной диссоциации, возможно, из-за эффектов повторного связывание исходной нестабильности и длительного времени измерения, необходимого для того, чтобы убедиться,что фаза диссоциации соответствует единому экспоненциальному параметру. Авторы настоящего изобретения, таким образом, осуществляли измерение константной величины koff кинетической диссоциации с помощью конкурентных экспериментов (Neri et al. (1996), Trends in Biotechnol., 14, 465-470) [фиг. 4]. Вкратце, анти-ED-B антитела (30 нМ) инкубировали с биотинилированным ED-B (10 нМ) в течение 10 мин в присутствии М 2 анти-FLAG антитела (0,5 мкг/мл) и поликлонального антимышиного IgG(Sigma), которые предварительно метили комплексом рутения, как описано (Deaver, D. R. (1995), Nature,377, 758-760). К этому раствору, в параллельных реакциях, добавляли неиотинилированный ED-B (1 мкМ) в различное время, затем добавляли гранулы dynabead со стрептавидиновым покрытием, разбавленные буфером Origen Assay Buffer (20 мкл, 1 мг/мл) (Deaver, D. R. (1995), Nature, 377, 758-760), и полученные смеси анализировали с помощью анализатора ORIGEN (IGEN Inc., Gaitiersburg, MD USA). Этот инструмент выявляет электрохемилюминесцентный сигнал (ЭХЛ), который коррелирует с количеством scFv-фрагмента, все еще связанного с биотинилированным ED-B к концу конкурентной реакции. График ЭХЛ сигнала в зависимости от времени конкурентного связывания представляет из себя параметр, который может быть снабжен единой экспонентой с показательной константной величиной koff[фиг. 4; табл. 2]. Пример 3. Нацеливание на опухоли высокоаффинными scFv с радиоизотопной меткой, специфичными в отношении ED-B-домена фибронектина. Меченные радиоактивным иодом scFv(L19) или scFv(D1.3) (постороннее антитело, специфичное в отношении лизоцима куриного яйца) инъецировали внутривенно мышам с имплантированной под кожу мышиной тератокарциномой F9, быстро растущей агрессивной опухолью. Биораспределение антител было получено через различные интервалы времени (фиг. 4). scFv(L19) и scFv(D1.3) подвергали аффинной очистке на колонке с антигеном (Neri et al. (1997), Nature Biotechnol., 15, 1271-1273) и метили радиоактивным изотопом иодом-125 с помощью метода иодогена (Pierce, Rockford, IL, USA). Меченные радиоактивным изотопом фрагменты антитела сохраняли 80% своей иммунореактивности, по оценке нагрузки антитела, меченного радиоизотопной меткой, в колонку с антигеном, с последующим подсчетом радиоактивности протекающей через колонку и элюированной фракций. Бестимусным мышам (возраст 12 недель, самцы швейцарской бестимусной мыши) с имплантированной под кожу мышиной тератокарциномой F9 (Neri et al. (1997), Nature Biotechnol., 15, 1271-1273) инъецировали 3 мкг (3-4 мкКи)scFv в 100 мкл физиологического раствора. Размеры опухоли составляли 50-250 мг, поскольку более крупные опухоли имеют тенденцию некротизироваться в центре. Однако эксперименты по нацеливанию,выполненные на более крупных опухолях (300-600 мг), дали практически те же результаты. Для каждого отрезка времени использовали трех животных. Мышей умерщвляли гуманным способом, органы взвешивали и подсчитывали их радиоактивность. Результаты нацеливания представленных органов выражали в виде процента инъецированной дозы антитела на грамм ткани (%ID/r). scFv(L19) быстро выводится из крови через почки; в противоположность обычным антителам, он не накапливается в печени или других органах. Восемь процентов инъецированной дозы на грамм ткани локализуется в опухоли уже через три часа после инъекции; последующее снижение этой величины происходит вследствие того факта, что опухоль увеличивается в размерах вдвое через 24-48 ч. Соотношения опухоль:кровь через 3, 5 и 24 ч после инъекции составляли 1,9, 3,9 и 11,8, соответственно, для L19, но были всегда ниже 1,0 для антитела,служившего отрицательным контролем.scFv(L19) с радиоактивной меткой предпочтительным образом локализуется на опухолях уже через несколько часов после инъекции, что предполагает его пригодность для иммуносцинтиграфического обнаружения ангиогенеза у пациентов. Пример 4. Анти-ED-B антитела избирательно окрашивают новообразованные кровеносные сосуды глаза. Ангиогенез, образование новых кровеносных сосудов из ранее существовавших, является характерным процессом, лежащим в основе многих заболеваний, включая рак и большинство глазных болезней,которые приводят к потере зрения. Способность избирательно нацеливаться на новообразованные сосуды и окклюзировать их открывает новые диагностические и терапевтические возможности. Авторы настоящего изобретения проводили исследование, направленное на решение вопроса о том,является ли B-FN специфичным маркером ангиогенеза в глазных структурах и могут ли антитела, распознающие B-FN, избирательно нацеливаться на новообразованные сосуды глаза in vivo после системного введения. Для решения этого вопроса авторы настоящего изобретения стимулировали ангиогенез в роговице кролика, что позволяет производить прямые наблюдения новообразованных кровеносных сосудов,посредством хирургической имплантации гранул, содержавших сосудистый эндотелиальный фактор роста (VEFG) или сложный эфир форбола (фиг. 7). Гранулы из сукралфата (любезный дар компанииMerck, Darmstadt, Germany)/гидрона, содержавшие по 800 нг сосудистого эндотелиального фактора роста(Sigma) или 400 нг 32-миристат-13-ацетат форбола ("РМА"; Sigma), имплантировали в роговицу самок Новозеландского белого кролика, как описано [D'Amato, R.J., et al., Proc. Natl. Acad. Sci., USA, 91, 40824085 (1994)]. Ангиогенез индуцировали с помощью обоих факторов. Наблюдение за кроликами осуществляли ежедневно. По результатам иммуногистохимического анализа новообразованные кровеносные сосуды, индуцированные обоими веществами, были резко ED-B-положительны. Во всех дальнейших экспериментах использовали гранулы РМА. Иммуногистохимические исследования показали, что L19 сильно окрашивает новообразованные сосуды, индуцированные в роговице кролика (фиг. 8; 9 а), но не окрашивает ранее существовавшие кровеносные сосуды глаза (фиг. 9b, с), и другие ткани (данные не представлены). Иммуногистохимический анализ выполняли как описано [Carnemolla, В. et al., Int. J. Cancer, 58, 397-405 (1996)]. Пример 5. Фрагмент L19 антитела человека, связывающийся с ED-B с субнаномолярной аффинностью, нацеливается на ангиогенез глазных структур in vivo. Используя экспериментальную модель ангиогенеза на роговице кролика, описанную в предыдущем примере, и методику иммунофотодетекции [(Neri, D, et al. Nature Biotechnol., 15, 1271-1273 (1997)], авторы настоящего изобретения показали, что L19, химически соединенный с красным флюорофором Су 5, а не с фрагментом антитела (HyHEL-10)-Су 5, направленного против постороннего антигена (фиг. 10 а, b),избирательно нацеливается на ангиогенез глаза после внутривенной инъекции. Флюоресцентное окрашивание растущих сосудов глаза четко выявлялось с помощью L19 немедленно после инъекции, и сохранялось по меньшей мере в течение двух дней, аналогично предыдущим наблюдениям по ангиогенезу в опухолях. Последующий ех vivo иммунофлюоресцентный микроскопический анализ срезов роговицы подтвердил локализацию L19, но не HyHEL-10, вокруг сосудистых структур (фиг. 10 с, d). Демонстрация избирательного нацеливания на новообразованные кровеносные сосуды глаза с помощью антител, вместе с реактивностью анти-B-FN антител в различных видах, служат основанием для проведения клинических исследований в будущем. Получение иммунофлюоресцентного изображения может быть полезным для раннего выявления ангиогенеза глазных структур у пациентов группы риска, до того, как повреждения станут видными при флюороангиографии. Некоторые методологические детали Для анализа иммунофлюоресценции ех vivo и для некоторых окрашивании Н/Е роговицы фиксировали в 4% параформальдегиде в PBS перед заливкой. Эксперименты по флюоресцентной фотодетекции выполняли на кроликах, седатированных ацеропромазином в дозе 5 мг/кг. Для экспериментов по нацеливанию каждому кролику внутривенно инъецировали 3,5 мг scFv (L19)1-Cy50,662,8 мг scFv (HyHEL-10)1Cy50,83 (время инъекции = 15 мин). Сразу же после инъекции L19, но не HyHEL-10, наблюдали интенсивную флюоресценцию в новообразованных сосудах роговицы, которая сохранялась в течение несколь- 10005685 ких часов. В качестве добавочного теста на специфичность кроликам, которым в предыдущий день инъецировали scFv(HyHEL-10)-Су 5 и которые показывали отрицательные результаты при флюоресцентной фотодетекции, инъецировали на следующий день scFv(L19)-Су 5 и наблюдали интенсивное флюоресцентное окрашивание новообразованных сосудов роговицы. Для выявления флюоресценции глаз освещали вольфрамовой галогеновой лампой (модель SchottKL 1500; Zeiss, Jena, Germany), снабженной фильтром возбуждения Су 5 (Chroma, Brattleboro, VT, USA) и двумя световодами, концы которых помещали на расстоянии приблизительно 2 см от глаза. Флюоресценцию выявляли с помощью охлажденной С-5985 монохромной CCD-камеры (Hamamatsu, HamamatsuCity, Japan), оборудованной увеличивающей линзой Canon в С-образной оправе (V6 х 16; 16-100 мм; 1:1,9) и фильтром эмиссии Су 5 диаметром 50 мм (Chroma), помещенной на расстоянии 3-4 см от облученного глаза. Время обнаружения составляло 0,4 с. Эксперименты Су 5 флюороангиографии выполняли по той же экспериментальной схеме, но внутривенно инъецировали 0,25 мг Cy5-Tris (продукт реакции Cy5-NHS и трис[гидроксиметил]аминометана; время инъекции = 5 с). Время обнаружения составляло 0,2 с. Фрагменты антител имели формат scFv. Очистка scFv(L19) и scFv(HyHEL-10) и их мечение Nгидроксисукцинимидными (NHS) эфирами индоцианиновых красителей описаны в других источниках(Neri, D, et al. Nature Biotechnol., 15, 1271-1273 (1997); Fattorusso, R., et al. (1999), Structure, 7, 381-390]. Соотношение антитело:метка Су 5 для этих двух антител составляло 1,5:1 и 1,2:1, соответственно. Cy5NHS приобретали в компании Amersham Pharmacia Biotech (Zurich, Switzerland), овальбумин - в компании Sigma (Buchs, Switzerland). После мечения конъюгаты антител отделяли от невключенного флюорофора или фотосенсибилизатора на колонках PD-10 (Amersham Pharmacia Biotech), уравновешенных в 50 мМ фосфате, рН 7,4, 100 мМ NaCl (PBS). Иммунореактивность конъюгатов антител определяли с помощью аффинной хроматографии на колонках с антигеном (Neri, D, et al. Nature Biotechnol., 15 1271-1273 (1997) и во всех случаях она составляла 78%. Иммуноконъюгаты анализировали с помощью электрофореза в додецилсульфат натрия - полиакриламидном геле и они мигрировали в виде полосы MW = 30 000 дальтон (чистота 3 90%). Пример 6. Фрагмент L19 антитела человека, химически конъюгированный с фотосенсибилизатором хлорина Sn (IV) е 6, избирательно нацеливается на ангиогенез глазных структур и опосредует его окклюзию после облучения красным светом. Для того, чтобы установить, можно ли достичь избирательного устранения сосудов посредством нацеливания с помощью антител, авторы настоящего изобретения инъецировали кроликам фрагмент антитела L19 или посторонний белок, который не локализуется в новообразованных кровеносных сосудах(овальбумин), соединенный с фотосенсибилизатором хлорина олова (IV) е 6 (далее упоминается как "PS"). Глаза животных, получивших инъекцию, облучали красным светом (световая доза = 78 дж/см 2). Репрезентативные результаты изображены на фиг. 11. Разительную макроскопическую разницу наблюдали через 16 ч после облучения у кроликов, которым вводили L19-PS (фиг. 11 а, b) в отношении коагуляции новообразованных сосудов роговицы, но не сосудов конъюнктивы или других глазных структур. Флюороангиография с индоцианиновым флюорофором Су 5 (фиг. 11 с) подтвердила окклюзию сосудов в виде характерной гипофлюоресцентной зоны. Напротив, гипофлюоресцентные зоны наблюдались в просачиваемых новообразованных сосудах необлученных глаз (фиг. 11d, h). В облученных сосудах кроликов,которым вводили овальбумин-PS (фиг. 11 е-g), не было выявлено макроскопических изменений, как по результатам офтальмоскопии, так и при Су 5 флюороангиографии. Влияние облучения при действии нацеленного конъюгата L19-PS на ранние стадии ангиогенеза роговицы показано на фиг. 11i-1. Избирательно коагулированные кровеносные сосуды были макроскопически видимыми у живых животных(фиг. 11i, j) и даже еще более очевидными у животных сразу после умерщвления (фиг. 11k, 1). Фотодинамическое повреждение далее изучали с помощью микроскопической техники. После облучения окклюзию сосудов можно выявить с помощью стандартного окрашивания гематоксилинэозином (Н/Е) как в нефиксированных, так и в фиксированных срезах роговицы у животных, которым вводили L19-PS (фиг. 11b, f, j), но не у животных, которым вводили овальбумин-PS (фиг. 11 а, е, i). Апоптоз в той части роговицы, на которую были нацелены конъюгаты с фотосенсибилизатором, был отчетливо виден при флюоресцентном исследовании TUNEL (фиг. 11 с, g), но с трудом выявлялся в отрицательных контролях с чернилами (фиг. 11d, h). При более сильном увеличении был виден апоптоз эндотелиальных клеток в сосудистых структурах (фиг. 11g). Никакого повреждения кровеносных сосудов радужной оболочки, склеры и конъюнктивы у леченных животных не наблюдалось как при исследованииTUNEL (не показано), так и при окрашивании Н/Е (фиг. 11k, l). Избирательное фотодинамическое уничтожение новообразованных сосудов обещает стать благоприятным способом лечения глазных болезней и других патологических состояний, связанных с ангиогенезом, которые доступны облучению с помощью рассеивателей света или световолоконной оптической техники. Результаты этого исследования ясно показывают, что новообразованные сосуды глаза можно избирательно окклюзировать без повреждения ранее существовавших кровеносных сосудов и нормальных тканей.- 11005685 Некоторые методологические детали Хлорин олова (IV) е 6 был выбран из ряда фотосенсибилизаторов с учетом их мощности, растворимости и специфичности, после соединения с кроличьим антимышиным поликлональным антителом(Sigma). Эти иммуноконъюгаты подвергали скринингу путем направленного фотолиза эритроцитов, покрытых моноклональным антителом, специфичным в отношении CD47 человека (313441 А; Pharmingen, San Diego CA, USA). Хлорин олова (IV) е 6 был получен как описано [Lu, Х.М. et al., J. Immunol.Methods 156, 85-99 (1992)]. Для связывания с белками хлорин олова (IV) е 6 перемешивали в течение 30 мин при комнатной температуре в диметилформамиде с десятикратным молярным избытком EDC (гидрохлорида N'-3-диметиламинопропил-N-этилкарбодимида, Sigma) и NHS (N-гидроксисукцинимида,Sigma). Полученную активированную смесь затем добавляли к восьмикратному объему раствора белка (1 мг/мл) и инкубировали при комнатной температуре в течение 1 ч. После мечения конъюгаты антител отделяли от невключенного флюорофора или фотосенсибилизатора на колонках PD-10 (Аmersham Pharmacia Biotech), уравновешенных в 50 мМ фосфате, рН 7,4, 100 мМ NaCl (PBS). Иммунореактивность конъюгатов антител определяли как описано в предыдущем примере. Для экспериментов по фотоуничтожению кроликам внутривенно инъецировали 12 мг scFv (L19)хлорина олова (IV) е 60,8 или 38 мг овальбумина-хлорина олова (IV) е 60,36 и содержали их в темноте в течение всего эксперимента. Через восемь часов после инъекции кроликам проводили анестезию кетамином 35 кг/кг/ксилазином (5 мг/кг)/ацеропромазином (1 мг/кг) и один из двух глаз облучали в течение 13 мин вольфрамовой галогеновой лампой Schott KL 1500, снабженной фильтром Су 5 (Chroma) и двумя световодами, концы которых помещали на расстоянии 1 см от глаза. Освещаемая область составляла приблизительно 1 см 2, при плотности мощности облучения 100 мВатт/см 2, по измерению фотодетектором SL818 (Newport Corp., Irvine, CA, USA). После облучения признаков дискомфорта у животных не наблюдалось. В качестве предупредительной меры после облучения кроликам вводили анальгетики (0,03 мг/кг бупренорфина). Для наблюдения за фотоуничтожением глаза исследовали с помощью офтальмоскопа и фотографировали с помощью камеры для глазного дна KOWA SL-14 (GMP SА, Rennens,Lausanne, Switzerland). По пять кроликов получали один из конъюгатов с хлорином олова (IV) е 6, затем животным облучали только один глаз, а другой глаз служил внутренним отрицательным контролем. В качестве дополнительного контроля двух кроликов только облучали, но не вводили им конъюгатов с фотосенсибилизатором. Немедленно после умерщвления кроликов посредством передозировки анестетика производили энуклеацию глаз, удаляли роговицы, затем заливали их в Tissue Tek (Sakura Finetechnical, Tokyo, Japan) и замораживали. Для анализа иммунофлюоресценции ex vivo и для некоторых видов окрашивания Н/Е роговицы перед заливкой фиксировали в 4% параформальдегиде в PBS. Замороженные в криостате срезы толщиной 5 мкм использовали для дальнейшего микроскопического анализа. Анализы флюоресценцииTUNEL выполняли в соответствии с инструкциями производителя (Roche Diagnostic, Rotkreuz, Switzerland). Таблица 1. Последовательности отобранных клонов анти-ED-B антител Соответствующие аминокислотные положения клонов антител, (: нумерация согласно Tomlinson etal. (1995), EMBO J., 14, 4628-4638), выделенных из сконструированных синтетических библиотек. Одинарные аминокислотные коды используются согласно стандартной номенклатуре IUPAC.) Kd = koff/kon. Для связывающихся с высокой аффинностью Н 10 и L19 величины koff по результатам экспериментов с использованием BIAcore недостаточно надежны из-за эффектов отрицательно заряженного карбоксилированного твердого декстранового матрикса; величины Kd, таким образом, рассчитаны по измерениям koff, полученным в конкурентных экспериментах (протоколы экспериментов).koff, кинетическая константа диссоциации; kon, кинетическая константа ассоциации; Kd, константа диссоциации. В = измерено с использованием BIAcore; С = измерено путем конкуренции с электрохемилюминесцентным обнаружением. Правильность величин составляет +/- 50%, на основе точности определений концентрации. Перечень последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенное антитело, представляющее собой антитело L19 или его функционально эквивалентную вариантную форму, которое распознает характерный эпитоп ED-(В)+ домена фибронектина со специфичной аффинностью и обладает константой диссоциации (Kd) в отношении указанного домена фибронектина менее 1 х 10-9 М, или фрагмент указанного антитела. 2. Антитело или его фрагмент по п.1, отличающееся тем, что Kd составляет 5,4 х 10-11 М. 3. Антитело или его фрагмент по п.1, отличающееся тем, что содержит вариабельный домен фрагмента scFv антитела L19, имеющий следующую аминокислотную последовательность: 4. Антитело или его фрагмент по п.3, отличающееся тем, что содержит домен VH, имеющий последовательность SEQ ID NO: 19. 5. Антитело или его фрагмент по п.3 или 4, отличающееся тем, что содержит домен VL, имеющий последовательность SEQ ID NO: 21. 6. Фрагмент по любому из пп.1-5, отличающийся тем, что представляет собой scFv. 7. Антитело или его фрагмент по любому из пп.1-6, меченные радиоактивным изотопом. 8. Антитело или его фрагмент по любому из пп.1-6, меченные радиоактивным йодом. 9. Применение антитела или его фрагмента по любому из пп.1-8 в качестве агента нацеливания на маркеры ангиогенеза или пролиферации сосудов. 10. Применение по п.9 для иммуносцинтиграфического выявления ангиогенеза.- 21005685 11. Применение по п.10 для выявления ангиогенеза, связанного с диабетической ретинопатией, возрастной дегенерацией желтого пятна сетчатки или опухолями. 12. Диагностический набор, содержащий антитело или его фрагмент по любому из пп.1-8 и один или несколько реагентов, необходимых для выявления ангиогенеза. 13. Применение антитела или его фрагмента по любому из пп.1-8 для производства диагностического средства для диагностики опухолей или заболевания, характеризующегося пролиферацией сосудов. 14. Применение антитела или его фрагмента по любому из пп.1-8 для производства лекарственного средства для лечения опухолей или заболевания, характеризующегося пролиферацией сосудов. 15. Конъюгат, содержащий антитело или его фрагмент по любому из пп.1-8 и соединение, способное индуцировать свертывание крови и окклюзию кровеносных сосудов. 16. Конъюгат по п.15, отличающийся тем, что соединение, способное индуцировать свертывание крови и окклюзию кровеносных сосудов, представляет собой фотоактивное соединение. 17. Конъюгат по п.16, отличающийся тем, что фотоактивное соединение представляет собой фотосенсибилизатор. 18. Конъюгат по п.17, отличающийся тем, что фотосенсибилизатор поглощает свет с длиной волны свыше 600 нм. 19. Конъюгат по п.18, отличающийся тем, что фотосенсибилизатор представляет собой производное хлорина е 6 олова (IV). 20. Применение конъюгата по любому из пп.15-19 для получения инъецируемой композиции для лечения патологического состояния, связанного с ангиогенезом. 21. Применение по п.20, отличающееся тем, что патологическое состояние, связанное с ангиогенезом, вызвано или связано с ангиогенезом глаза.
МПК / Метки
МПК: C12N 15/13, A61P 35/00, A61K 47/48, C07K 16/18
Метки: антитело, применения, способы, доменом, взаимодействующее, фибронектина
Код ссылки
<a href="https://eas.patents.su/30-5685-antitelo-vzaimodejjstvuyushhee-s-domenom-ed-b-fibronektina-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антитело, взаимодействующее с доменом ed-b (+) фибронектина, и способы его применения</a>
Предыдущий патент: Производные 1-аминоалкилциклогексана в качестве антагонистов рецептора nmda
Следующий патент: Производные пирролидина в качестве ингибиторов фосфодиэстеразы, специфичной к циклическому амф
Случайный патент: Пиразолилзамещенные производные угольной кислоты в качестве модуляторов рецептора простациклина (pgi2), применимые для лечения связанных с ним нарушений