Модифицированные пептиды как терапевтические агенты
Номер патента: 5404
Опубликовано: 24.02.2005
Авторы: Бун Томас Чарлз, Лиу Чуан-Фа, Фейдже Улрих, Читхэм Дженет
Формула / Реферат
1. Слитой рекомбинантный белок, применимый в качестве терапевтического агента, имеющий формулу
(X1)a-F1-(X2)b
и его мультимеры, где
F1 обозначает Fc-домен;
X1 и X2, каждый независимо, выбран из -(L1)c-P1, -(L1)c-P1-(L2)d-P2, -(L1)c-P1-(L2)d-P2-(L3)e-P3 и -(L1)c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4;
P1, P2, P3 и P4 обозначают, независимо каждая, последовательности рандомизированных пептидов;
L1, L2, L3 и L4, каждый независимо, обозначают линкеры и
a, b, c, d, e и f, каждый независимо, обозначает 0 или 1 при условии, что по меньшей мере один из a и b обозначает 1 и пептид относится к молекулам из от 2 до 40 аминокислот и ни X1, ни X2 не представляют собой природный белок.
2. Белок по п.1 формулы X1-F1 или F1-X2.
3. Белок по п.1 формулы F1-(L1)c-P1.
4. Белок по п.1 формулы F1-(L1)c-P1-(L2)d-P2.
5. Белок по п.1, у которого F1 обозначает Fc-домен IgG.
6. Белок по п.1, у которого F1 обозначает Fc-домен IgG1.
7. Белок по п.1, у которого F1 содержит последовательность SEQ ID NO:2.
8. Белок по п.1, у которого X1 и X2 содержат последовательность пептида-антагониста IL-1.
9. Белок по п.8, у которого последовательность пептида-антагониста IL-1 выбирают из SEQ ID NOS: 212, 907, 908, 909, 910, 917 и 979.
10. Белок по п.8, у которого последовательность пептида-антагониста IL-1 выбирают из SEQ ID NOS: 213-271, 671-906, 911-916 и 918-1023.
11. Белок по п.8, у которого F1 содержит последовательность SEQ ID NO: 2.
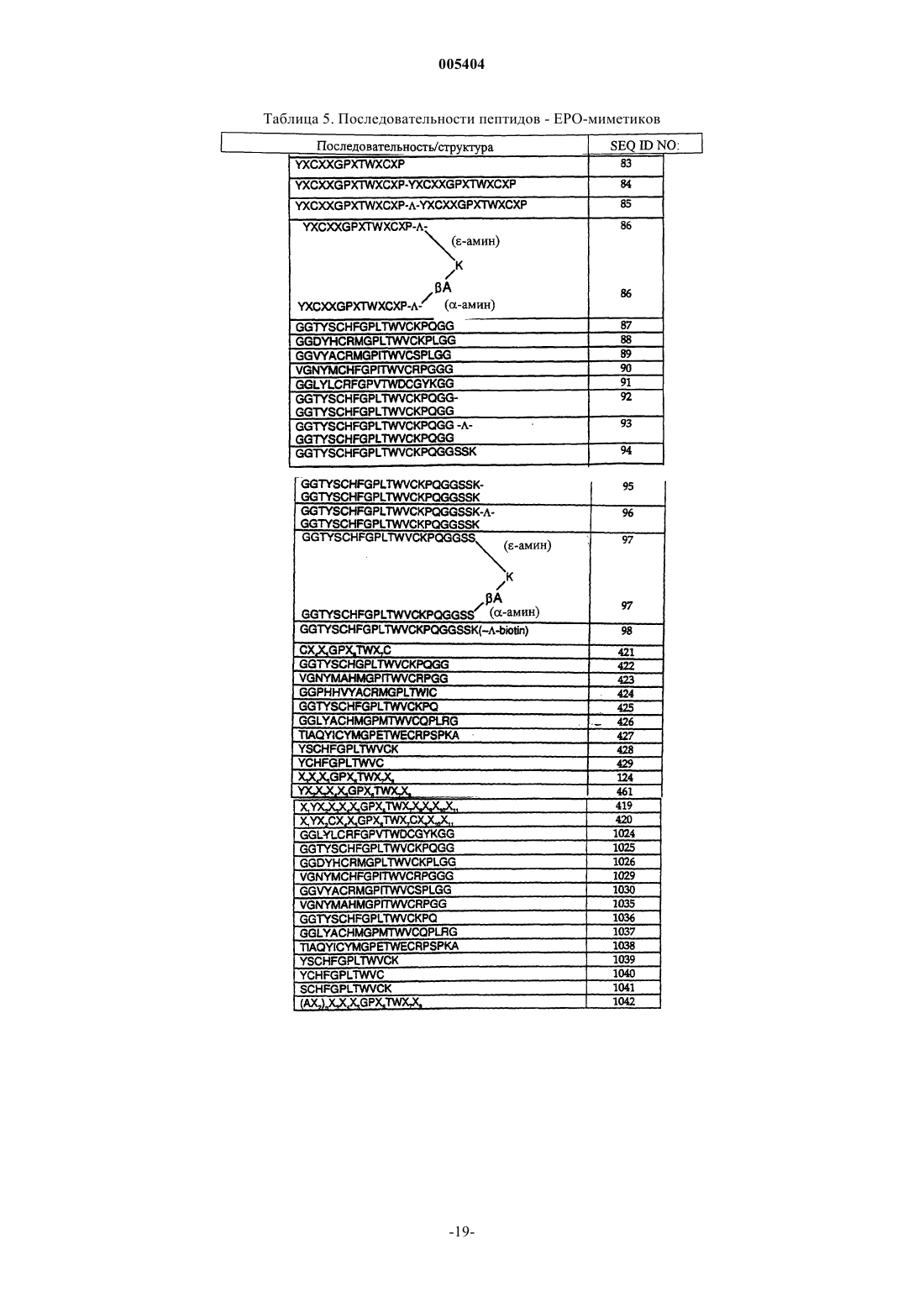
12. Белок по п.1, у которого X1 и X2 содержат последовательность EPO-миметического пептида (пептида-EPO-миметика).
13. Белок по п.12, у которого последовательность пептида-EPO-миметика выбирают из табл. 5.
14. Белок по п.12, у которого F1 содержит последовательность SEQ ID NO:2.
15. Белок по п.12, у которого последовательность пептида-EPO-миметика представляет собой SEQ ID NOS: 83, 84, 85, 124, 419, 420, 421 и 461.
16. Белок по п.12, у которого последовательность пептида-EPO-миметика представляет собой SEQ ID NOS: 339 и 340.
17. Белок по п.12, у которого последовательность пептида-EPO-миметика представляет собой SEQ ID NOS: 20 и 22.
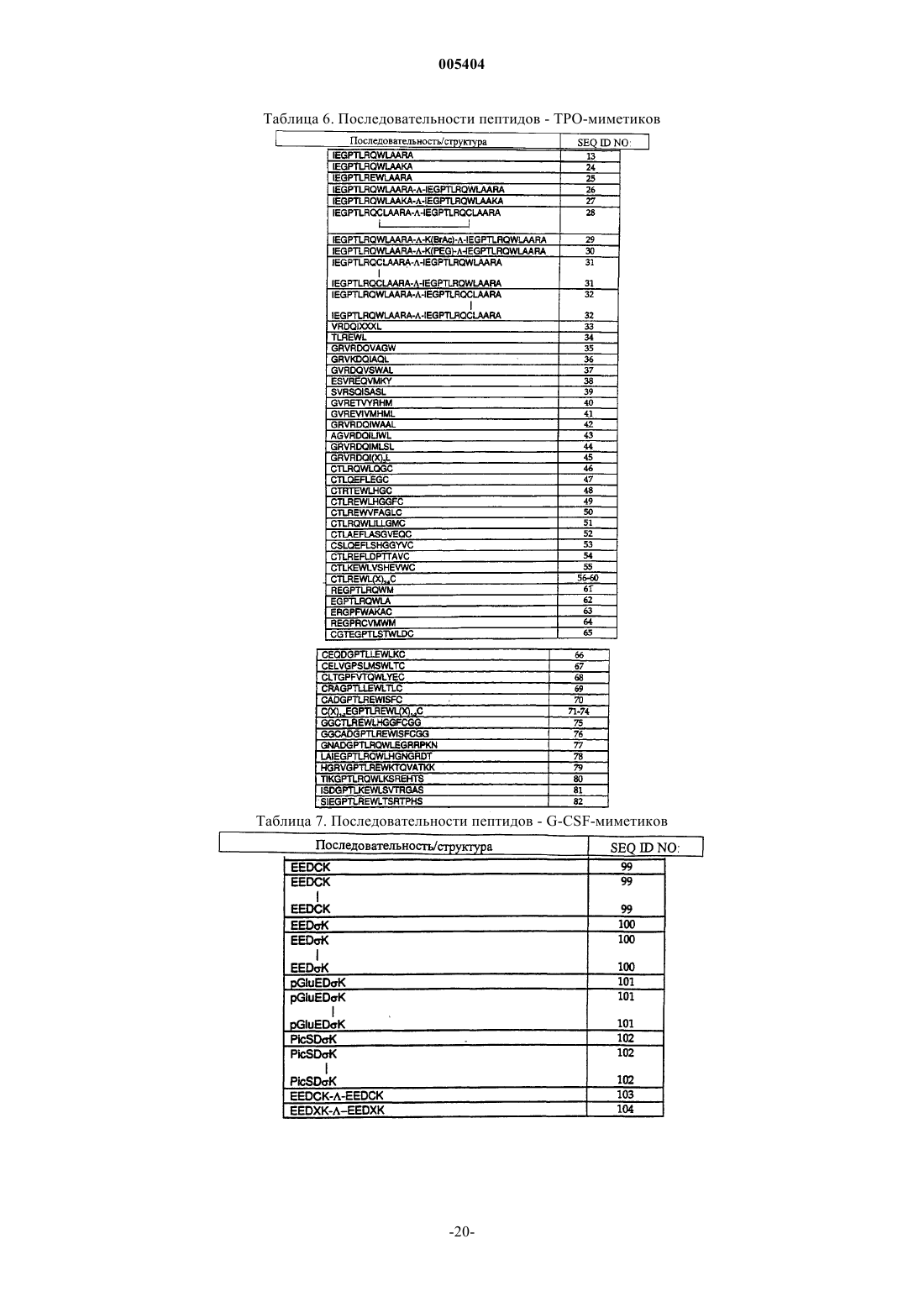
18. Белок по п.3, у которого P1 обозначает последовательность пептида-TPO-миметика.
19. Белок по п.18, у которого P1 обозначает последовательность пептида-TPO-миметика из табл. 6.
20. Белок по п.18, у которого F1 содержит последовательность SEQ ID NO:2.
21. Белок по п.18, содержащий последовательность, выбираемую из SEQ ID NOS: 6 и 12.
22. ДНК, кодирующая соединение по любому из пп.1-21.
23. Вектор экспрессии, включающий ДНК по п.22.
24. Клетка-хозяин, включающая вектор экспрессии по п.23.
25. Клетка по п. 24, представляющая собой клетку E.coli.
26. Способ получения фармакологически активного соединения, который заключается в
(а) выборе по меньшей мере одного рандомизированного пептида, который модулирует активность белка, представляющего интерес; и
(б) получении фармакологического агента, содержащего по меньшей мере один Fc-домен, ковалентно связанный с пептидом или пептидами, выбранными на стадии а), причем пептид относится к молекулам из от 2 до 40 аминокислот.
27. Способ по п.26, отличающийся тем, что пептид выбирают способом, включающим скрининг фаговой библиотеки визуализации, библиотеки E. coli-визуализации, рибосомной библиотеки или химической пептидной библиотеки.
28. Способ по п.26, отличающийся тем, что стадию б) осуществляют путем
(а) получения генной конструкции, содержащей нуклеотидную последовательность, кодирующую пептид, выбранный на стадии а), примыкающий либо к N-концу, либо к C-концу нуклеотидной последовательности, кодирующей Fc-домен; и
(б) экспрессирования генной конструкции.
29. Способ по п.28, отличающийся тем, что генная конструкция экспрессирует в клетке E.coli.
30. Способ по п.26, отличающийся тем, что белок, представляющий интерес, является рецептором клеточной поверхности.
31. Способ по п.26, отличающийся тем, что белок, представляющий интерес, имеет линейный эпитоп.
32. Способ по п.26, отличающийся тем, что белок, представляющий интерес, является рецептором для цитокинов.
33. Способ по п.26, отличающийся тем, что пептид является пептидом-EPO-миметиком.
34. Способ по п.26, отличающийся тем, что пептид является пептидом-TPO-миметиком (пептидом, имитирующим TPO).
35. Способ по п.26, отличающийся тем, что пептид является пептидом-IL-1-антагонистом.
36. Способ по п.26, отличающийся тем, что пептид является MMP-ингибирующим пептидом или пептидом-VEGF-антагонистом.
37. Способ по п.26, отличающийся тем, что пептид является пептидом-TNF-антагонистом.
38. Способ по п.26, отличающийся тем, что пептид является пептидом-CTLA4-миметиком (пептидом, имитирующим CTLA4).
39. Способ по п.26, отличающийся тем, что пептид выбирают из табл. 4-20.
40. Способ по п.26, отличающийся тем, что соединение является дериватизированным.
41. Способ по п.40, отличающийся тем, что дериватизированное соединение содержит циклический фрагмент, сайт перекрестного сшивания, непептидную связь, N-концевую замену, С-концевую замену или модифицированный аминокислотный фрагмент.
42. Способ по п.26, отличающийся тем, что Fc-домен является Fc-доменом IgG.
43. Способ по п.26, отличающийся тем, что Fc-домен является Fc-домен IgG1.
44. Способ по п.26, отличающийся тем, что Fc-домен содержит последовательность SEQ ID NO:2.
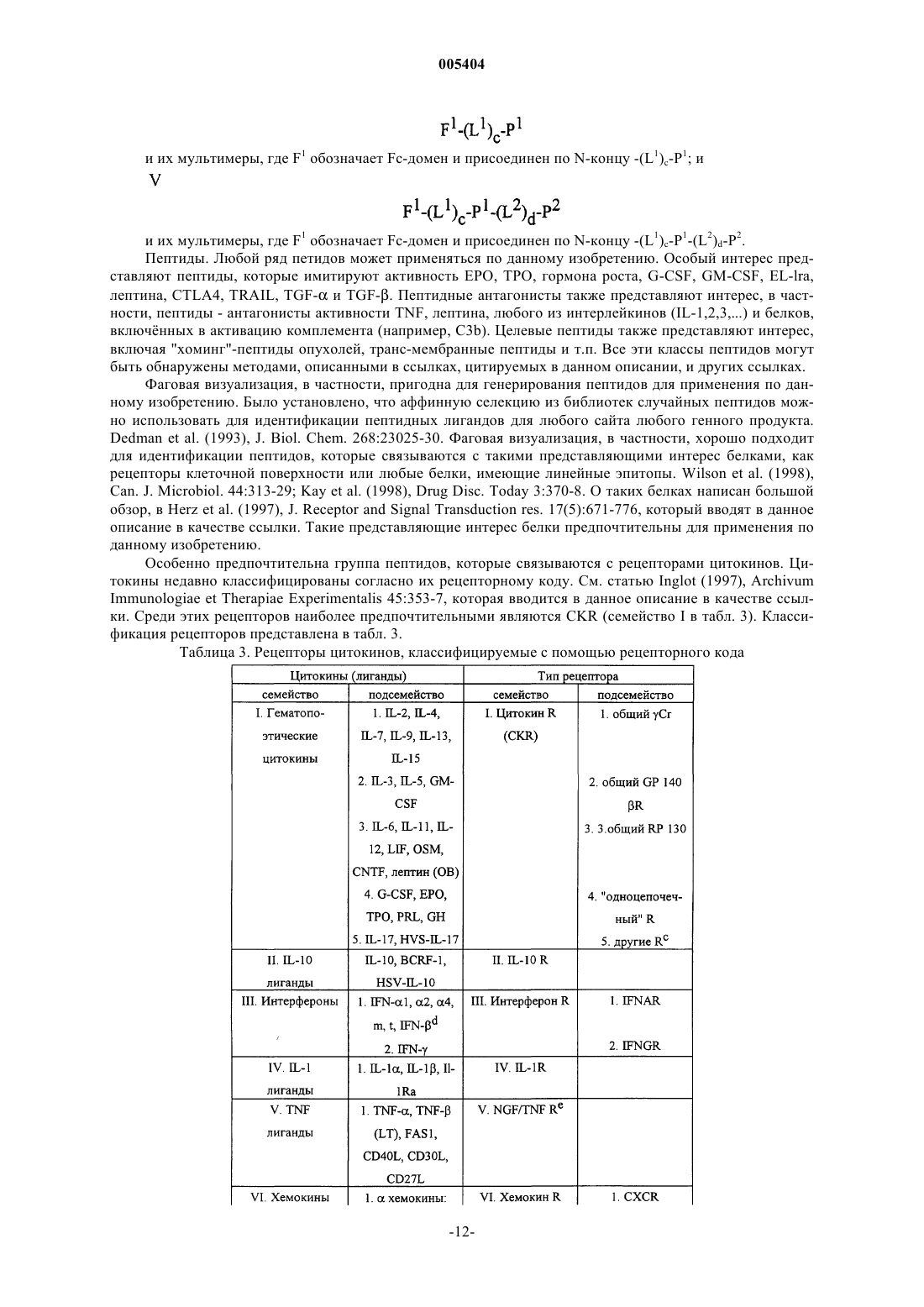
45. Способ по п.26, отличающийся тем, что получаемое соединение является соединением формулы
(X1)a-F1-(X2)b
и его мультимерами, где
F1 обозначает Fc-домен;
X1 и X2, каждый независимо, выбран из -(L1)c-P1, -(L1)c-P1-(L2)d-P2, -(L1)c-P1-(L2)d-P2-(L3)e-P3 и -(L1)c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4;
P1, P2, P3 и P4 обозначают, независимо каждая, последовательности рандомизированных пептидов;
L1, L2, L3 и L4, каждый независимо, обозначают линкеры и
a, b, c, d, e и f, каждый независимо, обозначает 0 или 1 при условии, что по меньшей мере один из a и b обозначает 1 и пептид относится к молекулам из от 2 до 40 аминокислот и ни X1, ни X2 не представляют собой природный белок.
46. Способ по п.45, отличающийся тем, что получаемое соединение является соединением формулы X1-F1 или F1-X2.
47. Способ по п.46, отличающийся тем, что получаемое соединение является соединением формулы F1-(L1)c-P1 или F1-(L1)c-P1-(L2)d-P2.
48. Способ по п.46, отличающийся тем, что F1 обозначает Fc-домен IgG.
49. Способ по п.46, отличающийся тем, что F1 обозначает Fc-домен IgG1.
50. Способ по п.46, отличающийся тем, что F1 содержит последовательность SEQ ID NO:2.
Текст
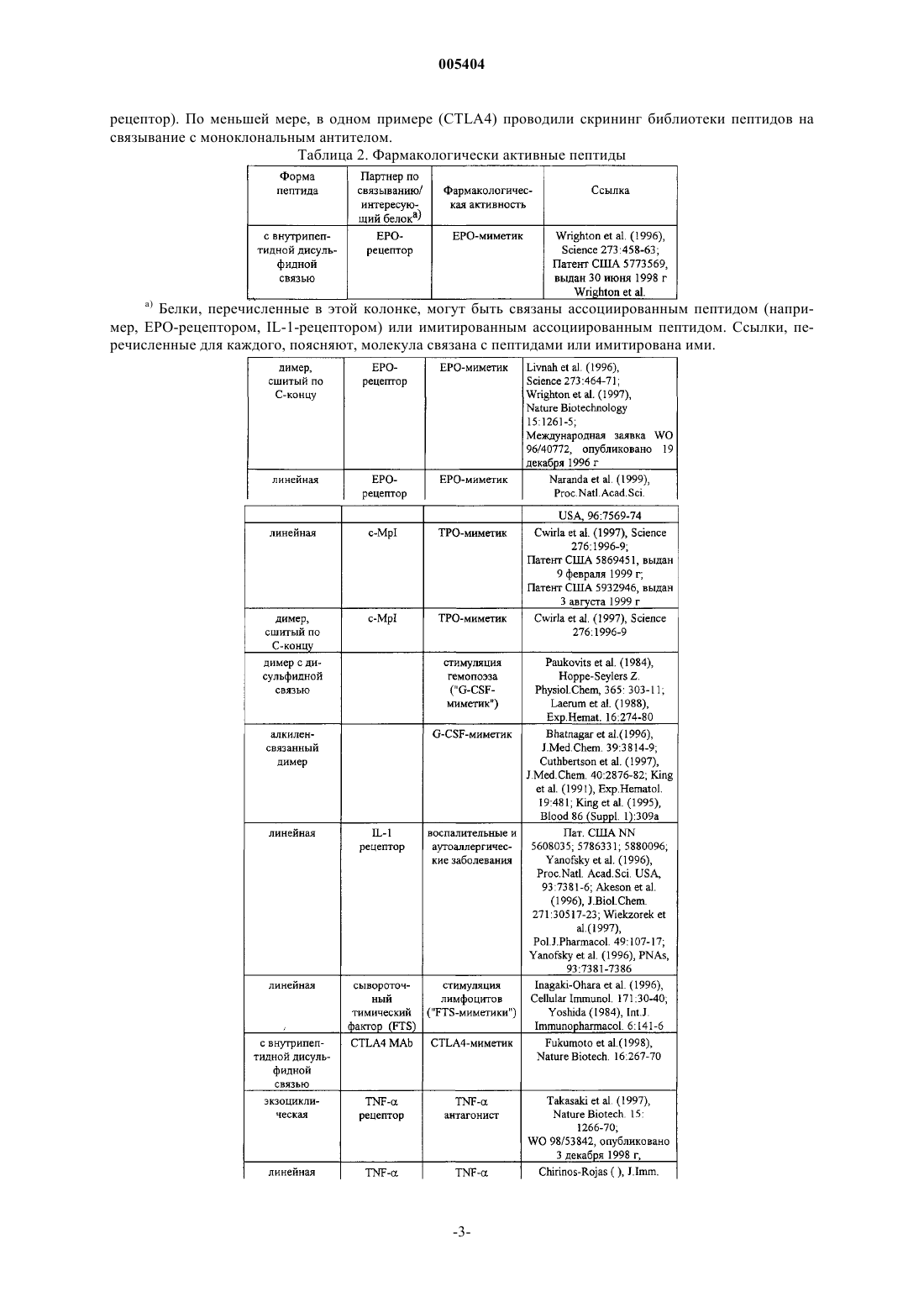
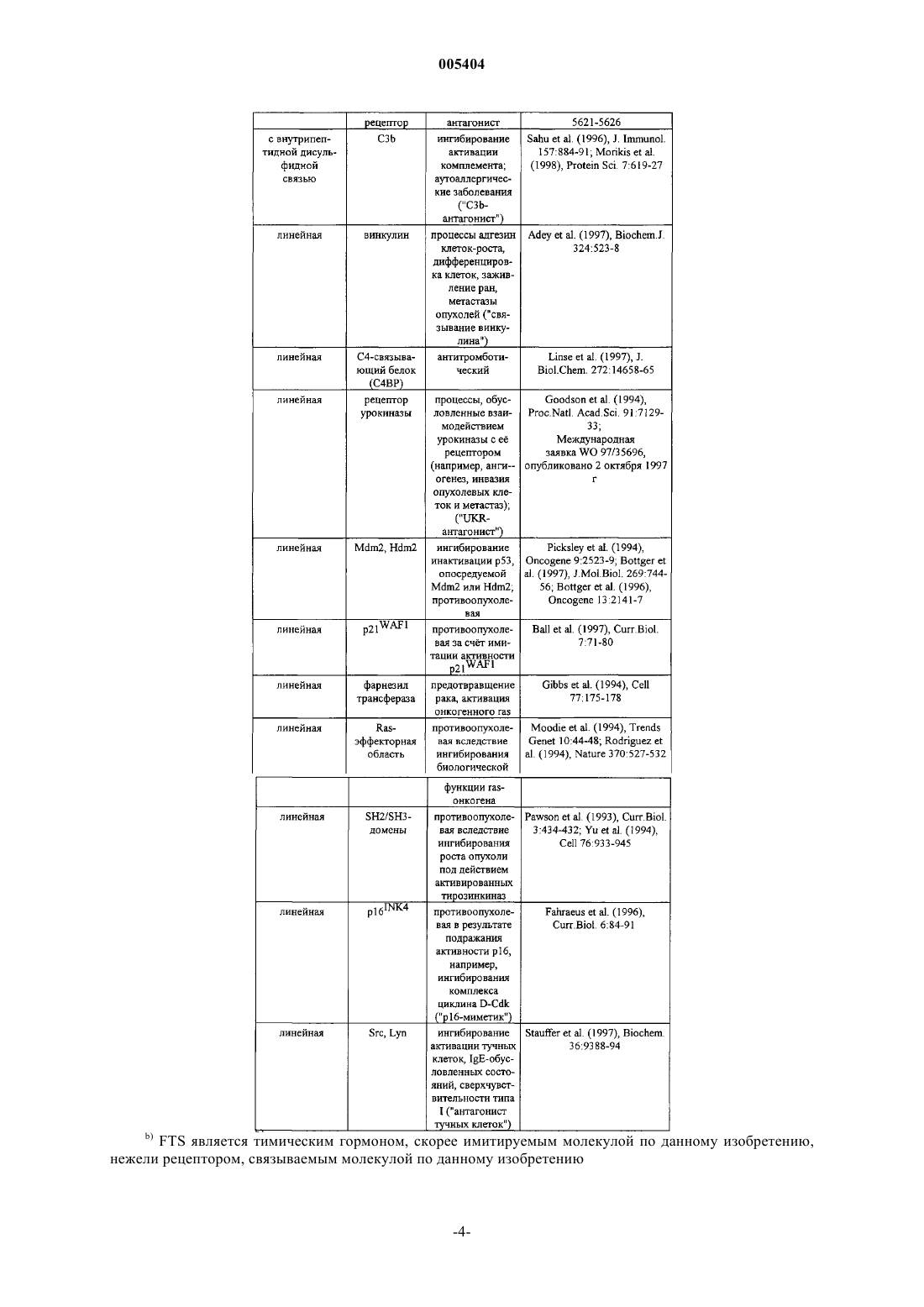
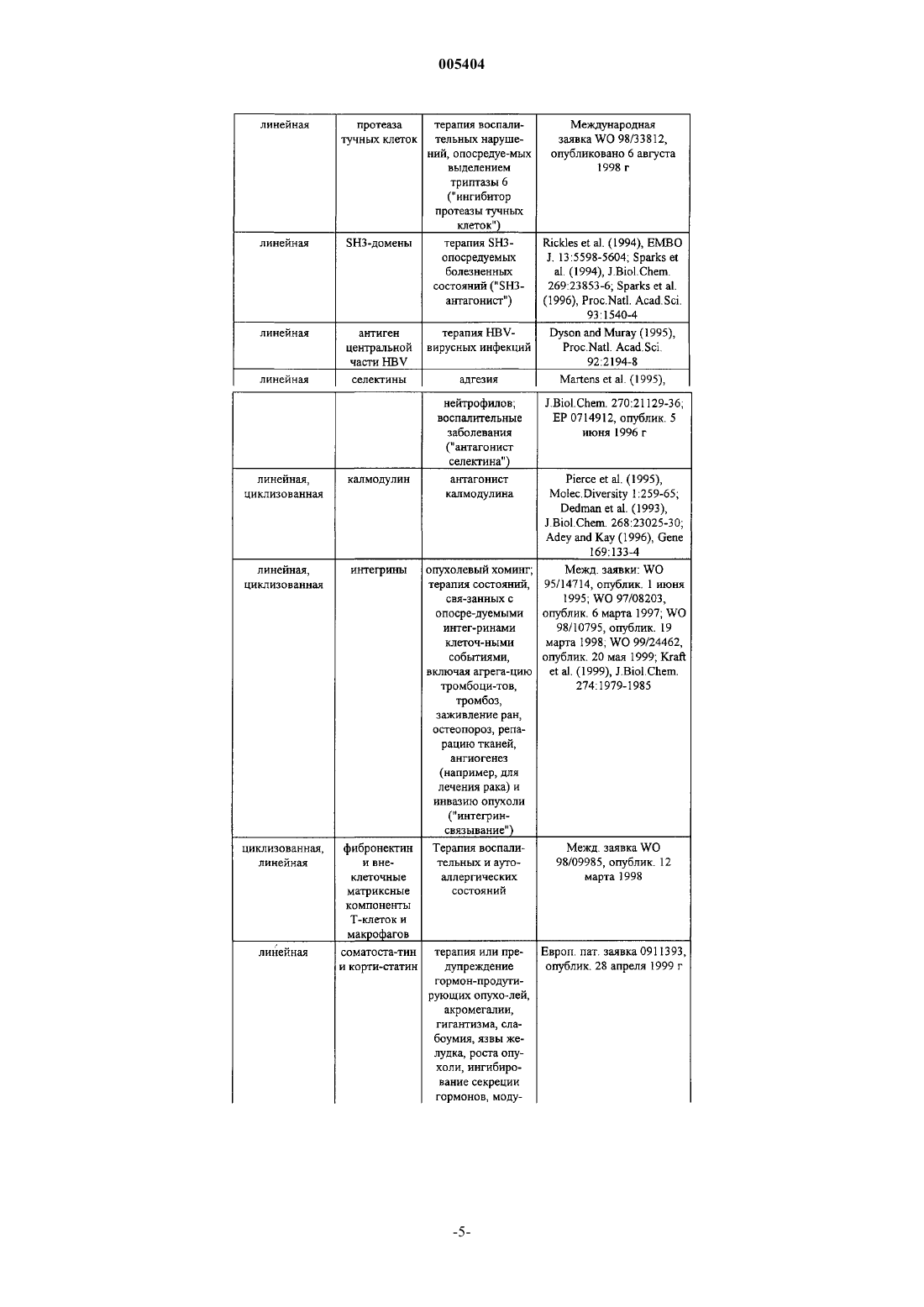
005404 Предпосылки создания изобретения Рекомбинантные белки представляют собой новый класс терапевтических агентов. Терапия с помощью таких рекомбинантных веществ вызвала прогресс в области рецептур и химической модификации белков. Такие модификации могут защитить терапевтические белки, во-первых, блокируя воздействие на них протеолитических ферментов. Белковые модификации могут также повышать устойчивость,время циркуляции и биологическую активность терапевтических белков. Обзорная статья, описывающая модификацию белков и слитые белки, - Francis (1992) Focus on Growth Factors 3:4-10 (Mediscript,London), - вводится в данное описание в качестве ссылки. Одна полезная модификация - это комбинация с "Fc" доменом антитела. Антитела содержат две функционально независимых части, вариабельную область (домен), известную как "Fab", которая связывает антиген, и константную область (домен), известную как "Fc", которая связывается с такими эффекторными функциями, как активация комплемента и атака фагоцитами. Fc имеет продолжительный полупериод существования в кровяном русле, тогда как Fab является короткоживущим. Capon et al. (1989),Nature 337:521-31. В совместной конструкции с терапевтическим белком Fc-домен может гарантировать более продолжительный полупериод существования или вводить такие функции, как Fc-рецепторное связывание, протеинА-связывание, фиксацию комплемента и, возможно, даже переход через плаценту. Совершенно отличный способ создания терапевтических агентов - это скрининг библиотеки пептидов. Взаимодействие белкового лиганда с его рецептором часто происходит на сравнительно большом интерфейсе. Однако, как продемонстрировано для человеческого фактора роста и его рецептора, только немногие ключевые остатки на интерфейсе вносят вклад в большую часть связывающей энергии Clack-1 005404son et al. (1995), Science 267:383-6. Объем белкового лиганда просто выявляют связывающие эпитопы при правильной топологии или выполняет функции, не относящиеся к связыванию. То есть молекулы только с "пептидной" протяженностью (2-40 аминокислот) могут связываться с рецепторным белком данного большого белкового лиганда. Такие пептиды могут имитировать биоактивность большого белкового лиганда ("пептидные агонисты") или, за счт конкурентного связывания, ингибировать биоактивность большого белкового лиганда ("пептидные антагонисты"). Оказалось, что фаговые библиотеки визуализации (выявления) пептидов являются мощным методом идентификации таких пептидных агонистов и антагонистов. См., например, Scott et al. (1990), Science 249:386; Devlin et al. (1990), Science 249:404; патент США 5223409, выдан 29 июня 1993 г; патент США 5733731, выдан 31 марта 1998 г; патент США 5498530, выдан 12 марта 1996 г; патент США 5432018, выдан 11 июля 1995 г; патент США 5338665, выдан 16 августа 1994 г; патент США 5922545,выдан 13 июля 1999 г; международная заявка 96/40987, опубликована 19 декабря 1996 г; и международная заявка 98/15833, опубликована 16 апреля 1998 г (вводятся в данное описание в качестве ссылки). В таких библиотеках случайные пептидные последовательности визуализируются (выявляются) с помощью слияния с оболочечными белками нитевидного фага. Обычно выявляемые пептиды аффинно элюируют против иммобилизованного антителами внеклеточного домена рецептора. Удержанные фаги можно обогатить за счт последовательных циклов аффинной очистки и рекультивирования. Пептиды, связывающие лучше всего, могут быть секвенированы с целью определения ключевых остатков в одном или более структурно родственных семейств пептидов. См., например, Cwirla et al. (1997), Science 276:1996-9,где были идентифицированы два различных семейства. Пептидные последовательности могут также подсказать, какие остатки можно без риска заменить на аланин сканированием или мутагенезом на уровне ДНК. Можно создать и подвергнуть скринингу библиотеки мутагенеза с целью дополнительной оптимизации последовательности лучшего связывающего агента. Lowman (1997), Ann. Rev. Biophys. Biomol. Struct. 26:401-24. Структурный анализ взаимодействия белок-белок можно также использовать для выявления пептидов, которые имитируют связывающую активность белковых лигандов. При таком анализе кристаллическая структура может показать идентичность и относительную ориентацию важных остатков большого белкового лиганда, из которых может быть построен пептид. См., например, Takasaki et al. (1997), NatureBiotech. 15:1266-70. Эти аналитические методы можно также использовать для исследования взаимодействия между рецепторным белком и пептидами, выбранными путем фаговой визуализации, которая может подсказать дальнейшую модификацию пептидов с целью повышения сродства к связыванию. Другие методы конкурируют с фаговой визуализацией в исследовании пептидов. Библиотеку пептидов можно слить с карбоксильным концом lac-репрессора и экспрессировать в Е.coli. Другой метод на основе Е.coli делает возможной визуализацию на внешней клеточной мембране за счт слияния с пептидогликан-ассоциированным липопротеином (PAL). В дальнейшем эти и родственные методы объединены под общим названием "Е.coli-дисплей". В другом методе трансляцию произвольной РНК останавливают перед выделением рибосомы, получая библиотеку полипептидов с вс ещ присоединенной ассоциированной с ними РНК. В дальнейшем эти и родственные методы в целом называются "рибосомная визуализация"; см., например, Roberts and Szostak (1997), Proc. Natl. Acad. Sci. USA, 94:12297-303. В дальнейшем этот и родственные методы в целом называются "РНК-пептидный скрининг". Химическим путем созданы пептидные библиотеки, в которых пептиды иммобилизованы на стабильных, небиологических материалах, таких как полиэтиленовые стержни или смолы, проницаемые для растворителя. Другая полученная химическим путем библиотека пептидов использует фотолитографию для сканирования пептидов, иммобилизованных на предметных стеклах. В дальнейшем эти и родственные методы в целом называются "химико-пептидный скрининг". Химико-пептидный скрининг может быть полезен тем, что он позволяет использовать D-аминокислоты и другие неприродные аналоги, а также не-пептидные элементы. Обзор как биологических, так и химических методов дан в Wells and Lowman (1992), Curr. Opin.Biotechnol. 3:355-62. Теоретически можно обнаруживать пептиды-миметики любого белка, применяя фаговую визуализацию и другие вышеупомянутые методы. Эти методы использовались для картирования эпитопов, для идентификации важных аминокислот при взаимодействии белок-белок, и как руководство к обнаружению новых терапевтических агентов. Например, Cortese et al. (1996), Curr. Opin. Biotechnol. 7:616-21. Библиотеки пептидов в настоящее время очень широко используются в иммунологических исследованиях, таких как картирование эпитопов. Kreeger (1996), The Scientist 10(13): 19-20. Особый интерес представляет здесь использование пептидных библиотек и других методов для обнаружения фармакологически активных пептидов. Ряд таких пептидов, идентифицированных в технике,представлен в Таблице 2. Пептиды описаны в перечисленных публикациях, каждая из которых вводится в данное описание в качестве ссылки. Фармакологическая активность пептидов описана, и во многих примерах приведена после аббревиатуры названия в скобках. Некоторые из этих пептидов были модифицированы (например, с образованием сшитых по С-концу димеров). Обычно библиотеки пептидов подвергали скринингу на связывание с рецептором фармакологически активного белка (например, ЕРО-2 005404 рецептор). По меньшей мере, в одном примере (CTLA4) проводили скрининг библиотеки пептидов на связывание с моноклональным антителом. Таблица 2. Фармакологически активные пептиды Белки, перечисленные в этой колонке, могут быть связаны ассоциированным пептидом (например, ЕРО-рецептором, IL-1-рецептором) или имитированным ассоциированным пептидом. Ссылки, перечисленные для каждого, поясняют, молекула связана с пептидами или имитирована ими.FTS является тимическим гормоном, скорее имитируемым молекулой по данному изобретению,нежели рецептором, связываемым молекулой по данному изобретению Пептиды, идентифицированные скринингом библиотеки пептидов, рассматривались скорее как"руководство" при создании терапевтических агентов, нежели как сами терапевтические агенты. Подобно другим белкам и пептидам они быстро выводятся in vivo либо почечной фильтрацией, по механизмам клеточного клиренса в ретикулоэндотелиальной системе, или протеолитическим расщеплением. Francis(1992), Focus on Growth Factors 3:4-11. В результате в настоящее время в технике используют идентифицированные пептиды, чтобы подтвердить правильность лекарственных веществ-мишеней или в качестве для построения органических соединений, которые нельзя так легко или так быстро идентифицировать скринингом химической библиотеки. Lowman (1997), Ann. Rev. Biophys. Biomol. Struct. 26:401-24; Kay etal. (1998), Drug disc. Today 3:370-8. Уровень техники получил бы преимущества, если бы способ перехода от таких пептидов к терапевтическим агентам был более простым. Сущность изобретения Данное изобретение относится к способу увеличения in vivo (биологического полупериода существования) времени полужизни одного или более биологически активных пептидов за счт слияния с носителем. По данному изобретению фармакологически активные соединения получают способом, заключающемся в: а) отборе, по меньшей мере, одного пептида, который модулирует активность белка, представляющего интерес; и-6 005404 б) получении фармакологического агента, содержащего, по меньшей мере, один носитель, ковалентно связанный с, по меньшей мере, одной аминокислотной последовательностью выбранного пептида. Предпочтительным носителем является Fc-домен. Пептиды, скрининг которых проводят на стадии(а), предпочтительно экспрессируют в библиотеке фаговой визуализации. Носитель и пептид могут быть связаны по N- или по С-концу пептида или носителя, как описано ниже. Производные вышеуказанных соединений (описанных ниже) также охватываются данным изобретением. Комбинации по изобретению можно приготовить стандартными синтетическими методами, методами рекомбинантной ДНК или любыми другими методами приготовления пептидов и слитых белков. Соединения по данному изобретению, которые охватывают непептидные фрагменты, можно синтезировать обычными реакциями органической химии, помимо стандартных реакций химии пептидов, когда они применимы. Важнейшее применение, которое рассматривается - это применение в качестве терапевтических или профилактических агентов. Пептид, связанный с носителем, может иметь активность, сравнимую с - или даже большую - активностью природного лиганда, имитируемого пептидом. Кроме того, некоторые терапевтические агенты на основе природных лигандов могут вызывать антитела против собственного эндогенного лиганда больного; связанный с носителем пептид позволяет избежать эту проблему, так как он имеет малую или, как правило, не имеет никакой идентичности с последовательностью природного лиганда. Хотя соединения по изобретению в основном рассматриваются как терапевтические агенты, они могут быть пригодны при скрининге на такие агенты. Например, можно использовать Fc-пептид (например, пептид Fc-SH2 домена) в анализе с применением планшетов с анти-Fс-покрытием. Носитель, в частности Fc, может сделать нерастворимые пептиды растворимыми и, следовательно, пригодными в ряде анализов. Соединения по данному изобретению можно применять для терапевтических и профилактических целей, если готовить из них рецептуру с подходящими фармацевтическими носителями и вводить эффективное количество больному, такому как человек (или другое млекопитающее), который в этом нуждается. Другие родственные аспекты также входят в состав данного изобретения. Многочисленные дополнительные аспекты и преимущества данного изобретения будут очевидны после изучения фигур и подробного описания изобретения. Краткое описание фигур На фиг. 1 схематически представлен пример способа по изобретению. В этом предпочтительном способе носителем является Fc-домен, который связан с пептидом ковалентно за счт экспрессии ДНКконструкции, кодирующей как Fc-домен, так и пептид. Как отмечено на фиг. 1, Fc-домены самопроизвольно образуют димер в этом процессе. На фиг. 2 показаны примеры Fc-димеры, которые могут быть образованы из IgGl-антитела. "Fc" на фигуре представляет собой любой из Fc-вариантов значения "Fc-домена" по данному описанию. "X1" и"X2" обозначают пептиды или комбинации линкер-пептид, как определяется в дальнейшем. Ниже даны конкретные димеры: A, D: димеры с однократной дисульфидной связью. IgG1-антитела обычно содержат две дисульфидные связи на шарнирном участке между константной и вариабельной областями. Fc-домен на фиг. 2 А и 2D может быть образован усечением между участками двух дисульфидных связей или заменой цистеинового остатка на нереакционноспособный остаток (например, аланин). На фиг. 2 А Fcдомен связан по амино-концу пептида; на 2D - по карбоксильному концу. В, Е: димеры с двумя дисульфидными связями. Этот Fc-домен может быть образован таким усечением исходного антитела, чтобы оставались оба цистеинильных остатка в цепях Fc-домена, или экспрессией конструкции, включая последовательность, кодирующую такой Fc-домен. На фиг. 2 В Fc-домен связан по амино-концу пептидов; на 2 Е - по карбоксильному концу. С, F: Нековалентные димеры. Этот Fc-домен может образовываться элиминацией (удалением) цистеинильных остатков, либо усечением или заменой. Можно удалить цистеинильные остатки, чтобы избежать примесей, образующихся при реакции цистеинильного остатка с остатком цистеина другого белка, присутствующего в клетке-хозяине. Нековалентного связывания Fcдоменов достаточно для того, чтобы удерживать димер как единое целое. Другие димеры можно получать, используя Fc-домены различных типов антител (например, IgG2,IgM). На фиг. 3 изображена структура предпочтительных соединений по изобретению, отличающихся тандемными повторами фармакологически активного пептида. Фиг. 3 А изображает одно цепочечную молекулу, и может также изображать ДНК-конструкцию для молекулы. На фиг. 3 В показан димер, линкер-пептидный фрагмент имеется только в одной цепи димера. На фиг. 3 С показан димер с пептидным фрагментом в обеих цепях. Димер на фиг. 3 С образуется самопроизвольно в некоторых клетках-хозяевах при экспрессии ДНК-конструкции, кодирующей одноцепочечную молекулу, изображенную на фиг. 3 А. В случае других клеток-хозяев клетки можно поместить в условия, благоприятствующие образованию димеров или димеры можно получать in vitro.-7 005404 На фиг. 4 даны примеры нуклеотидной и аминокислотной последовательностей (SEQ ID NOS: 1 и 2,соответственно) человеческого IgG1 Fc, который можно применять по данному изобретению. На фиг. 5 дана схема синтеза ПЭГированного пептида 19 (SEQ ID NO:3). На фиг. 6 дана схема синтеза ПЭГированного пептида 20 (SEQ ID NO:4). На фиг. 7 даны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 5 и 6, соответственно) молекулы, определяемой ниже в Примере 2 как "Fc-TMP". На фиг. 8 показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 7 и 8, соответственно) молекулы, определяемой ниже в Примере 2 как "Fc-TMP-ТМР". На фиг. 9 изображены нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 9 и 10,соответственно) молекулы, идентифицируемой ниже в Примере 2 как "TMP-TMP-Fc". На фиг. 10 изображены нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 11 и 12,соответственно) молекулы, идентифицируемой ниже в Примере 2 как "TMP-Fc". На фиг. 11 показано количество тромбоцитов, образующихся у нормальных самок мышей BDF1,однократно инъецируемых болюсом 100 мг/кг различных соединений с приведнными ниже названиямиPEG-MGDF: Пэг со средней молекулярной массой 20 kDa присоединяют восстановительным аминированием к N-концевой аминогруппе аминокислот 1-163 нативного человеческого ТРО, который экспрессирует в Е.coli (так, что он не гликозилирован); ТМР: пептид - ТРО-миметик, имеющий аминокислотную последовательность IEGPTLRQWLAARAPEG-TMP-TMP: пептид с последовательностью SEQ ID NO: 14, отличающийся тем, что PEGгруппа представляет собой ПЭГ со средней молекулярной массой 5 kDa, присоединнный, как показано на фиг. 6;Fc-TMP-TMP: соединение с последовательностью SEQ ID NO:8 (фиг. 8), димеризованное со вторым идентичным мономером (то есть остатки Cys 7 и 10 связаны с соответствующими Cys-остатками второго мономера в форме димера, как показано на фиг. 2) иTMP-TMP-Fc означает соединение SEQ ID NO: 10 (фиг. 9), димеризованное таким же образом, какTMP-TMP-Fc, за исключением того, что Fc-домен присоединн скорее по С-концу, нежели по N-концу пептида ТМР-ТМР. На фиг. 12 показано количество тромбоцитов, образующихся in vivo у нормальных мышей BDF1,обработанных различными соединениями, доставляемыми с помощью имплантированных осмотических насосов в течение 7 дней. Соединения показаны на фиг. 7. На фиг. 13 показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 15 и 16,соответственно) молекулы, идентифицируемой ниже в примере 3 как "Fc-ЕМР". На фиг. 14 показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 17 и 18,соответственно) молекулы, идентифицируемой ниже в примере 3 как "EMP-Fc". На фиг. 15 показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 19 и 20,соответственно) молекулы, идентифицируемой ниже в примере 3 как "EMP-EMP-Fc". На фиг. 16 показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 21 и 22,соответственно) молекулы, идентифицируемой ниже в Примере 3 как "Fc-ЕМР-ЕМР". На фиг. 17 А и 17 В показана последовательность ДНК (SEQ ID NO:23), встроенная в pCFM1656 между уникальными сайтами рестрикции Aat II (положение 4364 в pCFM1656) и Sac II (положение 4585 в pCFM1656) с образованием плазмиды экспрессии pAMG21 (ATCC, регистрационный номер 98113). На фиг. 18 А показано количество гемоглобина, эритроцитов и гематокрита, образующихся in vivo у нормальных самок мышей BDF-1, получивших однократную 100 мг/кг-болюсную инъекцию различных соединений. На фиг. 18 В даны те же показатели у мышей, получающих ежедневно в течение 7 дней 100 мг/кг с помощью микроосмотического насоса с ЕМР, доставляемом в количестве 100 мг/кг, rhEPO при 30 Ед/мышь. (В обоих экспериментах число нейтрофилов, лимфоцитов и тромбоцитов не изменялось). На этих фигурах обозначения определяются следующим образом: Fc-EMP: соединение с SEQ ID NO: 16(фиг. 13), димеризующееся с идентичным вторым мономером (то есть остатки Cys 7 и 10 связаны с соответствующими Cys-остатками второго мономера с образованием димера, как показано на фиг. 2);EMP-Fc: соединение с SEQ ID NO: 18 (фиг. 14), димеризованное таким же образом, как Fc-EMP, за исключением того, что Fc-домен присоединн скорее по С-концу, нежели по N-концу пептида ЕМР."EMP-EMP-Fc" относится к тандемному повтору того же самого пептида (SEQ ID NO:20), присоединенному к Fc-домену карбоксильным концом пептидов. "Fc-EMP-ЕМР" относится к тому же самому тандемному повтору пептида, но с тем же самым Fc-доменом, присоединнным по амино-концу тандемного повтора. Все молекулы экспрессируют в Е. соli и потому не гликозилированы. На фиг. 19 А и 19 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1055 и 1056) слитой молекулы Fc-TNFингибитор, описанной ниже в примере 4.-8 005404 На фиг. 20 А и 20 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1057 и 1058) слитой молекулы ингибитор TNFFc, описанной ниже в примере 4. На фиг. 21 А и 21 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1059 и 1060) слитой молекулы Fc-антагонист IL-1, описанной ниже в примере 5. На фиг. 22 А и 22 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1061 и 1062) слитой молекулы антагонист IL-1-Fc, описанной ниже в примере 5. На фиг. 23 А, 23 В и 23 С показаны нуклеотидная и аминокислотная последовательности (SEQ IDNOS: 1063 и 1064) слитой молекулы Fc-VEGF-антагонист, описанной ниже в примере 6. На фиг. 24 А и 24 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1065 и 1066) слитой молекулы антагонист VEGF-Fc, описанной ниже в примере 6. На фиг. 25 А и 25 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1067 и 1068) слитой молекулы Fc-ингибитор ММР, описанной ниже в примере 7. На фиг. 26 А и 26 В показаны нуклеотидная и аминокислотная последовательности (SEQ ID NOS: 1069 и 1070) слитой молекулы ингибитор MMP-Fc, описанной ниже в примере 7. Подробное описание изобретения Определение терминов Термины, используемые в данном описании, определяются следующим образом, если не указано иначе в конкретных примерах. Термин "содержащий" означает, что молекула может включать дополнительные аминокислоты по одному или обоим - N- или С-концам данной последовательности. Конечно, эти дополнительные аминокислоты не должны заметно влиять на активность соединения. Термин "носитель" относится к молекуле, которая предупреждает расщепление и/или повышает время полужизни, снижает токсичность, уменьшает иммуногенность или повышает биологическую активность терапевтического белка. Примеры носителей включают Fc-домен (который является предпочтительным), а также линейный полимер (например, полиэтиленгликоль (PEG, ПЭГ), полилизин, декстран и т.д.); разветвленный полимер (см., например патенты США 4289872, выдан 15 сентября 1981 г. Denkenwalter et al.; 5229490, выдан 20 июля 1993 г Tan; Международная заявка WO 93/21259 Frechet et al.,опубликована 28 октября 1993 г); липид; холестерольная группа (такая как стероид); углевод или олигосахарид; или любой природный или синтетический белок, полипептид или пептид, который связывается с рецептором-"мусорщиком" (salvage-сборщик утиля). Носители дополнительно описаны ниже. Термин "нативный Fc" относится к молекуле или последовательности, содержащей последовательность неантиген-связывающего фрагмента, возникающего в результате гидролиза полного антитела, в мономерной или много(мульти)мерной форме. Исходный иммуноглобулин - источник нативного Fc является предпочтительно человеческим, и может быть любым иммуноглобулином, хотя IgG1 и IgG2 являются предпочтительными. Нативный Fc готовят из мономерных полипептидов, которые могут быть связаны в виде димерной или много(мульти)мерной форм ковалентной (т.е., дисульфидными связями) и не-ковалентной ассоциацией. Число внутримолекулярных дисульфидных связей между мономерными субъединицами молекул нативного Fc составляет 1-4 в зависимости от класса (например, IgG, IgA, IgE) или подкласса (например, IgG1, IgG2, IgG3, IgA1, IgA2). Одним примером нативного Fc является дисульфид-связанный димер, получающийся при папаиновом гидролизе IgG (см. Ellison et al. (1982), Nucleic Acids Res. 10:4071-9). Термин "нативный Fc", так, как он употребляется в данном описании является общим для мономерной, димерной и мульти(поли)мерной форм. Термин "Fc-вариант" ("вариант Fc") относится к молекуле или последовательности, которая модифицирована из нативного Fc, но ещ содержит сайт связывания для рецептора-"мусорщика", FcRn. В Международных заявках WO 97/34631 (опубликованной 25 сентября 1997 г.) и WO 96/32478 описаны примеры Fc-вариантов, а также взаимодействие с рецептором-"мусорщиком", и они вводятся в данное описание в качестве ссылок. То есть термин "Fc-вариант" включает молекулу или последовательность,которая является "гуманизированным" не-человеческим нативным Fc. Кроме того, нативный Fc содержит сайты, которые могут быть удалены, так как они вносят структурные особенности или биологическую активность, которая не требуется от слитых молекул по данному изобретению. То есть термин "Fcвариант" включает молекулу или последовательность, в которой отсутствует один или более сайтов или остатков нативного Fc, которые влияют на или включены в (1) образование дисульфидной связи, (2) несовместимость с выбранной клеткой-хозяином, (3) N-концевую гетерогенность при экспрессии в выбранной клетке-хозяине, (4) гликозилирование, (5) взаимодействие с комплементом, (6) связывание с Fcрецептором, иное, нежели рецептор-"мусорщиком" (salvage), или (7) антитело-зависимую клеточную цитотоксичность (ADCC). Fc-варианты описаны подробно ниже. Термин "Fc-домен" охватывает молекулы Fc и Fc-варианта и последовательности, охарактеризованные выше. Как в случае Fc-вариантов, так и в случае нативных Fc, термин "Fc-домен" включает молекулы в мономерной или мульти(поли)мерной форме, полученные в результате гидролиза полного антитела или какими-либо другими способами. Термин "мультимер" применяется в отношении Fc-доменов или молекул, имеющих две или более полипептидных цепи, связанных ковалентно, нековалентно или за счт как ковалентного, так и некова-9 005404 лентного взаимодействий. IgG молекулы обычно образуют димеры; IgM, пентамеры; IgD, димеры; и IgA,мономеры, димеры, тримеры или тетрамеры. Мультимеры могут образовываться при использовании последовательности и результирующей активности нативного Ig - источника Fc или дериватизацией (как показано ниже) такого нативного Fc. Термин "димер" в применении к Fc-доменам или молекулам, содержащим Fc-домены, относится к молекулам, имеющим две полипептидные цепи, ассоциированные ковалентно или нековалентно. Так,примеры димеров в объеме данного изобретения показаны на фиг. 2. Термины "дериватизация" и "производные" или "образованный из" включают способ (процесс) и образующиеся соединения, соответственно, в которых (1) соединение имеет циклический фрагмент; например, перекрестное сшивание цистеинильных остатков в соединении; (2) соединение является перекрестно сшитым или имеет сайт для перекрестного сшивания; например, соединение имеет цистеинильный остаток и, следовательно, образует перекрестно связанные (сшитые) димеры в культуре in vivo; (3) одна или более пептидильных связей замещены на не-пептидильные связи; (4) N-конец замещен на-NRR1, NRC(O)R1, -NRC(O)OR1, -NRS(O)2R1, -NHC(O)NHR, сукцинимидную группу, или замещнную или незамещнную бензилкарбонил-NH-, где R и R1 и заместители в цикле охарактеризованы ниже; (5) С-конец замещен на -C(O)R2 или -NR3R4, где R2, R3 и R4 охарактеризованы ниже; и (6) соединения, в которых отдельные аминокислотные участки модифицированы обработкой агентами, способными реагировать с выбранными боковыми цепями или концевыми остатками. Производные дополнительно описаны ниже. Термин "пептид" относится к молекулам из 2-40 аминокислот, при этом более предпочтительны молекулы из 3-20 аминокислот, а наиболее предпочтительны молекулы из 6-15 аминокислот. Пептиды в примерах можно получать любым (произвольно выбранным) способом, цитируемым выше, осуществлять в библиотеке пептидов (например, фаговая визуализация (выявления) библиотек) или же гидролизом белков. Термин "рандомизировать" в отношении пептидных последовательностей относится к полностью произвольным (случайным) последовательностям (например, выбранным методами фаговой визуализации) и последовательностям, в которых один или более остатков природной (натуральной) молекулы замещен на аминокислотный остаток, не встречающийся в этом положении в природной молекуле. Примеры способов идентификации пептидных последовательностей включают фаговую визуализацию, Е.coli-дисплей, рибосомную визуализацию, РНК-скрининг пептида, химический скрининг и т.п. Термин "фармакологически активный" означает, что установлено, что вещество, охарактеризованное таким образом, обладает активностью, которая влияет на медицинский показатель (например, кровяное давление, анализ крови, уровень холестерина) или на состояние болезни (например, рака, аутоиммунных нарушений). Следовательно, фармакологически активные пептиды представляют собой пептиды-агонисты, -миметики и -антагонисты, как определено ниже (миметические, агонистические и антагонистические пептиды). Термины "-миметический пептид" и "-агонистический пептид" ("пептид-миметик", "-агонист") относятся к пептиду, имеющему биологическую активность, сравнимую с белком (например, ЕРО, ТРО, GCSF), который взаимодействует с нужным (представляющим интерес) белком. Эти термины далее включают пептиды, которые опосредованно подражают активности интересующего (нужного) белка, такой как усиление эффекта природного лиганда интересующего белка; см., например, пептиды, имитирующиеG-CSF, перечисленные в табл. 2 и 7. Так, термин "ЕРО-миметический пептид" включает любые пептиды,которые могут быть идентифицированы или образованы как описано в Wrighton et al. (1996), Science 273:458-63, Naranda et al. (1999), Proc. Natl. Acad. Sci. USA, 96:7569-74, или в любой другой ссылке в табл. 2 идентифицированы как содержащие ЕРО-миметический предмет изобретения. Рядовые специалисты в данной области поймут, что каждая из этих ссылок позволяет выбрать пептиды, отличные от тех,которые действительно там описаны, с помощью описанных там методов с различными (другими) пептидными библиотеками. Термин "ТРО-миметический пептид" включает пептиды, которые могут быть идентифицированы или образованы как описанные в Cwirla et al. (1997), Science 276:1996-9; патентах США 5869451 и 5932946, и в любой другой ссылке в табл. 2 определены как содержащие ТРО-миметический объект(предмет изобретения). Рядовые специалисты в данной области техники оценят, что каждая из этих ссылок позволяет выбрать пептиды, отличные от действительно описанных в них, следуя описанным методикам с различными (другими) пептидными библиотеками. Термин "G-CSF-миметический пептид" включает любой пептид, которые может быть определен или описан в Paukovits et al. (1984), Hoppe-Seylers Z. Physiol.Chem, 365: 303-11 или в любой из ссылок в табл. 2 идентифицирован как содержащий G-CSF-миметический объект (предмет изобретения). Рядовой специалист в данной области техники оценит, что каждая из этих ссылок позволяет выбрать иные пептиды, нежели действительно описанных в них, следуя описываемым методикам с иными пептидными библиотеками. Термин "СTLA4-миметический пептид" включает пептиды, которые могут быть идентифицированы или образованы как описано в Fukumoto et al.(1998). Nature Biotech. 16:267-70. Рядовые специалисты-10 005404 в данной области техники оценят, что каждая из этих ссылок позволяет выбрать пептиды, отличные от действительно описанных в них, следуя описанным методикам с различными (другими) пептидными библиотеками. Термин "пептид-антагониста" и "пептид ингибитора" ("ингибирующий") относится к пептиду, который блокирует биологическую активность интересующего связывающего белка или каким-либо образом мешает ей или имеет биологическую активность, сопоставимую с и активностью известного антагониста или ингибитора интересующего (нужного) ассоциированного белка, то есть термин "пептид TNFантагониста" ("TNF-антагонистический") включает пептиды, которые могут быть идентифицированы или получены как описано в Takasaki et al. (1997), Nature Biotech. 15:1266-70, и в любой из ссылок в Таблице 2 определены как имеющие TNF-антагонистический объект (предмет изобретения). Рядовые специалисты в данной области техники оценят, что каждая из этих ссылок позволяет выбрать иные пептиды,нежели действительно описанные в этих ссылках, следуя описанным методикам с различными (другими) пептидными библиотеками. Термин "IL-1-антагонист" или " пептид-IL-lra-миметик" включает пептиды, которые ингибируют или негативно регулируют активацию IL-1-рецептора с помощью IL-1. Активация IL-1-рецептора происходит в результате образования комплекса между IL-1, рецептором IL-1 и IL-1 рецепторным вспомогательным белком. IL-1-антагонистические или IL-lra-миметические пептиды (пептиды - IL-1-антагонисты и пептид-IL-lra-миметики) связываются с IL-1, рецептором EL-1 или IL-1 рецепторным вспомогательным белком и препятствуют образованию комплекса между любыми двумя или тремя компонентами комплекса. Примеры пептидов-IL-1-антагонистов или пептидов-IL-lra-миметиков могут быть идентифицированы или получены как описано в Патентах США 5608035, 5786331, 5880096 или в любой из ссылок в табл. 2 определены как имеющие IL-lra-миметический или IL-lra-антагонистический объект (предмет изобретения). Рядовые специалисты в данной области техники оценят, что каждая из этих ссылок позволяет выбрать иные пептиды, отличные от действительно описанных в этих ссылках, следуя описанным методикам с различными пептидными библиотеками. Термин "пептид VEGF-антагониста" включает пептиды, которые могут быть идентифицированы или получены как описано в Fairbrother (1998), Biochem. 37:17754-17764, и в любой из ссылок в табл. 2 определены как содержащие VEGF-антагонистический объект. Рядовые специалисты в данной области техники оценят, что каждая из этих ссылок позволяет выбрать иные пептиды, отличные от действительно описанных в этих ссылках, следуя описанным методикам с различными пептидными библиотеками. Термин "ММР-ингибирующий пептид" включает пептиды, которые могут быть идентифицированы или получены как описано в Koivunen (1999), Nature Biotech. 17:768-774, и в любой из ссылок в табл. 2 определены как содержащие ММР-ингибирующий объект. Рядовой специалист в данной области техники поймет, что каждая из этих ссылок позволяет выбрать иные пептиды, отличные от действительно описанных в этих ссылках, следуя описанным методикам с различными пептидными библиотеками. Кроме того, физиологически приемлемые соли соединений по изобретению также охватываются данным описанием. Под "физиологически приемлемыми солями" понимают любые соли, о которых известно, что они являются фармацевтически приемлемыми. Некоторые конкретные примеры представляют собой: ацетат, трифторацетат, гидрогалогениды, такие как гидрохлорид и гидробромид; сульфат; цитрат; тартрат; гликолят; и оксалат. Структура соединений В целом. В композициях - предметах изобретения, приготовленных по данному изобретению, пептиды могут связываться с носителем по N-концу или С-концу пептида. То есть молекулы носитель-пептид по данному изобретению можно описать следующей формулой I-(L )c-P1-(L2)d-P2-(L3)e-P3-(L4)f-P4; Р 1, Р 2, Р 3 и Р 4 обозначают независимо каждая последовательности фармакологически активных пептидов;L1, L2, L3 и L4 - каждый независимо, обозначают линкеры и а, b, с, d, е и f - каждый независимо, обозначает 0 или 1 при условии, что по меньшей мере один из а и b обозначает 1. Таким образом, соединение I включает предпочтительные соединения формул II и их мультимеры, где F1 обозначает Fc-домен и присоединен по N-концу -(L1)c-Р 1-(L2)d-P2. Пептиды. Любой ряд петидов может применяться по данному изобретению. Особый интерес представляют пептиды, которые имитируют активность ЕРО, ТРО, гормона роста, G-CSF, GM-CSF, EL-lra,лептина, CTLA4, TRAIL, TGF- и TGF-. Пептидные антагонисты также представляют интерес, в частности, пептиды - антагонисты активности TNF, лептина, любого из интерлейкинов (IL-1,2,3,) и белков,включнных в активацию комплемента (например, С 3b). Целевые пептиды также представляют интерес,включая "хоминг"-пептиды опухолей, транс-мембранные пептиды и т.п. Все эти классы пептидов могут быть обнаружены методами, описанными в ссылках, цитируемых в данном описании, и других ссылках. Фаговая визуализация, в частности, пригодна для генерирования пептидов для применения по данному изобретению. Было установлено, что аффинную селекцию из библиотек случайных пептидов можно использовать для идентификации пептидных лигандов для любого сайта любого генного продукта.Dedman et al. (1993), J. Biol. Chem. 268:23025-30. Фаговая визуализация, в частности, хорошо подходит для идентификации пептидов, которые связываются с такими представляющими интерес белками, как рецепторы клеточной поверхности или любые белки, имеющие линейные эпитопы. Wilson et al. (1998),Can. J. Microbiol. 44:313-29; Kay et al. (1998), Drug Disc. Today 3:370-8. О таких белках написан большой обзор, в Herz et al. (1997), J. Receptor and Signal Transduction res. 17(5):671-776, который вводят в данное описание в качестве ссылки. Такие представляющие интерес белки предпочтительны для применения по данному изобретению. Особенно предпочтительна группа пептидов, которые связываются с рецепторами цитокинов. Цитокины недавно классифицированы согласно их рецепторному коду. См. статью Inglot (1997), ArchivumImmunologiae et Therapiae Experimentalis 45:353-7, которая вводится в данное описание в качестве ссылки. Среди этих рецепторов наиболее предпочтительными являются CKR (семейство I в табл. 3). Классификация рецепторов представлена в табл. 3. Таблица 3. Рецепторы цитокинов, классифицируемые с помощью рецепторного кодаIL-17R принадлежит к CKR-семейству, но ни к одному из 4-х указанных подсемейств. Другие субтипы IFN типа I остаются неотнеснными. Гемопоэтические цитокины, IL-10-лиганды и интерфероны не обладают функциональными внутренними протеинкиназами. Молекулами, передающими сигнал, для цитокинов являются JAK, STAT и родственные нерецепторные молекулы. IL-14, IL-16 и IL-18 были клонированы, но они остаются неотнеснными в соответствии с рецепторным кодом.TNF-рецепторы используют сложные различные внутриклеточные молекулы для сигнальной трансдукции, включая "домен гибели (смерти)" FASR и TNF-R 55 kDa, который участвует в их цитотоксических эффектах. NGF/TNF R может связываться как с NGF, так и с родственными факторами, а также с TNF-лигандами. Рецепторы хемокинов представляют собой G белок-связанные рецепторы семи трансмембран (7 ТМ, серпентин) доменов.f) Антиген группы крови Даффи (Duffy) (DARC) представляет собой рецептор эритроцита, который может связывать несколько различных хемокинов. Он принадлежит к суперсемейству иммуноглобулинов, но особенности событий его сигнальной трансдукции до сих пор остаются неясными.g) Нейротрофические цитокины также могут ассоциироваться с NGF/TNF-рецепторами.STKS могут охватывать многие другие родственные TGFфакторы, которые остаются неотнеснными. Протеинкиназы являются внутренней частью внутриклеточного домена семейства рецепторных киназ (RKF). Ферменты участвуют в сигнальной трансмиссии с помощью рецепторов. Примеры пептидов по данному изобретению представлены ниже в табл. 4-20. Эти пептиды можно получать методами, описанными в уровне техники. Для обозначения аминокислот используются однобуквенные аббревиатуры. Х в этих последовательностях (и во всем данном описании, если не указано иначе в конкретном случае) обозначает, что могут присутствовать любые 20 остатков природных аминокислот. Любой из этих пептидов может быть связан в тандем (повтор, т.е. последовательно), с линкерами или без них, и ниже в Таблице приведено несколько примеров тандемного связывания. Линкеры обозначены "А" и могут быть любыми линкерами, входящими в данное описание. Тандемные повторы (дупликации) и линкеры разделены для ясности чрточками. Любой пептид, содержащий цистеинильный остаток, может быть перекрстно сшит с другим Cys-содержащим пептидом, или они оба могут быть связаны с носителем. В Таблице дано несколько примеров перекрстно сшитых соединений. Любой пептид, содержащий более одного Cys-остатка, может также образовывать внутрипептидную дисульфидную связь;-13 005404 см., например, пептиды ЕРО-миметики в табл. 5. В таблице приведено несколько примеров пептидов,связанных внутрипептидной дисульфидной связью. Любой из этих пептидов может быть дериватизирован, как представлено в данном описании, и в таблице дано несколько примеров таких дериватов. Дериватизированные пептиды в таблице приведены скорее в качестве примера, нежели в качестве ограничения, так как по данному изобретению могут использоваться также ассоциированные недериватизированные пептиды. Для производных (дериватов), у которых карбоксильный конец может быть "кэпирован" аминогруппой, кэпирующая аминогруппа показана как -NH2. В случае производных, у которых аминокислотные остатки замещены (заменены) другими фрагментами, нежели аминокислотные остатки, замены (заместители) помечены s, что обозначает любые фрагменты (частицы), описанные в Bhatnagar et al.Natl. Acad. Sci. 93:1540-4, вводимой в данное описание в качестве ссылки. Х 4, Х 5, X6 и Х 7 имеют значение, определяемое в патенте США 5773569, вводимом в данное описание в качестве ссылки, за исключением того, что значение интегрин-связывающих пептидов, X1, X2, X3, Х 4, Х 5, X6, Х 7 и X8 дано в Международных заявках WO 95/14714, опубликованной 1 июня 1995 г. и WO 97/08203, опубликованной 6 марта 1997 г., которые также вводятся в данное описание в качестве ссылок; и для пептидов-VIP-миметиков значения X1, X1', X1", Х 2, Х 3, Х 4, Х 5, Х 6 и Z и целочисленных тип даны в Международной заявке WO 97/40070, опубликованной 30 октября 1997 г, которая также вводится в данное описание в качестве ссылки. Значение Хаа и Yaa, см. ниже, дано в международной заявке WO 98/09985, опубликованной 12 марта 1998 г, вводимой в данное описание в качестве ссылки. Значения АА 1, АА 2, AB1, АВ 2 и АС даны в Международной заявке WO 98/53842, опубликованной 3 декабря 1998 г., которая вводится в данное описание в качестве ссылки. Значения Х 1, Х 2, Х 3 и X4 только в табл. 17 даны в Европейской заявке ЕР 0911393, опубликованной 28 апреля 1999 г. Остатки, напечатанные жирным шрифтом, являются Dаминокислоты. Все пептиды связаны пептидными связями, если не указано иначе. Сокращения пояснены в конце описания. В столбце "SEQ ID NO" NR обозначает, что для данной последовательности не требуется внесения последовательности в список. Таблица 4. Последовательности пептидов - IL-1-антагонистов-27 005404 Таблица 20. Дополнительные примеры фармакологически активных пептидов- рака, при этом пептиды представляют собой VEGF-миметик или антагонист VEGF-рецептора,НЕR2-агонист или антагонист, СD20-антагонист и т.п.- астмы, при этом интересующий белок представляет собой CKR3-антагонист и антагонист IL-5 рецептора и т.п.- тромбоза, при этом интересующий белок представляет собой GPIIb-антагонист, GPIIIa-антагонист и т.п.- аутоиммунных заболеваний и других состояний, включающих иммунную модуляцию, при этом интересующий белок является антагонистом IL-2-рецептора, СD40-агонистом или -антагонистом,СD40L-агонистом или -антагонистом, миметиком тимопоэтина и т.п. Носители. По данному изобретению требуется наличие, по меньшей мере, одного носителя (F1, F2),присоединенного к пептиду по N-концу, С-концу или к боковой цепи одного из аминокислотных остатков. Можно также использовать множественные носители; например, Fc на каждом конце или Fc - на каком-либо конце и ПЭГ (PEG)-группа на другом конце или в боковой цепи.Fc-домен является предпочтительным носителем. Fc-домен может быть слит по N- или С-концу пептидов или по обоим N- и С-концам. В случае ТРО-миметических пептидов молекулы, содержащиеFc-домен, слитый с N-концом пептидного участка молекулы, являются более биологически активными,чем другие подобные слияния, так что слияние по N-концу более предпочтительно. Как отмечено выше, Fc-варианты являются пригодными носителями в объме данного изобретения. Нативный Fc может быть в значительной степени модифицирован с образованием Fc-варианта по данному изобретению, при условии, что сохраняется связывание с рецептором-"мусорщиком" (salvage); см.,например, Международные патентные заявки WO 97/34631 и WO 96/32478. В таких Fc-вариантах можно удалять один или более сайтов нативного Fc, которые обеспечивают структурные особенности или функциональную активность, ненужные слитым молекулам по изобретению. Можно удалить эти сайты,например, заменяя или удаляя (делегируя) остатки, вводя остатки в сайт (встраивая), или путем усечения участков, содержащих сайт. Встроенные или замененные остатки могут также быть изменнными аминокислотами, такими как пептидомиметики или D-аминокислоты. По ряду причин, некоторые из которых описаны ниже, могут быть желательны Fc-варианты. Примеры Fc-вариантов включают молекулы и последовательности, в которых: 1. Сайты, участвующие в образовании дисульфидной связи, удаляют. Такое удаление помогает избежать реакции с другими цистеин-содержащими белками, присутствующими в клетке-хозяине, используемой для продуцирования молекул по изобретению. Для этой цели цистеин-содержащий сегмент на Nконце может быть усечен или цистеиновые остатки могут быть делегированы или заменены на другие аминокислоты (например, аланил, серил). В частности, можно отсекать содержащий 20 аминокислот Nконцевой сегмент последовательности SEQ ID NO: 2 или удалять или заменять цистеиновые остатки в положениях 7 и 10 последовательности SEQ ID NO:2. Даже в том случае, когда цистеиновые остатки удалены, одноцепочечные Fc-домены вс ещ могут образовывать димерный Fc-домен, который удерживается вместе за счет не-ковалентного связывания. 2. Нативный Fc модифицируют, чтобы сделать его более совместимым с выбранной клеткойхозяином. Например, можно удалить РА-последовательность близ N-конца типичного нативного Fc, который может расщепляться в присутствии отщепляющего (пищеварительного) фермента в Е. coli, такого как пролиниминопептидаза. Можно также добавлять N-концевой метиониновый остаток, в частности,когда молекула рекомбинантно экспрессирует в бактериальной клетке, такой как Е. coli. Fc-домен SEQID NO: 2 (фиг. 4) представляет собой такой Fc-вариант. 3. N-концевой участок нативного Fc удаляют с целью предотвратить N-концевую гетерогенность в процессе экспрессии в выбранной клетке-хозяине. С этой целью можно делегировать любые из первых 20 аминокислотных остатков на N-конце, особенно, остатки в положениях 1, 2, 3, 4 и 5. 4. Один или более сайтов гликозилирования удаляют. Остатки, которые обычно гликозилируются(например, аспарагин), могут обеспечивать цитолитический ответ. Такие остатки могут быть делегированы или заменены на негликозилированные остатки (например, аланин).-29 005404 5. Сайты, участвующие во взаимодействии с комплементом, такие как сайт связывания Clq, удаляют. Например, можно делегировагь или заменигь ЕКК-последовательность человеческого IgGl. Рекрутинг комплемента может быть неблагоприятен для таких молекул и таким образом его можно избежать с помощью такого Fc-варианта. 6. Удаляют сайты, которые влияют на связывание с Fc-рецепторами, иными, нежели salvageрецептор ("мусорщик"). Нативный Fc может иметь сайты для взаимодействия с некоторыми лейкоцитами, которые не требуются для слитых молекул по данному изобретению, и поэтому могут быть удалены. 7. Сайг ADCC удаляют. ADCC-сайты известны из уровня техники; см., например, Molec. Immunol. 29(5):633-9 (1992), относительно ADCC-сайтов в IgGl. Эти сайты также не нужны для слитых молекул по данному изобретению, и поэтому могут быть удалены. 8. Когда нативный Fc образован не из человеческого антитела, нативный Fc может быть "гуманизирован". Как правило, для "гуманизации" нативного Fc заменяют выбранные остатки в не-человеческом нативном Fc на остатки, которые обычно обнаруживаются в человеческом нативном Fc. Методы "гуманизации" антител хорошо известны из уровня техники. Предпочтительные Fc-варианты включают следующие. В SEQ ID NO:2 (фиг. 4) лейцин в положении 15 может быть заменн на глутамат; глутамат в положении 99 - на аланин; и лизины в положениях 101 и 103 - на остатки аланина. Кроме того, один или более остатков тирозина можно заменить на остатки фенилаланина. Альтернативным носителем может быть белок, полипептид, пептид, антитело, фрагмент антитела или малая молекула (например, соединение - пептидомиметик), способные связываться с рецептором "сборщиком утиля", "мусорщиком" (salvage). Например, можно использовать в качестве носителя полипептид, описанный в Патенте США 5739277, выданном 14 апреля 1998 г. Presta et al. Можно также проводить селекцию пептидов фаговой визуализацией на связывание с FcRn рецептором - "мусорщиком"(salvage). Такие связывающиеся с рецептором - "мусорщиком" (salvage) соединения также охватываются понятием "носитель" и входят в объм данного изобретения. Такие носители можно отбирать с целью повышения полупериода существования (периода полужизни) (например, избегая последовательностей,распознаваемых протеазами) и понижения иммуногенности (например, отдавая предпочтение неиммуногенным последовательностям, как обнаружено при "гуманизации" антител). Как отмечено выше, полимерные носители могут также использоваться для F1 и F2. В настоящее время доступны различные способы присоединения химических фрагментов, пригодных в качестве носителей, см., например, Patent Cooperation Treaty ("PCT") Международная заявка WO 96/11953, озаглавленная "N-terminally Chemically Modified Protein Compositions and Methods", во всей полноте вводимая в данное описание в качестве ссылки. Эта РСТ-публикация охватывает, среди прочего, селективное присоединение водорастворимых полимеров по N-концу белков. Предпочтительным полимерным носителем является полиэтиленгликоль (PEG, ПЭГ). ПЭГ-группа может иметь любую подходящую молекулярную массу и может быть линейной или разветвленной. Средняя молекулярная масс ПЭГ составляет интервал, предпочтительно, около 2-100 килодальтон("kDa"), более предпочтительно, около 5-50 kDa, наиболее предпочтительно, около 5-10 kDa. ПЭГгруппы обычно присоединяют к соединениям по изобретению ацилированием или восстановительным аминированием при реакции имеющейся в ПЭГ-фрагменте реакционноспособной группы (например,альдегидной, амино-, тиольной или сложноэфирной группы) с реакционноспособной группой соединения по изобретению (например, альдегидной, амино- или сложноэфирной группы). Соответствующая (применимая) стратегия ПЭГ-ирования синтетических пептидов заключается в объединении (соединение), за счт образования конъюгатного связывания в растворе, пептида и ПЭГфрагмента, причм каждый нест конкретную функциональную группу, которые реагируют друг с другом. Пептиды можно легко получить соответствующим твердофазным синтезом (см., например фиг. 5 и 6 и прилагаемый текст). Пептиды предварительно активированы ("преактивированы") подходящей функциональной группой в специфическом сайте. Предшественники очищают и полностью характеризуют перед реакцией с ПЭГ-частицей (фрагментом). Лигирование пептида с ПЭГ-фрагментом обычно происходит в водной фазе и может легко контролироваться обращение фазовой аналитической ВЭЖХ. ПЭГ-ированные пептиды можно легко очистить препаративной ВЭЖХ, а охарактеризовать с помощью аналитической ВЭЖХ, аминокислотного анализа и лазерной десорбционной масс-спектрометрией. Полимерные полисахариды представляют собой другой тип водорастворимых полимеров, которые можно применять для модификации белков. Декстраны являются полимерными полисахаридами, состоящими из отдельных субъединиц глюкозы, преимущественно связанных 1-6-связями. Сам декстан доступен в широком интервале молекулярных масс и легко доступен декстран с молекулярной массой около 1-70 kDa. Декстран является водорастворимым полимером, пригодным для применения по данному изобретению в качестве носителя сам по себе или в комбинации с другим носителем (например, Fc). См., например, Международные заявки WO 96/11953 и WO 96/05309. Сообщалось о применении декстрана,конъюгированного с терапевтическими иммуноглобулинами; см., например, Европейский патент
МПК / Метки
МПК: C07K 19/00, C12N 15/62
Метки: терапевтические, модифицированные, агенты, пептиды
Код ссылки
<a href="https://eas.patents.su/30-5404-modificirovannye-peptidy-kak-terapevticheskie-agenty.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированные пептиды как терапевтические агенты</a>