Сульфонилалканоиламиногидроксиэтиламиносульфонамид в качестве ингибиторов ретровирусной протеазы
Номер патента: 533
Опубликовано: 28.10.1999
Авторы: Макдонэлд Джозеф Дж., Гетмен Даниел П., Нагараян Сринивазан, Девадас Балекудру, Сикорски Джеймс А., Васкез Майкл Л., Фрескос Джон Н., Декрессенцо Гэри А.
Формула / Реферат
1. Соединение формулы
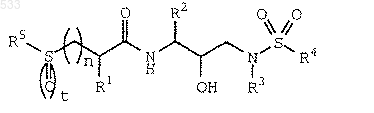
или его фармацевтически приемлемая соль, пролекарство или сложный эфир, где символы n и t, каждый независимо друг от друга, равны 0,1 или 2;
R1 обозначает водород, алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода, гидроксиалкил с 1-3 атомами углерода, алкоксиалкил, состоящий из алкила с 1-3 атомами и алкокси с 1-3 атомами углерода, цианоалкил, содержащий алкил с 1-3 атомами углерода, -CH2CONH2, -CH2CH2CONH2, -CH2S(O)2NH2, -СН2SСН3, -СН2S(O)СН3 или -СН2S(O)2СН3;
R2 обозначает алкил с 1-5 атомами углерода, аралкил, содержащий алкил с 1-3 атомами углерода, алкилтиоалкил, содержащий алкил с 1-3 атомами углерода, арилтиоалкил, содержащий алкил с 1-3 атомами углерода, или циклоалкилалкил, состоящий из алкила с 1-3 атомами углерода и 3-6-членного углеводородного кольца;
R3 обозначает алкил с 1-5 атомами углерода, 5-8-членный циклоалкил или 3-6-членный циклоалкилметил;
R4 обозначает сконденсированный с бензольным ядром 5-6-членный гетероарил или сконденсированный с бензольным ядром 5-6-членный гетероцикл;
или группу формулы
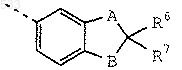
где А и В, каждый независимо друг от друга, обозначает О, S, SO или SO2;
R6 обозначает дейтерий, алкил с 1-5 атомами углерода, фтор или хлор;
R7 обозначает водород, дейтерий, метил, фтор или хлор;
или группу формулы
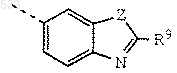
где Z обозначает О, S или NH и
R9 обозначает группу формулы
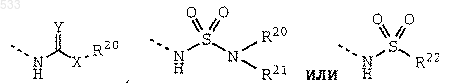
где Y обозначает О, S или NH;
Х обозначает связь, О или NR21;
R20 обозначает водород, алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода, аралкил, содержащий алкил с 1-5 атомами углерода, гетероаралкил, состоящий из 5-6-членного кольца и алкила с 1-5 атомами углерода, гетероциклоалкил, состоящий из 5-6-членного кольца и алкила с 1-5 атомами углерода, аминоалкил с 2-5 атомами углерода, N-монозамещенный или N,N-дизамещенный аминоалкил, содержащий алкил с 2-5 атомами углерода, где указанные заместители выбраны из группы, включающей алкил с 1-3 атомами углерода, аралкил, содержащий алкил с 1-3 атомами углерода, карбоксиалкил с 1-5 атомами углерода, алкоксикарбонилалкил, содержащий алкил с 1-5 атомами углерода, цианоалкил с 1-5 атомами углерода или гидроксиалкил с 2-5 атомами углерода;
R21 обозначает водород или алкил с 1-3 атомами углерода;
или группа формулы -NR20R21 обозначает 5-6-членный гетероцикл; и
R22 обозначает алкил с 1-3 атомами углерода или R20R21N-алкильную группу с 1-3 атомами углерода; и
R5 обозначает алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода или арил, замещенный алкилом с 1-5 атомами углерода.
2. Соединение по п.1 или его фармацевтически приемлемая соль, пролекарство или сложный эфир, где n равно 1; t равно 1 или 2;
R1 обозначает водород, алкил с 1-3 атомами углерода, алкенил с 2-3 атомами углерода, алкинил с 2-3 атомами углерода или цианометил;
R2 обозначает алкил с 3-5 атомами углерода, арилметил, алкилтиоалкил, содержащий алкил с 1-3 атомами углерода, арилтиометил или 5-6-членный циклоалкилметил;
R3 обозначает алкил с 1-5 атомами углерода, 3-6-членный циклоалкилметил, циклогексил или циклогептил;
R4 обозначает 2-аминобензотиазол-5-ил, 2-аминобензотиазол-6-ил, бензотиазол-5-ил, бензотиазол-6-ил, бензоксазол-5-ил, 2,3-дигидробензофуран-5-ил, бензофуран-5-ил, 1,3-бензодиоксол-5-ил или 1,4-бензодиоксан-6-ил; или группу формулы
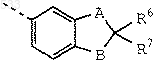
где А и В каждый обозначает О;
R6 обозначает дейтерий, метил, этил, пропил, изопропил или фтор и R7 обозначает водород, дейтерий, метил или фтор;
или группу формулы
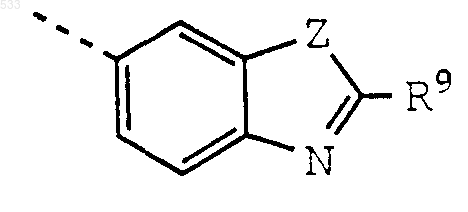
где Z обозначает О, S или NH и
R9 обозначает группу формулы
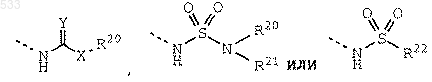
где Y обозначает О, S или NH;
Х обозначает связь, О или NR21;
R20 обозначает водород, алкил с 1-5 атомами углерода, фенилалкил, содержащий алкил с 1-3 атомами углерода, гетероциклоалкил, состоящий из 5-6-членногокольца и алкила с 1-3 атомами углерода, или N-монозамещенный или N,N-дизамещенный аминоалкил с 2-3 атомами углерода, где указанные заместители представляют собой алкил с 1-3 атомами углерода;
R21 обозначает водород или метил;
или группа формулы -NR20R21 обозначает пирролидинил, пиперидинил, пиперазинил, 4-метилпиперазинил, 4-бензилпиперазинил, морфолинил или тиаморфолинил; и
R22 обозначает алкил с 1-3 атомами углерода; и
R5 обозначает алкил с 1-5 атомами углерода, алкенил с 3-4 атомами углерода, алкинил с 3-4 атомами углерода или арил, замещенный алкилом с 1-4 атомами углерода.
3. Соединение по п.2 или его фармацевтически приемлемая соль, пролекарство или сложный эфир,
где R1 обозначает водород, метил, этил или цианометил;
R2 обозначает изобутил, н-бутил, CH3SCH2CH2-, фенилтиометил, (2-нафтилтио)метил, бензил, 4-метоксифенилметил, 4-гидроксифенилметил, 4-фторфенилметил или циклогексилметил;
R3 обозначает пропил, изоамил, изобутил, бутил, циклогексил, циклогептил, циклопентилметил или циклогексилметил; и
R4 обозначает бензотиазол-5-ил, бензотиазол-6-ил, бензоксазол-5-ил, 2,3-дигидробензофуран-5-ил, бензофуран-5-ил, 1,3-бензодиоксол-5-ил, 2-метил-1,3-бензодиоксол-5-ил, 2,2-диметил-1,3-бензодиоксол-5-ил, 2,2-дидейтерий-1,3-бензодиоксол-5-ил, 2,2-дифтор-1,3-бензодиоксол-5-ил или 1,4-бензодиоксан-6-ил; или группу формулы
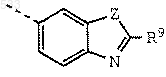
где Z обозначает О, S или NH и
R9 обозначает группу формулы
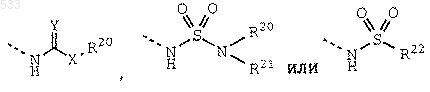
где Y обозначает О, S или NH;
Х обозначает связь, О или NR21;
R20 обозначает водород, метил, этил, пропил, изопропил, изобутил, бензил, 2-(1-пирролидинил)этил, 2-(1-пиперидинил)этил, 2-(1-пиперазинил)этил, 2-(4-метилпиперазин-1-ил)этил, 2-(1-морфолинил)этил, 2-(1-тиаморфолинил)этил или 2-(N,N-диметиламино) этил;
R21 обозначает водород и
R22 обозначает метил; и
R5 обозначает алкил с 1-5 атомами углерода или фенил, замещенный алкилом с 2-4 атомами углерода.
4. Соединение по п.3 или его фармацевтически приемлемая соль, пролекарство или сложный эфир, где
R1 обозначает метил или этил;
R2 обозначает бензил, 4-фторфенилметил или циклогексилметил;
R4 обозначает бензотиазол-5-ил, бензотиазол-6-ил, 2,3-дигидробензофуран-5-ил, бензофуран-5-ил, 1,3-бензодиоксол-5-ил, 2-метил-1,3-бензодиоксол-5-ил, 2,2-диметил-1,3-бензодиоксол-5-ил, 2,2-дидейтерий-1,3-бензодиоксол-5-ил, 2,2-дифтор-1,3-бензодиоксол-5-ил, 1,4-бензодиоксан-6-ил, 2-(метоксикарбониламино) бензотиазол-6-ил или 2-(метоксикарбониламино) бензимидазол-5-ил; и
R5 обозначает метил, этил, пропил, изопропил или 2-фенилэтил.
5. Соединение по п.1, выбранное из групяы, включающей:
N-[2R-гидрокси-3-[(2-метилпропил)[(1,3-бензодиоксол-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамид;
N-[2R-гидрокси-3-[(2-метилпропил)[(1,4-бензодиоксан-6-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил) пропанамид;
N-[2R-гидрокси-3-[(2-метилпропил)[(бензотиазол-6-ил) сульфонил]амино]-1S-(фенилметил)пропил]-2S-метил-3-(метилсульфонил) пропанамид;
N-[2R-гидрокси-3-[(2-метилпропил)[(бензотиазол-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-мeтил-3-(мeтилcyльфoнил)пропанамид; и
N-[2R-гидрокси-3-[(2-метилпропил)[(2,3-дигидробензофуран-5-ил)сульфонил]амино]-1S-(фенилметил)пропил]-2S-мeтил-3-(мeтилcyльфoнил)пропанамид.
6. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
7. Способ ингибирования протеазы ретровируса, включающий введение эффективного количества соединения по п.1.
8. Способ лечения ретровирусной инфекции, включающий введение эффективного количества композиции по п.6.
9. Способ предотвращения репликации ретровируса, включающий введение эффективного количества соединения по п.1.
10. Способ предотвращения репликации ретровируса in vitro, включающий введение эффективного количества соединения по п.1.
11. Способ лечения СПИДа, включающий введение эффективного количества композиции по п.6.
Текст
1 Настоящая заявка является частичным продолжением находящейся в процессе одновременного рассмотрения заявки на патент США 08/401838, поданной 10 марта 1995 г. на имя заявителя по настоящей заявке. Предпосылки создания изобретения Настоящее изобретение относится к ингибиторам протеаз ретровирусов, в частности к новым соединениям, к композиции и способу ингибирования протеаз ретровируса, таких как протеаза вируса иммунодефицита человека(ВИЧ). Изобретение, прежде всего, относится к соединениям из класса сульфонилалканоиламиногидроксиэтиламиносульфонамидов,обладающих способностью ингибировать протеазы ретровирусов, к композиции и к способу ингибирования протеаз ретровирусов, профилактическому предотвращению ретровирусной инфекции или распространения ретровируса и к лечению ретровирусной инфекции, например,ВИЧ-инфекции. Изобретение относится далее к способам получения таких соединений, а также к промежуточным соединениям, используемым в этих способах. Во время цикла репликации ретровирусов продукты транскрипции гена gag и gag-pol транслируются в виде протеинов. Эти протеины далее подвергаются воздействию (процессингу) кодируемой вирусом протеазы(или протеиназы), что приводит к образованию ферментов вируса и структурных протеинов ядра вируса. В основном протеины-предшественники гена gag процессируются в протеины ядра, а протеины-предшественники гена ро 1 процессируются в ферменты вируса, например в обратную транскриптазу и протеазу ретровируса. Было установлено, что правильный процессинг протеинов-предшественников протеазой ретровируса необходим для сборки инфекционных вирионов. Например, было подтверждено, что мутации "сдвига рамки" в протеазной области гена ро 1 ВИЧ препятствуют процессингу протеина-предшественника гена gag. Также было подтверждено, что сайтнаправленный мутагенез остатка аспарагиновой кислоты в активном сайте протеазы ВИЧ предотвращает процессинг протеина-предшественника гена gag. Таким образом, были предприняты попытки ингибировать репликацию вируса путем ингибирования активности протеаз ретровирусов. Ингибирование протеазы ретровируса обычно включает использование переходной миметической фазы, при этом протеаза ретровируса подвергается действию миметического соединения, которое конкурентно по отношению к протеинам gag и gag-pol связывается(обычно обратимым образом) с ферментом, тем самым ингибируя специфический процессинг структурных протеинов и высвобождение самой протеазы ретровируса. Таким образом, может быть осуществлено эффективное ингибирование репликационных протеаз ретровируса. 2 Специально для ингибирования протеаз, в частности для ингибирования протеазы ВИЧ,было предложено несколько классов соединений. В международных заявках WO 92/08701,WO 93/23368, WO 93/23379, WO 94/04493, WO 94/10136 и WO 94/14793 (каждая из которых полностью включена в настоящее описание в качестве ссылки) описаны, например, изостеры сульфонилалканоиламиногидроксиэтиламина,сульфонилалканоиламиногидроксиэтилмочевины,сульфонилалканоиламиногидроксиэтилсульфонамида и сульфонилалканоиламиногидроксиэтиламиносульфонамида, включающие ингибиторы протеазы ретровируса. См., например, ЕР 0346847; ЕР 0342541; Roberts и др.,"Rational Design of Peptide-Based Proteinase Inhibitors, "Science 248, 358 (1990); и Erickson и др., "Design Activity, and 2,8Crystal StructureWO 94/04491, WO 94/04492, WO 94/05639 и в заявке на патент США 08/294468, поданной 23 августа 1994 г. (каждый документ полностью включен в настоящее описание в качестве ссылки) описаны ингибиторы протеазы ретровируса,включающие изостеры гидроксиэтиламина,гидроксиэтилмочевины или гидроксиэтилсульфонамида. Известны несколько классов соединений,пригодных для использования в качестве ингибиторов протеолитического фермента ренина. См., например, патент США 4599198; патент Великобритании 2184730; патент Великобритании 2209752; ЕР 0264795; патент Великобритании 2200115 и U.S. Sir H725. Среди этих публикаций в патенте Великобритании 2200115, патенте Великобритании 2209752, ЕР 0264795,U.S. Sir H725 и в патенте США 4599198 описаны ингибиторы ренина из класса уреидосодержащих гидроксиэтиламинов. В ЕР 0468641 описаны ингибиторы ренина и промежуточные продукты для получения ингибиторов, которые включают сульфонамидсодержащие соединения из класса гидроксиэтиламинов, такие как 3(трет-бутоксикарбонил)аминоциклогексил-1(фенилсульфонил)амино-2(5)-бутанол. В патенте Великобритании 2200115 также описаны ингибиторы ренина из класса сульфамоилсодержащих гидроксиэтиламинов, а в ЕР 0264795 описаны некоторые ингибиторы ренина из класса сульфонамид содержащих гидроксиэтиламинов. Однако известно, что хотя протеазы ренина и ВИЧ обе и классифицируются как аспартильные протеазы, обычно нельзя предсказать, что соединения, эффективные в качестве ингибиторов ренина, будут эффективными ингибиторами и для протеазы ВИЧ. Краткое описание изобретения Настоящее изобретение относится к определенным соединениям-ингибиторам протеазы ретровируса, их аналогам и фармацевтически 3 приемлемым солям, сложным эфирам и пролекарствам. Соединения по изобретению характеризуются как соединения-ингибиторы из класса сульфонилалканоиламиногидроксиэтиламиносульфонамидов. Соединения по изобретению преимущественно ингибируют протеазы ретровирусов, такие как протеаза вируса иммунодефицита человека (ВИЧ). Таким образом, настоящее изобретение также включает фармацевтические композиции, способы ингибирования протеаз ретровирусов и способы лечения или профилактики ретровирусной инфекции, такой как ВИЧ-инфекция. Изобретение также включает способы получения таких соединений, а также промежуточные соединения, используемые в этих способах. Подробное описание изобретения Настоящее изобретение относится к ингибирующему протеазу ретровируса соединению формулы или к его фармацевтически приемлемой соли,пролекарству или сложному эфиру, где символыn и t каждый независимо друг от друга равны 0, 1 или 2; предпочтительно n равно 1 и t равно 1 или 2;-СН 2S(О)2 СН 3; предпочтительно R1 обозначает водород,алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода, гидроксиалкил с 1-3 атомами углерода,алкоксиалкил, состоящий из алкила с 1-3 атомами и алкокси с 1-3 атомами углерода, цианоалкил, содержащий алкил с 1-3 атомами углерода,-CH2CONH2,-CH2CH2CONH2,-CH2S(O)2NH2, -СН 2SСН 3, -СН 2S(O)СН 3 или-СН 2S(О)2 СН 3; более предпочтительно R1 обозначает водород, алкил с 1-3 атомами углерода,алкенил с 2-3 атомами углерода, алкинил с 2-3 атомами углерода или цианметил; еще более предпочтительно R1 обозначает водород, метил,этил или цианометил; и еще более предпочтительно R1 обозначает метил или этил; и наиболее предпочтительно R1 обозначает метил; 4 кольцо; более предпочтительно R2 обозначает алкил с 3-5 атомами углерода, арилметил, алкилтиоалкил, содержащий алкил с 1-3 атомами углерода, арилтиометил или циклоалкилметил,содержащий 5-6-членное углеводородное кольцо; еще более предпочтительно R2 обозначает изобутил, н-бутил, CH3SCH2CH2-, бензил, фенилтиометил,(2-нафтилтио)метил,4 метоксифенилметил, 4-гидроксифенилметил, 4 фторфенилметил или циклогексилметил; и еще более предпочтительно R2 обозначает бензил, 4 фторфенилметил или циклогексилметил; наиболее предпочтительно R2 обозначает бензил;R3 обозначает алкил, циклоалкил или циклоалкилалкил; предпочтительно R3 обозначает алкил с 1-5 атомами углерода, 5-8-членный циклоалкил или 3-6-членный циклоалкилметил; более предпочтительно R3 обозначает пропил,изоамил, изобутил, бутил, циклопентилметил,циклогексилметил, циклогексил или циклогептил; наиболее предпочтительно R3 обозначает изобутил или циклопентилметил;R4 обозначает гетероарил или гетероцикл; предпочтительно R4 обозначает сконденсированный с бензольным ядром 5-6-членный гетероарил или сконденсированный с бензольным ядром 5-6-членный гетероцикл; или R обозначает группу формулы где А и В каждый независимо друг от друга обозначает О, S, SO или SO2; предпочтительно А и В каждый обозначает О;R6 и R7 каждый независимо друг от друга обозначает фтор или хлор; и предпочтительно R6 и R7 каждый обозначает фтор; илиN,N-дизамещенный аминоалкил, где указанные заместители представляют собой алкил или аралкил, карбоксиалкил, алкоксикарбонилалкил,цианоалкил или гидроксиалкил; предпочтительно R20 обозначает водород, алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода, аралкил, содержащий алкил с 1-5 атомами углерода, гетероаралкил, состоящий из 5-6-членного кольца и алкила с 1-5 атомами углерода, гетероциклоалкил, состоящий из 5-6-членного кольца и алкила с 1-5 атомами углерода, аминоалкил с 2-5 атомами углерода, N-монозамещенный или N,Nдизамещенный аминоалкил, содержащий алкил с 2-5 атомами углерода, где указанные заместители представляют собой алкил с 1-3 атомами углерода, аралкил, содержащий алкил с 1-3 атомами углерода, карбоксиалкил с 1-5 атомами углерода, алкоксикарбонилалкил, содержащий алкил с 1-5 атомами углерода, цианоалкил с 1-5 атомами углерода или гидроксиалкил с 2-5 атомами углерода; более предпочтительно R20 обозначает водород, алкил с 1-5 атомами углерода,фенилалкил, содержащий алкил с 1-3 атомами углерода, гетероциклоалкил, состоящий из 5-6 членного кольца и алкила с 1-3 атомами углерода, или N-монозамещенный или N,Nдизамещенный аминоалкил с 2-3 атомами углерода, где указанные заместители представляют собой алкил с 1-3 атомами углерода; и наиболее предпочтительно R20 обозначает водород, метил, этил, пропил, изопропил, изобутил, бензил,2-(1-пирролидинил)этил,2-(1-пиперидинил) этил, 2-(1-пиперазинил)этил, 2-(4-метилпиперазин-1-ил)этил, 2-(1-морфолинил)этил, 2-(1 тиаморфолинил)этил или 2-(N,N-диметиламино) этил;R21 обозначает водород или алкил; предпочтительно R21 обозначает водород или алкил с 1-3 атомами углерода; более предпочтительноR21 обозначает водород или метил; и наиболее предпочтительно R21 обозначает водород; или группа формулы -NR20R21 обозначает гетероцикл; предпочтительно группа формулы-NR20R21 обозначает 5-6-членный гетероцикл; более предпочтительно группа формулыR22 обозначает алкил или R20R21N-алкил; предпочтительно R22 обозначает алкил илиR20R21N-алкил, где алкил имеет 1-3 атома углерода; и более предпочтительно R22 обозначает алкил с 1-3 атомами углерода; иR5 обозначает алкил, алкенил, алкинил или аралкил; предпочтительно R5 обозначает алкил с 1-5 атомами углерода, алкенил с 2-5 атомами углерода, алкинил с 2-5 атомами углерода или арил, замещенный алкилом с 1-5 атомами углерода; более предпочтительно R5 обозначает алкил с 1-5 атомами углерода, алкенил с 3-4 атомами углерода, алкинил с 3-4 атомами углерода или арил, замещенный алкилом с 1-4 атомами углерода; еще более предпочтительно R5 обозначает алкил с 1-5 атомами углерода или фенил, замещенный алкилом с 2-4 атомами углерода; и наиболее предпочтительно R5 обозначает метил, этил, пропил, изопропил или 2 фенилэтил. Абсолютная стереохимическая конфигурация атома углерода -СН(ОН)-группы предпочтительно представляет собой (R)-форму. Абсолютная стереохимическая конфигурация атома углерода -CH(R1)- группы предпочтительно представляет собой (S) -форму. Абсолютная стереохимическая конфигурация атома углерода -CH(R2)-группы предпочтительно представляет собой (S)-форму. 7 Семейством соединений, представляющих особенный интерес среди соединений формулы или их фармацевтически приемлемые соли,пролекарства или сложные эфиры, где t, R1, R2,R3, R4 и R5 имеют значения, указанные выше. Семейством соединений, представляющих дополнительный интерес среди соединений формулы II, являются соединения формулы или их фармацевтически приемлемые соли,пролекарства или сложные эфиры, где t, R1, R2,R3, R4 и R5 имеют значения, указанные выше. Наиболее предпочтительное семейство соединений формулы III образуют соединения или их фармацевтически приемлемые соли, пролекарства или сложные эфиры, гдеR1 обозначает метил или этил;R5 обозначает метил, этил, пропил, изопропил или 2-фенилэтил. Представляющие интерес соединения включают следующие:(фенилметил)пропил]-2S-метил-3-(метилсульфонил)пропанамид. В контексте данного описания понятие"алкил" индивидуально или в комбинации обозначает алкильный радикал с прямой или разветвленной цепью, содержащий предпочтительно от 1 до 8 атомов углерода, более предпочтительно от 1 до 5 атомов углерода, наиболее предпочтительно 1-3 атома углерода. Примеры таких радикалов включают метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, пентил, изоамил, гексил, октил и т.п. Понятие "гидроксиалкил" индивидуально или в комбинации обозначает алкильный радикал, как определено выше, где, по крайней мере, один атом водорода замещен гидроксильной группой, предпочтительно 1-3 атома водорода замещены гидроксильными группами, более предпочтительно 1-2 атома водорода замещены гидроксильными группами и наиболее предпочтительно один атом водорода замещен гидроксильной группой. Понятие "алкенил" индивидуально или в комбинации обозначает углеводородный радикал с прямой или разветвленной цепью, имеющий одну или более двойных связей и содержащий предпочтительно от 2 до 8 атомов углерода, более предпочтительно от 2 до 5 атомов углерода, наиболее предпочтительно от 2 до 3 атомов углерода. Примеры соответствующих алкенильных радикалов включают этенил, пропенил, 2-метилпропенил, 1,4 бутадиенил и т.п. Понятие "алкинил" индивидуально или в комбинации обозначает углеводородный радикал с прямой или разветвленной цепью, имеющий одну или более тройных связей и содержащий предпочтительно от 2 до 8 атомов углерода, более предпочтительно от 2 до 5 атомов углерода, наиболее предпочтительно от 2 до 3 атомов углерода. Примеры алкинильных радикалов включают этинил, пропинил(пропаргил), бутинил и т.п. Понятие "алкокси" индивидуально или в комбинации обозначает алкилэфирный радикал, где понятие "алкил" имеет значения, указанные выше. Примеры соответствующих алкилэфирных радикалов включают метокси, этокси, н-пропокси, изопропокси,н-бутокси, изобутокси, втор-бутокси, третбутокси и т.п. Понятие "циклоалкил" индивидуально или в комбинации обозначает насыщенный или частично насыщенный моно-, би- или трициклический алкильный радикал, в котором каждый циклический фрагмент предпочтительно содержит в кольце от 3 до 8 атомов углерода,более предпочтительно от 3 до 7 и наиболее предпочтительно от 5 до 6 атомов углерода и который необязательно может представлять собой сконденсированную с бензогруппой кольцевую систему, которая необязательно замещена аналогично тому, как это имеет место по отношению к арилу. Примеры таких циклоалкильных радикалов включают циклопропил,циклобутил, циклопентил, циклогексил, цикло 9 гептил,октагидронафтил,2,3-дигидро-1Hинденил, адамантил и т.п. Предполагается, что понятия "бициклический" и "трициклический",используемые в данном описании, включают как конденсированные кольцевые системы, такие как нафтил и -карболинил, так и связанные кольцевые системы, такие, как бифенил, фенилпиридил, нафтил и дифенилпиперазинил. Понятие "циклоалкилалкил" обозначает алкильный радикал, как определено выше, который замещен циклоалкильным радикалом, как определено выше. Примеры таких циклоалкилалкильных радикалов включают циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил,1-циклопентилэтил,1-циклогексилэтил,2-циклопентилэтил,2-циклогексилэтил, циклобутилпропил, циклопентилпропил, циклогексилбутил и т.п. Понятие "бензо" индивидуально или в комбинации обозначает двухвалентный радикал С 6 Н 4=, производный от бензола. Понятие "арил" индивидуально или в комбинации обозначает фенильный или нафтильный радикал, необязательно замещенный одним или несколькими заместителями, выбранными из группы, включающей алкил, алкокси, галоген, гидрокси, амино, нитро, циано,галоидалкил, карбокси, алкоксикарбонил, циклоалкил, гетероцикло, алканоиламино, амидо,амидино,алкоксикарбониламино,Nалкиламидино, алкиламино, диалкиламино, Nалкиламидо, N,N-диалкиламидо, аралкоксикарбониламино, алкилтио, алкилсульфинил, алкилсульфонил и т.п. Примерами арильных радикалов являются фенил,паратолил,4 метоксифенил, 4-(трет-бутокси)фенил, 3-метил 4-метоксифенил, 4-СF3-фенил, 4-фторфенил, 4 хлорфенил, 3-нитрофенил, 3-аминофенил, 3 ацетамидофенил, 4-ацетамидофенил, 2-метил-3 ацетамидофенил, 2-метил-3-аминофенил, 3 метил-4-аминофенил,2-амино-3-метилфенил,2,4-диметил-3-аминофенил, 4-гидроксифенил, 3 метил-4-гидроксифенил, 1-нафтил, 2-нафтил, 3 амино-1-нафтил, 2-метил-3-амино-1-нафтил, 6 амино-2-нафтил, 4,6-диметокси-2-нафтил, пиперазинилфенил и т.п. Понятия "аралкил" и "аралкокси" индивидуально или в комбинации обозначают алкил или алкокси, как определено выше, в котором, по крайней мере, один атом водорода замещен арильным радикалом, как определено выше, например, бензил, бензилокси, 2-фенилэтил, дибензилметил, гидроксифенилметил, метилфенилметил, дифенилметил,дифенилметокси, 4-метоксифенилметокси и т.п. Понятие "аралкоксикарбонил" индивидуально или в комбинации обозначает радикал формулы аралкил-О-С(О)-, в котором понятие "аралкил" имеет указанное выше значение. Примерами аралкоксикарбонильного радикала являются бензилоксикарбонил и 4-метоксифенилметоксикарбонил. Понятие "арилокси" обозначает радикал формулы арил-O-, в котором понятие "арил" имеет указанное выше значение. Понятие "ал 000533 10 каноил" индивидуально или в комбинации обозначает ацильный радикал, производный от алканкарбоновой кислоты, примеры которого включают ацетил, пропионил, бутирил, валерил,4-метилвалерил и т.п. Понятие "циклоалкилкарбонил" обозначает ацильный радикал формулы циклоалкил-С(О)-, в котором понятие"циклоалкил" имеет указанные выше значения,например, циклопропилкарбонил, циклогексилкарбонил, адамантилкарбонил, 1,2,3,4-тетрагидро-2-нафтоил, 2-ацетамидо-1,2,3,4-тетрагидро 2-нафтоил,1-гидрокси-1,2,3,4-тетрагидро-6 нафтоил и т.п. Понятие "аралканоил" обозначает ацильный радикал, производный от замещенной арилом алканкарбоновой кислоты, например,фенилацетил, 3-фенилпропионил(гидроциннамоил), 4-фенилбутирил, (2-нафтил) ацетил, 4 хлоргидроциннамоил, 4-аминогидроциннамоил,4-метоксигидроциннамоил и т.п. Понятие "ароил" обозначает ацильный радикал, производный арилкарбоновой кислоты, где "арил" имеет указанные выше значения. Примеры таких ароильных радикалов включают замещенный и незамещенный бензоил или нафтоил, например,бензоил, 4-хлорбензоил, 4-карбоксибензоил, 4(бензилоксикарбонил)бензоил, 1-нафтоил, 2 нафтоил, 6-карбокси-2-нафтоил, 6-(бензилоксикарбонил)-2-нафтоил, 3-бензилокси-2-нафтоил,3-гидрокси-2-нафтоил,3-(бензилоксиформамидо)-2-нафтоил и т.п. Понятие "гетероцикло" индивидуально или в комбинации обозначает насыщенный или частично ненасыщенный моно-, би- или трициклический гетероциклический радикал, содержащий в кольце, по крайней мере, один, предпочтительно 1-4, более предпочтительно 1-2 атома азота, кислорода или серы и имеющий предпочтительно 3-8 членов в каждом кольце, более предпочтительно 3-7 и наиболее более предпочтильно 5-6 членов. Подразумевается, что понятие "гетероцикло" включает сульфоны, сульфоксиды, N-оксиды третичного азота в кольце и карбоциклоконденсированные и бензоконденсированные кольцевые системы. В таких гетероциклических радикалах,по крайней мере, один, предпочтительно 1-4,более предпочтительно 1-2 атома углерода необязательно могут быть замещены галогеном,алкилом, алкокси-, гидрокси-, оксогруппой,арилом, аралкилом, гетероарилом, гетероаралкилом, амидино-, N-алкиламидино-, алкоксикарбониламино-, алкилсульфониламиногруппой и т.п., и/или вторичный атом азота (т.е. -NH-) может быть замещен гидроксигруппой, алкилом, аралкоксикарбонилом, алканоилом, гетероаралкилом, фенилом или фенилалкилом,и/или третичный атом азота (т.е. =N-) может быть замещен оксидогруппой. "Гетероциклоалкил" обозначает алкильный радикал, как определено выше, в котором, по крайней мере, один атом водорода замещен гетероциклическим радикалом, как определено выше, например, пирролидинилметил, тетрагидротиенилметил, пи 11 ридилметил и т.п. Понятие "гетероарил" индивидуально или в комбинации обозначает ароматический гетероциклический радикал, как определено выше, который необязательно замещен аналогично тому, как это определено выше по отношению к арилу и гетероцикло. Примерами таких гетероциклических и гетероарильных групп являются пирролидинил, пиперидинил,пиперазинил, морфолинил, тиаморфолинил,пирролил, имидазолил (например, имидазол-4 ил, 1-бензилоксикарбонилимидазол-4-ил и т.д.),пиразолил,пиридил(например, 1-изохинолинил, 3-изохинолинил и т.д.), тетрагидрохинолинил (например, 1,2,3,4 тетрагидро-2-хинолил и т.д.),1,2,3,4 тетрагидроизохинолинил (например, 1,2,3,4 тетрагидро-1-оксоизохинолинил и т.д.), хиноксалинил, -карболинил, 2-бензофуранкарбонил,1-,2-,4- или 5-бензимидазолил, метилендиоксифен-4-ил, метилендиоксифен-5-ил, этилендиоксифенил, бензотиазолил, бензопиранил, бензофурил, 2,3-дигидробензофурил, бензоксазолил,тиофенил и т.п. Понятие "гетероаралкил" индивидуально или в комбинации обозначает алкил,как определено выше, в котором, по крайней мере, один атом водорода замещен гетероарильным радикалом, как определено выше, например, бензофурилметил, 3-фурилпропил, хинолинилметил, 2-тиенилэтил, пиридилметил, 2 пирролилпропил, 1-имидазолилэтил и т.п. Понятие "циклоалкилалкоксикарбонил" обозначает ацильную группу, производную от циклоалкилалкоксикарбоновой кислоты формулы циклоалкилалкил-O-СООН, где циклоалкилалкил имеет указанное выше значение. Понятие "арилоксиалканоил" обозначает ацильный радикал формулы арил-O-алканоил, где арил и алканоил имеют указанные выше значения. Понятие "гетероциклоалкоксикарбонил" обозначает ацильную группу, производную от гетероциклоалкилO-СООН, где гетероциклоалкил имеет указанное выше значение. Понятие "гетероциклоалканоил" обозначает ацильный радикал, производный от гетероциклоалкилкарбоновой кислоты,где гетероцикло имеет указанные выше значения. Понятие "гетероциклоалкоксикарбонил" обозначает ацильный радикал, производный от гетероциклоалкил-O-СООН, где гетероцикло имеет указанные выше значения. Понятие "гетероарилоксикарбонил" обозначает ацильный радикал, производный от карбоновой кислоты и представленный формулой гетероарил-OСООН, где гетероарил имеет указанные выше значения. Понятие "аминокарбонил" индивиду 000533 12 ально или в комбинации обозначает замещенную аминогруппой карбонильную (карбамоильную) группу, где аминогруппа может представлять собой первичную, вторичную или третичную аминогруппу, содержащую заместители,выбранные из алкила, арила, аралкила, циклоалкила, циклоалкилалкила и т.п. Понятие "аминоалканоил" обозначает ацильную группу, производную от алкилкарбоновой кислоты и замещенную аминогруппой, где аминогруппа может представлять собой первичную, вторичную или третичную аминогруппу, содержащую заместители, выбранные из алкила, арила, аралкила,циклоалкила, циклоалкилалкила и т.п. Понятие"галоген" обозначает фтор, хлор, бром или йод. Понятие "галоидалкил" обозначает алкил,имеющий указанные выше значения, где один или более атомов водорода замещены галогеном. Примеры таких галоидалкильных радикалов включают хлорметил, 1-бромэтил, фторметил,дифторметил,трифторметил,1,1,1 трифторэтил и т.п. Понятие "уходящая группа"(L или W) обычно обозначает группу, легко замещаемую нуклеофильной группой, такой как амин, тиол или спиртовая нуклеофильная группа. Такие уходящие группы хорошо известны в данной области техники. Примеры таких уходящих групп включают, но не ограничены ими,N-гидроксисукцинимид, N-гидроксибензотриазол, галогениды, трифталаты, тозилаты и т.п. Предпочтительные уходящие группы при необходимости указаны в настоящем описании. Способы получения соединений формулыI описаны ниже. Следует отметить, что общая методика относится к получению соединений,имеющих определенную стереохимическую конфигурацию, например, таких, в которых абсолютная стереохимическая конфигурация относительно гидроксильной группы обозначена как (R), однако такие методы в целом применимы и к соединениям противоположной конфигурации, например таким, у которых стереохимическая конфигурация относительно гидроксильной группы обозначена как (S). Кроме того, соединения, имеющие (R)-стереохимическую конфигурацию, могут использоваться для получения соединений, имеющих (S)стереохимическую конфигурацию. Например,соединение, имеющие (R)-стереохимическую конфигурацию, может быть преобразовано в соединение, имеющее (S)-стереохимическую конфигурацию, хорошо известными способами. Получение соединений формулы I Соединения по настоящему изобретению,представленные выше формулой I, могут быть получены с использованием следующих общих способов, схематически показанных на схемах I и II. а) введение защитной группы; б) избирательное удаление защитной группы;N-защищенное хлоркетоновое производное аминокислоты формулы 14 где Р обозначает аминозащитную группу и R2 имеет указанные выше значения, восстанавливают до соответствующего спирта, используя соответствующий восстановитель. Пригодные аминозащитные группы хорошо известны в данной области техники и включают карбобензоксигруппу, трет-бутоксикарбонил и т.п. Предпочтительной аминозащитной группой является карбобензоксигруппа. Предпочтительным Nзащищенным хлоркетоном являетсяNбензилоксикарбонил-L-фенилаланинхлорметилкетон. Предпочтительным восстановителем является борогидрид натрия. Реакцию восстановления проводят при температуре от -10 С до приблизительно 25 С, предпочтительно приблизительно при 0 С, в пригодной системе растворителей, такой как, например, тетрагидрофуран,и т.п. N-защищенные хлоркетоны являются коммерчески доступными, например, поставляются фирмой Bachem, Inc. Torrance, California. В альтернативном варианте хлоркетоны могут быть получены способом, описанным у S.J.Fittkau, J. Prakt. Chem., 315, 1037 (1973), с последующим получением N-защищенных производных с использованием способов, хорошо известных в данной области техники. Галоидспирт может применяться непосредственно, как описано ниже, или же его предпочтительно подвергают взаимодействию преимущественно при комнатной температуре с пригодным основанием в соответствующей системе растворителей с получением где Р и R2 имеют указанные выше значения. Пригодные для получения аминоэпоксида системы растворителей включают этанол, метанол,изопропанол, тетрагидрофуран, диоксан и т.п., в том числе их смеси. Пригодные основания для получения эпоксида из восстановленного хлоркетона включают гидроксид калия, гидроксид натрия, трет-бутоксид калия, ДБУ и т.п. Предпочтительным основанием является гидроксид калия. В альтернативном варианте защищенный аминоэпоксид может быть получен по методам,описанным находящихся в процессе одновременного рассмотрения заявках PCT/US93/04804(WO 93/23388) и PCT/US94/12201 и заявке на патент США на имя заявителя по настоящей заявке, находящейся у патентного поверенного с номеромС-28 60 (каждая из этих публикаций полностью включена в настоящее описание в качестве ссылки), в которых представлены методы получения хирального эпоксида, хирального циангидрина, хирального амина и других хиральных промежуточных продуктов, которые могут использоваться для получения ингибито 15 ров протеазы ретровируса, при этом процесс начинают с DL-, D- или L-аминокислот, которые подвергают взаимодействию с соответствующей аминозащитной группой в пригодном растворителе, получая аминозащищенный эфир аминокислоты. Для получения ингибиторов по настоящему изобретению может быть использована, например, защищенная L-аминокислота следующей формулы где Р 3 обозначает карбоксизащитную группу,например, метил, этил, бензил, трет-бутил, 4 метоксифенилметил и т.п.; R2 имеет указанные выше значения и Р 1 и Р 2 и/или Р' независимо друг от друга выбирают из аминозащитных групп, которые включают, но не ограничены ими, аралкил, замещенный аралкил, циклоалкенилалкил и замещенный циклоалкенилалкил,аллил, замещенный аллил, ацил, алкоксикарбонил, аралкоксикарбонил и силил. Примеры аралкила включают, но не ограничены ими, бензил, орто-метилбензил, тритил и бензгидрил,который необязательно может быть замещен галогеном, С 1-С 8 алкилом, алкокси-, гидрокси-,нитрогруппой, алкиленом, амино-, алкиламино-,ациламиногруппой и ацилом, или их соли, такие как соли фосфония и аммония. Примеры арильных групп включают фенил, нафтил, инданил,антраценил, дуренил, 9-(9-фенилфлуоренил) и фенантренил, циклоалкенилалкил или замещенный циклоалкенилалкил, состоящий из С 6 С 10 циклоалкилов. Пригодные ацильные группы включают карбобензоксигруппу,третбутоксикарбонил, изобутоксикарбонил, бензоил, замещенный бензоил, бутирил, ацетил,трифторацетил, трихлорацетил, фталоил и т.п. Предпочтительно Р 1 и Р 2 независимо друг от друга выбирают из аралкила и замещенного аралкила. Более предпочтительно Р 1 и Р 2 каждый обозначает бензил. Кроме того, защитные группы Р 1 и/или Р 2 и/или Р' могут образовывать гетероциклическое кольцо с азотом, к которому они присоединены,например, 1,2-бис(метилен)бензол, фталимидил,сукцинимидил, малеимидил и т.п., причем эти гетероциклические группы дополнительно могут включать примыкающие арильные и циклоалкильные кольца. Кроме того, гетероциклические группы могут быть моно-, ди- или тризамещенными, как, например, нитрофталимидил. Понятие силил относится к атому кремния, необязательно замещенному одной или несколькими алкильной, арильной или аралкильной группами. Пригодные силильные защитные группы включают, но не ограничены ими, триметилсилил, триэтилсилил, триизопропилсилил, третбутилдиметилсилил, диметилфенилсилил, 1,2 000533 16 бис (диметилсилил) бензол, 1,2-бис (диметилсилил) этан и дифенилметилсилил. Путем силилирования аминных функций с получением моноили бисдисилиламина можно получать производные аминоспирта, аминокислоты, эфиров аминокислоты и амида аминокислоты. В случае аминокислот, эфиров аминокислот и амидов аминокислот восстановление карбонильной функции позволяет получить требуемый моноили биссилиловый аминоспирт. Силилирование аминоспирта может привести к получениюN,N,О-трисилилового производного. Удаление силильной функции из функции силилового эфира легко осуществляют обработкой, например, таким реагентом, как гидроксид металла или фторид аммония, или на отдельной стадии реакции либо in situ в процессе получения аминоальдегидного реагента. Пригодными силилирующими агентами являются, например, триметилсилил хлорид, трет-бутилдиметилсилилхлорид, фенилдиметилсилилхлорид, дифенилметилсилилхлорид или продукты их сочетания с имидазолом или ДМФ. Способы силилирования аминов и удаления силильных защитных групп хорошо известны специалистам в данной области техники. Способы получения этих аминовых производных из соответствующих аминокислот,амидов аминокислот или эфиров аминокислот хорошо известны специалистам в области органической химии, включающей химию аминокислот/эфиров аминокислот или аминоспиртов. Затем аминозащищенный эфирLаминокислоты восстанавливают до соответствующего спирта. Например, аминозащищенный эфир L-аминокислоты может быть восстановлен гидридом диизобутилалюминия при -78 С в пригодном растворителе, таком как толуол. Предпочтительные восстановители включают алюмогидрид лития, борогидрид лития, борогидрид натрия, боран, три-трет-бутоксиалюмогидрид лития, комплекс боран/ТГФ. Наиболее предпочтительным восстановителем является гидрид диизобутилалюминия (ДИБАЛ-Г) в толуоле. Образовавшийся спирт затем превращают, например, путем окисления по Сверну, в соответствующий альдегид формулы где Р 1, Р 2 и R2 имеют указанные выше значения. Например, раствор спирта в дихлорметане добавляют к охлажденному (от -75 до -68 С) раствору оксалилхлорида в дихлорметане и ДМСО в дихлорметане и перемешивают в течение 35 мин. Пригодные для применения окислители включают, например, комплекс триоксид серыпиридин и ДМСО, оксалилхлорид и ДМСО,ацетилхлорид или ангидрид и ДМСО, трифторацетилхлорид или ангидрид и ДМСО, метансульфонилхлорид и ДМСО или тетрагидротиа 17 фен-8-оксид, толуолсульфонилбромид и ДМСО,трифторметансульфониловый ангидрид (трифлиновый ангидрид) и ДМСО, пентахлорид фосфора и ДМСО, диметилфосфорилхлорид и ДМСО и изобутилхлорформиат и ДМСО. Условия окисления описаны у Reetz и др. [Angew.Ed. Engl., 26, стр. 1141, (1987)], в которых применяли оксалилхлорид и ДМСО при -78 С. Предпочтительный способ окисления,описанный в настоящем изобретении, основан на использовании комплекса триоксид серыпиридин, триэтиламина и ДМСО при комнатной температуре. Эта система позволяет получить очень высокий выход требуемого хирального защищенного аминоальдегида, который не нуждается в очистке для дальнейшего применения,т.е. не требует очистки килограммовых количеств промежуточных продуктов с помощью хроматографии, что делает менее опасными крупномасштабные операции. Проведение реакции при комнатной температуре также устраняет необходимость использования низкотемпературного реактора, что делает процесс более пригодным для коммерческого производства. Реакция может быть проведена в атмосфере инертного газа, такого как азот или аргон,или нормального либо сухого воздуха при атмосферном давлении или в закрытом реакционном сосуде при избыточном давлении. Предпочтительной является атмосфера азота. Альтернативные аминные основания включают, например, трибутиламин, триизопропиламин, Nметилпиперидин, N-метилморфолин, азабициклононан,диизопропилэтиламин,2,2,6,6 тетраметилпиперидин,N,N-диметиламинопиридин или смеси этих оснований. Предпочтительным основанием является триэтиламин. Альтернативами чистому ДМСО в качестве растворителя являются смеси ДМСО с непротонными или галогенированными растворителями,такими как тетрагидрофуран, этилацетат, толуол, ксилол, дихлорметан, этилендихлорид и т.п. Биполярные апротонные сорастворители включают ацетонитрил, диметилформамид, диметилацетамид, ацетамид, тетраметилмочевину и ее циклический аналог,N-метилпирролидон,сульфолан и т.п. Помимо N,N-дибензилфенилаланинола в качестве предшественника альдегидов для получения соответствующих Nмонозамещенного [либо Р 1, либо Р 2 обозначает Н] или N,N-дизамещенного альдегида могут применяться указанные выше производные фенилаланинола. Кроме того, для получения альдегидов может быть осуществлено гидридное восстановление амида или эфирного производного соответствующего защищенного по атому азота с помощью бензильной (или другой пригодной) защитной группы фенилаланина, замещенного фенилаланина или циклоалкильного аналога производного фенилаланина. Гидридный пере 000533 18 нос представляет собой дополнительный метод синтеза альдегидов в условиях, при которых исключены конденсации альдегида, ср. с окислением по Оппенауэру. В этом процессе альдегиды также могут быть получены способами восстановления защищенного фенилаланина и аналогов фенилаланина или их амидных или эфирных производных, например, с помощью амальгамы натрия с НСl в этаноле или лития, натрия, калия либо кальция в аммиаке. Температура реакции может составлять от приблизительно -20 С до приблизительно 45 С и предпочтительно от приблизительно 5 С до приблизительно 25 С. Два дополнительных способа получения защищенного по азоту альдегида включают окисление соответствующего спирта хлорной известью в присутствии каталитического количества свободного радикала 2,2,6,6-тетраметил-1-пиридилокси. Во втором способе окисление спирта до альдегида осуществляют с помощью каталитического количества перрутената тетрапропиламмония в присутствии N-метилморфолин-N-оксида. В альтернативном варианте хлорангидридное производное защищенного фенилаланина или производного фенилаланина, как описано выше, может быть восстановлено с помощью водорода и катализатора, такого, как Pd на карбонате бария или сульфате бария, с или без добавления смягчающего катализатор агента, такого, как сера или тиол (восстановление по Роземунду). Полученный в результате окисления по Сверну альдегид затем подвергают взаимодействию с таким реагентом, как галоидметиллитий, который получают in situ при взаимодействии алкиллитиевого или ариллитиевого соединения с дигалоидметаном, представленным формулой Х 1CН 2 Х 2, где X1 и X2 независимо друг от друга обозначают I, Вr или Сl. Например, раствор альдегида и хлорйодметана в ТГФ охлаждают до -78 С и добавляют раствор нбутиллития в гексане. Образовавшийся продукт представляет собой смесь диастереомеров соответствующих аминозащищенных эпоксидов формул: Диастереомеры могут быть разделены, например, хроматографией или в альтернативном варианте диастереомерные продукты могут быть разделены после взаимодействия на последующих стадиях. Вместо L-аминокислоты может быть использована D-аминокислота для получения соединения с (S)-стереохимической конфигурацией относительноатома углерода,связанного с R2. Добавление хлорметиллития или бромметиллития к хиральному аминоальдегиду являет 19 ся высоко селективным по отношению к диастереомерам. Предпочтительно хлорметиллитий или бромметиллитий получают in situ при взаимодействии дигалоидметана и н-бутиллития. Пригодные метиленирующие галоидметаны включают хлорйодметан, бромхлорметан, дибром метан, дийодметан, бромфторметан и т.п. Сложный эфир сульфокислоты и продукта присоединения, например, хлористого бромида к формальдегиду, также представляет собой метиленирующий агент. Тетрагидрофуран является предпочтительным растворителем, однако могут использоваться другие растворители, такие как толуол, диметоксиэтан, этилендихлорид,метиленхлорид, как в виде чистых растворителей, так и в виде их смесей. Биполярные апротонные растворители, такие как ацетонитрил,ДМФ, N-метилпирролидон, пригодны в качестве растворителей или в качестве части смеси растворителей. Реакцию можно проводить в атмосфере инертного газа, такого как азот или аргон. н-Бутиллитий может быть заменен на другие металлорганические реагенты, такие как метиллитий, трет-бутилитий, втор-бутиллитий,фениллитий, фенилнатрий и т.п. Реакцию можно проводить при температурах от приблизительно -80 до 0 С, однако предпочтительно от приблизительно -80 до -20 С. Наиболее предпочтительные температуры реакции находятся в диапазоне от -40 до -15 С. Реагенты могут быть добавлены по отдельности, но в определенных условиях предпочтительны совместные добавления. Предпочтительным давлением при проведении реакции является атмосферное, однако в определенных условиях, таких как повышенная влажность окружающей среды, целесообразно повышенное давление. Альтернативные способы превращения в эпоксиды по настоящему изобретению включают замену на другие виды несущих заряд предшественников метиленирования с последующей их обработкой основанием с получением аналогичного аниона. Примеры таких предшественников включают тозилат или трифталат триметилсульфоксония, галогенид тетраметиламмония, галогенид метилдифенилсульфоксония, где галогенид представляет собой хлорид, бромид или йодид. Превращение альдегидов по настоящему изобретению в их эпоксидное производное также может быть осуществлено в несколько стадий. Например, добавление аниона тиоанизола,полученного, например, из бутил- или ариллитиевого реагента, к защищенному аминоальдегиду и окисление полученного защищенного аминосульфидного спирта хорошо известными окислителями, такими как перекись водорода,трет-бутилгипохлорит, хлорная известь или перйодат натрия, приводит к получению сульфоксида. Алкилирование сульфоксида, например, метилйодидом или бромидом, метилтозилатом, метилмезилатом, метилтрифлатом, этил 000533 20 бромидом, изопропилбромидом, бензилхлоридом или т.п. осуществляют, например, в присутствии органического или неорганического основания. В альтернативном варианте защищенный аминосульфидный спирт может быть алкилирован, например, с помощью указанных выше алкилирующих агентов с получением солей сульфония, которые затем превращают в требуемые эпоксиды с помощью трет-амина или неорганических оснований. Требуемые эпоксиды образуются с использованием наиболее предпочтительных условий,избирательно по отношению к диастереомерам в соотношении, по крайней мере, приблизительно 85:15 (соотношение S:R). Продукт может быть очищен хроматографией с получением диастереомерно- и энантиомерно чистого продукта, однако более часто его используют непосредственно без очистки для получения ингибиторов протеазы ретровируса. Описанный выше способ применим как для смесей оптических изомеров, так и для разделенных соединений. Если требуется конкретный оптический изомер,то он может быть выделен путем соответствующего выбора исходных продуктов, например, L-фенилаланина, D-фенилаланина, Lфенилаланинола, D-фенилаланинола, D-гексагидрофенилаланинола и т.п., или же разделение можно проводить на промежуточных или конечной стадиях. Для образования солей, сложных эфиров или амидов соединений по настоящему изобретению могут быть использованы хиральные вспомогательные вещества, такие как один или два эквивалента камфорсульфокислоты, лимонной кислоты, камфарной кислоты, 2-метоксифенилуксусной кислоты и т.п. Эти соединения или производные могут быть подвергнуты кристаллизации или выделены хроматографическим путем с использованием либо хиральной, либо нехиральной колонки, как это известно специалистам в данной области техники. Затем аминоэпоксиды подвергают взаимодействию в пригодной системе растворителей с равным количеством или предпочтительно с избытком соответствующего амина формулыR3NH2, где R3 обозначает водород или имеет указанные выше значения. Реакцию можно проводить в широком диапазоне температур, например, от приблизительно 10 С до приблизительно 100 С, но предпочтительно, хотя это не является необходимым, проводить ее при температуре, при которой начинается кипение с обратным холодильником растворителя. Пригодные системы растворителей включают протонные, апротонные и биполярные органические растворители, например такие, в которых растворителем является спирт, такой как метанол, этанол, изопропанол и т.п., простые эфиры,такие как тетрагидрофуран, диоксан и т.п., и толуол, N,N-диметилформамид, диметилсульфоксид и их смеси. Предпочтительным раство 21 рителем является изопропанол. Полученный продукт является производным 3-(Nзащищенный амин)-3-(R2)-1-(NHR3)-пропан-2 ола (в настоящем описании названный аминоспиртом), которое может быть представлено формулами: где Р, Р 1, Р 2, R2 и R3 имеют указанные выше значения. В альтернативном варианте вместо аминоэпоксида может быть использован галоидспирт. Затем указанный выше спирт подвергают взаимодействию в соответствующем растворителе с сульфонилхлоридом R4SO2Cl, сульфонилбромидом R4SO2Br или с соответствующим сульфонилангидридом, предпочтительно в присутствии акцептора кислоты. Пригодные для осуществления реакции растворители включают метиленхлорид, тетрагидрофуран и т.д. Пригодные акцепторы кислоты включают триэтиламин,пиридин и т.п. В зависимости от используемого эпоксида образовавшееся сульфонамидное производное может быть представлено формулами где Р, Р 1, Р 2, R2, R3 и R4 имеют указанные выше значения. Эти промежуточные продукты пригодны для получения соединений-ингибиторов по настоящему изобретению. В альтернативном варианте защищенный аминоспирт, полученный при разрыве эпоксидной связи, далее может быть защищен на введенной вновь аминогруппе с помощью защитной группы Р', которая не удаляется при удалении аминозащитных групп Р или Р 1 и Р 2, т.е. Р' представляет собой избирательно удаляемую защитную группу. Специалист в данной области техники может выбрать соответствующие комбинации Р', Р, Р 1 и Р 2. Например, пригодными комбинациями являются следующие: Р обозначает Cbz и Р' обозначает ВОС; Р' обозначает Cbz и Р обозначает ВОС; Р 1 обозначает Cbz, Р 2 обозначает бензил и Р' обозначает ВОС; и Р 1 и Р 2 обозначают бензил и Р' обозначает ВОС. Образовавшееся соединение, представленное формулой может быть подвергнуто остальным стадиям синтеза с получением соединения формулы где n, t, Р', R1, R2, R3 и R5 имеют указанные выше значения. Указанные выше остальные стадии синтеза могут быть проведены при необходимости либо путем добавления требуемых фрагментов или групп по отдельности, либо в предварительно созданную молекулу встраивают более чем по одному фрагменту или группе в течение одной стадии. Первый подход представляет собой метод последовательного синтеза, а последний представляет собой конвергентный метод синтеза. На этой стадии также возможны трансформации синтеза. Защитную группу Р' затем избирательно удаляют и образовавшийся амин подвергают взаимодействию с сульфонилхлоридом R4SO2Cl, сульфонилбромидом R4SO2Br или с соответствующим сульфонилангидридом, предпочтительно в присутствии акцептора кислоты, с получением соединений по настоящему изобретению где n, t, Р', R1, R2, R3, R4 и R5 имеют указанные выше значения. Это избирательное удаление защитной группы и превращение в сульфонамид при необходимости может быть проведено либо в конце синтеза, либо на любой соответствующей промежуточной стадии. Примеры описаны на схеме II. Сульфонилгалогениды формулы R4SO2X могут быть получены взаимодействием соответствующего арила, гетероарила и сконденсированного с бензольным ядром гетероциклического реагента Гриньяра или литиевого реагента с сульфурилхлоридом или диоксидом серы с последующим окислением галогеном, предпочтительно хлором. Арил, гетероарил и сконденсированный с бензольным ядром гетероциклический реагент Гриньяра или литиевый реагент могут быть получены из соответствующих им галогенидов (таких, как хлор- или бромсодержащие соединения), которые являются коммерчески доступными или легко могут быть получены из коммерчески доступных исходных продуктов с использованием методов, известных в данной области техники. Кроме того, тиолы могут быть окислены до сульфонилхлоридов с использованием хлора в присутствии воды в тщательно контролируемых условиях. Кроме того, сульфоновые кислоты, такие,как арилсульфоновые кислоты, могут быть превращены в сульфонилгалогениды с использованием таких реагентов, как РСl5, SOCl2,ClC(O)C(O)Cl и т.п., а также в ангидриды с ис 23 пользованием дегидратирующих реагентов. Сульфоновые кислоты могут быть в свою очередь получены с использованием способов, хорошо известных в данной области техники. Некоторые сульфоновые кислоты являются коммерчески доступными. Вместо сульфонилгалогенидов для получения соединений, в которых фрагмент -SO2- заменен фрагментом -SO- или S-соответственно, могут использоваться сульфинилгалогениды (R4SOX) или сульфенилгалогенды (R4SX). Арилсульфоновые кислоты,сконденсированные с бензольным ядром гетероциклические сульфоновые кислоты или гетероарилсульфоновые кислоты могут быть получены сульфированием ароматического кольца по методам, хорошо известным в данной области техники, такими как взаимодействие с серной кислотой, с SO3, с комплексами на основе SO3,такими, как ДМФ(SO3), пиpидин(SO3), N,Nдиметилацетамид(SO3) и т.п. Предпочтительно арилсульфонилгалогениды получают из ароматических соединений взаимодействием с ДМФ(SO3) и SOCl2 или СlС(O)С(O)Сl. Реакции можно осуществлять постадийно или в одном сосуде. Арилсульфоновые кислоты, сконденсированные с бензольным ядром гетероциклосульфоновые кислоты, гетероарилсульфоновые кислоты, арилмеркаптаны, сконденсированные с бензольным ядром гетероциклические меркаптаны, гетероарилмеркаптаны, арилгалогениды,сконденсированные с бензольным ядром гетероциклические галогениды, гетероарилгалогениды и т.п. являются коммерчески доступными или легко могут быть получены из коммерчески доступных исходных продуктов с использованием стандартных методов, хорошо известных в данной области техники. Например, ряд сульфоновых кислот (R4SO3 Н), представленных формулами где А, В, Z, R6, R7 и R9 имеют указанные выше значения, получают из 1,2-бензодитиола, 2 меркаптофенола,1,2-бензодиола,2-аминобензотиазола,бензотиазола,2-аминобензимидазола, бензимидазола и т.п., которые являются коммерчески доступными, см. патент США 4595407 на имя Carter; патент США 4634465 на имя Ehrenfreund и др.; Yoder и др., J.Pays-Bas 108: 395-403 (1989); и Kajihara и Tsuchiya, EP 638564 А 1 (каждый документ полностью включен в данное описание в качестве ссылки). Например,1,2-бензодитиол,2 меркаптофенол или 1,2-бензодиол могут быть подвергнуты взаимодействию с R6R7C(L')2, гдеL' имеет указанные выше значения и обозначает предпочтительно Вr или I, в присутствии основания, такого, как гидроксид, или с R6R7 С=O в присутствии кислоты, такой как толуолсульфоновая кислота, или с Р 2 О 5 с получением замещенного сконденсированного с бензольным ядром гетероцикла формулы который затем может быть сульфонилирован до указанной выше сульфоновой кислоты. Например, CF2Br2 или CD2Br2 может быть подвергнут взаимодействию с 1,2-бензодитиолом, 2 меркаптофенолом или 1,2-бензодиолом в присутствии основания с получением соответственно соединений формул где А и В обозначают О или S и D обозначают атом дейтерия. Когда А и/или В обозначают S,сера может быть также окислена с использованием способов, описанных ниже применительно к сульфоновым или сульфоксидным производным. После получения сульфонамидного производного аминозащитную группу Р или аминозащитные группы Р 1 и Р 2 удаляют в условиях,которые не оказывают воздействия на оставшуюся часть молекулы. Эти способы хорошо известны в данной области техники и включают кислотный гидролиз, гидрогенолиз и т.п. В предпочтительном способе используется удаление защитной группы, например удаление карбобензоксигруппы, путем гидрогенолиза в присутствии палладия на угле в пригодной системе растворителей, такой как спирт, уксусная кислота и т.п. или их смеси. Когда защитная группа представляет собой трет-бутоксикарбонильную группу, она может быть удалена с использованием неорганической или органической кислоты, например НСl или трифторуксусной кислоты, в пригодной системе растворителей, например в диоксане или метиленхлориде. Полученный продукт представляет собой производное аминовой соли. После нейтрализации соли амин подвергают сочетанию с сульфон/ сульфоксидалканоильным соединением или с его оптическим изомером (например, таким, в котором группа где n, t и R5 имеют указанные выше значения иL обозначает уходящую группу, такую как галогенид, ангидрид, активный сложный эфир и т.п. В альтернативном варианте сульфон/ сульфоксидалканоильное соединение или его оптиче 25 ский изомер могут быть подвергнуты сочетанию с защищенным амином Сульфон/сульфоксид затем превращают в соответствующую свободную кислоту формулы с последующим удалением защитной группы и сочетанием с R4SO2X, где Х обозначает Сl или Вr и Р', R2, R3 и R4 имеют указанные выше значения. Такие сульфон/сульфоксидалканоильные соединения, в которых n равно 1, могут быть получены взаимодействием меркаптана формулы R5SH с замещенным метакрилатом формулы используя пригодное основание, например, гидроксид лития, гидроксид натрия и т.п., включая их смеси, в пригодном растворителе, таком как,например, ТГФ, ацетонитрил, ДМФ, ДМСО,метиленхлорид и т.п., включая их смеси. Свободная кислота затем может быть превращена в сульфон/сульфоксидалканоильное соединение формулы с помощью реакции Майкла. Такие замещенные метакрилаты являются коммерчески доступными или могут быть легко получены из коммерчески доступных исходных продуктов с использованием стандартных методов, хорошо известных в данной области техники. Реакцию Майкла проводят в пригодном растворителе и в присутствии пригодного основания с получением соответствующего тиольного производного, представленного формулой где Р 3, R1 и R5 имеют указанные выше значения. Пригодные для проведения реакции Майкла растворители включают спирты, такие как, например, метанол, этанол, бутанол и т.п., а также простые эфиры, например ТГФ и ацетонитрил,ДМФ, ДМСО и т.п., включая их смеси. Пригодные основания включают алкоксиды металлов группы I, такие как, например, метоксид натрия,этоксид натрия, бутоксид натрия и т.п., а также гидриды металлов группы I, такие как гидрид натрия, включая их смеси. Тиольное производное превращают в соответствующий сульфон или сульфоксид формулы окислением тиольного производного соответствующим окислителем в соответствующем растворителе. Пригодные окислители включают,например, перекись водорода, мета-перборат натрия, оксон (пероксимоносульфат калия), мета-хлорпероксибензойную кислоту, перйодную кислоту и т.п., включая их смеси. Пригодные растворители включают уксусную кислоту (для мета-пербората натрия) и простые эфиры для других перкислот, такие как ТГФ и диоксан, а также ацетонитрил, ДМФ и т.п., включая их смеси. где n, t и R5 имеют указанные выше значения иL обозначает уходящую группу, такую как галогенид, ангидрид, активный сложный эфир и т.п. В альтернативном варианте свободная кислота может быть разделена на ее оптические изомеры(например, такие, в которых группа -CH(R1)имеет R- или S-конфигурацию) с использованием методов, хорошо известных в данной области техники, таких как образование диастереомерных солей или сложных эфиров и кристаллизация или хроматография, а затем превращена в сульфон/сульфоксидалканоильное соединение. В альтернативном варианте тиоэфир или соответствующий замещенный тиол формул соответственно, где n, L, R1 и R5 имеют указанные выше значения, может быть подвергнут сочетанию с одним из аминов с последующим превращением в ингибиторы протеазы по настоящему изобретению. Р 4 обозначает защищающую серу группу, такую как ацетил, бензоил и т.п. Ацетильная и бензоильная группы могут быть удалены обработкой неорганическим основанием или амином, предпочтительно аммиаком, в соответствующем растворителе, таком как метанол, этанол, изопропанол, толуол или тетрагидрофуран. Предпочтительным растворителем является метанол. Например, может быть проведено сочетание коммерчески доступной кислоты с одним из аминов формулы деацетилирование группы серы, например, с помощью гидролиза с использованием пригодного основания, такого как гидроксид, или амина, такого как аммиак, и последующее взаимодействие образовавшегося тиола с агентом R5L',где R5 и L' имеют указанные выше значения, с получением соединений, имеющих одну из указанных ниже структур или его определенных диастереомеров. Затем сера может быть окислена до соответствующего сульфона или сульфоксида с использованием пригодных окислителей, как описано выше, с получением требуемого промежуточного продукта, а затем в результате дополнительных взаимодействий с получением сульфонамидного ингибитора или непосредственно с получением сульфонамидного ингибитора. В альтернативном варианте кислота или Р 3-защищенная кислота может быть подвергнута деацетилированию, взаимодействию с агентом R5L', удалению защитной группы и окислению до соответствующего сульфона или сульфоксида с использованием пригодных окислителей, как описано выше, с получением соединения формулы где t и R5 имеют указанные выше значения. Эта сульфон/сульфоксидная карбоновая кислота затем может быть подвергнута сочетанию с промежуточным аминосоединением, описанным выше, с последующим дополнительным взаимодействием с получением сульфонамидного ингибитора или с получением сульфонамидного амина и непосредственным получением сульфонамидного ингибитора. Группа L' или агентR5L' представляют собой уходящую группу,такую как галогенид (хлорид, бромид, йодид),мезилат, тозилат или трифталат. Взаимодействие меркаптана с R5L' проводят в присутствии пригодного основания, такого как триэтиламин,диизопропилэтиламин, 1,8-диазабицикло[5.4.0] ундек-7-ен (ДБУ) и т.п., в пригодном растворителе, таком как толуол, тетрагидрофуран или метиленхлорид. Предпочтительным основанием является ДБУ, а предпочтительным растворителем является толуол. Когда R обозначает метильную группу, R5L' может представлять собой метилхлорид, метилбромид, метилйодид или диметилсульфат, предпочтительно метилйодид. В альтернативном варианте замещенный метакрилат формулы где L' обозначает уходящую группу, как описано ранее, Р 3 имеет указанные выше значения иR10 обозначает радикалы, которые при восстановлении двойной связи образуют радикалы R1,подвергают взаимодействию с R5SM с последующим окислением, как описано выше, или с пригодным сульфирующим агентом, таким как,например, сульфиновая кислота, представленная формулой R5SO2M, где R5 имеет значения,указанные выше, а М обозначает металл, пригодный для образования соли кислоты, например, натрий, с получением соответствующего сульфона, представленного формулой где Р 3, R5 и R10 имеют указанные выше значения. У сульфона затем удаляют защитную группу с получением соответствующей карбоновой кислоты. Например, когда Р 3 обозначает третбутильную группу, она может быть удалена обработкой кислотой, такой как соляная или трифторуксусная кислота. В предпочтительном методе используют 4 н. соляную кислоту в диоксане. Образовавшуюся карбоновую кислоту затем асимметрично гидрируют с использованием катализатора для асимметричного гидрирования, такого как, например, комплекс рутенийBINAP, с получением восстановленного продукта, в значительной степени обогащенного более предпочтительным изомером, представленным одной из формул где R1 и R5 имеют указанные выше значения. Если наиболее активный изомер имеет Rстереохимическую конфигурацию, в качестве катализатора для асимметричного гидрирования может быть использован Ru(R-BINAP). И наоборот, если наиболее активный изомер имеетS-стереохимическую конфигурацию, в качестве катализатора может быть использован Ru(SBINAP). Если оба изомера являются активными или если требуется получить смесь двух диастереоизомеров, для восстановления вышеуказанного соединения путем гидрирования может быть использован такой катализатор, как платина или палладий на угле. Затем восстановленное соединение подвергают сочетанию с амином,как указано выше. Описанные выше химические реакции в целом приведены в форме, соответствующей их 29 наиболее широкому применению для получения соединений по настоящему изобретению. Может оказаться, что реакции не применимы в том виде, как они описаны, к каждому из соединений, включенных в объем настоящего изобретения. Соединения, для которых это имеет место,легко могут быть определены специалистами в данной области техники. Во всех таких случаях либо реакции могут быть успешно осуществлены обычными модификациями, известными специалистам в данной области техники, например, путем соответствующей защиты взаимодействующих групп, путем использования альтернативных обычных реагентов, путем обычной модификации условий реакции и т.п.,либо для получения соответствующих соединений по настоящему изобретению могут быть применены другие реакции, представленные в данном описании либо иные обычные реакции. Во всех способах получения все исходные продукты являются известными или могут быть легко получены из известных исходных продуктов. Предполагается, что специалист в данной области техники может без дальнейших исследований, используя предшествующее описание,применить настоящее изобретение в его наиболее полном объеме. Поэтому представленные ниже предпочтительные конкретные варианты осуществления должны рассматриваться исключительно как иллюстративные, а не как ограничивающие каким-либо образом остальной объем изобретения. Все реагенты использовали в том виде, как они были получены, без очистки. Все протонные и углеродные ЯМР-спектры получали с использованием спектрометра ядерного магнитного резонанса либо типа Varian VXR-300, либо типа VXR-400. Следующие примеры иллюстрируют получение соединений-ингибиторов по настоящему изобретению и промежуточных продуктов, пригодных для получения соединений-ингибиторов по настоящему изобретению. Пример 1. Получение 2S-[бис(фенилметил)амино] бензопропанола. Способ 1. Получение 2S-[бис(фенилметил) амино]бензопропанола путем восстановления фенилметилового эфира N,N-бис(фенилметил)L-фенилаланина с помощью ДИБАЛ. Стадия 1. Раствор, содержащий L-фенилаланин (50,0 г, 0,302 моля), гидроксид натрия (24,2 г, 0,605 моля) и карбонат калия (83,6 г, 0,605 моля) в воде (500 мл), нагревали до 97 С. Затем медлен 000533 30 но добавляли (время добавления 25 мин) бензилбромид (108,5 мл, 0,605 моля). Смесь перемешивали при 97 С в течение 30 мин в атмосфере азота. Раствор охлаждали до комнатной температуры и экстрагировали толуолом (2 х 250 мл). Объединенные органические слои промывали водой и соляным раствором, сушили над сульфатом магния, фильтровали и концентрировали, получая масло. Идентичность продукта подтверждали следующим образом. Аналитическая ТСХ (смесь 10% этилацетата/гексан, силикагель) показала, что основной компонент со значением Rf 0,32 является требуемым трибензилированным соединением, т.е. фенилметиловым эфиромN,N-бис(фенилметил)-Lфенилаланила. Это соединение может быть очищено с помощью хроматографии на колонках (силикагель, смесь 15% этилацетата/гексан). Обычно продукт является достаточно чистым для его использования непосредственно на следующей стадии без дополнительной очистки. 1 Н-ЯМР-спектр соответствовал таковому, известному по опубликованным литературным данным. 1 Н-ЯМР (CDCl3) , 3,00 и 3,14 (АВХсистема, 2 Н, JAB=14,1 Гц, JAX=7,3 Гц и JBX=5,9 Гц), 3,54 и 3,92 (АВ-система, 4 Н, JAB=13,9 Гц),3,71 (t, 1 Н, J=7,6 Гц), 5,11 и 5,23 (АВ-система,2 Н, JAB=12,3 Гц), и 7,18 (m, 20 Н). MC-EI: m/z 434 (М-1). Стадия 2. Фенилметиловый эфир бензилированного фенилаланина (0,302 моля), полученный на предыдущей стадии, растворяли в толуоле (750 мл) и охлаждали до -55 С. Добавляли 1,5 М раствор ДИБАЛ в толуоле (443,9 мл, 0,666 моля) с такой скоростью, чтобы поддерживать температуру между -55 и -50 С (время добавления 1 ч). Смесь перемешивали в течение 20 мин в атмосфере азота и затем реакцию прекращали при 55 С путем медленного добавления метанола(37 мл). Затем холодный раствор сливали на холодный (5 С) 1,5 н. раствор НСl (1,8 л). Выпавший в осадок твердый продукт (приблизительно 138 г) отфильтровывали и промывали толуолом. Твердый продукт суспендировали в смеси толуола (400 мл) и воды (100 мл). Смесь охлаждали до 5 С и обрабатывали 2,5 н. NaOH(186 мл) и затем перемешивали при комнатной температуре до растворения твердого продукта. Толуоловый слой отделяли от водной фазы и промывали водой и соляным раствором, сушили над сульфатом магния, фильтровали и концентрировали до объема 75 мл (89 г). К остатку добавляли этилацетат (25 мл) и гексан (25 мл),после чего начинал кристаллизоваться требуемый спиртовой продукт. Через 30 мин для усиления дальнейшей кристаллизации добавляли еще 50 мл гексана. Твердый продукт отфильтровывали и промывали 50 мл гексана, получая 34,9 г продукта в первом выходе. Второй выход продукта (5,6 г) выделяли повторной фильтра 31 цией маточного раствора. Оба выхода объединяли и перекристаллизовывали из этилацетата(20 мл) и гексана (30 мл), получая 40 г S-2[бис(фенилметил)амино]бензопропанола, 40%ный выход из L-фенилаланина. Дополнительные 7 г (7%) продукта могут быть получены в результате перекристаллизации концентрированного маточного раствора. ТСХ продукта с Rf = 0,23 (смесь 10% этилацетата/гексан, силикагель); 1 Н-ЯМР (CDCl3)2,44 (m, 1H), 3,09 (m,2H), 3,33 (m, 1H), 3,48 и 3,92 (АВ-система, 4 Н,JAB =13,3 Гц), 3,52 (m, 1H) и 7,23 (m, 15H); []D25+42,4 (с 1,45, СH2 Сl2); ДСК 77,67 С. Анализ: рассчитано для C23H25ON: С 83,34; Н 7,60; N 4,23; обнаружено: С 83,43; Н 7,59; N 4,22. ЖХВР на хиральной стационарной фазе: колонка Cyclobond I SP (250 х 4,6 мм внутренний диаметр (В.Д., подвижная фаза: метанол/триэтиламмонийацетатный буфер с рН 4,2(58:42, по объему), скорость потока 0,5 мл/мин,определение детектором при 230 нм и температуре 0 С. Время удержания: 11,25 мин, время удержания требуемого энантиомера: 12,5 мин. Способ 2. Получение S-2-[бис(фенилметил)амино]бензопропанола путем N,N-дибензилирования L-фенилаланинола.L-Фенилаланинол (176,6 г, 1,168 моля) добавляли к перемешиваемому раствору карбоната калия (484,6 г, 3,506 моля) в 710 мл воды. Смесь нагревали до 65 С в атмосфере азота. Добавляли раствор бензилбромида (400 г, 2,339 моля) в этаноле (305 мл) с такой скоростью,чтобы поддерживать температуру между 60 и 68 С. Двухфазный раствор перемешивали при 65 С в течение 55 мин и затем давали охладиться до 10 С при интенсивном перемешивании. Маслянистый продукт отвердевал в виде небольших гранул. Продукт разбавляли 2,0 л водопроводной воды и перемешивали в течение 5 мин до растворения неорганических побочных продуктов. Продукт выделяли фильтрацией при пониженном давлении и промывали водой до получения значения рН 7. Полученный неочищенный продукт сушили на воздухе в течение ночи, получая полусухой твердый продукт (407 г), который перекристаллизовывали из 1,1 л этилацетата/гептана (1:10, по объему). Продукт выделяли фильтрацией (при -8 С), промывали 1,6 л холодной смеси (-10 С) этилацетат/гептан(1:10, по объему) и сушили на воздухе, получая 339 г (выход 88%) S-2-[бис(фенилметил) амино]бензопропанола, tпл = 71,5 -73,0 С. При необходимости дополнительное количество продукта может быть получено из маточного раствора. Другие аналитические характеристики идентичны таковым для соединения, полученного согласно способу 1.(300 мл, 2,15 моля). Смесь охлаждали до 12 С и добавляли раствор комплекса триоксид серы/пиридин (380 г, 2,39 моля) в ДМСО (1,6 л) с такой скоростью, чтобы поддерживать температуру от 8 до 17 С (время добавления 1,0 ч). Раствор перемешивали при температуре окружающей среды в атмосфере азота в течение 1,5 ч, и к этому времени по данным ТСХ-анализа (смесь 33% этилацетата/гексан, силикагель) реакция была завершена. Реакционную смесь охлаждали ледяной водой и реакцию прекращали с помощью добавления 1,6 л холодной воды (10-15 С) в течение 45 мин. Образовавшийся раствор экстрагировали этилацетатом (2,0 л), промывали 5%-ной лимонной кислотой (2,0 л) и соляным раствором (2,2 л), сушили над MgSO4 (280 г) и фильтровали. Растворитель удаляли с помощью роторного испарителя при 35-40 С и затем сушили под вакуумом, получая 198,8 г 2S[бис(фенилметил)амино]бензопропанальдегида в виде масла светло-желтого цвета (99,9%). Полученный неочищенный продукт был достаточно чистым для его использования непосредственно на следующей стадии без дополнительной очистки. Аналитические характеристики соединения соответствовали таковым, известным по опубликованным литературным данным.(АВ-система, 4 Н, JAB=13,7 Гц), 7,25 (m, 15 Н) и 9,72 (s, 1 Н); МСВР: рассчитано для: (М+1) C23H24NO 330,450, обнаружено: 330,1836. Анализ: рассчитано для C23H23ON: С 83,86; Н 7,04; N 4,25; обнаружено С 83,64; Н 7,42; N 4,19. ЖХВР на хиральной стационарной фазе(S,S): колонка Pirkle-Whelk-О 1 (250 х 4,6 мм внутренний диаметр (В.Д., подвижная фаза: гексан/изопропанол (99,5:0,5, по объему), скорость потока 1,5 мл/мин, определение УФдетектором при 210 нм. Время удержания требуемого S-изомера: 8,75 мин, время удержания-74 С. Затем медленно добавляли раствор ДМСО (12,0 мл, 0,155 моля) в дихлорметане (50 мл) с такой скоростью, чтобы поддерживать температуру на уровне -74 С (время добавления 1,25 ч). Смесь перемешивали в течение 5 мин,S-2 а затем добавляли раствор-20 мин, температура от -75 С до -68 С). Раствор перемешивали при -78 С в течение 35 мин в атмосфере азота. Затем в течение 10 мин (температура от -78 до -68 С) добавляли триэтиламин (41,2 мл, 0,295 моля), после чего осаждалась аммониевая соль. Холодную смесь перемешивали в течение 30 мин и затем добавляли воду (225 мл). Дихлорметановый слой отделяли от водной фазы и промывали водой, соляным раствором, сушили над сульфатом магния,фильтровали и концентрировали. Остаток разбавляли этилацетатом и гексаном и затем фильтровали для последующего удаления аммониевой соли. Фильтрат концентрировали,получая S-[бис(фенилметил)амино] бензопропанальдегид. Альдегид использовали на следующей стадии без очистки. Способ 3. К смеси, содержащей 1,0 г (3,0 ммоля) S2-[бис(фенилметил)амино]бензопропанола,0,531 г (4,53 ммоля) N-метилморфолина, 2,27 г молекулярных сит (4) и 9,1 мл ацетонитрила,добавляли 53 мг (0,15 ммоля) тетрапропиламмонийперрутената (ТПАП). Смесь перемешивали в течение 40 мин при комнатной температуре и концентрировали при пониженном давлении. Остаток суспендировали в 15 мл этилацетата, фильтровали через подушку из силикагеля. Фильтрат концентрировали при пониженном давлении с получением продукта, содержащего приблизительно 50% S-2-[бис(фенилметил) амино] бензопропанальдегида в виде масла светло-желтого цвета. Способ 4. К раствору, содержащему 1,0 г (3,02 ммоля)S-2-[бис(фенилметил)амино]бензопропанола в 9,0 мл толуола, добавляли 4,69 мг (0,03 ммоля) 2,2,6,6-тетраметил-1-пиперидинилокси(ТЕМПО) в качестве свободного радикала, 0,32 г (3,11 ммоля) бромида натрия, 9,0 мл этилацетата и 1,5 мл воды. Смесь охлаждали до 0 С и медленно добавляли в течение 25 мин водный раствор 2,87 мл 5%-ной бытовой хлорной извести, содержащей 0,735 г (8,75 ммоля) бикарбоната натрия и 8,53 мл воды. Смесь перемешивали при 0 С в течение 60 мин. При перемешивании в течение 10 мин добавляли еще две порции (по 1,44 мл каждая) хлорной извести. Двухфазной смеси давали разделиться. Водный слой экстрагировали дважды 20 мл этилацетата. Объединенный органический слой промывали 4,0 мл раствора, содержащего 25 мг йодида калия и воду (4,0 мл), 20 мл 10%-ного водного раствора 34 тиосульфата натрия и затем соляным раствором. Органический раствор сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая 1,34 г неочищенного масла, содержащего небольшое количество требуемого альдегида, т.е. S-[бис (фенилметил)амино] бензопропанальдегида. Способ 5. По методике, аналогичной описанной в способе 1 данного примера, за исключением того, что использовали 3,0 эквивалента комплекса триоксид серы/пиридин, выделяли S[бис(фенилметил)амино]бензопропанальдегид с сопоставимым выходом. Пример 3.S-[бис(фенилметил)амино]бензопропанальдегид (191,7 г, 0,58 моля) и хлорйодметан (56,4 мл, 0,77 моля) в тетрагидрофуране (1,8 л), охлаждали до температуры от -30 до -35 С в реакторе из нержавеющей стали в атмосфере азота (можно также работать и при более низкой температуре, такой, как -70 С, однако более высокие температуры легче получать при крупномасштабных процессах). Затем добавляли раствор нбутиллития в гексане (1,6 М, 365 мл, 0,58 моля) с такой скоростью, чтобы поддерживать температуру ниже -25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Дополнительные добавления реагентов осуществляли следующим образом.(1) Добавляли дополнительную порцию хлорйодметана (17 мл), затем н-бутиллитий (110 мл) при температуре не выше -25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Эту процедуру повторяли еще один раз. (2) Добавляли дополнительную порцию хлорйодметана (8,5 мл, 0,11 моля), затем н-бутиллитий (55 мл, 0,088 моля) при температуре не выше -25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Эту процедуру повторяли пять раз. (3) Добавляли дополнительную порцию хлорйодметана (8,5 мл, 0,11 моля),затем н-бутиллитий (37 мл, 0,059 моля) при температуре не выше -25 С. После добавления смесь перемешивали при температуре от -30 до-35 С в течение 10 мин. Эту процедуру повторяли еще один раз. Прекращали внешнее охлаждение и смесь нагревали до температуры окружающей среды в течение 4-16 ч, после чего ТСХ (силикагель, смесь 20% этилацетата/гексан) показала, что реакция завершена. Ре 35 акционную смесь охлаждали до 10 С и реакцию прекращали, добавляя 1452 г 16%-ного раствора хлорида аммония (полученного растворением 232 г хлорида аммония в 1220 мл воды), поддерживая температуру ниже 23 С. Смесь перемешивали в течение 10 мин и разделяли органический и водный слои. Водную фазу экстрагировали этилацетатом (2 х 500 мл). Этилацетатный слой объединяли с тетрагидрофурановым слоем. Объединенный раствор сушили над сульфатом магния (220 г), фильтровали и концентрировали на роторном испарителе при 65 С. Остаток в виде коричневого масла сушили при 70 С в вакууме (0,8 бар) в течение 1 ч, получая 222,8 г неочищенного продукта. (Масса неочищенного продукта составляла 100%. Вследствие относительной нестабильности продукта на силикагеле неочищенный продукт обычно использовали непосредственно на следующей стадии без дополнительной очистки). Соотношение диастереомеров неочищенной смеси определяли протонным ЯМР: (2S)/(2R): 86:14. Характеристики минорного и основного эпоксидных диастереомеров в этой смеси определяли с помощью ТСХ-анализа (силикагель, смесь 10% этилацетата/гексан), Rf=0,29 и 0,32 соответственно. Аналитический образец каждого из этих диастереомеров получали очисткой с помощью хроматографии на силикагеле (смесь 3 % этилацетата/гексан), при этом были получены следующие характеристики:H-ЯМР (300 МГц, CDCl3)2,20 (m, 1H),2,59 (m, 1H), 2,75 (m, 2H), 2,97 (m, 1H), 3,14 (m,1H), 3,85 (АВ-система, 4 Н), 7,25 (m, 15H). ЖХВР на хиральной стационарной фазе: колонка Pirkle-Whelk-0 1 (250 х 4,6 мм В.Д.), подвижная фаза: гексан/изопропанол (99,5:0,5, об/об),скорость потока 1,5 мл/мин, определение УФдетектором при 210 нм. Время удержания продукта (8): 9,38 мин, время удержания энантиомера (4): 13,75 мин. Способ 2. Раствор, содержащий 0,704 моля неочищенного альдегида и хлорйодметан (7,0 мл,0,096 моля) в тетрагидрофуране (285 мл) охлаждали до -78 С в атмосфере азота. Затем добавляли 1,6 М раствор н-бутиллития в гексане (25 36 мл, 0,040 моля) с такой скоростью, чтобы поддерживать температуру на уровне -75 С (время добавления 15 мин). После первого добавления вновь добавляли хлорйодметан (1,6 мл, 0,022 моля), а затем н-бутиллитий (23 мл, 0,037 моля),поддерживая температуру на уровне -75 С. Смесь перемешивали в течение 15 мин. Каждый из реагентов, хлорйодметан (0,70 мл, 0,010 моля) и н-бутиллитий (5 мл, 0,008 моля), добавляли еще четыре раза в течение 45 мин при -75 С. Охлаждающую баню затем удаляли и раствор нагревали до 22 С в течение 1,5 ч. Смесь выливали в 300 мл насыщенного водного раствора хлорида аммония. Отделяли тетрагидрофурановый слой. Водную фазу экстрагировали этилацетатом (1 х 300 мл). Объединенные органические слои промывали соляным раствором, сушили над сульфатом магния, фильтровали и концентрировали, получая масло коричневого цвета (27,4 г). Продукт может использоваться на следующей стадии без дальнейшей очистки. Требуемый диастереомер может быть очищен перекристаллизацией на следующей стадии. Продукт также может быть очищен хроматографией. Способ 3. Раствор, содержащий S-[бис(фенилметил)амино]бензопропанальдегид (178,84 г, 0,54 моля) и бромхлорметан (46 мл, 0,71 моля) в тетрагидрофуране (1,8 л), охлаждали до температуры от -30 до -35 С в реакторе из нержавеющей стали в атмосфере азота (можно работать также при более низкой температуре, такой как -70 С,однако более высокие температуры легче получать при крупномасштабных процессах). Раствор н-бутиллития в гексане (1,6 М, 340 мл, 0,54 моля) добавляли с такой скоростью, чтобы поддерживать температуру ниже -25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Дополнительные добавления реагентов осуществляли следующим образом. (1) Добавляли дополнительную порцию бромхлорметана (14 мл), а затем нбутиллитий (102 мл) при температуре не выше 25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Эту процедуру повторяли еще один раз. (2) Добавляли дополнительную порцию бромхлорметана (7 мл, 0,11 моля), а затем н-бутиллитий(51 мл, 0,082 моля) при температуре не выше-25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Эту процедуру повторяли пять раз. (3) Добавляли дополнительную порцию бромхлорметана (7 мл, 0,11 моля), а затем н-бутиллитий(51 мл, 0,082 моля) при температуре не выше-25 С. После добавления смесь перемешивали при температуре от -30 до -35 С в течение 10 мин. Эту процедуру повторяли еще один раз. Прекращали внешнее охлаждение и смесь нагревали до температуры окружающей среды в течение 4-16 ч, после чего ТСХ (силикагель, 37 смесь 20% этилацетата/гексан) показала, что реакция завершена. Реакционную смесь охлаждали до 10 С и реакцию прекращали добавлением 1452 г 16%-ного раствора хлорида аммония(полученного растворением 232 г хлорида аммония в 1220 мл воды), поддерживая температуру ниже 23 С. Смесь перемешивали в течение 10 мин и разделяли органический и водный слои. Водную фазу экстрагировали этилацетатом (2 х 500 мл). Этилацетатный слой объединяли с тетрагидрофурановым слоем. Объединенный раствор сушили над сульфатом магния (220 г), фильтровали и концентрировали на роторном испарителе при 65 С. Остаток в виде коричневого масла сушили при 70 С в вакууме (0,8 бар) в течение 1 ч, получая 222,8 г неочищенного продукта. Способ 4. Использовали методы, описанные в способе 3 данного примера, за исключением того, что температура реакции составляла -20 С. Полученный N,N,S-трис(фенилметил)-2S-оксиранметанамин представлял собой смесь диастереомеров меньшей чистоты по сравнению с полученной по способу 3. Способ 5. Использовали методы, описанные в способе 3 данного примера, за исключением того, что температуры реакции составляли от -70 до-78 С. Полученный N,N,S-трис (фенилметил)2S-оксиранметанамин представлял собой смесь диастереомеров, которую непосредственно применяли на следующей стадии без дополнительной очистки. Способ 6. Использовали методы, описанные в способе 3 данного примера, за исключением того, что непрерывное добавление бромхлорметана и нбутиллития осуществляли при температуре от-30 до -35 С. После осуществления реакции и соответствующей обработки, как описано в способе 3 данного примера, выделяли требуемыйN,N,S-трис(фенилметил)-2S-оксиранметанамин с сопоставимым выходом и чистотой. Способ 7. Использовали методы, описанные в способе 2 данного примера, за исключением того, что вместо хлорйодметана применяли дибромметан. После осуществления реакции и соответствующей обработки, как описано в способе 2 данного примера,выделяли требуемый 38 Получение N-[3(S)-[N,N-бис(фенилметил) амино]-2-(R)-гидрокси-4-фенилбутил]-Nизобутиламина. К раствору N,N-дибензил-3(S)-амино 1,2(S)-эпокси-4-фенилбутана (388,5 г, 1,13 моля) в изопропаноле (2,7 л) (или в этилацетате) в течение 2 мин добавляли изобутиламин (1,7 кг,23,1 моля). Температура повышалась от 25 С до 30 С. Раствор нагревали до 82 С и перемешивали при этой температуре в течение 1,5 ч. Теплый раствор концентрировали при пониженном давлении и при 65 С. Остаток в виде масла коричневого цвета переносили в колбу объемом 3 л и сушили в вакууме (0,8 мм рт.ст.) в течение 16 ч, получая 450 г 3(S)-[N,N-бис(фенилметил) амино]-4-фенилбутан-2R-ол в виде неочищенного масла. Аналитический образец основного диастереомерного продукта получали очисткой небольшого образца неочищенного продукта с помощью хроматографии на силикагеле (смесь 40% этилацетата/гексан). ТСХ-анализ: силикагель, смесь 40% этилацетата/гексан; Rf = 0,28; ЖХВР-анализ: ультрасферная колонка типаODS, 25% триэтиламино/фосфатный буфер с рН 3-ацетонитрил, скорость потока 1 мл/мин, УФдетектор; время удержания 7,49 мин; МСВР: рассчитано для: C28H27N2O (M+1) 417,616, обнаружено: 417,2887. Аналитический образец минорного диастереомерного продукта, т.е. 3(S)[N,N-бис(фенилметил)амино]-4-фенилбутан-2Sола, получали очисткой небольшого образца неочищенного продукта с помощью хроматографии на силикагеле (смесь 40% этилацетата/гексан). Пример 5.N-[3(S)-[N,Nбис(фнилметил)амино]-2-(R)-гидрокси-4-фенилбутил]-N-изобутиламина. К раствору щавелевой кислоты (8,08 г,89,72 ммоля) в метаноле (76 мл) в течение 15 мин добавляли раствор неочищенного 3(S)[N,N-бис(фенил-метил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2R-ола 39,68 г, который содержит приблизительно 25,44 г (61,06 ммоля) 3(S),2(R)-изомера и приблизительно 4,49 г (10,78 ммоля) 3(S),2(S) -изомера в этилацетате (90 мл). Смесь перемешивали при комнатной температуре в течение приблизительно 2 ч. Твердый продукт выделяли фильтрацией, промывали этилацетатом (2 х 20 мл) и сушили под вакуумом в течение приблизительно 1 ч, получая 21,86 г (выход изомера 70,7%) соли с 97%ной диастереомерной чистотой (по данным о 39 площади пиков при ЖХВР-анализе). ЖХВРанализ: колонка типа Vydec-пептид/протеин С 18, УФ-детектор, 254 нм, скорость потока 2 мл/мин, градиент А = 0,05% трифторуксусная кислота в воде, Б = 0,05% трифторуксусная кислота в ацетонитриле, 0 мин 75% А/25% Б, 30 мин 10% А/90% Б, 35 мин 10% А/90% Б, 37 мин 75% А/25% Б; время удержания 10,68 мин для 3(S),2(R)-изомера и 9,73 мин для 3(S),2(S)изомера), tпл 174,99 С; микроанализ: рассчитано: С 71,05%, Н 7,50%, N 5,53%; обнаружено: С 71,71%, Н 7,75%, N5,39%. В альтернативном варианте дигидрат щавелевой кислоты (119 г, 0,94 моля) добавляли в круглодонную колбу объемом 5000 мл, снабженную механической мешалкой и капельной воронкой. Добавляли метанол (1000 мл) и смесь перемешивали до полного растворения. В течение 20 мин добавляли раствор неочищенного 3(S)-[N,N-бис(фенилметил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2(R)-ола в этилацетате (1800 мл, 0,212 г изомеров аминоспирта/мл, 0,9160 моля). Смесь перемешивали в течение 18 ч и твердый продукт выделяли центрифугированием при 400xg в виде шести порций. Каждую порцию промывали 125 мл этилацетата. Затем соль собирали и сушили в течение ночи при давлении 1 торр, получая 336,3 г продукта (71% по отношению к общему содержанию аминоспирта). Данные ЖХВР/МС (электроспрей) соответствовали требуемому продукту (m/z 417 [М+Н] +). В альтернативном варианте неочищенный 3(8)-[N,N-бис(фенилметил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2(R)-ол (5 г) растворяли в метил-трет-бутиловом эфире (МТБЭ)(10 мл) и добавляли щавелевую кислоту (1 г) в метаноле (4 мл). Смесь перемешивали в течение приблизительно 2 ч. Образовавшийся твердый продукт фильтровали, промывали холодным МТБЭ и сушили, получая 2,1 г белый твердый продукт с 98,9%-ной диастереомерной чистотой(по данным о площади пиков при ЖХВРанализе). Пример 6. Получение ацетатаN-[3(S)-[N,Nбисфенилметил)амино]-2-(R)-гидрокси-4 фенилбутил]-N-изобутиламина. К раствору неочищенного 3(S)-[N,Nбис(фенилметил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2(R)-ола в метил-третбутиловом эфире (МТБЭ) (45 мл, 1,1 г изомеров аминоспирта/мл) по каплям добавляли уксусную кислоту (6,9 мл). Смесь перемешивали при комнатной температуре в течение приблизительно 1 ч. Растворитель удаляли в вакууме,получая масло коричневого цвета в виде продукта с приблизительно 85%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВР-анализе). Коричневое масло кристаллизовали следующим образом: 0,2 г масла растворяли при нагревании в первом растворителе, 000533 40 получая прозрачный раствор, добавляли второй растворитель до тех пор, пока раствор не становился мутным, смесь вновь нагревали до получения прозрачного раствора, вносили затравку в виде продукта с приблизительно 99%-ной диастереомерной чистотой, охлаждали до комнатной температуры и затем выдерживали в холодильнике в течение ночи. Кристаллы фильтровали, промывали вторым растворителем и сушили. Диастереомерную чистоту кристаллов оценивали по площади пиков при ЖХВРанализе. Результаты приведены в таблице 1. Первый растворитель МТБЭ МТБЭ Метанол Толуол Толуол Второй растворитель Гептан Гексан Вода Гептан Гексан Выход по массе (г) 0,13 0,03 0,05 0,14 0,10 В альтернативном варианте неочищенный 3(S)-[N,N-бис(фенилметил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2(R)-ол (50,0 г,содержащий приблизительно 30,06 г (76,95 ммоля) 3(S),2(R)-изомера и приблизительно 5,66 г (13,58 ммоля) 3(S),2(S)-изомера) растворяли в метил-трет-бутиловом эфире (45,0 мл). К этому раствору в течение приблизительно 10 мин добавляли уксусную кислоту (6,90 мл, 120,6 ммоля). Смесь перемешивали при комнатной температуре в течение приблизительно 1 ч и концентрировали при пониженном давлении. Маслянистый остаток очищали перекристаллизацией из метил-третбутилового эфира (32 мл) и гептана (320 мл). Твердый продукт выделяли фильтрацией, промывали холодным гептаном и сушили в вакууме в течение приблизительно 1 ч, получая 21,34 г (выход изомера 58,2%) моноацетатной соли с 96%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВРанализе). tпл 105-106 С; микроанализ: рассчитано: С 75,53%, Н 8,39%, N 5,87%; обнаружено: С 75,05%, Н 8,75%, N 5,71%. Пример 7. Получение тартратаN-[3(S)-[N,Nбис(фенилметил)амино]-2-(R)-гидрокси-4 фенилбутил]-N-изобутиламина. Неочищенный 3(S)-[N,N-бис(фенилметил) амино]-1-(2-метилпропил) амино-4-фенилбутан 2R-ол (10,48 г, содержащий приблизительно 6,72 г (16,13 ммоля) 3(S),2(R)-изомера и приблизительно 1,19 г (2,85 ммоля) 3(S), 2(S) изомера) растворяли в тетрагидрофуране (10,0 мл). К этому раствору в течение приблизительно 5 мин добавляли раствор L-винной кислоты(2,85 г, 19 ммолей) в метаноле (5,0 мл). Смесь перемешивали при комнатной температуре в течение приблизительно 10 мин и концентрировали при пониженном давлении. К маслянистому остатку добавляли метил-трет-бутиловый 41 эфир (20,0 мл) и смесь перемешивали при комнатной температуре в течение приблизительно 1 ч. Твердый продукт выделяли фильтрацией,получая 7,50 г неочищенной соли. Неочищенную соль очищали перекристаллизацией из этилацетата и гептана при комнатной температуре, получая 4,13 г (выход изомера 45,2%) тартрата с 95%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВР-анализе). Микроанализ: рассчитано: С 67,76%, Н 7,41%, N 4,94%; обнаружено: С 70,06%, Н 7,47%, N 5,07%. Пример 8. Получение дигидрохлорида N-[3(S)-[N,Nбис(фенилметил)амино]-2(R)-гидрокси-4 фенилбутил]-N-изобутиламина. Неочищенный 3(S)-[N,N-бис(фенилметил) амино]-1-(2-метилпропил)амино-4-фенилбутан 2(R)-ол (10,0 г, содержащий приблизительно 6,41 г (15,39 ммоля) 3(S),2(R)-изомера и приблизительно 1,13 г (2,72 ммоля) 3(S), 2(S) изомера) растворяли в тетрагидрофуране (20,0 мл). К этому раствору в течение приблизительно 5 мин добавляли соляную кислоту (20 мл,6,0 н.). Смесь перемешивали при комнатной температуре в течение приблизительно 1 ч и концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола при 0 С,получая 3,20 г (выход изомера 42,7%) дихлорида с 98%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВР-анализе). Микроанализ: рассчитано: С 68,64%, Н 7,76%, N 5,72%; обнаружено: С 68,79%, Н 8,07%, N 5,55%. Пример 9. Получение толуолсульфоната N-[3(S)[N,N-бис(фенилметил)амино]-2(R)-гидрокси-4 фенилбутил]-N-изобутиламина. Неочищенный 3(S)-[N,N-бис(фенилметил) амино]-1-(2-метилпропил) амино-4-фенилбутан 2(R)-ол (5,0 г, содержащий приблизительно 3,18 г (7,63 ммоля) 3(S),2(R)-изомера и приблизительно 0,56 г (1,35 ммоля) 3(S),2(S)-изомера) растворяли в метил-трет-бутиловом эфире (10,0 мл). К этому раствору в течение приблизительно 5 мин добавляли раствор толуолсульфоновой кислоты (2,28 г, 12 ммолей) в метил-третбутиловом эфире (2,0 мл) и метанол (2,0 мл). Смесь перемешивали при комнатной температуре в течение приблизительно 2 ч и концентрировали при пониженном давлении. Остаток перекристаллизовывали из метил-трет-бутилового эфира и гептана при 0 С, фильтровали, промывали холодным гептаном и сушили в вакууме,получая 1,85 г (выход изомера 40,0%) монотолуолсульфоната с 97%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВР -анализе). 42 Пример 10. Получение метансульфоната N-[3(S)-[N,Nбис(фенилметил)амино]-2(R)-гидрокси-4-фенилбутил]-N-изобутиламина. Неочищенный 3 (S)-[N,N-бис(фенилметил) амино]-1-(2-метилпропил) амино-4-фенилбутан 2(R)-ол (10,68 г, содержащий приблизительно 6,85 г (16,44 ммоля) 3(S),2(R)-изомера и приблизительно 1,21 г (2,90 ммоля) 3(S),2(S)изомера) растворяли в тетрагидрофуране (10,0 мл). К этому раствору добавляли метансульфоновую кислоту (1,25 мл, 19,26 ммолей). Смесь перемешивали при комнатной температуре в течение приблизительно 2 ч и концентрировали при пониженном давлении. Маслянистый остаток перекристаллизовывали из метанола и воды при 0 С, фильтровали, промывали холодным метанолом/водой (1:4) и сушили в вакууме, получая 2,40 г (выход изомера 28,5%) монометансульфоната с 98%-ной диастереомерной чистотой (по данным о площади пиков при ЖХВРанализе). Пример 11. Получение N-бензил-L-фенилаланинола. Способ 1.L-фенилаланинол (89,51 г, 0,592 моля) растворяли в 375 мл метанола в атмосфере инертного газа, добавляли 35,52 г (0,592 моля) ледяной уксусной кислоты и 50 мл метанола, а затем добавляли раствор, содержащий 62,83 г (0,592 моля) бензальдегида в 100 мл метанола. Смесь охлаждали до приблизительно 15 С и приблизительно в течение 40 мин добавляли раствор, содержащий 134,6 г (2,14 моля) цианборогидрида натрия в 700 мл метанола, поддерживая температуру между 15 и 25 С. Смесь перемешивали при комнатной температуре в течение 18 ч. Смесь концентрировали при пониженном давлении и распределяли между 1 л 2 М раствора гидроксида аммония и 2 л простого эфира. Эфирный слой промывали 1 л 1 М раствора гидроксида аммония, дважды 500 мл воды, 500 мл соляного раствора и сушили над сульфатом магния в течение 1 ч. Эфирный слой фильтровали, концентрировали при пониженном давлении и неочищенный твердый продукт перекристаллизовывали из 110 мл этилацетата и 1,3 л гексана, получая 115 г (выход 81%) N-бензил-Lфенилаланинола в виде белого твердого вещества. Способ 2.(33,83 ммоля) бензальдегида растворяли в 55 мл 3 А этанола в атмосфере инертного газа в вибраторе Парра и смесь нагревали до 60 С в течение 2,7 ч. Смесь охлаждали до приблизительно 25 С, добавляли 0,99 г 5%-ной платины на угле и смесь гидрировали при давлении водорода 60 фунтов/кв.дюйм и 40 С в течение 10 ч. Катализатор отфильтровывали, продукт концентрировали при пониженном давлении и неочищенный твердый продукт перекристаллизовывали из 150 43 мл гептана, получая 3,83 г (выход 48%) Nбензил-L-фенилаланинола в виде белого твердого вещества. Пример 12. Получение N-(трет-бутоксикарбонил)-Nбензил-L-фенилаланинола.N-бензил-L-фенилаланинол (2,9 г, 12 ммолей) растворяли в 3 мл триэтиламина и 27 мл метанола и добавляли 5,25 г (24,1 ммоля) дитрет-бутилдикарбоната. Смесь нагревали до 60 С в течение 35 мин и концентрировали при пониженном давлении. Остаток растворяли в 150 мл этилацетата и дважды промывали 10 мл холодной (0-5 С) разбавленной соляной кислоты (рН от 2,5 до 3), 15 мл воды, 10 мл соляного раствора, сушили над сульфатом магния,фильтровали и концентрировали при пониженном давлении. Неочищенный продукт в виде масла очищали с помощью хроматографии на силикагеле (этилацетат:гексан в качестве растворителя для элюирования, 12:3), получая 3,98 г (выход 97%) бесцветного масла. Пример 13. Получение N-(трет-бутоксикарбонил)-Nбензил-L-фенилаланинала. Способ 1. К раствору, содержащему 0,32 г (0,94 ммоля)N-(трет-бутоксикарбонил)-N-бензил-Lфенилаланинола в 2,8 мл толуола, добавляли 2,4 мг (0,015 ммоля) 2,2,6,6-тетраметил-1-пиперидинилоксида (ТЕМПО) в качестве свободного радикала, 0,1 г (0,97 ммоля) бромида натрия, 2,8 мл этилацетата и 0,34 мл воды. Смесь охлаждали до 0 С и в течение 30 мин медленно добавляли 4,2 мл водного раствора 5%-ной бытовой хлорной извести, содержащего 0,23 г (3,0 мл,2,738 ммоля) бикарбоната натрия. Смесь перемешивали при 0 С в течение 10 мин. Добавляли еще три порции (по 0,4 мл каждая) хлорной извести с последующим перемешиванием в течение 10 мин после каждого добавления до поглощения всего исходного продукта. Двухфазной смеси давали разделиться. Водный слой дважды экстрагировали 8 мл толуола. Объединенный органический слой промывали 1,25 мл раствора, содержащего 0,075 г йодида калия,бисульфат натрия (0,125 г) и воду (1,1 мл), 1,25 мл 10%-ного водного раствора тиосульфата натрия, 1,25 мл фосфатного буфера с рН 7 и 1,5 мл соляного раствора. Органический раствор сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении,получая 0,32 г (выход 100%) N-(третбутоксикарбонил)-N-бензил-L-фенилаланиналя. Способ 2. К раствору 2,38 г (6,98 ммоля) N-(третбутоксикарбонил)-N-бензил-L-фенилаланинола в 3,8 мл (27,2 ммоля) триэтиламина при 10 С добавляли раствор 4,33 г (27,2 ммоля) комплекса триоксид серы/пиридин в 17 мл диметилсульфоксида. Смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. 44 Добавляли воду (16 мл) и смесь экстрагировали 20 мл этилацетата. Органический слой промывали 20 мл 5%-ной лимонной кислоты, 20 мл воды, 20 мл соляного раствора, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении,получая 2,37 г (выход 100%) N-(третбутоксикарбонил)-N-бензил-L-фенилаланиналя. Пример 14. Получение 3(S)-[N-(трет-бутоксикарбонил)-N-бензиламино]-1,2-(S)-эпокси-4-фенилбутана. Способ 1. Раствор, содержащий 2,5 г (7,37 ммоля) N(трет-бутоксикарбонил)-N-бензил-L-фенилаланиналя и 0,72 мл хлорйодметана в 35 мл ТГФ,охлаждали до -78 С. Медленно добавляли, поддерживая температуру ниже -70 С, 4,64 мл раствора н-бутиллития (1,6 М в гексане, 7,42 ммоля). Смесь перемешивали в течение 10 мин при температуре между -70 и -75 С. Последовательно добавляли еще две порции по 0,22 мл хлорйодметана и 1,4 мл н-бутиллития и после каждого добавления смесь перемешивали в течение 10 мин при температуре между -70 и-75 С. Последовательно добавляли еще четыре порции по 0,11 мл хлорйодметана и 0,7 мл нбутиллития и после каждого добавления смесь перемешивали в течение 10 мин при температуре между -70 и -75 С. Смесь нагревали до комнатной температуры в течение 3,5 ч. Реакцию прекращали при температуре ниже 5 С добавлением 24 мл ледяной воды. Двухфазные слои разделяли и водный слой дважды экстрагировали 30 мл этилацетата. Объединенные органические слои трижды промывали 10 мл воды, затем 10 мл соляного раствора, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 2,8 г неочищенного масла желтого цвета. Это неочищенное масло (выход 100%) представляет собой смесь диастереомерных эпоксидов N,S-бис (фенилметил)-N-(трет-бутоксикарбонил)-2S-оксиранметанамина и N,S-бис(фенилметил)-N-(третбутоксикарбонил)-2R-оксиранметанамина. Неочищенную смесь использовали непосредственно на следующей стадии без очистки. Способ 2. К суспензии, содержащей 2,92 г (13,28 ммоля) йодида триметилсульфоксония в 45 мл ацетонитрила, добавляли 1,49 г (13,28 ммоля) трет-бутоксида калия. Добавляли раствор, содержащий 3,0 г (8,85 ммоля) N-(третбутоксикарбонил)-N-бензил-L-фенилаланинала в 18 мл ацетонитрила, и смесь перемешивали 45 при комнатной температуре в течение 1 ч. Смесь разбавляли 150 мл воды и экстрагировали дважды 200 мл этилацетата. Органические слои объединяли и промывали 100 мл воды, 50 мл соляного раствора, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 3,0 г неочищенного масла желтого цвета. Неочищенный продукт очищали с помощью хроматографии на силикагеле (этилацетат:гексан в качестве растворителя для элюирования, 1:8), получая 1,02 г (выход 32,7%) смесь двух диастереомеров: N,Sбис(фенилметил)-N-(трет-бутоксикарбонил)-2Sоксиранметанамина и N,S-бис(фенилметил)-N(трет-бутоксикарбонил)-2R-оксиранметанамина. Способ 3. К суспензии, содержащей 0,90 г (4,42 ммоля) йодида триметилсульфония в 18 мл ацетонитрила, добавляли 0,495 г (4,42 ммоля) третбутоксида калия. Добавляли раствор, содержащий 1,0 г (2,95 ммоля) N-(трет-бутоксикарбонил)-N-бензил-L-фенилаланиналя в 7 мл ацетонитрила, и смесь перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли 80 мл воды и экстрагировали дважды 80 мл этилацетата. Органические слои объединяли и промывали 100 мл воды, 30 мл соляного раствора, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 1,04 г неочищенного масла желтого цвета. Неочищенный продукт представлял собой смесь двух диастереомеров: N,S-бис Получение 3S-[N-(трет-бутоксикарбонил)N-(фенилметил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2R-ола. К раствору, содержащему 500 мг (1,42 ммоля) неочищенного эпоксида (смесь двух диастереомеров N, S-бис(фенилметил)-N(трет-бутоксикарбонил)-2S-оксиранметанамина и N,S-бис(фенилметил)-N-(трет-бутоксикарбонил)-2R-оксиранметанамина) в 0,98 мл изопропанола, добавляли 0,71 мл (7,14 ммоля) изобутиламина. Смесь кипятили с обратным холодильником при 85-90 С в течение 1,5 ч. Смесь концентрировали при пониженном давлении и продукт в виде масла очищали с помощью хроматографии на силикагеле (хлороформ:метанол в качестве растворителя для элюирования,100:6),получая 330 мг 3S-[N-(трет 000533 46 бутоксикарбонил)-N-(фенилметил)амино]-1-(2 метилпропил)амино-4-фенилбутан-2R-ола в виде бесцветного масла (выход 54,5%). Также выделяли 3S-[N-(трет-бутоксикарбонил)-N(фенилметил)амино]-1-(2-метилпропил)амино 4-фенилбутан-2S-ол. Когда в качестве исходного материала использовали очищенный N, Sбис(фенилметил)-N-(трет-бутоксикарбонил)-2Sоксиранметанамин, то после очистки с помощью хроматографии выделяли 3S-[N-(третбутоксикарбонил)N-(фенилметил)амино]-1-(2 метилпропил)амино-4-фенилбутан-2R-ол с выходом 86%. Пример 16.(жидкий, 1,0 М в ТГФ), поддерживая температуру ниже 5 С. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 ч. Смесь охлаждали до 0 С и медленно добавляли 20 мл воды для разложения избыткаBH3 и прекращения образования продукта в смеси, поддерживая температуру ниже 12 С. После прекращения реакции смесь перемешивали в течение 20 мин и концентрировали при пониженном давлении. Реакционную смесь трижды экстрагировали 60 мл этилацетата. Органические слои объединяли и промывали 20 мл воды, 25 мл насыщенного раствора хлорида натрия и концентрировали при пониженном давлении, получая 1,1 г неочищенного масла. Неочищенный продукт очищали с помощью хроматографии на силикагеле (хлороформ:метанол в качестве растворителя для элюирования, 10:6),получая 900 мг (выход 94,4%) 3S-(N-третбутоксикарбонил)амино-4-фенилбутан-1,2Rдиола в виде белого твердого вещества. Пример 17. 47 0 С в виде одной порции добавляли 914 мг толуолсульфонилхлорида. Смесь перемешивали при температуре от 0 до 5 С в течение 5 ч. К реакционной смеси добавляли смесь, содержащую 6,5 мл этилацетата и 15 мл 5%-ного водного раствора бикарбоната натрия, и перемешивали в течение 5 мин. Реакционную смесь трижды экстрагировали 50 мл этилацетата. Органические слои объединяли и промывали 15 мл воды,10 мл насыщенного раствора хлорида натрия и концентрировали при пониженном давлении,получая приблизительно 1,1 г плотного твердого вещества желтого цвета. Неочищенный продукт очищали с помощью хроматографии на силикагеле (этилацетат:гексан в качестве растворителя для элюирования, 1:3), получая 850 мл (выход 74%) 3S-(N-трет-бутоксикарбонил)амино-2R-гидрокси-4-фенилбут-1-илтолуолсульфоната в виде белого твердого вещества. Пример 18. Получение 3S-[N-(трет-бутоксикарбонил)амино]-1-(2-метилпропил)амино-4-фенилбутан-2R-ола. К раствору, содержащему 90 мг (0,207 ммоля) 3S-(N-трет-бутоксикарбонил)амино-2Rгидрокси-4-фенилбут-1-илтолуолсульфоната в 0,143 мл изопропанола и 0,5 мл толуола, добавляли 0,103 мл (1,034 ммоля) изобутиламина. Смесь нагревали до 80-85 С и перемешивали в течение 1,5 ч. Реакционную смесь концентрировали при пониженном давлении при 40-50 С и очищали с помощью хроматографии на силикагеле (хлороформ:метанол в качестве растворителя для элюирования, 10:1), получая 54,9 мл(выход 76,8%) 3S-[N-(трет-бутоксикарбонил) амино]-1-(2-метилпропил)амино-4-фенилбутан 2R-ола в виде белого твердого вещества. Пример 19. Получение N-[3(S)-бензилоксикарбониламино-2(R)-гидрокси-4-фенилбутил]-N-изобутиламина. Раздел А. К раствору, содержащему 75,0 г (0,226 моля) хлорметилкетона N-бензилоксикарбонил-Lфенилаланина в смеси с 807 мл метанола и 807 мл тетрагидрофурана, при -2 С в течение 100 мин добавляли 13,17 г (0,348 моля, 1,54 экв.) твердого борогидрида натрия. Растворители удаляли при пониженном давлении при 40 С и 48 остаток растворяли в этилацетате (приблизительно 1 л). Раствор промывали последовательно 1 М бисульфатом калия, насыщенным раствором бикарбоната натрия и затем насыщенным раствором хлорида натрия. После сушки над безводным сульфатом магния и фильтрации раствор отгоняли при пониженном давлении. К образовавшемуся маслу добавляли гексан (приблизительно 1 л) и смесь нагревали при перемешивании до 60 С. После охлаждения до комнатной температуры собирали твердый продукт и промывали 2 л гексана. Образовавшийся твердый продукт перекристаллизовывали из горячего этилацетата и гексана, получая 32,3 г (выход 43%) N-бензилоксикарбонил-3(S)-амино-1-хлор 4-фенил-2(S)-бутанола, tпл 150-151 С и M+Li+ = 340. Раздел Б. К раствору, содержащему 6,52 г (0,116 моля, 1,2 экв.) гидроксида калия в 968 мл абсолютного этанола, при комнатной температуре добавляли 32,3 г (0,097 моля) N-Сbz-3(S)-амино 1-хлор-4-фенил-2(S)-бутанола. После перемешивания в течение 15 мин растворитель удаляли при пониженном давлении и твердый продукт растворяли в метиленхлориде. После промывки водой, сушки над сульфатом магния, фильтрации и упаривания получали 27,9 г белого твердого вещества. После перекристаллизации из горячего этилацетата и гексана получали 22,3 гN-бензилоксикарбонил-3(S)амино-1,2(S)-эпокси-4-фенилбутана, tпл 102103 С и МН+ 298. Раздел В. Раствор N-бензилоксикарбонил-3(S)-амино-1,2(S)-эпокси-4-фенилбутана (1,00 г, 3,36 ммоля) и изобутиламина (4,90 г, 67,2 ммоля, 20 экв.) в 10 мл изопропилового спирта нагревали с обратным холодильником в течение 1,5 ч. Раствор охлаждали до комнатной температуры,концентрировали в вакууме и затем сливали при перемешивании в 100 мл гексана, после чего продукт кристаллизовался из раствора. Продукт выделяли фильтрацией и сушили на воздухе,получая 1,18 г (выход 95%) N-3(S)фенилметилкарбамоил)амино-2(R)-гидрокси-4 фенилбутил]-N-[(2-метилпропил)]амина,С 22 Н 30N2O3, tпл 108,0-109,5 С, MH+ m/z = 371. Пример 20.(483 мкл, 3,8 ммоля) получали фенилметил [2Rгидрокси-3-[(3-метилбутил)(фенилсульфонил) амино]-1S-(фенилметил)пропил]карбамат. После хроматографии на силикагеле, элюируя хлороформом, содержащим 1% этанола, получали чистый продукт. Анализ: рассчитано для Получение 2R-гидрокси-3-(4-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Раздел А. Получение фенилметилового эфира 2R-гидрокси-3-(4-нитрофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил) пропилкарбаминовой кислоты. К раствору, содержащему 4,0 г (10,8 ммоля)(3,27 г, 32,4 ммоля) триэтиламина. Раствор охлаждали до 0 С и добавляли 2,63 г (11,9 ммоля) 4-нитробензолсульфонилхлорида, перемешивали в течение 30 мин при 0 С, а затем в течение 1 ч при комнатной температуре. Добавляли этилацетат, промывали 5%-ной лимонной кислотой,насыщенным бикарбонатом натрия, соляным раствором, сушили и концентрировали, получая 5,9 г неочищенного продукта. Этот продукт перекристаллизовывали из этилацетата/гексана,получая 4,7 г чистого фенилметилового эфира 2R-гидрокси-3-(4-нитрофенил)сульфонил](2 метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты, m/е = 556 (М+Н). Раздел Б. Получение 2R-гидрокси-3-(4 аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Раствор, содержащий 3,0 г (5,4 ммоля) фенилметилового эфира 2R-гидрокси-3-(4 нитрофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты в 20 мл этилацетата, гидрировали в течение 3,5 ч с использованием в качестве катализатора 1,5 г 10%-ного палладия на угле при избыточном давлении водорода 35 фунтов/кв.дюйм. Катализатор удаляли фильтрацией и раствор концентрировали, получая 2,05 г требуемого 2R-гидрокси-3-(4-аминофенил)сульфонил](2 метилпропил)амино]-1S-(фенилметил)пропиламина, m/е = 392 (М+Н). Получение 2R-гидрокси-3-(3-аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Раздел А. Получение фенилметилового эфира 2R-гидрокси-3-(3-нитрофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил) пропилкарбаминовой кислоты. К раствору, содержащему 1,1 г (3,0 ммоля)N-[3(S)-бензилоксикарбониламино-2(R)-гидрокси-4-фенил]-N-изобутиламина в 15 мл безводного метиленхлорида, добавляли 1,3 мл (0,94 г,9,3 ммоля) триэтиламина. Раствор охлаждали до 0 С и добавляли 0,67 г (3,0 ммоля) 3 нитробензолсульфонилхлорида, перемешивали в течение 30 мин при 0 С, а затем в течение 1 ч при комнатной температуре. Добавляли этилацетат, промывали 5%-ной лимонной кислотой,насыщенным бикарбонатом натрия, соляным раствором, сушили и концентрировали, получая 1,74 г неочищенного продукта. Этот продукт перекристаллизовывали из этилацетата/гексана,получая 1,40 г чистого фенилметилового эфира 2R-гидрокси-3-(3-нитрофенил)сульфонил](2 метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты, m/е = 562 (M+Li). Раздел Б. Получение 2R-гидрокси-3-(3 аминофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Раствор, содержащий 1,33 г (2,5 ммоля) фенилметилового эфира 2R-гидрокси-3-(3 нитрофенил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты в 40 мл смеси метанол:тетрагидрофуран (1:1),гидрировали в течение 1,5 ч с использованием в качестве катализатора 0,70 г 10%-ного палладия на угле при избыточном давлении водорода 40 фунтов/кв.дюйм. Катализатор удаляли фильтрацией и раствор концентрировали, получая 0,87 г требуемого 2R-гидрокси-3-(3-аминофенил) сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Пример 23. 51 К раствору, содержащему 3,35 г безводного N,N-диметилформамида, при 0 С в атмосфере азота добавляли 6,18 г сульфурилхлорида,после чего образовывался твердый продукт. После перемешивания в течение 15 мин добавляли 4,69 г 2,3-дигидробензофурана и смесь выдерживали при 100 С в течение 2 ч. Реакционную смесь охлаждали, сливали на ледяную воду, экстрагировали метиленхлоридом, сушили над сульфатом магния, фильтровали и концентрировали неочищенный продукт. Этот продукт перекристаллизовывали из этилацетата, получая 2,45 г 5-(2,3-дигидробензофуранил) сульфонилхлорида. Раздел Б. Получение фенилметилового эфира 2R-гидрокси-3-(2,3-дигидробензофуран 5-ил)сульфонил](2-метилпропил)амино]-1S(фенилметил)пропилкарбаминовой кислоты. К раствору, содержащему 1,11 г (3,0 ммоля)N-[3(S)-бензилоксикарбониламино-2R-гидрокси-4-фенил]-N-изобутиламина в 20 мл безводного метиленхлорида, добавляли 1,3 мл (0,94 г,9,3 ммоля) триэтиламина. Раствор охлаждали до 0 С и добавляли 0,66 г 5-(2,3-дигидробензофуранил)сульфонилхлорида, перемешивали в течение 15 мин при 0 С, а затем в течение 2 ч при комнатной температуре. Добавляли этилацетат, промывали 5%-ной лимонной кислотой,насыщенным бикарбонатом натрия, соляным раствором, сушили и концентрировали, получая 1,62 г неочищенного продукта. Этот продукт перекристаллизовывали из диэтилового эфира,получая 1,17 г чистого фенилметилового эфира 2R-гидрокси-3-(2,3-дигидробензофуран-5-ил) сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты. Раздел В. Получение 2R-гидрокси-3-(2,3 дигидробензофуран-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Раствор, содержащий 2,86 г фенилметилового эфира 2R-гидрокси-3-(2,3-дигидробензофуран-5-ил)сульфонил] (2-метилпропил)амино]-1S-(фенилметил)пропилкарбаминовой кислоты в 30 мл тетрагидрофурана, гидрировали в течение 16 ч с использованием 0,99 г 10%-ного палладия на угле при избыточном давлении водорода 50 фунтов/кв.дюйм. Катализатор удаляли фильтрацией и фильтрат концентрировали, получая 1,99 г требуемого 2R-гидрокси-3- (2,3 дигидробензофуран-5-ил)сульфонил](2-метилпропил)амино]-1S-(фенилметил)пропиламина. Пример 24. 52 карбонил)амино]-2R-гидрокси-4-фенилбутиламина. К раствору, содержащему 7,51 г (20,3 ммоля) N-[3S-[(фенилметоксикарбонил)амино]-2Rгидрокси-4-фенилбутил]-2-метилпропиламина в 67 мл безводного тетрагидрофурана, добавляли 2,25 г (22,3 ммоля) триэтиламина. После охлаждения до 0 С добавляли 4,4 г(20,3 ммоля) ди-трет-бутилдикарбоната и перемешивание продолжали при комнатной температуре в течение 21 ч. Летучие компоненты удаляли в вакууме, добавляли этилацетат, затем промывали 5%-ной лимонной кислотой, насыщенным бикарбонатом натрия, соляным раствором, сушили над сульфатом магния, фильтровали и концентрировали, получая 9,6 г неочищенного продукта. После хроматографии на силикагеле с использованием смеси 30% этилацетата/гексан получали 8,2 г чистого N-3S(фенилметилкарбамоил)амино]-2R-гидрокси-4 фенил]-1-[(2-метилпропил)амино-2-(1,1-диметилэтоксил)карбонил]бутана, масс-спектр m/е = 477 (M+Li). Пример 25. Получение N-гидроксибензотриазолового эфира 2-метил-3-[(2-фенилэтил)сульфонил] пропионовой кислоты. Раздел А. Раствор, содержащий метилметакрилат (7,25 г, 72,5 ммоля) и фенэтилмеркаптан (10,0 г, 72,5 ммоля) в 100 мл метанола, охлаждали в ледяной бане и обрабатывали метоксидом натрия (100 мг, 1,85 ммоля). Раствор перемешивали в атмосфере азота в течение 3 ч и затем концентрировали в вакууме, получая масло, которое растворяли в простом эфире и промывали 1 н. водным бисульфатом калия, насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали, получая 16,83 г (97,5%) метил-2-(R,S)-метил-4-тиа-6-фенилгексаноата в виде масла. Значение Rf =0,41 при анализе с помощью ТСХ на SiO2 при элюировании гексаном:этилацетатом (20:1, по объему). В альтернативном варианте вместо метилметакрилата можно использовать метил-3-бром-2-метилпропионат. Раздел Б. Раствор метил-2-(R,S)-метил-4 тиа-6-фенилгексаноата (4,00 г, 16,8 ммоля) в 100 мл дихлорметана перемешивали при комнатной температуре и обрабатывали по порциям в течение приблизительно 40 мин метахлорпероксибензойной кислотой (7,38 г, 39,2 ммоля). Раствор перемешивали при комнатной температуре в течение 16 ч, а затем фильтровали: и фильтрат промывали насыщенным водным бикарбонатом натрия, 1 н. гидроксидом натрия, насыщенным водным хлоридом натрия, сушили над безвод 53 ным сульфатом магния, фильтровали и концентрировали, получая 4,50 г (99%) требуемого сульфона. Неочищенный сульфон растворяли в 100 мл тетрагидрофурана и обрабатывали раствором гидроксида лития (1,04 г, 24,5 ммоля) в 40 мл воды. Раствор перемешивали при комнатной температуре в течение 2 мин и затем концентрировали в вакууме. Затем остаток подкисляли 1 н. водным бисульфатом калия до рН = 1,после чего трижды экстрагировали этилацетатом. Объединенный этилацетатный раствор промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали,получая белое твердое вещество. Твердое вещество растворяли в кипящем этилацетате/гексане и давали выстояться без перемешивания, после чего образовывались белые игольчатые кристаллы, которые выделяли фильтрацией и сушили на воздухе, получая 3,38 г (79%) 2-(R,S)метил-3-(-фенэтилсульфонил)пропионовой кислоты, tпл 91-93 С. Раздел В. Раствор, содержащий 2-(R,S)метил-3-(-фенэтилсульфонил)пропионовую кислоту (166,1 мг,0,65 ммоля),Nгидроксибензотриазол (ГОБТ) (146,9 мг, 0,97 ммоля) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭДК) (145,8 мг,0,75 ммоля) в 4 мл безводного диметилформамида (ДМФ), охлаждали до 0 С и перемешивали в атмосфере азота в течение 0,5 ч. Затем этот раствор обрабатывали требуемой аминозащитной группой или промежуточным продуктом в виде изостера сульфонамида и перемешивали при комнатной температуре в течение 16 ч. Раствор выливали в 30 мл 60%-ного насыщенного водного раствора бикарбоната натрия. Затем водный раствор сливали с органического остатка. Органический остаток растворяли в дихлорметане и промывали 10%-ной водной лимонной кислотой, соляным раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали. Может быть использована быстрая хроматография смеси на силикагеле с элюированием гексаном:этилацетатом (1:1), что позволяет разделить диастереомеры. Пример 26. Получение N-гидроксибензотриазолового эфира 2-метил-3-(метилсульфонил) пропионовой кислоты. Раздел А. Раствор метил-2-(бромметил) акрилата (26,4 г, 0,148 моля) в 100 мл метанола обрабатывали по порциям метансульфинатом натрия (15,1 г, 0,148 моля) в течение 10 мин при комнатной температуре. Затем раствор перемешивали при комнатной температуре в течение 1,25 ч и раствор концентрировали в вакууме. 54 Остаток растворяли в воде и 4 раза экстрагировали этилацетатом. Объединенный этилацетатный раствор промывали насыщенным хлоридом натрия, сушили над безводным сульфатом магния, фильтровали и концентрировали, получая 20,7 г белого твердого вещества, которое растворяли в кипящем ацетоне/метил-третбутиловом эфире и давали выстояться без перемешивания, после чего образовывались кристаллы чистого метил-2-(метилсульфонилметил)акрилата (18,0 г, 68%) tпл 65-68 С. Раздел Б. Раствор метил-2-(метилсульфонилметил)акрилата (970 мг, 5,44 ммоля) в 15 мл тетрагидрофурана обрабатывали раствором гидроксида лития (270 мг, 6,4 ммоля) в 7 мл воды. Раствор перемешивали при комнатной температуре в течение 5 мин и затем подкисляли 1 н. водным бисульфатом калия до рН = 1 и раствор трижды экстрагировали этилацетатом. Объединенный этилацетатный раствор сушили над безводным сульфатом магния, фильтровали и концентрировали, получая 793 мг (89%) 2(метилсульфонилметил)акриловой кислоты, tпл 147-149 С. Раздел В. Раствор 2-(метилсульфонилметил)акриловой кислоты (700 мг, 4,26 ммоля) в 20 мл метанола загружали в атмосфере азота в сосуд Фишера-Портера вместе с 10%ным палладием на угле в качестве катализатора. Реакционный сосуд закрывали и продували пять раз азотом, а затем пять раз водородом. Избыточное давление поддерживали в течение 16 ч на уровне 50 фунтов/кв.дюйм, а затем водород заменяли на азот и раствор фильтровали через подушку из целита для удаления катализатора и фильтрат концентрировали в вакууме, получая 682 мг (96%) 2-(R,S)-метил-3-(метилсульфонил) пропионовой кислоты. Раздел Г. Раствор, содержащий 2-(R,S)метил-3-(метилсульфонил)пропионовую кислоту(263,5 мг,1,585 ммоля),Nгидроксибензотриазол (ГОБТ) (322,2 мг, 2,13 ммоля) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭДК) (339,1 мг,1,74 ммоля) в 4 мл безводного диметилформамида (ДМФ), охлаждали до 0 С и перемешивали в атмосфере азота в течение 0,5 ч. Затем этот раствор обрабатывали требуемой аминозащитной группой или промежуточным продуктом в виде изостера сульфонамида и перемешивали при комнатной температуре в течение 16 ч. Раствор выливали в 60 мл 60%-ного насыщенного водного раствора бикарбоната натрия. Затем водный раствор сливали с органического остатка. Органический остаток растворяли в дихлорметане и промывали 10%-ной водной лимонной кислотой, соляным раствором, сушили над безводным сульфатом магния,фильтровали и концентрировали, получая требуемый продукт. Получение N-[2R-гидрокси-3-(1,1-диметилэтокси)карбонил](2-метилпропил)амино]-1Sфенилметил)пропил-3S-[2-R,S-метил-3-(метилсульфонил)]пропанамида. Раздел А. Полученный в примере 24 N[(1,1-диметилэтокси)карбонил]-N-[2-метилпропил]-3S-[N-(фенилметоксикарбонил)амино]-2Rгидрокси-4-фенилбутиламин, растворенный в этаноле, гидрировали при давлении водорода 45 фунтов/кв.дюйм в присутствии 5%-ного Pd/C в качестве катализатора, получаяN-[(1,1-диметилэтокси)карбонил]-N-[2 метилпропил]-3S-[N1-амино]-2R-гидрокси-4 фенилбутиламин. В соответствии со стандартным способом фильтрации катализатора (5%ный Pd/C) и после выпаривания растворителя фильтрата при пониженном давлении с использованием роторного испарителя получали амин формулы Раздел Б. Амин, полученный в разделе А,подвергали взаимодействию в ДМФ с Nгидроксибензотриазоловым эфиром 2-метил-3(метилсульфонил)пропионовой кислоты, полученным в примере 26, при или примерно при комнатной температуре. Раствор промывали раствором бикарбоната натрия и экстрагировали этилацетатом. Этилацетатный экстракт промывали раствором лимонной кислоты, соляным раствором и сушили над сульфатом натрия. Осушитель отфильтровывали и органический растворитель удаляли, получая продукт формулы Остаток перемешивали в этилацетате, добавляли 1,3-бензодиоксол-5-илсульфонилхлорид, а затем триэтиламин, и смесь перемешивали примерно при комнатной температуре. Реакционную смесь разбавляли этилацетатом, промывали насыщенным бикарбонатом натрия и соляным раствором, сушили (MgSO4) и концентрировали, получая требуемый продукт. При необходимости дополнительной очистки и/или разделения изомеров (например, см. ниже) остаток хроматографировали. Пример 27. Получение сульфоновых ингибиторов изL-(+)-S-ацетилмеркаптоизомасляной кислоты. Раздел А. В круглодонную колбу загружали требуемое аминозащитное соединение или промежуточный продукт, представляющий собой изостер сульфонамида (2,575 ммоля), и подвергали сочетанию с L-(+)-S-ацетилмеркаптомасляной кислотой в присутствии гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида(ЭДК) (339,1 мг, 1,74 ммоля) в 10 мл CH2Cl2 и давали перемешиваться при комнатной температуре в течение 16 ч. Раствор концентрировали в вакууме и остаток растворяли в этилацетате,промывали 1 н. KHSO4, насыщенным водным раствором NaHCO3, соляным раствором, суши 57 ли над безводным MgSO4, фильтровали и концентрировали, получая масло, которое может быть очищено с помощью радиальной хроматографии на SiO2 при элюировании этилацетатом с получением чистого продукта. Раздел Б: Раствор продукта, полученного в разделе А (0,85 ммоля), в 10 мл метанола обрабатывали безводным аммиаком в течение приблизительно 1 мин при 0 С. Раствор перемешивали при этой температуре в течение 16 ч и затем концентрировали в вакууме, получая требуемый продукт, который может использоваться непосредственно на следующей стадии без дополнительной очистки. Раздел В. Раствор продукта, полученного в разделе Б (0,841 ммоля), в 10 мл безводного толуола в атмосфере азота быстро последовательно обрабатывали 1,8-диазабицикло [5.4.0] ундек-7-еном (ДБУ) (128,1 мг, 0,841 ммоля) и йодметаном (119,0 мг, 0,841 ммоля). После выдержки в течение 0,5 ч при комнатной температуре реакционную смесь разбавляли этилацетатом, промывали 1 н. KHSO4, насыщенным водным раствором NаНСО 3, соляным раствором,сушили над безводным MgSO4, фильтровали и концентрировали в вакууме, получая требуемый продукт, который может быть использован непосредственно на следующей стадии. Раздел Г. Раствор продукта, полученного в разделе В (0,73 ммоля), и пербората натрия (500 мг, 3,25 ммоля) в 30 мл ледяной уксусной кислоты нагревали до 55 С в течение 16 ч. Раствор концентрировали в вакууме и затем остаток растворяли в этилацетате, промывали водой,насыщенным водным раствором NаНСО 3, соляным раствором, сушили над безводным MgSO4,фильтровали и концентрировали, получая требуемый продукт. Общая методика сочетания сульфонильных соединений с сульфонамидами Смесь, содержащую сульфонилалканоильное соединение (приблизительно 1 ммоль), Nгидроксибензотриазол (1,5 ммоля) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭДК) (1,2 ммоля), растворяли в пригодном растворителе, таком как ДМФ, и давали прореагировать в течение приблизительно 30 мин при 0 С. Требуемое аминозащитное соединение или промежуточный продукт, представляющий собой изостер сульфонамида (1,05 ммоля), растворяли в ДМФ, добавляли к вышеуказанной смеси и перемешивали при комнатной температуре в течение периода, достаточного для завершения реакции. Затем раствор сливали на насыщенный водный раствор NaHCO3 и экстрагировали, например, этилацетатом. Экстракты промывали, сушили, фильтровали и концентрировали. Образовавшийся продукт затем кристаллизовали из пригодного растворителя или смеси растворителей, таких как гексан и этилацетат, с получением конечного продукта. Получение 2(S)-метил-3-(метилсульфонил) пропионовой кислоты. Раздел А. Раствор, содержащий 10 г третбутилового эфира D-(-)-S-бензоилмеркаптоизомасляной кислоты в 20 мл метанола, барботировали газобразным аммиаком при 0 С. Затем реакционной смеси давали нагреться до комнатной температуры, перемешивали в течение ночи и концентрировали при пониженном давлении. Образовавшуюся смесь твердого продукта (бензамид) и жидкости фильтровали, получая 5,21 г светлого масла, которое затем затвердевало. Продукт был идентифицирован как третбутиловый эфир 2(S)-метил-3-меркаптопропионовой кислоты. Раздел Б. К раствору, содержащему 5,21 г трет-бутилового эфира 2(S)-метил-3-меркаптопропионовой кислоты в 75 мл толуола, при 0 С добавляли 4,50 г 1,8-диазабицикло[5.4.0]ундек 7-ена и 1,94 мл метилйодида. После перемешивания при комнатной температуре в течение 2,5 ч удаляли летучие компоненты, добавляли этилацетат, промывали разбавленной соляной кислотой, водой, соляным раствором, сушили и концентрировали, получая 2,82 г светлого масла, идентифицированного как трет-бутиловый эфир 2(S)-метил-3-(тиометил)пропионовой кислоты. Раздел В. К раствору, содержащему 2,82 г трет-бутилового эфира 2(S)-метил-3-(тиометил) пропионовой кислоты в 50 мл уксусной кислоты, добавляли 5,58 г пербората натрия и смесь нагревали до 55 С в течение 17 ч. Реакционную смесь сливали на воду, экстрагировали метиленхлоридом, промывали водным бикарбонатом натрия, сушили и концентрировали, получая 2,68 г трет-бутилового эфира 2(S)-метил-3(метилсульфонил)пропионовой кислоты в виде белого твердого вещества. Раздел Г. К 2,68 г трет-бутилового эфира 2(S)-метил-3-(метилсульфонил)пропионовой кислоты добавляли 20 мл 4 н. соляной кислоты/диоксана и смесь перемешивали при комнатной температуре в течение 19 ч. Растворитель удаляли при пониженном давлении, получая 2,18 г неочищенного продукта, который перекристаллизовывали из этилацетата/гексана, получая 1,44 г 2(S)-метил-3-(метилсульфонил) пропионовой кислоты в виде кристаллов белого цвета. Пример 29.[1S-[1R(R),2S-N-[2Rгидрокси-3-[(2-метилпропил)[(3,4-диметоксифенилсульфонил)амино]-1-(фенилметил) пропил]-2-метил-3-(метилсульфонил)]пропанамида. Раздел А. Раствор, содержащий Nбензилоксикарбонил-3(S)-амино-1,2-(S)-эпокси 4-фенилбутан (50,0 г, 0,168 моля) и изобутиламин (246 г, 3,24 моля, 20 экв.) в 650 мл изопропилового спирта, кипятили с обратным холодильником в течение 1,25 ч. Раствор охлаждали до комнатной температуры, концентрировали в вакууме и затем выливали при перемешивании в 1 л гексана, при этом продукт кристаллизовался из раствора. Продукт выделяли фильтрацией и сушили на воздухе, получая 57,56 г (92%) N[3(S)-бензилоксикарбониламино-2(R)-гидрокси 4-фенил]-N-изобутиламина, tпл 108,0-109,5 С,МН+ m/z = 371. Раздел Б. Раствор N-[3(S)-бензилоксикарбониламино-2(R)-гидрокси-4-фенил]-N-изобутиламина (1,5356 г, 4,14 ммоля) и триэтиламина (522 мг, 5,17 ммоля) в 15 мл дихлорметана обрабатывали 3,4-диметоксибензолсульфонилхлоридом (1, 0087 г, 4,26 ммоля) при комнатной температуре в течение 14 ч. Растворитель удаляли в вакууме и остаток растворяли в этилацетате и затем промывали 1 н. KHSO4, насыщенным водным NаНСО 3, соляным раствором, сушили над безводным MgSO4, фильтровали и концентрировали, получая 2,147 г (90,5%) белого твердого вещества, tпл 124-127C, MCBP(FAB), M+Li: рассчитано для С 30 Н 38N2O7S+Li: 577,2560, обнаружено: 577,2604. Раздел В. Раствор карбаминовой кислоты,продукта, полученного в разделе Б (513 мг, 0,90 ммоля), в 30 мл метанола перемешивали в течение 15 ч при комантной температуре с 20 мг палладиевой черни в качестве катализатора и 10 мл муравьиной кислоты. Катализатор удаляли фильтрацией через диатомовую землю, фильтрат концентрировали в вакууме и остаток растворяли в этилацетате. Этилацетатный раствор промывали насыщенным водным NaHCO3, соляным раствором и сушили над безводнымMgSO4, фильтровали и концентрировали в вакууме, получая 386 мг белого твердого продукта(выход 98%), tпл 123-130 С, МС (FAB), M+Li+ = 443, который непосредственно использовали на следующей стадии без дополнительной очистки. Раздел Г. Смесь, содержащую 2(S)-метил 3-(метилсульфонил)пропионовую кислоту (128 мг, 0,77 ммоля), N-гидроксибензотриазол (179,9 мг, 1,17 ммоля) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида(177,3 мг, 0,92 ммоля), растворяли в 1,5 мл диметилформамида (ДМФ) и давали прореагировать в течение 30 мин при 0 С. Полученный в разделе В амин (359 мг, 0,82 ммоля), растворенный в 1 мл ДМФ, добавляли к вышеуказанной смеси и перемешивали при комнатной температуре в течение 48 ч. Затем раствор выливали в 75 мл насыщенного водного NaHCO3 и экстра 000533 60 гировали этилацетатом. Этилацетатные экстракты промывали 5%-ной водной лимонной кислотой, насыщенным водным NаНСО 3, соляным раствором и сушили над безводным MgSO4,фильтровали и концентрировали, получая 220 мг прозрачного масла. Продукт кристаллизовали из гексана и этилацетата, получая 178 мг[1S-[1R(R),2S-N-[2Rгидрокси-3-[(3-метилбутил)[(4-аминофенилсульфонил)амино]-1-(фенилметил)пропил]-2 метил-3-(метилсульфонил)] пропанамида. Раздел А. Раствор, содержащий Nбензилоксикарбонил-3(S)-амино-1,2(S)-эпокси 4-фенилбутан (11,54 г, 38,81 ммоля) и изоамиламин (66,90 г, 0,767 моля, 19,9 экв.) в 90 мл изопропилового спирта, кипятили с обратным холодильником в течение 3,1 ч. Раствор охлаждали до комнатной температуры и частично концентрировали в вакууме, а оставшийся раствор сливали при перемешивании на 200 мл гексана, после чего продукт кристаллизовался из раствора. Продукт выделяли фильтрацией и сушили на воздухе, получая 11,76 г (79%) N3(S)-фенилметокси)карбонил)амино-2(R)гидрокси-4-фенилбутил]-N-(3-метилбутил) амина, tпл 118-122C, MC (FAB): МН+ = 385. Раздел Б. Раствор N-3(S)-фенилметокси) карбонил)амино-2(R)-гидрокси-4-фенилбутил]N-(3-метилбутил)амина (1,1812 г, 3,07 ммоля) и триэтиламина (325,7 мг, 3,22 ммоля) в 20 мл дихлорметана обрабатывали 4-нитробензолсульфонилхлоридом (767 мг, 90%-ной чистоты,3,11 ммоля) при комнатной температуре в течение 10 мин. Растворитель удаляли в вакууме и остаток растворяли в этилацетате, а затем промывали 1 н. KHSO4, насыщенным водным NaHCO3, соляным раствором, сушили над безводным MgSO4, фильтровали и концентрировали,получая 2,3230 г твердого вещества желтоватокоричневого цвета, которое кристаллизовали из этилацетата и петролейного эфира, получая 870 мг (50%) чистого продукта, tпл 130-132 С,МСВР(раствор не был полностью гомогенным) обрабатывали 70 мг 10%-ного палладия на угле в качестве катализатора и гидрировали при избыточном давлении 42 фунта/кв.дюйм в течение
МПК / Метки
МПК: C07D 317/62, C07C 311/00, A61K 31/34
Метки: протеазы, ингибиторов, ретровирусной, сульфонилалканоиламиногидроксиэтиламиносульфонамид, качестве
Код ссылки
<a href="https://eas.patents.su/30-533-sulfonilalkanoilaminogidroksietilaminosulfonamid-v-kachestve-ingibitorov-retrovirusnojj-proteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонилалканоиламиногидроксиэтиламиносульфонамид в качестве ингибиторов ретровирусной протеазы</a>
Предыдущий патент: Гербицидная композиция, содержащая 4-бензоилизоксазол и аклонифен.
Следующий патент: Карбапенемовый антибиотик, композиция и способ получения
Случайный патент: Способ изготовления неплоского изделия в виде короба


































