Производные стрептограминов, способ их получения и композиции на их основе
Номер патента: 5199
Опубликовано: 30.12.2004
Авторы: Баррьер Жан-Клод, Десмазо Паскаль, Ашар Даниель, Рибей Ив, Букерель Жан, Ронан Батист, Леконт Жан-Пьер, Бак Эрик, Гризони Серж
Формула / Реферат
1. Производные стрептограмина группы A общей формулы (I)

в которой
R1 означает атом галогена или азидо- или тиоцианатогруппу;
R2 означает атом водорода, или метил, или этил;
R3 означает атом водорода или радикал R'3-CO-, в котором R'3 означает фенил или фенилалкил, незамещенный или замещенный на фенильном радикале [одним или несколькими радикалами, выбираемыми из алкила, возможно содержащего радикал NR'R", в котором радикалы R' и R", одинаковые или различные, могут быть атомами водорода или алкильными радикалами, которые вместе с атомом азота, с которым они связаны, могут образовывать насыщенный или ненасыщенный 3-8-членный гетероциклил, возможно включающий другой гетероатом, выбираемый из атомов кислорода, серы или азота, причем указанный выше гетероцикл может быть сам замещен одним или несколькими радикалами (алкилом, гидроксиалкилом, алкилоксиалкилом, алкилоксикарбонилалкилом, фенилом, насыщенным или ненасыщенным 3-8-членным гетероциклилом, или гетероциклилалкилом, или радикалом -CH2-CO-NR'R"), или же R' и/или R" могут представлять собой гидроксиалкил, фенил, гетероциклилалкил 3-8-членный, насыщенный или ненасыщенный; радикал -CO-NR'R", в котором NR'R" имеет указанное выше значение, или алкил, или ацил, замещенные NR'R", указанным выше],
или же R'3 может быть выбран из фенильных или фенилалкильных радикалов, замещенных на фенильном радикале одним или несколькими радикалами [выбираемыми из алкильных радикалов, которые могут быть замещены алкилокси- или алкилтиогруппой, которые сами возможно содержат карбоксил или радикал NR'R", указанный выше, или выбираемыми из ацилоксигрупп, которые могут быть замещены NR'R", указанным выше],
или же R'3 может быть выбран из алкильных или циклоалкильных радикалов, возможно замещенных [карбоксилом, карбоксиалкилдисульфанилом или радикалом NR'R", -CH2-NR'R", -CO-NR'R", или алкилоксикарбонилом, алкилоксигруппой или алкилдисульфанилом, возможно замещенными -NR'R" или -CO-NR'R", в которых NR'R" имеет указанное выше значение],
или же R'3 может быть выбран из насыщенных или ненасыщенных 3-8-членных гетероциклильных радикалов, возможно замещенных [алкилом или ацилом, которые сами также возможно замещены NR'R"]; при условии, что алкильные или ацильные радикалы или алкильные или ацильные части радикалов являются линейными или разветленными и содержат 1-12 атомов углерода;
связь ---- означает простую связь (стереохимия 27R) или двойную связь;
и их соли, когда они существуют.
2. Производные стрептограмина группы A по п.1, в которых
R1 означает атом фтора, хлора, брома или иода или азидо- или тиоцианатогруппу;
R2 означает метил;
R3 означает атом водорода или радикал R'3-CO-, в котором R'3 означает фенил или фенилалкил, незамещенные или замещенные на фенильном радикале [одним или несколькими радикалами, выбираемыми из алкила, возможно содержащего радикал NR'R", в котором радикалы R' и R", одинаковые или различные, могут быть атомами водорода или алкильными радикалами, которые вместе с атомом азота, с которым они связаны, могут образовывать насыщенный или ненасыщенный 3-8-членный гетероциклил, возможно содержащий другой гетероатом, выбираемый из атомов кислорола, серы или азота, причем указанный выше гетероцикл сам может быть также замещен одним или несколькими радикалами (алкилом, гидроксиалкилом, алкилоксиалкилом, алкилоксикарбонилалкилом, фенилом, насыщенным или ненасыщенным 3-8-членным гетероциклилом или гетероциклилалкилом или радикалом -CH2-CO-NR'R"), или же R' и/или R" могут означать гидроксиалкил, фенил, насыщенный или ненасыщенный 3-8-членный гетероциклилалкил, радикал -CO-NR'R", в котором NR'R" имеет указанное выше значение, или алкил или ацил, замещенные NR'R", указанным выше], или же R'3 может представлять собой фенил, замещенный одним или несколькими радикалами [выбираемыми из алкильных радикалов, которые могут быть замещены алкилокси- или алкилтиогруппой, которая сама возможно содержит карбоксил или радикал NR'R", указанный выше, или выбираемыми из ацилоксигрупп, которые могут быть замещены NR'R", указанной выше], или же R'3 может быть выбран из алкильных или циклоалкильных радикалов, возможно замещенных [карбоксилом, карбоксиалкилдисульфанилом или радикалом NR'R", -CH2-NR'R", -CO-NR'R" или алкилоксикарбонилом, алкилоксигруппой или алкилдисульфанилом, возможно замещенными NR'R" или -CO-NR'R", в которых NR'R" является таким, как указано выше], или же R'3 может быть выбран из насыщенных или ненасыщенных 3-8-членных гетероциклильных радикалов, возможно замещенных [алкилом или ацилом, которые сами возможно замещены NR'R"], причем гетероциклы выбирают из пирролидинила, имидазолила, пиридила, пиперидинила, пиперазинила или морфолинила; при условии, что алкильные или ацильные радикалы или алкильные или ацильные части радикалов являются линейными или разветвленными и содержат 1-12 атомов углерода;
связь ---- означает простую связь (стереохимия 27R) или двойную связь;
а также их соли, когда они существуют.
3. Производные стрептограмина группы A по любому из пп.1-2, представляющие собой (16R)-16-дезоксо-16-фторпристинамицин IIB.
4. Производные стрептограмина группы A по любому из пп.1-2, представляющие собой (16R)-16-дезоксо-16-тиоцианатопристинамицин IIB.
5. Производные стрептограмина группы A по любому из пп.1-2, представляющие собой (16R)-16-дезоксо-16-хлорпристинамицин IIB.
6. Производные стрептограмина группы A по любому из пп.1-2, представляющие собой (16R)-16-азидо-16-дезоксопристинамицин IIB.
7. Производные стрептограмина группы A по любому из пп.1-2, представляющие собой (16R)-16-дезоксо-16-фторпристинамицин IIA.
8. Способ получения производных стрептограмина группы A по п.1, отличающийся тем, что галогенируют или превращают в азид, или превращают в тиоцианат производное стрептограмина общей формулы (II)
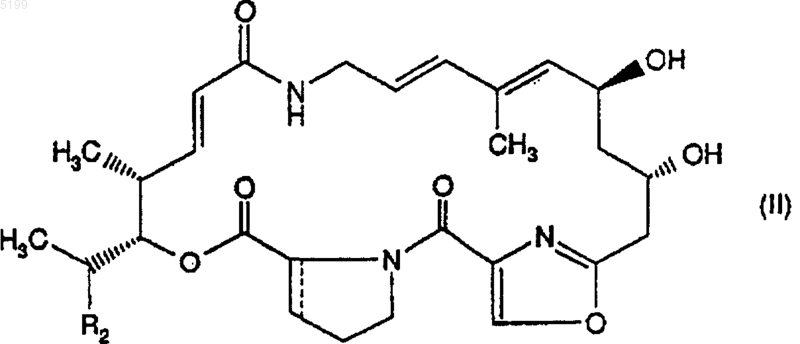
в которой R2 имеет указанное выше значение; связь --- означает простую связь (стереохимия 27R) или двойную связь; и гидроксильная функциональная группа которого в положении 14 предварительно защищена, затем удаляют защитную группу и, в случае необходимости, для получения производного стрептограмина группы A, в котором R3 является иным, чем атом водорода, вводят остаток алифатического, циклоалифатического, ароматического, аралифатического, гетероциклического или гетероциклилалифатического сложного эфира, который может быть замещен (R3), и, в случае необходимости, превращают в соль.
9. Способ по п.8, отличающийся тем, что реакцию осуществляют в присутствии трифторида аминосульфида или в присутствии тетрафторида серы, при использовании реагента, такого как тетраалкиламмоний-, триалкилбензиламмоний- или триалкилфениламмонийгалогенид, -азид или -тиоцианат, или при использовании галогенида, азида или тиоцианата щелочного металла с добавленным, в случае необходимости, краун-эфиром.
10. Способ по п.8, отличающийся тем, что реакцию фторирования осуществляют путем воздействия фторирующего агента, выбираемого из фторида серы, гексафторпропилдиэтиламина или N-(2-хлор-1,1,2-трифторэтил)диэтиламина.
11. Способ по любому из пп.8, 9 или 10, отличающийся тем, что, в случае необходимости, этерификацию осуществляют любым известным способом, который не затрагивает остальной части молекулы.
12. Способ по любому из пп.8, 9 или 10, отличающийся тем, что трифторид аминосульфида может быть выбран из трифторида диэтиламиносульфида, трифторида бис(2-метоксиэтил)аминосульфида или трифторшфр морфолиносульфида.
13. Фармацевтическая композиция, включающая производное стрептограмина группы A по п.1, как таковое или в сочетании по меньшей мере с одним производным стрептограмина группы B, в случае необходимости, в форме соли и/или в сочетании с одним или несколькими совместимыми и фармацевтически приемлемыми разбавителями или добавками.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что производное стрептограмина группы B выбирают из природных компонентов пристинамицина IA, пристинамицина IB, пристинамицина IC, пристинамицина ID, пристинамицина IE, пристинамицина IF, пристинамицина IG, виргиниамицина S1, S3 или S4, вернамицина B или C, этамицина, или из полусинтетических производных общей формулы (A)
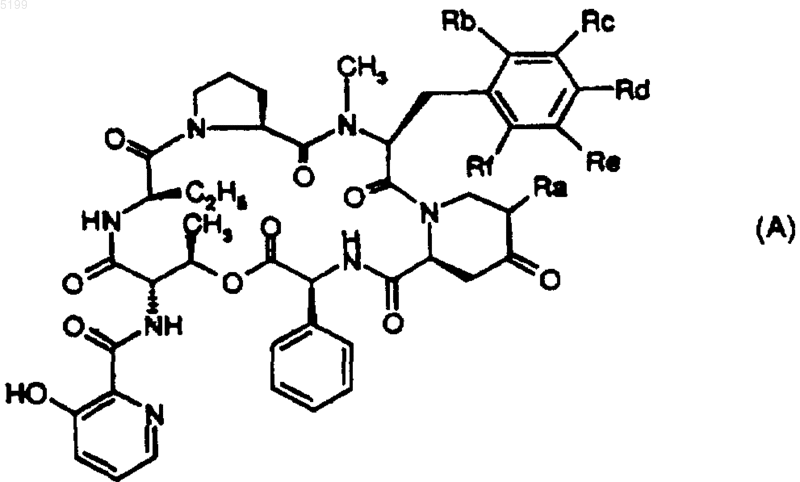
в которой
1. Rb, Rc, Re и Rf означают атомы водорода, Rd означает атом водорода или диметиламиногруппу и Ra означает радикал структуры -CH2R'a, в котором R'a означает 3-тиопирролидинильную, 3- (или 4)тиопиперидильную группу, которые могут быть замещены алкилом, алкилтиогруппой, замещенной 1 или 2 гидроксисульфонильной, алкиламино-, диалкиламиногруппой (которая сама может быть замещена меркапто- или диалкиламиногруппой), или замещенной 1 или 2 возможно замещенными пиперазиновыми циклами, морфолино-, тиоморфолино-, пиперидино-, 1-пирролидинильным, 2-, 3- или 4-пиперидильным или 2- или 3-пирролидинильным циклами (которые могут быть замещены алкилом), или же Ra означает радикал структуры =CHR'a, в котором R'a означает 3-аминопирролидинильную, 3-(или 4)аминопиперидильную, 3-оксипирролидинильную, 3-(или 4)оксипиперидильную, 3-тиопирролидинильную, 3-(или 4)тиопиперидильную группу, которые могут быть замещены алкилом; или R'a означает алкиламино-, алкилокси- или алкилтиогруппу, замещенные 1 или 2 гидроксисульфонильными, алкиламино-, диалкиламиногруппами (которые также могут быть замещены диалкиламиногруппой), или триалкиламмониевой группой, 4- или 5-имидазолильной группой, или 1 или 2 возможно замещенными пиперазиновыми циклами, морфолино-, тиоморфолино-, пиперидино-, 1-пирролидинильным, 2-, 3- или 4-пиперидильным или 2- или 3-пирролидинильным циклами (которые могут быть замещены алкилом), или
Ra означает 3-(или 4)тиометилхинуклидинил; или же
2. Ra означает атом водорода и
a) либо Rb, Re и Rf означают атомы водорода, Rd означает радикал -NHCH3 или -N(CH3)2 и Rc означает атом хлора или брома или означает алкенил, содержащий 3-5 атомов углерода [если Rd означает -N(CH3)2];
b) либо Rb, Rd, Re и Rf означают атом водорода и Rc означает атом галогена или аминомоноалкил, аминодиалкил, алкилоксигруппу, трифторметилоксигруппу, тиоалкил, алкил C1-C3 или тригалогенметил;
c) либо Rb, Rc, Re и Rf означают атом водорода и Rd означает атом галогена или этиламино-, диэтиламино- или метилэтиламино-, алкилокси- или трифторметилоксигруппу, тиоалкил, алкил C1-C6, арил или тригалогенметил;
d) либо Rb, Re и Rf означают атом водорода и Rc означает атом галогена или аминомоноалкил или аминодиалкил, алкилокси- или трифторметилоксигруппу, тиоалкил, алкил C1-C3 и Rd означает атом галогена или аминогруппу, аминомоноалкил или аминодиалкил, алкилокси- или трифторметилоксигруппу, тиоалкил, алкил C1-C6 или тригалогенметил;
e) либо Rc, Re и Rf означают атом водорода и Rb и Rd означают метил;
или же из полусинтетических производных общей формулы (B)
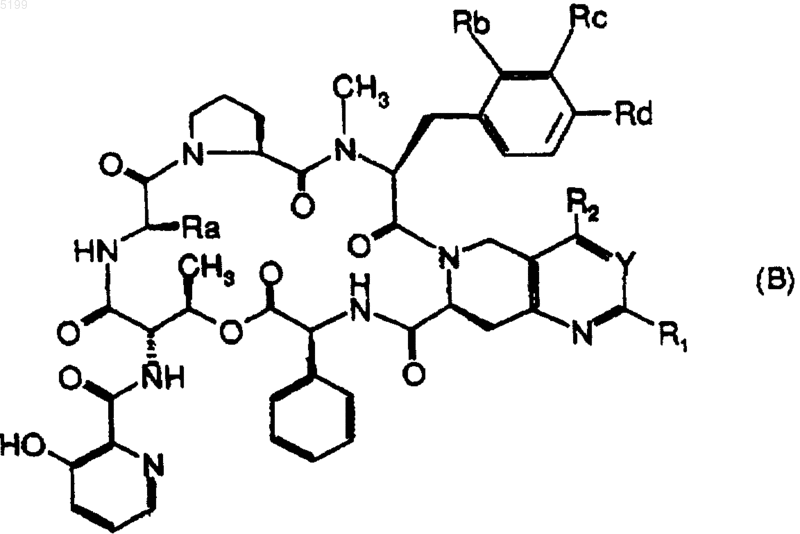
в которой
Y означает атом азота или радикал =CR3-;
R1 означает атом водорода, алкил (с 1-8 атомами углерода), алкенил (с 2-8 атомами углерода), циклоалкил (с 3-8 атомами углерода); насыщенный или ненасыщенный (3-8-членный гетероциклил; фенил; замещенный [одним или несколькими атомами галогена или гидроксильными, алкильными, алкилокси-, алкилтио-, алкилсульфинильными, алкилсульфонильными радикалами, амино-, алкиламино- или диалкиламиногруппами] фенил или радикал NR'R", где R' и R", одинаковые или различные, могут представлять собой атомы водорода или алкилы (с 1-3 атомами углерода) или вместе с атомом азота, с которым они связаны, могут образовывать 3-8-членный гетероцикл, возможно содержащий другой гетероатом, выбираемый из атомов кислорода, серы или азота, возможно замещенного [алкилом, алкенилом (с 2-8 атомами углерода), циклоалкилом (с 3-6 атомами углерода); насыщенным или ненасыщенным (4-6-членным) гетероциклилом; бензилом, фенилом или замещенным фенилом, таким как указано выше при определении R1];
или же, когда Y означает радикал =CR3-, R1 также может означать галогенметил, гидроксиметил, алкилоксиметил, алкилтиометил, алкильная часть которого возможно замещена NR'R", алкилсульфинилметилом, алкилсульфонилметилом, ацилоксиметилом, бензоилоксиметилом, циклопропиламинометилом или группой -(CH2)nNR'R" (где n означает целое число 1-4 и R' и R" имеет указанные выше значения),
или же, если R3 означает атом водорода, R1 также может означать формил, карбоксил, алкилоксикарбонил или -CONR'R", в котором R' и R" имеют указанные выше значения;
или же, когда Y означает атом азота, R1 также может означать радикал -XRш, в котором X означает атом кислорода или серы, сульфинил или сульфонил или радикал NH и Rш означает алкил (с 1-8 атомами углерода), циклоалкил (с 3-6 атомами углерода); насыщенный или ненасыщенный (3-8-членный) гетероциклил; (3-8-членный) гетероциклилметил, гетероциклильная часть которого связана с метильным радикалом через атом углерода; фенил; замещенный [одним или несколькими атомами галогена или гидроксильными, алкильными, алкилокси-, алкилтио-, алкилсульфинильными, алкилсульфонильными радикалами; амино-, алкиламино- или диалкиламиногруппами] фенил или радикал -(CH2)nNR'R", в котором R' и R" имеют указанные выше значения и n означает целое число 2-4, или же, если X означает NH, Rш также может означать атом водорода;
R2 означает атом водорода или алкил (с 1-3 атомами углерода);
R3 означает атом водорода или алкил, карбоксил, алкилоксикарбонил или карбамоил структуры -CO-NR'R", в которой R' и R" имеют указанные выше значения;
Ra означает метил или этил и
Rb, Rc и Rd имеют указанные ниже значения
1) Rb и Rc означают атомы водорода и Rd означает атом водорода или метиламино- или диметиламиногруппу;
2) Rb означает атом водорода; Rc означает атом водорода, хлора или брома или означает алкенил (C3-C5); и Rd означает радикал -NMe-R'", в котором R'" означает алкил, гидроксиалкил (C2-C4) или алкенил (C2-C8), возможно замещенный фенилом, циклоалкил(C3-C6)метилом, бензилом; замещенным [одним или несколькими атомами галогена или гидроксильным, алкильным, алкилокси-, алкилтио-, алкилсульфинильным, алкилсульфонильным радикалами; амино-, алкиламино- или диалкиламиногруппами] бензилом, гетероциклилметилом или гетероциклилэтилом, гетероциклильная часть которого является насыщенной или ненасыщенной и 5-6-членной и содержит 1 или 2 гетероатома, выбираемых из атомов серы, кислорода или азота, возможно замещенного [алкилом, алкенилом (с 2-8 атомами углерода), циклоалкилом (с 3-6 атомами углерода); насыщенным или ненасыщенным (4-6-членным) гетероциклилом, фенилом; замещенным фенилом, таким, как указано выше при определении R1, или бензилом],
или же R'" означает цианометил или радикал -CH2CORe, в котором либо Re означает -OR'e, где R'e представляет собой атом водорода, алкил (с 1-6 атомами углерода), алкенил (с 2-6 атомами углерода), бензил или гетероциклилметил, гетероциклильная часть которого является 5-6-членной и содержит 1 или 2 гетероатома, выбираемых из атомов серы, кислорода или азота, либо Re означает алкиламино-, алкилметиламино-, гетероциклиламино- или гетероциклилметиламиногруппу, гетероциклильная часть которой является насыщенной и 5-6-членнощ ш содержит 1 или 2 гетероатома, выбираемых из атомов серы, кислорода или азота, возможно замещенного алкилом, бензилом или алкилоксикарбонилом;
3) Rb означает атом водорода, Rd означает радикал -NHCH3 или -N(CH3)2 и Rc означает атом хлора или брома или означает алкенил (C3-C5) [если Rd означает -N(CH3)2];
4) Rb и Rd означают атомы водорода и Rc означает атом галогена или алкиламино- или диалкиламино-, алкилокси-, трифторметоксигруппу; тиоалкил, алкил (C1-C6) или тригалогенметил;
5) Rb и Rc означают атомы водорода и Rd означает атом галогена или этиламино-, диэтиламино- или метилэтиламино-, алкилокси- или трифторметокси-, алкилтиогруппу; алкилсульфинил, алкилсульфонил, алкил (C1-C6), фенил или тригалогенметил;
6) Rb означает атом водорода; Rc означает атом галогена, или алкиламино- или диалкиламино-, алкилокси- или трифторметоксигруппу; тиоалкил, алкил (C1-C3) и Rd означает атом галогена или амино-, алкиламино- или диалкиламино-, алкилокси или трифторметоксигруппу; тиоалкил, алкил (C1-C6) или тригалогенметил;
7) Rc означает атом водорода и Rb и Rd означают метил;
а также их солей.
Текст
1 Настоящее изобретение относится к производным группы А стрептограминов общей формулы (I) а также к их солям, которые обладают значительной антибактериальной активностью. Из известных стрептограминов пристинамицин (RP 7293), антибактериальный продукт природного происхождения, был выделен впервые в 1955 г. из Streptomyces pristinaespiralis. Пристинамицин, имеющийся в продаже под названием Pyostacine, представляет собой главным образом пристинамицин IIA, ассоциированный с пристинамицином IА. Другой антибактериальный продукт класса стрептограминов, виргиниамицин, был выделен из Streptomyces virginiae, ATCC 13161 [Antibiotics and Chemotherapy, 5, 632 (1955)]. Виргиниамицин (Staphylomycine) представляет собой главным образом фактор M1 (VM1), ассоциированный с фактором S (VS). Полусинтетические производные стрептограминов структуры в которых n означает 0-2, описаны в европейских патентах ЕР 135410 и ЕР 191662. В сочетании с полусинтетическим компонентом группы В стрептограминов они проявляют синергизм действия и их используют в виде инъекций. В международной заявке на патент WO 99/05165 описаны производные группы А стрептограминов общей формулы-NR'OR"', R2 означает атом водорода, метил или этил, и связь - - - означает простую связь или двойную связь, которые являются антимикробными средствами. Данные производные, однако, не достигают особенно высоких уровней активности и,кроме того, не всегда обладают также широким спектром действия, который желателен. 2 В настоящее время найдено, что производные стрептограмина группы А общей формулыR1 означает атом галогена или азидо- или тиоцианатогруппу;R2 означает атом водорода или метил или этил;R3 означает атом водорода или радикалR'3-CO-, в котором R'3 означает фенил или фенилалкил, незамещенный или замещенный на фенильном радикале [одним или несколькими радикалами, выбираемыми из алкила, возможно содержащего радикал NR'R", в котором радикалы R' и R", одинаковые или разные, могут быть атомами водорода или алкильными радикалами,которые вместе с атомом азота, с которым они связаны, могут образовывать насыщенный или ненасыщенный 3-8-членный гетероциклил, возможно включающий другой гетероатом, выбираемый из атомов кислорода, серы или азота,причем указанный выше гетероцикл может быть сам также замещен одним или несколькими радикалами (алкилом, гидроксиалкилом, алкилоксиалкилом, алкилоксикарбонилалкилом, арильным, 3-8-членным гетероциклильным или гетероциклилалкильным радикалом, насыщенными или ненасыщенными, или радикалом -СН 2-СОNR'R"), или же R' и/или R" могут представлять собой гидроксиалкил, фенил, 3-8-членный гетероциклический радикал, насыщенный или ненасыщенный, или радикал -CO-NR'R", в которомNR'R" имеет указанное выше значение, или алкил или ацил, замещенные группой NR'R", описанной выше],или же R'3 может быть выбран из фенильных или фенилалкильных радикалов, замещенных на фенильном радикале одним или несколькими радикалами [выбираемыми из алкильных радикалов, которые могут быть замещены алкилокси- или алкилтиогруппой, которые сами могут содержать радикал карбокси или радикал NR'R", описанный выше, или выбираемыми из ацилоксигрупп, которые могут быть замещены группой NR'R", указанной выше],или же R'3 может быть выбран из алкильных или циклоалкильных радикалов, возможно замещенных [карбокси, карбоксиалкилдисульфанилом или радикалом NR'R", -СН 2-NR'R",-CO-NR'R", или алкилоксикарбонилом, алкилоксигруппой или алкилдисульфанилом, возможно замещенными -NR'R" или -CO-NR'R", в которых NR'R" имеет указанное выше значение],или же R'3 может быть выбран из насыщенных или ненасыщенных 3-8-членных гетероциклических радикалов, возможно замещенных [алкилом или ацилом, которые сами также могут быть замещены NR'R"]; связь - - - означает простую связь (стереохимия 27R) или двойную связь; 3 и их соли, когда они существуют, проявляют особенно сильную антибактериальную активность при использовании индивидуально или в сочетании с производным стрептограмина группы В и/или обладают более широким спектром действия по сравнению с обычным спектром действия стрептограминов. Согласно изобретению, когда R1 означает атом галогена, он может быть выбран из атомов фтора, хлора, брома или йода. В общей формуле (I), за исключением специального указания, алкильные или ацильные радикалы или алкильные или ацильные части радикалов являются линейными или разветвленными и содержат 1-12 атомов углерода; гетероциклические радикалы могут быть выбраны, в частности, из пирролидинила, пирролила,фурила, тиенила, имидазолила, пиридина, пиперидинила, пиперазинила, морфолинила, тиоморфолинила, пиразинила, пиримидинила, пиридазинила, имидазолидинила; арильные радикалы могут быть выбраны, в частности, из возможно замещенных фенильных радикалов и в особенности фенильных радикалов, замещенных алкилом, алкилоксигруппой, галогеном или радикалом -СН 2 ОН, -(CH2)n-NH2, - (СН 2)n-NНалкил или -(СН 2)n-N(алкил)2. Производные стрептограмина общей формулы (I) могут быть получены галогенированием, превращением в азид или превращением в тиоцианат производного стрептограмина общей формулы (II) в которой R2 имеет указанное выше значение; связь - - - означает простую связь (стереохимия 27R) или двойную связь; и гидроксильная функциональная группа которого в положении 14 предварительно защищена, с последующим удалением защитной группы и, в случае необходимости, для получения производного общей формулы (I), в котором R3 является иным, чем атом водорода, введением радикала R3'-CO-,который может быть замещен, согласно обычным способам, которые не затрагивают остальной части молекулы. Реакции галогенирования, превращения в азид или превращения в тиоцианат могут быть осуществлены в присутствии трифторида аминосульфида (например, такого как трифторид диэтиламиносульфида, трифорид бис(2-метоксиэтил)аминосульфида (Deoxofluor), трифторид морфолиносульфида) или, альтернативно, в присутствии тетрафторида серы, с помощью реагента, например, такого как тетраалкиламмоний-, триалкилбензиламмоний- или триалкилфениламмонийгалогенид, -азид или -тио 005199 4 цианат, или с помощью галогенида, азида или тиоцианата щелочного металла с добавленным,в случае необходимости, краун-эфиром. Реакции фторирования также могут быть осуществлены путем воздействия фторирующего агента,например, такого как фторид серы [например,трифторид морфолиносульфида, тетрафторид серы (J. Org. Chem., 40, 3808 (1975, трифторид диэтиламиносульфида (Tetrahedron, 44, 2875(1988, трифторид бис(2-метоксиэтил)аминосульфида (Deoxofluor). Альтернативно, реакции фторирования также можно осуществлять с помощью фторирующего агента, например, такого как гексафторпропилдиэтиламин (JP 2039546) или N-(2-хлор-1,1,2-трифторэтил) диэтиламин. Если используют тетраалкиламмонийгалогенид, -азид или -тиоцианат, то последний может быть выбран, например, из тетраметиламмоний-, тетраэтиламмоний-, тетрапропиламмоний-, тетрабутиламмоний- (например, тетра-нбутиламмоний-), тетрапентиламмоний-, тетрациклогексиламмоний-, триэтилметиламмоний-,трибутилметиламмоний- или триметилпропиламмонийгалогенида, -азида или тиоцианата. Реакции осуществляют в органическом растворителе, таком как хлорированный растворитель (например, дихлорметан, дихлорэтан,хлороформ), или в простом эфире (как, например, тетрагидрофуран), при температуре от-78 до 40 С (предпочтительно при 0-30 С). Предпочтительно реакции осуществляют в атмосфере аргона или азота. Понятно, что использование гидроксисодержащего производного конфигурации (16S) приводит к производному конфигурации (16R). Введение и удаление защитной группы в случае гидрокси в положении 14 осуществляют обычными методами, которые не затрагивают остальной части молекулы, в частности, при использовании методов, описанных T.W. Greene и P.G.M. Wuts "Protective Groups in Organic(1973). Защиту осуществляют, например, с помощью триалкилсилильного, алкилдифенилсилильного (например, трет-бутилдифенилсилильного и трет-бутилдиметилсилильного) или аллильного радикала, которые вводят и удаляют как описано ниже в примерах. В случае необходимости, когда желают получить продукт общей формулы (I), в котором R3 означает радикал R3'-CO-, который может быть замещен, последующую операцию этерификации осуществляют обычными способами, которые не затрагивают остальной части молекулы. Этерификацию в особенности проводят реакцией кислоты или реакционноспособного производного кислоты (например, такого как хлорангидрид кислоты, реакционноспособный сложный эфир, ангидрид), возможно в присут 5 ствии связующего агента, такого как карбодиимид (например, дициклогексилкарбодиимид), и третичного амина (триалкиламина, такого как триэтиламин или диизопропилэтиламин, или пиридина или его производного) и, в случае необходимости, катализатора, такого как 4-Nдиметиламинопиридин, при температуре от-40 до +80 С, в органическом растворителе, таком как амид (например, диметилформамид илиN-метил-2-пирролидинон), пиридин, галогенированный растворитель (например, дихлорметан, дихлорэтан или хлороформ) или простой эфир (тетрагидрофуран, диоксан, диметоксиэтан). Понятно, что функциональные группы,которые могут влиять на реакцию, предварительно защищают, затем снимают защиту после реакции. Используемую кислоту или реакционноспособное производное кислоты получают, как описано ниже в примерах или по аналогии с описанными способами. Дигидроксилированное производное стрептограмина группы А общей формулы (II) может быть получено селективным восстановлением компонента природного пристинамицина общей формулы (III) в которой R2 имеет указанное выше значение и связь - - - означает простую связь (стереохимия 27R) или двойную связь, с последующим отделением эпимерной формы 16S. Восстановление осуществляют преимущественно в присутствии восстановителя, такого как боргидрид щелочного металла, например боргидрид натрия или триацетоксиборгидрид натрия, в органическом растворителе, выбираемом из хлорированных растворителей (таких,например, как дихлорметан, дихлорэтан, хлороформ), тетрагидрофурана, уксусной кислоты и спиртов, таких как, например, метанол, этанол или 2-пропанол, при температуре от -78 до 40 С. Разделение эпимерных форм 16R и 16S осуществляют обычными методами; например,разделение эпимерных форм можно осуществлять хроматографией, флэш-хроматографией,высокоэффективной жидкостной хроматографией (ВЭЖХ), при использовании хиральной или нехиральной фазы, или распределительной центрифужной хроматографией (СРС), исходя из смеси эпимеров 16R и 16S; или кристаллизацией. В частности, (16S)-16-гидроксипристинамицин IIА может быть получен согласно F. LeGoffic и др., Eur. J. Med. - Chimica Therapeutica; январь-февраль, - 16(1), 69-72 (1981). Производные пристинамицина общей формулы (III) соответствуют, соответственно,пристинамицину IIА (РIIА), пристинамицинуIIB (РIIВ), пристинамицину IIС (РIIС), пристинамицину IID (PIID), пристинамицину IIF (PIIF) и пристинамицину IIG (PIIG), которые являются известными компонентами природного пристинамицина. Компоненты PIIF и PIIG описаны в европейском патенте ЕР 614 910. Пристинамицин IIC (РIIС) и пристинамицин IID (PIID) могут быть получены как описано J.C. Barriere и др., Expert. Opin. Invest. Drugs,3(2), 115-131 (1994). Получение и разделение компонентов природных стрептограминов группы А [стрептограмины общей формулы (III)] осуществляют ферментацией и выделением компонентов из ферментативного бульона согласно или по аналогии со способом, описанным J. Preud'homme и др., Bull. Soc. Chim. Fr., 2, 585 (1968), или в европейском патенте ЕР 614910. Альтернативно,природные компоненты группы А могут быть получены специфической ферментацией, как описано в заявке на патент Франции FR 2689518. Производные стрептограмина общей формулы (I) могут быть, в случае необходимости,очищены физическими методами, такими как кристаллизация, хроматография или СРС. Некоторые производные стрептограмина общей формулы (I) могут быть превращены в аддитивные соли с кислотами обычными способами. Понятно, что такие соли, когда они существуют, также входят в объем настоящего изобретения. В качестве примеров аддитивных солей с фармацевтически приемлемыми кислотами можно назвать соли, образованные с неорганическими кислотами (гидрохлориды, гидробромиды, сульфаты, нитраты, фосфаты) или с органическими кислотами (сукцинаты, фумараты,тартраты, ацетаты, пропионаты, малеаты, цитраты, метансульфонаты, этансульфонаты, фенилсульфонаты, п-толуолсульфонаты, изетионаты, нафтилсульфонаты или камфорсульфонаты, или с производными, получаемыми замещением указанных соединений). Производные стрептограмина настоящего изобретения обладают антибактериальными свойствами и свойствами, приводящими к синергизму антибактериальной активности производных стрептограмина группы В. Они особенно представляют интерес вследствие их сильной активности при использовании индивидуально или в виде ассоциаций. Когда они ассоциированы с компонентом или производным группы В стрептограминов,то последние могут быть выбраны в зависимости от формы введения, пероральной или парентеральной, из природных компонентов присти 7 намицина IA, пристинамицина IB, пристинамицина IС, пристинамицина ID, пристинамицинаIE, пристинамицина IF, пристинамицина IG,виргиниамицина S1, S3 или S4, вернамицина В или С, этамицина или из полусинтетических производных таких, которые описаны в патентах или заявках на патент US 4618599, US 4798827, US 5326782, ЕР 772630 или ЕР 770132,в частности, производных стрептограминов общей формулы (А) в которой 1. Rb, Rс, Re и Rf означают атомы водорода, Rd означает атом водорода или диметиламиногруппу и Ra означает радикал структуры-CH2R'a, в котором R'a означает 3-тиопирролидинил, 3-(или 4-)тиопиперидил, которые могут быть замещены алкилом; алкилтиогруппой, замещенной 1 или 2 гидроксисульфонильной, алкиламино-, диалкиламиногруппой (которая сама может быть замещена меркапто- или диалкиламиногруппой) или замещенной 1 или 2 возможно замещенными пиперазиновыми циклами, морфолино-, тиоморфолино-, пиперидино-, 1-пирролидинильным, 2-, 3- или 4-пиперидильным или 2- или 3-пирролидинильным циклами (которые могут быть замещены алкилом),или же Ra означает радикал структуры =CHR'a,в котором R'a означает 3-аминопирролидинильную, 3-(или 4)аминопиперидильную, 3 оксипирролидинильную, 3-(или 4)оксипиперидильную, 3-тиопирролидинильную, 3-(или 4) тиопиперидильную группу, которая может быть замещена алкилом; или R'а означает алкиламино-, алкилокси- или алкилтиогруппу, замещенную 1 или 2 гидроксисульфонильными, алкиламино-, диалкиламиногруппами (которые сами могут быть замещены диалкиламиногруппой),или триалкиламмониевой группой, 4- или 5 имидазолильной группой, или 1 или 2 возможно замещенными пиперазиновыми циклами, морфолино-, тиоморфолино-, пиперидино-, 1 пирролидинильным, 2-, 3- или 4-пиперидильным или 2- или 3-пирролидинильным циклами(которые могут быть замещены алкилом), илиRa означает 3-(или 4)тиометилхинуклидинил-; или же 2. Ra означает атом водорода иa) либо Rb, Re и Rf означают атомы водорода, Rd означает радикал -NHCH3 или -N(СН 3)2 и Rc означает атом хлора или брома или означает алкенил, содержащий 3-5 атомов углеродаb) либо Rb, Rd, Re и Rf означают атом водорода и Rc означает атом галогена или аминомоноалкил, аминодиалкил, алкилоксигруппу,трифторметилоксигруппу, тиоалкил, алкил С 1 С 3 или тригалогенметил;c) либо Rb, Rc, Re и Rf означают атом водорода и Rd означает атом галогена или этиламино-, диэтиламино- или метилэтиламино-, алкилокси- или трифторметилоксигруппу, тиоалкил, алкил С 1-С 6, арил или тригалогенметил;d) либо Rb, Re и Rf означают атом водорода и Rc означает атом галогена или аминомоноалкил или аминодиалкил, алкилокси- или трифторметилоксигруппу, тиоалкил, алкил С 1-С 3 иRd означает атом галогена или аминогруппу,аминомоноалкил или аминодиалкил, алкилоксиили трифторметилоксигруппу, тиоалкил, алкил с 1-6 атомами углерода или тригалогенметил;e) либо Rc, Re и Rf означают атом водорода и Rb и Rd означают метил; или же из полусинтетических производных группы В стрептограминов общей формулы (В)Y означает атом азота или радикал =СR3-;R1 означает атом водорода, алкил (с 1-8 атомами углерода), алкенил (с 2-8 атомами углерода), циклоалкил (с 3-8 атомами углерода); насыщенный или ненасыщенный (3-8-членный) гетероциклил; фенил; замещенный [одним или несколькими атомами галогена или гидроксильными, алкильными, алкилокси-, алкилтио-, алкилсульфинильными,алкилсульфонильными радикалами, амино-, алкиламино- или диалкиламиногруппами] фенил или радикал NR'R", гдеR' и R", одинаковые или различные, могут представлять собой атомы водорода или алкилы (с 13 атомами углерода) или вместе с атомом азота,с которым они связаны, могут образовывать 3-8 членный гетероцикл, возможно содержащий другой гетероатом, выбираемый из атомов кислорода, серы или азота, возможно замещенного[алкилом, алкенилом (с 2-8 атомами углерода),циклоалкилом (с 3-6 атомами углерода), насыщенным или ненасыщенным (4-6-членным) гетероциклилом, бензилом, фенилом или замещенным фенилом, таким как указано выше при определении R1]; или же, когда Y означает радикал =СR3-,R1 также может означать галогенметил, гидроксиметил, алкилоксиметил, алкилтиометил, алкильная часть которого возможно замещена-(CH2)nNR'R" (где n означает целое число от 1 до 4 и R' и R" имеют указанные выше значения),или же, если R3 означает атом водорода, тоR1 также может означать формил, карбоксил,алкилоксикарбонил или -CONR'R", в котором R' и R" имеют указанные выше значения; или же, когда Y означает атом азота, R1 также может означать радикал -XR, в которомX означает атом кислорода или серы, сульфинил или сульфонил, или радикал NH, и R означает алкил (с 1-8 атомами углерода), циклоалкил (с 3-6 атомами углерода); насыщенный или ненасыщенный (3-8-членный) гетероциклил; (3-8 членный) гетероциклилметил, гетероциклильная часть которого связана с метильным радикалом через атом углерода; фенил; замещенный [одним или несколькими атомами галогена или гидроксильными, алкильными, алкилокси-, алкилтио-, алкилсульфинильными, алкилсульфонильными радикалами; амино-, алкиламиноили диалкиламиногруппами] фенил или радикал-(СН 2)nNR'R", в котором R' и R" имеют указанные выше значения и n означает целое число от 2 до 4, или же, если X означает NH, то R также может означать атом водорода;R2 означает атом водорода или алкил (с 1-3 атомами углерода);R3 означает атом водорода или алкил, карбоксил, алкилоксикарбонил или карбамоил структуры -CO-NR'R", в которой R' и R" имеют указанные выше значения;Ra означает метил или этил; иRb, Rс и Rd имеют указанные ниже значения: 1) Rb и Rс означают атомы водорода и Rd означает атом водорода или метиламино- или диметиламиногруппу; 2) Rb означает атом водорода; Rс означает атом водорода, хлора или брома или означает алкенил (С 3-С 5); и Rd означает радикал -NMeR"', в котором R"' означает алкил, гидроксиалкил (С 2-С 4) или алкенил (С 2-С 8), возможно замещенный фенилом,циклоалкил(С 3-С 6) метилом, бензилом, замещенным [одним или несколькими атомами галогена или гидроксильным, алкильным, алкилокси-, алкилтио-, алкилсульфинильным, алкилсульфонильным радикалами; амино-, алкиламино- или диалкиламиногруппами] бензилом, гетероциклилметилом или гетероциклилэтилом, гетероциклильная часть которого является насыщенной или ненасыщенной и 5-6 членной и содержит 1 или 2 гетероатома, выбираемых из атомов серы, кислорода или азота, возможно замещенного [алкилом,алкенилом (с 2-8 атомами углерода), циклоалкилом (с 3-6 атомами углерода), насыщенным или ненасыщенным (4-6-членным) гетероциклилом, фенилом, замещенным фенилом, таким как указано выше для определения R1, или бензилом], или же R"' означает цианометил или-OR'e, где R'е представляет собой атом водорода, алкил (с 1-6 атомами углерода), алкенил (с 26 атомами углерода), бензил или гетероциклилметил, гетероциклильная часть которого является 5-6-членной и содержит 1 или 2 гетероатома,выбираемых из атомов серы, кислорода или азота, либо Re означает алкиламино-, алкилметиламино-, гетероциклиламино- или гетероциклилметиламиногруппу, гетероциклильная часть которой является насыщенной и 5-6 членной и содержит 1 или 2 гетероатома, выбираемых из атомов серы, кислорода или азота, возможно замещенного алкилом, бензилом или алкилоксикарбонилом; 3) Rb означает атом водорода, Rd означает радикал -NHCH3 или -N(CH3)2 и Rc означает атом хлора или брома или означает алкенил(С 3-С 5) [если Rd означает -N(СН 3)2]; 4) Rb и Rd означают атомы водорода и Rc означает атом галогена или алкиламино- или диалкиламино-, алкилокси-, трифторметоксигруппу; тиоалкил, алкил (С 1-С 6) или тригалогенметил; 5) Rb и Rс означают атомы водорода и Rd означает атом галогена или этиламино-, диэтиламино- или метилэтиламино-, алкилокси- или трифторметокси-, алкилтиогруппу, алкилсульфинил, алкилсульфонил, алкил (С 1-С 6), фенил или тригалогенметил; 6) Rb означает атом водорода и Rс означает атом галогена или алкиламино- или диалкиламино-, алкилокси- или трифторметоксигруппу, тиоалкил, алкил (С 1-С 3) и Rd означает атом галогена или амино-, алкиламино- или диалкиламино-, алкилокси или трифторметоксигруппу,тиоалкил, алкил (С 1-С 6) или тригалогенметил; 7) Rc означает атом водорода и Rb и Rd означают метил; а также их солей. Понятно, что ассоциации производных изобретения и стрептограминов группы В также входят в объем настоящего изобретения. Производные группы В стрептограминов структуры (В) могут быть получены методами,описанными в международной заявке WO 9943699. Производные стрептограмина по изобретению оказались активными в тесте in vitro в концентрациях, составляющих от 0,015 до 32 мкг/мл, в отношении Staphylococcus aureus 209P,при использовании индивидуально или в ассоциации с производным группы В, таким, например, как пристинамицин IВ, и в концентрациях,составляющих от 0,015 до 32 мкг/мл, в отношении Staphylococcus aureus Schiclia (устойчивого к метициллину) , при использовании индивидуально или в ассоциации с пристинамицином IВ; в тесте in vivo на мышах они оказывают синергическое действие на антимикробную активность пристинамицина IB в случае экспериментальных инфекций, вызванных Staphylococcus 11 мг/кг, при введении подкожно (DC50) и большинство из соединений было активно также при введении перорально в дозах, составляющих 30150 мг/кг (DC50). Наконец, продукты изобретения особенно интересны тем, что они слаботоксичны. Ни один из продуктов не проявил токсичности в дозах 150 мг/кг в случае Staphylococcus aureusIP8203 при введении 2 раза в день подкожно или перорально мыши. Особый интерес представляют продукты общей формулы (I), в которыхR1 означает атом фтора, хлора, брома или йода или азидо- или тиоцианатогруппу;R3 означает атом водорода или радикалR'3-CO-, в котором R'3 означает фенил или фенилалкил, незамещенные или замещенные на фенильном радикале [одним или несколькими радикалами, выбираемыми из алкила, возможно содержащего радикал NR'R", в котором радикалы R' и R", одинаковые или различные, могут быть атомами водорода или алкильными радикалами, которые вместе с атомом азота, с которым они связаны, могут образовывать насыщенный или ненасыщенный 3-8-членный гетероциклил, возможно содержащий другой гетероатом, выбираемый из атомов кислорода, серы или азота, причем указанный выше гетероцикл сам может быть также замещен одним или несколькими радикалами (алкильным, гидроксиалкильным, алкилоксиалкильным, алкилоксикарбонилалкильным, арильным, насыщенными или ненасыщенными 3-8-членными гетероциклильным или гетероциклилалкильным радикалами или радикалом -CH2-CO-NR'R"), или же R' и/или R" могут означать гидроксиалкил, фенил,насыщенный или ненасыщенный 3-8-членный гетероциклилалкил, радикал -CO-NR'R", в котором NR'R" имеет указанное вьше значение, или алкил или ацил, замещенные NR'R", указанным выше], или же R'3 может представлять собой фенил, замещенный одним или несколькими радикалами [выбираемыми из алкильных радикалов, которые могут быть замещены алкилокси- или алкилтиогруппой, которые сами возможно содержат карбоксил или радикал NR'R",указанный выше, или выбираемыми из ацилоксигрупп, которые могут быть замещены NR'R",указанным выше], или же R'3 может быть выбран из алкильных или циклоалкильных радикалов, возможно замещенных [карбоксилом,карбоксиалкилдисульфанилом или радикаломNR'R", -CH2-NR'R", -CO-NR'R" или алкилоксикарбонилом, алкилоксигруппой или алкилдисульфанилом, возможно замещенными NR'R" или -CO-NR'R", в которых NR'R" является таким, как указано выше], или же R'3 может быть выбран из насыщенных или ненасыщенных 3-8 членных гетероциклильных радикалов, возможно замещенных [алкилом или ацилом, которые сами возможно замещены NR'R"], причем гете 005199 12 роциклы выбирают из пирролидинила, имидазолила, пиридила, пиперидинила, пиперазинила или морфолинила; и связь - - - означает простую связь (стереохимия 27R) или двойную связь; а также их соли, когда они существуют; и из этих продуктов наиболее интересны следующиеIIA. Следующие примеры, данные в качестве не ограничивающих объема изобретения, поясняют настоящее изобретение. В нижеследующих примерах номенклатура 16-дезоксопристинамицин IIА (или IIB) означает замену кетонной группы в положении 16 двумя атомами водорода. По мере протекания хроматографической обработки все фракции анализируют тонкослойной хроматографией (ТСХ) на пластинах с диоксидом кремния Merck 60F254. Фракции, соответствующие одному и тому же пятну в ТСХ, объединяют, затем концентрируют досуха при пониженном давлении (30 С; 2,7 кПа). Таким образом полученные остатки анализируют обычными спектроскопическими методами [ядерный магнитный резонанс (ЯМР); инфракрасная спектроскопия (ИК); массспектрометрия (МС)], что позволяет идентифицировать целевой продукт. Пример 1. (16R)-16-Дезоксо-16-фторпристинамицин IIВ. К раствору 1,12 г (16R)-16-дезоксо-16 фтор-14-O-(трет-бутилдифенилсилил)пристинамицина IIВ в 10 см 3 тетрагидрофурана, при температуре 20 С и в атмосфере аргона, добавляют 0,2 см 3 уксусной кислоты и 0,6 г тригидрата тетра-н-бутиламмонийфторида. После перемешивания в течение 168 ч реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая 1 г масла каштанового цвета, которое очищают флэш-хроматографией(90/5/5, по объему)]. Получают 0,3 г (16R)-16 дезоксо-16-фторпристинамицина IIВ в виде твердого вещества светло-бежевого цвета, плавящегося при температуре около 125 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-(трет-бутилдифенилсилил)пристинамицин IIB может быть получен следующим образом. К раствору 2 г (16S)-16-гидрокси-14-O(трет-бутилдифенилсилил)пристинамицина IIB в 50 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона, медленно добавляют 0,464 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 2 ч реакционную смесь выливают в 100 см 3 водного насыщенного раствора бикарбоната натрия. Органическую фазу декантируют, промывают 2 раза 100 см 3 воды, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,1 г твердого вещества цветы охры, которое очищают флэшхроматографией [элюент: градиент дихлорметан/ацетонитрил/метанол (100/0/0; 99/0,5/0,5,затем 98/1/1, по объему)]. Получают 1,35 г(16R)-16-дезоксо-16-фтор-14-O-(трет-бутилдифенилсилил) пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 116 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3,в м.д.): 0,96 (д, J=6,5 Гц: 3H); 0,99 (д, J=6,5 Гц: 3H); 1,00-1,15 (м: 12 Н); 1,29 (с: 3 Н); 1,55-1,95 (м: 4 Н); 1,96 (м: 1 Н); 2,13 (м: 1 Н); 2,24 (м: 1 Н); 2,76(16S)-16-Гидрокси-14-O-(трет-бутилдифенилсилил)пристинамицин IIB может быть получен следующим образом. К раствору 22 г (16S)-16-гидроксипристинамицина IIB в 200 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона, добавляют по каплям 29 см 3 диизопропилэтиламина,43,2 см 3 трет-бутилдифенилхлорсилана и 1,01 г 4-диметиламинопиридина. После перемешивания в течение 22 ч реакционную смесь выливают в 600 см 3 водного насыщенного раствора бикарбоната натрия. Водную фазу декантируют,затем экстрагируют 2 раза 100 см 3 дихлорметана. Органические фазы объединяют, промывают 400 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом натрия, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 70,6 г вязкого масла оранжевого цвета, которое перемешивают в 600 см 3 диизопропилового эфира в течение 16 ч. После фильтрования и высушивания при пониженном давлении (2,7 кПа) при 20 С получают 28 г (16S)-16-гидрокси-14-O-(трет-бутилдифенилсилил)пристинамицина IIB в виде твер 005199 14 дого вещества розового цвета, плавящегося при температуре около 133 С (разложение).(16S)-16-Гидроксипристинамицин IIВ может быть получен следующим образом. Суспензию 11,35 г боргидрида натрия в 550 см 3 дихлорметана кипятят с обратным холодильником в течение 20 мин. Добавляют по каплям, в течение примерно 30 мин, 68,6 см 3 уксусной кислоты, затем в течение примерно 45 мин, раствор (предварительно высушенный над сульфатом натрия) 52,75 г пристинамицина IIВ в 230 см 3 дихлорметана. Реакционную смесь перемешивают в течение 4,5 ч при температуре кипения с обратным холодильником, затем в течение 16 ч при температуре 20 С. После этого к реакционной смеси добавляют 500 см 3 дихлорметана и 1500 см 3 воды. Органическую фазу декантируют и водную фазу экстрагируют 500 см 3 дихлорметана. Органические фазы объединяют и значение рН доводят до 8 медленным добавлением 1000 см 3 водного насыщенного раствора бикарбоната натрия. Полученную в результате органическую фазу промывают последовательно 1000 см 3 воды и 1000 см 3 водного насыщенного раствора хлорида натрия, после чего обрабатывают растительной сажей 3S, сушат над сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа), получая 50 г твердого вещества светло-желтого цвета. К раствору полученного выше твердого вещества в 900 см 3 дихлорметана при температуре 20 С добавляют 378 см 3 0,5 М водного раствора гидроксида аммония. После перемешивания в течение 16 ч при температуре 20 С органическую фазу декантируют, промывают 1000 см 3 воды, затем 1000 см 3 водного насыщенного раствора хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа),получая 46 г твердого вещества бледно-желтого цвета, которое очищают флэш-хроматографией[элюент: градиент дихлорметан/метанол (98/2 и 97/3, по объему)]. Получают 31,68 г (16S)-16 гидроксипристинамицина IIB в виде твердого вещества не совсем белого цвета, плавящегося при температуре около 131 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3,в м.д.): 0,96 (д, J=6,5 Гц: 3 Н); 1,02 (д, J=6,5 Гц: 3 Н); 1,07 15 1,97 (м: 2 Н); 2,12 (м: 1 Н); 2,26 (шир. д. 14,5 Гц: 1 Н); 2,56 (д, J=3 Гц: 1 Н); 2,76 (м: 1 Н); 2,90 (дд,J=16 и 10 Гц: 1 Н); 3,08 (дд, J=16 и 3 Гц: 1 Н); 3,35 (м: 1 Н); 3,82 (м: 2 Н); 3,99 (д, J=2,5 Гц: 1H); 4,40-4,55 (м: 2 Н); 4,65-4,75 (м: 2 Н); 5,03 (м: 1 Н); 5,65-5,85 (м: 3 Н); 6,01 (м: 1 Н); 6,21 (д, J=16 Гц: 1H); 6,46 (дд, J=17 и 5 Гц: 1 Н); 8,13 (с: 1 Н). Пример 2. (16R)-16-Дезоксо-16-фторпристинамицин IIВ. К раствору 257 г (16R)-16-дезоксо-16 фтор-14-O-(трет-бутилдиметилсилил)пристинамицина IIB в 2500 см 3 дихлорметана в течение 40 мин, при температуре 40 С и в атмосфере аргона, медленно добавляют 970 см 3 триэтиламинтригидрофторида. После перемешивания в течение 2 ч при температуре 40 С реакционную смесь охлаждают до температуры 8 С, затем гидролизуют медленным добавлением в течение 25 мин 1940 см 3 воды. После перемешивания в течение 10 мин органическую и водную фазы декантируют и поверхность раздела фаз молочного цвета обрабатывают 4000 см 3 воды и 1000 см 3 дихлорметана. После перемешивания двух фаз органическую фазу декантируют и водные фазы объединяют, затем экстрагируют 1000 см 3 дихлорметана. Органические фазы объединяют и добавляют к 1500 см 3 воды. Значение рН водной фазы доводят до 7 медленным добавлением,в течение 10 мин при температуре 10 С, 400 см 3 водного насыщенного раствора бикарбоната натрия. Органическую фазу декантируют, разбавляют 1500 см 3 этилацетата, затем промывают 1000 см 3 воды. Органическую фазу декантируют и водную фазу экстрагируют 2 раза 1500 см 3 этилацетата, после чего фильтруют через целит на пористом стеклянном фильтре. Целит промывают 3 раза 400 см 3 этилацетата. Органические фазы объединяют, сушат над сульфатом натрия, затем фильтруют через целит на пористом стеклянном фильтре. Целит промывают 4 раза 800 см 3 этилацетата. Фильтрат концентрируют досуха при пониженном давлении(2,7 кПа), получая, после высушивания до постоянной массы при температуре 25 С, 218,5 г(16R)-16-дезоксо-16-фторпристинамицина IIВ в виде белого кристаллического порошка, плавящегося при температуре около 133 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-(третбутилдиметилсилил)пристинамицин IIВ может быть получен следующим образом. 16 Следуя аналогичной методике примера 1,но исходя из раствора 22 г (16S)-16-гидрокси 14-O-(трет-бутилдиметилсилил)пристинамицина IIB в 500 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона медленно добавляют 6,7 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 4 ч и аналогичной обработки по примеру 1 получают 25 г масла оранжевого цвета, которое очищают флэшхроматографией [элюент: градиент дихлорметан/метанол/ацетонитрил (100/0/0; от 99/0,5/0,5 до 96/2/2, по объему)]. Получают 6,6 г (16R)-16 дезоксо-16-фтор-14-О-(трет-бутилдиметилсилил)пристинамицина IIB в виде твердого вещества светло-желтого цвета, плавящегося при температуре около 128 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3,в м.д.): 0,04 (с: 3H); 0,07 (с: 3H); 0,89 (с: 9 Н); 0,96 (д,J=6,5 Гц: 3H); 0,99 (д, J=6,5 Гц: 3H); 1,09 (д,J=6,5 Гц: 3H); 1,50-2,05 (м: 5 Н); 1,79 (с: 3H); 2,10-2,25 (м: 2 Н); 2,76 (м: 1 Н); 2,90 (м: 1 Н); 3,15(16S)-16-Гидрокси-14-O-(трет-бутилдиметилсилил)пристинамицин IIB может быть получен следующим образом. К раствору 27 г (16S)-16-гидроксипристинамицина IIB (полученного как описано в примере 1) в 270 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона, добавляют 44,4 см 3 диизопропилэтиламина и раствор 39,6 г третбутилдиметилхлорсилана в 140 см 3 дихлорметана. После перемешивания в течение 17 ч реакционную смесь промывают 3 раза 300 см 3 воды. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая масло оранжевого цвета, которое очищают флэш-хроматографией [элюент: градиент дихлорметан/метанол/ацетонитрил (100/0/0; от 99/0,5/0,5 до 96/2/2, по объему)]. Получают 24 г(16S)-16-гидрокси-14-О-(трет-бутилдиметилсилил)пристинамицина IIB в виде твердого вещества светло-желтого цвета, плавящегося при температуре около 139 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3,в м.д.): 0,05 (с: 3H); 0,10 (с: 3H); 0,91 (с: 9 Н); 0,96 (д,J=6,5 Гц: 3H); 1,02 (д, J=6,5 Гц: 3H); 1,06 (д,J=6,5 Гц: 3H); 1,70-2,05 (м: 5 Н); 1,71 (с: 3H); 2,12 (м: 1 Н); 2,31 (шир. д, J=14 Гц: 1 Н); 2,702,80 (м: 1 Н); 2,80 (дд, J=17 и 11 Гц: 1 Н); 3,06 17 1 Н); 6,00 (м: 1 Н); 6,20 (д, J=16 Гц: 1H); 6,43 (дд,J=17 и 4 Гц: 1 Н); 8,12 (с: 1 Н). Пример 3. (16R)-16-Дезоксо-16-фторпристинамицин IIВ. К суспензии 0,09 г п-толуолсульфината натрия в 6 см 3 дихлорметана, при температуре 0 С и в атмосфере аргона, добавляют 0,5 см 3 1 н. водного раствора соляной кислоты. После перемешивания в течение 15 мин при температуре 20 С органическую фазу декантируют, сушат над сульфатом магния и фильтруют. К фильтрату, при температуре 20 С и в атмосфере аргона,добавляют 0,26 г (16R)-14-О-аллил-16-дезоксо 16-фторпристинамицина IIB и 0,04 г тетракис(трифенилфосфин)палладия. После перемешивания в течение 2 ч добавляют 0,01 г триэтиламина. После дополнительного перемешивания в течение 30 мин реакционную смесь концентрируют досуха, затем очищают флэшхроматографией [элюент: дихлорметан/метанол/ ацетонитрил (90/5/5, по объему)], получая 0,2 г(16R)-14-O-Аллил-16-дезоксо-16-фторпристинамицин IIB может быть получен следующим образом. К раствору 0,8 г (16S)-14-O-аллил-16 гидроксипристинамицина IIB в 25 см 3 дихлорметана, при температуре 0 С и в атмосфере аргона,добавляют по каплям раствор 0,28 см 3 трифторида диэтиламиносульфида в 5 см 3 дихлорметана. После перемешивания в течение 45 мин при температуре 0 С, затем при температуре 20 С,реакционную смесь выливают в 70 см 3 водного насыщенного раствора гидрокарбоната натрия при температуре 0 С. Полученную в результате смесь экстрагируют 100 см 3 дихлорметана. Органическую фазу промывают последовательно 70 см 3 водного насыщенного раствора гидрокарбоната натрия и 70 см 3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. После фильтрования и концентрирования досуха при пониженном давлении(16R)-14-O-аллил-16-дезоксо-16 фторпристинамицина IIB в виде твердого вещества кремового цвета. 1(16S)-14-O-Аллил-16-гидроксипристинамицин IIB может быть получен следующим образом. К раствору 10,6 г (16S)-16-гидроксипристинамицина IIB (полученного как описано в примере 1) в 500 см 3 2-бутанона добавляют 19 г карбоната калия и 31,5 см 3 аллилбромида. Реакционную смесь кипятят с обратным холодильником в течение 90 ч. После охлаждения до температуры 20 С и фильтрования реакционную смесь концентрируют при пониженном давлении (2,7 кПа). Остаток обрабатывают 100 см 3 дистиллированной воды и 300 см 3 дихлорметана. Органическую фазу декантируют, затем промывают 100 см 3 дистиллированной воды,сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(шир. д, J=9 Гц: 1 Н); 5,80 (дд, J=16 и 1,5 Гц: 1 Н); 5,79 (м: 1 Н); 5,98 (м: 1 Н); 6,25 (д, J=16 Гц: 1H); 6,45 (дд, J=16 и 4 Гц: 1 Н); 8,14 (с: 1 Н). Пример 4. (16R)-16-Дезоксо-16-тиоцианатопристинамицин IIВ. К раствору 0,85 г (16R)-16-дезоксо-16 тиоцианато-14-O-(трет-бутилдифенилсилил) пристинамицина IIB в 40 см 3 дихлорметана при температуре 20 С добавляют 5 см 3 тригидрофторида триэтиламина. После перемешивания в течение 20 ч при кипячении с обратным холодильником добавляют 3 см 3 тригидрофторида триэтиламина и кипятят с обратным холодильником еще в течение 3 ч. Реакционную смесь после этого выливают в 80 см 3 воды, затем нейтрализуют добавлением бикарбоната натрия. Органическую фазу декантируют, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа),получая 0,61 г твердого вещества, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол (96/4, по объему)]. Получают 0,36 г (16R)-16-дезоксо-16-тиоцианатопристин 19 амицина IIВ в виде твердого вещества белого цвета, плавящегося при температуре около 140 С (разложение). 1IIВ может быть получен следующим образом. К раствору 5,85 г тетра-н-бутиламмонийтиоцианата в 70 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона, добавляют 2,6 г (16S)-16-гидрокси-14-O-(трет-бутилдифенилсилил)пристинамицина IIB (полученного как описано в примере 1), затем, по каплям,1,56 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 10 мин реакционную смесь разбавляют 100 см 3 дихлорметана. Полученный раствор промывают последовательно 2 раза 100 см 3 воды и 100 см 3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении[элюент: циклогексан/этилацетат (6/4, по объему)]. Получают 0,87 г (16R)-16-дезоксо-16 тиоцианато-14-O-(трет-бутилдифенилсилил) пристинамицина IIB в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (400 МГц; CDCl3,в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,05-1,10 (м: 3H); 1,06 (с: 9 Н); 1,28 (с: 3H); 1,701,95 (м: 4 Н); 1,96 (м: 1 Н); 2,10-2,25 (м: 2 Н); 2,77(м: 1 Н); 4,53 (м: 1 Н); 4,67 (м: 1 Н); 4,75-4,85 (м: 2 Н); 5,35 (д, J=9 Гц: 1 Н); 5,56 (м: 1 Н); 5,81 (дд,J=16 и 1,5 Гц: 1 Н); 6,04 (м: 1 Н); 6,11 (д, J=16 Гц: 1 Н); 6,49 (дд, J=16 и 5 Гц: 1 Н); 7,30-7,50 (м: 6 Н); 7,63 (шир. д, J=7 Гц: 2H); 7,69 (м: 2 Н); 8,12 (с: 1 Н). Пример 5. (16R)-16-Дезоксо-16-бромпристинамицин IIB. Следуя аналгичной методике примера 4,но исходя из раствора 1,2 г (16R)-16-дезоксо-16 бром-14-O-(трет-бутилдифенилсилил)пристинамицина IIB в 30 см 3 дихлорметана, при температуре 20 С добавляют 7,5 см 3 тригидрофторида триэтиламина. После перемешивания в течение 25 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 4 получают твердое вещество оранжевого цвета, которое очищают флэш-хроматографией [элюент: ди 005199 20 хлорметан/метанол (97/3, по объему)]. Получают 0,78 г твердого вещества белого цвета, которое перекристаллизуют из 5 см 3 ацетонитрила,получая 0,48 г (16R)-16-дезоксо-16-бромпристинамицина IIB в виде кристаллов не совсем белого цвета, плавящихся при температуре около 146 С (разложение). 1(16R)-16-Дезоксо-16-бром-14-O-(третбутилдифенилсилил)пристинамицин IIB может быть получен следующим образом. Следуя аналогичной методике примера 4,но исходя из раствора 5,25 г тетра-нбутиламмонийбромида в 60 см 3 дихлорметана,при температуре 20 С и в атмосфере аргона,добавляют 2,5 г (16S)-16-гидрокси-14-O-(третбутилдифенилсилил)пристинамицина IIB (полученного как описано в примере 1), затем медленно добавляют 1,5 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 10 мин и аналогичной обработки по примеру 4 получают 4,6 г твердого вещества желтого цвета, которое очищают флэш-хроматографией[элюент: циклогексан/этилацетат (6/4, по объему)]. Получают 1,38 г (16R)-16-дезоксо-16 бром-14-О-(трет-бутилдифенилсилил)пристинамицина IIB в виде твердого вещества белого цвета. 1(16R)-16-Дезоксо-16-хлорпристинамицин IIB. Следуя аналогичной методике примера 4,но исходя из раствора 1,4 г (16R)-16-дезоксо-16 хлор-14-O-(трет-бутилдифенилсилил)пристинамицина IIB в 35 см 3 дихлорметана, при температуре 20 С добавляют 11 см 3 тригидрофторида триэтиламина. После перемешивания в течение 20 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 4 получают твердое вещество оранжевого цвета, которое 21 очищают флэш-хроматографией [элюент: дихлорметан/метанол (97/3, по объему)]. Получают 1 г твердого вещества белого цвета, к которому добавляют 0,5 г полученного в идентичном опыте вещества. После перекристаллизации из 10 см 3 ацетонитрила получают 1,12 г (16R)16-дезоксо-16-хлорпристинамицина IIB в виде кристаллов белого цвета, плавящихся при температуре около 142 С (разложение). 1(16R)-16-Дезоксо-16-хлор-14-O-(третбутилдифенилсилил)пристинамицин IIВ может быть получен следующим образом. Следуя аналогичной методике примера 4,но исходя из раствора 7,27 г тетра-нбутиламмонийхлорида в 50 см 3 дихлорметана,при температуре 20 С и в атмосфере аргона добавляют 4 г (16S)-16-гидрокси-14-O-(третбутилдифенилсилил)пристинамицина IIB (полученного как описано в примере 1), затем, по каплям, добавляют 2,44 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 10 мин и аналогичной обработки по примеру 4, получают 4,45 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат(55/45, по объему)]. Получают 0,51 г (16R)-16 дезоксо-16-хлор-14-O-(трет-бутилдифенилсилил)пристинамицина IIB в виде твердого вещества белого цвета. 1(м: 1 Н); 4,25 (м: 1 Н); 4,55 (м: 1 Н); 4,75-4,85 (м: 3H); 5,34 (д, J=9 Гц: 1 Н); 5,54 (м: 1 Н); 5,82 (дд,J=16 и 2 Гц: 1 Н); 5,99 (м: 1 Н); 6,11 (д, J=16 Гц: 1H); 6,50 (дд, J=16 и 5 Гц: 1 Н); 7,30-7,45 (м: 6 Н); 7,63 (дд, J=7 и 1,5 Гц: 2 Н); 7,68 (дд, J=7 и 1,5 Гц: 2 Н); 8,08 (с: 1 Н). Пример 7. (16R)-16-Дезоксо-16-иодпристинамицин IIB. Следуя аналогичной методике примера 4,но исходя из раствора 0,83 г (16R)-16-дезоксо 16-иод-14-O-(трет-бутилдифенилсилил)пристинамицина IIB в 15 см 3 дихлорметана, при температуре 20 С добавляют 6,2 см 3 тригидрофторида триэтиламина. После перемешивания в течение 23 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 4 получа 005199 22 ют 0,9 г твердого вещества не совсем белого цвета, которое очищают флэш-хроматографией(98/1/1, по объему)]. Получают 0,41 г твердого вещества желтого цвета, которое очищают высокоэффективной жидкостной хроматографией на колонке Kromasil с диоксидом кремния С 18, 5 мкм (диаметр колонки = 2 см, длина колонки = 25 см) [элюент: градиент вода/ ацетонитрил (от 80/20 до 60/40, по объему)]. Получают 0,18 г твердого вещества белого цвета, к которому добавляют 0,12 г полученных в эквивалентных опытах веществ, получая 0,3 г(16R)-16-дезоксо-16-иодпристинамицина IIB в виде твердого вещества бежевого цвета, плавящегося при температуре около 140 С (разложение). 1(16R)-16-Дезоксо-16-иод-14-O-(третбутилдифенилсилил)пристинамицин IIВ может быть получен следующим образом. Следуя аналогичной методике примера 4,но исходя из раствора 7,2 г тетра-нбутиламмонийиодида в 60 см 3 дихлорметана,при температуре 20 С и в атмосфере аргона добавляют 3 г (16S)-16-гидрокси-14-O-(третбутилдифенилсилил)пристинамицина IIB (полученного как описано в примере 1), затем, по каплям и при температуре 0 С, добавляют 1,8 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 20 мин при температуре 0 С и аналогичной обработки по примеру 4 получают 10,5 г масла оранжевого цвета, которое перемешивают в течение 15 мин в 30 см 3 смеси циклогексан/этилацетат (60/40). После фильтрования и концентрирования фильтрата при пониженном давлении (2,7 кПа) получают 5,5 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: циклогексан/этилацетат (60/40, по объему)]. Получают 1,81 г (16R)-16-дезоксо-16-иод-14-O-(третбутилдифенилсилил)пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 105 С. 1(д, J=16 Гц: 1 Н); 6,49 (дд, J=17 и 5 Гц: 1 Н); 7,307,45 (м: 6 Н); 7,63 (дд, J=7 и 1,5 Гц: 2 Н); 7,69 (дд,J=7 и 1,5 Гц: 2 Н); 8,08 (с: 1 Н). Пример 8. (16R)-16-Дезоксо-16-фторпристинамицин IIA. К раствору 0,97 г (16R)-16-дезоксо-16 фтор-14-O-(трет-бутилдифенилсилил)пристинамицина IIA в 8 см 3 тетрагидрофурана при температуре 20 С и в атмосфере аргона добавляют 0,2 см 3 уксусной кислоты и 0,6 г тригидрата тетра-н-бутиламмонийфторида. После перемешивания в течение 168 ч реакционную смесь выливают в 50 см 3 водного насыщенного раствора бикарбоната натрия. Органическую фазу декантируют и водную фазу экстрагируют 30 см 3 дихлорметана. Органические фазы объединяют,сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (95/2,5/2,5, по объему)]. Получают 0,38 г твердого вещества желтого цвета, к которому добавляют 0,21 г полученного в идентичном опыте вещества. После перемешивания в диэтиловом эфире, фильтрования и высушивания при пониженном давлении (2,7 кПа) при температуре 20 С получают 0,58 г (16R)-16-дезоксо-16-фторпристинамицинаIIА в виде твердого вещества светло-желтого цвета, плавящегося при температуре около 110 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-(третбутилдифенилсилил)пристинамицин IIA может быть получен следующим образом. К раствору 65 г (16S)-16-гидрокси-14-O(трет-бутилдифенилсилил)пристинамицина IIA в 700 см 3 дихлорметана при температуре 20 С и в атмосфере аргона медленно добавляют 20,5 см 3 трифторида диэтиламиносульфида. После перемешивания в течение 3 ч реакционную смесь медленно выливают в 1000 см 3 водного насыщенного раствора бикарбоната натрия. Органическую фазу декантируют и водную фазу экстрагируют 2 раза 500 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 67,62 г твердого вещества оранжевого цвета. После перемешивания твердого вещества в пентане, фильтрования и высушивания при пони 005199 24 женном давлении (2,7 кПа) при температуре 20 С получают 65,55 г (16R)-16-дезоксо-16 фтор-14-O-(трет-бутилдифенилсилил)пристинамицина IIA в виде твердого вещества желтооранжевого цвета. 1(16S)-16-Гидрокси-14-О-(трет-бутилдифенилсилил)пристинамицин IIА может быть получен следующим образом. Следуя аналогичной методике примера 1,но исходя из раствора 10 г (16S)-16 гидроксипристинамицина IIА в 100 см 3 дихлорметана, при температуре 20 С и в атмосфере аргона добавляют 13,2 см 3 диизопропилэтиламина, по каплям добавляют 19,7 см 3 третбутилдифенилхлорсилана и 0,46 г 4-диметиламинопиридина. После перемешивания в течение 20 ч и аналогичной обработки по примеру 1 получают 35 г масла каштанового цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (96/2/2, по объему)]. Получают 10,5 г (16S)-16-гидрокси 14-O-(трет-бутилдифенилсилил)пристинамицина IIA в виде твердого вещества бежевого цвета. 1(16S)-16-Гидроксипристинамицин IIА может быть получен согласно F. Le Goffic и др.,Eur. J. Med.-Chimica Therapeutica; январьфевраль, - 16(1), 69-72 (1981). Пример 9. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[4-(морфолин-4-илметил) бензоил]пристинамицина IIВ. К раствору 0,15 г (16R)-16-дезоксо-16 фтор-14-O-[4-(морфолин-4-илметил)бензоил] пристинамицина IIВ в 5 см 3 метанола при температуре 20 С добавляют 2 см 3 0,1 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток белого цвета, 25 который перемешивают в 10 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 10 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) при температуре 20 С получают 0,15 г метансульфоната (16R)-16-дезоксо-16-фтор-14-O-[4(морфолин-4-илметил)бензоил]пристинамицинаIIB в виде твердого вещества белого цвета, плавящегося при температуре около 150 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-[4-(морфолин-4-илметил)бензоил]пристинамицин IIВ может быть получен следующим образом. К раствору 2 г (16R)-16-дезоксо-16-фтор 14-O-[4-(хлорметил)бензоил]пристинамицинаIIВ в 50 см 3 тетрагидрофурана при температуре 20 С добавляют 0,44 г иодида натрия и 0,5 см 3 морфолина. После перемешивания в течение 17 ч при кипячении с обратным холодильником реакционную смесь выливают в 50 см 3 воды,затем экстрагируют 2 раза 50 см 3 дихлорметана. Органические фазы объединяют, промывают 2 раза 100 см 3 воды, сушат над сульфатом магния,фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 2,5 г остатка, который очищают флэш-хроматографией [элюент: градиент дихлорметан/ метанол (100/0; 99/1 и 98/2, по объему)]. Получают твердое вещество, которое перемешивают в пентане, отфильтровывают и сушат (90 Па) при температуре 30 С, получая 1,69 г (16R)-16 дезоксо-16-фтор-14-O-[4-(морфолин-4-илметил) бензоил]пристинамицина IIВ в виде твердого вещества не совсем белого цвета, плавящегося при температуре около 120 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,01 (д, J=6,5 Гц: 3H); 1,10(16R)-16-Дезоксо-16-фтор-14-O-[4-(хлорметил)бензоил]пристинамицин IIВ может быть получен следующим образом. К раствору 5,32 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 150 см 3 дихлорметана и 2,1 см 3 триэтиламина при температуре 10 С добавляют 2,84 г 4-(хлорметил)бензоилхлорида и 0,095 г 4-диметиламинопиридина. После перемешивания в течение 20 ч при температуре 20 С реакционную смесь промывают последовательно 50 см 3 воды, 50 см 3 5%-ного водного раствора бикарбоната натрия, 30 см 3 воды и 30 см 3 водного насыщенного раствора хлорида натрия. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 7,2 г остатка бежевого цвета, который очищают флэш-хроматографией [элюент: градиент дихлорметан/метанол/ацетонитрил (99/0,5/0,5 и 98/1/1, по объему)]. Получают 4,5 г (16R)-16 дезоксо-16-фтор-14-O-[4-(хлорметил)бензоил] пристинамицина IIB в виде твердого вещества светло-желтого цвета. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,01 (д, J=6,5 Гц: 3H); 1,10(м: 1 Н); 4,09 (м: 1 Н); 4,53 (м: 1 Н); 4,62 (с: 2 Н); 4,78 (дд, J=10 и 2 Гц: 1 Н); 4,83 (дд, J=9 и 3 Гц: 1 Н); 5,18 (неразрешенный дублет, JHF=48 Гц: 1 Н); 5,44 (д, J=9,5 Гц: 1 Н); 5,75-5,85 (м: 1 Н); 5,82 (дд, J=17 и 2 Гц: 1 Н); 5,94 (м: 1 Н); 6,06 (дт,J=9,5 и 5 Гц: 1 Н); 6,22 (д, J=16 Гц: 1 Н); 6,52 (дд,J=17 и 5 Гц: 1 Н); 7,47 (д, J=8 Гц: 2H); 8,02 (д,J=8 Гц: 2H); 8,14 (с: 1 Н). Пример 10. (16R)-16-Дезоксо-16-фтор-14O-[4-(имидазол-1-илметил)бензоил]пристинамицин IIB. Следуя аналогичной методике примера 9,но исходя из раствора 0,499 г (16R)-16-дезоксо 16-фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 30 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,11 г иодида натрия и 0,099 г имидазола. После перемешивания в течение 17 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 0,5 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/ метанол (97/3, по объему)]. Получают твердое вещество, которое перемешивают в диэтиловом эфире, отфильтровывают и сушат(16R)-16-дезоксо-16-фтор-14-O-[4-(имидазол-1 илметил)бензоил]пристинамицина IIВ в виде твердого вещества желтого цвета, плавящегося при температуре около 136 С (разложение).(м: 1 Н); 4,08 (м: 1 Н); 4,53 (м: 1 Н); 4,78 (шир. д,J=10 Гц: 1 Н); 4,83 (дд, J=9 и 3 Гц: 1 Н); 5,17 (неразрешенный дублет, JHF=48 Гц: 1H); 5,19 (с: 2 Н); 5,43 (д, J=9 Гц: 1 Н); 5,78 (м: 1 Н); 5,82 (дд,J=17 и 1,5 Гц: 1 Н); 5,94 (м: 1 Н); 6,05 (м: 1 Н); 6,22 (д, J=16 Гц: 1 Н); 6,52 (дд, J=17 и 5 Гц: 1 Н); 6,90 (с: 1 Н); 7,13 (с: 1 Н); 7,20 (д, J=8 Гц: 2H); 7,58 (с: 1 Н); 8,01 (д, J=8 Гц: 2 Н); 8,14 (с: 1 Н). Пример 11. (16R)-16-Дезоксо-16-фтор-14O-[4-(4-метилпиперазин-1-илметил)бензоил] пристинамицин IIB. Следуя аналогичной методике примера 9,но исходя из раствора 2 г (16R)-16-дезоксо-16 фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 90 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,44 г иодида натрия и раствор 0,65 см 3 метилпиперазина в 10 см 3 тетрагидрофурана. После перемешивания в течение 20 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9, получают 2,4 г остатка, который очищают флэшхроматографией [элюент: дихлорметан/метанол(99/1, по объему)]. Получают твердое вещество,которое перемешивают в 15 см 3 диэтилового эфира, отфильтровывают и сушат (90 Па) при температуре 20 С, получая 1 г (16R)-16-дезоксо 16-фтор-14-O-[4-(4-метилпиперазин-1-илметил) бензоил]пристинамицина IIB в виде твердого вещества бледно-желтого цвета, плавящегося при температуре около 160 С (разложение). 1(м: 1 Н); 4,52 (м: 1 Н); 4,79 (шир. д, J=10 Гц: 1 Н); 4,83 (дд, J=9 и 3 Гц: 1 Н); 5,18 (неразрешенный дублет, JHF=48 Гц: 1H); 5,44 (д, J=9,5 Гц: 1 Н); 5,70-5,85 (м: 1 Н); 5,82 (дд, J=17 и 1,5 Гц: 1 Н); 5,95 (м: 1 Н); 6,05 (дт, J=9,5 и 6 Гц: 1 Н); 6,22 (д,J=16 Гц: 1 Н); 6,52 (дд, J=17 и 5 Гц: 1 Н); 7,40 (д,J=8,5 Гц: 2H); 7,97 (д, J=8,5 Гц: 2 Н); 8,14 (с: 1 Н). Пример 12. (16R)-16-Дезоксо-16-фтор-14O-[4-(диэтиламинометил)бензоил]пристинамицин IIB. Следуя аналогичной методике примера 9,но исходя из раствора 0,55 г (16R)-16-дезоксо 16-фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 30 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,12 г иодида натрия и 0,17 см 3 диэтиламина. После перемешивания в течение 15,5 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 28 получают остаток, который очищают флэшхроматографией [элюент: дихлорметан/метанол(95/5, по объему)]. Получают твердое вещество,которое перемешивают в 20 см 3 пентана, отфильтровывают и сушат (90 Па) при температуре 20 С, получая 0,14 г (16R)-16-дезоксо-16 фтор-14-O-[4-(диэтиламинометил)бензоил] пристинамицина IIB в виде твердого вещества бледно-желтого цвета, плавящегося при температуре около 150 С (разложение). 1(м: 1 Н); 3,61 (с: 2 Н); 3,89 (м: 1 Н); 4,09 (м: 1 Н); 4,53 (м: 1 Н); 4,79 (шир. д, J=10 Гц: 1 Н); 4,82 (дд,J=9 и 3 Гц: 1 Н); 5,17 (неразрешенный дублет,JHF=48 Гц: 1H); 5,44 (д, J=9 Гц: 1 Н); 5,77 (м: 1 Н); 5,82 (дд, J=17 и 1,5 Гц: 1 Н); 5,92 (м: 1 Н); 6,05 (м: 1 Н); 6,21 (д, J=6 Гц: 1H); 6,50 (дд, J=16 и 5 Гц: 1 Н); 7,42 (д, J=8 Гц: 2H); 7,96 (д, J=8 Гц: 2H); 8,14 (с: 1 Н). Пример 13. (16R)-16-Дезоксо-16-фтор-14O-4-[2S)-2-гидроксиметил)пирролидин-1 илметил]бензоилпристинамицин IIВ. Следуя аналогичной методике примера 9,но исходя из раствора 1 г (16R)-16-дезоксо-16 фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 45 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,22 г иодида натрия и раствор 0,29 см 3 L-пролинола в 5 см 3 тетрагидрофурана. После перемешивания в течение 12 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 1,25 г остатка, который очищают флэшхроматографией [элюент: дихлорметан/метанол(98/2, по объему)]. Получают твердое вещество,которое перемешивают в 10 см 3 диэтилового эфира, отфильтровывают и сушат (90 Па) при температуре 20 С, получая 0,4 г (16R)-16 дезоксо-16-фтор-14-O-4-[2S)-2-гидроксиметил)пирролидин-1-илметил]бензоилпристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 158 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3 Н); 1,01 (д, J=6,5 Гц: 3 Н); 1,10 29 Пример 14. (16R)-16-Дезоксо-16-фтор-14O-[4-(2-пиколиламинометил)бензоил]пристинамицин IIв. Следуя аналогичной методике примера 9,но исходя из раствора 2 г (16R)-16-дезоксо-16 фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 20 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,44 г иодида натрия и 1,2 см 3 2-(аминометил)пиридина. После перемешивания в течение 17 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 2,1 г твердого вещества темно-желтого цвета, которое очищают двумя последовательными операциями флэш-хроматографии [элюент: соответственно, дихлорметан/метанол/ацетонитрил (92/4/4 и 95/2,5/2,5, по объему)]. Получают твердое вещество, которое перемешивают в диэтиловом эфире, отфильтровывают и сушат (90 Па) при температуре 20 С,получая 1,59 г (16R)-16-дезоксо-16-фтор-14-O[4-(2-пиколиламинометил)бензоил]пристинамицина IIВ в виде твердого вещества белого цвета, плавящегося при температуре около 106 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3 Н); 1,01 (д, J=6,5 Гц: 3H); 1,10IIВ. Следуя аналогичной методике примера 9,но исходя из раствора 1 г (16R)-16-дезоксо-16 фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIВ (полученного как описано в примере 9) в 50 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,22 г иодида натрия и 0,24 см 3 пирролидина. После перемешивания в течение 7 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают остаток, который очищают флэшхроматографией [элюент: дихлорметан/метанолIIВ в виде твердого вещества желтого цвета,плавящегося при температуре около 170 С (разложение).IIB. Следуя аналогичной методике примера 9,но исходя из раствора 0,75 г (16R)-16-дезоксо 16-фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 9) в 20 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,16 г иодида натрия и 0,22 см 3 пиперидина. После перемешивания в течение 15 ч при температуре 66 С и аналогичной обработки по примеру 9 получают 1 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/ метанол (97/3, по объему)]. Таким образом, после перемешивания в диэтиловом эфире, затем в пентане, фильтрования и высушивания (90 Па) при температуре 20 С, получают 0,33 г (16R)16-дезоксо-16-фтор-14-O-[4-(пиперидин-1-ил) бензоил]пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 110 С (разложение). 1(д, J=8 Гц: 2H); 8,14 (с: 1 Н). Пример 17. (16R)-16-Дезоксо-16-фтор-140-4-[(2-гидроксиэтил)аминометил]бензоил пристинамицин IIВ. Следуя аналогичной методике примера 9,но исходя из раствора 0,8 г (16R)-16-дезоксо-16 фтор-14-O-[4-(хлорметил)бензоил]пристинамицина IIВ (полученного как описано в примере 9) в 20 см 3 тетрагидрофурана, 0,17 г иодида натрия и 0,14 см 3 этаноламина и после перемешивания в течение 16 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 0,8 г твердого вещества бежевого цвета, которое очищают флэш 31 хроматографией [элюент: градиент дихлорметан/метанол (95/5 и 90/10, по объему)]. После перемешивания в диэтиловом эфире, фильтрования и высушивания (90 Па) получают 0,36 г твердого вещества белого цвета, которое очищают высокоэффективной жидкостной хроматографией на колонке Hypersil, 5 мкм (диаметр колонки = 2 см, длина колонки = 25 см)[элюент: дихлорметан/метанол (97/3, по объему)]. Получают 0,129 г (16R)-16-дезоксо-16 фтор-14-O-4-[(2-гидроксиэтил)аминометил] бензоилпристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 194 С (разложение). 1(шир. д, J=16 Гц: 1 Н); 5,93 (м: 1 Н); 6,05 (м: 1 Н); 6,22 (д, J=16 Гц: 1 Н); 6,51 (дд, J=16 и 5 Гц: 1 Н); 7,40 (д, J=8 Гц: 2H); 7,99 (д, J=8 Гц: 2H); 8,13 (с: 1 Н). Пример 18. (16R)-16-Дезоксо-16-фтор-14O-4-[(2-диэтиламино)этилтиометил]бензоил пристинамицин IIВ. К раствору 0,46 см 3 2-диэтиламиноэтантиола в 10 см 3 тетрагидрофурана при температуре 0 С добавляют 0,82 см 3 раствора бутиллития (2,5 М в гексане). После перемешивания в течение 15 мин добавляют по каплям в течение 15 мин раствор 1,4 г (16R)-16-дезоксо-16-фтор 14-O-[4-(хлорметил)бензоил]пристинамицинаIIВ (полученного как описано в примере 9) в 15 см 3 тетрагидрофурана. После перемешивания в течение 6,5 ч при температуре 0 С и 15 ч при температуре 20 С добавляют по каплям раствор,приготовленный как указано выше, но из 0,153 см 3 2-диэтиламиноэтантиола и 0,205 см 3 раствора бутиллития (2,5 М в гексане) в 0,5 см 3 тетрагидрофурана. После перемешивания в течение 3,5 ч при температуре 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 20 см 3 дихлорметана. Полученный раствор промывают 50 см 3 воды, затем декантируют. Водную фазу экстрагируют 20 см 3 дихлорметана. Органические фазы объединяют, промывают 2 раза 70 см 3 воды, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,6 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (92/4/4, по объему)]. Таким образом, после перемешивания в пентане, фильтрования и высушивания (2,7 кПа) при температуре 20 С, получают 0,926 г (16R) 005199 32 16-дезоксо-16-фтор-14-O-4-[(2-диэтиламино) этилтиометил]бензоилпристинамицина IIB в виде твердого вещества бежевого цвета, плавящегося при температуре около 84 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,90-1,05 (м: 12 Н); 1,10 (д, J=6,5 Гц: 3H); 1,752,05 (м: 5 Н); 1,96 (с: 3 Н); 2,16 (м: 1 Н); 2,40 (м: 1 Н); 2,50 (м: 6 Н); 2,62 (м: 2 Н); 2,76 (м: 1 Н); 3,05(дд, J=17 и 1,5 Гц: 1 Н); 5,92 (м: 1 Н); 6,05 (м: 1 Н); 6,22 (д, J=16 Гц: 1 Н); 6,52 (дд, J=17 и 5 Гц: 1 Н); 7,40 (д, J=8,5 Гц: 2H); 7,97 (д, J=8,5 Гц: 2H); 8,14 (с: 1 Н). Пример 19. (16R)-16-Дезоксо-16-фтор-14O-[4-(карбоксиметилтиометил)бензоил]пристинамицин IIB. К раствору 0,4 см 3 меркаптоуксусной кислоты в 10 см 3 тетрагидрофурана при температуре 0 С добавляют 4,64 см 3 раствора бутиллития (2,5 М в гексане). После перемешивания в течение 15 мин понижают температуру реакционной смеси до -50 С и медленно добавляют по каплям раствор 2 г (16R)-16-дезоксо-16-фтор 14-O-[4-(хлорметил)бензоил]пристинамицинаIIВ (полученного как описано в примере 9) в 10 см 3 тетрагидрофурана. После перемешивания в течение 3 ч при температуре -50 С и 15 ч при температуре 20 С снова понижают температуру реакционной смеси до -50 С и добавляют по каплям раствор, приготовленный как указано выше, при температуре -50 С, но из 0,2 см 3 меркаптоуксусной кислоты и 2,32 см 3 раствора бутиллития (2,5 М в гексане) в 5 см 3 тетрагидрофурана. После перемешивания при температуре-50 С в течение 5 ч реакционную смесь выливают в 100 см 3 воды и значение рН доводят до 3-4 добавлением 0,1 н. водного раствора соляной кислоты. После добавления 20 см 3 дихлорметана и 20 см 3 водного насыщенного раствора хлорида натрия органическую фазу декантируют и водную фазу экстрагируют 20 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа),получая 2,1 г твердого вещества желтого цвета,которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (90/5/5,по объему)]. Таким образом, после перемешивания в диэтиловом эфире, фильтрования и высушивания (90 Па) при температуре 20 С, получают 0,21 г (16R)-16-дезоксо-16-фтор-14-О-[4(карбоксиметилтиометил)бензоил]пристинамицина IIB в виде твердого вещества желтого цвета, плавящегося при температуре около 142 С(м: 1 Н); 3,88 (м: 1 Н); 3,88 (с: 2 Н); 4,10 (м: 1 Н); 4,52 (м: 1 Н); 4,78 (дд, J=10 и 2 Гц: 1 Н); 4,83 (дд,J=9 и 3,5 Гц: 1 Н); 5,19 (неразрешенный дублет,JHF=48 Гц: 1 Н); 5,44 (д, J=9 Гц: 1 Н); 5,78 (м: 1 Н); 5,83 (дд, J=16 и 2 Гц: 1 Н); 6,00 (м: 1 Н); 6,05 (м: 1 Н); 6,22 (д, J=16 Гц: 1 Н); 6,52 (дд, J=16 и 5 Гц: 1 Н); 7,41 (д, J=8 Гц: 2H); 7,97 (д, J=8 Гц: 2H); 8,16 (с: 1 Н). Пример 20. (16R)-16-Дезоксо-16-фтор-14O-4-[(2-диэтиламино)этоксиметил]бензоил пристинамицин IIB. К раствору 1 г (16R)-16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) в 15 см 3 дихлорметана при температуре 20 С добавляют 0,6 г 4-2-диэтиламино) этоксиметил)бензойной кислоты, 0,05 г 4-диметиламинопиридина, 0,43 г N,N'-дициклогексилкарбодиимида и 2 г сульфата магния. После перемешивания в течение 40 ч при температуре 20 С добавляют 0,24 г 4-2-диэтиламино)этоксиметил)бензойной кислоты, 0,025 г 4-диметиламинопиридина и 0,2 г N,N'-дициклогексилкарбодиимида. После перемешивания в течение дополнительных 3 ч при температуре 20 С реакционную смесь фильтруют и нерастворимую часть промывают 20 см 3 дихлорметана. Фильтрат промывают 3 раза 100 см 3 воды, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,5 г твердого вещества бежевого цвета, которое очищают флэш-хроматографией[элюент: градиент дихлорметан/метанол/ ацетонитрил (90/5/5 и 84/8/8, по объему)]. Таким образом, после перемешивания в 20 см 3 диэтилового эфира, фильтрования и высушивания получают 0,86 г твердого вещества белого цвета, которое растворяют в 20 см 3 дихлорметана. Полученный раствор промывают 2 раза 50 см 3 водного насыщенного раствора бикарбоната натрия, сушат над сульфатом магния, фильтруют, затем концентрируют при пониженном давлении (2,7 кПа) при температуре 20 С, получая 0,67 г (16R)-16-дезоксо-16-фтор-14-O-4-[(2 диэтиламино)этоксиметил]бензоилпристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 76 С(неразрешенный дублет, JHF=48 Гц: 1H); 5,45 (д,J=9 Гц: 1 Н); 5,78 (м: 1 Н); 5,82 (дд, J=17 и 2 Гц: 1 Н); 5,92 (м: 1 Н); 6,05 (м: 1 Н); 6,22 (д, J=16 Гц: 1H); 6,51 (дд, J=17 и 5 Гц: 1 Н); 7,41 (д, J=8 Гц: 2H); 7,99 (д, J=8 Гц: 2H); 8,14 (с: 1 Н). 4-[(2-Диэтиламино)этоксиметил]бензойная кислота может быть получена следующим образом. К раствору 3,67 г метил 4-[(2-диэтиламино)этоксиметил]бензоата в 50 см 3 метанола при температуре 20 С добавляют 28 см 3 1 н. водного раствора гидроксида натрия. После перемешивания в течение 2,5 ч при температуре 20 С значение рН реакционной смеси устанавливают равным 5 добавлением 29 см 3 1 н. водного раствора соляной кислоты. Реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перемешивают в 50 см 3 метанола. После отфильтровывания нерастворимой части, фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перемешивают в 50 см 3 дихлорметана. После отфильтровывания нерастворимой части,фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 20 С,получая 3,5 г 4-[(2-диэтиламино)этоксиметил] бензойной кислоты в виде масла желтого цвета. 1H-ЯМР-спектр (300 МГц; (CD3)2SO-d6;в м.д.): 1,07 (т, J=7,5 Гц: 6H); 2,79 (к, J=7,5 Гц: 4H); 2,93 (т, J=6,5 Гц: 2H); 3,66 (т, J=6,5 Гц: 2H); 4,57 (с: 2 Н); 7,42 (д, J=8 Гц: 2H); 7,92 (д, J=8 Гц: 2H). Метил 4-[(2-диэтиламино)этоксиметил] бензоат может быть получен следующим образом. К раствору 5,8 см 3 N,N-диэтилэтаноламина в 15 см 3 диметилформамида при температуре 0 С добавляют 2,64 г гидрида натрия (60 мас.%,в вазелиновом масле). После перемешивания в течение 1 ч при температуре 0 С добавляют по каплям в течение 20 мин раствор 10 г метил 4(бромметил)бензоата в 10 см 3 диметилформамида, затем 50 см 3 диметилформамида. После перемешивания в течение 17 ч при температуре 20 С добавляют 100 см 3 метанола, затем реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая масло желтого цвета, которое разбавляют 200 см 3 этилацетата. Полученный раствор промывают 300 см 3 воды. Водную фазу декантируют, затем экстрагируют 100 см 3 этилацетата. Органические фазы объединяют, промывают 2 раза 500 см 3 воды, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа), получая 10 г масла желтого цвета, которое очищают флэш-хроматографией[элюент: градиент дихлорметан/метанол (96/4 и 90/10, по объему)]. Таким образом получают 3,67 г метил 4-[(2-диэтиламино)этоксиметил] бензоата в виде масла желтого цвета.(т, J=6 Гц: 2 Н); 3,57 (т, J=6 Гц: 2H); 3,88 (с: 3H); 4,56 (с: 2 Н); 7,38 (д, J=8 Гц: 2H); 7,99 (д, J=8 Гц: 2H). Пример 21. (16R)-16-Дезоксо-16-фтор-14O-[3-(морфолин-4-илметил)бензоил]пристинамицин IIВ. Следуя аналогичной методике примера 9,но исходя из раствора 1 г (16R)-16-дезоксо-16 фтор-14-O-[3-(хлорметил)бензоил]пристинамицина IIВ в 25 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,212 г иодида натрия и 0,253 см 3 морфолина. После перемешивания в течение 16 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 1 г твердого вещества желтого цвета, которое очищают флэшхроматографией [элюент: градиент дихлорметан/метанол/ ацетонитрил (100/0/0, затем 98/1/1,по объему)]. Таким образом получают 0,8 г твердого вещества желтого цвета, которое после перемешивания в 10 см 3 диэтилового эфира,фильтрования и высушивания (90 Па) при температуре 20 С, дает 0,68 г (16R)-16-дезоксо-16 фтор-14-O-[3-(морфолин-4-илметил)бензоил] пристинамицина IIВ в виде твердого вещества белого цвета, плавящегося при температуре около 198 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,01 (д, J=6,5 Гц: 3H); 1,10(16R)-16-Дезоксо-16-фтор-14-O-[3-(хлорметил)бензоил]пристинамицин IIВ может быть получен следующим образом. К раствору 5 г (16R)-16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) в 250 см 3 дихлорметана при температуре 20 С добавляют 2 см 3 триэтиламина, 2 см 3 3-(хлорметил)бензоилхлорида и 0,23 г 4 диметиламинопиридина. После перемешивания в течение 24 ч при температуре 20 С реакционную смесь промывают 3 раза 120 см 3 воды, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая твердое вещество желтого цвета, которое перемешивают в 50 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 2 раза 10 см 3 диэтилового эфира и высушивания при пониженном давле 005199 36 нии (2,7 кПа) при температуре 20 С получают 5,56 г (16R)-16-дезоксо-16-фтор-14-О-[3-(хлорметил)бензоил]пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 190 С (разложение). 1(шир. д, J=8 Гц: 1 Н); 7,99 (шир. д, J=8 Гц: 1H); 8,04 (шир. с: 1 Н); 8,14 (с: 1 Н). Пример 22. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[3-(имидазол-1-илметил) бензоил]пристинамицина IIB. К раствору 0,450 г (16R)-16-дезоксо-16 фтор-14-O-[3-(имидазол-1-илметил)бензоил] пристинамицина IIB в 10 см 3 этанола при температуре 20 С добавляют 6,28 см 3 0,1 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перемешивают в 7 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 2 раза 2 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) получают 0,479 г метансульфоната (16R)-16-дезоксо-16 фтор-14-O-[3-(имидазол-1-илметил)бензоил] пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 160 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-[3-(имидазол-1-илметил)бензоил]пристинамицин IIВ может быть получен следующим образом. Следуя аналогичной методике примера 9,но исходя из раствора 1,2 г (16R)-16-дезоксо-16 фтор-14-O-[3-(хлорметил)бензоил]пристинамицина IIВ (полученного как описано в примере 21) в 30 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,263 г иодида натрия и 0,238 г 37 имидазола. После перемешивания в течение 16 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 0,9 г твердого вещества желтого цвета, которое очищают флэш-хроматографией [элюент: градиент дихлорметан/метанол/ацетонитрил (98/1/ 1, затем 96/2/2, затем 90/5/5, по объему)]. Таким образом получают 0,53 г (16R)-16-дезоксо-16 фтор-14-O-[3-(имидазол-1-илметил)бензоил] пристинамицина IIВ в виде твердого вещества желтого цвета, плавящегося при температуре около 125 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,10(с: 1 Н). Пример 23. (16R)-16-Дезоксо-16-фтор-14O-[3-(диэтиламинометил)бензоил]пристинамицин IIВ. Следуя аналогичной методике примера 9,но исходя из раствора 1 г (16R)-16-дезоксо-16 фтор-14-O-[3-(хлорметил)бензоил]пристинамицина IIB (полученного как описано в примере 21) в 25 см 3 тетрагидрофурана, при температуре 20 С добавляют 0,217 г иодида натрия и 0,3 см 3 диэтиламина. После перемешивания в течение 16 ч при кипячении с обратным холодильником и аналогичной обработки по примеру 9 получают 1 г твердого вещества желтого цвета, которое очищают флэш-хроматографией(16R)-16-дезоксо-16-фтор-14-O-[3-(диэтиламинометил)бензоил]пристинамицина IIB в виде твердого вещества желтого цвета, плавящегося при температуре около 115 С (разложение). 1(с: 1 Н). Пример 24. (16R)-16-Дезоксо-16-фтор-14O-[4-(морфолин-4-илметил)фенилацетил]пристинамицин IIВ. К раствору 0,87 г (16R)-16-дезоксо-16 фтор-14-O-[4-(галогенметил)фенилацетил] пристинамицина IIВ (смесь хлор- и бромпроизводных) в 5 см 3 диметилформамида при температуре 20 С добавляют 0,25 см 3 морфолина и несколько кристаллов иодида натрия. После перемешивания в течение 15 мин при температуре 85 С реакционную смесь выливают в 90 см 3 воды. Водную фазу декантируют, затем экстрагируют 2 раза 50 см 3 этилацетата. Органические фазы объединяют, промывают последовательно 30 см 3 воды и 30 см 3 водного насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Таким образом получают 0,91 г твердого вещества коричнево-оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (92/4/4, по объему)],получая 0,46 г твердого вещества желтого цвета,которое обрабатывают 5 см 3 дихлорметана. После фильтрования через целит, целит промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,42 г твердого вещества желтого цвета, которое перемешивают в течение 15 мин в 5 см 3 воды. После фильтрования и высушивания при пониженном давлении (2,7 кПа) при температуре 20 С получают 0,38 г (16R)-16 дезоксо-16-фтор-14-O-[4-(морфолин-4-илметил) фенилацетил]пристинамицина IIB в виде твердого вещества желтого цвета, плавящегося при температуре около 100 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,01 (д, J=6,5 Гц: 3H); 1,09(смесь хлор- и бромпроизводных) может быть получен следующим образом. К раствору 2 г (16R)-16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) в 60 см 3 дихлорметана в течение 5 мин добавляют при температуре 20 С и в атмосфере аргона, 1,3 см 3 диизопропилэтиламина и 1,75 г 4-(бромметил)фенилацетилхлорида. По 39 сле перемешивания в течение 16 ч при температуре 20 С реакционную смесь промывают последовательно 2 раза 25 см 3 воды и 25 см 3 водного насыщенного раствора хлорида натрия,затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Таким образом получают 2,79 г твердого вещества оранжевого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол (97/3, по объему)], получая 1,3 г твердого вещества желтого цвета, которое обрабатывают 50 см 3 этилацетата. Полученный раствор промывают 2 раза 25 см 3 водного насыщенного раствора бикарбоната натрия, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(16R)-16-дезоксо-16-фтор-14-О-[4-(галогенметил)фенилацетил]пристинамицина IIВ (смесь хлор- и бромпроизводных) в виде твердого вещества желтого цвета. 4-(Бромметил)фенилацетилхлорид может быть получен согласно заявке на патент ЕР 274999. Пример 25. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[(2-имидазол-1-илэтокси) ацетил]пристинамицина IIВ. К раствору 0,19 г (16R)-16-дезоксо-16 фтор-14-O-[(2-имидазол-1-илэтокси)ацетил] пристинамицина IIB в 8 см 3 этанола при температуре 20 С добавляют 0,26 см 3 1,09 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая маслянистый остаток,который перемешивают в 5 см 3 диэтилового эфира. Растворитель затем удаляют при пониженном давлении (2,7 кПа). Таким образом полученное твердое вещество перемешивают в 5 см 3 диэтилового эфира, после чего отфильтровывают, промывают диэтиловым эфиром и сушат при пониженном давлении (2,7 кПа), получая 0,189 г метансульфоната (16R)-16-дезоксо 16-фтор-14-O-[(2-имидазол-1-илэтокси)ацетил] пристинамицина IIB в виде порошка белого цвета, плавящегося при температуре около 115 С(16R)-16-Дезоксо-16-фтор-14-O-[(2-имидазол-1-илэтокси)ацетил]пристинамицин IIВ может быть получен следующим образом. 40 К раствору 1,3 г (16R)-16-дезоксо-16-фтор 14-O-[2-хлорэтоксиацетил]пристинамицина IIВ в 6,5 см 3 диметилсульфоксида при температуре 20 С добавляют 0,41 г имидазола и несколько кристаллов иодида натрия. После перемешивания в течение 4 ч при температуре 60 С добавляют 0,3 г иодида натрия. После перемешивания еще в течение 4 ч при температуре 60 С, 72 ч при температуре 85 С, затем 60 ч при температуре 20 С, реакционную смесь выливают в смесь 35 см 3 воды со льдом, потом добавляют 0,17 г бикарбоната натрия. После фильтрования,промывания твердого вещества водой, затем высушивания на воздухе получают маслянистый остаток, который разбавляют 30 см 3 дихлорметана. После концентрирования при пониженном давлении (2,7 кПа) получают 1,23 г твердого вещества желтого цвета, которое очищают флэш-хроматографией на диоксиде кремния Амикон, 20-40[элюент: дихлорметан/ метанол/ацетонитрил (88/6/6, по объему)]. Таким образом получают 0,64 г (16R)-16-дезоксо 16-фтор-14-О-[(2-имидазол-1-илэтокси)ацетил] пристинамицина IIВ в виде твердого вещества бледно-желтого цвета. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,10(16R)-16-Дезоксо-16-фтор-14-O-[2-хлорэтоксиацетил]пристинамицин IIВ может быть получен следующим образом. К раствору 5,32 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 130 см 3 дихлорметана при температуре 20 С добавляют 3,1 г N,N'дициклогексилкарбодиимида, 0,61 г 4-диметиламинопиридина и 2,08 г 2-хлорэтоксиуксусной кислоты в виде раствора в 20 см 3 дихлорметана. После перемешивания в течение 1 ч при температуре 20 С реакционную смесь фильтруют и остаток промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая 7,68 г твердого вещества оранжевого цвета, которое очищают флэшхроматографией на диоксиде кремния Амикон, 20-40[элюент: дихлорметан/этилацетат(50/50, по объему)]. Таким образом получают 4,68 г (16R)-16-дезоксо-16-фтор-14-О-[2-хлорэтоксиацетил]пристинамицина IIB в виде порошка белого цвета.(т, J=6 Гц: 2H); 3,80-3,90 (м: 1 Н); 3,83 (т, J=6 Гц: 2H); 4,05 (м: 1 Н); 4,14 (АВ-система неограниченная, J=13 Гц: 2H); 4,52 (м: 1 Н); 4,78 (дд, J=10 и 1,5 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,12 (неразрешенный дублет, JНF=48 Гц: 1 Н); 5,31 (шир. д, J=9 Гц: 1H); 5,78 (м: 1 Н); 5,82 (дд, J=16 и 2 Гц: 1 Н); 5,85-5,95 (м: 2 Н); 6,19 (д, J=16 Гц: 1 Н); 6,52 (дд, J=16 и 5 Гц: 1 Н); 8,12 (с: 1 Н). 2-Хлорэтоксиуксусная кислота может быть получена согласно E.J. Corey и Christopher J.Helal, Tetrahedron Letters, Vol. 37,28, pp. 4837-4840, 1996. Пример 26. (16R)-14-O-3,3-Диметил-3[4,6-диметил-2-(4-морфолин-4-илбутирилокси) фенил]пропионил-16-дезоксо-16-фторпристинамицин IIB. К раствору 1,6 г (16R)-14-О-3-[2-(4-бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропионил-16-дезоксо-16-фторпристинамицина IIB в 8 см 3 диметилсульфоксида добавляют при температуре 20 С и в атмосфере аргона 0,48 см 3 морфолина. После перемешивания в течение 30 мин при температуре 60 С реакционную смесь выливают в 300 см 3 смеси воды со льдом. Осадок отфильтровывают, промывают два раза 20 см 3 дистиллированной воды, затем растворяют в 150 см 3 дихлорметана. Полученный раствор промывают три раза 20 см 3 дистиллированной воды, сушат над сульфатом магния,фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,7 г остатка, который очищают флэш-хроматографией [элюент: дихлорметан/метанол (94/6,по объему)]. Получают твердое вещество, которое, после перемешивания в диизопропиловом эфире, фильтрования и высушивания (2,7 кПа) при температуре 20 С, приводит к 0,52 г (16R)14-O-3,3-диметил-3-[4,6-диметил-2-(4-морфолин-4-илбутирилокси)фенил]пропионил-16 дезоксо-16-фторпристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 88 С (разложение). 1 Н-ЯМР-слектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3 Н); 1,01 (д, J=6,5 Гц: 3 Н); 1,09(16R)-14-O-3-[2-(4-Бромбутирилокси)4,6-диметилфенил]-3,3-диметилпропионил-16 дезоксо-16-фторпристинамицин IIB может быть получен следующим образом. К раствору 2,7 г 3-[2-(4-бромбутирилокси)4,6-диметилфенил]-3,3-диметилпропионовой кислоты в 150 см 3 дихлорметана добавляют при температуре 20 С и в атмосфере аргона 1,2 гN,N'-дициклогексилкарбодиимида, 2,06 г (16R)16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) и 0,07 г 4 диметиламинопиридина. После перемешивания в течение 18 ч реакционную смесь фильтруют для удаления нерастворимой части. Фильтрат промывают четыре раза 25 см 3 дистиллированной воды, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 4,6 г остатка, который очищают двумя последовательными операциями флэш-хроматографии [элюент: дихлорметан/метанол (96/4, затем 97/3, по объему)]. Получают 1,6 г (16R)-14-О-3-[2-(4-бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропионил-16-дезоксо-16-фторпристинамицина IIB в виде твердого вещества кремового цвета. 1(дд, J=10 и 2 Гц: 1 Н); 4,80 (дд, J=9 и 3 Гц: 1 Н); 5,12 (д, J=9 Гц: 1H); 5,60-5,75 (м: 2 Н); 5,81 (дд,J=16 и 2 Гц: 1 Н); 5,92 (м: 1 Н); 6,13 (д, J=16 Гц: 1 Н); 6,50 (дд, J=16 и 5 Гц: 1 Н); 6,59 (д, J=1,5 Гц: 1 Н); 6,82 (д, J=1,5 Гц: 1H); 8,12 (с: 1H). 3-[2-(4-Бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропионовая кислота может быть получена следующим образом. К раствору 2,3 г 3-[2-(4-бромбутирилокси)4,6-диметилфенил]-3,3-диметилпропаналя в 200 см 3 ацетона при температуре 20 С добавляют по каплям раствор 1 г перманганата калия в смеси 46 см 3 дистиллированной воды и 30 см 3 ацетона. После перемешивания в течение 24 ч к реакционной смеси добавляют 100 см 3 дистиллированной воды, подкисляют до значения рН, равного 1-2, добавлением 1 н. водного раствора соляной кислоты, затем экстрагируют пять раз 100 см 3 дихлорметана. Органические фазы объединяют,сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 2,7 г 3-[2-(4-бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропионовой кислоты в виде бесцветного масла. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 43 1,59 (2 с: 6 Н в целом); 2,23 и 2,24 (2 с: 3 Н в целом); 2,29 (м: 2 Н); 2,54 и 2,55 (2 с: 3 Н в целом); 2,78 (т, J=7 Гц: 2H); 2,84 и 2,87 (2 с: 2 Н в целом); 3,55 (т, J=6,5 Гц: 2H); 6,57 и 6,59 (2 шир. с: 1 Н в целом); 6,81 и 6,83 (2 шир. с: 1 Н в целом). 3-[2-(4-Бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропаналь может быть получен следующим образом. К суспензии 3,1 г пиридинийхлорхромата в 900 см 3 дихлорметана при температуре 24 С добавляют по каплям раствор 2,5 г 3-[2-(4 бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропан-1-ола в 160 см 3 дихлорметана. После перемешивания в течение 2 ч при температуре 24 С реакционную смесь фильтруют с использованием 630 г диоксида кремния (гранулометрия 0,063-0,2 мм), элюируя последовательно чистым дихлорметаном, затем смесью дихлорметана и этилацетата (80/20, по объему). Таким образом получают 2,4 г 3-[2-(4-бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропаналя в виде бесцветного вязкого масла. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.):(т, J=7 Гц: 2H); 2,80-2,90 (м: 2 Н); 3,56 (т, J=6 Гц: 2H); 6,59 и 6,61 (2 шир. с: 1 Н в целом); 6,85 и 6,87 (2 шир.с: 1 Н в целом); 9,55 (шир.с: 1 Н). 3-[2-(4-Бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропан-1-ол может быть получен следующим образом. К раствору 5,4 г 4-бромбутирата 2-3(трет-бутилдиметилсилилокси)-1,1-диметилпропил-3,5-диметилфенола в 60 см 3 дихлорметана добавляют по каплям, при температуре 0 С и в атмосфере аргона, 2,24 см 3 тригидрофторида триэтиламина. После перемешивания в течение 42 ч при температуре 20 С реакционную смесь фильтруют с использованием 750 г диоксида кремния (гранулометрия 0,063-0,2 мм), элюируя последовательно дихлорметаном, затем смесью дихлорметан/этилацетат (90/10, по объему). Таким образом получают 2,6 г 3-[2-(4-бромбутирилокси)-4,6-диметилфенил]-3,3-диметилпропан-1-ола в виде бесцветного вязкого масла. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.):(2 шир. с: 1 Н в целом); 6,82 и 6,84 (2 шир. с: 1 Н в целом). 4-Бромбутират 2-3-(трет-бутилдиметилсилилокси)-1,1-диметилпропил-3,5-диметилфенола может быть получен следующим образом. К раствору 3,22 г 2-3-(трет-бутилдиметилсилилокси)-1,1-диметилпропил-3,5 диметилфенола в 60 см 3 тетрагидрофурана добавляют, при температуре 20 С и в атмосфере аргона, маленькими порциями 0,32 г гидрида 44 натрия (75% в минеральном масле), затем спустя 15 мин добавляют 1,16 см 3 4-бромбутирилхлорида. После перемешивания в течение 40 мин добавляют 100 см 3 диэтилового эфира, 10 см 3 дистиллированной воды и 10 см 3 водного насыщенного раствора хлорида натрия. После перемешивания органическую фазу декантируют, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который фильтруют с использованием 75 г диоксида кремния (гранулометрия 0,063-0,2 мм), элюируя последовательно циклогексаном, затем смесью циклогексан/этилацетат (90/10, по объему). Таким образом получают 2 г 4-бромбутирата 2-3(трет-бутилдиметилсилилокси)-1,1-диметилпропил-3,5-диметилфенола в виде бесцветного масла. 1(с: 3H); 2,77 (т, J=7,5 Гц: 2H); 3,40-3,65 (м: 4 Н); 6,56 и 6,58 (2 шир. с: 1 Н в целом); 6,81 и 6,83 (2 шир. с: 1 Н в целом). 2-3-(трет-Бутилдиметилсилилокси)-1,1 диметилпропил-3,5-диметилфенол может быть получен согласно K.L. Amsberry, A.E. Gerstenberger, R.T. Borchardt, Pharm. Res., 8(4), 455-61(1991). Пример 27. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[4-(морфолин-4-ил)бутирил]пристинамицина IIВ. К раствору 0,453 г (16R)-16-дезоксо-16 фтор-14-O-[4-(морфолин-4-ил)бутирил]пристинамицина IIВ в 10 см 3 этанола при температуре 20 С добавляют 6,58 см 3 0,1 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давлении(2,7 кПа), получая остаток, который перемешивают в 10 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 4 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) при температуре 20 С получают 0,506 г метансульфоната (16R)16-дезоксо-16-фтор-14-O-[4-(морфолин-4-ил) бутирил]пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 122 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 0,99 (д, J=6,5 Гц: 3H); 1,10(16R)-16-Дезоксо-16-фтор-14-O-[4-(морфолин-4-ил)бутирил]пристинамицин IIВ может быть получен следующим образом. К раствору 1,3 г (16R)-16-дезоксо-16-фторпристинамицина IIВ (полученного как описано в примере 1) в 35 см 3 дихлорметана при температуре 20 С добавляют 0,512 г гидрохлорида 4(морфолин-4-ил)масляной кислоты и 0,343 см 3 триэтиламина в виде раствора в 35 см 3 дихлорметана, 0,503 г N,N'-дициклогексилкарбодиимида и 0,03 г 4-диметиламинопиридина. После перемешивания в течение 16 ч при температуре 20 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают 10 см 3 дихлорметана, затем фильтруют. Фильтрат разбавляют 40 см 3 дихлорметана, промывают 50 см 3 воды, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа), получая 1 г твердого вещества желтого цвета, которое очищают флэш-хроматографией[элюент: градиент дихлорметан/метанол/ацетонитрил (98/1/1, затем 96/2/2,затем 94/3/3, по объему)]. Таким образом получают 0,584 г твердого вещества белого цвета,которое обрабатывают 20 см 3 дихлорметана. Полученный раствор промывают 20 см 3 воды,сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая после перемешивания в пентане, фильтрования и высушивания (2,7 кПа) при температуре 20 С 0,524 г (16R)-16-дезоксо 16-фтор-14-O-[4-(морфолин-4-ил)бутирил]пристинамицина IIВ в виде твердого вещества белого цвета, плавящегося при температуре около 100 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3 Н); 1,00 (д, J=6,5 Гц: 3 Н); 1,10(м: 1 Н); 3,49 (м: 1 Н); 3,71 (м: 4 Н); 3,85 (м: 1 Н); 4,07 (м: 1 Н); 4,54 (м: 1 Н); 4,78 (дд, J=10 и 1,5 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,11 (неразрешенный дублет, JНF=48 Гц: 1 Н); 5,30 (д, J=9 Гц: 1 Н); 5,75-5,85 (м: 1 Н); 5,76 (м: 1 Н); 5,81 (дд, J=17 и 1,5 Гц: 1 Н); 5,95 (м: 1 Н); 6,19 (д, J=16 Гц: 1H); 6,51 (дд, J=17 и 5 Гц: 1 Н); 8,12 (c: 1H). Гидрохлорид 4-(морфолин-4-ил)масляной кислоты может быть получен согласно Raj К. 46 полнительные 0,5 г имидазола и продолжают перемешивать в течение 2 ч при температуре 65 С. Смесь концентрируют при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 20 см 3 дистиллированной воды и 25 см 3 дихлорметана. Органическую фазу декантируют, затем промывают 2 раза 20 см 3 дистиллированной воды. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении(2,7 кПа), получая 1,13 г твердого вещества,которое очищают флэш-хроматографией [элюент: дихлорметан/метанол (98/2, по объему, затем 95/5, по объему)]. Таким образом получают 325 мг продукта, который перемешивают в диэтиловом эфире, отфильтровывают, затем сушат при температуре 20 С (90 Па), получая 248 мг(16R)-16-дезоксо-16-фтор-14-O-(4-имидазол-1 илбутирил)пристинамицина IIB в виде твердого вещества бежевого цвета, плавящегося при температуре 125 С. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3 Н); 1,10(16R)-14-O-(4-Бромбутирил)-16-дезоксо 16-фторпристинамицин IIB может быть получен следующим образом. К раствору 5 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 150 см 3 дихлорметана добавляют 2,64 см 3 триэтиламина, затем 2,3 см 3 хлорангидрида 4-броммасляной кислоты. После перемешивания в течение 18 ч при температуре 25 С добавляют дополнительные 1,32 см 3 триэтиламина и 1,15 см 3 хлорангидрида 4 броммасляной кислоты. Реакционную смесь перемешивают в течение 2 ч при температуре 25 С, затем промывают 2 раза 100 см 3 дистиллированной воды. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении[элюент: дихлорметан/метанол (97/3, по объему)]. Таким образом получают 3,4 г продукта,который перемешивают с диизопропиловым эфиром, фильтруют, сушат, затем очищают флэш-хроматографией [элюент: дихлорметан/ метанол (98/2, по объему)]. Таким образом получают после перемешивания в диизопропиловом эфире, фильтрования и высушивания при температуре 20 С (90 Па) 1,32 г (16R)-14-O-(4 47 бромбутирил)-16-дезоксо-16-фторпристинамицина IIB в виде твердого вещества не совсем белого цвета, используемого без дальнейшей очистки. 1IIB (полученного как описано в примере 28) в 3 см 3 диметилформамида добавляют 590 мг 1(пирролидинокарбонилметил)пиперазина. После перемешивания в течение 4 ч при температуре 60 С смесь концентрируют при пониженном давлении (2,7 кПа), получая остаток, который обрабатывают 40 см 3 дистиллированной воды и 20 см 3 дихлорметана. После добавления хлорида натрия водную фазу декантируют, затем экстрагируют 2 раза 20 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1 г твердого вещества каштанового цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/метанол (95/5,по объему)]. Таким образом получают 650 мг продукта, который перемешивают в диэтиловом эфире в течение 1 ч, фильтруют, затем сушат при температуре 20 С (90 Па), получая 413 мг(16R)-16-дезоксо-16-фтор-14-O-4-[4-(пирролидин-1-илкарбонилметил)пиперазин-1-ил]бутирилпристинамицина IIВ в виде твердого вещества не совсем белого цвета, плавящегося при температуре 128 С. 1 48 Пример 30. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[5-(морфолин-4-ил)пентаноил]пристинамицина IIB. К раствору 0,79 г (16R)-16-дезоксо-16 фтор-14-O-[5-(морфолин-4-ил)пентаноил]пристинамицина IIB в 15 см 3 этанола при температуре 20 С добавляют 11 см 3 0,1 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 20 мин реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который перемешивают в 10 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 5 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) при температуре 20 С получают 0,89 г метансульфоната (16R)16-дезоксо-16-фтор-14-O-[5-(морфолин-4-ил) пентаноил]пристинамицина IIB в виде твердого вещества не совсем белого цвета, плавящегося при температуре около 120 С (разложение). 1 Н-ЯМР-спектр (400 МГц; (CD3)2SO-d6;в м.д.): 0,85 (д, J=6,5 Гц: 3H); 0,94 (д, J=6,5 Гц: 3H); 1,03 (д, J=6,5 Гц: 3H); 1,45-1,70 (м: 5 Н); 1,70-2,25 (м: 6 Н); 1,77 (с: 3H); 2,32 (с: 3H); 2,39(16R)-16-Дезоксо-16-фтор-14-O-[5-(морфолин-4-ил)пентаноил]пристинамицин IIВ может быть получен следующим образом. К раствору 2 г (16R)-16-дезоксо-16-фтор 14-O-[5-хлорпентаноил]пристинамицина IIВ в 30 см 3 тетрагидрофурана при температуре 20 С добавляют 0,46 г иодида натрия и 0,54 см 3 морфолина. После перемешивания в течение 27 ч при кипячении с обратным холодильником добавляют дополнительные 0,54 см 3 морфолина. После перемешивания в течение дополнительных 16 ч при кипячении с обратным холодильником добавляют 1 см 3 диметилформамида и 0,54 см 3 морфолина. После перемешивания еще в течение 24 ч при кипячении с обратным холодильником реакционную смесь разбавляют 20 см 3 дихлорметана и промывают 50 см 3 воды. Органическую фазу декантируют и водную фазу экстрагируют 50 см 3 дихлорметана. Органические фазы объединяют, промывают 3 раза 150 см 3 воды, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 2 г остатка,который очищают флэш-хроматографией [элюент: дихлорметан/метанол/ацетонитрил (92/4/4,по объему)]. Таким образом, после перемешивания в пентане, фильтрования и высушивания(16R)-16-дезоксо-16-фтор-14-O-[5-(морфолин-4 49 ил)пентаноил]пристинамицина IIB в виде твердого вещества бежевого цвета. 1(16R)-16-Дезоксо-16-фтор-14-O-[5-хлорпентаноил]пристинамицин IIВ может быть получен следующим образом. К раствору 4 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 100 см 3 дихлорметана при температуре 28 С добавляют 2,1 см 3 триэтиламина, 2 cм 3 5-хлорпентаноилхлорида и 0,18 г 4 диметиламинопиридина. После перемешивания в течение 2 ч при температуре 28 С реакционную смесь выливают в 100 см 3 воды. Органическую фазу декантируют и водную фазу экстрагируют 100 см 3 дихлорметана. Органические фазы объединяют, промывают 2 раза 200 см 3 воды, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 6 г твердого вещества каштанового цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/ метанол (98/2, по объему)]. Таким образом, после перемешивания в пентане, фильтрования и высушивания (2,7 кПа) при температуре 20 С получают 3,77 г (16R)-16-дезоксо-16-фтор-14-O(5-хлорпентаноил)пристинамицина IIB в виде твердого вещества белого цвета. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,10(дд, J=9 и 3 Гц: 1 Н); 5,11 (неразрешенный дублет, JHF=48 Гц: 1 Н); 5,30 (д, J=9 Гц: 1H); 5,755,85 (м: 1 Н); 5,76 (м: 1 Н); 5,82 (дд, J=17 и 2 Гц: 1 Н); 5,96 (м: 1 Н); 6,19 (д, J=16 Гц: 1H); 6,51 (дд,J=17 и 5 Гц: 1 Н); 8,13 (с: 1 Н). Пример 31. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[5-(имидазол-1-ил)пентаноил]пристинамицина IIВ. К раствору 0,66 г (16R)-16-дезоксо-16 фтор-14-О-[5-(имидазол-1-ил)пентаноил]пристинамицина IIB в 10 см 3 этанола при температуре 20 С добавляют 10,2 см 3 0,095 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давле 005199 50 нии (2,7 кПа), получая остаток, который перемешивают в 20 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 5 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) получают 0,712 г метансульфоната (16R)-16-дезоксо-16-фтор-14O-[5-(имидазол-1-ил)пентаноил]пристинамицина IIB в виде твердого вещества желтого цвета,плавящегося при температуре около 126 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-[5-(имидазол-1-ил)пентаноил]пристинамицин IIB может быть получен следующим образом. К раствору 1,4 г (16R)-16-дезоксо-16-фтор 14-O-[5-хлорпентаноил]пристинамицина(полученного как описано в примере 30) в 20 см 3 тетрагидрофурана при температуре 20 С добавляют 0,29 г имидазола и 0,32 г иодида натрия. После перемешивания в течение 20 ч при кипячении с обратным холодильником добавляют 1 см 3 диметилформамида и 0,29 г имидазола. После перемешивания в течение дополнительных 8,5 ч при кипячении с обратным холодильником добавляют 0,29 г имидазола. После перемешивания еще в течение 15,5 ч при кипячении с обратным холодильником реакционную смесь разбавляют 50 см 3 дихлорметана, затем промывают 100 см 3 воды. Органическую фазу декантируют и водную фазу экстрагируют 50 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,6 г твердого вещества оранжевого цвета, которое очищают двумя последовательными операциями флэшхроматографии [элюент: дихлорметан/метанолIIВ в виде твердого вещества желтого цвета. 1(полученного как описано в примере 30) в 20 см 3 диметилформамида при температуре 20 С добавляют 1,1 г (пирролидин-1-илкарбонилметил)пиперазина и 0,42 г иодида натрия. После перемешивания в течение 27,5 ч при температуре 50 С добавляют 0,55 г (пирролидин-1 илкарбонилметил)пиперазина. После перемешивания в течение дополнительных 27,5 ч при температуре 54 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа), получая остаток, который разбавляют 100 см 3 дихлорметана. Полученный раствор промывают 4 раза 300 см 3 воды. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа), получая 1,61 г твердого вещества желтого цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол(95/5, по объему)]. Таким образом, после перемешивания в пентане, фильтрования и высушивания (2,7 кПа) получают 0,726 г (16R)-16 дезоксо-16-фтор-14-O-5-[4-(пирролидин-1 илкарбонилметил)пиперазин-1-ил]пентаноил пристинамицина IIB в виде твердого вещества бежевого цвета, плавящегося при температуре около 100 С (разложение). 1(дд, J=10 и 2 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,09 (неразрешенный дублет, JHF=48 Гц: 1 Н); 5,30 (д, J=9 Гц: 1H); 5,75-5,90 (м: 1 Н); 5,75 (м: 1 Н); 5,83 (дд, J=17 и 1,5 Гц: 1 Н); 6,04 (м: 1 Н); 6,19 (д, J=16 Гц: 1H); 6,53 (дд, J=17 и 5 Гц: 1 Н); 8,12 (с: 1 Н). Пример 33. (16R)-16-Дезоксо-16-фтор-14O-[(RR,SS)-транс-2-(морфолинометил)-1-циклопропанкарбонил]пристинамицин IIB (смесь двух диастереоизомеров в соотношении 50/50). К раствору 2,1 г (16R)-16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) в 80 см 3 дихлорметана добавляют при температуре 20 С и в атмосфере аргона 1,1 г (RR,SS)-транс-2-(морфолинометил)-1-циклопропанкарбоновой кислоты, 1,24 г N,N'-дициклогексилкарбодиимида и 0,73 г 4-диметил 005199 52 аминопиридина. После перемешивания в течение 16 ч реакционную смесь фильтруют для удаления нерастворимой части, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 4,2 г остатка, который очищают флэш-хроматографией [элюент: градиент дихлорметан/метанол (от 98/2 до 95/5, по объему)]. Получают твердое вещество, которое перемешивают в диизопропиловом эфире, отфильтровывают и высушивают (2,7 кПа) при температуре 20 С, получая 1,5 г (16R)-16-дезоксо-16 фтор-14-O-[(RR,SS)-транс-2-(морфолинометил)1-циклопропанкарбонил]пристинамицина(смесь двух диастереоизомеров в соотношении 50/50) в виде не совсем белого порошка. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.)(наблюдается наличие двух диастереоизомеров в соотношении 50/50): 0,77 (м: 1 Н); 0,96 (д,J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,09 (д,J=6,5 Гц: 3H); 1,24 (м: 1 Н); 1,41 (м: 1 Н); 1,52 (м: 1 Н); 1,60-2,05 (м: 5 Н); 1,87 (с: 3H); 2,05-2,45 (м: 4 Н); 2,50 (массив: 4 Н); 2,76 (м: 1 Н); 2,99 (м: 1 Н); 3,24 (м: 1 Н); 3,49 (м: 1 Н); 3,73 (т, J=5 Гц: 4H); 3,84 (м: 1 Н); 4,06 (м: 1 Н); 4,53 (м: 1 Н); 4,754,85 (м: 2 Н); 5,09 (неразрешенный дублет,JHF=48 Гц: 1H); 5,30 (м: 1 Н); 5,70-5,85 (м: 3H); 5,96 и 6,03 (2 м: 1 Н в целом); 6,19 (д, J=16 Гц: 1 Н); 6,51 (м: 1 Н); 8,12 (с: 1 Н).(RR,SS)-транс-2-(Морфолинометил)-1 циклопропанкарбоновая кислота может быть получена следующим образом. К раствору 1,0 г этил (RR,SS)-транс-2(морфолинометил)-1-циклопропанкарбоксилата в 50 см 3 этанола при температуре 20 С добавляют 10 см 3 1 н. водного раствора гидроксида натрия. После перемешивания в течение 2 ч при температуре 80 С этанол удаляют при пониженном давлении (2,7 кПа) и остаточную водную фазу промывают 50 см 3 этилацетата. В водной фазе устанавливают значение рН, равное 6,добавлением 1 н. водного раствора соляной кислоты, после чего концентрируют досуха при пониженном давлении (2,7 кПа). Остаток два раза обрабатывают 50 см 3 толуола и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают 50 см 3 этанола при температуре 50 С, нерастворимую часть удаляют фильтрованием и фильтрат концентрируют при пониженном давлении (2,7 кПа). Таким образом получают 0,9 г (RR,SS)-транс-2-(морфолинометил)-1-циклопропанкарбоновой кислоты в виде желтого масла. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,68 (м: 1 Н); 1,20 (м: 1 Н); 1,46 (м: 1 Н); 1,56 (м: 1 Н); 2,28 (дд, J=13 и 8 Гц: 1 Н); 2,60 (дд, J=13 и 5 Гц: 1 Н); 2,66 (массив: 2 Н); 2,77 (массив: 2 Н); 3,78 (т, J=5 Гц: 4H). Этил (RR,SS)-транс-2-(морфолинометил)1-циклопропанкарбоксилат может быть получен следующим образом. 53 К раствору 2,82 г этил (RR,SS)-транс-2 формил-1-циклопропанкарбоксилата в 100 см 3 дихлорметана добавляют при температуре 20 С и в атмосфере аргона 1,74 см 3 морфолина и 6,36 г трис(ацетат-О)гидридбората натрия. После перемешивания в течение 4 ч добавляют 100 см 3 дистиллированной воды. После перемешивания органическую фазу декантируют, затем промывают 100 см 3 дистиллированной воды. Органическую фазу сушат над сульфатом магния,фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Таким образом получают 1,1 г этил (RR,SS)-транс-2-(морфолинометил)-1-циклопропанкарбоксилата в виде желтого масла. 1IIВ в 7 см 3 диметилсульфоксида при температуре 20 С добавляют 0,34 г имидазола и несколько кристаллов иодида натрия. После перемешивания в течение 2 ч при температуре 53 С, затем 16 ч при температуре 20 С реакционную смесь выливают в 35 см 3 воды и фильтруют через пористый стеклянный фильтр. Нерастворимую часть промывают водой и растворяют в 70 см 3 этилацетата. Полученный в результате раствор экстрагируют 25 см 3 0,1 н. водного раствора соляной кислоты. Водную фазу декантируют, экстрагируют 10 см 3 этилацетата, затем нейтрализуют 0,5 см 3 5 н. водного раствора гидроксида натрия. Водную фазу экстрагируют 2 раза 25 см 3 этилацетата. Органические фазы объединяют, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1 г твердого вещества бледно-желтого цвета, которое очищают флэш-хроматографией [элюент: дихлорметан/ метанол/ацетонитрил (88/6/6, по объему)]. Получают 0,59 г твердого вещества белого цвета,которое обрабатывают 5 см 3 дихлорметана. Органическую фазу фильтруют через целит. Целит промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 20 С, получая 0,58 г (16R)-16-дезоксо-16-фтор-14-O-[6-(имидазол-1-ил)гексаноил]пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 90 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-(6-бромгексаноил)пристинамицин IIB может быть получен следующим образом. К раствору 5,32 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 150 см 3 дихлорметана при температуре 28 С добавляют 1,7 см 3 триэтиламина и 1,8 см 3 6-бромгексаноилхлорида. После перемешивания в течение 21,5 ч при температуре 23 С добавляют 0,43 см 3 триэтиламина и 0,45 см 3 6-бромгексаноилхлорида. После перемешивания дополнительно в течение 21 ч при температуре 28 С реакционную смесь выливают в 50 см 3 воды. Органическую фазу декантируют,сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 8,05 г твердого вещества коричневого цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол/ацетонитрил (96/2/2, по объему)]. Таким образом получают 5,6 г (16R)-16-дезоксо-16 фтор-14-O-(6-бромгексаноил)пристинамицинаIIB в виде твердого вещества бледно-желтого цвета. 1IIB (полученного как описано в примере 34) в 7 см 3 диметилсульфоксида при температуре 20 С добавляют 0,67 см 3 N-метилпиперазина. После перемешивания в течение 0,5 ч при температуре 60 С реакционную смесь выливают в 35 см 3 воды со льдом и экстрагируют 50 см 3 дихлорметана. Органическую фазу промывают 25 см 3 водного насыщенного раствора хлорида натрия,сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа), получая 1,2 г твердого вещества оранжевого цвета, которое растворяют в 30 см 3 этилацетата. Полученный в результате раствор 55 экстрагируют последовательно 20 см 3 0,1 н. водного раствора соляной кислоты и 10 см 3 воды. Водные фазы объединяют и нейтрализуют 0,4 см 3 5 н. водного раствора гидроксида натрия. Водную фазу экстрагируют 2 раза 25 см 3 дихлорметана. Органические фазы объединяют,сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 0,94 г твердого вещества желтого цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол(90/10, по объему)]. Таким образом получают 0,27 г твердого вещества белого цвета, которое обрабатывают 5 см 3 дихлорметана. Органическую фазу фильтруют через целит. Целит промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 20 С, получая 0,26 г(16R)-16-дезоксо-16-фтор-14-O-[6-(4-метилпиперазин-1-ил)гексаноил]пристинамицина IIB в виде твердого вещества белого цвета, плавящегося при температуре около 95 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,09IIB (полученного как описано в примере 34) в 7 см 3 диметилсульфоксида при температуре 20 С добавляют 1,18 г (пирролидин-1-илкарбонилметил)пиперазина. После перемешивания в течение 3 ч при температуре 60 С реакционную смесь выливают в 35 см 3 воды со льдом, затем экстрагируют 2 раза 25 см 3 этилацетата. Органические фазы объединяют, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа),получая 1,53 г смолообразного остатка, который очищают флэш-хроматографией [элюент: дихлорметан/метанол (90/10, по объему)]. Получают 0,96 г клейкой смолы, которую обрабатывают 10 см 3 дихлорметана. Этот раствор фильтруют через целит. Целит промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая смолу, которую перемешивают последовательно в диэтиловом эфире и пентане. После фильтрования, затем высушивания при пониженном давлении (2,7 кПа) получают 0,78 г (16R)-16 дезоксо-16-фтор-14-O-6-[4-(пирролидин-1-ил 005199 56 карбонилметил)пиперазин-1-ил]гексаноилпристинамицина IIВ в виде твердого вещества желтого цвета, плавящегося при температуре около 80 С (разложение). 1(м: 1 Н); 5,82 (дд, J=17 и 2 Гц: 1 Н); 6,02 (м: 1 Н); 6,19 (д, J=16 Гц: 1 Н); 6,52 (дд, J=17 и 5 Гц: 1 Н); 8,13 (с: 1 Н). Пример 37. Метансульфонат (16R)-16 дезоксо-16-фтор-14-O-[7-(имидазол-1-ил)гептаноил]пристинамицина IIB. К раствору 1,96 г (16R)-16-дезоксо-16 фтор-14-O-[7-(имидазол-1-ил)гептаноил]пристинамицина IIB в 10 см 3 этанола при температуре 20 С добавляют 2,7 см 3 1 н. раствора метансульфокислоты в этаноле. После перемешивания в течение 10 мин реакционную смесь концентрируют досуха при пониженном давлении(2,7 кПа), получая остаток, который перемешивают в 10 см 3 диэтилового эфира. После фильтрования, промывания твердого вещества 5 см 3 диэтилового эфира и высушивания при пониженном давлении (2,7 кПа) получают 2,13 г метансульфоната (16R)-16-дезоксо-16-фтор-14-O[7-(имидазол-1-ил)гептаноил]пристинамицинаIIB в виде твердого вещества кремового цвета,плавящегося при температуре около 110 С (разложение). 1(16R)-16-Дезоксо-16-фтор-14-O-[7-(имидазол-1-ил)гептаноил]пристинамицин IIВ может быть получен следующим образом. К раствору 3,2 г (16R)-16-дезоксо-16-фторпристинамицина IIB (полученного как описано в примере 1) в 100 см 3 дихлорметана при температуре 23 С добавляют 1,49 г N,N'-дициклогексилкарбодиимида, 0,075 г 4-диметиламинопиридина, 1,68 г гидрохлорида 7-(имидазол-1 ил)гептановой кислоты и 1 см 3 триэтиламина. После перемешивания в течение 84 ч при температуре 23 С реакционную смесь фильтруют и 57 нерастворимую часть промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа), получая маслянистый остаток, который разбавляют 100 см 3 этилацетата. Полученный в результате раствор промывают последовательно 2 раза 40 см 3 воды и 40 см 3 водного насыщенного раствора хлорида натрия, затем экстрагируют 60 см 3 0,1 н. водного раствора соляной кислоты. Водную кислую фазу экстрагируют 20 см 3 этилацетата, доводят до значения рН, равного 8, добавлением 6 см 3 1 н. водного раствора гидроксида натрия, затем экстрагируют 2 раза 40 см 3 этилацетата. Органические фазы объединяют, промывают водным насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении(2,7 кПа), получая 3,05 г твердого вещества бледно-желтого цвета, которое очищают флэшхроматографией [элюент: дихлорметан/метанол/ ацетонитрил (86/7/7, по объему)]. Таким образом получают 2,58 г твердого вещества, которое обрабатывают 10 см 3 дихлорметана. Полученный раствор фильтруют через целит. Целит промывают дихлорметаном. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) при температуре 20 С, получая 2,58 г(16R)-16-дезоксо-16-фтор-14-O-[7-(имидазол-1 ил)гептаноил]пристинамицина IIВ в виде твердого вещества белого цвета, плавящегося при температуре около 80 С (разложение). 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,95 (д, J=6,5 Гц: 3H); 0,99 (д, J=6,5 Гц: 3H); 1,09(дд, J=10 и 2 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,09 (неразрешенный дублет, JHF=48 Гц: 1H); 5,29 (д, J=9 Гц: 1H); 5,70-5,85 (м: 2 Н); 5,83 (дд,J=16,5 и 2 Гц: 1 Н); 6,17 (м: 1 Н); 6,19 (д, J=15 Гц: 1 Н); 6,52 (дд, J=16,5 и 5 Гц: 1 Н); 6,90 (с: 1 Н); 7,06 (с: 1 Н); 7,45 (с: 1 Н); 8,12 (с: 1 Н). Гидрохлорид 7-(имидазол-1-ил)гептановой кислоты может быть получен согласно KinjiIizuka и др., J. Med. Chem., Vol. 24,10, pages 1139-1148 (1981). Пример 38. (16R)-16-Дезоксо-16-фтор-14O-(4-метилпиперазин-1-ил)карбонилацетилпристинамицин IIВ. К раствору 2,5 г (16R)-16-дезоксо-16 фторпристинамицина IIВ (полученного как описано в примере 1) в 100 см 3 дихлорметана добавляют при температуре 20 С и в атмосфере аргона 1,74 г 4-метилпиперазин-1-илкарбонилуксусной кислоты, 1,44 г N,N'-дициклогексилкарбодиимида и 0,09 г 4-диметиламинопиридина. После перемешивания в течение 18 ч реакционную смесь разбавляют 50 см 3 дихлорметана, фильтруют для удаления нерастворимой части, затем промывают четыре раза 50 см 3 дис 005199 58 тиллированной воды. Органическую фазу декантируют, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток (3,4 г) очищают флэшхроматографией [элюент: градиент дихлорметан/метанол (97/3 и 92/8, по объему)]. Получают твердое вещество белого цвета, которое после перемешивания в диэтиловом эфире, фильтрования и высушивания (2,7 кПа), дает 1,3 г (16R)16-дезоксо-16-фтор-14-O-(4-метилпиперазин-1 ил)карбонилацетилпристинамицина IIB в виде твердого вещества белого цвета. 1(м: 1 Н); 4,05 (м: 1 Н); 4,53 (м: 1 Н); 4,78 (шир.д,J=10 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,14 (неразрешенный дублет, JHF=48 Гц: 1 Н); 5,34 (д,J=9,5 Гц: 1 Н); 5,77 (м: 1 Н); 5,82 (дд, J=16 и 2 Гц: 1 Н); 5,88 (дт, J=9,5 и 5 Гц: 1 Н); 5,95 (м: 1 Н); 6,20 (д, J=16 Гц: 1 Н); 6,51 (дд, J=16 и 4 Гц: 1 Н); 8,12 (с: 1 Н). 4-Метилпиперазин-1-илкарбонилуксусная кислота может быть получена следующим образом. К раствору 4,5 г этил 4-метилпиперазин-1 илкарбонилацетата в 100 см 3 этанола при температуре 20 С добавляют 23 см 3 0,1 н. водного раствора гидроксида натрия. После перемешивания в течение 24 ч реакционную смесь концентрируют досуха при пониженном давлении(2,7 кПа). Полученный остаток обрабатывают 50 см 3 дистиллированной воды и раствор промывают четыре раза 50 см 3 дихлорметана. Значение рН водной фазы доводят до 5-6 добавлением 1 н. водного раствора соляной кислоты, экстрагируют два раза 50 см 3 дихлорметана, затем концентрируют досуха при пониженном давлении (2,7 кПа). Три раза остаток обрабатывают 100 см 3 толуола и концентрируют досуха в одних и тех же условиях. Получают 4,6 г пастообразного остатка желтого цвета, который перемешивают в 50 см 3 этанола при температуре около 60 С. Нерастворимую часть удаляют фильтрованием и фильтрат концентрируют досуха при пониженном давлении (2,7 кПа). Таким образом получают 3,5 г 4-метилпиперазин 1-илкарбонилуксусной кислоты в виде клейкой гигроскопической массы, используемой без дальнейшей очистки. 1H-ЯМР-спектр (300 МГц; (CD3)2SO-d6;в м.д.): 2,21 (с: 3H); 2,29 (т, J=5 Гц: 2H); 2,34 (т,J=5 Гц: 2H); 3,30-3,50 (м: 4 Н); 3,39 (с: 2 Н). Этил 4-метилпиперазин-1-илкарбонилацетат может быть получен согласно Morren H.,Trolin S., Denayer R., Grivsky E., Bull. Soc. Chim. 59 К раствору 400 мг (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1) в 2 см 3 пиридина при температуре 20 С добавляют 258 мг глутарового ангидрида и 84,5 мг 4-диметиламинопиридина. После перемешивания в течение 20 ч пиридин выпаривают при пониженном давлении (2,7 кПа) и полученное масло обрабатывают 20 см 3 этилацетата. Полученный в результате раствор промывают 2 раза 10 см 3 дистиллированной воды, затем 0,1 н. водным раствором соляной кислоты. Водную фазу экстрагируют этилацетатом, затем декантируют. Органическую фазу промывают дистиллированной водой, затем 2 раза 2 см 3 насыщенного раствора хлорида натрия. Органическую фазу декантируют, сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении(2,7 кПа), получая твердое вещество светложелтого цвета, которое перемешивают в 20 см 3 диэтилового эфира, отфильтровывают, затем сушат при пониженном давлении (2,7 кПа). Таким образом получают 363 мг твердого вещества, которое очищают флэш-хроматографиейIIB в виде твердого вещества белого цвета, плавящегося при температуре 98 С. 1(д, J=6,5 Гц: 3H); 1,55-2,05 (м: 7 Н); 1,89 (с: 3H); 2,17 (м: 1 Н); 2,25 (м: 1 Н); 2,37 (т, J=7 Гц: 2H); 2,42 (т, J=7 Гц: 2H); 2,77 (м: 1 Н); 3,00 (тд, J=17 и 6 Гц: 1 Н); 3,25 (м: 1 Н); 3,50 (м: 1 Н); 3,86 (м: 1 Н); 4,08 (м: 1 Н); 4,53 (м: 1 Н); 4,79 (дд, J=10 и 1,5 Гц: 1 Н); 4,82 (дд, J=9 и 3 Гц: 1 Н); 5,13 (неразрешенный дублет, JНF=48 Гц: 1 Н); 5,31 (д,J=9,5 Гц: 1 Н); 5,75-5,90 (м: 1 Н); 5,77 (м: 1 Н); 5,83 (дд, J=17 и 2 Гц: 1 Н); 5,97 (м: 1 Н); 6,19 (д,J=16 Гц: 1H); 6,53 (дд, J=17 и 5 Гц: 1 Н); 8,14 (с: 1 Н). Пример 40. Гидрохлорид (16R)-16-дезоксо 16-фтор-14-O-[3-(4-метилпиперазин-1-илкарбонил)пропионил]пристинамицина IIB. К раствору 615 мг (16R)-16-дезоксо-16 фтор-14-O-[3-(4-метилпиперазин-1-илкарбонил) пропионил]пристинамицина IIB в 6 см 3 метилизобутилкетона добавляют 3 н. раствор хлористого водорода в диэтиловом эфире вплоть до выпадения обильного осадка. Его отфильтровывают, промывают 2 раза 2 см 3 метилизобутилкетона, затем 3 раза 10 см 3 диэтилового эфира. После высушивания при температуре 50 С (90 Па) получают 600 мг гидрохлорида (16R)-16 дезоксо-16-фтор-14-O-[3-(4-метилпиперазин-1 илкарбонил)пропионил]пристинамицина IIB в виде белого порошка, плавящегося при температуре 160 С. 60 пристинамицин IIВ может быть получен следующим образом. В трехгорлую колбу в атмосфере азота помещают 450 мг 4-(4-метилпиперазин-1-ил)-4 оксомасляной кислоты, 1 г (16R)-16-дезоксо-16 фторпристинамицина IIB (полученного как описано в примере 1), 470 мг N,N'-дициклогексилкарбодиимида, 140 мг 4-диметиламинопиридина, затем 20 см 3 дихлорметана. Реакционную смесь перемешивают в течение 48 ч при температуре 20 С. Затем ее разбавляют 10 см 3 дихлорметана, после чего выливают в 50 см 3 дистиллированной воды. Полученную смесь фильтруют через вату. Органическую фазу декантируют и водную фазу экстрагируют 2 раза 5 см 3 дихлорметана. Органические фазы объединяют, сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа), получая 1,66 г смеси, которую очищают флэш-хроматографией [элюент: дихлорметан/метанол (95/5, по объему)]. Таким образом получают 975 мг продукта, который перемешивают в 10 см 3 диэтилового эфира,фильтруют и сушат, затем снова очищают флэш-хроматографией[элюент: этилацетат/метанол (93/7, по объему)]. Фракции концентрируют, получая твердое вещество, которое обрабатывают 10 см 3 диэтилового эфира и перемешивают в течение 30 мин. Полученное твердое вещество белого цвета отфильтровывают, промывают диэтиловым эфиром, затем сушат при температуре 50 С (90 Па), получая 500 мг (16R)-16-дезоксо-16-фтор-14-O-[3-(4-метилпиперазин-1-илкарбонил)пропионил]пристинамицина IIB в виде белого порошка, плавящегося при температуре 130 С. 1 Н-ЯМР-спектр (400 МГц; CDCl3;в м.д.): 0,96 (д, J=6,5 Гц: 3H); 1,00 (д, J=6,5 Гц: 3H); 1,10(с: 1 Н). 4-(4-Метилпиперазин-1-ил)-4-оксомасляная кислота может быть получена следующим образом. К 20 см 3 диоксана добавляют 1,17 г янтарного ангидрида, затем 1,19 см 3 N-метилпиперазина. После перемешивания в течение 18 ч при комнатной температуре выпавший осадок отфильтровывают, затем промывают последовательно минимальным количеством диоксана, 2 раза 10 см 3 ацетона и 10 см 3 диэтилового эфира. После высушивания при пониженном давлении
МПК / Метки
МПК: A61P 31/04, A61K 38/05, C07K 5/078
Метки: способ, стрептограминов, основе, композиции, получения, производные
Код ссылки
<a href="https://eas.patents.su/30-5199-proizvodnye-streptograminov-sposob-ih-polucheniya-i-kompozicii-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные стрептограминов, способ их получения и композиции на их основе</a>
Предыдущий патент: Вакцина для лечения воспаления и доброкачественной гиперплазии предстательной железы на основе бактерий lactobacilli и способ лечения указанных заболеваний
Следующий патент: Новые соединения карбамат и тиокарбамат подофиллотоксина, способ их получения и содержащие их фармацевтические композиции
Случайный патент: Обрабатывающая композиция


































