Методы и составы для лечения сердечной недостаточности и вентрикулярной коррекции путем доставки in vivo ангиогенных трансгенов
Формула / Реферат
1. Способ лечения пациента, страдающего от застойной сердечной недостаточности, включающий доставку вектора в сердце упомянутого пациента, причем упомянутый вектор, содержащий ген, кодирующий ангиогенный белок или пептид, оперативно связан с промотором для экспрессии гена.
2. Способ по п.1, где застойная сердечная недостаточность ассоциирована с тяжелым поражением коронарной артерии и миокардиальной ишемией.
3. Способ по п.1, где застойная сердечная недостаточность ассоциирована с дилатационной кардиомиопатией.
4. Способ по п.1, где вектор доставляется в кровеносный сосуд, снабжающий кровью миокард сердца.
5. Способ по п.4, где упомянутый кровеносный сосуд, снабжающий кровью миокард, является коронарной артерией, трансплантатом подкожной вены ноги или трансплантатом внутренней артерии молочной железы.
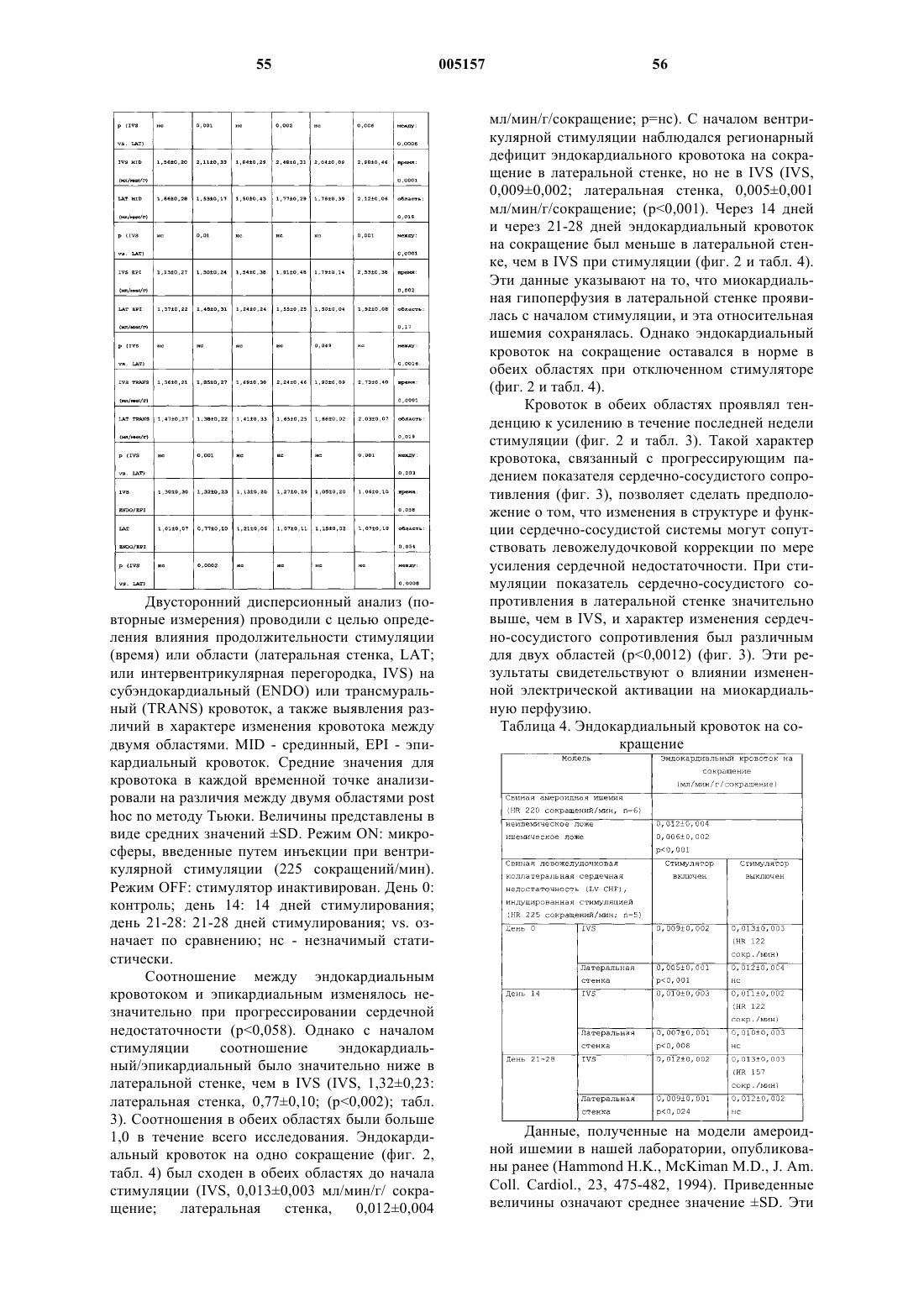
6. Способ по п.4, где вектор доставляют путем интракоронарной инъекции непосредственно в левую и/или правую коронарную артерии.
7. Способ по п.6, где упомянутую интракоронарную инъекцию проводят на глубину 1 см в просветы левой и/или правой коронарных артерий.
8. Способ по п.1, где ангиогенный белок или пептид является членом семейства фактора роста фибробластов (FGF).
9. Способ по п.8, где ангиогенный белок или пептид является FGF-4, FGF-5, FGF-6, FGF-1 или FGF-2.
10. Способ по п.9, где ангиогенный белок является FGF-4.
11. Способ по п.9, где ангиогенный белок является FGF-5.
12. Способ по п.9, где ангиогенный белок является FGF-1.
13. Способ по п.9, где ангиогенный белок является FGF-2.
14. Способ по п.1, где ангиогенный белок включает секреторную сигнальную последовательность.
15. Способ по п.14, где ангиогенный белок является FGF-2, модифицированным путем включения гетерологичной секреторной сигнальной последовательности.
16. Способ по п.1, где ангиогенный белок или пептид является членом семейства васкулярного эндотелиального фактора роста (VEGF).
17. Способ по п.16, где ангиогенный белок или пептид является VEGF-121, VEGF-145, VEGF-165, VEGF-189, VEGF-206, VEGF-167, VEGF-186 или VEGF-C.
18. Способ по п.1, где ангиогенный белок или пептид является членом семейства фактора роста тромбоцитов (PDGF).
19. Способ по п.18, где ангиогенный белок или пептид является PDGF-A или PDGF-B.
20. Способ по п.1, где ангиогенный белок или пептид является членом семейства инсулиноподобного фактора роста (IGF).
21. Способ по п.1, где упомянутый промотор является промотором CMV.
22. Способ по п. 1, где упомянутый промотор является тканеспецифичным для кардиомиоцитов.
23. Способ по п.22, где упомянутый тканеспецифичный промотор является вентрикулярным миоцит-специфичным промотором.
24. Способ по п.23, где упомянутый вентрикулярный миоцит-специфичный промотор является промотором легкой цепи-2 вентрикулярного миозина или промотором тяжелой цепи вентрикулярного миозина.
25. Способ по п.1, где вектор является вирусным вектором или липидным вектором.
26. Способ по п.25, где вектор является вирусной частицей.
27. Способ по п.26, где вирусная частица является дефектным по репликации аденовирусом (Ad).
28. Способ по п.26, где вирусная частица является дефектным по репликации аденоассоциированным вирусом (AAV).
29. Способ по п.26, где примерно 106-1014 вирусных частиц вектора доставляют путем инъекции.
30. Способ по п.27, где примерно 108-1012 аденовирусных частиц вектора доставляют путем инъекции.
31. Способ предотвращения или ослабления вентрикулярной коррекции у пациента, перенесшего инфаркт миокарда, включающий доставку в сердце упомянутого пациента вектора, включающего ген, кодирующий ангиогенный белок или пептид, оперативно связанный с промотором для экспрессии гена, усиливая тем самым миокардиальный кровоток и облегчая нежелательную вентрикулярную коррекцию.
32. Способ по п.31, где вектор доставляют в кровеносный сосуд, снабжающий кровью миокард сердца.
33. Способ по п.32, где упомянутый кровеносный сосуд, снабжающий кровью миокард, является коронарной артерией, трансплантатом подкожной вены ноги или трансплантатом внутренней артерии молочной железы.
34. Способ по п.32, где вектор доставляют путем интракоронарной инъекции непосредственно в левую и/или правую коронарные артерии.
35. Способ по п.34, где упомянутую интракоронарную инъекцию проводят примерно на 1 см в просвет левой и/или правой коронарных артерий.
36. Способ по п.31, где ангиогенный белок или пептид является членом семейства фактора роста фибробластов (FGF).
37. Способ по п.36, где ангиогенный белок или пептид является FGF-4, FGF-5, FGF-6, FGF-1 или FGF-2.
38. Способ по п.37, где ангиогенный белок является FGF-4.
39. Способ по п.37, где ангиогенный белок является FGF-5.
40. Способ по п.39, где ангиогенный белок является FGF-1.
41. Способ по п.39, где ангиогенный белок является FGF-2.
42. Способ по п.31, где ангиогенный белок включает секреторную сигнальную последовательность.
43. Способ по п.42, где ангиогенный белок является FGF-2, модифицированным путем включения гетерологичной секреторной сигнальной последовательности.
44. Способ по п. 31, где ангиогенный белок или пептид является членом семейства васкулярного эндотелиального фактора роста (VEGF).
45. Способ по п.44, где ангиогенный белок или пептид является VEGF-121, VEGF-145, VEGF-165, VEGF-189, VEGF-206, VEGF-167, VEGF-186 или VEGF-C.
46. Способ по п.31, где ангиогенный белок или пептид является членом семейства фактора роста тромбоцитов (PDGF).
47. Способ по п.46, где ангиогенный белок или пептид является PDGF-A или PDGF-B.
48. Способ по п.31, где ангиогенный белок или пептид является членом семейства инсулиноподобного фактора роста (IGF).
49. Способ по п.31, где упомянутый промотор является промотором CMV.
50. Способ по п.31, где упомянутый промотор является тканеспецифичным для кардиомиоцитов.
51. Способ по п.50, где упомянутый тканеспецифичный промотор является вентрикулярным миоцит-специфичным промотором.
52. Способ по п.51, где упомянутый вентрикулярный миоцит-специфичный промотор является промотором легкой цепи-2 вентрикулярного миозина или промотором тяжелой цепи вентрикулярного миозина.
53. Способ по п.31, где вектор является вирусным вектором или липидным вектором.
54. Способ по п.53, где вектор является вирусной частицей.
55. Способ по п.54, где вирусная частица является дефектным по репликации аденовирусом (Ad).
56. Способ по п.54, где вирусная частица является дефектным по репликации аденоассоциированным вирусом (AAV).
57. Способ по п.54, где примерно 106-1014 вирусных частиц вектора доставляют путем инъекции.
58. Способ по п.55, где примерно 108-1012 аденовирусных частиц вектора доставляют путем инъекции.
Текст
1 О финансировании исследования Правительством Некоторые исследования,описанные здесь, были частично поддержаны грантами Правительства Соединенных Штатов под номерами VA-HL0281201 и IP50HL53773.01, присужденными Национальным институтом здоровья. Правительство Соединенных Штатов может иметь определенные права по данному изобретению. Область изобретения Настоящее изобретение относится к способам и составам для лечения сердечнососудистых заболеваний. Более конкретно, настоящее изобретение относится к способам и полинуклеотидным конструкциям для лечения сердечной недостаточности и вентрикулярной коррекции путем доставки in vivo ангиогенных трансгенов. Уровень техники Известно, что 3-4 миллиона взрослого населения Соединенных Штатов имеют застойную сердечную недостаточность (сокращенно СНF); и распространенность СНF все увеличивается(см., например, Baughman K., Cardiology Clinics,13, 27-34, 1995). Ежегодно в клиниках Соединенных Штатов CHF является наиболее частой причиной госпитализации и диагнозом при выписке для 500000 пациентов. Когда симптомы сердечной недостаточности имеют среднюю тяжесть, прогноз хуже, чем для большинства онкологических больных, и в течение 2 лет умирает 50% таких пациентов (Braunwald E.(ed), in: Heart Disease, W.B. Saunders, Philadelphia, p. 471-485, 1988). Лекарственное лечение может первоначально ослабить симптомы сердечной недостаточности (например, отек, непереносимость физической нагрузки и одышку) и в некоторых случаях продлить жизнь. Однако даже при лекарственном лечении этого заболевания прогноз остается мрачным (см., например,Baughman K., Cardiology Clinics, 13, 27-34,1995).CHF определяют как аномальное функционирование сердца, в результате которого минутный сердечный выброс не соответствует метаболическим потребностям (Braunwald E.(ed), in: Heart Disease, W.B. Saunders, Philadelphia, p. 426, 1988). Симптомы включают одышку, усталость, слабость, опухание ног, непереносимость физической нагрузки. При обследовании у пациентов с сердечной недостаточностью обнаруживается склонность к высокому расположению сердца и дыхательных путей,хрипы (как показатель наличия жидкости в легких), отек, расширение яремной вены и, как правило, увеличенное сердце. Наиболее частой причиной CHF является атеросклероз, который вызывает блокаду коронарных артерий, снабжающих сердечную мышцу кислородом. В конечном итоге такая блокада может вызвать инфаркт миокарда (отмирание сердечной мышцы) 2 с последующим ослаблением функции сердца и возникающей сердечной недостаточностью. Другие причины CHF включают вальвулярную болезнь сердца, повышенное давление, вирусную инфекцию сердца, алкоголь и диабет. В некоторых случаях сердечная недостаточность не имеет ясной этиологии и поэтому называется идиопатической. Известные в настоящее время способы лечения CHF включают фармакологическую терапию, коронарную реваскуляризацию (например,хирургическое шунтирование коронарной артерии и ангиопластику) и пересадку сердца. Фармакологическая терапия направлена на усиление сокращения сердечной мышцы (путем использования инотропных агентов, таких, как дигиталис и агонисты -адренергических рецепторов), снижение накопления жидкости в легких и в других тканях (с помощью диуретиков) и уменьшение работы сердца (путем использования агентов, которые уменьшают системное сосудистое сопротивление, таких, как ингибиторы фермента, расщепляющего ангиотензин). Исследованы также антагонисты -адренергических рецепторов. Несмотря на то, что эти фармакологические агенты могут улучшать симптомы и, возможно, продлевать жизнь, прогноз в большинстве случаев остается мрачным. На некоторых пациентов с сердечной недостаточностью из-за ассоциированного с ней поражения коронарной артерии могут оказать благоприятное воздействие процедуры реваскуляризации, такие, как шунтирование коронарной артерии и ангиопластика. Такие процедуры являются потенциально благоприятными в том случае, когда вследствие неадекватного кровотока наблюдается не отмирание сердечной мышцы,а ее дисфункция. Если коронарный кровоток восстанавливается, то жизнеспособный миокард и при дисфункции может сокращаться более нормально, и деятельность сердца может улучшиться. Однако из-за того, что у пациентов с CHF микроваскулярное ложе повреждено, реваскуляризация очень редко восстанавливает сердечную функцию до нормального или близкого к нормальному уровня, хотя незначительные улучшения иногда наблюдаются. Пересадка сердца может быть подходящим выбором для пациентов, не имеющих других отягчающих заболеваний, и достаточно молодых, но это выбор только для небольшого количества пациентов с сердечной недостаточностью и только при огромных расходах. Дополнительными осложнениями физиологического состояния при CHF являются естественные адаптации, склонность к которым наблюдается у пациентов с дисфункцией сердца. Хотя эти естественные реакции и могут первоначально улучшать деятельность сердца, в конце концов они приводят к осложнениям, которые могут усилить CHF, затруднить лечение и 3 оказать неблагоприятное влияние на выживаемость. При CHF обычно наблюдаются три адаптивных реакции: (i) объемная задержка, вызванная изменениями в реабсорбции натрия, которая вызывает увеличение объема плазмы и вначале улучшает минутный выброс сердца; (ii) увеличение сердца (от дилатации и гипертрофии), что может вызвать увеличение его систолического объема при сохранении относительно нормального тонуса стенки и (iii) усиление высвобождения норэпинефрина из адренергических нервных окончаний, соприкасающихся с сердцем,которые при взаимодействии с -адренергическими сердечными рецепторами вызывают увеличение скорости и силы сокращения сердца, увеличивая тем самым минутный выброс сердца. Однако каждая из этих трех естественных реакций в конечном итоге по разным причинам имеет тенденцию к прекращению. В частности, задержка жидкости приводит к отеку и накоплению жидкости в легких, что затрудняет дыхание. Увеличение сердца может привести к разрушительной левой желудочковой коррекции с последующей тяжелой дилатацией и повышенным напряжением стенки, усиливая таким образом CHF. Наконец, длительное воздействие норэпинефрина на сердце, которое может вызвать толерантность к адренергическому стимулированию, связывается с плохим прогнозом. Ангиогенез обычно означает развитие и дифференциацию кровеносных сосудов. Известно, что ангиогенез промотируется большим количеством белков, называемых ангиогенными белками. Такие ангиогенные белки включают членов семейства фактора роста фибробластов (FGF), семейства васкулярного эндотелиального фактора роста (VEGF), семейства фактора роста тромбоцитов (PDGF), семейства инсулиноподобного фактора роста (IGF) и другие (описанные подробнее ниже и в иллюстративном материале). Например, было установлено, что члены семейства FGF и VEGF являются регуляторами ангиогенеза в течение периода роста и развития. Их роль в промотировании ангиогенеза у взрослых животных была недавно изучена (обсуждается ниже). Ангиогенная активность семейств FGF и VEGF при инфузии белка показана достаточно убедительно. Например, было показано, что кислый белок FGF("aFGF") в составе покрытой коллагеном матрицы при помещении в брюшную полость взрослых крыс вызывает образование хорошо васкуляризованной и нормально перфузированной структуры (Thompson et al., PNAS, 86, 79287932, 1989). Сообщалось, что при коронарной окклюзии у взрослой собаки инъекция основного белка FGF ("bFGF") в коронарную артерию приводила к снижению дисфункции миокарда,ослаблению инфарктов миокарда и увеличению количества кровеносных сосудов в сосудистом ложе с повышенным риском (Yanagisava-Miwa,et al., Science, 257, 1401-1403, 1992). Подобные 4 результаты получены на животных моделях миокардиальной ишемии при использовании белка bFGF (Harada, et al., J. Clin. Invest., 94,623-630, 1994; Unger, et al., Am. J. Physiol., 266,Н 1588-Н 1595, 1994). Усиление коллатерального кровотока продемонстрировано на собаках, обработанных белком VEGF (Banai et al., Circulation, 89, 2183-2189, 1994). Трудности, связанные с возможным применением таких белковых инфузий для того, чтобы промотировать кардиальный ангиогенез, включают достижение надлежащей локализации и уверенность в том, что белок достиг ее и остается в надлежащем виде и концентрации, необходимой для усвоения и промотирования ангиогенного эффекта в клетках миокарда. Другая трудность состоит в необходимости повторной инфузии или инъекции белка. Несколько групп исследователей описали перенос гена в миокард in vivo с использованием плазмид, ретровируса, аденовируса и других векторов (см., например, Barr et al., SupplementRowland et al., Am. Thorac. Surg., 60 (3), 721-728,1995. В общем, все описанные способы страдают одним или несколькими следующими недостатками: неадекватная трансдукционная эффективность и трансгенная экспрессия; выраженный иммунный ответ на примененный вектор,включая воспаление и некроз ткани; и, что важно, относительная невозможность сделать сердце объектом трансдукции и трансгенной экспрессии (т.е., перенос гена приводит к тому, что трансген доставляется также и в другие, не кардиальные локализации, такие как печень, почки,легкие, мозг и яички подопытных животных). Воспалительные инфильтраты были обнаружены в сердце после прямой интрамиокардиальной инъекции с помощью иглы, введенной в стенку миокарда (French et al., Circulation, 90 (5),2414-2424, 1994). Способ лечения некоторых форм застойной сердечной недостаточности, связанной с процессом передачи сигнала с участием адренергических рецепторов, продемонстрирован Hammond и соавторами в их заявке на патент США 08/708661 от 5 сентября 1996 года,включенной здесь полностью. Этот способ включает доставку генов, кодирующих элементы -адренергического сигнального пути, в 5 сердце пациента с сердечной недостаточностью,ассоциированной со снижением -адренергического сигнала. Способ лечения различных форм болезни сердца, таких как ишемия миокарда и поражение периферических сосудов,описан Hammond и соавторами в международной заявке 96/26742, опубликованной 6 сентября 1996 года. Одна из форм застойной сердечной недостаточности ассоциируется с поражением коронарной артерии (CAD), то есть настолько серьезна по своему режиму или внезапности, что приводит к хронической или острой сердечной декомпенсации. У таких пациентов обширная и/или внезапная окклюзия одной или нескольких коронарных артерий препятствует адекватному кровотоку к миокарду, приводя к тяжелой ишемии и в некоторых случаях - к инфаркту миокарда или отмиранию сердечной мышцы. Возникающий в результате этого некроз миокарда обычно сопровождается прогрессирующей хронической сердечной декомпенсацией или острым состоянием, связанным с низким минутным сердечным выбросом, оба состояния связаны с высокой смертностью. Некоторые формы застойной сердечной недостаточности особенно трудны для лечения,поскольку причина, вызывающая это состояние,остается неизвестной и не поддающейся лечению. Одним из таких примеров является дилатационная кардиомиопатия (или DCM, как она названа здесь). DCM является состоянием, при котором в сердце диагностируется расширенный гипоконтрактильный левый и/или правый желудочек, в отсутствие других характерных форм болезни сердца, таких как коронарная окклюзия или инфаркт миокарда в анамнезе. Пациенты с DCM могут испытывать стенокардию, даже если у них нет острого поражения коронарной артерии. В некоторых таких случаях причина DCM известна или предполагается. Примеры включают семейную кардиомиопатию(такую, как ассоциированная с прогрессирующей мышечной дистрофией, миотоническая мышечная дистрофия, атаксия Фридрейха и наследственная распространенная кардиомиопатия), инфекции, являющиеся результатом воспаления миокарда (такие, как инфекции, вызванные различными вирусами, бактериями и другими паразитами), неинфекционные воспаления (такие, как вызываемые аутоиммунными заболеваниями, peripartum кардиомиопатия, реакции гиперчувствительности или отторжения трансплантата), метаболические нарушения,вызывающие миокардит (включая пищевые,эндокринологические и электролитные аномалии) и контакт с токсическими агентами, приводящий к миокардиту (включая алкоголь, а также некоторые химиотерапевтические препараты и катехоламины). Однако в большинстве случаев,примерно в 80%, причина DCM остается неизвестной, и состояние определяется как идиопа 005157 6 тическая дилатационная кардиомиопатия. Проявление DCM вызывает несколько основных терапевтических проблем, включая прогрессирующее повреждение миокарда, гемодинамическую неэффективность, связанную с дилатацией сердца, угрозой системной эмболии и опасностью вентрикулярной аритмии. Традиционная реваскуляризация не является преимущественным способом лечения дилатационной кардиомиопатии потому, что основная проблема состоит не в обтурирующем коронарном процессе. Даже у тех пациентов, у которых причина DCM известна или предполагается, повреждение обычно не является легко обратимым. Например, в случае индуцированной адриамицином кардиотоксичности возникающая кардиомиопатия обычно необратима и приводит к смерти более чем 60% пораженных пациентов. Для большинства пациентов с DCM причина ее остается неизвестной. В результате не существует общего способа лечения DCM. Врачи традиционно сосредоточены на облегчении симптомов,проявляющихся у пациента с DCM (например,путем освобождения с помощью диуретиков от накопившейся жидкости и/или снижения потребности сердечной мышцы в кислороде и питательных веществах с помощью ингибиторов фермента, участвующего в превращении ангиотензина). В результате примерно 50% пациентов с DCM умирает в течение двух лет после постановки диагноза, часто от внезапной остановки сердца, связанной с вентрикулярной аритмией. Вентрикулярная коррекция часто наблюдается после инфаркта миокарда, приводящего к нарушению вентрикулярной функции. После инфаркта миокарда сердце стремится расшириться и реконструироваться. Это расширение или коррекция часто вызывает дальнейшее ухудшение вентрикулярной функции. Такое состояние вентрикулярной функции является наиболее вероятной причиной неблагоприятных последствий инфаркта миокарда. Таким образом, предотвращение вентрикулярной коррекции после инфаркта миокарда представляется полезным. Один из подходов в попытке предотвратить вентрикулярную коррекцию состоит в назначении пациентам, перенесшим инфаркт миокарда, ингибиторов фермента, расщепляющего ангиотензин (АСЕ) (см., например,McDonald K.M., Trans. Assoc. Am. Physicians,103, 229-235, 1990; Cohn, J. Clin. Cardiol., 18(Suppl. IV), IV-4-IV-12, 1995). Однако эти агенты недостаточно эффективны в предотвращении нежелательной вентрикулярной коррекции, и необходимо создание новых способов лечения. Сущность изобретения Настоящее изобретение относится к способам и составам для лечения застойной сердечной недостаточности (включая дилатационную кардиомиопатию, а также застойную сердечную недостаточность, связанную с острым поражением коронарной артерии) и для предот 7 вращения или облегчения нежелательной вентрикулярной коррекции путем введения в миокард пациента трансгенов, кодирующих ангиогенные белки. Различные аспекты настоящего изобретения включают следующее. Способ лечения пациента с застойной формой сердечной недостаточности, включающий доставку вектора в сердце упомянутого пациента, вектора, содержащего трансген, кодирующий ангиогенный белок или пептид, оперативно связанный с промотором для экспрессии трансгена. В число пациентов, страдающих от застойной сердечной недостаточности, входят пациенты с дилатационной кардиомиопатией. Другую группу пациентов с застойной сердечной недостаточностью составляют больные,перенесшие тяжелые инфаркты миокарда,обычно связанные с тяжелым или окклюзивным поражением коронарной артерии. Синтез ангиогенного белка в миокарде промотирует ангиогенез и усиливает кровоток. Предпочтительно вектор вводят в кровеносный сосуд, снабжающий кровью миокард, таким образом, чтобы доставить вектор в кардиомиоциты. Предпочтительно вектор вводят в просвет коронарной артерии, в трансплантат подкожной вены ноги или в трансплантат внутренней артерии молочной железы; более предпочтительно вектор вводят в просвет как левой, так и правой коронарной артерии. Интракоронарную инъекцию предпочтительно проводить достаточно глубоко внутрь артерии, предпочтительно по меньшей мере примерно на 1 см в просвет как левой, так и правой коронарной артерии. Инъекция может также проводиться примерно на 1 см в просвет трансплантата подкожной вены ноги и/или трансплантата внутренней артерии молочной железы и может быть проведена в дополнение к интракоронарной инъекции. Вектор может быть доставлен одной инъекцией в каждый из этих сосудов. Способ предотвращения или облегчения нежелательной вентрикулярной коррекции у пациента, страдающего (или того, кто может страдать) от инфаркта миокарда, включающий доставку вектора в сердце упомянутого пациента, вектора, содержащего ген, кодирующий ангиогенный белок или пептид, оперативно связанный с промотором для экспрессии гена. Синтез ангиогенного белка в миокарде индуцирует ангиогенез, усиливая таким образом кровоток и облегчая нежелательную вентрикулярную коррекцию. В предпочтительных способах промотирования ангиогенеза при лечении сердечной недостаточности в соответствии с одним из предшествующих вариантов осуществления изобретения вектор содержит по меньшей мере один ген, кодирующий ангиогенный белок или пептид из семейства FGF (фактор роста фибробластов), VEGF (васкулярный эндотелиальный фактор роста), PDGF (фактор роста тромбоци 005157 8 тов) или IGF (инсулиноподобный фактор роста). В некоторых предпочтительных вариантах осуществления изобретения вектор содержит ген,кодирующий FGF, включая, но не ограничиваясь FGF-4, FGF-5, FGF-6, aFGF (известный также как FGF-1) и bFGF (известный также какFGF-2). Предпочтительные ангиогенные белки включают те, которые секретируются естественным путем, или те, которые были модифицированы для усиления секреции. В настоящее время предпочтительными среди таких ангиогенных белков считаются виды FGF-4, FGF-5,FGF-6, FGF-1 и FGF-2, которые являются естественно секретируемыми или были модифицированы для усиления секреции. В одном из вариантов осуществления изобретения ген кодирует VEGF, включающего, но не ограниченного членами семейства VEGF-A (таких, как VEGF121, VEGF-145, VEGF-165, VEGF-189 и VEGF206), членами семейства VEGF-B (таких, какVEGF-C; или PDGF, или ICF. Ген, кодирующий ангиогенный белок,оперативно связан с промотором, который направляет транскрипцию и экспрессию гена в клетке млекопитающего, предпочтительно в кардиомиоците. В другом предпочтительном варианте осуществления изобретения промотором является тканеспецифичный промотор,предпочтительно кардиоспецифичный промотор, более предпочтительно вентрикулярный миоцитоспецифичный промотор. Предпочтительные примеры вентрикулярного миоцитоспецифичного промотора включают промотор легкой цепи-2 вентрикулярного миозина и промотор тяжелой цепи миозина. Предпочтительно ген, кодирующий ангиогенный фактор, также оперативно связан с сигналом полиаденилирования. В предпочтительных способах лечения сердечной недостаточности (включая DCM) или облегчения нежелательной вентрикулярной коррекции (например, после инфаркта миокарда) по данному изобретению вектором является вирусный вектор или вектор на основе липида,предпочтительно вирусный вектор. Вектор может быть направленным, особенно вектор, который нацелен преимущественно на вентрикулярные миоциты. В настоящее время предпочтительными вирусными векторами являются векторы, полученные на основе аденовируса (Ad) или аденоассоциированного вируса (AAV). Могут применяться как человеческие, так и не человеческие вирусные векторы, но преимущественно рекомбинантный вирусный вектор у человека является дефектным по репликации. Когда вектором является аденовирус, он предпочтительно включает полинуклеотид, содержащий промотор, оперативно связанный с геном, кодирующим FGF (например, FGF-1, FGF-2, FGF-4,FGF-5 или FGF-6), и является дефектным по репликации у человека. В настоящее время 9 предпочтительный дефектный по репликации аденовирусный вектор имеет делеции, которые удаляют гены Е 1 А и Е 1 В, или делеции, которые удаляют гены Е 1 А, Е 1 В и Е 4. В кровеносный сосуд предпочтительно вводят примерно 1061014 аденовирусных векторных частиц, более предпочтительно примерно 108-1012 векторных частиц, преимущественно в кровеносный сосуд,снабжающий кровью миокард. Более предпочтительно аденовирусный вектор, включающий ген, кодирующий ангиогенный белок, вводят в сердце пациента путем интракоронарной инъекции непосредственно в просветы обеих коронарных артерий. В случае вектора на основеAAV он предпочтительно включает полинуклеотид, содержащий промотор, оперативно связанный с геном, кодирующим ангиогенный белок, фланкированный с помощью инвертированных концевых повторов (ITRs) AAV. Преимущественно AAV векторы являются дефектными по репликации для человека. В настоящее время предпочтительные дефектные по репликации AAV векторы имеют делеции, действующие на одну или несколько AAV репликационных или инкапсулированных последовательностей. Более предпочтительно AAV гены rep иcap удаляются оба (и поэтому должны быть добавлены in trans для того, чтобы реплицировать и упаковать AAV векторы, обычно в упаковочную клеточную линию, как это известно дляAAV). Вектор может быть также на основе липида и включать ген, кодирующий ангиогенный белок. В литературе описано множество таких липидных векторов, включая липосомы, мицеллы и липидсодержащие эмульсии. Краткое описание рисунков Фиг. 1 представляет графически процент утолщения стенки при стимуляции на свиной модели застойной сердечной недостаточности. Процент утолщения стенки определяли последовательно в интервентрикулярной перегородке и в боковой стенке до стимуляции (день 0) и каждые 7 дней по мере того, как прогрессировала сердечная недостаточность (описано в примере 1). Символы означают средние значения; отрезки прямой, характеризующие погрешность, означают 1 SD (стандартное отклонение). Двусторонний дисперсионный анализ ANOVA(повторные измерения) показал, что на процент утолщения стенки влияет продолжительность стимуляции (р 0,001) и область (р 0,001). Кроме того, характер изменения утолщения стенки был различным для двух областей (р 0,0001). Средние значения процента утолщения стенки в каждой временной точке были тестированы на различия между двумя областями post hoc (после этого) по методу Тьюки; значения р для этих анализов приведены под отрезками прямых,характеризующими погрешность. Фиг. 2a и 2 в представляют графически субэндокардиальный кровоток при стимулирова 005157 10 нии на свиной модели застойной сердечной недостаточности, как описано в примере 1. Для фиг. 2a субэндокардиальный (эндо) кровоток измеряли последовательно в интравентрикулярной перегородке и боковой стенке при условиях, указанных вдоль оси X. День означает день непрерывной стимуляции, в который были получены данные (0, начало стимуляции; 14, 14 дней; 21-28, дни с 21 по 28). РАСЕ означает измерения кровотока при активированном водителе ритма (+) или при инактивированном (0). Скорость водителя ритма составила 225 сокращений/мин. (В табл. 3 приведены численные значения). Символы означают средние значения; отрезки прямой, характеризующие погрешность, означают 1 SD (стандартное отклонение). Двусторонний дисперсионный анализ ANOVA (повторные измерения) показал,что на субэндокардиальный кровоток влияет продолжительность стимуляции (р 0,0001) и область (р 0,017). Кроме того, характер изменения субэндокардиального кровотока был различным для двух областей (p0,006). Средние значения для субэндокардиального кровотока в каждой временной точке были тестированы на различия между двумя областями post hoc (после этого) по методу Тьюки; значения р для этих анализов приведены под отрезками прямых,характеризующими погрешность. Для фиг. 2 в субэндокардиальный кровоток измеряли последовательно в интравентрикулярной перегородке и боковой стенке при условиях,указанных вдоль оси X. Символы и условия, как на фиг. 2 а. (В табл. 4 приведены числовые значения). Двусторонний дисперсионный анализANOVA (повторные измерения) показал, что на субэндокардиальный кровоток влияет продолжительность стимуляции (р 0,0001) и область(р=0,0198). Фиг. 3 а представляет графически меридиональное напряжение стенки в конце систолы, определенное последовательно в интравентрикулярной перегородке и боковой стенке до стимуляции (день 0) и каждые 7 дней по мере прогрессирования сердечной недостаточности(описанной в примере 1). Двусторонний дисперсионный анализ ANOVA (повторные измерения) показал, что на систолическое напряжение стенки влияет продолжительность стимуляции(р 0,0001). Однако характер систолического напряжения стенки был сходным для двух областей (р 0,006). Измерения проводили при инактивированном водителе ритма. Фиг. 3 в представляет графически коронарное сосудистое сопротивление при стимуляции на свиной модели застойной сердечной недостаточности, как описано в примере 1. Индекс коронарного сосудистого сопротивления был определен последовательно в интравентрикулярной перегородке и боковой стенке при условиях,указанных вдоль оси X. Символы и условия такие, как на фиг. 2. Двусторонний дисперсион 11 ный анализ ANOVA (повторные измерения) показал, что на коронарное сосудистое сопротивление влияет продолжительность стимуляции (р 0,0001) и область (р 0,013). Кроме того,характер изменения коронарного сосудистого сопротивления был различным для двух областей (р 0,0012). Средние значения для коронарного сосудистого сопротивления в каждой временной точке были тестированы на различия между двумя областями post hoc (после этого) по методу Тьюки. Этот анализ показал, что коронарное сосудистое сопротивление в боковой стенке было выше, чем в перегородке непосредственно после начала стимуляции (значения р приведены под отрезками прямых, характеризующими погрешность). Фиг. 4 показывает схематически конструкцию типичного дефектного по репликации рекомбинантного аденовирусного вектора, применяемого для переноса гена в клетки и в сердце,как описано ниже в примерах. Фиг. 5 является схематическим изображением спасательной рекомбинантной конструкции трансгена, кодирующего аденовирус. Фиг. 6 а и 6 в представляют графически регионарную сократительную функцию обработанных животных, как описано в примере 5. Фиг. 6 а демонстрирует результаты, полученные на животных, исследованных через 2 недели после переноса гена, фиг. 6 в демонстрирует результаты, полученные через 12 недель после переноса гена. На фиг. 7 а, 7 в и 7 с приведены диаграммы,соответствующие миокардиальным контрастным эхокардиограммам. Светлые области означают контрастное усиление (больше кровотока),темные области означают сниженный кровоток. Фиг. 7 а иллюстрирует острую LCx окклюзию у нормальной свиньи. Фиг. 7 в иллюстрирует различие в контрастном усилении между IVS (интравентрикулярной перегородкой) и LCx (левым огибающим) ложем (ишемической областью) через 14 дней после переноса гена с lacZ, указывающее на различие кровотоков в двух областях при артиальном стимулировании (200 сокращений/мин). На фиг. 7 с контрастное усиление одинаково в IVS и в LCx ложе через 14 дней после переноса гена с FGF-5, что указывает на одинаковый кровоток в двух областях при артиальном стимулировании. Эти результаты описаны в примере 5. На фиг. 8 показано максимальное контрастное соотношение (коррелят кровотока), выраженное как отношение максимальной видеоинтенсивности в ишемической области (LCx ложе) к максимальной видеоинтенсивности интравентрикулярной перегородки (IVS), измеренное по видеоизображениям с использованием программы компьютерного видеоанализа при атриальном стимулировании (200 сокращений/мин) до и через 141 дней после переноса гена с lacZ(контрольным геном) и с FGF-5, и у 5 животных через 12 недель после переноса гена с FGF-5(описано в примере 5). Кровоток в ишемической области составил 50% от нормы после переноса гена с контрольным геном, но увеличился в два раза по отношению к норме после переноса гена с FGF-5 (р=0,0018), эффект сохранялся, по меньшей мере, в течение 12 недель. На фиг. 9 показано количество кровеносных сосудов, определенное микроскопическим анализом, в ишемической и неишемической областях после переноса гена с FGF-5 и с lacZ(описано в примере 5). Наблюдалось увеличение числа капиллярных сосудов вокруг каждого волокна в ишемической и неишемической областях у животных после переноса гена с FGF-5(р 0,038) по сравнению с животными, получавшими ген lacZ. На фиг. 10 а, 10 в и 10 с показан вид гелей,подтверждающих экспрессию ДНК, мРНК и белка после переноса ангиогенного трансгена в миокард в соответствии с настоящим изобретением (как описано в примере 5). На фиг. 10 д показан вид геля, полученного с помощью PCR(полимеразной цепной реакции), демонстрирующий отсутствие какого-либо детектируемого переноса гена в ретину, печень или скелетную мышцу обработанных животных (как описано в примере 5). На фиг. 11 приведено сопоставление утолщения стенки, полученного при переносе гена in vivo с использованием различных ангиогенных генных конструкций, FGF-4, FGF-5 иFGF-2LI+/-sp (т.е FGF-2LI плюс или минус секретируемый сигнальный пептид), как описано в примерах 6 и 7. Фиг. 12 показывает, что улучшение функции в ишемической области после переноса гена с FGF-4 (о чем свидетельствует утолщение стенки) было связано с улучшением регионарной перфузии. На фиг. 13 приведено сравнение перфузииFGF-4, FGF-5 или FGF-2LI+/-sp (FGF-2LI плюс или минус сигнальный пептид), как описано в примерах 6 или 7. На фиг. 14 показано утолщение стенки,полученное в результате переноса гена с FGF-2 плюс (FGF-2LI+sp) или минус секретируемый сигнальный пептид (FGF-2LI-sp), как описано в примере 7. Подробное описание предпочтительных вариантов осуществления изобретения Определения Сердечная недостаточность означает клинически подтвержденное состояние, при котором сердце не обеспечивает адекватного кровотока, удовлетворяющего метаболическим потребностям. Симптомы сердечной недостаточности включают одышку, утомляемость,слабость, опухание ног и непереносимость физической нагрузки. При физическом исследова 13 нии у пациентов с сердечной недостаточностью отмечается тенденция к сохранению приподнятого положения сердца и дыхательных путей,хрипы (указывающие на жидкость в легких),отек, расширение яремной вены и, как правило,увеличенное сердце. Для пациентов с сердечной недостаточностью характерна высокая смертность; обычно 50% пациентов погибают в течение двух лет развития заболевания. В некоторых случаях сердечная недостаточность ассоциирована с тяжелым поражением коронарной артерии (CAD), обычно приводящим к инфаркту миокарда и либо к прогрессирующей хронической сердечной недостаточности, либо к острому состоянию при низком минутном выбросе сердца, как описано в данном изобретении и в литературе. В других случаях сердечная недостаточность ассоциирована с дилатационной кардиомиопатией (как описано ниже) без связи с тяжелым поражением коронарной артерии. Дилатационная кардиомиопатия (илиDCM, как здесь обозначено) является разновидностью сердечной недостаточности, которая обычно диагностируется путем обнаружения расширенного правого и/или левого желудочка с пониженной сократительной способностью в отсутствие других характерных форм болезни сердца, таких, как коронарная окклюзия или инфаркт миокарда в анамнезе. DCM ассоциирована с нарушенной вентрикулярной функцией и симптомами сердечной недостаточности. У таких пациентов расширение полости и истончение стенки желудочка приводит обычно к повышенному напряжению стенки. Несмотря на отсутствие типичного окклюзивного поражения коронарной артерии, эти пациенты часто жалуются на стенокардию. Другие симптомы включают одышку, утомляемость, слабость, опухание ног и непереносимость физической нагрузки. У многих пациентов эти симптомы проявляются даже при слабом усилии или в состоянии покоя, и поэтому их состояние характеризуется как тяжелая форма сердечной недостаточности типа III или типа IV, соответственно. При физическом исследовании у пациентов сDCM отмечается тенденция к сохранению приподнятого положения сердца и дыхательных путей, хрипы (указывающие на жидкость в легких), отек, расширение яремной вены и, как правило, увеличенное сердце. В диагностикеDCM обычно используют эхокардиографию. Пациенты с DCM могут ощущать стенокардию даже в отсутствие тяжелого поражения коронарной артерии. В некоторых случаях причинаDCM известна или предполагается. Примеры включают семейную кардиомиопатию (такую,как ассоциированная с прогрессирующей мышечной дистрофией, миотонической мышечной дистрофией, атаксией Фридрейха и наследственной дилатационной кардиомиопатией), инфекции, приводящие к воспалению миокарда,неинфекционные воспаления (такие, как ауто 005157 14 иммунные заболевания, peripartum кардиомиопатия, реакции гиперчувствительности или отторжение трансплантата), метаболические нарушения (включая пищевые, эндокринологические и электролитные аномалии) и контакт с токсическими агентами (такими, как алкоголь,химиотерапевтические препараты и некоторые катехоламины). В большинстве случаев (примерно 80%) этиология DCM остается неизвестной, и поэтому состояние пациента определяется как идиопатическая дилатационная кардиомиопатия. Термины имеющий терапевтический эффект и успешное лечение, как они использованы в данном изобретении, по существу имеют одно и то же значение. В частности, пациент,страдающий сердечной недостаточностью (ассоциированной с тяжелой формой CAD илиDCM), считается успешно леченным, если после получения трансгена ангиогенного фактора в соответствии со способами настоящего изобретения в состоянии пациента отмечается наблюдаемое или измеряемое ослабление или отсутствие описанных выше симптомов. Ослабление этих показателей или симптомов может также ощущаться пациентом. Таким образом,показатели успешного лечения таких состояний сердечной недостаточности включают наблюдение или ощущение пациентом ослабления какого-либо из симптомов стенокардии, утомляемости, слабости, одышки, отеков ног, хрипов, частоты пульса или дыхания, отека или расширения яремной вены. У пациента может также наблюдаться повышенная толерантность к физической нагрузке, сердце уменьшенных размеров с улучшенной вентрикурярной и кардиальной функциями и, в общем, уменьшение числа посещений клиники, связанных с состоянием сердца. Предпочтительным является улучшение кардиальной функции, адекватное метаболическим потребностям пациента, при котором у пациента не обнаруживаются симптомы при легкой нагрузке или в состоянии покоя. Многие из этих показателей и симптомов легко заметны при простом наблюдении и/или измеряемы рутинными способами, известными врачу. Один из признаков улучшенной кардиальной функции - усилившийся кровоток в сердце, особенно в прежде ишемической области, - является также показателем успешного лечения. Как описано ниже, кровоток у пациента может быть измерен с помощью таллиевой визуализации (как описано Braunwald, in Heart(описанной в примерах 1 и 5, а также Sahn D.J.,Circulation, 58, 1072-1083, 1978). При использовании этих методов можно сопоставить кровоток до и после переноса ангиогенного гена. Как отмечено выше, улучшенная сердечная функция связана с ослаблением показателей и симптомов. Помимо эхокардиографии, фракцию лево 15 желудочкового (LV) выброса можно измерить с помощью ядерной (неинвазивной) техники, как это известно специалистам. Вентрикулярная (желудочковая) коррекция часто происходит после инфаркта миокарда и обычно характеризуется следующим образом. После заживления инфаркта миокарда продолжающаяся ишемия в пограничной области между заживленным инфарктом и нормальной тканью наряду с другими факторами приводит к расширению и/или коррекции оставшейся сердечной ткани, к состоянию, которое раньше определялось, как расширение инфаркта. Расширение (дилатация) всего сердца наблюдается примерно у 50% пациентов с такими инфарктами. Эта дилатация или коррекция вызывает дальнейшее ухудшение вентрикулярной функции. Коррекция обычно развивается в течение нескольких месяцев после инфаркта миокарда,хотя может проявиться и в ранние сроки, через 1-2 недели после инфаркта. Нежелательная левожелудочковая коррекция (или для краткости нежелательная коррекция) означает расширение полости после инфаркта миокарда, которое может прогрессировать с переходом в тяжелую форму сердечной недостаточности. Применяя способы лечения, описанные в данном изобретении, можно ожидать, что такая нежелательная коррекция может быть предотвращена или, по меньшей мере, существенно ослаблена. Даже если вентрикулярная коррекция уже началась, все же желательно индуцировать ангиогенез, поскольку создание микрососудистого ложа и усиление кровотока могут быть эффективными для компенсации вентрикулярной дисфункции. У пациента с инфарктом миокарда нежелательная вентрикулярная коррекция считается предотвращенной, если у него прекращается расширение полости, и симптомы сердечной недостаточности (описанные выше под термином сердечная недостаточность) не развиваются. Нежелательная вентрикулярная коррекция считается ослабленной, если наблюдается любое наблюдаемое или измеряемое снижение имеющихся симптомов сердечной недостаточности. Например, у пациента может уменьшиться одышка или улучшиться переносимость физической нагрузки. Способы оценки улучшения сердечной функции и ослабления симптомов во многом аналогичны способам, описанным выше дляDCM. Ожидается, что предотвращение или ослабление нежелательной вентрикулярной коррекции в результате улучшения коллатерального кровотока и вентрикулярной функции будет достигнуто в течение недель после переноса пациенту ангиогенного гена in vivo с применением способов, описанных в данном изобретении. Термин полинуклеотид относится к полимерной форме нуклеотидов любой длины,или рибонуклеотидов, или дезоксирибонуклео 005157 16 тидов, или их аналогов. Этот термин относится к первичной структуре молекулы и поэтому включает двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК. Он также включает модифицированные полинуклеотиды,такие, как метилированный и/или кэппированный полинуклеотид. Термин рекомбинантный в применении к полинуклеотиду означает, что полинуклеотид является продуктом различных комбинаций клонирования, рестрикции и/или лигирования, а также других процедур, которые приводят к конструкции, отличающейся от природного полинуклеотида. Термин ген или трансген относится к полинуклеотиду или части полинуклеотида,включающим последовательность, кодирующую белок. В большинстве случаев желательно,чтобы ген содержал также промотор, оперативно связанный с кодирующей последовательностью для того, чтобы эффективно промотировать транскрипцию. Энхансеры, репрессоры и другие регуляторные последовательности могут также быть включены для того, чтобы модулировать активность гена, как хорошо известно в этой области знаний (см., например, ссылки,приведенные ниже). Термины полипептид, пептид и белок взаимозаменяемы и относятся к аминокислотным полимерам любой длины. Эти термины включают также белки, которые являются посттрансляционно модифицированными посредством реакций, включающих гликозилирование,ацетилирование и фосфорилирование. Термин ангиогенный пептид или белок относится к любому белку или пептиду, который промотирует ангиогенез или ангиогенную активность, т.е. образование кровеносных сосудов. Кровеносные сосуды, которые образуются при ангиогенезе, включают капилляры, являющиеся самыми мелкими кровеносными сосудами с диаметром примерно 8 микрон, и сосуды большего размера с диаметром, по меньшей мере, примерно 10 микрон. Ангиогенная активность может быть определена по измерению кровотока, усилению миокардиальной функции или наличию кровеносных сосудов с применением методов, известных в этой области знаний или описанных в данном изобретении. Например, капиллярное число или плотность может быть количественно определена у животного с помощью микроскопии участка ткани (см. пример 5). Миокардиальный кровоток может быть определен с помощью метода радиоактивных микросфер, как описано Roth D.M., et al., Am. J.et al., Circulation, 82, 1778-1789, 1990. Миокардиальный кровоток может быть определен количественно, например, путем таллиевой визуализации, которая включает перфузию сердца радиоактивным таллием, как описано Braunwald, in Heart Disease, 4th ed., pp. 276-311 (Saun 17ders, Philadelphia, 1992). Клетки сердца имеют сродство к таллию. Поглощение таллия этими клетками позитивно коррелирует с кровотоком. Таким образом, пониженное поглощение таллия указывает на сниженный кровоток, как в условиях ишемии, при которой наблюдается перфузионный дефицит. В состоянии сознания индивидуальная ангиогенная активность может быть легко оценена контрастной эхокардиографией,как описано в примерах 1 и 5, а также Sahn D.J.et al., Circulation, 58, 1072-1083, 1978. Улучшенная миокардиальная функция может быть определена путем измерения утолщения стенки с помощью трансторакальной эхокардиографии. Ангиогенез является промотированным, если после получения ангиогенного трансгена в сердце пациента наблюдается измеряемое усиление ангиогенной активности по сравнению с показателями до обработки трансгеном. Ангиогенные пептиды включают пептидные предшественники, которые подверглись посттрансляционной модификации с образованием активных пептидов. Предпочтительно ангиогенный белок или пептид является членом семейства фактора роста фибробластов (FGF), включающим, но не ограниченным aFGF (известным также как FGF-1), bFGF (известным также какFGF-2), FGF-4, FGF-5 и FGF-6, членом семейства васкулярного эндотелиального фактора роста(VEGF), включающим, но не ограниченным членами семейства VEGF-A (такими, как VEGF121, VEGF-145, VEGF-165, VEGF-189 и VEGF206), членами семейства VEGF-B (такими, какVEGF-С; членом семейства фактора роста тромбоцитов (PDGF) (например, PDGF-A илиPDGF-B) или членом семейства инсулиноподобного фактора роста (IGF). Тем не менее возможно, что ген, кодирующий любой белок или пептид, который обладает ангиогенной активностью, измеряемой, например, описанными выше методами, является пригодным для применения в способах по данному изобретению. Ангиогенные пептиды или белки включают также производные и функциональные эквиваленты ангиогенных белков, таких как FGF, VEGF,PDGF и IGF. Производные такого ангиогенного белка или пептида являются пептидами, имеющими сходную аминокислотную последовательность, и до некоторой степени сохраняют одну или несколько активностей, присущих родственному ангиогенному белку или пептиду. Применяемые производные обычно имеют значительное сходство последовательности (на уровне аминокислот) в участках или доменах белка, имеющих отношение к ангиогенной активности. Сходство последовательности означает сходство, наблюдаемое между аминокислотными последовательностями у двух различных белков или пептидов, независимо от источника пептида. Как хорошо известно в этой области знаний, существует большое число 18 аминокислотных замен, по существу являющихся консервативными, в которых замещенная аминокислота довольна близка (например, по размеру и заряду) к исходной аминокислоте. Значительное сходство последовательности обычно предполагает по меньшей мере 30% идентичности последовательности (как правило,обычно измеряемой по протяженности из 10 или более аминокислот), предпочтительно 70%, более предпочтительно 90% и еще предпочтительнее 95% сходства последовательности с родственным ангиогенным белком или пептидом, или субъединицей. Как известно в этой области знаний, консервативные добавки или делеции обычно локализованы в участках или доменах белка, которые, по-видимому, не связаны с проявлением активности, в данном случае в участках, промотирующих ангиогенез. Термин функциональный эквивалент означает белок или пептид, обладающий активностью, которая может заменить одну или несколько активностей специфического ангиогенного белка или пептида. Предпочтительные функциональные эквиваленты сохраняют все виды активности специфического ангиогенного белка или пептида; однако функциональный эквивалент может иметь активность, которая при количественном определении сильнее или слабее активности пептида или белка дикого типа, измеренной при оценке ангиогенеза. Предпочтительные функциональные эквиваленты имеют активности,находящиеся в интервале от 1 до 10000% от активности родственного ангиогенного белка или пептида, или субъединицы, более предпочтительно между 10 и 1000%, еще предпочтительнее в интервале 50-200%. Как известно в этой области, для оценки вероятного воздействия таких вариаций существуют разнообразные методы, включая компьютерное моделирование; предполагаемые кандидаты могут быть легко скринированы на сохранение ангиогенного потенциала с применением анализа in vitro и invivo, как описано в данном изобретении. Термин гетерологичный относится к компоненту, который вводится или получается внутри объекта, отличающегося от того, в котором он находится в природе. Например, полинуклеотид, полученный от одного организма и введенный в другой организм с помощью методов генной инженерии, является гетерологичным полинуклеотидом, который при экспрессии может кодировать гетерологичный полипептид. Подобным образом промотор или энхансер,удаленный из нативной кодирующей последовательности и оперативно связанный с другой кодирующей последовательностью, является гетерологичным промотором или энхансером. Термин промотор, как он использован в данном изобретении, означает полинуклеотидную последовательность, контролирующую транскрипцию гена или кодирующую последовательность, с которой он оперативно связан. 19 Хорошо известно большое количество промоторов из различных источников, включая конститутивные, индуцируемые и репрессируемые промоторы, идентифицированных в базах данных, таких как ГенБанк, и доступных как таковые или в составе клонированных полинуклеотидных последовательностей [например, из депозитариев, таких, как АТСС (Американская коллекция культур тканей), а также из других коммерческих или индивидуальных источников]. Термин энхансер, как он использован в данном изобретении, относится к полинуклеотидным последовательностям, усиливающим транскрипцию гена или кодирующей последовательности, с которой он оперативно связан. Хорошо известно большое количество энхансеров из различных источников, идентифицированных в базах данных, таких как ГенБанк, и доступных как таковые или в составе клонированных полинуклеотидных последовательностей [например, из депозитариев, таких, как АТСС (Американская коллекция культур тканей), а также из других коммерческих или индивидуальных источников]. Многие полинуклеотиды, содержащие промоторные последовательности [такие, как часто используемый CMV(цитомегаловирусный) промотор], включают также энхансерные последовательности. Термин оперативно связанный относится к смежному расположению двух или нескольких компонентов, при котором описываемые этим термином компоненты находятся во взаимосвязи, позволяющей им функционировать в соответствии с их потенциальными возможностями. Промотор является оперативно связанным с геном или кодирующей последовательностью, если он контролирует транскрипцию гена или кодирующей последовательности. Несмотря на то, что оперативно связанный промотор обычно расположен против хода транскрипции кодирующей последовательности, он не обязательно соприкасается с ней. Энхансер является оперативно связанным с кодирующей последовательностью, если он усиливает транскрипцию кодирующей последовательности. Оперативно связанные энхансеры могут располагаться против хода транскрипции, внутри или по ходу транскрипции кодирующей последовательности. Последовательность полиаденилирования является оперативно связанной с кодирующей последовательностью, если она располагается в нижнем по ходу транскрипции конце кодирующей последовательности таким образом, что транскрипция проходит через кодирующую последовательность в последовательность полиаденилирования. Термин репликон относится к полинуклеотиду, содержащему источник репликации,который предусматривает репликацию полинуклеотида в соответствующей клетке-хозяине. Примеры включают репликоны клетки-мишени, 005157 20 в которую может быть интегрирована гетерологичная нуклеиновая кислота (например, ядерные и митохондриальные хромосомы), а также экстрахромосомальные репликоны (такие, как реплицирующиеся плазмиды и эписомы). Термины доставка гена, перенос гена и им подобные, как они использованы в данном изобретении, означают введение экзогенного полинуклеотида (иногда обозначаемого как трансген) в клетку-хозяина, независимо от способа введения. Такие способы включают разнообразные хорошо известные приемы, такие, как опосредованный вектором перенос гена(например,путем вирусной инфекции/трансфекции или с помощью различных других комплексов для доставки гена, основанных на белках и липидах), а также приемы, способствующие доставке раздетого полинуклеотида (такие, как электропорация, доставка генного ружья и другие разнообразные приемы,используемые для введения полинуклеотидов). Введенный полинуклеотид может стабильно или неустойчиво поддерживаться в клеткехозяине. Стабильное поддержание обычно требует, чтобы введенный полинуклеотид либо содержал источник репликации, совместимый с клеткой-хозяином, либо интегрировал в репликон клетки-хозяина, такой как экстрахромосомальный репликон (например, в плазмиду) или ядерная или митохондриальная хромосома. Известно множество векторов, способных служить медиаторами переноса генов в клетки млекопитающих, как известно в этой области знаний и описано в данном изобретении. Термины in vivo доставка гена, перенос гена, генная терапия и другие, как они использованы в данном изобретении, означают введение вектора, содержащего экзогенный полинуклеотид, непосредственно в тело организма, такого, как человек или другое млекопитающее,тем самым экзогенный полинуклеотид вводится в клетку такого организма in vivo. Термин вектор (иногда относящийся к доставке гена или носителю генного переноса) означает макромолекулу или комплекс молекул, содержащий полинуклеотид, который должен быть доставлен в клетку-хозяина либо invitro, либо in vivo. Полинуклеотид, который должен быть доставлен, может включать кодирующую последовательность, представляющую интерес для генной терапии. Векторы включают, например, вирусные векторы (на основе таких вирусов, как аденовирусы (Ad), аденоассоциированные вирусы (AAV) и ретровирусы),липосомы и другие липидсодержащие комплексы, а также другие макромолекулы, способные служить медиаторами доставки полинуклеотида в клетку-хозяина. Векторы могут включать также другие компоненты или носители функций,которые в дальнейшем модулируют доставку гена и/или экспрессию гена либо каким-либо иным способом обеспечивают полезные свойст 21 ва клеток-мишеней. Такие другие компоненты включают, например, компоненты, влияющие на связывание или нацеливание на клетки(включая компоненты, которые опосредуют связывание клеточного типа или тканеспецифичное связывание); компоненты, которые влияют на захват клеткой векторной нуклеиновой кислоты; компоненты, которые влияют на локализацию полинуклеотида внутри клетки после захвата (такие, как агенты, опосредующие локализацию в ядре); и компоненты, которые влияют на экспрессию полинуклеотида. Такие компоненты включают также маркеры, такие,как детектируемые и/или селектируемые маркеры, которые могут применяться для детекции или селекции клеток, подобранных для экспрессии нуклеиновой кислоты, доставляемой вектором. Такие компоненты могут обеспечиваться природным свойством вектора (как при использовании вирусного вектора, у которого есть компоненты или функции, опосредующие связывание и захват) или векторы могут быть модифицированы для обеспечения таких функций. В этой области знаний известно большое количество таких векторов, и они доступны (см.,например различные ссылки, приведенные в данном изобретении). Термин рекомбинантный вирусный вектор относится к вирусному вектору, содержащему один или несколько гетерологичных генов или последовательностей. Поскольку многие вирусные векторы имеют ограничения по размеру, связанные с упаковкой, гетерологичные гены или последовательности обычно вводят путем замены одной или нескольких частей вирусного генома. Такие вирусы могут стать дефектными по репликации, нуждаясь в том, чтобы удаленная(ые) функция(ии) были обеспечены in trans в ходе вирусной репликации и инкапсуляции (путем использования,например, вируса-помощника или упаковывающей клеточной линии, несущей гены, необходимые для репликации и/или инкапсуляции)(см., например, ссылки и иллюстрации, приведенные ниже). Описаны также модифицированные вирусные векторы для доставки полинуклеотида, который переносится на внешней стороне вирусной частицы (см., например, CurielD.T. et al., PNAS, 88, 8850-8854, 1991). Термин вирусная упаковка, как он использован в данном изобретении, относится к серии внутриклеточных событий, которые приводят к синтезу и сборке вирусного вектора. Упаковка обычно включает репликацию провирусного генома или рекомбинантного провектора, обычно обозначаемого как векторная плазмида (являющаяся рекомбинантным полинуклеотидом, который может быть упакован по типу вирусного генома и обычно в итоге фланкирован соответствующими вирусными упаковывающими последовательностями), и сопровождается инкапсуляцией или покрытием нуклеиновой кислоты другой внешней оболочкой. 22 Таким образом, когда подходящая векторная плазмида вводится в соответствующих условиях в упаковывающую клеточную линию, она может реплицироваться и собираться в вирусную частицу. Вирусные гены rep и cap, найденные во многих вирусных геномах, являются генами,кодирующими белки репликации и инкапсулирования, соответственно. Термин дефектный по репликации или некомпетентный по репликации вирусный вектор относится к вирусному вектору, в котором одна или несколько функций, необходимых для репликации и/или упаковки, отсутствуют или изменены, вызывая неспособность вирусного вектора к инициации вирусной репликации после захвата его клеткой-хозяином. Для получения источников таких дефектных по репликации вирусных векторов вирус или провирусная нуклеиновая кислота могут вводиться в упаковывающую клеточную линию, которая была модифицирована таким образом, что содержит гены, кодирующие отсутствующие функции, которые могут быть добавлены in trans. Например, такие упаковывающие гены могут быть стабильно интегрированы в репликон упаковывающей клеточной линии или они могут быть введены путем трансфекции с упаковывающей плазмидой либо с вирусомпомощником, несущим гены, кодирующие отсутствующие функции. Термин детектируемый маркерный ген означает ген, который позволяет клеткам, несущим ген, быть специфически детектированными(например, отличаться от клеток, которые не несут маркерный ген). В этой области знаний известно множество таких маркерных генов. Предпочтительные примеры таких генов включают детектируемый маркерный ген, который кодирует белки, появляющиеся на поверхности клеток, облегчая тем самым упрощенное и быстрое определение и/или сортировку клеток. В качестве иллюстрации ген lacZ, кодирующий галактозидазу, может использоваться в качестве детектируемого маркера, делая возможным обнаружение клеток, трансдуцированных с помощью вектора, несущего ген lacZ, путем контрастирования, как описано ниже. Термин селектируемый маркерный ген означает ген, позволяющий клеткам, несущим ген, быть специфически отобранными за или против в присутствии соответствующего селективного агента. Для иллюстрации ген устойчивости к антибиотику может быть использован в качестве положительного селектируемого маркерного гена, делающего возможным для клетки-хозяина положительный отбор в присутствии соответствующего антибиотика. Селектируемые маркеры могут быть положительными, отрицательными или бифункциональными. Положительные селектируемые маркеры делают возможной селекцию клеток, несущих маркер, тогда как отрицательные селектируемые маркеры делают возможной селективную элиминацию 23 клеток, несущих маркер. Описано множество таких маркерных генов, включая бифункциональные (т.е., положительные/отрицательные) маркеры (см., например, международный патент 92/08796, опубликованный 29 мая 1992 года, и международный патент 94/28143, опубликованный 8 декабря 1994 года), включенные, таким образом, в данное изобретение в виде ссылок. Такие маркерные гены могут обеспечить дополнительный показатель контроля, который может иметь преимущество в контексте генной терапии. Термины сосудистая сеть и васкулярный (сосудистый) относятся к системе сосудов,разносящих кровь (а также лимфатическую жидкость) по всему организму млекопитающего. Термин кровеносный сосуд относится к любому из сосудов сосудистой системы млекопитающих, включая артерии, артериолы, капилляры, венулы, вены, синусы и сосуды сосудов. В предпочтительных аспектах настоящего изобретения векторы, включающие ангиогенные трансгены, вводятся непосредственно в васкулярные каналы, снабжающие кровью миокард. Такие васкулярные каналы включают коронарные артерии, а также такие сосуды, как подкожная вена ноги или трансплантаты внутренней артерии молочной железы. Термин артерия относится к кровеносному сосуду, по которому кровь уходит из сердца. Коронарные артерии снабжают кровью ткани сердца, в то время как другие артерии снабжают остальные органы тела. Обычная структура артерии представляет собой просвет,окруженный многослойной артериальной стенкой. Термин индивидуум или пациент относится к млекопитающему, предпочтительно к крупному млекопитающему, наиболее предпочтительно к человеку. Термин лечение или терапия, как он использован в данном изобретении, означает введение отдельному пациенту агентов, которые способны оказать на него профилактическое,лечебное или другое полезное воздействие. Термин генная терапия, как он использован в данном изобретении, означает введение отдельному пациенту векторов, содержащих лечебный ген. Термин лечебный полинуклеотид или лечебный ген относится к нуклеотидной последовательности, которая при переносе индивидууму способна оказать профилактическое,лечебное или другое полезное воздействие на индивидуума. Ссылки В практике настоящего изобретения, если не отмечено иначе, будут использованы обычные методы молекулярной биологии и им подобные, известные в данной области знаний. 24 Такие методы подробно освещены в литературе. См., например, Molecular Cloning: A(R. Freshney ed., IRL Press, 1987). Дополнительные ссылки, описывающие доставку и материальное обеспечение хирургических методов, которые могут быть использованы по настоящему изобретению, включают следующие: Topol E.J. (ed.), The Textbook ofEd. (W.B. Saunders Co., 1991). Дополнительные ссылки, описывающие типы клеток в кровеносных сосудах и в кровеносной системе, которые могут применяться в способах по настоящему изобретению, включают: W. BloomD. Fawcett, A Textbook of Histology (W.B. Saunders Co.,1975). В различных публикациях постулировано применение переноса гена для предотвращения заболеваний, включая заболевания сердца. См.,например, Methods in Virology, Vol. 7: GeneMedical Sciences, 306, 129-136, 1993; Schneider,Circulation, 88, 1937-1942, 1993. Ссылки, упомянутые в приведенных выше разделах, тем самым включают в описание изобретения сведения в той степени, в которой они обучают методам, применяемым в практике настоящего изобретения. Включение в описание изобретения сведений путем цитирования Ссылки, цитированные в данной заявке на изобретение, включая патенты, опубликованные заявки и другие публикации, тем самым включают сведения в описание изобретения. Различные предпочтительные аспекты по настоящему изобретению суммированы ниже и далее изложены и проиллюстрированы в последующем подробном описании и на рисунках. Настоящее изобретение относится к способам и составам для лечения застойной сердечной недостаточности, включая дилатационную кардиомиопатию (DCM), а также тяжелую сердечную недостаточность, ассоциированную с поражением коронарной артерии (CAD) и инфарктом миокарда, и для предотвращения или облегчения нежелательной вентрикулярной коррекции путем введения трансгенов, кодирующих ангиогенные белки, в миокард пациента. По настоящему способу лечения застойной сердечной недостаточности векторная конструкция, содержащая ген, кодирующий ангиогенный белок или пептид, направляется в сердце пациента, где синтез экзогенного ангиогенного белка в миокарде промотирует ангиогенез,ослабляя таким образом сердечную дисфункцию путем улучшения кровотока через вновь образовавшиеся кровеносные сосуды. В конечном итоге улучшенная сердечная функция приводит к ослаблению или исчезновению симптомов сердечной недостаточности и увеличению продолжительности жизни по истечении двухлетнего периода предполагаемой смертности при развитии тяжелой CHF. Предпочтительные способы используют векторные конструкции и/или способы доставки, приводящие к локализованной экспрессии ангиогенного белка, который соответственно ограничен миокардом пациента. Примеры ангиогенных белков включают членов семействаFGF-5); членов семейства васкулярного эндотелиального фактора роста (VEGF), включая, но не ограничиваясь членами семейства VEGF-AVEGF-B (такими, как VEGF-167 и VEGF-186) и членами семейства VEGF-C; семейство факторов роста тромбоцитов (PDGF) и членов семейства инсулиноподобного фактора роста (IGF). Предпочтительные векторы по настоящему изобретению включают вирусные векторы,векторы на основе липидов и другие векторы, 005157 26 способные доставлять ДНК в неделящиеся клетки in vivo. В настоящее время предпочтительными являются вирусные векторы, особенно дефектные по репликации вирусные векторы(включающие, например, дефектные по репликации аденовирусные (Ad) векторы и аденоассоциированные вирусные (AAV) векторы. С точки зрения легкости получения и применения по настоящему изобретению наиболее предпочтительными являются дефектные по репликации аденовирусные векторы. В настоящее время предпочтительным средством доставки in vivo (особенно для векторных конструкций, которые не могут быть подругому нацелены на мишень для доставки и/или экспрессии, ограниченной миокардом) является доставка путем инъекции вектора в кровеносный сосуд, снабжающий непосредственно миокард, предпочтительно путем инъекции в коронарную артерию. Такая инъекция осуществляется предпочтительно с использованием катетера, введенного на значительную глубину (обычно, по меньшей мере, примерно на 1 см) в просвет одной или обеих коронарных артерий или одной или нескольких подкожных вен ноги или в трансплантаты внутренней артерии молочной железы, или в другие каналы,доставляющие кровь в миокард. Инъекции, при которых катетер не вводится достаточно глубоко в коронарную артерию, могут привести к системному артериальному распространению вируса. При инъекции вирусной векторной биомассы, предпочтительно не содержащей вирус дикого типа, глубоко в просвет одной или обеих коронарных артерий (или трансплантатов и других васкулярных каналов), предпочтительно как в правую, так и в левую коронарную артерию(или трансплантаты и другие васкулярные каналы) и предпочтительно в количестве 106-1014 вирусных частиц, что определяется с помощью оптической денситометрии (более предпочтительно 108-1012 вирусных частиц), возможно ввести местно желаемое число клеток, главным образом, кардиомиоцитов с генами, которые кодируют белки, промотирующие ангиогенез, в поврежденный миокард, максимизируя тем самым терапевтическую эффективность переноса гена и минимизируя нежелательные эффекты в экстракардиальных участках и возможность воспалительной реакции на вирусные белки. Векторные конструкции, которые специфически нацелены на миокард, такие, как векторы,включающие компоненты, специфически связываемые или поглощаемые миокардом, и/или которые включают трансгены ангиогенного белка, находящиеся под контролем специфичных к миокарду транскрипционных регуляторных последовательностей (например, промоторов специфичных к вентрикулярным миоцитам),могут использоваться вместо или предпочтительно в сочетании с такими методами направ 27 ленной инъекции, как способ дальнейшего ограничения экспрессии в миокарде, особенно в вентрикулярных миоцитах. Векторы, которые могут вызывать иммунный ответ, предпочтительно вводить путем инъекции непосредственно в кровеносный сосуд, снабжающий кровью миокард, как описано выше, хотя могут также использоваться дополнительные методы ограничения потенциала экстракардиальной экспрессии. Терапия ангиогенным геном при CHF может быть назначена пациенту в любое время, но более предпочтительно в период от 1 до 4 недель после выявления инфаркта миокарда. Введение проводят предпочтительно путем однократной (один раз) интракоронарной инъекции(например, в каждую коронарную артерию),хотя в некоторых случаях необходимо провести несколько инъекций. Как подробно описано ниже, мы показали,что применение таких способов с использованием векторов, несущих трансгены ангиогенных белков, может эффективно промотировать развитие коронарных коллатеральных сосудов и усиливать функцию миокарда сердца у крупных млекопитающих без какого-либо наблюдаемого воздействия на не кардиальные ткани и без генерирования воспалительной реакции. Не отмечено никаких клеточных инфильтратов, клеточного некроза или повышенного фиброза. Через две недели после переноса ангиогенного гена улучшался миокардиальный кровоток и ослаблялась ишемия, усиливая тем самым миокардиальную функцию. Эти положительные эффекты сохранялись в течение по меньшей мере 12 недель. В качестве иллюстрации мы применили однократную интракоронарную инъекцию(примерно 1011 векторных частиц), которая, по нашему наблюдению, обеспечила адекватную экспрессию ангиогенного белка с получением терапевтического преимущества и без проявления токсичности. В соответствии с усилением миокардиального кровотока наш анализ показал, что при использовании этой процедуры достижим высокий выход более 60% трансдукции миокардиальных клеток in vivo. Опосредованный аденовирусом перенос гена обычно не приводит к стабильному включению трансгена в хозяйский геном и вследствие этого трансгенная экспрессия имеет относительно неустойчивый характер (хотя показано,что векторы присутствуют в течение периода до 5 месяцев). Однако при данных способах лечения вышеупомянутых сердечных состояний временная экспрессия ангиогенного трансгена обычно адекватна достижению терапевтической цели. В действительности, для данных целей временная экспрессия обычно желательнее, чем стабильная интеграция, с точки зрения перспективы безопасности, поскольку позволяет избежать разрушения хозяйского генома. Как демонстрируют приведенные ниже примеры экс 005157 28 периментов, трансгенная экспрессия поддерживалась достаточно долго для того, чтобы вызвать развитие коллатеральных сосудов и сопутствующее ему восстановление нормальной сердечной функции. Таким образом, для проявления терапевтического эффекта ген ангиогенного фактора не должен присутствовать в трансфицированной клетке в течение более чем несколько недель. Как только новые кровеносные сосуды образовались, поддержание новой сосудистой структуры и улучшенного кровотока уже не требуют продолжительной экспрессии экзогенного ангиогенного белка. Таким образом, способы доставки ангиогенного трансгена по настоящему изобретению эффективно преодолевают необходимость многократных инъекций или инфузий ангиогенных белков. Локализованная трансдукция и трансгенная экспрессия, достигнутые с помощью данных методов лечения, позволяют также избежать возможных опасных эффектов ангиогенеза в не кардиальных тканях, таких как ретина. Другой аспект по настоящему изобретению составляет способ предотвращения или ослабления вентрикулярной коррекции у пациентов после инфаркта, способ, включающий направленные в сердце пациента in vivo доставку векторной конструкции, содержащей ген,кодирующий ангиогенный белок или пептид, с целью промотирования ангиогенеза. Улучшение сосудистой системы и кровотока, достигнутое при использовании способов по настоящему изобретению, вызовет тенденцию к снижению ишемии и вследствие этого ослабит прогрессирование нежелательной вентрикулярной коррекции. Для того, чтобы улучшить эти болезненные состояния, предпочтительно проводить лечение пациентов вскоре после выявления инфаркта, предпочтительно в течение одного месяца после инфаркта и еще более предпочтительно в течение от одной до трех недель после инфаркта. Настоящее изобретение может также применяться в профилактических целях у пациентов с возможным возникновением таких инфарктов. Методы и составы векторов для воздействия на направленный перенос гена в сердце пациента с целью предотвращения или ослабления вентрикулярной коррекции по существу являются такими, как при лечении DCN. Животные модели Необходимыми предварительными условиями успешных исследований по генной терапии являются а) создание животной модели,применимой для изучения клинической застойной сердечной недостаточности, которая способна обеспечить получение полезных данных,касающихся механизма ангиогенеза в условияхCHF, и б) точная оценка эффектов генного переноса. По данному изобретению этим предварительным условиям удовлетворяют свиные модели. Свинья благодаря сходству ее физиологии с человеческой является особенно подходя 29 щей моделью для изучения болезней сердца человека. Сердце свиньи близко напоминает человеческое сердце по следующим параметрам. Во-первых, природа коронарного кровообращения свиньи очень похожа на человеческую,включая отсутствие нативных коронарных коллатеральных сосудов. Во-вторых, размер сердца свиньи, выраженный в процентах от общего веса тела, подобен размеру человеческого сердца. Кроме того, свинья является крупной животной моделью, вследствие этого возможно более точное экстраполирование различных параметров, таких как эффективные дозы вектора, токсичность и т.д. В отличие от свиного сердца таких животных, как собаки и члены семейства мышиных, имеют много эндогенных коллатеральных сосудов. Что касается веса тела,то размер сердца собаки в два раза больше человеческого. Две свиных модели были использованы по настоящему изобретению. Первая модель, описанная в примере 1, имитирует клиническую застойную сердечную недостаточность. На этой модели продолжительная учащенная стимуляция в течение периода от 3 до 4 недель индуцирует сердечную недостаточность, которая по многим показателям напоминает клиническую сердечную недостаточность (включая DCM, а также сердечную недостаточность, ассоциированную с тяжелым поражением коронарной артерии). Такая стимуляция приводит к левожелудочковой дилатации с нарушением систолической функции, аналогичным регионарным функциональным аномалиям, выявляемым при сердечной недостаточности (включая аномалии,связанные с тяжелым поражением коронарной артерии (CAD), или DCM). Таким образом, эта модель может быть использована для того, чтобы определить, является ли доставка векторной конструкции, кодирующей ангиогенный пептид или белок, эффективной в ослаблении кардиальных дисфункций, связанных с этими состояниями. Эта модель особенно полезна тем, что позволяет получить некоторые параметры для оценки эффективности генной терапии in vivo при лечении застойной сердечной недостаточности и вентрикулярной коррекции. Вторая модель, модель миокардиальной ишемии, описана в данном изобретении в примере 5. С использованием этой модели было продемонстрировано, что опосредованная аденовирусом доставка гена, кодирующего ангиогенный белок, ослабляла миокардиальную ишемию путем стимуляции развития коллатеральных сосудов и усиления кровотока в ишемической области. В качестве иллюстрации мы успешно продемонстрировали эти способы переноса гена с тремя различными ангиогенными белками, включая как нативные формы, так и мутеины (как подробно описано ниже в примерах). 30 На второй модели установка амероидного констриктора вокруг левой огибающей (LCx) артерии приводит к ее постепенному полному закрытию (в течение 7 дней после установки) с минимальным инфарктом (1% левого желудочка, 41% LCx ложа) (Roth et al., Circulation, 82,1178, 1990; Roth et al., Am. J. Physiol., 235,H1279, 1987; White et al., Circ. Res., 71, 1490,1992; Hammond et al., Cardiol., 23, 475, 1994;Hammond et al., J. Clin. Invest., 92, 2644, 1993). Миокардиальная функция и кровоток являются нормальными в состоянии покоя в области, ранее перфузированной с помощью закупоренной артерии (обозначается как ишемическая область), благодаря ограниченному развитию эндогенных коллатеральных сосудов, но при увеличении потребности миокарда в кислороде резерв кровотока становится недостаточным для того, чтобы предотвратить ишемию. Таким образом LCx ложе является объектом эпизодической ишемии, аналогичной клинической стенокардии. Развитие коллатеральных сосудов и зависимость кровоток-функция являются стабильными в течение 21 дня нахождения амероидного констриктора и остаются не измененными в течение 4 месяцев (Roth et al., Circulation,82, 1778, 1990; Roth et al., Am. J. Physiol., 235,H1279, 1987; White et al., Circ. Res., 71, 1490,1992). Подтверждено с помощью телеметрии,что у животных в течение дня наблюдается период ишемической дисфункции в сосудистом ложе с повышенным риском, что связано с резким усилением сердечных сокращений во время приема пищи, вмешательства персонала и т.д. Таким образом, модель имеет сосудистое ложе со стабильными, но не адекватными коллатеральными сосудами и подвергается периодическим инфарктам. Другим отличительным преимуществом модели является нормально перфузированная и функционирующая область (LAD ложе), смежная с аномально перфузированной и функционирующей областью (LCx ложе), тем самым обеспечивается контрольное сосудистое ложе внутри каждого животного. Миокардиальная контрастная эхокардиография была использована для оценки регионарной миокардиальной перфузии. Контрастный материал состоит из микроагрегатов галактозы и усиливает эхогенность (белизну) изображения. Микроагрегаты распределяются в коронарных артериях и миокардиальных стенках пропорционально кровотоку (Skyba et al.,Circulation, 90, 1513-1521, 1994). Было показано,что при измерении с помощью микросфер максимальная интенсивность контраста тесно связана с миокардиальным кровотоком (Skyba etal., Circulation, 90, 1513-1521, 1994). Для того,чтобы подтвердить, что эхографические изображения, используемые по настоящему изобретению, точно идентифицировали LCx ложе и что миокардиальная контрастная эхокардиография могла быть применена для оценки миокар 31 диального кровотока, вокруг проксимальногоLCx ложа, смежного с амероидом, был установлен гидравлический манжетный обтуратор. В данном исследовании после забоя животных их сердца фиксировали путем перфузии(глутаровый альдегид, физиологическое давление, in situ) для того, чтобы количественно оценить рост капилляров с помощью микроскопии. Использовали PCR для определения ангиогенного белка, ДНК и мРНК в миокарде животных,которые подверглись переносу гена. Как описано ниже, через две недели после переноса гена в образцах миокарда от всех пяти lacZтрансдуцированных животных при микроскопическом исследовании была обнаружена существенная -галактозидазная активность. В заключение с использованием поликлонального антитела к ангиогенному белку была продемонстрирована экспрессия ангиогенного белка в клетках и миокарде всех животных, подвергшихся переносу гена. Стратегия терапевтических исследований включала определение времени доставки трансгена, пути введения трансгена и выбор ангиогенного гена. В амероидной модели миокардиальной ишемии перенос гена осуществляли после стабильного, но недостаточного развития коллатеральных сосудов. Предшествующие исследования использовали амероидную модель с доставкой ангиогенных пептидов в процессе закрытия амероида, перед развитием ишемии и коллатеральных сосудов. Однако эта стратегия не использовалась нами по нескольким причинам. Во-первых, предшествующие исследования были непригодны для строгого воспроизведения условий, которые были бы необходимы при лечении миокардиальной ишемии и при которых перенос гена осуществлялся бы в состоянии продолжающейся миокардиальной ишемии; предшествующие исследования являются сходными по обеспечению пептидом при проявлении признаков ишемии и поэтому менее актуальными. Во-вторых, на основании предыдущих исследований в культуре клеток предполагалось, что ишемические раздражители в сочетании с ангиогенным пептидом составили бы оптимальную среду для стимуляции ангиогенеза. Ангиогенез мог быть оптимально достижим путем доставки трансгена в то время, когда начало сердечной недостаточности (ассоциированной с DCM или тяжелым поражением коронарной артерии) или вентрикулярной коррекции уже проявляется. Эти заключения послужили основанием для выбора метода доставки трансгена. Свиная модель обеспечила превосходное средство слежения за регионарным кровотоком и функцией до и после доставки гена. Использование контрольных животных, получавших ту же самую рекомбинантную аденовирусную конструкцию, но с репортерным геном, обеспечило контроль для этих исследований. Основываясь 32 на упомянутых выше и предшествующих опубликованных результатах, специалисты в этой области знаний признают, что результаты, описанные ниже и полученные на свиньях, являются, как ожидается, прогностическими для человека. Трансгены, кодирующие ангиогенные белки и пептиды Один или несколько трансгенов, кодирующих ангиогенный белковый или пептидный фактор, который способен промотировать ангиогенную активность, могут быть использованы по настоящему изобретению. Любой белок или пептид, обладающий ангиогенной активностью (определенной выше), измеряемой с помощью методов, описанных в данном изобретении и известных в этой области знания, может быть потенциально использован в связи с настоящим изобретением. Подходящие ангиогенные белки или пептиды подтверждаются примерами членов семейства фактора роста фибробластов (FGF), васкулярного эндотелиального фактора роста (VEGF), фактора роста тромбоцитов (PDGF), инсулиноподобного фактора роста (IGF) и других. Члены семейства FGF включают, но не ограничиваются aFGF (FGF-1),bFGF (FGF-2), FGF-4 (известного также, какVEGF экспрессируется кардиомиоцитами в ответ на ишемию in vitro и in vivo; он является регулятором ангиогенеза при физиологических условиях, а также при адаптивном ответе на патологические состояния (Banai et al., Circulation, 89, 2183-2189, 1994). Семейство VEGF включает, но не ограничивается членами подсемейства VEGF-A (например, VEGF-121, VEGF145, VEGF-165, VEGF-189 и VEGF-206), а также члены подсемейства VEGF-B (например, VEGF167 и VEGF-186) и подсемейства VEGF-C.PDGF включает PDGF А и PDGF В. Нуклеотидные последовательности генов, кодирующих эти белки, и соответствующие аминокислотные последовательности известны в этой области знаний (для этих и других последовательностей см., например, базу данных последовательностей GenBank). Для семейства FGF см., например, Burgess, Ann. N.Y. Acad. Sci., 638, 89-97,1991; Burgess et al., Ann. Rev. Biochem., 58, 575606, 1989; Muhlhauser et al., Hum. Gene Therapy,6, 1457-1465, 1995; Zhan et al., Mol. Cell Biol., 8,3487, 1988; Seddon et al., Ann. N.Y. Acad. Ci.,638, 98-108, 1991. Для человеческого hst/KS3Chem., 206, 11947-11954, 1991 и цитированные там ссылки; Muhlhauser et al., Cir. Res., 77, 10771086, 1995. Информация о таких генах и кодируемых полипептидах легко доступна в базе данных последовательностей, такой, какGenBank или EMBL. Полинуклеотиды, кодирующие эти белки, могут также быть получены 33 из библиотек генов, например, с использованием PCR или методов гибридизации, являющихся рутинными для этой области знаний. Для успешной реализации подхода, основанного на переносе гена, необходимы как синтез генного продукта, так и секреция из трансфицированной клетки. С этой точки зрения ген,кодирующий FGF-4, FGF-5 или FGF-6, является предпочтительным, поскольку эти белки содержат функциональные секреторные сигнальные последовательности и легко секретируются из клеток. Многие, если не большинство белковVEGF (включая, но не ограничиваясь VEGF-121 и VEGF-165), также легко секретируются и после секреции способны к диффузии. Таким образом, при экспрессии эти ангиогенные белки могут легко доходить до кардиальной интерстициальной ткани и индуцировать ангиогенез. С другими ангиогенными белками, такими,как aFGF (GFG-1) и bFGF (FGF-2), которые лишены нативной секреторной сигнальной последовательности, гибридные белки, имеющие секреторные сигнальные последовательности, могут быть получены рекомбинантно с использованием стандартной методологии рекомбинантной ДНК, известной специалисту в этой области. Считается, что как aFGF, так и bFGF являются до некоторой степени естественно секретируемыми; однако включение дополнительной секреторной сигнальной последовательности можно использовать для усиления секреции белка. Секреторная сигнальная последовательность, как правило, располагается на N-конце целевого белка, но может быть расположена в любом положении, при котором возможна секреция ангиогенного фактора. Например, полинуклеотид, содержащий подходящую сигнальную последовательность, может быть присоединен к 5'-концу первого колена выбранного гена ангиогенного белка. Подходящие сигнальные последовательности включают таковые для генов FGF-4, FGF-5, FGF-6 или сигнальные последовательности различных секретируемых белков, таких как IL-1. Ниже в примере 7 проиллюстрирован один из типов модификации ангиогенного белка, осуществленной путем замены участков ангиогенного белка аминокислотными последовательностями, направляющими секрецию второго секретируемого белка. Может быть использована сигнальная последовательность, полученная от белка, который в норме секретируется из кардиомиоцитов. Для лечения человека предпочтительными являются гены, кодирующие человеческие ангиогенные белки, хотя могут использоваться также ангиогенные белки из других млекопитающих источников, обладающие перекрестной активностью, т.е., имеющие ангиогенную активность у человека. Векторы для доставки генов in vivo В общем, ген, представляющий интерес,переносится в сердце, включая миоциты, in vivo 34 и направляет продукцию кодированного белка. Предпочтительно такая продукция является основной (хотя могут использоваться и индуцируемые экспрессионные системы). Векторы, применяемые по настоящему изобретению, включают вирусные векторы, липидные векторы (например, липосомы) и другие векторы, способные доставить ДНК в неделящиеся клетки in vivo. В настоящее время предпочтительными являются вирусные векторы,особенно дефектные по репликации вирусные векторы, включающие, например, дефектные по репликации аденовирусные и аденоассоциированные вирусные (AAV) векторы. С точки зрения легкости получения и применения по настоящему изобретению дефектные по репликации аденовирусные векторы в настоящее время являются наиболее предпочтительными. В противоположность ретровирусу, для экспрессии гена аденовирусу не требуется репликация в хозяйской клетке, потому что интеграция не является компонентом его жизненного цикла. Аденовирус эффективно инфицирует неделящиеся клетки и поэтому применим для экспрессии рекомбинантных генов миокарда вследствие нерепликативной природы кардиомиоцитов. Многие другие векторы, пригодные для генной терапии in vivo, могут быть легко применены для доставки трансгенов ангиогенных белков при использовании по настоящему изобретению. Такие векторы включают другие вирусные векторы (такие, как AAV), невирусные белковые платформы для доставки, а также липидные векторы. Ссылки на работы, описывающие эти и другие векторы для доставки генов, хорошо известны в этой области знаний,некоторые из них цитируются в данном изобретении. Как описано выше и в цитированных ссылках, векторы могут также содержать другие компоненты или носители функций, которые в последующем модулируют доставку гена и/или генную экспрессию либо каким-нибудь другим образом обеспечивают полезные свойства клеток-мишеней. Такие другие компоненты включают, например, компоненты, влияющие на связывание или нацеливание на клетки (включая компоненты, которые являются медиаторами клеточного или тканеспецифичного связывания); компоненты, которые влияют на захват клеткой векторной нуклеиновой кислоты; компоненты, которые влияют на локализацию полинуклеотида внутри клетки после захвата(такие, как агенты, опосредующие ядерную локализацию); и компоненты, которые влияют на экспрессию полинуклеотида. Такие компоненты могут также включать маркеры, такие, как детектируемые и/или селектируемые маркеры,которые могут применяться для детекции или селекции клеток, подобранных для экспрессии нуклеиновой кислоты, доставляемой вектором. Такие компоненты могут обеспечиваться при 35 родным свойством вектора (как при использовании вирусного вектора, у которого есть компоненты или функции, опосредующие связывание и захват) или векторы могут быть модифицированы для обеспечения таких функций. Селектируемые маркеры могут быть положительными, отрицательными или бифункциональными. Положительные селектируемые маркеры делают возможной селекцию клеток, несущих маркер, тогда как отрицательные селектируемые маркеры делают возможной селективную элиминацию клеток, несущих маркер. Описано множество таких маркерных генов, включая бифункциональные (т.е., положительные/отрицательные) маркеры (см., например, международный патент 92/08796, опубликованный 29 мая 1992 года, и международный патент 94/28143, опубликованный 8 декабря 1994 года),маркеры, включенные таким образом в данное изобретение в виде ссылок. Такие маркерные гены могут обеспечить дополнительный показатель контроля, который может иметь преимущество в контексте генной терапии. Большое разнообразие таких векторов известно в этой области знаний и обычно они являются доступными (см., например, различные ссылки, цитированные выше). Ссылки на работы, описывающие аденовирусные векторы и другие вирусные векторы,которые могли бы применяться по способам настоящего изобретения, включают следующие:(12 October 1995). Разнообразные аденовирусные плазмиды также доступны от коммерческих источников, включая, например, Microbix Biosystems of Toronto, Ontario (см., например, Microbix Product Information Sheet: Plasmids forAAV векторы, которые могли бы применяться по способам настоящего изобретения, включают следующие: Carter В., Handbook of Parvoviruses,Vol. 1, pp. 169-228, 1990; Berns, Virology, pp. 1743-1764 (Raven Press, 1990); Carter В., Curr.Therapy, 3, 254-261, 1996. Ссылки на работы, описывающие невирусные векторы, которые могли бы применяться по способам настоящего изобретения, включают следующие: Ledley F.D., Human Gene Therapy, 6,1129-1144, 1995; Miller N., et al., FASEB Journal,9, 190-199, 1995; Chonn A., et al., Curr. Opin. In(25 January 1996). Примеры аденовирусных векторов, являющихся независимыми от вируса-помощника и дефектными по репликации у человека В общем, ген, представляющий интерес,переносится в сердце, включая кардиомиоциты,in vivo и направляет продукцию кодированного белка. Несколько различных подходов к переносу гена являются выполнимыми. В настоящее время предпочтительной является независимая от вируса-помощника дефицитная по репликации система, основанная на аденовирусе 5. Используя эту систему, мы продемонстрировали трансфекцию более чем 60% миокардиальных клеток in vivo путем однократной интракоронарной инъекции (Giordano, Hammond, Clim.Res., 42, 123A, 1994). Нерепликативные рекомбинантные аденовирусные векторы являются особенно полезными при трансфицировании коронарного эндотелия и кардиомиоцитов, приводя к высокоэффективной трансфекции после интракоронарной инъекции. Как показано в данном изобретении, независимая от вируса-помощника дефектная по репликации система, основанная на аденовирусе 5, может быть эффективно использована для трансфекции большого процента миокардиальных клеток in vivo путем однократной интракоронарной инъекции. Мы также показали, что такой метод доставки может быть использован для эффективного нацеливания векторов на 37 миокард сердца крупного млекопитающего. Дополнительные средства нацеливания векторов на специальные клетки или типы тканей описаны ниже и известны в этой области знаний. В различных иллюстративных примерах,описанных ниже, использованы рекомбинантные аденовирусные векторы, основанные на человеческом аденовирусе 5 (как описаноMcGrory W.J., et al., Virology, 163, 614-617,1988), которые лишены необходимых ранних генов аденовирусного генома(обычно Е 1 А/Е 1 В) и поэтому неспособны реплицировать в том случае, если не растут в пермессивных клеточных линиях, которые обеспечивают отсутствующий генный продукт in trans. Вместо утраты аденовирусных геномных последовательностей трансген, представляющий интерес,может быть клонирован и экспрессирован в тканях/клетках, инфицированных дефектным по репликации аденовирусом. Несмотря на то, что перенос основанного на аденовирусе гена не всегда приводит к стабильной интеграции трансгена в хозяйский геном (менее чем 0,1% опосредованных аденовирусом трансфекций приводят к включению трансгена в хозяйскую ДНК), аденовирусные векторы могут размножаться с высоким титром и трансфицировать нереплицирующие клетки; и, хотя трансген не проходит в дочерние клетки, он пригоден для переноса гена в зрелые кардиомиоциты, которые делятся не так активно. Ретровирусные векторы обеспечивают стабильный перенос гена, и в настоящее время высокие титры получают путем ретровирусного псевдотипирования(Burns et al., Proc. Natl. Acad. Sci. (USA), 90,8033-8037, 1993), но имеющиеся ретровирусные векторы обычно неспособны эффективно трансдуцировать нереплицирующие клетки (например, кардиомиоциты). Кроме того, потенциальная опасность включения трансгена в хозяйскую ДНК не доказана, если краткосрочный перенос гена является достаточным. Действительно, мы продемонстрировали,что ограниченная продолжительность экспрессии ангиогенного белка достаточна для того,чтобы вызвать существенный ангиогенез (см. пример 5). Таким образом, временный перенос гена терапевтически адекватен лечению таких сердечно-сосудистых состояний. В течение 14 дней после переноса гена FGF-5 в миокард кровоток в ишемическом ложе усиливался двукратно, и эффект сохранялся в течение по меньшей мере 12 недель (пример 5 и фиг. 8). Усиленный кровоток коррелирует с увеличением числа капилляров в сердце (см. пример 5). Утолщение стенки также увеличивается в течение двух недель после переноса гена и сохраняется в течение по меньшей мере 12 недель. Таким образом,для обеспечения терапевтического эффекта ген ангиогенного фактора не должен находиться в инфицированной клетке дольше, чем несколько недель. С развитием кровеносных сосудов про 005157 38 должительная экспрессия экзогенного ангиогенного белка может не потребоваться для поддержания новой сосудистой структуры и усиленного кровотока. Преимущество, связанное с неделящимися клетками, такими как миоциты, состоит в том,что вирусный вектор при делении клеток разбавляется медленно. Однако, если необходимо или желательно дополнительно увеличить продолжительность экспрессии трансгена в сердце,возможно также использовать различные аденовирусные векторы второго поколения с делециями как Е 1, так и Е 4, которые могут применяться в сочетании с введением циклофосфамида (см., например, Dai et al., Proc. Natl. Acad. Sc.(USA), 92, 1401-1405, 1995). Для дальнейшего увеличения продолжительности первоначального переноса гена могут быть применены дополнительные инфузии или инфузии на выделенном коронарном круге кровообращения. Человеческие клетки 293 (регистрационный номер Е 1 А/Е 1 В в Американской коллекции культур тканей), которые представляют собой человеческие эмбриональные почечные клетки,трансформированные аденовирусными генами Е 1 А/Е 1 В, являются типичным примером пермессивной клеточной линии, пригодной для получения таких дефектных по репликации векторов. Однако могут использоваться и другие клеточные линии, которые делают возможным размножение дефектного по репликации аденовируса, такие как клетки HeLa. Конструкция рекомбинантного аденовируса Аденовирусные векторы, применяемые по настоящему изобретению, могут быть сконструированы путем спасательной рекомбинантной технологии, описанной McGrory W.J. et al., Virology, 163, 614-617, 1988. В кратком изложении трансген, представляющий интерес, клонируют в бифункциональный вектор, содержащий промотор, полилинкер или аденовирусную последовательность с делецией генов Е 1 А/Е 1 В, которые существенны для репликации вируса. Трансген может быть клонирован в подходящий рестрикционный сайт внутри полилинкера. Такие бифункциональные векторы включают плазмиду pAC1 (McGrory W.J. et al., Virology,163, 614-617, 1988) (или ее аналог), которая кодирует части левого конца генома человеческого аденовируса 5 (Virology, 163, 614-617, 1988) минус ранние кодирующие белок последовательности Е 1 А и Е 1 В, и плазмиду ACCMVpLpA(Gomez-Foix et al., J. Biol. Chem., 267, 2512925134, 1992). Плазмида pACCMVpLpA содержит 5'-конец генома аденовируса серотипа 5(единица картирования от 0 до 17), в котором участок Е 1 был заменен на человеческий цитомегаловирусный энхансер-промотор (CMV промотор), сопровождаемый множественным клонирующим сайтом (полилинкером) из плазмиды pUC 19 (хорошо известной в этой области знаний), сопровождаемым сигналом полиадени 39 лирования вируса SV40. Использование плазмиды рАС 1 или ACCMVGLA благоприятствует процессу клонирования. Затем бифункциональный вектор может котрансфицироваться в клетки 293 с плазмидой,которая содержит полный геном человеческого аденовируса 5 с протяженностью большей, чем необходимо для инкапсуляции. Котрансфекция может проводиться одним из способов, обычно применяемых в этой области, таким как осаждение с помощью фосфата кальция или липофекция (см., например, Biotechniques, 15, 868-872,1993). В качестве иллюстрации плазмиды для котрансфекции плазмида JMI7 кодирует полный геном человеческого аденовируса 5 плюс части вектора pBR322, включающего ген устойчивости к ампициллину (4,3 т.п.н.). Хотя плазмидаJMI7 кодирует все аденовирусные белки, необходимые для получения зрелых вирусных частиц, она слишком велика для инкапсуляции в зрелые вирионы (40 т.п.н. против 36 т.п.н. для дикого типа). Среди сотрансфицированных клеток происходит спасательная рекомбинация между содержащим трансген бифункциональным вектором (таким, как плазмида рАС 1) и плазмидой,имеющей полный геном аденовируса 5 (такой,как pJM17), которая генерирует рекомбинантный геном, содержащий представляющий интерес трансген вместо отсутствующих последовательностей Е 1 А/Е 1 В, и которая при рекомбинации вторично теряет дополнительную последовательность (такую, как pBR322), тем самым становясь достаточно малой, чтобы быть инкапсулированной (см. фиг. 4 и 5; Giordano et al.,Nature Medicine, 2 (5), 534-538, 1996; Giordano etal., Circulation, 88, 1-139, 1993; Giordano,Hammond, Clin. Res., 42, 123F, 1994). Контролируемый CMV промотором (3-галактозидазный ген в аденовирусе HCMVSPllacZ (Clin. Res., 42,123 А, 1994) при использовании обработки с Хgа 1 может быть применен для оценки эффективности переноса гена. Иллюстративные примеры, демонстрирующие получение и применение таких векторов, приведены ниже. Преимущества таких векторов включают их способность вызывать высокоэффективный перенос гена (более 60% клеток органа-мишени, трансфицированных invivo), легкость получения высокого титра вирусного штамма и способность этих векторов оказывать влияние на перенос гена в такие клетки, как кардиомициты, которые не делятся. Конструкции направленного ангиогенного белкового вектора Как обсуждается ниже, ограниченная экспрессия ангиогенного трансгена в сердце или в отдельных типах клеток внутри сердца (например, в кардиомиоцитах) может обеспечить некоторые преимущества. 40 Настоящее изобретение предполагает нацеливание на клетки не только путем доставки трансгена, например, в коронарную артерию, но также путем применения направленных векторных конструкций, обладающих свойствами, которые способствуют направленной доставке гена и/или экспрессии гена в особых хозяйских клетках или типах хозяйских клеток (например,в кардиомиоцитах). Такие направленные векторные конструкции, как правило, включали векторы направленной доставки и/или направленные векторы, как описано подробнее ниже и опубликовано в этой области. Ограничение доставки и/или экспрессии может оказаться полезным в качестве средства дальнейшего сосредоточения на потенциальных эффектах генной терапии. Потенциальная польза от дальнейшего ограничения доставки/экспрессии в значительной степени зависит от типа используемого вектора и метода, а также места введения вектора. Как описано в данном изобретении, наблюдаемая доставка вирусных векторов в миокард посредством интракоронарной инъекции обеспечивает сама по себе высоконаправленную доставку гена (см. примеры, приведенные ниже). Кроме того, при использовании векторов, которые не вызывают интеграции трансгена в репликон клетки-хозяина (таких, как аденовирусные и многочисленные другие векторы), ожидалось, что в кардиомиоцитах будет наблюдаться относительно низкая экспрессия трансгена, поскольку эти клетки обычно не реплицируют. В противоположность этому экспрессия в быстро делящихся клетках, таких как эндотелиальные,обычно имеет тенденцию с снижению путем клеточного деления и оборота (прохождения клеточного цикла). Однако могут также применяться и другие способы ограничения доставки и/или экспрессии в дополнение или вместо описанного в данном изобретении способа доставки. Векторы направленной доставки, например векторы (такие как вирусы, невирусные белковые векторы и липидные векторы), содержащие поверхностные компоненты (такие, как составная часть пары лиганд-рецептор, другая половина которой находится на хозяйской клетке-мишени) или обладающие другими свойствами, которые способствуют предпочтительному связыванию и/или доставке гена в специальные хозяйские клетки или типы хозяйских клеток. Как известно в этой области, многие векторы как вирусного, так и невирусного происхождения, обладают наследственными свойствами,благоприятствующими такому предпочтительному связыванию и/или были модифицированы для того, чтобы оказывать влияние на предпочтительное нацеливание (см., например, DouglasTruong V.L., et al., WO 96/00295 (4 January 1996). Направленные векторы включают векторы(такие, как вирусы, невирусные белковые векторы и липидные векторы), доставка которых приводит к эспрессии трансгена, которая относительно ограничена хозяйскими клетками или типами хозяйских клеток. В качестве иллюстрации ангиогенные трансгены, которые должны быть доставлены по настоящему изобретению,могут быть оперативно связаны с гетерологичными тканеспецифичными промоторами, ограничивая тем самым экспрессию клетками этой специальной ткани. Например, тканеспецифичные транскрипционные контрольные последовательности, полученные от гена, кодирующего легкую цепь-2 желудочкового миозина (MLC2V) или тяжелую цепь миозина (МНС), могут быть соединены с трансгеном, таким как ген FGF, внутри вектора,такого, как аденовирусные конструкции, описанные выше. Поэтому экспрессия трансгена может быть относительно ограничена вентрикулярными кардиомиоцитами. Определена эффективность генной экспрессии и степень специфичности, обеспеченная с помощью промоторовMLC2V и МНС и опероном lacZ (с применением рекомбинантной аденовирусной системы,такой как описанная в настоящем изобретении),и описана кардиоспецифичная экспрессия (см.,например. Lee et al., J. Biol. Chem., 267, 1587515885, 1992). Поскольку промотор MLC2V включает только примерно 250 п.н., он легко умещается внутри даже ограниченного по размерам доставочного вектора, такого как упаковывающая система на основе аденовируса 5, приведенная в данном изобретении в качестве примера. Промотор тяжелой цепи миозина, являющийся, как известно, эффективным промотором транскрипции, обеспечивает альтернативный кардиоспецифичный промотор и включает менее чем 300 п.н. Другие промоторы, такие как промотор тропонина-С, хотя и являются высокоэффективными и достаточно малыми, не обеспечивают такой тканеспецифичности. В настоящее время при существующих способах лечения сердечных заболеваний предпочтительным считается направленный перенос гена в сердце путем интракоронарной инъекции вектора с высоким титром. Размножение и очистка аденовирусных векторов Рекомбинантный вирусный вектор, такой как аденовирусный вектор, может быть очищен от бляшек в соответствии со стандартными ме 005157 42 тодами. В качестве иллюстрации образующиеся рекомбинантные аденовирусные векторы могут размножаться в человеческих клетках 293 (которые обеспечивают функции Е 1 А и Е 1 В intrans) до титров в предпочтительном интервале примерно 1010-1012 вирусных частиц/мл. Методы размножения и очистки описаны для различных векторов, которые могут быть использованы по настоящему изобретению. В качестве примеров приведены аденовирусные векторы,но и другие векторы, такие как AAV, могут также применяться. В случае аденовируса клетки могут инфицироваться до 80% слияния и собираться через 48 ч после этого. После 3 циклов замораживания-оттаивания инфицированных клеток клеточные осколки осаждаются путем центрифугирования в градиенте хлористого цезия (предпочтителен двойной градиент хлористого цезия). Перед инъекцией in vivo вирусные образцы обессоливают (например, путем гель-фильтрации через колонки с сефарозой,такой как сефадекс G25). Обессоленные вирусные образцы при желании могут также очищаться путем фильтрации через фильтр 0,3 микрона. Обычно мы концентрируем и очищаем вирусный образец путем ультрацентрифугирования в двойном градиенте хлористого цезия с последующей хроматографией на сефадексеG25, уравновешенном физиологическим раствором, забуференным фосфатом (PBS). Получаемый образец вируса обычно имеет конечный титр, который, по меньшей мере, составляет примерно 1010-1012 вирусных частиц/мл. Предпочтительно рекомбинантный вирус имеет высокую степень очистки и в значительной степени освобожден от частиц дикого типа(потенциально репликативных). В связи с этим размножение и очистка могут проводиться для того, чтобы исключить примеси и вирус дикого типа, например, путем идентификации успешного рекомбинантного вируса с помощью PCR и соответствующих праймеров, проводя два цикла очистки от бляшек и ультрацентрифугирование в двойном градиенте хлористого цезия. Доставка векторов, несущих ангиогенный трансген Способы и составы, которые применяются для доставки векторов, несущих трансгены ангиогенного белка, зависят от особенности используемого вектора, как хорошо известно в этой области. Однако чаще всего вектор может быть в форме препарата для инъекции, содержащего фармацевтически приемлемый носитель/разбавитель, такой, как, например, забуференный фосфатом физиологический раствор. Другие фармацевтические носители, формы и дозы описаны ниже. В настоящее время предпочтительным способом доставки in vivo особенно для векторных конструкций, которые не нацелены другим способом на доставку и/или экспрессию, ограниченную миокардом) является доставка путем инъекции вектора в крове 43 носный сосуд, непосредственно снабжающий миокард, предпочтительно путем инъекции в одну или обе коронарных артерии. Такая инъекция предпочтительно осуществляется с помощью катетера, введенного на достаточную глубину (обычно по меньшей мере примерно на 1 см) в просвет одной или обеих коронарных артерий, либо одной или нескольких подкожных вен ноги, либо в трансплантаты внутренней артерии молочной железы, либо в другие каналы,доставляющие кровь в миокард. Предпочтительно инъекция проводится в обе коронарные артерии для того, чтобы обеспечить равномерное распределение вектора по всему сердцу. Векторы доставляются в количестве, достаточном для экспрессии трансгена и для обеспечения терапевтического эффекта. Для вирусных векторов (таких, как аденовирусные) конечный титр вируса при инъекции препарата находится предпочтительно в интервале примерно 106-1014 вирусных частиц, что способствует эффективному переносу гена. Образец аденовирусного вектора, не содержащий вирус дикого типа, может быть введен путем инъекции глубоко в просвет одной или обеих коронарных артерий (или трансплантатов), предпочтительно как в левую, так и в правую коронарные артерии(или трансплантаты) и предпочтительно в количестве 108-1012 вирусных частиц, определяемых оптической денситометрией. Предпочтительно вектор доставляется путем однократной инъекции в каждый канал (например, в каждую коронарную артерию). При инъекции векторного состава непосредственно в просвет коронарной артерии с помощью коронарных катетеров можно достаточно эффективно направить ген и минимизировать потерю рекомбинантных векторов в проксимальной аорте, имеющую место при инъекции. Такой способ инъекции позволяет осуществить локальную трансфекцию желаемого числа клеток, в частности кардиомиоцитов, с генами, кодирующими ангиогенный белок или пептид, в пораженный миокард, тем самым максимизируя терапевтическую эффективность переноса гена и минимизируя нежелательный ангиогенез в экстракардиальных областях. Векторные конструкции, направленные специфически на миокард, такие, как векторы,включающие компоненты специфического связывания с миокардом или захвата, и/или включающие трансгены ангиогенного белка, находящиеся под контролем миокардиальных специфических транскрипционных последовательностей (например, вентрикулярных миоцитспецифичных промоторов), могут применяться вместо или предпочтительно в сочетании с методами направленной инъекции, такими как последующее ограничение экспрессии в миокарде, особенно в вентрикулярных миоцитах. В случае векторов, которые могут вызвать иммунный ответ, предпочтительно вводить вектор 44 путем инъекции непосредственно в кровеносный сосуд, снабжающий миокард, как описано выше, хотя могут применяться и дополнительные методы ограничения возможности экстракардиальной экспрессии. Было показано, как подробно описано ниже, что при использовании таких методов для доставки in vivo вирусного вектора, содержащего ангиогенный трансген, в гепатоцитах не наблюдается экспрессия трансгена, и вирусная РНК не обнаруживается в моче в любые сроки после интракоронарной инъекции. Кроме того,при этом методе с помощью PCR не получено никаких доказательств экстракардиальной экспрессии гена в глазу, печени или скелетной мышце через две недели после интракоронарной доставки трансгенов. Разнообразные катетеры и пути поступления могут быть использованы для осуществления интракоронарной доставки, как хорошо известно в этой области. Прямая интракоронарная(или в сосуд трансплантата) инъекция может осуществляться методом, основанным на применении стандартного катетера, вводимого через кожу, при флуороскопическом контроле. По настоящему изобретению могут применяться любые разновидности коронарного катетера или, например, перфузионный катетер Стэка. В качестве примера разнообразные катетеры для общих целей, а также модифицированные катетеры, пригодные для применения по настоящему изобретению, доступны от коммерческих поставщиков, таких как Advanced CardiovascularSystem (ACS), Target Therapeutics, Boston Scientific и Cordis. К тому же, если доставка в миокард осуществляется путем инъекции непосредственно в коронарную артерию (что является в настоящее время предпочтительным), могут быть использованы многочисленные возможности для введения катетера в коронарную артерию, как известно в этой области. В качестве иллюстрации катетер может быть легко введен в бедренную артерию и протянут в обратном направлении через подвздошную артерию и абдоминальную аорту в коронарную артерию. В качестве альтернативы катетер может быть сначала введен в плечевую или сонную артерию и протянут в обратном направлении в коронарную артерию. Подробное описание этих и других приемов можно найти в публикациях, относящихся к этой области знаний (см., например,ссылки, цитированные выше, включая Topol E.J.Co., 1992); Sabiston D., The Textbook of Surgery,14th Ed. (W.B. Saunders Co., 1991). Направленная экспрессия гена Неожиданным по настоящему изобретению оказалось то, что рекомбинантный адено 45 вирус очень эффективно доставляется в первое же сосудистое ложе, в которое он попадает. Действительно, в примере 4 на животной модели эффективность попадания вируса в сердце после интракоронарной инъекции составила 98%, т.е., 98% вируса высвобождаются при первом прохождении вируса через миокардиальное сосудистое ложе. Более того, в сыворотке, полученной от животных при инъекции, не наблюдался рост вирусных бляшек (Graham, Virology, 163, 614-617, 1988) до тех пор, пока она не была разбавлена 200-кратно, что позволило предположить присутствие сывороточного фактора (или связывающего белка), ингибирующего размножение вируса. Эти два фактора (эффективная фиксация вируса при первом прохождении и возможное присутствие сывороточного связывающего белка) могут действовать вместе, ограничивая экспрессию гена первым сосудистым ложем, в которое попадает вирус. С целью дальнейшей оценки степени ограничения переноса гена областью сердца после интракоронарной доставки была использована полимеразная цепная реакция (PCR) для того,чтобы выяснить, имеется ли доказательство экстракардиального присутствия вирусной ДНК в течение двух недель после переноса гена у двух обработанных животных (пример 4, приведенный ниже). Наличие вирусной ДНК обнаружено у животных в сердце, но не в ретине, скелетных мышцах или печени. Чувствительность методаPCR такова, что обычно определяется одна последовательность ДНК на 5000000 клеток. Следовательно, эти данные демонстрируют, что в экстракардиальных тканях в течение двух недель после доставки гена вирусная ДНК не обнаружена. Эти результаты были в последующем подтверждены с применением других ангиогенных белков и их производных, как описано ниже. Эти данные являются чрезвычайно важными, поскольку они подтверждают концепцию кардиального нацеливания трансгена (т.е., обеспечения экспрессии трансгена в сердце, а не где-либо). Локализованная генная доставка и экспрессия обеспечивают преимущество безопасности и дальнейшего расширения применения данных методов при лечении пациентов. Терапевтическое применение Данный способ переноса in vivo трансгена,кодирующего ангиогенный белок, может быть применен для лечения застойной сердечной недостаточности, включая недостаточность, ассоциированную с дилатационной кардиомиопатией (DCM), а также с тяжелым поражением коронарной артерии (CAD) и для предотвращения или ослабления вентрикулярной коррекции. Как показывают приведенные ниже данные, экспрессия экзогенного ангиогенного трансгена в миокарде промотирует ангиогенез, приводящий к усилению кровотока и функции в ишемических и неишемических областях сердца. Такое увеличение числа кровеносных сосудов вызовет 46 ослабление сердечной недостаточности и компенсирует вентрикулярную дисфункцию, вызванную вентрикулярной коррекцией. Как описано в настоящем изобретении,множество различных векторов может применяться для доставки in vivo трансгенов ангиогенных белков в соответствии со способами данного изобретения. В качестве иллюстрации с применением дефектных по репликации рекомбинантных аденовирусных векторов, приводимых здесь в примерах, достигается высокоэффективный перенос гена in vivo без проявления цитопатического эффекта или воспаления в области генной экспрессии. При лечении застойной сердечной недостаточности перенос трансгена кодирующего ангиогенный белок, может проводиться, например, после диагностирования сердечной недостаточности или очевидного развития сердечной недостаточности. При лечении вентрикулярной коррекции перенос гена может осуществляться в любое время после того, как пациент перенес инфаркт, предпочтительно в течение 30 дней и еще более предпочтительно в течение 7-20 дней после инфаркта. Составы или продукты по изобретению для удобства могут быть приготовлены в виде лекарственных форм, пригодных для введения в кровоток (например, путем интракоронарной инъекции). Подходящая форма введения может быть лучше всего определена лечащим врачом для каждого пациента в отдельности. Подходящие фармацевтически приемлемые носители и лекарственные формы на их основе описаны в общеизвестных научных трудах по лекарственным формам, например E.W. Martin, Remington'sParental Sciences and Technology, Technical Report No. 10, Supp. 42, 2S, 1988. Векторы по настоящему изобретению предпочтительно должны быть приготовлены в виде раствора с нейтральным значением рН, например, приблизительно от рН 6,5 до рН 8,5, более предпочтительно от рН 7 до рН 8, и с добавлением наполнителя, обеспечивающего изотонические свойства раствора, например, с 4,5% маннита или 0,9% хлорида натрия, с добавлением поддерживающих рН буферных агентов, таких как фосфат натрия, обычно считающихся безвредными,наряду с добавлением известных консервантов,таких, как метакрезол в количестве от 0,1 до 0,75%, более предпочтительно от 0,15 до 0,4%. Желаемая изотоничность раствора может быть достигнута путем применения хлорида натрия или других фармацевтически приемлемых агентов, таких как декстроза, борная кислота, тартрат натрия, пропиленгликоль, полиолы (такие,как маннит и сорбит) либо других неорганических или органических растворенных веществ. Хлорид натрия является особенно предпочти 47 тельным в случае буферов, содержащих ионы натрия. При желании растворы упомянутых выше составов могут также готовиться с целью увеличения срока хранения или повышения стабильности. Терапевтически применимые составы по изобретению готовят путем смешения ингредиентов в соответствии с общепринятыми методами. Например, отобранные компоненты могут смешиваться, образуя концентрированную смесь, которая затем может доводиться до конечной концентрации и вязкости путем добавления воды и/или буфера до контрольного значения рН или дополнительного растворенного вещества для контроля изотоничности. Для врачебного применения составы будут готовиться в виде дозированных форм, содержащих количество вектора по изобретению,эффективное в виде одной или нескольких доз в индуцировании ангиогенеза, достаточного для получения терапевтического эффекта. Специалистам в данной области будет понятно, что эффективное количество терапевтического агента может изменяться в зависимости от многих факторов, включая возраст и вес пациента,физическое состояние пациента, уровень ангиогенеза, который должен быть достигнут, и от других факторов. Эффективная доза составов по данному изобретению обычно изменяется в интервале примерно 106-1014 вирусных частиц, предпочтительно примерно 108-1012 вирусных частиц. Количество вирусных частиц может составить, но предпочтительно не превышать 1014. Отмечается, что вводимая доза определяется обслуживающим клиницистом, но предпочтительно вводится в 5 мл или менее физиологически забуференного раствора (такого, как забуференный фосфатом физиологический раствор), более предпочтительно в 1-3 мл. В настоящее время в случае болезни сердца предпочтительным является способ введения путем интракоронарной инъекции в одну или в обе коронарные артерии (или в одну или несколько подкожных вен ноги, или в трансплантаты внутренней артерии молочной железы) с помощью соответствующего коронарного катетера. Следующие примеры приведены для того,чтобы в дальнейшем содействовать специалистам в этой области. Подразумевается, что эти примеры носят иллюстративный характер и,следовательно, не должны рассматриваться как ограничивающие настоящее изобретение. Для специалистов в этой области станут очевидными приведенные в качестве примеров модификации и варианты, описанные в этой заявке, и другие. Считается, что такие варианты охвачены данным изобретением, как заявлено в описании и формуле изобретения. Примеры Предпочтительные способы по настоящему изобретению включают лечение пациентов с 48 сердечной недостаточностью и/или вентрикулярной коррекцией. Пример 1 описывает модель для лечения сердечной недостаточности, индуцированной продолжительной (в течение периода свыше 3-4 недель) частой вентрикулярной стимуляцией. Пример демонстрирует, что на животной модели сердечной недостаточности левожелудочковый кровоток аномально низок, когда левый желудочек расширен и имеются симптомы сердечной недостаточности. На этой модели потребность миокарда в кислороде не соответствует миокардиальному кровотоку, что приводит к ишемии миокарда. Пример 2 демонстрирует конструкцию аденовирусного вектора, применяемого по настоящему изобретению. Пример 3 описывает предварительные эксперименты in vitro, проводимые для оценки эффективности аденовирусного вектора по настоящему изобретению. Был также использован контрольный (кодирующий -галактозидазу) аденовирусный вектор. Из результатов следует,что данный рекомбинантный аденовирусный вектор может действительно инфицировать зрелые кардиомиоциты и с высокой эффективностью обеспечить экспрессию трансгена. После этого следуют исследования in vivo. Пример 4 демонстрирует инфицированиеin vivo свиного миокарда аденовирусным вектором, кодирующим -галактозидазу (AdLacZ) и экспрессию -gаl в миокарде. Пример 5 демонстрирует, что опосредованная вирусом доставка ангиогенного генаFGF-5 в миокард in vivo может улучшить регионарный кровоток и ослабить регионарную миокардиальную сократительную функцию. Пример 6 демонстрирует, что опосредованная вирусом доставка ангиогенного трансгена FGF-4 в миокард in vivo может улучшить регионарный кровоток и ослабить регионарную миокардиальную сократительную функцию. Пример 7 демонстрирует, что опосредованная вирусом доставка ангиогенного генаFGF-2 в миокард in vivo может улучшить регионарный кровоток и ослабить регионарную миокардиальную сократительную функцию. Пример 1. Свиная модель застойной сердечной недостаточности и ассоциированной миокардиальной ишемии. 1-А. Животные и хирургическая процедура Девять йоркширских свиней (Sus Scrofa) весом 406 кг анестезировали кетамином (50 мг/кг внутримышечно) и сульфатом атропина(0,1 мг/кг внутримышечно), затем амиталом натрия (100 мг/кг внутривенно). После интратрахеальной интубации давали галотан (от 0,5 до 1,5%) с помощью вентилятора периодического давления в течение всей процедуры. В случае левой торакотомии катетеры помещали в аорту,легочную артерию и левое предсердие. Микро 49 манометр Конигсберга помещали в левый вентрикулярный апекс, и эпикардиальное униполярное отведение помещали на 1 см ниже атриовентрикулярной борозды в латеральной стенке левого желудочка. Электрогенератор(Spectrax 5985; Metronic, Inc.) вставляли в подкожный карман брюшной полости. Четырем животным вокруг главной легочной артерии были установлены проточные датчики (Transonic, Inc.). Перикард был неплотно аппроксимирован и грудная клетка закрыта. В течение 710 дней после торакотомии проводились базовые измерения гемодинамики, левой желудочковой функции и миокардиального кровотока. Затем начинали вентрикулярную стимуляцию(2209 сокращений/минуту (сокращений в минуту) в течение 264 дней). Амплитуда стимула составила 2,5 В, длительность импульса 0,5 мс. В качестве контроля использовали девять дополнительных свиней (407 кг); пять животных подвергали торакотомии и установке датчика без стимуляции и забивали через 307 дней после торакотомии. Данные, относящиеся к массе правого и левого желудочков, у контрольных животных были близки независимо от того,подвергались они торакотомии или нет, поэтому их данные были объединены в одну контрольную группу. 1-В. Гемодинамические исследования Гемодинамические данные получали от животных, находящихся в сознательном состоянии, без воздействия седативных средств, после того, как стимулятор был инактивирован в течение по меньшей мере 1 ч, и животные находились в начальном состоянии. Все данные получали на каждом животном с 7-дневными интервалами. Давление измеряли в левом предсердии, легочной артерии и аорте. Значение левожелудочкового dP/dt получали из значения высокоточного левожелудочкового давления. Регистрировали кровоток легочной артерии. Образцы аортальной и пульмонарной крови брали для расчета различий в артериовенозном содержании кислорода. 1-С. Эхокардиографические исследования Эхокардиография является методом измерения регионарного миокардиального кровотока, который включает инъекцию контрастного материала человеку или животному. Контрастный материал (микроагрегаты галактозы) усиливает эхогенность (белизну) изображения после инъекции в левое предсердие. Микроагрегаты распределяются в коронарных артериях и стенках миокарда таким образом, что их распределение пропорционально кровотоку (Skybaet al., Circulation, 90, 1513-1521, 1994). Максимальная интенсивность контрастного усиления коррелирует с миокардиальным кровотоком при измерении с помощью микросфер (Skyba et al.,Circulation, 90, 1513-1521, 1994). Двумерные и М-формата изображения получали с помощью видеосистемы Hewlett Pack 005157ard Sonos 1500. Изображения получали от правого парастернального подхода на уровне среднепапиллярной мышцы и регистрировали на ленте формата VHS. Измерения проводили в соответствии с критериями Американского общества эхокардиографии (Sahn et al., Circulation,58, 1072-1083, 19978). Благодаря срединной ориентации свиной интравентрикулярной перегородки (IVS) и использованию правой парастернальной проекции измерения М-формата с короткой осью проводились через IVS и анатомическую латеральную стенку. Все параметры,включая размер в конце диастолы (EDD), размер в конце систолы (ESD) и толщину стенки,измеряли по меньшей мере на пяти случайных сокращениях в конце выдоха и усредняли. Размер в конце диастолы получали в начале комплекса QRS. Размер в конце систолы получали в момент максимального латерального положенияIVS или в конце Т-волны. Левожелудочковую систолическую функцию оценивали с применением фракционного сокращения, FS=[(EDDESD)/EDD]x100. Процент утолщения стенки(%WTh) рассчитывали как %WTh=[(ESWThEDWTh)/EDWTh]x100. Для того, чтобы продемонстрировать воспроизводимость эхокардиографических измерений, животных подвергали процедуре получения изображения 2 дня подряд до начала протокола стимуляции. Данные отдельных измерений имели высокую воспроизводимость (фракционное сокращение, R2=0,94,р 0,006; утолщение латеральной стенкиR2=0,90, р 0,005). Все эти измерения получали при инактивированном стимуляторе. 1-D. Миокардиальный кровоток Миокардиальный кровоток измеряли с помощью методики радиоактивных микросфер,как подробно описано ранее (Roth D.M., et al.,Am. J. Physiol., 253, H1279-H1288, 1987; RothD.M., et al., Circulation, 82, 1778-1789, 1990). Трансмуральные образцы из левожелудочковой латеральной стенки и IVS разделяли на эндокардиальные, среднестеночные и эпикардиальные трети и определяли кровоток в каждой трети и трансмуральный кровоток. Трансмуральные секции брались из областей, в которых было проведено эхокардиографическое исследование, так что измерение кровотока и функциональные измерения были проведены в каждом сосудистом ложе. Микросферы вводили путем инъекции в контроле (без стимуляции), в начале вентрикулярной стимуляции (225 сокращений/мин) и затем с 7-дневными интервалами при вентрикулярной стимуляции при 225 сокращениях/мин; микросферы вводили также путем инъекции через 14 дней (n=4) и на 21-28 день (n=3). Миокардиальный кровоток на сокращение рассчитывали путем деления миокардиального кровотока на частоту сердечных сокращений (записанную при инъекции микросфер) (Indolfi С., et al., Circulation, 80, 933-993,1989). Среднее левопредсердное и среднее арте 51 риальное давления регистрировали при инъекции микросфер для того, чтобы можно было оценить коронарное васкулярное сопротивление; показатель коронарного васкулярного сопротивления равен среднему артериальному давлению минус среднее левопредсердное давление, деленное на трансмуральный кровоток. 1-Е. Систолическое напряжение стенки Периферическое систолическое напряжение стенки не могло быть определено из-за невозможности получить подходящую проекцию для оценки длинной оси левого желудочка. Поэтому мы рассчитали меридиональное напряжение стенки в конце систолы (Riechek N., et al.,Circulation, 65, 99-108, 1982) с использованием уравнения: меридиональное напряжение стенки в конце систолы (в динах) = (0,334xPxD):[h(1h/D)], где Р означает левожелудочковое давление в конце систолы (в динах), D означает левожелудочковый диаметр в конце систолы (в см) и h означает толщину стенки в конце систолы. Меридиональное напряжение стенки в конце систолы рассчитывали как для латеральной стенки, так и для IVS перед началом стимуляции и в последующем с недельными интервалами (стимулятор отключен). 1-F. Терминальная хирургия Через 262 суток непрерывного стимулирования животных анестезировали, интубировали и проводили срединную стернотомию. Все еще бьющиеся сердца погружали в физиологический раствор (4 С), коронарные артерии быстро перфузировали физиологическим раствором (4 С), правый и левый желудочки (включаяIVS) взвешивали и трансмуральные образцы от каждой области быстро замораживали в жидком азоте и хранили при температуре -70 С. 1-G. Адениновые нуклеотиды Измеряли содержание АТР и ADP в трансмуральных образцах IVS и латеральной стенке у четырех животных с сердечной недостаточностью (стимулированных 28 дней) и у четырех контрольных животных. Образцы от животных с сердечной недостаточностью получали при отключенном стимуляторе (60 мин) в день, когда животных забивали. Образцы были получены идентично от всех животных. Содержание АТР и ADP определяли с помощью высокоэффективного жидкостного хроматографа фирмыWaters, как описано ранее (Pilz R.B., et al., J.Biol. Chem., 259, 2927-2935, 1984). 1-Н. Статистический анализ Данные выражали как среднее значениестандартное отклонение (SD). Специфические измерения, проведенные в контрольном(перед стимуляцией) состоянии и с 1-недельными интервалами при стимулировании, сопоставляли с повторяющимися измерениями дисперсионного анализа ANOVA (Crunch 4, CrunchSoftware Corp.). При таких сопоставлениях (например, латеральной стенки с IVS) применяли двусторонний дисперсионный анализ ANOVA. 52 Сравнения post hoc проводили по методу Тьюки, как описано в литературе. Девять животных оставались в живых при стимулировании в течение 21 дня, шесть из них выжили в течение 28-дневого стимулирования. Данные, полученные от животных, выживших в течение 28 дней,были статистически неотличимы от данных,полученных от животных, проживших только 21 день. Поэтому дисперсионный анализANOVA проводили на девяти животных в четыре временные точки: контроль (перед стимулированием), 7 дней, 14 дней и 21-28 дней. Нулевая гипотеза отклонялась при р 0,05 (двустороннем). Результаты 1-1. Гемодинамические исследования Частое вентрикулярное стимулирование приводило к изменениям в гемодинамике, которые были значительными через 7-14 дней стимуляции. Через 7 дней у животных были повышенные показатели левопредсердного и легочного артериального давления. Эти значения становились аномально высокими при дополнительном стимулировании в течение недель(табл. 1). Симптомы застойного кровообращения (учащение дыхания, асциты и тахикардия) становились явными на 14-21 день. Легочный артериальный кровоток (минутный сердечный выброс) понижался к 21 дню стимулирования Дисперсионный анализ (повторные измерения) применяли для определения влияния продолжительности стимулирования на специфическую переменную величину; значения р по методу ANOVA приведены в правой колонке. Анализ post hoc проводили по методу Тьюки: а р 0,05: bр 0,01; c р 0,001 (по сравнению с контрольным значением для той же самой переменной); d р 0,05; e р 0,01; f р 0,001 (по сравнению с предыдущей неделей); gр 0,05; hp0,01;i р 0,001 (по сравнению со значением для седьмого дня). Измерения проводили при инактивированном стимуляторе и представляли как среднее значение SD. 7 дней: 7 дней стимулирования; 14 дней: 14 дней стимулирования; 2128 дней: 21-28 дней стимулирования. HR - час 53 тота сердечных сокращений, MAP - среднее аортальное давление, PA - легочное артериальное давление, LA - левоаритальное давление,AVO2 D - различие в атриовентрикулярном содержании О 2 (кислорода), EDD - размер в конце диастолы, FS - фракционное сокращение,LVdP/dT - изменение левожелудочкового давления в единицу времени (с). 1-J. Глобальная левожелудочковая функция Левожелудочковую функцию оценивали с помощью эхокардиографии и гемодинамических переменных показателей после инактивации стимуляторов. Фракционное сокращение прогрессивно снижалось в течение стимуляции(р 0,0001; табл. 1), достигая своих низших значений на 21-28 день (контроль, 393%; 21-28 день, 134%; р 0,0002). Размер левого желудочка в конце диастолы прогрессивно увеличивался в течение стимуляции (р 0,0001; табл. 1),достигая своих максимальных значений на 2128 день (контроль, 3,90,4 см; 21-28 день,5,80,6 см; р 0,0002). Положительное левожелудочковое dP/dT также снижалось в ходе исследования (р 0,0001; табл. 1). Прогрессирующее падение максимума dP/dT сопровождалось повышением левожелудочкового давления в конце диастолы, подтверждающим пониженную левожелудочковую сократимость, поскольку повышенное давление в конце диастолы в норме увеличивает левожелудочковый максимумdP/dT (Mahler et al., Am. J. Cardiol., 35, 626-634,1975). 1-K. Левожелудочковая регионарная функция При инактивированном стимуляторе регионарную левожелудочковую функцию оценивали путем измерения утолщения левожелудочковой латеральной стенки и IVS. Вентрикулярное стимулирование от латеральной стенки вызывало значительное истощение функции латеральной стенки по сравнению сIVS (р 0,001, фиг. 1 и табл. 2). Различие было значительным на 7 день и увеличивалось в последующем до 21-28 дня по мере истощения функции латеральной стенки. В IVS наблюдалось незначительное снижение утолщения стенки в течение всего исследования. В ходе исследования наблюдалось прогрессирующее уменьшение толщины стенки в конце диастолы, которое было выраженным в латеральной стенке (табл. 2). Таблица 2. Последовательное утолщение левожелудочковой стенки 54 Двусторонний дисперсионный анализ (повторные измерения) применяли для того, чтобы определить влияние продолжительности стимуляции (время) или области (латеральная стенка,LAT; или интервентрикулярная перегородка,IVS) на утолщение стенки в конце систолы(EDTh) или на % утолщения стенки (WTh), или имеется ли различие в изменении EDTh и WTh между двумя областями (между). Средние значения для EDTh и WTh в процентах в каждой временной точке анализировали на различия между двумя областями post hoc по методу Тьюки. Величины представлены в виде средних значений SD. 7 дней: 7 дней стимулирования; 14 дней: 14 дней стимулирования; 21-28 дней: 21-28 дней стимулирования; n=9; vs. означает по сравнению. 1-L. Левожелудочковый регионарный кровоток В начале стимуляции субэндокардиальный кровоток в минуту увеличивался больше в IVS, чем в латеральной стенке (фиг. 2 и табл. 3). Это различие в регионарном кровотоке при стимуляции сохранялось в течение всего исследования, и характер изменения кровотока был различным для этих двух областей (р=0,006). Характер изменения кровотока в минуту между двумя областями при стимуляции был постоянным независимо от того, проводились ли измерения в эндокардиальном (р 0,006), срединном (р 0,002), эпикардиальном (р 0,016) или трансмуральном(р 0,003) срезах (табл. 3). В противоположность этому при инактивации стимулятора в субэндокардиальном кровотоке регионарные различия не обнаруживались независимо от того, проводились измерения в контрольном состоянии через 14 дней или через 21-28 дней Двусторонний дисперсионный анализ (повторные измерения) проводили с целью определения влияния продолжительности стимуляции(время) или области (латеральная стенка, LAT; или интервентрикулярная перегородка, IVS) на субэндокардиальный (ENDO) или трансмуральный (TRANS) кровоток, а также выявления различий в характере изменения кровотока между двумя областями. MID - срединный, EPI - эпикардиальный кровоток. Средние значения для кровотока в каждой временной точке анализировали на различия между двумя областями posthoc no методу Тьюки. Величины представлены в виде средних значений SD. Режим ON: микросферы, введенные путем инъекции при вентрикулярной стимуляции (225 сокращений/мин). Режим OFF: стимулятор инактивирован. День 0: контроль; день 14: 14 дней стимулирования; день 21-28: 21-28 дней стимулирования; vs. означает по сравнению; нc - незначимый статистически. Соотношение между эндокардиальным кровотоком и эпикардиальным изменялось незначительно при прогрессировании сердечной недостаточности (р 0,058). Однако с началом стимуляции соотношение эндокардиальный/эпикардиальный было значительно ниже в латеральной стенке, чем в IVS (IVS, 1,320,23: латеральная стенка, 0,770,10; (р 0,002); табл. 3). Соотношения в обеих областях были больше 1,0 в течение всего исследования. Эндокардиальный кровоток на одно сокращение (фиг. 2,табл. 4) был сходен в обеих областях до начала стимуляции (IVS, 0,0130,003 мл/мин/г/ сокращение; латеральная стенка,0,0120,004 56 мл/мин/г/сокращение; р=нс). С началом вентрикулярной стимуляции наблюдался регионарный дефицит эндокардиального кровотока на сокращение в латеральной стенке, но не в IVS (IVS,0,0090,002; латеральная стенка, 0,0050,001 мл/мин/г/сокращение; (р 0,001). Через 14 дней и через 21-28 дней эндокардиальный кровоток на сокращение был меньше в латеральной стенке, чем в IVS при стимуляции (фиг. 2 и табл. 4). Эти данные указывают на то, что миокардиальная гипоперфузия в латеральной стенке проявилась с началом стимуляции, и эта относительная ишемия сохранялась. Однако эндокардиальный кровоток на сокращение оставался в норме в обеих областях при отключенном стимуляторе(фиг. 2 и табл. 4). Кровоток в обеих областях проявлял тенденцию к усилению в течение последней недели стимуляции (фиг. 2 и табл. 3). Такой характер кровотока, связанный с прогрессирующим падением показателя сердечно-сосудистого сопротивления (фиг. 3), позволяет сделать предположение о том, что изменения в структуре и функции сердечно-сосудистой системы могут сопутствовать левожелудочковой коррекции по мере усиления сердечной недостаточности. При стимуляции показатель сердечно-сосудистого сопротивления в латеральной стенке значительно выше, чем в IVS, и характер изменения сердечно-сосудистого сопротивления был различным для двух областей (р 0,0012) (фиг. 3). Эти результаты свидетельствуют о влиянии измененной электрической активации на миокардиальную перфузию. Таблица 4. Эндокардиальный кровоток на сокращение Данные, полученные на модели амероидной ишемии в нашей лаборатории, опубликованы ранее (Hammond H.K., McKiman M.D., J. Am.Coll. Cardiol., 23, 475-482, 1994). Приведенные величины означают среднее значение SD. Эти 57 данные показывают, что коллатеральнозависимая (ишемическая область) амероидная модель и модель вентрикулярной сердечной недостаточности, индуцированной стимуляцией, имеют сходный дефицит эндокардиального кровотока на сокращение при сопоставлении с миокардиальными областями с нормальной перфузией. 1-М. Напряжение левожелудочковой стенки в конце систолы Наблюдалось значительное увеличение определяемого меридионального напряжения стенки в зависимости от продолжительности стимуляции (р 0,0001), но характер изменения напряжения стенки был схожим для латеральной стенки и IVS (р=33), и анализ post hoc не обнаружил никаких регионарных различий в систолическом напряжении стенки ни в одной из временных точек (фиг. 3). Увеличение напряжения стенки в конце систолы было почти трехкратным в латеральной стенке (контроль,16840 х 103 дин; 28-ой день, 412143 х 103 дин; р=0,0001) и в IVS (контроль, 15935 х 103 дин; 28-ой день, 480225 х 103 дин; р=0,0001). 1-N. Аутопсия При аутопсии у животных с сердечной недостаточностью отмечались асциты (среднее количество жидкости 1809 мл, интервал от 300 до 3500 мл) и расширенное с истонченными стенками сердце, все четыре области которого казались сильно гипертрофированными. Отношение веса желудочка к весу тела свидетельствовало о гипертрофии только правого желудочка, подтверждая данные предшествующего исследования на этой модели (Roth D.A., et al., J.Clin. Invest., 91, 939-949, 1993). При сопоставлении с соответствующим весом контрольных животных не наблюдалось отличия левожелудочковой массы, связанного с сердечной недостаточностью (контроль, 11210 г; сердечная недостаточность, 11417 г); соотношения веса левого желудочка к весу тела в обеих группах были также близки (контроль, 2,80,3 г/кг; сердечная недостаточность, 2,90,3 г/кг). В противоположность этому сердечная недостаточность ассоциировалась с увеличением веса правого желудочка (контроль, 383 г; сердечная недостаточность, 5211 г; р=0,003) и увеличением соотношения веса левого желудочка к весу тела(контроль, 0,090,1 г/кг; сердечная недостаточность, 1,30,3 г/кг; р 0,003). Стимулированные животные в ходе исследования прибавляли 4 кг,частично это было связано с накоплением асцита. Если для расчета отношения веса левого желудочка к весу тела использовали начальный вес тела, то величина соотношения незначительно превышала соответствующий показатель контрольных животных. Эти данные подтверждают тот факт, что в ходе исследования не происходило существенное увеличение массы левого желудочка. 58 1-0. Адениновые нуклеотиды У контрольных животных наблюдались нормальные соотношения ATP/ADP, подобные тем, которые опубликованы для свиного сердца при отборе материала путем биопсии с помощью дрели и немедленного погружения в жидкий азот (White F.C., Boss G., J. Cardiovasc.Pathol., 3, 225-236, 1990), что подтверждало пригодность методики отбора образцов. У животных с сердечной недостаточностью наблюдалось значительное уменьшения соотношенияATP/ADP в образцах, взятых из IVS (контроль,14,81,1; сердечная недостаточность, 2,40,3; р 0,0001, n=4 для обеих групп) и из латеральной стенки (контроль, 14,34,0; сердечная недостаточность, 2,40,9; р 0,0012, n=4 для обеих групп). Это подтверждало несоответствие между поставляемым в миокард кислородом и необходимым. 1-Р. Миокардиальный кровоток Регионарные изменения миокардиального кровотока незамедлительное последствие частой вентрикулярной стимуляции - могут играть роль в патогенезе регионарной и глобальной дисфункции при индуцированной стимуляцией сердечной недостаточности. При стимуляции были найдены различия в миокардиальном кровотоке в минуту между левожелудочковой латеральной стенкой (смежной с участком стимуляции) и IVS. Сниженный кровоток наблюдался в латеральной стенке сразу после начала стимуляции и сохранялся в течение 21-28 дней. Левожелудочковая латеральная стенка, получая при стимуляции меньший ток крови, чем IVS, обнаруживала прогрессирующее снижение утолщения стенки (стимулятор отключен) в течение 2128 дней стимуляции. В противоположность этому IVS, получая больший ток крови при стимуляции, поддерживала относительно нормальное утолщение стенки в течение 21-28 дней стимулирования. Поскольку миокардиальный кровоток в минуту не позволяет легко оценить относительную миокардиальную ишемию, мы выражали также коронарный ток как эндокардиальный кровоток на сокращение. Физиологическая основа для такого анализа заложена в предыдущих экспериментах, показывающих, что регионарный субэндокардиальный кровоток в минуту(предпочтительнее чем внешняя стенка трансмурального тока) является первичным определяющим фактором регионарного миокардиального сокращения в условиях прогрессирующего стеноза коронарной артерии (Gallagher et al.,Am. J. Physiol., 16, H727-H738, 1984), который усиливает изменение скорости сердечного сокращения в этой зависимости ток-функция в сторону понижения, с более низкой регионарной функцией на любом уровне субэндокардиального кровотока (Delbaas Т., et al., J. Physiol.,477, 481-496, 1990). Однако, если зависимость ток - функция изобразить графически как ре 59 гионарную функцию против эндокардиального кровотока на сокращение, то для коррекции эффектов частоты сердечных сокращений существует единственная зависимость при различных частотах сердечных сокращений, указывающая на то, что эндокардиальный кровоток на сокращение прежде всего определяет уровень функции стенки при сниженном коронарном кровотоке (Indolfi С., et al., Circulation, 80, 933-993,1989; Ross J., Circulation, 83, 1076-1083, 1991). С началом стимуляции наблюдалось более чем 50%-ное снижение эндокардиального кровотока на сокращение при сопоставлении латеральной стенки с IVS (р 0,001; табл. 4). В прежних исследованиях на свиньях, находящихся в сознании, мы установили, что 50%ное снижение эндокардиального кровотока вызывает 50%-ное снижение регионарной функции и связано с субэндокардиальным кровотоком на сокращение, подобным тому, который наблюдался в латеральной стенке в данных исследованиях (табл. 4). Снижение кровотока в латеральной стенке при стимуляции сохранялось в течение всего исследования. Эти данные служат доказательством миокардиальной ишемии в латеральной стенке, возникающей при вентрикулярной стимуляции. В противоположность этому функция IVS и эндокардиальный ток на сокращение остаются относительно нормальными. При отключенном стимуляторе субэндокардиальный кровоток на сокращение оставался нормальным в обеих областях в течение всего исследования, тогда как регионарная дисфункция сохранялась в латеральной стенке в соответствии с наличием миокардиального шока в этой области. Таким образом, мы предполагаем,что сохраняющаяся длительное время ишемия латеральной стенки оказывает значительное влияние на глобальную функцию в ходе стимуляции и после нее. Пример 2. Получение аденовирусных конструкций Использовали независимую от вирусапомощника дефектную по репликации систему на основе человеческого аденовируса-5. В качестве первой иллюстрации векторной конструкции мы использовали гены, кодирующие галактозидазу и FGF-5. Рекомбинантные аденовирусы, кодирующие -галактозидазу и FGF-5,были сконструированы с использованием кДНК полной протяженности. Система, примененная для того, чтобы генерировать рекомбинантные аденовирусы, налагала ограничения по упаковке, составляющие примерно 5 т.н. для трансгенных вставок. Каждый из генов -gаl и FGF-5,оперативно связанных с промотором CMV и с полиаденилирующей последовательностьюSV40, составлял менее чем 4 т.н., соответствуя ограничениям упаковки. кДНК полной протяженности для человеческого FGF-5 выделяли из плазмидыpLTR122E (Zhan et al., Mol. Cell. Biol., 8, 3487,1988) в виде фрагмента ECOR1 в 1,1 т.н., который включает 981 п.н. открытой рамки считывания гена, и клонировали в полилинкер бифункциональной векторной плазмидыal., J. Biol. Chem., 267, 25129-25134, 1992. Плазмида pACCMVpLpA содержит 5'-конец генома аденовируса серотипа 5 (единицы картирования 0-17), где участок Е 1 заменен человеческим цитомегаловирусным энхансером-промотором(промотором CMV), за которым следует множественный клонирующий сайт (полилинкер) от плазмиды pUC19 (хорошо известной в этой области), за которой следует сигнал полиаденилирования SV40. Кодирующий lacZ контрольный аденовирус основан на делении Е 1 А/Е 1 В от единицы картирования 1-9,8. КодирующийFGF-5 аденовирус (AdFGF-5) основан на делении Е 1 А/Е 1 В от единицы картирования 1,3-9,3. Оба этих вектора элиминируют полностью кодирующие последовательности Е 1 А и большую часть кодирующей последовательности Е 1 В. Оба вектора содержат трансгенные вставки,клонированные в антисмысловой ориентации относительно аденовирусных последовательностей. Следовательно, в случае нежелательной транскрипции с прочитыванием терминатора аденовирусный транскрипт был бы антисмысловым и не экспрессировал вирусные белки. Плазмиду, содержащую ген FGF-5,котрансфицировали (путем осаждения с фосфатом кальция) в клетки 293 с плазмидой JM17(pJM17), которая содержала полный геном человеческого аденовируса 5 с дополнительной вставкой в 4,3 т.н., делающей плазмиду pJM17 слишком большой для инкапсуляции в зрелые аденовирусные вирионы. Затем клетки покрывали питательной агарозной средой. Инфекционные вирусные частицы, содержащие ангиогенный ген, генерировали путем гомологичной спасательной рекомбинации в клетках 293 и выделяли в виде единичных бляшек 10-12 днями позже. (Идентификация удачного рекомбинантного вируса может быть также проведена путем котрансфекции и липофекции и непосредственного наблюдения за цитопатическим эффектом с помощью микроскопии, как описано Zhang et al., Biotechniques, 15 (5), 868-872,1993). Полученные аденовирусные векторы содержат трансген, но лишены последовательностей Е 1 А/Е 1 В и вследствие этого являются дефектными по репликации. Аденовирусный вектор, несущий ген FGF-5, обозначен здесь также как AdFGF-5. Хотя эти рекомбинантные аденовирусы не реплицируются в клетках млекопитающих, они могут размножаться в клетках 293, которые трансформированы с помощью генов Е 1 А/Е 1 В,
МПК / Метки
МПК: A61P 9/04, A61K 48/00, C12N 15/12
Метки: методы, доставки, недостаточности, коррекции, ангиогенных, трансгенов, путем, составы, вентрикулярной, лечения, сердечной
Код ссылки
<a href="https://eas.patents.su/30-5157-metody-i-sostavy-dlya-lecheniya-serdechnojj-nedostatochnosti-i-ventrikulyarnojj-korrekcii-putem-dostavki-in-vivo-angiogennyh-transgenov.html" rel="bookmark" title="База патентов Евразийского Союза">Методы и составы для лечения сердечной недостаточности и вентрикулярной коррекции путем доставки in vivo ангиогенных трансгенов</a>
Предыдущий патент: 13-членные азалиды и их применение в качестве антибиотических агентов
Следующий патент: Применение ингибиторов cyp2d6 в комбинированных способах лечения
Случайный патент: Установка и способ обработки пара сжиженного природного газа