Соединения, модулирующие активность ppar&gamma
Номер патента: 4887
Опубликовано: 26.08.2004
Авторы: Рубенштейн Стивен М., Синкаи Хисаси, Макджи Лоренс Р., Фурукава Нобору, Хагивара Ацуси, Хауз Джонатан Б.
Формула / Реферат
1. Соединение формулы
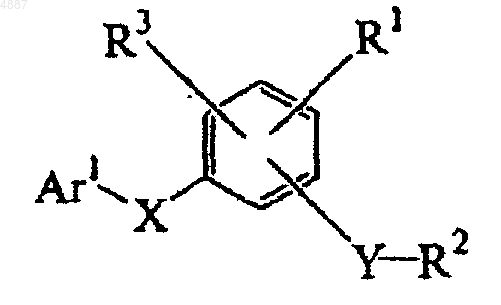
где Ar1 представляет собой незамещенный 2-бензотиазолил или замещенный 2-бензотиазолил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
X представляет собой -S(O)k-, где индекс k представляет собой целое число от 0 до 2;
Y представляет собой двухвалентный мостик, выбранный из группы, состоящей из (C1-C6)алкилена, -O-, -C(O)-, -N(R12)-S(O)m-, -N(R12)-S(O)m-N(R13)-, -N(R12)C(O)-, -S(O)n-, где R12 и R13 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила и арил(C1-C4)алкила; и индексы m и n независимо являются целыми числами от 0 до 2;
R1 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C2-C8)гетероалкила, арила, арил(C1-C4)алкила, галогена, циано, нитро, (C1-C8)алкила, (C1-C8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)p-R14, -S(O)q-NR15R16, -O-C(O)-OR17, -O-C(O)-R17, -O-C(O)-NR15R16, -N(R14)-C(O)-NR15R16, -N(R14)-C(O)-R17 и -N(R14)-C(O)-OR17; где
R14 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила;
R15 и R16 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо;
R17 представляет собой заместитель, выбранный из группы, состоящей из (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила;
индекс p представляет собой целое число от 0 до 3 и
индекс q представляет собой целое число от 1 до 2;
R2 представляет собой незамещенный арил или замещенный арил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
R3 представляет собой заместитель, выбранный из группы, состоящей из галогена, циано, нитро и (C1-C8)алкокси;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором R2 представляет собой замещенный или незамещенный арил, выбранный из группы, состоящей из фенила, пиридила, нафтила и пиридазинила, и имеющий от 0 до 3 заместителей, независимо выбранных из группы, включающей -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил.
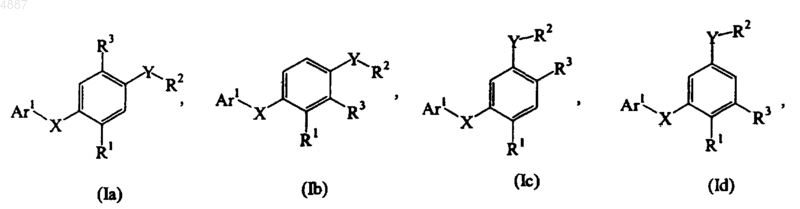
3. Соединение по п.1, представленное формулой, выбранной из группы, состоящей из

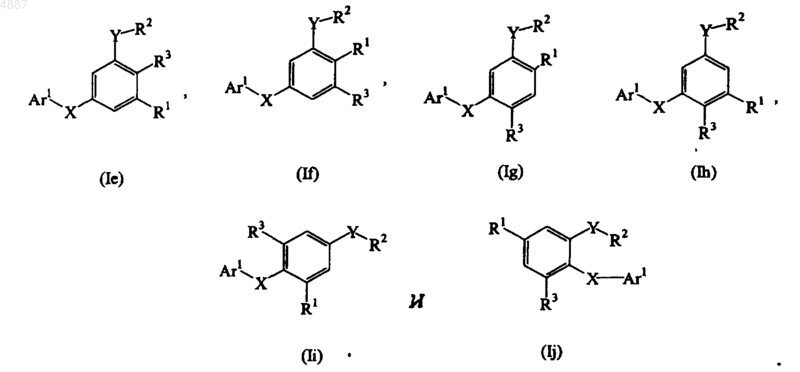
4. Соединение по п.1, представленное формулой, выбранной из группы, состоящей из
5. Соединение по п.4, в котором X представляет собой -S-; Y представляет собой -N(R12)-S(O)2-, где R12 представляет собой заместитель, выбранный из группы, состоящей из водорода и (C1-C8)алкила;
R1 представляет собой заместитель, выбранный из группы, состоящей из водорода, галогена, (C1-C8)алкила, (C2-C8)гетероалкила, (C1-C8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)p-R14, -S(O)q-NR15R16, -O-C(O)-R17 и -N(R14)-C(O)-R17; где
R14 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, гетеро(C2-C8)алкила, арила и арил(C1-C4)алкила;
R15 и R16 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо;
R17 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила;
индекс p представляет собой целое число от 0 до 2;
индекс q представляет собой 2; и
R2 представляет собой незамещенный или замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где
R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
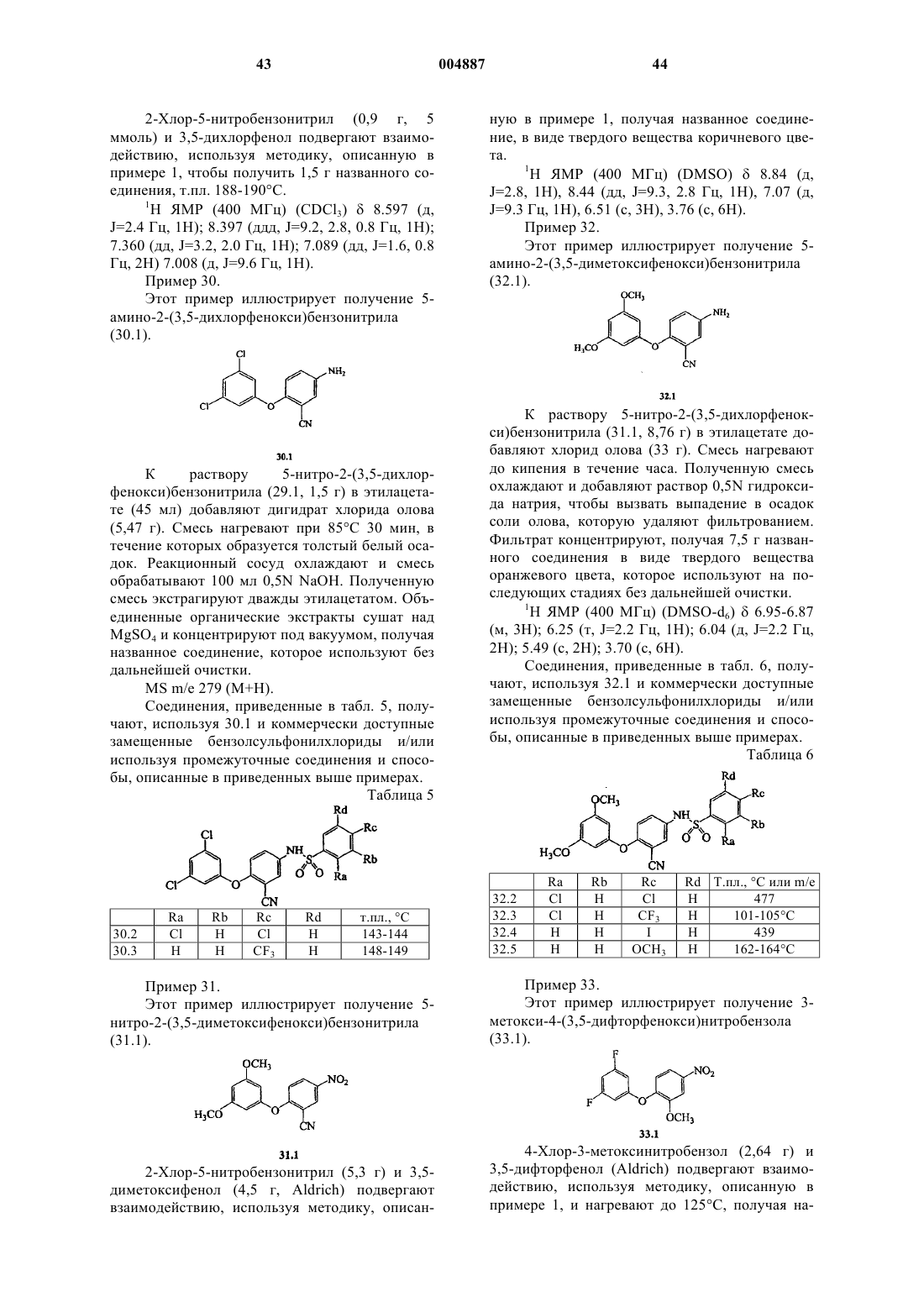
R3 представляет собой заместитель, выбранный из группы, состоящей из галогена, и (C1-C8)алкокси.
6. Соединение по п.5, в котором X представляет собой -S-; Y представляет собой -NH-SO2; R1 является заместителем, выбранным из группы, состоящей из галогена, (C1-C8)алкила, (C2-C8)гетероалкила, (C1-C8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)p-R14 и S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C8)алкила, -C(O)-(C1-C8)алкила, CN, -CF3, (C1-C8)алкила и -NH2; и R3 является заместителем, выбранным из группы, состоящей из галогена, метокси и трифторметокси.
7. Соединение по п.6, в котором Ar1 представляет собой бензотиазолильную группу, имеющую от 1 до 3 заместителей, независимо выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C6)алкила, -CF3, (C1-C8)алкила и -NO2; R1 представляет собой заместитель, выбранный из группы, состоящей из галогена, (C1-C8)алкила, (C2-C8)гетероалкила и (C1-C8)алкокси; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C8)алкила, -C(O)-(C1-C8)алкила, -CN, -CF3, (C1-C8)алкила и -NH2; и R3 является заместителем, выбранным из группы, состоящей из галогена, метокси и трифторметокси.
8. Соединение по п.1, имеющее формулу
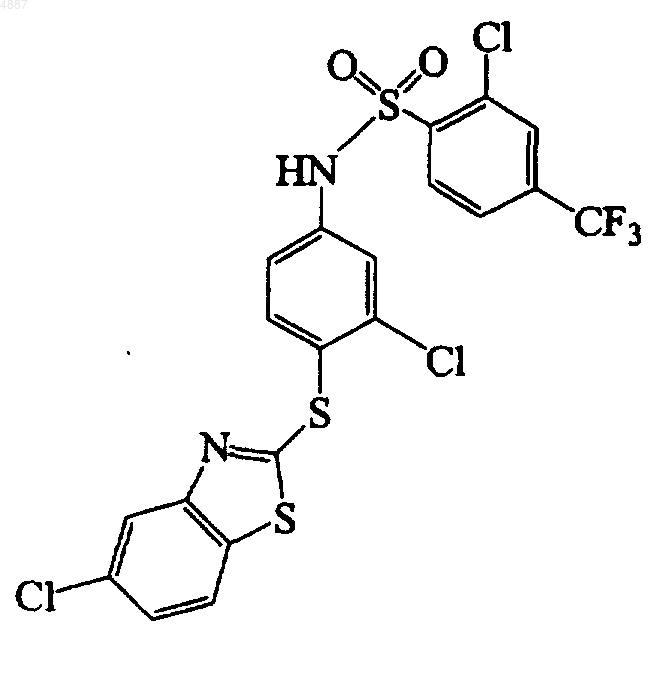
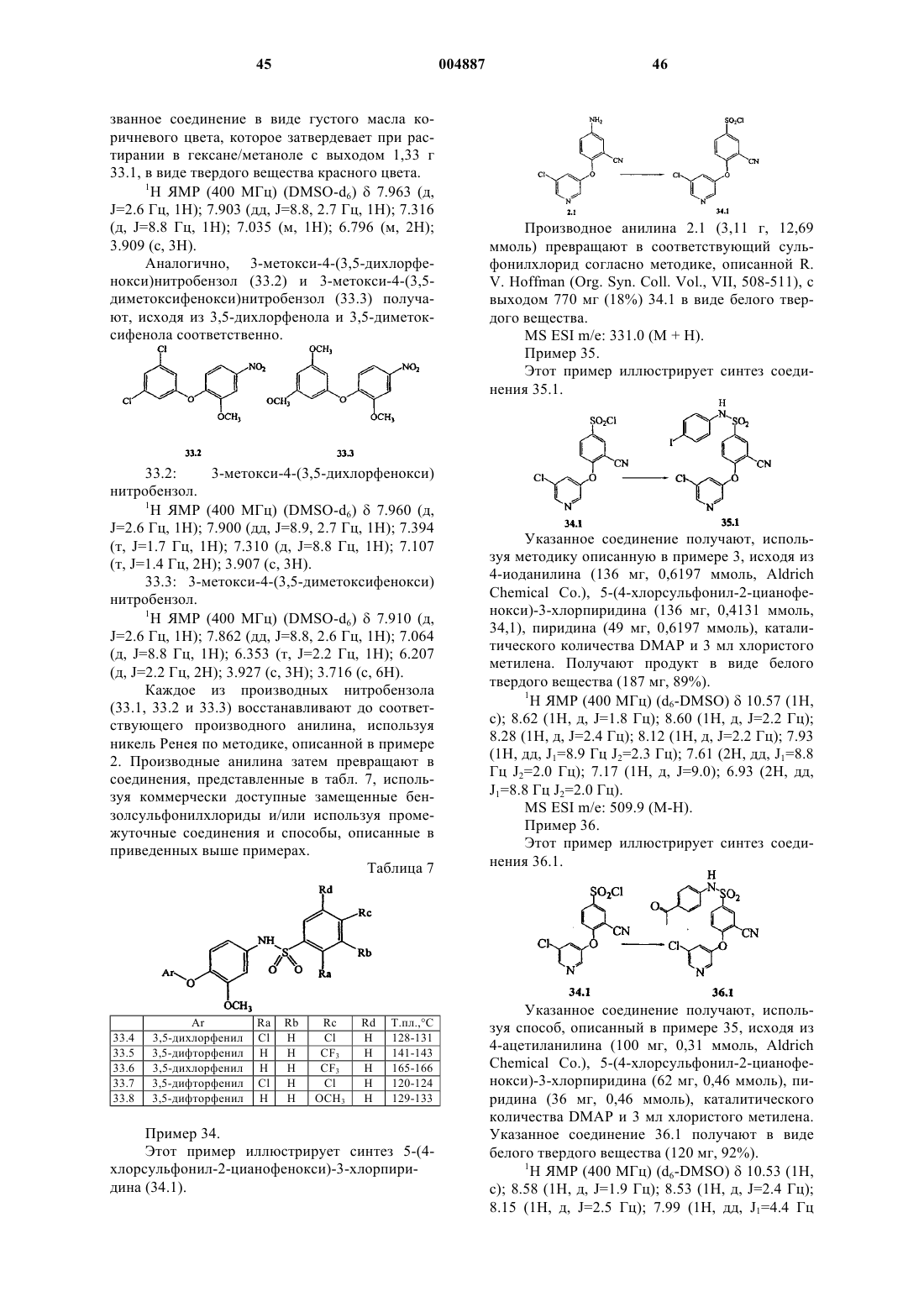
9. Соединение формулы

где Ar1 представляет собой незамещенный 3-хинолинил или замещенный 3-хинолинил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
X представляет собой двухвалентный мостик, выбранный из группы, состоящей из (C1-C6)алкилена, (C1-C6)алкиленокси, (C1-C6)алкиленамина, (C1-C6)алкилен-S(O)k-, -O-, -C(O)-, -N(R11)-, -N(R11)C(O)-, -S(O)k- и простой связи, где
R11 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила и арил(C1-C4)алкила,
индекс k представляет собой целое число от 0 до 2;
Y представляет собой двухвалентный мостик, выбранный из группы, состоящей из (C1-C6)алкилена, -O-, -C(O)-, -N(Rl2)-S(O)m-, -N(R12)-S(O)m-N(R13)-, -N(R12)C(O)-, -S(O)n-, где R12 и R13 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила и арил(C1-C4)алкила; и
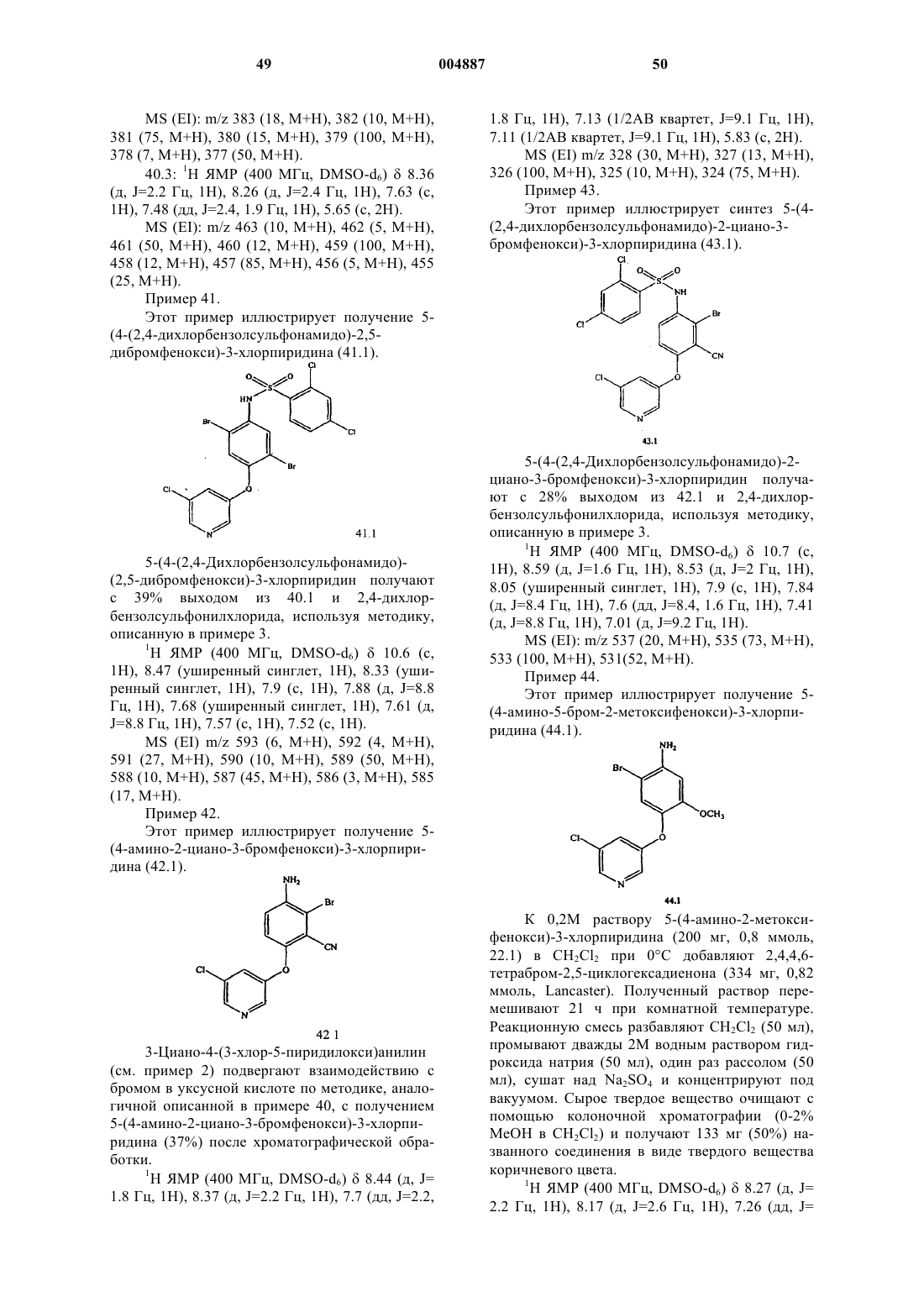
индексы m и n независимо являются целыми числами от 0 до 2;
R1 представляет собой заместитель, выбранный из группы, состоящей из (C2-C8)гетероалкила, арила, арил(C1-C4)алкила, галогена, циано, нитро, (C1-C8)алкила, (C1-C8)алкокси, -C(O)R14, CO2R14, -C(O)NR15R16, -S(O)P-R14, -S(O)q-NRl5R16, -O-C(O)-OR17, -O-C(O)-R17, -O-C(O)-NR15R16, -N(R14)-C(O)-NR15R16, -N(Rl4)-C(O)-R17 и -N(R14)-C(O)-OR17; где
R14 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила;
R15 и R16 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо;
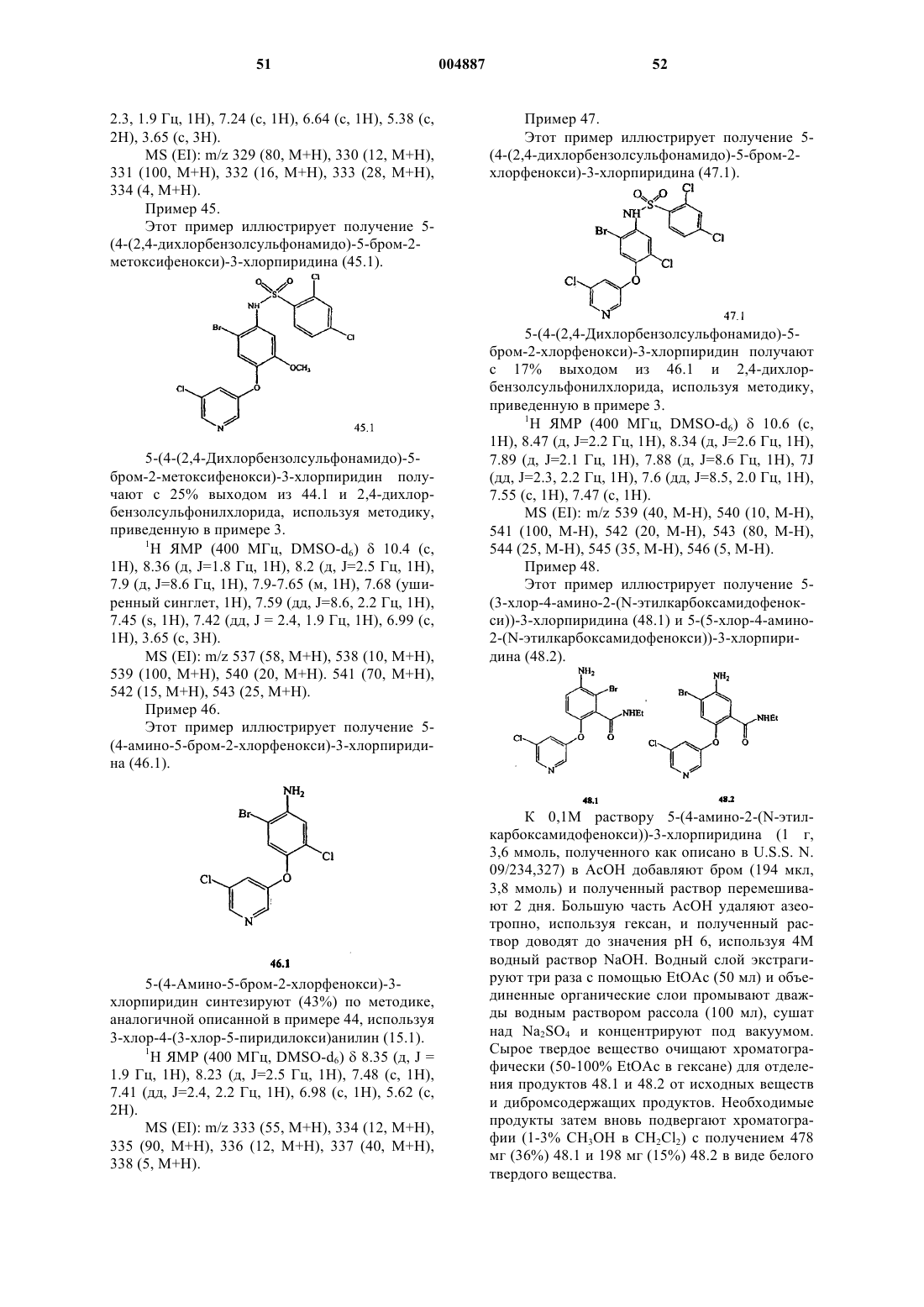
R17 представляет собой заместитель, выбранный из группы, состоящей из (C1-C8)алкила, (C2-C8)гетероалкила, арила и арил(C1-C4)алкила;
индекс p представляет собой целое число от 0 до 3 и
индекс q представляет собой целое число от 1 до 2;
R2 представляет собой незамещенный арил или замещенный арил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где
R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
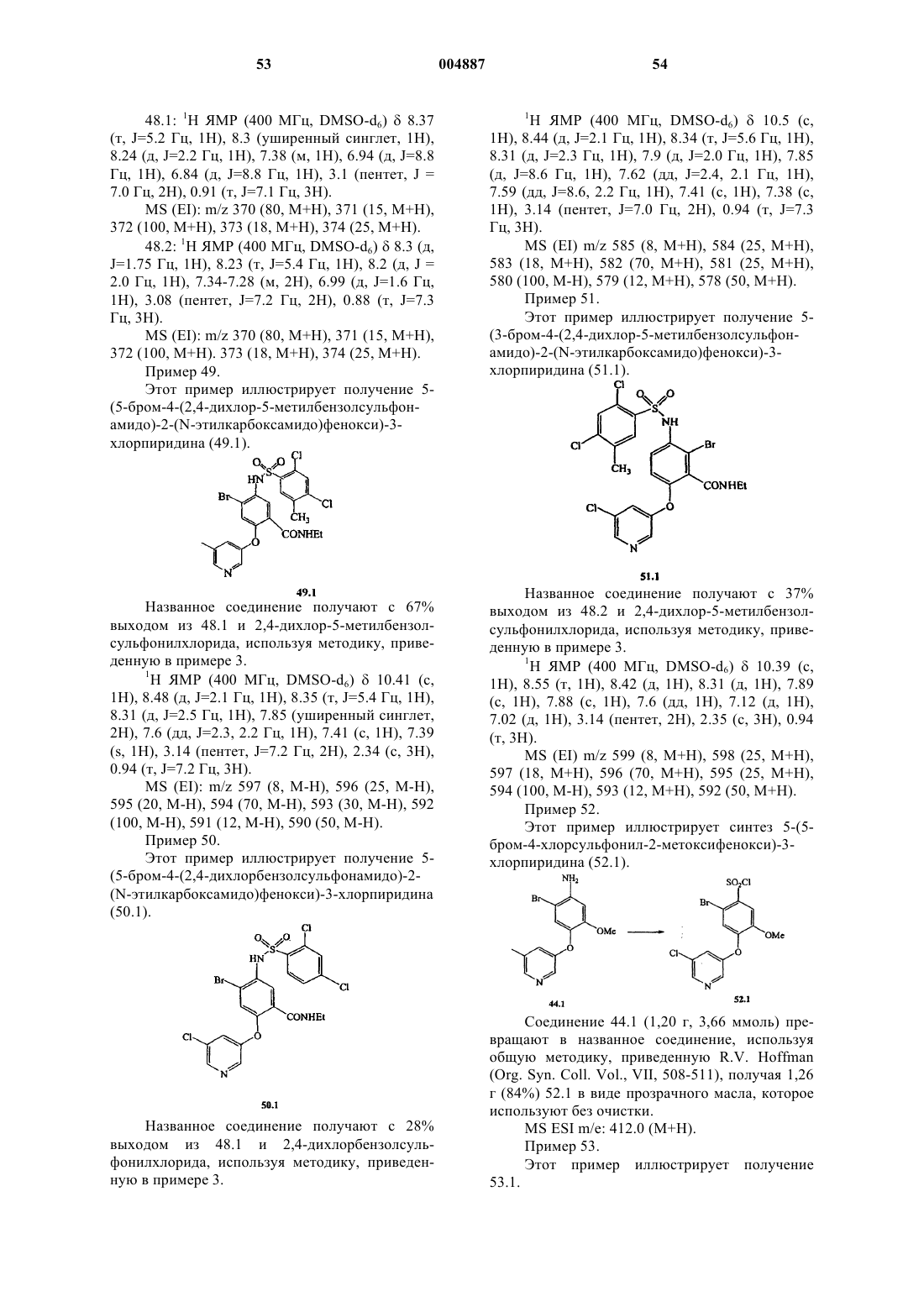
R3 представляет собой заместитель, выбранный из группы, состоящей из галогена, циано, нитро и (C1-C8)алкокси;
или его фармацевтически приемлемая соль.
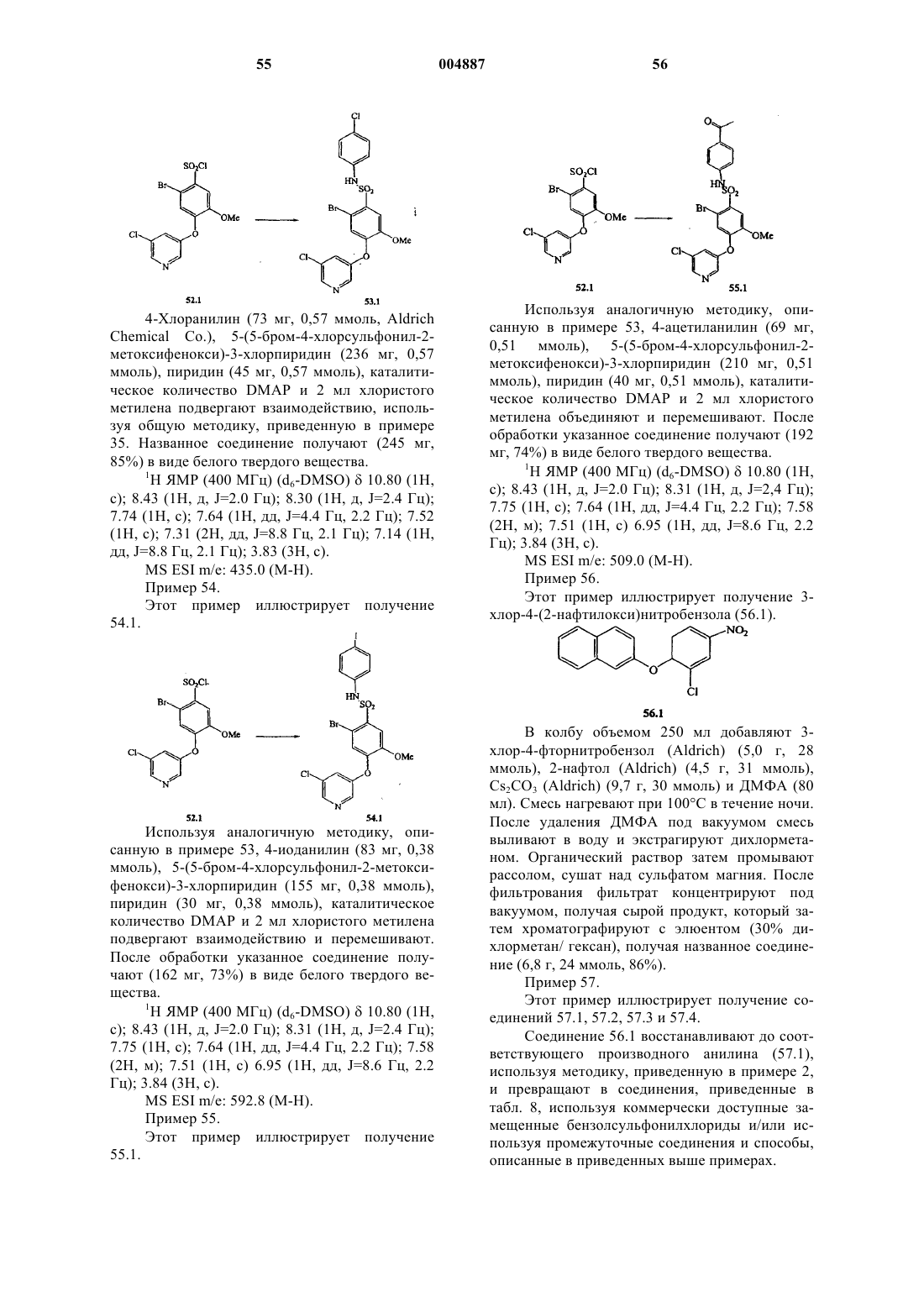
10. Соединение по п.9, в котором R2 представляет собой замещенный или незамещенный арил, выбранный из группы, состоящей из фенила, пиридила, нафтила и пиридазинила, и имеющий от 0 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил.
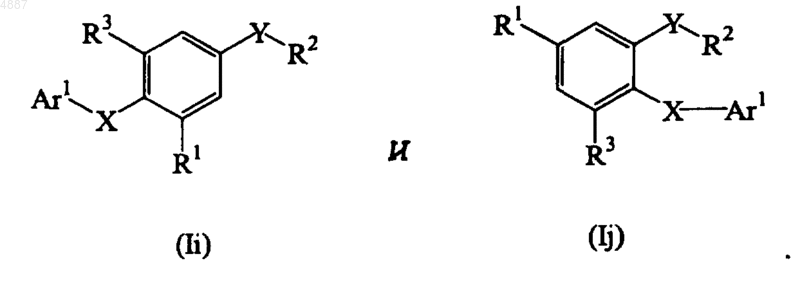
11. Соединение по п.9, представленное формулой, выбранной из группы, состоящей из
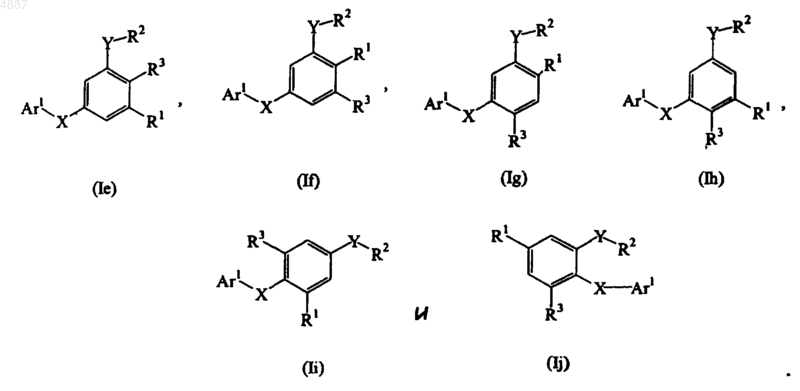
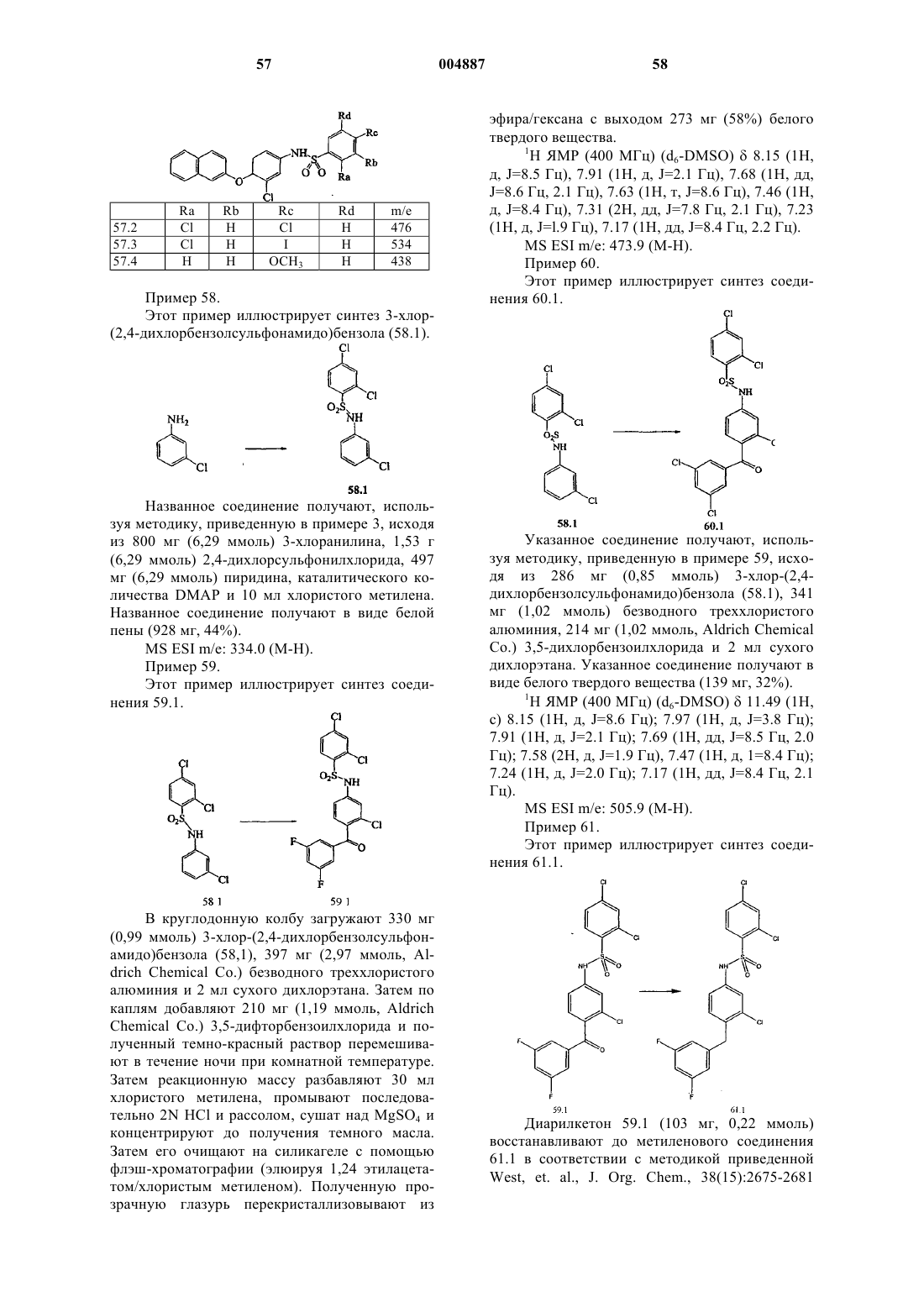
12. Соединение по п.9, представленное формулой, выбранной из группы, состоящей из
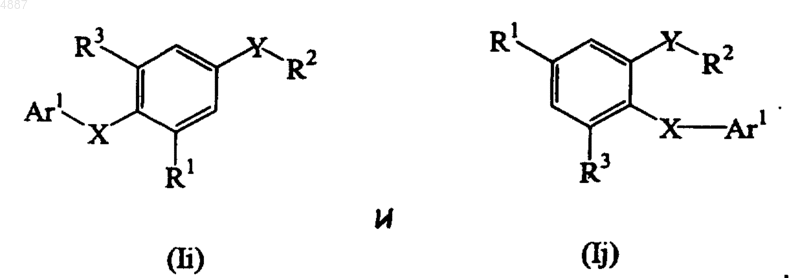
13. Соединение по п.12, в котором X представляет собой двухвалентный мостик, выбранный из группы, состоящей из -CH2-, -CH(CH3)-, -O-, -C(O)-, -N(R11)- и -S-; где
R11 представляет собой заместитель, выбранный из группы, состоящей из водорода и (C1-C8)алкила;
Y представляет собой -N(R12)-S(O)2-, где
R12 представляет собой заместитель, выбранный из группы, состоящей из водорода и (C1-C8)алкила;
R1 представляет собой заместитель, выбранный из группы, состоящей из галогена, (C1-C8)алкила, (C2-C8)гетероалкила, (C1-C8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)p-R14, -S(O)q-NR15R16, -O-C(O)-R17 и -N(R14)-C(O)-R17; где
R14 представляет собой заместитель, выбранный из группы, состоящей из водорофр, (C1-C8)алкила, гетеро(C2-C8)алкила, арила и арил(C1-C4)алкила;
R15 и R16 являются заместителями, независимо выбранными из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо;
R17 представляет собой заместитель, выбранный из группы, состоящей из водорода, (C1-C8)алкила, (C2-C8)гетероалкила;
индекс p представляет собой целое число от 0 до 2;
индекс q представляет собой 2; и
R2 представляет собой незамещенный или замещенный фенил, имеющий от 1 до 3 заместителей, независимо выбранных из группы, включающей галоген, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R", -C(O)R', -NR"C(O)R', -S(O2)R', -S(O)2NR'R", перфтор(C1-C4)алкокси и перфтор(C1-C4)алкил, где
R' и R" являются независимо выбранными из группы, включающей водород, (C1-C8)алкил, гетероалкил, незамещенный арил, (незамещенный арил)-(C1-C4)алкил и (незамещенный арил)окси-(C1-C4)алкил;
R3 представляет собой заместитель, выбранный из группы, состоящей из галогена, и (C1-C8)алкокси.
14. Соединение по п.13, в котором X представляет собой -O-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 является заместителем, выбранным из группы, состоящей из галогена, (C1-C8)алкила, (C2-C8)гетероалкила, (C1-C8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)p-R14 и S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C8)алкила, -C(O)-(C1-C8)алкила, -CN, -CF3, (C1-C8)алкила и -NH2; и R3 является заместителем, выбранным из группы, состоящей из галогена, метокси и трифторметокси.
15. Соединение по п.14, в котором Ar1 представляет собой 3-хинолильную группу, имеющую от 0 до 3 заместителей, независимо выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C6)алкила, -CF3, (C1-C8)алкила и -NO2; R1 представляет собой заместитель, выбранный из группы, состоящей из галогена, (C1-C8)алкила, (C2-C8)гетероалкила и (C1-C8)алкокси; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из группы, состоящей из галогена, -OCF3, -OH, -O(C1-C8)алкила, -C(O)-(C1-C8)алкила, -CN, -CF3, (C1-C8)алкила и -NH2; и R3 является заместителем, выбранным из группы, состоящей из галогена, метокси и трифторметокси.
16. Соединение по п.15, имеющее формулу
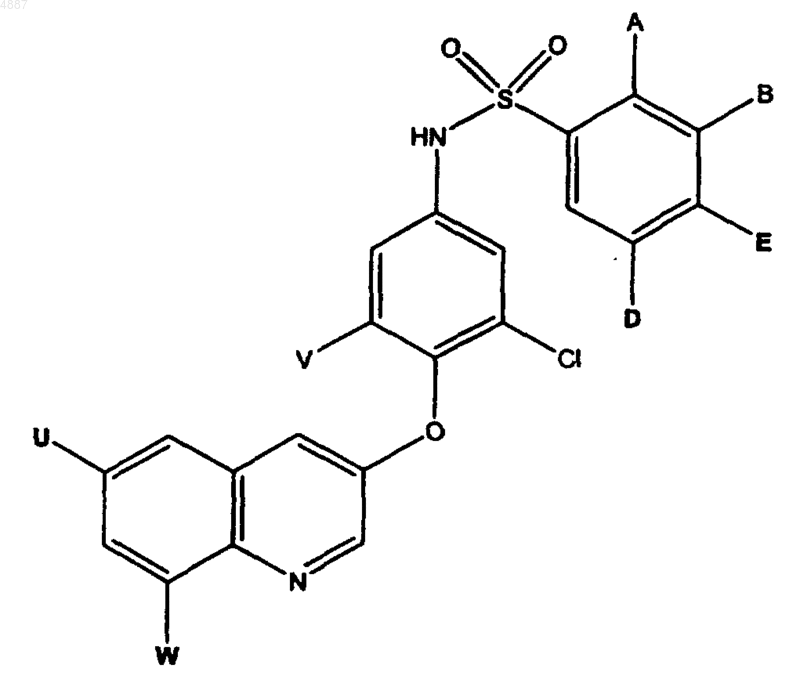
где A представляет собой заместитель, выбранный из группы, состоящей из H, Cl и CF3;
B представляет собой заместитель, выбранный из группы, состоящей из H и Cl;
E представляет собой заместитель, выбранный из группы, состоящей из H, Cl и CF3;
D представляет собой заместитель, выбранный из группы, состоящей из H и CH3;
V представляет собой заместитель, выбранный из группы, состоящей из F и Cl;
U представляет собой заместитель, выбранный из группы, состоящей из H, CH3 и CO2CH3; и
W представляет собой заместитель, выбранный из группы, состоящей из H, Cl, CO2H и CO2CH3.
17. Соединение по п.16, в котором A выбирают из группы, состоящей из Cl и CF3; B представляет собой H; E выбирают из группы, состоящей из Cl и CF3; D представляет собой H; V представляет собой Cl и U и W каждый представляет собой H.
18. Соединение по п.17, в котором A выбирают из группы, состоящей из Cl и CF3; B представляет собой H; E представляет собой Cl; D представляет собой H; V представляет собой Cl и U и W каждый представляет собой H.
19. Соединение по п.17, в котором A представляет собой Cl; B представляет собой H; E представляет собой Cl; D представляет собой H; V представляет собой Cl и U и W каждый представляет собой H.
20. Соединение по п.16, в котором A представляет собой Cl; B представляет собой H; E представляет собой Cl; D представляет собой M; V представляет собой F или Cl и U и W каждый представляет собой H.
21. Соединение по п.9, имеющее формулу
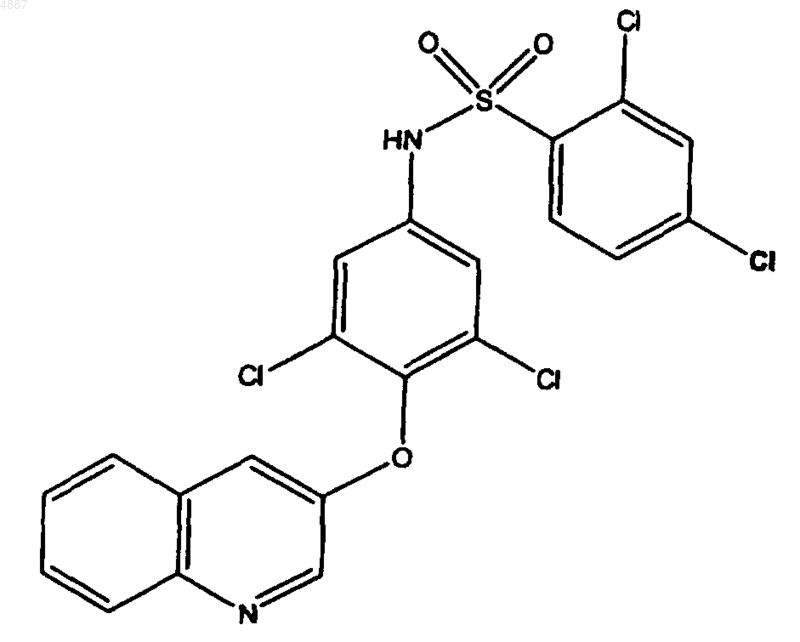
или его фармацевтически приемлемая соль.
22. Соединение по любому из пп.1-21, являющееся модулятором PPARg и имеющее ИК50 менее чем 1 мкМ.
23. Композиция, содержащая фармацевтически приемлемый носитель и соединение по любому из пп.1-21.
24. Композиция по п.23, выполненная в виде дозированной формы.
25. Композиция по п.24, которая предназначена для орального введения.
26. Композиция по п.23, содержащая соединение, охарактеризованное в п.21.
27. Применение соединения по любому из пп.1-21 в эффективном количестве для изготовления медикамента для предотвращения или лечения состояний, вызываемых PPARg в организме.
28. Применение по п.27, в котором указанным организмом является млекопитающее, выбранное из группы, состоящей из человека, собаки, обезьяны, мыши, крысы, лошади и кошки.
29. Применение по п.28, где млекопитающим является человек.
30. Применение по п.27, где медикаментом является медикамент для предотвращения возникновения состояния, вызываемого PPARg .
31. Применение по п.27, где указанное состояние выбирают из группы, состоящей из NIDDM, ожирения, гиперхолестеринемии, гиперлипидемии, гиперлипопротеинемии и воспалительных состояний.
32. Применение по п.27, где указанное состояние является метаболическим расстройством или воспалительным состоянием.
33. Применение по п.27, где указанное состояние выбирают из группы, состоящей из ревматоидного артрита и атеросклероза в организме.
34. Применение по п.33, где названным организмом является млекопитающее, выбранное из группы, состоящей из человека, собаки, обезьяны, мыши, крысы, лошади, кошки.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение касается соединений, которые модулируют активность рецептораPPAR и используются для диагностики и лечения диабета типа II (и его осложнений), гиперхолестеринемии (и заболеваний, связанных с патологически повышенным или пониженным уровнем липопротеинов или триглицеридов в плазме), а также воспалительных заболеваний. Уровень техники Пероксисомальные пролифераторноактивируемые рецепторы (PPARs) представляют собой преобразующие белки, принадлежащие к суперсемейству стероидных/тироидных/ретиноидных рецепторов. PPARs были первоначально идентифицированы как рецепторы без известных лигандов, но получили свое название, исходя из их способности регулировать множественные воздействия пероксисомальных пролифераторов жирных кислот. Эти рецепторы действуют так, как регулируемые лигандом факторы транскрипции, которые управляют экспрессией целевых генов, связываясь с определенной последовательностью ДНК в виде гетеродимеров с RXR. Целевые гены кодируют ферменты, участвующие в липидном обмене и дифференцировании жировых клеток. Соответственно, открытие факторов транскрипции, участвующих в управлении липидным обменом,помогло понять механизм регулирования энергетического гомеостаза у позвоночных животных и затем обеспечило новые мишени для разработки терапевтических агентов против таких заболеваний, как ожирение, диабет и дислипидемия.PPAR является одним из членов суперсемейства ядерных рецепторов ряда лигандактивируемых факторов транскрипции и было показано, что он специфическим образом экспрессируется в жировой ткани. Его экспрессия индуцируется по ходу раннего дифференцирования нескольких линий жирообразующих клеток в жировые клетки. В настоящее время дополнительные исследования показали, чтоPPAR играет основную роль в жирообразующем сигнальном каскаде. PPAR также регулирует ob/leptin ген, который участвует в регулировании энергетического гомеостаза и дифференцировании жировых клеток, которое является критической стадией для борьбы с ожирением и диабетом. В попытке понять роль PPAR в дифференцировании жировых клеток исследования были направлены на идентификацию активаторов PPAR. При этом было продемонстрировано, что соединения, относящиеся к классу тиазолидиндионов, которые, как известно, оказывают способствующее жирообразованию воздействие на жирообразующие клетки и мезенхимные исходные клетки in vitro, а также анти 004887 2 диабетическое воздействие в животных моделях инсулиннезависимого сахарного диабета(NIDDM), могут быть PPAR-селективными лигандами. Еще раньше было показано, что соединения, которые селективно активируют мышиный PPAR, обладают антидиабетической активностью in vivo у мышей. Несмотря на успехи, достигнутые при помощи антидиабетических препаратов класса тиазолидиндионов, недопустимые побочные эффекты ограничивают их клиническое использование. Соответственно сохраняется потребность в создании мощных, селективных активаторов PPAR, которые будут полезными для лечения NIDDM и других заболеваний, связанных с энергетическим гомеостазом и липидным обменом. Более того, соединения, которые блокируют активность PPAR, были бы полезны для предотвращения созревания жировых клеток из жирообразующих клеток и, таким образом, были бы полезны для лечения ожирения и других болезней, связанных с нежелательным созреванием жировых клеток. Таким образом,настоящее изобретение предлагает соединения,которые являются полезными и как активаторы,и как антагонисты активности PPAR, а также содержащие их композиции, наряду с методами их использования. Сущность изобретения В соответствии с одним из аспектов, настоящее изобретение обеспечивает способы модулирования состояний, которые связаны сPPAR. Обычно эти способы включают контактирование организма с PPAR-модулирующим количеством соединения, имеющим формулу где символ Аr1 представляет собой замещенную или незамещенную арильную группу; X представляет собой двухвалентный мостик, выбранный из группы, состоящей из замещенного или незамещенного -(С 1-С 6)алкилена, замещенного или незамещенного -(С 1-С 6)алкиленокси, замещенного или незамещенного -(С 1-С 6)алкиленамино, замещенного или незамещенного -(С 1 С 6)алкилен-S(О)k-,-О-,С(О)-,N(R11)-,11-N(R )C(O)-, -S(O)k- и простой связи, где R11 является заместителем, выбранным из группы,состоящей из водорода, (C1-C8)алкила, (С 2 С 8)гетероалкила и арил(С 1-С 4)алкила и индекс k представляет собой целое число от 0 до 2. Y в приведенной выше формуле представляет собой двухвалентный мостик, в любой ориентации,выбранный из группы, состоящей из замещенного или незамещенного (С 1-С 6)алкилена, -О-,-С(О)-, -N(R12)-S(O)m, -N(RI2)C(O)-, -N(R12)S(O)m(R13)-, -S(O)n-, простой связи и их комби 3 наций, где R12 и R13 являются заместителями,независимо выбранными из группы, состоящей из водорода, замещенного или незамещенного(С 2-С 8)гетероалкила и арил(С 1-С 4)алкила; и индексы m и n независимо являются целыми числами от 0 до 2.-C(O)NR R , -C(O)R , -S(O)P-R , -S(O)qNR15R16, -O-C(O)-OR17, -O-C(O)-R17, -O-C(O)NR15R16, -N(R14)-C(O)-NR15R16, -N(R14)-C(O)-R17 и -N(R14)-C(O)-OR17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода,(С 1-С 8)алкила, (С 2-С 8)гетероалкила, арила и арил(С 1-С 4)алкила, или взятые вместе с азотом,к которому они оба присоединены, образуют 5-,6- или 7-членное кольцо; и R17 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила. Во всех определениях заместителей, например алкила, алкокси и гетероалкила, группы могут быть замещенными или незамещенными.R2 представляет собой замещенную или незамещенную арильную группу. Предпочтительно R2 представляет собой фенильную, нафтильную, пиридазинильную или пиридильную группу. Более предпочтительно R2 представляет собой фенильную, нафтильную, пиридазинильную или пиридильную группу, замещенную 0-3 заместителями, выбранными из галогена, -OCF3,-ОН, -О(С 1-С 8)алкила, -CN, -CF3, -С(О)-(С 1 С 8)алкила, -(С 1-С 8)алкила и -NH2. Несмотря на то, что приведены определенные предпочтительные заместители (например, -OCF3 и -CF3),подразумевается, что определения алкил и алкокси также включают их производные, предпочтительно галогензамещенные производные,включая те, которые отмечены особо.R3 представляет собой галоген, циано,нитро или замещенную или незамещенную (С 1 С 8)алкоксигруппу, предпочтительно галоген,циано или (C1-С 4)алкоксигруппу. Наиболее предпочтительно галоген, метокси или трифторметокси. В другом аспекте настоящее изобретение обеспечивает соединения формулы, приведенной выше, а также фармацевтические композиции, содержащие описанные выше соединения. Подробное описание изобретения Сокращения и определения. В описании используют следующие сокращения: PPAR: пероксисомальный пролифераторно-активируемый рецептор ; NIDDM: инсулиннезависимый сахарный диабет; Et3N: 4 триэтиламин; МеОН: метанол и ДМСО: диметилсульфоксид. Термин "алкил" сам по себе или как часть другого заместителя означает, если не утверждается другое, прямую или разветвленную цепь или циклический углеводородный радикал или их комбинацию, которые могут быть полностью насыщенными, моно- или полиненасыщенными и могут включать ди- и поливалентные радикалы, имеющие указанное число атомов углерода (т.е. C1-С 10 означает от одного до десяти атомов углерода). Примеры насыщенных углеводородных радикалов включают такие группы, как метил, этил, н-пропил, изопропил,н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)этил, циклопропилметил, их гомологи и изомеры, например, нпентил, н-гексил, н-гептил, н-октил и тому подобное. Ненасыщенная алкильная группа - это такая группа, которая имеет одну или более двойных или тройных связей. Примеры ненасыщенных алкильных групп включают винил,2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил),этинил, 1- и 3-пропинил, 3-бутинил и их высшие гомологи и изомеры. Подразумевается, что термин "алкил", если не указано другое, также включает те алкильные производные, которые более подробно определены ниже как "гетероалкил," "циклоалкил" и "алкилен". Термин "алкилен" сам по себе или как часть другого заместителя означает двухвалентный радикал, являющийся производным алкана, например,-СН 2 СН 2 СН 2 СН 2-. Обычно алкильная группа содержит от 1 до 24 атомов углерода, при этом те группы, которые содержат 10 или менее атомов углерода, являются предпочтительными в соответствии с настоящим изобретением. "Низший алкил" или "низший алкилен" представляет собой алкильную или алкиленовую группу с короткой цепью, обычно содержащую восемь или менее атомов углерода. Термин "гетероалкил" сам по себе или в комбинации с другим термином означает, если не утверждается другое, устойчивую прямую или разветвленную цепь или циклический углеводородный радикал, или их комбинации, состоящие из указанного числа атомов углерода и от одного до трех гетероатомов, выбранных из группы, состоящей из О, N, Si и S, и при этом атомы азота и серы необязательно окислены и гетероатом азота может быть необязательно кватернизованным. Гетероатом(ы) О, N и S могут находиться в любом внутреннем положении гетероалкильной группы. Гетероатом Si может находиться в любом положении гетероалкильной группы, включая положение, которым алкильная группа присоединяется к остатку молекулы. Примеры включают -СН 2-СН 2-О-СН 3,-СН 2-СН 2-NH-СН 3, -CH2-CH2-N(CH3)-CH3, -CH2S-CH2-CH3, -CH2-CH2-S(O)-CH3, -CH2-CH2S(O)2-СН 3, -СН=СН-О-СН 3, -Si(CH3)3, -CH2 5CH=N-OCH3 и -CH=CH-N(CH3)-CH3. Последовательно могут располагаться вплоть до двух гетероатомов, так как, например, -CH2-NHOCH3 и -CH2-O-Si(CH3)3. Кроме того, термин"гетероалкил" включает радикалы, которые описаны ниже более детально как "гетероалкилен" и "гетероциклоалкил". Термин "гетероалкилен" сам по себе или как часть другого заместителя, означает двухвалентный радикал, являющийся производным гетероалкила, как, например, -CH2-CH2-S-CH2CH2- и -CH2-S-CH2CH2-NH-CH2-. В гетероалкиленовых группах гетероатомы могут также занимать либо один из концов цепи, либо оба. Кроме того, для алкиленовых и гетероалкиленовых мостиковых групп,а также всех остальных мостиковых групп по настоящему изобретению ориентация мостиковой группы не имеет значения. Термины "циклоалкил" и "гетероциклоалкил" сами по себе или в комбинации с другими терминами представляют собой, если не утверждается другое, циклические производные соответственно "алкила" и "гетероалкила". Кроме того, в гетероциклоалкиле гетероатом может занимать положение, которым гетероцикл присоединен к остатку молекулы. Примеры циклоалкилов включают циклопентил, циклогексил,1-циклогексенил, 3-циклогексенил, циклогептил и тому подобное. Примеры гетероциклоалкилов включают 1-(1,2,5,6-тетрагидропиридил), 1 пиперидинил, 2-пиперидинил, 3-пиперидинил,4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиенил-2-ил, тетрагидротиен-3-ил, 1-пиперазинил,2-пиперазинил и тому подобное. Термины "гало" или "галоген" сами по себе или как часть другого заместителя означают,если не утверждается другое, атом фтора, хлора,брома или иода. Кроме того, такие термины, как"фторалкил", означают, что они включают монофторалкил и полифторалкил. Термин "арил", используемый сам по себе или в комбинации с другими терминами (например, арилокси, арилтиокси, арилалкил), означает, если не утверждается другое, ароматический заместитель, который может быть одним кольцом или системой колец (до трех колец),которые могут быть сконденсированы или связаны друг с другом ковалентно. Каждое из колец может содержать от нуля до четырех гетероатомов, выбранных из N, О и S, где атомы азота и серы являются необязательно окисленными и атом(ы) азота являются необязательно кватернизированными. Арильные группы, которые содержат гетероатомы, могут быть определены как "гетероарил" и они могут присоединяться к остатку молекулы через гетероатом. Не ограничивающие примеры арильных групп включают фенил, 1-нафтил, 2-нафтил, 4 бифенил, 1-пирролил, 2-пирролил, 3-пирролил,3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4 004887 6 оксазолил, 5-оксазолил, 3-изоксазолил, 4 изоксазолил, 5-изоксазолил, 2-тиазолил, 4 тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 2-бензотиазолил, 5-бензотиазолил, 2-бензоксазолил, 5 бензоксазолил, пуринил, 2-бензимидазолил, 5 индолил, 1-изохинолинил, 5-изохинолинил, 2 хиноксалинил, 5-хиноксалинил, 3-хинолинил и 6-хинолинил. Заместители для каждых из упомянутых выше арильных кольцевых систем выбраны из групп приемлемых заместителей, описанных ниже. Подразумевается, что термин"арилалкил" включает те радикалы, где арильная группа присоединена к алкильной группе(например, феноксиметил, 2-пиридилоксиметил,3-(1-нафтилокси)пропил и тому подобное). Под каждым из перечисленных выше терминов (например, "алкил", "гетероалкил" и"арил") подразумевается, что они включают как замещенную, так и незамещенную формы указанного радикала. Предпочтительные заместители для каждого типа радикалов определены ниже. Заместители для алкильных и гетероалкильных радикалов (включая те группы, которые часто определяют как алкилен, алкенил,гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил) могут быть разнообразными группами, выбранными из: -OR', =O, =NR', =NOR', -NR'R", -SR', -галогена, -SiR'R"R"',-OC(O)R',-C(O)R',-CO2R',CONR'R",-OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R'",-NR"C(O)2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH,-NH-C(NH2)=NR,-S(O)R,-S(O)2R,-S(O)2NR'R", -CN и -NO2 в количестве от нуля до (2N+1), где N обозначает общее количество атомов углерода в таком радикале. R', R" и R'",каждый независимо, означает водород, незамещенный(С 1-С 8)алкил и гетероалкил, незамещенный арил, арил, замещенный 1-3 галогенами,незамещенный алкил, алкокси- или тиоалкоксигруппу или арил-(С 1-С 4)алкильную группу. Когда R' и R" присоединены к одному атому азота,они могут вместе с этим атомом азота образовывать 5-, 6- или 7-членное кольцо. Например,подразумевается, что -NR'R" включает 1 пирролидинил и 4-морфолинил. Исходя из представленного выше обсуждения, специалист в этой области поймет, что термин "алкил" также включает такие группы, как галогеналкил(например, -CF3 и -CH2CF3) и ацил (например,-С(О)СН 3, -C(O)CF3, -С(О)СН 2 ОСН 3 и тому подобное). Предпочтительно алкильные группы (и соответствующие алкокси, гетероалкильные группы, и так далее) являются незамещенными или имеют от 1 до 3 заместителей, выбранных из галогена, -OR', =O, -NR'R", -SR', -OC(O)R',-C(O)R',-CO2R',-CONR'R",-NR"C(O)R', 7-S(O)2R', -S(O)2NR'R", -CN и -NO2. Более предпочтительно алкильные и соответствующие группы имеют 0, 1 или 2 заместителя, выбранных из галогена, -OR, =O, -NR'R", -SR', -CO2R',-CONR'R", -NR"C(O)R', -CN и -NO2. Аналогично варьируются заместители для арильных групп, и их выбирают из галогена,-OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2-,-CO2R', -CONR'R", -C(O)R', -OC(O)NR'R",-NR"C(O)R', -NRС(O)2R', -NR'-C(O)NR"R'",-NH-C(NH2)=NH,-NR'C(NH2)=NH,-NHC(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -N3,-CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1 С 4)алкила, в количестве, которое находится в интервале от 0 до общего числа свободных валентностей в ароматической кольцевой системе; и где R', R" и R'" независимо выбраны из водорода, (С 1-С 8)алкила и гетероалкила, незамещенного арила, (незамещенный арил)-(С 1-С 4)алкила и (незамещенный арил)окси-(С 1-С 4)алкила. Предпочтительно арильные группы являются незамещенными или имеют от 1 до 3 заместителей, выбранных из галогена, -OR', -OC(O)R',-NR'R", -SR', -R', -CN, -NO2-, -CO2R', -CONR'R",-C(O)R', -NR"C(O)R', -S(O)2R', -S(O)2NR'R",перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила. Еще более предпочтительно арильные группы имеют 0, 1 или 2 заместителя, выбранных из галогена, -OR', -NR'R", -SR', -R', -CN, -NO2-,-CO2R', -CONR'R", -NR"C(O)R', -S(O)2R',-S(O)2NR'R", перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила. Два заместителя у соседних атомов арильного кольца могут быть необязательно замещены заместителем формулы -T-C(O)-(CH2)q-U-,где Т и U независимо представляют собой -NH-,-О-, -СН 2- или простую связь и q является целым числом от 0 до 2. Альтернативно, два заместителя у соседних атомов арильного кольца могут быть необязательно замещены заместителем формулы -А-(СН 2)r-В-, где А и В независимо представляют собой -СН 2-, -О-, -NH-, -S-,-S(O)-, -S(O)2-, -S(O)2NR'- или простую связь и r представляет собой целое число от 1 до 3. Одна из простых связей полученного таким образом нового кольца может быть необязательно заменена двойной связью. Альтернативно, два заместителя у соседних атомов арильного кольца могут быть необязательно заменены заместителем формулы -(CH2)s-X-(CH2)t, где s и t независимо представляют собой целые числа от 0 до 3,и X представляет собой -О-, -NR'-, -S-, -S(O)-,-S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и-S(O)2NR'- выбран из водорода или незамещенного (С 1-С 6)алкила. Термин "гетероатом" включает кислород"фармацевтически приемлемые соли" включает соли активных соединений с относительно нетоксичными кислотами и основаниями, которые получают в зависимости от конкретных замес 004887 8 тителей, которые присутствуют в описанных здесь соединениях. Когда соединения по настоящему изобретению содержат относительно кислые функциональные группы, могут быть получены основные аддитивные соли при взаимодействии нейтральной формы таких соединений с достаточным количеством желаемых оснований в чистом виде или в пригодном инертном растворителе. Примеры фармацевтически приемлемых основных аддитивных солей включают натриевые, калиевые, кальциевые, аммонийные, аминоорганические или магниевые соли, или им подобные. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, могут быть получены кислотные аддитивные соли при взаимодействии нейтральной формы таких соединений с достаточным количеством желаемой кислоты в чистом виде или в пригодном инертном растворителе. Примеры фармацевтически приемлемых кислотных аддитивных солей включают те, которые образуются из таких неорганических кислот, как соляная, бромоводородная, азотная, угольная, кислая угольная, ортофосфорная, пирофосфорная, метафосфорная,серная, сернистая, иодоводородная или фосфористая кислота и тому подобное, также как и соли, полученные из относительно не токсичных органических кислот, подобных уксусной,пропионовой, изомасляной, щавелевой, малеиновой, малоновой, бензойной, янтарной, субериновой, фумаровой, миндальной, фталевой,бензолсульфоновой, п-толуолсульфоновой, лимонной, винной, метансульфоновой и тому подобное. Кроме того, к ним относятся и соли аминокислот, таких как аргинин и тому подобное, и соли органических кислот, подобных глюкуроновой или галактуроновой кислотам и тому подобное (см., например, Berge S.M., et al.,"Pharmaceutical Salts", Journal of PharmaceuticalScience, 1977, 66, 1-19). Ряд конкретных соединений по настоящему изобретению содержит как кислотную, так и основную функциональные группы, что позволяет превратить эти соединения либо в основные, либо в кислотные аддитивные соли. Нейтральные формы соединений могут быть регенерированы путем обработки соли основанием или кислотой и выделения исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм рядом физических свойств, таких как растворимость в полярных растворителях,но, тем не менее, соли являются эквивалентом исходной формы соединения с точки зрения настоящего изобретения. В дополнение к солевым формам настоящее изобретение обеспечивает соединения в пролекарственной форме. Пролекарства соединений, описанные здесь, это те соединения, которые легко подвергаются химическим превращениям в физиологических условиях с получе 9 нием соединений по настоящему изобретению. Кроме того, пролекарства могут быть превращены в соединения по настоящему изобретению химическими и биохимическими способами в среде ex vivo. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению, когда их помещают в резервуар трансдермального пластыря вместе с пригодным ферментом или химическим реагентом. Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, также как и в сольватированных формах, включая гидратированные формы. В целом, сольватированные формы эквивалентны несольватированным формам и подразумевается, что они входят в рамки настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в многочисленных кристаллических или аморфных формах. В целом, все физические формы эквивалентны с точки зрения использования в соответствии с настоящим изобретением и подразумевается, что они входят в рамки настоящего изобретения. Некоторые соединения по настоящему изобретению содержат асимметрические атомы углерода (оптические центры) или двойные связи; подразумевается, что все рацематы, диастереоизомеры, геометрические изомеры и индивидуальные изомеры входят в рамки настоящего изобретения. Соединения по настоящему изобретению могут также содержать неприродные соотношения атомных изотопов одного или более атомов,из которых состоят эти соединения. Например, в соединения могут быть введены радиоактивные метки с помощью радиоактивных изотопов, таких как, например, тритий (3 Н), иод-125 (125I) или углерод-14 (14 С). Подразумевается, что все изотопные варианты соединений по настоящему изобретению, как радиоактивные, так и нерадиоактивные, входят в рамки настоящего изобретения. Общие положения. В настоящее время открыт новый класс соединений, которые взаимодействуют с PPAR. В зависимости от биологического окружения (например, типа клетки, патологического состояния организма и так далее), эти соединения могут активировать или блокировать активностьPPAR. Активируя рецептор PPAR, соединения будут находить применение в качестве терапевтических агентов, способных модулировать состояния, связанные с рецептором PPAR. Как отмечено выше, примером таких состояний является NIDDM. Кроме того, эти соединения пригодны для предотвращения и лечения осложнений диабета (например, нейропатии, ретинопатии, гломерулосклероза и сердечнососудистых заболеваний) и для лечения гипер 004887 10 липидемии. Кроме того, эти соединения пригодны для модулирования воспалительных состояний, которые, как недавно было обнаружено, регулируются PPAR (см., Ricote, et al., Nature, 391:79-82 (1998) и Jiang, et al., Nature,391:82-86 (1998). Примеры воспалительных состояний включают ревматоидный артрит и атеросклероз. Соединения, которые действуют как антагонисты PPAR, пригодны для лечения ожирения, гипертензии, гиперлипидемии, гиперхолестеринемии, гиперлипопротеинемии и метаболических заболеваний. В одном из аспектов настоящее изобретение обеспечивает соединения, которые представлены формулой В формуле (I) Аr1 представляет собой замещенную или незамещенную арильную группу. Предпочтительно Аr1 представляет собой моноциклическую или конденсированную бициклическую арильную группу, имеющую от нуля до четырех гетероатомов в качестве членов кольца. Более предпочтительно Аr1 представляет собой моноциклическую или конденсированную бициклическую арильную группу, содержащую два конденсированных шестичленных кольца, два конденсированных пятичленных кольца или шестичленное кольцо, конденсированное с пятичленным кольцом, гетероарильную группу, содержащую от 1 до 3 атомов азота в кольце или кольцах. Особенно предпочтительными вариантами осуществления изобретения являются те, в которых Аr1 представляет собой фенил, нафтил, 2-пиридил, 3-пиридил, 4 пиридил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 2-хинолинил, 3-хинолинил, 4-изохинолинил, бензотиазолил, бензоксазолил, бензимидазолил, 3-пиразолил, 2-фенил-4-изоксазолил и тому подобное. Аr1 может быть как незамещенным, так и замещенным. В предпочтительных вариантах осуществления, Аr1 замещен с помощью от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О-(С 1-Сб)алкила, -CF3, (С 1 С 6)алкила или -NO2. В одной группе предпочтительных вариантов осуществления Аr1 представляет собой моноциклическую гетероарильную группу, содержащую от 1 до 2 атомов азота в кольце и монозамещенную галогеном, -OCF3 или -CF3. В другой группе предпочтительных вариантов осуществления Аr1 представляет собой фенильную или нафтильную группу,имеющую от 1 до 3 заместителей, выбранных из галогена, циано, нитро, (С 1-С 8)алкила или (С 1 С 8)алкокси.X представляет собой двухвалентный мостик, выбранный из замещенного или незаме 11 щенного (С 1-С 6)алкилена, замещенного или незамещенного (С 1-С 6)алкиленокси, замещенного или незамещенного (С 1-С 6)алкиленамино, замещенного или незамещенного (С 1-С 6)алкиленS(О)k, -О-, -С(О)-, -N(R11)-, -N(R11)C(O)-, -S(O)kи простой связи, где R11 представляет собой заместитель, выбранный из водорода, (C1 С 8)алкила, (С 2-С 8)гетероалкила и арил(С 1 С 4)алкила, и индекс k представляет собой целое число от 0 до 2. В предпочтительных вариантахX представляет собой -О-,-С(О)-, замещенный или незамещенный (С 1-С 6)алкилен, -N(R11)- или-S(O)k-. Более предпочтительными являются те варианты, в которых X представляет собой -О-,-СН 2-, -СН(СН 3)-, -С(О)-, -N(R11)- или -S(O)k-,где R11 представляет собой водород, метил,этил, пропил и изопропил.Y в приведенной выше формуле представляет собой двухвалентный мостик, выбранный из замещенного или незамещенного (С 1 С 6)алкилена, -О-, -С(О)-, -N(R12)-S(O)m-, -N(R12)S(O)m-N(R13)-, -N(R12)C(O)-, -S(O)n-, простой связи и их комбинации, в которых R12 и R13 представляют собой заместители, независимо выбранные из водорода, замещенного или незамещенного (С 1-С 8)алкила, замещенного или незамещенного (С 2-С 8)гетероалкила и замещенного или незамещенного арил(С 1-С 4)алкила; и индексы m и n независимо представляют собой целые числа от 0 до 2. В предпочтительных вариантах Y представляет собой -N(R12)-S(O)2 или -N(RI2)-C(O)-. Более предпочтительно Y представляет собой -N(R12)-S(O)2-, в которомR12 представляет собой водород или замещенный или незамещенный (С 1-С 8)алкил. Более предпочтительно Y представляет собой -NHS(O)2-. Кроме того, приведенные здесь мостики(представленные как X и Y) могут располагаться в любой ориентации. Например, более конкретно, атом азота в -N(R12)-S(O)2- может быть присоединен либо к центральному бензольному кольцу, либо к группе R2.-C(O)NR R , -C(O)R , -S(O)P-R , -S(O)qNR15R16, -O-C(O)-OR17, -O-C(O)-R17, -O-C(O)NR15R16, -N(R14)-C(O)-NR15R16, -N(R14)-C(O)-R17 и -N(R14)-C(O)-OR17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 представляют собой заместители, независимо выбранные из водорода, (C1-С 8)алкила, (С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо; и R17 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, 004887 12 арила и арил(С 1-С 4)алкила. В каждом из определений заместителей, например, алкила, алкокси и гетероалкила, имеется ввиду, что группы могут быть замещенными или незамещенными. Предпочтительно, если они замещены такими заместителями, как галоген (например, -CF3,-OCF3). В предпочтительных вариантах R1 представляет собой водород, галоген, циано, (С 1 С 8)алкил,(С 1-С 8)алкокси,-CO2R14 и 15 16-C(O)NR R , где R представляет собой (C1 С 8)алкил и R15 и R16 представляют собой независимо водород или (С 1-С 8)алкил или взятые вместе с азотом, к которому они оба присоединены, образуют 5- или 6-членное кольцо. Другие предпочтительные группы R1 обсуждаются ниже в отношении групп соединений, в которых Аr1 представляет собой фенил, пиридил, нафтил, хинолинил, изохинолинил, бензоксазолил,бензотиазолил и бензимидазолил.R2 представляет собой замещенную или незамещенную арильную группу. Предпочтительно R2 представляет собой фенильную, нафтильную, пиридазинильную или пиридильную группу. Более предпочтительно R2 представляет собой фенильную, нафтильную, пиридазинильную или пиридильную группу, замещенную 0-3 заместителями, выбранными из галогена, -OCF3,-ОН, -О(С 1-С 8)алкила, -CN, -CF3, -С(О)-(С 1 С 8)алкила, -(С 1-С 8)алкила и -NH2. В то время когда приводится ряд предпочтительных заместителей (например, -OCF3 и -CF3), подразумевается, что термины алкил и алкокси также включают их замещенные варианты, предпочтительно галогензамещенные варианты, включая отмеченные особо.R3 представляет собой галоген, циано,нитро или замещенную или незамещенную (С 1 С 8)алкоксигруппу, предпочтительно галоген,циано или (C1-С 4)алкоксигруппу. Более предпочтительно галоген, метокси и трифторметокси. Далее приводится ряд предпочтительных вариантов. Например, в одном предпочтительном варианте X представляет собой двухвалентный мостик, выбранный из -СН 2-,-СН(СН 3)-, -О-,-С(О)-, -N(R11)- и -S-, и Y представляет собой -N(R12)-S(O)2-, где R12 представляет собой заместитель, выбранный из водорода и (С 1-С 8)алкила. В другом предпочтительном варианте X представляет собой двухвалентный мостик, выбранный из -СН 2-, -СН(СН 3)-, -О-,-С(О)-, -N(R11)- и -S-; Y представляет собой-N(R12)-S(O)2-, где R12 представляет собой заместитель, выбранный из водорода и (C1 С 8)алкила; и R2 представляет собой замещенный или незамещенный арил, выбранный из фенила,пиридила, нафтила и пиридазинила. И еще в одном предпочтительном варианте X представляет собой двухвалентный мостик, выбранный 13 из -СН 2-, -СН(СН 3)-, -О-, -С(О)-, -N(R11)- и -S-,Y представляет собой -N(RI2)-S(O)2-, где R12 представляет собой заместитель, выбранный из водорода и (С 1-С 8)алкила; R2 представляет собой замещенный или незамещенный арил, выбранный из фенила, пиридила, нафтила и пиридазинила; и Аr1 представляет собой замещенный или незамещенный арил, выбранный из пиридила, фенила, нафтила, хинолинила, изохинолинила, бензоксазолила, бензотиазолила и бензимидазолила. Специалисту в данной области понятно,что формула I включает ряд структурных изомеров. В одной группе вариантов осуществления изобретения изомерами являются те соединения, в которых группы на фенильном кольце не занимают смежные положения. В других вариантах к изобретению относятся соединения,имеющие структурную ориентацию, представленную формулами Более предпочтительными являются те соединения, которые имеют структурную ориентацию, представленную формулами Iа или Ib. Еще более предпочтительными являются соединения формулы Iа или Ib, в которых положенияR1 и R3 являются обращенными (или противоположными). Наиболее предпочтительными соединениями являются те, в которых Аr1-Х- и -Y-R2 находятся в орто-положении по отношению друг к другу (пример Ij). Еще одна группа предпочтительных соединений представлена формулой Аr1 представляет собой замещенный или незамещенный фенил. 14 В одной из групп особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную фенильную группу. Более предпочтительными являются варианты, в которых соединение представлено любой формулой от Iа до Ij. Еще более предпочтительными являются те соединения, в которыхX является -О-, -NH- или -S-; Y является -NHSO2-; R1 - это заместитель, выбранный из водорода, галогена, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси, -C(O)R14, -CO2R14,-C(O)NR15R16, -S(O)p-R14 и -S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)-(С 1 С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Другими особенно предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный фенил, являются те, которые представлены формулой Ii или Ij. В этой группе соединений X представляет собой двухвалентный мостик, выбранный из -СН 2-,-СН(СН 3)-, -О-, -С(О)-, -N(R11)- и -S-, где R11 это заместитель, выбранный из водорода и (С 1 С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(RI2)-S(O)2-, где R12 это заместитель, выбранный из водорода и (С 1 С 8)алкила, R1 представляет собой заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14,-S(O)q-NR15R16, -O-C(O)-R17 и -N(R14)-C(O)-R17,где R14 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила, (С 2 С 8)гетероалкила, арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода, (С 1-С 8)алкила и (С 2 С 8)гетероалкила или взятые вместе с азотом, к которому они оба присоединены, образуют 5-,6- или 7-членное кольцо, R17 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила и (С 2-С 8)гетероалкила; индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является замещенным или незамещенным фенилом; и R3 - это галоген или(С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой фенильную группу, имеющую от 1 до 3 заместителей, выбран 15 ных из галогена, -OCF3, -ОН, -O(C1-С 6)алкила,-CF3, (С 1-С 8)алкила и -NO2; R1 - это заместитель,выбранный из галогена, (C1-С 8)алкила, (С 2 С 8)гетероалкила и (С 1-С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -C(O)-(C1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена,-OCF3 и -CF3; и R3 выбран из галогена, метокси и трифторметокси. Наиболее предпочтительными являются соединения, в которых каждый изR1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу,имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. Аr1 представляет собой замещенный или незамещенный пиридил. В другой группе особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную пиридильную группу. Более предпочтительными являются варианты, в которых соединение представлено любой из формул от Iа до Ij. Еще более предпочтительными являются соединения, в которых X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель, выбранный из водорода, галогена, (С 1-С 8)алкила,(С 2-С 8)гетероалкила, (С 1-С 8)алкокси, -C(O)R14,-CO2R14, -C(O)NR15R16, -S(O)P-R14 и -S(O)qNR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (C1C8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Другими особенно предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный пиридил, являются те, которые представлены формулой Ii илиIj. В этой группе соединений X представляет собой двухвалентный мостик, выбранный изR11 - это заместитель, выбранный из водорода и(С 1-С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(R12)-S(O)2-,где R12 - это заместитель, выбранный из водорода и (С 1-С 8)алкила; R1 представляет собой заместитель, выбранный из водорода, галогена,(С 1-С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8) алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16,-S(O)P-R14, -S(O)q-NRI5R16, -O-C(O)-R17 и-N(R14)-C(O)-R17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода,(С 1-С 8)алкила и (С 2-С 8)гетероалкила или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо; R17 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила и (С 2-С 8)гетероалкила; 16 индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является замещенным или незамещенным фенилом; и R3- это галоген или (С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой пиридильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1 С 6)алкила, -CF3, (С 1-С 8)алкила и -NO2; R1 - это заместитель, выбранный из галогена, (С 1 С 8)алкила,(С 2-С 8)гетероалкила и(С 1 С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -O(C1-С 8)алкила, -С(О)-(С 1 С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей,выбранных из галогена, -OCF3 и -CF3; и R3 выбран из галогена, метокси и трифторметокси. Кроме того, другими предпочтительными соединениями являются те, в которых каждый изR1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу,имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. Наиболее предпочтительно, когда Аr1 представляет собой 3 пиридильную группу, имеющую предпочтительные заместители, обозначенные выше. В других особенно предпочтительных вариантах соединения представлены формулой I, в которой Аr1 представляет собой пиридильное кольцо, имеющее один заместитель, выбранный из галогена, -OCF3 и -CF3; X представляет собой двухвалентный мостик, выбранный из группы-C(O)NR15R16, в которых R15 выбран из водорода, (С 1-С 8)алкила, арила и арил(С 1-С 4)алкила; R2 представляет собой фенильное или пиридильное кольцо, необязательно замещенное 0-3 группами, выбранными из галогена, (С 1-С 8)алкила, -О(С 1-С 8)алкила и -CN; и R3 представляет собой галоген, циано или (С 1-С 4)алкокси. Аr1 представляет собой замещенный или незамещенный нафтил. В другой группе особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную нафтильную группу. Более предпочтительными являются те ва 17 рианты, в которых соединение представлено любой из формул от Iа до Ij. Еще более предпочтительными являются те соединения, в которых X представляет собой -О-, -NH- или -S-;-S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Другими особенно предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный нафтил, являются те, которые представлены формулой Ii илиIj. В этой группе соединений X представляет собой двухвалентный мостик, выбранный изR11 - это заместитель, выбранный из водорода и(С 1-С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(R12)-S(O)2-,где R12 - это заместитель, выбранный из водорода и (С 1-С 8)алкила; R1 представляет собой заместитель, выбранный из водорода, галогена,(С 1-С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)PR14, -S(O)q-NR15R16, -O-C(O)-R17 и -N(R14)-C(O)R17, где R14 представляет собой заместитель,выбранный из водорода, (С 1-С 8)алкила, (С 2 С 8)гетероалкила, арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода, (С 1-С 8)алкила и (С 2 С 8)гетероалкила или взятые вместе с азотом, к которому они оба присоединены, образуют 5-,6- или 7-членное кольцо; R17 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила и (С 2-С 8)гетероалкила; индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является замещенным или незамещенным фенилом; и R3 - это галоген или(С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях, Аr1 представляет собой нафтильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 6)алкила, CF3, (С 1-С 8)алкила и -NO2; R1 - это заместитель,выбранный из галогена, (С 1-С 8)алкила, (С 2 004887 18 С 8)гетероалкила и (С 1-С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -O(C1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена,-OCF3 и -CF3; и R3 выбран из галогена, метокси и трифторметокси. Наиболее предпочтительными соединениями являются те, в которых каждый из R1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу, имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. Аr1 представляет собой замещенный или незамещенный бензотиазолил. В другой группе особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную бензотиазолильную группу. Более предпочтительными являются варианты, в которых соединение представлено любой из формул от Iа до Ij. Еще более предпочтительными являются соединения, в которых X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель, выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (C1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Другими особенно предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный бензотиазолил,являются те, которые представлены формулой Ii или Ij. В этой группе соединений X представляет собой двухвалентный мостик, выбранный изR11 - это заместитель, выбранный из водорода и(С 1-С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(R12)-S(O)2-,где R12 - это заместитель, выбранный из водорода и (С 1-С 8)алкила; R1 представляет собой заместитель, выбранный из водорода, галогена,(С 1-С 8)алкила,(С 2-С 8)гетероалкила,(С 1 С 8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16,-S(O)P-R14, -S(O)q-NR15R16, -O-C(O)-R17 и-N(R14)-C(O)-R17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода,(С 1-С 8)алкила и (С 2-С 8)гетероалкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо; R17 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила и (С 2-С 8)гетероалкила,индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является 19 замещенным или незамещенным фенилом; и R3- это галоген или (С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2,и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой бензотиазолильную группу, имеющую от 1 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 6)алкила, -CF3, (С 1-С 8)алкила и -NO2; R1 выбран из галогена, (C1-С 8)алкила, (С 2-С 8) гетероалкила и (С 1-С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -C(O)-(C1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена,-OCF3 и -CF3; и R3 выбран из галогена, метокси и трифторметокси. Наиболее предпочтительными являются соединения, в которых каждый изR1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу,имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. В наиболее предпочтительных соединениях бензотиазолильная группа представляет собой 2-бензотиазольную группу. Аr1 представляет собой замещенный или незамещенный бензоксазолил. В другой группе особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную бензоксазолильную группу. Более предпочтительными являются варианты, в которых соединение представлено любой из формул от Iа до Ij. Кроме того, предпочтительными являются соединения, в которых X представляет собой -O-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель, выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей,выбранных из галогена, -ОСF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Еще более предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный бензоксазолил, являются те, которые представлены формулой Ii или Ij. В этой группе соединений X представляет собой двухвалентный мостик, выбранный изR11 - это заместитель, выбранный из водорода и(С 1-С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(R12)-S(O)2-,где R12 - это заместитель, выбранный из водорода и (С 1-С 8)алкила; R1 представляет собой заместитель, выбранный из водорода, галогена,(С 1-С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8) алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16,-S(O)p-R14, -S(O)q-NR15R16, -O-C(O)-R17 и-N(R14)-C(O)-R17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода,(С 1-С 8)алкила и (С 2-С 8)гетероалкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо; R17 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила и (С 2-С 8)гетероалкила; индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является замещенным или незамещенным фенилом; и R3- это галоген или (С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой бензоксазолильную группу, имеющую от 0 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 6)алкила, -CF3, (С 1-С 8)алкила и -NO2; R1 - это заместитель, выбранный из галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила и (С 1-С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3,-ОН, -О(С 1-С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN,-CF3, (С 1-С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3; и R3 выбран из галогена,метокси и трифторметокси. Наиболее предпочтительными являются соединения, в которых R1 и R3, каждый независимо, представляет собой галоген и R2 представляет собой фенильную группу, имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. В особенно предпочтительных соединениях бензоксазолильная группа представляет собой 2 бензоксазолильную группу. Аr1 представляет собой замещенный или незамещенный бензимидазолил. В другой группе особенно предпочтительных соединений Аr1 представляет собой замещенную или незамещенную бензимидазолиль 21 ную группу. Более предпочтительными являются варианты, в которых соединение представлено любой из формул от Iа до Ij. Еще более предпочтительны те соединения, в которых X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель, выбранный из водорода, галогена, (C1-C8)алкила,(С 2-С 8)гетероалкила, (C1-С 8)алкокси, -C(O)R14,-CO2R14, -C(O)NR15R16, -S(O)P-R14 и -S(O)qNR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Еще более предпочтительными соединениями, в которых Аr1 представляет собой замещенный или незамещенный бензимидазолил,являются те, которые представлены формулой Ii или Ij. В этой группе соединений X представляет собой двухвалентный мостик, выбранный изR11 - это заместитель, выбранный из водорода и(С 1-С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(R12)-S(O)2-,где R12 - это заместитель, выбранный из водорода и (С 1-С 8)алкила; R1 представляет собой заместитель, выбранный из водорода, галогена,(С 1-С 8)алкила,(С 2-С 8)гетероалкила,(С 1 С 8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16,-S(O)P-R14, -S(O)q-NR15R16, -O-C(O)-R17 и-N(R14)-C(O)-R17, где R14 представляет собой заместитель, выбранный из водорода, (С 1 С 8)алкила,(С 2-С 8)гетероалкила,арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода,(С 1-С 8)алкила и (С 2-С 8)гетероалкила или взятые вместе с азотом, к которому они оба присоединены, образуют 5-, 6- или 7-членное кольцо; R17 представляет собой заместитель, выбранный из водорода, (С 1-С 8)алкила и (С 2-С 8)гетероалкила; индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2, R2 является замещенным или незамещенным фенилом, и R3- это галоген или (С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -O-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой бензимидазолильную группу, имеющую от 0 до 3 заместителей,выбранных из галогена, -OCF3, -ОН, -О(С 1 С 6)алкила, -CF3, (С 1-С 8)алкила и -NO2; R1 - это 22 заместитель, выбранный из галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила и (С 1-С 8)алкокси; R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3,-ОН, -O(C1-С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN,-CF3, (С 1-С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3; и R3 выбран из галогена,метокси и трифторметокси. Наиболее предпочтительны те соединения, в которых каждый изR1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу,имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. В особенно предпочтительном варианте бензимидазолильная группа представляет собой 2-бензимидазолильную группу. Аr1 представляет собой замещенный или незамещенный хинолинил или изохинолинил. В другой группе особенно предпочтительных соединений, Аr1 представляет собой замещенную или незамещенную хинолинильную или изохинолинильную группу. Более предпочтительными являются варианты, в которых соединение представлено любой из формул от Iа до Ij. Еще более предпочтительны те соединения, в которых X представляет собой -О-, -NHили -S-; Y представляет собой -NH-SO2-; R1 это заместитель, выбранный из водорода, галогена, (С 1-С 8)алкила, (С 2-С 8)гетероалкила, (C1 С 8)алкокси, -C(O)R14, -CO2R14, -C(O)NR15R16,-S(O)p-R14 и -S(O)q-NR15R16; R2 представляет собой фенильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена, -OCF3,-ОН, -О(С 1-С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN,-CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. Особенно предпочтительными соединениями, в которых Аr1 представляет собой замещенную или незамещенную хинолинильную или изохинолинильную группу, являются те,которые представлены формулой Ii или Ij. В этой группе соединений X представляет собой двухвалентный мостик, выбранный из -СН 2-,-СН(СН 3)-, -О-, -С(О)-, -N(R11)- и -S-, где R11 это заместитель, выбранный из водорода и (С 1 С 8)алкила; Y представляет собой двухвалентный мостик, выбранный из -N(RI2)-S(O)2-, где R12 это заместитель, выбранный из водорода и (С 1 С 8)алкила; R1 представляет собой заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (C1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NRI5R16, -S(O)P-R14,-S(O)q-NR15R16, -O-C(O)-R17 и -N(R14)-C(O)-R17,где R14 представляет собой заместитель, выбранный из водорода, (C1-С 8)алкила, (С 2 С 8)гетероалкила, арила и арил(С 1-С 4)алкила; R15 и R16 являются заместителями, независимо выбранными из водорода, (С 1-С 8)алкила и (С 2 С 8)гетероалкила, или взятые вместе с азотом, к которому они оба присоединены, образуют 5-,6- или 7-членное кольцо; R17 представляет собой 23 заместитель, выбранный из водорода, (С 1 С 8)алкила и (С 2-С 8)гетероалкила; индекс р представляет собой целое число от 0 до 2; индекс q имеет значение 2; R2 является замещенным или незамещенным фенилом; и R3 - это галоген или(С 1-С 8)алкокси. В более предпочтительных соединениях X представляет собой -О-, -NH- или -S-; Y представляет собой -NH-SO2-; R1 - это заместитель,выбранный из водорода, галогена, (С 1 С 8)алкила, (С 2-С 8)гетероалкила, (С 1-С 8)алкокси,-C(O)R14, -CO2R14, -C(O)NR15R16, -S(O)P-R14 и-S(O)q-NR15R16; R2 - это фенильная группа,имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1-С 8)алкила, -С(О)(С 1-С 8)алкила, -CN, -CF3, (С 1-С 8)алкила и -NH2; и R3 выбран из галогена, метокси и трифторметокси. В еще более предпочтительных соединениях Аr1 представляет собой хинолинильную или изохинолинильную группу, имеющую от 0 до 3 заместителей, выбранных из галогена,-OCF3, -ОН, -О(С 1-С 6)алкила, -CF3, (С 1 С 8)алкила и -NO2; R1 - это заместитель, выбранный из галогена,(С 1-С 8)алкила,(С 2 С 8)гетероалкила и (C1-С 8)алкокси, R2 - это фенильная группа, имеющая от 0 до 3 заместителей, выбранных из галогена, -OCF3, -ОН, -О(С 1 С 8)алкила, -С(О)-(С 1-С 8)алкила, -CN, -CF3, (С 1 С 8)алкила и -NH2, более предпочтительно от 1 до 3 заместителей, выбранных из галогена,-OCF3 и -CF3; и R3 выбран из галогена, метокси и трифторметокси. Наиболее предпочтительны те соединения, в которых каждый из R1 и R3 независимо представляет собой галоген и R2 представляет собой фенильную группу, имеющую от 1 до 3 заместителей, выбранных из галогена, -OCF3 и -CF3. В особенно предпочтительных соединениях хинолинильная или изохинолинильная группа выбрана из 2 хинолинильной, 3-хинолинильной, 4-хинолинильной, 3-изохинолинильной и 4-изохинолинильной групп. В другом аспекте настоящее изобретение обеспечивает фармацевтические композиции,содержащие по крайней мере одно из указанных выше соединений в смеси с фармацевтически приемлемым носителем. Еще в одном аспекте настоящее изобретение обеспечивает способы модулирования состояний организма, связанных с PPAR. В частности, эти состояния выбирают из инсулиннезависимого сахарного диабета, ожирения, из состояний, связанных с аномальным уровнем липопротеинов и триглециридов в плазме, а также различных воспалительных состояний, таких как, например, ревматоидный артрит и атеросклероз. Получение соединений Соединения по настоящему изобретению могут быть получены с помощью известных способов синтеза. 24 В качестве примера на схеме 1 приведены способы получения соединений структурной формулы (Iа). Среднему специалисту в данной области понятно, что подобные методики могут использоваться для синтеза соединений других структурных классов. Как показано на схеме 1, соединения по настоящему изобретению могут быть получены,исходя из коммерчески доступного 2-хлор-5 нитробензонитрила (i). Обработка J с фенолом,тиофенолом или необязательно защищенным анилином в присутствии основания при нагревании приводит к получению аддукта (ii). Восстановление нитрогруппы в (ii), например, при помощи H2 в присутствии катализатора никеля Ренея, приводит к получению производного анилина (iii). Сульфирование (iii) соответствующим арилсульфонилгалогенидом (Аr1SO2Cl) в присутствии оснований (обычно третичных аминов) приводит к получению целевого соединения (iv). Соединение (iii) может быть также преобразовано в соответствующее соединение формулы (vi), в котором ориентация сульфамидной связи является обращенной. Таким образом, превращение анилина (iii) в бензолсульфонилхлорид (v), может быть выполнено, с использованием методов, описанных в публикации Hoffman, Organic Syntheses Collective Volume VII, стр. 508-511. Последующая обработка(v) подходящим анилином, приводит к получению целевого соединения (vi). Другие соединения по настоящему изобретению могут быть получены, исходя, например,из 3,4-дифторнитробензола, 3-хлор-4-фторнитробензола, 2-хлор-5-нитроанизола, 3-бром-4 фторнитробензола и им подобных. Анализ соединений Модуляцию PPAR рецептора соединениями по настоящему изобретению можно оценить с помощью методик, которые описаны в статьях Jiang, et al., Nature 391:82-86 (1998), Ri 25al., J. Biol. Chem. 270 (12): 12953-12956 (1995). Альтернативно, способность этих соединений вытеснять радиоактивно меченный BRL 49653 из объединенного белка PPAR-GST можно оценить следующим образом. Материалы.PPAR-GST объединенный белок (подготовленный согласно стандартным процедурам),[3H]-BRL 49653, имеющий специфическую активность 50 Ки/ммоль, фильтрующие планшетыPolyfiltronics Unifilter 350 и гранулы глутатионSepharose(от фирмы Pharmacia: дважды промытые 10 х связывающим буфером, в котором могут отсутствовать BSA и DTT). Метод. Связывающий буфер (10 мМ Трис - НСl,рН 8,0, 50 мМ KCl, 10 мМ DTT, 0,02% BSA и 0,01% NP-40) добавляют в количестве 80 мкл в лунки фильтрующего планшета. Затем добавляют тестируемое соединение в 10 мкл ДМСО. Объединенный белок PPAR-GST и радиоактивно меченное соединение BRL предварительно смешивают в связывающем буфере, содержащем 10 мМ DTT и добавляют в количестве 10 мкл в лунки планшета, чтобы обеспечить конечные концентрации объединенного белка[3 Н]-BRL 49653. Планшет инкубируют в течение 15 мин. Добавляют глутатион-агарозные гранулы в 50 мкл связывающего буфера и планшет энергично встряхивают в течение одного часа. Затем планшет промывают четыре раза связывающим буфером (без BSA и DTT) по 200 мкл/ячейку. Основание планшета герметизируют и в каждую лунку добавляют по 200 мкл смеси для сцинтилляции. Затем герметизируют верхнюю часть планшета и определяют радиоактивность. Изготовление и введение соединений(композиций) Соединения по настоящему изобретению можно изготавливать и вводить в виде разнообразных пероральных и парентеральных лекарственных форм. Так, соединения по настоящему изобретению можно вводить путем инъекции,т.е. внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно. Также описанные здесь соединения можно вводить путем ингаляции, например,интраназально. Кроме того, соединения по настоящему изобретению можно вводить трансдермально. Соответственно, настоящее изобретение также обеспечивает фармацевтические композиции, включающие фармацевтически приемлемый носитель или наполнитель и соединение формулы (I) или фармацевтически приемлемую соль соединения формулы (I) в эффективном количестве. Фармацевтически приемлемые носители для получения фармацевтических композиций 26 из соединений по настоящему изобретению могут быть твердыми или жидкими. Твердые формы препаратов включают порошки, таблетки,пилюли, капсулы, облатки, свечи и растворимые гранулы. Твердым носителем может быть одно или более веществ, которые при этом могут также действовать как растворители, ароматизирующие агенты, связующие компоненты, консерванты, агенты для разложения таблеток или материалы для заключения в капсулу. В порошках носитель является тонко размельченным твердым веществом и находится в смеси с тонко размельченным активным компонентом. В таблетках активный компонент смешан с носителем, имеющим необходимые связывающие свойства, в подходящем соотношении и сформирован в таблетку желаемой формы и размера. Порошки и таблетки предпочтительно содержат от 5 или 10 до 70% активного соединения. Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, сахар,лактозу, пектин, декстрин, крахмал, желатин,трагакант, метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, низкоплавкий воск,масло какао и т.п. Подразумевается, что термин"получение" включает изготовление композиции активного соединения с материалом для заключения в капсулу в качестве носителя с получением капсулы, в которой активный компонент присутствует вместе с носителем или без других носителей, окруженный носителем, который с ним связан. То же самое относится к облаткам и лепешкам. Таблетки, порошки, капсулы, пилюли, облатки и лепешки могут использоваться как твердые лекарственные формы, подходящие для перорального приема. Для получения свеч сначала расплавляют низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, и гомогенно распределяют в нем активный компонент при перемешивании. Расплавленную гомогенную смесь затем разливают в формы подходящего размера, позволяют охладиться и таким образом застыть. Жидкие формы препаратов включают растворы, суспензии и эмульсии, например, водные или водно/пропиленгликолевые растворы. Для парентеральных инъекций жидкие препараты могут быть изготовлены в виде раствора в водном растворе полиэтиленгликоля. Водные растворы, подходящие для перорального использования, могут быть получены путем растворения активного компонента в воде и добавления, при необходимости, подходящих пигментов, ароматизаторов, стабилизаторов и загустителей. Водные суспензии, подходящие для перорального использования, могут быть получены путем распределения мелко раздробленного активного компонента в воде с вязким материалом, типа природных или синтетических смол, камедей, метилцеллюлозы, натрие 27 вой соли карбоксиметилцеллюлозы и других известных суспендирующих агентов. Также сюда относятся твердые формы препаратов, которые предназначены для превращения, незадолго перед использованием, в жидкие формы препаратов для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, в дополнение к активному компоненту, пигменты, ароматизаторы, стабилизаторы, буферные растворы, искусственные и природные подсластители, диспергирующие агенты, загустители, солюбилизирующие агенты и им подобные. Фармацевтический препарат получают предпочтительно в форме единичных доз. В такой форме препарат разделяется на единичные дозы, содержащие соответствующее количество активного компонента. Форма единичной дозы может быть в виде упакованного препарата, при этом упаковка содержит дискретные количества препарата, такие как упакованные таблетки, капсулы и порошки в пробирках или ампулах. Кроме того, формой единичной дозы может быть сама по себе капсула, таблетка, облатка или лепешка, или это может быть соответствующее число любой из них в упаковке. Количество активного компонента в единичной дозе препарата может быть различным или установленным от 0,1 до 1000 мг, предпочтительно от 0,1 до 100 мг, в зависимости от конкретного применения и силы активного компонента. Композиция также может, по желанию,содержать другие совместимые терапевтические агенты. При терапевтическом использовании для лечения ожирения, NIDDM или воспалительных состояний соединения, используемые в фармацевтическом способе по изобретению, вводят в начальной дозе от приблизительно 0,001 до приблизительно 100 мг/кг ежедневно. Предпочтительный диапазон суточной дозы составляет приблизительно от 0,1 до приблизительно 10 мг/кг. Дозы, однако, могут отличаться в зависимости от требований пациента, серьезности состояния, которое лечат, и используемого соединения. Определение надлежащей дозы в конкретной ситуации осуществляется практикующим врачом. Как правило, лечение обычно начинают с небольших доз, которые меньше, чем оптимальная доза соединения. После этого понемногу дозу увеличивают, пока не будет достигнут оптимальный эффект при данных обстоятельствах. Для удобства полная ежедневная доза может быть, при желании, разделена и вводиться по частям в течение дня. Сведения, подтверждающие возможность осуществления изобретения Следующие примеры предлагаются лишь в качестве иллюстрации и никоим образом не ограничивают объем изобретения. 28 Примеры Реагенты и растворители, используемые ниже, могут быть получены из коммерческих источников, таких как Aldrich Chemical Co.(Milwaukee, Wisconcin, USA). Н-ЯМР спектры снимались на Varian Gemini 400 МГц спектрометре. Обозначения пиков приведены в следующем порядке: число протонов, мультиплетность (с, синглет; д, дуплет, т, триплет; кв, квартет; м, мультиплет; бр. с, уширенный синглет) и константы спин-спинового взаимодействия в Гц. Электронный Ионизационный (EI) массспектр записывали на Hewlett Packard 5989 А масс-спектрометре. Данные масс-спектрометрии приведены в виде соотношения массы к заряду,с последующим относительным избытком каждого иона (в скобках). В таблицах единичное значение m/е приведено для М+Н (или если указано М-Н) ионного содержания наиболее распространенных атомных изотопов. Структуры изотопов соответствует формулам во всех случаях. Электрораспылительная ионизация (ESI) масс-спектрометрического анализа снята на приборе Hewlett Packard 1100 MSD электрораспылительном масс-спектрометре при использовании НР 1 100 жидкостной хроматографии высокого разрешения (HPLC) для доставки образца. Обычно анализируемый образец растворяют в метаноле при 0,1 мг/мл и 1 мкл растворителя вводят в масс-спектрометр, который сканирует в интервале от 100 до 1500 дальтон. Все соединения могут быть анализированы при положительном ESI значении, используя 1:1 ацетонитрил/воду с 1% уксусной кислоты как доставляющего растворителя. Соединения, получаемые ниже, могут анализироваться при отрицательном значении ESI при использовании 2 мМNH4OAC в ацетнитриле/воде в качестве растворителя для доставки. Сокращения:(HATU), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI). Пример 1. Этот пример иллюстрирует получение 5 нитро-2-(3-хлор-5-пиридилокси)бензонитрила 29 нагревания при 60 С в течение 12 ч суспензию выливают в воду (1 л). Полученное твердое вещество собирают фильтрованием, промывают водой и сушат под вакуумом, чтобы получить 27,6 г (100%) названного соединения, т.пл. 104107 С. 1 Н ЯМР (400 МГц) (DMSO-d6)8.755 (д,J=2.8 Гц, 1 Н); 8.734 (уширенный синглет, 1 Н); 8.576 (уширенный синглет, 1H); 8.542 (дд, J=9.2,2.7 Гц, 1 Н); 7.689 (т, J=2.2 Гц, 1 Н); 7.122 (д,J=9.2 Гц, 1 Н). Пример 2. Этот пример иллюстрирует получение 5 амино-2-(3-хлор-5-пиридилокси)бензонитрила 30 тате 0,447 г указанного соединения в виде белого твердого вещества, т.пл. 154-156 С. 1 Н ЯМР (400 МГц) (CDCl3)8.59 (с, 1 Н); 8.42 (с, 1H) 8.08 (д, J=8.5 Гц, 1 Н); 7.72 (т, J=1.8,1H); 7.605 (д, J=27 Гц, 1 Н); 7.53 (дд, J=8.5, 2 Гц,1 Н); 7.48 (дд, J=9.4 Гц, 1 Н); 7.22 (с, 1H); 7.0 (д,J=9.0 Гц, 1H). m/e (M-H) 456. Полученное соединение окисляют до соответствующего N-оксида пиридина, используя 3 хлорпероксибензойную кислоту в хлористом метилене, с получением 3.2 в виде белого твердого вещества, m/e 470 (М+Н). Пример 4. Этот пример иллюстрирует синтез 4.1. К энергично перемешиваемому раствору промежуточного соединения из примера 1 (6,23 г) в этаноле и ТГФ добавляют взвесь никеля Ренея (300 мг, Aldrich). Колбу заполняют с помощью Н 2 при атмосферном давлении и давление отслеживают с помощью ТСХ. Исходный продукт быстро исчезает с образованием нитрозопромежуточного,которое постепенно превращается в необходимое производное анилина в течение примерно более 5 ч. Перемешивание останавливают, и никель Ренея притягивается к магнитному стержню мешалки. Оставшийся раствор фильтруют через Целит, который затем промывают этанолом и хлористым метиленом. Объединенные органические порции концентрируют, в результате чего получают 5,75 г производного анилина в виде масла, которое используют без дальнейшей очистки. 1 Н ЯМР (400 МГц) (CDCl3)8.456 (д,J=1.9 Гц, 1 Н); 8.389 (д, J=2.6 Гц, 1 Н); 7.38 (м,1 Н); 7.03 (м, 3 Н); 4.06 (м, 2 Н). Пример 3. Этот пример иллюстрирует синтез 3.1. К смеси 5-амино-2-(3-хлор-5-пиридилокси) бензонитрила из примера 2 (0,457 г) в хлористом метилене добавляют 2,4-дихлорбензолсульфонилхлорид (0,456 г, Maybridge), с последующим добавлением пиридина (150 мкл). Протекание реакции отслеживают с помощью ТСХ и после ее завершения растворитель удаляют под вакуумом. Полученный остаток распределяют между хлористым метиленом и водой. Органический слой отделяют и концентрируют. Остаток растирают с эфиром, получая в резуль Указанное соединение получают, используя методику, аналогичную описанной в примере 3, начиная с 1,6 г производного анилина, согласно методике в соответствии с примером 2 и 1,6 г 4-(трифторметил)бензолсульфонилхлорида(от Maybridge). Сырой продукт, оставшийся после обработки, очищают с помощью флэшхроматографии на кремнеземе, элюируя 10% этилацетатом/дихлорметаном, затем растирают с этиловым эфиром и собирают в виде белого порошка (1,04 г, 35% выход), т.пл. 143-144 С. Пример 5. Этот пример иллюстрирует синтез 5.1. Указанное соединение получают аналогично тому, как описано в примере 3, начиная с 397 мг производного анилина, полученного как описано в примере 2, и 345 мг 2-хлорпиридил-5 сульфонилхлоридаHoffman, R.V., Org. Syn. Coll. Vol. VII., p. 508511). Сырой продукт, оставшийся после обработки, очищают с помощью флэш-хроматографии на кремнеземе, элюируя 15% этилацетатом/дихлорметаном. Полученное твердое вещество перекристаллизовывают из дихлорметана и получают указанное соединение (270 мг, 40%) в виде белого твердого вещества, m/e 419 (М-Н). Пример 6. Этот пример иллюстрирует синтез 6.1. 31 Указанное соединение получают аналогично тому, как описано в примере 3, начиная с 400 мг производного анилина, полученного, как описано в примере 2, и 349 мг 3 пиридилсульфонилхлорида (полученного при использовании способов, аналогично описанным в J. Med. Chem. 40:1149 (1997. Сырой продукт, оставшийся после обработки, очищают с помощью флэш-хроматографии на кремнеземе, элюируя 1% этанолом/дихлорметаном. Полученное твердое вещество перекристаллизовывают из дихлорметана/диэтилового эфира и собирают в виде белого твердого вещества (121 мг, 19%), т.пл. 161-2 С. Аналогично, 6.2 получают из производного анилина 2.1 и 5-трифторметил-2-пиридинсульфонилхлорида, т.пл. 174-176 С. Пример 7. Этот пример иллюстрирует получение 7.1. В круглодонную колбу загружают производное анилина, полученное согласно примеру 2 (229 мг, 0,94 ммоль), 4-ацетилбензолсульфонилхлорид (205 мг, 0,94 ммоль, полученный согласно Hoffman, R.V., Org. Syn. Coll. Vol.Chemical Co.). Добавляют 5 мл дихлорметана и реакционную массу перемешивают при комнатной температуре в течение 8 ч. Затем реакционную массу разбавляют 25 мл дихлорметана и тщательно промывают 10 мл 1N HCl и рассолом. Органическую часть сушат над MgSO4 и пропускают через слой из силикагеля, чтобы удалить основные примеси. Полученное твердое вещество растирают в гексане, получая в результате 362 мг (90%) указанного соединения в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.81 (1 Н,с); 8.52 (1 Н, д, J=1.8 Гц); 8.43 (1 Н, д, J=2.3 Гц); 8.11 (2 Н, дд, J=6.8 Гц, 2.0 Гц), 7.90 (2 Н, дд, J=6.8 Гц, 2.0 Гц); 7.85 (1H, дд, J=4.4 Гц, 2.2 Гц); 7.53 Пример 8. Этот пример иллюстрирует получение 3 фтор-4-(3-хлор-5-пиридилокси)нитробензола 3,4-Дифторнитробензол (5,0 г, 32 ммоль) и 5-хлор-3-пиридинол объединяют, используя способ, описанный в примере 1, чтобы получить 8,2 г названного соединения. 1 Н ЯМР (400 МГц) (DMSO-d6)8.562 (д,J=1.9 Гц, 1 Н), 8.537 (д, J=2.5 Гц, 1H), 8.384 (дд,J=10.8, 2.8 Гц, 1H), 8.117 (ддд, J=9.1, 2.7, 1.5 Гц,1 Н), 7.967 (т, J=2.2 Гц, 1 Н), 7.418 (дд, J=9.2, 8.4 Гц, 1H). Пример 9. Этот пример иллюстрирует получение 3 фтор-4-(3-хлор-5-пиридилокси)анилина (9.1). Используя методику, описанную в примере 2, 3-фтор-4-(3-хлор-5-пиридилокси)нитробензол (8.1, 8,0 г) превращают в названное соединение, которое используют непосредственно в последующих реакциях.(уширенный синглет, 2 Н). Пример 10. Этот пример иллюстрирует получение 10.1.(239 мг, см. пример 9) и 2,4-дихлорбензолсульфонилхлорид (416 мг, Maybridge), 33 объединяют аналогично методике, описанной в примере 3. Сырой продукт очищают с помощью флэш-хроматографии на кремнеземе, элюируя 5% этилацетатом/дихлорметаном. Фракции продукта концентрируют и твердое вещество перекристаллизовывают из диэтилового эфира/ гексана, получая указанное соединение в виде белого твердого вещества (350 мг, 45%), т.пл. 149-151 С. Пример 11. Этот пример иллюстрирует получение 11.1.(310 мг, см. пример 9) и 4-метилтиобензолсульфонилхлорид (298 мг, получают, как описано у Burton, et al., J. Chem. Soc, 604-5 (1948,объединяют аналогично методике, описанной в примере 3. Сырой продукт очищают с помощью флэш-хроматографии на кремнеземе, элюируя этилацетатом/гексаном/дихлорметаном (1:5:4). Фракции продукта концентрируют и твердое вещество перекристаллизовывают из гексана/диэтилового эфира, получая указанное соединение в виде белого твердого вещества (315 мг, 57%), т.пл. 130-131 С. Указанное соединение окисляют с помощью mСРВА в соответствующий сульфоксид(11.2, т.пл. 140-144 С). Соответствующий сульфон (11.3) получают, используя 4-(метилсульфонил)бензолсульфонилхлорид (т.пл. 165168 С). Пример 12. Этот пример иллюстрирует получение 12.1. Указанное соединение получают в соответствии с методикой, аналогичной описанной в примере 3, исходя из 3-пиридилсульфонилхлорида (335 мг, см. пример 6) и 3-фтор-4-(3 хлор-5-пиридилокси)анилина (310 мг, см. пример 9) с добавлением каталитического количества 4-диметиламинопиридина. Когда реакция завершается по данным ТСХ, смесь фильтруют,чтобы удалить аминовые соли. Фильтрат концентрируют и остаток очищают с помощью флэш-хроматографии на кремнеземе, элюируя 5% метанолом/дихлорметаном. Фракции продукта объединяют, концентрируют и остаток растирают с диэтиловым эфиром, получая указанное соединение в виде белого твердого вещества (221 мг, 32%), т.пл. 129 С. 34 Пример 13. Этот пример иллюстрирует синтез 5-(4 ацетилбензолсульфонамидо-2-фторфенокси)-3 хлорпиридина (13.1).(1,0 ммоль) пиридина, каталитического количества DMAP и 5 мл хлористого метилена. Названное соединение получают в виде белого твердого вещества (269 мг, 64%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.75 (1 Н,д, J=4.7 Гц); 8.38 (1H, дд, J1=4.8 Гц, J2=2.1 Гц); 8.26 (1 Н, дд, J1=5.0 Гц, J2=2.4 Гц); 8.09 (2 Н, м); 7.91 (2 Н, м); 7.52 (1 Н, дд, J1=4.7, Гц J2=2.6 Гц); 7.21 (1 Н, дт, J1=5 Гц J2=1.0 Гц); 7.12 (1H, дд,J1=12.2 Гц J2=1.0 Гц); 6.92 (1H, д, J=8.8 Гц); 2.59MS ESI m/e: 418.7 (M-H). Пример 14. Этот пример иллюстрирует синтез 3-хлор 4-(3-хлор-5-пиридилокси)нитробензола (14.1).(т, J=2.3 Гц, 1 Н); 7.335 (д, J= 9.1 Гц, 1 Н). Пример 15. Этот пример иллюстрирует получение 3 хлор-4-(3-хлор-5-пиридилокси)анилина (15.1). Используя методику примера 2, 3-хлор-4(3-хлор-5-пиридилокси)нитробензол (7,6 г) превращают в названное соединение (7,2 г), которое используют непосредственно на следующей стадии. 1 Н ЯМР (400 МГц) (CDCl3)8.244 (уширенный синглет, 1 Н); 8.211 (уширенный синглет, 1H); 7.096 (уширенный синглет, 1 Н); 6.929MS (M+H) 255.1. Пример 16. Этот пример иллюстрирует получение 16.1.(410 мг, 15.1) и 2,4-дихлорбензолсульфонилхлорид (390 мг, Maybridge), объединяют аналогично тому, как описано в примере 3. Сырой продукт очищают с помощью флэш-хроматографии на кремнеземе, элюируя 5% этилацетатом/ дихлорметаном. Фракции продукта концентрируют и остаток растирают в гексане, получая указанное соединение в виде белого твердого вещества (538 мг, 73%), т.пл. 128-130 С. 1 Н ЯМР (400 МГц) (DMSO)8.40 (д, J=1.8 Гц, 1 Н); 8.24 (д, J=2.4 Гц, 1H); 8.06 (d, J=8.5 Гц,1 Н); 7.90 (д, J=2.0 Гц, 1 Н); 7.65 (дд, J=2,8.5 Гц,1H); 7.48 (т, J=2.2, 1H); 7.28 (д, J=2.5 Гц, 1 Н); 7.21 (д, J=8.84 Гц, 1 Н); 7.10 (дд, J=2.5, 7.1, 1 Н).MS m/e 465 (M+1). Соединение 16.1 окисляют с помощью 3 хлорпероксибензойной кислоты с получением соответствующего N-оксида пиридина, 16.2, в виде белого твердого вещества. После растирания в диэтиловом эфире, т.пл. 205-207 С. Пример 17. Этот пример иллюстрирует получение 17.1.(309 мг, 15.1) и 4-метилтиобензолсульфонилхлорид (223 мг, получают как описано у Burton,et al. J. Chem. Soc. 604-5 (1948, объединяют аналогично тому, как описано в примере 3. Сырой продукт очищают с помощью флэшхроматографии на кремнеземе, элюируя этилацетатом/гексаном/дихлорметаном(1:5:4). Фракции продукта концентрируют и полученный остаток растирают в гексане, получая указанное соединение в виде белого твердого вещества (200 мг, 37%), т.пл. 96-98 С. Окисление 17.1 в сульфоксид 17.2. Соединение 17.1 окисляют до соответствующего сульфоксида, используя окисление в сульфоксид с помощью пероксимоносульфата калия в метаноле и ацетоне. Реакцию отслеживают с помощью ТСХ. После того как реакция завершается, смесь фильтруют, фильтрат промывают водой, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают с помощью хроматографии на кремнеземе, элюируя с помощью от 50 до 100% этилацетатом/дихлорметаном. Растворитель удаляют из фракций продукта и остаток растирают в гексане. Продукт - белое твердое вещество собирают фильтрованием, получая 121 мг продукта 17.2 (63%),т.пл. 127-128 С. Пример 18. Этот пример иллюстрирует получение 18.1.(335 мг, см. пример 6) и 3-хлор-4-(3-хлор-5 пиридилокси)анилина (411 мг, 15.1) с добавлением каталитического количества 4 диметиламинопиридина. Когда реакция завершается по ТСХ, смесь фильтруют, чтобы удалить соли амина. Фильтрат концентрируют и остаток очищают с помощью флэшхроматографии на кремнеземе, элюируя с помощью 5% метанола/дихлорметана. Фракции продукта объединяют, концентрируют и остаток растирают с дихлорметаном, получая указанное соединение в виде белого твердого вещества(149 мг, 22%), т.пл. 164-165 С. Аналогично 18.2 (т.пл. 174-175 С) получают из производного анилина 15.1 и 5 трифторметил-2-пиридинсульфонилхлорида. Соединения, приведенные в табл. 2, получают, используя коммерчески доступные промежуточные соединения и/или используя промежуточные соединения и способы, описанные в примерах выше. Пример 19. ЭТОТ пример иллюстрирует получение 3 бром-4-(3-хлор-5-пиридилокси)нитробензолаReidel) и 5-хлор-3-пиридинол объединяют, используя способ, описанный в примере 1, чтобы получить названное соединение. 1 Н ЯМР (400 МГц, DMSO-d6)8.61 (д,J=2.6 Гц, 1H), 8.57 (д, J=2.2 Гц, 1H), 8.49 (д,J=2.5 Гц, 1 Н), 8.24 (дд, J=9.3, 2.6 Гц, 1 Н), 7.94MS (EI) m/z 333 (25, М+Н), 332 (15, М+Н),331 (100, М+Н), 330 (10, М+Н), 329 (76, М+Н). Пример 20. Этот пример иллюстрирует получение 3 бром-4-(3-хлор-5-пиридилокси)анилина (20.1). Используя способ по примеру 2, 3-бром-4(3-хлор-5-пиридилокси)нитробензол (19.1) превращают в названное соединение, которое используют непосредственно на следующих стадиях. 1 Н ЯМР (400 МГц, DMSO-d6)8.32 (д,J=2.1 Гц, 1 Н), 8.19 (д, J=2.5 Гц, 1 Н), 7.28 (дд,J=2.4, 2 Гц, 1 Н), 7.2 (д, J=8.7 Гц, 1 Н), 6.9 (д, J= 2.6 Гц, 1H), 6.62 (дд, J=8.7, 2.6 Гц, 1 Н).MS (EI) m/e 304 (5, М+Н), 303 (35, М+Н),302 (20, М+Н), 301 (100, М+Н), 300 (15, М+Н),299 (90, М+Н). Соединения, приведенные в табл. 3, получают, используя 20.1 и коммерчески доступные промежуточные соединения и/или используя промежуточные соединения и способы, описанные в примерах, приведенных выше. Аналогично, 20.5 получают из анилина 20.1 и 5-трифторметил-2-пиридинсульфонилхлорида, т.пл. 202-204 С. Пример 21. Этот пример иллюстрирует получение 5(4-нитро-2-метоксифенокси)-3-хлорпиридина В круглодонную колбу загружают 2-хлор 5-нитроанизол (1,03 г, 5,49 ммоль, Avocado(1,97 г, 6,04 ммоль, Aldrich Chemical Со.) и безводный ДМФА (16 мл). Смесь нагревают при 100 С в течение 18 ч. Затем температуру повышают до 130 С дополнительно еще в течение 2 ч, после чего реакционной массе дают охладиться до комнатной температуры. Реакционную смесь выливают в 800 мл дистиллированной воды и экстрагируют три раза с помощью 300 мл этилацетата. Объединенные экстракты сушат над MgSO4 и фильтруют. Растворитель удаляют из фильтрата под вакуумом и сырой продукт очищают с помощью флэшхроматографии на силикагеле (5% гексан в СН 2 Сl2 в качестве элюента), получая названное соединение (1,42 г, 93%) в виде желтого твердого вещества.MS ESI m/e: 281.1 (М + Н). Пример 22. Этот пример иллюстрирует синтез 5-(4 амино-2-метоксифенокси)-3-хлорпиридина(1,54 г, 6,56 ммоль), превращают в 1,38 г (99%) названного соединения в виде грязно-белого твердого вещества. Продукт используют без дальнейшей очистки (при стоянии в течение нескольких дней на воздухе соединение приобретает темно-коричневый цвет).MS ESI m/e: 251.1 (М + Н). Пример 23. Этот пример иллюстрирует синтез 5-(4(2,4-дихлорбензолсульфонамидо)-2-метоксифенокси)-3-хлорпиридина (23.1). В круглодонную колбу загружают производное анилина 22.1 (96 мг, 0,39 ммоль), 2,4 дихлорбензолсульфонилхлорид (104 мг, 0,42 ммоль, Maybridge Chemical Co.), пиридин (28 мг, 0,39 ммоль, Aldrich Chemical Co.) и каталитическое количество DMAP (Aldrich ChemicalCo.). Добавляют 3 мл дихлорметана и реакционную смесь перемешивают при комнатной температуре в течение 8 ч. Полученную смесь затем разбавляют 15 мл дихлорметана и тщательно промывают с помощью 10 мл 1N НСl и рассола. Объединенные органические порции сушат над MgSO4, затем пропускают через слой силикагеля, чтобы удалить основные примеси. Растворитель удаляют из фильтрата и полученное твердое вещество растирают в гексане, получая названное соединение (69 мг, 40%) в виде белого порошка. 1 Н ЯМР (400 МГц) (d6-DMSO)10.81 (1H,с); 8.29 (1 Н, д, J=2.1 Гц); 8.11 (1 Н, д, J=2.4 Гц); 8.07 (1 Н, д, J=8.5 Гц); 7.88 (1 Н, д, J=2.0 Гц); 7.63MS ESI m/e: 459.0 (М + Н). Пример 24. Этот пример иллюстрирует синтез 5-(4 метилсульфонилбензолсульфонамидо-2-метоксифенокси)-3-хлорпиридина (24.1).Co.) 4-метилсульфонбензолсульфонилхлорида,48 мг (0,61 ммоль) пиридина, каталитического количества DMAP и 5 мл хлористого метилена. Проведя процесс, получают названное соединение (67 мг, 24%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.63 (1H,с), 8.30 (1 Н, д, J=2.0 Гц), 8.14 (2 Н, м), 8.04 (1 Н,дд, J=8.6 Гц, 1.9 Гц), 7.27 (1 Н, дд, J=4.5 Гц, 2.2 Гц), 7.08 (1H, д, J=8.6 Гц), 6.93 (1 Н, д, J=2.4 Гц),6.70 (1 Н, дд, J=8.6 Гц, 2.4 Гц), 3.67 (3 Н, с), 3.28MS ESI m/e 4670 (М-Н). Пример 25. Этот пример иллюстрирует синтез 5-(4 ацетилбензолсульфонамидо-2-метоксифенокси)3-хлорпиридина (25.1). Названное соединение получают, используя методику, описанную в примере 7, исходя из 82 мг (0,33 ммоль) производного анилина 22.1,72 мг (0,33 ммоль) 4-ацетилбензолсульфонилхлорида, 26 мг (0,33 ммоль) пиридина, каталитического количества DMAP и 2 мл хлористого метилена. Названное соединение получают (92 мг, 65%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.52 (1 Н,с), 8.29 (1 Н, д, J=l.9 Гц), 8.10 (3 Н, м), 7.92 (2 Н,дд, J=8.0 Гц, 2.3 Гц), 7.23 (1 Н, дд, J=4.5 Гц, 2.4 Гц), 7.06 (1 Н, д, J=8.6 Гц), 6.93 (1 Н, дд, J=8.6 Гц,2.4 Гц), 6.70 (1 Н, дд, J=8.6 Гц, 2.4 Гц), 3.65 (3 Н,с), 2.60 (3 Н, с).MS ESI m/e 431.1 (М-Н). Аналогично, 25.2 и 25.3 получают из производного анилина 22.1 и подходящего сульфонилхлорида. Пример 26. Этот пример иллюстрирует получение 5 нитро-2-(3,5-дифторфенокси)бензонитрила Н ЯМР (400 МГц) (DMSO-d6)7.14 (д,J=2.0 Гц, 1 Н); 7.03-6.96 (м, 3 Н); 6.70 (дд, J=8.6,2.3 Гц, 2 Н); 5.60 (с, 2 Н). Соединения, приведенные в табл. 4, получают, используя 27.1 и коммерчески доступные замещенные бензолсульфонилхлориды и/или используя промежуточные соединения и способы, описанные в примерах, приведенных выше. Таблица 4 Пример 28. Этот пример иллюстрирует получение 28.1. 1(д, J=8.8 Гц, 1 Н); 7.227 (м, 1 Н); 7.103 (м, 2 Н). Пример 27. Этот пример иллюстрирует получение 5 амино-2-(3,5-дифторфенокси)бензонитрила Используя методику, описанную в примере 2, 5-нитро-2-(3,5-дифторфенокси)бензонитрил (26.1, 6,6 г) превращают в названное соединение (5,47 г, т.пл. 80-84 С), которое используют непосредственно на следующих стадиях. 1 Н ЯМР (400 МГц) (TFA/DMSO-d6)11.2 3-Амино-4-(3,5-дифторфенокси)бензонитрил (201 мг, 27.2) и 2,4-дихлорбензолсульфонилхлорид (302 мг, Maybridge), подвергают взаимодействию так, как описано в примере 3,затем нагревают до 40 С. Сырой продукт, полученный после обработки, очищают с помощью флэш-хроматографии на кремнеземе, элюируя дихлорметаном. Фракции продукта концентрируют и остаток растирают с диэтиловым эфиром, получая указанное соединение в виде белого твердого вещества (150 мг, 37%), т.пл. 197200 С. Пример 29. Этот пример иллюстрирует получение 5 нитро-2-(3,5-дихлорфенокси)бензонитрила 2-Хлор-5-нитробензонитрил (0,9 г, 5 ммоль) и 3,5-дихлорфенол подвергают взаимодействию, используя методику, описанную в примере 1, чтобы получить 1,5 г названного соединения, т.пл. 188-190 С. 1 Н ЯМР (400 МГц) (CDCl3)8.597 (д,J=2.4 Гц, 1 Н); 8.397 (ддд, J=9.2, 2.8, 0.8 Гц, 1 Н); 7.360 (дд, J=3.2, 2.0 Гц, 1 Н); 7.089 (дд, J=1.6, 0.8 Гц, 2 Н) 7.008 (д, J=9.6 Гц, 1 Н). Пример 30. Этот пример иллюстрирует получение 5 амино-2-(3,5-дихлорфенокси)бензонитрила К раствору 5-нитро-2-(3,5-дихлорфенокси)бензонитрила (29.1, 1,5 г) в этилацетате (45 мл) добавляют дигидрат хлорида олова(5,47 г). Смесь нагревают при 85 С 30 мин, в течение которых образуется толстый белый осадок. Реакционный сосуд охлаждают и смесь обрабатывают 100 мл 0,5N NaOH. Полученную смесь экстрагируют дважды этилацетатом. Объединенные органические экстракты сушат надMgSO4 и концентрируют под вакуумом, получая названное соединение, которое используют без дальнейшей очистки.MS m/e 279 (М+Н). Соединения, приведенные в табл. 5, получают, используя 30.1 и коммерчески доступные замещенные бензолсульфонилхлориды и/или используя промежуточные соединения и способы, описанные в приведенных выше примерах. Таблица 5 44 ную в примере 1, получая названное соединение, в виде твердого вещества коричневого цвета. 1 Н ЯМР (400 МГц) (DMSO)8.84 (д,J=2.8, 1 Н), 8.44 (дд, J=9.3, 2.8 Гц, 1H), 7.07 (д,J=9.3 Гц, 1 Н), 6.51 (с, 3 Н), 3.76 (с, 6 Н). Пример 32. Этот пример иллюстрирует получение 5 амино-2-(3,5-диметоксифенокси)бензонитрила К раствору 5-нитро-2-(3,5-дихлорфенокси)бензонитрила (31.1, 8,76 г) в этилацетате добавляют хлорид олова (33 г). Смесь нагревают до кипения в течение часа. Полученную смесь охлаждают и добавляют раствор 0,5N гидроксида натрия, чтобы вызвать выпадение в осадок соли олова, которую удаляют фильтрованием. Фильтрат концентрируют, получая 7,5 г названного соединения в виде твердого вещества оранжевого цвета, которое используют на последующих стадиях без дальнейшей очистки. 1 Н ЯМР (400 МГц) (DMSO-d6)6.95-6.87(м, 3 Н); 6.25 (т, J=2.2 Гц, 1 Н); 6.04 (д, J=2.2 Гц,2 Н); 5.49 (с, 2 Н); 3.70 (с, 6 Н). Соединения, приведенные в табл. 6, получают, используя 32.1 и коммерчески доступные замещенные бензолсульфонилхлориды и/или используя промежуточные соединения и способы, описанные в приведенных выше примерах. Таблица 6 Пример 31. Этот пример иллюстрирует получение 5 нитро-2-(3,5-диметоксифенокси)бензонитрила Пример 33. Этот пример иллюстрирует получение 3 метокси-4-(3,5-дифторфенокси)нитробензола званное соединение в виде густого масла коричневого цвета, которое затвердевает при растирании в гексане/метаноле с выходом 1,33 г 33.1, в виде твердого вещества красного цвета. 1 Н ЯМР (400 МГц) (DMSO-d6)7.963 (д,J=2.6 Гц, 1H); 7.903 (дд, J=8.8, 2.7 Гц, 1H); 7.316(д, J=2.2 Гц, 2 Н); 3.927 (с, 3 Н); 3.716 (с, 6 Н). Каждое из производных нитробензола(33.1, 33.2 и 33.3) восстанавливают до соответствующего производного анилина, используя никель Ренея по методике, описанной в примере 2. Производные анилина затем превращают в соединения, представленные в табл. 7, используя коммерчески доступные замещенные бензолсульфонилхлориды и/или используя промежуточные соединения и способы, описанные в приведенных выше примерах. Таблица 7 Пример 34. Этот пример иллюстрирует синтез 5-(4 хлорсульфонил-2-цианофенокси)-3-хлорпиридина (34.1). Производное анилина 2.1 (3,11 г, 12,69 ммоль) превращают в соответствующий сульфонилхлорид согласно методике, описанной R.V. Hoffman (Org. Syn. Coll. Vol., VII, 508-511), с выходом 770 мг (18%) 34.1 в виде белого твердого вещества.MS ESI m/e: 331.0 (M + H). Пример 35. Этот пример иллюстрирует синтез соединения 35.1. Указанное соединение получают, используя методику описанную в примере 3, исходя из 4-иоданилина (136 мг, 0,6197 ммоль, AldrichChemical Co.), 5-(4-хлорсульфонил-2-цианофенокси)-3-хлорпиридина (136 мг, 0,4131 ммоль,34,1), пиридина (49 мг, 0,6197 ммоль), каталитического количества DMAP и 3 мл хлористого метилена. Получают продукт в виде белого твердого вещества (187 мг, 89%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.57 (1H,с); 8.62 (1 Н, д, J=1.8 Гц); 8.60 (1 Н, д, J=2.2 Гц); 8.28 (1H, д, J=2.4 Гц); 8.12 (1 Н, д, J=2.2 Гц); 7.93MS ESI m/e: 509.9 (М-Н). Пример 36. Этот пример иллюстрирует синтез соединения 36.1.Chemical Co.), 5-(4-хлорсульфонил-2-цианофенокси)-3-хлорпиридина (62 мг, 0,46 ммоль), пиридина (36 мг, 0,46 ммоль), каталитического количества DMAP и 3 мл хлористого метилена. Указанное соединение 36.1 получают в виде белого твердого вещества (120 мг, 92%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.53 (1 Н,с); 8.58 (1H, д, J=1.9 Гц); 8.53 (1 Н, д, J=2.4 Гц); 8.15 (1H, д, J=2.5 Гц); 7.99 (1 Н, дд, J1=4.4 ГцMS ESI m/e: 425.9 (М-Н). Пример 37. Этот пример иллюстрирует синтез 5-(4 хлорсульфонил-2-хлорфенокси)-3-хлорпиридина (37.1).VII, 508-511). Названное соединение получают в виде бледно-желтого твердого вещества (1,65 г,59%).MS ESI m/e: 338.0 (М+Н). Пример 38. Этот пример иллюстрирует синтез соединения 38.1. Указанное соединение получают, используя методику, описанную в примере 35, исходя из 4-иоданилина (101 мг, 0,46 ммоль), 5-(4 хлорсульфонил-2-хлорфенокси)-3-хлорпиридина (104 мг, 0,31 ммоль), пиридина (35 мг, 0,46 ммоль), каталитического количества DMAP и 3 мл хлористого метилена. Соединение 38.1 получают в виде белого твердого вещества (150 мг,94%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.50 (1H,с), 8.55 (1 Н, д, J=2.1 Гц), 8.45 (1H, д, J=2.5 Гц),7.93 (1H, д, J=2.2 Гц), 7.89 (1 Н, дд, J1=4.4 ГцMS ESI m/e 518.9 (M-H). Пример 39. Этот пример иллюстрирует синтез соединения 39.1. Указанное соединение получают, используя способ по примеру 38, исходя из 4-ацетиланилина (55 мг, 0,41 ммоль), 5-(4-хлорсульфонил-2-хлорфенокси)-3-хлорпиридина (92 мг,0,27 ммоль), пиридина (33 мг, 0,41 ммоль), каталитического количества DMAP, 3 мл хлористого метилена. После обработки получают 39.1 в виде белого твердого вещества (130 мг, 93%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.94 (1 Н,с); 8.54 (1 Н, д, J=2.0 Гц); 8.44 (1H, д, J=2.2 Гц); 8.01 (1H, д, J=2.1 Гц); 7.90 (1 Н, дд, J1=4.4 ГцMS ESI m/e: 435.0 (М-Н). Пример 40. Этот пример иллюстрирует получение 5(4-амино-2,5-дибромфенокси)-3-хлорпиридина К 0,1 М раствору 3-бром-4-(3-хлор-5 пиридилокси)анилина (20.1) в уксусной кислоте добавляют бром (Aldrich). Полученный раствор перемешивают два дня. Большую часть уксусной кислоты удаляют азеотропно, используя гексан, и остаток доводят до рН 6, используя 4 М водный NaOH. Водный слой экстрагируют этилацетатом и объединенные органические порции промывают рассолом (2 Х), сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Продукты разделяют хроматографически, получая 5-(4-амино-2,5 дибромфенокси)-3-хлорпиридин (40.1, 32%), 5(4-амино-2,3-дибромфенокси)-3-хлорпиридин(25, М+Н). Пример 41. Этот пример иллюстрирует получение 5(4-(2,4-дихлорбензолсульфонамидо)-2,5 дибромфенокси)-3-хлорпиридина (41.1).(17, М+Н). Пример 42. Этот пример иллюстрирует получение 5(4-амино-2-циано-3-бромфенокси)-3-хлорпиридина (42.1).(см. пример 2) подвергают взаимодействию с бромом в уксусной кислоте по методике, аналогичной описанной в примере 40, с получением 5-(4-амино-2-циано-3-бромфенокси)-3-хлорпиридина (37%) после хроматографической обработки. 1 Н ЯМР (400 МГц, DMSO-d6)8.44 (д, J= 1.8 Гц, 1H), 8.37 (д, J=2.2 Гц, 1 Н), 7.7 (дд, J=2.2, 004887MS (EI) m/z 328 (30, М+Н), 327 (13, М+Н),326 (100, М+Н), 325 (10, М+Н), 324 (75, М+Н). Пример 43. Этот пример иллюстрирует синтез 5-(4(2,4-дихлорбензолсульфонамидо)-2-циано-3 бромфенокси)-3-хлорпиридина (43.1).MS (EI): m/z 537 (20, М+Н), 535 (73, М+Н),533 (100, М+Н), 531(52, М+Н). Пример 44. Этот пример иллюстрирует получение 5(4-амино-5-бром-2-метоксифенокси)-3-хлорпиридина (44.1). К 0,2 М раствору 5-(4-амино-2-метоксифенокси)-3-хлорпиридина (200 мг, 0,8 ммоль,22.1) в СН 2 Сl2 при 0 С добавляют 2,4,4,6 тетрабром-2,5-циклогексадиенона (334 мг, 0,82 ммоль, Lancaster). Полученный раствор перемешивают 21 ч при комнатной температуре. Реакционную смесь разбавляют СН 2 Сl2 (50 мл),промывают дважды 2 М водным раствором гидроксида натрия (50 мл), один раз рассолом (50 мл), сушат над Na2SO4 и концентрируют под вакуумом. Сырое твердое вещество очищают с помощью колоночной хроматографии (0-2% МеОН в CH2Cl2) и получают 133 мг (50%) названного соединения в виде твердого вещества коричневого цвета. 1 Н ЯМР (400 МГц, DMSO-d6)8.27 (д, J= 2.2 Гц, 1 Н), 8.17 (д, J=2.6 Гц, 1 Н), 7.26 (дд, J=MS (EI): m/z 329 (80, М+Н), 330 (12, М+Н),331 (100, М+Н), 332 (16, М+Н), 333 (28, М+Н),334 (4, М+Н). Пример 45. Этот пример иллюстрирует получение 5(4-(2,4-дихлорбензолсульфонамидо)-5-бром-2 метоксифенокси)-3-хлорпиридина (45.1).MS (EI): m/z 537 (58, М+Н), 538 (10, М+Н),539 (100, М+Н), 540 (20, М+Н). 541 (70, М+Н),542 (15, М+Н), 543 (25, М+Н). Пример 46. Этот пример иллюстрирует получение 5(4-амино-5-бром-2-хлорфенокси)-3-хлорпиридина (46.1). 52 Пример 47. Этот пример иллюстрирует получение 5(4-(2,4-дихлорбензолсульфонамидо)-5-бром-2 хлорфенокси)-3-хлорпиридина (47.1).MS (EI): m/z 539 (40, М-Н), 540 (10, М-Н),541 (100, М-Н), 542 (20, М-Н), 543 (80, М-Н),544 (25, М-Н), 545 (35, М-Н), 546 (5, М-Н). Пример 48. Этот пример иллюстрирует получение 5(3-хлор-4-амино-2-(N-этилкарбоксамидофенокси-3-хлорпиридина (48.1) и 5-(5-хлор-4-амино 2-(N-этилкарбоксамидофенокси-3-хлорпиридина (48.2). К 0,1 М раствору 5-(4-амино-2-(N-этилкарбоксамидофенокси-3-хлорпиридина (1 г,3,6 ммоль, полученного как описано в U.S.S. N. 09/234,327) в АсОН добавляют бром (194 мкл,3,8 ммоль) и полученный раствор перемешивают 2 дня. Большую часть АсОН удаляют азеотропно, используя гексан, и полученный раствор доводят до значения рН 6, используя 4 М водный раствор NaOH. Водный слой экстрагируют три раза с помощью ЕtOАс (50 мл) и объединенные органические слои промывают дважды водным раствором рассола (100 мл), сушат над Na2SO4 и концентрируют под вакуумом. Сырое твердое вещество очищают хроматографически (50-100% EtOAc в гексане) для отделения продуктов 48.1 и 48.2 от исходных веществ и дибромсодержащих продуктов. Необходимые продукты затем вновь подвергают хроматографии (1-3% СН 3 ОН в СН 2 Сl2) с получением 478 мг (36%) 48.1 и 198 мг (15%) 48.2 в виде белого твердого вещества.MS (EI): m/z 370 (80, М+Н), 371 (15, М+Н),372 (100, М+Н). 373 (18, М+Н), 374 (25, М+Н). Пример 49. Этот пример иллюстрирует получение 5(5-бром-4-(2,4-дихлор-5-метилбензолсульфонамидо)-2-(N-этилкарбоксамидо)фенокси)-3 хлорпиридина (49.1). Названное соединение получают с 67% выходом из 48.1 и 2,4-дихлор-5-метилбензолсульфонилхлорида, используя методику, приведенную в примере 3. 1 Н ЯМР (400 МГц, DMSO-d6)10.41 (с,1 Н), 8.48 (д, J=2.1 Гц, 1 Н), 8.35 (т, J=5.4 Гц, 1 Н),8.31 (д, J=2.5 Гц, 1 Н), 7.85 (уширенный синглет,2 Н), 7.6 (дд, J=2.3, 2.2 Гц, 1H), 7.41 (с, 1 Н), 7.39(100, М-Н), 591 (12, М-Н), 590 (50, М-Н). Пример 50. Этот пример иллюстрирует получение 5(5-бром-4-(2,4-дихлорбензолсульфонамидо)-2(N-этилкарбоксамидо)фенокси)-3-хлорпиридина Названное соединение получают с 28% выходом из 48.1 и 2,4-дихлорбензолсульфонилхлорида, используя методику, приведенную в примере 3.MS (EI) m/z 585 (8, М+Н), 584 (25, М+Н),583 (18, М+Н), 582 (70, М+Н), 581 (25, М+Н),580 (100, М-Н), 579 (12, М+Н), 578 (50, М+Н). Пример 51. Этот пример иллюстрирует получение 5(3-бром-4-(2,4-дихлор-5-метилбензолсульфонамидо)-2-(N-этилкарбоксамидо)фенокси)-3 хлорпиридина (51.1). Названное соединение получают с 37% выходом из 48.2 и 2,4-дихлор-5-метилбензолсульфонилхлорида, используя методику, приведенную в примере 3. 1 Н ЯМР (400 МГц, DMSO-d6)10.39 (с,1 Н), 8.55 (т, 1 Н), 8.42 (д, 1H), 8.31 (д, 1 Н), 7.89MS (EI) m/z 599 (8, М+Н), 598 (25, М+Н),597 (18, М+Н), 596 (70, М+Н), 595 (25, М+Н),594 (100, М-Н), 593 (12, М+Н), 592 (50, М+Н). Пример 52. Этот пример иллюстрирует синтез 5-(5 бром-4-хлорсульфонил-2-метоксифенокси)-3 хлорпиридина (52.1).(Org. Syn. Coll. Vol., VII, 508-511), получая 1,26 г (84%) 52.1 в виде прозрачного масла, которое используют без очистки.MS ESI m/e: 412.0 (М+Н). Пример 53. Этот пример иллюстрирует получение 53.1.Chemical Co.), 5-(5-бром-4-хлорсульфонил-2 метоксифенокси)-3-хлорпиридин (236 мг, 0,57 ммоль), пиридин (45 мг, 0,57 ммоль), каталитическое количество DMAP и 2 мл хлористого метилена подвергают взаимодействию, используя общую методику, приведенную в примере 35. Названное соединение получают (245 мг,85%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.80 (1 Н,с); 8.43 (1H, д, J=2.0 Гц); 8.30 (1 Н, д, J=2.4 Гц); 7.74 (1 Н, с); 7.64 (1 Н, дд, J=4.4 Гц, 2.2 Гц); 7.52MS ESI m/e: 435.0 (М-Н). Пример 54. Этот пример иллюстрирует получение 54.1. Используя аналогичную методику, описанную в примере 53, 4-иоданилин (83 мг, 0,38 ммоль), 5-(5-бром-4-хлорсульфонил-2-метоксифенокси)-3-хлорпиридин (155 мг, 0,38 ммоль),пиридин (30 мг, 0,38 ммоль), каталитическое количество DMAP и 2 мл хлористого метилена подвергают взаимодействию и перемешивают. После обработки указанное соединение получают (162 мг, 73%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.80 (1 Н,с); 8.43 (1H, д, J=2.0 Гц); 8.31 (1H, д, J=2.4 Гц); 7.75 (1H, с); 7.64 (1 Н, дд, J=4.4 Гц, 2.2 Гц); 7.58MS ESI m/e: 592.8 (М-Н). Пример 55. Этот пример иллюстрирует получение 55.1. Используя аналогичную методику, описанную в примере 53, 4-ацетиланилин (69 мг,0,51 ммоль), 5-(5-бром-4-хлорсульфонил-2 метоксифенокси)-3-хлорпиридин (210 мг, 0,51 ммоль), пиридин (40 мг, 0,51 ммоль), каталитическое количество DMAP и 2 мл хлористого метилена объединяют и перемешивают. После обработки указанное соединение получают (192 мг, 74%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц) (d6-DMSO)10.80 (1 Н,с); 8.43 (1 Н, д, J=2.0 Гц); 8.31 (1 Н, д, J=2,4 Гц); 7.75 (1 Н, с); 7.64 (1 Н, дд, J=4.4 Гц, 2.2 Гц); 7.58MS ESI m/e: 509.0 (М-Н). Пример 56. Этот пример иллюстрирует получение 3 хлор-4-(2-нафтилокси)нитробензола (56.1). В колбу объемом 250 мл добавляют 3 хлор-4-фторнитробензол (Aldrich) (5,0 г, 28 ммоль), 2-нафтол (Aldrich) (4,5 г, 31 ммоль),Cs2CO3 (Aldrich) (9,7 г, 30 ммоль) и ДМФА (80 мл). Смесь нагревают при 100 С в течение ночи. После удаления ДМФА под вакуумом смесь выливают в воду и экстрагируют дихлорметаном. Органический раствор затем промывают рассолом, сушат над сульфатом магния. После фильтрования фильтрат концентрируют под вакуумом, получая сырой продукт, который затем хроматографируют с элюентом (30% дихлорметан/ гексан), получая названное соединение (6,8 г, 24 ммоль, 86%). Пример 57. Этот пример иллюстрирует получение соединений 57.1, 57.2, 57.3 и 57.4. Соединение 56.1 восстанавливают до соответствующего производного анилина (57.1),используя методику, приведенную в примере 2,и превращают в соединения, приведенные в табл. 8, используя коммерчески доступные замещенные бензолсульфонилхлориды и/или используя промежуточные соединения и способы,описанные в приведенных выше примерах. Пример 58. Этот пример иллюстрирует синтез 3-хлор(2,4-дихлорбензолсульфонамидо)бензола (58.1).(6,29 ммоль) 2,4-дихлорсульфонилхлорида, 497 мг (6,29 ммоль) пиридина, каталитического количества DMAP и 10 мл хлористого метилена. Названное соединение получают в виде белой пены (928 мг, 44%).MS ESI m/e: 334.0 (M-H). Пример 59. Этот пример иллюстрирует синтез соединения 59.1. В круглодонную колбу загружают 330 мг(0,99 ммоль) 3-хлор-(2,4-дихлорбензолсульфонамидо)бензола (58,1), 397 мг (2,97 ммоль, Aldrich Chemical Co.) безводного треххлористого алюминия и 2 мл сухого дихлорэтана. Затем по каплям добавляют 210 мг (1,19 ммоль, AldrichChemical Co.) 3,5-дифторбензоилхлорида и полученный темно-красный раствор перемешивают в течение ночи при комнатной температуре. Затем реакционную массу разбавляют 30 мл хлористого метилена, промывают последовательно 2N НСl и рассолом, сушат над MgSO4 и концентрируют до получения темного масла. Затем его очищают на силикагеле с помощью флэш-хроматографии (элюируя 1,24 этилацетатом/хлористым метиленом). Полученную прозрачную глазурь перекристаллизовывают изMS ESI m/e: 473.9 (М-Н). Пример 60. Этот пример иллюстрирует синтез соединения 60.1.Co.) 3,5-дихлорбензоилхлорида и 2 мл сухого дихлорэтана. Указанное соединение получают в виде белого твердого вещества (139 мг, 32%). 1 Н ЯМР (400 МГц) (d6-DMSO)11.49 (1H,с) 8.15 (1 Н, д, J=8.6 Гц); 7.97 (1 Н, д, J=3.8 Гц); 7.91 (1H, д, J=2.1 Гц); 7.69 (1 Н, дд, J=8.5 Гц, 2.0 Гц); 7.58 (2 Н, д, J=1.9 Гц), 7.47 (1 Н, д, 1=8.4 Гц); 7.24 (1 Н, д, J=2.0 Гц); 7.17 (1 Н, дд, J=8.4 Гц, 2.1 Гц).MS ESI m/e: 505.9 (М-Н). Пример 61. Этот пример иллюстрирует синтез соединения 61.1. Диарилкетон 59.1 (103 мг, 0,22 ммоль) восстанавливают до метиленового соединения 61.1 в соответствии с методикой приведенной(1973). Указанное соединение получают в виде белого твердого вещества (86 мг, 86%). 1 Н ЯМР (400 МГц) (d6-DMSO)10.96 (1 Н,с) 8.05 (1H, д, J=8.6 Гц); 7.87 (1H, д, J=2.0 Гц); 7.63 (1 Н, дд, J=8.5 Гц, 2.1 Гц); 7.23 (1H, д, J=8.5 Гц); 7.14 (1 Н, д, J=2.2 Гц); 7.02 (2 Н, м); 7.17 (2 Н,м).MS ESI m/e: 460.0 (М-Н). Пример 62. Этот пример иллюстрирует получение 2 хлор-4-(3-хлор-5-пиридилокси)нитробензола 62.1. 5-Хлор-3-пиридинол (5 г, Aldrich) и 2,4 дихлорнитробензол (7,4 г, Aldrich) подвергают взаимодействию, как описано в примере 1. Названное соединение выделяют как побочный продукт, используя градиентную хроматографию на кремнеземе, элюируя 10% этилацетатом/гексаном. 1 Н ЯМР (400 МГц) (DMSO-d6)8.53 (с,1 Н), 8.4 (с, 1H), 8.0 (д, J=8.9 Гц, 1H), 7.44 (т,J=l.9 Гц, 1 Н), 7.26 (д, J=l.5 Гц, 1 Н), 7.14 (д, J=2.7 Гц, 1 Н), 6.99 (дд, J=9.0, 2.6 Гц, 1 Н), 1.6 (примесь). Пример 63. Этот пример иллюстрирует получение 2 хлор-4-(3-хлор-5-пиридилокси)анилина 63.1 Соединение 62.1 восстанавливают, используя методику, приведенную в примере 2, получая названное соединение в виде твердого вещества желтого цвета. 1 Н ЯМР (400 МГц) (DMSO)8.33 (д, J=2.1 Гц, 1 Н), 8.25 (д, J=2.4 Гц, 1 Н), 7.41 (т, J=2.2 Гц,1 Н), 7.12 (д, J=2.6 Гц, 1H), 6.91 (дд, J=2.6, 8.8 Гц, 1H), 6.84 (д, J=8.8 Гц, 1H), 5.35 (с, 2 Н). Пример 64. Этот пример иллюстрирует получение 64.1. Соединение 63.1 и 2,4-дихлорбензолсульфонилхлорид подвергают взаимодействию с пиридином и DMAP, используя методику,описанную в примере 3. Сырой продукт очищают с помощью флэш-хроматографии на кремнеземе, элюируя дихлорметаном. Полученный продукт затем растирают с этиловым эфиром/гексаном с получением указанного соединения в виде белого твердого вещества.MS ESI m/e: 461 (М-Н). Пример 65. Этот пример иллюстрирует получение 65.1. Соединение 63.1 и 3,4-дихлорбензолсульфонилхлорид подвергают взаимодействию с пиридином и DMAP, используя методику, описанную в примере 3. Сырой продукт очищают с помощью флэш-хроматографии на кремнеземе,элюируя 5% этилацетатом/дихлорметаном. Полученный продукт затем растирают в гексане с получением указанного соединения в виде белого твердого вещества.MS ESI m/e: 461 (М-Н). Пример 66. Этот пример иллюстрирует получение 66.1.
МПК / Метки
МПК: A61K 31/18, C07C 311/21, C07D 213/65
Метки: соединения, ppar&gamma, модулирующие, активность
Код ссылки
<a href="https://eas.patents.su/30-4887-soedineniya-moduliruyushhie-aktivnost-ppargamma.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, модулирующие активность ppar&gamma</a>
Предыдущий патент: Модуляторы рецепторов глюкокортикоидов
Следующий патент: Бездымный табачный продукт
Случайный патент: Комбинация феррохина и производного артемизинина для лечения малярии