Антитела к рецептору ii tgf-бета
Формула / Реферат
1. Антитело человека, которое специфически связывается с TGFβRII человека, содержащее:
CDRH1 с последовательностью GGSISNSYF (SEQ ID NO: 1);
CDRH2 с последовательностью SFYYGEKTYYNPSLKS (SEQ ID NO: 2);
CDRH3 с последовательностью GPTMIRGVIDS (SEQ ID NO: 3);
CDRL1 с последовательностью RASQSVRSYLA (SEQ ID NO: 10);
CDRL2 с последовательностью DASNRAT (SEQ ID NO: 11);
CDRL3 с последовательностью QQRSNWPPT (SEQ ID NO: 12),
или фрагмент указанного антитела, которое специфически связывается с TGFβRII человека и содержит указанные CDRH1-3 и CDRL1-3.
2. Антитело по п.1, содержащее
аминокислотную последовательность HCVR:

аминокислотную последовательность LCVR:
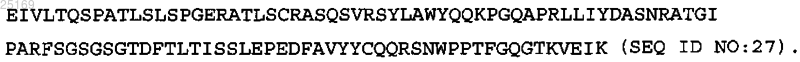
3. Антитело по п.2, содержащее тяжелую цепь SEQ ID NO: 37.
4. Антитело по п.2, содержащее тяжелую и легкую цепи, где указанная тяжелая цепь содержит SEQ ID NO: 37, указанная легкая цепь содержит аминокислотную последовательность LCVR
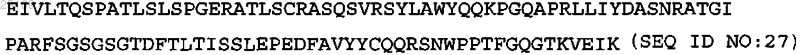
и константную область легкой цепи.
5. Антитело по п.2, содержащее две тяжелые и две легкие цепи, где указанные тяжелые цепи содержат SEQ ID NO: 37, указанные легкие цепи содержат аминокислотную последовательность LCVR:
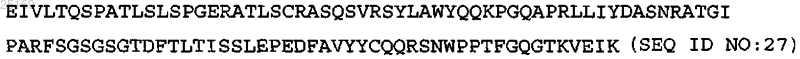
и две константные области легкой цепи.
6. Антитело по любому из пп.1-5, которое специфически связывается с экстрацеллюлярным доменом рецептора II TGFβ человека (TGFβRII) с KD, равным 10-80 пМ.
7. Антитело по любому из пп.1-5, которое ингибирует TGFβ-индуцируемое фосфорилирование Smad2 с IC50, равным 4-30 нМ.
8. Антитело по любому из пп.1-5, которое ингибирует TGFβ-индуцируемое фосфорилирование Smad2 с IC50, равным 4,5-25,5 нМ.
9. Антитело по любому из пп.1-5, где указанное антитело блокирует связывание TGFβ1, TGFβ2 или TGFβ3 человека с TGFβRII человека с IC50, равным 0,10-0,54 нМ, как определено ELISA.
10. Фармацевтическая композиция для лечения рака, где раком является рак молочной железы, рак поджелудочной железы или рак легких, содержащая антитело по любому из пп.1-9 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
11. Комбинация для одновременного, раздельного или последовательного применения для лечения рака, где раком является рак молочной железы, рак поджелудочной железы или рак легких, содержащая антитело по любому из пп.1-9 и дополнительное противоопухолевое средство.
12. Применение антитела или фрагмента по любому из пп.1-9 для получения лекарственного средства для лечения рака, где раком является рак молочной железы, рак поджелудочной железы или рак легких.
Текст
Изобретение относится к антителам, которые связывают рецептор II трансформирующего фактора роста бета (TGFRII) человека, фармацевтическим композициям, содержащим антитела, и способам применения антител в отдельности или в комбинации, например, для лечения рака и фиброза. Заявка на данное изобретение испрашивает приоритет заявки США 61/198697, поданной 7 ноября 2008 г., и заявки США 61/170369, поданной 17 апреля 2009 г. Настоящее изобретение относится к области медицины, в частности к антителам, которые связывают рецептор II трансформирующего фактора роста бета человека (TGFRII), фармацевтическим композициям, содержащим антитела, и способам применения таких антител, например, для лечения рака, фиброза и фиброзных заболеваний. Факторы TGF представляют собой плейотропные цитокины, которые регулируют рост и дифференцировку клеток, подвижность, выработку внеклеточного матрикса и иммунные функции. ФакторыTGF включают три изоформы TGF-1, TGF-2 и TGF-3 млекопитающих, каждая из которых выполняет определенные функции in vivo. Все три TGF используют одну сигнальную рецепторную систему. Связывание TGF с TGFRII является ключевым этапом в первоначальной активации сигнального путиTGF, приводящего к фосфорилированию Smad2 и переносу активированного комплекса Smad2/Smad4 в ядро для модуляции экспрессии генов. В документе JP 2004/121001A описаны моноклональные антитела человека (МАТ), которые связывают TGFRII человека с высокой степенью сродства (KD 8,0610-10 и 1,9110-9 М), для лечения заболевания почек и тканевого фиброза. В заявке также указано, что МАТ подавляют вызванный TGF рост кератиноцитов (среднее значение IC50 2,17-3,89, 3,17-4,95 и 3,21-5,07 мкг/мл). Сообщалось, что применение моноклонального антитела человека к TGFRII эффективно для снижения отложения внеклеточного матрикса в модели анти-Thy-1 нефрита у крыс (Kasuga, H., et al., Kidney Int'l, Vol. 60 (2001). 1745-1755). До сих пор не были описаны высокоспецифичные, обладающие высоким сродством антитела кTGFRII, которые специфично связывают внеклеточный домен TGFRII человека с очень высокой степенью сродства, блокируют связывание TGF1, TGF2 и TGF3 человека с TGFRII человека, подавляют ангиогенез, рост опухолевых клеток, миграцию и инвазию опухолевых клеток, снижают отложение коллагена и функцию печени, подавляют вызванную лигандами регуляцию Т-клеток или, в сочетании с цитотоксическими агентами, подавляют рост опухоли. Поэтому существует потребность в указанных антителах. Настоящее изобретение направлено на обеспечение новых выделенных МАТ к TGFRII, которые удовлетворят эти потребности. TGF бета RII представляет собой рецептор млекопитающего, предпочтительно человека. Антитела согласно настоящему изобретению оказывают одно или более из следующих действий: 1) связываются с высокой степенью сродства с внеклеточным доменом TGFRII человека; 2) блокируют связывание лигандов TGFRII (TGF1, TGF2 и TGF3) с TGFRII, тем самым ингибируют вызванное TGF фосфорилирование Smad2; 3) интернализируют TGFRII, который способен выступать в качестве механизма понижающей регуляции передачи сигнала, независимого от взаимодействия лиганда с рецептором; 4) подавляют лиганд-индуцируемые пути передачи сигнала TGFRII; 5) подавляют функции клетки, опосредованные TGFRII; 6) подавляют рост опухоли in vitro и in vivo; а также более предпочтительно дополнительно способны оказывать одно или более из следующих действий: 7) подавлять ангиогенез посредством снижения секреции фактора роста эндотелия сосудов A (VEGF-A),вызванной TGF; 8) подавлять миграцию и инвазию раковых клеток; 9) снижать отложение коллагена и функцию печени; 10) подавлять вызванную лигандом регуляцию Т-клеток с образованием Т-регуляторных клеток, которые оказывают иммуносупрессивное действие; или 11) в комбинации с цитотоксическими агентами подавлять рост опухоли. Моноклональное антитело с высокой степенью сродства, которое избирательно связывается сTGFRII и нейтрализует TGFRII-опосредованную активность, будет особенно полезно в качестве терапевтического биологического агента для лечения заболеваний, опосредованных сигналлингом TGF. Согласно первому аспекту настоящее изобретение обеспечивает выделенные антитела, которые специфично связываются с внеклеточным доменом TGFRII человека с KD менее 100 пМ при комнатной температуре (20-25C). Согласно одному аспекту настоящего изобретения антитела согласно настоящему изобретению блокируют связывание TGF1, TGF2 или TGF3 человека с TGFRII с IC50 менее 1,0 нМ согласно результатам анализа ELISA. Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению подавляют вызванное TGF фосфорилирование Smad2 с IC50 менее 30 нМ. Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению включают антитело, которое специфично связывается с TGFRII, содержащее:(SEQ ID NO: 11), и участок CDRL3, содержащий последовательность QQRSNWPPT (SEQ ID NO: 12). Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению содержат: Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению содержат аминокислотную последовательность HCVR: Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению содержат:ii) тяжелую цепь, содержащую последовательность SEQ ID NO: 6, и легкую цепь, содержащую последовательность SEQ ID NO: 14. Согласно другому аспекту настоящего изобретения антитела согласно настоящему изобретению содержат две тяжелые цепи, содержащие последовательность SEQ ID NO: 37, и две легкие цепи. Согласно другому аспекту настоящего изобретения настоящее изобретение включает фрагмент,связывающий TGFRII человека. Предполагается, что любое антитело согласно настоящему изобретению можно вводить пациенту,нуждающемуся в таком лечении. Соответственно согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая антитело или фрагмент согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или наполнитель. Согласно предпочтительному аспекту настоящего изобретения антитело или функциональный фрагмент указанного антитела конкурирует за связывание с внеклеточным доменом TGFRII в процессе конкурентного анализа ELISA с конкурентным антителом, при этом указанное конкурентное антитело связывает TGFRII с KD менее 100 пМ при комнатной температуре (20-25C). Согласно другому предпочтительному аспекту настоящего изобретения антитело согласно настоящему изобретению блокирует связывание TGF1, TGF2 или TGF3 человека с TGFRII человека с IC50 менее 1,0 нМ согласно результатам анализа ELISA. Предполагается также, что МАТ согласно настоящему изобретению можно применять для лечения фиброза или фиброзных заболеваний легких, печени и почек. Согласно одному аспекту настоящего изо-2 025169 бретения предложен способ лечения фиброза или фиброзных заболеваний легких, печени и почек, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества МАТ согласно настоящему изобретению. Согласно одному аспекту настоящее изобретение обеспечивает антитела согласно настоящему изобретению для применения в качестве лекарственного средства. Согласно одному аспекту настоящее изобретение обеспечивает антитела согласно настоящему изобретению для применения для лечения рака. Согласно дополнительному аспекту настоящее изобретение обеспечивает антитела для применения для лечения рака молочной железы, рака легких или рака поджелудочной железы. Антитела согласно настоящему изобретению можно применять для лечения рака совместно с противоопухолевым агентом. Согласно другому аспекту настоящее изобретение обеспечивает продукт, содержащий антитело или фрагмент указанного антитела и дополнительный противоопухолевый агент для комбинированного одновременного, раздельного или последовательного терапевтического применения. Согласно предпочтительному аспекту настоящее изобретение обеспечивает выделенное антитело,которое специфично связывается с внеклеточным доменом hTGFRII, содержащим участок CDRH1, содержащий последовательность GGSISX1SX2X3 (SEQ ID NO: 17), где X1 представляет собой N или S, Х 2 представляет собой Y или S и Х 3 представляет собой F или Y; участок CDRH2, содержащий последовательность SFYYX1X2X3TYYX4PSLKS (SEQ ID NO: 18), гдеX1 представляет собой G или S, Х 2 представляет собой Е или G, Х 3 представляет собой K или I, Х 4 представляет собой N или S; участок CDRH3, содержащий последовательность GX1TMIRGX2X3DX4 (SEQ ID NO: 42), где X1 представляет собой Р или F, Х 2 представляет собой V или А, Х 3 представляет собой I или L, Х 4 представляет собой S или Y; участок CDRL1, содержащий последовательность RASQSVRSX1LA (SEQ ID NO: 20), где X1 представляет собой Y или F; участок CDRL2, имеющий последовательность DASNRAT (SEQ ID NO: 11); и участок CDRL3, содержащий последовательность QQRSNWPPT(SEQ ID NO: 12). Согласно другому аспекту настоящее изобретение обеспечивает способ лечения рака у пациента,включающий введение указанному пациенту эффективного количества антител согласно настоящему изобретению. Рак может представлять собой рак молочной железы, рак легкого или рак поджелудочной железы. Антитела можно вводить пациенту совместно с эффективным количеством другого противоопухолевого агента одновременно, по отдельности или последовательно. Противоопухолевый агент может представлять собой циклофосфамид. Согласно другому аспекту настоящее изобретение обеспечивает выделенное антитело, которое специфично связывается с внеклеточным доменом рецептора II TGF (TGFRII) человека, содержащим участок CDRH1, содержащий последовательность GGSISNSYF (SEQ ID NO: 1),участок CDRH2, содержащий последовательность SFYYGEKTYYNPSLKS (SEQ ID NO: 2),участок CDRH3, содержащий последовательность GPTMIRGVIDS (SEQ ID NO: 3),участок CDRL1, содержащий последовательность RASQSVRSYLA (SEQ ID NO: 10),участок CDRL2, содержащий последовательность DASNRAT (SEQ ID NO: 11), и участок CDRL3, содержащий последовательность QQRSNWPPT (SEQ ID NO: 12); или участок CDRH1, содержащий последовательность GGSISSSSY (SEQ ID NO: 7),участок CDRH2, содержащий последовательность SFYYSGITYYSPSLKS (SEQ ID NO: 8),участок CDRH3, содержащий последовательность GFTMIRGALDY (SEQ ID NO: 9),участок CDRL1, содержащий последовательность RASQSVRSFLA (SEQ ID NO: 16),участок CDRL2, содержащий последовательность DASNRAT (SEQ ID NO: 11), и участок CDRL3, содержащий последовательность QQRSNWPPT (SEQ ID NO: 12), илиTGFRII-связывающий фрагмент антитела. Другой аспект настоящего изобретения включает антитело согласно настоящему изобретению, которое содержит аминокислотную последовательность HCVR:GSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 27) или аминокислотную последовательность HCVR:TGFRII-связывающий фрагмент антитела. Другой аспект настоящего изобретения включает антитело согласно настоящему изобретению, содержащее тяжелую цепь, содержащую последовательность SEQ ID NO: 37; или тяжелую цепь, содержащую последовательность SEQ ID NO: 6, и легкую цепь, содержащую последовательность SEQ ID NO: 14. Термин "выделенное антитело" обозначает антитело, которое (1) частично, существенно или полностью очищено от смеси других компонентов; (2) идентифицировано и выделено и/или извлечено из компонента соответствующей естественной среды; (3) является моноклональным; (4) не содержит других белков тех же видов; (5) экспрессируется клеткой другого вида или (6) не встречается в природе. Примесные компоненты соответствующей естественной природы. Примесные компоненты соответствующей естественной среды представляют собой вещества, которые будут препятствовать диагностическому или терапевтическому применению антитела и могут включать ферменты, гормоны и другие белковые или небелковые вещества. К примерам выделенных антител относится антитело, которое было аффинно очищено, антитело, которое было продуцировано гибридомной клеткой или другой клеточной линией in vitro, и антитело человека, полученное из трансгенной мыши. В настоящем описании термин "антитело" обозначает молекулы иммуноглобулина, содержащие 4 полипептидные цепи, две тяжелые цепи (Н) и две легкие цепи (L), поперечно связанные дисульфидными связями. Каждая тяжелая цепь состоит из вариабельного участка тяжелой цепи (сокращенно HCVR илиVH) и константного участка тяжелой цепи. Константный участок тяжелой цепи состоит из трех доменовCH1, CH2 и СН 3. Каждая легкая цепь состоит из вариабельного участка легкой цепи (сокращенно LCVR или VL) и константного участка легкой цепи. Легкие цепи антител (иммуноглобулинов) любого вида позвоночных на основе аминокислотных последовательностей их константных доменов можно отнести к одному из двух четко выраженных типов, обозначаемых каппаи лямбда . В настоящем описании вариабельные участки легких каппа цепей обозначаются V. Термин VL в настоящем изобретении включает вариабельные участки легких цепей каппа-типа (V) и легких цепей лямбда-типа. Константный участок легкой цепи состоит из одного домена CL. Участки VH и VL содержат участки гипервариабельности, обозначаемые термином "участки, определяющие комплементарность" (CDR), между которыми расположены более консервативные участки, обозначаемые термином "каркасные участки" (FR). Каждый VH и VL состоит из трех CDR и четырех FR, которые расположены от амино- до карбоксигруппы в следующем порядке: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4."CDRH1" обозначает первый участок CDR в тяжелой цепи антитела, "CDRH2" обозначает второй участок CDR тяжелой цепи антитела, и "CDRH3" обозначает третий участок CDR тяжелой цепи антитела. "CDRL1" обозначает первый участок CDR легкой цепи антитела, "CDRL2" обозначает второй участокCDR легкой цепи антитела, и "CDRL3" третий участок CDR легкой цепи антитела. Термин "антигенсвязывающий фрагмент" обозначает часть или фрагмент интактного антитела, содержащего его антигенсвязывающий или вариабельный участок. К примерам фрагментов антител относятся антитела неполной длины, например фрагмент Fab, F(ab')2 или одноцепочечный вариабельный фрагмент (scFv). Аналогично, изобретение включает диатела, линейные антитела, одноцепочечные антитела, химерные белки, рекомбинантные белки, мультивалентные или мультиспецифичные антитела, состоящие или частично состоящие из антигенсвязывающего фрагмента согласно настоящему изобретению. В настоящем описании термин "TGF- рецептор II" или "TGFRII" обозначает рецептор поверхности клеток, который связывает лиганд, включая, но не ограничиваясь указанными, TGF1, TGF2, иTGF3, и в результате инициирует путь сигнальной трансдукции в клетке. TGFRII человека представляет собой трансмембранный белок, который кодируется последовательностью ДНК SEQ ID NO: 40. Антитела согласно настоящему изобретению связывают TGFRII человека, в частности внеклеточный домен TGFRII человека, и блокируют связывание TGF1, TGF2 и TGF3 человека с TGFRII человека. Антитела согласно настоящему изобретению также включают антитела, связывающие характеристики которых улучшили с помощью направленного мутагенеза, методами "созревания аффинности",методом фагового дисплея или перестановкой цепей, известными в данной области техники. Антитела согласно настоящему изобретению включают любую комбинацию тяжелых и легких цепей (как полноразмерных, так и их частей) антител согласно изобретению, обозначенных TGF1 и TGF3. Антитела согласно настоящему изобретению можно применять в качестве матрицы или родительского антитела для создания дополнительных антител согласно изобретению с помощью различных методов, включая пересадку CDR, обшивку или нанесение нового покрытия и перестановку цепей (например, согласно патенту US 5565332). Антитела человека согласно настоящему изобретению могут включать аминокислотные остатки, не кодируемые зародышевыми последовательностями иммуноглобулинов человека (например, мутации, возникшие из-за случайного или сайт-специфического мутагенеза in vitro или соматических мутаций in vivo), например, в CDR. Антитело человека может содержать по меньшей мере одну аминокислотную замену, например остаток аминокислоты, усиливающий активность, который не кодируется эмбриональной последовательностью иммуноглобулина человека, и таким образом, образуются дополнительные аминокислотные последовательности вариабельного участка, полученные из приведенных в настоящем описании последовательностей. Согласно одному из подходов CDR родительского антитела пересаживают на каркас человека, последовательность которого в высокой степени идентична каркасу родительского антитела. Обычно последовательность нового каркаса по меньшей мере на 80%, по меньшей мере на 85% или по меньшей мере на 90% идентична соответствующему каркасу родительского антитела. Эта пересадка может приводить к снижению связывающего сродства по сравнению с родительским антителом. В этом случае каркас может мутировать к первоначальному виду родительского каркаса в определенных позициях на основе специфических критериев, предложенных Queen (Queen, et al., Proc. Natl. Acad. Sci. USA, 88, 2869(1991. Можно использовать другие методы, включая, например, Jones et al., Nature, 321:522 (1986);Riechmann et al., Nature, 332:323-327 (1988) и Verhoeyen et al., Science, 239:1534 (1988). В специфический сайт замены можно ввести до 20 различных природных аминокислот. Затем с помощью процесса отбора in vitro, определенного в настоящем описании, можно отобрать среди этих дополнительных аминокислотных последовательностей вариабельных участков Fab фрагменты, обладающие необходимой перекрестной реактивностью in vitro. Таким образом, определяют дополнительные фрагменты Fab, которые подходят для получения гуманизированного антитела согласно настоящему изобретению. Предпочтительно замены аминокислот в каркасе ограничиваются одной, двумя или тремя позициями в пределах одной или каждой каркасной последовательности, указанной в настоящем изобретении. Предпочтительно замены аминокислот в пределах CDR ограничены одной-тремя позициями в пределах одного или каждого CDR, более предпочтительно, проводят замену аминокислот в одной или двух позициях в пределах одного или каждого CDR. Еще более предпочтительно проводят замену аминокислот в одной или двух позициях в CDR вариабельного участка тяжелой цепи. Соответствующие методы комбинирования CDR и замен в каркасе для получения альтернативных антител согласно настоящему изобретению с использованием антител, указанных в настоящем изобретении, представлены в работе Wu et al., J. Mol. Biol., 294:151-162. Термин "KD" обозначает константу диссоциации конкретного взаимодействия антигена с антителом. Ее высчитывают по формуле koff/kon=KD. Термин "kon" обозначает константу ассоциации или скорость прямой реакции или константу скорости прямой реакции или комплекс образующей реакции, измеряемую в единицах: М-1 с-1. Термин "koff" обозначает константу диссоциации или константу скорости реакции диссоциации антитела из комплекса антитела с антигеном, измеряемую в единицах: 1/с. Зачастую связывающая способность антитела согласно настоящему изобретению соответствует более низкойkoff, чем с повышенной kon, однако, не будучи связанной с теорией, изобретение включает варианты реализации изобретения с повышенными koff и kon. В одном более предпочтительном аспекте антитела согласно настоящему изобретению представляют собой антитела с большой мощностью или их фрагменты,характеризующиеся низкими значениями koff. В некоторых аспектах антитела согласно настоящему изобретению характеризуются KD приблизительно 1-200 пМ, приблизительно 5-100 пМ или приблизительно 10-80 пМ. В настоящем описании термины "блокирует связывание" и "подавляет связывание", употребляемые взаимозаменяемо, обозначают блокирование/подавление связывания цитокина с его рецептором, что приводит к полному или частичному подавлению или снижению биологической функции сигнального пути через цитокин/рецептор. Блокирование/подавление связывания TGF с TGFRII определяют посредством полного или частичного подавления или снижения одного или более in vitro или in vivo показателей активности TGF, таких как связывание с рецептором, подавляющее действие на рост клеток,хемотаксис, апоптоз, фосфорилирование внутриклеточных белков или передача сигнала. Способность блокировать связывание TGF с TGFRII можно измерять с помощью ELISA, как указано в настоящем описании. Способность подавлять работу TGF можно оценить через измерение подавления фосфорилирования Smad2 в клетке, например, клетках MDA-MB-231 человека, как указано в настоящем описании. Антитела согласно настоящему изобретению блокируют связывание TGF1, TGF2, или TGF3 человека с TGFRII человека с IC50 приблизительно 0,05-1,0 нМ, приблизительно 0,08-0,75 нМ или приблизительно 0,10-0,60 нМ. Антитела согласно настоящему изобретению подавляют фосфорилирование Smad2, вызванноеTGF, с IC50 меньше или равно приблизительно 2,0-30 нМ, приблизительно 3,0-15,0 нМ или приблизительно 4,0-7,5 нМ в анализе блокирования in vitro, например в анализе блокирования клетокMDA-MB-231 in vitro, как указано в настоящем описании. Антитела могут иметь отличающиеся или измененные характеристики гликозилирования по сравнению с природными антителами. Как известно из предшествующего уровня техники, характеристики гликозилирования могут зависеть от последовательности антитела (например, присутствия или отсутствия конкретных аминокислотных остатков гликозилирования) или клетки-хозяина или организма, в котором вырабатывается белок. Предполагается, что антитела согласно настоящему изобретению включают антитела, указанные в настоящем изобретении, а также их гликозилированные варианты. Настоящее изобретение также включает векторы экспрессии, содержащие любые из указанных в настоящем описании полинуклеотиды. К примерам векторов относятся плазмиды, фагмиды, вирусы и фаговые нуклеиновые кислоты или другие молекулы аминокислот, способные к репликации в хозяинепрокариоте или эукариоте, таком как клетка-хозяин, например клетка млекопитающего. Вектор может представлять собой вектор экспрессии, где полинуклеотид, кодирующий антитело, действенным образом связан с элементами контроля экспрессии. Типичные векторы экспрессии включают терминаторы транскрипции и трансляции, последовательности инициации и промоторы, применяемые для экспрессии молекул нуклеиновых кислот согласно настоящему изобретению. Векторы также могут включать кассеты экспрессии генов, содержащие независимую последовательность терминатора, последовательности, разрешающие репликацию вектора в организме как прокариот, так и эукариот, т.е. челночные векторы, и маркеры селекции для эукариотических и прокариотических систем. Векторы обычно содержат маркер фенотипического признака для отбора трансформированных хозяев, например маркеры устойчивости к антибиотикам, например ампициллину или неомицину. Соответствующие промоторы включают конститутивные и индуцибельные промоторы. К примерам промоторов относятся промоторы, полученные из цитомегаловируса человека, промотор металлотионеина, ранний промотор SV-40, поздний промотор SV-40, промотор вируса рака молочной железы мыши, промотор вируса саркомы Рауса и промотор полиэдрина. Также настоящее изобретение включает рекомбинатные клетки, содержащие молекулу нуклеиновой кислоты или вектор экспрессии согласно настоящему изобретению. Термин "рекомбинантная клетка" обозначает многоклеточный организм, не относящийся к человеку, или "клетку-хозяина", что обозначает клетку или популяцию клеток, в которую вводят молекулу нуклеиновой кислоты или вектор согласно настоящему изобретению. Клетка-хозяин согласно настоящему изобретению может представлять собой клетку эукариота или клеточную линию, например клетку или клеточную линию растения, позвоночного, млекопитающего, грызуна, мыши, примата или человека. Согласно одному аспекту настоящего изобретения хозяин согласно настоящему изобретению может представлять собой прокариота или эукариота. Соответствующие хозяева-прокариоты включают,например, такие штаммы Escherichia coli, как Е.coli SG-936, Е.coli НВ 101, Е.coli W3110, Е.coli X1776,Е.coli Х 2282, Е.coli DHI и Е.coli MRC1, Pseudomonas, Bacillus, такие как Bacillus subtilis, и Streptomyces. Соответствующие клетки эукариот включают дрожжи и другие грибы, клетки насекомых, растений, человека и животных, включая клетки млекопитающих, такие как гибридомные линии, клетки COS, NS0 и СНО. Настоящее изобретение включает способы получения антитела посредством культивирования рекомбинантной клетки, экспрессирующей одну или более последовательность нуклеиновой кислоты, кодирующую антитело согласно настоящему изобретению, и очистку антитела из культуральной среды. Синтезированное таким образом антитело обычно очищают или выделяют после экспрессии. Антитела можно выделять или очищать различными способами, известными специалисту в данной области техники. Стандартные способы очистки включают методы хроматографии, электрофореза, иммунологические методы, методы преципитации, диализа, фильтрации, концентрирования и хроматофокусирования. Как хорошо известно в данной области техники, различные природные белки связывают антитела, например бактериальные белки A, G, и L, и эти белки можно использовать для очистки в настоящем изобретении. Можно проводить очистку с использованием определенного связывающего агента. Например, белки можно очищать с использованием глутатионовой смолы, если применяют GST слияние, аффинной хроматографией на ионах Ni+2, если применяют His-Tag, или иммобилизованного антитела к Flag, если применяют His-Tag. Антитело можно очищать посредством выделения его из культуральной среды. Можно получать антитела, имеющие более одной цепи, посредством экспрессии каждой цепи совместно в одном хозяине, или можно получать отдельные цепи, которые собирают до или после выделения из культуральной среды. Можно проводить анализ антител с помощью различных методов, включая, но не ограничиваясь указанными, анализы in vitro, анализы, основанные на клетках in vitro, анализы in vivo и методы селекции. Можно анализировать свойства антител, включая, но не ограничиваясь указанными, биологическое действие, стабильность, растворимость и связывающую активность в отношении мишени. Можно анализировать различные свойства одновременно или по отдельности. В зависимости от условий анализа можно очищать или не очищать белки. Согласно одному аспекту настоящего изобретения анализ представляет собой качественный или количественный анализ связывания антител с белковой или небелковой молекулой, о которой известно, что она связывает или предположительно связывает антитело. Согласно одному аспекту настоящего изобретения анализ представляет собой анализ связывания для измерения связывания с антигеном-мишенью. Для анализа можно использовать автоматические методы и методы с высокой пропускной способностью. В анализе можно использовать гибридный белок или меченый белок. Анализ связывания можно проводить различными методами, известными в данной области техники, включая, но не ограничиваясь указанными, анализ ELISA. В настоящем описании фраза "конкурирует за связывание" обозначает ситуацию, в которой антитело снижает связывание или сигналлинг по меньшей мере на 20, 30, 50, 70 или 90% согласно методам, доступным в данной области техники, на-6 025169 пример конкурентный анализ ELISA или измерение Kd с помощью BIAcore, но не означает полное исключение связывания. Одним из приборов для измерения взаимодействий по связыванию, хорошо известных в данной области техники, является прибор BIAcore 2000, который можно приобрести у Pharmacia Biosensor(Uppsala, Sweden). Настоящее изобретение включает фармацевтическую композицию, содержащую антитело согласно настоящему изобретению, указанное в настоящем описании, и фармацевтически приемлемый носитель,разбавитель или наполнитель. Дополнительно фармацевтическая композиция может содержать другие терапевтические ингредиенты. В настоящем описании термин "фармацевтически приемлемый носитель" включает растворители, диспергаторы, оболочки, антибактериальные и противогрибковые средства, изотонические агенты и средства, замедляющие всасывание и т.п. физиологически совместимые вещества. К примерам фармацевтически приемлемых носителей относятся вода, физиологический раствор,фосфатно-солевой буфер, декстроза, глицерол, этанол и т.п. вещества или их сочетания. Также фармацевтически приемлемые носители могут включать незначительные количества дополнительных веществ,например, увлажняющие компоненты или эмульгаторы, консерванты или буферы, которые увеличивают срок годности или эффективность антитела, а также изотонические агенты, такие как сахара, полиспирты, например маннит и сорбит, и хлорид натрия. Фармацевтические композиции согласно настоящему изобретению могут быть приготовлены различными способами, включая, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, инъецируемые и инфузионные растворы), дисперсии или суспензии,порошки, липосомы и суппозитории. Предпочтительно лекарственные композиции находятся в форме инъецируемых или инфузионных растворов. Предпочтительным способом введения является парентеральное введение (например, внутривенное, подкожное, внутрибрюшинное, внутримышечное). В частности, предпочтительными способами введения являются внутривенная инфузия или инъекция, внутримышечная инъекция или подкожная инъекция. Указанные композиции получают согласно традиционным способам, например, Remington,The Science и Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA 1995, который содержит сборник способов получения составов, которые обычно известны специалистампрактикам. Эффективные дозы композиций согласно настоящему изобретению для лечения заболевания или нарушения, указанные в настоящем описании, различаются в зависимости от различных факторов, включая способ введения, место направленного воздействия, физиологическое состояние пациента, того, является ли пациент человеком или животным, других вводимых лекарственных средств, и является ли лечение профилактическим или терапевтическим. Дозировки лекарственного средства можно менять традиционными способами, известными специалисту в данной области техники, для оптимизации безопасности и эффективности. Термины "лечить", "лечение" обозначают терапевтическое лечение, при котором требуется уменьшить нежелательные физиологические изменения, связанные с заболеванием или нарушением. Благоприятные или желаемые клинические результаты включают, но не ограничиваются указанными, облегчение симптомов, уменьшение масштаба заболевания или нарушения, стабилизацию заболевания или нарушения (т.е. если заболевание или нарушение не ухудшается), задержку или замедление прогрессирования заболевания или нарушения и ремиссию (частичную или полную) заболевания или нарушения,заметную или незаметную. Термин "лечение" также может обозначать большую продолжительность жизни по сравнению с предполагаемой продолжительностью в отсутствие приема лекарственного средства. Пациенты, которые нуждаются в таком лечении, включают тех, которые уже страдают от этого заболевания или нарушения, а также склонных к развитию заболевания или нарушения. Фармацевтические композиции согласно настоящему изобретению могут содержать "терапевтически эффективное количество" антитела к TGFRII согласно настоящему изобретению. Термин "терапевтически эффективное количество" означает количество, эффективное при дозировках и в течение периода времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела может различаться в зависимости от таких факторов, как стадия болезни,возраст, пол, вес пациента и способность антитела или части антитела вызывать желаемый ответ у пациента. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты антитела или его части превышают его терапевтически благоприятные эффекты. Можно подбирать режим дозирования для достижения оптимального желаемого ответа. Например,можно вводить одну дозу, несколько отдельных доз в течение времени или можно соответственно уменьшать или увеличивать дозу в зависимости от того, как продвигается лечение. Особенно преимущественным является приготовление парентеральных композиций в дозированной форме для простоты введения и равномерности дозирования. Дозированная форма означает дозу, содержащую заданное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, в соче-7 025169 тании с необходимым фармацевтическим носителем. Выбор конкретной дозированной формы согласно изобретению непосредственно зависит от (а) индивидуальных особенностей активного вещества и конкретного профилактического или терапевтического действия, которое необходимо оказать, и (б) ограничений, существующих в области приготовления лекарственных составов, таких как активное соединение для лечения чувствительности у пациентов. Терапевтически эффективное количество антитела согласно настоящему изобретению примерно находится в пределах, но не ограничивается указанными значениями, 0,1-50 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество антитела составляет 3-35 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество составляет 10-25 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество составляет 5-20 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество составляет 3-15 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество составляет 2-10 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество составляет 5-10 мг/кг. Согласно другому аспекту настоящего изобретения эффективное количество антитела составляет 1-10 мг/кг. Следует отметить, что размер доз может различаться в зависимости от типа и тяжести состояния, которое необходимо облегчить. Также следует понимать, что для каждого конкретного пациента необходимо с течением времени корректировать дозу согласно потребностям пациента и рекомендации врача, который вводит или наблюдает за введением композиций, при этом диапазоны дозировок, указанные в настоящем описании,приведены для примера и не ограничивают объем притязаний или применение заявленной композиции. Антитела согласно настоящему изобретению можно применять для лечения рака. Рак представляет собой большую группу заболеваний, классифицируемых в зависимости от ткани или степени развития опухоли. Также рак можно подразделять на первичные опухоли и метастазирующие опухоли, а также устойчивые или рецидивирующие опухоли. Устойчивые опухоли представляют собой опухоли, которые не отвечают на химиопрепараты или устойчивы к лечению химиопрепаратами в отдельности, антителами в отдельности, облучением в отдельности или их сочетанием. Рецидивирующие опухоли представляют собой опухоли, которые, как кажется, подавляются при лечении с использованием таких агентов, но появляются вновь через 5 лет, иногда 10 лет или более после прекращения лечения. Тип рака, который поддается лечению, также включает неваскуляризированные, недостаточно васкуляризированные, а также васкуляризированные опухоли. Рак может включать несолидные или солидные опухоли. Антитела к TGFRII согласно настоящему изобретению можно применять для лечения расстройств,заболеваний или состояний, вызванных TGFRII, которые включают хронические и острые нарушения или расстройства, включая патологические состояния, которые обеспечивают предрасположенность млекопитающего к заболеванию. К заболеваниям, которые необходимо вылечить согласно настоящему изобретению, относятся фиброз, вызванный травмой артерий, инфекцией, ревматоидным артритом, диабетом или диабетическим состоянием, опухолью, заболевания, для которых характерно отложение внеклеточного матрикса, заболевания, опосредованные сигналлингом TGFRII, заболевания, вызванные подавлением иммунной системы из-за действия TGFRII, острый иммунный дефицит, возникающий изза тяжелых ожогов, травм, и такие заболевания, как вирусные или бактериальные инфекции, и системные заболевания, поражающие множество органов, опосредованные TGFRII.TGF играют важную роль в обновлении, пролиферации и дифференцировке гемопоэтических стволовых клеток. Антитела согласно настоящему изобретению можно применять для обогащения и регенерации стволовых клеток и содействия способам лечения, основанным на стволовых клетках, для восстановления тканей после инфаркта миокарда, нейрональных заболеваний и других нарушений. Антитела согласно настоящему изобретению можно вводить по отдельности или в сочетании с противоопухолевыми агентами, кроме антител к TGFRII человека, включая химиотерапевтические агенты,облучение, другие антагонисты TGFRII, антагонисты TGF, антиангиогенные агенты, антитела к другим мишеням и малые молекулы. Антитела к TGFRII особенно подходят для лечения опухолей, устойчивых к VEGF-A. Введение антител совместно с другими антителами и/или способами лечения можно осуществлять совместно или по отдельности, одним и тем же путем или различными путями, одновременно или в разное время. Способы лечения, описанные в настоящем изобретении, можно применять для лечения соответствующих млекопитающих, включая приматов, например обезьян, и людей, лошадей, коров, кошек, кроликов, грызунов, например крыс и мышей. Представленные ниже примеры приводятся в целях иллюстрации и никоим образом не ограничивают изобретение.TGF1, TGF2, и TGF3 человека получали рекомбинантными методами и очищали или приобретали, например, у RD Systems. Рекомбинантные химерные белки TGFRII Fc (TGFRII-Fc) и растворимые рекомбинантные белки TGFRII с щелочной фосфатазой (TGFRII-AP) экспрессировались в стабильно трансфицированных клетках и их выделяли из супернатантов клеточных культур методами, известными специалистам в данной области техники (Tessler, J. Biol. Chem., 269:12456-12461 (1994. Линии клеток опухоли человека ВХРС-3, PANC-1, MDA-MB-231, линии опухолевых клеток мышей ЕМТ 6, 4 Т 1, СТ 26, B16-F10 и линии клеток миеломы Р 3-Х 63-Ag8.653 получали из Американской коллекции культур тканей (Manassas, VA). Линию клеток MDA-MB-231, трансфицированных люциферазой,получали в Sunnybrook Health Sciences Centre. Клетки культивировали в среде RPMI1640 или IMDM (Invitrogen/Life Technologies, Inc., Rockville, MD) с 10% фетальной бычьей сывороткой (FCS, Hyclone,Logan, UT). Все клетки культивировали при 37C во влажной атмосфере 5% CO2. Получение МАТ к TGFRII. МАТ к TGFRII получали с помощью стандартной гибридомной технологии (HarlowLane, ed.,Antibodies: A Laboratory Manual, Cold Spring Harbor, p. 211-213 (1998 с использованием трансгенных по генам иммуноглобулинов (Medarex, San Jose, CA) мышей, которые продуцируют тяжелые гамма-цепи и легкие каппа-цепи иммуноглобулина человека, или крыс Льюиса (Charles River Laboratories, Wilmington,MA). В общих чертах, мышей или крыс иммунизировали подкожно (s.c.) рекомбинантным белкомTGFRII-Fc человека или мыши, эмульгированным в полном адъюванте Фрейнда. Животным трижды вводили внутрибрюшинно (i.p.) одинаковый белок TGFRII-Fc в неполном адъюванте Фрейнда. Через месяц животным вводили i.p. последнюю дозу 50 мкг белка TGFRII-Fc в фосфатно-солевом буфере(PBS). Из иммунизированных мышей выделяли спленоциты и сливали с клетками плазмоцитомы Р 3-Х 63-Ag8.653 с применением полиэтиленгликоля (PEG, MW: 1450 KD). После этого клетки ресуспендировали в среде HAT (гипоксантин, аминоптерин, тимидин), дополненной 10% фетальной бычьей сывороткой (FBS), и сеяли в 96-луночные планшеты при плотности 200 мкл/лунка для получения клеток гибридомы. Через 10-12 дней гибридомы исследовали на образование антител и наличие специфической связывающее активности супернатантов культуры с белком TGFRII в процессе анализа связывания и блокировки, основанном на анализе ELISA. В частности, гибридомы, продуцирующие МАТ к TGFRII, первоначально определяли с помощью определения антитела, связавшего TGFRII с антителом козы к легкой каппа-цепи человека или конъюгата антител к IgG мыши с пероксидазой хрена (HRP) согласно описанной ниже методике. TGFRII-Fc человека или TGFRII-Fc мыши наносили в 96-луночные микротитровальные планшеты в концентрации 100 нг/лунка при 4C в течение ночи. Затем блокировали реакцию блокирующим буфером (PBS 0,05% TWEEN 20, 5% сухого молока) при комнатной температуре в течение 2 ч. Супернатанты гибридом или очищенные антитела разбавляли PBS с 2% альбумином бычьим сывороточном (BSA) и 0,05% TWEEN 20 (ELISA буфер) и инкубировали в 96-луночных микротитровальных планшетах, покрытых TGFRII, в течение 30 мин. Планшеты промывали буфером ELISA и инкубировали антителами козы к легкой каппа-цепи или конъюгатом антител к IgG мыши с HRP в течение 30 мин. Для получения цвета использовали субстрат ТМВ (3,3',5,5'-тетра-метилбензидин) согласно инструкциям изготовителя. Для количественного определения связывающего сродства антител считывали поглощение при длине волны 450 нм. Для определения гибридом, вырабатывающих нейтрализующие МАТ к TGFRII, проводили блокирующий анализ ELISA согласно описанной ниже методике. TGF1,TGF2 или TGF3 наносили в лунки 96-луночного планшета в концентрации 200 нг/лунка, затем реакцию в лунках блокировали блокирующим буфером. Супернатанты гибридом инкубировали с буферомELISA, содержащим TGFRII-AP в 96-луночных планшетах, покрытых TGF в течение 1 ч. После отмывки в лунки добавляли субстрат для АР п-нитрофенил фосфат (PNPP) для получения цвета согласно инструкциям производителя. Измеряли поглощение при длине волны 405 нм для количественной оценки связывания TGFRII с TGF1, TGF2, и TGF3. Оптическую плотность (OD) определяли на ридере микротитровальных планшетов (Molecular Devices Силир., Sunnyvale, CA). Положительные гибридомы клонировали трижды методом предельного разведения для получения моноклональных гибридомных клеточных линий. В табл. 1 показаны аминокислотные последовательности CDR легкой и тяжелой цепей МАТ к TGF1 и TGF3.SEQ ID NO аминокислотных последовательностей и последовательностей ДНК, кодирующих аминокислотные последовательности HCVR, LCVR, тяжелых цепей (НС) и легких цепей (LC) МАТ к TGF1 и TGF3 представлены в табл. 2. Таблица 2SEQ ID NO аминокислотных последовательностей и кодирующих последовательностей ДНК МАТ к TGFRII человека Аминокислотные последовательности с секреторной или сигнальной последовательностью.Последовательности кДНК включают секреторную сигнальную последовательность. Разработка и экспрессия антител человека IgG1 к рецептору II TGF человека. Последовательности ДНК, кодирующие вариабельные участки легкой и тяжелой цепи МАТ кTGFRII амплифицировали методом ПЦР для клонирования в векторы экспрессии. Вариабельные участки тяжелой цепи объединяли в одну рамку считывания с константным участком тяжелой гамма 1 цепи иммуноглобулина в вектор рЕЕ 6.1 (Lonza Biologics pic, Slough, Berkshire, UK). Всю кДНК легкой цепи человека непосредственно клонировали в вектор рЕЕ 12.1 (Lonza Biologics PLC, Slough, Berkshire, UK). Полученными методами инженерии векторами экспрессии иммуноглобулина стабильно трансфицировали клетки миеломы NS0 методом электропорации и отбирали векторы на среде для селекции на активность глутамин синтетазы. Проводили анализ стабильных клонов на экспрессию антител методомELISA, в котором исследовали специфическое связывание TGFRII. Положительные клоны культивировали в бессывороточной среде в роллерных колбах или биореакторах для продукции антител. Полноразмерные антитела IgG1 очищали методом аффинной хроматографии (Poros A, PerSeptive Biosystems Inc.,Foster City, CA) и элюировали в нейтральный солевой раствор. кДНК, кодирующую вариабельные участки легкой и тяжелой цепей MAT TGF1 и TGF3 к TGFRII человека, клонировали и объединяли в одной рамке считывания с константным участком тяжелой гаммацепи 1 иммуноглобулина в вектор экспрессии GS (глутаминсинтетаза). Полученными векторами,экспрессирующими иммуноглобулин, стабильно трансфицировали клетки СНО. В стабильных клонах подтверждали экспрессию антитела, которое специфически связывает TGFRII человека. Положительные клоны культивировали в бессывороточной среде в биореакторах для продукции антитела. Полно- 10025169 размерные антитела IgG1 очищали методом аффинной хроматографии на белке А и элюировали в нейтральный буферный солевой раствор. МАТ к TGFRII связываются с TGFRII и блокируют связывание TGFRII с лигандами. Связывающую и блокирующую активность очищенных МАТ к TGFRII определяли с помощью анализа ELISA согласно описанию "Получение МАТ к TGFRII" выше. ED50 и IC50 антител анализировали с помощью программного обеспечения GraphPad Prism software 3.03 (GraphPad Software Inc., SanDiego, CA). MAT к TGFRII человека TGF1 и TGF3 по отдельности имели связывающую активность в отношении TGFRII человека ED50 0,031-0,059 нМ по результатам анализа связывания, основанного на анализе ELISA, тогда, как нормальный IgG не связывался со своим рецептором. Очищенные MAT TGF1 и TGF3 по отдельности эффективно блокировали связывание TGF1, TGF2, или TGF3 человека сTGFRII человека с IC50 0,10-0,54 нМ. Связывающие и блокирующие свойства антител к TGFRII человека представлены в табл. 3. Таблица 3 Связывающие и блокирующие свойства антител к TGFRII человека Связывающее сродство МАТ к TGFRII. Связывающую способность МАТ по отношению к TGFRII определяли методом поверхностного плазмонного резонанса с использованием BIAcore 2000 при комнатной температуре(20-25C)(Pharmacia, Piscataway, NJ). Кинетические анализы МАТ проводили посредством иммобилизации гибридного белка, состоящего из связанного рекомбинантного внеклеточного домена TGFRII мыши(SEQ ID NO: 41) или внеклеточного домена TGFRII человека, который кодируется (SEQ ID NO: 40),соответственно с Fc константным участком тяжелой цепи мыши или человека, на сенсорной поверхности в концентрации 5-100 нМ. MAT TGF1 и TGF3 к TGFRII человека проявляли высокое сродство со значением KD 11, 78, 19 пМ соответственно. MAT MT1 к TGFRII мыши демонстрировали высокое сродство со значением KD 33 пМ. Кинетические свойства МАТ приведены в табл. 5. Таблица 5 Кинетические свойства МАТ по отношению к TGFRII человека Видовая специфичность МАТ к TGFRII человека. Специфичность МАТ к TGFRII человека определяли посредством измерения взаимодействия антител с TGFRII человека или мыши методом ELISA. TGF1 к TGFRII человека проявляло перекрестную реактивность с TGFRII мыши тогда, как MAT TGF3 проявляло минимальную или среднюю перекрестную реактивность в отношении TGFRII мыши. Однако MAT TGF3 не блокировало связываниеTGF1 человека с TGFRII мыши. Связывание МАТ к TGFRII с природным TGFRII на клетках, экспрессирующих TGFRII. Связывающую активность MAT TGF1 к TGFRII человека и антитела козы против IgG человека,меченного флуоресцеин изотиоционатом (FITC), определяли с помощью окрашивания с использованием 293 трансфицированных по TGFRII клеток человека и клеток карциномы человека. В частности, отбирали аликвоты трансфицированных клеток, клеток карциномы, селезенки или лимфатических узлов, и инкубировали с первичными антителами к желаемым молекулам, меченным или немеченым флуоресцеином, в PBS с 1% BSA (буфер для окраски) в течение 1 ч на льду. Соответствующий изотип IgG использовали в качестве отрицательного контроля. Клетки дважды промывали буфером для окрашивания и затем инкубировали с вторичным видоспецифичным антителом, меченым FITC, фикоэритрином (РЕ) илиAlxas Red, к первичному антителу (BioSource International, Camarillo, CA) в буфере в течение 30 мин на льду. Клетки промывали, как описано выше, и анализировали на проточном цитометре. Мертвые клетки и дебрис исключали из анализа на основе прямого и бокового светорассеяния. Среднюю единицу интенсивности флюоресценции (MFIU) вычисляли как среднее логарифмическое флуоресценции, умноженную на процент положительной популяции. Среднее соотношение интенсивности флуоресценции(MFIR) рассчитывали для количественного определения относительного уровня экспрессии TGFRII в линиях клеток. MFIR представляет собой среднюю интенсивность флуоресценции (MFI) клеток, окрашенных TGFRII специфичным МАТ, разделенную на MFI клеток, окрашенных изотипическим контрольным антителом.MAT TGF1 к TGFRII человека проявляли связывающую реактивность в отношении 293 трансфицированных по TGFRII клеток человека и клеток карциномы молочной железы человека MDA-MB-231 с MFIR 46 и 209, соответственно, тогда как нормальные IgG человека не взаимодействовали с клетками. Полученные результаты показали, что MAT TGF1 обладает специфической реактивностью в отношении нативного TGFRII, экспрессируемого на поверхности клеток. Подавляющее действие МАТ к TGFRII на активацию киназы Smad2, зависящую от TGFRII, в ответ на TGF1. Фосфорилирование Smad2 (p-Smad2), вызываемое TGF, запускает традиционный сигнальный путьTGF через TGFRII, который опосредует биологические ответы клеток, например, пролиферацию,смерть, выживание и дифференцировку различных типов клеток. Способность МАТ к TGFRII человека и МАТ к TGFRII мыши подавлять активацию p-Smad2 можно определять с помощью клеток опухоли молочной железы мыши 4 Т 1 и клеток карциномы молочной железы человека MDA-MB-231 согласно представленной ниже процедуре. В общих чертах, клетки культивировали до достижения 80% покрытия на среде, содержащей FCS. После смены среды на бессывороточную клетки обрабатывали антителом или изотипическим контролем в присутствии 10 нг/мл TGF в течение 1 ч. После промывки клетки лизировали лизирующим буфером и проводили электрофорез и перенос на нитроцеллюлозную мембрану. Фосфорилированные Smad2 и Smad2 определяли методом вестерн-блоттинга с использованием моноклональных антител к фосфорилированным Smad2 и Smad2 (Millipore Corporate) и электрогенерированной хемилюминесценции (ECL), делали снимки и определяли количественно методом денситометрии с использованием Fuji Image Analyzer.MAT TGF1 и МТ 1 к TGFRII снижали фосфорилирование Smad2, вызванное TGF, в клетках человека MDA-MB-231 и клетках рака молочной железы мыши 4 Т 1 дозозависимым образом. Определили,что IC50 MAT TGF1 и МТ 1 по результатам анализа подавления фосфорилирования Smad2 составляли 50,5 нМ, тогда, как MAT TGF3 имело IC50 менее 250,5 нМ. Ингибиторная активность МАТ к TGFRII в отношении миграции и инвазии in vitro опухолевых клеток. Ингибиторная активность МАТ к TGFRII в отношении инвазивности опухолевых клеток можно определить с помощью анализов миграции и инвазии in vitro. В общих чертах, клетки карциномы высевали при плотности 5103 в лунку в верхние камеры, вставленные в нижние камеры, покрытые коллаге- 12025169 ном I и IV, 48-луночных планшетов в бессывороточной среде. Клетки обрабатывали MAT TGF1 или МТ 1 в количестве 3, 10, и 30 мкг/мл в присутствии 10 нг/мл TGF при 37C в течение 24-48 ч. В качестве положительного и отрицательного контролей использовали TGFRII-Fc или изотип IgG в концентрации 25 мкг/мл. Анализ инвазии проводили в аналогичных условиях, за исключением того, что использовали верхние камеры, покрытые матригелем. После инкубации клетки, мигрировавшие на противоположные стороны верхних камер, фиксировали в 10% растворе формалина и окрашивали раствором Hoechst 33342, тригидрохлорида, тригидрата (Invitrogen) в концентрации 2 мкг/мл и подсчитывали при увеличении 20 Х с помощью Zeiss Digital Image Camera и программного обеспечения Image-Pro Plus 5.1.MAT TGF1 и МТ 1 к TGFRII значительно подавляли миграцию клеток карциномы поджелудочной железы человека ВХРС-3 и инвазию клеток карциномы молочной железы мыши 4 Т 1 на 100% (Р 0,0001) и 93% (Р 0,0005), соответственно, по сравнению с контролем, обработанным IgG. Полученные результаты показали ингибиторное действие антител к TGFRII согласно настоящему изобретению на инвазивность опухолевых клеток, несущих на своей поверхности TGFRII.TGF участвует в обеспечении ангиогенеза при развитии патологических состояний посредством стимуляции секреции VEGF-A в опухолевых клетках и модуляции работы клеток эндотелия. Ингибиторное действие МАТ к TGFRII на секрецию VEGF-A, вызванную TGF, в опухолевых клетках определяли в культуре клеток. Вкратце, опухолевые клетки культивировали в бессывороточной среде при 37C в инкубаторе при 5% CO2 в присутствии или отсутствии 10 нг/мл TGF и серийных разведений МАТ в течение 48 ч. Изменения секреции VEGF-A в супернатантах культур определяли набором ELIKON (RD Systems) согласно инструкциям производителя.MAT TGF1 к TGFRII человека в концентрации 10 мкМ/мл подавляло продукцию VEGF-A, вызванную TGF, в опухолевых клетках MDA-MB-231 человека на 63% (Р 0,01). MAT MT1 к TGFRII мыши в концентрации 10 мкМ/мл подавляло продукцию VEGF-A, вызванную TGF, в клетках опухоли молочной железы мыши 4 Т 1 на 30% (Р 0,02). Полученные результаты показали, что МАТ к TGFRII согласно настоящему изобретению подавляли ангиогенез посредством снижения секреции VEGF-A, вызванной TGF. Ингибиторная активность МАТ к TGFRII по отношению к конверсии Treg, вызванной TGF, in vitro. Показано, что TGF способен индуцировать превращение наивных Т-клеток в регуляторные Т-клетки (Treg), которые отрицательно влияют на иммунный ответ. Ингибиторное действие МАТ кTGFRII на конверсию регуляторных клеток, вызванную TGF можно оценить in vitro, как описано ниже. В общих чертах, выделенные наивные CD4+ клетки стимулировали 1 мкг/мл антитела к CD3 и выделяли антигенпрезентирующие клетки (АРС) в присутствии или отсутствии 10 нг/мл TGF и серийных разведениях MAT MT1 в полной среде RPMI при 37C в инкубаторе при 5% CO2 в течение 7 дней. Затем клетки снимали для окрашивания CD25+/Foxp3+ Treg клеток и окрашенные клетки анализировали на проточном цитометре.TGF in vitro на 75% (Р 0,005) по сравнению с контрольными обработанными IgG клетками. Ингибиторная активность МАТ к TGFRII по отношению к росту опухоли и метастазированию. Противоопухолевое действие МАТ к TGFRII исследовали на моделях подкожных или внутривенных метастазирующих опухолей. Бестимусных голых мышей (Charles River Laboratories, Wilmington, MA), Balb/c или С 57 В 6 (CharlesRiver Laboratories, Wilmington, MA) использовали для инокуляции клетками карциномы мыши или человека. Для лечения образованных опухолей на подкожных моделях допускали рост опухоли приблизительно до 200 мм 3 и затем мышей делили на группы по 12-15 животных. На модели метастаз легких мышам внутривенно вводили опухолевые клетки через хвостовую вену. Животным вводили i.p. (интраперитонально) МАТ к TGFRII в количестве 10-40 мг/кг три раза в неделю. Мышам в контрольной группе вводили равный объем физиологического раствора или нормальный раствор IgG. В течение всего эксперимента лечение животных продолжали. Размер опухолей определяли дважды в неделю с помощью кронциркуля. Размер опухоли определяли по формуле [/6 (w1 X w2 X w2)], в которой "w1" обозначает максимальный диаметр опухоли и "w2" обозначает наименьший диаметр опухоли. Данные о размере опухоли анализировали методом повторных измерений ANOVA (RM-ANOVA) для определения значимых различий в размерах опухолей в зависимости от способа лечения, временных точек и режима введения. Рост опухолевых клеток in vitro в контрольной группе и лечебной группе анализировали с помощью двустороннего t-критерия Стьюдента. Значение Р менее 0,05 считали статистически значимым. Мышам с опухолями вводили МАТ к TGF1 в количестве 40 мг/кг три раза в неделю через 24 ч после внутривенного введения опухолевых клеток или после образования первичных опухолей. Системное введение МАТ к TGF1 подавляло рост первичной подкожной опухоли ксенотрансплантатов карциномы поджелудочной железы PANC-1 (T/C=69%, ANOVA р 0,03), ксенотрансплантатов поджелудочной железы ВХРС-3 (Т/С=30%, ANOVA р 0,0001) и ксенотрансплантатов карциномы молочной железыMAT MT1 к TGFRII мыши исследовали на модели сингенных опухолей мыши для определения противоопухолевой активности в отношении первичных и метастазирующих опухолей у иммунокомпетентных мышей. Мышам вводили внутривенно (i.v.) клетки карциномы мыши 4 Т 1, СТ 26 или В 16 F10 или подкожно (s.c.) опухолевые клетки мыши ЕМТ 6. Мышам вводили МАТ к TGF1 в количестве 40 мг/кг три раза в неделю через 24 ч после внутривенного введения опухолевых клеток или после образования первичных подкожных опухолей. Системное введение MAT MT1 значительно снижало метастазирование легких опухолей 4 Т 1, СТ 26 и В 16 F10 на 84% (Р 0,0001), 94% (Р 0,0001) и 63% (Р 0,001) соответственно. МАТ МТ 1 к TGFRII мыши подавляет рост первичной опухоли на 28% (Р 0,05) и спонтанное метастазирование легких на 84%(Р 0,0001) на модели s.c. опухоли ЕМТ 6. Известно, что миелоидные клетки фенотипа Gr-1/CD11b+ играют значительную роль в метастазировании и иммуносупрессии ангиогенеза при развитии опухоли. Treg клетки CD4/CD25/Foxp3+ способны подавлять действие эффекторных клеток иммунной системы естественных киллеров и цитотоксических Т лимфоцитов (CTL) на опухолевые клетки. Подавляющее действие MAT MT1 в отношении иммуносупрессивных клеток,т.е.Gr-1+/CD11b+/TGFRII+ клеток, определяли на модели s.c. опухоли ЕМТ 6. Подавляющее действие антител к TGFRII на Treg клетки и популяцию миелоидных клеток Gr-1+/CD11b+ у мышей, имеющих опухоли, определяли помощью анализа FACS по изменениям в популяциях Gr-1+/CD11b+ иCD4/CD25/Foxp3/TGFRII+ и Gr-1+/CD11b+/TGFRII+ клеток после обработки мышей MAT MT1.MAT MT1 к TGFRII мыши значительно снижало количество миелоидных клетокGr-1+CD11b+/TGFRII+ на 95% (Р 0,0001) и Treg клеток CD4/CD25/Foxp3/TGFRII + на 71% (P0,0005) соответственно у пролеченных мышей, имеющих опухоли ЕМТ 6. Полученные результаты показали, что антитела к TGFRII контролировали популяцииTGF является ключевым регулятором активации звездчатых клеток печени (HSC) и дифференциации миофибробластов, а также отложения внеклеточного матрикса, который способствует фиброзу. Животные модели фиброза печени широко используются в качестве экспериментальных моделей для оценки активности ингибиторов сигнального пути TGF по подавлению фиброза. Известно, что отложение коллагена является показателем фиброза печени. Терапевтическое действие антитела к TGFRII в отношении защиты и нарушения фиброза определяли на моделях фиброза печени, вызванного четыреххлористым углеродом (CCl4). В общих чертах, мышам C57BL6 i.p. (интраперитонально) вводили раствор CCl4 1 мл/кг, смешанный с кукурузным маслом, два раза в неделю. Мышам в лечебной группе вводили MAT MT1 в количестве 40 мг/кг трижды в неделю в течение 14 дней после i.p. введения CCl4. Мышам в контрольной группе вводили контрольные IgG крысы в таком же количестве. Через 8 недель после введения CCl4 у пролеченных мышей брали ткани печени и плазму. Показатель нарушения работы печени - уровень аланинаминотрансферазы (ALT) в плазме - определяли с помощью набора для определения ALT в сыворотке(Pointe Scientific, Inc. MI). Ткань печени анализировали методом иммуногистохимического анализа (IHC) с окраской Sirius Red на отложение коллагена. В исследованиях, которые проводили согласно описанию выше, MAT MT1 к GFRII значительно уменьшало отложение коллагена на 95% (Р 00001) в печени мышей, которым вводили CCl4, по сравнению с контролем IgG крысы. MAT MT1 к TGFRII мыши предотвращало нарушение работы печени на 85% (Р 0,001) согласно измерениям уровня ALT в плазме мышей, которым вводили CCl4 тогда, как у мышей, которым вводили контрольный IgG, наблюдали значительно повышенный уровень ALT. Данные результаты позволили предположить, что антитело МТ 1 к TGFRII эффективно защищало мышей от фиброза, вызванного травмами и нарушением работы печени.In vivo исследования комбинированной терапии с помощью МАТ МТ 1 и циклофосфамида. Известно, что циклофосфамид (СТХ), сильный цитотоксический агент, обладающий способностью подавлять гемопоэтические и миелоидные прогениторные клетки, оказывает подавляющее действие на миелоидные клетки (см. Honeychurch, et al., Cancer Res. 65:7493-7501 (2005. Мыши с опухолью ЕМТ 6 подвергались лечению MAT MT1, СТХ по отдельности или их комбинацией. Например, мышей Balb/c или С 57 В 6 (Charles River Laboratories, Wilmington, MA) инокулировали клетками карциномы. Инокулированных мышей разделили на группы по 12 животных, например. Животным вводили i.p. 40 мг/кг МАТ к TGFRII, 80 мг/кг СХТ или их комбинацию три раза в неделю. Мыши в контрольной группе получали равный объем физиологического раствора или нормального раствора IgG. Размер опухоли определяли по формуле [/6 (w1w2w2)], в которой "w1" обозначает максимальный диаметр опухоли и "w2" обозначает наименьший диаметр опухоли. Комбинированная терапия MAT MT1 к TGFRII человека и СТХ, проведенная в точности согласно описанию выше, приводило к снижению роста первичной опухоли на 80% (Р 0, 0 0 01) и спонтанных метастаз легких на 99,99% (Р 0,000001) у мышей с опухолью ЕМТ 6 по сравнению со снижением роста первичной опухоли при монотерапии MAT MT1 на 28% (Р 0,05) или СТХ на 62% (Р 0,0005) и с подавлением метастазирования при монотерапии MAT MT1 на 84% (Р 0,0001) или СТХ на 96 % (Р 0,00001). Результаты показали, что подавление популяции миелоидных клеток антителом к TGFRII в сочетании с супрессивной в отношении миелоидных клеток химиотерапией представляет собой эффективную стратегию воздействия на рост опухоли и метастазирование.
МПК / Метки
МПК: A61P 35/00, A61K 39/395, C07K 16/28
Метки: антитела, tgf-бета, рецептору
Код ссылки
<a href="https://eas.patents.su/30-25169-antitela-k-receptoru-ii-tgf-beta.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к рецептору ii tgf-бета</a>
Предыдущий патент: Самогерметизирующаяся композиция для пневматического изделия
Следующий патент: Способ литья детали из пластика с присоединяемой металлической деталью, удерживаемой за счет намагничивания, устройство литья детали из пластика
Случайный патент: Вакцинная композиция, содержащая трансформирующий фактор роста альфа












