Антитела к рецептору эфрина epha2 и их применение
Номер патента: 20324
Опубликовано: 30.10.2014
Авторы: Хань Цзявэнь, Таварес Даниел, Ли Минь, Чжан Чунхой, Фромон Клодья, Чжоу Сяо-Май, Блан Вероник, Паркер Фабьенн, Стрели Мишель
Формула / Реферат
1. Антитело или его эпитопсвязывающий фрагмент, которое специфически связывается с рецептором эфрина EphA2 и является антагонистом указанного рецептора, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или несколько гипервариабельных областей с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 и 72.
2. Антитело или его эпитопсвязывающий фрагмент по п.1, где указанное антитело или его эпитопсвязывающий фрагмент представляет собой антитело мыши или его эпитопсвязывающий фрагмент и продуцируется гибридомой 37.3D7 РТА-7660; гибридомой 37.1 F5 РТА-7661; гибридомой 53.2Н11 РТА-7662; гибридомой EphA2-N1 PTA-8407 или гибридомой EphA2-N2 PTA-8408.
3. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1 или 2, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать рост раковой клетки.
4. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать миграцию раковой клетки.
5. Антитело или его эпитопсвязывающий фрагмент по любому из пп.3 и 4, отличающееся тем, что указанная раковая клетка представляет собой клетку, выбранную из группы, состоящей из клеток рака молочной железы, рака толстой кишки, рака эндометрия, карциномы яичников, остеосаркомы, рака шейки матки, рака предстательной железы, рака легких, синовиальной карциномы, рака поджелудочной железы, саркомы, глиомы, рака головы и шеи, рака желудка, рака печени и других карцином.
6. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать ангиогенез.
7. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент лишено агонистической активности.
8. Антитело или его эпитопсвязывающий фрагмент по п.7, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент не стимулирует фосфорилирование по остаткам тирозина EphA2.
9. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать связывание лиганда с указанным рецептором.
10. Антитело или его эпитопсвязывающий фрагмент по п.9, отличающееся тем, что указанный лиганд представляет собой эфрин А1.
11. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать фосфорилирование по остаткам тирозина EphA2.
12. Антитело или его эпитопсвязывающий фрагмент по п.11, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать фосфорилирование по остаткам тирозина EphA2 в присутствии эфрина А1.
13. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент способно ингибировать опосредованную EphA2 передачу сигнала.
14. Антитело или его эпитопсвязывающий фрагмент по п.13, отличающееся тем, что опосредованная EphA2 передача сигнала представляет собой увеличение фосфорилирования Akt.
15. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент связывает EphA2 с KD, составляющей 3´10-10 М или меньше.
16. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанный рецептор EphA2 является рецептором человека.
17. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:26, 28, 30, 78 и 80.
18. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:20, 22, 24, 74 и 76.
19. Антитело или его эпитопсвязывающий фрагмент по любому из предыдущих пунктов, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:1, 2 и 3, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:4, 5 и 6.
20. Антитело или его эпитопсвязывающий фрагмент по п.19, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность, состоящую из SEQ ID NO:26.
21. Антитело или его эпитопсвязывающий фрагмент по п.19, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотную последовательность SEQ ID NO:20.
22. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1-18, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:7, 8 и 9, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:10, 11 и 12.
23. Антитело или его эпитопсвязывающий фрагмент по п.22, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:28.
24. Антитело или его эпитопсвязывающий фрагмент по п.22, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотную последовательность SEQ ID NO:22.
25. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1-18, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:13, 14 и 15, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:16, 17 и 18.
26. Антитело или его эпитопсвязывающий фрагмент по п.25, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:30.
27. Антитело или его эпитопсвязывающий фрагмент по п.25, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотную последовательность SEQ ID NO:24.
28. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1-18, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:61, 62 и 63, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:64, 65 и 66.
29. Антитело или его эпитопсвязывающий фрагмент по п.28, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:78.
30. Антитело или его эпитопсвязывающий фрагмент по п.28, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотную последовательность SEQ ID NO:74.
31. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1-18, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:67, 68 и 69, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:70, 71 и 72.
32. Антитело или его эпитопсвязывающий фрагмент по п.31, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:80.
33. Антитело или его эпитопсвязывающий фрагмент по п.31, отличающееся тем, что указанное антитело или его эпитопсвязывающий фрагмент содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотную последовательность SEQ ID NO:76.
34. Антитело или его эпитопсвязывающий фрагмент по любому из пп.1-16, которые являются гуманизированными или поверхностно-модифицированными.
35. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.34, отличающееся тем, что содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:47, 48, 49, 50 и 52.
36. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34, 35, отличающееся тем, что содержит вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:32, 34, 36, 37, 38, 40, 42, 43 и 45.
37. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-36, отличающееся тем, что содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:1, 2 и 3, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:4, 5 и 6.
38. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.37, отличающееся тем, что содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:47.
39. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.37, отличающееся тем, что содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:32, 34 и 36.
40. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-36, отличающееся тем, что содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:7, 8 и 9, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:10, 11 и 12.
41. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.40, отличающееся тем, что содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность, выбранную из SEQ ID NO:48, 49 или 50.
42. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.40, отличающееся тем, что содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:37 и 38.
43. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-36, отличающееся тем, что содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:13, 14, и 15, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, представленные SEQ ID NO:16, 17 и 18.
44. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.43, отличающееся тем, что содержит вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO:52.
45. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по п.43, отличающееся тем, что содержит одну или более вариабельных областей тяжелой цепи, имеющих аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:40, 42, 43 и 45.
46. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-36, отличающееся тем, что содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:61, 62 и 63, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:64, 65 и 66.
47. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-36, отличающееся тем, что содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:67, 68 и 69, и где указанная легкая цепь содержит три последовательные определяющие комплементарность области, имеющие аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:70, 71 и 72.
48. Гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент по любому из пп.34-47, отличающееся тем, что указанное гуманизированное или поверхностно-модифицированное антитело или его эпитопсвязывающий фрагмент выбраны из группы, состоящей из hu37.3D7, hu37.1F5, hu53.2H11, huEphA2-N1 и huEphA2-N2, раскрытых в описании.
49. Конъюгат, содержащий антитело или его эпитопсвязывающий фрагмент, по любому из пп.1-48, связанный с цитотоксическим средством.
50. Конъюгат, содержащий гуманизированное или поверхностно-модифицированное антитело, содержащее вариабельную область легкой цепи с последовательностью, гомологичной по меньшей мере примерно на 95% последовательности SEQ ID NO:52, и вариабельную область тяжелой цепи с последовательностью, гомологичной по меньшей мере примерно на 95% последовательности, выбранной из группы, состоящей из SEQ ID NO:40, 42, 43 и 45, связанный с цитотоксическим средством.
51. Конъюгат, содержащий гуманизированное или поверхностно-модифицированное антитело, содержащее вариабельную область легкой цепи с последовательностью, гомологичной по меньшей мере примерно на 98% последовательности SEQ ID NO:52, и вариабельную область тяжелой цепи с последовательностью, гомологичной по меньшей мере примерно на 98% последовательности, выбранной из группы, состоящей из SEQ ID NO:40, 42, 43 и 45, связанный с цитотоксическим средством.
52. Конъюгат по любому из пп.49-51, отличающийся тем, что указанное цитотоксическое средство выбирают из группы, состоящей из мейтанзиноида, низкомолекулярного лекарственного средства, производного томеймицина, производного лептомицина, пролекарства, токсоида, аналога СС-1065 и СС-1065.
53. Конъюгат по п.52, отличающийся тем, что указанное цитотоксическое средство представляет собой мейтанзин DM1 формулы
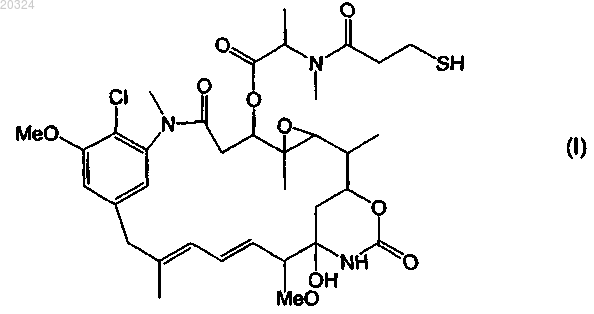
54. Конъюгат по п.52, отличающийся тем, что указанное цитотоксическое средство представляет собой мейтанзин DM4 формулы
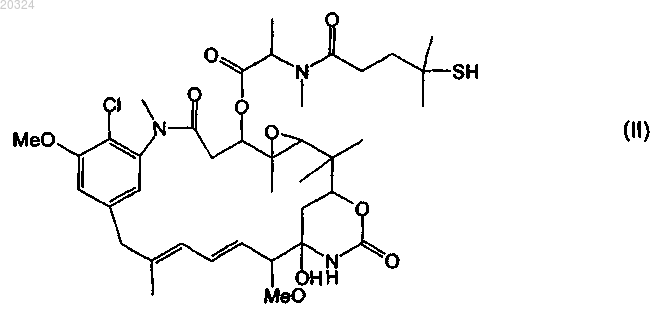
55. Конъюгат по п.52, отличающийся тем, что указанное цитотоксическое средство представляет собой производное томеймицина, выбранное из группы, состоящей из
8,8'-[1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[5-метокси-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[1,5-пентандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[1,4-бутандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[3-метил-1,5-пентандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[2,6-пиридиндиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[4-(3-трет-бутоксикарбониламинопропилокси)-2,6-пиридиндиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[5-(3-аминопропилокси)-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[5-(N-метил-3-трет-бутоксикарбониламинопропил)-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-{5-[3-(4-метил-4-метилдисульфанилпентаноиламино)пропилокси]-1,3-бензолдиилбис(метиленокси)}бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[5-ацетилтиометил-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-метилен-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
трет-бутиловый эфир бис{2-[(S)-2-метилен-7-метокси-5-оксо-1,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-8-илокси]этил}карбаминовой кислоты;
8,8'-[3-(2-ацетилтиоэтил)-1,5-пентандиилбис(окси)]бис[(S)-2-метилен-7-метокси-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[5-(N-4-меркапто-4,4-диметилбутаноил)амино-1,3-бензолдиилбис(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[5-(N-4-метилдитио-4,4-диметилбутаноил)амино-1,3-бензолдиилбис(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[5-(N-метил-N-(2-меркапто-2,2-диметилэтил))амино-1,3-бензолдиил(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[5-(N-метил-N-(2-метилдитио-2,2-диметилэтил))амино-1,3-бензолдиил(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11а-тетрагидро-5Н-пирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(4-(2-(4-меркапто-4-метил)пентанамидоэтокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(1-(2-(4-метил-4-метилдисульфанил)пентанамидоэтокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(4-(3-(4-метил-4-метилдисульфанил)пентанамидопропокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(4-(4-(4-метил-4-метилдисульфанил)пентанамидобутокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(4-(3-[4-(4-метил-4-метилдисульфанилпентаноил)пиперазин-1-ил]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он];
8,8'-[(1-(3-[4-(4-метил-4-метилдисульфанилпентаноил)пиперазин-1-ил]пропил)бензол-3,5-диметил)диокси]бис[(S)-2-эт(E)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(4-(2-{2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этокси}этокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(1-(2-{2-[2-(2-{2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этокси}этокси)этокси]этокси}этокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(1-(2-{2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этокси}этокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(4-(2-{2-[2-(2-{2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этокси}этокси)этокси]этокси}этокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(1-(2-[метил(2-метил-2-метилдисульфанилпропил)амино]этокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(4-(3-[метил(4-метил-4-метилдисульфанилпентаноил)амино]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(4-(3-[метил(2-метил-2-метилдисульфанилпропил)амино]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он];
8,8'-[(1-(4-метил-4-метилдисульфанил)пентанамидо)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11а-тетрагидропирроло [2,1-с][1,4]бензодиазепин-5-он].
56. Конъюгат по п.52, отличающийся тем, что цитотоксическое средство представляет собой производное лептомицина, выбранное из группы, состоящей из
(2-метилсульфанилэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
бис[(2-меркаптоэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты];
(2-меркаптоэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-метилдисульфанилэтил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-метил-2-метилдисульфанилпропил)амид(2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты;
(2-меркапто-2-метилпропил)амид (2Е,10Е,12Е,16Z,18Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил-19-((2S,3S)-3-метил-6-оксо-3,6-дигидро-2Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты.
57. Фармацевтическая композиция, содержащая антитело или его эпитопсвязывающий фрагмент по любому из пп.1-48 либо конъюгат по любому из пп.49-56 и фармацевтически приемлемый носитель или эксципиенты.
58. Полинуклеотид, кодирующий полипептид, входящий в состав антитела по любому из пп.1-48, выбранный из группы, состоящей из SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 37, 38, 40, 42, 43, 45, 47, 48, 49, 50, 52, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 74, 76, 78 и 80.
59. Полинуклеотид по п.58, отличающийся тем, что указанный полинуклеотид обладает последовательностью, имеющей как минимум 80% гомологию с полинуклеотидом, выбранным из группы, состоящей из SEQ ID NO:19, 21, 23, 25, 27, 29, 31, 33, 35, 39, 41, 44, 46, 51, 73, 75, 77 и 79.
60. Рекомбинантный вектор, содержащий полинуклеотид по любому из пп.58 и 59.
61. Клетка-хозяин, содержащая вектор по п.60.
62. Гибридомная клеточная линия, отличающаяся тем, что ее выбирают из группы, состоящей из гибридомной клеточной линии, обозначенной 37.3D7 РТА-7660; гибридомной клеточной линии, обозначенной 37.1F5 РТА-7661; гибридомной клеточной линии, обозначенной 53.2Н11 РТА-7662; гибридомной клеточной линии, обозначенной EphA2-N1 PTM-8407; или гибридомной клеточной линии, обозначенной EphA2-N2 PTM-8408, продуцирующая антитело по п.1.
Текст
Предложены антитела, в том числе гуманизированные и поверхностно-модифицированные,и их фрагменты, а также конъюгаты вышеперечисленных соединений с цитотоксическими средствами, которые специфически связывают и ингибируют рецепторы эфрина Eph класса А,противодействуют эффектам факторов роста на размножение и выживание опухолевых клеток и которые обладают минимальной агонистической активностью или предпочтительно лишены агонистической активности. Указанные антитела и их фрагменты можно применять для лечения опухолей, которые экспрессируют повышенные уровни рецепторов Eph класса А, таких как рак молочной железы, рак толстой кишки, рак легких, карцинома яичников, синовиальная карцинома и рак поджелудочной железы, а также для диагностики и визуализации опухолей, которые экспрессируют повышенные уровни рецепторов Eph класса А. Также предложены терапевтические композиции, содержащие указанные конъюгаты. Область техники изобретения Настоящее изобретение относится к новым мышиным анти-Eph моноклональным антителам или их фрагментам, а также их гуманизированным или поверхностно-модифицированным вариантам. Более конкретно, изобретение относится к новым моноклональным антителам или их фрагментам, а также их гуманизированным или поверхностно-модифицированным вариантам, которые взаимодействуют с семейством рецепторов EphA и действуют как антагонисты. Более конкретно, изобретение относится к антителам против рецептора EphA2, которые ингибируют клеточные функции рецептора EphA2. Еще более конкретно, изобретение относится к антителам против рецептора EphA2, которые препятствуют росту и выживанию опухолевых клеток и которые лишены агонистической активности. Кроме того, настоящее изобретение относится к цитотоксическим конъюгатам, содержащим связывающее клетки средство и цитотоксическое средство, терапевтическим композициям, содержащим конъюгат, способам применения конъюгатов для ингибирования клеточного роста и лечения заболевания, а также к набору, включающему цитотоксический конъюгат. В частности, связывающее клетки средство представляет собой моноклональное антитело или его эпитопсвязывающий фрагмент, а также его гуманизированный или поверхностно-модифицированный вариант, который распознает и связывает семейство рецепторов EphA. Уровень техники изобретения Рецепторные тирозинкиназы играют многообразную роль в клеточном росте и дифференциации при нормальных физиологических ответах, а также при онкогенной трансформации и развитии опухоли. Рецепторы Eph представляют собой уникальное семейство рецепторных тирозинкиназ (RTK), самое большое в геноме, состоящее по меньшей мере из 16 рецепторов, которые взаимодействуют с девятью мембраносвязанными эфриновыми лигандами (Pasquale, Е.В. et al., 2005, Nature Reviews Mol. Cell Biol.,6: 462-475). Их можно дополнительно подразделять на две группы, класс А и В, на основе гомологичности последовательности и афинности связывания (Pasquale, E.В. et al., 2005, Nature Reviews Mol. CellBiol., 6: 462-475). Рецепторы Eph класса А взаимодействуют с множественными лигандами семейства эфринов А, группы гликозилфосфатидилинозитол (GPI)-связанных мембранных белков, тогда как рецепторы Eph класса В связываются с эфриновыми В лигандами, семейством трансмембранных белков. Связывание рецепторов Eph со своими лигандами индуцирует группирование рецепторов, активацию киназной активности и последующее транс-фосфорилирование цитоплазматических доменов по остаткам тирозина с образованием центров причаливания для целого ряда сигнальных белков (Kullander, K. andKlein, R., 2002, Nature Reviews Mol. Cell Biol., 3: 475-486, Noren, N.K. and Pasquale, E.В., 2004, Cell signal.,16: 655-666). Рак представляет собой заболевание, характеризующееся неконтролируемой пролиферацией, являющейся следствием искаженной сигнальной трансдукции. Наиболее опасные формы рака представляют собой злокачественные клетки, обладающие способностью к распространению, либо непосредственно прорастая в прилегающие ткани посредством инвазии, либо путем имплантации в отдаленные участки с помощью метастазов. Метастатические клетки приобрели способность отделяться от первичной опухоли, перемещаться к отдаленным участкам по кровотоку или лимфатической системе и колонизировать отдаленное и чужеродное микроокружение. В настоящее время, очевидно, что молекулы Eph также играют роль в болезненных состояниях, таких как рак. В частности, сообщают о повышенной экспрессии рецептора EphA2 при раке яичников, молочной железы, предстательной железы, легких, толстой кишки, пищевода, клеток почечного эпителия,шейки матки, а также при меланоме. Предполагают, что EphA2 является позитивным регулятором клеточного роста и выживания злокачественных клеток (Landen, С.N. et al., 2005, Expert. Opin. Ther. Targets,9 (6): 1179-1187). Также описана роль EphA2 в метастазировании, поскольку сама по себе повышенная экспрессия EphA2 является достаточной для трансформации эпителиальных клеток молочной железы в злокачественный фенотип (Zelinski et al., 2001, Cancer Res., 61: 2301-2306) и увеличивает спонтанное метастазирование в отдаленные участки (Landen, С.N. et al., 2005, Expert. Opin. Ther. Targets, 9 (6): 11791187). Более того, имеется все больше указаний на то, что EphA2 принимает участие в ангиогенезе опухолей (Ogawa et al., 2000, Oncogene, 19: 6043-6052, Cheng et al. 2002, Mol. Cancer Res., 1: 2-11, Cheng et al. 2003, Neoplasia, 5 (5): 445-456, Dobrzanski et al., 2004, Cancer Res., 64: 910-919). Показано, что фосфорилирование EphA2 связано с его избытком. Фосфорилированный по остаткам тирозина EphA2 быстро интернализируется и обрекается на деградацию, в то время как нефосфорилированный EphA2 характеризуется замедленным метаболизмом и вследствие этого накапливается на клеточной поверхности. В настоящее время считается, что подобная модель может вносить вклад в высокую частоту встречаемости сверхэкспрессии EphA2 при раке (Landen, С.N. et al., 2005, Expert. Opin. Ther. Targets, 9 (6): 1179-1187). Однако реальная ситуация может быть более сложной, поскольку последние данные, судя по всему, свидетельствуют о роли зависимых и независимых от киназы функций EphA2 в развитии опухоли (Fang W.В., 2005, Oncogene, 24: 7859-7868). Разработаны агонистические антитела, которые стимулируют фосфорилирование по остаткам тирозина и интернализацию EphA2, что в конечном итоге приводит к ингибированию роста опухолевых клеток (Dodge-Zantek et al., 1999, Cell GrowthDiffer., 10: 629-638, WO 01/12172, WO 03/094859, WO 2004/014292, WO 2004/101764, WO 2006/023403, WO 2006/047637, WO 2007/030642). Данные антитела направлены против внеклеточного домена EphA2. Поскольку данные агонистические антитела не ингибируют, а скорее стимулируют фосфорилирование рецептора EphA2 и сигналы в нисходящем направлении, данные антитела не могут быть эффективными в отношении опухолей, развитию которых способствует киназная активность EphA2. С другой стороны, предложено использовать антагонистические средства, включая антитела (WO 2004/092343), однако в данном документе не раскрыто ни одного фактически существующего антагонистического антитела. Более того, подобные антитела были предложены скорее для стимулирования, чем для ингибирования клеточной пролиферации. В патентной заявке WO 2006/084226 раскрывают антитела, которые ни увеличивают, ни уменьшают киназную активностьEphA2, однако способны сдерживать пролиферацию опухолевых клеток. Однако в данном документе отсутствуют указания на то, что данные антитела предотвращают связывание эфрина А 1 с рецептором и ингибируют индуцированное эфрином А 1 фосфорилирование EphA2. Скорее, они могут влиять на пролиферацию опухолевых клеток посредством совершенно иного механизма, например, предотвращая группирование рецепторов после связывания эфрина А 1. Таким образом, специалист в данной области не сочтет такие антитела антагонистами, скорее, механизм их действия является неизвестным. Вследствие этого существует необходимость в новых антагонистических анти-EphA2 антителах,которые связываются с внеклеточными доменами рецептора EphA2, ингибируют его активацию лигандом эфрином А 1 и ингибируют зависимый от киназы EphA2 рост опухолевых клеток. Такие антагонистические антитела должны быть полезны для лечения рака. Сущность изобретения Соответственно, целью данного изобретения является предложить средства, которые специфически связываются с членами семейства рецепторов Eph класса А, такими как EphA2, и ингибируют клеточную активность рецептора, вызывая антагонизм рецептора. Таким образом, настоящее изобретение включает антитела или их фрагменты, которые распознают рецептор EphA2, предпочтительно человека, и действуют как антагонисты указанного рецептора. Рецептор EphA2 играет роль в развитии и росте опухолей, а также принимает участие в метастазировании. В некоторых вариантах осуществления антитела по изобретению способны ингибировать рост раковых клеток. В некоторых вариантах осуществления антитела по изобретению способны предотвращать миграцию метастатических раковых клеток. В предпочтительных вариантах осуществления раковая клетка представляет собой клетку злокачественного новообразования, выбранного из группы, состоящей из рака молочной железы, рака толстой кишки, рака эндометрия, карциномы яичника, остеосаркомы,рака шейки матки, рака предстательной железы, рака легких, синовиальной карциномы, рака поджелудочной железы, саркомы, глиомы, рака головы и шеи, рака желудка, рака печени и других карцином. В другом варианте осуществления антитела по изобретению способны ингибировать ангиогенез. Поскольку анти-EphA2 антитела, раскрытые в документах известного уровня техники, преимущественно являлись агонистами (например, WO 03/094859, WO 2004/014292, WO 2004/101764, WO 2006/023403, WO 2006/047637, WO 2007/030642), данное изобретение охватывает антитела, распознающие указанный рецептор, которые обладают минимальной агонистической активностью, или предпочтительно полностью лишены агонистической активности в отношении рецептора. В предпочтительном варианте осуществления антитела по изобретению не стимулируют фосфорилирование EphA2 по остаткам тирозина. Антитела по изобретению способны ингибировать связывание лиганда, предпочтительно эфрина А 1, с рецептором EphA2. В некоторых вариантах осуществления они способны ингибировать фосфорилирование EphA2 по остаткам тирозина. В другом варианте осуществления фосфорилирование EphA2 по остаткам тирозина ингибируется антителами по изобретению даже в присутствии эфрина А 1. В некоторых вариантах осуществления антитела по изобретению способны блокировать опосредованную EphA2 передачу сигнала, в частности, они способны ингибировать EphA2-зависимое фосфорилирование Akt. Данное изобретение также относится к антителам, которые связывают рецептор EphA2 с KD, составляющей 0,310-9 M или меньше. Антитела по изобретению могут быть поликлональными или моноклональными. Эпитопсвязывающие фрагменты, такие как фрагменты Fab, Fab', F(ab')2 или Fv, включены в объем данного изобретения. Предпочтительными являются моноклональные анти-EphA2 антитела. В более предпочтительном варианте осуществления предлагают мышиные антитела, выбранные из 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 иEphA2-N2, которые полностью охарактеризованы в данном описании в отношении их аминокислотных последовательностей вариабельных областей как легких, так и тяжелых цепей, последовательностей кДНК генов вариабельных областей легких и тяжелых цепей, идентификации их CDR (определяющих комплементарность областей), идентификации их поверхностных аминокислот и способов их экспрессии в рекомбинантной форме. Гибридомы, продуцирующие мышиные анти-EphA2 моноклональные антитела 37.3D7, 37.1F5 и 53.2 Н 11, а также EphA2-N1 и EphA2-N2, депонированы в соответствии с Будапештской конвенцией 16 июня 2006 г. и 3 мая 2007 г., соответственно, в Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Virginia 20110-2209, USA, под входящими номерами РТА 7660, РТА-7661, РТА-7662, РТА-8407 и РТА-8408, соответственно. Настоящее изобретение включает мышиные анти-EphA2 моноклональные антитела, выбранные из 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, а также поверхностно-модифицированные или гуманизированные варианты антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, где экспонированные на поверхности остатки каркасов вариабельной области антител, или их эпитопсвязывающие фрагменты,заменены как в легких, так и в тяжелых цепях для большего сходства с поверхностями известных человеческих антител. Гуманизированные антитела и их эпитопсвязывающие фрагменты по настоящему изобретению обладают улучшенными свойствами в том отношении, что они являются менее иммуногенными (или полностью неиммуногенными), чем мышиные варианты в субъектах-людях, которым их вводят. Таким образом, различные варианты гуманизированных антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 иEphA2-N2, а также их эпитопсвязывающие фрагменты по настоящему изобретению специфически распознают рецептор EphA2, при этом не являясь иммуногенными для человека. Гуманизированные варианты антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 по настоящему изобретению в данном описании полностью охарактеризованы в отношении их соответствующих аминокислотных последовательностей вариабельных областей как легких, так и тяжелых цепей, последовательностей ДНК генов вариабельных областей легких и тяжелых цепей, идентификации определяющих комплементарность областей (CDR), идентификации их поверхностных аминокислотных остатков каркасов вариабельных областей и раскрытия способов их экспрессии в рекомбинантной форме. Данное изобретение также предусматривает применение конъюгатов между цитотоксическими конъюгатами, включающих (1) связывающее клетки средство, которое распознает и связывает рецепторEphA, такой как рецептор EphA2, а также (2) цитотоксическое средство. В цитотоксических конъюгатах связывающее клетки средство обладает высокой афинностью для рецептора EphA (например, рецептораEphA2), и цитотоксическое средство обладает высокой степенью цитотоксичности для клеток, экспрессирующих рецептор EphA, так что цитотоксические конъюгаты по настоящему изобретению образуют эффективные цитолизирующие средства. В предпочтительном варианте осуществления связывающее клетки средство представляет собой анти-EphA2 антитело (например, 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2) или его эпитопсвязывающий фрагмент, более предпочтительно гуманизированное анти-EphA2 антитело (например,37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2) или его эпитопсвязывающий фрагмент, где цитотоксическое средство является ковалентно присоединенным, напрямую или через расщепляемый, либо нерасщепляемый линкер, к антителу или его эпитопсвязывающему фрагменту. В более предпочтительных вариантах осуществления связывающее клетки средство представляет собой гуманизированные антитела 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 или их эпитопсвязывающий фрагмент, а цитотоксическое средство представляет собой таксол, мейтанзиноид, производное томеймицина, производное лептомицина, СС-1065 или аналог СС-1065. В предпочтительных вариантах осуществления изобретения связывающее клетки средство представляет собой гуманизированное анти-EphA2 антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2N2, и цитотоксическое средство представляет собой мейтанзиновое соединение, такое как DM1 илиDM4. Настоящее изобретение также охватывает применение фрагментов анти-EphA2 антител, которые сохраняют способность связывать рецептор EphA2. В другом аспекте изобретения предусмотрено применение функциональных эквивалентов анти-EphA2 антител. Настоящее изобретение также охватывает способ ингибирования роста клеток, экспрессирующих рецептор EphA2. В предпочтительных вариантах осуществления способ ингибирования роста клеток,экспрессирующих рецептор EphA2, применяется in vivo и приводит к гибели клеток, хотя применения invitro и ex vivo также включены. Настоящее изобретение также относится к терапевтической композиции, содержащей анти-EphA2 антитело или конъюгат анти-EphA2 антитело-цитотоксическое средство и фармацевтически приемлемый носитель или эксципиенты. В некоторых вариантах осуществления терапевтическая композиция содержит второе терапевтическое средство. Это второе терапевтическое средство может быть выбрано из группы, включающей антагонисты фактора роста фибробластов (FGF), фактора роста гепатоцитов(HGF), тканевого фактора (TF), белка С, белка S, тромбоцитарного фактора роста (PDGF) или рецептораHER2. Кроме того, настоящее изобретение включает способ лечения субъекта, страдающего от рака, при помощи терапевтической композиции. В некоторых вариантах осуществления рак представляет собой метастатический рак. В частности, раковая клетка представляет собой клетку злокачественного новообразования, выбранного из группы, состоящей из рака молочной железы, рака толстой кишки, рака эндометрия, карциномы яичника, остеосаркомы, рака шейки матки, рака предстательной железы, рака легких,синовиальной карциномы, рака поджелудочной железы, саркомы, глиомы, рака головы и шеи, рака желудка, рака печени и других карцином. В предпочтительных вариантах осуществления цитотоксический конъюгат содержит анти-EphA2 антитело и цитотоксическое средство. В более предпочтительных вариантах осуществления цитотоксический конъюгат представляет собой конъюгат гуманизированное 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 антитело-DM1, гуманизированное 37.3D7, 37.1F5,-3 020324 53.2 Н 11, EphA2-N1 и EphA2-N2 антитело-DM4, конъюгат гуманизированное 37.3D7, 37.1F5, 53.2 Н 11,EphA2-N1 и EphA2-N2 антитело-таксан или конъюгат гуманизированное 37.3D7, 37.1F5, 53.2 Н 11,EphA2-N1 и EphA2-N2 антитело-производное томеймицина, и конъюгат вводят совместно с фармацевтически приемлемым носителем или эксципиентами. В другом аспекте изобретения анти-EphA2 антитела применяют для выявления белка EphA2 в биологическом образце. В предпочтительном варианте осуществления указанные антитела используют для определения уровней EphA2 в опухолевой ткани. Настоящее изобретение также относится к набору, включающему анти-EphA2 антитело или конъюгат анти-EphA2 антитело-цитотоксическое средство и инструкцию по применению. В предпочтительных вариантах осуществления анти-EphA2 антитела представляют собой гуманизированные антитела 37.3D7,37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, цитотоксическое средство представляет собой мейтанзиновое соединение, такое как DM1 или DM4, таксан, производное лептомицина или производное томеймицина,а инструкции относятся к применению конъюгатов в лечении субъекта, страдающего от рака. Набор может также включать компоненты, необходимые для приготовления фармацевтически приемлемого препарата, такие как разбавитель, в случае, если конъюгат находится в лиофилизированном состоянии или в концентрированной форме, а также для введения препарата. Если не указано особо, все литературные источники и патенты, цитированные в данном описании,включены в него посредством ссылок. Краткое описание чертежей На фиг. 1 представлен анализ методом FACS-анализа специфического связывания анти-EphA2 антител с клетками, сверхэкспрессирующими EphA2 человека (клетки 300-19/hu-EphA2). На фиг. 1 А представлены данные для антитела 37.3D7, на фиг. 1 В - для антитела 37.1F5 и на фиг. 1 С - для антитела 53.2 Н 11, соответственно. На фиг. 2 представлено специфическое связывание очищенного антитела 37.3D7 с клетками BxPC3 рака поджелудочной железы человека, клетками MDA-MB-231 рака молочной железы человека и клетками НТ-29 рака толстой кишки человека. Представлены гистограммы FACS-анализа. На фиг. 3 представлены кривые связывания для антител 37.3D7 (фиг. 3 А), 37.1F5 (фиг. 3 В) и 53.2 Н 11 (фиг. 3 С), полученные с мышиными клетками 300-19, сверхэкспрессирующими EphA2 человека(300-19/hu-EphA2). На фиг. 4 представлено специфическое связывание очищенных антител 37.3D7 и 53.2 Н 11 с клетками, сверхэкспрессирующими EphA2. Представлены гистограммы FACS-анализа. На фиг. 4 А представлены данные для клеток, сверхэкспрессирующих мышиный EphA2 (300-19/mu-EphA2), и на фиг. 4 В представлены данные для клеток, сверхэкспрессирующих крысиный EphA2 (300-19/rat-EphA2). На фиг. 5 А представлено специфическое связывание очищенных антител 37.3D7, 37.1F5 и 53.2 Н 11 с эпителиальными клетками почки обезьяны VERO. Представлены гистограммы FACS-анализа. На фиг. 5 В представлены кривые связывания для антител 37.3D7, 37.1F5 и 53.2 Н 11, полученные с эпителиальными клетками почки обезьяны VERO. На фиг. 6 показано ингибирование антителами 37.3D7, 37.1F5 и 53.2 Н 11 связывания биотинилированного эфрина А 1 с клетками MDA-MB-231 рака молочной железы человека. На фиг. 7 А показано ингибирование антителами 37.3D7 и 37.1F5 стимулированного эфрином А 1 фосфорилирования EphA2 в клетках MDA-MB-231 молочной железы. На фиг. 7 В показано ингибирование антителами 37.3D7 и 53.2 Н 11 стимулированного эфрином А 1 фосфорилирования EphA2 в клетках MDA-MB-231 молочной железы. На фиг. 7 С показано ингибирование антителами 37.3D7 и 37.1F5 стимулированного эфрином А 1 фосфорилирования Akt в клетках CFPAC-1 поджелудочной железы. На фиг. 8 А и В показано стимулирование фосфорилирования EphA2 эфрином А 1 и отсутствие стимулирования фосфорилирования EphA2 антителами 37.3D7, 37.1F5 и 53.2 Н 11 в клетках MDA-MB-231 молочной железы. На фиг. 9A-9D показано ингибирование стимулированных сывороткой роста и выживания клеток НТ-29 толстой кишки (9 А), клеток LoVo толстой кишки (9 В), клеток CFPAC-1 поджелудочной железы(9 С) и клеток UACC-257 меланомы (9D) антителами 37.3D7 и 53.2 Н 11. На фиг. 10 А показано дозозависимое ингибирование стимулированного сывороткой роста клеток ВхРС 3 поджелудочной железы антителом 37.3D7. На фиг. 10 В показано дозозависимое ингибирование стимулированного сывороткой роста клетокLoVo толстой кишки антителом 53.2 Н 11. На фиг. 10 С показано дозозависимое ингибирование стимулированного EGF роста клеток LoVo толстой кишки антителом 53.2 Н 11. На фиг. 11 А представлена кривая связывания антитела 37.3D7 с клетками HUVEC. На фиг. 11 В представлена кривая связывания антитела 37.1F5 с клетками HUVEC. На фиг. 12 показано ингибирование стимулированного VEGF роста и выживания клеток HUVEC антителом 37.3D7. На фиг. 13 показано ингибирование антителом 37.3D7 индуцированного VEGF фосфорилированияAkt в клетках HUVEC. На фиг. 14 показан эффект воздействия антителом 37.3D7 на рост ксенотрансплантата рака толстой кишки НТ-29 в мышах. Эффект сравнивается с таковым для анти-EGFR антитела и контрольного не связывающегося антитела IgG1. На фиг. 15 А показано ингибирование роста клеток РС 3 опухоли предстательной железы с помощьюhu37.3D7-SPDB-DM4. На фиг. 15 В показано ингибирование роста клеток РС 3 опухоли предстательной железы с помощьюhu53.2H11-SPDB-DM4. На фиг. 16 А показан эффект воздействия hu37.3D7-SPDB-DM4 на рост ксенотрансплантата опухоли молочной железы MDA-MB-231 у мышей. На фиг. 16 В показан эффект воздействия hu53.2H11-SPDB-DM4 на рост ксенотрансплантата опухоли молочной железы MDA-MB-231 у мышей. Подробное описание изобретения В данном описании предложены новые средства, способные специфически связывать рецепторыEphA и вызывать антагонизм указанных рецепторов. В частности, авторы настоящего изобретения открыли новые антитела, которые специфически связываются с рецепторами EphA на клеточной поверхности. В то время как известные ранее антитела, которые специфически связывают рецептор EphA, также активируют его даже в отсутствие его лигандов, антитела или фрагменты по настоящему изобретению предпочтительно лишены любой агонистической активности. С другой стороны, они обладают уникальной способностью ингибировать клеточные функции рецептора даже в присутствии его лигандов, свойством, которое полностью отсутствует у известных ранее EphA2-связывающих антител. Более того, антагонистические антитела и фрагменты антител по настоящему изобретению ингибируют рост и/или миграцию опухолевых клеток человека, и/или ангиогенез, три свойства, абсолютно неожиданные, принимая во внимание известный уровень техники (Landen, С.N. et al., 2005, Expert. Opin. Ther. Targets, 9 (6): 11791187, WO 01/12172, WO 2004/014292, WO 2004/092343). Как используется в данном описании, термин рецептор Eph означает тирозинкиназу, принадлежащую к семейству рецепторов Eph (обзор в Pasquale, Е.В. et al., 2005, Nature Reviews Mol. Cell Biol., 6,462-475). Семейство рецепторов Eph класса А или рецепторы EphA, как используется в данном описании, предпочтительно взаимодействуют с гликозилфосфатидилинозитол (GPI)-связанными лигандами(подкласса эфрина А, который в настоящее время включает пять лигандов). Специфические рецепторыmEek), а также их существующие в природе варианты. Предпочтительным рецептором Eph в данном описании является рецептор EphA2, обладающий, например, аминокислотной последовательностью под номерами доступа в Genbank NM004431 (человеческий EphA2), NM010139 (мышиный EphA2) илиNXM345596 (крысиный EphA2). Термин лиганд Eph, как используется в данном описании, означает белок, который связывает и необязательно активирует (например, стимулирует его аутофосфорилирование) рецептор Eph. В данном описании предпочтительным лигандом Eph является эфрин А 1, который связывается с рецептором EphA2 и обладает, например, аминокислотной последовательностью под номером достура в Genbank NM004428 (человеческий эфрин А 1). Термин антагонист, как используется в данном описании, означает молекулу, которая способна ингибировать одну или более биологических активностей молекулы-мишени, такой как рецептор EphA. Антагонисты могут действовать, препятствуя связыванию рецептора с лигандом и наоборот, уменьшая фосфорилирование EphA2 и/или выводя из строя, либо уничтожая клетки, которые были активированы лигандом. Антагонисты могут полностью блокировать взаимодействия рецептор-лиганд или могут существенно уменьшать такие взаимодействия. Все подобные особенности вмешательства со стороны антагониста следует считать эквивалентными для целей данного изобретения. Таким образом, в объем изобретения входят антагонисты (например, нейтрализующие антитела), которые связываются с рецепторомEphA, лигандом Eph или комплексом рецептора Eph и лиганда Eph; варианты, отличающиеся по аминокислотным последовательностям, или производные рецептора EphA или лиганда EphA, которые препятствуют взаимодействию между рецептором EphA и лигандом EphA; растворимый рецептор EphA или растворимый лиганд EphA, необязательно слитые с гетерологичной молекулой, такой как область иммуноглобулина (например, иммуноадгезин); комплекс, включающий рецептор EphA, связанный с лигандомEphA; пептиды с синтетической или природной последовательностью, которые связываются с рецептором EphA или лигандом EphA. Термин агонист, как используется в данном описании, означает любое соединение, включая белок, полипептид, пептид, антитело, фрагмент антитела, конъюгат, большую молекулу, малую молекулу,способное активировать одну или более биологических активностей молекулы-мишени. Агонисты EphA действуют, стимулируя фосфорилирование белка, тем самым запуская процесс деградации указанного белка. Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится,среди прочих отличительных признаков, к анти-EphA моноклональным антителам, анти-EphA гуманизированным антителам, а также фрагментам анти-EphA антител. Все антитела и фрагменты антител по настоящему изобретению разработаны для специфического распознавания и связывания рецептора EphA2 и действуют как антагонисты рецептора EphA2. Кроме того, антагонистические антитела и фрагменты антител по изобретению обладают уникальными свойствами, будучи способными ингибировать рост опухолевых клеток человека и/или миграцию метастатических раковых клеток, и/или ангиогенез. Предпочтительный рецептор EphA, связываемый антагонистическими антителами и фрагментами антител по изобретению, представляет собой рецептор EphA2. Человеческий EphA2 является предпочтительным рецептором EphA2. Рецептор EphA2 принадлежит к семейству рецепторов, у которых фосфорилирование цитоплазматического концевого сегмента возрастает после связывания лиганда для взаимодействия с множеством регулирующих и сигнальных белков, что приводит к активации различных клеточных сигнальных каскадов реакций в нисходящем направлении (Kullander, K. and Klein, R., 2002, Nature Reviews Mol. Cell Biol.,3: 475-486, Noren, N.K. and Pasquale, E. В., 2004, Cell signal., 16: 655-666). Как используется в данном описании, термин опосредованная EphA2 передача сигнала означает все клеточные события, которые происходят в ответ на связывание лиганда с EphA2. В то время как антитела, раскрытые в документах известного уровня техники, действуют как агонисты рецептора EphA2 и, в частности, увеличивают фосфорилирование по остаткам тирозина белка EphA2, антитела и фрагменты антител по изобретению предпочтительно лишены любых подобных агонистических свойств. В частности, они не способны сами стимулировать фосфорилирование EphA2. С другой стороны, данное изобретение относится к первым подлинно антагонистическим антиEphA2 антителам. В одном варианте осуществления антитела и фрагменты антител по изобретению способны ингибировать связывание лиганда с рецептором EphA. В предпочтительном варианте осуществления связывание эфрина А 1 с EphA2 предотвращают антитела и их фрагменты, предложенные по данному изобретению. Примечательно, что в другом варианте осуществления антитела и фрагменты антител по изобретению способны ингибировать фосфорилирование по остаткам тирозина рецептора EphA2, даже в присутствии эфрина А 1. Более того, указанные антитела и их фрагменты способны ингибировать опосредованную EphA2 передачу сигнала. В частности, зависимое от эфрина А 1 фосфорилирование Akt можно предотвращать с помощью антител и фрагментов антител по изобретению. Антитела Термин антитело в данном описании используется в самом широком смысле и, в особенности, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела) любого изотипа, такие как IgG, IgM, IgA, IgD и IgE, поликлональные антитела, мультиспецифические антитела, химерные антитела и фрагменты антител. Антитело, способное вступать в реакцию с определенным антигеном, можно получать рекомбинантными методами, такими как селекция библиотек рекомбинантных антител в фаге или схожих векторах, либо иммунизируя животное антигеном или кодирующей антиген нуклеиновой кислотой. Типичное антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей,которые соединены дисульфидными мостиками. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область. Каждая вариабельная область содержит три сегмента, называемые определяющие комплементарность области (CDR) или гипервариабельные области, которые в первую очередь ответственны за связывание эпитопа антигена. Обычно их называют CDR1, CDR2 и CDR3,пронумерованные последовательно, начиная с N-конца. Более консервативные участки вариабельных областей называются каркасные области. Как используется в данном описании, VH или VH означает вариабельную область иммуноглобулиновой тяжелой цепи антитела, включая тяжелую цепь фрагмента Fv, scFv, dsFv, Fab, Fab' или F(ab')2. Обозначение VL или VL относится к вариабельной области иммуноглобулиновой легкой цепи антитела, включая легкую цепь фрагмента Fv, scFv, dsFv, Fab, Fab' или F(ab')2. Поликлональное антитело представляет собой антитело, которое было получено в числе прочих или в присутствии одного или большего количества других, не идентичных антител. Как правило, поликлональные антитела получают из В-лимфоцитов в присутствии нескольких других В-лимфоцитов, продуцирующих не идентичные антитела. Обычно поликлональные антитела получают непосредственно от иммунизированного животного. Моноклональное антитело, как используется в данном описании, представляет собой антитело,полученное из популяции в основном гомогенных антител, то есть антитела, образующие данную популяцию, являются по существу идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Данные антитела направлены против одного эпитопа и вследствие этого являются высоко специфическими. Эпитоп представляет собой участок антигена, с которым связывается антитело. Он может быть образован смежными остатками или несмежными остатками, расположенными в непосредственной близости друг от друга при укладке антигенного белка. Эпитопы, образованные смежными аминокислотами,обычно сохраняются в условиях денатурирующих растворителей, тогда как эпитопы, образованные несмежными аминокислотами, обычно утрачиваются в указанных условиях. Как используется в данном описании, термин KD означает константу диссоциации при взаимодействии конкретное антитело/антиген. В основе настоящего изобретения лежат мышиные анти-EphA2 антитела, в данном описании обозначенные 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, которые полностью охарактеризованы в отношении аминокислотных последовательностей как легких, так и тяжелых цепей, идентификации CDR,идентификации поверхностных аминокислот, а также способов их экспрессии в рекомбинантной форме. Первичные аминокислотные последовательности и последовательности ДНК легких и тяжелых цепей антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, a также гуманизированных вариантов, раскрыты в данном описании. Антитела 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 получены с помощью гибридом, соответственно обозначенных 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, и депонированы в соответствии с Будапештской конвенцией 16 июня 2006 г. и 3 мая 2007 г., соответственно, в Американской коллекции типовых культур, 10801 University Boulevard, Manassas, Virginia 20110-2209, USA, под номерами доступа РТА-7660, РТА-7661, РТА-7662, РТА-8407 и РТА-8408, соответственно. Объем настоящего изобретения не ограничен антителами и фрагментами, обладающими данными последовательностями. Напротив, все антитела и фрагменты, которые специфически связываются с рецептором EphA2 и противодействуют биологической активности рецептора, но которые лишены агонистической активности, входят в объем настоящего изобретения. Таким образом, антитела и фрагменты антител могут отличаться от антитела 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2, либо от гуманизированных производных, по аминокислотным последовательностям их каркасной структуры, CDR, легкой цепи и тяжелой цепи, и все-таки входить в объем настоящего изобретения. В одном варианте осуществления данное изобретение относится к антителам или их эпитопсвязывающим фрагментам, содержащим одну или более CDR, обладающих аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1, 2, 3, 4, 5, б, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 и 72. В предпочтительном варианте осуществления антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, 2, 3, 7, 8, 9, 13, 14, 15, 61, 62, 63, 67, 68 и 69, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:4, 5, 6, 10, 11, 12, 16, 17, 18, 64, 65, 66, 70, 71 и 72. В более предпочтительном варианте осуществления антитела по изобретению содержат три CDR,обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ IDNO:1, 2, 3, 4, 5 и 6. В еще более предпочтительном варианте осуществления предлагают антитело 37.3D7,которое содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:1, 2 и 3, и указанная легкая цепь содержит три последовательныеCDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:4, 5 и 6. В другом более предпочтительном варианте осуществления антитела по изобретению содержат триID NO:7, 8, 9, 10, 11 и 12. В еще более предпочтительном варианте осуществления предлагают антитело 37.1F5, которое содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:7, 8 и 9, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:10, 11 и 12. В другом более предпочтительном варианте осуществления антитела по изобретению содержат триID NO:13, 14, 15, 16, 17 и 18. В еще более предпочтительном варианте осуществления предлагают антитело 53.2 Н 11, которое содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:13, 14 и 15, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ IDNO:16, 17 и 18. В другом более предпочтительном варианте осуществления антитела по изобретению содержат триID NO:61, 62, 63, 64, 65 и 66. В еще более предпочтительном варианте осуществления предлагают анти-7 020324 тело EphA2-N1, которое содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:61, 62 и 63, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ IDNO:64, 65 и 66. В другом более предпочтительном варианте осуществления антитела по изобретению содержат триID NO:67, 68, 69, 70, 71 и 72. В еще более предпочтительном варианте осуществления предлагают антитело EphA2-N2, которое содержит по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:67, 68 и 69, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ IDNO:70, 71 и 72. В другом варианте осуществления антитела по изобретению содержат VH, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:20, 22, 24, 74 и 76. В предпочтительном варианте осуществления предлагают антитело 37.3D7, содержащее VH, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:20. В другом предпочтительном варианте осуществления предлагают антитело 37.1F5, содержащее VH, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:22. В другом предпочтительном варианте осуществления предлагают антитело 53.2 Н 11, содержащее VH, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:24. В другом предпочтительном варианте осуществления предлагают антителоNO:74. В другом предпочтительном варианте осуществления предлагают антитело EphA2-N2, содержащее VH, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:76. В другом предпочтительном варианте осуществления антитела по изобретению содержат VL, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:26, 28,30, 78 и 80. В предпочтительном варианте осуществления предлагают антитело 37.3D7, содержащее VL,обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:26. В другом предпочтительном варианте осуществления предлагают антитело 37.1F5, содержащее VL, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:28. В другом предпочтительном варианте осуществления предлагают антитело 53.2 Н 11, содержащее VL, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:30. В другом предпочтительном варианте осуществления предлагают антитело EphA2-N1, содержащее VL, обладающую аминокислотной последовательностью, состоящей изSEQ ID NO:78. В другом предпочтительном варианте осуществления предлагают антитело EphA2-N2,содержащее VL, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:80. Гуманизированные или поверхностно-модифицированные антитела 37.3D7, 37.1F5, 53.2 Н 11,EphA2-N1 и EphA2-N2 Как используется в данном описании, термин гуманизированное антитело означает химерное антитело, которое содержит минимальную последовательность, происходящую из иммуноглобулина, отличного от человеческого. Химерное антитело, как используется в данном описании, представляет собой антитело, в котором константная область или ее часть подвергнута изменению, замене или обмену таким образом, что вариабельная область присоединена к константной области других видов, либо принадлежащей к другому классу или подклассу антител. Химерное антитело также означает антитело, в котором вариабельная область или ее часть подвергнута изменению, замене или обмену таким образом,что константная область присоединена к вариабельной области других видов, либо принадлежащей к другому классу или подклассу антител. Целью гуманизации является снижение иммуногенности ксеногенного антитела, такого как мышиное антитело, для введения человеку, но при этом с сохранением полной антигенсвязывающей активности и специфичности антитела. Гуманизированные антитела, или антитела, адаптированные, чтобы не отторгаться другими млекопитающими, можно получать с помощью различных методик, таких как поверхностная модификация и пересадка CDR. Как используется в данном описании, в методике поверхностного модифицирования используют сочетание молекулярного моделирования, статистического анализа и мутагенеза для изменения отличных от CDR поверхностей вариабельных областей антитела с тем,чтобы они напоминали поверхности известных антител целевого хозяина. Стратегии и способы поверхностной модификации антител, а также другие способы снижения иммуногенности антител в отличающемся хозяине описаны в патенте США 5639641, полное содержание которого включено в данное описание посредством ссылки. Кратко, в предпочтительном способе (1) производят выравнивания по позициям пула вариабельных областей тяжелой и легкой цепи антител для получения набора экспонированных на поверхности позиций каркаса вариабельной области тяжелой и легкой цепи, где выравниваемые позиции для всех вариабельных областей являются по меньшей мере примерно на 98% идентичными, (2) набор экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи определяют для антитела грызуна (или фрагмента антитела), (3) определяют набор экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, который в наибольшей степени идентичен набору экспонированных на поверхности аминокислотных остатков грызуна, (4) набор экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, определенный на этапе (2), замещают набором экспонированных на поверхности аминокислотных остатков каркаса вариабельной области тяжелой и легкой цепи, определенным на этапе (3), за исключением тех аминокислотных остатков, которые находятся в пределах 5 от любого атома любого остатка определяющих комплементарность областей антитела грызуна, и (5) получают гуманизированное антитело грызуна, обладающее специфичностью связывания. Антитела можно гуманизировать, применяя разнообразные методики, включая пересадку CDR (ЕР 0239400, WO 91/09967, патенты США 5530101 и 5585089), маскирование или поверхностную модификацию (ЕР 0592106, ЕР 0519596, Padlan Е.А., 1991, Molecular Immunology 28(4/5): 489-498, StudnickaG.M. et al., 1994, Protein Engineering 7(6): 805-814, Roguska M.A. et al., 1994, Proc. Natl. Acad. Sci. U.S.A.,91:969-973), а также перетасовку цепи (патент США 5565332). Человеческие антитела можно получать с помощью разнообразных методов, известных в данной области, включая методы фагового дисплея. См. также патенты США 4444887, 4716111, 5545806 и 5814318, а также публикации международных патентных заявок номера WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741 (полное содержание указанных литературных источников включено посредством ссылок). Настоящее изобретение относится к гуманизированным антителам или их фрагментам, которые распознают рецептор EphA2 и действуют как антагонисты. В другом варианте осуществления гуманизированные антитела или их эпитопсвязывающие фрагменты обладают дополнительной способностью ингибировать рост раковых клеток, экспрессирующих рецептор EphA2. В следующем варианте осуществления гуманизированное антитело или его эпитопсвязывающий фрагмент обладает дополнительной способностью ингибировать миграцию метастатических раковых клеток, экспрессирующих рецепторEphA2. Предпочтительным вариантом осуществления такого гуманизированного антитела является гуманизированное антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, либо его эпитопсвязывающий фрагмент. В более предпочтительных вариантах осуществления предлагают поверхностномодифицированные или гуманизированные варианты антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 иEphA2-N2, где экспонированные на поверхности остатки антитела или его фрагментов заменены как в легкой, так и в тяжелой цепях, чтобы в большей степени напоминать поверхности известных человеческих антител. Гуманизированные антитела 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 или их эпитопсвязывающие фрагменты по настоящему изобретению обладают улучшенными свойствами. Например, гуманизированные антитела 37.3D7, 37.1F5 и 53.2 Н 11 или их эпитопсвязывающие фрагменты специфически распознают рецептор EphA2. Более предпочтительно гуманизированные антитела 37.3D7,37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 или их эпитопсвязывающие фрагменты обладают дополнительной способностью ингибировать рост клеток, экспрессирующих рецептор EphA2. Гуманизированные варианты антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 также полностью охарактеризованы в данном описании в отношении соответствующих им аминокислотных последовательностей вариабельных областей как легкой, так и тяжелой цепи, последовательностей ДНК генов вариабельных областей легких и тяжелых цепей, идентификации CDR, идентификации их поверхностных аминокислот и раскрытия способов для их экспрессии в рекомбинантной форме. Однако объем настоящего изобретения не ограничен антителами и фрагментами, обладающими данными последовательностями. Напротив, все антитела и фрагменты, которые специфически связываются с рецептором EphA2,включены в настоящее изобретение. Предпочтительно антитела и фрагменты, которые специфически связываются с рецептором EphA2, проявляют антагонизм с биологической активностью рецептора. Более предпочтительно такие антитела, дополнительно, по существу лишены агонистической активности. Таким образом, антитела и эпитопсвязывающие фрагменты антител по настоящему изобретению могут отличаться от антитела 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2 или его гуманизированных производных по аминокислотным последовательностям их каркасной структуры, CDR и/или легкой цепи и тяжелой цепи, и все-таки входить в объем настоящего изобретения.CDR антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2 идентифицированы при помощи моделирования, и их молекулярные структуры прогнозируемы. Кроме того, хотя CDR являются важными для распознавания эпитопа, они не являются незаменимыми для антител и фрагментов по изобретению. Соответственно, предлагают антитела и фрагменты, которые обладают улучшенными свойствами,полученными, например, при помощи созревания афинности антитела по настоящему изобретению. Гены гаметического типа для IgV и J легкой цепи мыши, а также гены гаметического типа для IgVh иEphA2-N2, были идентифицированы, как раскрыто в разделе экспериментальных примеров. Такие последовательности генов гаметического типа полезны для выявления соматических мутаций в антителах,в CDR включительно. Последовательности вариабельных областей тяжелой цепи и легкой цепи антител 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 и EphA2-N2, а также последовательности их CDR ранее не были известны и опубликованы в данной заявке. Подобную информацию можно использовать для получения гуманизированных вариантов антител 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2. Данные гуманизированные антиEphA антитела или их производные могут также быть использованы в качестве связывающего клетки средства по настоящему изобретению. Таким образом, в одном варианте осуществления данное изобретение относится к гуманизированным антителам или их эпитопсвязывающим фрагментам, содержащим одну или более CDR, обладающих аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:1, 2, 3, 4, 5, 6, 7,8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71 и 72. В предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, и указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, 2, 3, 7, 8, 9, 13, 14, 15, 61, 62, 63, 67, 68 и 69, и указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, выбранными из группы,состоящей из SEQ ID NO:4, 5, 6, 10, 11, 12, 16, 17, 18, 64, 65, 66, 70, 71 и 72. В дополнительном предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQID NO:1, 2 и 3, и где указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQ ID NO:4, 5 и 6. В другом дополнительном предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQ ID NO:7, 8 и 9, и где указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQ ID NO:10, 11 и 12. В другом дополнительном предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQ ID NO:13, 14 и 15, и где указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, представленными SEQID NO:16, 17 и 18. В другом более предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, где указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:61, 62 и 63, и где указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ IDNO:64, 65 и 66. В другом более предпочтительном варианте осуществления гуманизированные антитела по изобретению содержат по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь,где указанная тяжелая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ ID NO:67, 68 и 69, и где указанная легкая цепь содержит три последовательные CDR, обладающие аминокислотными последовательностями, состоящими из SEQ IDNO:70, 71 и 72. В одном варианте осуществления данное изобретение относится к гуманизированным антителам или их фрагментам, которые содержат VH, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:32, 34, 36, 37, 38, 40, 42, 43 и 45. В предпочтительном варианте осуществления предлагают гуманизированное антитело 37.1D7, которое содержит VH, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:32, 34 и 36. В другом предпочтительном варианте осуществления предлагают гуманизированное антитело 37.1F5, которое содержит VH, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:37 и 38. В другом предпочтительном варианте осуществления предлагают гуманизированное антитело 53.2 Н 11, которое содержит VH, обладающую аминокислотной последовательностью,выбранной из группы, состоящей из SEQ ID NO:40, 42, 43 и 45. В другом варианте осуществления данное изобретение относится к гуманизированным антителам или их фрагментам, которые содержат VL, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:47, 48, 49, 50 и 52. В предпочтительном варианте осуществления предлагают гуманизированное антитело 37.1D7, которое содержит VL, обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:47. В другом предпочтительном варианте осуществления предлагают гуманизированное антитело 37.1F5, которое содержит VL, обладающую аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO:48, 49 и 50. В другом предпочти- 10020324 тельном варианте осуществления предлагают гуманизированное антитело 53.2 Н 11, которое содержит VL,обладающую аминокислотной последовательностью, состоящей из SEQ ID NO:52. Гуманизированные антитела 37.3D7 и их эпитопсвязывающие фрагменты по настоящему изобретению могут также содержать замены аминокислотных остатков в легкой и/или тяжелой цепи на одной или большем числе позиций, маркированные серым остатки в табл. 1 А и 1 В, которые представляют собой мышиные поверхностные остатки каркаса, претерпевшие изменение с исходного мышиного остатка на соответствующий поверхностный остаток каркаса в человеческом антителе, 28 Е 4. Помеченные звездочкойостатки в табл. 1 В соответствуют мышиным обратным мутациям в вариантах тяжелой цепи гуманизированного 37.3D7 (SEQ ID NO:34 и SEQ ID NO:36). Остатки для обратных мутаций являются проксимальными относительно CDR и были выбраны, как описано в патенте США 5639641, или по аналогии с выбором остатков, который в предыдущих попытках гуманизации привел к снижению афинности связывания антигена (Roguska et al., 1996, Protein Eng.; 9(10): 895-904, публикации патентных заявок США 2003/0235582 и 2005/0118183). Аналогичным образом, гуманизированные антитела 37.1F5, 53.2 Н 11, EphA2-N1 и EphA2-N2 и их эпитопсвязывающие фрагменты по настоящему изобретению могут также содержать замены аминокислотных остатков в легкой и/или тяжелой цепи. Полинуклеотиды, векторы и клетки-хозяева Предложены нуклеиновые кислоты, кодирующие анти-EphA2 антитела по изобретению. В одном варианте осуществления молекула нуклеиновой кислоты кодирует тяжелую и/или легкую цепь антиEphA2 иммуноглобулина. В предпочтительном варианте осуществления одна нуклеиновая кислота кодирует тяжелую цепь анти-EphA2 иммуноглобулина, и другая молекула нуклеиновой кислоты кодирует легкую цепь анти-EphA2 иммуноглобулина. В другом аспекте данного изобретения предлагают полинуклеотиды, кодирующие полипептиды,обладающие аминокислотной последовательностью, выбранной из группы SEQ ID NO:1, 2, 3, 4, 5, 6, 7, 8,9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 37, 38, 40, 42, 43, 45, 47, 48, 49, 50, 52,61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 74, 76, 78 и 80. В предпочтительном варианте осуществления полинуклеотид по изобретению выбирают из группы, состоящей из SEQ ID NO:19, 21, 23, 25, 27, 29, 31,33, 35, 39, 41, 44, 46, 51, 73, 75, 77 и 79. Изобретение не ограничивается указанными полинуклеотидами в чистом виде, но также включает все полинуклеотиды, характеризующиеся по меньшей мере 80% идентичностью с указанными полинуклеотидами. Изобретение относится к векторам, содержащим полинуклеотиды по изобретению. В одном варианте осуществления вектор содержит полинуклеотид, кодирующий тяжелую цепь анти-EphA2 иммуноглобулина. В другом варианте осуществления указанный полинуклеотид кодирует легкую цепь антиEphA2 иммуноглобулина. Изобретение также относится к векторам, содержащим молекулы полинуклеотида, кодирующие слитые белки, модифицированные антитела, фрагменты антител и их зонды. Для того чтобы экспрессировать тяжелую и/или легкую цепь анти-EphA2 антител по изобретению,полинуклеотиды, кодирующие указанные тяжелые и/или легкие цепи, встраивают в экспрессионные векторы таким образом, что гены являются функционально связанными с транскрипционными и трансляционными последовательностями. Экспрессионные векторы включают плазмиды, YAC, космиды, ретровирусы, производные от EBV эписомы, а также все другие векторы, которые, как известно квалифицированному специалисту в данной области, удобно использовать для гарантированной экспрессии указанных тяжелых и/или легких цепей. Специалист в данной области понимает, что полинуклеотиды, кодирующие тяжелые и легкие цепи, могут быть клонированы в различные векторы или в один и тот же вектор. В предпочтительном варианте осуществления указанные полинуклеоитды клонированы в один и тот же вектор. Полинуклеотиды по изобретению и векторы, содержащие данные молекулы, можно использовать для трансформации подходящей клетки-хозяина млекопитающего, либо любого другого типа клеткихозяина, известного специалисту в данной области. Трансформацию можно проводить любым из известных способов введения полинуклеотидов в клетку-хозяина. Такие способы хорошо известны специалистам в данной области и включают опосредованную декстраном трансформацию, преципитацию с фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида в липосомы, биолистические инъекции и прямые микроинъекции ДНК в ядра. Фрагменты антител Антитела по настоящему изобретению включают как полноразмерные антитела, обсуждавшиеся выше, так и эпитопсвязывающие фрагменты. Как используется в данном описании, фрагменты антител включают любые части антитела, которые сохраняют способность связывать эпитоп, распознаваемый полноразмерным антителом, обычно называемые эпитопсвязывающими фрагментами. Примеры фрагментов антител включают, но не ограничиваются ими, Fab, Fab' и F(ab')2, Fd, одноцепочечные Fv (scFv),одноцепочечные антитела, связанные дисульфидными мостиками Fvs (dsFv), и фрагменты, содержащие либо VL, либо VH-область. Эпитопсвязывающие фрагменты, включая одноцепочечные антитела, могут включать вариабельную область(ти) саму по себе или в сочетании с полным или частичным вариантом перечисленного далее: шарнирная область, домены CH1, CH2 и CH3. Такие фрагменты могут содержать один или оба фрагмента Fab или фрагмент F(ab')2. Предпочтительно фрагменты антитела содержат все шесть CDR полноразмерного антитела, хотя фрагменты, содержащие менее шести подобных областей, например, три, четыре или пять CDR, также являются функциональными. Далее, фрагменты могут представлять собой или сочетать в себе членов любого из следующих классов иммуноглобулинов: IgG, IgM, IgA, IgD или IgE, а также их подклассов. Фрагменты Fab и F(ab')2 можно получать протеолитическим расщеплением при помощи ферментов,таких как папаин (фрагменты Fab) или пепсин (фрагменты F(ab')2). Одноцепочечные FVs (scFvs) фрагменты представляют собой эпитопсвязывающие фрагменты,которые содержат по меньшей мере один фрагмент вариабельной области тяжелой цепи антитела (VH),связанный с по меньшей мере одним фрагментом вариабельной области легкой цепи антитела (VL). Линкер может представлять собой короткий гибкий пептид, выбранный так, чтобы гарантировать правильную трехмерную укладку областей (VL) и (VH), в то время как они связаны таким образом, чтобы сохранять специфичность связывания молекулы-мишени целого антитела, от которого происходит данный одноцепочечный фрагмент антитела. Карбоксильный конец последовательности (VL) или (VH) может быть ковалентно присоединен к амино-концу комплементарной последовательности (VL) или (VH). Одноцепочечные фрагменты антител по настоящему изобретению содержат аминокислотные последовательности, обладающие по меньшей мере одной из вариабельных или определяющих комплементарность областей (CDR) полноразмерных антител, описанных в данном описании, однако лишенные некоторых или всех константных доменов таких антител. Данные константные домены не являются необходимыми для связывания антигена, однако представляют собой большую часть структуры полноразмерных антител. Вследствие этого, использование одноцепочечных фрагментов антител позволит преодолеть некоторые из проблем, связанных с применением антител, содержащих константный домен частично или полностью. Например, одноцепочечные фрагменты антител, как правило, свободны от нежелательных взаимодействий между биологическими молекулами и константной областью тяжелой цепи,либо от другой нежелательной биологической активности. Кроме того, одноцепочечные фрагменты антител значительно меньше, чем целые антитела, и вследствие этого могут обладать большей способностью проникать в капилляры, чем целые антитела, что позволяет одноцепочечным фрагментам антител локализовать и связывать центры связывания целевого антигена более эффективно. Кроме того, можно наладить относительно крупномасштабную продукцию фрагментов антител в прокариотических клетках,что облегчает их производство. Более того, относительно малые размеры одноцепочечных фрагментов антител делает менее вероятным развитие иммунного ответа у реципиента, чем в случае с полноразмерными антителами. Одноцепочечные фрагменты антител можно получать молекулярным клонированием, с помощью библиотек фагового дисплея антител или аналогичных методик, хорошо известных квалифицированным специалистам в данной области. Данные белки можно получать, например, в эукариотических клетках или прокариотических клетках, включая бактерии. Эпитопсвязывающие фрагменты по настоящему изобретению можно также получать, используя различные методы фагового дисплея, известные в данной области. В методах фагового дисплея функциональные домены антитела экспонированы на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие их. В частности,такие фаги можно использовать, чтобы экспонировать эпотопсвязывающие домены, экспрессированные из репертуара или комбинаторной библиотеки антител (например, человека или мыши). Фаг, экспрессирующий эпитопсвязывающий домен, который связывает интересующее антитело, можно выбирать или идентифицировать при помощи антигена, например, используя меченый антиген, связанный или иммобилизованный на твердой поверхности или гранулах. Фаги, используемые в данных методах, обычно представляют собой нитчатые фаги, включая fd и М 13 связывающие домены, экспрессированные из фага с Fab, Fv или стабилизированными при помощи дисульфидных мостиков Fv-доменами антитела, рекомбинантно слитыми либо с фаговым геном III, либо с белком гена VIII. Примеры методов фагового дисплея, которые можно использовать для получения эпитопсвязывающих фрагментов по настоящему изобретению, включают те, что описаны в Brinkman et al., 1995, J.Immunol. Methods, 182: 41-50, Ames et al., 1995, J. Immunol. Methods, 184: 177-186, Kettleborough et al.,1994, Eur. J. Immunol., 24:952-958, Persic et al., 1997, Gene 187: 9-18, Burton et al., 1994, Advances in Immunology, 57: 191-280, PCT заявкеPCT/GB91/01134, PCT публикациях WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/11236, WO 95/15982, WO 95/20401 и патентах США 5698426, 5223409,5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108, полное содержание каждого из которых включено в данное описание посредством ссылок. После выбора фага, области фага, кодирующие фрагменты можно выделять и использовать для получения эпитопсвязывающих фрагментов посредством экспрессии в выбранном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, с применением методики рекомбинантных ДНК, например, как описано подробно ниже. Например, можно также использовать методики для рекомбинантной продукции фрагментов Fab, Fab' и F(ab')2 при помощи способов, известныхal., 1992, BioTechniques, 12(6): 864-869; Sawai et al., 1995, AJRI, 34: 26-34; а также Better et al., 1988, Science, 240: 1041-1043, полное содержание указанных литературных источников включено посредством ссылок. Примеры методик, которые можно использовать для продуцирования одноцепочечных Fv и антител, включают те, что описаны в патентах США 4946778 и 5258498; Huston et al., 1991, Methods inEnzymology 203: 46-88, Shu et al., 1993, Proc. Natl. Acad. Sci. U.S.A., 90: 7995-7999, Skerra et al., 1988, Science, 240: 1038-1040. Функциональные эквиваленты В объем данного изобретения также включены функциональные эквиваленты анти-EphA антитела и гуманизированного антитела против рецептора EphA2. Термин функциональные эквиваленты охватывает антитела с гомологичными последовательностями, химерные антитела, искусственные антитела и модифицированные антитела, например, где каждый функциональный эквивалент охарактеризован по его способности связываться с рецептором EphA2. Квалифицированный специалист в данной области понимает, что группа молекул, называемых фрагменты антитела, и группа, называемая функциональные эквиваленты, перекрываются. Способы получения функциональных эквивалентов известны специалистам в данной области и описаны, например, в РСТ заявке WO 93/21319, европейском патентеЕР 0239400, РСТ заявке WO 89/09622, европейском патентеЕР 0338745 и европейской патентной заявке ЕР 0332424, соответствующее полное содержание которых включено посредством ссылок. Антитела с гомологичными последовательностями представляют собой такие антитела, аминокислотные последовательности которых обладают гомологией последовательностей с аминокислотной последовательностью анти-EphA антитела и гуманизированного анти-EphA антитела по настоящему изобретению. Предпочтительно гомология существует с аминокислотной последовательностью вариабельных областей анти-EphA антитела и гуманизированного анти-EphA антитела по настоящему изобретению. Гомология последовательности, применительно к аминокислотной последовательности в данном описании, определена как последовательность с по меньшей мере примерно 90, 91, 92, 93 или 94% гомологией последовательности, более предпочтительно с по меньшей мере примерно 95, 96, 97, 98 или 99% гомологией последовательности с другой аминокислотной последовательностью, как определено, например, методом поиска FASTA в соответствии с Pearson and Lipman, 1988, Proc. Natl. Acad. Sci. U.S.A.,85: 2444-2448. Химерное антитело представляет собой антитело, в котором различные части антитела происходят из различных видов животных. Например, антитело, обладающее вариабельной областью, происходящей из мышиного моноклонального антитела, в паре с константной областью человеческого иммуноглобулина. Способы получения химерных антител известны в данной области. См., например, Morrison, 1985,Science, 229: 1202, Oi et al., 1986, BioTechniques, 4: 214, Gillies et al., 1989, J. Immunol. Methods, 125: 191202; патенты США 5807715, 4816567 и 4816397, полное содержание которых включено в данное описание посредством ссылок. Гуманизированные формы химерных антител получают, вставляя определяющие комплементарность области, например, мышиного антитела, в человеческий каркасный домен, например, см. РСТ публикацию WO 92/22653. Гуманизированные химерные антитела предпочтительно имеют константные области и вариабельные области за исключением определяющих комплементарность областей (CDR),происходящие, в основном или исключительно, из соответствующих областей антитела человека, и CDR,происходящие, в основном или исключительно, из млекопитающих, отличных от человека. Искусственные антитела включают фрагменты scFv, диатела, триатела, тетратела и mru (см. обзорыWinter, G. and Milstein, С, 1991, Nature, 349: 293-299, Hudson, P.J., 1999, Current Opinion in Immunology,11: 548-557), каждое из которых обладает антигенсвязывающей способностью. В одноцепочечном фрагменте Fv (scFv) домены VH и VL антитела связаны гибким пептидом. Как правило, длина данного линкерного пептида составляет примерно 15 аминокислотных остатков. Если линкер намного короче, например, 5 аминокислот, образуются диатела, которые представляют собой двухвалентные димеры scFv. Если линкер укорочен до менее чем трех аминокислотных остатков, образуются трехмерные и тетрамерные структуры, которые называют триатела и тетратела. Наименьшей связывающей единицей антитела является CDR, как правило, CDR2 тяжелой цепи, который обладает способностью к специфическому распознаванию и связыванию, достаточной, чтобы быть использованным самостоятельно. Такой фрагмент называют "молекулярная распознающая единица" или mru. Несколько подобных mru можно сшивать вместе при помощи коротких линкерных пептидов, образуя, таким образом, искусственный связывающий белок с более высокой авидностью, чем отдельная mru. Функциональные эквиваленты согласно настоящему изобретению также включают модифицированные антитела, например, антитела, модифицированные ковалентным присоединением молекулы любого типа к антителу. Например, модифицированные антитела включают антитела, которые модифицированы, например, гликозилированием, ацетилированием, пегилированием, фосфорилированием, амидированием, дериватизацией известными защитными/блокирующими группами, протеолитическим расще- 13020324 плением, сшиванием с клеточным лигандом или другим белком, и так далее. Ковалентное присоединение не мешает антителу вызывать анти-идиотипический ответ. Такие модификации можно осуществлять известными способами, включая, но не ограничиваясь ими, специфическое химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и так далее. Кроме того, модифицированные антитела могут содержать одну или более неклассических аминокислот. Функциональные эквиваленты можно получать путем взаимного обмена различных CDR на различных цепях в различных каркасах. Так, например, различные классы антител являются возможными для данного набора CDR путем замещения различных тяжелых цепей, посредством чего можно получать, например, IgG1-4, IgM, IgA1-2, IgD, IgE типы и изотипы антител. Аналогично, искусственные антитела в объеме данного изобретения можно получать, вставляя данный набор CDR в полностью синтетический каркас. Функциональные эквиваленты можно легко получать посредством мутаций, делеций и/или вставок в последовательностях вариабельной и/или константной области, которые примыкают к конкретному набору CDR, используя широкое разнообразие способов, известных в данной области. Фрагменты антител и функциональные эквиваленты по настоящему изобретению охватывают молекулы с детектируемой степенью связывания с EphA, при сравнении с антителом 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 или EphA2-N2. Детектируемая степень связывания включает все значения в диапазоне по меньшей мере 10-100%, предпочтительно по меньшей мере 50, 60 или 70%, более предпочтительно по меньшей мере 75, 80, 85, 90, 95 или 99% связывающей способности мышиного антитела 37.3D7,37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2 по отношению к EphA. Усовершенствованные антителаCDR обладают первостепенной важностью для распознавания эпитопа и связывания антитела. Однако можно производить изменения в остатках, которые составляют CDR, без отрицательного влияния на способность антитела распознавать и связывать родственный ему эпитоп. Например, можно осуществлять изменения, которые не влияют на распознавание эпитопа, но увеличивают афинность связывания антитела для эпитопа. Таким образом, в объем настоящего изобретения также включены усовершенствованные варианты как мышиных, так и гуманизированных антител, которые также специфически распознают и связываютEphA, предпочтительно с повышенной афинностью. Во многих исследованиях изучали эффекты от введения одного или более аминокислотных изменений на различных позициях в последовательности антитела, на основании знаний о первичной последовательности антитела, на его свойства, такие как связывание или уровень экспрессии (Yang, W.P. et al.,1995, J. Mol. Biol., 254: 392-403, Rader, C. et al., 1998, Proc. Natl. Acad. Sci. U.S.A., 95: 8910-8915, Vaughan,T. J. et al., 1998, Nature Biotechnology, 16: 535-539). В данных исследованиях получали эквиваленты первичного антитела путем изменения последовательностей генов тяжелой и легкой цепей в CDR1, CDR2, CDR3 или каркасных областях с помощью таких методов, как опосредованный олигонуклеотидами направленный мутагенез, кассетный мутагенез,ошибочно-направленная ПЦР, перетасовка ДНК или штаммы-мутаторы Е. coli (Vaughan, Т.J. et al., 1998,Nature Biotechnology, 16: 535-539, Adey, N.B. et al., 1996, Chapter 16, pp. 277-291, in Phage Display of Peptides and Proteins, Eds. Kay, В.K. et al., Academic Press). Данные способы изменения последовательности первичного антитела привели к повышенным уровням афинности вторичных антител (Gram, H. et al.,1992, Proc. Natl. Acad. Sci. U.S.A., 89: 3576-3580, Boder, E. T. et al., 2000, Proc. Natl. Acad. Sci. U.S.A., 97: 10701-10705, Davies, J. and Riechmann, L., 1996, Immunotechnolgy, 2: 169-179, Thompson, J. et al., 1996, J.Biol. Chem., 276: 27 622-27 628). С помощью аналогичным образом направленной стратегии изменения одного или более аминокислотных остатков антитела, последовательности антител, описанные в данном изобретении, можно использовать для разработки анти-EphA антител с улучшенными функциями, включая более высокую афинность для EphA. Предпочтительными аминокислотными заменами являются такие, которые: (1) уменьшают подверженность протеолизу, (2) уменьшают подверженность окислению, (3) изменяют афинность связывания для образования белковых комплексов и (4) придают или изменяют другие физико-химические или функциональные свойства подобных аналогов. Аналоги могут включать различные мутеины с последовательностью, отличной от природной пептидной последовательности. Например, одну или множество аминокислотных замен (предпочтительно консервативные аминокислотные замены) можно осуществлять в природной последовательности, предпочтительно в области полипептида за пределами домена(ов), образующих межмолекулярные контакты. Консервативные аминокислотные замены не должны существенно изменять структурные характеристики исходной последовательности (например, замена аминокислоты не должна приводить к нарушению спирали, которая имеет место в исходной последовательности, или разрушать другие типы вторичной структуры, которые характеризуют исходную последовательность). Примеры принятых в данной области техники вторичных и третичных структур поли- 14020324 пептидов описаны в Proteins, Structures and Molecular Principles (Creighton, Ed., W.H. Freeman and Company, New York (1984, Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing,New York, N.Y. (1991, и Thornton et al., 1991, Nature, 354: 105, полное содержание всех источников включено в данное описание посредством ссылок. Усовершенствованные антитела также включают такие антитела с улучшенными характеристиками, которые получены с помощью стандартных методик иммунизации животных, создания гибридом и отбора на антитела со специфическими характеристиками. Настоящее изобретение также включает цитотоксические конъюгаты. Данные цитотоксические конъюгаты содержат два первичных компонента, связывающее клетки средство и цитотоксическое средство. Как используется в данном описании, термин связывающее клетки средство означает средство,которое специфически распознает и связывает рецепторы EphA на клеточной поверхности. В одном варианте осуществления связывающее клетки средство специфически распознает рецептор таким образом,что это дает возможность конъюгатам действовать целевым образом с незначительными побочными эффектами, происходящими вследствие неспецифического связывания. В другом варианте осуществления связывающее клетки средство по настоящему изобретению также специфически распознает рецептор EphA таким образом, что конъюгаты будут находиться в контакте с клеткой-мишенью в течение периода времени, достаточного, чтобы дать возможность цитотоксической лекарственной части конъюгата воздействовать на клетку и/или обеспечить достаточно времени для того, чтобы конъюгат был интернализован клеткой. В предпочтительном варианте осуществления цитотоксические конъюгаты содержат анти-EphA антитело в качестве связывающего клетки средства, более предпочтительно мышиное анти-EphA моноклональное антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2. В более предпочтительном варианте осуществления цитотоксические конъюгаты содержат гуманизированное антитело 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 или EphA2-N2 или его эпитопсвязывающий фрагмент. Антитело 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 или EphA2-N2 способно специфически распознавать рецептор EphA, такой какEphA2, и направлять цитотоксическое средство на аномальную клетку или ткань, такую как раковые клетки, целевым образом. Второй компонент цитотоксических конъюгатов по настоящему изобретению представляет собой цитотоксическое средство. Термин цитотоксическое средство, как используется в данном описании,означает вещество, которое снижает или блокирует функцию или рост клеток и/или вызывает разрушение клеток. В предпочтительных вариантах осуществления цитотоксическое средство представляет собой токсоид, мейтанзиноид, такой как DM1 или DM4, низкомолекулярное лекарственное средство, производное томеймицина, производное лептомицина, пролекарство, аналог СС-1065 или СС-1065. В предпочтительных вариантах осуществления связывающие клетки средства по настоящему изобретению являются ковалентно присоединенными, напрямую или через расщепляемый или нерасщепляемый линкер, к цитотоксическому средству. Связывающие клетки средства, цитотоксические средства и линкеры обсуждаются более подробно ниже. Связывающие клетки средства Эффективность соединений по настоящему изобретению как терапевтических средств зависит от тщательного отбора соответствующего связывающего клетки средства. Связывающие клетки средства могут представлять собой любой тип известных в настоящее время средств, или тех, что становятся известными, и включают пептиды и не-пептиды. Связывающее клетки средство может представлять собой любое соединение, которое способно связывать клетку, либо специфическим, либо неспецифическим образом. Как правило, это могут быть антитела (особенно моноклональные антитела), лимфокины, гормоны, факторы роста, витамины, молекулы, переносящие питательные вещества (такие как трансферрин) или любые другие связывающие клетки молекулы или вещества. Более конкретные примеры связывающих клетки средств, которые можно использовать, включают поликлональные антитела, моноклональные антитела, фрагменты антител, такие как Fab, Fab' и F(ab')2,Fv (Parham, 1983, J. Immunol., 131:2895-2902, Spring et al., 1974, J. Immunol., 113: 470-478, Nisonoff et al.,1960, Arch. Biochem. Biophys., 89: 230-244). Предпочтительно гуманизированное анти-EphA антитело используют в качестве связывающего клетки средства по настоящему изобретению. Более предпочтительно гуманизированное анти-EphA антитело выбирают из гуманизированных или поверхностно-модифицированных антител 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 и EphA2-N2. Цитотоксические средства В другом варианте осуществления гуманизированное антитело или его эпитопсвязывающий фрагмент могут быть конъюгированными с лекарственным средством, таким как мейтанзиноид или производное томеймицина, с образованием пролекарства, обладающего специфической цитотоксичностью в отношении зкспрессирующих антиген клеток вследствие нацеливания лекарственного средства на рецептор EphA2. Цитотоксические конъюгаты, содержащие такие антитела и небольшое высокотоксичное лекарственное средство (например, мейтанзиноиды, таксаны, производные томеймицина, производные лептомицина, аналоги СС-1065 и СС-1065), можно использовать в качестве терапевтических средств для лечения опухолей, таких как опухоли молочной железы и яичников. Цитотоксическое средство, используемое в цитотоксическом конъюгате по настоящему изобретению, может представлять собой любое соединение, которое приводит к гибели клетки или индуцирует клеточный лизис или каким-либо образом снижает жизнеспособность клеток. Предпочтительные цитотоксические средства включают, например, мейтанзиноиды и аналоги мейтанзиноидов, пролекарства,производные томеймицина, токсоиды, производные лептомицина, аналоги СС-1065 и СС-1065, охарактеризованные ниже. Данные цитотоксические средства конъюгированы с антителами, фрагментами антител, функциональными эквивалентами, усовершенствованными антителами и их аналогами, как раскрыто в данном описании. Цитотоксические конъюгаты можно получать методами in vitro. Чтобы присоединить лекарственное средство или пролекарство к антителу, используют сшивающую группу. Подходящие сшивающие группы хорошо известны в данной области и включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, расщепляемые пептидазой группы и расщепляемые эстеразой группы. Предпочтительными сшивающими группами являются дисульфидные группы и тиоэфирные группы. Например, конъюгаты можно создавать, используя дисульфидную обменную реакцию,или образуя тиоэфирную связь между антителом и лекарственным средством или пролекарством. Мейтанзиноиды Среди цитотоксических средств, которые можно использовать по настоящему изобретению для получения цитотоксического конъюгата, находятся мейтанзиноиды и аналоги мейтанзиноидов. Примеры соответствующих мейтанзиноидов включают мейтанзинол и аналоги мейтанзинола. Мейтанзиноиды представляют собой лекарственные средства, которые ингибируют образование микротрубочек и которые являются высокотоксичными для клеток млекопитающих. Примеры соответствующих аналогов мейтанзинола включают те, которые имеют модифицированное ароматическое кольцо и которые имеют модификации по другим позициям. Такие соответствующие мейтанзиноиды раскрыты в патентах США 4424219, 4256746, 4294757, 4307016, 4313946, 4315929,4331598, 4361650, 4362663, 4364866, 4450254, 4322348, 4371533, 6333410, 5475092, 5585499 и 5846545. Конкретные примеры соответствующих аналогов мейтанзинола, имеющих модифицированное ароматическое кольцо, включают(1) С-19-дехлоро (патент США 4256746) (полученный восстановлением анзамитоцина Р 2 при помощи LAH),(2) С-20-гидрокси (или С-20-деметил) +/-С-19-дехлоро (патенты США 4361650 и 4307016) (полученный деметилированием при помощи Streptomyces или Actinomyces, либо дехлорированием при помощи LAH), и(3) С-20-деметокси, С-20-ацилокси (-OCOR), +/-дехлоро (патент США 4294757) (полученный ацилированием при помощи ацилхлоридов). Конкретные примеры соответствующих аналогов мейтанзинола, имеющих модификации по другим позициям, включают(1) C-9-SH (патент США 4424219) (полученный в результате реакции мейтанзинола с H2S илиP2S5),(2) С-14-алкоксиметил (деметокси/CH2OR) (патент США 4331598),(3) С-14-гидроксиметил или ацилоксиметил (СН 2 ОН или СН 2 ОАс) (патент США 4450254) (полученный из Nocardia),(4) С-15-гидрокси/ацилокси (патент США 4364866) (полученный конверсией мейтанзинола Streptomyces),(5) С-15-метокси (патенты США 4313946 и 4315929) (выделенные из Trewia nudiflora),(6) С-18-N-деметил (патенты США 4362663 и 4322348) (полученный деметилированием мейтанзинола Streptomyces), и(7) 4,5-дезокси (патент США 4371533) (полученный восстановлением мейтанзинола трихлоридом титана/LAH). В предпочтительном варианте осуществления в цитотоксических конъюгатах по настоящему изобретению используют тиолсодержащий мейтанзиноид (DM1), официально называемый N2'-деацетил-N2'(3-меркапто-1-оксопропил)мейтанзин, в качестве цитотоксического средства. DM1 представлен следующей структурной формулой (I): В другом предпочтительном варианте осуществления в цитотоксических конъюгатах по настоящему изобретению используют тиолсодержащий мейтанзиноид N2'-деацетил-N2'-(4-метил-4-меркапто-1 оксопентил)мейтанзин в качестве цитотоксического средства. DM4 представлен следующей структурной формулой (II): В дополнительных вариантах осуществления изобретения можно использовать другие мейтанзины,включая тиол- и дисульфидсодержащие мейтанзиноиды, имеющие моно- или диалкильное замещение по атому углерода, несущему атом серы. Сюда входит мейтанзиноид, имеющий на С-3, С-14 гидроксиметил, С-15 гидрокси или С-20 дезметил, ацилированную аминокислотную боковую цепь с ацильной группой, несущей экранированную сульфгидрильную группу, где атом углерода ацильной группы, несущей тиоловую функциональную группу, имеет один или два заместителя, где указанные заместители представляют собой СН 3, С 2 Н 5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и где дополнительно один из заместителей может представлять собой Н, и где ацильная группа имеет длину линейной цепи по меньшей мере три атома углерода между карбонильной функциональной группой и атомом серы. Такие дополнительные мейтанзины включают соединения, представленные формулой (III)R1 и R2 каждый независимо представляют собой СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,А, В, D представляют собой циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода,простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал,R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 каждый независимо представляют собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m, n, о, р, q, r, s и t каждый независимо равен 0 или целому числу от 1 до 5, при условии, что по меньшей мере два из l, m, n, о, р, q, r, s и t не равны нулю одновременно, иZ представляет собой Н, SR или -COR, где R представляет собой линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, либо простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал. Предпочтительные варианты осуществления формулы (III) включают соединения формулы (III), гдеR1 и R2 представляют собой метил, и Z представляет собой -SCH3. Такие дополнительные мейтанзины также включают соединения, представленные формулами (IVL), (IV-D) или (IV-D,L)R1 и R2 каждый независимо представляют собой СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,R3, R4, R5, R6, R7 и R8 каждый независимо представляют собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил,содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m и n каждый независимо равен целому числу от 1 до 5, и дополнительно n может быть равен 0,Z представляет собой Н, SR или -COR, где R представляет собой линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, либо простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал, иMay представляет собой мейтанзиноид, который несет боковую цепь на С-3, С-14 гидроксиметиле,С-15 гидрокси или С-20 дезметиле. Предпочтительные варианты осуществления формул (IV-L), (IV-D) и (IV-D,L) включают соединения формул (IV-L), (IV-D) и (IV-D,L), гдеR1 представляет собой метил, R2 представляет собой Н, R5, R6, R7 и R8 каждый представляет собой Н, 1 и m каждый равен 1, n равен 0, и Z представляет собой Н.R1 и R2 представляют собой метил, R5, R6, R7, R8 каждый представляет собой Н, l и m равны 1, n равен 0, и Z представляет собой Н.R1 представляет собой метил, R2 представляет собой Н, R5, R6, R7 и R8 каждый представляет собой Н, l и m каждый равен 1, n равен 0, и Z представляет собой -SCH3.R1 и R2 представляют собой метил, R5, R6, R7, R8 каждый представляет собой Н, l и m равны l, n равен 0, и Z представляет собой - SCH3. Предпочтительно цитотоксическое средство представлено формулой (IV-L). Такие дополнительные мейтанзины также включают соединения, представленные формулой (V)R1 и R2 каждый независимо представляют собой СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,R3, R4, R5, R6, R7 и R8 каждый независимо представляют собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил,содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m и n каждый независимо равен целому числу от 1 до 5, и дополнительно n может быть равен 0,Z представляет собой Н, SR или -COR, где R представляет собой линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, либо простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал. Предпочтительные варианты осуществления формулы (V) включают соединения формулы (V), гдеR1 представляет собой метил, R2 представляет собой Н, R5, R6, R7 и R8 каждый представляет собой Н, l и m каждый равен l, n равен 0, и Z представляет собой Н.R1 и R2 представляют собой метил, R5, R6, R7, R8 каждый представляет собой Н, l и m равны l, n равен 0, и Z представляет собой Н.R1 представляет собой метил, R2 представляет собой Н, R5, R6, R7 и R8 каждый представляет собой Н, l и m каждый равен l, n равен 0, и Z представляет собой -SCH3.R1 и R2 представляют собой метил, R5, R6, R7, R8 каждый представляет собой Н, l и m равны l, n равен 0, и Z представляет собой - SCH3. Такие дополнительные мейтанзины добавочно включают соединения, представленные формуламиR1 и R2 каждый независимо представляют собой СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,R3, R4, R5, R6, R7 и R8 каждый независимо представляет собой Н, СН 3, С 2 Н 5, линейный или циклический алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m и n каждый независимо равен целому числу от 1 до 5, и дополнительно n может быть равен 0,Z2 представляет собой SR или COR, где R представляет собой линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, либо простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал, иMay представляет собой мейтанзиноид. Такие дополнительные мейтанзины также включают соединения, представленные формулой (VII)R1 и R2 каждый независимо представляет собой СН 3, С 2 Н 5, линейный или разветвленный алкил или алкенил, содержащий от 1 до 10 атомов углерода, циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,А, В и D каждый независимо представляет собой циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматический или гетероциклоалкильный радикал,R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 каждый независимо представляет собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m, n, о, р, q, r, s и t каждый независимо равен 0 или целому числу от 1 до 5, при условии, что по меньшей мере два из l, m, n, о, р, q, r, s и t не равны 0 одновременно, иZ2 представляет собой SR или -COR, где R представляет собой линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, либо простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал. Предпочтительные варианты осуществления формулы (VII) включают соединения формулы (VII),где R1 представляет собой метил, R2 представляет собой Н. Вышеуказанные мейтанзиноиды можно конъюгировать с анти-EphA антителом 37.3D7, 37.1F5,53.2 Н 11, EphA2-N1 или EphA2-N2, либо его гомологом или фрагментом, где антитело сшито с мейтанзиноидом при помощи тиоловой или дисульфидной функциональной группы, которая находится на ацильной группе ацилированной аминокислотной боковой цепи, находящейся на С-3, С-14 гидроксиметиле, С-15 гидрокси или С-20 дезметиле мейтанзиноида, и где у ацильной группы ацилированной аминокислотной боковой цепи тиоловая или дисульфидная функциональная группа расположена на атоме углерода, который имеет один или два заместителя, где указанные заместители представляют собой СН 3,С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и, дополнительно, один из заместителей может представлять собой Н, и где ацильная группа имеет длину линейной цепи по меньшей мере три атома углерода между карбонильной функциональной группой и атомом серы. Предпочтительный конъюгат по настоящему изобретению представляет собой конъюгат, который содержит анти-EphA антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, либо его гомолог или фрагмент, конъюгированный с мейтанзиноидом формулы (VIII)(CR7R8)l(CR9=CR10)p(CC)qAr(CR5R6)mDu(CR11=CR12)r(CC)sBt(CR3R4)nCR1R2S-, где А, В и D каждый независимо представляет собой циклоалкил или циклоалкенил, содержащий 3-10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматический или гетероциклоалкильный радикал,R3, R4, R5, R6, R7, R8, R9, R10, R11 и R12 каждый независимо представляет собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, иl, m, n, о, р, q, r, s и t каждый независимо равен 0 или целому числу от 1 до 5, при условии, что по меньшей мере два из l, m, n, о, р, q, r, s и t не равны нулю одновременно. Предпочтительно R1 представляет собой метил, R2 представляет собой Н или R1 и R2 представляют собой метил. Еще более предпочтительный конъюгат по настоящему изобретению представляет собой конъюгат,который содержит анти-EphA антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, либо его гомолог или фрагмент, конъюгированный с мейтанзиноидом формул (IX-L), (IX-D) или (IX-D,L)R1 и R2 каждый независимо представляет собой СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал, и дополнительно R2 может представлять собой Н,R3, R4, R5, R6, R7 и R8 каждый независимо представляет собой Н, СН 3, С 2 Н 5, линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил,содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил или гетероциклический ароматический или гетероциклоалкильный радикал,l, m и n каждый независимо равен целому числу от 1 до 5, и дополнительно n может быть равен 0, иMay представляет собой мейтанзинол, который несет боковую цепь на С-3, С-14 гидроксиметиле,С-15 гидрокси или С-20 дезметиле. Предпочтительные варианты осуществления формул (IX-L), (IX-D) и (IX-D,L) включают соединения формул (IX-L), (IX-D) и (IX-D,L), гдеR1 представляет собой метил, R2 представляет собой Н, или R1 и R2 представляют собой метил,R1 представляет собой метил, R2 представляет собой Н, R5, R6, R7 и R8 каждый представляет собой Н, l и m каждый равен 1, n равен 0,R1 и R2 представляют собой метил, R5, R6, R7 и R8 каждый представляет собой Н, l и m равны 1, n равен 0. Предпочтительно цитотоксическое средство представлено формулой (IX-L). Дополнительный предпочтительный конъюгат по настоящему изобретению представляет собой конъюгат, который содержит анти-EphA антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2,либо его гомолог или фрагмент, конъюгированный с мейтанзиноидом формулы (X) где заместители такие, как определены для вышеприведенной формулы (IX). Особенно предпочтительными являются любые из вышеописанных соединений, где R1 представляет собой Н, R2 представляет собой метил, R5, R6, R7 и R8 каждый представляет собой Н, l и m каждый равен 1, и n равен 0. Дополнительно особенно предпочтительными являются любые из вышеописанных соединений, гдеR1 и R2 представляют собой метил, R5, R6, R7, R8 каждый представляет собой Н, l и m равны 1, и n равен 0. Дополнительно предпочтительным является стереоизомер L-аминоацил. Каждый из мейтанзиноидов, о котором сообщается в находящейся на рассмотрении патентной заявке США 10/849136, зарегистрированной 20 мая 2004 г., можно также использовать в цитотоксическом конъюгате по настоящему изобретению. Полное содержание патентной заявки США 10/849136 включено в данное описание посредством ссылки. Дисульфидсодержащие сшивающие группы Для присоединения мейтанзиноида к связывающему клетки средству, такому как антитело 37.3D7,37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, в состав мейтанзиноида входит сшивающий фрагмент. Сшивающий фрагмент содержит химическую связь, которая позволяет высвобождать полностью активные мейтанзиноиды в определенном участке. Соответствующие химические связи хорошо известны в данной области и включают дисульфидные связи, кислотолабильные связи, фотолабильные связи, расщепляемые пептидазой связи и расщепляемые эстеразой связи. Предпочтительными являются дисульфидные связи. В состав сшивающего фрагмента также входит реакционно-способная химическая группа. В предпочтительном варианте осуществления реакционно-способная химическая группа может быть ковалентно присоединена к мейтанзиноиду посредством сшивающего фрагмента с дисульфидной связью. Особенно предпочтительными реакционно-способными химическими группами являются Nсукцинимидильные сложные эфиры и N-сульфосукцинимидильные сложные эфиры. Особенно предпочтительными мейтанзиноидами, в состав которых входит сшивающий фрагмент,содержащий реакционно-способную химическую группу, являются сложные С-3 эфиры мейтанзинола и его аналоги, где сшивающий фрагмент содержит дисульфидную связь, а в состав реакционно-способной химической группы входит N-сукцинимидильный или N-сульфосукцинимидильный сложный эфир. Многие позиции на мейтанзиноидах могут служить в качестве позиции для химического присоединения сшивающего фрагмента. Например, позиция С-3 с гидроксильной группой, позиция С-14, модифицированная гидроксиметилом, позиция С-15, модифицированная гидрокси-, и позиция С-20 с гидроксигруппой, предположительно, все являются пригодными. Однако позиция С-3 является предпочтительной, и позиция С-3 мейтанзинола является особенно предпочтительной. В то время как синтез сложных эфиров мейтанзинола, содержащих сшивающий фрагмент, описан в отношении сшивающих фрагментов с дисульфидными связями, любому специалисту в данной области будет понятно, что сшивающие фрагменты с другими химическими связями (как описано выше) можно также использовать по настоящему изобретению, так же как и другие мейтанзиноиды. Конкретные примеры других химических связей включают кислотолабильные связи, фотолабильные связи, расщепляемые пептидазой связи и расщепляемые эстеразой связи. В раскрытии патента США 5208020, включенного в данное описание, сообщается о получении мейтанзиноидов, содержащих такие связи. Синтез мейтанзиноидов и производных мейтанзиноидов с дисульфидным фрагментом, содержащим реакционно-способную группу, описан в патентах США 6441163 и 6333410, а также в патентной заявке США 10/161651, все они включены в данное описание посредством ссылок. Содержащие реакционно-способные группы мейтанзиноиды, такие как DM1, реагируют с антителом, таким как антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, образуя цитотоксические конъюгаты. Данные конъюгаты можно очищать с помощью ВЭЖХ или гель-фильтрации. Несколько наулучших схем производства таких конъюгатов антитело-мейтанзиноид приведены в патенте США 6333410 и патентных заявках США 09/867598, 10/161651 и 10/024290, полное содержание их всех включено в данное описание посредством ссылок. Как правило, раствор антитела в водном буфере можно инкубировать с молярным избытком мейтанзиноидов с дисульфидным фрагментом, содержащим реакционно-способную группу. Реакционную смесь можно гасить добавлением избытка аминов (таких как этаноламин, таурин и так далее). Конъюгат мейтанзиноид-антитело затем можно очищать гель-фильтрацией. Количество молекул мейтанзиноида, связанных с молекулой антитела, можно определять спектрофотометрическим измерением отношения поглощений при 252 и 280 нм. Предпочтительным является среднее значение 1-10 молекул мейтанзиноида/молекулу антитела. Конъюгаты антител с мейтанзиноидными лекарственными средствами можно оценивать по их способности подавлять пролиферацию различных нежелательных клеточных линий in vitro. Например, такие клеточные линии, как линия А-431 человеческого плоскоклеточного рака, линия SW2 человеческого мелкоклеточного рака легких, линия SKBR3 рака молочной железы человека и линия Namalwa лимфомы Беркитта, легко могут быть использованы для оценки цитотоксичности этих соединений. Оцениваемые клетки можно подвергать действию данных соединений в течение 24 ч, и выжившие фракции клеток измерять в прямых анализах известными способами. Затем по результатам анализов могут быть рассчитаны значения IC50. ПЭГ-содержащие сшивающие группы Мейтанзиноиды можно также сшивать со средствами, связывающими клетки, с помощью ПЭГсодержащих сшивающих групп, как указано в патентной заявке США 10/024290. Эти ПЭГсодержащие сшивающие группы растворимы как в воде, так и в неводных растворителях и могут быть использованы для присоединения одного или большего количества цитотоксических средств к связывающему клетки средству. Иллюстративные примеры ПЭГ-содержащих сшивающих групп включают гетеробифункциональные ПЭГ-линкеры, которые соединяют цитотоксические средства и связывающие клетки средства по противоположным концам линкеров через функциональную сульфгидрильную или дисульфидную группу на одном конце и активный сложный эфир на другом конце. В качестве основного примера синтеза цитотоксического конъюгата с использованием ПЭГсодержащей сшивающей группы можно опять сослаться на патентную заявку США 10/024290 для конкретизации деталей. Синтез начинается с реакции одного или более цитотоксических средств, имеющих в составе реакционно-способный фрагмент ПЭГ, со средством, связывающим клетки, что приводит к замещению концевого активного сложного эфира каждого реакционно-способного фрагмента на аминокислотный остаток средства, связывающего клетки, такого как антитело 37.3D7, 37.1F5, 53.2 Н 11,EphA2-N1 или EphA2-N2, приводя в результате к образованию цитотоксического конъюгата, содержащего одно или более цитотоксических средств, ковалентно связанных со средством, связывающим клетки,- 22020324 через ПЭГ-содержащую сшивающую группу. Таксаны Цитотоксическим средством, используемым в цитотоксических конъюгатах по настоящему изобретению, может также являться таксан или его производные. Таксаны представляют собой класс соединений, который включает паклитаксел (таксол), цитотоксический природный продукт, и доцетаксел (таксотер), полусинтетическое производное, два соединения,которые широко применяются в лечении раковых заболеваний. Таксаны являются ядами митотического веретена, которые ингибируют деполимеризацию тубулина, что приводит к гибели клетки. Несмотря на то что доцетаксел и паклитаксел являются полезными средствами для лечения рака, их противоопухолевая активность ограничена из-за их неспецифической токсичности для нормальных клеток. Кроме того,соединения типа паклитаксела и доцетаксела сами по себе недостаточно эффективны для применения в конъюгатах средств, связывающих клетки. Предпочтительным таксаном, используемым для получения цитотоксических конъюгатов, является таксан формулы (XI) Способы синтеза таксанов, которые можно применять в цитотоксических конъюгатах по настоящему изобретению, наряду со способами конъюгирования таксанов со средством, связывающим клетки,таким как антитело 37.3D7, 37.1F5, 53.2 Н 11, EphA2-N1 или EphA2-N2, подробно описаны в патентах США 5416064, 5475092, 6340701, 6372738 и 6436931, а также в патентных заявках США 10/024290,10/144042, 10/207814, 10/210112 и 10/369563. Производные томеймицина Цитотоксические средства по настоящему изобретению могут также являться производными томеймицина. Производные томеймицина представляют собой пирроло[1,4]бензодиазепины (PBDs), известный класс соединений, проявляющих свои биологические свойства путем ковалентного связывания сN2 гуанина в малой бороздке молекулы ДНК. PBDs включают целый ряд связывающих малую бороздку соединений, таких как антрамицин, неотрамицин и DC-81. Новые производные томеймицина, которые сохраняют высокую цитотоксичность и могут быть эффективно присоединены к связывающим клетки средствам, описаны в международной заявкеPCT/IB2007/000142, содержание которой включено в данное описание в качестве ссылки. Комплексы связывающее клетки средство-производное томеймицина позволяют в полной мере использовать цитотоксическое действие производных томеймицина целенаправленно только против нежелательных клеток, тем самым избегая побочных эффектов из-за повреждения нецелевых здоровых клеток. Цитотоксическое средство по настоящему изобретению включает одно или более производных томеймицина, сшитых со связывающим клетки средством, таким как антитело 37.3D7, 37.1F5, 53.2 Н 11,EphA2-N1 или EphA2-N2, через сшивающую группу. Сшивающая группа является частью химического фрагмента, который ковалентно связан с производным томеймицина обычными способами. В предпочтительном варианте осуществления химический фрагмент может быть ковалентно связан с производным томеймицина через дисульфидную связь. Производные томеймицина, применяемые по настоящему изобретению, имеют формулу (XII),представленную ниже представляет собой необязательную одинарную связь,представляет собой либо одинарную, либо двойную связь,при условии, что когда представляет собой одинарную связь, U и U', одинаковые или различные, независимо представляют собой Н, a W и W', одинаковые или различные, независимо выбирают из группы, состоящей из ОН, простого эфира, такого как -OR, сложного эфира (например, ацетата), такого как -OCOR, карбоната, такого как -OCOOR, карбамата, такого как -OCONRR', циклокарбамата, в котором N10 и С 11 являются частью цикла, мочевины, такой как -NRCONRR', тиокарбамата, такого как - 23020324-NRCOR, азида, такого как -N3, циано, галогена, триалкила или триарилфосфония, группы аминокислотного происхождения; предпочтительно W и W' являются одинаковыми или различными и представляют собой ОН, Ome, Oet, NHCONH2, SMe; и когда представляет собой двойную связь, U и U' отсутствуют, a W и W' представляют собой Н;R1, R2, R1', R2' являются одинаковыми или различными и независимо выбраны из галида или алкила, необязательно замещенного одним или более Hal, CN, NRR', CF3, OR, арилом, Het, S(O)qR, или R1 иR2, а также R1' и R2' образуют вместе двойную связь, содержащую группу =В и =В', соответственно. Предпочтительно R1 и R2, а также R1' и R2' образуют вместе двойную связь, содержащую группу=В и =В', соответственно. В и В' являются одинаковыми или различными и независимо выбраны из алкенила, необязательно замещенного одним или более Hal, CN, NRR', CF3, OR, арилом, Het, S(O)qR, либо В и В' представляют собой атом кислорода. Предпочтительно В=В'. Более предпочтительно В=В'= =СН 2 или =СН-СН 3, - X, X' являются одинаковыми или различными и независимо выбраны из одного или более -O-, -NR-, -(С=O)-, -S(O)q-. Предпочтительно Х=Х'. Более предпочтительно Х=Х'=О.A, А' являются одинаковыми или различными и независимо выбраны из алкила или алкенила, необязательно содержащего атом кислорода, азота или серы, каждый из которых необязательно замещен одним или более Hal, CN, NRR', CF3, OR, S(O)qR, арилом, Het, алкилом, алкенилом. Предпочтительно А=А'. Более предпочтительно А=А'=линейный незамещенный алкил.Y, Y' являются одинаковыми или различными и независимо выбраны из Н, OR. Предпочтительно Y=Y'. Более предпочтительно Y=Y'=Оалкил, более предпочтительно Ометил. Т является -NR-, -O-, -S(O)q-, или 4-10-членным арилом, циклоалкилом, гетероциклом или гетероарилом, каждый необязательно замещен одним или более Hal, CN, NRR', CF3, R, OR, S(O)qR, и/или линкером(ами), или разветвленным алкилом, необязательно замещенным одним или более Hal, CN, NRR', CF3,OR, S(O)qR и/или линкером(ами), или линейным алкилом, замещенным одним или более Hal, CN, NRR',CF3, OR, S(O)qR и/или линкером(ами). Предпочтительно Т является 4-10-членным арилом или гетероарилом, более предпочтительно фенилом или пиридилом, необязательно замещенными одним или более линкером(ами). Указанный линкер содержит сшивающую группу. Подходящие сшивающие группы хорошо известны в данной области и включают тиоловые, сульфидные, дисульфидные группы, тиоэфирные группы,кислотолабильные группы, фотолабильные группы, расщепляемые пептидазой группы и расщепляемые эстеразой группы. Предпочтительными являются дисульфидные группы и тиоэфирные группы. Когда сшивающая группа представляет собой тиол-, сульфид (или так называемый тиоэфир -S-)или дисульфид (-S-S-)-содержащую группу, боковая цепь, содержащая тиоловую, сульфидную или дисульфидную группу, может быть линейной или разветвленной, ароматической или гетероциклической. Специалист в данной области легко определит подходящие боковые цепи. Предпочтительно указанный линкер имеет формулу -G-D-(Z)p-S-Z', гдеG представляет собой одинарную или двойную связь, -O-, -S-или -NR-;D представляет собой одинарную связь или -Е-, -E-NR-, -Е-NR-F-, -Е-O-, -E-O-F-, -E-NR-CO-, -ENR-CO-F-, -Е-СО-, -СО-Е-, -E-CO-F, -E-S-, -E-S-F-, -E-NR-C-S-, -E-NR-CS-F-; где Е и F являются одинаковыми или различными и независимо выбраны из линейных или разветвленных-(ОСН 2 СН 2)i-алкил(ОСН 2 СН 2)j-,-алкил(ОСН 2 СН 2)i-алкил-,-(ОСН 2 СН 2)i-,(ОСН 2 СН 2)iциклоалкил(ОСН 2 СН 2)j-,-(ОСН 2 СН 2)i-гетероцикл(ОСН 2 СН 2)j-,(ОСН 2 СН 2)i-арил(ОСН 2 СН 2)j-,-(ОСН 2 СН 2)i-гетероарил(ОСН 2 СН 2)j-, -алкил-(ОСН 2 СН 2)i-алкил(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)i-, алкил(ОСН 2 СН 2)i-циклоалкил(ОСН 2 СН 2)j-, алкил(ОСН 2 СН 2)i-гетероцикл(ОСН 2 СН 2)j-, -алкил(ОСН 2 СН 2)iарил(OCH2CH2)j-, -алкил(ОСН 2 СН 2)i-гетероарил(ОСН 2 СН 2)j-, циклоалкил-алкил-, -алкил-циклоалкил-,-гетероцикл-алкил-, -алкил-гетероцикл-, -алкил-арил-, -арил-алкил-, -алкил-гетероарил-, гетероарил-алкил-; где i и j, одинаковые или различные, являются целыми числами и независимо выбраны из 0, 1 до 2000;Z представляет собой линейный или разветвленный -алкил-; р равен 0 или 1; цикл, при условии, что если Z' представляет собой Н, указанное соединение находится в равновесии с соответствующим соединением, образованным внутримолекулярной циклизацией, полученной в результате добавления тиоловой группы -SH к иминной связи -NH= одного из фрагментов PBD;R, R' являются одинаковыми или различными и независимо выбраны из Н, алкила, арила, каждый из которых необязательно замещен Hal, CN, NRR', CF3, R, OR, S(O)qR, арилом, Het; или его фармацевтически приемлемые соли, гидраты или гидратированные соли, или полиморфные кристаллические структуры этих соединений, или его оптические изомеры, рацематы, диастереоизомеры или энантиомеры. Соединения общей формулы (XII), имеющие геометрические и стереоизомеры, также являются частью данного изобретения. Известно, что двойная связь между N-10 и С-11 у производных томеймицина формулы (XII) легко превращается обратимым образом в соответствующие иминные аддукты в присутствии воды, спирта,тиола, первичного или вторичного амина, мочевины и других нуклеофилов. Этот процесс является обратимым и соответствующие производные томеймицина могут быть легко регенерированы в присутствии дегидратирующего средства, в непротонированных органических растворителях, в вакууме или при высоких температурах (Z. Tozuka, 1983, J. Antibiotics, 36: 276). Таким образом, обратимые производные томеймицина общей формулы (XIII) также можно применять согласно настоящему изобретениюW' являются одинаковыми или различными и представляют собой ОН, Ome, Oet, NHCONH2, SMe. Соединения формулы (XIII) могут, таким образом, считаться сольватами, включающими воду, если растворителем является вода, эти сольваты могут быть особенно полезны. В предпочтительном варианте осуществления производные томеймицина по изобретению выбирают из группы, включающей 8,8'-[1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Нпирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[5-метокси-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[1,5-пентандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[1,4-бутандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[3-метил-1,5-пентандиилбис(окси)]бис[(S)-2-эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Нпирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[2,6-пиридиндиилбис(окси)]бис[(S)-2-эт(E)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[4-(3-трет-бутоксикарбониламинопропилокси)-2,6-пиридиндиилбис(метиленокси)]бис[(S)-2 эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[5-(3-аминопропилокси)-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-эт(Е)илиден-7-метокси 1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[5-(N-метил-3-трет-бутоксикарбониламинопропил)-1,3-бензолдиилбис(метиленокси)]бис[(S)-2 эт(Е)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-5-[3-(4-метил-4-метилдисульфанилпентаноиламино)пропилокси]-1,3-бензолдиилбис(метиленокси)бис[(S)-2-эт(E)илиден-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[5-ацетилтиометил-1,3-бензолдиилбис(метиленокси)]бис[(S)-2-метилен-7-метокси-1,2,3,11 атетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; трет-бутиловый эфир бис 2-[(S)-2-метилен-7-метокси-5-оксо-1,3,11 а-тетрагидро-5 Н-пирроло[2,1 е][1,4]бензодиазепин-8-илокси]этилкарбаминовой кислоты; 8,8'-[3-(2-ацетилтиоэтил)-1,5-пентандиилбис(окси)]бис[(S)-2-метилен-7-метокси-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[5-(N-4-меркапто-4,4-диметилбутаноил)амино-1,3-бензолдиилбис(метиленокси)]бис[7-метокси 2-метилен-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[5-(N-4-метилдитио-4,4-диметилбутаноил)амино-1,3-бензолдиилбис(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[5-(N-метил-N-(2-меркапто-2,2-диметилэтил)амино-1,3-бензолдиил(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[5-(N-метил-N-(2-метилдитио-2,2-диметилэтил)амино-1,3-бензолдиил(метиленокси)]бис[7-метокси-2-метилен-1,2,3,11 а-тетрагидро-5 Н-пирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(4-(2-(4-меркапто-4-метил)пентанамидоэтокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(1-(2-(4-метил-4-метилдисульфанил)пентанамидоэтокси)бензол-3,5-диметил)диокси]бис[(S)-2 эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(4-(3-(4-метил-4-метилдисульфанил)пентанамидопропокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(4-(4-(4-метил-4-метилдисульфанил)пентанамидобутокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(4-(3-[4-(4-метил-4-метилдисульфанилпентаноил)пиперазин-1-ил]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5 он]; 8,8'-[(1-(3-[4-(4-метил-4-метилдисульфанилпентаноил)пиперазин-1-ил]пропил)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5 он]; 8,8'-[(4-(2-2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этоксиэтокси)пиридин-2,6 диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(1-(2-2-[2-(2-2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этоксиэтокси)этокси]этоксиэтокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[(1-(2-2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этоксиэтокси)бензол-3,5 диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-c][1,4]бензодиазепин-5-он]; 8,8'-[(4-(2-2-[2-(2-2-[2-(4-метил-4-метилдисульфанилпентаноиламино)этокси]этоксиэтокси)этокси]этоксиэтокси)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(E)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[(1-(2-[метил(2-метил-2-метилдисульфанилпропил)амино]этокси)бензол-3,5-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[(4-(3-[метил(4-метил-4-метилдисульфанилпентаноил)амино]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[(4-(3-[метил(2-метил-2-метилдисульфанилпропил)амино]пропил)пиридин-2,6-диметил)диокси]бис[(S)-2-эт(Е)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он]; 8,8'-[(1-(4-метил-4-метилдисульфанил)пентанамидо)бензол-3,5-диметил)диокси]бис[(S)-2-эт(E)илиден-7-диметокси-1,2,3,11 а-тетрагидропирроло[2,1-с][1,4]бензодиазепин-5-он],а также соответствующие меркапто-производные, либо их фармацевтически приемлемые соли, гидраты, или гидратированные соли, либо полиморфные кристаллические структуры этих соединений, либо их оптические изомеры, рацематы, диастереоизомеры или энантиомеры. Предпочтительными соединениями являются соединения формулы где X, X', A, A', Y, Y', Т, n, n' определены, как указано выше. Соединения формулы (XII) могут быть получены множеством способов, хорошо известных специалистам в данной области. Соединения можно синтезировать, например, путем приложения или адаптации способов, описанных ниже, или их вариациями, как признают квалифицированные специалисты. Соответствующие модификации или замены совершенно очевидны и хорошо известны, либо легко могут быть получены из научной литературы специалистами в данной области. В частности, такие способы можно найти в R.C. Larock, Comprehensive Organic Transformations, Wiley-VCH Publishers, 1999. Способы синтеза производных томеймицина, которые могут быть использованы согласно настоящему изобретению, описаны в международной заявкеPCT/IB2007/000142. Соединения по настоящему изобретению можно получать различными путями синтеза. Реагенты и исходные материалы являются коммерчески доступными, либо легко синтезируемыми с помощью методов, хорошо известных специалистам в данной области (см., например, WO 00/12508, WO 00/12507, WO 2005/040170, WO 2005/085260,FR1516743, M. Mori et al., 1986, Tetrahedron, 42: 3793-3806). Молекулы-конъюгаты по данному изобретению можно получать с помощью любой методики. Производные томеймицина по изобретению могут быть сшиты с антителом или другим связывающим клетки средством через кислотолабильный линкер, либо с помощью фотолабильного линкера. Производные можно конденсировать с пептидом, имеющим подходящую последовательность, а затем сшивать со связывающим клетки средством для получения линкера, расщепляемого пептидазой. Можно получать конъюгаты, содержащие первичную гидроксильную группу, которая может быть сукцинилирована и сшита со связывающим клетки средством для получения конъюгата, который может быть расщеплен внутриклеточными эстеразами для высвобождения свободных производных. Предпочтительно производные синтезируют содержащими свободные или защищенные тиоловые группы, а затем одно или более дисульфидных или тиолсодержащих производных каждое ковалентно сшивают со связывающим клетки средством через дисульфидную связь или тиоэфирный мостик. Многочисленные способы конъюгации изложены в USP 5416064 и 5475092. Производные томеймицина можно модифицировать так, чтобы получить свободную аминогруппу, и затем сшить с антителом или другим связывающим клетки средством через кислотолабильный линкер, либо фотолабильный линкер. Производные томеймицина со свободной амино- или карбоксильной группой можно конденсировать с пептидом, а затем сшивать со связывающим клетки средством для получения линкера, расщепляемого пептидазой. Производные томеймицина со свободной гидроксильной группой в составе линкера можно сукцинилировать и сшивать со связывающим клетки средством для получения конъюгата, который может быть расщеплен внутриклеточными эстеразами для высвобождения свободного лекарственного средства. Наиболее предпочтительно производные томеймицина обрабатывают так, чтобы создать свободные или защищенные тиоловые группы, а затем дисульфидные или тиолсодержащие димеры томеймицина сшивают со связывающим клетки средством через дисульфидные связи. Предпочтительно конъюгатами моноклональное антитело- или связывающее клетки средствопроизводное томеймицина являются те, которые соединены через дисульфидную связь, как обсуждалось выше, которые способны обеспечить доставку производных томеймицина. Такие связывающие клетки конъюгаты получают известными способами, такими как модификация моноклональных антител сукцинимидилпиридилдитиопропионатом (SPDP) (Carlsson et al., 1978, Biochem. J., 173: 723-737). Полученную в результате тиопиридиловую группу затем замещают обработкой тиолсодержащими производными томеймицина для получения конъюгатов, сшитых через дисульфид. Альтернативно, в случае арилдитиопроизводных томеймицина, образование связывающего клетки конъюгата осуществляется прямым замещением арил-тиола производного томеймицина сульфгидрильными группами, заранее встроенными в молекулы антитела. Конъюгаты, содержащие от 1 до 10 молекул лекарственного средства из производных томеймицина, сшитых через дисульфидный мостик, легко получать любым из способов. Конкретнее, раствор модифицированного дитионитропиридилом антитела в концентрации 2,5 мг/мл в 0,05 М калий-фосфатном буфере, при рН 7,5, содержащем 2 мМ EDTA, обрабатывают тиолсодержащим производным томеймицина (1,3 молярных экв./дитиопиридиловую группу). Высвобождение тионитропиридина из модифицированного антитела контролируется спектрофотометрически при 325 нм и завершается приблизительно через 16 ч. Конъюгат антитело-производное томеймицина очищают и освобождают от непрореагировавшего лекарственного средства и другого низкомолекулярного материала гель-фильтрацией на колонке с Sephadex G-25 или Sephacryl S300. Количество связанных фрагментов производного томеймицина на молекулу антитела можно определять измерением отношения поглощений при 230 и 275 нм. В среднем таким способом может быть пришито через дисульфидные связи 1-10 молекул производного томеймицина/молекулу антитела. Эффект конъюгации на аффинность связывания в отношении клеток, экспрессирующих антиген,- 27020324 можно определять способами, ранее описанными Liu et al., 1996, Proc. Natl. Acad. Sci. U.S.A., 93: 86188623. Цитотоксичность для клеточных линий производных томеймицина и их конъюгатов с антителом можно измерять путем обратной экстраполяции кривых клеточной пролиферации, как описано в Goldmacher et al., 1985, J. Immunol., 135: 3648-3651. Цитотоксичность этих соединений для адгезивных клеточных линий можно определять клоногенными анализами, как описано в Goldmacher et al., 1986, J. CellBiol., 102: 1312-1319. Производные лептомицина Согласно настоящему изобретению цитотоксическим может также являться производное лептомицина. Согласно настоящему изобретению производные лептомицина относятся к членам лептомицинового семейства, как определено у Kalesse et al. (2002, Synthesis 8: 981-1003), и включают: лептомицины,такие как лептомицин А и лептомицин В, каллистатины, ратжадоны, такие как ратжадон А и ратжадон В,ангвиномицины, такие как ангвиномицин А, В, С, D, казусамицины, лептолстатины, лептофуранины,такие как лептофуранин А, В, С, D. Производные лептомицина А и В являются предпочтительными. Конкретнее, производные по данному изобретению представлены формулой (I) где Ra и Ra' представляют собой Н или -алк; предпочтительно Ra представляет собой -алк, предпочтительно метил, и Ra' представляет собой Н,R17 представляет собой алкил, необязательно замещенный OR, CN, NRR', перфторалкилом; предпочтительно R17 представляет собой алкил, более предпочтительно метил или этил,R9 представляет собой алкил, необязательно замещенный OR, CN, NRR', перфтороалкилом; предпочтительно R9 представляет собой алкил, более предпочтительно метил,X представляет собой -О- или -NR-; предпочтительно X представляет собой -NR-,Y представляет собой -U-, -NR-U-, -O-U-, -NR-CO-U-, -U-NR-СО-, -U-CO-, -CO-U-,предпочтительно, если X представляет собой -О-, Y представляет собой -U-, -NR-U-, -U-NR-CO-,где U выбирают из линейных или разветвленных -алк-, алк(ОСН 2 СН 2)m-, -(ОСН 2 СН 2)m-алк-, -алк(ОСН 2 СН 2)m-алк-, - (ОСН 2 СН 2)m-, -циклоалкил-, -гетероцикл-, -циклоалкил-алк-, -алк-циклоалкил-, гетероцикл-алк-, -алк-гетероцикл-,где m представляет собой целое число, выбранное от 1 до 2000,предпочтительно U представляет собой линейный или разветвленный -алк-,Z представляет собой -алк,n равен 0 или 1, предпочтительно n равен 0,Т представляет собой Н, тиоловую защитную группу, такую как Ac, R1 или SR1, где R1 представляет собой Н, метил, алк, циклоалкил, необязательно замещенный арил или гетероцикл, либо Т представляет собой где Ra, Ra', R17, R9, X, Y, Z, n определены выше,предпочтительно Т представляет собой Н или SR1, где R1 представляет собой алк, более предпочтительно метил,R, R', одинаковые или различные, представляют собой Н либо алкил, алк представляет собой линейный или разветвленный алкил, предпочтительно алк представляет собой - (CH2-q(СН 3)q)p-, где р представляет собой целое число от 1 до 10, и q представляет собой целое число от 0 до 2; предпочтительно алк представляет собой -(СН 2)- или -С(СН 3)2-,или их фармацевтически приемлемые соли, гидраты или гидратированные соли, либо полиморфные кристаллические структуры этих соединений, или их оптические изомеры, рацематы, диастереоизомеры или энантиомеры. Предпочтительные соединения можно выбирать из следующих:(2-меркапто-2-метилпропил)амид (2 Е,10 Е,12 Е,16Z,18 Е)-(R)-6-гидрокси-3,5,7,9,11,15,17-гептаметил 19-2S,3S)-3-метил-6-оксо-3,6-дигидро-2 Н-пиран-2-ил)-8-оксононадека-2,10,12,16,18-пентаеновой кислоты; или их фармацевтически приемлемых солей, гидратов или гидратированных солей, либо полиморфных кристаллических структур этих соединений, или их оптических изомеров, рацематов, диастереоизомеров или энантиомеров. Для того чтобы сшить производное со связывающим клетки средством, данное производное должно содержать фрагмент (сшивающую группу), который позволяет производным быть сшитыми со связывающим клетки средством через сочленение, такое как дисульфидная связь, сульфидная (иначе называемая в данном описании тиоэфирной) связь, кислотолабильная группа, фотолабильная группа, расщепляемая пептидазой группа и расщепляемая эстеразой группа. Производные получают таким образом,чтобы они содержали фрагмент, необходимый для сшивки производного лептомицина со связывающим клетки средством через, например, дисульфидную связь, тиоэфирную связь, кислотолабильную группу,фотолабильную группу, расщепляемую пептидазой группу и расщепляемую эстеразой группу. Для того чтобы дополнительно повысить растворимость в водных растворах, сшивающая группа может содержать полиэтиленгликолевый спейсер. Предпочтительно применяют сульфидное или дисульфидное сочленение, так как восстановительная среда клетки-мишени приводит к расщеплению сульфида или дисульфида и к высвобождению производных с сопутствующим возрастанием цитотоксичности. Соединения по настоящему изобретению можно получать различными путями синтеза. Реагенты и исходные материалы являются коммерчески доступными, либо легко синтезируемыми с помощью методов, хорошо известных рядовым специалистам в данной области. Методы синтеза производных лептомицина, которые можно использовать для цитотоксических конъюгатов по настоящему изобретению,наряду с методами конъюгации указанных производных лептомицина со связывающими клетки средствами, такими как антитела, подробно описаны в европейской патентной заявке 062909486, содержание которой включено в данное описание посредством ссылки. Аналоги СС-1065 Цитотоксическое средство, используемое в цитотоксических конъюгатах по настоящему изобретению, может также представлять собой СС-1065 или его производное. СС-1065 является эффективным противоопухолевым антибиотиком, выделенным из среды культивирования Streptomyces zelensis. СС-1065 примерно в 1000 раз более эффективен in vitro по сравнению с обычно применяемыми противораковыми лекарственными средствами, такими как доксорубицин, метотрексат и винкристин (В.K. Bhuyan et al., 1982, Cancer Res., 42, 3532-3537). СС-1065 и его аналоги раскрыты в патентах США 6372738, 6340701, 5846545 и 5585499. Цитотоксическая эффективность СС-1065 коррелировала с его алкилирующей активностью и его ДНК-связывающей или ДНК-интеркалирующей активностью. Эти две активности свойственны различным частям данной молекулы. Так, алкилирующая активность присуща циклопропапирролоиндольной(CPI) субъединице, а ДНК-связывающая активность свойственна двум пирролоиндольным субъединицам. Хотя СС-1065 обладает определенными привлекательными свойствами в качестве цитотоксического средства, оно имеет ограничения в терапевтическом применении. Введение СС-1065 мышам вызывало отсроченную гепатотоксичность, приводящую к летальному исходу на 50 день после единичной внутривенной дозы, составляющей 12,5 мкг/кг (V.L. Reynolds et al., 1986, J. Antibiotics, XXIX: 319-334). Это привело к форсированным попыткам разработать аналоги, не вызывающие отсроченную токсичность, и был описан синтез более простых аналогов, смоделированных на основе СС-1065 (М.А. Warpehoski et al.,1988, J. Med. Chem., 31: 590-603). В другой серии аналогов фрагмент CPI был заменен циклопропабензиндольным (CBI) фрагментом(D.L. Boger et al., 1990, J. Org. Chem., 55: 5823-5833, D.L. Boger et al., 1991, BioOrg. Med. Chem. Lett., 1: 115-120). Эти соединения сохраняют высокую эффективность in vitro исходного лекарственного средства, но не приводят к отсроченной токсичности у мышей. Как и СС-1065, эти соединения являются алкилирующими средствами, которые связываются с малой бороздкой ДНК ковалентным образом, что приводит к гибели клетки. Однако клиническая экспертиза наиболее перспективных аналогов, адоцелезина и карцелезина, привела к разочаровывающим результатам (В.F. Foster et al., 1996, Investigational NewDrugs, 13: 321-326; I. Wolff et al., 1996, Clin. Cancer Res., 2: 1717-1723). Эти лекарственные средства обладали неудовлетворительным терапевтическим действием из-за своей высокой системной токсичности.
МПК / Метки
МПК: C12N 15/63, C12N 15/13, A61P 35/00, G01N 33/53, C07K 16/28, C12N 5/20, A61K 39/395
Метки: антитела, применение, эфрина, рецептору, epha2
Код ссылки
<a href="https://eas.patents.su/30-20324-antitela-k-receptoru-efrina-epha2-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к рецептору эфрина epha2 и их применение</a>
Предыдущий патент: Способ получения углеродного энтеросорбента
Случайный патент: Иммуноцитокины для лечения рака в сочетании с химиотерапевтическими агентами












