Конструкция пептидного каркаса
Номер патента: 25152
Опубликовано: 30.11.2016
Авторы: Ланге Эйнар Теннес, Хольмберг Йенс Олоф, Серенсен Биргер, Гренвольд Мая Соммерфельт
Формула / Реферат
1. Выделенный проникающий в клетку пептид, вызывающий иммунный ответ, содержащий следующую структуру:
Х1-Х2-Х3-Х4-Х5 (формула I),
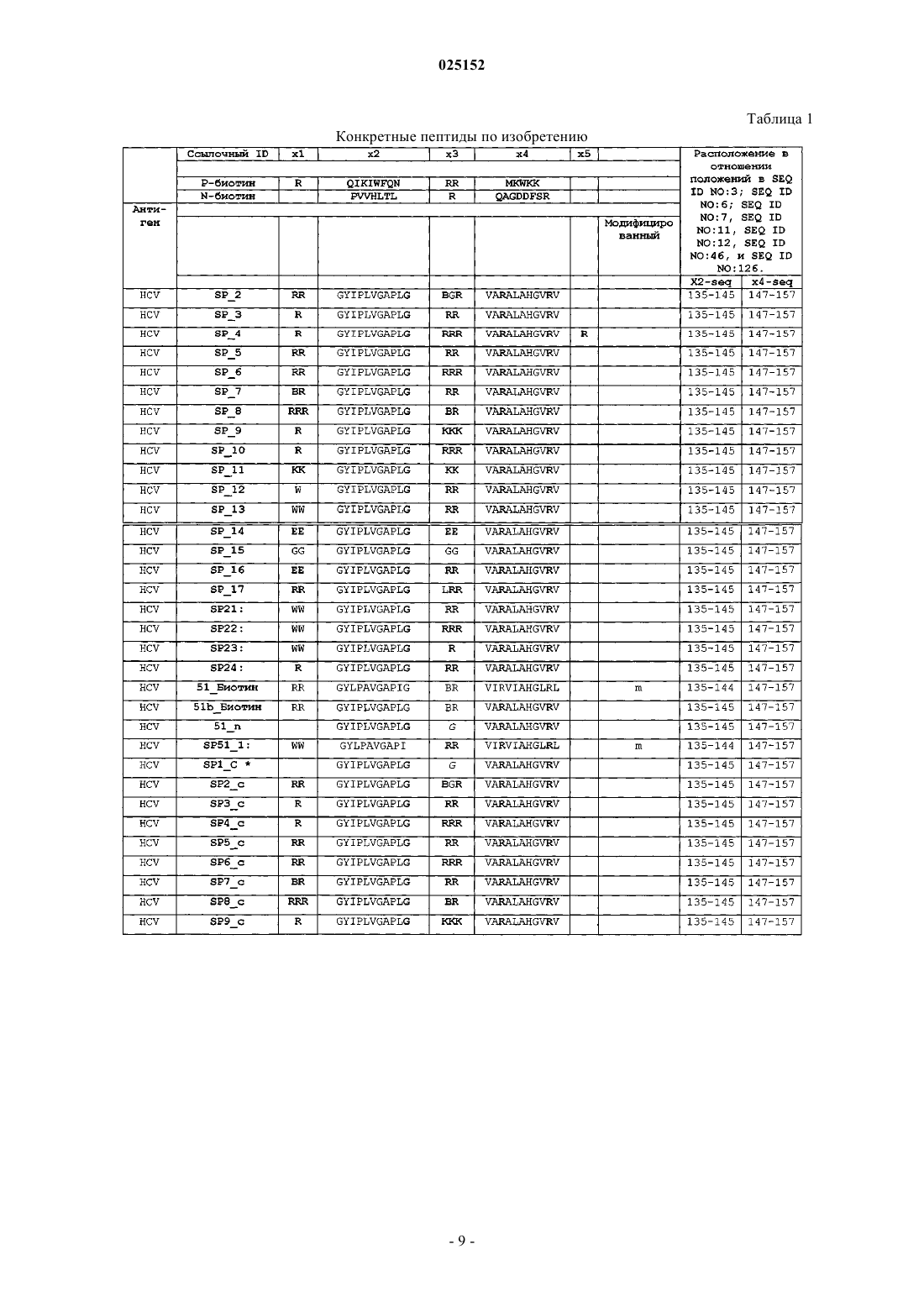
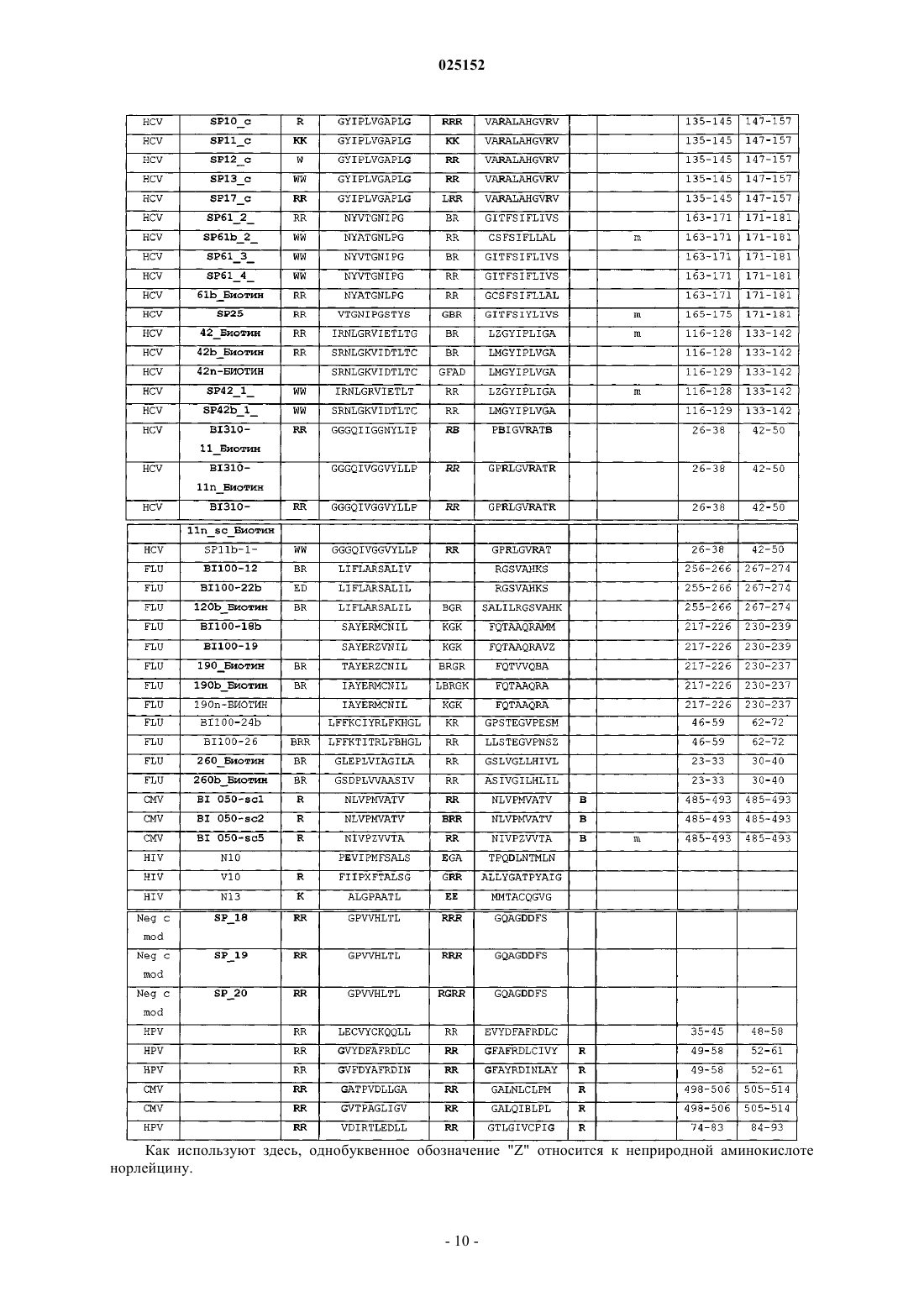
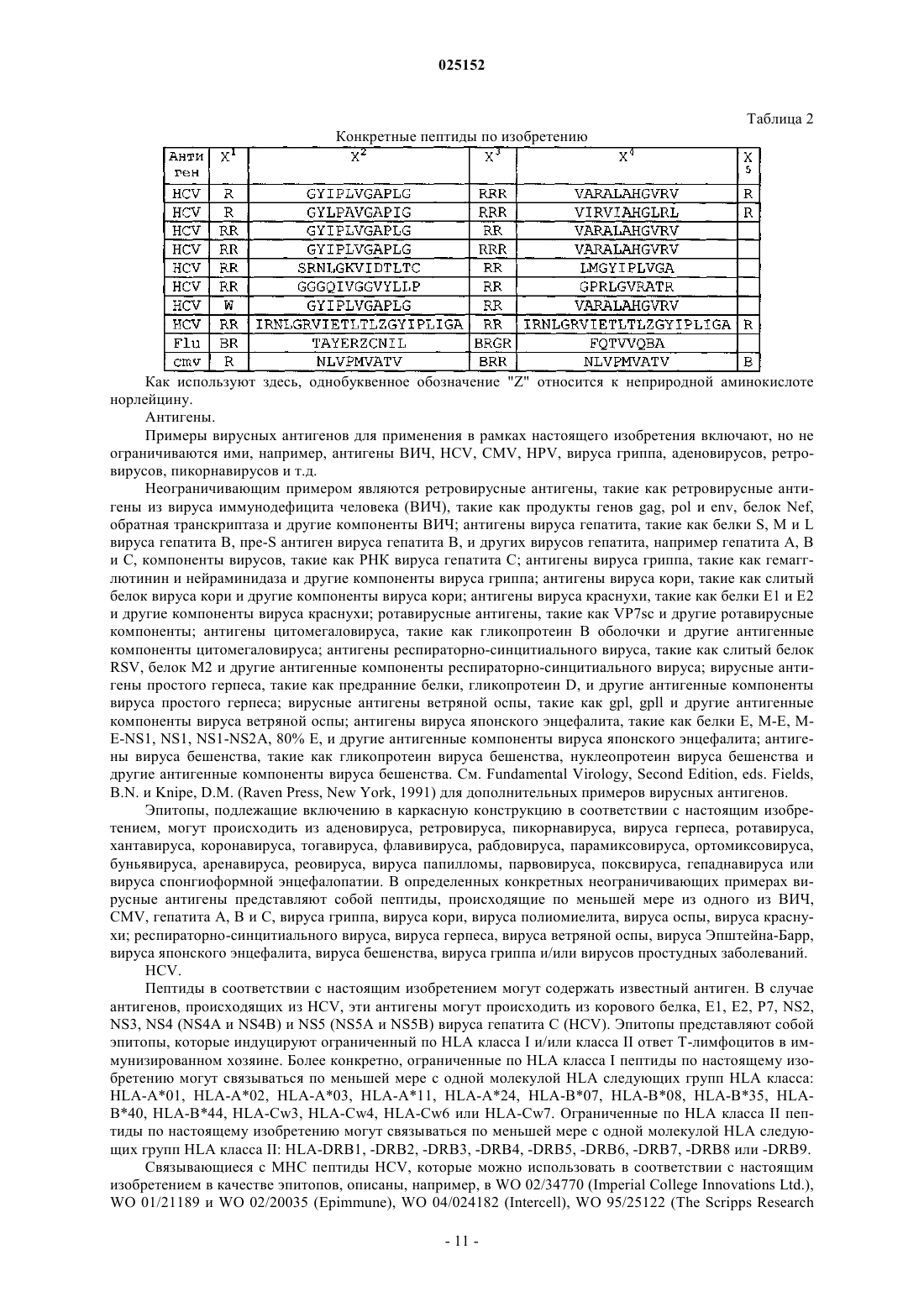
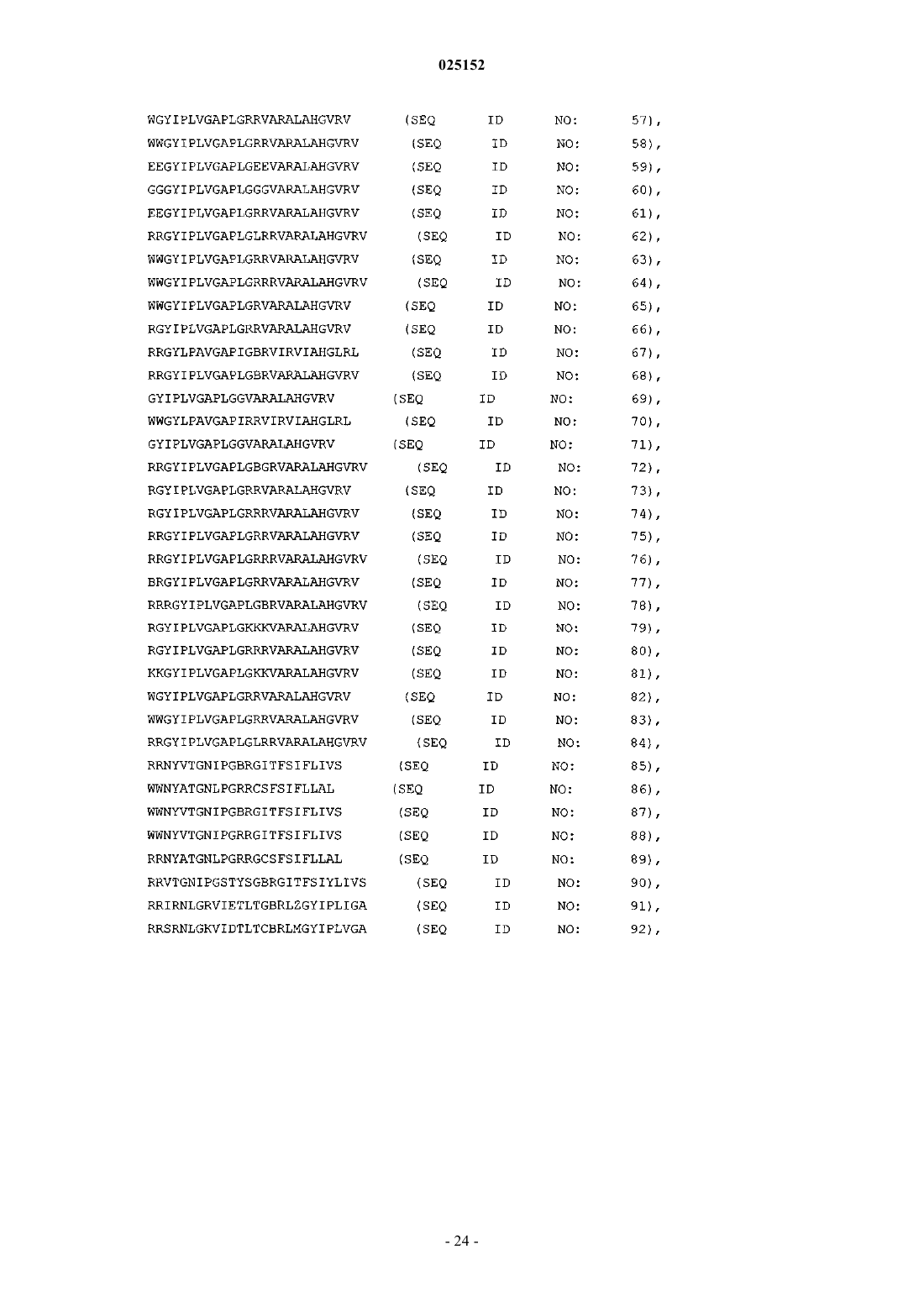
где X1 и X3 независимо определяют линейную последовательность любых 1, 2, или 3 аргининов; X2 и X4 независимо определяют линейную последовательность из 8-15 аминокислот из одного и того же антигена HCV, CMV, HPV или вируса гриппа, или его вариантной последовательности, содержащей 1-10 замен, вставок или делеций относительно антигена и обладающей по меньшей мере 50% идентичностью с природной последовательностью указанного антигена, причем указанная последовательность X4 отличается от X2; и X5 представляет собой необязательно аргигин, где выделенный проникающий в клетку пептид состоит из 18-60 аминокислот, и последовательность аминокислот, определенная формулой I Х1-Х2-Х3-Х4-Х5, отсутствует в природной последовательности указанного антигена.
2. Выделенный пептид по п.1, где X2 и X4 независимо определяют линейную последовательность, имеющую по крайней мере 60 или 70% идентичность природной последовательности указанного антигена.
3. Выделенный пептид по п.1 или 2, где пептид содержит один или несколько остатков цистеина.
4. Выделенный пептид по любому из пп.1-3, где N- и/или С-концевая аминокислота в X2 представляет собой гидрофильную или полярную аминокислоту.
5. Выделенный пептид по любому из пп.1-4, где N-концевая аминокислота в X4 представляет собой гидрофильную или полярную аминокислоту.
6. Выделенный пептид по любому из пп.1-5, где X1 и/или X3 состоит из 2 или 3 аргининов.
7. Выделенный пептид по п.6, где X1 состоит из RR.
8. Выделенный пептид по п.6 или 7, где X3 состоит из RR.
9. Выделенный пептид по любому из пп.1-8, где X2 и/или X4 представляет собой линейную последовательность менее чем из 12 аминокислот.
10. Димерный пептид, содержащий два пептидных мономера, где каждый пептидный мономер является таким, как определено в любом из пп.1-9.
11. Комбинация пептидов, содержащая два или более пептидов по любому из пп.1-9.
12. Выделенная нуклеиновая кислота или полинуклеотид, кодирующий пептид по любому из пп.1-9.
13. Вектор, содержащий нуклеиновую кислоту или полинуклеотид по п.12.
14. Клетка-хозяин, содержащая указанный вектор по п.13.
15. Иммуногенная композиция, содержащая по меньшей мере один пептид по любому из пп.1-9, димерный пептид по п.10, комбинацию пептидов по п.11, нуклеиновую кислоту или полинуклеотид по п.13 или вектор по п.14; в комбинации с фармацевтически приемлемым разбавителем или носителем и необязательно иммунологическим адъювантом.
16. Иммуногенная композиция по п.15 в форме вакцинной композиции.
17. Применение пептида по любому из пп.1-10 для лечения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом.
18. Применение пептида по любому из пп.1-10 или комбинации пептидов по п.11 в способе индуцирования иммунного ответа у индивидуума против антигена или для снижения и/или устранения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом.
19. Применение нуклеиновой кислоты или полинуклеотида по п.12 или вектора по п.13 в способе индуцирования иммунного ответа у индивидуума против антигена или для снижения и/или устранения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом.
20. Применение композиции по любому из пп.15-16 в способе индуцирования иммунного ответа у индивидуума против антигена или для снижения и/или устранения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом.
Текст
Настоящее изобретение относится к новым пептидам и способам лечения, диагностики и прогнозирования вирусных инфекций, включая инфекции HCV, ВИЧ, CMV и вирусом гриппа. Кроме того, изобретение относится к способам идентификации и предоставления пептидов,пригодных для лечения и диагностики. Ланге Эйнар Теннес, Гренвольд Мая Соммерфельт (NO), Хольмберг Йенс Олоф (SE), Серенсен Биргер (NO) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: БИОНОР ИММУНО АС (NO) Область изобретения Настоящее изобретение относится к новым пептидам и способам лечения, диагностики и прогнозирования вирусных инфекций, включая инфекции HCV, ВИЧ, CMV и вирусом гриппа. Кроме того, изобретение относится к способам идентификации и предоставления пептидов, пригодных для лечения и диагностики. Уровень техники, к которому относится изобретение Традиционные подходы к разработке вакцин вовлекают либо целый способный к репликации вирус, который является ослабленным (например, вакцина против полиомиелита Сэбина, вакцина против кори, свинки, краснухи (MMR, либо инактивированные вирионы, которые не способны к репликации. Иногда инактивированные вирусные вакцины могут включать расщепленные вакцины, где вирусные частицы разрушены. Также используются молекулярные способы для разработки субъединичной вакцины (например, вакцина против гепатита В), которая состоит только из поверхностных гликопротеинов вируса гепатита В. Инактивированные вирусные вакцины имеют тенденцию к индукции, главным образом, антительных ответов на соответствующие вирусы, в то время как живые ослабленные вакцины индуцируют как клеточно-опосредуемый иммунитет, так и антительный ответ, поскольку вакцина индуцирует временную инфекцию. Единственным заболеванием, которое было устранено с помощью успешной кампании по вакцинации, является оспа. В настоящее время проходит кампания по устранению полиомиелита. Признаками вирусных инфекций, которые могут быть устранены посредством вакцинации, являются инфекции, вызываемые вирусом со стабильными вирусными антигенами (т.е. очень низкая частота мутаций, мало подтипов), у которых отсутствует резервуар в других видах животных, вирусы, которые не персистируют в организме после завершения инфекции, и где вакцинация приводит к длительному иммунитету. Вирусы,такие как вирус полиомиелита и вирус кори, удовлетворяют этим критериям, в то время как вирусы, такие как вирус гриппа (Flu), HCV и ВИЧ, у которых варьируют их белковые последовательности, не удовлетворяют им. Именно по этой причине требуются новые и альтернативные подходы для разработки вакцин от этих заболеваний. Вакцинация нацелена на стимуляцию иммунного ответа на конкретный патоген до инфекции. Когда этот патоген воздействует на индивидуума, запускается ответ памяти, который препятствует развитию инфекции. Вакцины, таким образом, стимулируют адаптивный иммунный ответ, который в отличие от врожденного иммунитета является продолжительным и обладает памятью. Существует два основных звена адаптивной иммунной системы. Гуморальный иммунитет вовлекает формирование антител, которые могут связывать вирусные частицы, и определенных антител, которые могут нейтрализовывать инфекцию. Клеточно-опосредуемый иммунитет приводит к развитию цитотоксических Т-клеток, которые уничтожают инфицированные клетки, экспонирующие вирусные эпитопы в контексте лейкоцитарного антигена человека (HLA) класса I, таким образом, устраняя инфицированные клетки. Проблема предоставления вакцин, пригодных для стимуляции адаптивной иммунной системы, состоит в том, что пептидные эпитопы должны захватываться антигенпредставляющими клетками. Было показано, что некоторые пептиды перемещаются через плазматическую мембрану эукариотических клеток с помощью, по-видимому, не зависящего от энергии каскада. Эти пептиды определяют как проникающие в клетку пептиды (СРР). Доставка в клетку с использованием этих проникающих в клетку пептидов обеспечивает несколько преимуществ над общепринятыми способами. Она является неинвазивной, не зависящей от энергии, является эффективной для широкого диапазона типов клеток, и ее можно применять к клеткам в массе. Гепатит означает воспаление печени, которое может быть вызвано различными факторами, включающими токсины, определенные лекарственные средства, некоторые заболевания, тяжелое употребление алкоголя и бактериальные и вирусные инфекции. Гепатитом также называют семейство вирусных инфекций, которые поражают печень; наиболее распространенными его типами в развитом мире являются гепатит А, гепатит В и гепатит С. Гепатит С представляет собой заболевание печени, которое является результатом инфекции вирусом гепатита С (HCV). Его тяжесть может находиться в диапазоне от мягкого недомогания, длящегося несколько недель, до тяжелого заболевания на всю жизнь. Гепатит С распространяется через кровь; наиболее распространенной формой передачи является передача путем пользования одним шприцом или другим оборудованием, используемым для инъекции лекарственных средств. Инфекция может быть либо "острой", либо "хронической". Острая инфекция HCV представляет собой бессимптомное кратковременное заболевание, которое продолжается в течение первых 6 месяцев после воздействия вируса гепатита С. Для большинства людей острая инфекция приводит к хронической инфекции, которая может приводить к отдаленным осложнениям и даже смерти.HCV представляет собой заключенный в оболочку вирус с положительной цепью рибонуклеиновой кислоты (РНК) диаметром приблизительно 50 нм, принадлежащий роду Hepacivirus семейства Flaviviridae, который реплицируется в цитоплазме инфицированных клеток. Единственным известным резервуаром для HCV являются люди, хотя вирус в экспериментах передавался шимпанзе. Природной мишеньюHCV являются гепатоциты и, возможно, В-лимфоциты. На 2008 г. было известно шесть различных гено-1 025152 типов и более 100 подтипов этого вируса. Репликация происходит через РНК-зависимую РНКполимеразу, которая лишена корректирующей функции, что приводит к очень высокой частоте мутаций. Быстрые мутации в гипервариабельной области генома HCV, кодирующего белки оболочки, обеспечивают ускользание вируса от иммунного надзора хозяина. Вследствие этого, у большинства инфицированных HCV людей инфекция переходит в хроническую форму. Согласно оценке 170 млн человек инфицированы HCV по всему миру, что соответствует приблизительно 3% всей популяции. Также приблизительно 3-4 млн человек инфицируются каждый год; причем приблизительно у 80% из этих вновь инфицированных пациентов инфекция прогрессирует в хроническую инфекцию. 6 генотипов HCV имеют различное географическое распространение. Заболевание на ранних стадиях, как правило, является бессимптомным; у большинства пациентов хроническая инфекция в конечном итоге прогрессирует в осложнения, такие как фиброз печени и цирроз, и в 1-5% случаев печеночноклеточную карциному.HCV является главной причиной не-А, не-В-гепатита по всему миру. Острая инфекция HCV часто приводит к хроническому гепатиту и его конечной стадии - циррозу. Согласно оценке у вплоть до 20% носителей HCV с хронической инфекцией может развиваться цирроз в течение периода времени приблизительно 20 лет и 1-4% носителей с циррозом имеют риск развития карциномы печени. Одноцепочечный РНК-геном вируса HCV размером 9,6 т.п.н. содержит 5'- и 3'-некодирующие области (NCR), и между этими NCR он содержит единую длинную открытую рамку считывания размером приблизительно 9 т.п.н., кодирующую полибелок HCV размером приблизительно 3000 аминокислот. Полипептиды HCV получают путем трансляции с открытой рамки считывания и котрансляционного протеолитического процессинга. Структурные белки происходят N-концевой четверти кодирующей области и включают капсидный или коровый белок (приблизительно 21 кДа), гликопротеин оболочки Е 1(приблизительно 35 кДа) и гликопротеин оболочки Е 2 (приблизительно 70 кДа, ранее называемый NS1) и р 7 (приблизительно 7 кДа). Белок Е 2 может встречаться со слитым на С-конце белком р 7 или без него(Shimotohno et al. 1995). Была выявлена альтернативная открытая рамка считывания в коровой области,которая кодирует и экспрессирует белок размером приблизительно 17 кДа, называемый белком F(Frameshift) (Xu et al. 2001; OuXu в публикации патентной заявки СШАUS 2002/0076415). В той же области были открыты ORF для других ARFP (белки альтернативной рамки считывания) массой 14-17 кДа, А 1-А 4 и в сыворотках пациентов с хронической инфекцией выявлены антитела, по меньшей мере, к А 1, А 2 и A3 (Walewski et al. 2001). Из остальной части кодирующей области HCV происходят неструктурные белки HCV, которые включают NS2 (приблизительно 23 кДа), NS3 (приблизительно 70 кДа),NS4A (приблизительно 8 кДа), NS4B (приблизительно 27 кДа), NS5A (приблизительно 58 кДа) и NS5B(приблизительно 68 кДа) (Grakoui et al. 1993). Вирус гриппа остается существенной причиной заболеваемости и смертности по всему миру. Согласно оценкам Всемирной организации здравоохранения (ВОЗ) сезонные эпидемии поражают 3-5 млн человек с тяжелой формой заболевания каждый год и приводят к 250000-500000 смертей. Грипп вызывается вирусами семейства Orthomyxoviridae, которые представляют собой вирусы с отрицательной цепью РНК. Вирус гриппа существует в качестве трех типов: А, В и С, из которых только А ассоциирован с пандемиями. Вирусы типа А встречаются у человека и животных, в частности птиц, но также у других млекопитающих, таких как свиньи. Вирусы А далее типируются на подтипы в соответствии с различными типами и комбинациями поверхностных белков вируса. Среди многих подтипов в 2009 г. среди людей циркулировали вирусы подтипов A (H1N1) и A (H3N2). Вирусы гриппа А и В включены в сезонную вакцину, в то время как вирус гриппа С встречается редко, так что он не включен в сезонную вакцину. Вирусы типа В являются специфическими для человека и вирусы типа С вызывают очень мягкое заболевание. Геномы ортомиксовирусов сегментированы. Вирусы гриппа типов А и В имеют 8 сегментов, в то время как тип С имеет семь. Пандемии могут возникать в результате реассортации сегментов генов, когда два различных вируса типа А инфицируют одну и ту же клетку. В популяции отсутствует иммунитет к этому новому реассортантному вирусу. В двадцатом веке произошло три пандемии: "Испанка" в 1918 г., "Азиатский грипп" в 1957 г. и "Гонконгский грипп" в 1968 г. Согласно оценке пандемия 1918 г. привела к гибели 40-50 млн человек. Последующие пандемии были значительно более мягкими, с приблизительно 2 миллионами смертей в 1957 г. и 1 миллионом смертей в 1968 г. В июне 2009 г ВОЗ объявила о пандемии вируса H1N1 (свиной грипп), которая была объявлена завершенной в августе 2010 г. Вирусы папилломы человека состоят из группы ДНК-вирусов в семействе Papillomaviridae, которые инфицируют кожу и слизистые оболочки. Две группы, которые образованы более чем 100 различными идентифицированными подтипами, являются основной причиной клинических проблем: подтипы, вызывающие бородавки (как доброкачественные, так и генитальные бородавки), и группа из 12 подтипов "высокого риска", которые могут привести к раку шейки матки. Этой последней группе приписывается роль способствующего фактора при развитии практически всех типов рака шейки матки. По всем миру рак шейки матки остается второй из наиболее распространенных злокачественных опухолей у женщин и является ведущей причиной связанной со злокачественной опухолью смерти среди женщин в развивающихся странах. Главным образом, с раком шейки матки ассоциированы HPV 16 и 18, однако этот вирус также является причиной рака горла как у мужчин, так и у женщин. HPV передается контактным путем и проникает в кожу через царапины. Абортивная инфекция, где экспрессируются только ранние белки,ассоциирована с развитием злокачественной опухоли. Задача изобретения Задачей вариантов осуществления изобретения является предоставление пептидов, которые можно использовать в качестве иммуногенов для стимуляции адаптивного иммунного ответа у индивидуума. В частности, задачей вариантов осуществления изобретения является предоставление пептидов, которые могут захватываться антигенпредставляющими клетками (макрофаги и дендритные клетки) так,чтобы эпитопы в пептидах правильным образом процессировались и представлялись Т-лимфоцитам для стимуляции эффективного иммунного ответа. Кроме того, задачей вариантов осуществления изобретения является предоставление пептидов, которые можно использовать в качестве антигенов, предоставление иммунногенных композиций и способов индукции иммунного ответа у индивидуума против антигена. Сущность изобретения Настоящее изобретение относится к конструкции пептида, обеспечивающей захват пептидных эпитопов антигенпредставляющими клетками (макрофаги и дендритные клетки) так, чтобы эпитопы можно было надлежащим образом процессировать и представлять в контексте HLA класса I и II для стимуляции как CD4+, так и CD8+ Т-лимфоцитов. CD8+ Т-лимфоциты с цитотоксической способностью уничтожают инфицированные клетки, несущие представляющие интерес эпитоп. CD4+ Т-лимфоциты обеспечивают"помощь" для поддержания эффективных ответов CD8+ Т-лимфоцитов. Автором(ами) настоящего изобретения было открыто, что пептидные конструкции - аминокислотные последовательности с конкретной структурой или конструкцией каркаса - обладают способностью эффективно проникать через клеточную мембрану. Таким образом, пептидные конструкции в соответствии с настоящим изобретением можно использовать для нагрузки клеток иммуногенно эффективным количеством пептида или фрагментов этого пептида, которые могут представляться макрофагами и дендритными клетками. Таким образом, эти пептидные конструкции могут индуцировать иммунный ответ цитотоксических Т-лимфоцитов (CTL) и/или гуморальный иммунный ответ. Таким образом, в первом аспекте настоящее изобретение относится к выделенному проникающему в клетку пептиду не более чем из 60 аминокислот со следующей структурой Х 1-Х 2-Х 3-Х 4-Х 5 (формула I),где X1 и X3 независимо определяют линейную последовательность любой 1, 2, 3 или 4 аминокислоты(аминокислот), независимо выбранной из основной аминокислоты, цитруллина, триптофана или их производного; X2 определяет линейную последовательность из 8-30 аминокислот, происходящую из антигена; X4 определяет линейную последовательность из 8-30 аминокислот, происходящую из указанного антигена, причем указанная последовательность X4 отличается от X2; и X5 представляет собой любую необязательную аминокислоту, выбранную из основной аминокислоты, цитруллина, триптофана или их производного. Следует понимать, что аминокислотная последовательность формулы I относится к пептидной последовательности в стандартном направлении от N- к С-концу, где первая упомянутая аминокислота представляет собой N-концевую аминокислоту, которая может иметь аминогруппу (-NH2) или альтернативно группу -NH3+. Последняя упомянутая аминокислота является С-концевой, которая может иметь свободную карбоксильную группу (-COOH) или карбоксилатную группу. В некоторых вариантах осуществления N- и/или С-концевая аминокислота является модифицированной, например, путем N-концевого ацетилирования или С-концевой амидации. Обозначение "-", используемое в формуле I, относится к стандартной пептидной связи, такой как стандартная пептидная связь между X1 и X2 в Х 1-Х 2. Кроме того, следует понимать, что пептиды по изобретению, главным образом, предназначены для синтетического синтеза пептидов. Однако пептиды могут быть длиннее 60 аминокислот, если пептиды продуцируют рекомбинантными способами. Таким образом, альтернативный первый аспект настоящего изобретения относится к выделенному проникающему в клетку пептиду, содержащему пептидную последовательность со следующей структурой: Х 1-Х 2-Х 3-Х 4-Х 5 (формула I),1 3 где X и X независимо определяют линейную последовательность любых 1, 2, 3 или 4 аминокислоты(аминокислот), независимо выбранной из основной аминокислоты, цитруллина, триптофана или их производного; X2 определяет линейную последовательность из 8-30 аминокислот, происходящую из антигена; X4 определяет линейную последовательность из 8-30 аминокислот, происходящую из указанного антигена, причем указанная последовательность X4 отличается от X2; и X5 представляет собой любую необязательную аминокислоту, выбранную из основной аминокислоты, цитруллина, триптофана или их производного. Во втором аспекте настоящее изобретение относится к выделенному пептиду не более чем из 60 аминокислот, содержащему последовательность X2 и/или X4, как независимо определено в любой из табл. 1 или 2. В третьем аспекте настоящее изобретение относится к применению пептида, содержащего последовательность X2 или X4, как независимо определено в любой из табл. 1 или 2, для индукции иммунного ответа у индивидуума. В следующем аспекте настоящее изобретение относится к выделенному пептиду, состоящему из Х 1-X5, как определено в любой из табл. 1 или 2. В следующем аспекте настоящее изобретение относится к димерному пептиду, содержащему два пептидных мономера, где каждый пептидный мономер представляет собой мономер согласно изобретению. В следующем аспекте настоящее изобретение относится к комбинации пептидов, содержащей два или более пептидов по изобретению. В следующем аспекте настоящее изобретение относится к выделенной нуклеиновой кислоте или полинуклеотиду, кодирующим пептид по изобретению. В следующем аспекте настоящее изобретение относится к вектору, содержащему нуклеиновую кислоту или полинуклеотид, кодирующие пептид по изобретению. В следующем аспекте настоящее изобретение относится к клетке-хозяину, содержащей вектор, содержащий нуклеиновую кислоту или полинуклеотид, кодирующие пептид по изобретению. В следующем аспекте настоящее изобретение относится к иммуногенной композиции, содержащей по меньшей мере один пептид по изобретению, димерный пептид, содержащий два пептидных мономера, где каждый пептидный мономер представляет мономер по изобретению, комбинацию пептидов, содержащую два или более пептидов по изобретению, нуклеиновую кислоту или полинуклеотид, кодирующие пептид по изобретению, или вектор, содержащий нуклеиновую кислоту или полинуклеотид,кодирующие пептид по изобретению; в комбинации с фармацевтически приемлемым разбавителем или носителем и необязательно иммунологическим адъювантом. В следующем аспекте настоящее изобретение относится к способу индукции иммунного ответа у индивидуума против антигена, который включает введение по меньшей мере одного пептида по изобретению; димерного пептида, содержащего два пептидных мономера, где каждый пептидный мономер представляет мономер по изобретению; комбинации пептидов, содержащей два или более пептидов по изобретению; нуклеиновой кислоты или полинуклеотида, кодирующих пептид по изобретению; вектора,содержащего нуклеиновую кислоту или полинуклеотид, кодирующие пептид по изобретению; или композиции по изобретению. В следующем аспекте настоящее изобретение относится к способу уменьшения и/или замедления патологических эффектов вируса у индивидуума, инфицированного указанным вирусом, причем способ включает введение эффективного количества по меньшей мере одного пептида по изобретению; димерного пептида, содержащего два пептидных мономера, где каждый пептидный мономер представляет мономер по изобретению; комбинации пептидов, содержащей два или более пептидов по изобретению; нуклеиновой кислоты или полинуклеотида, кодирующих пептид по изобретению; вектора, содержащего нуклеиновую кислоту или полинуклеотид, кодирующие пептид по изобретению; или композиции по изобретению. В следующем аспекте настоящее изобретение относится к пептиду по изобретению для применения в качестве лекарственного средства. В следующем аспекте настоящее изобретение относится к пептиду по изобретению для лечения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом. Подробное описание изобретения Определения. Когда в настоящем описании используют форму единственного числа, это может означать "по меньшей мере один" или "один или несколько", если нет иных указаний. Кроме того, термин "содержащий" означает "включающий" и, таким образом, позволяет наличие других составляющих, признаков,условий или стадий помимо явно перечисленных."ВИЧ", главным образом, обозначает вирус иммунодефицита человека I."Заболевание ВИЧ" состоит из нескольких стадий, включая острую ВИЧ-инфекцию, которая часто проявляется как гриппоподобная инфекция, и заболевание ранней и средней стадии, которое имеет несколько нехарактерных симптомов, таких как кожная сыпь, усталость, ночная потливость, небольшое снижение массы тела, язвы рта, и грибковые инфекции кожи и ногтей. Большинство ВИЧинфицированных испытывают мягкие симптомы, такие как симптомы до развития более тяжелого заболевания. Главным образом, появление первых мягких симптомов происходит через от пяти до семи лет. По мере прогрессирования ВИЧ некоторые индивидуумы могут быть довольно нездоровыми, даже если у них еще не диагностирован СПИД (см. ниже), поздняя стадия заболевания ВИЧ. Типичные проблемы включают хронический кандидозный стоматит или кандинозный кольпит (грибковая сыпь или пятна),рецидивирующие буллезное поражение рта (герпетическая лихорадка) или половых органов, длительные лихорадки, персистирующая диарея и значительное снижение массы тела. "СПИД" представляет собой заболевание ВИЧ поздней стадии и является состоянием, которая постепенно снижает эффективность иммунной системы и делает индивидуумов чувствительными к оппортунистическим инфекциям и опухолям. Термин "проникающий в клетку пептид", как используют в рамках изобретения, относится к любо-4 025152 му пептиду, способному проходить через плазматическую мембрану либо в цитоплазматический и/либо ядерный компартменты эукариотических и/или прокариотических клеток, такие как цитоплазма, ядро,эндоплазматическая сеть, аппарат Гольджи, митохондрии и/или хлоропласты, по-видимому, независимо от энергии. Эта способность "проникающего в клетку пептида" по изобретению проходить через плазматическую мембрану может быть неинвазивной, независимой от энергии, ненасыщаемой и/или независимой от рецепторов. В одном варианте осуществления термин "проникающий в клетку пептид" относится к пептиду, для которого показано, что он проходит через плазматическую мембрану при определении с помощью анализа, описанного в примере 1. Следует понимать, что проникающий в клетку пептид в соответствии с настоящим изобретением может проходить через мембрану с полной и неизмененной последовательностью, или альтернативно он может частично деградировать, но в форме, где антигены, содержащиеся в этом пептиде, могут быть представлены в клетке для стимуляции иммунного ответа. Таким образом, проникающий в клетку пептид в соответствии с настоящим изобретением представляет собой пептид, для которого может быть показано, что он проходит через плазматическую мембрану при определении с помощью анализа в примере 1, и может быть показано, что он стимулирует эффективный иммунный ответ. Термин "происходящий из антигена", когда его применяют в отношении пептида, происходящего из источника (такого как вирус и т.д.), как используют в рамках изобретения, относится к пептиду, который получен (например, выделен, очищен и т.д.) из источника. Предпочтительно пептид можно получать способами генетической инженерии и/или химически синтезировать так, чтобы он был, по существу,идентичен нативному пептиду из источника. Термин включает использование вариантов известных наивных пептидных последовательностей, таких как пептидные последовательности, где 1, 2, 3, 4, 5, 6, 7, 8,9 или 10 аминокислот нативной пептидной последовательности заменены любой другой аминокислотой,такой как консервативные замены. Альтернативно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот удалены или добавлены к нативной пептидной последовательности. Таким образом, в некоторых вариантах осуществления пептиды в соответствии с настоящим изобретением содержат последовательности X2 и/или X4,которые определяют как последовательность из 8-30 аминокислот, как, например, 8-20 аминокислот,происходящих из антигена, где пептидная последовательность антигена содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 замен, вставок или делеций относительно антигена, таких как вставка аргинина на N- или С-конце аминокислотной последовательности X2 и/или X4. Аминокислоты, используемые в аминокислотных последовательностях по изобретению, могут быть в L-форме и/или в D-форме. Следует понимать, что в одной и той же пептидной последовательности можно использовать как L-форму, так и D-форму различных аминокислот. В некоторых вариантах осуществления аминокислоты в пептидной последовательности находятся в L-форме, как, например, природные аминокислоты. Следует понимать, что в конструкциях в соответствии с настоящим изобретением можно использовать любой известный антиген. В некоторых конкретных вариантах осуществления первые 1, 2 или 3 аминокислоты на N-конце аминокислотных последовательностей по изобретению находятся в D-форме. Полагают, что N-концевое укорочение и, тем самым, деградация пептидов, в некоторой степени замедляются вследствие наличия аминокислот в D-форме на N-конце этих проникающих в клетку пептидов. Альтернативно и в некоторых вариантах осуществления первые 1, 2 или 3 аминокислоты на N-конце аминокислотных последовательностей по изобретению представляют собой аминокислоты в бета-форме или гамма-форме. Бетааминокислоты имеют их аминогруппу, связанную с бета-атомом углерода, вместо альфа-атома углерода,как в случае 20 стандартных природных аминокислот. Альтернативно, первые 1, 2 или 3 аминокислоты на N-конце аминокислотных последовательностей по изобретению можно модифицировать включением фтора, или альтернативно используют циклические аминокислоты или другие подходящие неприродные аминокислоты."Вариант" или "аналог" пептида относится к пептиду, имеющему аминокислотную последовательность, которая, по существу, идентична эталонному пептиду, как правило, нативному или "родительскому" полипептиду. Вариант пептида может обладать одной или несколькими аминокислотными заменами, делециями и/или инсерциями в определенных положениях нативной аминокислотной последовательности."Консервативные" аминокислотные замены представляют собой замены, в которых аминокислотный остаток заменен аминокислотным остатком, имеющим боковую цепь со сходными физикохимическими свойствами. Семейства аминокислотных остатков, имеющие сходные боковые цепи, известны в данной области и включают аминокислоты с основными боковыми цепями (например, лизин,аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин,треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например,треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин,триптофан, гистидин). Конкретная форма консервативных аминокислотных замен включает замены аминокислотами, которые не относятся к нормальным 20 аминокислотам, кодируемым генетическим кодом. Поскольку предпочтительные варианты осуществления настоящего изобретения охватывают использование синтетических пептидов, не является проблематичным предоставление таких "не встречающихся в природе" аминокислотных остатков в пептидах, описанных в настоящем описании, и, таким образом,можно заменять природные насыщенные углеродные цепи в боковых цепях аминокислотных остатков более короткими или более длинными углеродными цепями: например, лизин может быть заменен аминокислотой, имеющей боковую цепь -(CH2)nNH3, где n отлично от 4, и аргинин может быть заменен аминокислотой, имеющей боковую цепь -(СН 2)nNHC(=NH2)NH2, где n отлично от 3, и т.д. Аналогично, кислотные аминокислоты аспарагиновая кислота и глутаминовая кислота могут быть заменены аминокислотными остатками, имеющими боковые цепи -(CH2)nCOOH, где n2. Термин "по существу, идентичный" в контексте двух аминокислотных последовательностей означает, что последовательности после оптимального выравнивания, например, с помощью программ GAP или BESTFIT с использованием веса пропусков по умолчанию обладают по меньшей мере приблизительно 50, по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95, по меньшей мере приблизительно 98 или по меньшей мере приблизительно 99-процентной идентичностью последовательностей. В одном варианте осуществления положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. Идентичность последовательностей, как правило, измеряют с использованием программного обеспечения для анализа последовательностей. Программное обеспечения для анализа белков сопоставляет сходные последовательности с использованием показателей сходства, присваиваемых различным заменам, делециям и другим модификациям,включая консервативные аминокислотные замены. Например, общедоступное программное обеспечениеGCG включает программы, такие как "Gap" и "BestFit", которые можно использовать с параметрами по умолчанию для определения гомологии последовательностей или идентичности последовательностей между близко родственными полипептидами, такими как гомологичные полипептиды из различных видов организмов, или между белком дикого типа и его мутеином. См., например, GCG Version 6.1. Полипептидные последовательности также можно сравнивать с использованием FASTA или ClustalW, используя параметры по умолчанию или рекомендованные параметры. Программа FASTA (например,FASTA2 и FASTA3) в GCG Version 6.1. проводит выравнивание и выдает процентную идентичность последовательностей для областей наилучшего перекрывания между последовательностью запроса и последовательностью поиска (Pearson, Methods Enzymol. 1990; 183:63-98; Pearson, Methods Mol. Biol. 2000; 132:185-219). Другой предпочтительный алгоритм при сравнении последовательности с базой данных,содержащей большое количество последовательностей из различных организмов, или при установлении происхождения является компьютерная программа BLAST, особенно blastp, с использованием параметров по умолчанию. См., например, Altschul et al., J. Mol. Biol. 1990; 215:403-410; Altschul et al., NucleicAcids Res. 1997; 25:3389-402 (1997); каждый из которых включен в настоящее описание в качестве ссылки. "Соответствующие" положения аминокислот в двух, по существу, идентичных аминокислотных последовательностях представляют собой положения, выравниваемые любым программным обеспечением для анализа белка, упомянутым в настоящем описании, как правило, с использованием параметров по умолчанию."Выделенная" молекула представляет собой молекулу, которая является преобладающей разновидностью в композиции, где она находится, относительно класса молекул, к которому она принадлежит(т.е. она составляет по меньшей мере приблизительно 50% этого типа молекул в композиции и, как правило, составляет вплоть до по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, или более этой разновидности молекул, например пептидов, в композиции). Обычно композиция молекулы пептида проявляет 98-99% однородность для пептидных молекул в контексте всех присутствующих разновидностей пептидов в композиции или по меньшей мере в отношении, по существу, активных разновидностей пептидов в контексте предполагаемого применения. Термин "линейная последовательность", как используют в рамках изобретения, относится к конкретной последовательности аминокислот, соединенных стандартными пептидными связями в стандартном направлении от N- к С-концу. Пептид может содержать только пептидные связи. Однако термин не исключает того, что аминокислота в последовательности, как, например, в X3, может быть связана, например, через боковые цепи с другой аминокислотой в отдаленном положении в пептидной последовательности, таком как отдаленное положение в X3. В контексте настоящего изобретения "лечение" или "проведение лечения" относится к предупреждению, смягчению, управлению течением, излечению или уменьшению одного или нескольких симптомов клинических значимых проявлений заболевания или нарушения, если контекст не указывает на иное. Например, "лечение" пациента, у которого не было идентифицировано симптомов или клинически значимых проявлений заболевания или нарушения, представляет собой превентивную или профилактическую терапию, в то время как "лечение" пациента, у которого симптомы или клинически значимые проявления заболевания или нарушения были идентифицированы, как правило, не является превентивной или профилактической терапией. Термин "антиген" обозначает вещество, которое распознается специфично распознающими компонентами (антитела, Т-клетки) иммунной системы. Термин "иммуноген" в контексте настоящего изобретения обозначает вещество, которое способно индуцировать адаптивный иммунный ответ у индивидуума, где указанный адаптивный иммунный ответ нацелен на иммуноген. В отношении настоящего изобретения иммуноген индуцирует гуморальный и/или клеточно-опосредуемый иммунный ответ. Иными словами, иммуноген представляет собой антиген, который способен индуцировать иммунитет. Термины "эпитоп", "антигенная детерминанта" и "антигенный центр" используют в настоящем описании взаимозаменяемо, и они обозначают область в антигене или иммуногене, которая распознается антителами (в случае связывающих антитело эпитопов, также известных как "В-клеточные эпитопы") или Т-клеточными рецепторами, когда эпитоп образует комплекс с молекулой основного комплекса гистосовместимости (МНС) (в случае связывающих эпитопов Т-клеточного рецептора, т.е. "Т-клеточных эпитопов"). Термин "иммуногенно эффективное количество" имеет его обычное значение в данной области, т.е. количество иммуногена, которое способно индуцировать иммунный ответ, который, по существу, направлен на патогенные агенты, которые обладают общими иммунологическими признаками с иммуногеном. Термин "вакцина" используют для композиции, содержащей иммуноген, и которая способна индуцировать иммунный ответ, который либо способен снижать риск развития патологического состояния,либо способен индуцировать терапевтически эффективный иммунный ответ, который может способствовать излечению (или, по меньшей мере, смягчению симптомов) патологического состояния. Термин "фармацевтически приемлемый" имеет его обычное значение в данной области, т.е. его используют для вещества, которое может быть допущено в качестве части лекарственного средства для применения у человека при лечении рассматриваемого заболевания и, таким образом, термин, по существу, исключает использование высокотоксичных веществ, которые могут ухудшить, а не улучшить состояние подвергаемого лечению индивидуума."Эпитоп Т-хелперных лимфоцитов" (ТН-эпитоп) представляет собой пептид, который связывает молекулу МНС класса II и может представляться на поверхности антигенпредставляющей клетки (АРС),связанной с молекулой МНС класса II. "Иммунологический носитель", как правило, представляет собой вещество, которое включает один или несколько ТН-эпитопов, и которое увеличивает иммунный ответ против антигена, с которым оно сопряжено, путем обеспечения активации и пролиферации Т-хелперных лимфоцитов. Примерами известных иммунологических носителей являются столбнячный и дифтерийный токсоиды и гемоцианин лимфы улитки (KLH). В конструкции каркаса в соответствии с настоящим изобретением X2 и X4 обозначает последовательность из 8-30 аминокислот, как, например, 8-20 аминокислот, происходящую из антигена. Эта последовательность аминокислот, происходящая из антигена, в настоящем описании может называться эпитопом. Предпочтительно эпитопы, используемые в каркасе в соответствии с настоящим изобретением,представляют собой эпитопы CTL. "Индуцирующий CTL пептид" представляет собой связывающий пептид HLA класса I, который способен индуцировать ответ CTL. В других вариантах осуществления эпитопы, используемые в каркасной конструкции в соответствии с настоящим изобретением, представляют собой индуцируемые HTL пептиды. "Индуцируемый HTL пептид" представляет собой связывающий пептид HLA класса II, который способен индуцировать ответ HTL. Термин "основная аминокислота", как используют в рамках изобретения, относится к любой аминокислоте, включающей как природные, так и неприродные аминокислоты, которые имеют изоэлектрическую точку выше 6,3 (как например, выше 7,4) при измерении в соответствии с KiceMarvell "ModernPrinciples of organic Chemsitry" (Macmillan, 1974) или Matthews и van Holde "Biochemistry" Cummings Publishing Company, 1996. В это определение включены аргинин, лизин, гомоаргинин (Har) и гистидин, а также их производные. Подходящие неприродные аминокислоты представляют собой аминокислоты,например, как описано в US 6858396. Подходящие положительно заряженные аминокислоты включают неприродные альфа-аминокислоты, доступные от Bachem AG, и включают альфа-аминоглицин, альфа,гамма-диаминомасляную кислоту, орнитин, альфа, бета-диаминопропионовую кислоту, альфадифторметилорнитин, 4-аминопиперидин-4-карбоновую кислоту, 2,6-диамино-4-гексиновую кислоту,бета-(1-пиперазинил)аланин, 4,5-дегидролизин, дельта-гидроксилизин, омега-гидроксинораргинин, гомоаргинин, омега-аминоаргинин, омега-метиларгинин, альфа-метилгистидин, 2,5-дийодгистидин, 1 метилгистидин,3-метилгистидин,бета-(2-пиридил)аланин,бета-(3-пиридил)аланин,бета-(2 хинолил)аланин, 3-аминотирозин, 4-аминофенилаланин и спинацин. Более того, любая моно- или дикарбоновая аминокислота представляет собой подходящую положительно заряженную аминокислоту. Термин "нейтральная аминокислота", как используют в рамках изобретения, относится к аминокислоте, которая имеет изоэлектрическую точку от 4,8 до 6,3 при измерении в соответствии с KiceMarvell"Modern Principles of organic Chemsitry" (Macmillan, 1974). Термин "кислотная аминокислота", как используют в рамках изобретения, относится к аминокислоте, которая имеет изоэлектрическую точку ниже 4,8 при измерении в соответствии с KiceMarvell "Modern Principles of organic Chemsitry" (Macmillan,1974). Если нет иных указаний, аминокислоты сокращенно обозначены и упоминаются с помощью их стандартной номенклатуры, известной специалисту в данной области, как например, "Nomenclature andsymbolism for amino acids and peptides" от Международного союза теоретической и прикладной механики(IUPAC) (www.iupac.org). Цитруллин (в этом документе обозначаемый однобуквенным обозначением "В") и/или гомоцитруллин представляют собой хорошо известные неприродные аминокислоты, которые в некоторых вариантах осуществления можно использовать в последовательности, определяемой X1, X3 или X5. В других альтернативных вариантах осуществления триптофан или производные триптофана используют в последовательности, определяемой X1, X3 или X5. Можно использовать любые подходящие производные триптофана. Как используют в рамках изобретения, "производные триптофана" обозначает неприродный модифицированный аминокислотный остаток триптофана, включающий аминокислотные остатки, описанные в US 7232803, такие как три-трет-бутилтриптофан, ди-трет-бутилтриптофан, 7 бензилокситриптофан, гомотриптофан, 5'-аминоэтилтриптофан (доступный в качестве производного боковой цепи Boc и N-альфа FMOC от RSP Amino Acids Analogues Inc, Boston, Mass., США), Nацетилгомотриптофан (Toronto Research), 7-бензилокситриптофан (Toronto Research), гомотриптофан(Toronto Research), и остатки триптофана, которые замещены в 1, 2, 5 и/или 7 положении индольного кольца, причем положения 1 или 2 являются предпочтительными, например, 5'-гидрокситриптофан. Термин "антительный ответ" относится к продукции антител (например, IgM, IgA, IgG), которые связываются с представляющим интерес антигеном; этот ответ измеряют, например, путем анализа сыворотки с помощью ELISA для антигена. Термин "адъювант", как используют в рамках изобретения, относится к любому соединению, которое, когда его доставляют вместе или одновременно с антигеном, неспецифически усиливает иммунный ответ на этот антиген. Иллюстративные адъюванты включают, но не ограничиваются ими, адъюванты типа "масло-в-воде" и адъюванты типа "вода-в-масле", адъюванты на основе алюминия (например,AlOH, AlPO4, и т.д.) и Montanide ISA 720. Термины "пациент" и "индивидуум" относятся к млекопитающему, которое можно лечить с использованием способов по настоящему изобретению. Как используют в рамках изобретения, термин "иммунный ответ" относится к реактивности иммунной системы организма в ответ на антиген. У позвоночных он может вовлекать продукцию антител,индукцию клеточно-опосредуемого иммунитета и/или активацию комплемента (например, явление, ассоциированное с профилактикой и устранением инфекции микроорганизмами иммунной системой позвоночных). В предпочтительных вариантах осуществления термин иммунный ответ охватывает, но не ограничивается ими, одно или несколько из "пролиферативного ответа лимфоцитов", "ответа цитокинов" и "ответа антител". Термин "суммарный заряд", как используют в рамках изобретения в отношении пептидной последовательности, относится к общему электрическому заряду пептидной последовательности, соответствующему сумме зарядов каждой отдельной аминокислоты в пептидной последовательности, где каждая основная аминокислота имеет заряд +1, каждая кислотная аминокислота имеет заряд -1, и каждая нейтральная аминокислота имеет заряд 0. Таким образом, суммарный заряд зависит от количества и типа заряженных аминокислот. Таблица 1 Конкретные пептиды по изобретению Таблица 2 Конкретные пептиды по изобретению Как используют здесь, однобуквенное обозначение "Z" относится к неприродной аминокислоте норлейцину. Антигены. Примеры вирусных антигенов для применения в рамках настоящего изобретения включают, но не ограничиваются ими, например, антигены ВИЧ, HCV, CMV, HPV, вируса гриппа, аденовирусов, ретровирусов, пикорнавирусов и т.д. Неограничивающим примером являются ретровирусные антигены, такие как ретровирусные антигены из вируса иммунодефицита человека (ВИЧ), такие как продукты генов gag, pol и env, белок Nef,обратная транскриптаза и другие компоненты ВИЧ; антигены вируса гепатита, такие как белки S, М и L вируса гепатита В, пре-S антиген вируса гепатита В, и других вирусов гепатита, например гепатита А, В и С, компоненты вирусов, такие как РНК вируса гепатита С; антигены вируса гриппа, такие как гемагглютинин и нейраминидаза и другие компоненты вируса гриппа; антигены вируса кори, такие как слитый белок вируса кори и другие компоненты вируса кори; антигены вируса краснухи, такие как белки Е 1 и Е 2 и другие компоненты вируса краснухи; ротавирусные антигены, такие как VP7sc и другие ротавирусные компоненты; антигены цитомегаловируса, такие как гликопротеин В оболочки и другие антигенные компоненты цитомегаловируса; антигены респираторно-синцитиального вируса, такие как слитый белокRSV, белок М 2 и другие антигенные компоненты респираторно-синцитиального вируса; вирусные антигены простого герпеса, такие как предранние белки, гликопротеин D, и другие антигенные компоненты вируса простого герпеса; вирусные антигены ветряной оспы, такие как gpl, gpll и другие антигенные компоненты вируса ветряной оспы; антигены вируса японского энцефалита, такие как белки Е, М-Е, ME-NS1, NS1, NS1-NS2A, 80% Е, и другие антигенные компоненты вируса японского энцефалита; антигены вируса бешенства, такие как гликопротеин вируса бешенства, нуклеопротеин вируса бешенства и другие антигенные компоненты вируса бешенства. См. Fundamental Virology, Second Edition, eds. Fields,B.N. и Knipe, D.M. (Raven Press, New York, 1991) для дополнительных примеров вирусных антигенов. Эпитопы, подлежащие включению в каркасную конструкцию в соответствии с настоящим изобретением, могут происходить из аденовируса, ретровируса, пикорнавируса, вируса герпеса, ротавируса,хантавируса, коронавируса, тогавируса, флавивируса, рабдовируса, парамиксовируса, ортомиксовируса,буньявируса, аренавируса, реовируса, вируса папилломы, парвовируса, поксвируса, гепаднавируса или вируса спонгиоформной энцефалопатии. В определенных конкретных неограничивающих примерах вирусные антигены представляют собой пептиды, происходящие по меньшей мере из одного из ВИЧ,CMV, гепатита А, В и С, вируса гриппа, вируса кори, вируса полиомиелита, вируса оспы, вируса краснухи; респираторно-синцитиального вируса, вируса герпеса, вируса ветряной оспы, вируса Эпштейна-Барр,вируса японского энцефалита, вируса бешенства, вируса гриппа и/или вирусов простудных заболеваний.HCV. Пептиды в соответствии с настоящим изобретением могут содержать известный антиген. В случае антигенов, происходящих из HCV, эти антигены могут происходить из корового белка, Е 1, Е 2, Р 7, NS2,NS3, NS4 (NS4A и NS4B) и NS5 (NS5A и NS5B) вируса гепатита С (HCV). Эпитопы представляют собой эпитопы, которые индуцируют ограниченный по HLA класса I и/или класса II ответ Т-лимфоцитов в иммунизированном хозяине. Более конкретно, ограниченные по HLA класса I пептиды по настоящему изобретению могут связываться по меньшей мере с одной молекулой HLA следующих групп HLA класса:HLA-A01, HLA-A02, HLA-A03, HLA-A11, HLA-A24, HLA-B07, HLA-B08, HLA-B35, HLAB40, HLA-B44, HLA-Cw3, HLA-Cw4, HLA-Cw6 или HLA-Cw7. Ограниченные по HLA класса II пептиды по настоящему изобретению могут связываться по меньшей мере с одной молекулой HLA следующих групп HLA класса II: HLA-DRB1, -DRB2, -DRB3, -DRB4, -DRB5, -DRB6, -DRB7, -DRB8 или -DRB9. Связывающиеся с МНС пептиды HCV, которые можно использовать в соответствии с настоящим изобретением в качестве эпитопов, описаны, например, в WO 02/34770 (Imperial College Innovations Ltd.),WO 01/21189 и WO 02/20035 (Epimmune), WO 04/024182 (Intercell), WO 95/25122 (The Scripps ResearchInstitute), WO 95/27733 (Government of the USA, Department of Health и Human Services), EP 0935662 (Chiron), WO 02/26785 (Immusystems GmbH), WO 95/12677 (Innogenetics N.V), WO 97/34621 (Cytel Corp) и ЕР 1652858 (Innogenetics N.V.). В других вариантах осуществления каркасная конструкция в соответствии с настоящим изобретением содержит пептид PADRE, такой как универсальный Т-клеточный эпитоп, называемый PADRE, как описано в WO 95/07707 (Epimmune), содержание которой включено в настоящее описание в качестве ссылки. "Связывающий пептид PanDR или пептид PADRE" является представителем семейства молекул,которые связывают более одной молекулы DR HLA класса II. PADRE связывается с большинством молекул HLA-DR и стимулирует хелперные Т-лимфоциты человека (HTL) in vitro и in vivo. Альтернативно можно использовать эпитопы Т-хелперов из универсально используемых вакцин, такие как столбнячный токсоид. В следующем варианте осуществления пептиды в композиции или плейотропном пептиде характеризуются тем, что они происходят из белка HCV, или, более конкретно, по меньшей мере из одной из следующих областей HCV, выбранных из группы, состоящей из корового белка, E1, E2/NS1, NS2, NS3,NS4A, NS4B, NS5A и NS5B. Еще более предпочтительным является то, что пептиды характеризуются тем, что они присутствуют в консенсусной последовательности HCV генотипа 1a, 1b и/или 3 а. Другие связывающие HLA класса I и II пептиды, которые можно использовать в соответствии с изобретением, можно идентифицировать способом, как описано в WO 03/105058 Algonomics, способом,как описано Epimmune в WO 01/21189, и/или тремя общедоступными прогнозирующими серверами с базами данных, соответственно, Syfpeithi, BIMAS и nHLAPred. Также аспектом настоящего изобретения является то, что каждый пептид можно использовать в каркасной конструкции по изобретению в комбинации с тем же пептидом в качестве многократных повторов или с любым другим пептидом(ами) или эпитопом(ами).CMV. Эпитопы, подлежащие включению в каркасную конструкцию в соответствии с настоящим изобретением, могут происходить из цитомегаловируса (CMV), включая гликопротеины gB и gH CMV. Вирус гриппа. Эпитопы, подлежащие включению в каркасную конструкцию в соответствии с настоящим изобретением, могут происходить из фрагментов или частей гемагглютинина (НА) вируса гриппа или нейраминидазы (NA) вируса гриппа, нуклеопротеина (NP), M1, М 2, NS1, NEP, PA, PB1, PB1-F2, РВ 2 для каждой из подгрупп, таких как H1N1, H2N2 или H3N2. Подходящие эпитопы могут происходить из белка НА одного или более одного подтипа, включаяH1, Н 2, Н 3, Н 4, Н 5, Н 6, Н 7, Н 8, Н 9, Н 10, Н 11, Н 12, Н 13, Н 14, Н 15 или Н 16 или их фрагмент или часть. Примеры подтипов, содержащих такие белки НА, включают A/New Caledonia/20/99 (H1N1),A/Indonesia/5/2006 (H5N1), A/chicken/New York/1995, A/herring gull/DE/677/88 (H2N8), A/Texas/32/2003,A/mallard/MN/33/00, A/duck/Shanghai/1/2000, A/northern pintail/TX/828189/02, A/Turkey/Ontario/6118/68(H2N2), A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1), A/Teal/HongKong/W312/97 (H6N1),A/Equine/Prague/56 (H7N7), A/HongKong/1073/99 (H9N2. В некоторых вариантах осуществления изобретения белок НА может быть подтипа H1, Н 2, Н 3, Н 5,Н 6, Н 7 или Н 9. В других вариантах осуществления белок H1 может быть из штамма A/NewCaledonia/20/99 (H1N1), A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1) или A/Solomon Islands 3/2006 (H1N1). Белок Н 3 также может быть из штамма A/Brisbane 10/2007 (H3N2) илиA/Wisconsin/67/2005 (H3N2). В других вариантах осуществления белок Н 2 может быть из штаммаA/Singapore/1/57 (H2N2). Белок Н 5 может быть из штамма A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004(H5N1) или A/Indonesia/5/2005. В других вариантах осуществления белок Н 6 может быть из штаммаA/Teal/HongKong/W312/97 (H6N1). Белок Н 7 может быть из штамма A/Equine/Prague/56 (H7N7). В других вариантах осуществления белок Н 9 представляет собой белок из штамма A/HongKong/1073/99(H9N2). В других вариантах осуществления белок НА может быть из вируса гриппа типа В, включаяB/Malaysia/2506/2004 или B/Florida/4/2006. Белок вируса гриппа НА может представлять собой Н 5 Indonesia. Вирус иммунодефицита человека (ВИЧ). В случае ВИЧ эпитопы, подлежащие включению в каркасную конструкцию в соответствии с настоящим изобретением, могут происходить из группы, состоящей из gp120, gp160, gp41, р 24gag или р 55gag, происходящих из ВИЧ, включая представителей различных генетических подтипов. Вирус папилломы человека (HPV). В случае HPV эпитопы, подлежащие включению в каркасную конструкцию в соответствии с настоящим изобретением, могут происходить из группы, состоящей из белков Е 1, Е 2, Е 3, Е 4, Е 6 и Е 7, L1 иL2. Эпитопы могут происходить из любого типа, включая типы 8, 11, 16, 18, 31, 33, 35, 39, 45, 51, 52, 56,58 и 59. Носители, адъюванты и наполнители - доставка. Выделенные проникающие в клетку пептиды в соответствии с изобретением можно доставлять с помощью различных способов и в различных композициях, называемых в настоящем описании "композициями", "вакцинными композициями" или "фармацевтическими композициями". Пептиды по настоящему изобретению и фармацевтические, и вакцинные композиции по изобретению пригодны для введения млекопитающим, в частности человеку, для лечения и/или профилактики вирусной инфекции. Вакцинные композиции, содержащие пептиды по изобретению, вводят пациенту, инфицированному представляющим интерес вирусом, или индивидууму, чувствительному к или имеющему иной риск вирусной инфекции для индукции иммунного ответа против конкретных антигенов и, таким образом, усиления способностей собственного иммунного ответа пациента. Для доставки пептидов в соответствующие клетки можно использовать различные признанные в данной области системы для доставки. Пептиды можно доставлять в фармацевтически приемлемом носителе или в качестве коллоидных суспензий, или в качестве порошков, с разбавителями или без них. Они могут быть "голыми" или ассоциированными с носителями и их можно доставлять с использованием систем для доставки, известных в данной области."Фармацевтически приемлемый носитель" или "фармацевтически приемлемый адъювант" представляет собой любой подходящий эксципиент, разбавитель, носитель и/или адъювант, которые сами по себе не индуцируют продукцию антител, вредоносных для индивидуума, которому вводят композицию,но также они не индуцируют защиту. Предпочтительно фармацевтически приемлемый носитель или адъювант усиливает иммунный ответ, индуцируемый антигеном. Подходящие носители или адъюванты,как правило, включают одно или несколько соединений, включенных в следующий неполный список: крупные медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы; гидроксид алюминия, фосфат алюминия (см. публикацию международной патентной заявкиWO 93/24148), квасцы (KAl(SO4)2,12H2O), или один из них в комбинации с 3-Одеацилированным монофосфориллипидом А (см. публикацию международной патентной заявкиWO 93/19780); N-ацетил-мурамил-L-треонил-D-изоглутамин (см. патент США 4606918), N-ацетилнормурамил-L-аланил-D-изоглутамин,N-ацетилмурамил-L-аланил-D-изоглутамил-L-аланин-2-(1',2'дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин; RIBI (ImmunoChem Research Inc., Hamilton, MT, США), который содержит монофосфориллипид А (т.е. детоксисфицированный эндотоксин),трегалозо-6,6-димиколат и скелет клеточной стенки (MPL + TDM + CWS) в 2% эмульсии сквален/Tween 80. Любой из трех компонентов MPL, TDM или CWS также можно использовать отдельно или в комбинации по 2: адъюванты такие как Stimulon (Cambridge Bioscience, Worcester, MA, USA), SAF-1 (Syntex); адъюванты, такие как комбинации QS21 и 3-де-О-ацетилированного монофосфориллипида А (см. международную заявкуWO 94/00153), которые далее могут быть дополнены эмульсией типа "масло-вводе" (см., например, международные заявкиWO 95/17210, WO 97/01640 и WO 9856414), в которых эмульсия типа "масло-в-воде" содержит метаболизирующееся масло и сапонин, или метаболизирующееся масло, сапонин и стерин, или которые далее могут быть дополнены цитокином (см. международную заявкуWO 98/57659); адъюванты, такие как MF-59 (Chiron), или адъюванты на основе поли[ди(карбоксилатофенокси)фосфазена] (Virus Research Institute); адъюванты на основе блоксополимеров, такие как Optivax (Vaxcel, Cytrx) или адъюванты на основе инулина, такие как Algammulin и Gammalnulin (Anutech); полный или неполный адъювант Фрейнда (CFA или IFA соответственно) или препараты Gerbu (Gerbu Biotechnik); сапонин, такой как QuilA, очищенный сапонин, такой как QS21,QS7 или QS17, эсцин или дигитонин; иммуностимулирующие олигонуклеотиды, содержащие неметилированные CpG-динуклеотиды, такие как олигонуклеотиды [пурин-пурин-CG-пиримидин-пиримидин]. Эти иммуностимулирующие олигонуклеотиды включают молекулы CpG класса А, В, и С (Coley Pharmaceuticals), ISS (Dynavax), Immunomers (Hybridon). Иммуностимулирующие олигонуклеотиды также можно комбинировать с катионными пептидами, как описано, например, Riedl et al. (2002); иммуностимулирующие комплексы, содержащие сапонины, например, Quil A (ISCOMS); эксципиенты и разбавители,которые в своей основе являются нетоксичными и нетерапевтическими, такие как вода, солевой раствор,глицерин, этанол, изопропиловый спирт, DMSO, смачивающие средства или эмульгаторы, рН-буферные вещества, консерванты и т.п.; биологически деградируемое и/или биосовместимое масло, такое как сквалан, сквален, эйкозан, тетратетраконтан, глицерин, арахисовое масло, растительное масло, в концентрации, например, 1-10% или 2,5-5%; витамины, такие как витамин С (аскорбиновая кислота или ее соли или сложные эфиры), витамин Е (токоферол), или витамин А; каротиноиды или природные или синтетические флаваноиды; микроэлементы, такие как селен; любой лиганд Toll-подобного рецептора, как рассмотрено в Barton and Medzhitov (2002). В любых из вышеупомянутых адъювантов, содержащих 3-де-О-ацетилированный монофосфориллипид А, указанный 3-де-О-ацетилированный монофосфориллипид А может образовывать небольшие частицы (см. международную заявкуWO 94/21292). В любом из упомянутых выше адъювантов MPL или 3-де-О-ацетилированный монофосфориллипид А могут быть заменены синтетическим аналогом, называемым RC-529, или любым другим аминоалкилглюкозаминид-4-фосфатом (Johnson et al. 1999, Persing et al. 2002). Альтернативно он может быть замен другими аналогами липида А, такими как ОМ-197 (Byl et al. 2003)."Фармацевтически приемлемый носитель" включает носители, такие как вода, солевой раствор, физиологические солевые растворы, глицерин, этанол и т.д. В такие носители могут быть включены вспомогательные вещества, такие как смачивающие вещества или эмульгаторы, рН-буферные вещества, консерванты. Системы для доставки, известные в данной области, представляют собой, например, липопептиды, пептидные композиции, инкапсулированные в сополимер DL-лактида и гликолида ("PLG"), микросферы, пептидные композиции, содержащиеся в иммуностимулирующих комплексах (ISCOMS), множественные антигенные пептидные системы (MAPs), векторы для доставки вирусов, частицы вирусного или синтетического происхождения, адъюванты, липосомы, липиды, микрочастицы или микрокапсулы,частицы золота, наночастицы, полимеры, конденсирующие агенты, полисахариды, полиаминокислоты,дендримеры, сапонины, QS21, усиливающие всасывание материалы, жирные кислоты или, голые или абсорбированные на частицы кДНК. Как правило, вакцину или вакцинную композицию получают в качестве инъцируемого вещества, в качестве либо жидкого раствора, либо суспензии. Инъекция может быть подкожной, внутримышечной,внутривенной, внутрибрюшинной, интратекальной, внутрикожной или внутриэпидермальной. Другие типы введения включают электропорацию, имплантацию, суппозитории, пероральный прием, введение в кишечник, ингаляцию, распыление или назальный спрей или капли. Также можно получать твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Препарат также можно эмульгировать или инкапсулировать в липосомы для усиления адъювантного эффекта. Жидкий состав может включать масла, полимеры, витамины, углеводы, аминокислоты, соли, буферы, альбумин, поверхностно-активные вещества или наполнители. Предпочтительно углеводы включают сахар или спирты сахаров, такие как моно-, ди-, три-, олиго- или полисахариды, или растворимые в воде глюканы. Сахариды или глюканы могут включать фруктозу, декстрозу, лактозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, сахарозу, декстран, пуллулан, декстрин, альфа- и бета-циклодекстрин, растворимый крахмал, гидроксиэтилкрахмал и карбоксиметилцеллюлозу или их смеси. Сахароза является наиболее предпочтительной. "Спирт сахара" определяют как С 4-С 8 углеводород, имеющий -ОН группу, и он включает галактит, инозитол, маннит, ксилит, сорбит, глицерин и арабит. Маннит является наиболее предпочтительным. Эти сахара или спирты сахаров, упомянутые выше, можно использовать по отдельности или в комбинации. Отсутствует фиксированный предел используемого количества при условии,что сахар или спирт сахара является растворимым в водном препарате. Предпочтительно концентрация сахара или спирта сахара составляет от 1,0 до 7,0% (мас./об.), более предпочтительно от 2,0 до 6,0%(мас./об.). Предпочтительно аминокислоты включают левовращающие (L) формы карнитина, аргинина и бетаина; однако можно добавлять другие аминокислоты. Предпочтительные полимеры включают поливинилпирролидон (PVP) со средней молекулярной массой от 2000 до 3000 или полиэтиленгликоль (PEG) со средней молекулярной массой от 3000 до 5000. Также предпочтительно использовать в композиции буфер для минимизации изменений рН в растворе до лиофилизации или после восстановления. Можно использовать любой физиологический буфер, однако предпочтительными являются цитратные, фосфатные, сукцинатные и глутаматные буферы и их смеси. Наиболее предпочтительным является цитратный буфер. Предпочтительно концентрация составляет 0,01-0,3 моль/л. Поверхностно-активные вещества,которые можно добавлять в состав, представлены в патентных заявках ЕРЕР 0270799 и ЕР 0268110. Кроме того, полипептиды можно химически модифицировать путем ковалентной конъюгации с полимером для увеличения их времени полужизни в кровотоке. Предпочтительные полимеры и способы их присоединения представлены в патентах США 4766106; 4179337; 4495285 и 4609546. Предпочтительными полимерами являются полиоксиэтилированные полиолы и полиэтиленгликоль (PEG). PEG растворим в воде при комнатной температуре и имеет общую формулу: R(O-CH2-CH2)nO-R, где R может представлять собой водород или защитную группу, такую как алкильная или алканольная группа. Предпочтительно защитная группа имеет от 1 до 8 атомов углерода, более предпочтительно она представляет собой метил. Обозначение n представляет собой положительное целое число, предпочтительно от 1 до 1000,более предпочтительно от 2 до 500. PEG имеет предпочтительную среднюю молекулярную массу от 1000 до 40000, более предпочтительно от 2000 до 20000, наиболее предпочтительно от 3000 до 12000. Предпочтительно PEG имеет по меньшей мере одну гидроксигруппу, более предпочтительно она представляет собой концевую гидроксигруппу. Именно эту гидроксигруппу предпочтительно активируют. Однако понятно, что тип и количество реакционноспособных групп можно варьировать для достижения ковалентно конъюгированного PEG/полипептида по настоящему изобретению. Растворимые в воде полиоксиэтилированные полиолы также пригодны в рамках настоящего изобретения. Они включают полиоксиэтилированный сорбит, полиоксиэтилированную глюкозу, полиоксиэтилированный глицерин (POG) и т.д. Предпочтительным является POG. Одной из причин является то,что глицериновый каркас полиоксиэтилированного глицерина представляет собой тот же каркас, который встречается в природе, например у животных и человека, в моно-, ди-, триглицеридах. Таким обра- 14025152 зом, это ветвление не обязательно будет восприниматься как чужеродный агент в организме. POG имеет предпочтительную молекулярную массу в том же диапазоне, что и PEG. Структура POG представлена вKnauf et al., 1988, и обсуждение конъюгатов POG/IL-2 представлено в патенте США 4766106. Другой системой для доставки лекарственного средства для увеличения его полужизни в кровотоке является липосома. Пептиды и нуклеиновые кислоты по изобретению также можно вводить через липосомы, которые служат для нацеливания на конкретную ткань, такую как лимфоидная ткань, или для нацеливания селективино на инфицированные клетки, а также для увеличения времени полужизни композиции пептида и нуклеиновых кислот. Липосомы включают эмульсии, пены, мицеллы, нерастворимые монослои, жидкие кристаллы, дисперсиии фосфолипидов, многослойные структуры и т.п. В этих препаратах пептид или нуклеиновые кислоты, подлежащие доставке, включены в качестве части липосомы или погружены отдельно или совместно с молекулой, которая связывается с рецептором, преобладающим среди лимфоидных клеток, такой как моноклональные антитела, которые связываются с антигеномCD45 или с другими терапевтическими или иммуногенными композициями. Таким образом, липосомы,либо заполненные, либо покрытые желательным пептидом или нуклеиновыми кислотами по изобретению, можно направлять в область лимфоидных клеток, где липосомы затем доставляют композиции пептида и нуклеиновых кислот. Липосомы для применения в соответствии с изобретением образованы из стандартных образующих везикулы липидов, которые, как правило, включают нейтральные и отрицательно заряженные фосфолипиды и стерин, такой как холестерин. Выбор липидов, как правило, определяется, например, размером липосом, устойчивостью к кислотам и стабильностью липосом в кровотоке. Для получения липосом доступны различные способы, как описано, например, в Szoka et al/, 1980, и патентах США 4235871, 4501728, 4837028 и 5019369. Для нацеливания на клетки иммунной системы лиганд, подлежащий включению в липосому, может включать, например, антитела или их фрагменты, специфичные к детерминантам клеточной поверхности желаемых клеток иммунной системы. Суспензию липосом, содержащую пептид, можно вводить внутривенно, локально, местно и т.д. в дозе, которая варьирует в зависимости, среди прочих, от способа введения, пептида, подлежащего доставке, и стадии заболевания, подвергаемого лечению. Например, известно, что липосомы, несущие любые иммунногенные полипептиды, индуцируют ответы CTL in vivo (Reddy et al., 1992; Collins et al., 1992; Fries et al., 1992; Nabel et al., 1992). После получения жидкой фармацевтической композиции ее предпочтительно лиофилизируют для предупреждения деградации и сохранения стерильности. Способы лиофилизации жидких композиций известны средним специалистам в данной области. Непосредственно перед применением композицию можно восстанавливать с помощью стерильного разбавителя (раствор Рингера, дистиллированная вода,или стерильный солевой раствор, например), который может включать дополнительные ингредиенты. После восстановления композицию предпочтительно вводят индивидуумам с использованием способов,известных специалистам в данной области. Применение пептидов для оценки иммунных ответов Пептиды в соответствии с настоящим изобретением можно использовать в качестве диагностических реагентов. Например, пептид по изобретению можно использовать для определения чувствительности конкретного индивидуума к режиму лечения, в котором используется пептид или родственные пептиды, и, таким образом, он может быть полезен для модификации существующего протокола лечения или для определения прогноза для больного индивидуума. Кроме того, пептиды также можно использовать для предсказания того, какие индивидуумы будут иметь существенный риск развития хронической вирусной инфекции. Таким образом, настоящее изобретение относится к способу определения исхода для индивидуума,подвергнутого воздействию вируса, включающему стадию определения того, имеет ли индивидуум иммунный ответ на один или несколько пептидов в соответствии с настоящим изобретением. В предпочтительном варианте осуществления изобретения пептиды, как описано в настоящем описании, можно использовать в качестве реагентов для оценки иммунного ответа. Иммунный ответ, подлежащий оценке, можно индуцировать с использованием в качестве иммуногена любого агента, который может приводить к образованию специфических CTL или HTL, которые распознают и связываются с пептидом(ами), подлежащим применению в качестве реагента. В качестве иммуногена не обязательно использовать пептидный реагент. Системы анализа, которые можно использовать для такого анализа,включают относительно новые технические разработки, такие как тетрамеры, окрашивание внутриклеточных лимфокинов и анализы высвобождения интерферона, или анализы ELISPOT. Например, пептиды по настоящему изобретению можно использовать в анализах окрашивания тетрамеров для оценки мононуклеарных клеток периферической крови на присутствие антигенспецифических CTL после воздействия антигена опухолевых клеток или иммуногена. Тетрамерный комплекс HLA используют, чтобы прямо визуализировать специфичные к антигену CTL (см., например, Ogg et al., 1998; и Altman et al., 1996) и определить долю популяции антигенспецифических CTL в образце мононуклеарных клеток периферической крови. Реагент тетрамера с использованием пептида по изобретению можно получать следующим образом: пептид, который связывается с молекулой HLA, подвергают рефолдингу в присутствии соответствующей тяжелой цепи HLA и бета-2-микроглобулина с получением тримолеку- 15025152 лярного комплекса. В комплексе С-конец тяжелой цепи биотинилируют в участке, который был ранее встроен способами инженерии в белок. Затем индуцируют образование тетрамера путем добавления стрептавидина. С помощью флуоресцентно меченого стрептавидина тетрамер можно использовать для окрашивания антигенспецифических клеток. Затем клетки можно идентифицировать, например, проточной цитометрией. Такой анализ можно использовать для диагностических или прогностических целей. Клетки, идентифицированные с помощью такой методики, также можно использовать для терапевтических целей. В качестве альтернативы тетрамерам, также можно использовать пентамеры или димеры (Current Protocols in Immunology (2000)unit 17,2 supplement 35). Пептиды по изобретению также можно использовать в качестве реагентов для оценки иммунных ответов на повторную дозу (см., например, Bertoni et al., J. Clin. Invest. 100: 503-513, 1997 и Penna et al., J.Exp. Med. 174: 1565-1570, 1991). Например, образцы РВМС пациента от индивидуумов с инфекциейHCV можно анализировать на присутствие антигенспецифических CTL или HTL с использованием специфических пептидов. Образец крови, содержащий мононуклеарные клетки, можно оценивать путем культивирования РВМС и стимуляции клеток пептидом по изобретению. После соответствующего периода культивирования увеличенную в количестве популяцию клеток можно анализировать, например,на цитотоксическую активность (CTL) или на активность HTL. Пептиды также можно использовать в качестве реагентов для оценки эффективности вакцины. РВМС, полученные от пациента, вакцинированного иммуногеном, можно анализировать с использованием, например, любого из способов, описанных выше. Проводят типирование пациента по HLA и реагенты пептидных эпитопов, которые распознают аллелеспецифические молекулы, присутствующие у этого пациента, отбирают для анализа. На иммуногенность вакцины указывает присутствие специфичных к эпитопу CTL и/или HTL в образце РВМС. Пептиды по изобретению также можно использовать для получения антител с использованием способов, хорошо известных в данной области (см., например, CURRENT PROTOCOLS IN IMMUNOLOGY,Wiley/Greene, NY; и Antibodies A Laboratory Manual, Harlow и Lane, Cold Spring Harbor Laboratory Press,1989). Такие антитела включают антитела, которые распознают пептид в контексте молекулы HLA, т.е. антитела, которые связываются с комплексом пептид-МНС. Конкретные варианты осуществления изобретения Настоящее изобретение относится к выделенному проникающему в клетку пептиду, имеющему следующую структуру Х 1-Х 2-Х 3-X4-Х 5 (формула I),1 3 где X и X независимо определяют линейную последовательность любой из 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного; X2 определяет линейную последовательность из 8-30 аминокислот, происходящую из антигена; X4 определяет линейную последовательность из 8-30 аминокислот, происходящую из указанного антигена, причем указанная последовательность X4 отличается от X2; и X5 представляет собой любую необязательную аминокислоту, выбранную из основной аминокислоты, цитруллина, триптофана ли их производного. В некоторых конкретных вариантах осуществления последовательность X4 идентична последовательности X2. В некоторых вариантах осуществления выделенный проникающий в клетку пептид имеет всего не более 60 аминокислот. В некоторых вариантах осуществления X1 определяет линейную последовательность из любых 1, 2,3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, триптофана или их производного. В некоторых вариантах осуществления X1 определяет линейную последовательность в любом порядке одного цитруллина и любых 1, 2 или 3 аминокислот, независимо выбранных из любой основной аминокислоты, триптофана или их производного. В некоторых вариантах осуществления X3 определяет линейную последовательность любых 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты. В некоторых вариантах осуществления X1 определяет линейную последовательность любых 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты. В некоторых вариантах осуществления X3 определяет линейную последовательность в любом порядке из одного цитруллина и любых 1, 2 или 3 аминокислот, независимо выбранных из любой основной аминокислоты. В некоторых вариантах осуществления последовательность аминокислот, определяемая Х 2-Х 3-Х 4 формулы I, как определено в п.1, не встречается в нативной последовательности указанного антигена. В некоторых вариантах осуществления последовательность аминокислот, определяемая Х 1-Х 2-Х 34 Х формулы I, как определено в п.1, не встречается в нативной последовательности указанного антигена. В некоторых вариантах осуществления последовательность аминокислот, определяемая Х 1-Х 2-Х 3-Х 45 Х формулы I, как определено в п.1, не встречается в нативной последовательности указанного антигена. В некоторых вариантах осуществления показано, что пептид проходит через плазматическую мем- 16025152 брану в анализе на основе биотинилировния пептидов, как описано в примере 1. В некоторых вариантах осуществления 1, 2, 3 или 4 аминокислоты, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного, представляет собой основную аминокислоту. В некоторых вариантах осуществления 1, 2, 3 или 4 аминокислоты, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного, представляет собой триптофан или его производное. В некоторых вариантах осуществления 1, 2, 3 или 4 аминокислоты, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного, представляет собой цитруллин или его производное. В некоторых вариантах осуществления одна необязательная аминокислота, выбранная из основной аминокислоты, цитруллина, триптофана или их производного, выбрана из Arg, Lys и His.В. В некоторых вариантах осуществления необязательная аминокислота, выбранная из основной аминокислоты, цитруллина, триптофана или их производного, представляет собой триптофан или его производное. В некоторых вариантах осуществления одна необязательная аминокислота, выбранная из основной аминокислоты, цитруллина, триптофана или их производного, представляет собой цитруллин или его производное. В некоторых вариантах осуществления X2 и/или X4 определяют последовательность, идентичную нативной последовательности указанного антигена. В некоторых вариантах осуществления пептид способен индуцировать ответ Т-лимфоцитов. В некоторых вариантах осуществления пептид способен индуцировать ответ CD4+ и/или CD8+ Тлимфоцитов. В некоторых вариантах осуществления антиген представляет собой вирусный белок, такой как капсидный белок. В некоторых вариантах осуществления вирусный белок выбран из белка вируса гепатита С, такого как коровый белок; белка вируса гриппа, такого как белок М 2 белок. В некоторых вариантах осуществления вирусный белок вируса гепатита С выбран из консенсусной последовательности HCV генотипа 1, такого как подтипы 1 а и 1b, генотипа 2, такого как 2 а и 2b, и генотипа 3, такого как 3 а. В некоторых вариантах осуществления проникающий в клетку пептид состоит из 19-60 аминокислот, как, например, 20-60 аминокислот, как, например, 21-60 аминокислот, как, например, 22-60 аминокислот, как, например, 23-60 аминокислот, как, например, 24-60 аминокислот, как, например, 25-60 аминокислот, как, например, 26-60 аминокислот, как, например, 27-60 аминокислот, как, например, 28-60 аминокислот, как, например, 29-60 аминокислот, как, например, 30-60 аминокислот, как, например, 31-60 аминокислот, как, например, 32-60 аминокислот, как, например, 33-60 аминокислот, как, например, 34-60 аминокислот, как, например, 35-60 аминокислот. В некоторых вариантах осуществления проникающий в клетку пептид состоит из 18-60 аминокислот, как, например, 18-59 аминокислот, как, например, 18-58 аминокислот, как, например, 18-57 аминокислот, как, например, 18-56 аминокислот, как, например, 18-55 аминокислот, как, например, 18-54 аминокислот, как, например, 18-53 аминокислот, как, например, 18-52 аминокислот, как, например, 18-51 аминокислот, как, например, 18-50 аминокислот, как, например, 18-49 аминокислот, как, например, 18-48 аминокислот, как, например, 18-47 аминокислот, как, например, 18-46 аминокислот, как, например, 18-45 аминокислот, как, например, 18-44 аминокислот, как, например, 18-43 аминокислот, как, например, 18-42 аминокислот, как, например, 18-41 аминокислот, как, например, 18-40 аминокислот, как, например, 18-39 аминокислот, как, например, 18-38 аминокислот, как, например, 18-37 аминокислот, как, например, 18-35 аминокислот, как, например, 18-34 аминокислот, как, например, 18-33 аминокислот, как, например, 18-32 аминокислот, как, например, 18-31 аминокислот, как, например, 18-30 аминокислот, как, например, 18-29 аминокислот, как, например, 18-28 аминокислот, как, например, 18-27 аминокислот, как, например, 18-26 аминокислот, как, например, 18-25 аминокислот, как, например, 18-24 аминокислот, как, например, 18-23 аминокислот, как, например, 18-22 аминокислот, как, например, 18-21 аминокислот, как, например, 18-20 аминокислот, как, например, 18-19 аминокислот. В некоторых вариантах осуществления суммарный заряд X2 меньше или равен 0. В некоторых вариантах осуществления суммарный заряд X2 меньше или равен 0; и X1 и X3 определяют последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. В некоторых вариантах осуществления суммарный заряд X2 меньше или равен 0; и суммарный заряд X4 больше или равен 1. В некоторых вариантах осуществления суммарный заряд X2 меньше или равен 0; суммарный заряд 4X больше или равен 1; и X1 и X3 определяет последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. В некоторых вариантах осуществления суммарный заряд X2 и X4 меньше или равен 0.- 17025152 В некоторых вариантах осуществления суммарный заряд X2 и X4 меньше или равен 0; и X1 и X3 определяют последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. В некоторых вариантах осуществления суммарный заряд X2 и X4 больше или равен 1. В некоторых вариантах осуществления суммарный заряд X2 и X4 больше или равен 1, и X1 и X3 определяют последовательность из 1 или 2 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. В некоторых вариантах осуществления суммарный заряд X2 больше или равен 1; и суммарный заряд X4 меньше или равен 0. В некоторых вариантах осуществления суммарный заряд X2 больше или равен 1; суммарный заряд 4X меньше или равен 0; X1 определяет последовательность из 1 или 2 аминокислот с положительным зарядом; и X3 определяет последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. В некоторых вариантах осуществления основная аминокислота независимо выбрана из Arg, Lys иHis. В некоторых вариантах осуществления X2 и/или X4 содержит последовательность аминокислот, определяемую положениями 135-157 SEQ ID NO: 3, или ее фрагмент или вариант. В некоторых вариантах осуществления X2 и/или X4 состоит из последовательности, выбранной из или их фрагмента или варианта. В некоторых вариантах осуществления X2 и/или X4 состоят из последовательности, происходящей из аминокислотной последовательности, выбранной из или их фрагмента или варианта. В некоторых вариантах осуществления пептид по изобретению выбран из или их фрагмента или варианта. В некоторых вариантах осуществления пептид состоит из последовательности, выбранной из Необязательно с X5 на С-конце пептида, где X1, X3 и X5 относятся к X1, X3 и X5 формулы I. В некоторых вариантах осуществления пептид содержит один или несколько остатков цистеина. В некоторых вариантах осуществления пептид содержит внутримолекулярные связи, такие как внутримолекулярные дисульфидные (S-S) связи между двумя остатками cys. В других вариантах осуществления пептид содержит внутримолекулярные связи, такие как в форме ацилальной части (СОО-СН 2-ООС, COO-CHR-OOC или COO-CR2-OOC). В некоторых вариантах осуществления N- и/или С-концевая аминокислота в X2 представляет собой гидрофильную или полярную аминокислоту. В некоторых вариантах осуществления N-концевая аминокислота в X4 представляет собой гидрофильную или полярную аминокислоту. В некоторых вариантах осуществления пептид по изобретению имеет не более 58 аминокислот, как,например, не более 56, 54, 52, 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18 аминокислотных остатков. В некоторых вариантах осуществления X1 состоит из 2 или 3 аминокислот. В некоторых вариантах осуществления X1 состоит из WW, BR или RR. В некоторых вариантах осуществления X1 состоит из R или W. В некоторых вариантах осуществления X3 состоит из 2 или 3 аминокислот. В некоторых вариантах осуществления X3 состоит из WW, BR или RR. В некоторых вариантах осуществления X3 состоит из RRR, BRR или BRGR. В некоторых вариантах осуществления выделенный пептид по изобретению состоит из последовательности X2 или X4, как определено в табл. 1 или в 2. В некоторых вариантах осуществления выделенный пептид по изобретению содержит последовательность X2 и/или X4, как определено в табл. 1 или в 2, или ее фрагмент. В некоторых вариантах осуществления X2 определяет последовательность из 8-25 аминокислот,как, например, 8-20 аминокислот, как, например, 8-15 аминокислот, как, например, 8-11 аминокислот. В некоторых вариантах осуществления X2 определяет последовательность менее чем из 25, как, например, менее чем из 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7 или 6 аминокислот. В некоторых вариантах осуществления X2 определяет последовательность более чем из 8, как, например, более чем из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 аминокислот. В некоторых вариантах осуществления X4 определяет последовательность из 8-25 аминокислот,как, например, 8-20 аминокислот, как, например, 8-15 аминокислот, как, например, 8-11 аминокислот. В некоторых вариантах осуществления X4 определяет последовательность менее чем из 25, как, например, менее чем из 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7 или 6 аминокислот. В некоторых вариантах осуществления X4 определяет последовательность более чем из 8, как, например, более чем из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 аминокислот. В некоторых вариантах осуществления димерный пептид по изобретению состоит из двух идентичных пептидных мономеров. В некоторых вариантах осуществления иммуногенная композиция по изобретению находится в форме вакцинной композиции. В некоторых вариантах осуществления проникающий в клетку пептид по изобретению содержит не более 60, не более 59, не более 58, не более 57, не более 56, не более 55, не более 54, не более 53, не более 52, не более 51, не более 50, не более 49, не более 48, не более 47, не более 46, не более 45, не более 44, не более 43, не более 42, не более 41, не более 40, не более 39, не более 38, не более 37, не более 36,не более 35, не более 34, не более 33, не более 32, не более 31, не более 30, не более 29, не более 28, не более 27, не более 26, не более 25, не более 24, не более 23, не более 22, не более 21, не более 20, не более 19, не более 18 аминокислот. В некоторых вариантах осуществления проникающий в клетку пептид по изобретению содержит по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22,по меньшей мере 23, по меньшей мере 24, по меньшей мере 25, по меньшей мере 26, по меньшей мере 27, по меньшей мере 28, по меньшей мере 29, по меньшей мере 30, по меньшей мере 31, по меньшей мере 32, по меньшей мере 33, по меньшей мере 34, по меньшей мере 35 по меньшей мере 36, по меньшей мере 37, по меньшей мере 38, по меньшей мере 39, по меньшей мере 40, по меньшей мере 41, по меньшей мере 42, по меньшей мере 43, по меньшей мере 44, по меньшей мере 45, по меньшей мере 46, по меньшей мере 47, по меньшей мере 48, по меньшей мере 49, по меньшей мере 50, по меньшей мере 51,по меньшей мере 52, по меньшей мере 53, по меньшей мере 54, по меньшей мере 55, по меньшей мере 56, по меньшей мере 57, по меньшей мере 58, по меньшей мере 59, по меньшей мере 60 аминокислотных остатков. В некоторых вариантах осуществления проникающий в клетку пептид по изобретению содержит 18 аминокислотных остатков, или 19 аминокислотных остатков, или 20 аминокислотных остатков, или 21 аминокислотных остатков, или 22 аминокислотных остатков, или 23 аминокислотных остатков, или 24 аминокислотных остатков, или 25 аминокислотных остатков, или 26 аминокислотных остатков, или 27 аминокислотных остатков, или 28 аминокислотных остатков, или 29 аминокислотных остатков, или 30 аминокислотных остатков, или 31 аминокислотных остатков, или 32 аминокислотных остатков, или 33 аминокислотных остатков, или 34 аминокислотных остатков, или 35 аминокислотных остатков, или 36 аминокислотных остатков. или 37 аминокислотных остатков, или 38 аминокислотных остатков, или 39 аминокислотных остатков, или 40 аминокислотных остатков, или 41 аминокислотных остатков, или 42 аминокислотных остатков, или 43 аминокислотных остатков, или 44 аминокислотных остатков, или 45 аминокислотных остатков, или 46 аминокислотных остатков, или 47 аминокислотных остатков, или 48 аминокислотных остатков, или 49 аминокислотных остатков, или 50 аминокислотных остатков, или 51 аминокислотных остатков, или 52 аминокислотных остатков, или 53 аминокислотных остатков, или 54 аминокислотных остатков, или 55 аминокислотных остатков, или 56 аминокислотных остатков, или 57 аминокислотных остатков, или 58 аминокислотных остатков, или 59 аминокислотных остатков, или 60 аминокислотных остатков. В некоторых вариантах осуществления проникающий в клетку пептид по изобретению не состоит из следующей последовательности RFIIP[Nle]FTALSGGRRALLYGATPYAIG, где Nle обозначает норлейцин. В некоторых вариантах осуществления X2 и/или X4 не происходит из ВИЧ. В некоторых вариантах осуществления X4 представляет собой линейную последовательность менее чем из 12 аминокислот. В некоторых вариантах осуществления X2 представляет собой линейную последовательность менее чем из 12 аминокислот. В некоторых вариантах осуществления X2 и/или X4 не содержит норлейцин. В некоторых вариантах осуществления X2 не содержит норлейцин. В некоторых вариантах осуществления X2 и/или X4 содержит только природные аминокислоты. В некоторых вариантах осуществления X2 содержит только природные аминокислоты. В некоторых вариантах осуществления X2 содержит только природные аминокислоты, если он происходит из ВИЧ. В некоторых вариантах осуществления X2 и/или X4 происходит из HCV, CMV, ВИЧ, вируса гриппа,аденовирусов или пикорнавирусов. Пронумерованные варианты осуществления изобретения. 1. Выделенный проникающий в клетку пептид, содержащий следующую структуру: Х 1-Х 2-Х 3-Х 4-Х 5 (формула I),1 3 где X и X независимо определяют линейную последовательность любых 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного; X2 определяет линейную последовательность из 8-30 аминокислот, происходящих из антигена; X4 определяет линейную последовательность из 8-30 аминокислот, происходящих из указанного антигена, причем указанная последовательность X4 отличается от X2; и X5 представляет собой любую необязательную аминокислоту, выбранную из основной аминокислоты, цитруллина, триптофана или их производного. 2. Выделенный пептид согласно варианту осуществления 1, где X1 определяет линейную последовательность любых 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты,триптофана или их производного. 3. Выделенный пептид согласно варианту осуществления 1, где X1 определяет линейную последовательность в любом порядке из одного остатка цитруллина и любых 1, 2 или 3 аминокислот, независимо выбранных из любой основной аминокислоты, триптофана или их производного. 4. Выделенный пептид согласно любому из вариантов осуществления 1-3, где X3 определяет линейную последовательность любых 1, 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты. 5. Выделенный пептид согласно любому из вариантов осуществления 1-3, где X3 определяет линейную последовательность в любом порядке из одного остатка цитруллина и любых 1, 2 или 3 аминокислот,независимо выбранных из любой основной аминокислоты. 6. Выделенный пептид согласно любому из вариантов осуществления 1-5, где последовательность аминокислот, определяемая Х 2-Х 3-Х 4 формулы I, как определено в варианте осуществления 1, не встречается в нативной последовательности указанного антигена. 7. Выделенный пептид согласно любому из вариантов осуществления 1-6, где продемонстрировано,что указанный пептид проходит через плазматическую мембрану в анализе на основе биотинилирования пептидов, как описано в примере 1. 8. Выделенный пептид согласно любому из вариантов осуществления 1-7, где указанная одна необязательная аминокислота, выбранная из основной аминокислоты, цитруллина, триптофана или их производного, выбрана из Arg, Lys и His. 9. Выделенный пептид согласно любому из вариантов осуществления 1-8, где X2 и/или X4 определяет последовательность, идентичную нативной последовательности указанного антигена. 10. Выделенный пептид согласно любому из вариантов осуществления 1-9, где указанный пептид способен индуцировать ответ Т-лимфоцитов. 11. Выделенный пептид согласно любому из вариантов осуществления 1-10, где указанный антиген представляет собой вирусный белок, такой как капсидный белок. 12. Выделенный пептид согласно варианту осуществления 11, где указанный вирусный белок выбран из белка вируса гепатита С, такого как коровый белок; белка вируса гриппа, такого как белок М 2. 13. Выделенный пептид согласно варианту осуществления 11, где указанный вирусный белок вируса гепатита С выбран из консенсусной последовательности HCV генотипа 1, такого как подтипы 1 а и 1b,генотипа 2, такого как 2 а и 2b, и генотипа 3, такого как 3 а. 14. Выделенный пептид согласно любому из вариантов осуществления 1-13, причем этот проникающий в клетку пептид имеет 19-60 аминокислот, как, например, 20-60 аминокислот, как, например, 2160 аминокислот, как, например, 22-60 аминокислот, как, например, 23-60 аминокислот, как, например,24-60 аминокислот, как, например, 25-60 аминокислот, как, например, 26-60 аминокислот, как, например,27-60 аминокислот, как, например, 28-60 аминокислот, как, например, 29-60 аминокислот, как, например,30-60 аминокислот, как, например, 31-60 аминокислот, как, например, 32-60 аминокислот, как, например,33-60 аминокислот, как, например, 34-60 аминокислот, как, например, 35-60 аминокислот. 15. Выделенный пептид согласно любому из вариантов осуществления 1-14, причем этот проникающий в клетку пептид имеет 18-60, как, например, 18-59, как, например, 18-58, как, например, 18-57,как, например, 18-56, как, например, 18-55, как, например, 18-54, как, например, 18-53, как, например,18-52, как, например, 18-51, как, например, 18-50, как, например, 18-49, как, например, 18-48, как, например, 18-47, как, например, 18-46, как, например, 18-45, как, например, 18-44, как, например, 18-43,как, например, 18-42, как, например, 18-41, как, например, 18-40, как, например, 18-39, как, например,18-38, как, например, 18-37, как, например, 18-35 аминокислот, как, например, 18-34 аминокислот, как,например, 18-33 аминокислот, как, например, 18-32 аминокислот, как, например, 18-31 аминокислот, как,например, 18-30 аминокислот, как, например, 18-2 9 аминокислот, как, например, 18-28 аминокислот,как, например, 18-27 аминокислот, как, например, 18-26 аминокислот, как, например, 18-25 аминокислот,как, например, 18-24 аминокислот, как, например, 18-23 аминокислот, как, например, 18-22 аминокислот,как, например, 18-21 аминокислот, как, например, 18-20 аминокислот, как, например, 18-19 аминокислот. 16. Выделенный пептид согласно любому из вариантов осуществления 1-15, где суммарный зарядX2 меньше или равен 0; и где X1 и X3 определяют последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. 17. Выделенный пептид согласно любому из вариантов осуществления 1-16, где суммарный зарядX2 меньше или равен 0; где суммарный заряд X4 больше или равен 1; и X1 и X3 определяют последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. 18. Выделенный пептид согласно любому из вариантов осуществления 1-17, где суммарный зарядX2 и X4 меньше или равен 0 и X1 и X3 определяют последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. 19. Выделенный пептид согласно любому из вариантов осуществления 1-18, где суммарный зарядX2 и X4 больше или равен 1 и где X1 и X3 определяют последовательность из 1 или 2 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. 20. Выделенный пептид согласно любому из вариантов осуществления 1-19, где суммарный зарядX2 больше или равен 1; суммарный заряд X4 меньше или равен 0; X1 определяет последовательность из 1 или 2 аминокислот с положительным зарядом; и X3 определяет последовательность из 2, 3 или 4 аминокислот, независимо выбранных из любой основной аминокислоты, цитруллина, триптофана или их производного. 21. Выделенный пептид согласно любому из вариантов осуществления 1-20, где указанная основная аминокислота независимо выбрана из Arg, Lys и His. 22. Выделенный пептид согласно любому из вариантов осуществления 1-21, где X2 и/или X4 содержат последовательность аминокислот, определяемую положениями 135-157 SEQ ID NO: 3, или ее фрагмент или вариант. 23. Выделенный пептид согласно любому из вариантов осуществления 1-22, где X2 и/или X4 состоят из последовательности, выбранной из или их фрагмента или варианта. 24. Выделенный пептид согласно любому из вариантов осуществления 1-23, где X2 и/или X4 состоят из последовательности, происходящей из аминокислотной последовательности, выбранной из или их фрагмента или варианта. 25. Выделенный пептид согласно любому из вариантов осуществления 1-24, где указанный пептид выбран из или их фрагмента или варианта. 26. Выделенный пептид согласно любому из вариантов осуществления 1-25, где пептид состоит из последовательности, выбранной из 27. Выделенный пептид согласно любому из вариантов осуществления 1-26, где пептид содержит один или несколько остатков цистеина. 28. Выделенный пептид согласно любому из вариантов осуществления 1-27, где пептид содержит внутримолекулярные связи, такие как внутримолекулярные дисульфидные (S-S) связи между двумя остатками cys или ацилалями. 29. Выделенный пептид согласно любому из вариантов осуществления 1-28, где N- и/или Сконцевая аминокислота в X2 представляет собой гидрофильную или полярную аминокислоту. 30. Выделенный пептид согласно любому из вариантов осуществления 1-29, где N-концевая аминокислота в X4 представляет собой гидрофильную или полярную аминокислоту. 31. Выделенный пептид согласно любому из вариантов осуществления 1-30, который имеет не более 58 аминокислот, как, например, не более 56, 54, 52, 50, 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24,22, 20, 18 аминокислотных остатков. 32. Выделенный пептид согласно любому из вариантов осуществления 1-31, где X1 состоит из 2 или 3 аминокислот. 33. Выделенный пептид согласно варианту осуществления 32, где X1 состоит из WW, BR или RR. 34. Выделенный пептид согласно любому из вариантов осуществления 1-33, где X3 состоит из 2 или 3 аминокислот. 35. Выделенный пептид согласно варианту осуществления 34, где X3 состоит из WW, BR или RR. 36. Выделенный пептид не более чем из 60 аминокислот, содержащий последовательность X2 и/или 4X , как независимо определено в любой из табл. 1 или 2. 37. Выделенный пептид согласно варианту осуществления 36, который состоит из последовательности X2 или X4, как независимо определено в любой из табл. 1 или 2. 38. Выделенный пептид согласно любому из вариантов осуществления 1-37, где X2 определяет последовательность из 8-25 аминокислот, как, например, 8-20 аминокислот, как, например, 8-15 аминокислот. 39. Выделенный пептид согласно любому из вариантов осуществления 1-38, где X4 определяет последовательность из 8-25 аминокислот, как, например, 8-20 аминокислот, как, например, 8-15 аминокислот. 40. Выделенный пептид согласно любому из вариантов осуществления 1-39, где X2 определяет последовательность менее чем из 25, как, например, менее чем из 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13,12, 11, 10, 9, 8, 7 или 6 аминокислот. 41. Выделенный пептид согласно любому из вариантов осуществления 1-40, где X2 определяет последовательность более чем из 8, как, например, более чем из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21, 22, 23, 24, 25, 26, 27, 28, 29 аминокислот. 42. Выделенный пептид согласно любому из вариантов осуществления 1-41, где X4 определяет последовательность менее чем из 25, как, например, менее чем из 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13,12, 11, 10, 9, 8, 7 или 6 аминокислот. 43. Выделенный пептид согласно любому из вариантов осуществления 1-42, где X4 определяет последовательность более чем из 8, как, например, более чем из 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,21, 22, 23, 24, 25, 26, 27, 28, 29 аминокислот. 44. Выделенный пептид согласно любому из вариантов осуществления 1-43, где проникающий в клетку пептид по изобретению не состоит из следующей последовательностиRFIIP[Nle]FTALSGGRRALLYGATPYAIG, где, Nle обозначает норлейцин. 45. Выделенный пептид согласно любому из вариантов осуществления 1-44, где X2 и/или X4 не происходит из ВИЧ. 46. Выделенный пептид согласно любому из вариантов осуществления 1-45, где X4 представляет собой линейную последовательность менее чем из 12 аминокислот. 47. Выделенный пептид согласно любому из вариантов осуществления 1-46, где X2 представляет собой линейную последовательность менее чем из 12 аминокислот. 48. Выделенный пептид согласно любому из вариантов осуществления 1-47, где X2 и/или X4 не содержит норлейцин. 49. Выделенный пептид согласно любому из вариантов осуществления 1-48, где X2 не содержит норлейцин. 50. Выделенный пептид согласно любому из вариантов осуществления 1-49, где X2 и/или X4 содержит только природные аминокислоты. 51. Выделенный пептид согласно любому из вариантов осуществления 1-50, где X2 содержит только природные аминокислоты. 52. Выделенный пептид согласно любому из вариантов осуществления 1-51, где X2 содержит только природные аминокислоты, если он происходит из ВИЧ. 53. Выделенный пептид согласно любому из вариантов осуществления 1-52, где X2 и/или X4 происходит из HCV, CMV, HPV, вируса гриппа, аденовирусов или пикорнавирусов. 54. Применение пептида, содержащего последовательность X2 или X4, как независимо определено в любой из табл. 1 или 2, для индукции иммунного ответа у индивидуума. 55. Димерный пептид, содержащий два пептидных мономера, где каждый пептидный мономер является таким, как определено в любом из вариантов осуществления 1-53. 56. Димерный пептид согласно варианту осуществления 55, где два пептидных мономера являются идентичными. 57. Комбинация пептидов, содержащая два или более пептидов согласно любому из вариантов осуществления 1-53. 58. Выделенная нуклеиновая кислота или полинуклеотид, кодирующий пептид согласно любому из вариантов осуществления 1-53. 59. Вектор, содержащий нуклеиновую кислоту или полинуклеотид согласно варианту осуществления 58. 60. Клетка-хозяин, содержащая вектор согласно варианту осуществления 59. 61. Иммуногенная композиция, содержащая по меньшей мере один пептид согласно любому из вариантов осуществления 1-53, димерный пептид согласно любому из вариантов осуществления 55-56,комбинацию пептидов согласно варианту осуществления 57, нуклеиновую кислоту или полинуклеотид согласно варианту осуществления 58 или вектор согласно варианту осуществления 59; в комбинации с фармацевтически приемлемым разбавителем или носителем и необязательно иммунологическим адъювантом. 62. Иммуногенная композиция согласно варианту осуществления 61 в форме вакцинной композиции. 63. Способ индукции иммунного ответа у индивидуума против антигена, который включает введение по меньшей мере одного пептида согласно любому из вариантов осуществления 1-53, димерного пептида согласно любому из вариантов осуществления 55-56, комбинации пептидов согласно варианту осуществления 57, нуклеиновой кислоты или полинуклеотида согласно варианту осуществления 58, или вектора согласно варианту осуществления 59; или композиции согласно любому из вариантов осуществления 61-62. 64. Способ уменьшения и/или замедления патологических эффектов вируса у индивидуума, инфицированного указанным вирусом, причем способ включает введение эффективного количества по меньшей мере одного пептида согласно любому из вариантов осуществления 1-53, димерного пептида согласно любому из вариантов осуществления 55-56, комбинации пептидов согласно варианту осуществления 57, нуклеиновой кислоты или полинуклеотида согласно варианту осуществления 58, или вектор согласно варианту осуществления 59; или композиции согласно любому из вариантов осуществления 61-62. 65. Пептид согласно любому из вариантов осуществления 1-53 для применения в качестве лекарственного средства. 66. Пептид согласно любому из вариантов осуществления 1-53 для лечения патологических эффектов вируса у индивидуума, инфицированного указанным вирусом. Список последовательностей (аминокислоты полужирным шрифтом соответствуют подходящим антигенным последовательностям, которые можно использовать в качестве любого из X2 и/или X4, как определено в формуле I по настоящему изобретению).SEQ ID NO: 1: номер доступаAF009606; ген полибелка вируса гепатита С подтипа 1 а, полная
МПК / Метки
МПК: C07K 14/16, C07K 14/025, C07K 14/045, C07K 14/085, C07K 14/18, C07K 14/005, C07K 14/075, C07K 14/11, A61K 39/12
Метки: конструкция, пептидного, каркаса
Код ссылки
<a href="https://eas.patents.su/30-25152-konstrukciya-peptidnogo-karkasa.html" rel="bookmark" title="База патентов Евразийского Союза">Конструкция пептидного каркаса</a>
Предыдущий патент: Ингибиторы вируса гепатита с
Следующий патент: Способ двухстадийной промывки газа
Случайный патент: Антитела против il-12 и способы их применения