Применение антитела к человеческому прогастрину (hpg) для лечения рака поджелудочной железы
Формула / Реферат
1. Применение антитела к человеческому прогастрину (hPG) для получения лекарственного средства для лечения рака поджелудочной железы, где указанное антитело к hPG является моноклональным антителом, которое специфически связывает полипептид человеческого прогастрина (hPG), имеющий аминокислотную последовательность SEQ ID NO: 101, и не связывает амидированный гастрин 17, состоящий из SEQ ID NO: 104, гастрин 17 с удаленными глицинами, состоящий из SEQ ID NO: 105, или С-концевой фланкированный пептид (CTFP), состоящий из SEQ ID NO: 106.
2. Применение по п.1, в котором моноклональное антитело к hPG является гуманизированным.
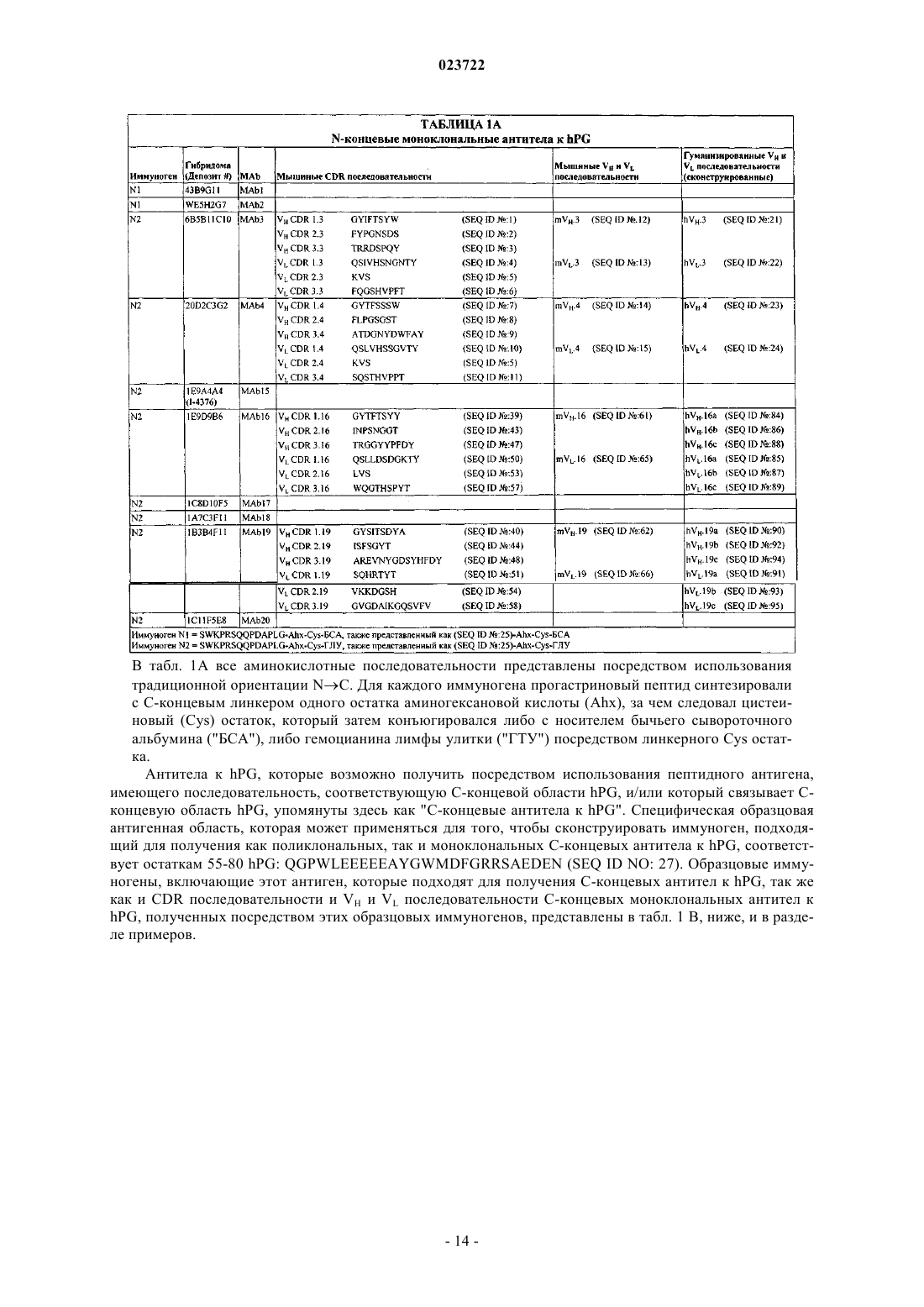
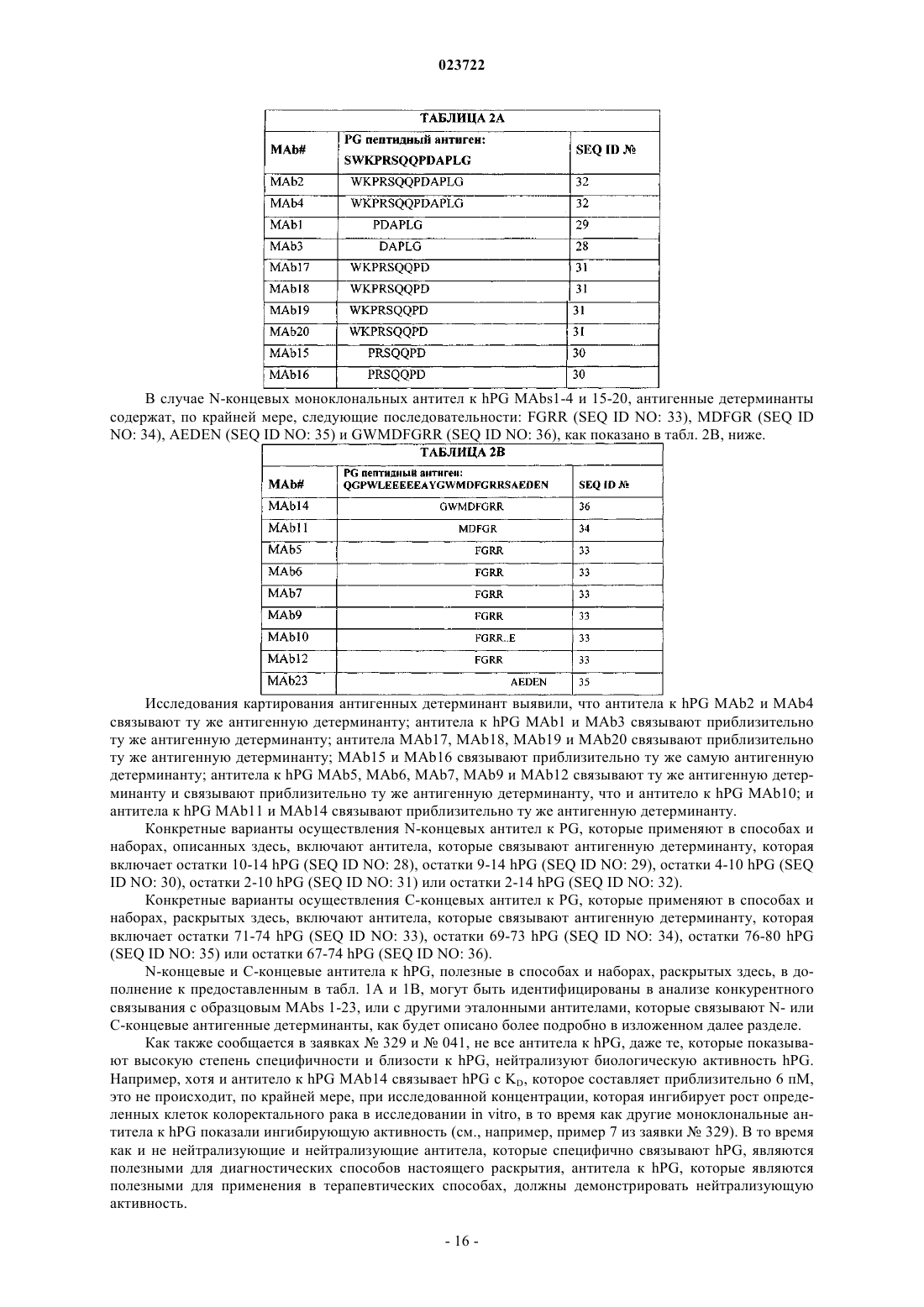
3. Применение по п.1, в котором антитело к hPG представляет собой антитело, которое связывает N-концевую область hPG, включающую остатки 1-14 (SEQ ID NO: 25).
4. Применение по п.3, в котором антитело к hPG связывает эпитоп, содержащий последовательность, выбранную из группы, состоящей из DAPLG (SEQ ID NO: 28), PDAPLG (SEQ ID NO: 29), PRSQQPD (SEQ ID NO: 30), WKPRSQQPD (SEQ ID NO: 31) и WKPRSQQPDAPLG (SEQ ID NO: 32).
5. Применение по п.3 или 4, в котором антитело к hPG индуцируется иммуногеном, содержащим пептид, имеющий последовательность SWKPRSQQPDAPLG (SEQ ID NO: 25).
6. Применение по п.3 или 4, в котором моноклональное антитело к hPG содержит:
(а) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.3 (SEQ ID NO: 1), CDR2 включает аминокислотную последовательность VH CDR2.3 (SEQ ID NO: 2) и CDR3 включает аминокислотную последовательность VH CDR3.3 (SEQ ID NO: 3), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.3 (SEQ ID NO: 4), CDR2 включает аминокислотную последовательность VL CDR2.3 (SEQ ID NO: 5) и CDR3 включает аминокислотную последовательность VL CDR3.3 (SEQ ID NO: 6);
(б) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.4 (SEQ ID NO: 7), CDR2 включает аминокислотную последовательность VH CDR2.4 (SEQ ID NO: 8) и CDR3 включает аминокислотную последовательность VH CDR3.4 (SEQ ID NO: 9), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.4 (SEQ ID NO: 10), CDR2 включает аминокислотную последовательность VL CDR2.4 (SEQ ID NO: 5) и CDR3 включает аминокислотную последовательность VL CDR3.4 (SEQ ID NO: 11);
(в) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.16 (SEQ ID NO: 39), CDR2 включает аминокислотную последовательность VH CDR2.16 (SEQ ID NO: 43) и CDR3 включает аминокислотную последовательность VH CDR3.16 (SEQ ID NO: 47), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.16 (SEQ ID NO: 50), CDR2 включает аминокислотную последовательность VL CDR2.16 (SEQ ID NO: 53) и CDR3 включает аминокислотную последовательность VL CDR3.16 (SEQ ID NO: 57);
(г) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.19 (SEQ ID NO: 40), CDR2 включает аминокислотную последовательность VH CDR2.19 (SEQ ID NO: 44) и CDR3 включает аминокислотную последовательность VH CDR3.19 (SEQ ID NO: 48), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.19 (SEQ ID NO: 51), CDR2 включает аминокислотную последовательность VL CDR2.19 (SEQ ID NO: 54) и CDR3 включает аминокислотную последовательность VL CDR3.19 (SEQ ID NO: 58).
7. Применение по п.3 или 4, в котором моноклональное антитело к hPG конкурирует за связывание hPG с эталонным антителом, выбранным из группы, включающей:
(а) моноклональное антитело, включающее последовательность вариабельной области тяжелой цепи SEQ ID NO: 12 и последовательность вариабельной области легкой цепи SEQ ID NO: 13;
(б) моноклональное антитело, включающее последовательность вариабельной области тяжелой цепи SEQ ID NO: 14 и последовательность вариабельной области легкой цепи SEQ ID NO: 15;
(в) моноклональное антитело, включающее последовательность вариабельной области тяжелой цепи SEQ ID NO: 61 и последовательность вариабельной области легкой цепи SEQ ID NO: 65;
(г) моноклональное антитело, включающее последовательность вариабельной области тяжелой цепи SEQ ID NO: 62 и последовательность вариабельной области легкой цепи SEQ ID NO: 66.
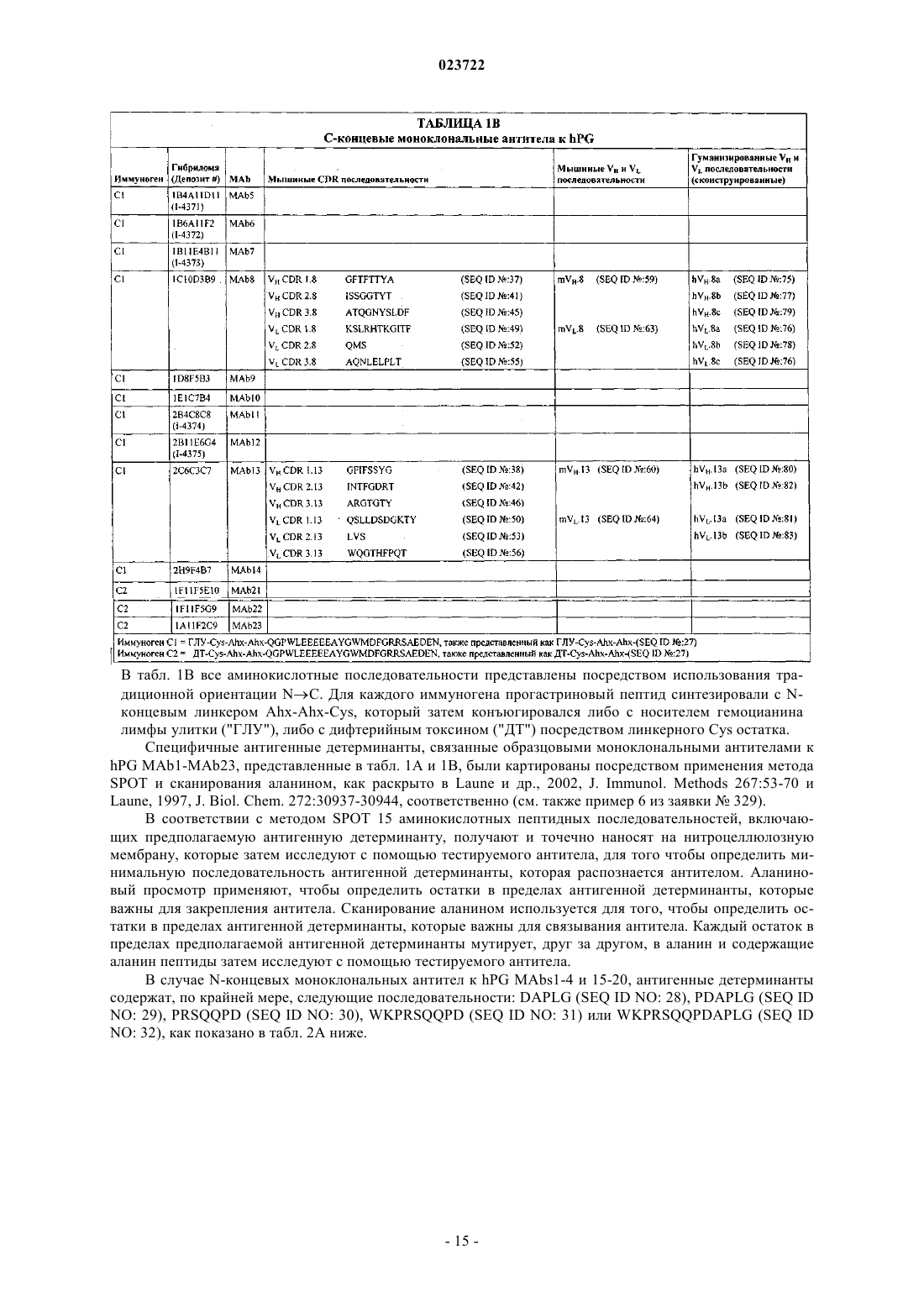
8. Применение по п.1, в котором антитело к hPG представляет собой антитело, которое связывает С-концевую область hPG, включающую остатки 55-80 (SEQ ID NO: 27).
9. Применение по п.8, в котором антитело к hPG связывает эпитоп, содержащий последовательность, выбранную из группы, состоящей из FGRR (SEQ ID NO: 33), MDFGR (SEQ ID NO: 34), AEDEN (SEQ ID NO: 35) и GWMDFGRR (SEQ ID NO: 36).
10. Применение по п.8, в котором антитело к hPG индуцируется иммуногеном, содержащим пептид, имеющий последовательность QGPWLEEEEEAYGWMDFGRRSAEDEN (SEQ ID NO: 27).
11. Применение по п.8, в котором моноклональное антитело к hPG содержит:
(а) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.8 (SEQ ID NO: 37), CDR2 включает аминокислотную последовательность VH CDR2.8 (SEQ ID NO: 41) и CDR3 включает аминокислотную последовательность VH CDR3.8 (SEQ ID NO: 45), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.8 (SEQ ID NO: 49), CDR2 включает аминокислотную последовательность VL CDR2.8 (SEQ ID NO: 52) и CDR3 включает аминокислотную последовательность VL CDR3.8 (SEQ ID NO: 55);
(б) вариабельную область тяжелой цепи, в которой CDR1 включает аминокислотную последовательность VH CDR1.13 (SEQ ID NO: 38), CDR2 включает аминокислотную последовательность VH CDR2.13 (SEQ ID NO: 42) и CDR3 включает аминокислотную последовательность VH CDR3.13 (SEQ ID NO: 46), и вариабельную область легкой цепи, в которой CDR1 включает аминокислотную последовательность VL CDR1.13 (SEQ ID NO: 50), CDR2 включает аминокислотную последовательность VL CDR2.13 (SEQ ID NO: 53) и CDR3 включает аминокислотную последовательность VL CDR3.13 (SEQ ID NO: 56).
12. Применение по п.8, в котором моноклональное антитело к hPG конкурирует за связывание hPG с эталонным антителом, выбранным из:
(в) моноклонального антитела, включающего последовательность вариабельной области тяжелой цепи SEQ ID NO: 59 и последовательность вариабельной области легкой цепи SEQ ID NO: 63;
(г) моноклонального антитела, включающего последовательность вариабельной области тяжелой цепи SEQ ID NO: 60 и последовательность вариабельной области легкой цепи SEQ ID NO: 64.
13. Применение по п.1, в котором рак поджелудочной железы представляет собой первичный рак поджелудочной железы.
14. Применение по п.1, в котором рак поджелудочной железы представляет собой метастатический рак поджелудочной железы.
Текст
ПРИМЕНЕНИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ ПРОГАСТРИНУ (hPG) ДЛЯ ЛЕЧЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Изобретение относится к применению антитела к человеческому прогастрину (hPG) для получения лекарственного средства для лечения рака поджелудочной железы. Причем указанное антитело к hPG является моноклональным антителом, которое специфически связывает полипептид человеческого прогастрина (hPG), имеющий аминокислотную последовательность SEQ ID NO: 101, и не связывает амидированный гастрин 17, состоящий из SEQ ID NO: 104, гастрин 17 с удаленными глицинами, состоящий из SEQ ID NO: 105, или С-концевой фланкированный пептид 1. Ссылка на родственные заявки Заявка на данный патент пользуется преимуществом, изложенным в соответствии с положением 35U.S.С.119(e), предварительной заявки 61/293612, поданной 8 января 2010 г., содержание которой включено здесь посредством ссылки в полном объеме. 2. Ссылка на перечень последовательностей, таблицу или компьютерную программу Перечень последовательностей при этом представлен. 3. Заявленное изобретение Настоящее раскрытие, в частности, относится к способам лечения субъектов с первичным и/или метастатическим раком поджелудочной железы посредством введения субъекту композиции, содержащей антитело, специфическое к прогастрину. 4. Уровень техники Несмотря на десятилетия фундаментальных и клинических исследований, рак остается одним из самых больших проблем человечества. В соответствии со статистическими данными, собранным Всемирной организацией здравоохранения, рак является одной из ведущих причин смерти во всем мире, от которого умерло 7,4 млн человек в 2004 году, или приблизительно 13% всех смертельных случаев в этом году. Несмотря на то что было много изучено в отношении причин рака, и в отношении того, как рак воздействует на молекулярном уровне, самые большие сокращения показателей смертности от рака остаются обусловленными воздействием общественного здравоохранения, таким как кампании против курения, и более ранняя диагностика, которая стала возможной благодаря успехам в технологии формирования и обработки изображений и молекулярной диагностике. Однако когда дело доходит до сложной работы фактического уничтожения раковых клеток, то практикующие врачи все еще полагаются на такие терапевтические способы, как хирургия, радиационная терапия и химиотерапия, которые были известны онкологам еще поколение назад. Хотя эффективность указанного лечения улучшилась за указанные годы, улучшение показателей эффективности лечения и увеличение продолжительности жизни были возрастающими постепенно. Даже результаты новой таргетной терапии. Рак поджелудочной железы, злокачественное новообразование поджелудочной железы, является особенно сложной формой рака для лечения, поскольку он обычно протекает нераспознанным до тех пор, пока уже не поддается лечению (Jemal и др., 2008, СА Cancer J. Clin. 58(2):71-96). Прогнозы являются плохими - меньше чем 5% субъектов, у которых был диагностирован рак поджелудочной железы, остаются живыми 5 лет после диагноза (Jemal и др., 2010, СА Cancer J. Clin. 60 (5):277-300), и полная ремиссия является редкой (Ghaneh и др., 2007, Gut 56 (8): 1134-1152). Медиана выживаемости в результате диагноза составляет только 3-6 месяцев (StathisMoore, 2010, Nat. Rev. Clin. Oncol. 7 (3):163-172). Оценивали, что в 2010 году приблизительно 43000 людей в одних только Соединенных Штатах Америки будет диагностировано как имеющие рак поджелудочной железы, и что приблизительно 36800 умрут от этого заболевания (см. www.cancer.gov/cancertopics/types/pancreatic). Хотя рак поджелудочной железы составляет только 2,5% новых случаев рака, диагностируемых каждый год, они приводят к 6% ежегодных смертельных случаев в результате рака (Jemal и др., 2007, Cancer J. Clin. 57 (1):43-46), представляя один из самых высоких коэффициентов смертности из всех раковых образований. В действительности, в Соединенных Штатах Америки рак поджелудочной железы представляет собой в четыре раза больше причин смерти от рака среди мужчин и женщин. Другим стимулирующим аспектом контроля рака является лечение пациентов, у которых клетки первичного (оригинального) новообразования высвободились и мигрировали в другое место в пределах тела, обычно через лимфу или кровь, в результате процесса, который называется "метастаз", с формированием другого, метастатического (или вторичного) новообразования. Вторичное или метастатическое новообразование имеет обычно тот же самый тип, что и оригинальное новообразование, независимо от его нового местоположения, так что заболевание упоминается как метастатический рак, а не рак новой,присущей ему ткани. Например, рак поджелудочной железы, который распространился на печень, является метастатическим раком поджелудочной железы, а не раком печени. Так как первичный рак поджелудочной железы часто не диагностируется до последней стадии, то уровень метастаза высок. В действительности, приблизительно у 80% пациентов уже есть метастаз во время постановки диагноза (Sohn и др., 2000, J. Gastrointest. Surg. 4 (6):567-579). Метастаз ограничивает варианты лечения, поскольку резекция или удаление первичного новообразования больше не является достаточным вариантом лечения. Химиотерапия на основе гемцитабина в настоящее время представляет стандарт лечения любого пациента с метастатическом заболеванием. Выживание пациентов с метастатическим заболеванием, которых лечили гемцитабином, составляет только приблизительно 6 месяцев (в пределах от 4,0 до 7,1 месяцев, в зависимости от исследования). Исследования, которые проводятся в настоящее время, где применяют комбинированное лечение, например гемцитабин и химиотерапию (оксалиплатин, 5-фторурацил или иринотекан) или гемцитабин и таргетную терапию (эрлонтиниб, бевацизумаб или цетуксимаб), сообщают только о 1-2 месяцах выигрыша в выживании (SathisMoore, 2000, Nat. Rev. Clin. Oncol. 7 (3):163-172). Несмотря на умеренные успехи вариантов лечения первичного рака поджелудочной железы и метастатического рака поджелудочной железы, которые были достигнуты в последние годы (см. Id), остается насущная потребность в альтернативных и/или более эффективных способах лечения. 5. Краткое изложение сущности изобретения Гастрин представляет собой пептидный гормон желудочно-кишечного тракта, который стимулирует секрецию желудочного сока. У взрослых млекопитающих он вырабатывается преимущественно Gклетками в полости желудка, и в некоторой степени в верхнем тонком кишечнике и поджелудочной железе. Ссылаясь на фиг. 1, ген гастрина транслируется в полипептид, состоящий из 101 аминокислоты,названный "препрогастрин", который содержит сигнальную последовательность (подчеркнутую), которая расщепляется, из которого образуется прогастрин ("PG"), полипептид, состоящий из 80 аминокислотных остатков. Гастрин, который изначально найден в трех формах, G34, G17 и G14 (не показан), является результатом процессинга прогастрина. Наличие амидированного гастрина наблюдалось в новообразованиях поджелудочной железы(Goetze и др., 2000, Cancer 88 (11):2487-2494), и исследователи пытались применять антигастрин для лечения новообразования поджелудочной железы (см., например, Chau и др., 2006, Br. J. Cancer 94:11071115; Brett и др., 2002, J. Clin. Oncol. 20:4225-4231). Было также замечено, что пациенты, страдающие от рака поджелудочной железы, имеют обнаруживаемые уровни прогастрина в новообразованиях поджелудочной железы (Caplin и др., 2000, Br. J. Surg. 87 (8): 1035-1040). В настоящее время установлено, что к прогастрину может применяться для диагностики, контроля и лечения как первичного, так и метастатического рака поджелудочной железы. Как демонстрируется впервые здесь, пациенты как с первичным,так и с метастатическим раком поджелудочной железы имеют повышенный уровень прогастрина в плазме и/или в сыворотке крови, и при этом пролиферация клеточных линий, происходящих из первичных и метастатических новообразований поджелудочной железы, ингибируется тогда, когда пациентов лечат антителами, которые специфично связывают прогастрин, что является их способностью образовывать сфероиды из раковых клеток в условиях низкой адгезии, указанные открытия обеспечивают новые мощные инструменты для диагностики, лечения, предотвращения рецидива, и контроля течения прогрессирования и/или лечения рака поджелудочной железы. Соответственно, в одном аспекте настоящее раскрытие обеспечивает способы лечения рака поджелудочной железы, который может быть первичным раком поджелудочной железы или метастатическим раком поджелудочной железы, которые содержат введение субъекту, у которого диагностировали первичный или метастатический рак поджелудочной железы, количество антитела, которое специфично связывает прогастрин ("антитело к PG"), способного обеспечивать терапевтический действие. Антитело кPG можно вводить одно в качестве монотерапии, или вместе с, или дополнительно к другим способам лечения, таким как резекция новообразования, радиационная терапия, химиотерапия и т.д. Когда антитело применяют вместе с, или дополнительно к резекции новообразования, антитело кPG можно вводить до и/или после удаления новообразования, и введение антитела может быть продолжено на протяжении определенного промежутка времени после удаления новообразования, пока уровень прогастрина в плазме и/или в сыворотке крови станет ниже указанного порогового уровня, или до уменьшения уровня прогастрина в плазме и/или сыворотке крови в течение определенного промежутка времени. Когда антитело применяют вместе с, или дополнительно к химиотерапии, антитело к PG можно вводить до химиотерапии, одновременно с химиотерапией, или после химиотерапии. Кроме того, антитело к PG можно вводить на протяжении определенного промежутка времени, пока уровень прогастрина в плазме и/или сыворотке крови станет ниже указанного порогового уровня, или до уменьшения уровня прогастрина в плазме и/или сыворотке крови в течение определенного промежутка времени. Как будет обсуждаться более подробно ниже, пациенты, у которых диагностирован первичный и/или метастатический раком поджелудочной железы, имеют повышенный уровень PG в плазме и/или сыворотке крови. Например, ссылаясь на фиг. 4, уровень прогастрина в сыворотке и/или плазме крови у здоровых людей обычно является незначительным. Люди, страдающие от рака поджелудочной железы,имеют могущий быть определяемым уровень прогастрина, который составляет приблизительно 50 пМ. Это открытие приводит к нескольким полезным и важным новым средствам диагноза и контроля рака поджелудочной железы. Во-первых, поскольку рак поджелудочной железы может быть трудно поддающимся диагностике,то установленный уровень PG в плазме и/или сыворотке крови может использоваться вместе с другими диагностическими тестами для того, чтобы либо подтвердить диагноз рака поджелудочной железы, либо помочь в установлении начального диагноза. Например, обычно известно, что симптомы рака поджелудочной железы, когда он присутствует, подобны признакам многих других заболеваний. Общие симптомы включают боль в верхнем отделе брюшной полости, которая иррадирует в спину, потерю аппетита и/или тошноту и рвоту, существенную потерю веса, и безболезненную желтуху. Менее общие симптомы включают тромбоз дистальных отделов вены и легочную эмболию, сахарный диабет и панкреатит. Так как раннее выявление дает больше вариантов лечения и лучший прогноз, то у пациентов, у которых присутствуют указанные и/или другие симптомы рака поджелудочной железы, должны быть установлены уровень PG в плазме и/или сыворотке крови, для того чтобы помочь установлению диагноза, где повышенный уровень, например в плазме и/или в сыворотке крови, составляющий приблизительно 50 пМ или выше, укажет, что у пациента имеется рак поджелудочной железы. Установление уровня PG в плазмы и/или в сыворотке крови, для того чтобы помочь установлению диагноза, может быть особенно полезным у субъектов, у которых имеются факторы риска возникновения рака поджелудочной железы, включая, но не ограничиваясь ими, курение, диетические и экологические факторы, инфекция H. pylori, метаболические синдромы (например, ожирение, нарушение толерантности к глюкозе, застарелый диабет), и семейный анамнез, которые составляют приблизительно 5-10% пациентов с раком поджелудочной железы (MaisonneuveLowenfels, 2010, Dig. Dis. 28 (4-5):645-656). УровеньPG в плазме и/или в сыворотке крови у субъектов, у которых имеются указанные или другие факторы риска, должен периодически проверяться, чтобы отмечать повышение в динамике по времени, или отмечать уровень, составляющий приблизительно 50 пМ или выше указанного порога, что указывает на человека, у которого может развиться рак поджелудочной железы. Такой мониторинг людей в группе риска может помочь раннему выявлению заболевания, обеспечивая лучшие способы лечения. Во-вторых, установленный уровень PG в плазме и/или в сыворотке крови может использоваться для того, чтобы контролировать эффективность любой терапии рака поджелудочной железы, включая способы лечения антителами к PG, описанные здесь, и/или потенциальное возникновение рецидива или метастазы. Не желая быть связанным в соответствии с какой-либо теорией, ожидается, что, поскольку новообразования уменьшаются в размерах после курса терапии, то уровень PG в плазме и/или в сыворотке крови снижается и может возвратиться к нормальному. Таким образом, в другом аспекте описание изобретения обеспечивает способы, полезные для диагностики и/или контроля эффективности лечения и/или контроля рецидива рака поджелудочной железы у субъекта как первичного рака поджелудочной железы, так и метастатического рака поджелудочной железы. Способ, как правило, содержит установление уровня PG в плазме и/или в сыворотке крови у соответствующего субъекта, либо в определенный момент времени, либо на протяжении какого-либо периода времени, и определения того, является ли уровень выше или ниже порогового значения, либо повышается или понижается в динамике по времени. Уровни выше порогового уровня или уровни, которые повышаются в динамике по времени у субъектов, у которых присутствует риск развития рака поджелудочной железы, или у субъектов, у которых имеется один или более симптомов, связанных с раком поджелудочной железы, указывают на то, что у субъекта имеется рак поджелудочной железы. Уровни ниже порогового уровня, или их снижение в динамике по времени, указывают на то, что конкретная терапия является эффективной. Ввиду короткого времени выживания пациентов, имеющих рак поджелудочной железы, измерения уровней должны проводиться довольно часто, например один раз каждые две недели или даже в более коротких интервалах времени. 6. Краткое описание фигур Фиг. 1 представляет аминокислотные последовательности человеческого препрогастрина (SEQ IDNO: 100), где сигнальная пептидная последовательность является подчеркнутой, зрелый человеческий прогастрин (SEQ ID NO: 20) и определенные продукты процессинга прогастрина, включая G34 (SEQ IDNO: 106). Фиг. 2 представляет полинуклеотидные и аминокислотные последовательности вариабельных легких и вариабельных тяжелых цепей определенных образцов мышиных моноклональных антител к hPG. В каждом случае указанные три CDR-участка выделены полужирным подчеркнутым шрифтом, а именно: фиг. 2 А представляет полипептидную последовательность VH цепи мышиного антитела MAb3 кhPG (SEQ ID NO: 12) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 16); фиг. 2 В представляет полипептидную последовательность VL цепи мышиного антитела MAb3 кhPG (SEQ ID NO: 13) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 17); фиг. 2 С представляет полипептидную последовательность VH цепи мышиного антитела MAb4 кhPG (SEQ ID NO: 14) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 18); фиг. 2D представляет полипептидную последовательность VL цепи мышиного антитела MAb4 кhPG (SEQ ID NO: 15) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 19); фиг. 2 Е представляет полипептидную последовательность VH цепи мышиного антитела MAb8 кhPG (SEQ ID NO: 59) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 67); фиг. 2F представляет полипептидную последовательность VL цепи мышиного антитела MAb8 к hPG(SEQ ID NO: 63) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 71); фиг. 2G представляет полипептидную последовательность VH цепи мышиного антитела MAb13 кhPG (SEQ ID NO: 60) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 68); фиг. 2 Н представляет полипептидную последовательность VL цепи мышиного антитела MAb13 кhPG (SEQ ID NO: 64) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 72); фиг. 2I представляет полипептидную последовательность VH цепи мышиного антитела MAb16 кhPG (SEQ ID NO: 61) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 69); фиг. 2J представляет полипептидную последовательность VL цепи мышиного антитела MAb16 к фиг. 2K представляет полипептидную последовательность VH цепи мышиного антитела MAb19 кhPG (SEQ ID NO: 62) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 70); и Фиг. 2L представляет полипептидную последовательность VL цепи мышиного антитела MAb19 кhPG (SEQ ID NO: 66) и полинуклеотидную последовательность, ее кодирующую (SEQ ID NO: 74). Фиг. 3 представляет предполагаемые полипептидные последовательности для гуманизированных вариабельных тяжелых и легких цепей выбранных моноклональных антител к hPG, описанных здесь. В каждом случае указанные три CDR-участки выделены полужирным подчеркнутым шрифтом, а именно: фиг. 3 А представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb3 (SEQ ID NO: 21); фиг. 3 В представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb3 (SEQ ID NO: 22); фиг. 3 С представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb4 (SEQ ID NO: 23); фиг. 3D представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb4 (SEQ ID NO: 24); фиг. 3 Е представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb8(а) (SEQ ID NO: 75); фиг. 3F представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb8(а) (SEQ ID NO: 76); фиг. 3G представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb8(b) (SEQ ID NO: 77); фиг. 3 Н представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb8(b) (SEQ ID NO: 78); фиг. 3I представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb8(с) (SEQ ID NO: 79); фиг. 3J представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb8(с) (SEQ ID NO: 76); фиг. 3K представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb13(а) (SEQ ID NO: 80); фиг. 3L представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb13(а) (SEQ ID NO: 81 Q); фиг. 3 М представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb13(b) (SEQ ID NO: 82); фиг. 3N представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb13(b) (SEQ ID NO: 83); фиг. 3O представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb16(а) (SEQ ID NO: 84); фиг. 3 Р представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb16(а) (SEQ ID NO: 85); фиг. 3Q представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb 16(b) (SEQ ID NO: 86); фиг. 3R представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb16(b) (SEQ ID NO: 87); фиг. 3S представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb16(c) (SEQ ID NO: 88); фиг. 3 Т представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb16(с) (SEQ ID NO: 89); фиг. 3U представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb19(а) (SEQ ID NO: 90); фиг. 3V представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb19(a) (SEQ ID NO: 91); фиг. 3W представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb19(b) (SEQ ID NO: 92); фиг. 3 Х представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb19(b) (SEQ ID NO: 93); фиг. 3Y представляет предполагаемую аминокислотную последовательность VH цепи гуманизированного антитела MAb19(c) (SEQ ID NO: 94); Фиг. 3Z представляет предполагаемую аминокислотную последовательность VL цепи гуманизированного антитела MAb19(с) (SEQ ID NO: 95). Фиг. 4 представляет диаграмму, иллюстрирующую концентрации прогастрина в плазме или в сыворотке крови у пациентов с первичным (М-) или метастатическим (М+) раком поджелудочной железы, по сравнению со здоровыми субъектами из контрольной группы. Фиг. 5 представляет диаграмму, иллюстрирующую уровни экспрессии прогастрина в различных видах клеточных линий первичного и метастатического рака поджелудочной железы. Фиг. 6 представляет диаграмму, иллюстрирующую секрецию прогастрина различными видами клеточных линий первичного и метастатического рака поджелудочной железы. Фиг. 7 представляет диаграмму, где сравниваются антипролиферативные свойства образцового антитела MAb3 к hPG в клетках Capan 1 (клетки метастатического новообразования поджелудочной железы) по сравнению с негативным контролем моноклонального антитела. Фиг. 8 представляет диаграмму, где сравниваются антипролиферативные свойства образцового антитела MAb8 к hPG в клетках ВхРС-3 (клетки первичного новообразования поджелудочной железы) по сравнению с негативным контролем моноклонального антитела. Фиг. 9 представляет диаграмму, где сравниваются антипролиферативные свойства образцового антитела MAb8 к hPG в клетках MIA РаСа 2 (клетки первичного новообразования поджелудочной железы) по сравнению с негативным контролем моноклонального антитела. Фиг. 10 представляет диаграмму, демонстрирующую ингибирующее свойство образцового антителаMAb3 к hPG на способность клеток Capan 1 (клетки метастатического новообразования поджелудочной железы) на протяжении длительного периода времени образовывать сфероиды из раковых клеток при условиях низкой адгезии, по сравнению с необработанными контрольными клетками. Фиг. 11 представляет диаграмму, демонстрирующую ингибирующие свойства образцовых антителMAb8, MAb13, MAb16 и MAb19 к hPG на способность клеток SU.86.86 (клетки метастатического новообразования поджелудочной железы) на протяжении длительного периода времени образовывать сфероиды из раковых клеток при условиях низкой адгезии, по сравнению с необработанными контрольными клетками. 7. Детальное описание 7.1. Рак поджелудочной железы. Поджелудочная железа, тонкая железа приблизительно шесть дюймов в длину, имеет две главные функции: вырабатывает соки, которые помогают пище перевариваться, и вырабатывает гормоны, такие как инсулин и глюкагон, которые помогают контролировать уровень сахара в крови. Желудочные соки вырабатываются экзокринными клетками поджелудочной железы, а гормоны вырабатываются эндокринными клетками поджелудочной железы. Приблизительно 95% или больше злокачественных новообразований поджелудочной железы начинаются в экзокринных клетках (Yao и др., 2007, Oncology 14(12):3492-3450). Из экзокринных злокачественных новообразований поджелудочной железы приблизительно 95% составляют аденокарциномы, при этом остальные 5%, включают аденоскамозные карциномы, перстевидно-клеточный рак, гепатоидные карциномы, коллоидные карциномы, недифференцированные карциномы, и недифференцированные карциномы с остеокластоподобными гигантскими клетками (см. http://pathology.jhu.edu/pancreas/BasicTypesl.php). Рак поджелудочной железы на ранней стадии часто не вызывает симптомов (Jemal и др., 2008, САCancer J. Clin. 58 (2):71-96), а симптомы, вызванные более поздней стадией рака поджелудочной железы,являются обычно различными и неопределенными (StathisMoore, 2010, Nat. Rev. Clin. Oncol. 7 (3): 163-172). Как следствие, рак поджелудочной железы часто не диагностируется, пока он не запущен (Jemal и др., 2008, СА Cancer J. Clin. 58 (2):71-96). Общие симптомы включают, но не ограничиваются ими,боль в верхней части живота и боли в спине, потерю аппетита и/или тошноту и рвоту, существенную потерю веса, безболезненную желтуху, тромбоз дистальных отделов вен, легочную эмболию, так же как сахарный диабет и/или панкреатит. С раком поджелудочной железы связаны различные факторы риска и включают, но не ограничиваются ими, курение; застарелый диабет; хронический панкреатит; а также определенные наследственные факторы, такие как наследственный панкреатит, синдром множественной эндокриннойнеоплазии 1 типа,наследственный неполипозный колоректальный рак (HNPCC; синдром Линча), синдром фон-ГиппеляЛиндау, атаксия-телеангиэктазия, и семейный синдром множественных атипичных невусов (FAMMM). Диагностические процедуры, которые применяют для диагностики рака поджелудочной железы,включают визуализирующие исследования, такие как компьютерная томография (КТ), магнитнорезонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ), эндоскопическое ультразвуковое исследование (ЭУИ), лапароскопия, эндоскопическая ретроградная холангиопанкреатография(ЭРХП) и чрескожная транспеченочная холангиография (ЧТХ), но окончательный диагноз делают посредством эндоскопической пункционной биопсии или изъятия подозрительной ткани хирургическим путем. Указанные различные диагностические методы также используются для того, чтобы диагностировать стадии рака, что необходимо для подбора вариантов лечения. Для того чтобы определить рак поджелудочной железы, обычно используются следующие стадии. Стадия 0 (карцинома in situ): на этой стадии патологические клетки находят в эпителиальной выстилке поджелудочной железы. Указанные патологические клетки могут стать злокачественными и распространиться к окружающим тканям. Стадия I: на этой стадии рак образуется и выявляется только в поджелудочной железе. Стадию I дополнительно разделяют на две подстадии, в зависимости от размера новообразования: стадия IA (но-5 023722 вообразование составляет 2 см или меньше) и стадия IB (новообразование составляет больше чем 2 см). Стадия II: на этой стадии рак распространяется к соседним тканям и органам, и, возможно, распространяется к лимфатическим узлам. Эту стадию дополнительно разделяют на подстадии, на основании того, где распространился рак. Стадия IA (распространение к соседней ткани и органам, но не в лимфу); и стадия IIB (распространение в лимфу и возможно к другим соседним тканям и органам). Стадия III: на этой стадии рак распространяется к основным кровеносным сосудам возле поджелудочной железы, и, возможно, также распространяется к соседним лимфатическим узлам. Стадия IV: на этой стадии рак может иметь любой размер, и распространяется к отдаленным тканям и органам, таким как печень, легкое, и брюшная полость (т.е. рак метастазировал). Существует три основных варианта лечения (хирургия, радиационная терапия и химиотерапия), которые зависят от стадии. Лечение первичного рака поджелудочной железы стадии I и стадии II может включать хирургию, со вспомогательной химиотерапией, основанной на гемцитабине или на схеме лечения 5-фторурацилом, с или без радиационной терапии. Часто первичный рак поджелудочной железы после лечения рецидивирует (названый рецидивирующим раком поджелудочной железы). Химиотерапию на основе гемцитабина, как правило, также применяют для пациентов с рецидивирующим и локально распространившимся раком поджелудочной железы, иногда ее сопровождают радиацией или химиолучевой терапией. 7.2. Метастаз. Как отмечено в "Разделе уровня техники", метастаз относится к процессу, в соответствии с которым распространяется рак. Если коротко, то клетки новообразования покидают первичное новообразование,передвигаются через кровеносную или лимфатическую систему к новому участку ткани, и формируют вторичное новообразование. Новообразования на новом участке ткани упоминаются как метастатические новообразования, и обычно идентифицируются с источником первичного новообразования. Например,рак поджелудочной железы, который распространяется к другим тканям, упоминается "как метастатический рак поджелудочной железы", несмотря на местоположение ткани вторичного, метастатического новообразования. Раковые клетки часто распространяются к лимфатическим узлам возле первичного новообразования, которую называют поражением лимфатического узла или местно-распространенным заболеванием. Метастаз состоит из многих различных стадий: прорастание и миграция, интравазация, циркуляция,экстравазация и колонизация, пролиферация и ангиогенез. Во время прорастания и миграции, отдельные клетки отделяются от первичного новообразования и проникают в смежную, здоровую ткань. Чтобы достичь этого, раковые клетки должны стать подвижными, и вероятно, подвергаются фенотипическому преобразованию, названному эпителиально-мезенхимальным переходом, который обеспечивает это. Kalluri, R., и др., J. Clin. Invest., 119 (6) (2009), 1420-28. Такие клетки могут вырабатывать ферменты, которые ослабляют внеклеточный матрикс, таким образом, облегчая миграцию из первичного новообразования в окружающие здоровые ткани. Когда раковая клетка контактирует с кровеносными или лимфатическими сосудами, она вставляется между эндотелиальными клетками, выстилающими сосуды, и проникает в кровоток или лимфатическую систему. Затем аберрантная клетка перемещается через систему кровообращения или лимфатическую систему к новому органу или к лимфатическому узлу. Затем раковая клетка может разместиться в капиллярах или лимфатических сосудах органа, такого как печень, легкое,или в другой ткани или органе, и затем экставазитировать, проникая через эндотелий в пространство ткани. Наконец, во время колонизации, пролиферации и ангиогенеза, опухолевых клеток занимают место нахождения в их новой питающей ткани и начинают расти. Когда новое метастатическое новообразование достигает достаточного размера, оно может выделять факторы роста, такие как ФРЭС, для того чтобы стимулировать рост новых кровеносных сосудов в новообразовании, что приводит к доставке кислорода и питательных веществ для быстрого роста новообразования. Новообразования могут распространяться посредством метастаза почти к любой части организма. Местный рецидив, метастазы в печень, и распространение в брюшинную полость являются самыми общими участками рецидива после резекции новообразований поджелудочной железы. Типичное локорегионарное прорастание находят в ретропанкреатической нервной ткани, двенадцатиперстной кишке,воротной вене (ВВ), и брыжеечной верхней вене (БВВ), или региональных лимфатических узлах. Наиболее типичными участками отдаленных метастаз рака поджелудочной железы являются печень и брюшная полость. Другими, менее типичными участками являются легкое, кости и мозг. О других необычных участках, таких как мускулы, кожа, сердце, плевра, желудок, пупок, почка, аппендикс, семенной канатик и простата, также сообщалось (Говард Howard, 1996, Curr. Probl Cancer 20(5):281-328; Borad и др., 2009,Yale J. Biol. Med. 82(1): 1-6). 7.3. Лечение первичного и метастатического рака поджелудочной железы. Пациенты, у которых диагностировали рак поджелудочной железы, обычно имеют плохой прогноз,частично потому что рак поджелудочной железы обычно не проявляет симптомов вначале, что приводит к местному разрастанию или к метастатическому заболеванию, что устанавливается уже во время диагноза. Варианты лечения, обсужденные выше, зависят от стадии заболевания, которая была установлена при диагнозе. 7.4. Антитела к hPG и их действие на первичный и метастатический рак поджелудочной железы. Как раскрыто здесь, было сообщено, что пациенты с раком поджелудочной железы имеют выявляемый уровень прогастрина в новообразованиях поджелудочной железы (Caplin и др., 2000, Br. J. Surg. 87 (8): 1035-1040). Данные, которые сообщили здесь, и обсудили в разделе примеров, демонстрируют,что клеточные линии рака поджелудочной железы ВхРС-3, MIA РаСа-2, Capan 1 и SU.86.86 экспрессируют мРНК для прогастрин-кодирующего гена (GAST) (пример 7), и также что клеточные линии рака поджелудочной железы секретируют прогастрин (пример 8). Теперь было обнаружено, что как пациенты с первичным, так и пациенты с метастатическим раком поджелудочной железы имеют повышенный уровня прогастрина в плазме и/или в сыворотке крови (пример 6), что рост клеток, полученных из первичных и метастатических новообразований поджелудочной железы, ингибируется в результате обработки антителами, которые специфично связывают человеческий прогастрин ("hPG") (примеры 9, 10 и 11), и что способность клеток рака поджелудочной железы расти в качестве сфероидов новообразования при культивировании в условиях низкой адгезии значительно уменьшается после предварительной обработки антителами к hPG (пример 12). На основании этих неожиданных и обнадеживающих открытиях,предполагается, что такие антитела к hPG могут применяться для того, чтобы помочь установлению диагноза рака поджелудочной железы, контролировать эффективность схемы лечения рака поджелудочной железы, лечить рак поджелудочной железы любой стадии развития, включая и первичный и метастатический рак поджелудочной железы, и предотвратить рецидив рака поджелудочной железы. Как недавно было продемонстрировано Hollande и др., прогастрин стимулирует метаболический путь бета-катенина/Tcf-4 колоректальных раковых клеток, подавляя ICAT, негативный регулятор сигнальной системы бета-катенина/Tcf-4 (см. WO 2007/135542). Сигнальная система бета-катенина/Tcf-4 вызывает пролиферацию клеток. В отсутствии этой сигнальной системы они дифференцируют и подвергаются нормальному клеточному циклу, включая запрограммированную гибель клетки, или апоптоз.Hollande и др. также продемонстрировали, что воздействие на такие клетки антителами к hPG блокирует пролиферацию, которая вызывается бета-катенином/Tcf-4, и что рост или пролиферация клеток CRC ингибируется (см., например, WO 2007/135542). Клетки, которые пролиферируют в ответ на обработку или подвержение воздействию прогастрина, либо выработанного эндогенно, либо экзогенно, и в которых пролиферация ингибируется после обработки или подвержения воздействию антител к PG, упоминаются здесь как "прогастрин-зависимые". Как отмечено выше, было выявлено, что как клетки первичного, так и клетки метастатического новообразования являются прогастрин-зависимыми, и отвечают на обработку или подвержение воздействию антител к PG. Не желая быть связанным с какой-либо теорией, полагают, что антитела к PG проявляют свои антипролиферативные свойства, связывая PG и блокируя его взаимодействие с его предполагаемым рецептором, в свою очередь, подавляя пролиферацию, которая вызывается бета-катенином/Tcf-4,что является результатом повышенной экспрессии ICAT. Другие механизмы, с помощью которых антитела к PG могут препятствовать выживанию и/или росту первичных и/или метастатических раковых клеток, также возможны, и не предназначены для ограничения объема изобретений, раскрытого здесь. 7.5. Терапевтические способы. Соответственно, в одном аспекте настоящее раскрытие обеспечивает способы лечения субъекта,страдающего от или у которого диагностирован рак поджелудочной железы. Способ содержит введение субъекту количества одного или более антитела(л) к PG, эффективных для того, чтобы обеспечить терапевтический эффект. Антитела к PG в общем и определенные антитела к PG, полезные в указанных способах, описаны подробно в изложенном ниже разделе. Субъект, который подвергается лечению, может представлять собой любое животное, например млекопитающее, такое как сельскохозяйственное животное (например, корова, свинья, лошадь и т.д.),или домашнее животное (например, собака, кошка и т.д.) или человек. Антитело к PG, которое вводится,должно быть определенным для видов животного, которое подвергают лечению. Для лечения таких пациентов, как человек, антитело(а) к PG должны специфично связать человеческий прогастрин (упомянутые здесь как "антитела к hPG", описанные более подробно ниже). Рак поджелудочной железы, который лечат, может быть в любой стадии развития, от стадии 0 до стадии I, стадии II, стадии III или даже стадии IV. В действительности, существенное преимущество терапии антителами к PG, описанной здесь, состоит в том, что она, как ожидают, будет эффективна как против метастатических новообразований поджелудочной железы, так и против первичных новообразований поджелудочной железы, таким образом, обеспечивая пользу пациентам, имеющим рак поджелудочной железы даже в последних стадиях развития. Указанное, как ожидают, также предотвращает рецидив рака поджелудочной железы. Терапия антителами к PG может применяться одна, в качестве монотерапии, или в комбинации с или дополнительно к другим способам лечения, которые традиционно применяют для лечения определенной стадии рака поджелудочной железы. Такое традиционное лечение отмечено выше, и включает химиотерапию с применением, например, гемцитабина, 5-фторурацила или других химиотерапевтических препаратов, а также таргетную терапию, такую как терапию бевацизумабом. В конкретном варианте осуществления изобретения терапию антителами к PG применяют в комбинации с, или в качестве до-7 023722 полнительной, в терапии с другими антителами, направляющимися к клеткам новообразования, такими как бевацизумаб. Когда терапию антителами к PG применяют в комбинации с другой терапией, то антитело(а) к PG и другую терапию можно вводить одновременно, последовательно, или раздельно. Как применяется здесь, говорят, что антитело к hPG и второй терапевтический препарат вводят последовательно, если их вводят пациенту в тот же день, например во время того же посещения пациента. Последовательное введение может происходить с интервалом в 1, 2, 3, 4, 5, 6, 7, 8 или более часов. В отличие от этого, говорят, что антитело к PG и второй терапевтический препарат вводят раздельно, если их вводят пациенту в разные дни. Например, антитело к PG и второй терапевтический препарат можно вводить в интервалы, составляющие 1, 2, 3, 4, 5, 6 дней, 1 неделя, 2 недели или 1 месяц. Введение антитела кPG может предшествовать или следовать за введением второго терапевтического препарата. В качестве альтернативы, антитело к PG и второй терапевтический препарат можно вводить одновременно на протяжении периода времени, за которым следует второй период времени, в котором чередуют введение антитела к PG и второго терапевтического препарата. Точно так же антитело к PG можно вводить в комбинации с, или дополнительно к хирургическому удалению новообразования(й), если это возможно. Антитело(а) к PG можно вводить до, во время или после удаления новообразования. 7.6. Фармацевтические композиции. Антитело(а) к PG традиционно вводят в виде фармацевтических препаративных форм или составов. Такие препаративные формы или композиции могут необязательно включать дополнительные активные и/или терапевтические вещества, которые являются известными в данной области. Препаративные формы традиционно включают фармацевтически приемлемый носитель, наполнитель или разбавитель. Определенные носители, наполнители и/или разбавители будут зависеть от желательного способа введения. Композиция может быть предоставлена в любом подходящем виде в зависимости от желательного способа введения конкретному пациенту. Антитела к PG можно вводить субъекту многими путями введения, как правило, парентерально,например, посредством подкожной, внутривенной, внутрибрюшинной или внутримышечной инъекции. Введение может быть произведено как одна или более болюсных инъекций или как одна или более инфузий. Другие пути введения также возможны в соответствии со знаниями специалиста в данной области. Самый подходящий путь введения в любом данном случае будет зависеть от конкретного антитела,субъекта, и стадии рака поджелудочной железы, который подвергается лечению. Фармацевтические композиции могут быть подходящим образом представлены в виде одноразовой дозы, содержащей заранее определенное количество антитела к PG на дозу. Такая одноразовая доза может содержать, например, но не ограничиваясь, 5 мг-5 г, например 10 мг-1 г или 20-50 мг. Фармацевтические композиции могут быть подготовлены для хранения в виде лиофилизованных препаративных форм или водных растворов, посредством смешивания антитела, имеющее желательную степень чистоты с дополнительными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами, обычно используемыми в данной области (все из которых упоминаются здесь как "носители"), т.е. буферирующими агентами, стабилизаторами, консервантами, изотонирующими добавками,неионогенными детергентами, антиокислителями, и другими различными добавками. См. Remington'sPharmaceutical Sciences, 16-й выпуск (Osol, ред. 1980). Такие добавки должны быть нетоксичными для субъекта в применяемых дозах и концентрациях. Буферирующие агенты способствуют поддержанию значения рН в диапазоне, приближенном к физиологическим значениям. Они могут присутствовать в концентрации, составляющей пределы от приблизительно 2 до приблизительно 50 мМ. Подходящие буферирующие агенты для применения в соответствии с настоящим раскрытием включают как органические, так и неорганические кислоты, и их соли,такие как цитратные буферы (например, смесь мононатрий цитрата - двунатрий цитрата, смесь лимонной кислоты - тринатрий цитрата, смесь лимонной кислоты -мононатрия цитрата и т.д.), сукцинатные буферы (например, смесь янтарной кислоты -мононатрий сукцината, смесь янтарной кислоты - гидрооксида натрия, смесь янтарной кислоты - двунатрий сукцината и т.д.), тартратные буферы (например, смесь винной кислоты - тартрата натрия, смесь винной кислоты - тартрата калия, смесь винной кислоты - гидрооксида натрия и т.д.), фумаровые буферы (например, смесь фумаровой кислоты - мононатрий фумарата, смесь фумаровой кислоты - двунатрий фумарата, смесь мононатрий фумарата - двунатрий фумарата и т.д.) глюконовые буферы (например, смесь глюконовой кислоты - натрий глюконата, смесь глюконовой кислоты - гидрооксида натрия, смесь глюконовой кислоты - глюконата калия и т.д.), оксалатные буферы(например, смесь щавелевой кислоты - оксалата натрия, смесь щавелевой кислоты - гидрооксида натрия,смесь щавелевой кислоты - оксалата калия и т.д.), лактатные буферы (например, смесь молочной кислоты - натрий лактата, смесь молочной кислоты - гидрооксида натрия, смесь молочной кислоты - лактата калия и т.д.) и ацетатные буферы (например, смесь уксусной кислоты - ацетата натрия, смесь уксусной кислоты - гидрооксида натрия и т.д.). Дополнительно могут применяться фосфатные буферы, гистидиновые буферы и триметиламиновые соли, такие как Трис. Консерванты могут быть добавлены, для того чтобы задержать рост микробов, и они могут быть добавлены в количестве в пределах от 0,2-1% (мас./об.). Подходящие консерванты для применения в со-8 023722 ответствии с настоящим раскрытием включают фенол, бензиловый спирт, мета-крезол, метилпарабен,пропилпарабен, октадецилдиметилбензил аммоний хлорид, бензалкониевые галиды (например, хлорид,бромид и йодид), гексамнтоний хлорид, и алкилированные парабены, такие как метилпарабен или пропилпарабен, катехол, резорцинол, циклогексанол, и 3-пентанол. Изотонирующие добавки, иногда известные как "стабилизаторы", могут быть добавлены для того,чтобы гарантировать изотоничность жидких композиций настоящего раскрытия и включают многоатомные сахарные спирты, например, трехатомные или более высокие сахарные спирты, такие как глицерин,эритритол, арабитол, ксилитол, сорбитол и маннит. Стабилизаторы относятся к широкой категории наполнителей, которые могут варьироваться в зависимости от функции от объемообразующего препарата до добавки, которая солюбилизирует терапевтический препарат или помогает предотвратить денатурацию или прилипает к стенке емкости. Традиционные стабилизаторы могут представлять собой многоатомные сахарные спирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутамин, треонин и т.д., органический сахар или сахарные спирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбитол, ксилитол, рибитол, миоиниситол, галактитол, глицерин и т.п., включая циклитолы, такие как инозитол; полиэтиленгликоль; аминокислотные полимеры; уменьшающие содержание серы агенты, такие как мочевина,глутатинон, тиоктовая кислота, натрий тиоглиеолат, тиоглицерол, -ионотиоглицерол и натрий тиосульфат; полипептиды низкой молекулярной массы (например, пептиды из 10 остатков или меньше); белки,такие как человеческий сывороточный альбумин, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон моносахариды, такие как ксилоза, манноза, фруктоза, глюкоза; дисахариды, такие как лактоза, мальтоза, сахароза и трисахариды, такие как раффиноза; и полисахариды, такие как декстран. Стабилизаторы могут присутствовать в диапазоне от 0,1 до 10000 в весовом отношении активного белка. Неионогенные поверхностно-активные вещества или детергенты (также известные как "смачивающие вещества") могут быть добавлены для того, чтобы помочь солюбилизировать терапевтический препарат, а также защитить терапевтический белок от агрегации, вызываемой встряхиванием, что также позволяет подвергать препаративную форму скалыванию поверхности, не вызывая денатурацию белка. Подходящие неионогенные поверхностно-активные вещества включают полисорбаты (20, 80 и т.д.), полиоксамеры (184, 188 и т.д.), Плюрониловые полиолы, моноэфиры полиоксиэтилен-сорбитана(TWEEN-20, TWEEN-80 и т.д.). Неионогенные поверхностно-активные вещества могут присутствовать в диапазоне от приблизительно 0,05 мг/мл до приблизительно 1,0 мг/мл, например приблизительно 0,07 мг/мл - приблизительно 0,2 мг/мл. Однако поверхностно-активные вещества имеют тенденцию связываться с антителами, и могут поставить под угрозу их конформацию. Поэтому, когда их используют,устойчивые концентрации должны быть низкими и определяться экспериментально. Дополнительные различные наполнители могут включать хелатирующие вещества (например,EDTA), антиокислители (например, аскорбиновая кислота, метионин, витамин Е), и сорастворители. 7.7. Эффективные дозы. Антитела к PG вводят субъекту в количестве, достаточном или эффективном для того, чтобы обеспечить терапевтический эффект. В контексте лечения первичного и/или метастатического рака поджелудочной железы, терапевтический эффект может подразумеваться, если достигается одно или больше из следующих условий: остановка или замедление роста новообразований, уменьшение количества и/или размеров новообразований у пациента, уменьшение неоперабельных новообразований до размеров и местоположений таким образом, что они могут быть удалены хирургическим путем, увеличение продолжительность жизни, и/или улучшение качества жизни пациента. Полное излечение, в то время как это является желательным, не требуется для того, чтобы существовала терапевтический эффект. В действительности, так как медиана выживаемости от установления диагноза рака поджелудочной железы составляет только 3-6 месяцев (StathisMoore, 2010, Nat Rev ClinOncol. 7(3): 163-72), то увеличение выживания человека дополнительных 3 месяца сверх этой медианы обеспечивает значительный терапевтический эффект. См., например, Philip и др., 2009, J. Clin. Oncol. 24(33):5660-5669. В неком контексте терапевтический эффект может быть коррелирован с одной или более суррогатными конечными точками, в соответствии со знаниями специалиста в данной области. В качестве неограничивающего примера, у субъекта могут быть установлены концентрации PG в плазме и/или в сыворотке крови, в динамике по времени, где снижение уровня PG, или снижение уровня ниже порогового значения, например, ниже приблизительно 50, 40, 30, 20, 10 или 5 пМ будет указывать на терапевтический эффект. Размер новообразования, количество и метаболизм могут быть установлены, посредством использования различных способов визуализации, таких как, но не ограничиваясь ими, КТ, МРТ, функциональная МРТ, ОФЭКТ и ПЭТ, так же как и другие способы, известные специалистом в данной области. Связывание всего свободного PG не обязательно для достижения терапевтической эффективности,хотя это может быть и желательно. Свободный PG означает PG, который может быть связывается анти-9 023722 телом к PG. Часто уменьшение концентрации свободного PG в пределах или возле новообразований,системно, в определенных жидкостях организма, или где-либо еще, до более ограниченной степени, также может быть эффективным. Образцовые ткани и жидкости организма, в которых свободная концентрация PG может быть уменьшена посредством введения композиций антитела(л) к PG, включают, но не ограничиваются ими, образцы новообразования, удаленные от пациента, жидкость асцита, жидкость от плевральных излияний, цереброспинальную жидкость, лимфу, кровь, плазму, сыворотку и другие. Концентрация PG в одной или более указанных тканей или жидкостей организма может быть определена количественно посредством использования метода ELISA или других методов, которые являются известными специалистам в данной области. В соответствии со знаниями специалиста в данной области, доза антитела к PG может титроваться для пациента, для того чтобы снизить концентрацию свободного PG в ткани или жидкости организма,которые представляют интерес, в предварительно определенный период времени после введения по крайней мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100%, или приблизительно 5-10%, приблизительно 10-15%, приблизительно 15-20%, приблизительно 20-25%, приблизительно 25-30%, приблизительно 30-35%, приблизительно 35-40%, приблизительно 40-45%, приблизительно 45-50%, приблизительно 50-55%, приблизительно 55-60%, приблизительно 60-65%, приблизительно 65-70%, приблизительно 70-75%, приблизительно 75-80%, приблизительно 80-85%, приблизительно 85-90%, или приблизительно 90-95%, или уменьшения процента концентрации свободного PG, который находится в пределах любых из предшествующих значений. Количество вводимого антитела к PG, будет зависеть от многих факторов, включая стадию рака поджелудочной железы, который подвергается лечению, вид, путь и место введения, схему лечения (например, применяют ли второе терапевтическое вещество), возраст и состояние конкретного пациента,которого подвергают лечению, чувствительность пациента, которого подвергают лечению антителами кPG. Соответствующая доза может быть легко определена специалистом в данной области. В конечном счете, практикующий врач определяет соответствующие дозы, которые будут применяться. Указанная доза может повторяться настолько часто как это необходимо. Если развиваются побочные эффекты, то количество и/или частота дозы может быть изменена или уменьшена, в соответствии с нормальной клинической практикой. Надлежащая доза и схема лечения могут быть установлены, посредством контроля продвижение терапии при помощи применения способов настоящего раскрытия или других способов,известных специалисту в данной области. Эффективные дозы могут быть установлены первично в результате in vitro исследования. Например, начальная доза для применения у животных может быть составлена для достижения в крови или в сыворотке концентрации антитела к PG, которая является около или выше связывающей способности,постоянной для конкретного антитела к PG. Вычисляя дозы для достижения такой концентрации в крови или в сыворотке, принимают во внимание бионакопление конкретного антитела, что является в пределах способностей специалистов в данной области. Для руководства читателя отправляют к части 1: GeneralPrinciples in "Goodman u Gilman's The Pharmacological Basis of Therapeutics", 11 е изд., Hardman, J.G., и др.,Eds., McGraw-Hill Professional, и к ссылкам, процитированным там. Начальные дозы также могут быть установлены в соответствии с данными исследования in vivo, таких как экспериментальные модели на животных. Модели на животных, полезные для тестирования эффективности лечения рака поджелудочной железы являются известными в данной области. Обычно специалисты в данной области могут привычно адаптировать такую информацию, для того чтобы определить дозы, подходящие для введения человеку. В определенных вариантах осуществления изобретения в.в. доза может быть определена для отдельного субъекта, посредством измерения концентрации PG в сыворотке крови или плазме человека,несколько раз несколько дней за несколько недель до лечения, и вычисления количества антитела к PG,которое было бы насыщающим, т.е. количества, которого будет достаточно для того, чтобы связать весьPG. Как будет воспринято специалистами в данной области, количество любого конкретного антитела,необходимого для достижения насыщенности концентрации PG для данной сыворотки крови или плазмы, будет зависеть, частично, от аффинной константы конкретного антитела. Способы для вычисления количества насыщения для определенных антител к PG, которые представляет интерес, известны. Для того чтобы обеспечить насыщенность, можно вводить количество, которое является большим,чем расчетное количество насыщения, например, можно вводить по крайней мере в 2, 3, 4, 5, 6, 7, 8, 9 или даже в 10 раз больше, чем расчетное количество насыщения. Для способов введения других, чем в.в.,количество может подбираться на основании фармакокинетики и бионакопления, которые известны в данной области. Эффективная доза антитела к PG, предполагают, будет варьироваться в пределах от приблизительно 0,001 мг/кг до приблизительно 250 мг/кг как однократное (например, болюс) введение, многократные введения или непрерывное (например, инфузия) введение, или составлять любой эффективный диапазон или его значение, в зависимости от стадии рака поджелудочной железы, который подвергается лечению,пути введения и возраста, веса и состояния субъекта. В определенных вариантах осуществления изобретения каждая доза может варьироваться приблизительно от 0,1 до приблизительно 0,5 мг/кг; приблизи- 10023722 тельно 0,25 мг/кг - приблизительно 0,75 мг/кг и составлять приблизительно 0,5 мг/кг - приблизительно 1 мг/кг; приблизительно 2 мг/кг; от приблизительно 1,5 мг/кг до приблизительно 2,5 мг/кг; приблизительно 2 мг/кг - приблизительно 3 мг/кг; приблизительно 2,5 мг/кг - приблизительно 3,5 мг/кг; приблизительно 3 мг/кг - приблизительно 4 мг/кг; приблизительно 3,5 мг/кг - приблизительно 4,5 мг/кг; приблизительно 4 мг/кг - приблизительно 5 мг/кг; приблизительно 5 мг/кг - приблизительно 7 мг/кг; приблизительно 6 мг/кг - приблизительно 8 мг/кг; приблизительно 7 мг/кг - приблизительно 9 мг/кг; приблизительно 8 мг/кг - приблизительно 10 мг/кг; приблизительно 10 мг/кг - приблизительно 15 мг/кг; приблизительно 12,5 мг/кг - приблизительно 17,5 мг/кг; приблизительно 15 мг/кг - приблизительно 20 мг/кг; приблизительно 17,5 мг/кг - приблизительно 22,5 мг/кг; приблизительно 20 мг/кг - приблизительно 25 мг/кг; приблизительно 22,5 мг/кг - приблизительно 27,5 мг/кг; приблизительно 25 мг/кг - приблизительно 30 мг/кг; приблизительно 30 мг/кг - приблизительно 40 мг/кг; приблизительно 35 мг/кг - приблизительно 45 мг/кг; приблизительно 40 мг/кг - приблизительно 50 мг/кг; приблизительно 45 мг/кг - приблизительно 55 мг/кг; приблизительно 50 мг/кг - приблизительно 60 мг/кг; приблизительно 55 мг/кг - приблизительно 65 мг/кг; приблизительно 60 мг/кг - приблизительно 70 мг/кг; приблизительно 65 мг/кг - приблизительно 75 мг/кг; приблизительно 70 мг/кг - приблизительно 80 мг/кг; приблизительно 75 мг/кг - приблизительно 85 мг/кг; приблизительно 80 мг/кг - приблизительно 90 мг/кг; приблизительно 85 мг/кг - приблизительно 95 мг/кг; приблизительно 90 мг/кг - приблизительно 100 мг/кг; приблизительно 95 мг/кг - приблизительно 105 мг/кг; приблизительно 100 мг/кг - приблизительно 150 мг/кг; приблизительно 125 мг/кг - приблизительно 175 мг/кг; приблизительно 150 мг/кг - приблизительно 200 мг/кг; приблизительно 175 мг/кг приблизительно 225 мг/кг; приблизительно 200 мг/кг - приблизительно 250 мг/кг. Другие диапазоны дозы также возможны. Количество, частота и продолжительность введения будут зависеть от множества факторов, таких как возраст пациента, вес и состояние заболевания. Таким образом, в неограничивающих примерах, схема лечения введения может продолжаться на протяжении 1 дня или больше, 2 дней или больше, 3 дней или больше, 4 дней или больше, 5 дней или больше, 6 дней или больше, 1 недели или больше, от 2 недель без ограничений, на протяжении 2 недель до 6 месяцев, от 3 месяцев до 5 лет, от 6 месяцев до 1 или 2 лет, от 8 месяцев до 18 месяцев, или подобным образом. Необязательно, схема лечения предусматривает повторное введение, например, один раз ежедневно, два раза в день, каждые два дня, три дня, пять дней,одну неделю, две недели, или один месяц. Повторное введение может быть в той же дозе или в отличной дозе. Введение может быть повторено один раз, два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз, или больше. Терапевтически эффективное количество антитела кPG можно вводить как одноразовую дозу или на протяжении схемы лечения, например, в течение недели, двух недель, трех недель, одного месяца, трех месяцев, шести месяцев, одного года, или дольше. 7.8. Способы диагностики и мониторинга пациентов для определения терапевтической эффективности. Как отмечено выше, пациенты, у которых диагностирован первичный и/или метастатический рак поджелудочной железы, имеют повышенный уровень PG в плазме и/или в сыворотки крови. Ссылаясь на фиг. 4, базовый уровень PG у здоровых людей является незначительным, являясь обычно в пределах выявления. Уровень PG в плазме и/или в сыворотки крови у субъектов с первичным и/или метастатическим раком поджелудочной железы является определяемым и составляет приблизительно 50 пМ. На основании этого наблюдения, уровень PG в плазме и/или в сыворотке крови может быть использован для того,чтобы помочь установлению диагноза, или для контроля эффективности лечения первичного или метастатического рака поджелудочной железы. Соответственно, настоящее раскрытие также обеспечивает способы диагностики, или контроля эффективности курса лечения первичного или метастатического рака поджелудочной железы. Чтобы помочь установлению диагноза, уровень PG в плазме или в сыворотке крови от индивидуального образца для установления диагноза может быть установлен по сравнению с пороговым значением, где уровень выше чем пороговое значения указывает на рак поджелудочной железы, особенно если другие диагностические тесты указывают на то, что человек может страдать от рака поджелудочной железы. В некоторых вариантах осуществления изобретения, концентрация PG в плазме или в сыворотке крови, составляющая по крайней мере приблизительно 50 пМ, является показательной для рака поджелудочной железы, особенно когда соотносится с другими положительными результатами исследования. Для целей контроля эффективности терапии, уровень PG в крови, плазме или в сыворотке крови может быть установлен в определенные моменты времени. Снижение концентрации в динамике по времени, и/или установленный уровень, ниже порогового значения в определенный момент времени, указывают на эффективность лечения. Пороговое значение может составлять значение, которое обсуждалось выше, или может быть определенным для субъекта значением, полученным от субъекта до начала лечения, или на раннем этапе во время раунда терапии. Не желая быть связанным с какой-либо определенной теорией, полагают, что, поскольку количество и/или размеры новообразования у пациента уменьшаются в результате раунда терапии, то общее количество PG, вырабатываемого новообразованием, также понижается. В отличие от этого, отсутствие существенных изменений, или повышение уровня PG после того, как раунд терапии завершен, может указывать на то, что терапия была не эффективна. Эта информация может применяться практикующими врачами для того, чтобы решить, нужно ли начинать новый раунд терапии. Уровень PG может быть установлен посредством использования аналитических методов, которые являются известными специалистам в данной области, таких, но, не ограничиваясь ими, как РИА и ELISA. Антитела к hPG, подходящие для установления уровней PG у человека, описаны в разделе, приведенном ниже. В конкретном варианте осуществления изобретения уровень PG может быть установлен посредством использования метода сэндвич-ELISA с одним антителом к PG, направленным к N-концу прогастрина, и вторым антителом к PG, направленным к С-концу прогастрина. Образцовые N-и С-концевые антитела к PG, полезные для такого сэндвич-анализа, описаны в изложенном далее разделе. В таком анализе,подготавливают поверхность, такую как лунки в 96-луночном планшете, с которой связывается известное количество первого, "иммобилизованного", N-концевого или С-концевого антитело к PG. Испытательный образец затем наносят на поверхность, затем следует инкубационный период. Поверхность затем промывают, для того чтобы удалить несвязанный антиген и применяют раствор, содержащий второе,"идентифицирующее", антитело к PG, где идентифицирующее антитело связывает разные антигенные детерминанты PG (например, если иммобилизованное антитело представляет собой С-концевое антитело к PG, то N-концевое антитело к PG используется в качестве идентифицирующего антитела, и наоборот). Уровни PG затем устанавливают либо непосредственно (если, например, идентифицирующее антитело конъюгировано с идентифицирующей меткой), или косвенно (посредством меченного вторичного антитела, которое связывает идентифицирующее антитело к PG). Для этого анализа антитела должны применяться в избытке таким образом, чтобы весь PG связывался и определялся количественно. Конкретный сэндвич-анализ для установления уровня PG в плазме и/или в сыворотке крови приведен в примере 1. Могут быть проведены многократные измерения при различных интервалах времени после завершения терапии, и затем изображены в виде графика, для того чтобы определить, существует ли тенденция. В неограничивающем примере, уровень PG может определяться еженедельно или ежемесячно в течение первых шести месяцев после того, как раунд терапии заключен. Другие интервалы времени также возможны. В варианте осуществления изобретения, включающем раунд терапии с применения антитела к PG,одно или более измерений также могут быть проведены в течение терапии таким образом, чтобы оценить действие антител на уровень PG. В других таких вариантах осуществления изобретения, где остаточные антитела к PG присутствуют во время взятия проб у пациента, данные могут показывать уменьшение уровней PG, по причине секвестирования PG антителами, за чем следует повышение, поскольку указанный эффект понижается, сопровождаемый последующим понижением, если лечение было эффективным. В еще других вариантах осуществления изобретения измерения после проведения терапии могут быть проведены после того, как считается, что антитела к PG были очищены после пациента так, чтобы связывание PG такими антителами не повлияло на точность измерения концентрации PG. Могут применяться разные исходные уровни для сравнения уровня PG, установленного у конкретного пациента. В некоторых вариантах осуществления изобретения исходный уровень установлен предыдущими измерениями у того же пациента, который был установлен в предварительный период времени. В неограничивающем примере, уровни PG могут определяться каждую неделю или каждый месяц в течение первых шести месяцев после окончания лечения, затем каждые три месяца до истечения второго года после окончания лечения, и затем каждые шесть месяцев или год после этого. Другие интервалы времени также возможны. В других вариантах осуществления изобретения исходный уровень может быть установлен из средних уровней PG в популяции людей с характеристиками, подобными таковым у людей из контрольной группы. Такие характеристики могут включать, но не обязательно ограничиваются ими, пол, возраст,первичный вид рака, подвержение определенному виду лечения, любые их комбинации, и другие. В еще других вариантах осуществления изобретения больше чем один исходный уровень может применяться для мониторинга конкретного пациента. Например, могут применяться как определенный для пациента исходный уровень, так и исходный уровень, полученный от популяции. В некоторых вариантах осуществления изобретения, где средняя концентрация PG у ранее подвергавшемся лечению от рака пациента находится в нормальном диапазоне для соответствующей популяции, с которой сравнивается пациент, и остается устойчивым, пациент должен отмечаться как не имеющий метастаз и, таким образом, не требующий нового лечения. В отличие от этого, если концентрацияPG, как замечают, повышается в динамике по времени у ранее подвергавшемся лечению от рака пациента, и в определенных вариантах осуществления изобретения, превышает порог, полученный из данных популяции, то пациент должен отмечаться как возможно имеющий метастазы и, таким образом, быть кандидатом на новое лечение от метастатического рака. Поскольку пища обычно увеличивает секрецию и синтез гастрина, то это также может вызывать преходящее повышение уровня PG в крови, что может препятствовать точному установлению уровня PG у пациентов, в отношении которых производится мониторинг на терапевтическую эффективность и на наличие метастаз. Чтобы избежать этого эффекта, в частности, когда нужно определить концентрациюPG в образцах крови, образцы могут быть взяты у пациента после голодания. 7.9. Антитела к PG. Антитела, которые применяют в способах, раскрытых здесь, являются антителами, которые специфично связывают человеческий прогастрин предпочтительно перед другими продуктами гена гастрина. Ссылаясь на фиг. 1, ген гастрина транслируется в полипептид, состоящий из 101 аминокислоты, названный пре-прогастрин, который содержит сигнальную последовательность (подчеркнутую), которая расщепляется, из которого образуется прогастрин, полипептид, состоящий из 80 аминокислот. Прогастрин,в свою очередь, расщепляется с образованием продукта, состоящего из 34 аминокислот, соответствующих в последовательности остаткам 38-71 прогастрина, который затем который затем удлиняется на карбоксильном конце посредством глицинового остатка, образуя глицин-удлиненный G34 ("G34-Gly"). Промежуточным продуктом указанного расщепления является пептид, который состоит из 6 аминокислот, который называют С-концевым фланкирующим пептидом или CTFP, который соответствует в последовательности остаткам 75-80 прогастрина. Затем G34-Gly далее расщепляется с образованием полипептида, который состоит из 17 остатков, соответствующий в последовательности остаткам 55-71 прогастрина, и который называют G17-Gly. Удаление С-концевых глицинов G34-Gly и G17-Gly, за чем следует С-концевое амидирование, дает G34 и G17, соответственно, оба из которых являются амидированными на С-конце. Как используется здесь, антитело является "высокоспецифичным по отношению к" hPG, или "высокоспецифично связывает" hPG, если оно связывается с полноразмерным прогастрином, но совсем не связывается с CTFP, с амидированным гастрином, или с глицин-удлиненным гастрином, и является "специфичным по отношению к" hPG, или "специфично связывает" hPG если оно демонстрирует по крайней мере приблизительно в 5 раз большее связывание hPG чем CTFP и других продуктов гена гастрина, как установлено в стандартном анализе связывания. Специфические исследование ELISA, которое может применяться, чтобы оценить специфику конкретного антитела к hPG, предоставлено в примере 2. Такие высокоспецифичные и/или специфичные антитела к hPG (которые упоминаются здесь как"антитела к hPG") могут быть поликлональными ("антитела к hPG PAbs") или моноклональными ("антитела к hPG MAbs"), хотя для терапевтического применения и, в некоторых случаях, для диагностического или другого in vitro применения, моноклональные антитела являются предпочтительными. Антигенная детерминанта, связанная антителами к hPG, не важна. Полезные антитела к hPG могут связать N-концевую область hPG, С-концевую область hPG, или разные области hPG. Недавно было обнаружено, что, по крайней мере, для моноклональных антител к hPG, выбор антигена, который используется для индуцирования антител к hPG, может быть важным (см. международную заявкуРСТ/ЕР 2010/006329, поданную 15 октября 2010 г. и заявку US12/906,041 поданную 15 октября 2010 г., описания и конкретные описанные антитела к hPG которых включены здесь посредством ссылки; которые далее называют как заявки 329 и " 41 соответственно). Как раскрыто в заявках 329 и 041, не все антигены, hPG-специфичных, стимулируют производство моноклональных антител, которые специфично связывают hPG в физиологических условиях. Действительно, специфичных антигены,которые использовались для того, чтобы успешно индуцировать поликлональные антитела к hPG, такие как полноразмерный рекомбинантный hPG (см., например, WO 08/076454, заявитель Singh), и пептид,соответствующий последним десяти аминокислотам на С-концевом конце hPG (см. WO 07/135542, заявитель Hollande и др.), были не в состоянии вырабатывать моноклональные антитела. Как отмечено в заявках 329 и 041, антигенные N-концевые и С-концевые последовательности в пределах последовательности hPG были определены как такие, которые могут применяться для образования ноноклональных антител, которые специфично связывают hPG., которая представляет интересно, что антигенная последовательность не должна быть ограничена областями последовательности hPG, что является уникальным в этом случае. Пептидные антигены, имеющие области последовательности наряду с другими продуктами гена гастрина, например, G17, G34 и CTFP, дают моноклональные антителам, которые не только связывают hPG, но и связывают его специфически. Антитела к hPG, которые можно получить, используя пептидный антиген, имеющий последовательность, соответствующую N-концевой области hPG и/или который связывает N-концевую областьhPG, которые упоминаются здесь как "N-концевые антитела к PG". Специфическая образцовая антигенная область hPG, которая может применяться для того, чтобы сконструировать иммуноген, подходящий для того, чтобы получить как поликлональные, так и моноклональные антитела, специфичных по отношению к hPG, соответствует остатку 1-14 hPG: SWKPRSQQPDAPLG (SEQ ID NO: 25). Образцовые иммуногены, которые подходят для получения N-концевого антитела к hPG, так же как и CDR последовательности и VH и VL последовательности N-концевых моноклональных антител к hPG, полученные с помощью эти образцовых иммуногенов, представлены в табл. 1 А, ниже, и в разделе примеров. В табл. 1 А все аминокислотные последовательности представлены посредством использования традиционной ориентации NC. Для каждого иммуногена прогастриновый пептид синтезировали с С-концевым линкером одного остатка аминогексановой кислоты (Ahx), за чем следовал цистеиновый (Cys) остаток, который затем конъюгировался либо с носителем бычьего сывороточного альбумина ("БСА"), либо гемоцианина лимфы улитки ("ГТУ") посредством линкерного Cys остатка. Антитела к hPG, которые возможно получить посредством использования пептидного антигена,имеющего последовательность, соответствующую С-концевой области hPG, и/или который связывает Сконцевую область hPG, упомянуты здесь как "С-концевые антитела к hPG". Специфическая образцовая антигенная область, которая может применяться для того, чтобы сконструировать иммуноген, подходящий для получения как поликлональных, так и моноклональных С-концевых антитела к hPG, соответствует остаткам 55-80 hPG: QGPWLEEEEEAYGWMDFGRRSAEDEN (SEQ ID NO: 27). Образцовые иммуногены, включающие этот антиген, которые подходят для получения С-концевых антител к hPG, так же как и CDR последовательности и VH и VL последовательности С-концевых моноклональных антител кhPG, полученных посредством этих образцовых иммуногенов, представлены в табл. 1 В, ниже, и в разделе примеров. В табл. 1B все аминокислотные последовательности представлены посредством использования традиционной ориентации NС. Для каждого иммуногена прогастриновый пептид синтезировали с Nконцевым линкером Ahx-Ahx-Cys, который затем конъюгировался либо с носителем гемоцианина лимфы улитки ("ГЛУ"), либо с дифтерийным токсином ("ДТ") посредством линкерного Cys остатка. Специфичные антигенные детерминанты, связанные образцовыми моноклональными антителами кhPG MAb1-MAb23, представленные в табл. 1 А и 1 В, были картированы посредством применения методаLaune, 1997, J. Biol. Chem. 272:30937-30944, соответственно (см. также пример 6 из заявки 329). В соответствии с методом SPOT 15 аминокислотных пептидных последовательностей, включающих предполагаемую антигенную детерминанту, получают и точечно наносят на нитроцеллюлозную мембрану, которые затем исследуют с помощью тестируемого антитела, для того чтобы определить минимальную последовательность антигенной детерминанты, которая распознается антителом. Аланиновый просмотр применяют, чтобы определить остатки в пределах антигенной детерминанты, которые важны для закрепления антитела. Сканирование аланином используется для того, чтобы определить остатки в пределах антигенной детерминанты, которые важны для связывания антитела. Каждый остаток в пределах предполагаемой антигенной детерминанты мутирует, друг за другом, в аланин и содержащие аланин пептиды затем исследуют с помощью тестируемого антитела. В случае N-концевых моноклональных антител к hPG MAbs1-4 и 15-20, антигенные детерминанты содержат, по крайней мере, следующие последовательности: DAPLG (SEQ ID NO: 28), PDAPLG (SEQ ID Исследования картирования антигенных детерминант выявили, что антитела к hPG MAb2 и MAb4 связывают ту же антигенную детерминанту; антитела к hPG MAb1 и MAb3 связывают приблизительно ту же антигенную детерминанту; антитела MAb17, MAb18, MAb19 и MAb20 связывают приблизительно ту же антигенную детерминанту; MAb15 и MAb16 связывают приблизительно ту же самую антигенную детерминанту; антитела к hPG MAb5, MAb6, MAb7, MAb9 и MAb12 связывают ту же антигенную детерминанту и связывают приблизительно ту же антигенную детерминанту, что и антитело к hPG MAb10; и антитела к hPG MAb11 и MAb14 связывают приблизительно ту же антигенную детерминанту. Конкретные варианты осуществления N-концевых антител к PG, которые применяют в способах и наборах, описанных здесь, включают антитела, которые связывают антигенную детерминанту, которая включает остатки 10-14 hPG (SEQ ID NO: 28), остатки 9-14 hPG (SEQ ID NO: 29), остатки 4-10 hPG (SEQID NO: 30), остатки 2-10 hPG (SEQ ID NO: 31) или остатки 2-14 hPG (SEQ ID NO: 32). Конкретные варианты осуществления С-концевых антител к PG, которые применяют в способах и наборах, раскрытых здесь, включают антитела, которые связывают антигенную детерминанту, которая включает остатки 71-74 hPG (SEQ ID NO: 33), остатки 69-73 hPG (SEQ ID NO: 34), остатки 76-80 hPGN-концевые и С-концевые антитела к hPG, полезные в способах и наборах, раскрытых здесь, в дополнение к предоставленным в табл. 1 А и 1 В, могут быть идентифицированы в анализе конкурентного связывания с образцовым MAbs 1-23, или с другими эталонными антителами, которые связывают N- или С-концевые антигенные детерминанты, как будет описано более подробно в изложенном далее разделе. Как также сообщается в заявках 329 и 041, не все антитела к hPG, даже те, которые показывают высокую степень специфичности и близости к hPG, нейтрализуют биологическую активность hPG. Например, хотя и антитело к hPG MAb14 связывает hPG с KD, которое составляет приблизительно 6 пМ,это не происходит, по крайней мере, при исследованной концентрации, которая ингибирует рост определенных клеток колоректального рака в исследовании in vitro, в то время как другие моноклональные антитела к hPG показали ингибирующую активность (см., например, пример 7 из заявки 329). В то время как и не нейтрализующие и нейтрализующие антитела, которые специфично связывают hPG, являются полезными для диагностических способов настоящего раскрытия, антитела к hPG, которые являются полезными для применения в терапевтических способах, должны демонстрировать нейтрализующую активность. Как используется здесь, "нейтрализующее антитело к hPG" представляет собой антитело к hPG, которое приводит к статистически значительному уменьшению количества живых клеток ВхРС-3 в испытательном образце, обработанном антителом к hPG, по сравнению с контрольным образцом, обработанным неспецифичным антителом. Специфическое исследование для установления способности любого отдельного антитела к hPG быть нейтрализующим раскрыто в примере 3. В этом исследовании те антитела к hPG, которые показывают по крайней мере приблизительно 50-е уменьшение количества живых клеток в этом исследовании, как полагают, являются особенно полезными в лечении рака поджелудочной железы, хотя антитела к hPG, показывающие более низкие уровень нейтрализации деятельности,например, статистически существенного уменьшения 40, 30, 20, 15 или даже 10% количества живых клеток в этом исследовании, обеспечивают терапевтические преимущества. Соответственно, в некоторых вариантах осуществления изобретения, например в терапевтических вариантах осуществления изобретения, полезные антитела к hPG являются нейтрализующими. Как раскрыто здесь и в заявках 329 и 041, способность моноклонального антитела к hPG быть нейтрализующим не зависит от антигенной детерминанты, поскольку как N-концевые, так и С-концевые моноклональные антитела к hPG показывают нейтрализующую активность в исследованиях с клетками рака поджелудочной железы. Таким образом, в некоторых определенных вариантах осуществления изобретения, нейтрализующие антитела к hPG являются N-концевыми нейтрализующими антителами к hPG. В других вариантах осуществления изобретения, нейтрализующие антитела к hPG являются С-концевыми нейтрализующими антителами к hPG. Аффинность любого специфичного антитела к hPG не важна. Однако для некоторых случаев применения антитела, показывающие аффинность, которая составляет по крайней мере приблизительно 1 мкМ, может быть предпочтительной. Для терапевтического применения может быть желательной аффинность, которая составляет по крайней мере приблизительно 90, 80, 70, 60, 50, 40, 30, 20, 15, 10, 7, 6, 5,4, 3, 2, 1, 0,1, 0,01, 0,001 нМ или еще больше. Установленная аффинность моноклональных антител к Моноклональное антитело к PG, имеющее аффинность, особенно подходящую для конкретного желательного применения, легко может быть выбрано из указанных, или произведено или сконструировано посредством использования различных иммуногенов, последовательностей определяющей комплементарность участки (CDR), последовательностей вариабельной тяжелой (VH) и вариабельной легкой (VL) цепей антител к hPG, описанных здесь. Аффинность любого специфичного моноклонального антитела кPG может быть определена посредством применения методов, известных в данной области, или описанных здесь, таких как, например, ELISA, изотермическая титрационная калориметрия (ИТК), BIAcore, или поляризационный флуоресцентный анализ. Специальный анализ приведен в примере 4. Как отмечено в табл. 1 А и 1 В, многие из N-концевых и С-концевых моноклональных антител, специфичных по отношению к hPG, были идентифицированы. Все указанные антитела являются специфичными к hPG, и, за исключением MAb14, все демонстрируют нейтрализующую активность в анализах с клетками колоректального рака. Все антитела, проанализированные с клетками рака поджелудочной железы (MAbs 8, 13, 16 и 19) демонстрируют нейтрализующую активность. Несколько гибридом, полезных для получения антител, были депонированы 6 октября 2010 года в Национальной коллекции культур микроорганизмов (CNCM) в соответствии с Будапештским соглашением. Присвоенные названия гибридом, вырабатывающих антитела к hPG MAbs1-23 и регистрационные номера депозитария указанных депонированных гибридом представлены в табл. 1 А и 1 В. Кроме того, для нескольких антител были определены аминокислотные последовательности их вариабельных тяжелых цепей (VH), вариабельных легких цепей (VL), VL определяющих комплементарность участков (CDR-участков) и VH CDR-участков. Эти аминокислотные последовательности, и условное номенклатурное обозначение, которое используется для ссылок на них в описании, также представлены в табл. 1 А и 1 В. Если кратко, то мышиные вариабельные домены тяжелых и легких цепей упоминаются здесь как mVH и mVL, затем следует номер соответствующего моноклонального антитела, например mVH.3 и mVL.3 для вариабельных легких и вариабельных тяжелых цепей антител к hPG MAb3 соответственно. Точно так же человеческие вариабельные домены тяжелых и легких цепей упоминаются здесь как hVH и hVL, за чем следует номер соответствующего моноклонального антитела. Три вариабельные CDR-участки тяжелых цепей и три вариабельныеCDR-участки легких цепей упоминаются как VH CDR1, 2 или 3, и VL CDR1, 2 или 3 соответственно, за чем следует номер специфичного моноклонального антитела к hPG. Например, VH CDR1 MAb3 обозначают как VH CDR1.3 и VL CDR1 MAb3, обозначают как VL CDR1.3. VH CDR2 MAb3 обозначают как VHCDR2.3 и VL CDR2 MAb3 обозначают как VL CDR2.3. Предполагают, что соответствующие CDR-участки и/или VH и VL цепи моноклональных антител кhPG, которые связывают приблизительно те же антигенные детерминанты, могут быть взаимозаменяемыми для получения новых моноклональных антител к hPG, которые являются полезными в способах и наборах, описанных здесь. Например, как отмечено выше, образцовые моноклональные антитела к hPGMAb5 и MAb6 связывают ту же антигенную детерминанту. Может быть сконструировано моноклональное антитело к hPG, которое включает, в своей VL цепи, различные комбинации VL CDR-участков указанных двух антител, и/или в своей VH цепи, различные комбинации VH CDR-участков указанных двух антител. В качестве конкретного неограничивающего примера, иллюстрирующего различные возможные комбинации, такое антитело может включать в своей VL цепи, CDR-участки 1 и 2 MAb5 (VL CDR1.5 и VLCDR-участки 2 и 3 MAb5 (VH CDR2.5 и VH CDR3.5 соответственно). Аминокислотные последовательности CDR-участков антител (также известных как гипервариабельные участки), произведенных гибридомами, которые были депонированы, могут быть получены посредством применения традиционных средств. Как это известно из уровня техники, положение аминокислоты/границы аминокислоты, очерчивающей гипервариабельный участок антитела, может меняться, в зависимости от окружения и различных дефиниций, известных в уровне техники. Некоторые положения в пределах вариабельного домена могут рассматриваться как гибридные гипервариабельные положения, в том смысле, что указанные положения могут считаться находящимися в пределах гипервариабельного участка в соответствии с одной системой критериев, и считаться находящимися за пределами гипервариабельного участка в соответствии с другой системой критериев. Одно или более из этих положений также могут находиться в удлиненных гипервариабельных участках. Антитела к PG, описанные здесь, могут содержать модификации в указанных гибридных гипервариабельных положениях. Каждый из вариабельных доменов нативных тяжелых и легких цепей включает четыре FR участка, в основном, посредством принятия ими конфигурации -листа, связанной тремя CDR-участками, которые образуют петлевое соединение, и в некоторых случаях образуют часть -листовой структура. CDR-участки в каждой цепи удерживаются вместе в непосредственной близости с помощью FR участков в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 и, вместе с CDRучастками другой цепи, способствуют формированию целевой сайт связывания антител (см. Kabat и др.,1987, Sequences of Proteins of Immunological Interest, National Institute of Health, Бетесда, штат Мэриленд). Как используется здесь, нумерация аминокислотных остатков иммуноглобулина осуществлена в соответствии с системой нумерации аминокислотных остатков иммуноглобулина в соответствии с Kabat и др., если не указано другое. Что касается табл. 1 А, то конкретные варианты осуществления N-концевых антител к hPG, которые применяют в способах и наборах, описанных здесь, включают, но, не ограничиваются ими, следующие:(e) антитела, имеющие VL и VH, которые соответствует в последовательности VL и VH MAb1, MAb2,MAb3, MAb4, MAb15, MAb16, MAb17, MAb18, MAb19 или MAb20. Что касается табл. 1 В, то конкретные варианты осуществления С-концевых антител к hPG, которые являются полезными в способах и наборах, описанных здесь, включают, но, не ограничиваются ими,следующие:(j) антитела, имеющие VL и VH, которые соответствуют в последовательности VL и VH, которые соответствуют в последовательности VL и VH MAb5, MAb6, MAb7, MAb8, MAb9, MAb10, MAb1 1, MAb12,MAb13, MAb14, MAb21, MAb22 или MAb23. Как будет оценено специалистами в данной области, антитела к hPG, полезные в диагностических способах, могут иметь любое происхождение, включая, например, млекопитающих (например, человек,примат, грызун, коза или кролик), не млекопитающих, или быть химерными по своей природе (полученные из больше чем одного видов происхождения). Антитела, подходящие для терапевтического применения у животных, включая людей, предпочтительно получают из тех же видов, которые предполагают подвергать лечению, или они были модифицированы или сконструированы таким образом, что являются не иммуногенными или иммуногенность в животном, которое подвергают лечению, была понижена. Определенным классом антител к hPG, полезных для терапевтического применения у людей, является класс гуманизированных антител, которые обсуждаются более подробно ниже. Антитела к hPG, которые применяют в способах и наборах, описанных здесь, могут также быть, или их получают из любого изотипа,включая, например, IgA (например, IgA1 или IgA2), IgD, IgE, IgG (например, IgG1, IgG2, IgG3 или IgG4) или IgM. Антитела к hPG, разработанные для терапевтического применения, имеют предпочтительно изотип IgG. В некоторых вариантах осуществления изобретения антитела к hPG, полезные для терапевтических способов, описанных здесь, являются гуманизированными. Как правило, гуманизированные антитела содержат в основном все, по крайней мере один и обычно два, вариабельных домена, в которых все или в основном все участки CDR соответствуют таковым из нечеловеческого иммуноглобулина и все или в основном все каркасные участки являются таковыми из консенсусной последовательности человеческого иммуноглобулина, и могут упоминаться как "CDR-привитые". Гуманизированное антитело также может содержать по крайней мере часть константной области (Fc) иммуноглобулина, обычно константной области из консенсусной последовательности человеческого иммуноглобулина. Методы гуманизирования антитела, включая методы конструирования гуманизированных антител, известны в данной области. См.,например, Lefranc и др., 2003, Dev. Сотр. Immunol. 27:55-77; Lefranc и др., 2009, Nucl. Acids Res. 37:D1006-1012; Lefranc, 2008, Mol. Biotechnol. 40: 101-111; Riechmann и др., 1988, Nature 332:323-7; патенты США 5530101, 5585089, 5693761, 5693762 и 6180370 Queen и др.; ЕР 239400; РСТ публикацияStudnicka и др., 1994, Prot. Eng. 7:805-814; Roguska и др., 1994, Proc. Natl. Acad. Sci. 91:969-973; и патент США 5565332, описания которых включены настоящим документом посредством ссылки в их полноте. Гуманизированные версии антител, имеющих последовательности CDR, соответствующие CDRучасткам нечеловеческих антител к hPG, включающие в качестве примера и не являясь ограничением,различные N-концевые моноклональные антитела к hPG, представленные в табл. 1 А, и различные Сконцевые моноклональные антитела к hPG, представленные в табл. 1 В, могут быть получены посредством применения указанных известные методов. Предполагаемые последовательности для гуманизированных VL и VH цепей выбранных антител к hPG представлены в табл. 1 А и 1 В. Конкретные примеры гуманизированных антител включают антитела, содержащие:(l) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, соответствующую SEQ ID NO: 21, и вариабельную области легкой цепи, включающую аминокислотную последовательность, соответствующую SEQ ID NO: 22;(m) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, соответствующую SEQ ID NO: 23, и вариабельную область легкой цепи, включающую аминокислотную последовательность, соответствующую SEQ ID NO: 24;(n) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 75, 77 и 79, и вариабельную область легкой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 76 и 78;(о) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 80 и 82, и вариабельную область легкой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 81 и 83;(р) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 84, 86 и 88, и вариабельную область легкой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 85, 87 и 89; и(q) вариабельную область тяжелой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 90, 92 и 94, и вариабельную область легкой цепи, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 91, 93 и 95. Как будет отмечено специалистами в данной области, антитела к hPG, имеющие специфические связывающие характеристики, такие как способность связывать специфическую антигенную детерминанту, которая представляет интерес, могут быть легко получены посредством применения различных антигенов и иммуногенов, описанных здесь, и посредством оценки их способности конкурентно связывать hPG перед эталонным антителом, которое представляет интерес. Любое из антител к hPG, описанных здесь, может быть использовано в качестве эталонного антитела в таком анализе конкурентного связывания. Специфическое исследование, подходящее для оценки способности антитела конкурентно связывать hPG перед биотинилированным эталонным антителом к hPG, которое представляет интерес. Любое из антител к hPG, описанных здесь, может быть использовано как эталонное антитело в таком анализе конкурентного связывания. Специфическое исследование, подходящее для оценки способности анти- 20023722 тела конкурентно связывать hPG перед биотинилированным эталонным антителом к hPG, которое представляет интерес, представлен в примере 5. В проведении анализа конкурентного связывания антитела между эталонным антителом к hPG и любым тестируемым антителом (независимо от видов или изотипа), можно сначала сделать метку эталона при помощи метки, которую можно обнаружить либо непосредственно, такой как, например, радиоизотоп или флуорофор, либо косвенно, такой как, например, биотин (который можно обнаружить через связывание с флуоресцентно меченным стрептавидином) или фермент (который можно обнаружить через ферментативную реакцию), что дает возможность последующей идентификации. В этом случае, меченное эталонное антитело к hPG (в фиксированных или повышающихся концентрациях) инкубируют с известным количеством hPG, образуя hPG меченый комплекс антител к hPG. Немеченное тестируемое антитело затем добавляют к комплексу. Измеряют интенсивность метки комплекса. Если тестируемое антитело конкурирует с меченным эталонным антителом к hPG для hPG, посредством связывания перекрывающейся антигенной детерминанты, то интенсивность метки комплекса будет уменьшаться, в сравнении с контрольным исследованием, выполненным в отсутствии тестируемого антитела. Известно много способов выполнения анализа конкурентного связывания, и они могут быть адаптированы, для того чтобы получить результаты, сравнимые с анализом, описанным выше и в примере 5. Антитело, как полагают, конкурирует за связывание hPG с эталонным антителом к hPG, и таким образом, как полагают, связывает приблизительно ту же или перекрывающуюся антигенную детерминанту hPG, что и эталонное антитело к hPG, если это понижает связывание эталонного антитела к hPG сhPG в анализе конкурентного связывания и, в частности в анализе конкурентного связывания Примера 5,по крайней мере на 50%, при концентрации тестируемого антитела в диапазоне 0,01-100 мкг/мл (например, 0,01, 0,08, 0,4, 2, 10, 50 или 100 мкг/мл или при другой концентрации в пределах установленного диапазона), даже если более высокие уровни понижения, например, на 60, 70, 80, 90 или даже 100%, могут быть желательными. Специалисты в данной области понимают, что некоторых случаях, например, в случае диагностики и контроля лечения, может быть желательным метить антитела к PG. Такие метки антитела являются полезными для их обнаружения и определения количества. Подходящие метки являются известными в данной области, и могут быть "прямыми" в том смысле, что они могут быть непосредственно заметными или обнаруживаемыми (например, флюоресцентные метки или радиоизотопы) или "косвенными" в том смысле, что они взаимодействуют с чем-то еще, что производит заметный или обнаруживаемый сигнал(например, фермент, который действует на субстрат с образованием обнаруживаемого сигнала, или связывает молекулу, такую как биотин, который связывает меченую молекулу стрептавидин). Многочисленные системы меток, так же как и средства для мечения антител с их помощью, являются известными в данной области, и рассматриваются для применения здесь. Хотя антитела анти-hPG, применимые в способах, описанных в изобретении, проиллюстрированы с антителами полной длины, специалисты в данной области могут понять, что связывающие фрагменты,или суррогатные антитела, сконструированные или полученные из полноразмерных антител или связывающих фрагментов, также могут применяться. Подходящие фрагменты, суррогаты и т.д., включают, но,не ограничиваются ими, фрагменты Fab', F(ab')2, Fab, Fv, vIgG, scFv и сурротела. Если не определено иначе, термин "антитело", как используется здесь, включает все формы антител и "антитело-подобных" суррогатных молекул, включая одноцепочечные антитела, сурротела и связывающие фрагменты. Антитела, имеющие структуры, типичные для антител естественного происхождения, упоминаются здесь как"нативные антитела". 7.10. Способы производства антител к PG. Антитела к PG, которые применяют в способах, описанных здесь, могут быть получены посредством использования стандартных, известных способов. Для того чтобы экспрессировать антитела к PG,которые применяют в способах, описанных здесь, кодирующие ДНК частичные или полноразмерные легкие и тяжелые цепи вставляют в экспрессирующие векторы таким образом, что гены функционально связываются с транскрипционными и трансляционными контролирующими последовательностями. В этом контексте термин "функционально связанный" предназначен для того, чтобы означать, что ген антитела лигатируется в вектор таким образом, что транскрипционные и трансляционные контролирующие последовательности в пределах вектора служат своей намеченной функции регулирования транскрипции и трансляции гена антитела. Экспрессирующий вектор и контролирующие экспрессию последовательности выбирают так, чтобы они были совместимыми с используемой клеткой-хозяином экспрессии. Ген легкой цепи антитела и ген тяжелой цепи антитела может быть вставлен в отдельные векторы или, более традиционно, оба гена вставляют в тот же экспрессирующий вектор. Гены антитела вставляют в экспрессирующий вектор стандартными способами (например, лигирование комплементарно рестрикционных сайтов на фрагменте гена антитела и векторе, или лигирование по тупым концам, если рестрикционные сайты отсутствуют). Перед вставкой антитела к PG, последовательности легких или тяжелых цепей экспедирующий вектор может уже нести последовательности константной области антитела. Например, одним из способов преобразования последовательностей VH и VL цепей антитела к PG в гены антитела полной длины, является их вставка в экспрессирующие векторы,- 21023722 которые уже кодируют константные области тяжелой цепи и постоянная константные области легкой цепь, соответственно, таким образом, что сегмент VH функционально связывается с сегментом(ми) CH в пределах вектора, и сегмент VL функционально связывается с сегментом CL в пределах вектора. Дополнительно или в качестве альтернативы, рекомбинантный экспедирующий вектор может кодировать сигнальная последовательность, который способствует секреции цепи антитела из клетки хозяина. Ген цепи антитела может быть клонирован в вектор таким образом, что сигнальная последовательность связывается внутри рамки считывания с N-концом гена цепи антитела. Сигнальная последовательность может быть сигнальнальной последовательностью иммуноглобулина или гетерологичной сигнальнальной последовательностью (т.е. сигнальнальной последовательностью неиммуноглобулинового белка). В дополнение к генам цепи антитела, рекомбинантные экспрессирующие векторы настоящего раскрытия несут регуляторные последовательности, которые контролируют экспрессию генов цепи антитела в клетке хозяина. Термин "регуляторная последовательность" включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования), которые контролируют транскрипцию или трансляцию генов цепи антитела. Такие регуляторные последовательности описаны,например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185 (Academic Press. СанДиего, Калифорния, 1990). Специалисты в данной области должны понимать, что конструирование экспрессионного вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов как выбор клетки хозяина, которая будет преобразована, уровень желательной экспрессии белка и т.д. Подходящие регуляторные последовательности для экспрессии клеток хозяина млекопитающих включают вирусные элементы, которые вызывают высокий уровень экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (ЦМВ) (такого как промотор/энхансер ЦМВ), вирус обезьян 40 (ОВ 40) (такой как промотор/энхансер ОВ 40), аденовирус,(например, основной поздний промотор аденовируса (AdMLP и полиома. Для дополнительного описания вирусных регуляторных элементов, и их последовательностей, см., например, патент США 5168062, изобретатель Stinski, патент США 4510245, изобретатель Bell и др., и патент США 4968615, изобретатель Schaffner и др. В дополнение к генам цепи антитела и регуляторным последовательностям, рекомбинантные экспрессирующие векторы могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках хозяина (например, начало репликации) и селектируемые маркера гена. Селектируемый маркер гена способствует селекции клеток хозяина, в которые был введен вектор (см., например, патенты США 4399216, 4634665 и 5179017, заявители Axel и др.). Например, обычно селектируемый маркер гена придает устойчивость к лекарственным веществам, таким как G418, пуромицин, бластицидин, гигромицин или метотрексат, в клетке хозяина, в которую был введен вектор. Подходящие селектируемые маркеры гена включают ген дигидрофолат редуктазы (DHFR)(для применения в клетках хозяина DHFR- для селекции/амплификации метотрексата) и нео ген (для селекции G418). Для экспрессии легких и тяжелых цепей, экспрессирующий вектор(ы), кодирующий тяжелые и легкие цепи, трансфектируют в клетку хозяина стандартными методами. Различные формы термина "трансфекция" охватывают множество методов, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку хозяина, например электропорацию, липофекцию,кальций-фосфатную преципитацию, трансфекцию DEAE-декстрана и т.п. Возможно экспрессировать антитела, описанные здесь либо в прокариотические, либо в эукариотические клетки хозяина. В определенных вариантах осуществления изобретения экспрессию антител производят в эукариотических клетках, например, клетках-хозяинах млекопитающих, для оптимальной секреции должным образом сложенного и иммунологически активного антитела. Образцовые клеткихозяины млекопитающих для экспрессии рекомбинантных антител раскрытия включают клетки яичника китайского хомячка (клетки СНО) (включая клетки DHFR-CHO, описанные в UrlaubChasin, 1980,Proc. Natl. Acad. Sci. USA 77: 4216-4220, где используют селектируемый маркер DHFR, например, как описано в KaufmanSharp, 1982, Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS, клетки 293 и клетки SP2/0. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антитела, вводят в клетки-хозяины млекопитающих, то антитела вырабатываются посредством культивирования клетокхозяев на протяжении периода времени, достаточного для того, чтобы произошла экспрессия антитела в клетках-хозяинах или секреция антител в культуральной среде, в которой выращивают клетки-хозяины. Антитела могут быть восстановлены из культуральной среды посредством использования стандартных способов очистки белка. Клетки хозяина также могут применяться с образованием части целых антител,таких как Fab фрагменты или scFv молекулы. Подразумевается, что изменения вышеупомянутой процедуры находятся в пределах настоящего раскрытия. Например, может быть желательно трансфектировать клетку-хозяина ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе) антитела к PG, описанного здесь. Рекомбинантные методики ДНК могут также применяться для того, чтобы удалить некоторых или все ДНК, кодирующую какую-либо или обе из легких и тяжелых цепей, который не являются необходимыми для того, чтобы связаться с PG. Молекулы, экспрессированные из таких процессированных молекул ДНК, также полезны в способах, описанных здесь. Для рекомбинантной экспрессии антитела к PG клетка-хозяин может быть со-трансфектирована двумя векторами экспрессии, первый вектор, кодирующий тяжелую цепь, получен из полипептида, и второй вектор, кодирующий легкую цепь, получен из полипептида. Как правило, каждый из двух векторов содержит отдельный селектируемый маркер. В качестве альтернативы, может применяться один вектор, который кодирует и тяжелые, и легкие полипептиды цепи. Антитела к PG также могут быть получены посредством химического синтеза (например, в соответствии со способами, описанными в Solid Phase Peptide Synthesis, 2nd ed., 1984 The Pierce Chemical Co.,Rockford, 111). Разные антитела также могут быть произведены посредством использования бесклеточную подложу (см., например, Chu и др., 2001, Biochemia No. 2 (Roche Molecular Biologicals. Как только антитело к PG произведено посредством рекомбинантной экспрессии или синтетическими средствами, оно может быть очищено любым способом, известным в данной области для очистки молекулы иммуноглобулина, например, посредством хроматографии (например, ионообменной, аффинной, особенно аффинностью к PG после селекции белка А или белка G, и калибровочной колоночной хроматографии), центрифугирования, дифференциальной растворимости р, или любой другой стандартной методики для очистки белков. Дополнительно, антитела к PG или их связывающие фрагменты могут быть сконденсированы с гетерологичными полипептидными последовательностями, описанными здесь или известными в данной области для способствования очистки. 8. Примеры. 8.1. Пример 1. Определение количества уровня PG в плазме или сыворотки крови. Уровень PG в плазме и/или в сыворотке крови могут быть подходящим образом определены посредством применения следующего исследования. 96-луночные микротитровальные планшеты покрывают в пределах между 0,5 и 10 мкг/мл С-концевого антитела к hPG, например, С-концевого кроличьего поликлонального антитела к hPG, или С-концевого антитела к hPG, описанного здесь, и затем инкубировали всю ночь с вечера. Планшеты затем промывали три раза в TWEEN ФСБ (0,05%) и блокировали с помощью 2% (м/о) обезжиренного сухого молока в TWEEN ФСБ (0,05%). Отдельно, испытательные образцы, контрольные образцы (контрольная проба или образцы PG-негативной плазмы или сыворотки крови), и количество в пределах приблизительно 5 пМ (0,510-11 М) и приблизительно 0,1 нМ (110-10 М)hPG стандартного образца (лиофилизованный hPG, разбавленный в PG-негативной плазме или сыворотке крови) подготавливали в соответствующем разбавителе (например, TWEEN ФСБ 0,05%). Образцы инкубировали на покрытых пластинах на протяжении промежутка времени между 2 и 4 часами при температуре 37 С, или в качестве альтернативы на протяжении промежутка времени между 12 и 16 часами при температуре 21 С. После инкубации планшеты промывали три раза ФСБ-Tween (0,05%) и инкубировали с количеством в пределах между 0,001 и 0,1 мкг/мл N-концевого антитела к hPG, например, Nконцевого поликлонального антитела к hPG или N-концевого моноклонального антитела к hPG, как описано здесь, конъюгированного с пероксидазой хрена (HRP) (см. Nakane и др., 1974, J. Histochem. Cytochem), на протяжении 30 мин при 21 С. Планшеты затем промывали три раза в ФСБ-Tween (0,05%) и субстраты HRP добавляли на протяжении 15 мин при температуре 21 С. Реакцию останавливали посредством добавления 100 мкл 0,5 М серной кислоты, и проводили оптическое измерения плотности при 405 нм. Уровень hPG испытательного образца определяли по сравнению со стандартной кривой, построенной в соответствии с измерениями, полученными из значений hPG стандартного образца. 8.2. Пример 2. Анализ ELISA для определения специфичности антител к hPG. Специфичность антител к hPG может быть подходящим образом определена посредством применения анализа ELISA следующим образом. 96-луночные планшеты инкубировали на протяжении ночи при температуре 4 С с соответствующей концентрацией(ми) испытательного полипептида (например, 25 и 50 нг рекомбинантного человеческого PG и 50 и 250 нг CTFP или других гастрин-производных генных продуктов) в фосфатно-солевом буфере (ФСБ), после чего лунки промывали три раза промывочным буфером (ФСБ и 0,1% Tween-20) и затем инкубировали на протяжении 2 ч при температуре 22 С с 100 мкл блокирующего буфера (ФСБ, 0,1% Tween-20, 0,1% бычьего сывороточного альбумина или гидролизата казеина) на лунку. После блокирования лунки промывали три раза и добавляли антитело, подлежащее анализу (тестируемое антитело). 100 мкл тестируемого антитела (от 0,3 до 1 нг/мл) в ФСБ и 0,1% Tween20 добавляли в каждую лунку. Планшеты затем инкубировали на протяжении 2 ч при температуре 22 С,после чего испытательный раствор антитела сливали и заменяли после стадии промывки (3 Х 100 мкл промывочным буфером, как отмечено выше) на блокирующий буфер, содержащий вторичное антитело,козье антимышиное антитело IgG (Fc), соединенное с пероксидазой хрена. После 1 ч инкубации со вторичным антителом, 100 мкл субстратного раствора (например, Fast OPD, или О-Фенилендиамина дигидрохлорид, коммерчески доступный от компании Sigma-Aldrich Co., приготовленный в соответствии с указаниям изготовителя), добавляли в каждую лунку и инкубировали в темноте на протяжении 20 мин при температуре 22 С. Реакцию останавливали, при помощи добавления 50 мкл 4N серной кислоты, и количество катализованного субстрата определяли посредством измерения оптической плотности (ОП) при 492 нм. Преобразование субстрата пропорционально количеству первичного (тестируемого) антитела, связанного с антигеном. Исследования проводят в двух параллельных опытах и установленные значения ОП представляют графически как функцию концентрации антигена. Тестируемые антитела отме- 23023722 чают как специфические к PG, если значение О.П. находится в пределах между 0,2 и 1,5 в отношенииhPG и отсутствует статистически значимый сигнал выше фона, содержащего CTFP, или любые другие пептиды, полученные из гена гастрина, где фон представляет собой средний сигнал от контрольных лунок, содержащих только ФСБ. 8.3. Пример 3. Исследование для определения нейтрализующей активности антител к hPG. Особый тест для определения того, является ли нейтрализующим конкретное антитело к hPG, может быть выполнен следующим образом. Клетки рака молочной железы высевали в 6-луночный планшет, где количество клеток составляло приблизительно 150000 клеток на лунку. Клетки затем обрабатывали тестируемым антителом к hPG или контрольным антителом, где концентрация антитела составляла приблизительно 5 мкг/мл, с интервалом в 12 ч на протяжении 48 ч. В исследовании тестируемое антитело определяют как нейтрализующее, если количество клеток, обработанных испытательным антителом,показывает статистически значимое уменьшение по крайней мере на 10% количества жизнеспособных клеток, по сравнению с количеством клеток, обработанных контрольным антителом, неспецифичным антителом посредством применения двустороннего теста Манна-Уитни (с разницей, считающейся существенной, когда р 0.05). Общее количество клеток корректируют с количеством клеток в начале периода обработки, которое упоминается как Т 0. 8.4. Пример 4. Исследование для определения аффинности антитела к hPG. Константы аффинности антител к hPG могут быть установлены посредством применения методикиProteon (компания BioRad), в соответствии с Nahshol и др., 2008, Analytical Biochemistry 383:52-60, включенной здесь посредством ссылки в полном объеме. Если коротко, то для мышиных антител к PG, антимышиное антитело IgG (50 мкг/мл) сначала наносили на сенсорный чип, убеждаясь, что сигнал, определяемый чипом после инъекции антитела, находится между 10000 и 11500 единиц ответа (ЕО). Затем вводили мышиное антитело к hPG, которое представляет интерес (тестируемое антитело) (при обычной концентрации 30 мкг/мл). Если тестируемое антитело связывает достаточно, то будет наблюдаться дополнительный сигнал, составляющий по крайней мере 500 ЕО. Затем получают динамику связывания между тестируемым антителом и hPG с помощью введения различных концентраций hPG, например 200,100, 50, 25 и 12,5, и определяют степень связывания. Как правило, для того чтобы протестировать многочисленные антитела, параллельно в одном исследовании, доступно несколько каналов, позволяя оценить связывание одного тестируемого антитела при различных концентрациях hPG параллельно. В дин канал может быть введено мышиное моноклональное антителом, которое не является специфичным по отношению к hPG, в качестве контроля для неспецифичного связывания, и в другой канал может быть введен один только буферный раствор как основа для фонового сигнала. Как правило, в канале, в который ввели неспецифичное мышиное антитело, связывания не выявляют. Антитела, показывающие высокую степень связывания при этих параметрах, что может проявляться в насыщенности связанного с hPG моноклонального антитела, могут быть протестированы с применением более низких концентраций hPG (50, 25,12,5, 6,25 нМ и 3,125 нМ), допуская более точное измерение. Константы аффинности (KD) вычисляют как соотношение между константой диссоциации (kd) и константой ассоциации (ka). Экспериментальные значения могут быть обоснованы посредством анализа статистически соответствующего подобия между экспериментальными кривыми, основанными на измерениях связывания и теоретических параметрах. Константы аффинности немышиных антител к hPG могут быть установлены подобным образом посредством применения IgG, специфичных для видов происхождения тестируемого антитела к hPG. 8.5. Пример 5. Исследование для определения конкурентного связывания с эталонным антителом кhPG. Специфическое исследование для определения того, подходит ли антитело, которое представляет интерес (тестируемое антитело), для конкурентного связывания hPG с биотинилированным эталонным антителом к hPG, может быть выполнено следующим образом. 96-луночные планшеты покрывали иммобилизованным антителом к hPG (поликлональное или моноклональное антитело, распознающее, N- или С-концевую область hPG, которая отличается от антигенной детерминанты, распознаваемой биотинилированным эталонным антителом к hPG), при концентрации, которую выбирают в пределах диапазона 110 мкг/мл, на протяжении ночи при температуре 4 С (0,1-1 мкг/лунку). После блокирования с помощью блокирующего буферного раствора (0,1% Tween-20, 0,1% БСА в ФСБ) на протяжении 2 ч при температуре 22 С, добавляли рекомбинантный hPG при концентрации, находящейся в пределах между 10 пМ-1 нМ (10-1000 пг/лунку) и инкубировали на протяжении 2 ч при температуре 22 С. После этого биотинилированное эталонное антитело к hPG (или смесь, содержащую биотинилированное эталонное антитело к hPG) добавляли вместе с повышенной концентрациейнемеченного испытательного антитела, и инкубировали на протяжении 1 ч при температуре 22 С. После промывания, для того чтобы удалить несвязанные антитела, осуществляли выявление связанного меченного эталонного антитела к hPG, посредством инкубирования смеси с 50 нг/мл стрептавидин-HRP на протяжении 1 ч при температуре 22 С, за чем следовала инкубация с флуорогенным субстратом для пероксидазы хрена, и затем определяли количество относительных световых единиц (ОСЕ) в люминометре. Исследование осуществляли в двух параллельных опытах. Антитела, которые конкурируют с эталонным антителом к hPG, ингибируют связывание эталонного антитела к hPG. Антитело, которое связывается, в основном, с той же антигенной детерминантой, или с перекрывающейся антигенной детерминантой, как эталонное антитело значительно снижает (например,по крайней мере на 50%) количество связанного эталонного антитела к hPG, что подтверждается уменьшением наблюдаемого количества ОСЕ. Высокое контрольное значение получают из контрольного исследования, которое выполняют посредством инкубирования меченного эталонного антитела с рекомбинантным hPG без тестируемого антитела. Низкие контрольные значения получают из контрольного исследования, которое выполняют посредством инкубирования меченного эталонного антитело с рекомбинантным hPG в присутствии превышающих концентраций немеченного эталонного антитела (немеченное эталонное антитело, таким образом конкурирует с меченным антителом за связывание с hPG). Способность тестируемых антител конкурировать с эталонным антителом к hPG затем определяют посредством инкубирования меченного эталонного антитела с рекомбинантным hPG в присутствии повышенных концентраций немеченного тестируемого антитела. В проведенном исследовании значительное уменьшение наблюдаемого количества ОСЕ в присутствии тестируемого антитела демонстрирует, что тестируемое антитело распознает в основном ту же антигенную детерминанту, что и эталонное антитело к hPG. Ингибирование связывания может быть выражено как константа ингибирования, или Ki, которую вычисляют в соответствии со следующей формулой:Ki = ИК 50/(1 + ([концентрация Ab эталонного антитела к hPG]/KDAb эталонного антитела к hPG где ИК 50 представляет собой концентрацию тестируемого антитела, которая приводит к 50-у снижению связывания эталонного антитела;KDAb эталонного антитела к hPG представляет собой константу диссоциации эталонного антитела к hPG, степень его аффинности к hPG. Полезные тестируемые антитела, которые конкурируют с эталонным антителом к hPG (например,одно из антител к hPG, описанных здесь), обычно будут иметь KiS, которое варьируется в пределах от 10 пМ до 100 нМ при условиях исследования, описанных здесь. 8.6. Пример 6. Концентрации прогастрина в плазме крови у пациентов, у которых диагностирован первичный и метастатический рак поджелудочной железы. Этот пример демонстрирует, что пациенты, у которых диагностирован либо первичный, либо метастатический рак поджелудочной железы, имеют повышенный уровень прогастрина в плазму или в сыворотке крови. 8.6.1. Способы. Концентрации прогастрина в плазме крови измеряли у здоровых людей, в качестве контроля, и у пациентов, у которых диагностирован рак поджелудочной железы, рак желудка, рак пищевода, рак яичников или рак молочной железы. Здоровые контрольные образцы (n=104) были получены из банка крови и плазмы. Из пациентов, вовлеченных в исследование, 25/32 больных раком поджелудочной железы имели метастатическое заболевание, десяти из которых удалили свои первичные новообразования. Количественное определение уровня прогастрина в плазме или сыворотке крови было выполнено посредством применения прогастрин-специфического анализа сэндвич-ELISA, подобного тому, как описано ниже. Лунки Nunc MaxiSORP-96-луночных планшетов покрывали первым прогастрин-специфичным антителом следующим образом. Поликлональные антитела к прогастрину, специфичные по отношению к карбокси-концевой области прогастрина, растворяли в концентрации 3 мкг/мл в растворе 50 мМ, со значением рН 9.6, буферного раствора карбоната/бикарбоната натрия в воде MilliQ. Общее количество, составляющее 100 мкл раствора антитела, затем добавляли в каждую лунку 96-луночных планшетов, и инкубировали на протяжении ночи при температуре 4 С. После связывания раствор антитела удаляли из лунок, которые затем промывали три раза 100 мкл промывочного буфера (1X ФСБ/0.1% Tween-20). Общее количество 100 мкл блокирующего буфера (IX ФСБ/0,1% Tween-20/0,1% BSA), затем добавляли к каждой лунке и инкубировали на протяжении 2 ч при температуре 22 С. Блокирующий буфер затем удаляли и лунки промывали три раза промывочным буфером. Образцы плазмы или сыворотки, выделенные от пациентов, затем добавляли к лункам в объеме 100 мкл в серии растворений, обычно 1:1, 1:2, 1:5 и 1:10 растворений, и затем инкубировали на протяжении 2 ч при температуре 22 С. Образцы плазмы или сыворотки были проанализированы в двух параллельных опытах. Исследование также включает две стандартных кривые. Первая стандартная кривая подготовлена посредством применения растворения рекомбинантного гена прогастрина до окончательного количества,которое представляет собой 1, 0,5, 0,25, 0,1, 0,05, 0,01 и 0 нг на лунку. Вторая стандартная кривая, которая служит негативным контролем, подготовлена из прогастрин-негативной человеческой сыворотки,растворенной в блокирующем буфере при тех же растворениях, что и испытательные образцы, т.е. 1:1,1:2, 1:5 и 1:10. В качестве альтернативы, когда оценивают образцы плазмы, вторую стандартную кривую,которая служит негативным контролем, подготавливают из прогастрин-негативной человеческой плаз- 25023722 мы, растворенной в блокирующем буфере при тех же растворениях, что и испытательные образцы, т.е. 1:1, 1:2, 1:5 и 1:10. После того как инкубация с образцами плазмы или сыворотки завершена, содержание лунок удаляли, и лунки промывали три раза промывочным буфером, в количестве 100 мкл/лунку, после чего прогастрин, связанный с первым антителом, определяли посредством применения второго антитела, специфичного к прогастрину, следующим образом. Биотин-сопряженные поликлональные или моноклональные антитела к прогастрину, специфичные по отношению к амино-концевой области прогастрина, растворяли в блокирующем буфере до концентрации 0,1-10 мкг/мл, в зависимости от антитела. Общее количество 100 мкл раствора антитела затем добавляли к каждой лунке, и инкубировали на протяжении 1 ч при температуре 22 С. После того как связывание вторичного антитела завершено, планшеты промывали три раза с промывочным буфером, 100 мкл/лунку, после чего 100 мкл раствора стрептавидин-HRP (25 нг/мл в блокирующем буфере) добавляли к каждой лунке и инкубировали на протяжении 1 ч при температуре 22 С. После того как инкубация с стрептавидин-HRP раствором завершена, планшеты промывали три раза с промывочным буфером, 100 мкл/лунку. После этого, приготавливали 100 мкл хемилюминесцентного субстрата посредством применения набора Pierce SuperSignal ELISA Femto Maximum Sensitivity Chemiluminescent Substrate, который добавляли на лунку, инкубировали на протяжении 5 мин при комнатной температуре в темноте, и затем прочитывали на люминометре. На основании данных люминометра, применяли линейный регрессный анализ, для того чтобы получить соотношение линий, соответствующих данным стандартной кривой. Применяя это соотношение,затем вычисляли концентрацию прогастрина в образцах от различных пациентов. 8.6.2. Результаты. Коробчатая диаграмма на фиг. 4 показывает 25-й процентиль, медиану, и 75-й процентиль концентраций прогастрина в плазме крови у пациентов, страдающих от рака, по сравнению со здоровыми из контрольной группы. Усы указывают на 5-й и 95-й процентили концентраций прогастрина в плазме крови. Эти данные демонстрируют, что пациенты, страдающие первичным и метастатическим раком поджелудочной железы, имеют повышенный уровень прогастрина в плазме или сыворотке по сравнению со здоровыми людьми. 8.7. Пример 7. Экспрессия гена гастрина в первичных и метастатических клеточных линиях рака поджелудочной железы. Этот пример показывает, что ген GAST экспрессирует в первичных и метастатических клеточных линиях рака поджелудочной железы. 8.7.1. Способ. Тестируемые клетки представляли собой клеточные линии первичного рака поджелудочной железы ВхРС-3 и MIA РаСа-2 и клеточные линии метастатического рака поджелудочной железы Capan 1 иSU.86.86. После периода роста клетки ресуспендировали и лизировали, и общее количество мРНК экстрагировали посредством применения мининабора QIAGEN Rneasy в соответствии с протоколом изготовителя. РНК был обратно транскрибировали, применяя Superscript II RT (компания Invitrogen) в присутствии праймера 01igo(dT)15 (компания Roche Applied Science). Выполняли ПЦР в реальном времени посредством применения набораQuantifast SYBR Green PCR (компания Qiagen) и Eppendorf Mastercycler ep realplex (компания Eppendorf). Праймеры для GAST и амплификации гена GAPDH были получены от компании Sigma LifeScience. Каждую амплификацию-ПЦР осуществляли в тройных лунках при следующих условиях: 5 мин при температуре 95 С, за чем следовало в общей сложности 45 два температурных цикла (10 с при температуре 95 С и 30 с при температуре 60 С). 8.7.2. Результаты. Соответствующие уровни гастрин мРНК, экспрессированного в различных клеточных линиях,представлены на фиг. 56. Уровни были нормализованы относительно количества GAST мРНК, экспрессированного в клеточной линии колоректального рака LS174 Т, которая служила в качестве положительного контроля, и данные выражены относительно уровней экспрессии в клеточной линии LS174T CRC. Все протестированные клеточные линии рака поджелудочной железы экспрессируют мРНК для прогастрин-кодирующего гена (GAST). 8.8. Пример 8. Секреция прогастрина клеточными линиями рака поджелудочной железы. Этот пример демонстрирует, что клеточные линии рака поджелудочной железы секретируют прогастрин. 8.8.1. Способ. Секрецию прогастрина определяли количественно посредством применения метода сэндвич-ELISA в кондиционированной среде, полученной из клеток поджелудочной железы, выращенных в культуре 2D, посредством применения следующего протокола. Клетки выращивали во флягах объемом 75 см 2,пока они не достигали 60%ого слияния. Среда затем удаляли, и клетки промывали один раз ФСБ. Затем клетки выращивали в 20 мл среды M11 (без фенолового красного) на протяжении 48 ч. Среду затем собирали, центрифугировали в 1,000 г на протяжении 5 мин, чтобы удалить клеточный дебрис, и замора- 26023722 живали при температуре -80 С. Затем клетки трипсинизировали и считали. Чтобы измерить секретированный прогастрин, замороженную среду медленно растапливали на льду, и затем производили 40-кратное выпаривание до объема 500 мкл, посредством применения концентраторов белка (Icon Pierce), используя центрифугирование при 2,500 г на протяжении 45 мин. Затем посредством применения метода сэндвич-ELISA устанавливали концентрацию прогастрина. 8.8.2. Результаты. Концентрации прогастрина в среде, кондиционированной клеточными линиями рака поджелудочной железы, представлены на фиг. 6. Данные выражены как концентрация прогастрина в пМ, на миллион клеток за 48 ч роста. 8.9. Пример 9. Действие моноклональных антител к hPG на рост метастатических клеток рака поджелудочной железы Capan 1 в культуре. Этот пример демонстрирует, что антитела к hPG ингибируют пролиферацию клеток метастатического рака поджелудочной железы. 8.9.1. Способы. Клетки Capan 1 высевали в 6-луночные планшеты (50 000 клеток/лунку) и выращивали в DMEM,содержащем 20-ю эмбриональную сыворотку теленка, на протяжении 8 ч. Клетки выдерживали без сыворотки всю ночь с вечера, и начиная через 24 часа после высева (время ТО), клетки обрабатывали каждые 12 ч на протяжении 48 ч, в присутствии 0,5% PanexinH, 1 мкг/мл контрольного моноклонального антитела (мышиным античеловеческим IgG1, Calbiochem Ref 411451) или 1 мкг/мл MAb3 антитела кhPG, как обозначено, технический специалист был поражен относительно содержания растворов для обработки. 8.9.2. Результаты. Результаты, показанные на фиг. 7, были вычислены как среднее количество клеток на лунку в конце исследования минус количество клеток, высеянных в начале исследования. Результаты указанного исследования демонстрируют, что антитело MAb3 к hPG является эффективным для снижения роста клетка метастатического рака поджелудочной железы Capan 1 in vitro, по сравнению с контрольным антителом. 8.10. Пример 10. Ингибирующее действие двойной обработки моноклональными антителами к hPG на рост клеток ВхРС-3. Этот пример демонстрирует ингибирующий действие моноклональных антител к hPG на рост клеток первичного рака поджелудочной железы ВхРС-3 в культуре. 8.10.1. Способ. Для каждого эксперимента 150000 клеток ВхРС-3 высевали в 6-луночные планшеты и выращивали в среде, содержащей 10-ю эмбриональную сыворотку теленка на протяжении 8 ч. Клетки выдерживали без сыворотки всю ночь с вечера, и начиная через 24 ч после высева (время ТО), клетки обрабатывали каждые 12 ч на протяжении 48 ч, в присутствии 0,5% PanexinH, 1 мкг/мл контрольного моноклонального антитела (P3X63Ag8, ATCC, Ref TIB-9) или 1 мкг/мл антитела MAb8 к hPG, как указано. Количество живых клеток в клетках, обработанных как контрольным антителом MAb, так и антителом MAb к hPG, было посчитано через 48 ч. Количество клеток в начале обработки (Т 0) было вычтено от количества тестируемых и контрольных клеток, установленного через 48 ч. 8.10.2. Результаты. Результаты показаны на фиг. 8. Фактические количества клеток и для контрольного образца и для тестируемого образца, и количество клеток тестируемого образца относительно контроля, предоставлены в табл. 4 ниже. 8.11. Пример 11. Ингибирующее действие двойной обработки моноклональными антителами к hPG на рост клеток MIA РаСа-2. Этот пример демонстрирует ингибирующее действие моноклональных антител к hPG на рост клеток MIA РаСа-2 первичного рака поджелудочной железы в культуре. 8.11.1. Способ. Для каждого исследования 100000 клеток MIA РаСа-2 высевали в 6-луночные планшеты и выращивали в среде, содержащей 10-ю эмбриональную сыворотку теленка + 2,5% сыворотки лошади на протяжении 8 ч. Клетки выдерживали без сыворотки всю ночь с вечера, и, начиная через 24 ч после высева(время Т 0), клетки обрабатывали каждые 12 ч на протяжении 72 ч в присутствии 0,5% Panexin H, 10 мкг/мл контрольного моноклонального антитела (P3X63Ag8, ATCC, Ref TIB-9) или 10 мкг/мл антителаMAb8 к hPG, как указано. Количество живых клеток в клетках, обработанных как контрольным антителом MAb, так и антителом MAb к hPG, было посчитано через 72 ч. Количество клеток в начале лечения(ТО) был вычтено от количества тестируемых и контрольных клеток, установленного через 72 ч. 8.11.2. Результаты. Результаты исследования предоставлены на фиг. 9. Фактические количества клеток и для контрольного образца и для тестируемого образца, и количество клеток тестируемого образца относительно контроля, предоставлены в табл. 5, ниже. 8.12. Пример 12. Ингибирующее действие двойной предварительной обработки моноклональным антителом к прогастрину на последующий рост клеток рака поджелудочной железы в качестве сфероидов из раковых клеток в суспензии. Этот пример демонстрирует ингибирующее действие, которое оказывает предварительная обработка клеток метастатическорго рака поджелудочной железы моноклональным антителом к прогастрину на последующую способность этих клеток расти в качестве сфероидов из раковых клеток при культивировании в условиях низкой адгезии 8.12.1. Эксперимент 1. Способ. 100000 клеток Capan 1/лунку сначала высевали в 6-луночные планшеты в DMEM с 20-м FCS, выдерживали без сыворотки всю ночь с вечера и выращивали на протяжении 48 ч в DMEM с 0,5% PanexinH, в присутствии моноклонального антитела MAb3 к прогастрину или контрольным моноклональным антителом (мышиное античеловеческое IgG1; Calbiochem ref 411451). В конце обработки, для каждой группы обработки, 500 клеток/лунку было нанесено в восемь лунок 24-луночных планшетов ультранизкой адгезии в 500 мкл среды M11 без сыворотки, содержащей bFGF и EGF, и выращивали на протяжении последующих 11 дней без обработки. В конце этого периода осуществляли фотографирование, количество сфероидов на лунку подсчитывали, и поверхность сфероидов замеряли. 8.12.2. Эксперимент 1. Результаты. Фотографирование осуществляли в конце 11-дневного периода во время "отмывания", во время которого клетки Capan 1 после первичной обработки были выращены в той же среде M11. После этого,оператор, который был поражен идентичностью всех лунок, посчитал сфероиды. Как показано на фиг. 10, способность клеток рака поджелудочной железы Capan 1 расти в качестве сфероидов в планшетах низкой адгезии была значительно уменьшена в результате предварительной 48 часовой обработки моноклональным антителом против прогастрина. 8.12.3. Эксперимент 2. Способ. 150000 клеток/лунку (метастатическая линия клеток рака поджелудочной железы SU.86.86) были сначала высеяны в 6-луночные планшеты (в обычной адгезивной культуре) на протяжении 8 ч при температуре RPMI с 10-м FCS, выдерживали без сыворотки всю ночь с вечера и выращивали на протяжении 48 ч при температуре RPMI с 0,5% Panexin H, в отсутствии или присутствии моноклональных антителMAb8, MAb13, MAb16 или MAb19 к прогастрину. В конце обработки, для каждой группы обработки, 50 клеток/лунку были внесены в восемь лунок 96-луночных планшетов ультранизкой адгезии в 100 мкл среды M11 без сыворотки, содержащей bFGF и EGF, и выращивали на протяжении дальнейших 6 дней без обработки. В конце этого периода осуществляли фотографирование, подсчитывали количество сфероидов в лунках, и измеряли поверхность сфероидов. 8.12.4. Эксперимент 2. Результаты. Фотографирование осуществляли в конце 6-дневного периода "промывания", во время которого клетки SU.86.86 после первичной обработки были выращены в той же самой среде M11. После этого,оператор, который был поражен идентичностью всех лунок, посчитал сфероиды. Как показано фиг. 11, способность клеток рака поджелудочной железы SU.86.86 расти в качестве сфероидов в планшетах низкой адгезии была значительно уменьшена в результате предварительной 48 часовой обработки моноклональным антителом против прогастрина. Все публикации, патенты, заявки на патент и другие документы, процитированные в этом изобретении, включены здесь полностью посредством ссылки во всех смыслах в одинаковой степени, как если бы каждая отдельная публикация, патент, заявка на патент, или другой документ были бы отдельно указаны для того, чтобы быть включенными посредством ссылки во всех смыслах. Притом что различные конкретные варианты осуществления были проиллюстрированы и описаны,следует понимать, что различные модификации могут быть осуществлены, не выходя за рамки сущности и объема изобретения.
МПК / Метки
МПК: C07K 16/26, A61P 35/00, A61K 39/395
Метки: железы, hpg, лечения, поджелудочной, человеческому, антитела, применение, прогастрину, рака
Код ссылки
<a href="https://eas.patents.su/30-23722-primenenie-antitela-k-chelovecheskomu-progastrinu-hpg-dlya-lecheniya-raka-podzheludochnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Применение антитела к человеческому прогастрину (hpg) для лечения рака поджелудочной железы</a>
Предыдущий патент: Водная суспензия для электродов батарей
Следующий патент: Пестицидная композиция, содержащая фосетил-алюминий, пропамокарб-hcl и инсектицидно активное вещество
Случайный патент: Соединение бурильных труб