Инъецируемые композиции мелфалана, содержащие производное циклодекстрина, и способы их применения
Формула / Реферат
1. Применение фармацевтической композиции, содержащей мелфалан и производное циклодекстрина формулы I
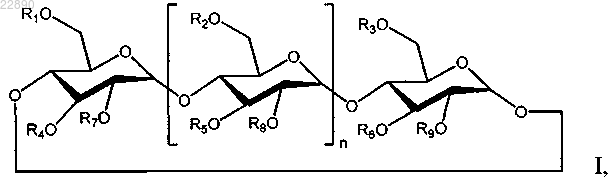
где n равен 5;
R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью;
где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью;
при этом указанная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6 и
при этом производное циклодекстрина находится в соотношении с мелфаланом по меньшей мере 50:1 (мас./мас.),
в способе подготовки субъекта, которому показана трансплантация стволовых клеток, путем введения указанной фармацевтической композиции указанному субъекту, которому показана трансплантация стволовых клеток, с обеспечением дозы мелфалана от 50 до 300 мг/м2 в день, при этом:
a) введение осуществляют в течение периода времени, составляющего два или более дня; и
b) введение осуществляют внутривенно.
2. Применение по п.1, отличающееся тем, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой гидроксизамещенную C3-группу.
3. Применение по п.1, отличающееся тем, что указанное производное циклодекстрина представляет собой соединение формулы II
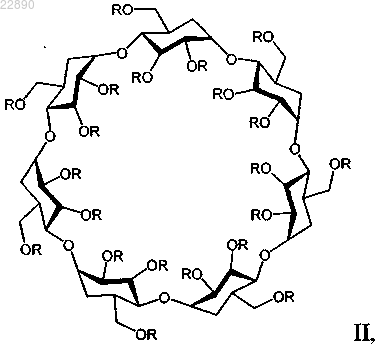
где R=(H)21-x или (-(CH2)4-SO3-Na+)x, a x=6,0-7,1,
причем указанная фармацевтическая композиция содержит примерно 200 мг мелфалана в виде гидрохлоридной соли.
4. Применение по любому из пп.1-3, отличающееся тем, что указанный субъект, которому показана трансплантация стволовых клеток, страдает заболеванием или расстройством, выбранным из миеломы, множественной миеломы, лимфомы, неходжкинской лимфомы, лейкоза, острого миелоидного лейкоза, болезни Ходжкина, острого лимфобластного лейкоза, миелодиспластического синдрома, миелопролиферативного заболевания, хронического миелогенного лейкоза, нейробластомы, апластической анемии, хронического гранулоцитарного лейкоза, нейробластомы, серповидно-клеточного заболевания, остеогенной саркомы, саркомы Юинга, десмопластической мелкокруглоклеточной опухоли, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций.
5. Применение по любому из пп.1-4, включающее разбавление концентрированной композиции мелфалана водным разбавителем с обеспечением указанной фармацевтической композиции, при этом:
a) указанная концентрированная композиция мелфалана содержит от 50 до 500 мг мелфалана и
b) указанный водный разбавитель представляет собой физиологический раствор.
6. Применение по п.5, отличающееся тем, что указанная концентрированная композиция мелфалана содержит примерно 200 мг мелфалана.
7. Применение по любому из пп.1-6, отличающееся тем, что указанная фармацевтическая композиция, по существу, не содержит спирта.
8. Применение по любому из пп.5-7, отличающееся тем, что мелфалан в указанной фармацевтической композиции разлагается на 4% или менее при температуре примерно 25°С в течение 10 ч после разбавления.
9. Применение по любому из пп.5-8, отличающееся тем, что указанная фармацевтическая композиция перед введением хранится от примерно 0,5 до примерно 12 ч.
10. Применение по любому из пп.1-9, отличающееся тем, что указанное введение обеспечивает Cmax мелфалана у субъекта, которому показана трансплантация стволовых клеток, по меньшей мере на 20% или более превосходящую Cmax мелфалана, обеспечиваемую составом мелфалана, содержащим эквивалентную дозу мелфалана и не содержащим указанного производного циклодекстрина.
11. Применение по любому из пп.1-9, отличающееся тем, что указанное введение обеспечивает AUC0-t мелфалана у субъекта, которому показана трансплантация стволовых клеток, по меньшей мере на 20% или более превышающую AUC0-t мелфалана, обеспечиваемую составом мелфалана, содержащим эквивалентную дозу мелфалана и не содержащим указанного производного циклодекстрина.
12. Применение разбавленной фармацевтической композиции в способе лечения субъекта, страдающего опухолевым заболеванием, путем введения указанной разбавленной фармацевтической композиции инъекционно указанному субъекту, нуждающемуся в этом, при этом указанная разбавленная фармацевтическая композиция получена путем разбавления композиции водным разбавителем с обеспечением разбавленной фармацевтической композиции, содержащей от 25 до 125 мг мелфалана и производное циклодекстрина формулы I
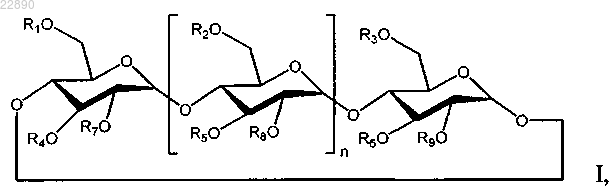
где n равен 5;
R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью;
где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью;
при этом указанная разбавленная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6;
при этом производное циклодекстрина находится в соотношении с мелфаланом по меньшей мере 50:1 (мас./мас.) и
при этом мелфалан в указанной разбавленной фармацевтической композиции разлагается на 2% или менее при температуре примерно 25°С в течение 5 ч после разбавления.
13. Применение по п.12, отличающееся тем, что указанное опухолевое заболевание выбрано из миеломы, множественной миеломы, меланомы, острого миелоидного лейкоза, злокачественной меланомы, рака молочной железы, рака яичников, рака яичка, распространенного рака предстательной железы, нейроэндокринного рака, метастатической меланомы, метастатической нейроэндокринной опухоли, метастатической аденокарциномы, гепатоклеточной карциномы, остеогенной саркомы, истинной полицитемии плазмы крови, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций.
14. Применение по п.12 или 13, отличающееся тем, что указанное опухолевое заболевание представляет собой множественную миелому, введение осуществляется системно и обеспечивает паллиативное лечение множественной миеломы.
15. Применение по любому из пп.12-14, отличающееся тем, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой гидроксизамещенную C3-группу.
16. Применение по любому из пп.12-14, отличающееся тем, что R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой группу C1-C8-(алкилен)-SO3- с прямой или разветвленной цепью со степенью замещения от 4 до 8 на производное циклодекстрина, а остальные заместители представляют собой -Н.
17. Применение по любому из пп.12-14 или 16, отличающееся тем, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 содержит в качестве заместителя группу С4-(алкилен)-SO3- с прямой цепью.
18. Применение по любому из пп.12-14, 16 или 17, отличающееся тем, что производное циклодекстрина представляет собой соединение формулы II

где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1;
где фармацевтическая композиция содержит примерно 50 мг мелфалана в виде гидрохлоридной соли и
где производное циклодекстрина присутствует в концентрации от 50:1 до 100:1 (мас./мас.) по отношению к мелфалану.
19. Применение по любому из пп.12-18, отличающееся тем, что указанная разбавленная фармацевтическая композиция, по существу, не содержит спирта и указанный водный разбавитель представляет собой физиологический раствор.
20. Применение по любому из пп.12-19, отличающееся тем, что мелфалан в указанной разбавленной фармацевтической композиции разлагается на 4% или менее при температуре 25°С в течение 10 ч после разбавления.
21. Применение по любому из пп.12-20, отличающееся тем, что указанная разбавленная фармацевтическая композиция перед введением хранится от примерно 0,5 до примерно 18 ч.
22. Фармацевтическая композиция, содержащая мелфалан в виде гидрохлоридной соли, буфер и производное циклодекстрина формулы I
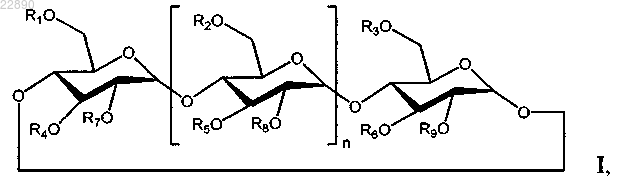
где n равен 5;
R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью;
где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью;
где фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6;
при этом разбавление указанной фармацевтической композиции водным раствором обеспечивает разбавленную фармацевтическую композицию, в которой мелфалан разлагается на 2% или менее при температуре примерно 25°С в течение 5 ч после разбавления; и
при этом указанная фармацевтическая композиция содержит от 25 до 125 мг соли мелфалана и производное циклодекстрина находится в соотношении с мелфаланом от 50:1 до 100:1 (мас./мас.).
23. Фармацевтическая композиция по п.22, отличающаяся тем, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой гидроксизамещенную C3-группу.
24. Фармацевтическая композиция по п.22, отличающаяся тем, что производное циклодекстрина представляет собой соединение формулы II
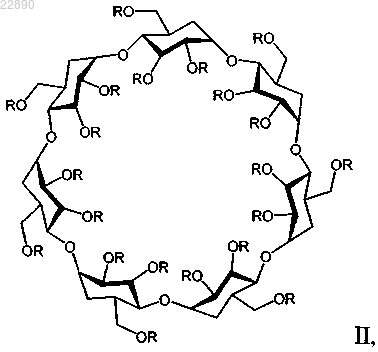
где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1;
где фармацевтическая композиция содержит примерно 50 мг мелфалана в виде гидрохлоридной соли и
где производное циклодекстрина находится в соотношении с мелфаланом примерно 55:1 (мас./мас.).
25. Фармацевтическая композиция по любому из пп.22 или 24, отличающаяся тем, что производное циклодекстрина представляет собой соединение формулы II
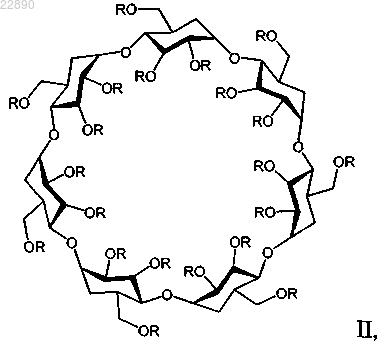
где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1.
26. Фармацевтический набор, содержащий
первую емкость, содержащую мелфалан в виде гидрохлоридной соли и водорастворимый полимер; и
вторую емкость, содержащую водный разбавитель, буфер и производное циклодекстрина формулы I
где n равен 5;
R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С1-С8-(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью;
где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу C1-С8-(алкилен)-SO3- с прямой или разветвленной цепью;
при этом объединение содержимого первой и второй емкостей обеспечивает разбавленную фармацевтическую композицию, имеющую значение рН от примерно 4 до примерно 6, и которая разлагается на 2% или менее при температуре примерно 25°С в течение 5 ч после разбавления; и
при этом первая емкость содержит от 25 до 125 мг мелфалана в виде гидрохлоридной соли и производное циклодекстрина находится во второй емкости в концентрации по меньшей мере 50:1 (мас./мас.) по отношению к мелфалану.
27. Фармацевтический набор по п.26, отличающийся тем, что первая емкость содержит повидон в количестве от 10 до 30 мг, а вторая емкость содержит регулятор уровня рН в концентрации, достаточной для обеспечения значения рН от примерно 4 до примерно 6 при объединении содержимого первой и второй емкостей, при этом производное циклодекстрина представляет собой соединение формулы II

где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1.
Текст
Изобретение относится к фармацевтическим композициям и фармацевтическим наборам,содержащим мелфалан и производное циклодекстрина, и к способам применения указанных композиций. Уровень техники Область техники Настоящее изобретение относится к фармацевтическим композициям, содержащим мелфалан и производное циклодекстрина, и к способам применения указанных композиций, например, для лечения расстройств и заболеваний, являющихся терапевтически восприимчивыми к мелфалану. Уровень техники Мелфалан представляет собой алкилирующий агент бисхлорэтиламинного типа, активный в отношении как покоящихся, так и быстро делящихся опухолевых клеток; см., например, патенты США 3032584, 3032585 и 4997651. Инъецируемая композиция мелфалана (Alkeran для инъекций, компанияGlaxoSmithKline) была одобрена Управлением по контролю за продуктами и лекарствами США для паллиативного лечения пациентов с множественной миеломой, для которых не подходит пероральная терапия, а пероральная композиция мелфалана (таблетки Alkeran, GlaxoSmithKline) была одобрена для паллиативного лечения множественной миеломы и временного облегчения при неоперабельной эпителиальной карциноме яичника.Alkeran для инъекций (GlaxoSmithKline) вводят внутривенно после предварительного разбавления стерильного, апирогенного, лиофилизированного порошка, содержащего гидрохлорид мелфалана (эквивалент 50 мг мелфалана) и 20 мг повидона, стерильным разбавителем, содержащим цитрат натрия (0,2 г),пропиленгликоль (6 мл), этанол (96%, 0,52 мл) и воду, до общего объема 10 мл. Обычная внутривенная доза составляет 16 мг/м 2; ее вводят путем однократной инфузии в течение 15-20 мин. Мелфалан вводят внутривенно 4 дозами с интервалами в 2 недели, затем после достаточного восстановления организма от токсического воздействия с интервалами в 4 недели. Согласно инструкции по применению лекарственного препарата Alkeran для инъекций (GlaxoSmithKline) после введения препарата Alkeran для инъекций концентрации мелфалана в плазме быстро снижаются по биэкспоненциальной модели с периодами полураспада на фазе распределения и фазе конечной элиминации, составляющими примерно 10 и 75 мин соответственно. Средний общий клиренс составляет от 7 до 9 мл/мин/кг (от 250 до 325 мл/мин/м 2). Исследование показало, что при повторяющейся дозировке 0,5 мг/кг каждые 6 недель клиренс мелфалана уменьшился с 8,1 мл/мин/кг после первого курса до 5,5 мл/мин/кг после третьего курса, но после третьего курса далее существенно не уменьшался. Средние (станд. откл.) пиковые концентрации мелфалана в плазме у пациентов, больных миеломой,после введения 10 или 20 мг/м 2 доз мелфалана составили 1,20,4 и 2,81,9 мкг/мл соответственно. После внутривенного введения 50 мг мелфалана объем распределения мелфалана в равновесном состоянии составляет 0,5 л/кг. Степень связывания мелфалана с белками плазмы варьирует от 60 до 90%. Сывороточный альбумин является главным связывающим белком, в то время как на долю 1-кислого гликопротеина приходится примерно 20% связываний с белками плазмы. Примерно 30% лекарственного препарата(ковалентно) необратимо связывается с белками плазмы. Было выяснено, что взаимодействие лекарственного препарата с иммуноглобулинами незначительно. Мелфалан выводится из плазмы главным образом путем химического гидролиза до моногидроксимелфалана и дигидроксимелфалана. Кроме указанных продуктов гидролиза, у человека не наблюдалось других метаболитов мелфалана. Контролируемые клинические исследования по сравнению внутривенной и пероральной форм мелфалана показали большую миелосупрессию при внутривенном введении мелфалана. Кроме того, реакции гиперчувствительности, включая анафилаксию, возникали примерно у 2% пациентов, получавших мелфалан внутривенно. Мелфалан также подвергается быстрому гидролизу в водном растворе; см. S.A. Stoutet al., Int. J. Pharm. 24:193 (1985). Мелфалан в препарате Alkeran для инъекций (GlaxoSmithKline) также быстро образует цитратное производное после восстановления и не может храниться в холодильнике вследствие выпадения мелфалана из раствора в осадок. Известны композиции мелфалана, содержащие производное циклодекстрина в качестве носителя и/или разбавителя; см., например, N.J. Medlicott, et al., J. Pharm. Sci. 57:1138 (1998), D.Q. Ma et al., Int. J.Pharm. 189:221 (1999), D.Q. Ma et al., J. Pharm. Sci. 89:215 (2000) и патенты США 4983586, 5024998 и 6583125. Существует потребность в композиции мелфалана, которая сможет снизить токсическое воздействие и профиль побочного действия внутривенной формы мелфалана. Также существует потребность в композиции мелфалана для внутривенного введения, имеющей повышенную биодоступность и/или ускоренное начало терапевтического действия. Также существует потребность в композиции мелфалана,которая подходит для внутривенного введения, стабильна в условиях окружающей среды и в условиях охлаждения и может обеспечить полное растворение мелфалана без необходимости органических растворителей (например, этанол и/или пропиленгликоль и подобные). Также существует потребность в композиции, не содержащей компонентов, которые быстро образуют производное с мелфаланом. Также существует потребность в композиции мелфалана, которая подходит для внутривенного введения и имеет повышенную стабильность, что позволяет проводить более длительные инфузии и увеличивать продолжительность воздействия мелфалана, который пациент получает посредством однократного удобного введения. В настоящем описании представлены разработанные композиции, подходящие для перорального или парентерального введения, которые содержат мелфалан и производное циклодекстрина. Настоящее изобретение относится к фармацевтической композиции, содержащей от 25 до 125 мг мелфалана в виде гидрохлоридной соли, необязательный буфер и производное циклодекстрина формулы где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или С 1-С 6 группу с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу C1-C8(алкилен)-SO3- с прямой или разветвленной цепью; при этом фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6; причем разбавление фармацевтической композиции водным раствором позволяет получить готовый для инфузии раствор мелфалана, в котором мелфалан разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления; и указанная фармацевтическая композиция содержит от 25 до 125 мг соли мелфалана и производное циклодекстрина находится в соотношении с мелфаланом от 50:1 до 100:1 (мас./мас.). Настоящее изобретение также относится к фармацевтической композиции, в которой по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу гидроксизамещенную C3 группу. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x, и х=6,0-7,1; и фармацевтическая композиция содержит примерно 50 мг мелфалана в виде гидрохлоридной соли, а производное циклодекстрина находится в соотношении с мелфаланом примерно 55:1 (мас./мас.); или фармацевтическая композиция содержит примерно 200 мг мелфалана в виде гидрохлоридной соли. Настоящее изобретение относится к применению разбавленной фармацевтической композиции в способе лечения субъекта, страдающего опухолевым заболеванием, включающему введение разбавленной фармацевтической композиции путем инъекции субъекту, нуждающемуся в этом, при этом указанная разбавленная фармацевтическая композиция получена путем разбавления композиции водным разбавителем с получением разбавленной фармацевтической композиции, содержащей от 25 до 125 мг мелфалана и производного циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу C1-C8(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С 1-С 8-(алкилен)SO3- с прямой или разветвленной цепью; при этом разбавленная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6; причем производное циклодекстрина находится в соотношении с мелфаланом по меньшей мере 50:1 (мас./мас.); где мелфалан в указанной разбавленной фармацевтической композиции разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления. В некоторых вариантах реализации опухолевое заболевание выбрано из миеломы, множественной миеломы, острого миелоидного лейкоза, меланомы, злокачественной меланомы,рака молочной железы,рака яичников, рака яичка, распространенного рака предстательной железы, нейроэндокринного рака,метастатической меланомы (например, метастатической меланомы глаза, метастатической меланомы кожи и подобных), метастатической нейроэндокринной опухоли, метастатической аденокарциномы, гепатоклеточной карциномы, остеогенной саркомы, истинной полицитемии плазмы крови, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций. В некоторых вариантах реализации опухолевое заболевание представляет собой множественную миелому, а введение является системным и обеспечивает паллиативное лечение множественной миеломы. В некоторых вариантах реализации по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу гидроксизамещенную С 3-группу. В некоторых вариантах реализации R1, R2, R3,R4, R5, R6, R7, R8 и R9 независимо представляют собой группу С 1-С 8-(алкилен)-SO3- с прямой или разветвленной цепью со степенью замещения от 4 до 8 на производное циклодекстрина, а остальные заместители представляют собой -Н. В некоторых вариантах реализации по меньшей мере один из R1, R2, R3, R4,R5, R6, R7, R8 и R9 содержит в качестве заместителя группу С 4-(алкилен)-SO3- с прямой цепью. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1; причем указанная фармацевтическая композиция содержит примерно 50 мг мелфалана в виде гидрохлоридной соли и производное циклодекстрина присутствует в концентрации от 50:1 до 100:1 (мас./мас.) по отношению к мелфалану. В некоторых вариантах реализации разбавленная фармацевтическая композиция, по существу, не содержит спирта и указанный водный разбавитель представляет собой физиологический раствор. В некоторых вариантах реализации мелфалан в указанной разбавленной фармацевтической композиции разлагается на 4% или менее при температуре 25 С в течение 10 ч после разбавления. В некоторых вариантах реализации указанная разбавленная фармацевтическая композиция перед введением хранится от примерно 0,5 до примерно 18 ч. Настоящее изобретение также относится к применению фармацевтической композиции, содержащей мелфалан и производное циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-C6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С 1-С 8-3 022890(алкилен)-SO3- с прямой или разветвленной цепью; где разбавленная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6 и где производное циклодекстрина находится в соотношении с мелфаланом по меньшей мере 50:1 (мас./мас.), в способе подготовки субъекта, нуждающегося в трансплантации стволовых клеток, включающему введение субъекту, нуждающемуся в трансплантации стволовых клеток, дозы мелфалана, составляющей от 50 до 300 мг/м в день, причем введение осуществляется в течение периода двух или более дней и введение осуществляется внутривенно. В некоторых вариантах реализации по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой гидроксизамещенную C3-группу. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x, а х=6,0-7,1; причем указанная фармацевтическая композиция содержит примерно 200 мг мелфалана в виде гидрохлоридной соли. В некоторых вариантах реализации субъект, которому показана трансплантация стволовых клеток,страдает заболеванием или расстройством, выбранным из миеломы, множественной миеломы, острого миелоидного лейкоза, меланомы, злокачественной меланомы, рака молочной железы, рака яичников,рака яичка, распространенного рака предстательной железы, нейроэндокринного рака, метастатической меланомы (например, метастатической меланомы глаза, метастатической меланомы кожи и подобных),метастатической нейроэндокринной опухоли, метастатической аденокарциномы, гепатоклеточной карциномы, остеогенной саркомы, истинной полицитемии плазмы крови, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций. В некоторых вариантах реализации фармацевтическая композиция или разбавленная фармацевтическая композиция практически не содержит спирта. В некоторых вариантах реализации водный разбавитель представляет собой физиологический раствор. В некоторых вариантах реализации разбавленная фармацевтическая композиция перед введением хранится от примерно 0,5 до примерно 18 ч. В некоторых вариантах реализации мелфалан в фармацевтической композиции согласно настоящему изобретению разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления. В некоторых вариантах реализации указанная фармацевтическая композиция перед введением хранится от примерно 0,5 до примерно 12 ч. В некоторых вариантах реализации введение обеспечивает среднюю максимальную концентрацию (Cmax) мелфалана у субъекта, по меньшей мере на 20% или более превосходящую Cmax мелфалана, обеспечиваемую составом мелфалана, содержащим эквивалентную дозу мелфалана, и не содержащим производного циклодекстрина. В некоторых вариантах реализации введение обеспечивает AUC0-t мелфалана у субъекта, по меньшей мере на 20% или более превосходящуюAUC0-t мелфалана, обеспечиваемую составом мелфалана, содержащим эквивалентную дозу мелфалана и не содержащим производного циклодекстрина. В некоторых вариантах реализации способ согласно настоящему изобретению включает разбавление концентрированной композиции мелфалана водным разбавителем для получения фармацевтической композиции. В некоторых вариантах реализации концентрированная композиция мелфалана содержит от 50 до 500 мг мелфалана. В некоторых вариантах реализации концентрированная композиция мелфалана содержит примерно 200 мг мелфалана. Настоящее изобретение также относится к фармацевтическому набору, содержащему первую емкость, содержащую от 25 до 125 мг мелфалана в виде гидрохлоридной соли и необязательный водорастворимый полимер, и вторую емкость, содержащую водный разбавитель, необязательный буфер и производное циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, С 1-С 8(алкилен)-SO3- группу с прямой или разветвленной цепью или C1-C6 группу с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой С 1-С 8(алкилен)-SO3- группу с прямой или разветвленной цепью; причем производное циклодекстрина находится во втором контейнере в концентрации по меньшей мере 50:1 (мас./мас.) относительно мелфалана; и где объединение содержимого первой и второй емкостей позволяет получить разбавленную фармацевтическую композицию, имеющую значение рН от примерно 4 до примерно 6, которая разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления. В некоторых вариантах реализации первая емкость содержит повидон в количестве от 10 до 30 мг, а вторая емкость содержит регулятор уровня рН в концентрации, достаточной для обеспечения уровня рН от примерно 4 до примерно 6 при объединении содержимого первой и второй емкостей. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1. Дальнейшие варианты реализации, отличительные признаки и преимущества настоящего изобретения, а также композиция, структура и действие различных вариантов реализации настоящего изобретения подробно описаны ниже со ссылкой на прилагаемые чертежи. Краткое описание чертежей Прилагаемые чертежи, включенные в настоящее описание и являющиеся его частью, иллюстрируют один или более вариантов реализации настоящего изобретения и вместе с описанием служат для объяснения принципов настоящего изобретения и позволяют специалисту в данной области техники изготовить и использовать настоящее изобретение. На фиг. 1 представлено графическое изображение растворимости свободного основания мелфалана как функции рН и концентрации производного циклодекстрина. На фиг. 2 представлено графическое изображение растворимости свободного основания мелфалана и гидрохлорида мелфалана при значении рН 7,5 как функции концентрации производного циклодекстрина. На фиг. 3 и 4 представлены принципиальные схемы процессов получения единичной дозированной формы согласно настоящему изобретению. На фиг. 5 А, 5 В представлено графическое изображение нормализированных по дозе концентраций мелфалана в цельной крови (фиг. 5 А) и плазме крови (фиг. 5 В) после внутривенного введения самцам крыс линии Спраг-Доули с использованием состава мелфалана, содержащего производное циклодекстрина (SBE6.5CD), и состава мелфалана, не содержащего производного циклодекстрина (Alkeran для инъекций, GlaxoSmithKline). На фиг. 6 представлено графическое изображение средней концентрации мелфалана в плазме крови у человека после внутривенного введения состава мелфалана, содержащего производное циклодекстрина(SBE6.5CD), и после внутривенного введения состава мелфалана, не содержащего производного циклодекстрина (Мелфалан HCl для инъекций (Melphalan HCl Injectable), Bioniche Pharma США). Далее приведено описание одного или более вариантов реализации настоящего изобретения со ссылкой на прилагаемые чертежи. На чертежах сходные номера могут обозначать идентичные или функционально схожие элементы. Кроме того, крайний (-ие) левый (-ые) знак номера может обозначать чертеж, на котором впервые появляется указанный номер. Подробное описание изобретения В настоящем описании приведены один или более вариантов реализации, включающих признаки настоящего изобретения. Описываемые варианты реализации призваны лишь проиллюстрировать настоящее изобретение. Объем изобретения не ограничен описываемыми вариантами реализации. Настоящее изобретение определено прилагаемой формулой изобретения. Предполагается, что в настоящем описании использование термина "примерно" в отношении любого количества включает это количество. Например, предполагается, что "примерно 10 мл" в настоящем описании включает "10 мл", а также значения, принимаемые в данной области техники как примерно 10 мл по отношению к описываемым величинам. Настоящее описание включает комбинации и суб-комбинации различных аспектов и вариантов реализации, приведенных в нем. Далее, когда в связи с вариантом реализации описывается определенный признак, структура или характеристика, следует понимать, что специалист в данной области может использовать данный признак, структуру или характеристику по отношению к другим вариантам реализации вне зависимости от того, были ли они детально описаны. Эти и другие аспекты настоящего изобретения очевидны из ссылки на последующее подробное описание, примеры, формулу изобретения и прилагаемые чертежи. Мелфалан. Композиции, составы и единичные дозированные формы согласно настоящему изобретению содержат мелфалан, имеющий следующую химическую структуру: В настоящем описании термин "мелфалан" относится к L-изомеру вышеуказанного соединения, 4[бис-(хлорэтил)амино]фенилаланину, а также к солям присоединения, полиморфам, сольватам, гидратам,дегидратам, сокристаллам, безводным и аморфным формам указанного соединения. Мелфалан имеет хиральный атом и, таким образом, в настоящем описании "мелфалан" может относиться к практически чистой форме L-изомера. В настоящем описании "практически чистый" относится к мелфалану, имеющему степень чистоты 90% и выше, 95% и выше, 98% и выше, 99% и выше, 99,5% и выше или 99,9% и выше.D-изомер вышеуказанного соединения, известный как медфалан, менее активен в отношении определенных опухолей животных, а доза этого соединения, необходимая для оказания влияния на хромосомы, больше, чем требуемая для мелфалана. Рацемическая (DL-) форма известна как мерфалан или сарколизин. В некоторых вариантах реализации композиции согласно настоящему изобретению практически не содержат медфалана. В некоторых вариантах реализации композиции согласно настоящему изобретению содержат мелфалан в виде гидрохлоридной соли, имеющей степень чистоты 95% или выше, 98% или выше, 99% или выше, 99,5% или выше, или 99,9% или выше. Мелфалан представляет собой бифункциональный алкилирующий агент, активный в отношении ряда опухолевых заболеваний человека. Молекулярная формула мелфалана - C13H18Cl2N2O2, а молекулярный вес его формы свободного основания - 305,20 г/моль. Мелфалан практически нерастворим в воде(рН 7) и имеет значение pKa примерно 2,5. В некоторых вариантах реализации фармацевтические композиции и лекарственные формы согласно настоящему изобретению содержат мелфалан в виде гидрохлоридной соли. В настоящем описании"мелфалан в виде гидрохлоридной соли" относится к соли присоединения соляной кислоты вышеуказанного соединения. Тем не менее, количества и концентрации мелфалана приведены в отношении к эквивалентной массе свободного основания мелфалана. Таким образом, 5 мг "мелфалана в виде гидрохлоридной соли" относятся к 5 мг активного агента мелфалана, за исключением соли присоединения соляной кислоты, что при ее учете дало бы общую массу в примерно 5,6 мг. Производные циклодекстрина. Композиции, составы и/или единичные дозированные формы согласно настоящему изобретению содержат производное циклодекстрина. В настоящем описании "производное циклодекстрина" относится к циклическому олигосахариду, включающему пять или более -D-глюкопиранозидных звеньев, замкнутых в циклическую 14 конфигурацию, а также включающему замещающую группу, соединенную с одним или более глюкопиранозидными звеньями в положении (-ях) 2, 3 и/или 6 посредством эфирной связи (-O-R-, где R относится к замещающей группе). В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы I где n равен 5 и где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо выбраны из -Н, группы С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или С 1-С 6 с прямой или разветвленной цепью. В некоторых вариантах реализации циклодекстрин для применения согласно настоящему изобретению выбрано на основании средней степени замещенности (average degree of substitution, ADS), которая в настоящем описании относится к среднему числу замещающих групп на молекулу циклодекстрина. Средняя степень замещенности для производных циклодекстрина подробно описана в международной заявке WO 2009/018069, которая полностью включена в настоящее описание посредством ссылки. В на-6 022890 стоящем описании композиция производного циклодекстрина для применения согласно настоящему изобретению определена согласно следующему примечанию: заместитель (-и) сокращены (например,группы сульфобутилового эфира сокращены как SBE) с подстрочным индексом, обозначающим ADS заместителя, и структура циклодекстрина определена. Например, композиция сульфобутилэфирного производного -циклодекстрина, имеющая ADS 6,5, обозначается как "SBE6.5CD". В качестве второго примера приводится то, что композиция -циклодекстрина, содержащая молекулы циклодекстрина, образующие производные как с сульфобутилэфирной группой, так и с гидроксипропильной группой, обозначаются как "SBE4.2-HP2.5CD", где ADS сульфобутилэфирных групп составляет 4,2, a ADS гидроксипропильных групп составляет 2,5. Производные циклодекстрина, которые подходят для применения в настоящем изобретении, включают композиции циклодекстрина, имеющие замещающие группы (R1-R9 и R в формулах I и II соответственно), которые независимо выбраны из -Н, группы С 1-С 8-(алкилен)-SO3- с прямой или разветвленной цепью или необязательно замещенной группы C1-C6 с прямой или разветвленной цепью. В некоторых вариантах реализации по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 формулы I замещен группой С 4-(алкилен)-SO3- с прямой цепью. Примеры групп С 1-С 8-(алкилен)-SO3-, подходящих для применения согласно настоящему изобретению, включают, без ограничения, сульфоэтил,сульфопропил, 1-метилсульфопропил, сульфобутил, 1-метилсульфобутил, 2-метилсульфобутил, 1 метилсульфобут-3-ил, 2-этилсульфобутил, 3-этилсульфобутил, сульфопентил, 1-сульфопент-3-ил, сульфогексил, сульфогептил, сульфооктил и подобные, а также их комбинации. В некоторых вариантах реализации R1, R2, R3, R4, R5, R6, R7, R8 и R9 формулы I независимо представляют собой группу С 1-С 8-(алкилен)-SO3- с прямой или разветвленной цепью, имеющую ADS от 4 до 8, от 4 до 7,5, от 4 до 7, от 4 до 6,5, от 4,5 до 8, от 4,5 до 7,5, от 4,5 до 7, от 5 до 8, от 5 до 7,5, от 5 до 7, от 5,5 до 8, от 5,5 до 7,5, от 5,5 до 7, от 5,5 до 6,5, от 6 до 8, от 6 до 7,5, от 6 до 7,1, от 6,5 до 5, примерно 6,5 или примерно 7 на производное циклодекстрина, а остальные заместители представляют собой -Н. В некоторых вариантах реализации заместитель представляет собой необязательно замещенную группу C1-C6 с прямой или разветвленной цепью. В настоящем описании "необязательно замещенный" относится к одному или более необязательным заместителям, выбранным из галогена (т.е. -F, -Cl, -Br, -I),-NO2, -CN, -OR22, -SR22, -SO2R22, -C(=O)OR22, -C(=O)R22, -C(=O)N(R22)2, -SO2N(R22)2, -SO2N(H)C(=O)R22,-SO2N(H)C(=O)OR22 (где R22 не является H), -N(R22)2, -N(R22)SO2R22, -N(R22)C(O)mR22 (где m=1 или 2),-N(R22)C(O)N(R22)2,-N(R22)SO2N(R22)2,-O-C(=O)R22,-O-C(=O)OR22,-O-C(=O)N(R22)2,-C(=O)N(H)SO2N(R22)2, -C(=O)N(H)SO2R22, оксо (или кето, т.е. =O), тиоксо (т.е. =S), имино (т.е. =NR22),-NR22-C(=NR22)R22, -NR22-C(=NR22)N(R22)2, -C(=NR22)N(R22)2, -O-C(=NR22)N(R22)2, -O-C(=NR22)R22,-C(=NR22)R22, -C(=NR22)OR22 и их ионных форм (например, -N+(R22)2X- и подобные, где Х- представляет собой фармацевтически приемлемый анион), где R22 в каждом случае независимо выбран из Н и С 1-С 4 алкила. Примеры групп C1-C6 с прямой или разветвленной цепью включают, без ограничения, 2 гидроксипропил, 3-гидроксипропил, 2,3-дигидроксипропил, 3-оксобутил и 2-этоксиэтил. В некоторых вариантах реализации по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 формулы I представляет собой гидроксизамещенную C3-группу. В некоторых вариантах реализации производное циклодекстрина содержит -циклодекстрин, который включает гидроксизамещенную С 3-группу,имеющую ADS от 1 до 8, от 2 до 8, от 3 до 7, от 4 до 7,5, от 4,3 до 7,5, примерно 1, примерно 2, примерно 2,5, примерно 3, примерно 3,5, примерно 4, примерно 4,3, примерно 5, примерно 5,5, примерно 6, примерно 6,5, примерно 7 или примерно 7,5. Примеры композиций циклодекстрина и способы их получения, которые подходят для применения в настоящем изобретении, также включают примеры и способы, описанные в патентах США 5134127, 5241059, 5376645, 5874418, 6046177, 6133248, 6153746, 6204256, 7034013, 7629331 и 7635773,публикации заявки на патент США 2009/0012042 и публикации международной заявки согласно РСТWO 2005/117911, содержание которых полностью включено в настоящее описание посредством ссылки. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II-7 022890 где R=(H)21-x или (-(CH2)4-SO3-Na+)x. В некоторых вариантах реализации х=6,0-7,1. В некоторых вариантах реализации производное циклодекстрина формулы II имеет среднюю молекулярную массу примерно 2163 г/моль. В некоторых вариантах реализации производное циклодекстрина представляет собой сульфобутилэфирциклодекстрин, имеющий ADS примерно 7 (например, Captisol, CyDex Pharmaceuticals, Inc.,Lenexa, KS). Циклодекстрин Captisol представляет собой полианионное производное -циклодекстрина с солью сульфоната натрия, отделенное от липофильной полости циклодекстрина спейсерной группой бутилового эфира или сульфобутиловым эфиром (SBE). Было показано, что циклодекстрин Captisol безопасен при введении парентеральным, пероральным или ингаляционным путем и не демонстрирует нейротоксичность, характерную для -циклодекстрина. В сравнении с -циклодекстрином сульфоалкилэфирный циклодекстрин Captisol обеспечивает сравнимые или более высокие характеристики комплексообразования и большую растворимость в воде, превосходящую 90 г на 100 мл, т.е. увеличение в 50 раз. Мелфалан имеет низкую связывающую способность по отношению к Captisol (Ka=3102 M-1). В некоторых вариантах реализации производное циклодекстрина включает заместитель, который содержит ионную группу, способную необязательно образовывать соль с фармацевтически приемлемым анионом или катионом. Фармацевтически приемлемые катионы, которые подходят для формирования солей с отрицательно заряженными производными циклодекстрина согласно настоящему изобретению,включают, без ограничения, Н+, Li+, Na+, K+, Mg2+, Ca2+, катионы аммония и амина в виде катионов(C1-C6)-алкиламинов, (C4-C8)-циклоалкиламинов (например, пиперидин, пиразин и подобные), (C1-C6)алканоламинов и (С 4-С 8)-циклоалканоламинов и подобных, а также их комбинации. В некоторых вариантах реализации фармацевтически приемлемый катион представляет собой Na+. Фармацевтически приемлемые анионы, которые подходят для образования солей с положительно заряженными производными циклодекстрина согласно настоящему изобретению, включают, без ограничения, галогениды (например,Cl- и подобные), анионы (C1-C6)-алкильных кислот (например, ацетат, оксалат, фумарат, сукцинат и подобные) и их комбинации. Фармацевтические композиции и единичные дозированные формы. Настоящее изобретение относится к фармацевтическим композициям и единичным дозированным формам, содержащим мелфалан и производное циклодекстрина. Фармацевтические композиции согласно настоящему изобретению подходят для парентерального введения субъекту. Парентеральное введение фармацевтических композиций может включать инъекцию, но не ограничивается ей. В связи с тем, что парентеральное введение блокирует естественные защитные реакции субъекта в отношении инородных материалов, фармацевтические композиции согласно настоящему изобретению являются стерильными или могут быть стерилизованы перед введением. Примеры фармацевтических композиций включают, без ограничения, растворы, суспензии или эмульсии, готовые для введения, растворы, суспензии или эмульсии, готовые для растворения в фармацевтически приемлемом носителе и/или разбавления фармацевтически приемлемым носителем, а также сухие продукты, готовые для растворения и/или разбавления фармацевтически приемлемым носителем. В целом, фармацевтические композиции согласно настоящему изобретению содержат мелфалан в концентрации, подходящей для лечения состояния, поддающегося лечению мелфаланом. Таким образом,фармацевтические композиции согласно настоящему изобретению могут быть использованы для приготовления единичной дозированной формы, содержащей терапевтически эффективное количество мелфалана для введения субъекту, нуждающемуся в этом. В некоторых вариантах реализации настоящее изобретение относится к единичной дозированной форме, содержащей мелфалан в концентрации, подходящей для введения без разбавления. В другом варианте единичная дозированная форма согласно настоящему изобретению может быть разбавлена перед введением нуждающемуся субъекту. Настоящее изобретение также относится к фармацевтической композиции, содержащей от 25 до 125 мг, от 25 до 100 мг, от 25 до 75 мг, от 25 до 50 мг, от 50 до 125 мг, от 50 до 100 мг, от 75 до 125 мг, от 100 до 125 мг, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг или примерно 125 мг мелфалана в виде гидрохлоридной соли, необязательный буфер и производное циклодекстрина формулы формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу C1-C8(алкилен)-SO3- с прямой или разветвленной цепью или C1-C6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С 1-С 8-(алкилен)-SO3- с прямой или разветвленной цепью; где разбавленная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6, от примерно 4 до примерно 5, от примерно 4,5 до примерно 6, от примерно 5 до примерно 6, от примерно 5,5 до примерно 6, примерно 4, примерно 4,5, примерно 5, примерно 5,5 или примерно 6; где разбавление фармацевтической композиции водным раствором позволяет получить раствор, в котором мелфалан разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% и менее при температуре примерно 25 С в течение 10 ч после разбавления; и где производное циклодекстрина находится в соотношении с мелфаланом, составляющем от 50:1 до 100:1, от 55:1 до 60:1,примерно 50:1, примерно 55:1 или примерно 60:1 (мас./мас.). Настоящее изобретение также относится к фармацевтической композиции, содержащей от 150 до 300 мг, от 150 до 250 мг, от 150 до 225 мг, от 175 до 250 мг, от 200 до 250 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 225 мг или примерно 250 мг мелфалана в виде гидрохлоридной соли,необязательный буфер и производное циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или группу C1-С 6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью; где разбавленная фармацевтическая композиция имеет значение рН от примерно 4 до примерно 6; где разбавление фармацевтической композиции водным раствором позволяет получить раствор мелфалана, в котором мелфалан разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% и менее при температуре примерно 25 С в течение 10 ч после разбавления; и где производное циклодекстрина находится в соотношении с мелфаланом, составляющем от 25:1 до 35:1 или примерно 27:1, примерно 30:1 или примерно 32:1 (мас./мас.). В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1; и фармацевтическая композиция содержит примерно 50 мг мелфалана в виде гидрохлоридной соли, а производное циклодекстрина находится в концентрации от 50:1 до 100:1, от 55:1 до 60:1, примерно 50:1,примерно 55:1 или примерно 60:1 (мас./мас.) относительно мелфалана; или фармацевтическая композиция содержит примерно 200 мг мелфалана в виде гидрохлоридной соли,а производное циклодекстрина находится в концентрации от 35:1 до 35:1 или примерно 27:1, примерно 30:1 или примерно 32:1 (мас./мас.) относительно мелфалана. Стерильные растворы, суспензии, эмульсии и подобные могут быть приготовлены путем включения мелфалана в подходящий растворитель или носитель с другими необязательными ингредиентами,перечисленными в настоящем описании с последующей стерилизацией. Стерильные порошки могут быть приготовлены путем распылительной сушки, стерильной распылительной сушки, вакуумной сушки или лиофильной сушки стерильного раствора, суспензии или эмульсии с получением высушенного твердого вещества (например, порошка), содержащего мелфалан, а также любые дополнительные наполнители. В некоторых вариантах реализации настоящее изобретение относится к твердой фармацевтической композиции, состоящей из примерно 50 мг мелфалана в виде гидрохлоридной соли, количества кислоты,основания или их комбинации, достаточного для того, чтобы обеспечить значение рН от примерно 4 до примерно 6 после разбавления физиологическим раствором до объема примерно 10 мл, и производное циклодекстрина формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x, и х=6,0-7,1, при этом разбавление твердой фармацевтической композиции водным раствором позволяет получить раствор мелфалана, в котором мелфалан разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления, и где производное циклодекстрина находится в соотношении с мелфаланом примерно 55:1 (мас./мас.). В некоторых вариантах реализации настоящее изобретение относится к твердой фармацевтической композиции, состоящей из примерно 200 мг мелфалана в виде гидрохлоридной соли, количества кислоты, основания или их комбинации, достаточного для того, чтобы обеспечить значение рН от примерно 4 до примерно 6 после разбавления физиологическим раствором до объема примерно 20 мл, и производное циклодекстрина формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1, при этом разбавление твердой фармацевтической композиции водным раствором позволяет получить раствор мелфалана, в котором мелфалан разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления, и где производное циклодекстрина находится в соотношении с мелфаланом, составляющем примерно 27:1, примерно 30:1 или примерно 32:1 (мас./мас.). В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит твердое вещество (например, порошок) или жидкий раствор, который разбавляют жидким носителем или разбавителем перед введением субъекту. Таким образом, фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению включают стерильные водные растворы, суспензии и дисперсии, а также стерильные твердые вещества (например, порошки), содержащие мелфалан, которые могут быть приготовлены для немедленного приема путем их разбавления или растворения для получения стерильного раствора, суспензии или дисперсии. В некоторых вариантах реализации композиции, составы и/или единичные дозированные формы согласно настоящему изобретению содержат фармацевтически приемлемый наполнитель. В настоящем описании термин "фармацевтически приемлемый" относится к тем наполнителям, соединениям, веществам и/или композициям, которые в рамках тщательной медицинской оценки являются пригодными для контактирования с тканями человека и животных без избыточного токсического действия, раздражения,аллергической реакции или других возможных осложнений в соответствии с приемлемым соотношением пользы и риска. В некоторых вариантах реализации фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению являются, по существу, однородными. В настоящем описании"однородный" относится к смесям, растворам, суспензиям, композициям, лекарственным формам и/или составам согласно настоящему изобретению, ингредиенты в которых распределены равномерно. Однородность синонимична равномерности и может относиться к однородности внутри образца, однородности от партии к партии (batch-to-batch), однородности run-to-run и/или однородности разных лекарственных форм. Например, однородность внутри образца может быть определена путем анализа первой пробы образца, смеси или композиции и сравнения ее со второй пробой того же образца, смеси или композиции. Стандартные отклонения для композиции, однородной, по существу, (например, варьирование процентного содержания по массе наполнителей и подобного) составляют примерно 5% или менее, примерно 3% или менее, примерно 2% или менее, примерно 1% или менее или в пределах погрешности эксперимента. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит фармацевтически приемлемый наполнитель. В настоящем описании термин "наполнитель" относится к любому инертному веществу, которое можно объединить с мелфаланом и сульфоалкильным эфиром циклодекстрина для получения фармацевтических композиций. Фармацевтически приемлемые наполнители, которые подходят для применения согласно настоящему изобретению, включают, без ограничения, носитель, водорастворимый полимер, консервант, антиоксидант, регулятор уровня рН (например, подкисляющий агент, подщелачивающий агент и/или буфер),объемообразующий агент, агент, усиливающий комплексообразование, криопротектор, модификатор плотности, электролит, корригент, отдушку, лиофилизирующее средство (например, объемообразующий агент или стабилизатор), пластификатор, агент, улучшающий растворимость, стабилизатор, подсластитель, регулятор поверхностного натяжения, регулятор летучести, регулятор вязкости и их комбинации. Кроме того, среднему специалисту известно, что фармацевтически приемлемые наполнители, пригодные для применения согласно настоящему изобретению, также включают перечисленные в руководстве TheHandbook of Pharmaceutical Excipients, 5 th Ed., The Pharmaceutical Press and American Pharmacists Association, London, UK and Washington, DC (2006), полностью включенном в настоящее описание посредством ссылки. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма содержит фармацевтически приемлемый носитель. В настоящем описании "носитель" относится к носителю, который подходит для переноса и/или разбавления фармацевтической композиции или единичной лекарственной формы согласно настоящему изобретению. Фармацевтически приемлемые носители для применения согласно настоящему изобретению включают, без ограничения, жидкие вещества,твердые вещества, коллоиды, гели и их комбинации. Жидкие носители, пригодные для применения согласно настоящему изобретению, включают растворители, жидкие диспергенты и подобные, например,без ограничения, вода, этанол, многоатомный спирт (например, глицерол, пропиленгликоль, жидкие полиэтиленгликоли и подобные), растительное масло, нетоксичный эфир глицерина и их комбинации. В некоторых вариантах реализации жидкий носитель выбран из раствора декстрозы, физиологического раствора, плазмы и раствора Рингера с лактатом. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма содержит водорастворимый полимер, такой как, без ограничения, гомополимеры Nполивинилпирролидона (например, "повидон"), гидроксипропилцеллюлоза с низкой молекулярной массой, метилцеллюлоза с низкой молекулярной массой, гидроксипропилметилцеллюлоза с низкой молекулярной массой и подобные, и их комбинации. В некоторых вариантах реализации концентрация производного циклодекстрина в разбавленной фармацевтической композиции после разбавления составляет примерно 75, примерно 100 или примерно 125 мМ. В некоторых вариантах реализации концентрация мелфалана в разбавленной фармацевтической композиции после разбавления составляет от 0,1 до 50 мг/мл, от 0,15 до 40 мг/мл, от 0,2 до 30 мг/мл, от 0,3 до 25 мг/мл, от 0,4 до 20 мг/мл, от 0,45 до 15 мг/мл, от 0,5 до 10 мг/мл, примерно 0,45 мг/мл, примерно 1 мг/мл, примерно 1,5 мг/мл, примерно 2 мг/мл, примерно 2,5 мг/мл или примерно 5 мг/мл. В некоторых вариантах реализации фармацевтическая композиция и/или разбавитель для применения согласно настоящему изобретению не содержит солюбилизирующий агент, такой как, без ограничения, вода, спирт (например, этанол и подобные), многоатомный спирт (например, глицерол, пропиленгликоль, жидкие полиэтиленгликоли и подобные), растительное масло, нетоксичный эфир глицерина и их комбинации. Таким образом, в некоторых вариантах реализации разбавитель в целом состоит из воды и необязательных веществ, регулирующих тоничность (например, 0,9% физиологический раствор для инъекций и подобные). В некоторых вариантах реализации рН фармацевтической композиции или единичной дозированной формы контролируется. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит фармацевтически приемлемый буфер и/или регулятор уровня рН (например, подкисляющий агент и/или подщелачивающий агент). В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению имеет значение рН от примерно 4 до примерно 6, от примерно 4 до примерно 5, от примерно 5 до примерно 6, примерно 4, примерно 5, примерно 5,5 или примерно 6 после разбавления водным разбавителем. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению, которую разбавляют перед введением субъекту, имеет значение рН от примерно 2 до примерно 6, от примерно 3 до примерно 6, от примерно 4 до примерно 6 или от примерно 5 до примерно 6. В некоторых вариантах реализации после разбавления (например, жидким носителем) единичная дозированная форма согласно настоящему изобретению имеет значение рН от примерно 4 до примерно 6, от примерно 4 до примерно 5, от примерно 5 до примерно 6, примерно 4,примерно 4,5, примерно 5, примерно 5,5 или примерно 6 во время введения нуждающемуся субъекту. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит буфер. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит буфер, подходящий для получения разбавленной фармацевтической композиции, имеющей значение рН от примерно 4 до примерно 6, от примерно 4 до примерно 5, от примерно 5 до примерно 6, примерно 4, примерно 4,5, примерно 5, примерно 5,5 или примерно 6. В некоторых вариантах реализации концентрация буфера составляет от примерно 0,01 до примерно 10 М, от примерно 0,01 до примерно 5 М или от примерно 0,01 до примерно 1 М. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит регулятор уровня рН, такой как, без ограничения,подкисливающий агент (например, лимонная кислота, HCl и подобные), подщелачивающий агент (например, NaOH и подобные), соль кислоты (например, цитрат натрия и подобные) и их комбинации. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит регулятор уровня рН в количестве, достаточном для получения разбавленной фармацевтической композиции, имеющей значение рН от примерно 4 до примерно 6, от примерно 4 до примерно 5, от примерно 5 до примерно 6, примерно 4, примерно 4,5, примерно 5,примерно 5,5 или примерно 6. В некоторых вариантах реализации фармацевтическая композиция или единичая дозированная форма согласно настоящему изобретению содержит цитрат натрия в количестве от 50 до 500 мг, от 75 до 400 мг, от 100 до 300 мг, от 150 до 250 мг или примерно 200 мг. В некоторых вариантах реализации фармацевтическая композиция или единичная дозированная форма согласно настоящему изобретению содержит второй терапевтический агент. Приемлемые вторые терапевтические агенты включают, без ограничения, соединение платины, антиметаболит, нитрозомочевину, кортекостероид, ингибитор кальциневрина, моноклональное антитело, поликлональное антитело,цитотоксический антибиотик, интерферон, опиоид, антигистамин, плазмозамещающее средство, агент,повышающий кровяное давление, и их комбинации. Дополнительные вторые терапевтические агенты включают, без ограничения, доксорубицин, бортезомиб, ритуксимаб, талидомид, леналидомид, гемцитабин, тиотепа, флударабин, кармустин, этопозид, цитарабин, колониестимулирующий фактор гранулоцитов, ADH-1, топотекан, палифермин, преднизон, триоксид мышьяка, аскорбиновую кислоту, бусульфан,бутионин сульфоксимин и их комбинации. В настоящем описании "единичная дозированная форма" относится к композиции, содержащей определенное количество мелфалана, которое полностью предназначено для введения субъекту в одной дозе. Единичная дозированная форма может быть выделена из многодозового количества фармацевтической композиции, например бутылки лекарственного средства, из которой отмеряется доза для однократного введения. В некоторых вариантах реализации единичная дозированная форма согласно настоящему изобретению содержит терапевтически эффективное количество мелфалана. В настоящем описании "терапевтически эффективное количество" относится к количеству мелфалана, которое вызывает биологический или лекарственный ответ в ткани, системе, животном или человеке, которого добивается исследователь,ветеринар, врач или другой клиницист, причем указанный ответ включает облегчение симптомов заболевания или расстройства, которое лечат. Единичная дозированная форма обычно содержит фармацевтическую композицию согласно настоящему изобретению и необязательно один или несколько фармацевтически приемлемых наполнителей, причем количество мелфалана, содержащегося в единичной дозированной форме, достаточно для однократного введения субъекту, нуждающемуся в этом. Единичные дозированные формы согласно настоящему изобретению включают, без ограничения, жидкие растворы, жидкие суспензии, жидкие дисперсии, эмульсии, гели, порошки, таблетки, капсулы, таблетки в форме капсулы и подобные. Лечение заболевания или патологического состояния, поддающегося лечению мелфаланом, может включать периодическое введение единичной лекарственной формы согласно настоящему изобретению, например,один раз в две недели, один раз в четыре недели или с другим интервалом. В некоторых вариантах реализации лекарственная форма для однократного введения согласно настоящему изобретению содержит от 25 до 125 мг или от 150 до 250 мг мелфалана в виде гидрохлоридной соли. В некоторых вариантах реализации лекарственная форма для однократного введения согласно на- 12022890 стоящему изобретению содержит 50 или 200 мг мелфалана в виде гидрохлоридной соли. В некоторых вариантах реализации единичная дозированная форма согласно настоящему изобретению представляет собой твердое вещество. В некоторых вариантах реализации единичная дозированная форма согласно настоящему изобретению представляет собой лиофилизированное твердое вещество или асептическое твердое вещество, высушенное распылением. В некоторых вариантах реализации единичная дозированная форма согласно настоящему изобретению подходит для разбавления и/или восстановления (reconstitution) заранее определенным количеством жидкого носителя. Например, единичная лекарственная форма (например, жидкое или твердое вещество) согласно настоящему изобретению может быть разбавлена жидким носителем в объеме от 5 до 500 мл, от 10 до 100 мл или от 10 до 50 мл. Фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению являются стабильными. В настоящем описании стабильность может относиться либо к сроку годности неразбавленной твердой или жидкой лекарственной формы, либо к устойчивости к разложению разбавленной жидкой лекарственной формы. В частности, доступные в настоящее время композиции мелфалана, подходящие для внутривенного введения, должны быть использованы в максимально краткий срок после разбавления ввиду быстрого разложения мелфалана в водном растворе. Тем не менее, лекарственные формы согласно настоящему изобретению сохраняют стабильность в течение значительного периода времени после разбавления, например, от по меньшей мере 90 мин до по меньшей мере 48 ч и более. Таким образом, в вариантах реализации, где твердая или жидкая единичная дозированная форма согласно настоящему изобретению разбавляется, разбавление можно осуществить непосредственно перед введением или за некоторое время до него без существенных потерь терапевтической эффективности. Это позволяет осуществлять разбавление жидкой фармацевтической композиции или жидкой единичной дозированной формы согласно настоящему изобретению за период от 90 мин до 48 ч до применения (т.е. перед парентеральным введением субъекту, нуждающемуся в этом). В некоторых вариантах реализации мелфалан в фармацевтической композиции согласно настоящему изобретению разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч или на 4% или менее при температуре примерно 25 С в течение 10 ч после разбавления водным разбавителем с получением разбавленной композиции, содержащей производное циклодекстрина в концентрации примерно 75 или примерно 125 мМ. Первичным продуктом разложения мелфалана в водном растворе является моногидроксид мелфалана (также известный как моногидроксимелфалан), причем реакция протекает в виде гидролиза; см.,например, S.A. Stout et al., Int. J. Pharm. 24:193 (1985). В некоторых вариантах реализации разбавление фармацевтической композиции согласно настоящему изобретению позволяет получить моногидроксид мелфалана в концентрации (на основании 100% первоначальной концентрации мелфалана) 2% или менее в течение 5 ч после разбавления, когда разбавленную композицию хранят при комнатной температуре(примерно 25 С). В некоторых вариантах реализации разбавление фармацевтической композиции согласно настоящему изобретению позволяет получить моногидроксид мелфалана в концентрации (на основании 100% первоначальной концентрации мелфалана) 4% или менее в течение 10 ч после разбавления, когда разбавленную композицию хранят при комнатной температуре (примерно 25 С). В некоторых вариантах реализации разбавление фармацевтической композиции согласно настоящему изобретению позволяет получить моногидроксид мелфалана в концентрации (на основании 100% первоначальной концентрации мелфалана) 2% или менее в течение 24 ч после разбавления или 4% или менее в течение 48 ч после разбавления, когда разбавленную композицию хранят при температуре примерно 10 С или менее. Кроме того, фармацевтические композиции согласно настоящему изобретению могут храниться длительное время перед разбавлением без существенной потери мелфалана. Например, твердая фармацевтическая композиция, содержащая мелфалан и производное циклодекстрина, содержит 2% или менее по массе мелфалана, разложившегося после хранения при 25 С в течение периода по меньшей мере 2 лет, или 5% или менее по массе мелфалана, разложившегося после хранения при 25 С в течение периода по меньшей мере 3 лет. В некоторых вариантах реализации фармацевтическая композиция в виде сухого порошка согласно настоящему изобретению образует 2% или менее моногидроксида мелфалана (на основании 100% первоначальной концентрации мелфалана) после хранения в течение 2 лет при комнатной температуре. Фармацевтические наборы. Настоящее изобретение также относится к фармацевтическому набору, содержащему первую емкость, содержащую от 25 до 125 мг мелфалана в виде гидрохлоридной соли и необязательный водорастворимый полимер, и вторую емкость, содержащую водный разбавитель, необязательный буфер и производное циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой группу -Н, С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или C1-C6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой группу С 1-С 8-(алкилен)-SO3- с прямой или разветвленной цепью; где производное циклодекстрина находится во втором контейнере в концентрации по меньшей мере 50:1 (мас./мас.) относительно мелфалана; и при этом объединение содержимого первой и второй емкостей позволяет получить разбавленную фармацевтическую композицию, имеющую значение рН от примерно 4 до примерно 6, которая разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч после разбавления. Настоящее изобретение также относится к фармацевтическому набору, содержащему первую емкость, содержащую от 150 до 250 мг мелфалана в виде гидрохлоридной соли и необязательный водорастворимый полимер; и вторую емкость, содержащую водный разбавитель, необязательный буфер и производное циклодекстрина формулы I где n равен 5; где R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо представляют собой -Н, группу С 1-С 8(алкилен)-SO3- с прямой или разветвленной цепью или C1-C6 с прямой или разветвленной цепью; где по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 представляет собой С 1-С 8-(алкилен)-SO3- группу с прямой или разветвленной цепью; где производное циклодекстрина находится во втором контейнере в концентрации от 25:1 до 35:1 (мас./мас.) относительно мелфалана; и где объединение содержимого первой и второй емкостей позволяет получить разбавленную фармацевтическую композицию, имеющую значение рН от примерно 4 до примерно 6, которая разлагается на 2% или менее при температуре примерно 25 С в течение 5 ч после разбавления. В другом варианте первая емкость содержит мелфалан (в количестве, описанном выше) и производное циклодекстрина (как описано выше), необязательный водорастворимый полимер (например, повидон и подобные) и необязательный регулятор уровня рН; а вторая емкость содержит растворитель (например, воду, физиологический раствор и подобные), необязательный регулятор тоничности и необязательный регулятор уровня рН. Материалы, подходящие для применения в качестве емкостей с наборами согласно настоящему изобретению, включают, без ограничения, стекло (например, боросиликатное стекло, янтарное стекло и подобные), пластик (например, полипропилен, полиэтилен высокой плотности, полиэтилентерефталат,полистирол, поликарбонат и подобные, а также их комбинации), металл (например, фольгу) и подобные,а также их комбинации (например, стекло и/или металл, покрытые пластиком). Емкости, подходящие для применения с наборами согласно настоящему изобретению, включают,без ограничения, флаконы, бутылки, порционные пакеты и подобные. Емкости могут быть открывающимися и/или содержимое может быть извлечено из них посредством, например, разрывания, отрезания,отвинчивания винтовой крышки, удаления пробки, прокалывания, выдавливания и подобного, а также комбинациями указанных действий. В некоторых вариантах реализации первая емкость содержит повидон в количестве от 10 до 30 мг,от 15 до 25 мг или примерно 20 мг. В некоторых вариантах реализации вторая емкость содержит регулятор уровня рН (например, подкисляющий агент, подщелачивающий агент и/или буфер) в концентрации,достаточной для обеспечения уровня рН от примерно 4 до примерно 6 при совмещении содержимого первой и второй емкостей. В некоторых вариантах реализации вторая емкость содержит цитрат натрия в количестве от 50 до 500 мг, от 75 до 400 мг, от 100 до 300 мг, от 150 до 250 мг или примерно 200 мг. В некоторых вариантах реализации производное циклодекстрина представляет собой соединение формулы II где R=(H)21-x или (-(CH2)4-SO3-Na+)x и х=6,0-7,1; где первая емкость содержит примерно 200 мг мелфалана в виде гидрохлоридной соли и где производное циклодекстрина во второй емкости находится в соотношении с мелфаланом, составляющем примерно 27:1, примерно 30:1 или примерно 32:1 (мас./мас.). Способы введения и лечения. В некоторых вариантах реализации настоящее изобретение относится к способам доставки мелфалана субъекту, нуждающемуся в этом, причем указанный способ включает введение фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению субъекту, нуждающемуся в этом. Способы согласно настоящему изобретению включают парентеральное введение фармацевтических композиций или единичных дозированных форм согласно настоящему изобретению. В некоторых вариантах реализации фармацевтические композиции или единичные дозированные формы (или их разбавленные формы) вводят внутривенно. Внутривенное введение включает, без ограничения, внутривенное струйное введение, внутривенное вливание, перфузию конечностей, нормотермическую изолированную перфузию конечностей, чрескожное печеночное вливание и подобные, а также их комбинации. Введение композиций согласно настоящему изобретению также может быть осуществлено посредством инъекции и/или капельного введения с применением катетера, центрального катетера,периферически вводимого центрального катетера и подобных. В некоторых вариантах реализации фармацевтическую композицию согласно настоящему изобретению вводят путем инфузии в течение периода от 15 мин до 6 ч, от 30 мин до 4 ч, от 45 мин до 3 ч, от 1 до 2 ч, примерно 15, примерно 30, примерно 45 мин, примерно 1, примерно 1,5, примерно 2, примерно 2,5, примерно 3, примерно 4, примерно 5 или примерно 6 ч. В некоторых вариантах реализации настоящее изобретение относится к парентеральному введению фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению субъекту, для которого пероральная композиция мелфалана непригодна по одной или более причинам. Например, пероральные композиции мелфалана могут быть непригодны в случае, если субъект слишком молод, не может глотать, перенес хирургическое вмешательство, недееспособен или страдает расстройством, которое блокирует всасывание мелфалана, вводимого пероральным путем. Кроме того, парентеральное введение фармацевтических композиций согласно настоящему изобретению подходит для лечения патологических состояний у субъекта, которому требуется быстрое повышение концентрации мелфалана in vivo. В некоторых вариантах реализации настоящее изобретение относится к лечению и/или предотвращению заболеваний у человека путем введения фармацевтических композиций и/или единичных дозированных форм согласно настоящему изобретению. В некоторых вариантах реализации настоящее изобретение относится к способам лечения субъекта, страдающего заболеванием или расстройством, поддающимся лечению мелфаланом, причем указанный способ включает введение субъекту фармацевтической композиции или единичной дозированной формы. В настоящем описании термины "лечить" и "лечение" относятся к введению композиции согласно настоящему изобретению до появления клинических симптомов заболевания/патологического состояния с целью предотвращения развития любого из таких симптомов, а также введения композиции после появления одного или более клинических симптомов заболевания/патологического состояния с целью ослабления или устранения любого из таких симптомов,аспектов или характеристик указанного заболевания/патологического состояния. Такое лечение не обязательно должно быть полным для достижения полезного эффекта. Кроме того, термины "лечить" и"лечение" относятся как к терапевтическому лечению, так и к профилактике, уходу или превентивным мерам, когда целью является предотвращение или замедление развития (облегчение) нежелательного физиологического состояния, расстройства или заболевания, или достижение полезных или желаемых клинических эффектов. В контексте настоящего изобретения полезные или желаемые клинические эффекты включают, без ограничения, частичное снятие симптома или признака; уменьшение степени патологического состояния, расстройства или заболевания; стабилизацию (т.е. отсутствие ухудшения) патологического состояния, расстройства или заболевания; задержку появления или замедление развития патологического состояния, расстройства или заболевания; улучшение состояния при патологическом состоянии, расстройстве или заболевании, ремиссию (частичную или полную), поддающуюся или не расстройстве или заболевании, ремиссию (частичную или полную), поддающуюся или не поддающуюся обнаружению, или положительную динамику патологического состояния, расстройства или заболевания. Лечение включает вызывание клинически значимого ответа без повышенных показателей побочных эффектов. Лечение также включает увеличение продолжительности жизни по сравнению с ожидаемой в случае отсутствия лечения. В настоящем описании термин "субъект" относится к теплокровным животным, таким как млекопитающие, включающим человека и животных, таких как, без ограничения, домашние и сельскохозяйственные животные, животные в зоопарках, животные, используемые в спорте, а также домашние питомцы(например, кошки, собаки, мыши, морские свинки, лошади, коровы и овцы). В некоторых вариантах реализации субъект является человеком. Субъекты, которым подходит введение фармацевтических композиций и единичных дозированных форм согласно настоящему изобретению, включают, без ограничения,пациентов детского возраста, взрослых пациентов и пациентов преклонного возраста. В некоторых вариантах реализации настоящего изобретения субъект является пациентом детского возраста. Например,согласно Управлению по контролю за продуктами и лекарствами США пациент "детского возраста" находится в возрасте до 21 года и включает новорожденных (от рождения до примерно 1 месяца), младенцев (от примерно 1 месяца до примерно 2 лет), детей (от примерно 2 до примерно 12 лет) и подростковDevices and Radiological Health, and Center for Biologics Evaluation and Research (May 14, 2004). В некоторых вариантах реализации настоящего изобретения субъект является взрослым пациентом. В настоящем описании "взрослый" пациент находится в возрасте от 18 лет. В некоторых вариантах реализации субъект находится в возрасте около 50 лет или старше. В некоторых вариантах реализации субъект является пациентом преклонного возраста. Пациенты преклонного возраста находятся в возрасте по меньшей мере около 65 лет. В некоторых вариантах реализации субъект находится в возрасте около 70 лет или старше. В некоторых вариантах реализации субъект является пациентом детского возраста, страдающим таким расстройством, как, без ограничения, врожденный дефект, иммунодефицит, комбинированный иммунодефицит, тяжелый комбинированный иммунодефицит, генетический агранулоцитоз с дефектом стволовых клеток, апластическая анемия и их комбинации. В некоторых вариантах реализации субъект является пациентом преклонного возраста, которому назначено проведение немиелоаблятивной процедуры. В некоторых вариантах реализации настоящее изобретение включает способ лечения субъекта,страдающего или находящегося под риском развития патологического состояния, поддающегося лечению мелфаланом, причем указанный способ включат введение субъекту эффективного количества (т.е. терапевтически эффективного количества) композиции согласно настоящему изобретению. Патологические состояния, поддающиеся лечению мелфаланом, включают, без ограничения, опухолевые заболевания. В некоторых вариантах реализации терапевтически эффективное количество мелфалана для введения субъекту, страдающему или находящемуся под риском развития патологического состояния, поддающегося лечению мелфаланом, составляет от 25 до 125 мг, от 40 до 110 мг, от 40 до 75 мг, от 40 до 60 мг, примерно 40 мг, примерно 50 мг, примерно 60 мг, примерно 75 мг или примерно 100 мг мелфалана в виде гидрохлоридной соли. Способы согласно настоящему изобретению также включают повышение или снижение дозы мелфалана относительно первоначальной дозы для обеспечения терапевтически эффективной дозы мелфалана. Терапевтически эффективная доза может вводиться один, два, три, четыре,пять, шесть, семь, восемь, десять, двенадцать или более раз по мере необходимости. В некоторых вариантах реализации настоящее изобретение относится к способу лечения заболевания, расстройства или патологического состояния, которое является терапевтически восприимчивым к трансплантации стволовых клеток, причем указанный способ включает введение субъекту, нуждающемуся в этом, фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению и последующее проведение трансплантации стволовых клеток указанному субъекту. В некоторых вариантах реализации способ согласно настоящему изобретению включает введение фармацевтической композиции или единичной дозированной формы (или ее разбавленной формы) субъекту, страдающему расстройством, выбранным из миеломы, множественной миеломы, острого миелоидного лейкоза, злокачественной меланомы, метастатической меланомы (например, метастатической меланомы глаза, метастатической меланомы кожи и подобных), рака молочной железы, рака яичников, рака яичка, распространенного рака предстательной железы, миелодиспластического синдрома, нейроэндокринного рака (например, метастатической нейроэндокринной опухоли и подобных), метастатической аденокарциномы, гепатоклеточной карциномы, остеогенной саркомы, истинной полицитемии плазмы крови, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций. В некоторых вариантах реализации способ согласно настоящему изобретению включает введение фармацевтической композиции или единичной дозированной формы (или ее разбавленной формы) субъекту, которому показана трансплантация стволовых клеток (например, трансплантация гемопоэтических стволовых клеток). В некоторых вариантах реализации субъект, которому показана трансплантация стволовых клеток, страдает заболеванием или расстройством, выбранным из лейкемии, рака, незлокачественного заболевания и их комбинаций. В некоторых вариантах реализации субъект, которому показана трансплантация стволовых клеток, страдает заболеванием или расстройством, выбранным из миеломы,множественной миеломы, лимфомы, неходжкинской лимфомы ("NHL"), лейкемии, острого миелоидного лейкоза ("AML"), болезни Ходжкина, острого лимфобластного лейкоза ("ALL"), миелодиспластического синдрома ("MDS"), миелопролиферативного расстройства ("MPD"), хронического миелолейкоза("CML"), нейробластомы, апластической анемии, хронического гранулоцитарного лейкоза, нейробластомы, серповидно-клеточного заболевания, остеогенной саркомы, саркомы Эвинга, десмопластической мелкокруглоклеточной опухоли, плазмацитарной неоплазии, амилоидоза, склеромикседемы и их комбинаций. В некоторых вариантах реализации субъект, которому показана трансплантация стволовых клеток, представляет собой субъект, которому не принесет пользу длительное лечение при помощи хемотерапии, или который уже является резистентным к ней. Таким образом, фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению могут быть использованы для лечения патологического состояния, поддающегося лечению мелфаланам, а также для подготовки субъекта, нуждающегося в этом, к трансплантации стволовых клеток. Количество вводимой фармацевтической композиции является терапевтически эффективным для требуемого лечения. Например, терапевтически эффективное количество для лечения множественной миеломы относится к количеству, которое при введении уменьшает выраженность одного или более симптомов, присущих данному заболеванию. В некоторых вариантах реализации настоящее изобретение относится к способу подготовки субъекта для проведения трансплантации стволовых клеток, причем указанный способ включает введение субъекту эффективного количества фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению (например, внутривенно). Таким образом, фармацевтические композиции или единичные дозированные формы согласно настоящему изобретению могут быть использованы для лечения субъекта, страдающего патологическим состоянием, поддающимся лечению трансплантацией стволовых клеток. В настоящем описании "трансплантация стволовых клеток" включает процедуры аутотрансплантации и/или аллотрансплантации. Фармацевтические композиции согласно настоящему изобретению могут быть использованы для введения мелфалана в режиме "высокой интенсивности", или режиме миелоаблятивной подготовки к трансплантации стволовых клеток, или в режиме подготовки к трансплантации стволовых клеток "пониженной интенсивности". В настоящем описании "пониженная интенсивность" относится к дозировкам, в которых дозу мелфалана, составляющую менее 150 мг/м 2, вводят субъекту в форме любой одной дозы. В некоторых вариантах реализации фармацевтическую композицию согласно настоящему изобретению вводят субъекту в возрасте 50 лет и старше, страдающему патологическим состоянием, поддающимся лечению трансплантацией стволовых клеток. В некоторых вариантах реализации мелфалан вводят субъекту, нуждающемуся в трансплантации стволовых клеток, в дозировке от 50 до 300 мг/м 2, от 50 до 250 мг/м 2, от 50 до 225 мг/м 2, от 50 до 200 мг/м 2, от 50 до 175 мг/м 2, от 50 до 150 мг/м 2, от 100 до 300 мг/м 2, от 100 до 250 мг/м 2, от 100 до 225 мг/м 2,от 100 до 200 мг/м 2, от 100 до 175 мг/м 2, от 100 до 150 мг/м 2, от 125 до 300 мг/м 2, от 125 до 250 мг/м 2, от 125 до 225 мг/м 2, от 125 до 200 мг/м 2, от 150 до 300 мг/м 2, от 150 до 250 мг/м 2, от 200 до 300 мг/м 2, от 200 до 250 мг/м 2, примерно 50 мг/м 2, примерно 100 мг/м 2, примерно 125 мг/м 2, примерно 150 мг/м 2, примерно 175 мг/м 2, примерно 200 мг/м 2, примерно 250 или примерно 300 мг/м 2. В некоторых вариантах реализации введение включает дозу, вводимую с интервалами в четыре недели. В некоторых вариантах реализации дозу вводят два, три, четыре, пять, шесть, восемь или десять раз. Например, в некоторых вариантах реализации дозу примерно 100 мг/м вводят три раза с интервалом между дозами четыре недели. В некоторых вариантах реализации дозу примерно 200 мг/м 2 вводят два раза с интервалом между дозами четыре недели. После конечной дозы может быть проведена трансплантация стволовых клеток. Фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению могут быть введены отдельно или совместно с другими лекарственными средствами или фармацевтическими композициями. В некоторых вариантах реализации способ согласно настоящему изобретению включает введение субъекту второго терапевтического агента, выбранного из алкилирующего агента отличного от мелфалана, соединения платины, антиметаболита, нитрозомочевины, кортикостероида,ингибитора кальциневрина, интерферона, опиоида, антигистамина, плазмозамещающего средства, агента, повышающего кровяное давление, и их комбинаций. Дополнительные вторые терапевтические агенты включают, без ограничения, цисплатин, карбоплатин, доксорубицин, бортезомиб, ритуксимаб, талидомид, леналидомид, гемцитабин, тиотепу, флударабин, кармустин, этопозид, цитарабин, колониестимулирующий фактор гранулоцитов (G-CSF), ADH-1, топотекан, палифермин, преднизон, триоксид мышьяка,аскорбиновую кислоту, бусульфан, циклофосфамид, N,N',N-триэтилентиофосфорамид, бутионин сульфоксимин и их комбинации. Второй терапевтический агент может быть введен субъекту либо в фарма- 17022890 цевтической композиции или единичной дозированной форме согласно настоящему изобретению, которая включает по меньшей мере один дополнительный терапевтический агент (в дополнение к мелфалану), либо в форме отдельной фармацевтической композиции или единичной дозированной формы. В некоторых вариантах реализации фармацевтические композиции и/или единичные дозированные формы согласно настоящему изобретению вводят с другими комбинациями терапевтически активных агентов, таких как, без ограничения, кармустин, этопозид и цитарабин; бусульфан и тиотепа; доксорубицин и бортезомиб; триоксид мышьяка и лимонная кислота; талидомид и ритуксимаб; талидомид и преднизон; а также бусульфан, флударабин и G-CSF. В некоторых вариантах реализации фармацевтические композиции и единичные дозированные формы согласно настоящему изобретению могут увеличивать биодоступность, скорость начала терапевтического действия и/или терапевтическую эффективность мелфалана. Таким образом, настоящее изобретение также относится к способу уменьшения времени до начала терапевтического действия мелфалана после его введения, причем указанный способ включает пероральное или парентеральное введение субъекту, нуждающемуся в этом, фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению, где время до начала терапевтического действия мелфалана, обеспечиваемого фармацевтической композицией или единичной дозированной формой, введенной пероральным или парентеральным путем, меньше, чем время до начала терапевтического действия мелфалана,обеспечиваемого сходной композицией, не содержащей производного циклодекстрина и содержащей эквивалентную дозу мелфалана, введенной пероральным путем. В некоторых вариантах реализации время до начала терапевтического действия мелфалана после введения фармацевтической композиции или единичной дозированной формы согласно настоящему изобретению уменьшается по меньшей мере на 5%, по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% по сравнению со временем до начала терапевтического действия мелфалана, обеспечиваемого сходной композицией, не содержащей производного циклодекстрина, и содержащей эквивалентную дозу мелфалана, введенной внутривенно. В некоторых вариантах реализации растворение мелфалана из лекарственных форм согласно настоящему изобретению может быть связано с фармакокинетическими параметрами и/или концентрацией мелфалана и/или его метаболита (-ов) in vivo. Концентрация мелфалана и/или его метаболита (-ов) invivo, как и фармакокинетические параметры, присущие активной форме мелфалана, могут быть определены, например, путем взятия образца плазмы крови субъекта после введения композиции согласно настоящему изобретению. Измеримые фармакокинетические параметры включают, без ограничения, AUC0t, AUCt-, AUC0- и ln(AUCLAST). В настоящем описании "AUC0-t" относится к площади под кривой концентрация-время (например,график соотношения концентрации в плазме ко времени) после введения мелфалана. Площадь обычно определяют методом трапеций: точки на графике соединяют прямыми линиями, проводят перпендикуляры от оси абсцисс к каждой точке на графике, а затем вычисляют сумму площадей треугольников и трапеций, полученных таким образом. В настоящем описании "AUCt-" относится к площади под кривой концентрация-время, где последнюю концентрацию экстраполировали до базовой линии на основании константы скорости выведения. В настоящем описании "AUC0-" относится к сумме площадей под фармакокинетическими кривыми концентрация-время в пределах длительности наблюдения для AUC0-t и AUCt-. В настоящем описании "ln(AUCLAST)" относится к площади под кривой концентрация-время, построенной путем размещения концентрации в плазме на натуральной логарифмической шкале, причем в качестве конечной точки используется последняя измеренная концентрация в плазме. В настоящем описании "IntraCV" относится к среднестатистической погрешности метода, которая представляет собой стандартное отклонение в пределах выборочной совокупности, разделенное на среднее значение выборочной совокупности, причем результат деления указывается в процентах. В некоторых вариантах реализации биодоступность мелфалана из композиции согласно настоящему изобретению у человека значительно выше, чем наблюдаемая после введения эквивалентной дозы мелфалана из композиции, не содержащей производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. Например, лекарственные формы согласно настоящему изобретению могут иметь AUC0-t или AUC0- по меньшей мере на 20% или выше, по меньшей мере на 25% или более, по меньшей мере на 30% или более, по меньшей мере на 40% или более, по меньшей мере на 50% или более, по меньшей мере на 60% или более или по меньшей мере на 70% или более, превышающие AUC0-t или AUC0-, наблюдаемые после введения субъекту состава мелфалана, содержащего такое же количество мелфалана и не содержащего производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций(Bioniche Pharma, США. В некоторых вариантах реализации биодоступность мелфалана из композиции согласно настоящему изобретению выше, чем наблюдаемая после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. Например, лекарственные формы согласно настоящему изобретению могут иметь AUC0-t или AUC0- по меньшей мере на 20% или более, по меньшей мере на 25% или более, по меньшей мере на 30% или более, по меньшей мере на 40% или более, по меньшей мере на 50% или более, по меньшей мере на 60% или более или по меньшей мере на 70% или более превышают AUC0-t или AUC0-, наблюдаемые после введения субъекту состава мелфалана, содержащего такое же количество мелфалана и не содержащего производного циклодекстрина (например,Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации значение AUC0-t или AUC0- мелфалана из композиции согласно настоящему изобретению на 20-70%, 20-60%, 20-50%, 30-70%, 30-60%, 30-50%, 40-70%, 40-60% или 5070% превышают AUC0-t или AUC0-, наблюдаемые после введения субъекту эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций(GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации максимальная концентрация мелфалана в плазме (Cmax) из композиции согласно настоящему изобретению по меньшей мере на 20% или более, по меньшей мере на 25% или более, по меньшей мере на 30% или более, по меньшей мере на 40% или более, по меньшей мере на 50% или более, по меньшей мере на 60% или более или по меньшей мере на 70% или более превышает Cmax, наблюдаемую после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации максимальная концентрация мелфалана в плазме (Cmax) из композиции согласно настоящему изобретению на 20-70%, 20-60%, 20-50%,30-70%, 30-60%, 30-50%, 40-70%, 40-60% или 50-70% превышает Cmax, наблюдаемую после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например,Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации скорость начала терапевтического действия мелфалана из композиции согласно настоящему изобретению выше, чем наблюдаемая после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций(GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. Например, лекарственные формы согласно настоящему изобретению имеют значение времени до наступления Cmax (т.е. tmax) примерно на 5%, примерно на 10%, примерно на 15%, примерно на 20%, примерно на 25% или примерно на 30% или примерно на 35% меньше, чем tmax, наблюдаемое после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации лекарственные формы согласно настоящему изобретению имеют значение времени до наступленияCmax (т.е. tmax) примерно на 5-35%, 5-30%, 5-25%, 5-20%, 10-35%, 15-35%, 20-35% или 25-30% меньше,чем tmax, наблюдаемое после введения эквивалентной дозы мелфалана из состава, не содержащего производного циклодекстрина (например, Alkeran для инъекций (GlaxoSmithKline) или Мелфалан HCl для инъекций (Bioniche Pharma, США. В некоторых вариантах реализации фармацевтические композиции согласно настоящему изобретению обеспечивают пониженный уровень гиперчувствительности у пациентов после парентерального введения по сравнению с пациентами, которым ввели аналогичную дозу мелфалана без производного циклодекстрина. В некоторых вариантах реализации фармацевтические композиции согласно настоящему изобретению позволяют снизить уровень тяжелой миелотоксичности у пациентов (например, у пациентов с уровнем лейкоцитов 1000 на мл и/или с уровнем тромбоцитов 25000) после парентерального введения по сравнению с пациентами, которым ввели аналогичную дозу мелфалана без производного циклодекстрина. В некоторых вариантах реализации фармацевтические композиции согласно настоящему изобретению позволяют снизить уровень смертности среди пациентов после парентерального введения по сравнению с пациентами, которым ввели аналогичную дозу мелфалана без производного циклодекстрина. После общего описания настоящего изобретения дальнейшее понимание может быть достигнуто при помощи приведенных ниже примеров. Указанные примеры являются исключительно иллюстративными и ни в коей мере не предназначены для ограничения настоящего изобретения. Примеры Пример 1. Исследовали скорость растворения свободного основания мелфалана (Chemwerth, Woodbridge, CT) в растворах с различными значениями рН и с различными концентрациями производного циклодекстрина. Процедура была следующей: свободное основание мелфалана добавляли к раствору, содержащему производное циклодекстрина (SBE6.5CD, Captisol), затем перемешивали с использованием вортекса в течение 1-5 мин и, в случае необходимости, обрабатывали ультразвуком в ледяной воде до получения чистого раствора. Время растворения свободного основания мелфалана в зависимости от концентрации, объема и рН производного циклодекстрина Согласно данным, приведенным выше в таблице, растворение свободного основания мелфалана было очень быстрым при значении рН 1,1 вне зависимости от концентрации производного циклодекстрина. После растворения раствор нейтрализовывали гидроксидом натрия. Растворы свободного основания мелфалана в данном примере могут быть приготовлены путем добавления свободного основания мелфалана к раствору, содержащему производное циклодекстрина, или путем добавления 0,1 М раствора HCl к мелфалану и последующего добавления производного циклодекстрина, или одновременного растворения свободного основания мелфалана и производного циклодекстрина. Тем не менее, обработка ультразвуком давала лучшие результаты при усилении растворения и разбивании комков сухого вещества в растворе, чем перемешивание и/или встряхивание. Пример 2. Изучали связывание свободного основания мелфалана (Chemwerth, Woodbridge, CT) в зависимости от концентрации производного циклодекстрина при значениях рН 5 и 7, после чего сравнивали полученные данные литературными данными о связывании свободного основания мелфалана. Растворы со значением рН 5 содержали 100 мМ буфера на основе гидротартрата натрия и их рН доводили до 5 при помощи гидроксида натрия в 0,9% растворе хлорида натрия. Растворы со значением рН 7 содержали по 50 мМ моно- и диосновного фосфата и 0,9% хлорида натрия. Были приготовлены растворы с содержаниемSBE6.5CD (Captisol) 0, 50, 75 и 100 мМ, после чего к 2 мл образцов каждого раствора добавляли избыток свободного основания мелфалана. После добавления избытка свободного основания мелфалана образцы перемешивали с использованием вортекса в течение 30 с, обрабатывали ультразвуком в бане с ледяной водой в течение 20 мин, после чего перемешивали путем вращения с донышка на крышку при комнатной температуре в течение 30 мин. Затем образцы центрифугировали, чистую надосадочную жидкость разбавляли водой и анализировали при помощи ВЭЖХ. Все исследования мелфалана с применением ВЭЖХ проводили согласно следующему протоколу. Использовали систему ВЭЖХ компании Шимадзу, оснащенную контроллером системы SCL-10A, автоинжектором SIL-10A, жидкостным хроматографом LC-10AT, спектрофотометром-детектором SPD-10AUV, термостатом колонок СТО-10 А и программным обеспечением для автоматизации лабораторной хроматографии Class-VP. Использовали колонку ZORBAX RX-C18 размерами 4,6 на 150 мм (AgilentTechnologies, Santa Clara, CA) с размером частиц 5 мкм. Образцы (20 мкл) вводили в колонку для изократического элюирования с использованием подвижной фазы "раствор фосфатного буфера (рН 7,4):метанол:ледяная уксусная кислота" в соотношении 500:250:10 (об./об.). Подвижная фаза была выбрана с целью уменьшения или незначительного подавления перегруппировки мелфалана вследствие повышенной концентрации хлорида. Образцы готовили непосредственно перед введением. Детектирование было установлено на 260 нм. Процедура, описанная в литературе, включала добавление избыточного количества мелфалана к 0,10, 20, 30, 40, 50, 75 и 100 мМ растворам SBE7-P-CD (сред. молек. масса = 2248 г/моль) в 25 мМ раствора фосфатного буфера при значении рН 7,5. Суспензии помещали в плотно закрываемые крышками флаконы, обрабатывали ультразвуком в течение 1 ч и перемешивали встряхиванием при температуре 25 С в течение 23 ч. Затем растворы центрифугировали, чистую надосадочную жидкость разбавляли дважды дистиллированной водой и анализировали при помощи ВЭЖХ; см. D.Q. Ma et al, J. Pharm. Sci. 89:275(1999). Данные, полученные при исследованиях солюбилизации свободного основания мелфалана, представлены на фиг. 1. Как показано на фиг. 1, свободное основание мелфалана демонстрировало значительно меньшее улучшение растворимости по сравнению с ранее описанным в литературе; см. id. Так как улучшение растворимости свободного основания мелфалана, обеспечиваемое SBE6.5CD, было ниже ожидаемого, были проведены дополнительные исследования фазовой растворимости с использованием гидрохлорида мелфалана. Пример 3. Связывание гидрохлорида мелфалана (эталонный стандарт Фармакопеи США (USP и свободного основания мелфалана (Chemwerth) с производным циклодекстрина (SBE6.5CD, Captisol, сред. молек. масса = 2163 г/моль) определяли в зависимости от концентрации производного циклодекстрина при значении рН 7,5. Температуру поддерживали на уровне 22 С и добавляли 25 мМ фосфатного буфера к каждому раствору. Данные сравнивали с данными из литературных источников о связывании свободного основания мелфалана с SBE7CD (сред. молек. масса = 2248 г/моль) в 25 мМ фосфатного буфера при значении рН 7,5 (см. пример 2). Образцы готовили путем добавления избытка гидрохлорида мелфалана или свободного основания мелфалана к 1 мл образцов различных растворов SBE6.5CD. Образцы перемешивали с использованием вортекса в течение 30 с, обрабатывали ультразвуком при 20-24 С в течение 60 мин, а затем перемешивали путем вращения с донышка на крышку при температуре 22 С в течение 60 мин. Затем образцы центрифугировали, чистую надосадочную жидкость разбавляли водой и анализировали при помощи ВЭЖХ. Данные представлены на фиг. 2. Как показано на фиг. 2, гидрохлоридная соль мелфалана продемонстрировала значительное улучшение растворимости по сравнению со свободным основанием мелфалана для всех концентраций производного циклодекстрина свыше 25 мМ. Пример 4. Фармацевтическую композицию, содержащую мелфалан в виде гидрохлоридной соли, готовили в соответствии с процессом, схематически изображенным на фиг. 3. Как показано на фиг. 3, воду для инъекций, USP, загружали в миксер из нержавеющей стали при температуре 15-20 С, после чего к ней добавляли соляную кислоту до достижения уровня рН примерно 4,6. Полученный раствор перемешивали на скорости, достаточной для создания вихревого движения (вортекса) (но без образования пены) в течение примерно 15 мин, медленно добавляли производное циклодекстрина (27,2 г SBE6.5CD, Captisol) при перемешивании с использованием вортекса, после чего полученный раствор перемешивали в течение примерно 15 мин для достижения полного растворения. Полученный раствор имел значение рН примерно 2,5. Мелфалан в виде гидрохлоридной соли (516 мг) медленно добавляли при перемешивании с использованием вортекса, после чего полученный раствор перемешивали в течение примерно 15 мин для достижения полного растворения. Затем медленно добавляли основание (2 н. NaOH) при перемешивании с использованием вортекса до достижения рН раствора примерно 5,6. Затем раствор анализировали с использованием спектрофотометра в УФ и видимой областях спектра (детектирование при длине волны 260 нм). Раствор содержал мелфалан в концентрации 5,16 мг/мл, а соотношение мелфалана к производному циклодекстрина составляло примерно 1:55 мас./мас. Затем раствор пропускали через стерильный фильтр (0,22 мкм поливинилиденфторид) и охлаждали до 10-15 С. Пример 5. Жидкую фармацевтическую композицию, полученную в примере 4, лиофилизировали с получением ресуспендируемого и/или разбавимого сухого порошка, содержащего 50 мг мелфалана в виде гидрохлоридной соли. Стеклянные флаконы заполняли раствором (10 мл) и размещали на подносах на заранее охлажденной полке при температуре 5 С. Флаконам давали отстояться для достижения той же температуры в течение 30 мин, после чего лиофилизировали содержимое для получения сухого порошка в каждом флаконе. Затем флаконы заполняли азотом при давлении примерно 400 мм рт. ст., после чего их запечатывали. Пример 6. Фармацевтическую композицию, содержащую мелфалан в виде гидрохлоридной соли, получали в соответствии с процессом, описанным в примере 4 и схематически изображенным на фиг. 3, за исключением того, что конечный раствор содержал мелфалан в концентрации 10 мг/мл, и того, что соотношение мелфалана к производному циклодекстрина в растворе составляло примерно 1:27 мас./мас. Пример 7. Жидкую фармацевтическую композицию, полученную в примере 6, лиофилизировали с получением ресуспендируемого и/или разбавимого сухого порошка, содержащего 200 мг мелфалана в виде гидрохлоридной соли. Стеклянные флаконы заполняли раствором (20 мл) и размещали на подносах на заранее охлажденной полке при температуре 5 С. Флаконам давали отстояться для достижения той же температуры в течение 30 мин, после чего лиофилизировали содержимое с получением сухого порошка в каждом флаконе. Затем флаконы заполняли азотом при давлении примерно 400 мм рт. ст., после чего их запечатывали, упаковывали и прикрепляли этикетки. Флаконы были защищены от света в течение всех стадий лиофилизации, заполнения азотом, запечатывания, упаковки и прикрепления этикеток. Пример возможной реализации А. Жидкую фармацевтическую композицию, полученную в примерах 4 и 6, можно высушить распылением в асептических условиях с получением свободнотекучего порошка для заполнения в асептических условиях. Указанный подвижный порошок будет обладать сходными или превосходящими свойствами растворимости по сравнению с лиофилизированным порошком, полученным в примерах 4 или 6. Пример 8. Фармацевтическая композиция, содержащая мелфалан в виде гидрохлоридной соли, была получена при помощи процесса, схематически изображенного на фиг. 4. Как показано на фиг. 4, воду для инъекций, USP, загружали в миксер из нержавеющей стали при температуре 18-25 С и полученный раствор перемешивали на скорости, достаточной для создания вихревого движения (вортекса) (но без образования пены). Затем медленно добавляли производное циклодекстрина (SBE6.5CD, Captisol) при перемешивании с использованием вортекса, после чего полученный раствор перемешивали в течение примерно 15 мин для достижения полного растворения. Полученный раствор затем охлаждали до примерно 2-8 С. Мелфалан в виде гидрохлоридной соли медленно добавляли при перемешивании с использованием вортекса, после чего полученный раствор перемешивали в течение примерно 15 мин для достижения полного растворения. Затем медленно добавляли основание (2 н. NaOH) при перемешивании с использованием вортекса до достижения уровня рН примерно 5-6 (целевое рН 5,5). Затем проводили производственный контроль (IPC) для наблюдения за уровнем рН, после чего раствор доводили до конечного целевого объема при помощи воды для инъекций, USP. Затем раствор анализировали с использованием спектрофотометра в УФ и видимой областях спектра (детектирование на длине волны 260 нм) и проводили анализ биологической нагрузки. После этого раствор пропускали через стерильный фильтр (0,22 мкм поливинилиденфторид) и охлаждали до 15-25 С. В конце проводили производственный контроль. Пример 9. Раствор, полученный в примере 8, лиофилизировали с получением ресуспендируемого и/или разбавимого сухого порошка, содержащего мелфалан в виде гидрохлоридной соли. Для проведения лиофилизации стеклянные флаконы заполняли раствором (10 мл) и размещали на подносах на заранее охлажденной полке при температуре 5 С. Флаконам давали отстояться для достижения той же температуры в течение 1 ч, после чего лиофилизировали содержимое с получением сухого порошка в каждом флаконе. Затем флаконы заполняли азотом, запечатывали, упаковывали и прикрепляли этикетки. Флаконы были защищены от света в течение всех стадий лиофилизации, заполнения азотом, запечатывания, упаковки и прикрепления этикеток. Пример возможной реализации В. Жидкую фармацевтическую композицию, полученную в примере 8, можно высушить распылением в асептических условиях с получением свободнотекучего порошка для заполнения в асептических условиях. Указанный подвижный порошок будет обладать сходными или превосходящими свойствами растворимости по сравнению с лиофилизированным порошком, полученным в примере 9. Пример 10. Свойства фармацевтических композиций согласно настоящему изобретению после разбавления водой для инъекций, USP, были проанализированы разнообразными аналитическими методами. Результаты приведены ниже в таблице. Композиции A-D были приготовлены в соответствии с процессом, описанным в примерах 8, 9. Разбавленные композиции содержали SBE6.5CD (Captisol) в концентрации 75,100, 125 и 125 мМ соответственно. Содержание влаги в каждой композиции перед разбавлением составляло от примерно 1,3 до примерно 2,5%. Свойства фармацевтических композиций согласно настоящему изобретению,содержащих различные концентрации производного циклодекстрина Пример 11. Определяли стабильность гидрохлорида мелфалана после разбавления фармацевтической композиции согласно настоящему изобретению. Фармацевтические композиции, содержащие производное циклодекстрина (SBE6.5CD, Captisol, сред. молек. масса = 2163 г/моль), разбавляли изотоничным физиологическим раствором с получением 0,45 мг/мл растворов мелфалана, содержащих производное циклодекстрина в концентрации 75 и 125 мМ соответственно. Мелфалан оценивали в зависимости от времени,а также определяли время, необходимое для 5 или 10% потерь мелфалана (на основе исходной концентрации мелфалана 100%). Данные представлены в нижеследующей таблице. Время, необходимое для уменьшения концентрации мелфалана до 90 или 95% от исходной концентрации в растворах, содержавших производное циклодекстрина, сравнивали со стабильностью мелфалана в Препарате сравнения(Alkeran для инъекций, GlaxoSmithKline). Стабильность мелфалана в зависимости от концентрации производного циклодекстрина в сравнении со стандартом мелфалана Согласно данным, приведенным выше в таблице, стабильность мелфалана после разбавления фар- 22022890 мацевтической композиции согласно настоящему изобретению демонстрирует повышение примерно в 4,2 и 6,8 раз при концентрациях производного циклодекстрина 75 и 125 мМ соответственно относительно стандартного состава мелфалана, не содержащего производное циклодекстрина. Пример 12. Определяли стабильность гидрохлорида мелфалана после разбавления фармацевтической композиции согласно настоящему изобретению в зависимости от температуры и условий хранения. Фармацевтические композиции, содержащие мелфалан (50 мг) и производное циклодекстрина (SBE6.5CD, Captisol, сред. молек. масса = 2163 г/моль, 270 мг), разбавляли изотоническим физиологическим раствором(8,5 мл) с получением концентрированного раствора. Указанный концентрированный раствор далее разбавляли в 10 раз с получением разбавленного раствора. Концентрированный и разбавленный растворы мелфалана хранили при температуре 25 С и 60% относительной влажности или в холодильнике (10 С),и контролировали содержание мелфалана в зависимости от времени. Полученные данные приведены в нижеследующей таблице. Стабильность мелфалана в зависимости от температуры и условий хранения Согласно данным, приведенным выше в таблице, стабильность мелфалана после разбавления фармацевтической композиции согласно настоящему изобретению значительно улучшается по сравнению с доступными на данный момент фармацевтическими композициями, не содержащими производного циклодекстрина. Пример 13. Определяли стабильность лиофилизированной композиции гидрохлорида мелфалана до и после разбавления в зависимости от температуры и условий хранения. Исследование было проведено под руководством компании CyDex Pharmaceuticals, Inc., компанией BioConvergence LLC, Bloomington, Индиана. Композиции, содержащие мелфалан (50 мг) и повидон (20 мг), разбавляли композициями, содержащими производное циклодекстрина (SBE6.5CD, Captisol, сред. молек. масса = 2163 г/моль, 270 мг),цитрат натрия (200 мг) и дистиллированную воду (10 мл), с получением концентрированных растворов мелфалана (5 мг/мл). Наряду с измерением стабильности концентрированных растворов проводили дальнейшее 11-кратное разбавление с получением разбавленных композиций, содержащих мелфалан(0,45 мг/мл). Кинетическую стабильность ресуспендированного концентрированного раствора (5 мг/мл мелфалана) определяли после хранения в стеклянном флаконе, а кинетическую стабильность ресуспендированного разбавленного раствора (0,45 мг/мл мелфалана) определяли после хранения в емкости BaxterIntravia вместимостью 50 мл при температуре холодильника (примерно 2-8 С) и комнатной температуре (примерно 25 С, наблюдение при флуоресцентном свете). Оценку кинетической стабильности разбавленной (0,45 мг/мл мелфалана) композиции проводили в стеклянной емкости класса 1 вместимостью 50 мл: ресуспендировали с использованием физиологического раствора (8,5 мл), после чего из каждого флакона удалили аликвоты (4,5 мл) и поместили их в 4 стеклянных емкости, содержавших 45,5 мл физиологического раствора. После того как некоторое количество содержимого взяли из каждой емкости для анализа t=0, емкости хранили при комнатной температуре держанием мелфалана в зависимости от времени. Полученные данные приведены в таблице ниже. Обобщенные данные о стабильности мелфалана в зависимости от температуры и условий хранения Согласно данным, приведенным выше в таблице, стабильность мелфалана после разбавления из фармацевтической композиции согласно настоящему изобретению позволяет получить стабильную композицию, которая может храниться при комнатной температуре до 5 ч, и демонстрировать деградацию мелфалана менее чем на 2%, или до 10 ч, и демонстрировать деградацию мелфалана менее чем на 4%. При охлаждении разбавленная композиция мелфалана может храниться до 24 ч и демонстрировать деградацию мелфалана менее чем на 2%. К тому же, лиофилизированная фармацевтическая композиция может храниться до 2 лет при комнатной температуре и демонстрировать деградацию мелфалана менее чем на 2%. Кроме того, как показано в примерах 12 и 13, фармацевтические композиции согласно настоящему изобретению обеспечивают значительное повышение стабильности мелфалана по сравнению с другими составами, в которых заявлено применение производного циклодекстрина. Например, в D.Q. Ma et al.,Int. J. Pharm. 189:221 (1999) описана композиция мелфалана, которая после разбавления раствором, содержащим производное циклодекстрина, демонстрирует потерю мелфалана более чем на 60% после 48 ч при комнатной температуре. Что особенно важно, данные из вышеприведенных таблиц показывают, что после разбавления фармацевтической композиции согласно настоящему изобретению наблюдается потеря мелфалана не более чем 30% после 48 ч при комнатной температуре. Потеря мелфалана может быть снижена до 2 или 3% при условии, что раствор хранится при пониженной температуре (например, в холодильнике). Пример 14. Анализировали гемолитический потенциал производного циклодекстрина, подходящего для применения с фармацевтической композицией согласно настоящему изобретению, в сравнении с ранее представленным в продаже носителем-разбавителем для мелфалана (Alkeran для инъекций,GlaxoSmithKline). Гемолитический потенциал оценивали на эритроцитах грызунов (крыс линии Спраг Доули (SPRAGUE DAWLEUY) или линии Wistar Han IGS) и человека, полученных из субъектов натощак, с применением спектофотометрических методов. В качестве контроля (или фона) и в качестве отрицательного контроля для сравнения с различными концентрациями носителей-разбавителей, содержащих и не содержащих производное циклодекстрина, использовали физиологический раствор (0,9% хлорид натрия). Также использовали положительный контроль, содержащий Triton X-100 (1%) в растворе фосфатного буфера. Забор эритроцитов проводили у взрослых субъектов натощак (8 ч). Компоненты различных образцов перечислены в следующей таблице. Эритроциты крыс и человека подвергали воздействию различных концентраций носителейразбавителей и гемолитический потенциал оценивали по уравнению (1) Результаты гемолиза приведены в следующей таблице, где группа А относится к эритроцитам крыс,подвергнутым воздействию носителя, содержащего производное циклодекстрина; группа В относится к эритроцитам крыс, подвергнутым воздействию разбавителя Alkeran для инъекций (GlaxoSmithKline); группа С относится к эритроцитам человека, подвергнутым воздействию носителя, содержащего производное циклодекстрина; и группа D относится к эритроцитам человека, подвергнутым воздействию разбавителя Alkeran для инъекций (GlaxoSmithKline). Значения поглощения для отрицательного контроля в каждом эксперименте были ниже 0,13, а для положительного контроля в каждом эксперименте значения поглощения составили примерно от 2,8 до 3. Результаты гемолиза эритроцитов крыс и человека, подвергнутых воздействию различных носителей-разбавителей Согласно данным по гемолизу, приведенным выше в таблице, раствор, содержавший производное циклодекстрина в высоких концентрациях (например, без разбавления, при разбавлении физиологическим раствором 1:2 и при разбавлении физиологическим раствором 1:4), вызывал пониженный гемолиз эритроцитов крыс, который также выражался в виде уменьшения спектрофотометрического поглощения примерно на 30% по сравнению с разбавителем Alkeran для инъекций (GlaxoSmithKline). Несмотря на то что пробы на гемолиз эритроцитов человека показали сходное уменьшение спектрофотометрического поглощения при высоких концентрациях, ни раствор производного циклодекстрина, ни носительразбавитель Alkeran для инъекций (GlaxoSmithKline) не вызывали гемолиз эритроцитов человека. Пример 15. Проводили исследование, согласно которому было определено, что мелфалан, связанный с SAE6.5-CD (Captisol, CyDex Pharmaceuticals, Inc., Lenexa, KS), демонстрирует тот же уровень связывания с белками, что и не связанный мелфалан. Исследование было проведено компанией Analytical BiochemistryLaboratories, Inc., Columbia, МО, под руководством компании CyDex Pharmaceuticals, Inc. Предварительное исследование. Было проведено предварительное исследование, согласно которому было определено, что мелфалан, меченный радиоактивными изотопами, [14 С]-мелфалан (Moravek Biochemicals, Inc., Brea, CA), не связывается неспецифично с ультрафильтрационными аппаратами. Для определения связывания с белками [14 С]-мелфалана отдельно или в комбинации с SAE6.5CD к ультрафильтрату плазмы крови человека добавляли следующие смеси соединений: В качестве положительного контроля во всех экспериментах использовали варфарин, меченный радиоактивными изотопами, [3 Н]-варфарин (Moravek Biochemicals, Inc., Brea, CA), соединение с документально подтвержденными белок-связывающими свойствами. Навески порошкового материала (согласно конкретному случаю) помещали в сцинтилляционные флаконы (20 мл), после чего при помощи пипетки с позитивным вытеснением во флаконы добавляли соединения, меченные радиоактивными изотопами. Затем во флаконы добавляли контрольный ультрафильтрат плазмы крови человека (5 мл) при помощи стеклянной серологической пипетки. После этого смеси быстро перемешивали. Временную зависимость связывания с белками плазмы определяли путем взятия образцов смесей спустя 0,5, 1 и 5 мин после добавления тестовых соединений к ультрафильтрату плазмы крови человека. Аликвоты образцов (31 мл) разливали в ультрафильтрационные аппараты, после чего образцы сразу же центрифугировали (1600 г в течение 5 мин при температуре 25 С). Раствор,оставшийся во флаконах, делили на аликвоты для жидкостно-сцинтилляционного анализа (LSC) (20,1 мл). Наблюдалось более чем 95% выведение [3 Н]-варфарина во всех экспериментах. В экспериментах на связывание с белками, более чем 99% [3 Н]-варфарина оказалось связано с белками. Меченый радиоактивными изотопами мелфалан (отдельно или в комбинации с SAE6.5CD), помещенный в ультрафильтрационные аппараты с отсечением по молекулярной массе в 30 кДа, показал степень радиоактивного выведения в среднем более 97%: [14 С]-Мелфалан отдельно показал степень выведения 97,7% (n=3), a[14 С]-мелфалан в сочетании с SAE6.5CD показал степень выведения 97,6% (n=3). Результаты демонстрируют, что имело место минимальное (т.е. менее 2,4%) неспецифичное связывание меченного радиоактивными изотопами мелфалана с ультрафильтрационными аппаратами. Исследование связывания с белками. Для исследования связывания с белками мелфалан, меченный радиоактивными изотопами, мелфалан, не меченный радиоактивными изотопами, и SAE6.5CD (в установленном порядке) добавляли в сцинтилляционный флакон (20 мл) и высушивали досуха под потоком азота для стандартизации количества растворителя в каждом эксперименте. Во флаконы добавляли метанол (50 мкл) и затем контроль плазмы крови человека (5 мл) при помощи стеклянной серологической пипетки. Затем смеси быстро перемешивали. Аликвоты (31 мл) перемещали из флаконов в ультрафильтрационные аппараты, после чего центрифугировали (2000 г в течение 5 мин при температуре 25 С). Интервал времени между добавлением плазмы крови человека во флаконы и началом центрифугирования составлял 0,5, 1,5, 10 и 30 мин. Оставшийся во флаконах раствор затем повторно делили на аликвоты (объемом 0,1, 0,05 и 0,025 мл) дляLSC-анализа. Радиоактивность образцов подсчитывали при помощи сцинтилляционного счетчика (Beckman Instruments, Inc. Schaumberg, IL), оснащенного оборудованием для Н-количественного метода преобразования числа импульсов в 1 мин в число распадов в 1 мин. LSC-анализ проводили на образцах (5 мл) в стеклянных сцинтилляционных флаконах (7 мл), из которых проводились основные измерения с использованием того же количества сцинтилляционной жидкости, добавленной во флаконы. Результаты приведены в следующей таблице. Связывание с белками мелфалана, меченного радиоактивными изотопами ("[14 С]-мел"),и не меченого мелфалана ("мел") в присутствии и отсутствие SAE6.5CD- 26022890 Результаты показали, что [14 С]-мелфалан в отсутствие SAE6.5CD имел степень связывания с белками плазмы 64,3% после 1 мин нахождения в плазме крови человека. Сходные степени связывания с белками плазмы наблюдались у [14 С]-мелфалана в присутствии SAE6-5CD: 64,3% (0,5 мин, n=3), 64,4%(1 мин, n=3) и 67,2% (5 мин, n=3). Исследование показало, что SAE6.5CD не влиял на степень связывания [14 С]-мелфалана, меченного радиоактивными изотопами, с белками плазмы. Пример 16. Проводили исследование способности сульфоалкильного эфира циклодекстрина изменять фармакокинетику мелфалана in vivo. Определение фармакокинетических параметров мелфалана проводили после его внутривенного введения самцам крыс линии Спраг Доули в присутствии или отсутствиеSAE6.5CD в носителе. Фармакокинетику мелфалана изучали на самцах крыс линии Спраг Доули, натощак. Все экспериментальные процедуры были одобрены и выполнены в соответствии с руководствами Комитета по этике экспериментов над животными (регистрационный номер Совета по этике университета МонашVCPA/2008/02). За один день до введения дозы в левую сонную артерию каждой крысы под изофлурановой анестезией (2%) вводили имеющийся в продаже катетер BASi CULEX (для использования с автоматизированным устройством для забора крови CULEX). Также вводили полиэтиленовый катетер в правую яремную вену. Катетеры выводили под кожу, чтобы они были видны над лопатками. Непосредственно после операции и в ходе всего эксперимента до его завершения крыс содержали в метаболических клетках RATURN в автоматизированном устройстве для забора крови CULEX. Все крысы возвратились к нормальному поведению в уходе за поверхностью тела, питье и сне спустя 1 ч после проведения операции. Животным давали небольшое количество пищи сразу после пробуждения от анестезии, но после этого им не давали пищу в течение 16-18 ч перед введением лекарственного средства. У животных все время был неограниченный доступ к воде. Кормление было возобновлено спустя 4 ч после введения лекарственного средства. По завершении каждого эксперимента крыс убивали однократной летальной инъекцией пентобарбитона. Состав мелфалана, не содержащий производного циклодекстрина, готовили согласно листкувкладышу Alkeran для инъекций (GlaxoSmithKline). Содержимое одного флакона Alkeran для инъекций (GlaxoSmithKline) ресуспендировали 10 мл стерильного разбавителя (поставляемого с Alkeran и содержащего 0,2 г цитрата натрия, 6 мл пропиленгликоля, 0,52 мл этанола (96%) и воду). Затем раствор далее разбавляли 0,9% физиологическим раствором (2 мл Alkeran для инъекций (GlaxoSmithKline) в 10 мл 0,9% физиологического раствора, т.е. 12 мл общего объема) и получившуюся фармацевтическую композицию стерилизовали путем фильтрации через 0,22-мкм шприцевой фильтр перед введением крысам. Измеренная концентрация мелфалана в составе для внутривенного введения составляла 0,54 мг/мл(в виде свободного основания), а значение рН конечного раствора составляло от 5 до 6 (проверку осуществляли при помощи индикаторной бумаги для определения рН). Состав вводили животным в течение 30 мин после приготовления. Состав, содержащий SBE6.5CD (27% мас./об.), готовили путем растворения SBE6.5CD в воде,очищенной при помощи системы Milli-Q. Затем содержимое флакона Alkeran для инъекций (GlaxoSmithKline) ресуспендировали 10 мл раствора SBE6.5CD. Данный раствор затем разбавляли 0,9% физиологическим раствором (2 мл в 10 мл 0,9% физиологического раствора), после чего полученный состав стерилизовали путем фильтрации через 0,22-мкм шприцевой фильтр перед введением крысам. Таким образом, конечный раствор содержал 4,5% (мас./об.) SBE6.5CD. Измеренная концентрация мелфалана(в виде свободного основания) составила 0,58 мг/мл, а значение рН конечного раствора составляло от 5 до 6 (проверка при помощи индикаторной бумаги для определения рН). Состав вводили животным в течение 30 мин после приготовления. Полный объем дозы составлял 1 мл, и все дозы вводили вручную путем инфузии через катетер в яремной вене. Полную дозу вводили за 10 мин, после чего катетер промывали гепаринизированным физиологическим раствором (10 ед./мл) для обеспечения полного введения дозы. Забор образцов артериальной крови и мочи проводили по следующему расписанию: время забора крови/плазмы крови было до введения дозы и 5, 10 (конец инфузии), 15, 25, 40, 55, 70, 100, 130, 190, 250,370 и 490 мин после введения дозы; интервалы между заборами мочи составляли 0-70, 70-130, 130-190,190-250, 250-310, 310-370, 370-430, 430-490 и 490-1450 мин. Артериальную кровь собирали непосредственно в боросиликатные флаконы (при температуре 4 С),содержащие гепарин, COMPLETE (смесь ингибиторов протеаз), фторид калия и ЭДТА для снижения возможности разрушений образцов крови/плазмы крови вне организма. После сбора аликвоту (50 мкл) цельной крови перемещали в новую пробирку для микроцентрифуги. Оставшуюся кровь центрифугировали, а надосадочную плазму удаляли. Все образцы крови, плазмы и мочи мгновенно замораживали на сухом льду и затем переносили в морозильник на -20 С для хранения до проведения анализа. Концентрацию мелфалана в цельной крови, плазме крови, моче и образцах дозированных растворов определяли с использованием ЖХ-МС. Приготовление образцов проводили путем выделения белков в осадок ацетонитрилом. Аликвоты плазмы крови и крови (50 мкл) обрабатывали внутренним стандартом (10 мкл), ацетонитрилом (130 мкл),перемешивали на вортексе и центрифугировали. Надосадочную жидкость удаляли и анализировали при помощи ЖХ-МС. Стандартные образцы готовили путем введения точно измеренных доз стандартных растворов в соответствующую контрольную матрицу. Исходный раствор свободного основания мелфалана изготавливали в концентрации 10 мг/мл в диметилсульфоксиде. Указанный исходный раствор далее разбавляли в водном ацетонитриле (50% об./об.) с получением растворов для приготовления калибровочных стандартов. Все образцы анализировали путем ЖХ-МС/МС на тройном квадропуле Micromass Quattro PremierPR совместно с установкой СЭЖХ Waters Acquity (Waters Corp., Milford, MA). Аналитические разделения проводили на колонке с обращенной фазой Phenomenex Polar (внутренний диаметр 501,0 мм, размер частиц 4 мкм), оснащенной колонкой Phenomenex Polar Security Guard из того же материала (Torrance, CA). Образцы (7,5 мкл) инжектировали в колонку и проводили элюирование соединений (на скорости потока 0,15 мл/мин) с использованием трехкомпонентной системы растворителей, состоящей из водного раствора метанола (2% об./об.) и муравьиной кислоты (0,05% об./об.) в воде, очищенной в системе Milli-Q (растворитель А), и ацетонитрила, содержащего муравьиную кислоту (0,05% об./об.) (растворитель В). Градиентные условия, примененные при анализе путем ЖХ-МС, приведены в следующей таблице. Градиентные условия хроматографии, примененные при анализе мелфалана Элюирование анализируемых соединений было подтверждено при помощи мониторинга множественных реакций (MRM) с использованием диазепама (0,2 мкг/мл) в качестве внутреннего стандарта (диазепам). Напряжение входных конусов составляло 20 и 40 эВ для мелфалана и внутреннего стандарта соответственно, а энергия столкновений - 15 и 27 эВ для мелфалана и внутреннего стандарта соответственно. Контроль элюирования мелфалана и внутреннего стандарта проводили с применением переходов 304,94267,88 и 285,17154,02 соответственно. Мелфалан показал время удерживания 2,0 мин, а внутренний стандарт - 2,8 мин. Масс-спектрометрию проводили с применением ионизации электрораспылением в положительном режиме со значением капиллярного напряжения 3,2 кВ, коэффициента усиления электронного умножителя детектора 650 В и температурами исходного блока и десольватации 90 и 300 С соответственно. Поддерживали значения потока десольватационного газа (азот) и газа для соударений (аргон) 500 л/ч и 0,38 мл/мин соответственно. Нижний предел количественного анализа (LLQ) для стандартов крови и плазмы крови составлял 5,0 нг/мл, a LLQ для разбавленных образцов мочи составлял 0,5 нг/мл. Проводили анализ данных по концентрации образцов плазмы крови и цельной крови для получения фармакокинетических параметров с использованием программного обеспечения WinNonLin (WinNonLin professional version 5.2.1, Pharsight Corp., Mountain View, CA). Общий клиренс (CLобщ., для цельной крови или плазмы крови) после внутривенного введения вычисляли по формуле:CLобщ.=доза/AUC, где AUC представляет собой площадь под кривой "концентрация цельной крови или плазмы крови - время", полученной с использованием линейного метода трапеций. Объем распределения(Vz) вычисляли по формуле: Vz=CLобщ./Z, где Z представляет собой константу скорости выведения после внутривенного введения. Профили мелфалана "средняя нормализованная по дозе концентрация - время" в цельной крови и плазме крови после внутривенного введения в составе, содержащем SBE6.5CD (n=4), и в составе, не содержащем циклодекстрина (n=5), представлены в нижеследующей таблице. Фармакокинетические параметры мелфалана в цельной крови и плазме крови после внутривенного введения самцам крыс линии Спраг Доули в номинальной дозе 2,0 мг/кг в составе, содержащем производное циклодекстрина (SBE6.5CD), и в составе, не содержащем производного циклодекстрина ("Состав, не сод. ПЦ") На фиг. 5 А, 5 В представлены графические изображения нормализованных по дозе концентраций мелфалана в цельной крови (фиг. 5 А) и плазме крови (фиг. 5 В) после внутривенного введения состава мелфалана, содержащего SBE6.5CD ( ), n=4, и состава мелфалана, не содержащего циклодекстрина( ), n=5, (Alkeran для инъекций, GlaxoSmithKline). На фиг. 5 А, 5 В данные представлены как средние с планками погрешностей, отображающими единичное стандартное отклонение. Мелфалан показал биэкспоненциальную фармакокинетику как в цельной крови, так и в плазме крови, а кажущаяся фаза конечного полувыведения хорошо определялась в периоде забора проб крови спустя 8 ч после введения дозы, с кажущимся конечным периодом полувыведения. Кривые средней концентрации в цельной крови и плазме крови относительно времени для состава, содержавшего SBE6.5CD (27% мас./об.), и для состава, не содержавшего циклодекстрин, были, по существу, совпадающими при наложении, а статистически значимых различий в каких-либо фармакокинетических параметрах между двумя составами не было (р 0,05). Таким образом, как показано в вышеприведенной таблице, у крыс in vivo фармакокинетические параметры состава мелфалана, содержавшего SBE6.5CD, по существу, идентичны фармакокинетическим параметрам состава, не содержавшего циклодекстрина (Alkeran для инъекций, GlaxoSmithKline). Кроме того, в обоих составах процент дозы мелфалана, выведенной с мочой в виде неизменного соединения в пределах 24 ч после введения дозы, был низким: для состава, не содержащего мелфалана,среднее значение составляло 2,71,7%, а для состава, содержащего SBE6.5CD, среднее значение составляло 2,32%. Данные показывают, что фармакокинетические параметры, в т.ч. период полувыведения, AUC, объем распределения, клиренс и степень выведения почками мелфалана были, по существу, неизменными для Alkeran для инъекций (GlaxoSmithKline) и состава мелфалана, содержавшего SBE6.5CD. В частности, кривые "средняя концентрация в цельной крови и плазме крови - время" при наличии и отсутствиеSBE6.5CD являются, по существу, совпадающими при наложении. Результаты показывают, что у крыс видимой разницы в кривых "средняя концентрация в цельной крови и плазме крови - время" для SBE6.5-CD не было. Более того, у крыс видимой разницы не было и в выведении мелфалана с мочой. Пример 17. Фазу IIa, многоцентровое открытое рандомизированное исследование эффективности и безопасности гидрохлорида мелфалана, вводимого путем инъекции с использованием растворителя-носителя, не содержащего пропиленгликоля, проводили на 3 пациентах с множественной миеломой, которые прошли миелоаблятивную терапию в порядке подготовки к аутотрансплантации. Исследование продолжается. Основной целью данного исследования является определение скорости миелоабляции и приживления нейтрофилов у пациентов с множественной миеломой, получающих высокие дозы гидрохлорида мелфалана путем инъекций, при которых одну дозу вводят с использованием разбавителя на основе пропиленгликоля, а другую дозу - с использованием разбавителя, не содержащего пропиленгликоля. Введение применяется в качестве миелоаблятивной терапии перед трансплантацией аутологичных стволовых клеток. Вторичной целью настоящего исследования является определение: а) скорости приживления тромбоцитов у пациентов с множественной миеломой, получающих высокие дозы гидрохлорида мелфалана путем инъекций с использованием разбавителя, содержащего пропиленгликоль, и разбавителя, не содержащего пропиленгликоля, перед трансплантацией аутологичных стволовых клеток; b) среднего времени до приживления нейтрофилов и тромбоцитов у пациентов со множественной миеломой, получающих высокие дозы гидрохлорида мелфалана путем инъекций с использованием разбавителя, содержащего пропиленгликоль, и разбавителя, не содержащего пропиленгликоля, перед трансплантацией аутологичных стволовых клеток; с) скорости ответа (строгий полный ответ (sCR), полный ответ (CR), хороший частичный ответ (VGPR), частичный ответ (PR), стабильное заболевание (SD) или прогрессирующее заболевание (PD при трансплантации аутологичных стволовых клеток в День +100 у пациентов со множественной миеломой, получающих высокие дозы гидрохлорида мелфалана путем инъекций с использо- 29
МПК / Метки
МПК: A01N 43/04
Метки: производное, содержащие, циклодекстрина, способы, инъецируемые, композиции, применения, мелфалана
Код ссылки
<a href="https://eas.patents.su/30-22890-ineciruemye-kompozicii-melfalana-soderzhashhie-proizvodnoe-ciklodekstrina-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Инъецируемые композиции мелфалана, содержащие производное циклодекстрина, и способы их применения</a>
Предыдущий патент: Изделия на основе полимолочной кислоты и их использование
Следующий патент: Применение макроциклических ингибиторов сериновых протеаз гепатита с
Случайный патент: Соединения фосфиновой аминокислоты и содержащие их фармацевтические композиции












