Эффективные пролекарства аспирина
Номер патента: 22878
Опубликовано: 31.03.2016
Авторы: Гилмер Джон Фрэнсис, Клун-Мориарти Луиз, Лалли Маеве
Формула / Реферат
1. Соединение изосорбид аспиринат, имеющее формулу

где OR представляет собой -OC(O)C1-С7 алкильную группу, -OC(O)C1-С7 алкоксигруппу, -ОС(О)С3-С9 циклоалкильную группу или -OC(O)C1-С7 циклоалкоксильную группу; которая может быть незамещенной или замещенной ONO2; или
R представляет собой бензоат, никотинат, изоникотинат, оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1-С8 алкила, C1-С8 алкокси, бензилокси, -NHC(O)R', -NH2, -NO2, -(СН2)nONO2, -OCOAr, где R' представляет собой C1-С8 алкильную группу, n=1-8 и Ar представляет собой фенил;
и его фармацевтически приемлемая соль и/или его гидраты.
2. Соединение по п.1, где R замещен во 2 или 3 положениях арильного кольца гидроксидом, Cl, Br, C1-С8 алкильной группой, C1-С8 алкоксигруппой, бензилокси, -NHC(O)R', -NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-С8 алкильную группу, n=1-8 и Ar представляет собой фенил.
3. Соединение по п.2, где R представляет собой бензоат, никотинат или изоникотинат.
4. Соединение по п.1, где R представляет собой оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1-С8 алкила, C1-С8 алкоксигруппы, бензилокси, -NHC(O)R', -NH2, -NO2, -(CH2)nONO2, где R' представляет собой C1-С8 алкильную группу и n=1-8.
5. Соединение по п.4, где R замещен во 2 или 3 положениях арильного кольца.
6. Соединение по п.1, в котором OR выбирают из группы, состоящей из
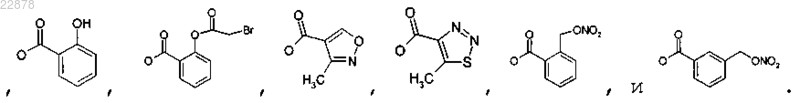
7. Соединение по п.1, в котором OR выбирают из группы, состоящей из
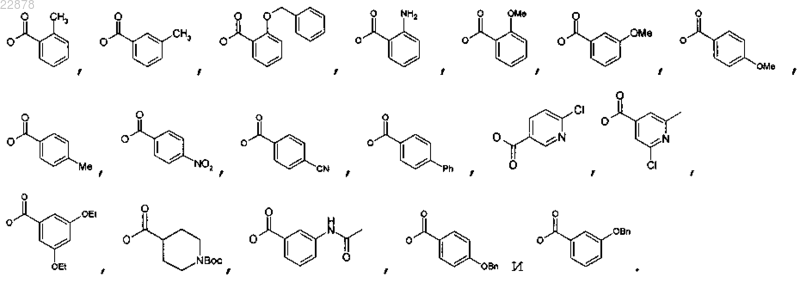
8. Соединение по п.1, в котором OR выбирают из группы, состоящей из
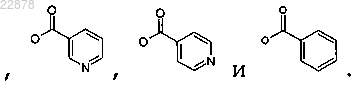
9. Фармацевтическая композиция для применения в лечении сердечно-сосудистых и цереброваскулярных расстройств, боли, повышенной температуры, воспаления, рака, болезни Альцгеймера или деменции, содержащая соединение по пп.1-8 и по меньшей мере один фармацевтически приемлемый носитель или эксципиент.
10. Применение соединения по пп.1-8 для индуцирования аспириноподобного действия или для уменьшения конститутивного экспрессирования гликопротеинов тромбоцитов на уровне, когда аспирин не действует.
11. Применение соединения по пп.1-8 в качестве лекарственного средства для лечения сердечно-сосудистых и цереброваскулярных расстройств, боли, повышенной температуры, воспаления, рака, болезни Альцгеймера или деменции.
12. Способ лечения сердечно-сосудистых и цереброваскулярных расстройств, боли, повышенной температуры, воспаления, рака, болезни Альцгеймера или деменции введением нуждающемуся в этом пациенту эффективного количества соединения по пп.1-8.
Текст
Медведев В.Н. (RU) Аспирин представляет собой одно из наиболее широко используемых лекарственных средств для лечения воспаления, боли и при повышенной температуре. Он имеет найденные позже применения для предотвращения сердечных приступов и удара и исследуется в качестве хемопревентивного средства против рака. Несмотря на свое значение аспирин по-прежнему используется недостаточно, поскольку он вызывает желудочное кровотечение. Разрабатываемая технология потенциально устраняет эту проблему. Она разрабатывается для уменьшения контакта между лекарственным средством и внутренними стенками кишечника. Таким образом, предусматривается пролекарственное соединение изосорбид аспиринат. Соединение имеет общую структуру, как показано формулой (I) где OR представляет собой -ОС(О)С 1-С 7 алкильную группу, -OC(O)C1-С 7 алкоксигруппу,-ОС(О)С 3-С 9 циклоалкильную группу или -OC(O)C1-С 7 циклоалкоксильную группу; которая может быть незамещенной или замещенной ONO2; или где R представляет собой бензоат, никотинат, изоникотинат,оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой,состоящей из гидроксида, -Cl, -Br, C1-С 8 алкила, С 1-С 8 алкокси, бензилокси, -NHC(O)R', -NH2, -NO2, (CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил; и его фармацевтически приемлемая соль и/или его гидраты.(71)(73) Заявитель и патентовладелец: ДЗЕ ПРОВЕСТ, ФЕЛЛОУЗ ЭНД СКОЛАРЗ ОФ ДЗЕ КОЛЛЕДЖ ОФ ДЗЕ ХОЛИ ЭНД АНДИВАЙДЕД ТРИНИТИ ОФ КВИН ЭЛИЗАБЕТ, НИАР ДУБЛИН (IE) Область техники, к которой относится изобретение Настоящее изобретение относится к сильнодействующим пролекарствам аспирина, которые являются стабильными по отношению к влаге и по отношению к условиям, встречающимся в просвете желудочно-кишечного тракта, но будут быстро разрушаться во время и после поглощения с высвобождением аспирина и/или оксида азота (NO). Уровень техники Аспирин представляет собой одно из наиболее широко используемых в мире лекарственных средств. Регулярное его использование связано с уменьшением риска смертности во всех группах с сердечно-сосудистыми рисками. Он представляет собой противовоспалительное, анальгетическое и антипиретическое средство и используется в борьбе против сердечно-сосудистого заболевания и, согласно предсказаниям, играет некоторую роль в предотвращении раковых заболеваний толстой и прямой кишки, пищевода, желудка и легких (например, Chan 2005), а также инсульта, болезни Альцгеймера (Etminanet al., 2003) и других форм деменции. Некоторые модели предсказывают, что ежедневное потребление аспирина людьми старше пятидесяти лет удвоило бы их шансы дожить до 90 лет (Morgan, 2003). Главные побочные действия, связанные с использованием аспирина, являются желудочнокишечными. Аспирин вызывает диспепсию почти у половины всех пациентов и утраивает риск желудочно-кишечного кровотечения. Эндоскопически контролируемые исследования демонстрируют повышение риска кровотечения при всех дозах аспирина, даже при относительно низких дозах, используемых при предотвращении инфаркта миокарда (MI). В одном из исследований 10% пациентов при низкой дозе аспирина (10-300 мг/день) имеют эндоскопические язвы после 12 недель, при этом один случай произошел при 10 мг/день (CryerFeldman, 1999, Cryer 2002). Некоторые исследования показывают случаи кровотечения через 5-30 дней после начала терапии, указывая, что адаптации не происходит. Важно, что риск побочных желудочно-кишечных воздействий ограничивает использование аспирина в группах пациентов с высокой вероятностью тромботического случая: в случайно выбранной популяции риск серьезного желудочно-кишечного повреждения выше, чем риск смерти при аспириновой профилактике. К настоящему времени нет соотносимых с дозами данных по профилактическому использованию аспирина при раке, однако, вероятно, доза при этом выше, чем оптимальная доза, необходимая для его установленной роли при предотвращении сердечного приступа, и, таким образом, имеется вероятность повышения риска более высокой желудочно-кишечной токсичности. Хотя абсолютные риски являются низкими(1-2%), его широкое и быстро растущее потребление делает вызываемую аспирином желудочнокишечную токсичность проблемой общественного здравоохранения (Morgan, 2003; Laheij 2001; Newtonet al., 2004). Наблюдают ряд вкладов в желудочно-кишечную токсичность аспирина. Кишечная стенка защищена от едкого содержания просвета защитным слоем. Этот барьер частично поддерживается с помощью двух ферментов циклооксигеназ (СОХ-1 и СОХ-2). Сердечно-сосудистые защитные действия аспирина происходят от ингибирования им фермента циклооксигеназы тромбоцитов СОХ-1, в то время как его цитопротекторные действия приписываются его уникальной способности ацетилировать фермент циклооксигеназу СОХ-2, который заставляет арахидоновую кислоту действовать в обход, шунтируяPGE2, промотор рака, в сторону НЕТЕ, супрессора рака. СОХ-2 также играет некоторую роль в заживлении ран ЖКТ. Аспирин ингибирует эти ферменты, когда он проходит через кишки во время поглощения и, таким образом, ослабляет их защитную роль. Следовательно, биохимический аспект токсичности происходит от локального ингибирования аспирином СОХ-1 и СОХ-2, которое приводит к подавлению простагландинов (PGE2, PGI2), которые обычно регулируют секрецию желудочной кислоты и кровоток. Имеется также четкий химический аспект токсичности аспирина. Аспирин представляет собой гидрофобную кислоту (pKa 3,5). Он растворим в липидах при низких значениях рН, и он способен разрушать гидрофобный слой, покрывающий эпителий, делая возможным доступ для содержимого просвета, вызывая раздражение, возможно, приводя к образованию язвы. Это может быть более важной причиной токсичности, чем биохимический компонент. В одном из последних исследований пероральное введение аспирина крысам вызывает повреждения желудка, в то время как повреждений желудка нет, когда лекарственное средство вводят подкожно, несмотря на доказательство ингибирования СОХ при обоих способах (Mahita, 2006). Лекарственно-индуцируемая желудочно-кишечная токсичность является очень сложной и представляет собой объект часто противоречивых данных, но данное конкретное исследование показывает, что химическая токсичность является значимой. Проблема желудочно-кишечной токсичности сосредотачивает на себе внимание фармацевтов в течение многих лет, но эндоскопические исследования демонстрируют, что обычные решения, такие как энтеральные покрытия или использование буферов, являются в лучшем случае неадекватными (Kelly etal., 1996, Walker et al., 2007). Таким образом, установление новых путей доставки аспирина или изучение его желудочно-кишечных воздействий является предметом, важным для общественного здравоохранения и имеющим важное коммерческое значение. Потенциально ценное решение проблемы представляет собой разработку производных аспирина,способных замедлить высвобождение аспирина от осуществляемого в желудочно-кишечном тракте до происходящего после поглощения в плазме. Такое производное должно соответствующим образом быть названо пролекарством. Пролекарства представляют собой терапевтические средства, которые сами по себе неактивны, но при метаболизме образуют активные агенты (Albert, 1958). Пролекарства аспирина исследуют в течение многих лет в качестве средств подавления его желудочной токсичности (Jones,1985). Предложена рациональная основа оригинального пролекарства аспирина, которое блокирует карбоновую кислоту аспирина, например, с помощью сложного эфира, что эффективно устраняло бы химический аспект желудочной токсичности, которая возникает в результате прямого контакта между карбоновой кислотой аспирина и слизистой оболочкой желудка. Сложные эфиры аспирина, которые активируются во время прохождения через желудочно-кишечный эпителий, как ожидается, проявляют сильно пониженную желудочную токсичность, если эта модель является правильной, даже если высвобождение лекарственного средства происходит внутри эпителиальных клеток. Когда биохимический компонент токсичности аспирина стал оцениваться шире, рациональная основа пролекарства была уточнена. В противоположность аспирину его сложные эфиры не обладают способностью к ингибированию СОХ. По этой причине они не прерывают синтез защитных простагландинов во время прохождения через стенку кишечника. Затем, после поглощения, эстеразы в крови будут разрушать сложный эфир, высвобождая аспирин. Затем лекарственное средство достигает кишечника посредством системной циркуляции, но при гораздо более низкой концентрации; аспирин быстро метаболизируется в организме и имеет время полужизни только 20 мин. Предполагается, что эффективная блокада СОХ-зависимых систем защиты слизистой оболочки требует скорее высокой концентрации аспирина. Это происходит потому, что аспирин является слабым ингибитором одного из ферментов СОХ(СОХ-1) и очень слабым ингибитором другого (СОХ-2). Другими словами, аспирин ингибирует оба защитных фермента во время фазы поглощения, но он вряд ли достигает необходимой концентрации для блокирования обоих ферментов после распределения в организме после поглощения (подобный вид фармакокинетического аргумента объясняет селективное ингибирование аспирином тромбоксана А 2 тромбоцитов по сравнению с эндотелиальным простациклином в сердце (Pedersen А.К.FitzGerald G.A. 1984. Сложные эфиры пролекарств аспирина, следовательно, как ожидается, имеют более низкую желудочно-кишечную токсичность, поскольку они не будут вызывать местного раздражения, первое прохождение аспирина через желудочно-кишечный тракт при высокой концентрации устранялось бы и второе распределение, вероятно, происходило при концентрации, которая оставляла бы зависимые от СОХ-2 защитные функции интактными. Идея таких сложноэфирных пролекарств аспирина является привлекательной, поскольку пролекарства не являются кислотными во время прохождения через защитный барьер и не будут его разрушать. Они, как ожидается, также имеют меньшие воздействия на биохимические механизмы, регулирующие барьер, активируются ли они в эпителии или, по существу, позже, после поступления в кровоток. Это имеет то преимущество, что устраняются связанные с аспирином отрицательные желудочно-кишечные воздействия. Лекарственное средство является более безопасным, поскольку оно не активируется до тех пор, пока оно не пройдет через желудочно-кишечный тракт (фиг. 1). Другая проблема, относящаяся к аспирину с клинической точки зрения, заключается в том, что он нестабилен по отношению к влаге и по этой причине не может быть приготовлен в растворах. Водные растворы аспирина были бы особенно желательными в педиатрической и гериатрической медицине. Одним из главных факторов, способствующих нестабильности аспирина, является некоторая форма автокатализа, описанная впервые Jencks и Pierre (1958). Аспирин имеет группу карбоновой кислоты и ацетильную группу. Группа карбоновой кислоты обладает способностью к активированию находящейся вблизи молекулы воды, вызывая образование гидроксида, который взаимодействует с ацетильной группой. За счет образования сложного эфира аспирина группа карбоновой кислоты маскируется и не может участвовать в автокатализе. Сложные эфиры аспирина обычно являются более стабильными, чем аспирин, и поэтому могут быть получены различными пригодными путями, которые не могут быть применимы для аспирина. Это второе преимущество сложных эфиров аспирина хорошо установлено экспериментально. С другой стороны, гипотетическая теория устранения токсичности аспирина никогда не проверялась, поскольку никогда не было подходящего потенциального пролекарства на основе сложного эфира аспирина. Это связано с тем, что разработка пролекарств на основе сложных эфиров аспирина является очень сложной. Сложный эфир аспирина и парацетамола-бенорилата находился на рынке в течение примерно тридцати лет, пока не было показано, что его доза при введении людям не приводит к высвобождению аспирина (Williams et al., 1989). Проблема со сложными эфирами аспирина и соответствующими производными является метаболической. Сложные эфиры аспирина преобразуются в организме скорее в салициловую кислоту, чем в аспирин (NielsenBundgaard, 1989). Сложные эфиры аспирина метаболизируются в тканях и крови человека возможными путями, показанными на фиг. 2. Эффективное пролекарство аспирина должно расщепляться на группе носителя с высвобождением аспирина после поглощения. Быстрый гидролиз сложных эфиров аспирина происходит в крови и плазме (t1/21 мин), но не у желаемой несущей аспирин сложноэфирной связи (положение В на фиг. 2). Вместо этого, ацетильная группа расщепляется (А на фиг. 2), и полученный продукт представляет собой сложный салицилатный эфир (сложный эфир салициловой кислоты) и, в конечном счете, салициловую кислоту. Этим биохимическим путем нельзя получить аспирин. Отношение салицилата к аспирину составляет обычно более чем 99:1, несмотря на вид группы носителя(спиртовой компонент пролекарства, используемый для образования сложного эфира с карбоновой кислотой лекарственного средства, известен как носитель в терминологии пролекарств). Если можно образовать сложный эфир из кислотного лекарственного средства, часть, которую присоединяют, блокирует химические свойства кислоты, но она также придает новому продукту некоторые из своих собственных физико-химических характеристик (см. фиг. 2). Эта проблема вызывает интерес как фармацевтическая задача, так и как коммерческая возможность. Имеется значительное количество академической и патентной литературы в данной области (см. Gilmer et al., 2002 и ссылки в ней). Однако большая часть соединений, упоминаемых в литературе в качестве пролекарств аспирина, на самом деле не функционируют как пролекарства аспирина in vitro или in vivo, и они высвобождают вместо него соответствующий сложный салицилатный эфир (NielsenBundgaard, 1989). Для того чтобы сложный эфир аспирина функционировал в качестве пролекарства, гидролиз при расщеплении в крови должен осуществляться на сложнозфирной связи носителя. Проблема при разработке заключается в том, что образование сложного эфира аспирина заставляет неправильную сложноэфирную группу подвергаться гидролизу в присутствии плазмы человека. Эта проблема впервые была объяснена Bundgaard и Nielsen (1989). Когда аспирин поступает в кровоток, его ацетильная группа гидролизуется с помощью доминантного фермента эстеразы в бутирилхолинэстеразе плазмы человека(BuChE), приводя к образованию салициловой кислоты. Аспирин заряжен отрицательно при рН крови, и бутирилхолинэстераза реально не находится в своих наиболее эффективных условиях при обработке отрицательно заряженных субстратов. Посредством образования сложного эфира аспирина отрицательный заряд (который подавляет метаболизм) удаляется и ацетильная группа становится гораздо лучшим субстратом для бутирилхолинэстеразы. Введение новой сложноэфирной группы поэтому сильно увеличивает скорость метаболизма существующего сложного ацетилового эфира. Например, аспирин имеет время полужизни в разбавленной плазме около одного часа, но сложные эфиры аспирина подвергаются тому же самому процессу деацетилирования со временем полужизни менее одной минуты: нейтральные фенилацетаты, такие как сложные эфиры аспирина, находятся среди наиболее эффективно гидролизуемых типов субстратов бутирилхолинэстеразы. Интерпретация этого с точки зрения основной энзимологии заключается в том, что сложный эфир аспирина лучше совпадает по форме с ферментом, чем сам аспирин. Bundgaard заметил, что для того чтобы метаболизм осуществлялся в нужном месте, несущая группа должна иметь структуру с конкурирующей комплементарностью к ацетильной группе, то есть она должна быть, по меньшей мере, настолько же привлекательным субстратом для фермента BuChE, как и ацетильная группа. В принципе могут иметься еще лучшие группы-носители, которые ускоряют их собственный гидролиз, в тоже время подавляя гидролиз соседней ацетильной группы. Фермент бутирилхолинэстераза получил свое наименование по его эффективности при гидролизе сложных эфиров холина.Neilsen и Bundgaard изучили сложные гликольамидные эфиры аспирина, где группу-носитель конструировали так, чтобы она была сходной с холином, чтобы ее отсоединение могло удачно конкурировать с гидролизом ацетильной группы. Гликольамиды являются только частично удачными, при этом наиболее удачным примером будет, если гидролизуется примерно 50% как в желаемом, так и в непродуктивном направлениях (пути А и В на фиг. 2). Работой Nielsen и Bundgaard установлен тот важный принцип, что удачное пролекарство аспирина требует группы-носителя, которая совпадает по форме с эстеразой плазмы человека таким образом, что превосходит ее предпочтение для ацетильной группы. Это становится в высшей степени необходимым требованием, на которое их ответ был адекватен только частично. Однако кроме технологии, описанной в настоящем документе, гликольамиды являются единственными известными соединениями, которые даже частично могут быть описаны как истинные пролекарства аспирина. Другая стратегия, которая принимается время от времени, заключается в разработке сложных эфиров,где связь носитель-аспирин является настолько лабильной, что она разрушается прежде, чем эстеразы начинают взаимодействовать с ацетильной группой. Проблема при этом подходе заключается в том, что аспирин уже является совершенно нестабильным по отношению к гидролизу с помощью воды и других нуклеофилов на его ацетильной группе. Введение второго химически активного сложного эфира вызывает повышение химической активности ацетильной группы (а также добавление другой точки лабильности). Сложные эфиры аспирина имеют тенденцию к произвольному расщеплению под действием химических стимулов, таких как вода, и по этой причине они имеют тот очевидный недостаток, что они с вероятностью встретят такие стимулы во время хранения, и поэтому они склонны к деградации при хранении в упаковке. Это нивелирует одно из преимуществ пролекарств на основе сложных эфиров аспирина,в первую очередь то, что они являются более стабильными, чем аспирин, по отношению к влаге. Пролекарства, разработанные для расщепления в ответ на общие химические стимулы, имеют также тенденцию к разрушению при условиях, обнаруживаемых в ЖКТ, которые они могут встретить перед поглощением. Интерес в области пролекарств аспирина усилился с появлением так называемых оксид азота (NO)аспиринов, которые представляют собой тип сложного эфира аспирина, но с остатком, высвобождающимNO, прикрепленным к группе-носителю. Главная рациональная основа для разработки NO-аспиринов заключается в том, что NO способствует защите слизистой оболочки, уменьшая повреждения, вызывае-3 022878 мые аспирином (Fiorucci и Del Soldato, 2003). Эта концепция теперь хорошо воспринята в биомедицинском сообществе. Оксид азота и аспирин также обладают комплементарными и иногда синергическими фармакологическими действиями, так что сочетание, как ожидается, покажет более широкий диапазон фармакологических действий, чем аспирин сам по себе. Высвобождение NO защищает желудок от вызываемой аспирином эрозии желудка путем ускорения кровотока и уменьшения адгезии лейкоцитов, в то время как его антитромботические свойства через путь GMP усиливают противотромбоцитные действия,возникающие за счет ингибирования СОХ-1 аспирином. Таким образом, считается разумным связать их в виде сложного эфира в попытке получения общего пролекарства аспирина и оксида азота. NCX-4016(NicOx SA, France) представляет собой соединение-прототип для лекарственных средств NO-аспирин(WO 95/030641, WO 97/16405, WO0044705.). Оно продуцирует NO in vivo и обладает противотромбоцитными действиями. NCX-4016 проявляет более высокую желудочную переносимость, чем аспирин, на нескольких животных моделях. Для NCX-4016 начали доклиническую разработку в 1996 году, и с 2002 года он оценивается при лечении сердечно-сосудистых расстройств (например, периферийного артериального окклюзивного заболевания (PAOD) (фаза II, при профилактике рака толстой кишки (фаза I) и болях при раке.NCX-4016 представляет собой одну из наиболее широко рекламируемых фармацевтических разработок за последние десять лет и рассматривается как значительный биомедицинский прогресс (см., например Levin, 2004). Однако в качестве пролекарства NO-аспирина NCX-4016, видимо, имеет значительный конструктивный недостаток. Ключевое исследование для пролекарства на основе сложного эфира аспирина заключается в том, гидролизуется ли аспирин или его сложный салицилатный эфир, когда он инкубируется в плазме или крови человека. NCX-4016 представляет собой сложный аспириновый эфир замещенного фенола. Опубликованные данные по структуре гидролиза NCX-4016 в плазме человека отсутствуют, но они имеются для аналогичных сложных эфиров - сложного аспиринового эфира парацетамола (бенорилата -Williams et al., 1989), сложного аспиринового эфира гваякола (Qu et al., 1990) и сложного аспиринового эфира фенола (NielsenBundgaard, 1989; см. также табл. 8). Ни одно из этих соединений не продуцирует более чем 0,5% аспирина при инкубировании в релевантных биологических матрицах. Следовательно, прямых доказательств того, что NCX4016 может или мог бы продуцировать аспирин, не имеется. Метаболические исследования соединений in vivo и in vitro относятся только к салицилатным метаболитам (Carini et al., 2002). Кроме того, ингибирование СОХ с помощью NCX-4016 является менее распространенным, чем с помощью аспирина. Это является значительным недостатком, поскольку ингибирование СОХ тромбоцитов должно быть совершенно полным, чтобы предотвратить агрегацию тромбоцитов человека. Другие недавние исследования свидетельствуют о том, что NCX-4016 может действовать непосредственно на свою мишень без высвобождения аспирина (Corazzi et al., 2005). Имеется ряд других недавних попыток разработки соединений, способных высвобождать в тканях человека как аспирин, так и оксид азота. Результаты были неутешительные. Все соединения, о которых сообщалось, подвергаются гидролизу на типичном салицилатном пути и не могут высвобождать значительных количеств аспирина, хотя они потенциально способны высвобождать оксид азота (Gilmer et al.,2007; Valezquez et al., 2005; Cena et al., 2003). В международной публикацияWO9403421 описаны сложные салицилатные эфиры клинически используемого изосорбида нитрата, ISMN. Описанное соединение представляет собой изосорбидмононитрат-аспиринат (ISMNA) и обсуждается его потенциальное использование в трансдермальном пластыре. Соединение, как сказано, является полезным относительно его антиангинальных свойств и свойств отмывания тромбоцитов. Исследования химического гидролиза, как сообщалось, показывают деградацию с получением изосорбид-мононитрата (ISMN), салициловой кислоты и аспирина, которые проявляют активность отмывки тромбоцитов и антиангинальную активность. Однако не ожидается, что ISMNA мог бы действовать в качестве жизнеспособного пролекарства аспирина, поскольку никакой другой сложный эфир аспирина, как показано, не действует в качестве пролекарства аспирина, кроме гликольамидов, и они целенаправленно разрабатываются так, чтобы быть комплементарными к BuChE плазмы. Однако ISMNA становится сильнодействующим ингибитором агрегации тромбоцитов в ткани кролика invitro, и позднее показано, что ISMNA эффективно преобразуется в аспирин с помощью эстераз плазмы кролика. Его тестировали при пероральном исследовании на собаках, в котором его сравнивали с аспирином по двум фармакологическим критериям для аспирина: по ингибированию биосинтеза тромбоксана(биохимическое соединение, которое стимулирует агрегацию тромбоцитов) и по функциональному ингибированию агрегации тромбоцитов. ISMNA показывает слабые воздействия на обоих маркерах, указывая, что он высвобождает только малые количества аспирина у собак. Путем инкубирования ISMNA в крови собак и мониторинга его гидролиза можно показать, что он не преобразуется эффективно в аспирин под действием эстераз собаки из-за различий между эстеразами в крови собаки и кролика. Позднее показано, что ISMNA не гидролизуется продуктивно и в плазме человека. В растворе плазмы человека и в крови человека in vitro ISMNA продуцирует 90% салицилата и 10% аспирина. Соответственно ISMNA является гораздо менее действенным, чем аспирин, в качестве ингибитора агрегации тромбоцитов в цельной крови человека и в плазме человека, обогащенной тромбоцитами (его IC50 составляет 85 мкМ по сравнению с 5 мкМ для аспирина при агрегации тромбоцитов человека с арахидоновой кислотой в плазме, обогащенной тромбоцитами). Результаты говорят о том, что для сложного эфира аспирина способность к ингибированию агрегации тромбоцитов или синтеза тромбоксана коррелирует со способностью продуцировать аспирин: неэффективное пролекарство делает неэффективным ингибитор агрегации тромбоцитов. Низкий уровень высвобождения аспирина и недостаточная эффективность не дает возможности считать изосорбид-мононитрат-аспиринат (ISMNA) жизнеспособным потенциальным лекарственным средством для людей. В международной публикацииWO 9817673 описывается диаспиринат изосорбида и два сложных моноаспирината изосорбида, а именно изосорбид-2-аспиринат и изосорбид-5-аспиринат. Изосорбиддиаспиринат (ISDA), главный предмет WO 9817673, не имеет, по существу, никакого отличия от множества других более ранних сложноэфирных потенциальных пролекарств, которые были исследованы. Кроме того, специалист в данной области не должен ожидать, что изосорбид-диаспиринат (ISDA) будет функционировать в качестве жизнеспособного пролекарства аспирина, и нет никакой химической или биохимической причины предполагать, что гидролиз привел бы к чему-нибудь иному, чем расщепление ацетильной группы, и таким образом, в конечном счете, к салициловой кислоте. По этой причине очень неожиданно, что авторы могут показать в своей собственной лаборатории, что ISDA ингибирует агрегацию тромбоцитов в плазме кролика, обогащенной тромбоцитами. Он также оказывает ингибиторное действие на синтез тромбоксана после перорального введения группе собак (Gilmer et al., 2003). Аспириноподобные свойства показывают, что гидролиз ISDA в плазме приводит к получению некоторого количества аспирина. ISDA, как показано, подвергается быстрому гидролизу, когда инкубируется в растворах плазмы человека с фосфатным буфером, с получением приблизительно 60% аспирина (Gilmer etal., 2002). Остальные 40% соединения гидролизуются по непродуктивному салицилатному пути. Исследование показывает, что конкретный фермент, присутствующий в плазме человека, катализирует высвобождение аспирина из изосорбид-диаспирината (ISDA). Подтверждается, что бутирилхолинэстераза представляет собой вовлеченный фермент плазмы человека. Близко родственная бутирилхолинэстераза плазмы лошади генерирует только 11% аспирина. Gilmer et al. (2001, 2002), кроме того, описывают характеристики гидролиза и биологические действия изосорбид-мононитрата-аспирината (ISMNA) и изосорбид-диаспирината (ISDA). Сложный диаспиринатный эфир ISDA и сложные гликольамидные эфиры Nielsen и Bundgaard являются единственными сложными эфирами в химической литературе, которые могут до значительной степени действовать как пролекарства аспирина в плазме человека. Соединения, не продуцирующие аспирин в качестве продукта гидролиза, лучше классифицировать как пролекарства салициловой кислоты. Например, в настоящем контексте ISMNA представляет собой пролекарство аспирина только в ткани кролика, но представляет собой пролекарство салициловой кислоты в крови человека. Имеется насущная потребность в улучшенных соединениях, являющихся пролекарствами аспирина,благодаря его собственному терапевтическому потенциалу и благодаря потребности в соединениях, способных высвобождать как аспирин, так и оксид азота. Высвобождающий оксид азота сложный эфир аспирина должен в первом случае представлять собой сложный эфир, способный подвергаться преобразованию в аспирин в ключевой модели гидролиза в плазме. В частности, желательно получение соединений как пролекарств аспирина, которые противостоят водному гидролизу и -химотрипсину, при этом они будут подвергаться быстрому гидролизу в присутствии плазмы человека с высвобождением аспирина и, возможно, других фармакологически активных остатков, в частности оксида азота. Сущность изобретения В соответствии с настоящим изобретением предусматривается соединение изосорбид аспиринат,имеющее общую структуру, как показано в общей формуле (I) где OR представляет собой -OC(O) C1-С 7 алкильную группу, -OC(O) C1-С 7 алкоксигруппу, -ОС(О) С 3-С 9 циклоалкильную группу или -OC(O)C1-С 7 циклоалкоксильную группу; которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат, никотинат, изоникотинат, оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1 С 8 алкила, C1-С 8 алкокси, бензилокси, -NHC(O)R', -NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил; и его фармацевтически приемлемая соль и/или его гидраты. Используемый в настоящем описании термин "алкил" включает любую из ряда одновалентных групп общей формулы RC(O)R или, более конкретно, -ОС(О)CnH2n+1, которая представляет собой сложный эфир, полученный из алифатических углеводородов. Алкильные цепи цепей сложных алкиловых эфиров могут быть прямыми или разветвленными, при этом метильная группа (-СН 3) представляет собойC1 алкильную группу, этил (-С 2 Н 5) представляет собой С 2 алкильную группу, пропил (-С 3 Н 7) представляет собой С 3 алкильную группу, бутил (-С 4 Н 9) представляет собой С 4 алкильную группу и пентил (-С 5 Н 7) представляет собой С 5 алкильную группу. Термин "сложный алкоксиэфир" включает группу, имеющую общую формулу RC(O)OR или, более конкретно, -ОС(О)OCnH2n+1, где CnH2n+1 представляет собой алкильную цепь, которая может быть прямой или разветвленной, где метильная группа (-СН 3) представляет собой C1 алкильную группу, этил (-С 2 Н 5) представляет собой С 2 алкильную группу, пропил (-С 3 Н 7) представляет собой С 3 алкильную группу, бутил (-С 4 Н 9) представляет собой С 4 алкильную группу и пентил (-С 5 Н 7) представляет собой С 5 алкильную группу. Термин "сложный циклоалкиловый эфир" означает, что группа CnH2n+1 указанной выше формулы представляет собой циклическую алкильную группу, такую как циклопропан, циклобутан, циклопентан и т.д. Термин "сложный ариловый эфир" используется для обозначения RC(O)Ar, где Ar представляет собой любую функциональную группу или заместитель, полученный из простого ароматического кольца,например бензольного кольца, толуола, ксилола, бензойной кислоты, бензоата, никотината, хлорбензола или других галогенбензольных групп. Термин "сложные эфиры 5-членных гетероциклических колец" представляет собой любую сложноэфирную функциональную группу, представленную -С(О)ORring, где Rring представляет собой 5-членное ароматическое или неароматическое 5-членное кольцо, имеющее по меньшей мере один гетероатом, замещающий атом углерода кольцевой системы. Соответствующим образом группы Rring могут быть выбраны из группы, состоящей из тиофенов, тиадиазолинов, пирролов, имидазолов, тиазолов, пиразолов,4,5-дигидропирролов, имидазолидин-2-онов, пиразинов, 4,5-дигидротиофенов и имидазолидин-2-тионов. Предпочтительные Rring представляют собой гетероциклические кольца Предпочтительные группы -C(O)ORring по настоящему изобретению представляют собой изооксазолоат, оксазолоат или тиадиазолоат. Соответственно все эти соединения активно высвобождают аспирин в плазму человека до некоторой степени. Некоторые из соединений, как показано, имеют лучшую активность, чем другие соединения, в то время как некоторые соединения имеют меньшую активность, в зависимости от природы заместителя, выбранного в качестве Y. Некоторые из соединений высвобождают NO в дополнение к аспирину. Соответственно предпочтительные соединения по настоящему изобретению имеют активность,равную или большую чем 15% аспирина, высвобождаемого в плазму человека. Группа, высвобождающая оксид азота из соединений, описанная здесь, может содержать сложный нитратный эфир, сложный С 1-С 8 алкилнитратный эфир, сложный С 3-С 10 циклоалкилнитратный эфир или сложный C1-C8 алкилнитратный эфир. Однако наиболее предпочтительными являются соединения, имеющие сложные эфиры, содержащие 5-членные гетероциклические кольца, которые могут быть выбраны из группы, состоящей из оксазолоата, изоксазолата и тиадиазолоата. В настоящем описании раскрыто соединение изосорбид аспиринат, имеющее формулу (I) где OR представляет собой -OC(O) C1-С 7 алкильную группу, -OC(O) C1-С 7 алкоксигруппу, -ОС(О) С 3-С 9 циклоалкильную группу или -OC(O) C1-С 7 циклоалкоксильную группу, которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат, никотинат, изоникотинат, оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, С 1 С 8 алкила, C1-С 8 алкокси, бензилокси, -NHC(O)R', -NH2, -NO2, -(CH2)nONO2, OC(O)[(CH2)m]cyclicONO2, OCOArONO2, -OCOAr(CH2)nONO2 или сложноэфирной C1-C5 галогеналкильной группы, -OCOAr, где R' представляет собой C1-С 8 алкильную группу или C1-С 8 алкоксильную группу, n=l-8, m=3-10, и Ar представляет собой фенил; Конкретно, предпочтительные соединения включают соединение изосорбид аспиринат, имеющее общую структуру, как показано в общей формуле (I) где X и Y независимо выбраны из О, S и N. В другом варианте осуществления предусматривается соединение, которое имеет общую структуру,как показано в общей формуле (I) где OR представляет собой -OC(O) C1-С 7 алкильную группу, -OC(O) C1-С 7 алкоксигруппу, которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат, никотинат, изоникотинат, оксазолоат, изоксазолоат или тиадиазолоат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1 С 8 алкила, С 1-С 8 алкокси, бензилокси, -NHC(O)R', -NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил. Другие предпочтительные соединения иллюстрируются общей структурой, как показано в общей формуле (I) где OR представляет собой -OC(O) C1-С 7 алкильную группу, -OC(O) C1-С 7 алкоксигруппу, -ОС(О) С 3-С 9 циклоалкильную группу или -ОС(О) С 1-С 7 циклоалкоксильную группу; которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, -Cl, -Br, C1-С 8 алкила, C1-C8 алкокси, бензилокси, -NHC(O)R', NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил. Другие предпочтительные соединения иллюстрируются общей структурой, как показано в общей формуле (I)-ОС(О) С 1-С 7 циклоалкоксильную группу; которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1-С 8 алкила, C1-С 8 алкокси, бензилокси, -NHC(O)R', NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил. Дополнительные предпочтительные соединения иллюстрируются общей структурой, как показано в общей формуле (I) где OR представляет собой -OC(O) C1-С 7 алкоксигруппу, которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1-С 8 алкила, C1-С 8 алкокси, бензилокси, -NHC(O)R', NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил. В предпочтительном варианте осуществления соединение изосорбид аспиринат может иметь общую структуру, как показано в общей формуле (I) где OR представляет собой -ОС (О) С 1-С 7 алкильную группу или -OC(O) C1-С 7 алкоксигруппу, которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, Br, C1-С 8 алкила, C1-C8 алкокси, бензилокси, -NHC(O)R', NH2, -NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=l-8, и Ar представляет собой фенил. Когда на арильном кольце используют бензилокси в качестве заместителя, предпочтительно чтобы он представлял собой заместитель о-бензилокси. В конкретном предпочтительном варианте осуществления соединение может иметь общую структуру, как показано в общей формуле (I) где OR представляет собой -OC(O) C1-С 7 алкильную группу, которая может быть незамещенной или замещенной ONO2; илиR представляет собой бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из: гидроксида, C1-С 8 алкила, С 1-С 8 алкокси, бензилокси, -NHC(O)R', -NH2, NO2, -(CH2)nONO2, -OCOAr, где R' представляет собой C1-C8 алкильную группу, n=1-8, и Ar представляет собой фенил. Когда на арильном кольце используют бензилокси в качестве заместителя, предпочтительно чтобы он представлял собой заместитель о-бензилокси. Еще в одном варианте осуществления соединения могут иметь общую структуру, как показано в общей формуле (I) где R представляет собой незамещенную или замещенную бензоатную или никотинатную группу,которая может быть замещена по меньшей мере одним гидроксидом, C1-C8 алкилом, С 1-С 8 алкилокси, обензилокси или -(CH2)nONO2 (n=l-8). Когда на соединении находится бензилокси в качестве заместителя,предпочтительно чтобы он представлял собой о-бензилокси. Соответствующим образом, соединения по настоящему изобретению могут иметь общую структуру, как показано в общей формуле (I) где R представляет собой незамещенную или замещенную бензоатную или никотинатную группу,которая может быть замещена по меньшей мере одним гидроксидом, C1-C8 алкилом, C1-С 8 алкилокси, обензилокси или -(CH2)nONO2 (n=1-8). Соответственно соединения по настоящему изобретению имеют высокую степень комплементарности к активному центру карбоксилэстераз человека и, таким образом, направляют гидролиз по идеальному пути высвобождая аспирин. Преимущественно соединения могут быть конкретно активированы более чем одним ферментом человека, поскольку если пациент имеет аберрантное функционирование фермента по отношению к одному из них, другой, вероятно, компенсирует это и высвободит аспирин. Кроме того, соединения как пролекарства аспирина являются стабильными при условиях, обнаруживаемых в просвете желудочно-кишечного тракта, но быстро разрушаются при поглощении в потоке крови до аспирина. Дополнительные преимущества возникают от этих соединений, поскольку они являются стабильными по отношению к влаге, и это может быть успешно использовано в препаратах, где может встретиться влага. Стабильное по отношению к влаге пролекарство аспирина является преимущественным по многим причинам, включая возможность получения в форме раствора и в трансдермальной форме. Одна из проблем с трансдермальной доставкой аспирина состоит в том, что влага из кожи вызывает гидролиз аспирина, находящегося в пластыре. Соответственно соединения, стабильные по отношению к влаге, не потребуют влагонепроницаемой фармацевтической упаковки для хранения. В предпочтительном варианте осуществления группа R может быть выбрана из группы, состоящей из Соединения по настоящему изобретению, когда R в общей формуле (I) представлен любой из этих конкретных структур, высвобождают аспирин из плазмы человека до некоторой различной степени и,таким образом, все они являются активными. Однако соединения, имеющие заместитель R, выбранный из группы, состоящей из являются особенно предпочтительными, поскольку соединения, включающие любое соединение из этих групп, показывают активности, равные или больше чем 15% высвобождения аспирина в плазме человека. В другом предпочтительном варианте осуществления соединения по настоящему изобретению включают те, которые имеют активности высвобождения аспирина, равные или больше чем уровень 15%, в расчете на количество аспирина в виде процента от начальной концентрации сложного эфира в молях, измеренного с помощью ВЭЖХ на пике продуцирования аспирина, после добавления потенциальных сложных эфиров в забуференную плазму крови человека при 37 С и рН 7,4 (фосфатный буфер). В конкретных вариантах осуществления соединения могут иметь общую структуру, как показано в общей формуле (I) где R представляет собой незамещенный или замещенный бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, метила, бензилокси, метокси, NHC(O)CH3, -OC(O)CH2Br, -NO2, -OAc, CH2ONO2. Когда на арильном кольце используют бензилокси в качестве заместителя, предпочтительно чтобы он представлял собой заместитель о-бензилокси. В конкретном варианте осуществления соединения могут иметь общую структуру, как показано в общей формуле (I) где R представляет собой незамещенный или замещенный бензоат или никотинат, который может быть замещен по меньшей мере одной группой, состоящей из гидроксида, Cl, метила, бензилокси, метокси, -NHC(O)CH3, -OC(O)CH2Br, -NO2, -CH2ONO2. Когда на арильном кольце используют бензилокси в качестве заместителя, предпочтительно чтобы он представлял собой заместитель о-бензилокси. Наиболее предпочтительные изосорбид-аспиринатные соединения имеют одну из следующих структур Альтернативно, соединение изосорбид аспиринат может иметь любую из структур, выбранных из группы, состоящей из Преимущественно соединения по настоящему изобретению, являющиеся пролекарствами аспирина,противостоят водному гидролизу и -химотрипсину, подвергаясь при этом быстрому гидролизу в присутствии плазмы человека с высвобождением аспирина и, потенциально, других фармакологически активных остатков. Предпочтительные соединения по настоящему изобретению высвобождают оксид азота в дополнение к аспирину. Таким образом, в этом аспекте соединения по настоящему изобретению являются преимущественными, поскольку они обеспечивают лучшие соединения, являющиеся пролекарствами аспирина, в частности пролекарственное соединение, способное высвобождать как аспирин, так и оксид азота. Пролекарственные средства, способные к высвобождению как аспирина, так и оксида азота (NO), являются особенно преимущественными. Такие соединения, вероятно, будут менее токсичными, но будут иметь больший спектр фармакологических действий и эффективность, чем отдельные их компоненты, поскольку аспирин и оксид азота обладают синергическим действием в применениях при сердечнососудистом заболевании и раке. Сложный эфир аспирина, высвобождающий оксид азота, должен в первом случае представлять собой сложный эфир, способный подвергаться преобразованию в аспирин в ключевой модели гидролиза в плазме или в сходной биологически релевантной модели. Носители, раскрытые в настоящем описании,могут иметь группу, высвобождающую оксид азота, которая содержит сложный нитратный эфир, сложный C1-C8 алкилнитратный эфир, сложный С 3-С 10 циклоалкилнитратный эфир или сложный C1-C8 алкилнитратный эфир. Дополнительные преимущества получают от того факта, что пролекарства по настоящему изобретению являются стабильными в присутствии типичных переваривающих протеаз и по отношению к ферментам, находящимся в клетках САСО-2 слизистых оболочек, но могут гидролизоваться до аспирина с помощью эстераз человека, в частности BuChE и СЕ-2. Соответственно соединения-носители по настоящему изобретению направляют гидролиз в нужное место благодаря их комплементарности к активным центрам эстераз человека. В другом аспекте настоящего изобретения предусматривается лекарственное соединение, содержащее соединение-носитель, как описано в настоящем документе. Еще в одном аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую соединение, определенное выше, и по меньшей мере один фармацевтически приемлемый носитель или эксципиент. В конкретном аспекте соединения и/или композиции по настоящему изобретению могут быть использованы in-vivo или in-vitro для уменьшения конститутивного экспрессирования гликопротеинов тромбоцитов на том уровне, где аспирин не оказывает действия. Соединения и/или композиции по настоящему изобретению можно также использовать in-vivo илиin-vitro для индуцирования аспириноподобного действия. Аспириноподобным действием является, например, понижение антитромбоцитной активности или ингибирование продуктов СОХ, таких как тром- 11022878 боксан А 2 или малондиальдегид. Преимущественно предпочтительные соединения по настоящему изобретению являются более действенными, чем сам аспирин, и являются лучшими ингибиторами агрегации тромбоцитов человека и лучшими ингибиторами продуктов, образующихся после СОХ (таких как тромбоксан А 2 и малондиальдегид), а также конститутивного экспрессирования гликопротеинов тромбоцитов. В другом аспекте соединения по настоящему изобретению могут быть использованы для получения лекарственного средства для лечения заболеваний, или состояний, или симптомов, включая сердечнососудистые и цереброваскулярные расстройства, боль, повышенную температуру, воспаление, рак, болезнь Альцгеймера или деменцию. Аспирин вызывает желудочное кровотечение путем химического раздражения клеток кишечной стенки во время поглощения и путем влияния на секрецию их защитного барьера. Решение этой проблемы состоит в том, чтобы сделать аспирин временно инертным путем химического присоединения маскировочной группы, которая удаляется позже в процессе поглощения, вдали от чувствительной поверхности желудочно-кишечного тракта. Ключевой проблемой при разработке этой технологии является нахождение маскировочной группы, которая предсказуемо и точно удаляется в крови, препятствие, которое еще никто не преодолел. По существу, настоящее изобретение предусматривает инертную форму аспирина, которая активируется в организме. При дальнейшем усовершенствовании разработки в группу-носитель был включен предшественник оксида азота для создания дополнительных соединений, которые высвобождают NO вместе с аспирином. Такие двойные пролекарства, следовательно, потенциально вмешиваются в патологические процессы на двух различных уровнях. Нитроаспириновый подход становится широко принятым, но технология, описанная в настоящем документе, представляет собой единственную технологию, которая доказуемо продуцирует как аспирин, так и NO в тканях человека. Гидролиз изосорбид-диаспирината (ISDA, 16 в табл. 2) в крови человека исследуют для обнаружения того, как он продуцирует аспирин. Изосорбид-диаспиринат (ISDA, 16) имеет четыре сложноэфирные группы, по одной, расположенной на каждом из двух аспириновых остатков, и по одной, соединяющей каждый из этих остатков с изосорбидным ядром. Прямая интерпретация данных по продуцированию аспирина заключается в том, что один из двух сложных аспиринатных эфиров в положениях 2 или 5 отсоединяется под действием эстераз непосредственно от ISDA, высвобождая аспирин. Это частично верно, но реальный механизм обещает быть более интересным и неожиданным. Четыре сложноэфирные группы в ISDA склонны к гидролизу под действием эстераз с потенциально сложным рядом сложноэфирных метаболитов. В конечном счете,все они гидролизуются до изосорбида и салициловой кислоты. Каскад гидролиза можно отслеживать с помощью хроматографии, которая делает возможным разделение и измерение каждого из метаболитов,когда они выделяются и разрушаются. Было проведено множество экспериментов, в которых ISDA вводили в биологическую среду, реакцию останавливали в последовательные моменты времени и смесь метаболитов измеряли методом ВЭЖХ. График зависимости этих данных от времени называют кривой хода гидролиза. Кривые хода для ISDA представлены на фиг. 3 А и 3 В. Кривые показывают исчезновениеISDA и появление аспирина с течением времени. Тщательное изучение этих кривых обнаруживает два факта: во-первых, концентрация аспирина продолжает расти после исчезновения исходного ISDA, и, вовторых, его пик следует за ростом и исчезновением других метаболитов. Это представляет собой неожиданные и очень важные данные, показывающие, что аспирин, который появляется после добавления ISDA в плазму человека, может высвобождаться не из самого ISDA, но скорее из метаболита ISDA. Таким образом, все потенциальные метаболиты ISDA независимо синтезируются и оцениваются с помощью ВЭЖХ как пролекарства аспирина путем инкубирования их в плазме и отслеживания их гидролиза с помощью ВЭЖХ. Один из них, изосорбид-2-аспиринат-5-салицилат (ISAS, 2), видимо, является наиболее эффективным пролекарством, известным к настоящему времени, в ключевой модели плазмы человека(фиг. 4 А и В). В плазме человека он превращается по большей части в аспирин вместе с носителем изосорбид-5-салицилатом. Он гидролизуется почти исключительно по этому пути в очищенном раствореBuChE (фиг. 4 В). Общие результаты показывают, что изосорбид-диаспиринат (ISDA, 16) действует в качестве предшественника подлинного пролекарства аспирина, его метаболита изосорбид-2-аспиринат-5-салицилата(ISAS, 2). Обнаружено, что BuChE плазмы человека сначала селективно удаляет ацетильную группу аспирината из изосорбид-диаспирината (ISDA), который присоединяется в положении 5, образуя, таким образом, изосорбид-2-аспиринат-5-салицилат (ISAS). Затем BuChE человека эффективно отсоединяет аспирин от изосорбид-2-аспиринат-5-салицилата (ISAS). ISDA подвергается гидролизу по другим параллельным путям (фиг. 5 представляет собой упрощенную версию этого процесса, для ясности), и он не метаболизируется эффективно до аспирина, как изосорбид-2-аспиринат-5-салицилат (ISAS), и не является,как обнаружено при биологических анализах, таким же действенным. ISAS имеет долю высвобождения аспирина в плазме 85% (t1/2=2 мин), в то время как ISDA гидролизуется примерно на 60% по аспириновому пути, при этом остальные 40% проходят по непродуктивному салицилатному пути. На самом деле,- 12022878 поскольку ISDA имеет две присоединенные молекулы аспирина, его общий выход в самом строгом смысле равен 30%. Используя конкретные ингибиторы ферментов и очищенные растворы ферментов,можно однозначно установить фермент в плазме человека, ответственный за уникально точное активирование ISAS, как бутирилхолинэстеразу (см., например, фиг. 5). Изосорбид-2-аспиринат-5-салицилат (ISAS) не описывается в международной публикацииWO9817673. Хотя потенциально он является метаболитом, никто не ожидал, что он будет пролекарством. Другие реальные или потенциальные метаболиты ISDA (например, 5-аспиринат, 2-аспиринат или 2 салицилат-5-аспиринат), каждый, синтезированы и охарактеризованы. Ни один из них не действует в качестве пролекарств аспирина в плазме человека. Преимущественно ISAS (2) является значительно более действенным, чем аспирин, в качестве ингибитора агрегации тромбоцитов человека, индуцируемой коллагеном (фиг. 6), АДФ и арахидоновой кислотой, и он соответственно ингибирует продукты, получаемые после СОХ, включая тромбоксан А 2 и малондиальдегид. Он также замедляет конститутивное экспрессирование гликопротеинов тромбоцитов при таких концентрациях, при которых аспирин не оказывает действия. Более высокая активность изосорбид-2-аспиринат-5-салицилата (ISAS), чем у аспирина, хотя и желательная с точки зрения разработки лекарственного средства, является непонятной и представляет собой объект дальнейших исследований. Показано также, что изосорбид-2-аспиринат-5-салицилат (ISAS) должен активироваться эстеразами для оказания своих фармакологических действий: он не имеет собственной биологической активности и поэтому является пролекарством. Хотя ISAS подвергается гидролизу в крови человека с временем полужизни 2 мин, он является стабильным в присутствии типичных переваривающих протеаз и по отношению к эстеразам, находящимся в клетках САСО-2. Он ингибирует агрегацию тромбоцитов в направлении арахидоновой кислоты в цельной крови человека (метод импеданса) с IC50, равной 17 мкМ. IC50 аспирина в этой модели составляет 25 мкМ. ISAS является также эффективным для предотвращения синтеза ТХА 2in vivo (ТХВ 2/цельная кровь) и синтеза MDA отмытыми тромбоцитами. Ферментативные исследования показывают, что изосорбид-2-аспиринат-5-салицилат (ISAS) специфично активируется двумя ферментами человека: BuChE в плазме человека, и менее быстро, но на том же пути, отношением А/В карбоксилэстеразы-2 человека (СЕ-2), присутствующей в микросомах желудочно-кишечного эпителия. То наблюдение, что высвобождать аспирин из изосорбид-2-аспиринат-5 салицилата (ISAS) могут два фермента, является клинически важным и преимущественным, если пациент имеет аберрантное функционирование фермента по отношению к одному из них, другой с вероятностью компенсирует это и высвободит аспирин. Другое преимущество этой конструкции состоит в том,что соединение является стабильным при условиях, встречающихся в просвете желудочно-кишечного тракта, но быстро разрушается после поглощения на хорошо характеризуемые метаболиты: салициловую кислоту, изосорбид и, разумеется, аспирин (подобие предпочтений к субстрату в этом отношении со стороны СЕ-2 и BuChE является очень неожиданным). Дополнительным преимуществом соединения является то, что его носитель метаболизируется, по существу, до салициловой кислоты и изосорбида, соединений, которые являются либо нетоксичными, либо хорошо характеризуемыми фармацевтически. ХотяISAS обладает значительными фармацевтическими достоинствами сам по себе, его обнаружение выглядит несколько более важным в целом. Обнаружение ISAS и кинетических моделей для его получения и высвобождение аспирина в плазме описано в недавней статье авторов (Moriarty et al. 2008). Изосорбид-2-аспиринат-5-салицилат (ISAS) действует в качестве пролекарства аспирина, поскольку изосорбид-5-салицилатная часть молекулы пролекарства имеет высокую степень комплементарности к активному центру карбоксилэстераз человека. Это является причиной того, что он подвергается очень быстрому гидролизу. Изосорбид-5-салицилатная часть или группа-носитель ISAS успешно содействует своему собственному отделению от аспирина, подавляя в то же время гидролиз ацетильной группы аспирина. Это вводит в употребление новый и очень эффективный тип носителя для аспирина и, потенциально, для других лекарственных средств на основе карбоновых кислот. Это является важным аспектом настоящего изобретения. Возникает вопрос относительно того, имеется ли возможность изменения структуры изосорбид-5 салицилата для улучшения фармацевтических характеристик, в то же время сохраняя его комплементарность к эстеразе. Кроме того, имеется доказательство того, что структура замещения в положении 5 является решающей для высвобождения аспирина, поскольку ISMNA (в котором 5-салицилат заменен нитратом) не является пролекарством аспирина в плазме человека. Вывод заключается в том, что 5-нитрат не является совместимым с продуктивным связыванием с эстеразой человека. Получили приблизительно 25 соединений, в которых положение 5 систематически изменено для исследования влияния 5-группы на характеристики высвобождения аспирина для группы-носителя (фиг. 7 и табл. 2). Новые сложные эфиры аспирина исследуют, инкубируя их в растворе плазмы человека и измеряя количества продуцируемого аспирина по отношению к молярному количеству соединения, добавленного в раствор плазмы. Сложные эфиры подвергаются характерному быстрому гидролизу до различной степени по путям А и В, некоторые со скоростями высвобождения, достигающими производительности ISAS (табл. 2 и фиг. 7). Характеристики высвобождения аспирина набора из 25 сложных эфиров показаны в табл. 2 вместе с некоторыми выбранными примерами в виде структурных формул с процентом высвобождения аспирина на фиг. 7. Показано, что группа в 5-положении заметно влияет на направление гидролиза (фиг. 8 и примеры на фиг. 9). Незамещенное соединение (изосорбид-2-аспиринат, 17) не является пролекарством аспирина, указывая, что для высвобождения аспирина требуется 5-замещение. Как правило, обнаруживают, что значительное высвобождение аспирина осуществляется с помощью сложных 5-бензоатных и никотинатных эфиров. Доминантный центр гидролиза в случае соединений, замещенных сложными алифатическими эфирами, представляет собой обычный сложный ацетиловый эфир (см. соединения 4, 5, 23 в табл. 2). Обнаружено также, что сложные ариловые эфиры, у которых фенильная группа замещена в 2- и 3 положениях, являются наиболее продуктивными. Например, соединение 1 подвергается гидролизу по продуктивному аспириновому пути примерно до 60%. Наиболее эффективное обнаруженное соединение представляет собой ISAS, который подвергается почти полному преобразованию в аспирин в присутствии очищенной бутирилхолинэстеразы и примерно на 80% в крови человека. Изосорбид-2-аспиринат-5-салицилат (ISAS, 2), метаболит ISDA, принадлежит к новому семейству соединений сложных замещенных 5-ароматических эфиров, которые действуют в качестве пролекарств аспирина в присутствии эстераз человека. Неизвестно, почему бензоатные соединения, дополнительно замещенные в орто- или мета-положении, являются настолько успешными, но, вероятно, это связано с подходящим расположением на активном центре фермента. Этот вид удаленного контроля положения действия фермента является необычным. Таким образом, обнаружено, что определенные несущие группы на основе изосорбида ускоряют гидролиз в нужном месте, приводя к высвобождению аспирина в крови человека (b, выше). Определенные замещенные изосорбидные соединения высвобождают аспирин в значительных количествах, когда инкубируются в крови человека. Селективный гидролиз вызывается высокоспецифичным взаимодействием между несущей группой и бутирилхолинэстеразой человека, присутствующей в плазме, и с СЕ-2 в кишечном эпителии. То наблюдение, что сложные изосорбидные эфиры аспирина могут действовать как пролекарства аспирина при условии, что 5-положение замещено соответствующим образом, является решающим для настоящего изобретения. Наиболее эффективные заместители представляют собой сложные 5-ариловые эфиры, которые дополнительно замещаются в 2- или 3-положении бензольного кольца. Такие группы ускоряют высвобождение аспирина в удаленном изосорбид-2-положении вместо гидролиза ацетильной группы. Соединение 2 является наиболее эффективным и наиболее исследованным из пролекарств, и оно приводит к идентификации нового эффективного класса носителей для пролекарств аспирина. Однако настоящее изобретение включает и предполагает другие соединения, иначе замещенные в положении 5,но также эффективно преобразуемые в аспирин в присутствии ферментов плазмы крови. В частности,вызывает большой коммерческий и академический интерес пролекарственное средство, способное высвобождать как аспирин, так и оксид азота, NO. Поскольку структурные требования к продуктивному гидролизу (или к направлению в пределах активного центра эстеразы) идентифицированы, проблема разработки как пролекарства аспирина, так и оксида азота остается. SAR говорит о том, что несущая группа изосорбид-5-бензоата могла бы выдержать дополнительное замещение нитратом на бензольном кольце без влияния на его характеристики управления гидролизом. К сожалению, ароматические нитраты представляют собой нестабильные сложные нитратные эфиры фенола, которые легко диспропорционируются до орто-нитрофенола. Вместо этого был получен ряд нитроксиметильных производных изосорбид-2-аспиринат-5-бензоата, которые соответствуют структуре, представленной ниже, они включают соединения 20-23 в табл. 2. Их исследовали в ключевой модели гидролиза в плазме человека на способность продуцировать аспирин в плазме человека. В соответствии с предыдущей структурой обнаружено, что орто- и метазамещенное нитроксиметильное соединение высвобождает аспирин в плазму человека. Высвобождения аспирина из паразамещенного соединения не происходит. Успешные соединения также высвобождают значительные количества аспирина в присутствии желудочно-кишечных микросом человека, что явно опосредуется ферментом СЕ-2, и следуя такой же структуре, какую дает ISAS (фиг. 9). Преимуществом этого является то, что, когда пациент имеет низкую активность BuChE, фермент СЕ-2 мог бы высвобождать аспирин вместе с остатком, являющимся донором оксида азота. Соединение 20 исследовали на индуцируемую коллагеном агрегацию тромбоцитов in vitro, и, как обнаружено, оно является более действенным, чем аспирин, при ингибировании агрегации. Оно также является более активным ингибитором АДФ-индуцированной агрегации тромбоцитов в PRP. Однако поскольку оно также высвобождает NO, то ожидается, что оно будет ингибировать агрегацию относительно патологических стимулов, на которые аспирин не действует. Аспирин ингибирует только тромбоксанзависимую агрегацию, то есть агрегацию тромбоцитов только для одного стимула. Он имеет небольшое влияние на агрегацию при высоких дозах коллагена или на агрегацию в присутствии АДФ. Оксид азота, как показано, ослабляет желудочную токсичность аспирина и способствует заживлению язв. Соединения, способные высвобождать как аспирин,так и оксид азота, обладают значительным потенциалом для предотвращения, терапии рака и при лечении сердечно-сосудистых заболеваний. Активирование интегринового рецептора гликопротеинаGPIIb/IIIa является решающим для осуществления агрегации тромбоцитов. В дополнение к этому транслокация Р-селектина из -гранул на поверхностную мембрану тромбоцитов лежит в основе адгезии тромбоцитов соответственно. Авторами определены эти рецепторы при агрегации с различными концентрациями соединений. Фиг. 32-36 показывают, что npo-asa и нитро-asa существенно уменьшают активирование GPIIb/IIIa и транслокацию Р-селектина. Активирование GPIIb/IIIa контролирует динамическое взаимодействие путей, которые стимулируют или ингибируют агрегацию. Оксид азота опосредует главный ингибиторный путь и регулирует функционирование GPIIb/IIIa. Аспирин не может ингибировать активирование тромбоцитов при такой же концентрации подобно ISAS (2) или/и нитратным соединениям 31-32. Настоящее изобретение также предусматривает фармацевтические композиции, содержащие соединение по настоящему изобретению, которое может быть адаптировано для перорального введения в виде капсулы или таблетки или для чрескожного введения, например в форме трансдермального пластыря. Композиция может также быть в форме суппозитория или препарата на водной основе. Настоящее изобретение также предусматривает использование соединения для достижения противотромбоцитной активности и/или других типов активности аспирина, таких как антипиретическая и/или противовоспалительная активность. В особенно предпочтительном варианте осуществления настоящего изобретения композиция содержит другие фармацевтические компоненты, в частности терапевтическое масло, обычно рыбий жир,такой как жир печени трески, или растительное масло, такое как масло примулы. В этом случае композиция может быть в форме капсулы, имеющей удерживающую оболочку, содержащую наполнитель,включающий активные ингредиенты. Наполнитель может содержать суспендирующий агент, такой как агент, выбранный из одного или нескольких веществ, таких как коллоидный диоксид кремния, гидрированные растительные масла (необязательно, в сочетании с пчелиным воском), частично расщепленные глицериды с высокой температурой плавления и/или лецитины. Наполнитель может также включать антиоксидант, такой как антиоксидант, выбранный из одного или нескольких соединений, таких как Dальфа токоферол, D-альфа токоферола ацетат, смешанные токоферолы и аскорбиновая кислота. Оболочка может представлять собой желатиновую оболочку. Краткое описание чертежей Фиг. 1 - теория устранения токсичности аспирина. Фиг. 2 - успешное пролекарство аспирина должно подвергаться гидролизу на сложном эфире В с большей скоростью, чем на О-ацетильной группе А. Фиг. 3 А и 3 В - кривая хода гидролиза ISDA в 10% плазме человека (рН 7,4, 37 С): показывает концентрацию исходного вещества и некоторых его метаболитов, как измерено с помощью ВЭЖХ в последовательные моменты времени: ISDA , аспирина ( ), салициловой кислоты (о), изосорбид-2/5- 15022878 аспиринат-2/5-салицилата , изосорбида дисалицилатаи изосорбид-5-салицилата . Максимум аспирина задерживается по времени по отношению к исчезновению исходного ISDA, показывая, что за его продуцирование является ответственным метаболит. График построен повторно, при этом криваяISDA отсутствует. Фиг. 4 А. - кривая хода гидролиза изосорбид-2-аспиринат-5-салицилата ISAS (2) в 50% плазме человека (рН 7,4) при 37 С: ISAS , изосорбид дисалицилат , изосорбид-5-салицилат , аспирин ( ) и салициловая кислота (о). Фиг. 4 В - кривая хода гидролиза изосорбид-2-аспиринат-5-салицилата ISAS с помощью очищеннойBuChE сыворотки человека при рН 7,4 и 37 С: изосорбид-2-аспиринат-5-салицилат , изосорбид-5 салицилат , аспирин ( ), салициловая кислота (о) и изосорбид дисалицилат . Фиг. 5 - ISDA сначала подвергается гидролизу на ацетильной группе 5-аспирината (70%), высвобождая ISAS (2), который подвергается гидролизу в основном до аспирина и изосорбид-5-салицилата. Главные места продуктивного вмешательства холинэстеразы плазмы (BuChE) показаны красным цветом. Следует заметить, что это соединение является относительно стабильным по отношению к эстеразам. Происходит также гидролиз ISDA (30%) по параллельному непродуктивному пути, который высвобождает не аспирин, но вместо этого изосорбид и салициловую кислоту. Фиг. 6 - кривые концентрация-отклик, показывающие ингибирование коллагениндуцированной агрегации тромбоцитов человека in vitro под действием ISAS (2) и аспирина (ASA). Также показаны концентрации лекарственных средств, ингибирующие агрегацию на 50% (IC50,). ISAS является значительно более действенным, чем ASA, по отношению к агрегации (данные представляют собой среднее значениеS,D (среднеквадратичное отклонение) р 0,01, n=4). Фиг. 6 В показывает кривые относительного ингибирования для ISAS (2), пролекарств, высвобождающих оксид азота, 31, 32, 33 и аспирина. Фиг.6 показывает % агрегации PRP после инкубирования с ISAS, соединениями 31-33 или аспирином. Эта фигура показывает процент агрегации для коллагена, вместо процента ингибирования агрегации для коллагена,при трех различных концентрациях для пяти соединений, аспирина, ISAS и трех изомерных нитратов, 31,32, 33. (Р 0,05). Фиг. 7 - примеры альтернативных сложных 5-эфиров, инкубируемых в растворе плазмы человека,из табл. 2. Величины % представляют величину гидролиза, осуществляемого на центрах А, высвобождающих сложный салицилатный эфир, и на центре В, высвобождающем аспирин. Эта фигура иллюстрирует зависимость высвобождения аспирина в положении 2 от структуры сложного эфира в удаленном положении 5. Фиг. 8 - 5-заместитель R явно влияет на путь гидролиза. Фиг. 9 - показывает исчезновение изосорбид-2-аспиринат-5-(3-нитроксиметил)бензоата после инкубирования в присутствии микросом из кишечного эпителия человека и высвобождение аспирина, салициловой кислоты и нитратзамещенного изосорбидного носителя. Фиг. 10 - синтез ISAS 2 из ISMN посредством сочетания с защищенной салициловой кислотой с последующим дебензилированием. Фиг. 11 - способ синтеза для получения Is-2-аспиринат-5-(3-нитрооксиметил)бензоата 21. Фиг. 12 - способ синтеза для получения 2-хлорметилбензоилхлорида. Фиг. 13 - прямой синтез нитратзамещенных сложных 5-эфиров. Фиг. 14 - синтез сложного 3-нитроксибензоатного эфира изосорбид-2-аспирината посредством этерификации (образования сложного эфира) с помощью хлорметилбензоата и замены галогенида на нитрат серебра. Фиг. 15 - Is-2-аспиринат-5-салицилат (ISAS, 2) в HLM. Получено 9,4 мкМ аспирина. Фиг. 16 - Is-2-аспиринат-5-салицилат (ISAS, 2) (1,0410-4 М) в HIM. Получено 27 мкМ аспирина. Фиг. 17 - HLM инкубируют в течение 5 мин вместе с сильнодействующим ингибитором BuChE перед добавлением Is-2-аспиринат-5-салицилата (ISAS, 2). Получено 16 мкМ аспирина. Фиг. 18 - Is-2-аспиринат-5-салицилат (ISAS, 2) (11,110-4 М) в HLM с изо-ОМРА (10 мкМ). Получено 8,5 мкМ аспирина. Фиг. 19 - Is-2-аспиринат-5-салицилат (ISAS, 2) (1,0410-4 М) в HIM с BNPP (14 мкМ). Фиг. 20 - Is-2-аспиринат-5-(3-нитрооксиметил)бензоат (21) (2,510-4 М) в 50% плазме человека. Получено 26 мкМ аспирина. Фиг. 21 - Is-2-аспиринат-5-(3-нитрооксиметил)бензоат (21) (110-4 М) в 80% плазме человека. Получено 21 мкМ аспирина. Фиг. 22 - Is-2-аспиринат-5-(3-нитрооксиметил)бензоат (21) (110-4 М) в HLM с изо-ОМРА (14,4 мкМ). Получено 1,4 мкМ аспирина. Фиг. 23 - Is-2-аспиринат-5-(3-нитрооксиметил)бензоат (21) (1,0510-4 М) в HIM. Получено 20 мкМ аспирина. Фиг. 24 - Is-2-аспиринат-5-(3-нитрооксиметил)бензоат (21) (1,110-4 М) в HIM с изо-ОМРА (14 мкМ). Получено 12,7 мкМ аспирина.- 16022878 Фиг. 25 - Is-2-аспиринат-5-(2-нитроокси-метил)бензоат (20) (110-4 М) в 50% плазме человека. Получено 10,3 мкМ аспирина. Фиг. 26: Is-2-аспиринат-5-(2-нитрооксиметил)бензоат (20) (110-4 М) в HIM. Получено 21,7 мкМ аспирина. Фиг. 27 - Is-2-аспиринат-5-(4-нитроокси-метил)бензоат (22) (110-4 М) в 50% плазме человека. Получено 2 мкМ аспирина. Фиг. 28 - Is-2-аспиринат-5-(4-нитрооксиметил)бензоат (22) (110-4 М) в HIM. Получено 9,97 мкМ аспирина. Фиг. 29 - сложный фениловый эфир 2-ацетоксибензойной кислоты (сложный феноловый эфир аспирина) (1,0910-4 М) в HIM (40 мкг/мл). Получено 7,7 мкМ аспирина. Фиг. 30 - сложный фениловый эфир 2-ацетоксибензойной кислоты (1,0910-4 М) в HIM (20 мкг/мл). Получено 5,3 мкМ аспирина. Фиг. 31 - ингибирование агрегации тромбоцитов в ответ на АДФ in vitro с помощью пяти исследуемых соединений при трех различных концентрациях. Нулевая концентрация представляет собой ингибирование с помощью носителя, ДМСО. Фиг. 32 - экспрессирование PAC-I в ответ на коллаген в отмытых тромбоцитах, обработанных исследуемыми соединениями 2, 31-33, аспирином. Эта фигура показывает процент экспрессии гликопротеинов PAC-I в отмытых тромбоцитах. В этом препарате имеется немного эстеразы, так что данные иллюстрируют необходимость эстеразного активирования пролекарств по настоящему изобретению перед ингибированием функционирования тромбоцитов invitro. Фиг. 33 - экспрессирование PAC-I в ответ на коллаген в плазме, обогащенной тромбоцитами, с помощью исследуемых соединений 2, 31-33, аспирина. Эта фигура показывает степень экспрессии гликопротеинов в плазме, обогащенной тромбоцитами. Экспрессия гликопротеинов необходима для поперечной сшивки тромбоцитов при полной агрегации, и данные показывают, что соединения по настоящему изобретению являются более действенными, чем аспирин, при подавлении этой экспрессии в препарате плазмы. Фиг. 34 - экспрессия Р-селектина для коллагена в плазме, обогащенной тромбоцитами, с помощью исследуемых соединений 2, 31-33, аспирина. Р-селектин представляет собой другой гликопротеин, экспрессирование которого коррелирует с активированием тромбоцитов. Соединения по настоящему изобретению являются гораздо более действенными, чем аспирин, при ингибировании активирования тромбоцитов в препаратах плазмы. Фиг. 35 - экспрессия Р-селектина для коллагена в отмытых тромбоцитах с помощью исследуемых соединений 2, 31-33, аспирина. Здесь опять в отмытых тромбоцитах имеется некоторое замедление экспрессии гликопротеинов (значимое различие с коллагеном (Р 0,001). Однако в суспензиях отмытых тромбоцитов, в которых эстеразы отсутствуют, соединения не являются такими же эффективными, как аспирин. Подробное описание изобретения Общие экспериментальные подходы: материалы. 5-ISMN получают от Sifa Ltd. Очищенную бутирилхолинэстеразу сыворотки человека (ЕС 3.1.1.8),карбоксилэстеразу печени кролика (ЕС 3.1.1.1), BNPP (бис-4-нитрофенилфосфат), изо-ОМРА (тетраизопропилпирофосфорамид), собранные микросомы печени человека, 3-хлорметилбензоилхлорид, 4 хлорметилбензоилхлорид, нитрат серебра, фталид, дихлортрифенилфосфоран и растворители качества ВЭЖХ получают от Sigma-Aldrich. Коллаген и АДФ получают от Chronolog (Havertown, PA, U.S.A.). Аллофикоцианин (АРС)-конъюгированное моноклональное антитело против GPIIb/IIIa с высоким сродством (PAC-I-APC) и АРС-конъюгированное моноклональное антитело против Р-селектина тромбоцитов человека (CD62P) получают от BD Biosciences (Oxford, UK). Все другие растворители и реагенты имеют аналитическое качество. Собранные кишечные микросомы человека получают от BD Gentest в UK. Соединения по настоящему изобретению легко получают из изосорбид-мононитрата аспирината(ISMNA), который сам получают путем этерификации изосорбид-мононитрата (ISMN) с помощью ацетилсаликоилхлорида в соответствии с Gilmer et al. 2001. Нитрат селективно удаляют обработкой палладием на угле в атмосфере водорода, получая ключевое промежуточное соединение изосорбид-2 аспиринат. Соединения также могут быть получены путем селективной 5-этерификации изосорбида с последующим прикреплением аспиринатной группы в положении 2 (5-положение изосорбида, несмотря на то что оно является эндоположением, является более химически активным по отношению к ацилированию, чем 2-экзоположение, поскольку 5-ОН активируется с помощью внутримолекулярной Н-связи). В случае изосорбид-2-аспиринат-5-салицилата (ISAS) прямое ацилирование с помощью салициловой кислоты осложнялось бы конкуренцией между ОН салицилата и ОН изосорбида. Как следствие, защищенную простым бензиловым эфиром салициловую кислоту вводят первой, используя стандартную методику связывания с помощью DCC, а бензильную защиту удаляют при восстанавливающих условиях(фиг. 10). Другие сложноэфирные соединения по настоящему изобретению могут быть получены путем прямого ацилирования с использованием связывания с помощью DCC или путем обработки с помощью соответствующего хлорангидрида в присутствии третичного основания, такого как триэтиламин. Сложные нитроксизамещенные эфиры могут быть получены прямым связыванием с соответствующим образом замещенными кислотами. Альтернативно, нитроксизамещенные соединения могут быть получены сначала путем этерификации (образования сложного эфира) с помощью кислоты, несущей хлорид или бромид, который может быть впоследствии замещен нитратом путем обработки AgNO3 в ацетонитриле. Экспериментальные примеры: синтез сложных изосорбид-2-аспиринат-5-эфиров (молекулярные формулы приведены на фиг. 2). Изосорбид-2-аспиринат-5-[2-метилбензоат] 1. К раствору изосорбид-2-аспирината 17 (0,2 г, 0,65 ммоль) в дихлорметане (15 мл) добавляют триэтиламин (0,11 мл, 0,98 ммоль) и 2-толуоилхлорид (0,09 мл, 0,72 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, а затем промывают водой (225 мл), HCl (1 М, 25 мл) и насыщенным водным раствором NaHCO3 перед сушкой над безводным MgSO4. Растворитель удаляют в вакууме с получением 0,41 г неочищенного продукта в виде коричневого масла. Очистка колоночной хроматографией с использованием гексана и этилацетата (2:1) в качестве элюента дает продукт в виде желтого масла. Его перекристаллизовывают в этаноле с получением соединения 1 в виде белого твердого вещества (0,11 г, 39,6%) т.пл. 104-106 С. IRvmax (KBr): 2987,1 и 2922,8 (растяжение С-Н), 1762,0 и 1718,1Ar2C-4), 128,46 (Ar2C-2 и Ar2C-5), 130,19 (Ar2C-3), 133,78 (Ar1C-3), 140,08 (Ar2C-1), 150,26 (Ar1C-5),163,12 (ArOCOMe), 169,15 (ArCOOR). Изосорбид-2-аспиринат-5-салицилат, ISAS, 2. 2-Бензилоксибензойную кислоту (364,8 мг=1,6 ммоль) растворяют в сухом DCM (20 мл) и перемешивают. Добавляют Is-2-асп-5-ОН (500 мг=1,6 ммоль) и 10% DMAP. Колбу охлаждают до 0 С и добавляют DCC (340 мг, 1,6 ммоль). Перемешивание продолжают в течение 5 мин и температуре позволяют дойти до комнатной температуры, при этом смесь перемешивают в течение ночи. Реакционную смесь фильтруют и фильтрат промывают 0,1 М HCl, 5% NaHCO3 и водой, сушат над сульфатом натрия и выпаривают до масла. Его очищают с помощью колоночной хроматографии, гексан/этилацетат (2:1) с получением продукта белого цвета (Rf=0,4, 228 мг) . Его растворяют в смеси метанол/этилацетат (1:1). Добавляют Pd/C и перемешивают реакционную смесь в атмосфере водорода в течение ночи. Реакционную смесь фильтруют и концентрируют. Масло очищают с помощью колоночной хроматографии, используя смесь гексан/этилацетат (1:1) с получением твердого вещества белого цвета (107 мг, Rf=0,67). 1 Н ЯМР(CDCl3) 400 МГц: 2,38 (3 Н, с, ОСОСН 3), 4,02 (4 Н, м, ISH-I, ISH-I', ISH-6 и ISH-6'), 4,63(ISC-2), 80,69 (ISC-4), 85,70 (ISC-3), 117,30 (Ar2C-1), 118,90, 123,41, 125,65, 129,47, 131,42, 133,94, 135,65,150,24 (Ar1C-2), 163,12 (ArOCOCH3), 168,87 (ArC(O)OR). Изосорбид-2-аспиринат-5-[3-метилбензоат] 3. Изосорбид-2-аспиринат 17 (0,2 г, 0,65 ммоль) растворяют в толуоле (15 мл) при 0 С, к нему добавляют DCC (0,13 г, 0,65 ммоль) и DMAP (0,08 г, 0,07 ммоль). Через 10 мин реакционную емкость возвращают к комнатной температуре, добавляют 3-толуиловую кислоту (0,09 г) и дают перемешиваться в течение 24 ч. После промывки HCl (30 мл, 1 М), насыщенным водным раствором NaHCO3 (30 мл), насыщенным солевым раствором (30 мл) и водой (330 мл) реакционную смесь сушат над безводным Na2SO4 и удаляют растворитель в вакууме, получая неочищенный продукт в виде прозрачного масла. Очистка колоночной хроматографией с использованием гексана и этилацетата (3:2) в качестве элюента дает соединение 3 в виде белых кристаллов (0,12 г, 43,2%): т.пл. 96-98 С. IRvmax (KBr): 2987,1 и 2922,8 (растяжение С-Н), 1762,0 и 1718,1 (С=О), 1259,5 и 1199,8 (C(O)OR, ароматический), 1072,4 (С-О-С) см-1. 7,12 (1 Н, д, J=8,0 Гц, ArH-4), 7,35 (3 Н, м, ArH-2), 7,58 (1 Н, кв, J=1,0, 6,56 и 1,48 Гц, ArH-3), 8,01 (1 Н, дд,J=1,0 и 1,52 Гц, ArH-I). 13 С ЯМР м.д. (CDCl3): 20,42 (ArCH3), 20,79 (ОСОСН 3), 70,39 (ISC-1), 72,77 (ISC-6), 73,92 (ISC-5),78,19 (ISC-4), 80,66 (ISC-2), 85,66 (ISC-3), 122,35 (Ar1C-1), 123,39 (Ar1C-4), 125,57 (Ar1C-6), 126,45 (Ar1C2), 12,89 (Ar2C-4), 129,80 (Ar2C-5), 131,37 (Ar2C-3), 133,77 (Ar2C-1), 150,25 (Ar1C-5), 163,15 (ArOCOCH3),165,58 (ISOCOAr), 169,12 (ArOCO). Изосорбид-2-аспиринат-5-ацетат 4. К раствору изосорбид-2-аспирината 17 (0,2 г, 0,65 ммоль) в дихлорметане (20 мл) добавляют триэтиламин (0,09 мл, 0,65 ммоль) и уксусный ангидрид (0,06 мл, 0,65 ммоль). Реакционную смесь в емкости перемешивают при комнатной температуре в течение 24 ч перед промывкой водой (220 мл), HCl(1 М, 30 мл), насыщенным водным раствором NaHCO3 (30 мл) и сушкой над MgSO4. Растворитель удаляют на роторном испарителе с получением 0,52 г неочищенного продукта. Очистка колоночной хроматографией с использованием гексана и этилацетата (3:2) в качестве элюента дает соединение 4 в виде белого кристаллического вещества (0,1 г, 43,8%). Т.пл. 96-98 С. IRvmax (KBr): 2966,9 и 2928,6 (растяжение С-Н), 1751,6 и 1734,0 (С=О), 1607,8 (растяжение С=С), 1262,0 и 1193,9 (C(O)OR ароматический), 1082,5(ISC-5), 78,345 (ISC-3), 80,32 (ISC-1), 122,29 (ArC-5), 123,39 (ArC-1), 125,58 (ArC-3), 131,36 (ArC-2),133,81 (ArC-4), 154,32 (ArC-6), 167,15 (OCOAr), 168,48 (ArOCOCH3), 171,27 (OCOCH3). Изосорбид-2-аспиринат-5-пропионат 5. Изосорбид-2-аспиринат 17 (0,3 г, 0,98 ммоль) растворяют в дихлорметане (20 мл), к нему добавляют пропионовый ангидрид (0,14 мл, 1,07 ммоль) и триэтиламин (0,09 мл, 1,07 ммоль). Смеси дают перемешиваться при комнатной температуре в течение 24 ч перед промывкой HCl (30 мл, 1 М), насыщенным водным раствором NaHCO3 (30 мл) и водой (230 мл). Реакционную смесь сушат над безводным Na2SO4 и удаляют растворитель в вакууме с получением неочищенного продукта в виде масла желтого цвета(0,19 г). Очистка колоночной хроматографией с использованием гексана и этилацетата (5:2) в качестве элюента дает продукт в виде белых кристаллов (0,3 г, 84,3%): т.пл. 54-56 С. IRvmax (KBr): 2989,0 и 2933,0(1 Н, кв, J=5,04, 6,0 и 5,52 Гц, ISH-5), 5,43 (1 Н, д, J=3,0 Гц, ISH-2), 7,12 (1 Н, дд, J=1,0 и 1,0 Гц, ArH-4),7,33 (1 Н, т, J=1,0, 6,56 и 8,0 Гц, ArH-2), 7,59 (1 Н, т, J=6,0 и 6,52 Гц, ArH-3), 8,01 (1 Н, дд, J=1,48 и 2,0 Гц,ArH-1). 13 С ЯМР м.д. (CDCl3): 8,62 (СН 2 СН 3), 20,49 (СОСН 3), 26,84 (ОСОСН 2), 70,08 (ISC-2), 72,72 (ISC-6),73,32 (ISC-5), 78,12 (ISC-3), 80,37 (ISC-1), 85,45 (ISC-4), 122,22 (ArC-5), 123,41 (ArC-1), 125,64 (ArC-3),131,41 (ArC-2), 133,89 (ArC-4), 150,24 (ArC-6), 163,09 (OCOAr), 169,28 (ОСОСН 3), 173,40 (ОСОСН 2). Изосорбид-2-аспиринат-5-бензоат 6. К раствору изосорбид-2-аспирината 17 (1,0 г, 3,25 ммоль) в дихлорметане (20 мл) добавляют бензойную кислоту (0,59 г, 4,88 ммоль), DCC (1,34 г, 6,49 ммоль) и DMAP (0,38 г, 3,11 ммоль). Реакционной смеси дают перемешиваться при комнатной температуре в течение 3 ч перед отфильтровыванием преципитата и промывкой фильтрата HCl (30 мл, 1 М), насыщенным водным раствором Na2HCO3 (30 мл) и водой (330 мл). Его сушат над безводным Na2SO4 и удаляют растворитель в вакууме с получением бесцветного масла, которое перекристаллизовывают в этаноле с получением продукта в виде белых кристаллов (1,13 г, 84,3%): т.пл. 80-82 С. IRvmax (KBr): 2991,1 и 2932,9 (растяжение С-Н), 1762,9 и 1720,6 131,39 (Ar1C-2 и Ar2C-6), 132,82 (Ar2C-2 и Ar2C-1), 133,79 (Ar2C-4), 134,81 (Ar1C-4), 154,32 (Ar1C-6),167,10 (OCOCH3), 168,2 (OCOAr1 и OCOAr2). Изосорбид-2-аспиринат-5-никотинат 7. Изосорбид-2-аспиринат 17 (0,3 г, 0,98 ммоль) в дихлорметане (20 мл) при 0 С перемешивают в течение 10 мин в присутствии DCC (0,2 г, 0,98 ммоль) и DMAP (0,12 г, 0,98 ммоль). Реакционную смесь в емкости возвращают к комнатной температуре, добавляют никотиновую кислоту (0,12 г, 0,98 ммоль) и дают перемешиваться в течение 24 ч. Реакционную смесь промывают HCl (20 мл, 1 М), насыщенным водным раствором NaHCO3 (20 мл), водой (320 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного масла (0,95 г). Очистка колоночной хроматографией на силикагеле с использованием дихлорметана и этилацетата (95:5) в качестве элюента дает соединение 7 в виде белых кристаллов (0,12 г, 29,1%): т.пл. 94-96 С. IRvmax (KBr): 3327,6 (N=C), 2929,6(Ar1C-6), 131,35 (Ar2C-6), 133.83 (Ar1C-2), 136,68 (Ar1C-3), 150,55 (Ar2C-5), 153,30 (Ar2C-1), 164,13 (Ar1C5), 164,13 (Ar2C-3), 170,59 (ArCOOR). Изосорбид-2-аспиринат-5-[изоникотинат] 8. Изосорбид-2-аспиринат 17 (0,2 г, 0,65 ммоль) растворяют в дихлорметане (20 мл) при 0 С, к нему добавляют DCC (0,13 г, 0,65 ммоль) и DMAP (0,08 г, 0,65 ммоль). Через 10 мин реакционную смесь в емкости возвращают к комнатной температуре, добавляют изоникотиновую кислоту (0,08 г, 0,65 ммоль) и перемешивают в течение 24 ч. Реакционную смесь промывают HCl (20 мл, 1 М), насыщенным водным раствором NaHCO3 (20 мл), водой (320 мл), сушат над безводным MgSO4 и растворитель удаляют в вакууме с получением соединения 8 в виде порошка белого цвета (0,17 г, 63,1%): т.пл. 86-88 С. IFvmaxHRMS: рассчитано 436,1008 (М 23), найдено 436,1004 (М 23). 1 Н ЯМР(CDCl3): 2,37 (3 Н, с, ОСОСН 3), 4,09 (5 Н, м, ISl-H2[+] и IS6-H2[+]), 4,65 (1 Н, д, J=4,52 Гц, ISH-3), 5,05 (1 Н, т, J=5,52 и 5,04 Гц, ISH-4), 5,46 (2 Н, дд, J=5,52 и 5,04 Гц, ISH-5 и ISH-2), 7,12 (1 Н, д,J=7,04 Гц, Ar1H-2), 7,33 (1 Н, м, Ar1H-3), 7,59 (2 Н, т, J=6,04 и 6,04 Гц, Ar1H-5 и Ar1H-4), 7,90 (1 Н, д, J=5,04 Гц, Ar2H-6), 8,01 (Н, дд, J=2,0 и 1,52 Гц, Ar2H-2), 8,84 (1 Н, с, Ar2H-5), 8,98 (1 Н, с, Ar2H-3). Изосорбид-2-аспиринат-5-бензилоксибензоат 9. К раствору изосорбид-2-аспирината 17 (0,27 г, 0,87 ммоль) в дихлорметане (20 мл) добавляют бензилоксибензойную кислоту (0,20 г, 0,87 ммоль), DCC (0,18 г, 0,87 ммоль) и DMAP (0,01 г, 0,09 ммоль). Реакционную смесь в емкости перемешивают при комнатной температуре в течение 24 ч перед фильтрованием и промывкой фильтрата HCl (30 мл, 0,1 М), насыщенным водным раствором NaHCO3 (30 мл) и водой (230 мл). После сушки над безводным Na2SO4 дихлорметан удаляют в вакууме с получением 0,7 г неочищенного продукта в виде бесцветного масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (3:1) в качестве элюента дает 0,19 г соединения 9 в виде белых кристаллов (41,5%): т.пл. 76-78 С. IRvmax (KBr): 1772,7 и 1726,2 (С=O), 1276,6 (C(O)OR ароматический),1078,1 (С-О-С) см-1.(0,44 г, 2,2 ммоль) и DMAP (0,05 г, 0,22 ммоль) и реакционную смесь в емкости перемешивают при 0 С в течение 10 мин. После возращения к комнатной температуре добавляют антраниловую кислоту (0,29 г,2,2 ммоль) и дают перемешиваться в течение 3 ч. Реакционную смесь промывают HCl (20 мл, 1 М), насыщенным водным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл) и водой (220 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного масла желтого цвета. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (4:1) в качестве элюента дает соединение 10 в виде твердого вещества желтого цвета (0,39 г, 41,5%). Продукт хранят при 0-4 С, до тех пор пока он не потребуется для исследования. Т.пл. 150-152 С. IRvmax (KBr): 3443,4 (растяжение N-H), 2920,5 (растяжение С-Н), 1742,7 (С=О), 1548,0(Ar1C-1), 125,42 (Ar1C-3), 130,23 (Ar1C-2), 130,59 (Ar2C-2), 133,27 (Ar1C-4), 133,36 (Ar2C-4), 147,99 (Ar2C6), 154,32 (Ar1C-6), 167,02 (OCOAr), 167,06 (OCOAr), 168,92 (ОСОСН 3). Изосорбид-2-аспиринат-5-[2'-метокси]бензоат 11. Изосорбид-2-аспиринат 17 (0,2 г, 0,65 ммоль) растворяют в толуоле (15 мл) при 0 С, к нему добавляют DMAP (0,08 г, 0,65 ммоль) и DCC (0,13 г, 0,65 ммоль). Через 10 мин реакционную смесь в емкости возвращают к комнатной температуре, добавляют 2-анисовую кислоту (2-метоксибензойную кислоту,0,10 г, 0,65 ммоль) и дают перемешиваться в течение 12 ч. Реакционную смесь промывают HCl (20 мл,1 М), насыщенным водным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл) и водой(320 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (3:1) в качестве элюента дает соединение 11 в виде белых кристаллов (0,23 г, 79,8%): т.пл. 132-134 С. IRvmax (KBr): 2920,5 (растяжение С-Н), 1764,9 и 1720,4 (С=О), 1253,2 (C(O)OR, ароматический), 1075,2 (С-О-С) см-1.(Ar2C-5), 122,91 (Ar1C-5), 123,38 (Ar1C-1), 125,42 (Ar1C-3), 125,56 (Ar1C-2), 131,38 (Ar2C-6), 133,45 (Ar1C4), 133,75 (Ar2C-4), 150,24 (Ar1C-6), 159,09 (Ar2C-6), 164,79 (ArCOOR), 169,13 (ArOC(O)CH3). Изосорбид-2-аспиринат-5-[3'-метокси]бензоат 12. Изосорбид-2-аспиринат 17 (0,2 г, 0,65 ммоль) растворяют в толуоле (15 мл) при 0 С, к нему добавляют DMAP (0,08 г, 0,65 ммоль) и DCC (0,13 г, 0,65 ммоль). Через 10 мин реакционную смесь в емкости возвращают к комнатной температуре, добавляют 3-анисовую кислоту (3-метоксибензойную кислоту)(0,10 г, 0,65 ммоль) и дают перемешиваться в течение 12 ч. Реакционную смесь промывают HCl (20 мл,1 М), насыщенным водным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл) и водой(320 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (3:1) в качестве элюента дает соединение 12 в виде белых кристаллов (0,23 г, 79,8%): т.пл. 125-128 С. IRvmax (KBr): 2980,9 (растяжение С-Н), 1768,3 и 1723,8 (С=О), 1298,5 и 1253,5 (С(О)OR, ароматический), 1075,9 (С-О-С) см-1. Изосорбид-2-аспиринат-5-[4-метокси]бензоат 13. Изосорбид-2-аспиринат 17 (0,2 г, 0,65 ммоль) растворяют в толуоле (15 мл) при 0 С, к нему добавляют DMAP (0,08 г, 0,65 ммоль) и DCC (0,13 г, 0,65 ммоль). Через 10 мин реакционную смесь в емкости возвращают к комнатной температуре, добавляют 4-анисовую кислоту (4-метоксибензойную кислоту)(0,10 г, 0,65 ммоль) и дают перемешиваться в течение 12 ч. Реакционную смесь промывают HCl (20 мл,1 М), насыщенным водным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл) и водой(320 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (2:1) в качестве элюента дает продукт в виде белых кристаллов (0,17 г, 58,9%): т.пл. 141144 С. IRvmax (KBr): 2994,1 и 2936,7 (растяжение С-Н), 1764 и 724,9 (С=), 1605,8 (растяжение С=С),1260,5 (C(O)OR, ароматический), 1078,6 (С-О-С) см-1.H ЯМР (CDCl3): 2,32 (3 Н, с, ОСОСН 3), 3,84 (3 Н, с, ArOCH3, 3,99 (1 Н, м, IS6-H), 4,07 (6 Н, м, IS1H2[+] и IS6-H), 4,59 (1 Н, д, J=4,52 Гц, ISH-3), 4,98 (1 Н, т, J=5,52 и 5,0 Гц, ISH-4), 5,38 (1 Н, т, J=5,0 и 5,52 Гц, ISH-5), 5,43 (1 Н, д, J=2,0 Гц, ISH-2), 6,91 (2 Н, д, J=8,52 Гц, Ar2H-3 и Ar2H-5), 7,08 (1 Н, д, J=8,0 Гц, Ar1H-4), 7,28 (1 Н, т, J=7,56 и 9,52 Гц, Ar1H-2), 7,54 (1 Н, т, J=8,0 и 7,52 Гц, Ar1H-3), 7,99 (3 Н, кв, J=9,0,7,04 и 8,04 Гц, Ar1H-1, Ar2H-2 и Ar2H-6). 13 С ЯМР м.д. (CDCl3): 20,48 (ArOCOCH3), 59,83 (ArOCH3), 70,41 (ISC-1), 72,82 (ISC-6), 73,58 (ISOCOAr), 76,58 (ISC-5). 78,26 (ISC-4), 80,47 (ISC-2), 85,46 (ISC-3), 113,33 (Ar2C-3 и Ar2C-5), 121,46 (Ar1C-5),122,35 (Ar2C-1), 123,36 (Ar1C-1), 125,54 (Ar1C-3), 131,35 (Ar1C-2), 133,73 (Ar2C-2 и Ar2C-6), 133,76 (Ar1C4), 150,23 (Ar1C-6), 163,12 (ArOCH3 и Ar2C-4), 165,09 (ArCOOR), 169,08 (ArCOOR), 170,52 (ArOCOCH3). Изосорбид-2-аспиринат-5-[4-метилбензоат] 14. Раствор изосорбид-2-аспирината 17 (0,2 г, 0,65 ммоль) растворяют в толуоле при 0 С, к нему добавляют триэтиламин (0,13 мл, 0,98 ммоль) и 4-толуоилхлорид (0,93 мл, 0,78 ммоль). Реакционную смесь в емкости возвращают к комнатной температуре и дают перемешиваться в течение 10 ч, затем промываютHCl (30 мл, 1 М), насыщенным водным раствором NaHCO3 (30 мл), водой (330 мл) и насыщенным раствором NaCl (30 мл). Реакционную смесь сушат над безводным Na2SO4 и растворитель удаляют в вакууме с использованием этилацетата в качестве сорастворителя, получая неочищенный продукт. Очистка колоночной хроматографией с использованием гексана и этилацетата (9:1) в качестве элюента дает соединение 14 в виде белых кристаллов (0,1 г, 35,99%): т.пл. 102-104 С. IRvmax (KBr): 2982,7 и 2923,6 (растяжение С-Н), 1763,9 и 1717,8 (С=О), 1608,5 (С=С), 1275,4 и 1202,0 (C(O)OR), 1100,3 (С-О-С см-1.(1,12 мл, 0,78 ммоль). Реакционной смеси дают перемешиваться при комнатной температуре в течение 48 ч перед промывкой HCl (20 мл, 1 М), насыщенным водным раствором NaHCO3 (25 мл), насыщенным солевым раствором (20 мл) и водой (220 мл), сушат над безводным Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде неочищенного желтого масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата (3:2) в качестве элюента дает соединение 15 в виде бесцветного масла, которое при перекристаллизации в этаноле дает продукт в виде белых кристаллов Изосорбид-2-аспиринат-5-ОН 17. Перемешиваемый раствор ацетилсалицилоилхлорида (мол. масса 198,60 г/моль, 10,9 г=54,9 ммоль) в дихлорметане (160 мл) обрабатывают триэтиламином (мол. м. 101,19 г/моль, d=0,726 г/мл, 9,1 мл=65,4 ммоль). Смесь охлаждают до 0 С и добавляют 5-ISMN (мол. м. 191,12 г/моль, 10 г=52,3 ммоль). Реакционную смесь в колбе перемешивают при комнатной температуре в течение ночи и защищают от света. Смесь промывают HCl (2 М), 5% NaHCO3 и водой, сушат над сульфатом натрия и концентрируют до масла. Его перекристаллизовывают с использованием горячего этанола (кристаллизация может быть очень медленной), получая 10 г кристаллов желтого цвета. Их растворяют в смеси метанол/этилацетат(1:1), добавляют Pd/C и присоединяют камеру с водородом. Перемешивают в течение ночи и отслеживают с помощью ТСХ (гексан/этилацетат 2:1) для определения завершения реакции. Смесь фильтруют и удаляют растворитель. Добавляют некоторое количество дихлорметана и концентрируют, добавляют простой диэтиловый эфир, дают отстояться в течение 10-15 мин и концентрируют до кристаллов белого цвета (7,4 г). 1 Н ЯМР(CDCl3) 400 МГц: 2,37 (3 Н, с, ОСОСН 3), 3,6 (1 Н, м, ISH-6), 3,9 (1 Н, м, ISH-61), 4,07 (2 Н,2 дд, ISH-1/H-1'), 4,3 (1 Н, кв, ISH-3), 4,58 (1 Н, д, ISH-4), 4,69 (1 Н, м, ISH-2), 5,45 (1 Н, д, ISH-5), 7,11 (1 Н,д, Ar-H), 7,28 (1 Н, т, Ar-H), 7,57 (1 Н, т, Ar-H), 8,00 (1 Н, дд, Ar-Н). 13 С ЯМР м.д. (CDCl3) 400 МГц: 20,48 (ОСОСН 3), 71,56 (ISC-1), 72,91 (ISC-6), 73,11 (ISC-5), 78,44(ISC-2), 81,56 (ISC-4), 85,09 (ISC-3), 122,18 (Ar2C-2/С-6), 123,42, 125,66 (Ar2C-4), 131,37 (Ar1C-4), 133,95,150,23 (Ar2OCO), 163,03 (OCOArCH2ONO2), 169,27 (ArC(О)OR). Изосорбид-2-аспиринат-5-(3-(2-бромацетоксибензоат 18. К раствору изосорбид-2-аспиринат-5-салицилата (0,15 г, 0,35 ммоль) и DBU (0,052 мл, 0,35 ммоль) в дихлорметане (5 мл) добавляют бромацетилхлорид (0,03 мл, 0,35 ммоль), и реакционной смеси дают перемешиваться в течение ночи. Реакционную смесь промывают водой (25 мл) и удаляют растворители в вакууме с получением соединения 18 в виде бесцветного масла (0,13 г). IRvmax (пленка) см-1: 1765,6 и 1724,3 (С=O), 1608,1 (С=О), 1288,4 и 1251,4 (C(O)OR), 1196,9 и 1135,6 (С-О-С), 732,6 (C-Br).DCM (10 мл). Добавляют триэтиламин (500 мкл=6 ммоль) и смесь охлаждают до 0 С. Добавляют изосорбид-2-аспиринат 17 (506,2 мг=1,6 ммоль), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Промывают 2 М HCl (10 мл), 5% NaHCO3 (10 мл) и водой (10 мл). Сушат над сульфатом натрия и концентрируют. Очищают колоночной хроматографией (гексан/этилацетат 2:1) Rf=0,3 с получением 396 мг масла. 1 Н ЯМР(CDCl3) 400 МГц: 0,9-1,18 (2 дд и т, 4 Н, 2 СН 2), 2,32 (3 Н, с, ОСОСН 3), 3,78 (м, 1 Н, ISH1), 3,9 (м, 1 Н, ISH-6), 4,06 (2 Н, д, ISH-1' и ISH-6'), 4,5(1 Н, д, ISH-3), 4,83 (1 Н, т, ISH-4), 5,12 (1 Н, кв, ISH2), 5,38 (1 Н, с, Н-5), 7,06 (1 Н, д, Ar-H), 7,26 (1 Н, т, Ar-H), 7,52 (1 Н, т, Ar-H), 7,95 (1 Н, д, Ar-H). 13 С ЯМР м.д.(CDCl3) 400 МГц: 9 и 10 (2 СН 2), 12,15 (СН), 20,43 (ОСОСН 3), 69,96 (ISC-1), 72,71(ОСОциклопропан). Изосорбид-2-аспиринат-5-(п-цианобензоат) 20. Изосорбид-2-аспиринат 17 (200 мг, 0,6 ммоль) и 4-цианобензоилхлорид (120 мг, 0,72 ммоль) взаимодействуют друг с другом в соответствии с GP2 с получением 213 мг (81%) масла желтого цвета после флэш-хроматографии с использованием EtOac:Hex 1:4. 1 Н ЯМР (CDCl3, 400 МГц)8,2 (2 Н, д, J=8,5 Гц), 8,0 (1 Н, дд, J=8 Гц, 1,5 Гц), 7,8 (2 Н, д, J=10 Гц), 7,6HRMS (EI) C23H19O8N, [M+H]+ рассчитано 438,4068, найдено 438,4183. Анал. C23H19O8N рассчитано С: 63,16, Н: 4,38, N: 3,20, найдено С: 63,46, Н: 4,51, N: 2,97. Изосорбид-2-аспиринат-5-(п-фенилбензоат) 21. Изосорбид-2-аспиринат 17 (200 мг, 0,6 ммоль) и 4-фенилбензоилхлорид (156 мг, 0,72 ммоль) взаимодействуют друг с другом с получением 185 мг (65%) бесцветного масла после флэш-хроматографии с использованием EtOac:Hex 1:4.HRMS (EI) C28H24O8, [M+H]+ рассчитано 489,4933, найдено 489,5021. Анал. С 28 Н 24 О 8 рассчитано С: 68,85, Н: 4,95, найдено С: 68,88, Н: 5,08. Изосорбид-2-аспиринат-5-(6-хлорникотинат) 22. Изосорбид-2-аспиринат 17 (250 мг, 0,8 ммоль) и 6 хлорникотиноилхлорид(230 мг, 0,9 ммоль) взаимодействуют друг с другом в соответствии с GP2 с получением 256 мг (70%) твердого вещества белого цвета после флэш-хроматографии с использованиемHRMS (EI) C21H18ClNO8, [M+H]+ рассчитано 448,8304, найдено 448,8295. Анал. C21H18ClNO8 рассчитано С: 56,32, Н: 4,05, N: 3,13, найдено С: 56,20, Н: 4,21, N: 3,02. Изосорбид-2-аспиринат-5-(-2-хлор-6-метилпиридин-4-оат) 23. Изосорбид-2-аспиринат 17 (250 мг, 0,8 ммоль) и 2-хлор-6-метилпиридин-4-карбамоилхлорид (247 мг, 0,9 ммоль) взаимодействуют друг с другом в соответствии с GP2 с получением 196 мг (53%) белой пены после флэш-хроматографии с использованием EtOac:Hex 2:6. 1 Н ЯМР (CDCl3, 400 МГц)8,0 (1 Н, дд, J=8 Гц, 1,5 Гц), 7,74 (1 Н, с), 7,68 (1 Н, с) 7,6 (1 Н, дт, J=8 Гц,1,5 Гц), 7,45 (1 Н, т, J=1 Гц), 7,35 (1 Н, дт, J=6,5, 1 Гц), 7,1 (1 Н, д, J=8,5 Гц), 5,45 (2 Н, м), 5,05 (1 Н, т, J=5 Гц), 4,65 (1 Н, д, J=5 Гц), 4,1 (4 Н, м), 2,65 (3 Н, с), 2,4 (3 Н, с). 13 С ЯМР (CDCl3 400 МГц)169,3, 163,1, 151,1, 150,2, 139,3, 134,0, 131,4, 125,7, 123,4, 122,1, 120,8,120,4, 85,7, 80,4, 77,8, 77,6, 75,1, 72,8, 70,2, 23,8, 20,5.HRMS (EI) C22H20ClNO8, [М+Н]+ рассчитано 462,8570, найдено 462,8601. Анал. C22H20ClNO8 рассчитано С: 57,21, Н: 4,36, N: 3,03, найдено С: 56,91, Н: 4,38, N: 2,94. Изосорбид-2-аспиринат-5-(3,5-этоксибензоат) 24. Изосорбид-2-аспиринат 17 (200 мг, 0,65 ммоль) и 3,5-этоксибензоилхлорид (157 мг, 0,72 ммоль) взаимодействуют друг с другом в соответствии с GP2 с получением 296 мг (74%) вязкого масла желтого цвета после флэш-хроматографии с использованием EtOac:Hex 1:4. 1HRMS (EI) C26H28O10, [М+Н]+ рассчитано 500,4945, найдено 500,4932. Анал. C26H28O10 рассчитано С: 62,39, Н: 5,64, найдено С: 62,45, Н: 5,79. Изосорбид-2-аспиринат-5-(3-метил-изоксазол-4-оат) 25. Изосорбид-2-аспиринат 17 (200 мг, 0,65 ммоль) и 3-метил-изоксазол-4-карбоновая кислота (127 мг,0,72 ммоль) взаимодействуют друг с другом в соответствии с GP1 с получением 228 мг (83%) белой пены после флэш-хроматографии с использованием EtOacrHex 1:3. 1 Н ЯМР (CDCl3, 400 МГц)8,55 (1 Н, с, изокс), 8,0 (1 Н, д, J=8 Гц, Асп Н 5), 7,65 (1 Н, дт, J=8, 1,5 Гц,Асп Н 4), 7,3 (1 Н, т, J=1 Гц, Асп Н 3), 7,1 (1 Н, д, 8,5 Гц, Асп Н 2), 5,4 (2 Н, м, IS Н 5+Н 2), 5,0 (1 Н, т, J=5 Гц,IS Н 4), 4,6 (1 Н, д, J=5,5 Гц, IS Н 3), 4,1 (4 Н, м, IS1-H2 [+], IS6-H2 [+]), 3,8 (3 Н, с, изокс-СН 3), 2,35(3 Н, с, Асп-ацет-СН 3). 13 С ЯМР (CDCl3 400 МГц)169,2, 163,0, 160,4, 150,2, 149.6, 133,9, 131,4, 125,6, 123,4, 122,1, 85,6,80,5, 73,9, 72,7, 70,2, 33,5, 24,5, 20,5, 12,3. Изосорбид-2-аспиринат-5-(-4-метил-1,2,3-тиадиазол-5-оат) 26. Изосорбид-2-аспиринат 17 (200 мг, 0,65 ммоль) и 4-метил-1,2,3-тиадиазол-5-карбоновая кислота взаимодействуют друг с другом с получением 228 мг (83%) бледно-розовой пены после флэшхроматографии с использованием EtOac:Hex 1:3. 1 Н ЯМР (CDCl3, 400 МГц)8,1 (1 Н, д, J=8 Гц, Асп Н 5), 7,7 (1 Н, дт, J=8, 1,5 Гц, Асп Н 4), 7,35 (1 Н, т,J=1 Гц, Асп Н 3), 7,15 (1 Н, д, 8,5 Гц, Асп Н 2), 5,5 (2 Н, м, IS Н 5+Н 2), 5,05 (1 Н, т, J=5 Гц, IS Н 4), 4,65 (1 Н,д, J=5,5 Гц, IS Н 3), 4,1 (4 Н, м, IS1-Н 2 [+], IS6-H2 [+]), 3,05(3 Н, с, тиад-СН 3), 2,4 (3 Н, с, Асп-ацетСН 3). С ЯМР (CDCl3 400 МГц)169,7, 163,5, 162,9, 159,1, 150,7, 134,4, 131,8, 126,1, 123,8, 122,5, 86,2,80,9, 78,2, 75,9, 73,2, 70,8, 21,0, 14,1. Изосорбид-2-аспиринат-5-(N-Boc-изонипекотат) 27. Изосорбид-2-аспиринат 17 (200 мг, 0,65 ммоль) и 4N-Boc-изонипекотиновая кислота (162 мг, 0,72 ммоль) взаимодействуют друг с другом с получением 166 мг (49%) не совсем белого масла после флэшхроматографии с использованием MeOH:DCM 3:97. 1 Н ЯМР (CDCl3, 400 МГц)8,1 (1 Н, д, J=8 Гц, Асп Н 5), 7,7 (1 Н, дт, J=8, 1,5 Гц, Асп Н 4), 7,35 (1 Н, т,J=1 Гц, Асп Н 3), 7,15 (1 Н, д, 8,5 Гц, Асп Н 2), 5,5 (1 Н, д, J=1,5 Гц IS Н 2), 5,5 (1 Н, дд, J=5, 1 Гц), 4,95 (1 Н,т, J=5 Гц, IS Н 4), 4,65 (1 Н, д, J=5,5 Гц, IS Н 3), 4,1 (8 Н, м, IS1-H2 [+], IS6-H2 [+], 4 нип Н), 2,6 (1 Н, м,нип-метин-Н), 2,4 (3 Н, с, Асп-Ацет-СН 3), 1,7 (4 Н, м, 4 нип Н), 1,5, (9 Н, с, t-Bu). 13 С ЯМР (CDCl3 400 МГц)173,9, 169,8, 163,5, 154,7, 150,7, 134,4, 131,9, 126,1, 123,9, 122,6, 85,9,80,7, 79,6, 78,5, 77,2, 76,5, 73,9, 73,0, 70,7, 42,9, 40,9, 28,4, 28,1, 27,9, 20,9.HRMS (EI) C26H33O10N, [М+Н]+ рассчитано 520,4616, найдено 520,4631. Анал. C26H33O10N рассчитано С: 60,11, Н: 6,40, N: 2,69, найдено С: 60,15, Н: 6,79, N: 2,76. Изосорбид-2-аспиринат-5-(м-ацетамидобензоат) 28. Изосорбид-2-аспиринат 17 (200 мг, 0,65 ммоль) и м-ацетамидобензойная кислота (128 мг, 0,72 ммоль) взаимодействуют друг с другом с получением 202 мг (66%) твердого вещества белого цвета после флэш-хроматографии с использованием MeOH:DCM 3:97. 1 Н ЯМР (CDCl3, 400 МГц)8,0 (3 Н, м, Асп Н 5, Ar H2+4), 7,85 (1 Н, д, J=8 Гц, Ar H6), 7,6 (1 Н, дт,J=8, 1,5 Гц, Асп Н 4), 7,45 (1 Н, т, J=7,5 Гц, Ar H5), 7,35 (1 Н, т, J=1 Гц, Асп Н 3), 7,15 (1 Н, д, 8,5 Гц, Асп Н 2), 5,5 (2 Н, м, IS Н 5+Н 2), 5,05 (1 Н, т, J=5 Гц, IS Н 4), 4,65 (1 Н, д, J=5,5 Гц, IS Н 3), 4,1 (4 Н, м, IS1-H2HRMS (EI) C24H23O9N, [М+Н]+ рассчитано 470,4392, найдено 470,4403. Анал. C24H23O9N рассчитано С: 61,41, Н: 4,93, N: 2,98, найдено С: 61,52, Н: 5,09, N: 2,86. Изосорбид-2-аспиринат-5-(м-бензилоксибензоат) 29. Изосорбид-2-аспиринат 17 (250 мг, 0,8 ммоль) и м-бензилоксибензойная кислота (182 мг, 0,88 ммоль) взаимодействуют друг с другом в соответствии с GP1 с получением 346 мг (85%) твердого вещества белого цвета после флэш-хроматографии с использованием EtOac:Hex 1:2. 1 Н ЯМР (CDCl3, 400 МГц)8,0 (1 Н, д, J=8 Гц, Асп Н 5), 7,7 (3 Н, м, Асп Н 4, Ar2H), 7,35 (2 Н, м, Асп Н 3, ArH), 7,1 (2 Н, м, Асп Н 2, ArH), 7,25 (5 Н, м, BnH), 5,5 (3 Н, м, IS Н 2, Bn-СН 2), 5,05 (1 Н, т, J=5 Гц, IS Н 4), 4,65 (1 Н, д, J=5,5 Гц, IS Н 3), 4,1 (4 Н, м, IS1-H2 [+] , IS6-H2 [-]), 2,4 (3 Н, с, Асп-Ацет-СН 3). 13 С ЯМР (CDCl3 400 МГц)169,76, 165,2, 163,6, 150,7, 135,8, 134,4, 133,7, 132,9, 131,9, 130,8, 130,3,130,2, 129,2, 126,1, 123,9, 122,7, 97,7, 86,1, 81,1, 78,5, 74,7, 73,2, 70,8, 43,9, 20,9.HRMS (EI) С 29 Н 26 О 9, [М+Н]+ рассчитано 518,4344, найдено 518,4357. Анал. С 29 Н 26 О 9 рассчитано С: 67,19, Н: 5,05, найдено С: 67,28, Н: 5,09. Изосорбид-2-аспиринат-5-(п-бензилоксибензоат) 30. Изосорбид-2-аспиринат (250 мг, 0,8 ммоль) и м-бензилоксибензойная кислота (182 мг, 0,88 ммоль) взаимодействуют друг с другом в соответствии с GP1 с получением 346 мг (85%) твердого вещества белого цвета после флэш-хроматографии с использованием EtOac:Hex 1:2. 1 Н ЯМР (CDCl3, 400 МГц)8,0 (1 Н, д, J=8 Гц, Асп Н 5), 7,7 (1 Н, дт, J=8, 1,5 Гц, Асп Н 4),7,45 (м, 4 Н,ArH), 7,35 (1 Н, т, J=1 Гц, Асп Н 3), 7,25 (5 Н, м, BnH) 7,1 (1 Н, д, 8,5 Гц, Асп Н 2), 5,5 (3 Н, м, IS Н 2, BnCH2), 5,05 (1 Н, т, J=5 Гц, IS Н 4), 4,65 (1 Н, д, J=5,5 Гц, IS Н 3), 4,1 (4 Н, м, IS1-H2 [+], IS6-H2 [+]), 2,4HRMS (EI) С 29 Н 26 О 9, [М+Н]+ рассчитано 518,4344, найдено 518,4338. Анал. С 29 Н 26 О 9 рассчитано С: 67,19, Н: 5,05, найдено С: 67,35, Н: 5,18. Изосорбид-2-аспиринат-5-(2-нитроокси-метил)бензоат 31. Фталид (мол. м. 134,13 г/моль, 5,03 г=37 ммоль) и дихлортрифенилфосфоран (мол. м. 333,19 г/моль,12,3 г=38 ммоль) нагревают при 180 С в течение 4 ч при перемешивании[3]. Изменение цвета от зеленого до коричневого видно в течение 4 ч. ТСХ (гексан/этилацетат 2:1) показано 3 пятна, и ЯМР определено,что верхнее пятно (Rf 0,77) соответствует 2-хлорметилбензоилхлориду, второе пятно (Rf 0,57) соответствует фталиду и нижнее пятно (Rf 0,14) соответствует трифенилфосфору. Большое количество фталида остается непрореагировавшим. 2-Хлорметилбензоилхлорид (фиг. 12) (мол. м. 189,04 г/моль, 600 мкл) растворяют в дихлорметане (10 мл). Добавляют триэтиламин (мол. м. 101,19 г/моль, d=0,726 г/мл, 600 мкл=4,3 ммоль) и смесь охлаждают до 0 С. Добавляют соединение 17 (мол. м. 308,14 г/моль, 0,5298 г=1,7 ммоль) и смесь перемешивают при комнатной температуре в течение ночи, в то же время защищая от света. Смесь (зеленого цвета) промывают HCl (2 М, 10 мл), 5% NaHCO3 (10 мл) и дистиллированной водой (10 мл) и сушат над сульфатом натрия. Смесь концентрируют, получая 769,5 мг коричнево- 25022878 го/зеленого масла. Его подвергают хроматографии с использованием смеси гексан/этилацетат (2:1), получая 419,4 мг коричневого твердого продукта (Rf 0,38). 1 Н ЯМР(CDCl3) 400 МГц: 2,38 (3 Н, с, ОСОСН 3), 4,03 (4 Н, м, ISH-1, ISH-11, ISH-6 и ISH-61), 4,66(Ar1C-6), 128,07 (Ar1C-2), 130,60 (Ar1C-5), 130,73 (Ar1C-1), 131,43 (Ar1C-4), 133,45 (Ar2C-5), 133,92,138,54, 150,25 (Ar2OCO), 163,12 (OCOArCH2ONO2), 165,47 (ArOCOCH3), 169,29 (ArC(O)OR). 400 мг растворяют в смеси CH3CN/ТГФ (6 мл, 4/2 об./об.), обрабатывают AgNO3 (мол. м. 169,87 г/моль, 0,30 г=1,7 ммоль) и нагревают с обратным холодильником в течение 4 ч перед перемешиванием в течение ночи при комнатной температуре, в то же время защищая от света. Смесь фильтруют и концентрируют. Ее разбавляют этилацетатом (10 мл) и водой (2 мл). Органическую фазу промывают водой (32 мл), насыщенным раствором соли (2 мл) и сушат над сульфатом натрия. Концентрируют, получая масло,которое подвергают хроматографии с использованием смеси гексан/этилацетат (2:1), получая 95 мг воскообразного вещества желтого цвета. 1 Н ЯМР(CDCl3) 400 МГц: 2,38 (3 Н, с, ОСОСН 3), 4,01 (4 Н, м, ISH-1, ISH-1', ISH-6 и ISH-6'), 4,65(1 Н, д, ISH-3), 5,02 (1 Н, т, ISH-4), 5,41 (2 Н, м, СН 2), 5,86 (2 Н, cc, ISH-2/H-5), 7,11 (1 Н, д, Ar-H), 7,28 (1 Н,т, Ar-H), 7,49 (2 Н, кв, Ar-H), 7,61 (2 Н, кв, Ar-H), 8,01 (1 Н, д, Ar-H), 8,10 (1 Н, д, Ar-H). 13 С ЯМР м.д. (CDCl3) 400 МГц: 20,51 (ОСОСН 3), 70,37 (CH2ONO2), 72,78 (ISC-1), 73,46 (ISC-6),74,30 (ISC-5), 78,01 (ISC-2), 80,61 (ISC-4), 85,64 (ISC-3), 122,19 (Ar2C-2/C-6), 123,40, 125,66 (Ar2C-4),128,76 (Ar1C-6), 129,77 (Ar1C-2), 129,85 (Ar1C-5), 130,30 (Ar1C-1), 131,41 (Ar1C-4), 132,44 (Ar2C-5), 133,25,133,93, 150,23 (Ar2OCO), 163,12 (OCOArCH2ONO2), 164,71 (ArOCOCH3), 169,28 (ArC(O)OR). Изосорбид-2-аспиринат-5-(3-нитроокси-метил)бензоат 32. 3-Хлорметилбензоилхлорид (мол. м. 189,04 г/моль, d=l,33 г/мл, 500 мкл=3,5 ммоль) растворяют в дихлорметане (10 мл). Добавляют триэтиламин (мол. м. 101,19 г/моль, d=0,726 г/мл, 600 мкл=4,3 ммоль) и смесь охлаждают до 0 С. Добавляют соединение 17 (мол. масса 308,14 г/моль, 0,511 г=1,6 ммоль) и смесь перемешивают при комнатной температуре в течение ночи, в то же время защищая от света. Смесь промывают HCl (2 М, 10 мл), 5% NaHCO3 (10 мл) и дистиллированной водой (10 мл) и сушат над сульфатом натрия. Смесь концентрируют с получением 1,18 г масла. Его подвергают хроматографии с использованием смеси гексан/этилацетат (3:1), получая 903,4 мг масла (Rf 0,2). 1 Н ЯМР(CDCl3) 400 МГц: 2,37 (3 Н, с, ОСОСН 3), 4,06 (4 Н, м, ISH-1, ISH-1', ISH-6 и ISH-6'), 4,65(Ar1C-6), 129,28 (Ar1C-2), 129,36 (Ar1C-5), 129,52 (Ar1C-1), 131,41 (Ar1C-4), 133,02 (Ar2C-5) , 133,93,137,57, 150,20 (Ar2OCO), 163,16 (OCOArCH2ONO2), 164,94 (ArOCOCH3), 169,37 (ArC(O)OR). Его растворяют в смеси CH3CN/ТТФ (6 мл, 4/2 об./об.), обрабатывают AgNO3 (мол. м. 169,87 г/моль, 0,67 г=3,9 ммоль) и нагревают с обратным холодильником в течение 4 ч перед перемешиванием в течение ночи при комнатной температуре, в то же время защищая от света. Смесь фильтруют и концентрируют. Ее разбавляют этилацетатом (10 мл) и водой (2 мл). Органическую фазу промывают водой (32 мл), насыщенным раствором соли (2 мл) и сушат над сульфатом натрия. Концентрируют, получая масло, которое подвергают хроматографии, используя смесь гексан/этилацетат (1:1), с получением 184,3 мг воскообразного вещества желтого цвета. 1 Н ЯМР(CDCl3) 400 МГц: 2,38 (3 Н, с, ОСОСН 3), 4,09 (4 Н, м, ISH-1, IsH-1', IsH-6 и ISH-6'), 4,65(1 Н, д, ISH-3), 5,05 (1 Н, т, ISH-4), 5,5 (4 Н, дд, ISH-2, ISH-5 и СН 2), 7,12 (1 Н, д, Ar-H), 7,29 (1 Н, т, Ar-H),7,50 (3 Н, м, Ar-H), 7,65 (1 Н, д, Ar-H), 8,01 (2 Н, шир.с, Ar-H). 13 С ЯМР м.д. (CDCl3) 400 МГц: 20,51 (ОСОСН 3), 70,37 (CH2ONO2), 72,78 (ISC-1), 73,46 (ISC-6),74,30 (ISC-5), 78,01 (ISC-2), 80,61 (ISC-4), 85,64 (ISC-3), 122,19 (Ar2C-2/C-6), 123,40, 125,66 (Ar2C-4),128,76 (Ar1C-6), 129,77 (Ar1C-2), 129,85 (Ar1C-5), 130,30 (Ar1C-1), 131,41 (Ar1C-4), 132,44 (Ar2C-5), 133,25,133,93, 150,23 (Ar2OCO), 163,12 (OCOArCH2ONO2), 164,71 (ArOCOCH3), 169,28 (ArC(O)OR). Изосорбид-2-аспиринат-5-(4-нитроокси-метил)бензоат 33. 4-Хлорметилбензоилхлорид (мол. м. 189,04 г/моль, 650 мкл) растворяют в дихлорметане (10 мл). Добавляют триэтиламин (мол. м. 101,19 г/моль, d=0,726 г/мл, 600 мкл=4,3 ммоль) и смесь охлаждают до 0 С. Добавляют соединение 17 (мол. м. 308,14 г/моль, 0,5320 г=1,7 ммоль) и смесь перемешивают при комнатной температуре в течение ночи, в то же время защищая от света. Смесь промывают HCl (2 М, 10 мл), 5% NaHCO3 (10 мл) и дистиллированной водой (10 мл) и сушат над сульфатом натрия. Смесь концентрируют и подвергают хроматографии с использованием смеси гексан/этилацетат (2:1), получая 100 мг белого твердого вещества.(Ar1C-6), 128,96 (Ar1C-2), 129,77 (Ar1C-5), 130,16 (Ar1C-1), 130,56 (Ar1C-4), 131,43 (Ar2C-5), 139,91,142,23, 150,23 (Ar2OCO), 163,14 (OCOArCH2ONO2), 164,91 (ArOCOCH3), 169,31 (ArC(O)OR). Его растворяют в смеси CH3CN/ТГФ (6 мл, 4/2 об./об.), обрабатывают AgNO3 (мол. м. 169,87 г/моль, 75 мг=0,4 ммоль) и нагревают с обратным холодильником в течение 4 ч перед перемешиванием в течение ночи при комнатной температуре, в то же время защищая от света. Смесь фильтруют и концентрируют. Ее разбавляют этилацетатом (10 мл) и водой (2 мл). Органическую фазу промывают водой (32 мл), насыщенным раствором соли (2 мл) и сушат над сульфатом натрия. Концентрируют, получая масло,которое подвергают хроматографии с использованием смеси гексан/этилацетат (2:1), получая 28,3 мг твердого продукта не совсем белого цвета. 1 Н ЯМР(CDCl3) 400 МГц: 2,35 (3 Н, с, ОСОСН 3), 4,04 (4 Н, м, ISH-1, ISH-1', ISH-6 и ISH-6'), 4,62(0,33 г, 1,6 ммоль), DMAP (0,02 г, 0,16 ммоль) и нитрооксиуксусную кислоту (0,19 г, 1,6 ммоль). Смесь перемешивают при комнатной температуре в течение ночи перед фильтрованием и промывкой фильтрата HCl (210 мл, 0,1 М), насыщенным водным раствором NaHCO3 (210 мл) и водой 210 мл). После сушки над безводным Na2SO4 дихлорметан удаляют в вакууме с получением продукта в виде неочищенного масла. Очистка колоночной хроматографией на силикагеле с использованием гексана и этилацетата(5:2) в качестве элюента дает соединение 23 (0,38 г) в виде бесцветного масла. IRvmax (пленка) см-1: 1759,0 и 1727,5 (С=О), 1643,6 (NO2), 1287,7 (NO2), 1256,3 (C(O)OR, ароматический), 1193,5 (С-О-С).(ароматический метин), 150,74 (СО), 163,51 (ArOC(O)Me), 169,59 (ArC(O)OR). Изосорбид-2-аспиринат-5-мононитрат ISMNA. К раствору IS-5-MN (5 г, 26,65 ммоль) в толуоле (100 мл) при 0 С добавляют триэтиламин (5,52 мл,3,96 ммоль) и ацетилсалицилоилхлорид (6,31 г, 31,74 ммоль). Реакционную смесь возвращают к комнатной температуре и дают перемешиваться в течение 6 ч перед промывкой водой (250 мл), HCl (1 М, 250 мл), насыщенным водным раствором NaHCO3 (250 мл) и насыщенным раствором соли (100 мл). Органическую фазу сушат над Na2SO4 и растворитель удаляют в вакууме с получением продукта в виде масла. Его кристаллизуют из этанола с получением 5,42 г продукта в виде белых кристаллов. (58,05%): т.пл. 82-84 С. IRvmax (KBr): 1757,6 и 1733,4 (С=О), 1651,8 (NO2), 1261,4 (C(O)OR, ароматический), 915,5HRMS: рассчитано 376,0645 (М 23), найдено 376,0640 (М 23). 1 Н ЯМР(CDCl3): 2,37 (3 Н, с,ОСОСН 3), 3,93 (1 Н, дд, J=6,0, 11,5 и 6,0 Гц, IS6-H), 4,09 (3 Н, м, IS1H [] и IS6H [] ), 4,58 (1 Н, д, J=4,5 Гц, IS3-H), 5,03 (1 Н, т, J=5,0 и 5,5 Гц, IS4-H), 5,38 (1 Н, м, IS5-H), 5,45 (1 Н, д, J=3,0 Гц, IS2-H), 7,12 (1 Н, д,J=8,0 Гц, Ar-H), 7,33 (1 Н, т, J=7,5 и 8,0 Гц, Ar-H), 7,60 (1 Н, т, J=7,5 и 8,0 Гц, Ar-H), 8,01 (1 Н, д, J=7,5 Гц,Ar-H). 13 С ЯМР м.д. (CDCl3): 20,40 (ОСОСН 3), 68,88 и 72,84 (ISC-1 и ISC-6), 77,50 (ISC-5), 80,83 (ISC-4),81,08 (ISC-2), 122,19 (ArC-1), 123,41, 125,61, 131,37, 133,92 (ароматический метин), 150,24 (ArC-2),163,09 (ArOCO(Me, 169,17 (ArC(O)OR). Экспериментальный способ: исследования гидролиза с использованием растворов плазмы/фермента. Собранные растворы плазмы/сыворотки (4 мл) приготавливают с необходимой крепостью путем разбавления плазмы фосфатным буфером, рН 7,4 (например, для получения 10% раствора 0,4 мл плазмы/сыворотки добавляют к 3,6 мл фосфатного буфера, рН 7,4). После уравновешивания образца плазмы/сыворотки при 370,5 С добавляют 100 мкл исходного раствора исследуемого соединения в ацетонитриле (110-4 М) и удаляют 250 мкл аликвоты через задан- 27022878 ные интервалы времени. Образцы переносят в 1,5-мл пробирки Эппендорфа, содержащие 500 мкл 2% мас./об. раствора nSO47H2O (вода:ацетонитрил, 1:1). Пробирки встряхивают в течение 2 мин, затем центрифугируют при 10000 об/мин в течение 3 мин при комнатной температуре. Супернатант отсасывают и анализируют с помощью ВЭЖХ. Концентрацию исследуемого соединения и метаболитов определяют в сравнении с калибровочными кривыми, полученными в этот же день, в том же диапазоне концентраций и при тех же экспериментальных условиях. Для воссоздания условий во время первого прохождения лекарственных средств после кишечного поглощения выбранные соединения инкубируют в фосфатном буфере при 37 С в присутствии микросом из печени человека (HLM) и кишечного эпителия (HIM). Метаболический путь сложных эфиров при этих условиях также определяют с помощью ВЭЖХ-ОФ, измеряя концентрацию лекарственного средства и метаболитов в среде как функцию времени. Идентичность вовлеченных ферментов подтверждают посредством использования очищенного фермента в случае плазмы (BuChE) и посредством повторения экспериментов по гидролизу в присутствии ингибиторов,специфичных к эстеразе - isoOMPA для BuChE и BNPP для карбоксилэстеразы. Активность BuChE плазмы и микросомальные образцы определяют с использованием анализа Эльмана (Ellman et al., 1964). Методика ВЭЖХ. Высокоэффективную жидкостную хроматографию осуществляют с использованием системы, состоящей из насоса и контроллера Waters 600, автоматического устройства для отбора образцов Waters 717 и фотодиодного матричного детектора Waters 2996, контролируемого с помощью программного обеспечения Empower. Используют колонку Hichrom Nucleosil C18 (4,0250 мм). Подвижную фазу фильтруют перед использованием и продувают гелием на протяжении анализов. Конечный градиентный способ используют следующим образом: Таблица 1 Градиентный способ, используемый для анализов гидролиза Способ проверяют на линейность, точность и на метаболиты для LOQ и LOD. Разработка способа, который обеспечивает хорошее разделение аспирина и салициловой кислоты,представляет собой трудоемкую задачу, поскольку начальный выбор колонки Spherisorb ODS C18 с буфером при рН 3,19 дает большое уширение пиков и плохое разделение (буфер с рН 3,19 выбирают, поскольку он близок к их pKa - для аспирина он составляет 3,5, а для салициловой кислоты 2,97[2]). Это в принципе решается посредством использования колонки Hichrom Nucleosil и буфера с рН 2,5. Поскольку аспирин представляет собой слабую кислоту с pKa 3,5, уменьшение рН буфера ниже его pKa уменьшает удерживание, поскольку соединение становится более гидрофобным. Колонка Nucleosil дает превосходную форму пика и разрешение для обоих соединений. Первоначально использовали моногидратные соли, которые дают большой пик буфера при 18 мин. Использование дигидратных солей устраняет этот пик. Хотя вблизи окончания этой работы какие-то большие пики буфера начинают опять появляться. Имеются также способы измерения ингибирования агрегации тромбоцитов, ТХВ 2, экспрессииGP2B3A тромбоцитов, MDA и соответствующие данные, которые демонстрируют, что ключевые соединения имеют аспириноподобную активность. Исследования агрегации в цельной крови. 500 мкл аликвоту крови смешивают с 500 мкл физиологического солевого раствора и дают возможность инкубироваться при 37 С в течение 10 мин в инкубационной лунке Chrono-Log Whole Blood Aggregometer model 591/592. Затем образцы переносят в лунки для анализа, устанавливают фон и добавляют соответствующий объем реагента, как указано выше. Агрегацию отслеживают в течение 6 мин с выходным сигналом полного сопротивления, регистрируемым на самописце. Когда исследуют ингибиторы,цельную кровь предварительно инкубируют с соответствующими концентрациями ингибитора в ДМСО при 37 С в течение заданного периода времени, перед добавлением стимулятора (10 мин при перемешивании). Используют три различных агрегирующих агента: АА (0,5 мМ), АДФ (10 мкМ) и коллаген (5 мкг/мл). Там, где не наблюдают реакции агрегирования в присутствии ингибитора, осуществляют контрольный эксперимент без присутствия ингибитора. ДМСО при высоких концентрациях (выше 0,25%) может индуцировать зависимое от концентрации изменение уровня ионов кальция в цитоплазме тромбоцитов. Перед каждым экспериментом осуществляют контроль с использованием PRP для получения нормальных реакций агрегирования. Образец также инкубируют в течение 10 мин при 37 С с 10 мкл ДМСО, чтобы убедиться, что он не обладает ингибиторным действием на реакцию агрегирования. Два метаболита ISAS, салициловую кислоту и изосорбид, исследуют для определения того, обладают ли они ингибиторным действием на тромбоциты. В этой модели ISAS демонстрирует значительно более высокую активность, чем аспирин или ISDA, при ингибировании агрегации тромбоцитов для всех агрегационных стимулов. Агрегация тромбоцитов в плазме, обогащенной тромбоцитами. Собирают кровь от здоровых добровольцев, которые не принимают никаких лекарственных средств, известных как влияющие на функцию тромбоцитов, в течение, по меньшей мере, 14 дней перед исследованиями. Обогащенную тромбоцитами плазму (PRP) и суспензии отмытых тромбоцитов (2,5108 тромбоцитов/мл) получают из крови, как описано ранее. Агрегацию тромбоцитов измеряют с помощью световой агрегометрии, как описано ранее. Кратко,PRP и образцы отмытых тромбоцитов (2,5108/мл) помещают в люминесцентный агрегометр для ионов кальция в цельной крови (Chronolog Corp., Havertown, PA, U.S.А), и (BIO/DATA CORPORATION) и инкубируют в течение 10 мин при 37 С, перемешивая при 900 об/мин, перед добавлением агрегирующих агентов. Агрегацию начинают добавлением агонистов и отслеживают с помощью программного обеспечения Aggro-Link, по меньшей мере, в течение 6 мин. Для экспериментов с использованием ингибиторов агрегацию начинают через 10 мин предварительного инкубирования с этими соединениями. Для исследования агрегаторной активности АДФ образуют кривые концентрация-отклик (0,3-10 мкМ). Коллаген при различных концентрациях (3-5 мкг/мл) также используют для индуцирования агрегации тромбоцитов. Субмаксимальные концентрации агонистов, то есть концентрации, которые дают приблизительно 95% от максимальной агрегации, используют для исследования действий ингибиторов агрегации. Результаты выражают в процентах изменения от максимального прохождения света, при этом 100% представляет прохождение света в среде только с тромбоцитами. Ингибирование синтеза ТХВ 2. Аспирин ингибирует агрегацию тромбоцитов за счет ослабления опосредуемого циклооксигеназой синтеза PGH2, который преобразуется в клетках в мощный агрегирующий агент ТХА 2 с помощью тромбоксансинтазы. ТХА 2 вызывает сильное затухание и непригоден для прямого измерения, но его метаболит ТХВ 2 обычно, как считается, дает пригодный показатель своего исходного соединения. Обработка тканей аспирином in vivo или in vitro отражается в подавлении ТХВ 2. Для сравнения соединений по настоящему изобретению с аспирином, в этом отношении, необработанной цельной крови дают свертываться в присутствии аспирина или исследуемых соединений в течение 1 ч при 37 С. Затем образцы центрифугируют. Сыворотку собирают и измеряют ТХВ 2 с помощью наборов для иммуносорбентного анализа с использованием связанных ферментов (ELISA), получаемых от Cayman Chemicals. Эксперименты осуществляют с аспирином при концентрации, понижающейся от значений, которые дают полное ингибирование синтеза ТХВ 2. В этих анализах ISAS является значительно более действенным, чем аспирин,что отражается в более низких значениях IC50. Проточная цитометрия. Для анализа экспрессирования рецепторов на поверхности отдельных тромбоцитов и для сведения к минимуму активирования тромбоцитов, вызываемого процедурами подготовки образца, стадий перемешивания или встряхивания не используют. Избыток активированного GPIIb/IIIa и Р-селектина на поверхности тромбоцитов в присутствии и в отсутствие ингибиторов измеряют проточной цитометрией. Образцы тромбоцитов сначала активируют агонистами либо коллагена, либо АДФ. Когда агрегация тромбоцитов достигает 50% от максимального прохождения света, реакцию завершают путем 10 кратного разбавления физиологическим солевым раствором. Тромбоциты в состоянии покоя используют в качестве контроля. В большинстве экспериментов тромбоциты предварительно инкубируют с ингибиторами в течение 10 мин перед добавлением агонистов. Затем образцы тромбоцитов инкубируют в темноте без перемешивания в течение 5 мин при комнатной температуре в присутствии насыщающих концентраций (10 мкг/мл) Р-селектина (CD62P-APC). Активированные рецепторы GPIIb/IIIa тромбоцитов измеряют с использованием моноклонального антитела PAC-I при такой же концентрации, как указано выше. PAC-I специфично распознает эпитоп на комплексе GPIIb/IIIa с высоким сродством у активированных тромбоцитов, на тромбоците или вблизи него 5. После инкубирования образцы разбавляют в проточном жидком FACS и анализируют в пределах 5 мин, используя BD FACSArray (BD Biosciences, Oxford, UK). Проточную цитометрию осуществляют на отдельных окрашенных образцах тромбоцитов, как описано выше. Инструмент настраивают для измерения размера (прямое светорассеяние), гранулярности(боковое (угловое) светорассеяние) и клеточной флуоресценции. Окно двухмерного анализа прямого и бокового светорассеяния подбирают для включения отдельных тромбоцитов и исключения агрегатов тромбоцитов и микрочастиц. Связывание антител измеряют путем анализа индивидуальных тромбоцитов на флуоресценцию. Среднюю интенсивность флуоресценции определяют после корректировки на аутофлуоресценцию клеток. Для каждого образца флуоресценцию анализируют с использованием логарифмической шкалы. Получают гистограммы флуоресценции для 10000 индивидуальных событий. Данные анализируют с использованием программного обеспечения Cytometer RXP и выражают как процент от флуоресценции контроля в произвольных единицах. Подготовка биологических образцов для гидролиза и измерения высвобождения аспирина. Образцы крови человека собирают путем прокола вены в пробирки Li-Heparin Sarstedt Monovette (9 мл). Образцы плазмы получают центрифугированием крови при 10000 об/мин в течение 5 мин и замораживают в аликвотах, до тех пор пока они не потребуются для исследования. Собранные микросомы пе- 29
МПК / Метки
МПК: C07D 493/04, A61K 31/34, A61P 29/00
Метки: пролекарства, аспирина, эффективные
Код ссылки
<a href="https://eas.patents.su/30-22878-effektivnye-prolekarstva-aspirina.html" rel="bookmark" title="База патентов Евразийского Союза">Эффективные пролекарства аспирина</a>
Предыдущий патент: Полинуклеотид гена стрелкования b сахарной свеклы и его применение
Следующий патент: Антибактериальное средство
Случайный патент: Сшиваемая силаном полимерная композиция, изделие и способ получения кабеля












