Рнк с комбинацией из немодифицированных и модифицированных нуклеотидов для экспрессии белков
Формула / Реферат
1. Полирибонуклеотид с последовательностью, которая кодирует белок или фрагмент белка, причем полирибонуклеотид содержит комбинацию из немодифицированных и модифицированных нуклеотидов, причем от 5 до 50% уридиновых нуклеотидов и от 5 до 50% цитидиновых нуклеотидов представляют собой модифицированные уридиновые нуклеотиды, соответственно модифицированные цитидиновые нуклеотиды.
2. Полирибонуклеотид с последовательностью, которая кодирует белок или фрагмент белка, который может быть получен из нуклеотидной смеси нуклеотидов АТФ, ГТФ, ЦТФ и УТФ, причем от 5 до 50% цитидиновых нуклеотидов и от 5 до 50% уридиновых нуклеотидов являются модифицированными.
3. Полирибонуклеотид по п.1 или 2, отличающийся тем, что полирибонуклеотид представляет собой иРНК, причем иРНК при необходимости представляет собой in vitro транскрибированную иРНК (IVT-иРНК).
4. Полирибонуклеотид по одному из предыдущих пунктов, отличающийся тем, что РНК кодирует белок или фрагмент белка, дефект или недостаток которого может вызывать заболевание, который может облегчать, предотвращать или вылечивать болезнь или который может способствовать полезной или необходимой функции, и/или отличающийся тем, что от 15 до 30%, предпочтительно от 7,5 до 25% уридиновых нуклеозидов и от 15 до 30%, предпочтительно от 7,5 до 25% цитидиновых нуклеозидов являются модифицированными, и/или отличающийся тем, что он содержит по меньшей мере два вида модифицированных уридиновых нуклеозидов и/или по меньшей мере два вида модифицированных цитидиновых нуклеозидов, причем при необходимости по меньшей мере один вид из модифицированных уридиновых нуклеозидов и/или цитидиновых нуклеозидов в качестве модификации имеет одну функциональную группу для присоединения одного или нескольких функциональных носителей, причем предпочтительно функциональный один носитель представляет собой последовательность-мишень, группу ПЭГ и/или нацеленный лиганд.
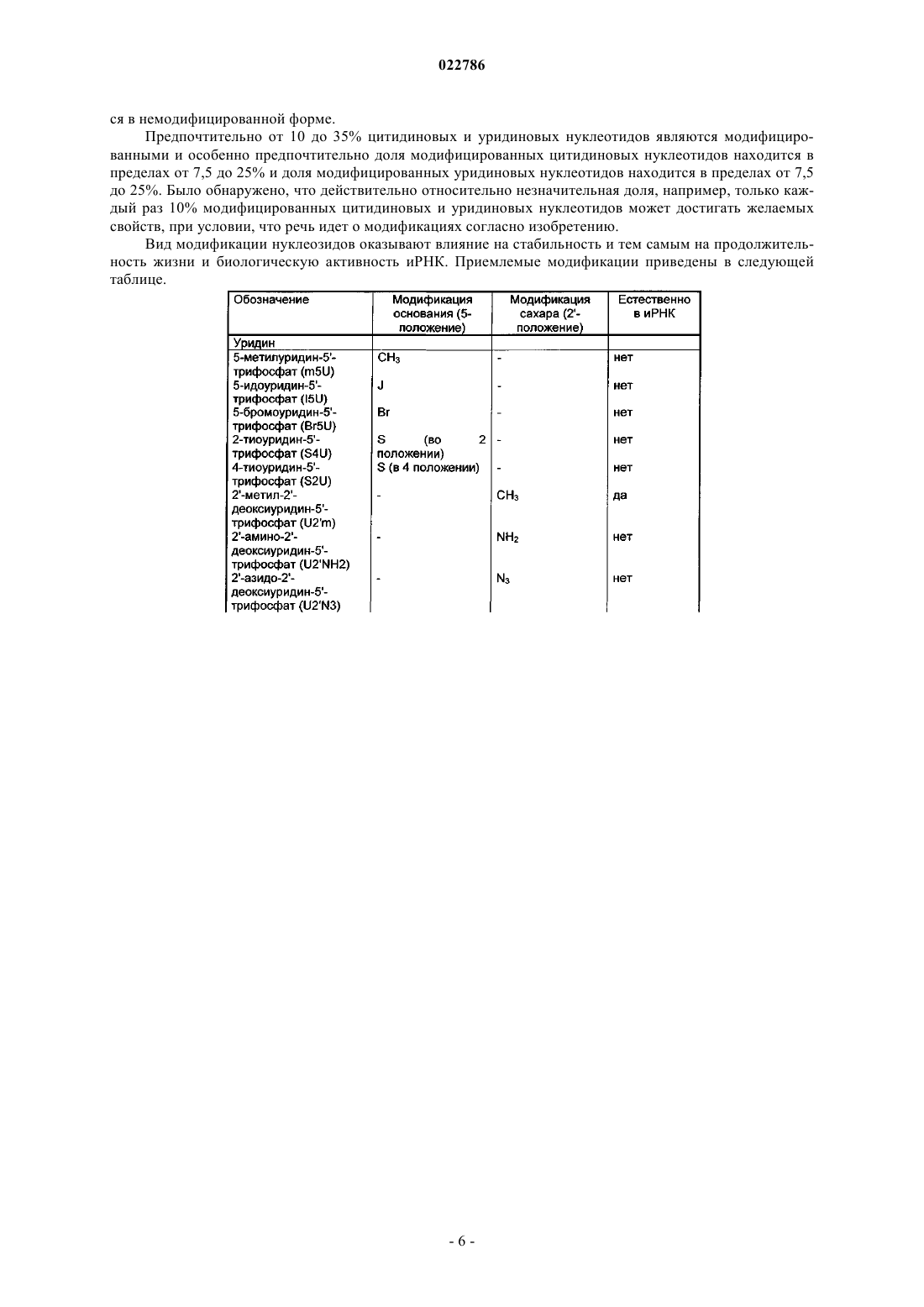
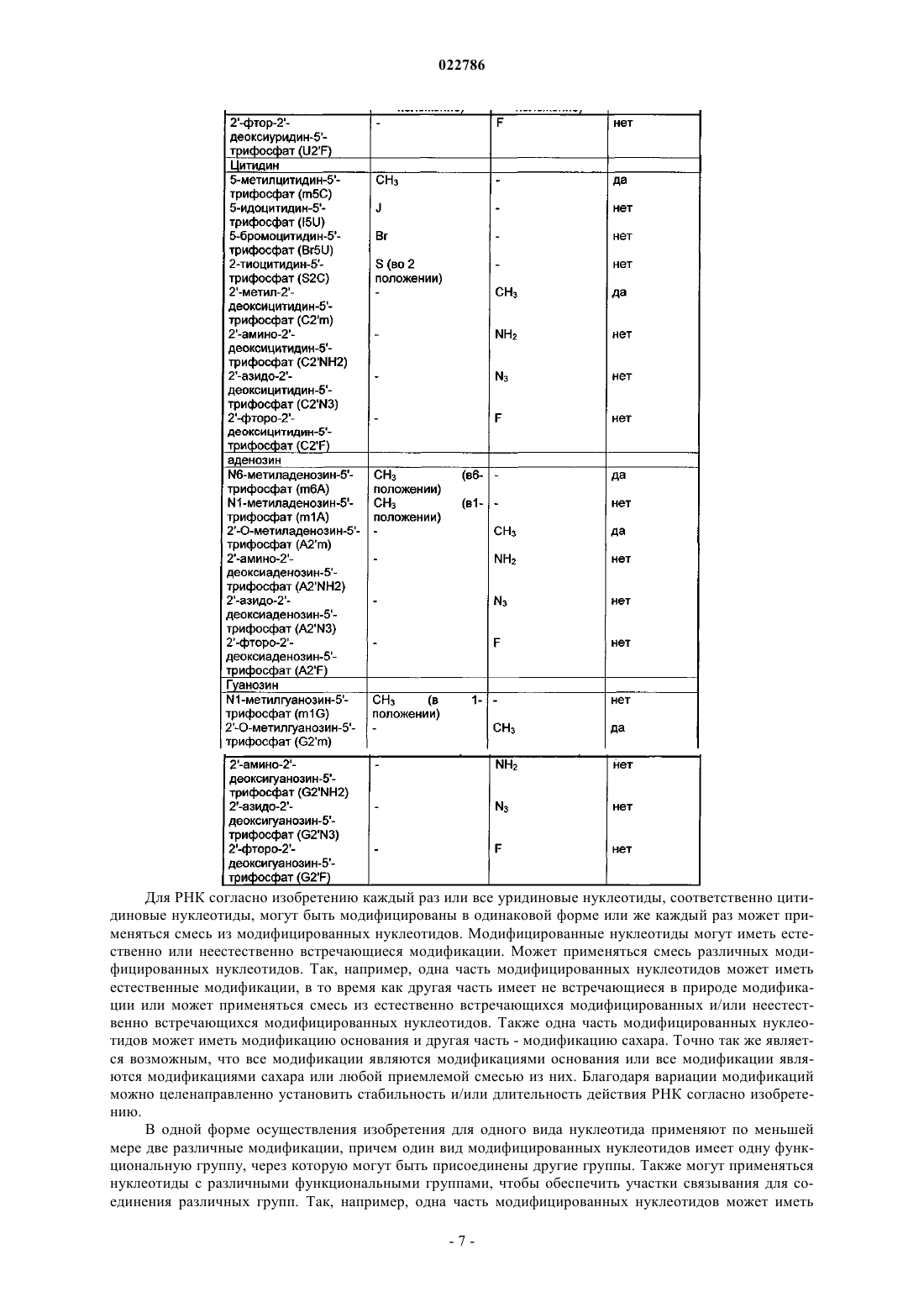
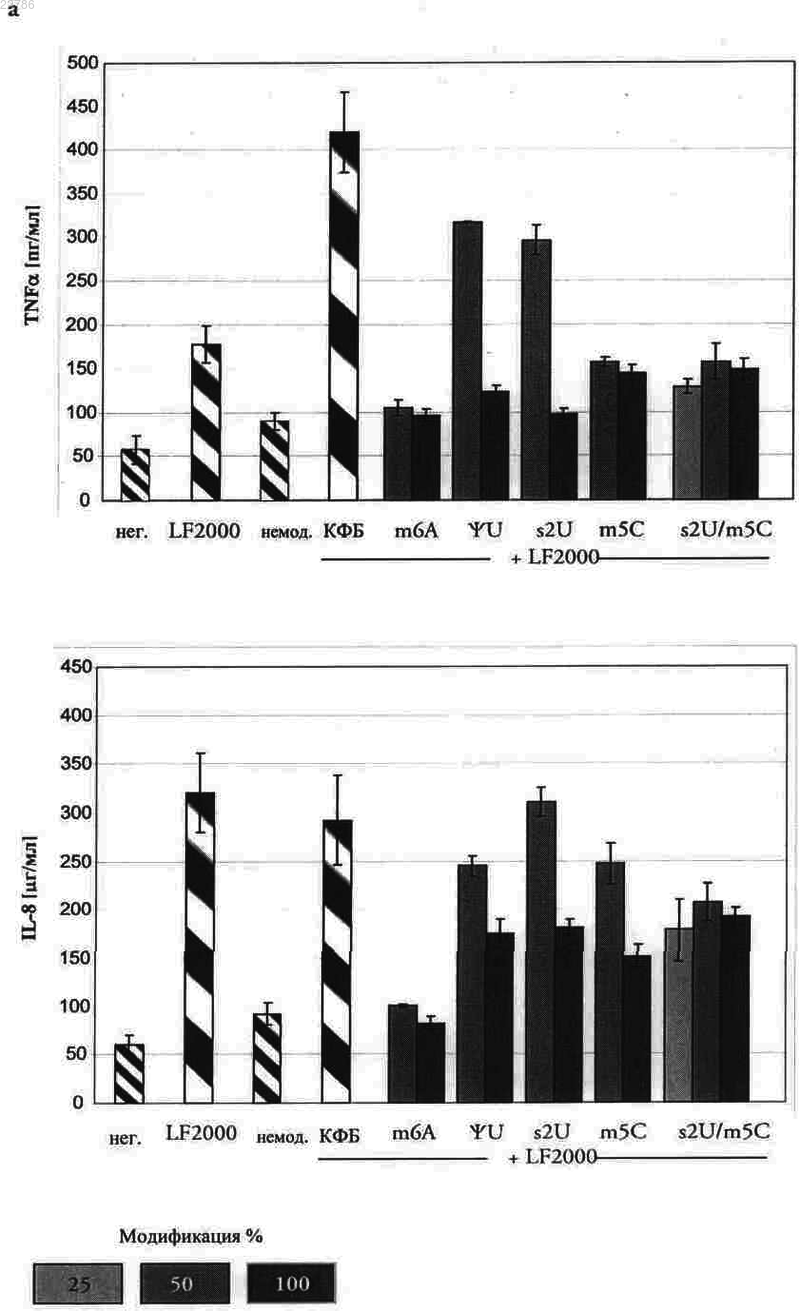
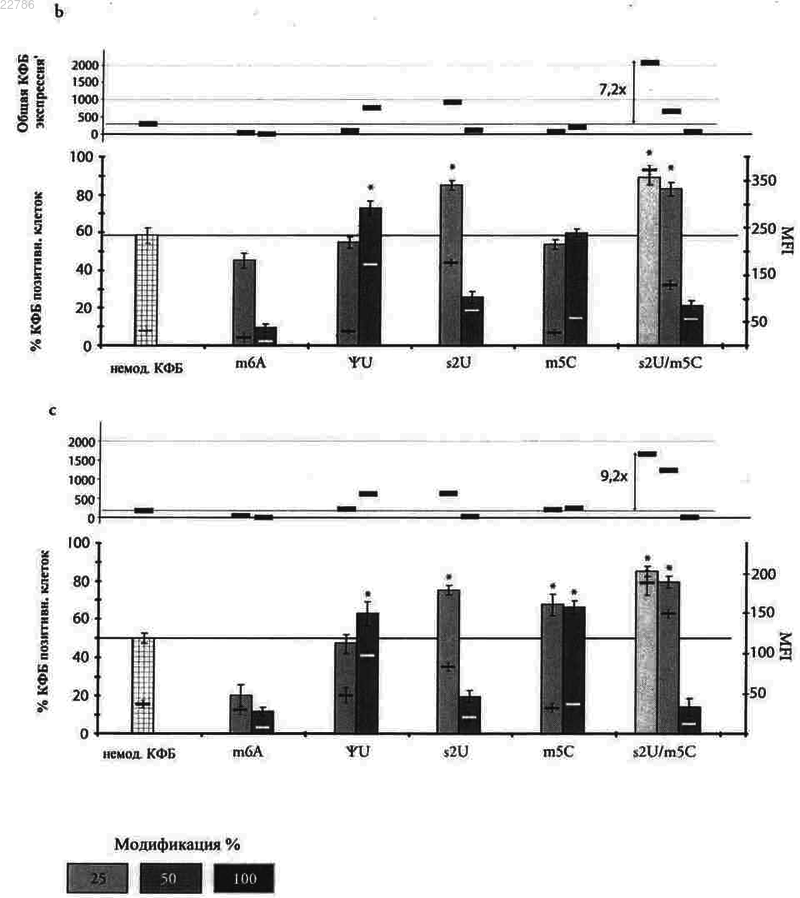
5. Полирибонуклеотид по одному из предыдущих пунктов, отличающийся тем, что модифицированные уридины выбраны из 2-тиоуридина, 5-метилуридина, псевдоуридина, 5-метилуридин-5'-трифосфата (m5U), 5-йдоуридин-5'-трифосфата (I5U), 4-тиоуридин-5'-трифосфата (S4U), 5-бромоуридин-5'-трифосфата (Br5U), 2'-метил-2'-деоксиуридин-5'-трифосфата (U2'm), 2'-амино-2'-деоксиуридин-5'-трифосфата (U2'NH2), 2'-азидо-2'-деоксиуридин-5'-трифосфата (U2'N3), 2'-фторо-2'-деоксиуридин-5'-трифосфата (U2'F), и/или отличающийся тем, что модифицированные цитидины выбраны из 5-метилцитидина, 3-метилцитидина, 2-тиоцитидина, 2'-метил-2'-деоксицитидин-5'-трифосфата (С2'm), 2'-амино-2'-деоксицитидин-5'-трифосфата (C2'NH2), 2'-фторо-2'-деоксицитидин-5'-трифосфата (С2'F), 5-йодцитидин-5'-трифосфата (I5U), 5-бромоцитидин-5'-трифосфата (Br5U), 2'-азидо-2'-деоксицитидин-5'-трифосфата (C2'N3), и/или отличающийся тем, что в 5'-конце он имеет m7GpppG-кэп, и/или по меньшей мере один IRES, и/или один полиА-хвост.
6. Полирибонуклеотид по одному из предыдущих пунктов, отличающийся тем, что он содержит последовательность иРНК, которая кодирует по меньшей мере один фактор, который является необходимым или поддерживающим для организма.
7. Полирибонуклеотид по одному из предыдущих пунктов, отличающийся тем, что он содержит последовательность РНК, которая кодирует фактор роста, фактор ангиогенеза, стимулятор, индуктор, фермент или другую биологически активную молекулу, и/или отличающийся тем, что он содержит последовательность иРНК, которая кодирует сурфактантный белок В (SP-B), ЭПО, ABCA3, ВМР-2 или его фрагмент, и/или далее содержащий по меньшей мере одну последовательность-мишень или одну целевую последовательность для эндогенных микроРНК, которые не экспрессируются в клетках-мишенях.
8. Применение полирибонуклеотида по одному из предыдущих пунктов для транскриптной заместительной терапии.
9. Применение полирибонуклеотида по п.8 для лечения респираторного дистресс-синдрома у новорожденных, когда он содержит кодирующую SP-B последовательность, или для лечения дефицита ЭПО, когда он содержит кодирующую ЭПО последовательность, или для покрытия имплантата, когда он содержит по меньшей мере одну последовательность, кодирующую фактор роста, фактор ангиогенеза, стимулятор, индуктор или фермент.
10. Фармацевтическая композиция, содержащая по меньшей мере один полирибонуклеотид по пп.1-7 вместе с фармацевтически приемлемыми вспомогательными веществами.
11. Фармацевтическая композиция по п.10 в форме для интратрахеального и/или пульмонального введения или в форме наносящегося на имплантат слоя, причем фармацевтическая композиция при необходимости дополнительно содержит по меньшей мере один перфторуглерод для введения перед или во время введения композиции, содержащей РНК, причем фармацевтическая композиция предпочтительно содержит перфторуглерод и s2U(0,25)m5C(0,25)SP-B-иРНК.
12. Имплантат с покрытием из полирибонуклеотида по одному из пп.1-7 в высвобождающемся замедленно полимере в качестве носителя.
13. Имплантат по п.12, который представляет собой зубной имплантат, эндопротез бедра, эндопротез коленного сустава или имплантат для спондилодеза.
14. Имплантат по п.12 или 13, причем полимер-носитель содержит по меньшей мере один вид модифицированной РНК, которая кодирует один или несколько факторов роста и один или несколько факторов ангиогенеза.
Текст
РНК С КОМБИНАЦИЕЙ ИЗ НЕМОДИФИЦИРОВАННЫХ И МОДИФИЦИРОВАННЫХ НУКЛЕОТИДОВ ДЛЯ ЭКСПРЕССИИ БЕЛКОВ В изобретении описывается полирибонуклеотид с последовательностью, которая кодирует белок или фрагмент белка, причем полирибонуклеотид включает комбинацию из немодифицированных и модифицированных нуклеотидов, причем от 5 до 50% уридиновых нуклеотидов и от 5 до 50% цитидиновых нуклеотидов представляют собой модифицированные уридиновые нуклеотиды,соответственно модифицированные цитидиновые нуклеотиды. Изобретение относится к полирибонуклеотиду, в особенности к информационной РНК, который/которая содержит комбинацию из немодифицированных и модифицированных нуклеотидов, для экспрессии белков и к применению подобных РНК для лечения заболеваний и для способов диагностики. Информационные РНК (иРНК) представляют собой полимеры, которые состоят из структурных компонентов нуклеозид-фосфат главным образом с аденозином, цитидином, уридином и гуанозином в качестве нуклеозидов, которые как промежуточные носители несут генетическую информацию от ДНК в клеточном ядре в цитоплазму, где она переводится в белки. Таким образом, они пригодны в качестве альтернативы экспрессии генов. Исследование биохимических процессов в клетке и исследование человеческого генома раскрыли взаимосвязь между искаженными генами и болезнями. Поэтому уже давно существовало желание посредством генной терапии лечить болезни, основывающиеся на искаженных генах. Ожидания были высоки, однако, как правило, испытания терпели неудачу. Первая концепция для генной терапии состояла в том, чтобы доставить неповрежденную ДНК искаженного или дефектного гена в одном векторе в ядро клетки, чтобы достичь экспрессии исправного гена и тем самым предоставления недостающего или испорченного белка. Как правило, эти испытания не были успешными, и немногие благополучные исследования были обременены значительными побочными эффектами, в особенности повышенным онкогенезом. Кроме того, существуют болезни, которые основываются на недостатке белков или дефекте белков,без того что это сводится к генетическому дефекту. В таком случае также принимается во внимание выработка соответствующих белков in vivo путем введения ДНК. Также существует подготовка факторов,имеющих значение в обмене веществ и по патологическим или непатологическим причинам повреждение или ингибирование, которые можно было бы лечить с помощью терапии нуклеиновой кислотой, не имеющей побочных эффектов или имеющей незначительные побочные эффекты. Также уже предлагалось использовать иРНК для терапии заболеваний, чтобы лечить генетические дефекты, приводящие к заболеваниям. При этом преимущество состоит в том, что иРНК должна вноситься только в цитоплазму клетки, а не должна вводиться в ядро. Введение в ядро является затруднительным и неэффективным, кроме того, существует значительный риск того, что хромосомная ДНК изменится, если вектор или его часть встроится в геном. Хотя могло показаться, что транскрибируемая in vitro информационная РНК может действительно экспрессировать в ткани млекопитающего, разумеется, при попытке использовать иРНК для терапии заболеваний возникали другие трудности. Недостаточная устойчивость иРНК приводила к тому, что желаемый белок невозможно было предоставить в достаточном количестве в ткань млекопитающего. Другой существенный недостаток заключался в том, что иРНК вызывает значительные иммунологические реакции. Исходили из того, что эти сильные иммунные реакции возникают вследствие связывания с Tollподобными рецепторами, такими как TLR3, TLR7, TLR8 и геликаза-RIG-1. Для того чтобы предотвратить иммунологическую реакцию, в заявке WO 2007/024708 было предложено использовать РНК, в которой один из четырех рибонуклеотидов заменен модифицированным нуклеотидом. В частности, исследовали, как себя ведет иРНК, в которой уридин в совокупности заменен псевдоуридином. Было обнаружено, что подобная молекула РНК является существенно менее иммуногенной. Тем не менее, для успешной терапии биологическая активность этих продуктов по-прежнему не является удовлетворительной. Кроме того, оказалось, что очень трудно получить или вообще не получить последовательности РНК, в которых два или более вида нуклеотидов полностью заменены модификациями. Для того чтобы предоставить организму необходимые или полезные белки и/или чтобы можно было посредством нуклеиновых кислот лечить заболевание, зависящее от недостатка или отсутствия белков, желательно иметь в распоряжении нуклеиновую кислоту, которая может трансфицировать клетки,которая остается стабильной в клетке достаточно долго и доставляет достаточное количество белка, так что избегается слишком частая дозировка. И одновременно эта нуклеиновая кислота может не вызывать иммунологические реакции в значительном количестве. Поэтому задача настоящего изобретения состояла в том, чтобы предложить средство, пригодное для терапии заболеваний, вызванных недостающими или дефектными генами, соответственно недостающими или дефектными белками, или которое может in vivo вырабатывать необходимые или полезные белки, которое не вызывает или вызывает сильно уменьшенный иммунный ответ, является стабильным в физиологической среде, т.е. расщепляется не сразу после введения, и в целом пригодно как средство для терапии. Далее задача изобретения состояла в том, чтобы предоставить средство для терапии заболеваний, на которые можно оказать положительное влияние посредством образования белков in vivo. Эта задача решается с помощью полирибонуклеотида, определенного в п.1 формулы изобретения. В частности, пригодной является иРНК, которая кодирует белок или фрагмент белка, дефект или недостаток которого является вредным для организма, соответственно его экспрессия является благоприятной для организма. Если в дальнейшем используется понятие "полирибонуклеотид" или "иРНК", то таким образом, если в контексте не указано другое, всегда следует исходить из того, что при этом речь идет о полирибонуклеотиде или иРНК, которая кодирует белок или фрагмент белка, что связано с болезнью или недостатком, как описано выше, или кодирует белок или фрагмент белка, который является полезным или поддерживающим для организма. Неожиданно было обнаружено, что вышеуказанные проблемы с рибонуклеиновой кислотой, соответственно полирибонуклеотидами (в дальнейшем также обозначаются как РНК), в особенности с информационной РНК (иРНК), можно решить, если использовать РНК, которая содержит как немодифицированные, так и модифицированные нуклеотиды, причем существенным является то, что каждый раз имеется предопределенная доля уридиновых и цитидиновых нуклеотидов в модифицированной форме. Далее неожиданно было установлено, что РНК, в двух видах нуклеотидов частично заменены каждый раз модифицированными нуклеотидами, показывают высокую эффективность трансляции и трансфекции, т.е. РНК трансфицирует большее количество клеток и вырабатывает больше кодируемого белка на клетку, чем это было возможно с известными РНК. Сверх того, модифицированная РНК согласно изобретению является активной более продолжительное время, чем известная из уровня техники РНК или немодифицированная РНК. Преимущества, достигнутые с помощью РНК согласно изобретению, не получают ни с помощью немодифицированных, ни с помощью полностью модифицированных РНК. Оказалось, что можно добиться как сниженной иммуногенности, так и повышенной стабильности, если целенаправленно устанавливается доля модифицированных уридиновых и цитидиновых нуклеотидов в иРНК и, по меньшей мере, каждый раз составляет 5%, но не белее чем 50%. Если иРНК применяется без модификаций, то она является чрезвычайно иммуногенной, в то время как, если все уридиновые и цитидиновые нуклеотиды находятся в модифицированной форме, то биологическая активность является незначительной, чтобы можно было использовать для терапевтических целей. РНК, в которой доля модифицированных нуклеотидов является очень высокой, можно совсем не получить или получить при очень трудных условиях. Таким образом, было установлено, что смесь нуклеотидов, которая содержит только псевдоуридин вместо уридина и только модифицированный цитозин и/или модифицированный аденозин, не может представить последовательность РНК. Однако неожиданно можно было получить последовательности РНК,которые модифицированы способом согласно изобретению, без затруднений с рациональной эффективностью. Кроме того, было обнаружено, что критическим является вид модифицирования. Модифицированные согласно изобретению иРНК показывают незначительную иммуногенность и имеют длительную продолжительность жизни. Было обнаружено, что стабильность РНК согласно изобретению сильно повышается по сравнению с применяемыми до сих пор нуклеиновыми кислотами. Таким образом, было установлено, что иРНК согласно изобретению через 10 дней после трансфекции обнаруживается в 10-кратно большем количестве,чем немодифицированные иРНК. Наряду с высокими скоростями трансфекции, прежде всего, повышенная продолжительность жизни способствует использованию иРНК согласно изобретению для терапевтических целей, так как высокая стабильность и вместе с тем длительная продолжительность жизни позволяет принимать дозировку в более длительные периоды времени, которые таким образом также являются приемлемыми для пациентов. Тем самым согласно изобретению предлагается особенно выгодное средство для терапевтических целей. РНК согласно изобретению удовлетворяет условиям, которые ставятся к продукту, применяемому в терапии: в качестве РНК она должна вводиться для проявления действия только в цитоплазме, а не в клеточном ядре, не существует опасности интеграции в геном, вид модифицирования согласно изобретению существенно предотвращает иммунную реакцию и, кроме того, модификация защищает РНК от быстрого распада. Таким образом, с помощью РНК согласно изобретению удается генерировать или регенерировать физиологические функции в тканях, например функции, которые были нарушены вследствие недостающего или дефектного гена, восстановить in vivo и тем самым лечить заболевания, вызванные недостающими или дефектными генами. Далее неожиданно было обнаружено, что полирибонуклеотиды согласно изобретению могут оказывать положительное влияние тем, что in vivo образуются белки, которые могут прямо или опосредованно влиять на течение болезни. Поэтому согласно изобретению могут быть также приготовлены полирибонуклеотиды, кодирующие такие факторы, которые в общем или в определенной ситуации являются полезными и поддерживающими для организма, например факторы роста, факторы ангиогенеза, стимуляторы, индукторы, ферменты или другие биологически активные молекулы. Подробнее изобретение поясняется в последующем описании и на прилагающихся чертежах. Фиг. 1 показывает влияние различных модификаций нуклеотида на иммуногенность и стабильность разных иРНК. Фиг. 1 а представляет собой диаграмму, в которой представлен TNFуровень после введения разных РНК с различными модифицированными нуклеотидами. Немодифицированная и на 25% однократно модифицированная РНК приводит к высокому уровню маркеров воспаления и демонстрирует высокую иммуногенность этой РНК, в то время как для дважды модифицированной РНК согласно изобретению маркеры воспаления находятся в допустимом количестве. Фиг. 1b и 1c показывают биологическую активность (эффективность трансфекции и экспрессию) модифицированных различным обра-2 022786 зом иРНК в клетках человека и клетках мыши как процентное содержание положительных для красного флуоресцирующего белка (КФБ) клеток и количество КФБ на клетку. Диаграммы показывают, что белки, кодированные немодифицированной, однократно модифицированной и полностью модифицированной РНК могут обнаруживаться только в незначительном процентном содержании, в то время как согласно изобретению частично дважды модифицированная РНК на основании ее высокой стабильности обеспечивает существенно более высокие количества белка. Фиг. 2 для многократно модифицированной иРНК показывает высокую стабильность и более длительную продолжительность экспрессии. Фиг. 2a и 2b каждый раз показывают диаграммы, в которых представлена продолжительность экспрессии разных модифицированных и немодифицированных иРНК. Фиг. 2c показывает данные иммунной преципитации РНК для немодифицированной РНК, однократно модифицированной РНК и многократно модифицированной РНК. Фиг. 2d показывает диаграммы, в которых представлена иммуногенность разных иРНК после внутривенного введения in vivo. Данные показывают, что двукратно модифицированная РНК согласно изобретению обладает комбинацией из высокой стабильности и незначительной иммуногенности. Фиг. 3 показывает разные результаты тестов, которые были получены после интратрахеального аэрозольного применения модифицированной SP-B-иРНК в SP-B условно дефектных мышей. Фиг. 3a показывает биолюминесцентные снимки легких мышей, которых обрабатывали немодифицированной и многократно модифицированной РНК. Можно вразумительно увидеть, что только от модифицированной РНК согласно изобретению даже еще через 5 дней экспрессируется достаточное количество белка, в то время как у немодифицированной РНК уже через 3 ч экспрессия является незначительной. Фиг. 3b показывает диаграмму, в которой представлен поток по сравнению со временем после трансфекции. Можно явно распознать, что модификация согласно изобретению продлевает продолжительность экспрессии. Фиг. 3c показывает дозировочную схему для SP-B-иРНК. Фиг. 3dпоказывает диаграмму, которая представляет процент выживаемости мышей, которых подвергали лечению модифицированной иРНК по сравнению с мышами, которых обрабатывали контрольной иРНК, причем выживаемость у мышей, обработанных РНК согласно изобретению, является отчетливо более продолжительной. Фиг. 3e показывает имуноокрашивание, причем видно, что с помощью РНК согласно изобретению, которая кодирует SP-B,SP-B могла быть восстановлена в SP-B дефектных мышей. Фиг. 3f как результат полуколичественного анализа Вестерн-Блот показывает распределение белков в бесклеточной фракции БАЛЖ (бронхоальвеолярная лаважная жидкость). Фиг. 3g и 3h показывают снимки гистологических препаратов легких и препараты бронхоальвеолярного лаважа согласно фиг. 3c обработанных мышей. В то время как препараты легких и лаважа мышей получили контрольные РНК, которые для дефицита SP-B указывали обычные повреждения легких, препараты мышей, обработанных с помощью РНК согласно изобретению, были без изменений. Фиг. 3i показывает диаграмму совместимости легких с течением времени. При обработке с помощью РНК согласно изобретению легочная функция сохраняется в течение длительного промежутка времени, в то время как у животных, обработанных с помощью контрольной РНК, были обнаружены повреждения легких. Фиг. 4 показывает диаграмму, в которой была представлена интенсивность флуоресценции образованного КФБ в течение времени для немодифицированных и различно модифицированных иРНК. Модифицированная иРНК, в противоположность немодифицированной иРНК, транслируется позже и менее сильно. Фиг. 5 показывает три диаграммы, в которых представлены маркеры воспаления для мышей, обработанных различных иРНК. Можно отчетливо обнаружить, что модифицированная РНК согласно изобретению не вызывает воспалительные реакции, в то время как немодифицированная РНК приводит к сильной иммунной реакции. Фиг. 6 показывает диаграммы, в которых представлены различные, типичные легким параметры для мышей, обработанных разными иРНК согласно изобретению. Параметрами являются эластичность ткани (HL), демпфирование ткани (GL), инерционность ткани, сопротивление дыхательных путей (Rn) и состав легочной ткани Eta (GL/HL). Для РНК согласно изобретению не ухудшился ни один из параметров по сравнению с положительной контрольной группой. Фиг. 7 показывает экспрессионную способность модифицированной иРНК в диаграмме, в которой представлено процентное содержание КФБ позитивных клеток для иРНК с разной долей модифицированных нуклеотидов. Сравнение показывает, что только модифицированная иРНК согласно изобретению приводит к длительно стойкой экспрессии, в то время как модифицированная иРНК не согласно изобретению как в человеческих клетках, так и в клетках мышей экспрессируется в незначительной мере. Фиг. 8 показывает экспрессионную способность различно модифицированной иРНК в диаграмме, в которой представлено процентное содержание КФБ позитивных клеток для иРНК с различно модифицированными нуклеотидами. Сравнение показывает, что только модифицированная иРНК согласно изобретению приводит к длительно стойкой экспрессии, в то время как модифицированная иРНК не согласно изобретению как в человеческих клетках, так и в клетках мышей экспрессируется в незначительной мере. Фиг. 9 показывает стабильность сублимированной РНК согласно изобретению. Фиг. 10a показывает диаграмму, в которой представлена эффективность трансфекции для различ-3 022786 ных модифицированных нуклеотидов. Можно отчетливо распознать, что достигается наивысшая эффективность трансфекции с РНК, в которой модифицированы 10% уридиновых нуклеотидов и 10% цитидиновых нуклеотидов и при необходимости еще 5% других нуклеотидов. Фиг. 10b показывает диаграмму, в которой представлено образование TNF- в качестве маркера для иммунологической реакции для РНК с различно модифицированными нуклеотидами. Это результаты ELISA человеческих РВМС, которые каждый раз были трансфицированы с 5 мкг иРНК. Норма модификации, если не указано другое, каждый раз составляла 10%. Можно отчетливо увидеть, что РНК, в которой модифицированы от 5 до 50% уридиновых нуклеотидов и цитидиновых нуклеотидов, обладает явно сниженной иммуногенностью по сравнению с немодифицированной РНК. Фиг. 11 показывает результаты различных тестов, с помощью которых измеряли стабильность и иммуногенность модифицированной иРНК согласно изобретению, которая кодирует ЭПО. Диаграмма фиг. 11 а показывает долю эритропоэтина, который обнаруживается через 14 дней после введения иРНК,кодирующей ЭПО, которая модифицирована разным способом. Можно четко увидеть, что через 14 дней доля ЭПО у мышей, которым впрыскивали модифицированную иРНК согласно изобретению, в 4,8 раза выше, чем у необработанных мышей, но также в 4,8 раза выше, чем у мышей, обработанных немодифицированной РНК, и все еще в 2,5 раза выше, чем у мышей, обработанных однократно модифицированной РНК. Диаграмма фиг. 11b показывает значения гематокрита через 14 дней, соответственно 28 дней после введения кодирующей ЭПО иРНК с различными модификациями. Диаграмма четко показывает, что мыши, обработанные модифицированной иРНК согласно изобретению, имеют значительно более высокое значение гематокрита. В диаграмме фиг. 11 с представлено изображение факторов, типичных для иммунологической реакции. Выясняется, что повышены все четыре маркера воспаления при введении немодифицированной иРНК, в то время как при модифицированной РНК согласно изобретению иммунологическая реакция едва обнаруживается. Диаграммы фиг. 11d показывают соответствующие значения для IFN- и IL-12, которые равным образом являются маркерами воспаления. Также здесь выясняется, что согласно изобретению модифицированная иРНК практически не вызывает иммунологическую реакцию в противоположность немодифицированной иРНК. Фиг. 12 показывает диаграмму, в которой представлен процент выживаемости трех групп мышей,которые получали согласно изобретению модифицированную SP-B-иРНК дважды в неделю (В), соответственно в течение 28 дней дважды в неделю (С) или в сравнительной группе модифицированную УЗФБLuk-иРНК (А). Оказывается, что мыши выживали только тогда, если они получали SP-B-иРНК (В, С). Без введения SP-B-иРНК мыши умирали (А). Фиг. 13 показывает уровень цитокина в бронхоальвеолярном лаваже мышей через 8 ч после применения немодифицированной SP-B-иРНК, модифицированной SP-B-иРНК согласно изобретению, соответственно SP-B-плазмидной ДНК. Результаты показывают, что в противоположность интратрахеальному применению немодифицированной иРНК или плазмидной ДНК, которые каждый раз приводят к сильному повышению маркеров воспаления IFN- и IL-12, при введении модифицированной SP-B-иРНК согласно изобретению маркеры воспаления практически не повышены по сравнению с необработанной группой, соответственно с группой, обработанной перфторуглеродом. Фиг. 14 показывает значения гематокрита, которые получены после повторного применения модифицированной иЭПО-иРНК согласно изобретению. Результаты показывают, что повторное применение модифицированной иЭПО-иРНК согласно изобретению переносится хорошо и приводит к длительно стойкому повышению гематокрита. Фиг. 15 показывает люциферазную экспрессию клеток, которые были инкубированы титановыми имплантатами, которые были снабжены различными формами покрытий, содержащих модифицированную РНК согласно изобретению. Оказалось, что модифицированная РНК согласно изобретению, которая содержалась в покрытии из замедленно высвобождающегося полимера, которое было нанесено на титановые пластины, и постепенно выпускалась из него, не теряла своей активности. Фиг. 16 показывает люциферазную экспрессию нанесенных на титановые имплантаты покрытий,которые содержали модифицированную иРНК. Оказалось, что экспрессия белка для модифицированной иРНК согласно изобретению была намного выше, чем для необработанной РНК, но также была выше,чем для плазмидной ДНК. Фиг. 17a и 17b показывают относительную долю позитивных клеток КФБ соответственно относительной экспрессии КФБ от иРНК, которая имеет участки связывания микро-РНК для микро-РНК 1423 р. Выяснилось, что доля позитивных клеток КФБ для РНК, имеющей участки связывания микро-РНК была ниже и экспрессия кодированного белка была значительно меньшей в клетках, которые содержали соответствующую микро-РНК 142-3 р. Фиг. 18 показывает последовательность посредством встраивания участков связывания микро-РНК модифицированной РНК, которая кодирует КФБ. Подчеркивание, выделенное серым цветом, представляет собой последовательность КФБ. Подчеркиванием выделено четырехкратное последовательное воспроизведение участка связывания микроРНК для микроРНК 142-3 р (подчеркнуто светло-серым) со спейсерными последовательностями (не подчеркнуто). Согласно изобретению подготавливают молекулу полирибонуклеотида с частично многократно модифицированными нуклеотидами, частично многократно модифицированную иРНК, IVT-иРНК, а также применение молекулы РНК для получения лекарственного средства для лечения заболеваний, зависящих от отсутствующих или дефектных генов или для лечения заболеваний, которые могут быть облегчены или излечены путем выработки белков in vivo, таких как факторы, стимуляторы, индукторы или ферменты. В одной другой форме осуществления иРНК согласно изобретению комбинируется с участками связывания мишени, целевыми последовательностями и/или с участками связывания микро-РНК, чтобы допустить активность желаемой иРНК только в надлежащие клетки. В одной другой форме осуществления РНК согласно изобретению комбинируется с микроРНК или малыми РНК ниже 3'полиА-хвоста. В одной другой форме осуществления в распоряжение предоставляется РНК, длительность действия которой была установлена или продлевалась путем других целенаправленных модификаций. Таким образом, объектом изобретения является РНК с повышенной стабильностью и сниженной иммуногенностью. РНК согласно изобретению может быть создана известным образом. Как правило, она вырабатывается посредством транскрипции ДНК, которая кодирует интактный или желаемый белок,который может влиять на болезнь, или отсутствие или дефицитная форма которого вызывает заболевание. Под РНК в рамках настоящего изобретения следует понимать каждую молекулу полирибонуклеотида, которая, если она попадает в клетку, пригодна для экспрессии белка или его фрагмента, соответственно способна транслировать белок или его фрагмент. Понятие "белок" при этом включает любой вид аминокислотной последовательности, т.е. цепи из двух или более аминокислот, которые каждый раз связаны пептидными связями и включают пептиды, а также гибридные белки. РНК согласно изобретению содержит последовательность рибонуклеотидов, которая кодирует белок или его фрагмент, функция которого используется или необходима в клетке или в клеточной среде,например белок, отсутствие которого или дефектная форма которого является разрешающим фактором для заболевания или недуга, его выработка может облегчить или предотвратить заболевание или недуг,или белок, который может способствовать процессу, полезному для организма, в клетке или в ее среде. Как правило, РНК согласно изобретению содержит последовательность для полного белка или его функционального варианта. Далее, последовательность рибонуклеотидов может кодировать белок или его функциональный фрагмент, который действует как фактор, индуктор, регулятор, стимулятор или фермент, причем этот белок представляет собой такой, функция которого необходима, для того чтобы ликвидировать нарушение, в особенности нарушение обмена веществ, или чтобы in vivo инициировать процессы, такие как образование новых сосудов, тканей и т.д. При этом под функциональным вариантом понимается фрагмент, который в клетке может взять на себя функцию белка, функция которого используется в клетке или отсутствие или дефект которого является вызывающим заболевание. Сверх того,РНК согласно изобретению также может иметь другие функциональные области и/или 3'- и 6'некодирующие области. 3'- и/или 5-некодирующие области могут быть областями, которые естественно фланкируют кодированный белок или же искусственными последовательностями, которые способствуют стабилизации РНК. Специалист в данной области техники может найти каждый раз приемлемые для этого последовательности в ходе рутинных экспериментов. В одной предпочтительной форме осуществления РНК содержит m7GpppG-Сар, Internal RibosomeEntry Site (IRES) и/или полиА-хвост в 3'-конце, в особенности для того чтобы улучшить трансляцию. РНК может иметь другие участки, способствующие трансляции. Существенной для РНК согласно изобретению является доля модифицированных нуклеотидов. Согласно изобретению РНК с повышенной стабильностью и сниженной иммуногенностью получается вследствие того, что для ее получения применяется смесь нуклеотидов, в которой устанавливается доля модифицированных цитидиновых нуклеотидов и модифицированных уридиновых нуклеотидов. Предпочтительно РНК согласно изобретению получается со смесью нуклеотидов, которая содержит как немодифицированные, так и модифицированные нуклеотиды, причем от 5 до 50% цитидиновых нуклеотидов и от 5 до 50% уридиновых нуклеотидов являются модифицированными. Аденозинсодержащие и гуанозинсодержащие нуклеотиды могут быть немодифицированными. Равным образом можно применять смесь нуклеотидов, в которой некоторые из ATPs и/или GTPs тоже являются модифицированными,причем их доля не должна превышать 20% и причем предпочтительно их доля, при наличии, должна находиться в пределах от 0,5 до 10%. Поэтому в одной предпочтительной форме осуществления в распоряжение предоставляется иРНК,которая имеет от 5 до 50% модифицированных цитидиновых нуклеотидов и от 5 до 50% уридиновых нуклеотидов, а также от 50 до 95% немодифицированных цитидиновых нуклеотидов, от 50 до 95% модифицированных уридиновых нуклеотидов, причем аденозиновые и гуанозиновые нуклеотиды могут быть немодифицированными или частично модифицированными, причем предпочтительно они находят-5 022786 ся в немодифицированной форме. Предпочтительно от 10 до 35% цитидиновых и уридиновых нуклеотидов являются модифицированными и особенно предпочтительно доля модифицированных цитидиновых нуклеотидов находится в пределах от 7,5 до 25% и доля модифицированных уридиновых нуклеотидов находится в пределах от 7,5 до 25%. Было обнаружено, что действительно относительно незначительная доля, например, только каждый раз 10% модифицированных цитидиновых и уридиновых нуклеотидов может достигать желаемых свойств, при условии, что речь идет о модификациях согласно изобретению. Вид модификации нуклеозидов оказывают влияние на стабильность и тем самым на продолжительность жизни и биологическую активность иРНК. Приемлемые модификации приведены в следующей таблице. Для РНК согласно изобретению каждый раз или все уридиновые нуклеотиды, соответственно цитидиновые нуклеотиды, могут быть модифицированы в одинаковой форме или же каждый раз может применяться смесь из модифицированных нуклеотидов. Модифицированные нуклеотиды могут иметь естественно или неестественно встречающиеся модификации. Может применяться смесь различных модифицированных нуклеотидов. Так, например, одна часть модифицированных нуклеотидов может иметь естественные модификации, в то время как другая часть имеет не встречающиеся в природе модификации или может применяться смесь из естественно встречающихся модифицированных и/или неестественно встречающихся модифицированных нуклеотидов. Также одна часть модифицированных нуклеотидов может иметь модификацию основания и другая часть - модификацию сахара. Точно так же является возможным, что все модификации являются модификациями основания или все модификации являются модификациями сахара или любой приемлемой смесью из них. Благодаря вариации модификаций можно целенаправленно установить стабильность и/или длительность действия РНК согласно изобретению. В одной форме осуществления изобретения для одного вида нуклеотида применяют по меньшей мере две различные модификации, причем один вид модифицированных нуклеотидов имеет одну функциональную группу, через которую могут быть присоединены другие группы. Также могут применяться нуклеотиды с различными функциональными группами, чтобы обеспечить участки связывания для соединения различных групп. Так, например, одна часть модифицированных нуклеотидов может иметь одну азидогруппу, одну аминогруппу, одну гидроксигруппу, одну тиольную группу или какую-нибудь другую реакционноспособную группу, которая пригодна для реакции при предопределенных условиях. Также функциональная группа может быть такой, которая при определенных условиях может активировать естественно имеющуюся способную к связыванию группу, так что могут присоединяться молекулы с функциями. Нуклеотиды, которые модифицированы так, что они обеспечивают участки связывания,могут также вводиться как аденозиновые или гуанозиновые модификации. Выбор приемлемых каждый раз модификаций и выбор предоставленных в распоряжение участков связывания зависит от того, какие группы должны вводиться и с какой частотой они должны быть в наличии. Таким образом, доля нуклеотидов, снабженных функциональными и/или активирующими группами, зависит от того, насколько высокой должна быть доля подлежащих присоединению групп и может быть легко определена специалистом в данной области техники. Как правило, доля модифицированных нуклеотидов с функциональными и/или активирующими группами, если имеются, составляет от 1 до 25% модифицированных нуклеотидов. При необходимости специалист в данной области техники благодаря рутинным экспериментам может определить каждый раз наиболее пригодные группы и их оптимальную долю. Было обнаружено, что особенно хорошие результаты достигаются тогда, когда РНК согласно изобретению содержит 2'-тиоуридин как модифицированный уридинсодержащий нуклеотид. Далее является предпочтительным, что РНК согласно изобретению содержит 5'-метилцитидин в качестве модифицированного цитидинового нуклеотида. И поэтому оба эти нуклеотида являются предпочтительными. Также предпочтительна комбинация из этих обеих модификаций. В одной особенно предпочтительной форме осуществления оба эти нуклеотида каждый раз содержатся в доле от 10 до 30%. При необходимости могут присоединяться по-другому модифицированные нуклеотиды, пока общая доля модифицированных нуклеотидов не превышает 50% соответствующего вида нуклеотидов. Предпочтительным является полирибонуклеотид, в котором от 5 до 50%, особенно предпочтительно от 5 до 30% и в особенности от 7,5 до 25% уридиновых нуклеотидов представляют собой 2'тиоуридиновые нуклеотиды, и от 5 до 50%, особенно предпочтительно от 5 до 30% и в особенности от 7,5 до 25% цитидиновых нуклеотидов представляют собой 5-метилцитидиновые нуклеотиды, причем аденозиновые и гуанозиновые нуклеотиды могут быть немодифицированными или частично модифицированными нуклеотидами. В одной предпочтительной форме осуществления эта иРНК согласно изобретению дополнительно имеет 7'-метилгуанозиновый кэп (шапочку) и/или поли(А)-конец. Таким образом,в одной предпочтительной форме осуществления получается иРНК в ее зрелом виде, т.е. с GppG-кэпом,IRES и/или полиА-хвостом. Оптимальные виды и доли модифицированных уридиновых нуклеотидов, соответственно цитидиновых нуклеотидов для одной специфической РНК могут быть определены с помощью рутинных экспериментов. В этой связи в качестве оптимальной обозначается иРНК, иммуногенность которой является настолько незначительной, что она не обременяет подлежащий лечению организм и обладает предопределенной стабильностью и вместе с тем предопределенной продолжительностью экспрессии. Способы контрольных испытаний и определения этих свойств известны специалисту в данной области техники и описаны ниже и в примерах. РНК согласно изобретению может быть получена известным образом. Например, пригодным является способ, при котором иРНК согласно изобретению получается благодаря транскрипции in vitro из смеси АТФ, ЦТФ, ГТФ и УТФ, причем от 5 до 50%, предпочтительно от 5 до 30% и в особенности от 7,5 до 25% цитидиновых нуклеотидов и от 5 до 50%, предпочтительно от 5 до 30% и в особенности от 7,5 до 25% уридиновых нуклеотидов являются модифицированными и остаток является немодифицированным. Гуанозиновые и аденозиновые нуклеозиды, в особенности аденозин, при необходимости равным образом могут быть модифицированными. Однако существенной для изобретения является модификация УТФ и ЦТФ в указанной области. Если доля модифицированного УТФ и/или ЦТФ является более низкой или более высокой, то больше не достигаются благоприятные свойства. Таким образом, было обнаружено,что вне заявленных областей иРНК больше не является такой стабильной. Кроме того, при более низкой доле модификации следует опасаться иммунологических реакций. Чтобы установить приемлемое соотношение немодифицированных и модифицированных нуклеотидов, пригодным образом РНК вырабатывается при применении смеси нуклеотидов, доли нуклеозидов которых в соответствии с желаемым соотношением частично модифицированы и частично немодифицированы, причем согласно изобретению по меньшей мере 5% уридиновых нуклеозидов и по меньшей мере 5% цитидиновых нуклеозидов модифицированы, однако в совокупности модифицированы не более чем каждый раз 50% уридиновых нуклеозидов, соответственно цитидиновых нуклеозидов. Другие нуклеозиды, т.е. аденозины и гуанозины, могут быть модифицированными, разумеется также для этих нукдлеозидов верхняя граница не должна превышать 50% модификации, предпочтительно 20%. Предпочтительно модифицированы только соответствующие доли уридиновых нуклеозидов и цитидиновых нуклеозидов. Подлежащие модификации нуклеозиды могут иметь модификации, которые также можно найти в естественно встречающихся нуклеозидах, например метилирования или вариации связи или же "синтетические", т.е. не встречающиеся в природе, или можно применять смесь нуклеозидов с природными и/или синтетическими модификациями. Таким образом, естественно модифицированные нуклеозиды по меньшей мере одного вида могут комбинироваться с синтетически модифицированными нуклеозидами того же самого вида или другого вида или также естественно и синтетически модифицированные нуклеозиды одного вида с только естественно, только синтетически или смешанно естественно/синтетически модифицированные нуклеозиды другого вида, причем "вид" здесь относится к виду нуклеозидов, т.е. АТФ, ГТФ, ЦТФ или УТФ. В некоторых случаях, как приведено выше, для улучшения иммуногенности и стабильности или для регулирования свойств могут быть выгодным модифицированные нуклеозиды с функциональными группами, которые предоставляют участки связывания, комбинировать с не функционально модифицированными нуклеозидами. В каждом случае наиболее приемлемый вид или комбинацию специалист в данной области техники может легко отыскать с помощью рутинных экспериментов, которые, например, также указываются ниже. Особенно предпочтительно в качестве модифицированных нуклеозидов используют 2-тиоуридин и 5-метилцитидин. Если желательными являются функционально модифицированные нуклеозиды, то предпочтительно принимают в расчет 2'-азидо- и 2'-аминонуклеозиды. Длина используемой согласно изобретению иРНК зависит от генного продукта, соответственно белка или фрагмента белка, который должен быть предоставлен, соответственно дополнен. Поэтому иРНК может быть очень короткой, например иметь только 20 или 30 нуклеотидов, или же соответственно длина гена может иметь несколько тысяч нуклеотидов. Специалист в данной области техники может выбирать каждый раз пригодную последовательность обычным образом. Существенным является то, что может быть предоставлена функция белка, вызывающего заболевание, белка, облегчающего или предотвращающего заболевание, соответственно белка, обеспечивающего полезное свойство, для которого должна использоваться иРНК. Предпочтительно для получения РНК согласно изобретению применяют 2'-тиоуридин в качестве модифицированного уридинсодержащего нуклеотида. Далее предпочтительно применять 5'метилцитидин в качестве модифицированного цитидинового нуклеотида. Поэтому предпочтительно для получения РНК согласно изобретению используют смесь нуклеотидов, которая наряду с АТФ и ГТФ каждый раз содержит от 95 до 50% немодифицированного ЦТФ и от 95 до 50% немодифицированного УТФ, а также от 5 до 50% 2'-тиоуридиновых нуклеотидов и от 5 до 50% метилцитидиновых нуклеотидов. Поэтому особенно предпочтительным является полирибонуклеотид, в котором от 5 до 50, предпочтительно от 5 до 30 и в особенности от 7,5 до 25% уридиновых нуклеотидов являются 2'-тиоуридиновыми нуклеотидами, от 5 до 50%, предпочтительно от 5 до 30% и в особенности от 7,5 до 25% цитидиновых нуклеотидов являются 5'-метилцитидиновыми нуклеотидами, причем аденозиновые и гуанозиновые нуклеотиды являются немодифицированными нуклеотидами. Подобная комбинация приводит к получению частично модифицированной РНК, которая отличается особенно высокой стабильностью. Можно было показать, что РНК, которая была получена с помощью смеси нуклеотидов, которая в качестве ЦТФ, соответственно УТФ каждый раз содержала от 5 до 50% 2-тиоуридиновых, соответственно 5 метилцитидиновых нуклеотидов, является особенно стабильной, т.е. по сравнению с немодифицированной или известным образом модифицированной РНК имела до 10-кратно повышенную жизнеспособность. В другой предпочтительной форме осуществления являются из от 5 до 50% модифицированных уридиновых, соответственно цитидиновых нуклеотидов от 1 до 50%, предпочтительно от 2 до 25% такие нуклеотиды, которые в качестве модификации имеют группы, создающие или активирующие участки связывания, т.е. каждый раз от 0,5 до 20%, предпочтительно от 1 до 10% цитидиновых нуклеотидов и/или уридиновых нуклеотидов могут иметь модификацию, которая создает участок связывания, как,например, азидо-, NH-, SH- или ОН-группы. Благодаря этой комбинации предоставляется как особенно стабильная, так и неустойчивая РНК. Далее предпочтительно, что состоящая из немодифицированных и модифицированных нуклеотидов молекула полирибонуклеотида имеет 7'-метилгуанозиновый кэп и/или поли(А)-конец. Сверх того, РНК может иметь еще дополнительные последовательности, например нетранслируемые участки и функциональные нуклеиновые кислоты, которые хорошо известны специалисту в данной области техники. Предпочтительно РНК согласно изобретению предоставляется как транскрибированная in vitro РНК(IVT-PHK). Материалы, необходимые для осуществления транскрипции in vitro, известны специалисту в данной области техники и имеются в продаже, в особенности буферы, ферменты и смеси нуклеотидов. Вид ДНК, используемой для получения РНК согласно изобретению, равным образом не является критическим, как правило, это клонированная ДНК. Как изложено выше, предоставляется РНК, в особенности иРНК, которая имеет модифицированные уридиновые нуклеозиды и модифицированные цитидиновые нуклеозиды в предопределенной доле. Оптимальная доля модифицированных уридиновых нуклеозидов, соответственно цитидиновых нуклеозидов для специфической иРНК может быть определена с помощью рутинных экспериментов, которые хорошо известны специалисту в данной области техники. РНК согласно изобретению предпочтительно используется для лечения заболеваний или для предоставления организму полезных белков. Если РНК согласно изобретению используется для лечения заболеваний, то предпочтительно она имеет in vitro транскрипт для белка или фрагмента белка, дефект или отсутствие которого приводит к болезненному состоянию, соответственно его предоставление приводит к облегчению недуга. Для получения РНК согласно изобретению предпочтительно используется ДНК, которая кодирует белок или фрагмент белка, дефект или отсутствие которого имеет отношение к заболеванию или недугу. В одной форме осуществления для получения РНК согласно изобретению используется ДНК гена, дефект или отсутствие которого приводит к заболеванию или недугу. В одной другой форме осуществления для получения РНК согласно изобретению используется ДНК, которая кодирует белок, наличие, при необходимости периодическое, которого необходимо или полезно для организма. В качестве заболевания или недуга при этом рассматривается любое состояние, при котором имеются субъективно и/или объективно физические и/или душевные расстройства, соответственно изменения,или при котором неправильное течение физических, душевных или умственных жизненных процессов требует ухода за больным и при случае может повлечь за собой потерю трудоспособности. При этом под белком или фрагментом белка, наличие которого может облегчить болезнь или который может быть полезным или необходимым для организма, понимают такие белки или фрагменты белка, которые без того, что существует генный дефект, должны предоставляться организму полностью или периодически, так как они отсутствуют или вследствие каких-либо нарушений, или по причине природных условий, или потому что они могут быть полезными для организма при определенных обстоятельствах, например при лечении дефектов или в рамках имплантаций. Также к ним принадлежат измененные формы белков или фрагменты белков, т.е. формы белков, которые изменяются в ходе обмена веществ,например зрелые формы белка и т.д. Также могут быть предоставлены белки, которые имеют важное значение для процессов роста и ангиогеназа, которые необходимы, например, при контролированной регенерации и в таком случае могут возникать целенаправленно путем введения иРНК согласно изобретению. Это может быть необходимым, например, при процессах роста или для лечения костных дефектов, дефектов ткани и в рамках имплантаций и трансплантаций. Было обнаружено, что модифицированная иРНК согласно изобретению может выгодно применяться для того, чтобы способствовать врастанию имплантированных протезов. иРНК согласно изобретению,если она находится на поверхности используемых протезов, таких как зубные имплантаты, эндопротезы бедра, эндопротезы коленного сустава или имплантаты для спондилодеза, может выделять факторы, которые могут способствовать врастанию, новому образованию сосудов и другим функциям, которые необходимы для новоиспользованных протезов. Так, например, известно введение биологически активных веществ, таких как факторы роста, как ВМР-2 или факторы ангиогенеза в рамках имплантации протезов или после нее. Так как биологические вещества очень часто имеют предельно короткие периоды полураспада, то до сих пор было необходимым вводить их в очень высокой дозировке, что обременяет пациентов сильными побочными эффектами. Согласно изобретению этот недостаток устраняется, так как при применении РНК согласно изобретению желаемые и/или необходимые белки могут использоваться целенаправленно и соразмерно дозировке. Это уменьшает или даже избавляет пациента от побочных эффектов. В этой форме осуществления РНК согласно изобретению, которая кодирует желаемые и/или необходимые вещества, такие как факторы роста, факторы ангиогенеза и т.д., в покрытии, выдающем дозировано РНК, может наноситься на имплантат и затем оттуда дозироваться постепенно, так что непрерывно или периодически клетки в среде имплантата могут вырабатывать и при необходимости высвобождать желаемые факторы. Носители, как правило, биосовместимые, синтетические, природные или смешанные естественно-синтетические полимеры, выделяющие свойства которых могут регулироваться целенаправленно, являются хорошо известными и поэтому здесь не нуждаются в подробном пояснении. Например, используют полилактид- или полилактид/гликолидные полимеры. Таким образом, является возможным желаемые факторы дозировать непрерывно, периодически, в течение длительного или короткого времени и в желаемое место. Под отсутствующим или дефектным геном или под дефицитом или отсутствием в рамках настоящего изобретения понимают такие гены, которые не экспрессируются, экспрессируются неправильно или в недостаточном объеме и вследствие этого вызывают заболевания или недуги, например, тем, что они служат причиной нарушений обмена веществ. РНК согласно изобретению может благоприятно использоваться в каждом случае, в котором белок бы имелся природным образом в организме, однако по причине генетических дефектов или заболеваний не имеется, имеется в дефицитной форме или в меньшем количестве, чем должен предоставляться организму. Белки, соответственно кодирующие их гены, дефицит или дефект которых связан с заболеванием,являются известными. В дальнейшем приводятся различные белки и гены, при недостатке которых можно использовать РНК согласно изобретению. Другие заболевания, в основе которых находятся дефектные гены, указаны в дальнейшем. Таким образом, вышеуказанная таблица показывает примеры генов, дефект которых приводит к заболеванию, которое можно лечить транскриптной заместительной терапией с помощью РНК согласно изобретению. В особенности здесь можно назвать заболевания, которые относятся, например, к легким,такие как SPB-дефицит, АВСА 3-дефицит, мистический фиброз и дефицит 1-антитрипсина; которые относятся к белкам плазмы и вырабатывают дефекты свертывания и дефекты комплемента; иммуноде- 12022786 фициты, такие как, например, ТКИД; септические гранулематозы и болезни накопления. У всех этих заболеваний белок, например фермент, является дефектным, который можно лечить посредством терапии с помощью РНК согласно изобретению, которая предлагает кодированный дефектным геном белок или его функциональный фрагмент. Поэтому примерами белков, которые могут быть кодированы с помощью РНК согласно изобретению, являются эритропоэтин (ЭПО), гормон роста (соматотропин, hGH), трансмембранный регулятор муковисцидоза (CFTR), факторы роста, такие как GM-SCF, G-CSF, MPS, белок С, гепцидин, АВСА 3 и сурфактантный белок В. Другими примерами заболеваний, которые можно лечить с помощью РНК согласно изобретению, являются гемофилия А/В, болезнь Фабри, CGD, ADAMTS13, болезнь Гурлера, передающаяся через X-хромосому Аглобулинемия, иммунодефицит, относящийся к аденозиндезаминазе, и респираторный дистресс-синдром у новорожденных, который относится к SP-B. Особенно предпочтительно иРНК согласно изобретению содержит последовательность для сурфактантного белка-В (SP-B) или для эритропоэтина. Другие примеры белков, которые могут быть кодированы с помощью модифицированной РНК согласно изобретению, являются факторы роста, такие как ВМР-2 или факторы ангиогенеза. Другая область применения РНК согласно изобретению показана для таких заболеваний или недугов, при которых в организме белки не вырабатываются или больше не вырабатываются, например, по причине отказа органов. В настоящее время при таких заболеваниях для замещения вводится рекомбинантный белок. Теперь для этого согласно изобретению предоставляется РНК, так что замещение отсутствующего белка может происходить на уровне транскрипта. Это имеет множество преимуществ. Если белок имеет гликозилирования, то посредством замещения на уровне транскрипта достигают того, что в организме происходит типичное для людей гликозилирование. В рекомбинантных, т.е. нормальным образом в микроорганизмах выработанных белках, гликозилирование является, как правило, иным, чем в организме, подвергшемся замещению. Это может привести к побочным эффектам. В общем, следует исходить из того, что от РНК согласно изобретению экспрессированный белок является идентичным с аутологичным в отношении структуры и гликозилирования, что в рекомбинантных белках, как правило,отсутствует. Примерами белков, замещение или использование которых может быть желательным, являются функциональные белки, такие как эритропоэтин, факторы роста, такие как соматотропин (hGH), G-CSF,GM-CSF и тромбопоэтин. Другой областью, где может применяться РНК согласно изобретению, является область восстановительной медицины. Из-за болезненных процессов или вследствие старения доходит до дегенеративных заболеваний, которые можно лечить и облегчать или даже излечивать путем поступления мало вырабатываемых или не вырабатываемых белков вследствие болезненных процессов, соответственно процессов старения. Благодаря поступлению этих соответствующих кодирующих белки РНК можно остановить процесс дегенерации или даже запустить регенерацию. Примерами этого являются факторы роста для регенерации тканей, которые могут использоваться, например, при нарушениях роста, при дегенеративных заболеваниях, таких как остеопороз, артроз или нарушенное заживление ран. РНК согласно изобретению здесь предлагает не только преимущество того, что отсутствующий белок может предоставляться целенаправленно и в правильной дозировке, но и, кроме того, является возможным обеспечение белком в один промежуток времени. Так, например, при нарушенном заживлении ран можно предоставить соответствующий лечебный фактор или фактор роста для ограниченного времени посредством дозированного введения РНК. Кроме того, через поясняемые позже механизмы можно позаботиться о том, что РНК целенаправленно доставляется к месту ее желательного действия. Примерами факторов, которые могут экспрессироваться с помощью РНК согласно изобретению,чтобы оказывать регенеративное действие, являются фактор роста фибробластов (FGF), например FGF-123; трансформирующий фактор роста (TGF), например TGF-, TGF-, BMPs (костный морфогенетический белок), например ВМР 1 до 7, 8 а, b, 10, 15; фактор роста тромбоцитарный (PDGF), например PDGFA, PDGF-B, PDGF-C и PDGF-D; эпидермальный фактор роста (EGF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF); эндотелиальный фактор роста сосудов (VEGF-A до F иPIGF); инсулиноподобные факторы роста, например IgF1 и IgF2; фактор роста гепатоцитов (HGF); интерлейкины, например интерлейкин-1 В, IL-8, IL-1 до 31; фактор роста нервов (NGF) и другие факторы,которые стимулируют образование эритроцитов, нейтрофилов, сосудов и т.д. Также РНК согласно изобретению может целенаправленно использоваться в области раковых заболеваний. Благодаря экспрессии индивидуально разработанных Т-клеточных рецепторов в Т-лимфоцитах,которые распознают специфические раково-ассоциированные опухолевые антигены, они могут становиться еще эффективнее. Уже было показано, что в принципе иРНК может применяться с успехом в этой области. Однако ее использование до сих пор задерживалось вследствие уже описанных выше иммуногенных эффектов. Теперь с помощью предоставленной согласно изобретению мало иммуногенной и высокостабильной РНК является возможным экспрессировать соответствующим образом Т-клеточные рецепторы. Также РНК согласно изобретению может применяться для того, чтобы экспрессировать факторы транскрипции, которые заботятся о том, что соматические клетки репрограммируются в эмбриональные стволовые клетки. Примерами этого являются О-ср 3/4, Sox2, KLF4 и c-MYC. Поэтому стабильная РНК согласно изобретению, в особенности иРНК, которая кодирует эти факторы транскрипции, может приводить к выработке стволовых клеток, не вызывая побочные эффекты, которые могут возникать при принимаемом до сих пор во внимание переносе генов через вирусные или невирусные векторы. При применении РНК согласно изобретению преимущество состоит в том, что в противоположность к применению векторов ДНК можно установить длительность лечения. В случае индукции стволовых клеток, как правило, желательным является то, что факторы транскрипции являются активными только временно, чтобы перепрограммировать соматические клетки в стволовые клетки. Благодаря дозированному введению соответствующей, кодирующей факторы транскрипции РНК активность поддается временному регулированию. В противоположность этому в известных до сих пор способах существует риск интеграции примененных генов, который ведет к осложнениям, например онкогенезу, и, кроме того, препятствует возможности регулировать продолжительность. Также РНК согласно изобретению предлагает новые возможности в области вакцин. Классическое развитие вакцинации основывается на умерщвленных или ослабленных возбудителях. В последнее время также принимали во внимание ДНК, которая кодирует белок возбудителя. Получение этих вакцин является дорогостоящим и длится очень долго. Часто возникают побочные эффекты, которые приводят к тому, что от прививок отказываются. С помощью иРНК согласно изобретению является возможным приготовить вакцину, которая не имеет проблем, связанных с возбудителями или ДНК. Кроме того, вакцину такого рода можно приготовить очень быстро, если только имеются последовательности антигена возбудителя. Это особенно благоприятно при угрожающих пандемиях. Поэтому в одной форме осуществления настоящего изобретения приготавливается РНК, которая кодирует антигенную часть возбудителя заболевания, например поверхностный антиген. Также возможно изготовить иРНК, которая кодирует последовательность аминокислот, которая имеет комбинацию из нескольких эпитопов, при необходимости связанных участками спейсеров. Также возможна комбинация с иммуномоделирующими веществами,или тем, что РНК кодирует белок слияния или как комбинация нуклеиновых кислот. Далее РНК согласно изобретению также может кодировать те белки, которые оказывают влияние на течение болезни в качестве факторов, стимуляторов, индукторов и т.п. Примерами являются заболевания, которые не следует сводить непосредственно к генетическому дефекту, но при которых с помощью экспрессии иРНК можно положительно влиять на течение болезни. Примерами являются эритропоэтин для стимуляции образования эритроцитов, G-CSF или GM-SCF для образования нейтрофилов, факторы роста для образования новых сосудов, для консолидации перелома и заживления ран в качестве факторов для "тканевой инженерии", лечения опухолей посредством индукции апоптоза или посредством образования белковых цитотоксинов, например дифтерийный токсин А, посредством индукции плюрипотентных стволовых клеткок (iPS) и т.д. Было установлено, что только полирибонуклеотид согласно изобретению, который имеет предопределенную долю модифицированных и немодифицированных нуклеотидов, имеет незначительную иммуногенность при одновременно высокой стабильности. Чтобы для определенного полирибонуклеотида можно было определить оптимальную комбинацию модифицированных и немодифицированных,иммуногенность и стабильность могут определяться известным образом. Для определения иммуногенности РНК могут применяться различные способы, хорошо известные специалисту в данной области техники. Весьма приемлемым способом является определение маркеров воспаления в клетках в качестве реакции на введение РНК. Способ подобного рода описан в примерах. Обычно измеряют цитокины, которые связаны с воспалением, такие как, например, TNF-, IFN-, IFN-, IL-8, IL-6, IL-12, или другие известные специалисту в данной области техники цитокины. Также для определения иммуногенности может применяться экспрессия ДК-активирующих маркеров. Другим указанием на иммунологическую реакцию является доказательство связывания с toll-подобными рецепторами TLR-3, TLR-7 и TLR-8, а также с геликазой RIG-1. Иммуногенность, как правило, определяется в соотношении к контролю. В общепринятом способе вводят в клетки или РНК согласно изобретению, или немодифицированную или другим образом модифицированную РНК и измеряют секрецию маркеров воспаления в течение определенного временного интервала как реакцию на введение РНК. В качестве стандарта, с которым сравнивают, может служить или немодифицированная РНК, причем тогда иммунный ответ должен быть более незначительным, или РНК, о которой известно, что она не вызывает вообще или вызывает незначительный иммунный ответ,причем в таком случае иммунный ответ РНК согласно изобретению должен находиться в том же самом пределе и не должен быть повышенным. С помощью РНК согласно изобретению возможно снизить иммунный ответ в отношении немодифицированной РНК на по меньшей мере 30%, как правило по меньшей мере 50 или даже 75% или даже вообще предотвратить. Иммуногенность может быть определена посредством измерения указанных выше факторов, в особенности посредством измерения уровня TNF- и уровня IL-8, а также связующей способности с TLR-3-,- 14022786TLR-7-, TLR-8- и геликазой-RIG1. Чтобы таким образом установить, имеет ли иРНК желаемую незначительную иммуногенность, можно измерить количество одного или нескольких из указанных выше факторов после введения соответствующего полирибонуклеотида. Так, например, можно мышам через хвостовую вену или в плазму ввести количество исследуемой иРНК и затем определить один или несколько из указанных выше факторов в крови через предопределенный промежуток времени, например через 7 или 14 дней. Затем количество фактора устанавливают к количеству фактора, которое находится в крови необработанных животных. Весьма ценным для определения иммуногенности оказалось определение связующей способности с TLR-3, TLR-7, TLR-8 и/или геликазой RIG-1. Очень хорошие показания также дают уровни TNF- и IL-8. С помощью иРНК согласно изобретению возможно снизить связующую способность с TLR-3, TLR-7, TLR-8 и RIG-1 на по меньшей мере 50% по сравнению с немодифицированной РНК. Как правило, удается снизить связывание с указанными факторами по меньшей мере на 75 или даже на 80%. В предпочтительных формах осуществления связующая способность с TLR-3, TLR-7, TLR-8 и RIG-1 находится в том же самом пределе для иРНК согласно изобретению и для животных, которым не вводили иРНК. Другими словами иРНК согласно изобретению практически не вызывает воспалительные, соответственно иммунологические реакции. В каждом случае РНК согласно изобретению обладает настолько незначительной иммуногенностью, что не оказывается влияние на общее состояние пациента. Поэтому незначительное повышение указанных выше факторов может допускаться до тех пор, пока вследствие этого не ухудшится общее состояние. Другими свойствами иРНК согласно изобретению являются ее эффективность и стабильность. Для этого являются важными эффективность транскрипции, эффективность трансфекции, эффективность трансляции и длительность экспрессии белков, и могут определяться известными способами. Эффективность транскрипции указывает на то, как эффективно можно создать РНК из ДНК. Здесь при применении высокой доли модифицированных нуклеотидов могут возникнуть проблемы. Согласно изобретению модифицированная РНК может быть получена с высокой эффективностью транскрипции. Для того чтобы достичь стабильной и удовлетворительной экспрессии белков, кодированных посредством РНК, важным является то, что РНК достаточно достичь желаемых клеток. Это можно определить тем, что после введения маркированной РНК доля РНК, которая достигла клеток, определяется путем измерения маркировки. Для определения маркировки можно применять проточную цитометрию. Если маркировали флуоресцирующей молекулой, то эффективность трансфекции можно подсчитать,например, как процентное содержание популяции клеток, при котором интенсивность флуоресценции является выше, по сравнению с контрольными клетками, которые были обработаны только посредствомPBS. Было обнаружено, что модифицированная РНК согласно изобретению получается хорошо, в противоположность к РНК, в которой два или более видов нуклеотидов до 100% заменены модифицированными нуклеотидами, и что эффективность трансфекции для РНК согласно изобретению, в которой модифицирована только часть нуклеотидов, намного выше, чем в РНК, в которой один вид нуклеотидов каждый раз модифицирован до 100%. Эффективность трансляции обозначает эффективность, с которой РНК транслируется в белок. Чем выше эффективность трансляции, тем меньшей может быть доза РНК, которая затем должна использоваться для лечения. Эффективность трансляции можно определить тем, что доля трансляции для модифицированной РНК согласно изобретению сравнивается с квотой трансляции немодифицированной РНК. Эффективность трансляции у РНК согласно изобретению, как правило, немного ниже, чем у немодифицированной РНК. Разумеется, это уравновешивается гораздо более высокой стабильностью, которая выражается в длительности экспрессии белка. В особенности РНК согласно изобретению обеспечивает высокую стабильность, которая приводит к продолжительной экспрессии белка. В частности, если модифицированная РНК согласно изобретению предусмотрена для лечения заболеваний, в основе которых находятся генетические дефекты, то она тем ценнее, чем дольше она сохраняется в клетке. Чем быстрее расщепляется РНК, тем быстрее заканчивается экспрессия белка и тем чаще необходимо вводить РНК. Напротив, частота дозировки у стабильной РНК, которая долго остается в клетке, может сильно уменьшаться. Было обнаружено, что модифицированная РНК согласно изобретению стабильно экспрессируется до 4 недель. Для других форм осуществления, т.е. если РНК предусмотрена только для периодической экспрессии, длительность экспрессии белка можно установить путем влияния на стабильность. Поэтому другим ценным свойством РНК согласно изобретению является то, что можно целенаправленно установить длительность действия через стабильность, так что длительность экспрессии белка можно приспособить так, что она происходит в желаемом промежутке времени. С другой стороны, очень продолжительно действующая РНК может использоваться там, где это необходимо. Поэтому модифицированная РНК согласно изобретению, экспрессия которой может длиться до 4 недель, идеально подходит для лечения хронических заболеваний, так как в данном случае дозировка должна осуществляться только все 4 недели. Также для форм осуществления, в которых РНК кодирует факторы, которые должны поставляться организму в течение длительного времени, чтобы облегчить или предотвратить заболевания,является выгодной высокая стабильность и продолжительная экспрессия белка, например, для применения РНК, кодирующей эритропоэтин. Также особенно выгодно РНК согласно изобретению может ис- 15022786 пользоваться для лечения гемофилии. В данном случае до сих пор является необходимым еженедельно вводить отсутствующий фактор. С помощью изготовления РНК согласно изобретению можно снизить частоту введения, так что кодирующая фактор РНК должна вводиться только все 2 или даже все 4 недели. Стабильность иРНК согласно изобретению может быть определена известными способами. В особенности пригодны способы определения жизнеспособности клеток, которые содержат модифицированную РНК согласно изобретению по сравнению с клетками, которые содержат немодифицированную или полностью модифицированную РНК, например, по сравнению с немодифицированной или известным образом модифицированной РНК. Также выработка кодированного белка может наблюдаться со временем. Под стабильностью РНК здесь понимается, что РНК, если она была доставлена в клетку, может экспрессировать желаемый белок, соответственно транслируется в белок или его функциональный фрагмент, остается способной к экспрессии в течение длительного времени, расщепляется не сразу и не инактивируется. Поэтому способ для проверки стабильности и длительности выживания РНК в клетке состоит в том, чтобы определить, насколько долго кодированный посредством РНК белок обнаруживается в клетке или выполняет свою функцию. Эти методы описаны в примерах. Так, например, иРНК с кодирующей репортерную молекулу последовательностью может доставляться в клетку, при необходимости вместе с РНК, кодирующей желаемый белок, и затем через предопределенные периоды времени определяют присутствие репортерной молекулы и при необходимости белка. Пригодные репортерные молекулы хорошо известны из уровня техники и применяемые обычно могут также использоваться здесь. В одной предпочтительной форме осуществления в качестве репортерной молекулы применяется КФБ, красный флуоресцирующий белок. Как указано выше РНК согласно изобретению может применяться для терапии так, что в клетке, в которую доставляется РНК, может образовываться белок, который не экспрессируется природным образом или не экспрессируется в желаемом объеме. При этом РНК согласно изобретению может использоваться как тогда, когда белок не образуется по причине дефицита гена, так и в случаях, в которых белок не образуется по причине заболевания, или в тех случаях, в которых доставка белка является полезной для организма. Также РНК может применяться для того, чтобы дополнить белок, который не экспрессируется в достаточном объеме. Применяемая каждый раз доза зависит от функции, которую должна выполнить РНК. Как указано выше, длительность действия РНК согласно изобретению может устанавливаться целенаправленно. Длительность лечения зависит от соответствующего показания. Если РНК применяется для хронической терапии заболевания, в основе которого лежит отсутствующий ген, то длительность действия должна быть длительной, насколько это возможно, в то время как при других показаниях можно целенаправленно устанавливать временные промежутки. В соответствии с одной особенно предпочтительной формой осуществления в качестве РНК применяют IVT-иРНК, которая кодирует сурфактантный белок В. Если этот белок отсутствует у млекопитающих, то образуется синдром удушья у недоношенных и новорожденных, также обозначаемый как респираторный дистресс-синдром. Это синдром по причине легочной болезни у новорожденных часто приводит к смерти. Применение многократно модифицированной in vitro транскрибированной SP-B кодирующей иРНК, у которой от 5 до 50% уридиновых нуклеозидов и от 5 до 50% цитидиновых нуклеозидов модифицированы, приводит к тому, что образуется белок и заболевание ослабевает или вылечивается. Согласно одной другой предпочтительной форме осуществления в качестве РНК применяется IVTиРНК, которая кодирует эритропоэтин. Эритропоэтин представляет собой очень важный для организма белок, который, например, при заболеваниях почек не имеется больше в достаточном количестве и поэтому его нужно доставлять. В настоящее время для этого применяют рекомбинантный эритропоэтин,который был выработан в микроорганизмах или в животных клетках и поэтому имеет не встречающееся обычным образом гликозилирование. При применении рекомбинантного ЕРО в редких случаях получают серьезные побочные эффекты, например аплазию эритроцитов. Подготовленная согласно изобретению IVT-иРНК содержит рибонуклеиновую кислоту, которая кодирует эритропоэтин, причем от 5 до 50% уридиновых нуклеотидов и от 5 до 50% цитидиновых нуклеотидов являются модифицированными. В одной особенно предпочтительной форме осуществления изготавливается иРНК, кодирующая ЭПО, у которой от 15 до 25% уридиновых нуклеотидов и от 15 до 25% цитидиновых нуклеотидов являются модифицированными. Было обнаружено, что эта иРНК по сравнению с немодифицированной РНК имеет сильно уменьшенную иммуногенность. Одновременно она показывает эффективность трансфекции в более 90% и такую стабильность, что значение гематокрита через 14 дней все еще повышается. Так как в организме образованный от РНК согласно изобретению ЭПО имеет правильное гликозилирование, то не следует опасаться побочных эффектов. Благодаря целенаправленному прерывистому введению модифицированной согласно изобретению РНК, кодирующей ЭПО можно было удерживать на желаемом уровне значение гематокрита в течение длительного времени. Согласно изобретению изготавливается неиммуногенная стабильная РНК, которая применима in vivo у млекопитающих и которая предоставляет необходимый белок в форме, которая очень схожа с встречающимся природным образом аутологичным белком, если не идентична, и в особенности имеет аутологичное гликозилирование. иРНК согласно изобретению может использоваться прямо так, какой она есть. Но также существует возможность подвергать иРНК дальнейшей модификации, чтобы внести дополнительные полезные свойства. С одной стороны иРНК может быть модифицированной тем, что к кодирующей ветви присоединяют другие кодирующие или некодирующие последовательности. С другой стороны она также может быть модифицированной тем, что к предусмотренным в модифицированных нуклеотидах функциональным группам присоединяют другие молекулы. В одной форме осуществления иРНК согласно изобретению может комбинироваться с целевыми лигандами, которые связываются со специфическими для клеток-мишеней поверхностными рецепторами, так что возможна рецептор-опосредованная трансфекция клетки-мишени. Для этого с одной стороны могут быть модифицированы переносчики, которые пригодны для введения иРНК в клетки, или же сама иРНК с лигандом. Примерами пригодных переносчиков для введения иРНК в клетки являются катионные агенты. К ним относят катионные липиды, катионные полимеры или также наночастицы, нанокапсулы, магнитные наночастицы и наноэмульсии. Пригодные переносчики известны специалисту в данной области техники и описаны в специальных литературных источниках. Пригодные лиганды также хорошо известны специалисту в данной области техники, описаны в литературных источниках и имеются в продаже. В качестве лигандов могут применяться, например, трансферрин, лактоферрин, кленбутерол, сахар, уроновые кислоты, антитела, аптамеры и т.д. Но также иРНК может сама быть модифицированной с лигандом. Для этого предпочтительны мРНК с модифицированными нуклеозидами, которые в 2'положении рибозы имеют первичную аминогруппу или азидогруппу. Примеры можно найти в таблице выше. Подобные модификации являются особенно предпочтительными, так как они способствуют биологической активности. Посредством этих модификаций благодаря амидному образованию или "клик"-химии можно легко вводить лиганд, например,посредством технологических приемов биоконъюгата. В одной другой форме осуществления вводится последовательность РНК, которая может связываться с белками, например рецепторами (аптамеры), в 5'-конце иРНК. Преимущество этой процедуры состоит в том, что лиганд уже на уровне ДНК вводится непосредственно в матрицу и может быть клонирован и посредством IVT вводится в иРНК. Поэтому больше не нужна никакая последующая модификация иРНК с лигандом. В одной другой форме осуществления иРНК модифицируется благодаря дополнительной модификации с инертными полимерами, например полиэтиленгликолем (ПЭГ). Способы для этого хорошо известны специалисту в данной области техники, можно применять способы, которые известны для лигандов. Так, например, в малой части применяемых для иРНК согласно изобретению модифицированных нуклеотидов можно предусмотреть участок связывания для полиэтиленгликоля, с которым ПЭГ связывается после транскрипции. Полиэтиленгликоль служит для внеклеточной стабилизации иРНК, т.е. он защищает молекулу полирибонуклеотида до тех пор, пока она принимается в клетке. При поступлении в клетку ПЭГ отщепляется. Поэтому связь между ПЭГ и РНК предпочтительно сформирована так, что при поступлении в клетку отщепление облегчается. Для этого может быть предусмотрена, например, функциональная группа, которая расщепляется в зависимости от рН. Также могут быть предусмотрены другие стабилизирующие РНК молекулы над соответствующими активными участками модифицированных нуклеотидов. Таким образом, иРНК может быть защищена от ферментативного расщепления посредством стерической стабилизации и предотвращается взаимодействие с компонентами биофлюидов. Модифицированная таким образом иРНК может обозначаться как иРНК-невидимка (Stealth-mRNA). Предпочтительный способ защиты и стабилизации РНК описывается в документе ЕР 1198489, на содержание которого делается определенная ссылка. РНК согласно изобретению предпочтительно защищается с помощью методов, описанных в ЕР 1198489. Было обнаружено, что, с одной стороны, модифицированная РНК согласно изобретению может также благоприятно стабилизироваться и защищаться с помощью этого метода, и, с другой стороны, что активность соответствующим образом обработанной РНК согласно изобретению не ограничивается или ограничивается не существенно. Поэтому в одной предпочтительной форме осуществления настоящего изобретения модифицированная РНК согласно изобретению обрабатывается согласно ЕР 1198489. Примером клеточно-специфического регулирования является встраивание участков связывания микро-РНК для микро-РНК 142-3 р, которая экспрессируется в гематопоэтических клетках, но не в клетках другого происхождения. Вследствие этого экспрессия регулируется так, что трансляция иРНК в гематопоэтических клетках сильно уменьшена по сравнению с другими клетками. Соответственно экспрессия может целенаправленно регулироваться в других видах клеток путем встраивания каждый раз пригодных участков связывания микро-РНК, которые известны специалисту в данной областитехники. В одной другой форме осуществления иРНК согласно изобретению комбинируется с мишенью соответственно участком связывания по меньшей мере для одной микро-РНК, которая имеется только в здоровых клетках, а не в клетках, пораженных болезнью. Таким образом, достигают того, что кодированный посредством иРНК белок вырабатывается только в клетках, которым необходим белок. Выбор пригодных мишеней происходит с помощью рутинных экспериментов, которые хорошо известны специалисту в данной области техники. Распространенным способом, который осуществляется на уровне ДНК, является клонирование участка связывания микро-РНК в 3'UTR (Gu et al., Nat Struct Mol. Biol. 2009Feb; 16(2):144-50., Brown et al, Nat Biotechnol. 2007 Dec; 25(12):1457-67., Brown et al., Nat Med. 2006 May; 12(5):585-91, WO 2007000668). В одной предпочтительной форме осуществления РНК, снабженная участком связывания для микро-РНК, применяется тогда, когда РНК кодирует цитотоксин. В этом случае особенно желательно нести ядовитый для клеток белок только туда, где он должен проявить свое действие. Для этой формы осуществления преимуществом также может быть установление длительности действия РНК тем, что целенаправленно РНК модифицируется так, что ее стабильность находится в предопределенном промежутке времени. Далее РНК согласно изобретению может комбинироваться с микроРНК или короткой РНК ниже 3'полиА-хвоста. Преимущество этого состоит в том, что гибрид иРНК-микроРНК/короткая РНК может расщепляться внутриклеточно от дайсера и вместе с тем могут высвобождаться две действующие молекулы, которые вступают в различные каскады возникновения заболевания. Подобный гибрид может быть подготовлен для лечения заболеваний, таких как рак или астма. Следовательно, РНК согласно изобретению пригодна для того, чтобы одновременно дополнить дефицитную иРНК и вступить в дефектный каскад микроРНК. Таким образом, согласно изобретению в распоряжение предоставляется РНК с выгодными свойствами, которые можно протестировать с помощью скринингового способа, при котором применяется кодирующая последовательность для репортерного белка, например красного флуоресцирующего белка(КФБ). Если исследуют токсичность и стабильность последовательностей репортерного гена с немодифицированными, однократно или многократно модифицированными нуклеотидами с различными модификациями на их иммуногенность и эффективность трансфекции, то выясняется, что только предлагаемая в изобретении, т.е. многократно модифицированная иРНК, у которой каждый раз по меньшей мере 5% уридиновых нуклеозидов, соответственно цитидиновых нуклеозидов заменены на модифицированные нуклеозиды, приводит к сильно сниженной иммуногенности в отношении человеческих первичных моноцитов в крови, и одновременно может обеспечивать высокие проценты трансфекции в более чем 80%. Это можно проверить, например, в альвеолярных эпителиальных клетках типа II у человека или у мыши. Кроме того, длительность экспрессии РНК для модифицированных РНК согласно изобретению значительно продолжительнее, чем у известных РНК. Было обнаружено, что главным образом по причине более высокой стабильности и более низкой иммуногенности многократно модифицированной иРНК согласно изобретению экспрессия длится дольше, чем в известных препаратах. В количественной оценке модифицированное согласно изобретению производное через 10 дней после трансфекции показало 10 кратно более высокое количество продукта экспрессии, чем немодифицированная или только однократно модифицированная РНК. Другим объектом изобретения является способ скрининга нуклеотидных последовательностей, чтобы проверить иммуногенность и качество экспрессии, при котором последовательность иРНК соединяется по меньшей мере с одним рецептором, выбранным из TLR3, TLR3, TLR8 и геликаза-RIG-1, и измеряется связующая способность по сравнению с контрольной последовательностью. В качестве контрольной последовательности применяется последовательность, связующая способность которой известна. Чем слабее связывание по меньшей мере с одним из этих рецепторов, тем более многообещающей является последовательность. Свойства иРНК согласно изобретению, в особенности IVT-иРНК, могут быть протестированы с помощью способов скрининга экспрессирующей репортерный белок РНК. В качестве репортерного белка предпочитается красный флуоресцирующий белок (КФБ). Кодирующие этот белок последовательности,которые имеют нуклеотиды с различными модификациями, могут быть исследованы на их иммуногенность и эффективность трансфекции. Так, для теста могут применяться разные модификации иРНК, например уридиновые нуклеозиды, частично замененные 2-тиоуридиновыми нуклеозидами (в дальнейшем также обозначаются как s2U) и цитидиновые нуклеозиды частично заменены 5-метилцитидиновыми нуклеозидами (в дальнейшем также обозначаются как m5 С). Фиг. 1 а-1 с и 2 а и 2b показывают результаты, которые получают при проведении такого способа скрининга. Подробности можно найти в примерах. Представленные на чертежах результаты основываются на опытах, которые были проведены для КФБ-РНК и показывают, что только многократно модифицированная иРНК, у которой каждый раз по меньшей мере 5% уридиновых нуклеозидов и каждый раз по меньшей мере 5% цитидиновых нуклеозидов являются модифицированными, может приводить к сильно сниженной иммуногенности в отношении человеческих первичных моноцитов в крови, как exvivo, так и in vivo, и одновременно обеспечивать высокие нормы трансфекции в более чем 80%, как в альвеолярных эпителиальных клетках типа II у человека, так и у мыши. Кроме того, длительность экспрессии для модифицированных иРНК согласно изобретению является существенно продолжительнее,чем для немодифицированной иРНК. В одной другой форме осуществления предлагается способ, чтобы протестировать, пригодна ли принимаемая во внимание РНК для терапии, с применением теста иммунопреципитации иРНК (РИП). Приемлемый тест РИП описывается подробнее в примерах. Исследования показали, что клетки иммунной системы активируются немодифицированными репортерными иРНК благодаря связыванию РНК сToll-подобным рецептором (TLR) 3, TLR7, TLR8 и геликазой-RIG-L. Если результаты показывают, что связывание протестированной иРНК с TLR3, TLR7, TLR8 и/или RIG-1 сильно уменьшается по сравнению с немодифицированной иРНК, то это указывает на сниженную иммуногенность. Можно было показать, что в этом отношении применяемые согласно изобретению многократные модификации являются существенно эффективнее, чем отдельные s2U-модификации. В примерах исследовали влияние РНК на уровень IFN-, IL-12 и IFN- после того, как РНК была введена мышам внутривенно. Выяснилось, что многократно модифицированная s2U(0,25)m5C(0,25)КФБиРНК предотвращала иммунный ответ. Результаты,полученные в примерах, в совокупности показывают, что многократно модифицированная иРНК существенно снижает TLR- и RIG-1-связывание и тем самым уменьшает иммунный ответ при одновременно повышенной и продленной экспрессии. Поэтому многократно модифицированная РНК, в особенностиIVT-иРНК, является приемлемым претендентом для лечения in vivo заболевания, в основе которого находится отсутствующий ген. Особенно многообещающий претендент коротко поясняется в дальнейшем и подробнее описывается в примерах. Для того чтобы проверить, возможно ли использовать модифицированную РНК согласно изобретению для лечения легких, непосредственно в легкие мыши вводили многократно модифицированную иРНК, которая кодировала белок слияния из усиленного зеленого флуоресцирующего белка и люциферазы (УЗФБ-Luc), и проверяли, экспрессировалась ли люцифераза по сравнению с немодифицированной УЗФБ-Luc-РНК. Экспрессия люциферазы в легком достигла максимума через 3 ч, хотя общий поток люминесценции через 24 ч быстро опустился до очень незначительных процентов содержания через 5 дней после лечения. В противоположность этому высокие значения экспрессии наблюдали у мышей, которых подвергли лечению с помощью многократно модифицированной УЗФБ-Luc-иРНК, до 5 дней после лечения. В одной особенно предпочтительной форме осуществления подготавливается РНК, терапевтический потенциал которой допускает лечение болезни, которая сводится к дефициту SP-B, а именноs2U(0,25)m5C(0,25)SP-B-иРНК. SP-B представляет собой относительно малый амфипатический пептид, который кодируется отдельным геном и вырабатывается протеолитическим действием предшественника с 381 аминокислотами в альвеолярных эпителиальных клетках типа II, которые выстилают альвеолы. Он улучшает распределение, адсорбцию и стабильность сурфактантных липидов, которые необходимы для сокращения поверхностного натяжения в альвеолах. При недостатке SP-B возникают симптомы, такие как утолщенные стенки альвеол, клеточная инфильтрация и интерстициальные отеки. Это повреждение легких сопровождается гиперемией, т.е. повышенным количеством эритроцитов, и повышенным количеством макрофагов, нейтрофилов и соответствующих долей воспалительных цитокинов в бронхоальвеолярной промывной жидкости. Наследственный дефицит у человека и исследования на трансгенных мышах доказали, что SP-B играет важную роль в выживании после рождения. Наследственный дефицит SPB, который возникает вследствие мутаций в гене SP-B, является значительным для замены сурфактанта и приводит к смертельному отказу дыхательных путей у новорожденных во время первых месяцев жизни. Поэтому единственным доступным в настоящее время вмешательством является трансплантация легких. Поэтому терапия иРНК для дефицита SP-B, которая возможна с помощью РНК согласно изобретению,представляет собой важное альтернативное лечение. РНК согласно изобретению может использоваться для лечения этого заболевания предпочтительно с перфторуглеродом в качестве носителя. Поэтому в одной предпочтительной форме осуществления предлагается фармацевтический препарат, включающий перфторуглерод и s2U(0,25)m5C(0,25)SP-B-иРНК. Эта комбинация позволяет восстанавливать SP-B в легком пациента с дефицитом SP-B, так что повышаются шансы на выживание. К тому же по причине высокой стабильности РНК согласно изобретению достаточной является дозировка с регулярными промежутками, например от 1 до 3 раз в неделю. Предпочтительно для этого SP-B-иРНК вводится интратрахеально при помощи аэрозоля путем впрыскивания под высоким давлением. Было обнаружено, что иРНК согласно изобретению может улучшить описанные выше симптомы и тем самым улучшить функцию легких, что может быть показано путем перепроверки параметров легких, что подробно приводится в примерах. иРНК согласно изобретению может эффективно использоваться в терапевтических способах и способствует лечению заболеваний, в основе которых находится отсутствие или недостаток белков. Возможным является и систематическое введение многократно модифицированной иРНК. Могут быть случаи, в которых является нежелательной трансляция иРНК в клетках, которые не поражены генетическим дефектом, например когда возникают нежелательные побочные эффекты. Для того чтобы иРНК транслировать целенаправленно только в клетках, которые нуждаются в кодированном белке, например в клетках, в которых существует генный дефект, соответствующий вектор можно дополнить последовательностями, которые содействуют адресации пораженной ткани, например, через лиганды. В одной другой форме осуществления к вектору, который содержит иРНК, могут добавляться последовательности, с которыми связываются эндогенные микро-РНК, которые не экспрессируются в клетках-мишенях,так что иРНК во всех клетках, которые содержат соответствующие эндогенные микро-РНК, расщепля- 19022786 ются, в то время как они сохраняются в клетках-мишенях. Вследствие этого можно свести к минимуму побочные эффекты. РНК согласно изобретению может вводиться известным образом пациентам, которые нуждаются в кодированном посредством РНК белке или фрагменте белка, например когда у них имеется заболевание,в основе которого лежит дефицитный ген. Для этого приготавливают РНК в виде фармацевтического препарата с обычными фармацевтически приемлемыми вспомогательными веществами. Форма препарата зависит от места и вида введения. Так как РНК согласно изобретению отличается особенно высокой стабильностью, она может быть приготовлена разнообразными способами, в зависимости от того где и в какой форме она должна применяться. Было обнаружено, что РНК согласно изобретению является настолько стабильной, что она может быть высушена в замороженном состоянии и быть переработанной в этом виде, например измельчена, соответственно размолота, и может храниться, и затем при необходимости может быть восстановлена и ее биологическая активность сохраняется. Если РНК вводится системно, то обычно ее приготавливают в виде жидкости для инъекций с обычными вспомогательными веществами, такими как вещества, регулирующие тоничность, и стабилизаторы, предпочтительно в виде единой дозированной формы. В качестве стабилизаторов применяют обычно известные, такие как, например, липиды, полимеры и наносистемы или липосомы. В одной предпочтительной форме осуществления предлагается композиция, пригодная для парентерального введения, которая содержит модифицированную РНК согласно изобретению, кодирующую ЭПО. В одной предпочтительной форме осуществления, в особенности, если РНК кодирует SP-B-белок,предлагается РНК согласно изобретению в форме, пригодной для введения через легкие, например, путем ингаляции. Приемлемые для этого рецептуры известны специалисту в данной области техники. В этом случае препарат находится в форме, которая может вводиться в дыхательные пути через обычные аэрозольные распылители или ингаляторы, например, в виде распыляемой жидкости или в виде порошка. Устройства для введения в виде жидкости являются известными, пригодными являются ультразвуковые распылители или распылители с перфорированной вибрирующей мембраной, которые действуют с незначительными срезывающими силами по сравнению со струйными аэрозольными распылителями. Равным образом пригодны порошковые аэрозоли. Как комплексированная катионными липидами иРНК, так и голая иРНК после сублимационной сушки с сахаром доступна в виде порошка, которая затем может быть измельчена до размера, употребительного для легких, и далее показывает биологическую активность. В одной предпочтительной форме осуществления фармацевтическая композиция, предусмотренная для введения в легкие, комбинируется с перфторуглеродом, который вводится ранее или одновременно в фармацевтической композицией, для того чтобы повысить эффективность трансфекции. В другой предпочтительной форме осуществления предлагается модифицированная РНК согласно изобретению в замедленно высвобождаемом полимере в качестве носителя для покрытия имплантатов. Для этого можно применять как саму модифицированную РНК согласно изобретению, так и РНК, защищенную оболочечным полимером и/или полимерным комплексом. Другим объектом изобретения являются имплантаты, на поверхности которых находится покрытие из замедленно высвобождаемого полимера, содержащего РНК, которая для врастания имплантата кодирует нужные факторы. При этом согласно изобретению принимают во внимание как покрытия, содержащие иРНК, которая кодирует только один фактор, так и те покрытия, содержащие иРНК, которые кодируют несколько факторов, например различные факторы роста, или факторы роста и факторы ангиогенеза, или другие способствующие врастанию факторы. Также различные факторы могут предлагаться в такой форме, что они дозируются замедленно во времени. Далее под выражением "РНК, которая кодирует один или несколько факторов роста и один или несколько факторов ангиогенеза" следует понимать как последовательность РНК, которая кодирует более чем один белок, отдельно или как белок слияния, так и как смесь различных последовательностей РНК,которые кодируют различные белки, причем каждая последовательность РНК каждый раз кодирует один белок. Далее изобретение поясняется посредством следующих примеров. Пример 1. Чтобы можно было оценить терапевтическую применимость IVT-иРНК, анализировали, можно ли было получить неиммуногенную IVT-иРНК для применения in vivo. Поэтому в этой первой стадии исследовали транскрибированную in vitro иРНК для красного флуоресцирующего белка (КФБ) с модифицированными нуклеозидами относительно иммуногенности и эффективности трансфекции. Результаты показывают, что многократно модифицированная иРНК, у которой 25% уридина заменено 2 тиоуридином (s2U) и 25% цитидина заменено 5-метилцитидина (m5 С), обеспечивает (s2U(0,25)m5C(0,25IVT-иРНК, которая имеет сильно сниженную иммуногенность в отношении человеческих первичных одноядерных клеток крови, как показано на фиг. 1 а, и высокую норму трансфекции в более чем 80% в эпителиальных клетках альвеолярного типа II, как у человека (фиг. 1b), так и у мыши (фиг. 1c). Далее длительность экспрессии иРНК была существенно продолжительнее (фиг. 2a). Результаты показывают,что эта продолжительная экспрессия главным образом основывается на боле высокой стабильности мно- 20022786 гократно модифицированных иРНК согласно изобретению. Абсолютное количественное оценивание показало приблизительно в 10 раз большее количество s2U(0,25)m5C(0,25)КФБ-иРНК через 7 дней после трансфекции (фиг. 2b). Эффективность трансляции была немного снижена для модифицированной КФБ-иРНК и поэтому не могла способствовать более высокой и длительной активности (фиг. 4). В следующей стадии исследовали механизм, на котором основывается сниженный иммунный ответ,причем применяли тест иммунопреципитации модифицированной РНК (анализ РИП). Исследования показали, что клетки иммунной системы активируются немодифицированной репортерной иРНК (1) путем РНК-связывания с Toll-подобным рецептором (TLR) 3 (2), TLR7 (3), TLR8 (4) и геликазой RIG-1 (5). Результаты показывают, что связывание многократно модифицированных согласно изобретению КФБиРНК с TLR3, TLR7, TLR8 и RIG-1 по сравнению с немодифицированной КФБ-иРНК было сильно снижено. В этом отношении многократные модификации были существенно эффективнее, чем отдельнаяs2U-модификация (фиг. 2c). Как и следовало ожидать от исследований связывания, немодифицированная КФБ-иРНК повышала IFN-, IL-12 и IFN- в значительной мере, если ее вводили мышам внутривенно, в то время как многократно модифицированная s2U(0,25)m5 С(0,25)КФБ-иРНК предотвращала иммунный ответ (фиг. 2d). В совокупности эти результаты показывают, что многократно модифицированная иРНК согласно изобретению сильно снижала TLR- и RIG-1-связывание и тем самым иммунный ответ и одновременно повышала и удлиняла экспрессию, что выполняет подобная иРНК до получения многообещающего претендента для теста in vivo. Поэтому испытывали, могла ли s2U(0,25)m5C(0,25)иРНК, которая кодировала белок слияния из усиленного зеленого флуоресцирующего белка и люциферазы (УЗФБ-Luc), которую вводили непосредственно в легкие мыши, усилить и продлить экспрессию люциферазы in vivo по сравнению с немодифицированной УЗФБ-Luc-иРНК. С этой целью применяли известное распылительное устройство высокого давления для интратрахеального введения, как это описывается, например, в (6), причем ранее вводили перфторуглерод (Fluorinert FC-77) (7), чтобы повысить эффективность трансфекции. Экспрессия люциферазы через 3 ч достигала максимума в легких in vivo, хотя общая люминесценция через 24 ч быстро спадала до низкого уровня через 5 дней после лечения (фиг. 3 а и 3b). В противоположность этому наблюдали высокие значения экспрессии у мышей, которых обрабатывали с помощьюs2U(0,25)m5 С(0,25)УЗФБ-Luc-иРНК, до 5 дня после лечения (фиг. 3a и 3b). Это показывает, что терапевтический потенциал многократно модифицированной иРНК согласно изобретению для терапии является весьма многообещающим. Поэтому многократно модифицированнуюs2U(0,25)m5C(0,25)SP-B-иРНК согласно изобретению испытывали для лечения мышей с дефицитом SP-B.SP-B представляет собой относительно малый амфипатический пептид, который кодируется отдельным геном и вследствие протеолитического действия превращается в предшественник с 381 аминокислотами в клетках эпителия альвеолярного типа II, которые выстилают альвеолы (8, 9). Это улучшает распространение, адсорбцию и стабильность поверхностно-активных липидов, которые необходимы для редукции поверхностного натяжения в альвеолах. Если ген является дефицитным для этого белка, то после рождения возникают нарушения в дыхательных путях, которые могут быстро привести к смерти. Наблюдалось, что наследственный дефицит у человека и у трансгенных мышей играет важную роль для посмертного выживания (10). Наследственный SP-B-дефицит, который возникает вследствие мутаций в гене SPB, препятствует образованию поверхностно-активных липидов, что приводит к отказу дыхательных путей в течение первых месяцев после рождения (11). Трансплантация легких представляет собой единственное терапевтическое вмешательство, которое возможно в настоящее время (12). Поэтому иРНКтерапия для дефицита SP-B была бы альтернативным лечением, чтобы гарантировать жизнеспособность при этой нехватке. Поэтому для дефицита SP-B выбрали нокаутную модель мышей, чтобы испытать генную терапиюSP-B с помощью многократно модифицированной иРНК согласно изобретению. Для этого выбрали модель мышей, у которой SP-В-сДНК мыши был экспрессирован под контролем экзогенного доксициклина в SP-B-/нокаутных мышах. Удаление доксициклина у взрослых мышей SP-B-/- приводило к сниженному содержанию SP-B в легких, что приводило к отказу дыхательных путей, когда концентрация SP-B падала ниже 25% нормального уровня. Кондиционированные трансгенные мыши, которые содержали доксициклин, выживали нормально (13, 14). Применяемая терапевтическая стратегия содержала следующее:(i) предварительная обработка мышей перфторуглеродом перед введением SP-B-иРНК, чтобы повысить экспрессию, (ii) повторное применение SP-B-иРНК два раза в неделю на каждый третий или четвертый день в течение четырех недель (фиг. 3c). Чтобы провести опыт для доказательства этого принципа, интратрахеально вводили s2U(0,25)m5C(0,25)SP-В-иРНК через распылитель высокого давления в виде аэрозоля в условные SP-В-/мышей. Это лечение избавляло мышей от отказа дыхательных путей и продлевало их средний период жизни до 28,81,1 дней (фиг. 3d) до определенной конечной точки исследования. В противоположность этому после извлечения доксициклина необработанные SP-B-/мыши показали симптомы острого респираторного затруднения в течение от 3 до 4 дней. Это также наблюдалось после введения одного перфторуглерода или перфторуглерода с s2U(0,25)m5C(0,25)УЗФБ-Luc-иРНК в качестве контро- 21022786 ля, причем в таком случае мыши умирали в течение от 3,80,4 дней (фиг. 3d, и непоказанные данные). Далее подтверждали успешное восстановление SP-B в легких мышей, обработанных с помощьюs2U(0,25)m5C(0,25)SP-B-иРНК посредством иммунного окрашивания (фиг. 3e) и полуколичественного анализа Вестерн-Блот (фиг. 3f) для SP-B. Гистология легкого была нормальной у мышей, которых лечили в течение 4 недель с помощью s2U(0,25)m5C(0,25)SP-B-иРНК, в то время как легкие мышей, которые не получали s2U(0,25)m5 С(0,25)УЗФБ-Luc-контрольную иРНК, через 4 дня показывали утолщенные стенки альвеол,клеточные инфильтрации и интерстициальные отеки (фиг. 3g). Это повреждение легких сопровождалось гиперемией (повышенное число эритроцитов) и повышенным количеством макрофагов, нейтрофилов и повышенным уровнем воспалительных цитокинов (фиг. 3h и фиг. S4) в бронхоальвеолярной промывной жидкости (БАЛ), в то время как это существенно предотвращалось у обработанных посредством SP-BиРНК мышей. Оказалось, что извлечение доксициклина ухудшало функцию легких без лечения (14, 15). Было замечено, что более продолжительное лечение SP-В-/мышей с помощью s2U(0,25)m5C(0,25)SP-BиРНК поддерживало нормальную функцию легких, подобно как у SP-В-/мышей, которые получали доксициклин (фиг. 31 и фиг. S5). Обобщая, эти результаты показывают, что все функциональные и патологические параметры дефицита SP-B в легких существенно улучшались и были сопоставимыми с кондиционными SP-В-/мышами,которые получали доксициклин. Результаты показывают терапевтическую эффективность многократно модифицированных иРНК в модели мышей для смертельного заболевания легких. Однако другое применение терапии иРНК можно еще улучшить следующим образом: (i) нежелательная трансляция иРНК в клетках не пораженной ткани могла бы привести к нежелательным эффектам вне целевой области, (ii) если многократно модифицированная иРНК также попадает в не пораженную ткань, то необходимо подготавливать достаточное количество иРНК и (iii) необходима повторная дозировка для кратковременной активности иРНК. Чтобы это улучшить, можно привлечь биологию микро-РНК, чтобы предотвратить нежелательную трансляцию иРНК в не пораженные болезнью клетки. В то время как встраиваются целевые последовательности эндогенных микро-РНК, которые не экспрессируются в клетках-мишенях, распад иРНК может вызываться целенаправленно в не пораженных болезнью, однако причем сохраняется иРНК в клетках-мишенях,вследствие чего сводятся к минимуму побочные эффекты (16, 17). В другом составе могут комбинироваться системы дозирования, целенаправленные лиганды, которые связываются со специфическими рецепторами клеточных поверхностей, тем самым делается возможной рецепторно-опосредованная трансфекция клетки-мишени. Так как в настоящее время можно изготовить иРНК в больших количествах (18) и эффективные процессы изготовления для получения многократно модифицированной иРНК также возможны в большом масштабе, то возможно клиническое использование иРНК согласно изобретению и можно разработать специфически нарезанные системы иРНК для каждого заболевания (19, 20), причем частота дозировки и кратковременная активность могут удерживаться на минимуме, что невозможно с помощью известной до сих пор терапии. Таким образом,согласно изобретению предлагается эффективная молекулярная терапия для лечения заболевания, в основе которого лежит генный дефицит. Пример 2. Для того чтобы показать, что у мышей с дефицитом SP-B достигается улучшение состояния, соответственно повышение ожидаемой продолжительности жизни, только благодаря использованию модифицированной иРНК согласно изобретению, которая кодирует SP-B, был осуществлен следующий опыт. Применяли модель мышей и условия, которые опсианы в примере 1. Были образованы три группы мышей. Одна группа мышей с дефицитом SP-B дважды в неделю получала модифицированную согласно изобретению иРНК (В), вторая группа в течение 28 дней дважды в неделю получала модифицированную согласно изобретению иРНК (С) и для сравнения третья группа мышей получала модифицированную УЗФБ-Luc-иРНК (А). Выяснилось, что мыши, которые не получали модифицированную SPB-иРНК согласно изобретению, через короткий промежуток времени умирали. Мыши, которые получали РНК согласно изобретению, доживали до тех пор, пока они получали SP-B-PHK согласно изобретению. Это доказывает, что РНК согласно изобретению является биологически активной и может заменять необходимый белок. В подробностях опыт был осуществлен следующим образом. Мыши SP-B KO, как описано в примере 1, получали или модифицированную УЗФБ-Luc-иРНК (А) (n = 10), или модифицированную SP-BиРНК два раза в неделю (В) (n = 4), или модифицированную SP-B-иРНК в течение 28 дней два раза в неделю (С) (n = 4). Составляли кривую выживаемости Каплана-Майера и проводили тест УилкоксонаГехана. Было обнаружено, что интратрахеальное применение дважды модифицированной SP-B-иРНК два раза в неделю в легкие трансгенных SP-B-мышей (В), в которых SP-B-ген контролировался путем добавления доксициклина в питьевую воду, после удаления доксициклина из питьевой воды перед началом лечения продлевало средний срок жизни мышей до 10,20,5 дней (В) по сравнению с 3,40,2 днями после применения УЗФБ-Luc-контрольной иРНК. Результаты представлены в диаграмме фиг. 12. Оказывается, что интратрахеальное применение дважды модифицированной SP-B-иРНК согласно изобретению действительно является спасительным для жизни. Без добавления иРНК согласно изобретению через короткое время мыши умирали. Также этот опыт показывает, что, с одной стороны, SP-B-иРНК вырабатывает in vivo жизненно необходимыйSP-B и, с другой стороны, что SP-B-иРНК должна применяться непрерывно, чтобы уберечь подопытных животных от смерти. Пример 3. В другом опыте, в котором применяли описанных в примере 1 мышей, которые все получали доксициклин, исследовали, вызывает ли РНК согласно изобретению воспалительные реакции в ранней фазе после введения. Для этого образовывали 5 групп и измеряли уровень цитокинов, IFN- и IL-12 через 8 ч после применения различных препаратов в бронхоальвеолярном лаваже мышей. Шесть групп получали следующие препараты: а) сравнение, необработанное, т.е. ни перфторуглерода, ни РНК; b) сравнение,перфторуглерод; с) сравнение, перфторуглерод и немодифицированная SP-B-иРНК; d) изобретение, перфторуглерод и модифицированная s2U(0,25)m5C(0,25)SP-B-иРНК; e) сравнение, перфторуглерод и SP-Bплазмидная ДНК; (n = 4). Каждый раз вводили 20 мкг (50 мкл) препарата. Результаты показаны на фиг. 13. На фиг. 13 показано среднее значениенормированная ошибка. В фиг. 13 применяли следующие сокращения: докси - доксициклин, Pfc - перфторуглерод, pDNA - плазмидная ДНК (Р 0,05 сравнили с необработанной группой). Результаты показывают, что при интратрахеальном применении немодифицированной иРНК или плазмидной ДНК маркер воспаления IL-12 сильно повышается в бронхоальвеолярном лаваже, в то время как при применении дважды модифицированной иРНК по сравнению с необработанными мышами не происходит повышение IL-12. Хотя применение дважды модифицированной иРНК слегка повышает уровень маркера воспаления IFN, разумеется только насколько, как он также наблюдается после применения перфторуглерода. В противоположность этому применение немодифицированной иРНК или применение плазмидной ДНК также приводит к явному повышению уровня INF. Тем самым при применении модифицированной иРНК согласно изобретению не следует опасаться воспалительной реакции, в то время как введение немодифицированной иРНК или также плазмидной ДНК очень быстро вызывает воспалительные реакции. Пример 4. Чтобы продемонстрировать возможности использования модифицированной иРНК согласно изобретению, были исследованы различные виды модификаций и их влияние на эффективность трансфекции и эффективность трансляции, а также на иммуногенность. Трансфекции подвергали А 459-клетки с каждый раз 200 нг иРНК и затем исследовали, сколько из клеток были трансфицированы и в каком количестве клеток был транслирован флуоресцирующий белок. Это оценивание происходило через среднюю интенсивность флуоресценции (MFI). Результаты показаны на фиг. 10 А. Проверяли модифицированную иРНК согласно изобретению и по сравнению с этим модифицированную иРНК не согласно изобретению,у которой применялись две различные модификации уридиновых нуклеотидов, а также немодифицированную иРНК. Модифицированные молекулы иРНК согласно изобретению представляли собойs2U/m5C, соответственно s4U/m5C, причем модифицированные нуклеотиды каждый раз имели долю в 10%, а также молекулы РНК, которые дополнительно к каждый раз 10%/10% s2U/m5C, соответственноs2U/5mC, содержали другие 5% модифицированных нуклеотидов, а именно однократно C2'NH2 и однократно 5% G'N3. Результаты показывают, что модифицированная иРНК согласно изобретению показывает очень высокую эффективность трансфекции, в то время как немодифицированная иРНК и модифицирования иРНК не согласно изобретению каждый раз показывают весьма более низкую эффективность трансфекции и эффективность трансляции. Кроме того, для описанной ранее модифицированной иРНК проверяли иммуногенность тем, что исследовали уровень TNF- человеческих РВМС, после введения каждый раз 5 мкг иРНК. Результаты представлены на фиг. 10 В. Как недвусмысленно оказывается, уровень TNF- сильно повышается при введении немодифицированной иРНК или при иРНК, у которой применяли два вида модифицированных уридиновых нуклеотидов. Уровень TNF- при модифицированных РНК согласно изобретению по меньшей мере на 50% ниже, чем при немодифицированной РНК. Пример 5. Способ получения многократно модифицированной иРНК согласно изобретению.a. Конструкты для транскрипции in vitro. Для транскрипции in vitro КФБ кДНК (678 bp) применяли содержащий SP6-промотон плазмид,pCS2+DsRedT4. Для транскрипции in vitro SP-B-кДНК (1146 bp) применяли содержащий Т 7-промоторpVAX1-плазмид (Invitrogen). Чтобы создать вектор для транскрипции in vitro УЗФБ-Luc (2,4 kb), применяли содержащий Т 7-промотор pST1-2-глобин-UTR-A-(120)-конструкт, который получали, как описано в (19). Конструкты клонировали с применением стандартных технических приемов молекулярной биологии. Создание модифицированной иРНК. Чтобы создать матрицы для транскрипции in vitro, линеаризировали pCS2+DsRed.T4 -, УЗФБ-Luc- иSP-B-плазмиды с XbaI. Линеаризированные векторные ДНК очищали посредством набора NucleoSpinExtrakt-II (Macherey-Nagel) и оценивали спектрофотометрически. Транскрипцию in vitro осуществляли сmMESSAGE-mMACHINE SP6-, соответственно T7-Ultrakit (Ambion). Набор SP-6 кэпировал иРНК с 7 метил-GpppG, в то время как набор Т 7 производил аналогичный антиреверсный кэп (ARCA; 7-метил-(3'О-метил)GpppGm7G(5')ррр(5')G в реакции транскрипции с ультравысоким выходом. Чтобы произвести модификации РНК, к реакционному составу добавляли следующие модифицированные трифосфаты рибонуклеиновой кислоты в указанных соотношениях: 2'-тиоуридин-5'-трифосфат, 5'-метилцитидин-6'трифосфат, псевдоуридин-5'-трифосфат и N6-метиладенозин-5'-трифосфат (все от TriLink BioTechnologies и относительно чистоты контролировали с помощью ВЭЖХ и 31 Р-ЯМР). После транскрипции invitro ферментативно полиаденилировали РНК из pVAX1-SP-B-плазмида при применении набора поли(А)-хвост (Ambion). Поли(А)-хвосты имели длину приблизительно 200 nt. Все кэпированные иРНК(КФБ, УЗФБ-Luc и SP-B) были очищены с применением набора MEGAclear (Ambion) и проанализированы по размеру и чистоте с помощью анализа Agilent RNA 6000 Nano на приборе биологического анализа 2100 (Agilent Technologies). Трансфекции клеток. Трансфекция клеток легкого. Линии альвеолярных эпителиальных клеток типа II человека и мыши А 549, соответственно MLE12,выращивали в среде MEM (Minimum Essential Medium от Invitrogen), которая была дополнена 10% фетальной телячьей сывороткой (FCS), 1% пеницилин-стрептомицином и 0,5% гентамицином. За один день до трансфекции осаждали 80000 клеток на лунку в 24-луночные планшеты. Клетки трансфицировали(более чем 90% слияния) с 200 нг иРНК с применением липофектамина 2000 (Invitrogen) согласно инструкции производителя. Через 4 ч клетки промывали посредством PBS и добавляли среду, содержащую сыворотку. Для анализа длительной экспрессии клетки регулярно разделяли (если слияние было 90%). Трансфекция человеческих РВМС. Криоконсервированные в жидком азоте человеческие РВМС (CTL-Europe GmbH) осторожно размораживали при 37 С с применением CTL-Anti-Aggregate-Wash Supplement, причем медленно добавляли стерилизованный при фильтровании RPMI-1640 (Invitrogen). Для всех описанных опытов применяли единственную характеризованную порцию РВМС, чтобы данные поддавались воспроизведению. Проточная цитометрия. Анализ проточной цитометрией проводили на А 549- и MLE12-клетках, которые были трансфицированы посредством КФБ-иРНК, как описано выше. Клетки снимали с поверхности планшета с помощью 0,25% трипсин/EDTA, три раза промывали с помощью PBS и снова суспендировали в PBS, чтобы измерить флуоресценцию с применением FACSCalibur (BD Biosciences). Эффективность трансфекции рассчитывали из процентного содержания популяции клеток, который превышал интенсивность флуоресценции контрольных клеток, которые были обработаны только посредством PBS. Подсчитывали по меньшей мере 2500 клеток на пробирку. Данные были проанализированы при помощи Cellquest Pro. Определение цитокинов. Твердофазный иммуноферментный анализ (ELISA) проводили с применением набора человеческий-IL-8 и TNF- (RayBio), набора мышь-IFN- и IL-12-(Р 40/Р 70) (RayBio) и набора мышь-IFN- (RnDIn vitro трансляция в реальном времени. 500 нг КФБ-иРНК транслировали in vitro с применением Retic Lysat IVT (Ambion). Метионин добавляли до конечной концентрации в 50 мМ. Смесь инкубировали при 30 С в водяной бане, к различным моментам времени отбирали образцы и измеряли интенсивность флуоресценции при 590 нм на WallacVictor2 1420 Multilabel Counter (Perkin Elmer). Количественные РТ-ПЦР. Общую РНК экстрагировали из А 549-клеток с помощью RNeasy Minikit (Qiagen) или из человеческих РВМС (см. протокол РИП ниже) и подвергали реверсной транскрипции (RT) в составе 20 мкл с применением iScript cDNA Synthesekit (Bio-Rad) согласно руководству к продукту. кДНК амплифицировали с применением iQ SYBR Green Supermix и iCycler (Bio-Rad) в удвоенных составах со следующими праймерами: КФБ: 5'-GCACCCAGACCGCCAAGC (вперед), КФБ: 5'-ATCTCGCCCTTCAGCACGC (назад). Ct-значения получали с применением iCycler IQ Software 3.1 (Bio-Rad), который автоматически подсчитывал основные циклы и пороговые значения. Иммунопреципитация РНК (РИП). 1106 человеческие РВМС (CTL-Europe GmbH) трансфицировали с 5 мкг иРНК с применением 12,8 мкл липофектамина 2000 в 1 мл OptiMEM 1. Через 4 ч среды дополняли 10% FCS. Через 24 ч клеточную суспензию переводили в пробирку и клетки гранулировали посредством 10-минутного центрифугирования с 350 мин-1. Затем применяли модифицированную версию ChIP-IT экспресс-протокола применяли для получения всех необходимых реагентов. Согласно руководству ChIP-IT к клеткам добавляли фиксирующий раствор и затем раствор Glycin-Stop-Fix и холодный как лед 1PBS и клетки гранулировали при 4 С. Затем клетки снова суспендировали в лизисном буфере, к которому добавляли ингибиторы протеазы PIC и PMSF, и 30 мин инкубировали на льду. После 10-минутного центрифугирования с 2.400 мин-1 при 4 С жидкую фракцию подвергали реакции поглощения. Комплексы TLR-иРНК/RIGиРНК в течение ночи захватывали магнитными шариками в 8-луночные ПЦР полоски, как описано в руководстве ChIP-IT-Express. Кроме того, добавляли ингибитор SUPERase-RNase (Applied Biosystems/Ambion) до конечной концентрации в 1 U/мкл. В качестве антител применяли анти-человеческийTLR3-мышь-IgG1, TLR7-кролик-IgG1, TLR8-мышь-IgG1 (все от Imgenex) и RIG-1-кролик-IgG1 (ProSciIncorporated). После промывания магнитных шариков комплексы антител TLR-иРНК/RIG-иРНК элюировали, обратно сшивали и обрабатывали протеиназой K согласно экспресс-протоколу ChIP-IT. В заключение элюированную иРНК подвергали реверсной транскрипции и количественной РТ-ПЦР, как описано выше. Биолюминесценция in vivo. Субстрат D-люциферина растворяли в воде, значение рН устанавливали до 7 и конечный объем устанавливали таким образом, что достигалась концентрация в 30 мг/мл. 50 мкл этого раствора наносили на ноздри обезболенных мышей и всасывали путем нюхания (1,5 мг люциферин/мышь). Через 10 мин определяли биолюминесценцию с помощью системы отображения IVIS100 (Xenogen), как описано в (21) с применением следующих точек съемки: поле зрения 10, f1 f-stop, высокое разрешение и время экспозиции от 1 до 10 мин. Сигнал в области легких оценивали и анализировали количественно, причем задний план удаляли с применением Living Image Software версия 2.50 (Xenogen). Исследования на животных. Самок BALB/C мышей возрастом от 6 до 8 недель (Charles River Laboratories) выдерживали в специальных беспатогенных условиях и с циклом 12 ч светло:12 ч темно в проветриваемых клетках, и обеспечивали водой и кормом по желанию. Животные привыкали к условиям жизни по меньшей мере в течение 7 дней до начала испытания. Все манипуляции с животными были дозволенными и контролировались местной этической комиссией и осуществлялись согласно директивам немецкого закона об охране животных. Для всех опытов, кроме инъекции в хвостовую вену, животных подвергали анестезии в плазму смесью медетомидина (0,5 мкг/кг), мидазолама (5 мкг/кг) и фентанила (50 мкг/кг). После соответствующего опыта животным подкожно вводили антидот, который состоял из атипамезола (50 мкг/кг),флумазенила (10 мкг/кг) и налоксона (24 мкг/кг). Кровь для тестов ELISA получали в различные моменты времени путем пункции ретробульбарной вены с применением гепаринизированных 1,3-мм капилляров (Marienfeld). Инъекция в хвостовую вену. 25 мкг КФБ-иРНК смешивали in vivo с мегафектином (МР Biomedicals Europe) в соотношении иРНК к липиду в 0,25 и добавляли ген-усилитель-3 в соответствии с рекомендацией производителя. Целостность и величина частиц инъецированных комплексов определяли динамической дифракцией света(DLS) с применением анализаторов Zeta-PALS/Zeta-Potenzial (Brookhaven Instruments Corp.). Мышей помещали в фиксатор и впрыскивали 100 мкл раствора иРНК/мегафектин (эквивалент 5 мг иРНК) в хвостовую вену в течение 30 с с применением иглы 27 калибра и 1 мл шприца. Интратрахеальное введение посредством распыления под высоким давлением.BALB/c- и SP-B-/мышей подвергали анестезии, как описано в (14) и фиксировали на системе пластин (Halowell EMC) таким образом, что верхние зубы находились под углом в 45. Применяли модифицированный фиброоптический отоскоп Beta 200 (Heine Optotechnik), чтобы оптимально осветить пасть. Маленьким шпателем открывали нижнюю челюсть мыши и использовали тупой пинцет, чтобы сдвинуть язык, и максимально раскрыть глотку. MikroSprayer модель 1 А-1 С, который был соединен с шприцем под высоким давлением модель FMJ-250 (оба от PennCentury-Inc), использовали эндотрахеально и следуя один за другим применяли 25 мкл Fluorinert FC-77 (Sigma) и 25 мл люциферазы иРНК (10 мкг) или 50 мкл раствора SP-B-иРНК (20 мкг). Шприц MikroSprayer вынимали через 5 с и через 5 мин мышь доставали из носителя. Измерения функции легких. Гомозиготные SP-В-/мышидоксициклинмодифицированная иРНК подвергали анестезии, как описано выше. Чтобы предотвратить самопроизвольное дыхание, внутрибрюшинно впрыскивали векурония бромид (0,1 мг/кг). Проводили легочно-механические измерения, как описано в (22). Вкратце, использовали тупую стальную канюлю (внешний диаметр 1 мм) в трахею с трахеостомией. Респиратор с поршневым насосом служил как респиратор, так и как измерительное устройство (flexiVent, SAV). Во время дыхательной вентиляции респиратор устанавливали на контролированную вентиляцию ограничения объема и давления Vt = 10 мкл/г; Pmax = 30 см Н 2 О, PEEP 2-3 см Н 2 О) при 2,5 Гц и 100% кислорода). Применяемая Vt составляла 8,4 1,4 мкл/г у животных, которые получали доксициклин и 8,90,4 мкл/г BW у животных, которые получали доксициклин и иРНК (N.S.). Динамически-механические свой- 25022786 ства дыхательной системы в такой же степени как и входное сопротивление легких измеряли у животных с 5-минутными интервалами, после того как дважды накачивали 15 мкл/г в течение 1 с, чтобы создать стандартную историю объема. Для вибрационного измерения вентиляцию останавливали на уровнеPEEP. Чтобы определить полное сопротивление системы дыхания (Zrs) путем вынужденных осцилляции(FOT), которые состояли из псевдостатистического вибрационного сигнала в 8 с, применяли амплитуду в 3 мл/г. Вынужденный сигнал имел частоты между 1,75 и 19,6 Гц (23,24). Данные собирали при 256 Гц и анализировали с промежутком в 4 с при 66% перекрытия. Данные полного сопротивления легких были представлены как сопротивление (реальная часть) и реакционная способность (воображаемая часть) дыхательной системы внутри частотной области. Данные полного сопротивления легких (Zrs) были разделены, причем была применена постоянная фазовая модель легкого, как предлагалось Hantos et al. (25). В этой модели Zrs состоит из сопротивления дыхания (Rn), инерции дыхательных путей (Inertia), эластичности ткани (HL) и притупления в ткани (GL) по уравнению причемпредставляет собой угловую частоту ичастотную зависимость от Zrs ( = (2/tan-1(1/. Гистерезис легких (eta = GL/HL) представляет собой меру для состава легочной ткани, причем вводят как притупление в ткани, так и эластичность ткани (26, 27). Для каждого измерения постоянная фазовая модель автоматически проверяется на адаптацию. Качество адаптации представляется как когерентность определения (COD), данные отклоняются, если COD является ниже 0,85. Анализ сурфактантного белка. Общее содержание белка жидких фракций лаважа определяли с помощью набора Bio-Rad Proteinassay (Bio-Rad). 10 мкг общего белка разделяли при не восстанавливающих условиях на NuPage 10% геляхBis-Tris с применением NOVEX Xcell II Mini-Cell System (Novex). После электрофореза перепроверяли белки на мембране PVDF (ImmobilonP) с NuPage Blot Modul (Novex). Сурфактантный белок В (SP-B) обнаруживали с поликлональной антисывороткой кролика, которая была направлена против SP-B (с 329,подарок от Dr. W. Steinhilber, Altana AG) и затем проводили улучшенный хемилюминесцентный тест(Amersham Biosciences) с пероксидазой хрена конъюгированным поликлональным коза-анти-кроликанти-IgG (1:10.000; Dianova). При этих условиях тест смог подтвердить примерно 2,5 нг SP-B на траекторию (28). В качестве индикаторной системы хемилюминесценции применяли DIANA III dev. 1.0.54 с анализатором изображения Aida (Ray test Isotopenmessgerate GmbH) и данные оценивали количественно с помощью Quantity One 4.6.7 (Bio-Rad). Анализ флуоресцентным микроскопом. Фиксированные (3% параформальдегид) и залитые в парафин разрезы подвергали иммунной гистохимии, как рекомендуется производителем (Abeam, www.abcam.com/technica). Носители инкубировали с антителами анти-человеческий-анти-мышь-SP-B и с Texasrot конъюгированным антителом анти-кроликIgG (оба от Abeam, 1:500) и окрашивали в контрастный цвет с DAPI. Флуоресцентные изображения получали от Zeiss Axiovert 135. Статистика. Различия в экспрессии иРНК между группами анализировали посредством попарно фиксированного рандомизированного теста на перераспределение с REST 2005 Software (29). Периоды полураспада для затухания биолюминесценции подсчитывали с помощью Prism 5.0. Все другие анализы проводили с применением теста Уилкоксон-Манн-Уитни с SPSS 15 (SPSS Inc.). Данные указываются как среднее значениеSEM (нормированная ошибка среднего значения) или как медианаIQR (межквартильные размахи) и Р 0,05 (двусторонний) рассматривали как статистически существенные. Пример 6. Многократно модифицированная иРНК согласно изобретению, которая кодирует ЭПО. По существу, с помощью способа, как описано в примере 3, получали модифицированную иРНК,которая содержала ЭПО кодирующую часть. Эту иРНК тестировали на ее эффективность экспрессии. Для этого каждый раз 5 мкг модифицированной иРНК согласно изобретению соответственно немодифицированной иРНК впрыскивали мышам внутримышечно. Каждая группа из мышей состояла из четырех членов. На 14 и на 28 день после введения РНК количественно оценивали долю ЭПО в сыворотке с помощью теста ELISA. Значение гематокрита оценивали в цельной крови мышей при одинаковом опыте. Показанные в прилагаемой фиг. 11 данные представляют собой каждый раз среднее значениеSEM. Scatter-Blot показывает отдельные значения гематокрита, штрихи показывают срединные значения. Р 0,05 по отношению к необработанной группе к соответствующему моменту времени; +Р 0,05 по отношению к немодифицированной иЭПО-группе к соответствующему моменту времени.(c) Данные показывают среднее значениеSEM. Человеческие РВМС трансфицировали с 5 мкг немодифицированной соответственно модифицированной КФБ-иРНК и проценты регенерации определяли с помощью РИП с применением специфических для TLR-3, TLR-7 и TLR-8 антител. Блоки означают средние значенияIQR. Штрихи показывают минимальные соответственно максимальные значения. Р 0,5, Р 0,01, Р 0,001 в отношении немодифицированной иЭПО-группы.(d) 5 мкг немодифицированную и модифицированную иЕРОиРНК впрыскивали мышам внутривенно (каждый раз n = 4). Через 24 ч количественно оценивали уровень интерферон-, IL-12 и интерферон- 26022786 в сыворотке с помощью ELISA. Как можно понять из диаграмм, маркеры воспаления для модифицированной РНК согласно изобретению находятся в незаметной области, в то время как сильно повышены маркеры воспаления для немодифицированной РНК или только модифицированной РНК с модифицированными уридиновыми нуклеотидами. Таким образом, согласно изобретению предлагается иРНК, которая кодирует ЭПО, которая является очень стабильной и одновременно не вызывает или вызывает незначительные иммунологические реакции. иРНК подобного рода может благоприятно использоваться для лечения дефицита эритропоэтина. На основе высокой стабильности необходимой является дозировка только все от 2 до 4 недель. Пример 7. Было исследовано, как отражается повторное применение кодирующей ЭПО модифицированной иРНК согласно изобретению на значения гематокрита. Благодаря этому должно быть показано, остается ли активной модифицированная иРНК согласно изобретению также в течение длительного времени, если она вводится в организм. Иммунологическая реакция на иРНК согласно изобретению уменьшила бы,например, активность. Поэтому мышам внутримышечно вводили 10 мкг модифицированной иЭПО-иРНК (как описано в примере 6) на 0, 21 и 34 день (n = 10). Затем значение гематокрита определяли в общей крови мышей на 0, 21, 34, 42 и 51 день. Результаты приведены на фиг. 14. Данные в диаграмме показывают среднее значениенормированная ошибка Р 0,05 по сравнению со значением гематокрита в 0 день. Результаты подтверждают, что повторное применение модифицированной иРНК согласно изобретению приводит к продолжительному повышению значения гематокрита. Это показывает, что остается активной иРНК, даже когда ее применяют многократно. Пример 8. Модифицированная иРНК согласно изобретению также пригодна. Для того чтобы способствовать излечению или врастанию стимулирующих белков в окружение имплантатов, чтобы вследствие этого промотировать процессы выздоровления или врастание. Чтобы показать, что модифицированная иРНК согласно изобретению является стабильной и экспрессируется продолжительное время, если она наносится в виде покрытия на титановые поверхности, на титановые пластины наносили покрытие, содержавшее иРНК, которая кодировала люциферазу. Затем перепроверяли, могла ли и как долго определяться люцифераза в окружении, свободно или в клетках. Для исследования применяли последовательности, кодирующие два различных белка, а именно РНК для люциферазы, которая выделялась из экспрессирующей ее клетки как модель для таких белков,которые должны подаваться в окружение, как, например, факторы роста или факторы ангиогенеза. Далее применяли РНК, которая кодирует люциферазу, которая не выделяется, а остается в клетке как модель для таких белков, которые должны вызывать что-либо в клетке. Для модели секреции применяли РНК,которая кодировала Metridia люциферазу, в которой по сравнению с диким типом 25% уридиновых единиц были заменены посредством s2U и 25% цитидиновых единиц были заменены посредством m5 С. Для несекретирующей модели белков применяли иРНК, кодирующую люциферазу светлячков, у которой равным образом 25% уридиновых единиц были заменены посредством s2U и 25% цитидиновых единиц посредством модифицированной m5 С. Было обнаружено, что препараты иРНК согласно изобретению, которая была защищена как комплекс с полимером, после выделения из покровного материала оставались активными и экспрессировались в течение длительного времени. Оказалось, что каждый раз белок, кодированный посредством модифицированной иРНК согласно изобретению, мог обнаруживаться в течение длительного периода времени. Для тестов модифицированную иРНК согласно изобретению, защищенную полимерным комплексом, вводили в носитель, который наносили в виде слоя на титановые пластины. Носитель представлял собой полилактид (PDLLA), хорошо известный для этой цели материал, который мог целенаправленно и постепенно высвобождать полученную иРНК. Преимущество подобного покрытия состоит в том, что можно целенаправленно установить выделение. Результаты показывают, что при распаде свободно применяемых фрагментов полилактида не нарушается активность иРНК так, что эта система является весьма пригодной. Сама иРНК была стабилизирована посредством оболочечного полимера. Для опыта применяли кодирующую Metridia люциферазу плазмидную ДНК (пДНК) соответственно модифицированную иРНК. Каждый раз 9 мкг Metridia люциферазы пДНК или дважды модифицированную s2U(0,25)5C(0,25)иРНК в 200 мкл Н 2 О (+ при необходимости 500 мкг лактозы) образовывали комплекс с 9,4 мкг L-PEI (L-полиэтиленимин) в 200 мкл Н 2 О. После этого комплексы добавляли в 100 мкл раствора оболочечного полимера (2,4 мкл 409,1 mM P6YE5C) и лиофилизировали в течение ночи (оболочечный полимер P6YE5C получали, как описано в ЕР 1198489). После этого комплексы суспендировали в 72 мклPDLLA (поли-DL-лактид)/EtOAc (50 мг/мл PDLLA) смеси на льду и диспергировали с помощью Mikropotter. Этой дисперсией покрывали стерилизованные в автоклаве титановые пластинки (r = 3 мм, по 18 мкл) в 96-луночном планшете. После последующей лиофилизации в течение ночи А 549-клетки добавля- 27022786 ли в 200 мкл среды RPMI-1640 (5000 клеток/200 мкл). Co второго дня каждый раз снимали 50 мкл с жидкой фракции, меняли среду и с помощью по 100 мл раствора целентеразина (0,003 mM конечная концентрация) в последующие дни определяли экспрессию Metridia люциферазы. В другом опыте проверяли активность модифицированной иРНК согласно изобретению, кодирующей Metridia люциферазу, если ее осаждали на частицы фосфата кальция и в этом виде вносили в покрытие. Для этого каждый раз 4 мкг Metridia люциферазы s2U(0,25)m5C(0,25)иРНК в 600 мкг 1HBS смешивали с 33 мкл 2,5 М CaCl2. Через 30 мин этим покрывали стерилизованные в автоклаве титановые пластины(r = 3 мм, по 18 мкл) в 96-луночном планшете. После лиофилизации в течение ночи А 549-клетки добавляли в 200 мкл RPMI-1640-среду (5000 клеток/200 мл). Со второго дня каждый раз снимали 50 мкл с жидкой фракции, среду меняли и с помощью по 100 мкл раствора целентеразина (0,003 mM конечная концентрация) в последующие дни определяли экспрессию Metridia люциферазы. Результаты можно получить из диаграммы на фиг. 15. Результаты показывают, что модифицированная иРНК согласно изобретению остается еще активной также еще тогда, когда она защищается полимерной оболочкой, вносится в замедленно высвобождающую матрицу и наносится на титановые имплантаты. Далее модифицированная иРНК согласно изобретению остается биологически активной и непрерывно транслируется в кодированный белок. Также сохраняется секреционная способность, что выражается в том, что Metridia люцифераза может обнаруживаться в клеточной среде (как модель для выделяющих факторов роста костей, как, например, ВМР-2). Кроме того, неожиданно результаты показывают, что покрытие модифицированной иРНК обеспечивает более высокую экспрессию белка, чем покрытие титановых имплантатов аналогичной плазмидной ДНК. Если комплексы иРНК/PEI снабжены оболочечным полимером перед внедрением в покрытие титановых имплантатов, то получается еще более высокая экспрессия белка, чем при применении тех же самых комплексов, но без оболочечного полимера (на чертеже мод. иРНК/IPEI-Р 6 УЕ 5 С). Далее было обнаружено, что возможно добавление лактозы в качестве вспомогательного вещества без потери модифицированной иРНК ее биологической активности. Результаты также показывают, что осажденная на частицы фосфата кальция модифицированная иРНК сохраняет свою активность и может выполнять свои благоприятные свойства в покрытии титановых имплантатов. Биологическая активность сохраняется. Это имеет особое значение, так как фосфат кальция может встраиваться непосредственно в кости. Как поясняется выше, следующий опыт проводили с ДНК, соответственно РНК, кодирующей люциферазу светлячков. Для этого каждый раз 9 мкг люциферазы светлячков пДНК соответственно модифицированной s2U0,25m5C0,25 иРНК в 200 мкл Н 2 О комплексировали с 9,4 мкг L-PEI в 200 мкл Н 2 О. После этого комплексы добавляли в 100 мкл раствора оболочечного полимера (2,4 мкл, 409,1 mMP6YE5C) и лиофилизировали в течение ночи. Затем комплексы растворяли в 72 мкл поли-DL-молочной кислоты (PDLLA)/этилацетат (EtOAc) (50 мг/мл PDLLA)-смеси на льду и диспергировали с помощьюMikropotter. Этой дисперсией покрывали стерилизованные в автоклаве титановые пластины (r = 3 мм, по 18 мкл) в 96-луночном планшете. После последующей лиофилизации в течение ночи добавляли А 549 клетки в 200 мкл среды RPMI-1640 (5000 клеток/200 мкл). На второй день в лунки добавляли по 1 мкл 350 рМ D-люциферина, инкубировали 20 мин и определяли люциферазную экспрессию посредством BioImaging. Результаты приведены на фиг. 16. Как можно понять из диаграммы на фиг. 16, титановые имплантаты покрывают модифицированной иРНК согласно изобретению, причем далее иРНК также остается биологически активной и транслируется кодированный белок. Образованный белок остается в клетке и может обнаруживаться внутриклеточно. Кроме того, результаты показывают, что покрытие модифицированной иРНК приводит к более высокой экспрессии белка, чем покрытие титановых имплантатов аналогичной плазмидной ДНК. Пример 9. Чтобы урегулировать экспрессию модифицированной иРНК согласно изобретению так, что кодированный белок экспрессируется только в клетках, в которых он является желательным, однако в других клетках - нет, один участок связывания микро-РНК был включен в иРНК, чтобы способствовать специфической клеточной регуляции экспрессии иРНК. Для этого культивировали HEK293-клетки в MEM с 10% FCS и 1% пеницилин-стрептомицин. За 24 ч до трансфекции высеивали 100000 клеток/лунку в 24-луночный планшет. Непосредственно перед трансфекцией среду заменяли на 400 мкл среды Opti-MEM (Invitrogen). U937-клетки культивировали вRPMI-1640-среде с 10% FCS и 1% пеницилин-стрептомицином. Непосредственно перед трансфекцией высеивали 800000 U937-клеток в 400 мкл среды Opti-MEM (Invitrogen) на лунку в 24-луночный планшет. Для каждой лунки разбавляли 100 нг УЗФБ-иРНК и 250 нг КФБмиРНК-BS-иРНК (см. ниже) с Optimem до 50 мкл. 2 мкл липофектамина 2000 доводили до 50 мкл с помощью Optimem и инкубировали при комнатной температуре в течение 5 мин. Затем раствор иРНК добавляли пипеткой к раствору липофектамин 2000 и инкубировали при комнатной температуре последующие 20 мин. Полученный раствор добавляли пипеткой в лунки с клетками, через 4 ч добавляли пеницилин-стрептомицин (5 мл) и инкубацию продолжали в термостате в течение ночи. После этого HEK293-клетки промывали посредством PBS и путем добавления трипсина снимали со дна лунок, прежде чем их центрифугировали в течение 5 мин при 300G. U937-клетки равным образом центрифугировали в течение 5 мин при 300 G. Жидкую фракцию отбирали и затем клетки каждый раз дважды промывали посредством PBS. В заключение клетки ресуспендировали в 500 мкл PBS для FACS анализа. В обеих диаграммах фиг. 17 представлено соотношение экспрессии УЗФБ к экспрессии КФБ как количество положительных клеток (фиг. 17 а) и как средняя интенсивность флуоресценции КФБ (фиг. 17b). Результаты показывают, что благодаря инкорпорации участка связывания микро-РНК в in vitro транскрибируемую иРНК, экспрессия может регулироваться клеточно-специфически. В КФБмиРНК-BSиРНК находится 3' от последовательности КФБ и 5' от полиА-хвоста нетранслируемая последовательность четырехкратного повторения участка связывания микро-РНК, которые разделены друг от друга короткими спейсерными последовательностями (SEQ ID1). Применяли участок связывания микроРНК, который привязывает к микро-РНК 142-3 р. Эта микро-РНК экспрессируется в гематопоэтических клетках, таких как U937-клетки, а не в клетках другого происхождения, как HEK293-клетки. Если микроРНК 142-3 р привязывает к КФБ-ми-PHK-BS-иРНК, например, в U937-клетках, то начинается распад иРНК из-за интерференции РНК. Вследствие этого снижается образование КФБ, т.е. меньше клеток экспрессируют КФБ с более незначительной интенсивностью, чем в подобных клетках, в которых отсутствует микро-РНК 142-3 р. Чтобы показать, что этот принцип также хорошо действует с модифицированной иРНК согласно изобретению, котрансфицировали U937- и HEK-293-клетки каждый раз с УЗФБиРНК (без участка связывания микро-РНК) и КФБмиРНК-BS-иРНК (с четырехкратным тандемным повтором участка связывания микро-РНК для микро-РНК 142-3 р) и затем измеряли экспрессию УЗФБ и КФБ с помощью FACS. Так как КФБмиРНК-BS-иРНК в U937-клетках по причине интерференции РНК расщепляется быстрее, чем в HEK293-клетках, в то время как УЗФБ-иРНК и в тех и других клетках является стабильной, ожидается, что соотношение УЗФБ к КФБ в HEK293-клетках является выше, чем вU937-клетках. Это можно было подтвердить посредством проведенных опытов. Изображение четко показывает, что количество КФБ положительных U937-клеток после нормализации до количества УЗФБ положительных клеток является явно ниже, чем у HEK293-клеток. То же самое относится к количеству КФБ, образованному на клетку. Тем самым результаты также отчетливо показывают, что размер биологической активности транскрибированных in vitro иРНК может регулироваться путем введения участков связывания микро-РНК после трансфекции в клетки. Таким образом может подавляться трансляция иРНК в подобные клетки, в которых трансляция иРНК является нежелательной. Вследствие этого также могут быть уменьшены побочные эффекты. Применяемая для экспериментов в этом примере иРНК имеет следующую последовательность(SEQ ID1). Депонированная серым представлена последовательность КФБ. Подчеркнутая последовательность показывает четырехкратный тандемный повтор участка связывания микро-РНК для микроРНК 142-3 р со спейсерными последовательностями. Последовательность была клонирована в соответствии с синтезом через BamHI-EcoRv в вектор pVAX1.
МПК / Метки
МПК: C07H 21/00, A61K 48/00, A61F 2/00
Метки: белков, комбинацией, модифицированных, нуклеотидов, немодифицированных, рнк, экспрессии
Код ссылки
<a href="https://eas.patents.su/30-22786-rnk-s-kombinaciejj-iz-nemodificirovannyh-i-modificirovannyh-nukleotidov-dlya-ekspressii-belkov.html" rel="bookmark" title="База патентов Евразийского Союза">Рнк с комбинацией из немодифицированных и модифицированных нуклеотидов для экспрессии белков</a>
Предыдущий патент: Стереоселективный синтез производных пиперидина
Следующий патент: Дизамещенные тетрагидрофуранильные соединения в качестве антагонистов брадикининового рецептора в1
Случайный патент: Алатрофлоксациновые парентеральные составы