Композиция опухолеассоциированных пептидов и относящаяся к ним противораковая вакцина для лечения рака желудка и других видов рака
Номер патента: 22743
Опубликовано: 29.02.2016
Авторы: Фриче Йенс, Сингх Харприт, Вайншенк Тони, Левандровский Петер, Вальтер Штеффен
Формула / Реферат
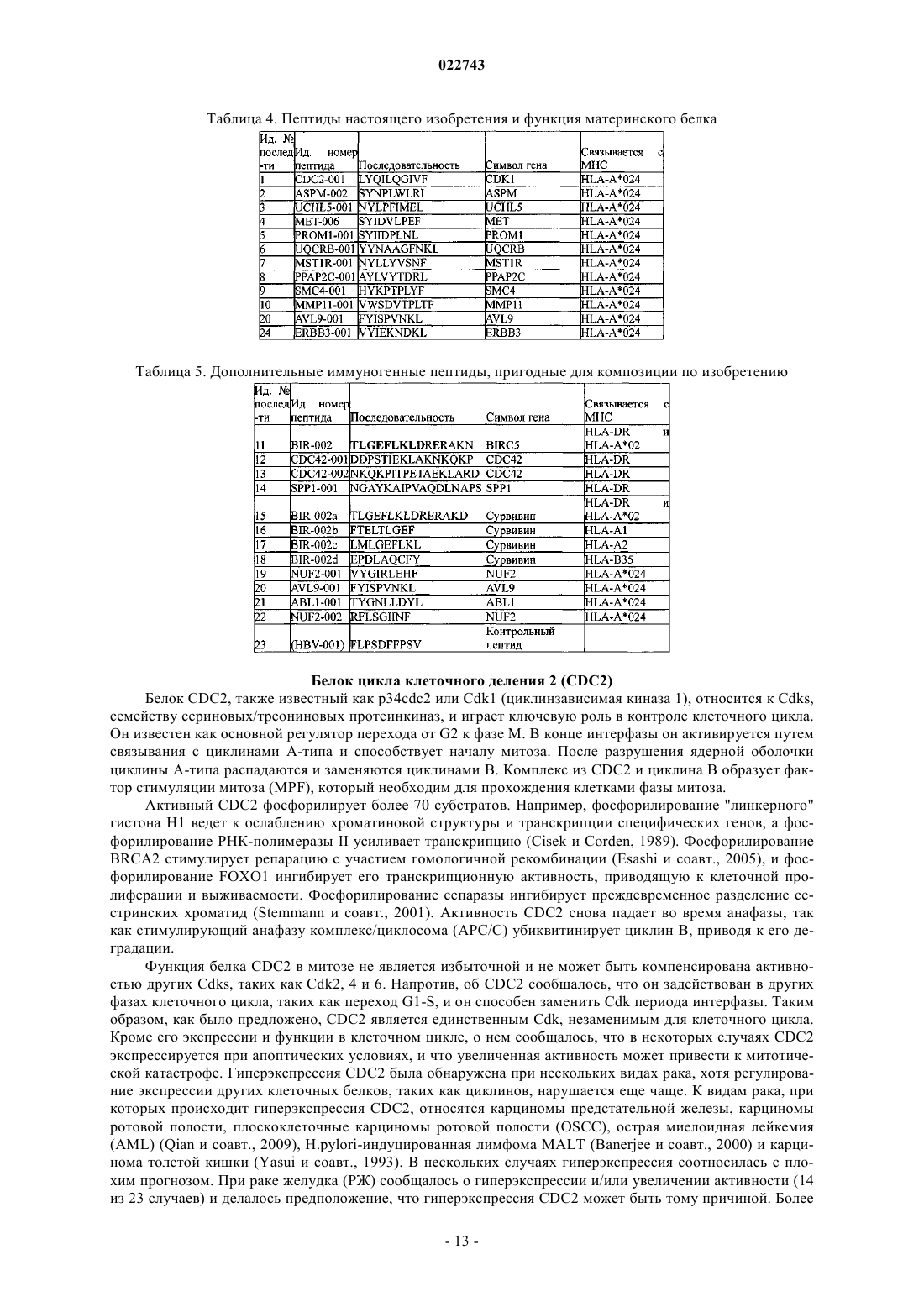
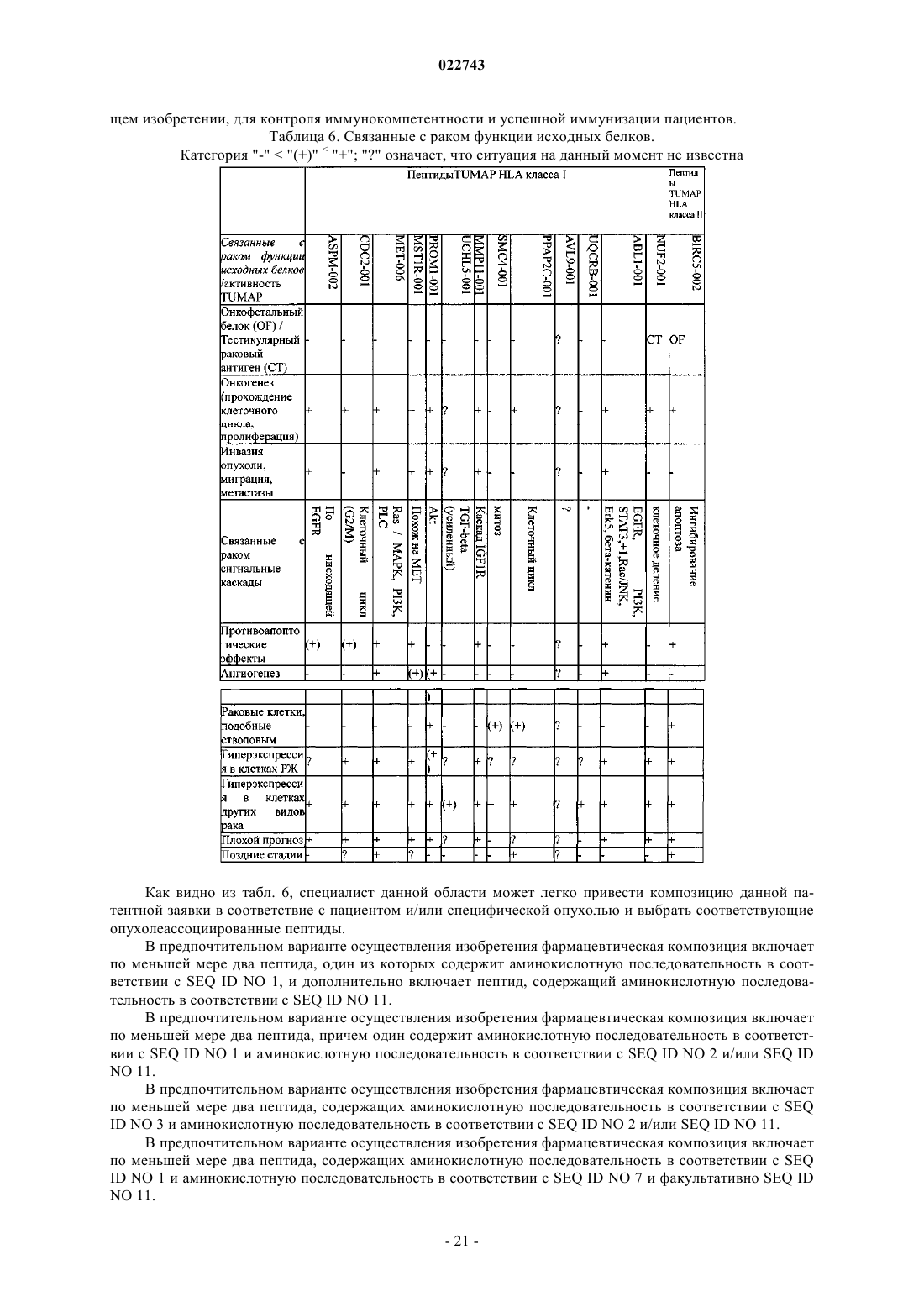
1. Фармацевтическая композиция, включающая по меньшей мере два пептида, состоящих из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO 1 по SEQ ID NO 10, SEQ ID NO 20 и SEQ ID NO 24, и/или полинуклеотид, содержащий нуклеиновую кислоту, кодирующую SEQ ID NO 1 по SEQ ID NO 10, SEQ ID NO 20 и SEQ ID NO 24, и фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п.1, дополнительно включающая по меньшей мере один дополнительный пептид, состоящий из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO 11 по SEQ ID NO 22, или полинуклеотид, содержащий нуклеиновую кислоту, кодирующую SEQ ID NO 9 по SEQ ID NO 22.
3. Фармацевтическая композиция в соответствии по п.1 или 2, где по меньшей мере один пептид включает непептидные связи.
4. Фармацевтическая композиция по любому из пп.1-3, включающая по меньшей мере два пептида MHC класса I с SEQ ID NO 1 и с SEQ ID NO 11, или один из этих двух пептидов МНС класса I с SEQ ID NO 2 и с SEQ ID NO 11, или один из этих двух пептидов МНС класса I с SEQ ID NO 3 и с SEQ ID NO 11.
5. Фармацевтическая композиция по любому из пп.1-4, где выбор, число и/или количество пептидов, присутствующих в композиции, является/являются ткане-, раково- и/или пациентспецифической/ими.
6. Фармацевтическая композиция по любому из пп.1-5, дополнительно включающая по меньшей мере один приемлемый адъювант, выбранный из группы, включающей 1018 ISS, соли алюминия, Amplivax, AS15, BCG, CP-870,893, CpG7909, CyaA, dSLIM, GM-CSF, IC30, IC31, Имиквимод, ImuFact IMP321, IS Patch, ISCOMATRIX, Juvlmmune, LipoVac, MF59, монофосфорил липид А, Монтанид IMS 1312, Монтанид ISA 206, Монтанид ISA 50V, Монтанид ISA-51, OK-432, OM-174, OM-197-MP-EC, ONTAK, векторную систему PepTel, микрочастицы PLG, резиквимод, SRL172, виросомы и другие вирусоподобные частицы, YF-17DBCG, стимулон Aquila's QS21, Detox компании Ribi, Quil, Superfos, адъювант Фрейнда, GM-CSF, холерный токсин, иммунологические адъюванты, MF59 и цитокины.
7. Фармацевтическая композиция по п.6, где адъювант выбран из группы, состоящей из колониестимулирующих факторов, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) или имиквимод или резимиквимод.
8. Фармацевтическая композиция по любому из пп.1-7, дополнительно содержащая по меньшей мере одну антигенпрезентирующую клетку, такую как, например, дендритную клетку.
9. Фармацевтическая композиция по п.8, где по меньшей мере одна антигенпрезентирующая клетка является:
a) клеткой с введенным импульсным методом или нагруженной пептидом, выбранным из группы, состоящей из SEQ ID NO 1 по SEQ ID NO 22, или
b) включает экспрессионную конструкцию, кодирующую и экспрессирующую пептид.
10. Фармацевтическая композиция по любому из предыдущих пунктов, где указанная фармацевтическая композиция является противораковой вакциной и где указанная вакцина вводится внутривенно, внутриартериально, внутрибрюшинно, внутримышечно, внутрикожно, внутрь опухоли, перорально, дермально, назально, буккально, ректально, вагинально, с помощью ингаляции или посредством топического введения.
11. Применение композиции по любому из предшествующих пунктов для лечения или профилактики рака у пациента.
12. Применение по п.11, где рак является карциномой предстательной железы, карциномой полости рта, плоскоклеточной карциномы полости рта (OSCC), острой миелоидной лейкемией (AML), вызываемой Н. pylori MALT-лимфомой, карциномой толстого кишечника/колоректальным раком, глиобластомой, немелкоклеточным раком легких (NSCLC), карциномой шейки матки, раком молочной железы человека, раком предстательной железы, раком толстого кишечника, раком поджелудочной железы, протоковой аденокарциномой поджелудочной железы, раком яичника, гепатоклеточной карциномой, раком печени, опухолями головного мозга различных фенотипов; лейкемиями, такими как острая лимфобластная лейкемия, ALL; раком легких, саркомой Юинга, эндометриальным раком, плоскоклеточной карциномой головы и шеи, эпителиальным раком гортани, карциномой пищевода, карциномой ротовой полости, карциномой мочевого пузыря, карциномами яичника, почечно-клеточной карциномой, атипической менингиомой, папиллярной карциномой щитовидной железы, опухолями головного мозга, карциномой слюнного протока, экстранодальными T/NK-клеточными лимфомами, нехожкинскими лимфомами и злокачественными солидными опухолями легких и молочной железы, предпочтительным видом рака является рак желудка.
13. Применение по п.11 или 12, где рак является раком желудка.
Текст
КОМПОЗИЦИЯ ОПУХОЛЕАССОЦИИРОВАННЫХ ПЕПТИДОВ И ОТНОСЯЩАЯСЯ К НИМ ПРОТИВОРАКОВАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ РАКА ЖЕЛУДКА И ДРУГИХ ВИДОВ РАКА Изобретение относится к иммунотерапевтическим пептидам и их применению в иммунотерапии,в частности иммунотерапии рака. Настоящее изобретение раскрывает опухолеассоциированные пептидные эпитопы Т-хелперных клеток в отдельности или в комбинации с другими опухолеассоциированными пептидами, которые служат как активные фармацевтические ингредиенты для композиций вакцины, которая стимулирует противоопухолевые иммунные ответы. В частности, композиция пептидов настоящего изобретения может применяться в вакцинных композициях для инициации противоопухолевых иммунных ответов против рака желудка (РЖ).(71)(73) Заявитель и патентовладелец: ИММАТИКС БАЙОТЕКНОЛОДЖИЗ ГМБХ (DE) 022743 Изобретение относится к иммунотерапевтическим пептидам и их применению в иммунотерапии, в частности иммунотерапии рака. Настоящее изобретение раскрывает опухолеассоциированные пептидные эпитопы Т-хелперных клеток, в отдельности или в комбинации с другими опухолеассоциированными пептидами, которые служат как активные фармацевтические ингредиенты композиций вакцины, которая стимулирует противоопухолевые иммунные ответы. В частности, композиция пептидов настоящего изобретения может быть использована в вакцинных композициях для инициации противоопухолевых иммунных ответов против рака желудка и других видов рака (РЖ). В соответствии с целями настоящего изобретения все цитаты описания включены во всей полноте путем ссылки. Уровень техники Рак желудка является заболеванием, при котором злокачественные клетки формируются в слизистой оболочке желудка. Рак желудка может развиваться в любой части желудка и может распространяться по всему желудку и проникать в другие органы; в частности пищевод, легкие и печень. Рак желудка занимает четвертое место по частоте распространения в мире, в 2002 г. этот диагноз был поставлен в 930000 случаев. Это заболевание связано с высокой смертностью (800 000 случаев в год), из-за чего оно является второй по частоте причиной летального исхода от рака после рака легких. Оно более распространено среди мужчин и возникает чаще в странах Азии и развивающихся странах. (Информацию можно получить в ВОЗ). На него приходятся ежегодно 2% (25500 случаев) всех новых случаев заболевания раком в США,однако данное заболевание больше распространено в других странах. Это самый распространенный вид рака в Корее, на который приходятся 20,8% всех злокачественных новообразований. В Японии рак желудка остается наиболее распространенным видом рака у мужчин. В США диагноз рак желудка ежегодно ставится около 13000 мужчин и 8000 женщин, большинству из которых больше 70 лет. Рак желудка занимает четвертое место по частоте распространения в мире после рака легких, молочной железы, рака толстой и прямой кишки. Кроме того, рак желудка продолжает быть второй по частоте причиной летального исхода от рака. По прогнозу Американского общества по борьбе с раком в 2007 г. число новых случаев заболевания предположительно составило один миллион, около 70% из которых приходится на развивающиеся страны и около 800000 летальных исходов (см. публикации Американского общества по борьбе с раком). В отношении частоты заболеваемости по всему миру существуют колоссальные географические различия. Наиболее высокий процент распространения заболевания приходится на Азию и части Южной Америки, наиболее низкий - на Северную Америку. Наиболее высокий уровень смертности зарегистрирован в Чили, Японии, Южной Америке и в странах бывшего Советского Союза. Зачастую диагноз рака желудка ставится на поздней стадии, так как скрининговое исследование не проводится в большинстве стран мира, за исключением Японии (и в ограниченной степени в Корее), где обнаружение зачастую происходит на ранней стадии. Таким образом, это продолжает оставаться наиболее сложной задачей для специалистов здравоохранения. Фактором риска для заболевания раком желудка является бактериальная инфекция Helicobacter pylori (H. pylori), курение, потребление соли в больших количествах и другие факторы, связанные с питанием. Небольшое число случаев рака желудка (1-3%) связано с синдромом наследственной предрасположенности к раку желудка. Мутации гена Е-кадхерина происходят приблизительно у 25% семей с аутосомным доминантным геном предрасположенности к раку желудка диффузного вида. Этот подвид рака желудка получил название наследственный диффузный рак желудка. Целесообразным может быть проведение генетического консультирования и принятие во внимание профилактической гастрэктомии в юном возрасте для носителей усеченной зародышевой линии при бессимптомном протекании. Стенки желудка состоят из трех слоев тканей: слизистого (глубинного) слоя, мышечного (среднего) слоя и серозного (наружного) слоя. Рак желудка развивается в клетках, выстилающих слизистую оболочку, и распространяется во время роста во внешние слои. Применяются четыре стандартных способа лечения. Лечение рака желудка может включать хирургическую операцию, химиотерапию, лучевую терапию или химиолучевую терапию. Операция является основным способом лечения рака желудка. Целью операции является проведение полной резекции с отрицательным хирургическим краем (резекция типаR0). Однако приблизительно 50% пациентов, больных местно-распространенным раком желудка, не могут быть подвергнуты резекции типа R0. Тип R1 указывает на микроскопические признаки неполной резекции (положительные края); и R2 указывает на макроскопические признаки неполной резекции, но без отдаленного распространения заболевания. Исход для пациента зависит от стадии рака во время постановки диагноза. (Руководство по клинической практике в онкологии Национальной онкологической сети США (NCCN Clinical Practice Guidelines in Oncology Процент выживаемости в течение 5 лет в случае радикальной резекции составляет 30-50% для пациентов на II стадии заболевания и 10-25% для пациентов на III стадии заболевания. Для этих пациентов существует высокая вероятность появления локальных и системных рецидивов. Метастазы появляются у 80-90% лиц, больных раком желудка, а показатель шестимесячной выживаемости равен 65% для тех,кому диагноз был поставлен на ранних стадиях, и менее 15% для тех, кому диагноз был поставлен на-1 022743 поздних стадиях. Таким образом, до сих пор существует потребность в новом, эффективном и безопасном способе лечения рака желудка, карциномы предстательной железы, карцином полости рта, плоскоклеточной карциномы полости рта (OSCC), острой миелоидной лейкемии (AML) (Qian и соавт., 2009), вызываемом Н.pylori MALT-лимфомы (Banerjee и соавт., 2000), карциномы толстого кишечника/колоректального рака,глиобластомы, немелкоклеточного рака легких (NSCLC), карциномы шейки матки, рака молочной железы человека, рака предстательной железы, рака толстого кишечника, рака поджелудочной железы, протоковой аденокарциномы поджелудочной железы, рака яичника, гепатоклеточной карциномы, рака печени, опухолей головного мозга различных фенотипов; лейкемии, такой как острая лимфобластная лейкемия (ALL); рака легких, саркомы Юинга, эндометриального рака, плоскоклеточной карциномы головы и шеи, эпителиального рака гортани, карциномы пищевода, карциномы ротовой полости, карциномы мочевого пузыря, карцином яичника, почечно-клеточной карциномы, атипической менингиомы, папиллярной карциномы щитовидной железы, опухолей головного мозга, карциномы слюнного протока, рака шейки матки, экстранодальных T/NK-клеточных лимфом, нехожкинской лимфомы и злокачественных солидных опухолей легких и молочной железы, а также других видов опухолей. Также существует потребность в способах лечения для улучшения самочувствия пациентов без применения химиотерапевтических средств или же других препаратов, которые могут вызывать серьезные побочные эффекты. Колоректальная карцинома По данным Американского общества по борьбе с раком, колоректальный рак (CRC) занимает третье место по частоте распространения в США, это заболевание поражает ежегодно более 175000 новых пациентов. В США, Японии, Франции, Германии, Италии, Испании и Великобритании оно поражает более 480000 пациентов. Это одна из наиболее частых причин смертности от рака в развитых странах. Исследователи предполагают, что возникновение колоректального рака является результатом взаимодействия между наследственными факторами и факторами окружающей среды. В большинстве случаев появляются аденоматозные полипы, становясь предшественниками колоректальных опухолей, хотя процесс их перехода в опухоль может занять множество лет. Первостепенный фактор риска для заболевания колоректальным раком - это возраст, в 90% случаев диагноз был поставлен, когда возраст превышал 50 лет. Другие факторы риска заболевания колоректальным раком по данным Американского общества по борьбе с раком включают употребление алкоголя, питание с высоким содержанием жиров и/или красного мяса и неадекватное потребление фруктов и овощей. Число новых случаев продолжает расти в особенности на территории таких стран, как Япония, где виновником может быть внедрение западных образцов питания с избыточным потреблением жира и мяса и снижение потребления волокнистой пищи. Несмотря на это частота заболеваемости растет не так быстро, как раньше, что может быть связано с увеличением количества скрининговых обследований и удалением полипов, предотвращая, таким образом, прогрессирование заболевания и переход полипов в рак. Как и при большинстве солидных опухолей, лечение первого ряда - операция, однако только пациенты на ранней стадии могут получить от этого пользу, значительной же доле пациентов диагноз ставится лишь на поздних стадиях заболевания. В химиотерапии колоректального рака на поздних стадиях стандартом лечения являются лечебные схемы, основанные на фторурациле. Большинство данных лечебных схем представляют собой т.н. курсы лечения "FOLFOX" (вливание 5-FU/лейковорин плюс оксалиплатин) и "FOLFIRI" (иринотекан, лейковорин, болюсное и продолжительное вливание 5-FU). Внедрение цитотоксических препаратов третьего поколения, таких как иринотекан и оксалиплатин,увеличило надежду на значительное улучшение эффективности, однако прогнозы до сих пор относительно неблагоприятные. Срок выживаемости при метастатической болезни, как правило, составляет приблизительно 20 месяцев и, в результате этого, остается высокой неудовлетворенность потребностей медицины при данном заболевании. Недавно стало доступным новое поколение медикаментов, действующих на молекулярные мишени,таких как Авастин (Avastin) (бевацизумаб) и Эрбитукс (Erbitux) (цетуксимаб), а около 40 соединений находятся на последней стадии клинических исследований по лечению различных стадий колоректального рака. Комбинации из нескольких таких соединений повышают число потенциальных вариантов лечения, ожидаемых в будущем. Подавляющее большинство веществ находятся на 2-ой фазе исследований, при этом данные соединения более часто, чем другие разрабатываемые медикаменты против колоректального рака, адресованы против EGFR (рецептор эпидермального фактора роста), что связано с тем фактом, что у 80% пациентов с колоректальным раком наблюдается повышенная экспрессия EGFR. На данный момент проводятся клинические исследования с пациентами II стадии с комбинацией химиотерапии с одобренными недавно моноклональными антителами (mAb) (цетуксимаб + иринотекан или FOLFOX4; бевацизумаб в качестве монотерапии или вместе с FOLFOX4). Для получения статистически достоверных результатов по данным исследованиям необходимы трех-, четырехгодичные периоды наблюдения. Моноклональные антитела (mAb), используемые в настоящее время в онкологии, в целом имеют превосходные шансы на то, что они не будут создавать помех активной иммунотерапии. Действительно,имеются доклинические данные, предполагающие, что элиминация фактора роста эндотелия сосудовVEGF (в случае бевацизумаба) вносит положительный вклад в опосредованную ДК (дендритными клетками) активацию Т-клеток. Карцинома предстательной железы и другие виды опухолей Число смертей от рака предстательной железы в 2007 году составил 27050, что делает его наиболее частой причиной смерти от рака у мужчин. Несмотря на то, что процент смертности среди белого и афроамериканского населения снижается с начала 1990-х годов, до сих пор число афроамериканских мужчин более чем в два раза превышает число белых мужчин. Рак предстательной железы является наиболее часто диагностируемым видом рака у мужчин. По неизвестным причинам частота заболеваемости значительно выше среди афроамериканцев, чем среди белых мужчин. Частота заболеваемости раком предстательной железы постоянно менялась на протяжении последних 20 лет: быстрый рост с 1988 г. по 1992 г.,резкое снижение с 1992 г. по 1995 г. и умеренный рост с 1995 года. Данные тенденции отражают, главным образом, увеличение числа скрининговых обследований на рак предстательной железы с помощью анализа крови на простата-специфический антиген (PSA). Умеренный рост частоты заболеваемости за последнее десятилетие связан, скорее всего, с распространенным скринингом PSA среди мужчин моложе 65 лет. Частота заболеваемости раком предстательной железы стабилизируется у мужчин 65 лет и старше. Число случаев достигло своего пика для белых мужчин в 1992 году (237,6 случаев на 100000 человек) и для афроамериканцев - в 1993 году (342,8 случаев на 100 000 человек). Лечение рака предстательной железы может включать внимательное наблюдение, операцию, лучевую терапию, высокоинтенсивный фокусированный ультразвук (HIFU), химиотерапию, криохирургию,гормональное лечение или какую-либо комбинацию указанных выше методов. Какая из возможностей является наилучшей, зависит от стадии заболевания, оценки по шкале Глисона и уровня PSA. Другие важные факторы включают возраст мужчины, общее состояние его здоровья и его отношение к возможным способам лечения и побочным эффектам от них. Так как все способы лечения могут иметь побочные эффекты, такие как эректильная дисфункция и недержание мочи, то в центре внимания при дискуссиях о способе лечения часто стоит возможность нахождения баланса между целью лечения и рисками,связанными с изменением стиля жизни. Если рак распространился за пределы предстательной железы, то возможности для лечения значительно изменяются, так что большинство врачей, лечащих рак предстательной железы, используют множество томограмм для предсказания вероятности распространения. Лечение с использованием внимательного наблюдения, высокоинтенсивного фокусированного ультразвука (HIFU), лучевой терапии,криохирургии и операции предлагаются обычно мужчинам, заболевание которых остается в пределах предстательной железы. Гормональная терапия и химиотерапия часто предусматриваются для лечения заболевания, которое распространилось за пределы предстательной железы. Однако возможны исключения: лучевая терапия может использоваться для некоторых опухолей на поздних стадиях, а гормональная терапия - для опухолей на ранней стадии. Криотерапия, гормональная терапия и химиотерапия могут быть также предложены, если первоначальное лечение было неудачным, и рак прогрессирует. У значительного числа пациентов, страдающих раком предстательной железы, которые подвергаются простатэктомии из-за клинического подозрения на рост внутри органа, окончательное гистологическое обследование операционного материала показывает локально экстенсивное распространение опухоли за пределы органа. Для таких пациентов существует высокий риск быстрого локального рецидива,обнаруживаемого обычно как повышение уровня PSA с точки зрения биохимического рецидива заболевания. Терапевтические возможности в данной ситуации включают наружную лучевую терапию и гормон-депривационную терапию; однако значимость данных терапевтических подходов, в особенности в отношении продления жизни пациента в долгосрочной перспективе, не подтверждена. Кроме того, необходимо учитывать возможность связанных с лечением осложнений, таких как появление стриктуры уретры (лучевая терапия), потеря полового влечения и импотенция, риск снижения содержания солей кальция в костях в связи с остеопорозом и существенно возросший риск патологической хрупкости костей (гормон-депривационная терапия). Более 90% всех случаев заболевания раком предстательной железы обнаруживаются на локальной и региональной стадиях; 5-летняя относительная выживаемость для пациентов, опухоли которых были диагностированы на этих стадиях, достигает 100%. В течение последних 25 лет 5-летняя выживаемость для всех стадий в целом увеличилась с 69% до примерно 90%. В соответствии с последними данными относительная 10-летняя выживаемость составляет 93%, а 15-летняя - 77%. Разительное увеличение выживаемости, в особенности 5-летней, отчасти связано с ранней постановкой диагноза и совершенствованием методов лечения. Несмотря на это, сроки выживаемости значительно сокращаются после распространения на другие ткани и органы. Рак легких В 2007 году ожидаются приблизительно 210000 новых случаев в США, что составляет около 15% диагнозов всех видов рака. Частота заболеваемости значительно снижается среди мужчин, с 102 случаев на 100000 человек в 1984 году до 78,5 в 2003 году. Среди женщин частота заболеваемости стабилизировалась после долгого периода роста. В целях лечения рак легких классифицируется клинически на мелкоклеточный (13%) и немелкоклеточный (87%).-3 022743 Рак легких является наиболее частой причиной смертности от рака как среди мужчин, так и среди женщин. Около 160390 смертей, составляющих приблизительно 29% всех летальных исходов от рака,ожидаются в 2007 году. Начиная с 1987 года, от рака легких ежегодно умирало больше женщин, чем от рака молочной железы. Число смертей среди мужчин значительно снижалось в период с 1991 по 2003 г.,примерно на 1,9% ежегодно. Смертность от рака легких среди женщин сохраняется на неизменном уровне после продолжительного роста на протяжении нескольких десятилетий. Данные тенденции по смертности от рака легких отражают снижение числа курящих на протяжении последних 30 лет. Вид лечения определяется типом (мелкоклеточный или немелкоклеточный) и стадией ракового заболевания и включают хирургическое вмешательство, лучевую терапию, химиотерапию, а также нацеленные биологические терапии, такие как бевацизумаб (Avastin) и эрлотиниб (Tarceva). Для локализованного вида рака в качестве терапии обычно выбирается операция. Последние исследования указывают на то, что выживаемость с немелкоклеточным раком легких ранней стадии улучшается, если за операцией следует химиотерапия. Так как на момент своего обнаружения заболевание обычно уже распространено, часто используются лучевая терапия и химиотерапия, иногда в сочетании с операцией. Химиотерапия в отдельности или в сочетании с лучевой терапией является стандартным лечением, выбираемым для мелкоклеточного рака легких; при данной схеме лечения большой процент пациентов испытывает ремиссию, которая в некоторых случаях бывает продолжительной. Одногодичная относительная выживаемость для пациентов, больных раком легких, слегка возросла с 37% в 1975-1979 г. до 42% в 2002 году, во многом благодаря усовершенствованиям в хирургической технике и комбинированным способам лечения. Однако 5-летний срок выживаемости для всех стадий в целом составил лишь 16%. Процент выживаемости для всех случаев, обнаруживаемых, когда заболевание все еще локализовано, составляет 49%; однако только 16% всех случаев рака легких диагностируются на этой ранней стадии. Таблица 1. Предполагаемое количество случаев заболевания раком и смертей в зависимости от пола для США в 2007 году (данные Американского общества по борьбе с раком. Факты и цифры о раке - 2007 г. Atlanta: American Cancer Society; 2007)-4 022743 Таким образом, до сих пор существует потребность в новом, эффективном и безопасном способе лечения глиобластомы, опухоли предстательной железы, рака молочной железы, рака пищевода, колоректального рака, светлоклеточной почечно-клеточной карциномы, рака легких, ЦНС, яичника, меланомы, рака поджелудочной железы, плоскоклеточной карциномы, лейкемии и медуллобластомы, а также других видов опухолей, демонстрирующих гиперэкспрессию сурвивина, который улучшал бы самочувствие пациентов без применения химиотерапевтических средств или других веществ, которые могут вызывать серьезные побочные эффекты. Подробное описание изобретения Все термины, используемые здесь, если не указано иное, имеют значения, данные ниже. Понятие"пептид" в контексте настоящего описания обозначает серии аминокислотных остатков, связанных друг с другом типично пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Пептиды предпочтительно имеют длину в 9 аминокислот, но могут быть короче - 8 аминокислот в длину, и длиннее - 11 или 13, 14,15,16, 17 или 18 аминокислот в длину. Понятие "олигопептид" в контексте настоящего описания обозначает серии аминокислотных остатков, связанных один с другим типично пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Длина олигопептида не особенно важна для изобретения до тех пор,пока в нем сохраняются надлежащие эпитоп или эпитопы. Олигопептиды, как правило, состоят из менее чем примерно 30 аминокислотных остатков в длину и более чем примерно 14 аминокислот в длину. Понятие "полипептид" обозначает серии аминокислотных остатков, связанных один с другим типично пептидными связями между альфа-аминными и карбонильными группами смежных аминокислот. Длина полипептида не особенно важна для изобретения до тех пор, пока сохраняются надлежащие эпитопы. В отличие от понятий "пептид" или "олигопептид", понятие "полипептид" введено для обозначения молекул, содержащих более чем приблизительно 30 аминокислотных остатков. Пептид, олигопептид, белок или полинуклеотид, кодирующий для такой молекулы, является "иммуногенным" (и, таким образом, "иммуногеном" в рамках настоящего изобретения), если он способен индуцировать иммунный ответ. В контексте настоящего изобретения, иммуногенность получает более специфическое определение как способность индуцировать Т-клеточный ответ. Таким образом, "иммуноген" будет представлять собой молекулу, которая способна индуцировать иммунный ответ, и, в случае настоящего изобретения, молекулу, способную индуцировать Т-клеточный ответ. Для Т-клеточного "эпитопа" необходим короткий пептид, который связан с рецептором МНС I илиII класса, образующий трехчленный комплекс (альфа-цепь МНС класса I, бета-2-микроглобулин и пептид), который может быть распознан Т-клеткой, несущей подходящий Т-клеточный рецептор, связывающийся с комплексом МНС/пептид с подходящей аффинностью. Пептиды, связывающиеся с молекулами МНС I класса, как правило, имеют длину в 8-14 аминокислот и, в особенности, как правило, длину в 9 аминокислот. Т-клеточные эпитопы, которые связываются с молекулами МНС II класса, как правило,имеют длину в 12-30 аминокислот. В случае пептидов, которые связываются с молекулами МНС II класса, один и тот же пептид и соответствующий Т-клеточный эпитоп могут иметь общий центральный сегмент, но различаться по общей длине из-за примыкающих последовательностей с различными длинами,расположенными перед аминным концом центральной последовательности и после ее карбоксильного конца, соответственно. Рецепторы МНС II класса имеют более открытую структуру, пептиды, связанные с рецепторами МНС II класса, соответствующим образом, не полностью углублены в структуру пептидсвязывающей бороздки молекулы МНС II класса, как это имеет место с пептидсвязывающей бороздкой молекулы МНС I класса. Как ни удивительно, это не применимо к пептиду в соответствии с SEQ ID NO 1, так как небольшие изменения в длине пептида ведут к экстремальному снижению активности (см. ниже). У человека имеется три различных генетических локуса, которые кодируют молекулы МНС I класса (молекулы МНС человека называются также человеческими лейкоцитарными антигенами (HLA:HLA-A, HLA-B и HLA-C, HLA-A01, HLA-A02 и HLA-A11 являются примерами различных аллелей МНС I класса, которые могут экспрессироваться из этих локусов. Человеческий геном имеет 3 различных локуса для генов МНС II класса: HLA-DR, HLA-DQ и HLADP. Рецепторы МНС II класса являются гетеродимерами, состоящими из альфа- и бета-цепи, обе из которых фиксируются на клеточной мембране с помощью трансмембранного региона. HLA-DRB104 иHLA-DRB107 - это два примера различных бета-аллелей МНС II класса, о которых известно, что они кодируются в данных локусах. Аллели II класса очень полиморфны, к примеру, было описано несколько сотен различных аллелей HLA-DRB1. Для HLA-A02 и наиболее частых серологических видов HLA-DR частоты экспрессии в различных популяциях представлены в табл. 2.-5 022743 Таблица 2. Частота экспрессии (F) HLAA02 и наиболее частые серотипы HLA-DR. Частоты экспрессии выведены из частот гаплотипа Gf среди американцев, приводимых в работе Mori и соавт. (Mori и соавт., 1997), с использованием формулы Харди-Вейнберга F=1-(1-Gf)2. Комбинации А 02 с определенными аллелями HLA-DR могут быть обогащенными или менее частыми, чем ожидается от их одиночных частот в связи с неравномерным распределением связей. Более подробная информация представлена в работе Chanock и соавт. (Chanock и соавт., 2004). Частоты экспрессии HLA02 и серотипов HLA-DR в подгруппах североамериканского населения В табл. 3: показаны частоты экспрессии F HLAA024 и серотипа HLAA02402. Частоты экспрессии выведены из частот гаплотипа Gf в популяции, опираясь на работу Mori и соавт. (Mori и соавт., 1997), с использованием формулы Харди-Вейнберга F=1-(1-Gf)2. Более подробная информация представлена в работе Chanock и соавт. (Chanock и соавт., 2004). Таблица 3. Частоты экспрессии HLA02 и серотипов А 2402 по всему миру Поэтому для терапевтических и диагностических целей крайне желателен пептид, который связывается с подходящей аффинностью с несколькими различными рецепторами HLA II класса. Пептид, связывающийся с несколькими различными молекулами HLA II класса, называется беспорядочно связывающимся пептидом. Используемая в контексте данного описания ссылка на последовательность ДНК включает как однонитевую, так и двунитевую ДНК. Таким образом, специфическая последовательность, если в контексте не указано иное, относится к однонитевой ДНК такой последовательности, дуплексу такой последовательности с его комплементом (двунитевая ДНК) и комплементу такой последовательности. Понятие"кодирующая область" относится к тому участку гена, который в естественных или обычных условиях кодирует продукт экспрессии того гена в его естественном геномном окружении, т.е., участку, кодирующему in vivo нативный продукта экспрессии гена. Кодирующая область может быть из нормального, мутировавшего или измененного гена или может даже быть из последовательности ДНК или же гена, целиком синтезированного в лаборатории с использованием методов, хорошо известных специалистам из области синтеза ДНК.-6 022743 Понятие "нуклеотидная последовательность" относится к гетерополимеру дезоксирибонуклеотидов. Нуклеотидная последовательность, кодирующая конкретный пептид, олигопептид или полипептид,может быть встречающейся в природе или может быть синтезирована. В целом, сегменты ДНК, кодирующие пептиды, полипептиды и белки данного изобретения, собраны из фрагментов кДНК и коротких олигонуклеотидных линкеров или же из серий олигонуклеотидов для получения синтетического гена,который способен экспрессироваться в рекомбинантной транскрипционной единице, включающей регуляторные элементы, образованные из микробного или вирусного оперона. Понятие "продукт экспрессии" означает полипептид или белок, являющийся естественным продуктом трансляции гена и любой последовательности нуклеиновой кислоты, кодирующей эквиваленты, образующиеся в результате вырожденности генетического кода и, таким образом, кодирующей ту/те же самую(ые) нуклеиновую(ую) кислоту(ы). Понятие "фрагмент", если относится к кодирующей последовательности, означает участок ДНК,включающий меньше, чем полную кодирующую область, продукт экспрессии которого, по существу,сохраняет ту же самую биологическую функцию или активность, что и продукт экспрессии целой кодирующей области. Понятие "сегмент ДНК" относится к полимеру ДНК в виде отдельного фрагмента или в качестве компонента более крупной конструкции ДНК, которая была образована из ДНК, выделенной по меньшей мере один раз, по существу, в чистой форме, т.е. без контаминирующих эндогенных материалов и в количестве или с концентрацией, позволяющей идентификацию, манипуляцию и восстановление сегмента и его составных нуклеотидных последовательностей стандартными биохимическими методами, например, с использованием вектора для клонирования. Такие сегменты предлагаются в форме открытой рамки считывания, не прерываемой внутренними нетранслированными последовательностями или нитронами, которые обычно присутствуют в эукариотических генах. Последовательности нетранслированной ДНК могут присутствовать по ходу транскрипции из открытой рамки считывания, где она не интерферирует с манипуляцией или экспрессией кодирующих областей. Понятие "праймер" означает короткую последовательность нуклеиновой кислоты, которая может быть спарена с одной нитью ДНК с получением свободного конца 3'ОН, на котором ДНК-полимераза начинает синтезировать дезоксирибонуклеотидную цепь. Понятие "промотор" означает участок ДНК, задействованный в связывании РНК-полимеразы для инициации транскрипции. Понятие "выделенный" означает, что материал удален из его исходного окружения (к примеру, естественного окружения, если он встречается в природе). Например, встречающийся в природе полинуклеотид или полипептид, представленный в живых организмах, не является выделенным, но тот же самый полинуклеотид или полипептид, отделенный от некоторых или всех сосуществующих материалов природной системы, является выделенным. Такие полинуклеотиды могли быть частью вектора и/или такие полинуклеотиды или полипептиды могли быть частью композиции и все-таки могли быть выделены, так что такой вектор или композиция не является частью своего естественного окружения. Полинуклеотиды и рекомбинантные или иммуногенные полипептиды, раскрытые в соответствии с настоящим изобретением могут также быть в "очищенной" форме. Понятие "очищенный" не требует абсолютной чистоты; скорее он предназначен для дачи относительного определения и может включать препараты с высокой очисткой или препараты только с частичной очисткой, в соответствии с тем, как эти термины понимаются специалистами соответствующей области. Например, отдельные клоны, выделенные из библиотеки кДНК, как обычно очищались до электрофоретической чистоты. Очистка исходного материала или природного материала от примесей по меньшей мере на один порядок величины,предпочтительно два или три порядка, и, более предпочтительно, четыре или пять порядков величины определенно рассматривается в изобретении. Более того, определенно рассматривается заявленный полипептид, чистота которого составляет предпочтительно 99,999% или по меньшей мере 99,99% или 99,9%; и даже желательно 99% по массе или более. Нуклеиновые кислоты и продукты экспрессии полипептида, раскрываемые в соответствии с настоящим изобретением, в равной степени как и векторы экспрессии, содержащие такие нуклеиновые кислоты и/или такие полипептиды, могут быть в "обогащенной форме". В контексте настоящего описания понятие "обогащенный" означает, что концентрация материала по меньшей мере приблизительно в 2, 5,10, 100 или 1000 раз выше его естественной концентрации (например), преимущественно 0,01 мас.%,предпочтительно по меньшей мере около 0,1 мас.%. Рассматриваются также обогащенные препараты с концентрацией примерно 0,5, 1, 5, 10 и 20 мас.%. Последовательности, конструкции, векторы, клоны и другие материалы, включенные в настоящее изобретение, могут быть предпочтительно в обогащенной форме или выделенными. Понятие "активный фрагмент" означает фрагмент, который дает иммунный ответ (т.е. обладает иммуногенной активностью), если он введен отдельно или факультативно с подходящим адъювантом животному, такому как млекопитающее, например кролику или мыши, также включая человека; таковой иммунный ответ, принимающий форму стимуляции ответа Т-клетки, у животного-реципиента, такого как человек. Альтернативно "активный фрагмент" может также быть использован для инициации ответа-7 022743 Т-клетки in vitro. В контексте настоящего описания понятия "участок", "сегмент" и "фрагмент", если они использованы по отношению к полипептидам, относятся к непрерывной последовательности остатков, таких как аминокислотные остатки, последовательность которых формирует подкласс более крупной последовательности. Например, если полипептид был подвергнут обработке любой из известных эндопептидаз,таких как трипсин или химотрипсин, то полученные в результате такой обработки олигопептиды будут представлять участки, сегменты или фрагменты исходного полипептида. Это означает, что любой таковой фрагмент будет обязательно содержать как часть его аминокислотной последовательности сегмент,фрагмент или участок, который по существу идентичен, если не в точности идентичен последовательности с SEQ ID NO 1 по 20, которая соответствует встречающимся в природе или "материнским" белкам последовательностей с SEQ ID NO 1 по 20. При использовании по отношению к полинуклеотидам такие понятия относятся к продуктам, полученным при обработке указанных полинуклеотидов любой из известных эндонуклеаз. В соответствии с настоящим изобретением понятие "процентная доля идентичности" или "идентичный с процентной долей", если оно относится к последовательности, означает, что последовательность сравнивается с заявленной или описанной последовательностью после выравнивания сравниваемой последовательности ("Сравниваемая последовательность") с описанной или заявленной последовательностью ("Контрольная последовательность"). Процентная доля идентичности определяется затем по следующей формуле: где "С" является числом различий между Контрольной последовательностью и Сравниваемой последовательностью по длине выравнивания между Контрольной последовательностью и Сравниваемой последовательностью, где(i) каждое основание или аминокислота в Контрольной последовательности, которые не имеют соответствующего выравненного основания или аминокислоты в Сравниваемой последовательности, и(iii) каждое выравненное основание или аминокислота в Контрольной последовательности, которые отличаются от выравненного основания или аминокислоты в Сравниваемой последовательности, представляют собой различие; и "R" - это число оснований или аминокислот в Контрольной последовательности по длине выравнивания со Сравниваемой последовательностью с любой брешью, образующейся в Контрольной последовательности, считающейся также за основание или аминокислоту. Если существует выравнивание между Сравниваемой последовательностью и Контрольной последовательностью, для которых процентная доля идентичности, по расчетам выше, приблизительного равна или выше установленной минимальной Процентной доли идентичности, тогда Сравниваемая последовательность имеет установленную минимальную процентную долю идентичности с Контрольной последовательностью, если даже могут существовать выравнивания, в которых подсчитанная здесь выше Процентная доля идентичности меньше, чем установленная Процентная доля идентичности. Исходные пептиды, раскрываемые в данном описании, могут быть модифицированы путем замены одного или нескольких остатков в различных, возможно отобранных, участках по длине пептидной цепи,если не заявлено иное. Такие замены могут носить консервативный характер, например, где одна аминокислота заменяется аминокислотой с похожей структурой и характеристиками, так же как при замене гидрофобной аминокислоты на другую гидрофобную аминокислоту. Еще более консервативным будет замена аминокислот одинакового или похожего размера и химического характера, такое как при замене лейцина на изолейцин. В исследованиях вариаций последовательностей внутри семейств встречающихся в природе гомологичных белков определенные замены аминокислот допускаются чаще, чем другие, и они часто проявляют взаимосвязь со сходствами по размеру, заряду, полярности и гидрофобности между исходной аминокислотой и ее заменой; и таковой является основа понятия "консервативных замен". Консервативные замены определены в контексте настоящего описания как обмены внутри одной из последующих пяти групп: группа 1 - малые алифатические неполярные или слабо полярные остатки (Ala,Ser, Thr, Pro, Gly); группа 2 полярные отрицательно заряженные остатки и их амиды (Asp, Asn, Glu,Gln); группа 3 - полярные положительно заряженные остатки (His, Arg, Lys); группа 4 - крупные алифатические, неполярные остатки (Met, Leu, Ile, Val, Cys); и группа 5 - крупные ароматические остатки (Phe,Tyr, Trp). Менее консервативные замены могут охватывать замену одной аминокислоты другой, имеющей похожие характеристики, но отличающейся в какой-то степени по размеру, как в случае замены аланина остатком изолейцина. Высоко неконсервативные замены могут охватывать замену кислой аминокислоты другой, которая имеет полярность, или даже такой, которая имеет основный характер. Такие "радикальные" замены не могут, однако, быть отвергнуты как потенциально неэффективные из-за того, что химические эффекты не полностью предсказуемы, и радикальные замены могут неожиданно привести к благоприятным эффектам, не предсказуемых исходя из обычных химических принципов.-8 022743 Разумеется, в таких заменах могут участвовать другие структуры, отличающиеся от обычных Lаминокислот. Таким образом, D-аминокислоты могут быть заменены L-аминокислотами, обычно встречающимися в антигенных пептидах по изобретению и также охватываемые настоящим раскрытием сущности изобретения. Кроме того, аминокислоты, содержащие нестандартные R-группы (т.е. R-группы,отличающиеся от обнаруженных в повсеместно встречающихся 20 аминокислотах природных белков) могут быть также использованы в целях замены для получения иммуногена и иммуногенных полипептидов в соответствии с настоящим изобретением. Если были произведены замены на более чем одной позиции с получением пептида с практически эквивалентной или большей антигенной активностью, чем та, что определена ниже, то комбинации таких замен будут проанализированы для определения того, приведут ли эти комбинации замен к дополнительным или синергетическим эффектам по отношению к антигенности пептида. По большей части замены должны производиться не более чем на 4 позициях внутри пептида одновременно. Понятие "Т-клеточный ответ" означает специфическую пролиферацию и активацию эффекторных функций, индуцированных пептидом in vitro или in vivo. Для ЦТЛ, рестриктированных по MHC I класса,эффекторными функциями может быть лизис клеток-мишеней, нагруженных пептидом, нагруженных предшественником пептида или клеток-мишеней, естественно презентирующих пептид; секреция цитокинов, предпочтительно интерферона-гамма, TNF-альфа или ИЛ-2, индуцированная пептидом; секреция эффекторных молекул, предпочтительно гранзимов или перфоринов, индуцированная пептидом, или дегрануляция. Для Т-хелперных клеток, рестриктированных по МНС II класса, эффекторными функциями может быть индуцированная пептидом секреция цитокинов, предпочтительно, IFN-гамма, TNF-альфа,ИЛ-4, ИЛ-5, ИЛ-10 или ИЛ-2, или индуцированная пептидом дегрануляция. Возможные эффекторные функции ЦТЛ и Т-хелперных клеток не ограничиваются данным списком. Иммунотерапевтические подходы в лечении Стимуляция иммунных ответов находится под воздействием присутствия антигенов, распознаваемых иммунной системой хозяина как чужеродные. Открытие существования опухолеассоциированных антигенов повысило сейчас возможность использования иммунной системы хозяина для вмешательства в рост опухоли. Различные механизмы объединения обеих ветвей иммунной системы, как гуморальной,так и клеточной, исследуются в настоящее время для иммунотерапии рака. Отдельные элементы клеточных иммунных ответов способны к специфическому распознаванию и уничтожению опухолевых клеток. Выделение цитотоксических Т-клеток (ЦТЛ) из популяций опухольинфильтрирующих клеток или из периферической крови предполагает, что такие клетки играют важную роль в естественной иммунной защите против рака. В частности, CD8-положительные Т-клетки, которые распознают молекулы I класса главного комплекса гистосовместимости (МНС), связанные с пептидами,имеющими обычно 8-10 остатков, образованными из белков или дефектных рибосомных продуктовfraction of newly synthesized proteins by proteasomes; Nature 2000; 404(6779):770-774), находящихся в цитозоли, играют важную роль в этом ответе. Молекулы МНС человека также являются человеческими лейкоцитарными антигенами (HLA). Существуют два класса молекул МНС: молекулы МНС I класса, которые могут встречаться на большинстве клеток, имеющих ядро, которые презентируют пептиды, образующиеся после протеолитического расщепления преимущественно эндогенных, цитозольных или ядерных белков, DRIPS, и более крупных пептидов. Однако пептиды, образованные из эндосомальных компартментов или экзогенных источников, также часто встречаются на молекулах МНС I класса. Этот неклассический способ презентации классом I в литературе называется кросс-презентацией. Молекулы МНС II класса могут встречаться преимущественно на профессиональных антигенпрезентирующих клетках (АПК) и презентировать пептиды экзогенных белков, которые поглощаются АПК в период эндоцитоза и впоследствии процессируются. Для I класса описаны альтернативные способы процессинга антигена, которые позволяют пептидам из эндогенных источников быть презентированными молекулами МНС II класса (например, аутофагоцитоз). Комплексы из пептида и молекулы МНС I класса распознаются CD8-положительными цитотоксическими Т-лимфоцитами с соответствующим ТКР (Т-клеточный рецептор), тогда как комплексы из пептида и молекулы МНС класса II распознаются CD4-положительными хелперными Т-клетками с соответствующим ТКР.CD4-положительные хелперные Т-клетки играют важную роль в управлении эффекторными функциями противоопухолевых Т-клеточных ответов, и поэтому идентификация CD4-положительных Тклеточных эпитопов, образованных из опухолеассоциированных антигенов (ТАА), может быть чрезвычайно важна для разработки фармацевтических препаратов для инициации противоопухолевых иммунных ответов (Gnjatic, S., D. Atanackovic, E. Jger, M. Matsuo, A. Selvakumar, N.K. Altorki, R.G. Maki, B.against NY-ESO-1 in cancer patients: Correlation with antibody responses. Proc. Natl. Acad. Sci. U.S.A. 2003,100 (15): 8862-7); CD4-положительные Т-клетки могут приводить к локальному повышению уровня IFNгамма. На моделях млекопитающих животных, например мышах, было показано, что даже при отсутствии-9 022743 эффекторных клеток ЦТЛ (т.е. CD8-положительных Т-лимфоцитов), CD4-положительных Т-клеток достаточно для ингибирования проявления опухолей посредством ингибирования ангиогенеза при секреции интерферона -гамма (IFN) (Qin, Z. and T. Blankenstein. CD4+ T-cell-mediated tumour rejection involvesinhibition of angiogenesis that is dependent on IFN gamma receptor expression by nonhematopoietic cells. Immunity. 2000, 12:677-686). К тому же было показано, что CD4-положительные Т-клетки, распознающие пептиды из опухолеассоциированных антигенов, презентированные молекулами HLA II класса, могут препятствовать опухолевой прогрессии посредством индукции ответов антител (Ab) (Kennedy, R.C.,М.Н. Shearer, A.M. Watts, and R.K. Bright. 2003. CD4+ T lymphocytes play a critical role in antibody production and tumor immunity against simian virus 40 large tumor antigen. Cancer Res. 2003, 63:1040-1045). В отличие от опухолеассоциированных пептидов, связывающихся с молекулами HLA I класса, до сих пор было описано лишь небольшое число лигандов класса II ТАА (www.cancerimmunity.org,www.syfpeithi.de). Так как конститутивная экспрессия молекул HLA II класса обычно ограничена клетками иммунной системы, то возможность выделения пептидов II класса непосредственно из первичных опухолей считалась невозможной. Тем не менее, авторам изобретения недавно удалось идентифицировать ряд эпитопов МНС II класса непосредственно из опухолей (ЕР 1642905, ЕР 1760088; Dengjel J, Nastke MD, Gouttefangeas C, Gitsioudis G, Schoor O, Altenberend F, Mller M, Krmer B, Missiou A, Sauter M, Hennenlotter J,Wernet D, Stenzl A, Rammensee HG, Klingel K, Stevanovi S.; Unexpected abundance of HLA class II presented peptides in primary renal cell carcinomas; Clin Cancer Res. 2006; 12:4163-4170). При отсутствии воспаления экспрессия молекул МНС II класса преимущественно ограничена клетками иммунной системы, в особенности АПК, например моноцитами, образованными из моноцитов клеткам, макрофагами, дендритными клетками. Неожиданным образом, у пациентов с опухолевыми заболеваниями было обнаружено, что клетки опухолей экспрессируют молекулы МНС II класса (Dengjel J,Nastke MD, Gouttefangeas С, Gitsioudis G, Schoor O, Altenberend F, Mller M, Krmer B, Missiou A, SauterHLA class II presented peptides in primary renal cell carcinomas; Clin Cancer Res. 2006; 12:4163-4170). Для того чтобы пептид инициировал (вызывал) клеточный иммунный ответ, он должен связываться с молекулой МНС. Этот процесс зависит от аллеля молекулы МНС и специфических полиморфизмов аминокислотной последовательности пептида. Пептиды, связывающиеся с МНС I класса, имеют, как правило, 8-10 аминокислотных остатков в длину и обычно содержат два консервативных остатка("якорь") в их последовательности, которые взаимодействуют с соответствующей связывающей бороздкой молекулы МНС. Таким образом, каждый аллель МНС имеет "связывающий мотив", определяющий,какие пептиды могут специфически связываться со связывающей бороздкой (Rammensee HG, BachmannJ, Stevanovic S. МНС ligands and peptide motifs, Landes Bioscience, USA, 1997). В зависящей от МНС иммунной реакции пептиды не только должны быть в состоянии связываться с конкретными молекулами МНС, экспрессируемыми опухолевыми клетками, но они также должны распознаваться Т-клетками, несущими Т-клеточные рецепторы (ТКР). Антигены, которые распознаются опухолеспецифическими Т-лимфоцитами, то есть их эпитопы,могут быть молекулами, образованными из любого класса белков, таких как ферменты, рецепторы, факторы транскрипции и т.д. Кроме того, опухолеассоциированные антигены, могут, например, также присутствовать только в опухолевых клетках, например, в качестве продуктов мутировавших генов. Другой важный класс опухолеассоциированных антигенов представлен тканеспецифическими антигенами, такими как СТ-антигены ("раковые тестикулярные"), которые экспрессированы в различных видах опухолей и здоровой ткани семенника. Были идентифицированы различные опухолеассоциированные антигены. Затем много усилий было потрачено на исследования по идентификации дополнительных опухолеассоциированных антигенов. Некоторые группы опухолеассоциированных антигенов, также именуемые в области техники как опухолеспецифические антигены, являются тканеспецифическими. Примеры включают без ограничения тирозиназу для меланомы, PSA (простата-специфический антиген) и PSMA (простата-специфический мембранный антиген) для рака простаты и хромосомные кроссоверы (транслокации), такие как bcr/abl в лимфоме. Тем не менее, многие опухолеассоциированные антигены, которые были идентифицированы,встречаются во множестве видов опухолей, и некоторые, такие как онкогенные белки и/или генысупрессоры опухоли (обзор генов-супрессоров опухоли для почечного рака дается, например, в работе(6Ptl):2163-72), которые фактически вызывают трансформационное явление, встречаются практически во всех видах опухолей. Например, нормальные клеточные белки, контролирующие рост и дифференциацию клетки, такие как р 53 (который является примером гена-супрессора опухоли), ras, c-met, myc, pRB,VHL и HER-2/neu, могут аккумулировать мутации, приводящие к повышению уровня экспрессии этих генных продуктов, делая их тем самым онкогенными. (McCartey et al. Cancer Research 1998 15:58 2601-5;Disis et al. Ciba Found. Symp. 1994 187:198-211). Эти мутантные белки также могут быть мишенью опухолеспецифического иммунного ответа при многих видах рака. Иммунотерапия больных раком направлена на специфическую активацию клеток иммунной систе- 10022743 мы, в особенности т.н. цитотоксических Т-клеток (ЦТЛ, также известных как "киллерные клетки", известных также как CD8-положительные Т-клетки), против опухолевых клеток, но не против здоровой ткани. Опухолевые клетки отличаются от здоровых клеток экспрессией опухолеассоциированных белков. Молекулы HLA презентируют наружу на клеточной поверхности клеточное содержимое, таким образом, давая возможность цитотоксическим Т-клеткам отличать здоровую клетку от опухолевой. Это происходит путем расщепления всех белков внутри клетки на короткие пептиды, которые присоединяются затем к молекулам HLA и презентируются на клеточной поверхности (Rammensee 1993). Пептиды,представленные на опухолевых клетках, но которые не презентируются или в намного меньшей степени презентируются на здоровых клетках организма, называются опухолеассоциированными пептидами(TUMAP). Для того чтобы белки были распознаны цитотоксическими Т-лимфоцитами в качестве опухолеспецифического или опухолеассоциированного антигена и чтобы они могли применяться в терапии, должны выполняться особые предварительные требования. Антиген должен быть экспрессирован преимущественно опухолевыми клетками, а не здоровыми тканями или в сравнительно малом объеме. Далее, желательно, чтобы соответствующий антиген не только присутствовал в каком-либо виде опухоли, но и также имел высокую концентрацию (т.е. число копий соответствующего пептида на клетку). Опухолеспецифические и опухолеассоциированные антигены часто образованы из белков, напрямую задействованных в трансформации нормальной клетки в опухолевую, в связи с функцией, например, при контроле клеточного цикла или в апоптозе. Кроме того, нисходящие мишени белков, напрямую являющихся причиной трансформации, могут быть представлены в повышенном количестве и, таким образом, косвенно опухолеассоциированными. Такие косвенно опухолеассоциированные антигены могут также быть мишенями вакцинационного подхода. В обоих случаях необходимо присутствие эпитопов в аминокислотной последовательности антигена, поскольку такой пептид ("иммуногенный пептид"), который образован из опухолеассоциированного антигена, должен вести in vitro или in vivo к Т-клеточному ответу. По существу любой пептид, способный связываться с молекулой МНС, может выполнять функцию Т-клеточного эпитопа. Предварительным условием для индукции Т-клеточного ответа in vitro или in vivo является присутствие Т-клетки с соответствующим ТКР и отсутствие толерантности к данному конкретному эпитопу. Т-хелперные клетки играют важную роль в управлении эффекторной функцией ЦТЛ в противоопухолевом иммунитете. Эпитопы Т-хелперных клеток, инициирующие ответы Т-хелперных клеток типа ТН 1, поддерживают эффекторные функции CD8-положительных киллерных Т-клеток, которые включают цитотоксические функции, направленные против опухолевых клеток, проявляющих комплексы опухолеассоциированный пептид/МНС на их клеточной поверхности. Таким образом, эпитопы опухолеассоциированных пептидов Т-хелперных клеток, одни или в комбинации с другими опухолеассоциированными пептидами, могут служить в качестве активных фармацевтических ингредиентов вакцинных композиций, которые стимулируют противоопухолевые иммунные ответы. Так как оба вида ответов, зависящие от CD8 и от CD4, вносят свой вклад в противоопухолевый эффект сообща и синергически, то идентификация и характеристика опухолеассоциированных антигенов,распознаваемых как CD8-положительными ЦТЛ (молекула МНС I класса), так и CD4-положительными ЦТЛ (молекула МНС II класса) являются важными при разработке противоопухолевых вакцин. Поэтому целью настоящего изобретения является предложение композиций пептидов, которые содержат пептиды,связывающиеся с комплексами МНС любого класса. Первые клинические испытания с использованием опухолеассоциированных пептидов были начаты в середине 1990 гг. Буном (Boon) и коллегами, в основном, для меланомы. Клинические ответы в лучших попытках достигали от 10 до 30%. О серьезных побочных эффектах или сильной аутоиммунности не сообщалось ни в одном клиническом исследовании с использованием основанной на пептидах вакцинной монотерапии. Сообщалось о слабых формах витилиго у некоторых пациентов, проходивших лечение меланома-ассоциированными пептидами. Тем не менее, прайминга одного вида ЦТЛ обычно не достаточно для устранения всех опухолевых клеток. Опухоли обладают сильной мутагенностью и, таким образом, способны быстро реагировать на атаки ЦТЛ изменением своей белковой структуры во избежание узнавания ЦТЛ. Для противодействия механизмам уклонения опухоли от ударов для вакцинации использовались различные специфические пептиды. Таким способом по опухоли могла быть произведена одновременная атака несколькими клонами ЦТЛ. Так могут быть снижены шансы опухоли на ускользание от иммунного ответа. Эта гипотеза недавно получила подтверждение в клиническом исследовании по лечению пациентов с меланомой на поздней стадии. Со всего лишь несколькими исключениями, пациенты, имевшие по меньшей мере три различных Т-клеточных ответа, демонстрировали объективные клинические ответы или стабилизацию заболевания (Banchereau и соавт., 2001), а также увеличение выживаемости (личные беседы с J. Banchereau), в то время как подавляющему большинству пациентов, имевшему менее трех Т-клеточных ответов,был поставлен диагноз прогрессирования заболевания. Исследование заявителей продемонстрировало похожий эффект, если пациенты, страдавшие от почечно-клеточной карциномы, проходили курс лечения вакциной, составленной из 13 различных пептидов (Н. Singh-Jasuja, S. Walter, T. Weinschenk, A. Mayer, P. Y. Dietrich, M. Staehler, A. Stenzl, S. Stevanovic,- 11022743IMA901, ASCO meeting 2007; Poster 3017). Основной задачей в разработке вакцины против опухолей является поэтому не только идентификация и характеристика новых опухолеассоциированных антигенов и полученных из них иммуногенных Тхелперных эпитопов, но и комбинирование различных эпитопов для увеличения вероятности ответа на более чем один эпитоп для каждого пациента. Поэтому целью настоящего изобретения является предложение комбинаций аминокислотных последовательностей таких пептидов, которые обладают способностью связываться с молекулой главного комплекса гистосовместимости человека (МНС) класса I (HLA класса I) или II (HLA класса II). Дополнительной задачей настоящего изобретения является предложение эффективной противораковой вакцины, которая основана на комбинации этих пептидов. В рамках настоящего изобретении изобретатели выделили и охарактеризовали пептиды, связывающиеся с молекулами HLA I или II класса непосредственно из опухолей млекопитающих, т.е. первичных образцов, взятых, в основном, у пациентов, страдающих раком желудка, но и также первичных образцов тканей глиобластомы, колоректального рака, почечно-клеточной карциномы, рака легких, рака поджелудочной железы, злокачественной меланомы и рака желудка. В настоящем изобретении предложены пептиды, которые образованы из антигенов, связанных с генезом опухоли, и имеют способность связываться в достаточной мере с молекулами МНС (HLA) II класса для инициации иммунного ответа человеческих лейкоцитов, в особенности лимфоцитов, в особенности Т-лимфоцитов, в особенности CD4-положительных Т-лимфоцитов, в особенности CD4 положительных Т-лимфоцитов, опосредующих иммунные ответы типа TH1. В настоящем изобретении также предложены пептиды, которые образованы из антигенов, ассоциированных с генезом опухоли, и имеют способность связываться в достаточной мере с молекулами МНС(HLA) I класса для инициации иммунного ответа человеческих лейкоцитов, в особенности лимфоцитов,в особенности Т-лимфоцитов, в особенности CD8-положительных цитотоксических Т-лимфоцитов, в равной степени как и комбинации двух вариантов, которые особенно полезны для вакцинации пациентов, страдающих от рака. В соответствии с настоящим изобретением поставленная задача решена предложением фармацевтической композиции, включающей по меньшей мере два пептида, содержащих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 1 по SEQ ID NO 10, и/или содержащих вариантную аминокислотную последовательность, которая по меньшей мере на 85% гомологична последовательностям с SEQ ID NO 1 по SEQ ID NO 10, и/или полинуклеотид, содержащий нуклеиновую кислоту, кодирующую SEQ ID NO 1 по SEQ ID NO 10 или вариантную аминокислотную последовательность, и фармацевтически приемлемый носитель. Фармацевтические композиции по настоящему изобретению также могут включать по меньшей мере один дополнительный пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 11 по SEQ ID NO 22, или содержащий вариантную аминокислотную последовательность, которая по меньшей мере на 85% идентична последовательностям с SEQ ID NO 11 по SEQ ID NO 22, или полинуклеотид, содержащий нуклеиновую кислоту, кодирующую последовательности с SEQ ID NO 11 по SEQ ID NO 22 или вариантную аминокислотную последовательность. Пептиды могут иметь общую длину от 8 до 100, предпочтительно от 8 до 30 и особенно предпочтительно от 8 до 17 аминокислот. Пептиды могут также иметь непептидные связи. Как будет описано далее, пептиды, формирующие основу настоящего изобретения, были все идентифицированы как презентируемые клетками, несущими МНС I или II класса. Таким образом, эти конкретные пептиды, так же как и все другие пептиды, содержащие данную последовательность (т.е. производные пептидов), вызывают специфический Т-клеточный ответ, хотя уровень, до которого такой ответ будет индуцирован, может варьироваться между отдельными пептидами и отдельными пациентами. Различия, например, могут быть вызваны мутациями в пептидах. Специалист данной области полностью осведомлен о способах, которые могут использоваться для определения силы, с которой был индуцирован ответ каждым отдельным пептидом, в частности, благодаря ссылкам на приведенные здесь примеры и соответствующую литературу. Предпочтительным образом, варианты по изобретению будут индуцировать Т-клеточную перекрестную реакцию с соответствующим пептидом по изобретению. Пептиды образованы из опухолеассоциированных антигенов, в особенности опухолеассоциированных антигенов с функциями, например, в протеолизе, ангиогенезе, росте клеток, регуляции клеточного цикла, делении клеток, регуляции транскрипции, регуляции трансляции, инвазии ткани и т.д. В табл. 4 представлены пептиды и функция белка, из которого они образованы.- 12022743 Таблица 4. Пептиды настоящего изобретения и функция материнского белка Таблица 5. Дополнительные иммуногенные пептиды, пригодные для композиции по изобретению Белок цикла клеточного деления 2 (CDC2) Белок CDC2, также известный как p34cdc2 или Cdk1 (циклинзависимая киназа 1), относится к Cdks,семейству сериновых/треониновых протеинкиназ, и играет ключевую роль в контроле клеточного цикла. Он известен как основной регулятор перехода от G2 к фазе М. В конце интерфазы он активируется путем связывания с циклинами А-типа и способствует началу митоза. После разрушения ядерной оболочки циклины А-типа распадаются и заменяются циклинами В. Комплекс из CDC2 и циклина В образует фактор стимуляции митоза (MPF), который необходим для прохождения клетками фазы митоза. Активный CDC2 фосфорилирует более 70 субстратов. Например, фосфорилирование "линкерного" гистона H1 ведет к ослаблению хроматиновой структуры и транскрипции специфических генов, а фосфорилирование РНК-полимеразы II усиливает транскрипцию (Cisek и Corden, 1989). ФосфорилированиеBRCA2 стимулирует репарацию с участием гомологичной рекомбинации (Esashi и соавт., 2005), и фосфорилирование FOXO1 ингибирует его транскрипционную активность, приводящую к клеточной пролиферации и выживаемости. Фосфорилирование сепаразы ингибирует преждевременное разделение сестринских хроматид (Stemmann и соавт., 2001). Активность CDC2 снова падает во время анафазы, так как стимулирующий анафазу комплекс/циклосома (АРС/С) убиквитинирует циклин В, приводя к его деградации. Функция белка CDC2 в митозе не является избыточной и не может быть компенсирована активностью других Cdks, таких как Cdk2, 4 и 6. Напротив, об CDC2 сообщалось, что он задействован в других фазах клеточного цикла, таких как переход G1-S, и он способен заменить Cdk периода интерфазы. Таким образом, как было предложено, CDC2 является единственным Cdk, незаменимым для клеточного цикла. Кроме его экспрессии и функции в клеточном цикле, о нем сообщалось, что в некоторых случаях CDC2 экспрессируется при апоптических условиях, и что увеличенная активность может привести к митотической катастрофе. Гиперэкспрессия CDC2 была обнаружена при нескольких видах рака, хотя регулирование экспрессии других клеточных белков, таких как циклинов, нарушается еще чаще. К видам рака, при которых происходит гиперэкспрессия CDC2, относятся карциномы предстательной железы, карциномы ротовой полости, плоскоклеточные карциномы ротовой полости (OSCC), острая миелоидная лейкемия(AML) (Qian и соавт., 2009), H.pylori-индуцированная лимфома MALT (Banerjee и соавт., 2000) и карцинома толстой кишки (Yasui и соавт., 1993). В нескольких случаях гиперэкспрессия соотносилась с плохим прогнозом. При раке желудка (РЖ) сообщалось о гиперэкспрессии и/или увеличении активности (14 из 23 случаев) и делалось предположение, что гиперэкспрессия CDC2 может быть тому причиной. Более- 13022743 того, было обнаружено, что CDC2 находится среди набора генов, которые активны во время митоза и которые при гиперэкспрессии приводят к хромосомной нестабильности опухолей. Ингибиторы CDC2 и других Cdk рассматривали в качестве кандидатов для лекарственных средств для лечения рака (Shapiro,2006). Белок, ассоциированный с аномальной веретеновидной микроцефалией (ASPM) Аномальный ген белка веретена деления (ASPM), ассоциированный с микроцефалией, является человеческим ортологом аномального веретена дрозофилы (asp) и наиболее часто мутирующим геном аутосомной рецессивной первичной микроцефалии. Дефектный нейрогенез у человека, вызванный гомозиготной мутацией гена ASPM, приводит к микроцефалии и умственной отсталости. Наиболее частой причиной первичной аутосомной рецессивной микроцефалии (МСРН) являются,по-видимому, мутации в гене ASPM, который задействован в регуляции нейрогенеза. Во время митозаASPM локализован на полюсах веретена деления. Ингибирование ASPM с помощью siPHK-опосредованного нокдауна ингибирует пролиферацию опухолевых клеток и пролиферацию нейрональных стволовых клеток, подтверждая роль ASPM как потенциальной молекулярной мишени в глиобластоме. ASPM был гиперэкспрессирован в глиобластоме по сравнению с нормальным головным мозгом. Экспрессия белка ASPM может использоваться в качестве маркера злокачественности глиомы, представляя собой потенциальную терапевтическую мишень. Гиперэкспрессия белка ASPM является молекулярным маркером, предсказывающим увеличенный инвазивный/метастатический потенциал гепатоклеточной карциномы ГКК, более высокий риск быстрого рецидива опухоли (ETR) вне зависимости от статуса мутации р 53 и стадии опухоли и, поэтому, плохого прогноза. ASPM экспрессируется также в повышенном количестве в иммортализованных клетках,раковых клетках и в тканях немелкоклеточного рака легких (NSCLC) (Jung и соавт., 2009). Убиквитин карбоксил-терминальная гидролаза L5 (UCHL5) Убиквитин карбоксил-терминальная гидролаза L5 (UCHL5), известная также как Убиквитин Стерминальная гидролаза (UCH37) или INO80R, является деубиквитиназой, которая связана с протеасомой. Она разбивает на части связанные с белком полиубиквитиновые цепи на дистальном конце путем расщепления изопептидной связи между С-концевыми Cys76 и Lys48 (Nishio и соавт., 2009).UCHL5 связывается с hRpn13 (известной также как Adrml), компонентом регулирующей частицы 19S (РА 700) протеасомы, которая инициирует ее изопептидазную активность. hRpn13 функционирует также в качестве рецептора убиквитина, тем самым связывая распознание субстрата с деубиквитинированием. UCHL5 может также связываться с Rpn10/S5a, другим компонентом частицы 19S, расположенной между его "шапочкой" и "основанием", но данное взаимодействие не в состоянии активироватьUCHL5. UCH37 может защищать слабо убиквитинированные субстраты или другие медленно деградирующие конъюгаты убиквитина от протеолиза. В качестве альтернативы, она также может усилить деградацию, способствуя высвобождению полиубиквитинированных субстратов из их начального сайта связывания в регуляторном комплексе 19S для транслокации в протеолитическое "ядро", частицу 20S протеасомы 26S. В ядре UCHL5 соединен также с хроматин-ремоделирующим комплексом Ino80. После связывания с протеасомой она активируется и может вносить свой вклад в регуляцию транскрипции или репарации ДНК, что, как предполагают, опосредуется Ino80 и протеасомой. Функции UCHL5 могут осуществляться, по меньшей мере частично, другими белками, так как RNAi-опосредованный нокдаунUCHL5 не имеет обнаруживаемого воздействия на клеточный рост, структуру протеасомы или протеолитическую способность, хотя она ускоряет деградацию клеточных белков. Убиквитин-специфические протеазы, подобные UCHL5, задействованы в нескольких процессах,таких как контроль прохождения клеточного цикла, дифференциация, репликация и репарация ДНК,транскрипция, контроль качества белков, иммунный ответ и апоптоз. Некоторые существующие данные указывают на то, что UCHL5 содействует злокачественной трансформации. Ее активность, как было продемонстрировано, повышена в тканях карциномы шейки матки человека по сравнению с соседней нормальной тканью. Она способна деубиквитинировать и, тем самым, стабилизировать рецептор TGFбета и его медиаторы нисходящих путей, т. н. Smad, тем самым стимулируя сигнальные каскады, активируемые TGF-бета. Простимулированные TGF-бета сигнальные каскады могут выступать в качестве стимулятора опухолевого роста на поздних стадиях прогрессии рака, хотя он обладает двоякой функцией и может также выступать в качестве супрессора опухоли на ранних стадиях и перед инициацией (Wicks и соавт., 2005; Wicks и соавт., 2006; Horton и соавт., 2007; Bierie и Moses, 2006).c-Met См., например, ЕР 08008292.8 и ЕР 1507795 В 1. Кроме того, конститутивная активация с-Met посредством фосфорилирования также описывалась в качестве важного механизма онкогенеза при светлоклеточной почечно-клеточной карциноме у человека (Nakaigawa и соавт., 2006). Гиперэкспрессия МЕТ, зачастую вызванная опухолевой гипоксией, ведет к конститутивной активации рецептора и соотносится с плохим прогнозом. "Выключение" эндогенного гена МЕТ, гиперэкспрессированного в опухолевых клетках, приводит к сбоям в выполнении полной программы инвазивного роста in vitro, отсутствию роста опухоли и снижению образования экспериментальных метастазов invivo. Примечательно, что "выключение" гена МЕТ при уже распространившихся метастазах приводит к- 14022743 их практически полной регрессии (Corso и соавт., 2008). Макрофаг-стимулирующий белковый рецептор (MST1R) Рецептор MST1R (также известный под названием RON) является членом семейства Met рецепторных тирозинкиназ клеточной поверхности, и он, в первую очередь, экспрессирован на эпителиальных клетках и макрофагах. Как и с-МЕТ, RON экспрессируется клетками различных опухолей эпителиального происхождения и линиями раковых клеток и, как считается, играет функциональную роль при онкогенезе. В клинических исследованиях было продемонстрировано, что гиперэкспрессия MST1R связана как с ухудшением исхода для пациента, так и с метастазами. Экспрессия MST1R значительна в тканях карциномы желудка и соответствующей паранеопластической ткани, однако он не экспрессируется в нормальной слизистой оболочке желудка (Zhou и соавт.,2008). Рецептор MST1R может вызывать клеточную миграцию, инвазию, пролиферацию и выживаемость в ответ на его соответствующий лиганд. Более того, MST1R имеет онкогенную активность in vitro, в моделях с животными in vivo и часто дерегулирован при раковых заболеваниях человека (Dussault и Bellon,2009). Данные показывают, что нокдаун рецептора MST1R в раковых клетках предстательной железы приводит к существенно пониженному хемотаксису эндотелиальных клеток при сравнении с MST1Rэкспрессирующими клетками in vitro, в равной степени как и к снижению роста опухоли и уменьшению плотности микрососудов после ортотопической трансплантации в предстательную железу in vivo. Было продемонстрировано, что опосредованный РНК-интерференцией нокдаун MST1R-киназы в клеточной линии высоко онкогенного рака толстой кишки приводил к снижению пролиферации в сравнении с контрольными клетками. Белок 4 поддержания структуры хромосом (SMC4) Белки, поддерживающие структуру хромосом (SMC), являются хромосомными АТФ-азами с высокой консервативностью от бактерий до человека, которые играют фундаментальную роль во многих аспектах поддержания структуры высшего порядка в хромосомах и их динамики. Белок SMC4 является центральным компонентом комплекса конденсина, который играет роль при конденсации хроматина, а также был связан с ядрышковой сегрегацией, репарацией ДНК и сохранением хроматинового каркаса. Эукариоты имеют по меньшей мере шесть белков SMC в отдельных организмах,и они образуют три различных гетеродимера со специальными функциями: SMC2 и SMC4 функционируют в качестве центра комплексов конденсина, которые необходимы для сборки хромосомы и сегрегации. Анализ уровней мРНК в 25 различных нормальных тканях с помощью ОТ-ПЦР (обратной транскрипции, совмещенной с полимеразной цепной реакцией) показывает, что этот ген высоко экспрессируется в тканях нормальной предстательной железы и слюнной железы, очень слабо - в тканях толстой кишки, поджелудочной железы и кишечника и вообще не экспрессируются в других тканях. Исследования с помощью ОТ-ПЦР проб ткани раковой опухоли человека показывают, что РНК высоко экспрессируется во многих раковых клеточных линиях и образцах ткани раковой опухоли, включая 26 из 33 образцах ткани раковых опухолей молочной железы человека, 3 из 3 образцах ткани раковой опухоли предстательной железы, 3 из 3 образцах ткани раковой опухоли толстой кишки и 3 из 3 образцах ткани раковой опухоли поджелудочной железы (Egland и соавт., 2006).AVL9 Неожиданным образом, данный белок был обнаружен в качестве белка-источника, так как имеется лишь ограниченная информация о белке AVL9 и функции соответствующего гена. Белок кинетохора Nuf2 Ген NUF2 (CDCA-1) кодирует белок, который очень похож на дрожжевой белок Nuf2, компонент консервативного белкового комплекса, связанного с центромерой. Дрожжевой Nuf2 исчезает из центромеры во время мейотической профазы, когда центромеры теряют свою связь с полярными тельцами веретена деления, и играет регуляторную роль в хромосомной сегрегации. Было продемонстрировано, чтоcsiPHK сурвивина и hNuf2 производят временный нокдаун своих мРНК, вызывая образование многоядерных клеток и клеточную смерть за счет митотического блока, соответственно (Nguyen и соавт.,2006). Nuf2 и Hec1 требуются для организации стабильных сайтов связывания плюс-конца микротрубочек на внешней пластине, которые нужны для сохранения устойчивых сил, направленных к полюсу, необходимых для биоориентации на кинетохорах (DeLuca и соавт., 2005). Иммуногистохимический анализ на основе тканевых микроматриц рака легких подтвердил высокие уровни белков CDCA1 и KNTC2 в значительном большинстве видов рака легких различных гистологических типов. Их повышенная экспрессия была связана с худшим прогнозом для пациентов с немелкоклеточным раком легких (NSCLC). Ингибирование их связывания с помощью проникающего в клетку пептида, нагруженного образованным из CDCA1 пептидом из 19 аминокислот (11R-CDCA1(398-416,который соответствует домену связывания с KNTC2, эффективно подавлял рост клеток NSCLC (Hayama и соавт., 2006). Было обнаружено, что опосредованный siPHK нокдаун CDCA1 или KNTC2 ингибирует клеточную пролиферацию и индукцию апоптоза при NSCLC, раке яичников, раке шейки матки, раке желудка, колоректальном раке и глиоме (Kaneko и соавт., 2009). Ген CDCA 1 дифференциально экспрессирован в клетках рака шейки матки (экспрессия мРНК подтверждена по методике ПЦР в реальном време- 15022743 ни и белком - иммуногистохимическим методом) (Martin и соавт., 2009). Анализ ОТ-ПЦР на удаленных хирургической резекцией тканях рака желудка (диффузного типа, 6; кишечного типа, 4) подтвердил, что два варианта CDCA1 были в повышенном количестве в раковых тканях. В этом исследовании были обнаружены варианты альтернативного сплайсинга, особенно в CDCA1, которые могут быть потенциально пригодны в качестве диагностических маркеров и/или новых мишеней в рамках противораковой терапии(Ohnuma и соавт., 2009). Липидная фосфат-фосфогидролаза 2 (РРАР 2 С) Белок, кодируемый этим геном, является членом семейства фосфатаз фосфатидной кислоты (PAP).PAP преобразуют фосфатидную кислоту в диацилглицерин и имеет функцию как в синтезе глицеролипидов de novo, так и в трансдукции активированного рецептором передачи сигнала, опосредованного фосфолипазой D. Сообщалось о трех транскрипционных вариантах альтернативного сплайсинга, кодирующих различные изоформы. РРАР 2 С является потенциально новой мишенью, которая представлена в повышенном количестве в трансформированных первичных мезенхимных стволовых клетках (MSC) взрослого человека. Нокдаун РРАР 2 С приводит к снижению клеточной пролиферации за счет задержания вхождения в S-фазу клеточного цикла и транскрипционно регулируется р 53. Некоторые данные позволяют предположить, что гиперэкспрессия РРАР 2 С, наблюдаемая в клетках многочисленных видов рака человека, может быть необходима для увеличения клеточной пролиферации (Flanagan и соавт., 2009). Исследование демонстрирует,что РРАР 2 С является регулятором протекания клеточного цикла в фибробластах. Гиперэкспрессия РРАР 2 С, но не каталитически неактивный мутант, вызывала преждевременное вхождение в S-фазу, сопровождавшееся преждевременным накоплением циклина А. Это демонстрирует значительные изменения в скорости вхождения в S-фазу, что могло отражаться на таких процессах, как митогенез, миграция,заживление ран, развитие и онкогенез. Убихинон-связывающий белок комплекса убихинол-цитохром-с-оксиредуктаза (UQCRB) Ген UQCRB кодирует белок, который является частью комплекса убихинол-цитохром-соксидоредуктазы, который содержит десять субъединиц, кодируемых ядерной и одну - кодируемую митохондриальной ДНК. Закодированный белок связывается с убихиноном и участвует в передаче электронов, когда убихинон связан. Мутации этого гена связаны с недостаточностью митохондриального комплекса III. Был описан псевдоген на X-хромосоме. Ген UQCRB может быть потенциальным онкогеном или геном-супрессором опухоли при аденокарциноме протока поджелудочной железы (Harada и соавт., 2009). Ген UQCRB гиперэкспрессирован в клетках гепатоклеточной карциномы (Jia и соавт., 2007). Проминин 1 (Prom1) Проминин-1, называемый также CD133, был первоначально идентифицирован как молекула, специфическая для CD34-положительных кроветворных клеток-предшественников, и, как было показано позже, он является маркером для нормальных стволовых клеток и раковых стволовых клеток (CSC) различных тканей (Mizrak и соавт., 2008). Однако о его функции известно немного. Так как он в основном локализован на выростах плазматической мембраны, таких как микроворсинки эпителиальных клеток,приминину-1 приписывали функциональную роль, "организатора" топологии плазматической мембраны. Так как было обнаружено, что он взаимодействует с холестерином, то он может быть важным для сохранения надлежащей липидной композиции внутри плазматической мембраны. Проминин-1 используют в качестве маркера CSC для многих видов опухолей человека. Обычно только небольшой процент опухолевых клеток является положительным для проминина-1, как это ожидается от маркера CSC. В зависимости от вида опухоли число положительных клеток на опухолевую массу достигает от 1 до 15% и в большинстве случаев составляет около 2%. Опухолями, для которых функциональные пробы (такие как формирование сфер, высокая способность к инициации роста опухоли у иммунодефицитных мышей и асимметрическое деление / самообновление / плюрипотентность) показали, что экспрессирующие проминин-1 клетки являются CSC, являются: рак толстой кишки (2-2,5% опухолевой массы) (Todaro и соавт., 2007; Ricci-Vitiani и соавт., 2007),рак печени (Ма и соавт., 2007; Suetsugu и соавт., 2006; Yin и соавт., 2007),рак поджелудочной железы (Hermann 2007; Wang 2009),рак предстательной железы (1% опухолевой массы) (Richardson и соавт., 2004),опухоли головного мозга различных фенотипов (Singh и соавт., 2003; Singh и соавт., 2004),лейкемии, такие как острая лимфобластная лейкемия, ALL (Сох и соавт., 2009),меланома (Monzani и соавт., 2007; Rappa и соавт., 2008),рак легких (Chen и O'Shea, 2008; Eramo и соавт., 2008; Tirino и соавт., 2009),саркома Юинга (Suva и соавт, 2009),эндометриальный рак (Rutella и соавт, 2009),плоскоклеточная карцинома полости рта (Zhang и соавт., 2009) и плоскоклеточная карцинома головы и шеи (Harper и соавт., 2007). Более того, несколько исследований показали наличие повышенного уровня экспрессии проминина-1 в раковой ткани по сравнению со здоровой тканью, и в большинстве из них была установлена взаи- 16022743 мосвязь экспрессии проминина-1 с клиническими параметрами, такими как общая выживаемость, стадия опухоли или метастазирование. Примерами являются немелкоклеточный рак легких, злокачественная меланома, ретинобластома, нейробластома и синовиальная карцинома. Экспрессия проминина-1 также соотносится с плохим прогнозом для пациентов, больных глиомой, раком поджелудочной железы(вплоть до 15% PROM1-положиткльных клеток), колоректальным, ректальным и раком толстой кишки и протоковой карциномы молочной железы. Интересно, что мРНК PROM1 представлена в повышенном количестве в РВМС (мононуклеарах периферической крови) больных раком с метастатической болезнью, в особенности у пациентов с костными метастазами, и экспрессия PROM1 в РВМС является прогностическим фактором для общей выживаемости. Взаимосвязи с прогнозом при раке яичников установлено не было. Предположение об экспрессии PROM1 при диффузном раке желудка было основано на анализе insilico (Katoh и Katoh, 2007), о гиперэкспрессии при раке желудка в сравнении с нормальной тканью желудка на уровне белка сообщалось в работе (Smith и соавт., 2008). Однако (Boegl и Prinz, 2009) сообщали, что уровень экспрессии проминина-1 был пониженным при раке желудка, в частности на поздних стадиях, и заявляли, что экспрессия проминина-1 скорее взаимосвязана с ангиогенезом - который также снижается на поздних стадиях - чем с ростом опухоли. В исследовании с использованием клеточных линий рака желудка (Takaishi и соавт., 2009) утверждается, что CD44, а не проминин-1 является маркеромCSC при раке желудка. Данные о том, что клетки, экспрессирующие проминин-1, задействованы в образовании опухоли,представлены в работе (Zhu и соавт., 2009), где сообщается, что в модели рака кишечника мышей все неопластические клетки возникли из Prom1-положительных клеток, но только 7% сохраняли Prom1 положительный фенотип. Кроме того, проминин-1-положительные клетки, как было показано, участвуют в ангиогенезе опухоли. Как ожидалось от CSC, проминин-1-положительные клетки были хеморезистентными вследствие активации антиапоптозного Akt-каскада (Ма 2008). В работе (Bertolini и соавт., 2009) сообщается, что они не реагируют на лечение цисплатином. Они резистентны к TRAIL- и Fasиндуцированному апоптозу из-за повышенного уровня FLIP. Они защищают самих себя от апоптоза секрецией ИЛ-4. Однако они могут быть доступны для иммунной системы, так как они могут быть уничтожены NK-клетками (Castriconi и соавт., 2007; Pietra и соавт., 2009) и цитотоксическими Т-клетками(Brown и соавт., 2009). Матричная металлопротеиназа 11 (ММР 11) Матричная металлопротеиназа 11 (ММР 11), как было сделано предположение, играет роль во время нескольких физиологических процессов, требующих ремоделирования тканей, таких как развитие, инволюция молочной железы после лактации, заживление ран и образование шрамов и во время менструального цикла. Также было сделано предположение, что она отрицательно регулирует гомеостаз жиров посредством снижения дифференциации адипоцитов. В отличие от других ММР, она не в состоянии расщеплять обычные молекулы внеклеточного матрикса - за исключением коллагена VI. Однако были идентифицированы другие субстраты, такие как альфа-2-макроглобулин, определенные ингибиторы серинпротеазы (серпины), включая альфа-1-антитрипсин, белок-1, связывающий инсулиноподобный фактор роста, и рецептор ламинина. Было обнаружено, что ММР 11 является продуктом, который специфически гиперэкспрессирован в клетках стромы, расположенных вокруг инвазивной карциномы молочной железы. Дальнейшие исследования подтвердили ее экспрессию в окружающей опухоль строме карциномы молочной железы и других видов рака, таких как рак кожи, немелкоклеточные в равной степени, как и мелкоклеточные карциномы легких, плоскоклеточная карцинома головы и шеи, карцинома толстой кишки и колоректальная карцинома, эпителиальный рак гортани, карцинома пищевода, карцинома ротовой полости, карцинома поджелудочной железы, карцинома мочевого пузыря, карциномы яичника, почечно-клеточная карцинома, атипичная менингиома, папиллярная карцинома щитовидной железы, опухоли головного мозга (ММР 11 был экспрессирован в клетках астроцитом, но только в малой степени в клетках олигодендроглиом и злокачественных глиомах), карцинома слюнного протока, рак шейки матки, экстранодальные NK/Tклеточные лимфомы, нехожкинская лимфома и карцинома предстательной железы. Утверждалось, что ММР 11 гиперэкспрессируется в строме наиболее инвазивных карцином человека, но редко в клетках сарком и других неэпителиальных опухолей. В основном, ММР 11 экспрессируется в стромальных клетках, непосредственно граничащих с опухолью, тогда как сами опухолевые клетки, нормальные ткани и стромальные клетки, расположенные далеко от опухоли, остаются негативными. Однако это не следует обобщать, так как в некоторых случаях ММР 11 была также обнаружена в нераковых тканях, таких как ткани толстой кишки или в опухолевых клетках, например, опухолей поджелудочной железы, молочной железы, паутинной оболочки мозга и желудка. Более высокие уровни ММР 11 соотносятся со злокачественным фенотипом / более высокой инвазивностью и плохим прогнозом. Однако в клетках папиллярных карцином щитовидной железы экспрессия ММР 11 была обратно пропорциональна агрессивным характеристикам. Е участие в ангиогенезе является маловероятным, так как экспрессия ММР 11 не связана с плотностью микрососудов. Скорее всего, она повышает выживаемость раковых клеток и подавляет апоптоз.- 17022743 Было сделано предположение, что ММР 11 из фибробластов приводит к стимуляции IGF-1R сигнального пути в клетках карциномы, таким образом увеличивая их пролиферативную способность. Ее способность приводить к дедифференциации адипоцитов стимулирует рак посредством аккумуляции перитуморальных фибробласт-подобных клеток, которые способствуют выживаемости раковых клеток и прогрессии опухоли (Motrescu и Rio, 2008). ММР 11 была обнаружена в опухолевой ткани, как и в сыворотке пациентов, страдающих раком желудка, и уровень экспрессии соотносился с метастазами (Yang и соавт., 2008). Более того, (Deng и соавт., 2005) показали, что ММР 11 высоко экспрессирована в линиях опухолевых клеток и первичных опухолях рака желудка - в отличие от других видов рака, не исключительно в строме- и что она, по-видимому, усиливает пролиферацию опухолевых клеток.Src, которые участвуют в процессах клеточной дифференциации, клеточного деления, адгезии и реакциях на стресс (Yoshida, 2007). C-Abl перемещается между ядерным и цитоплазматическим компартментами. Ядерный c-Abl задействован в ингибировании клеточного роста и содействии апоптозу. Напротив,роль цитоплазматического c-Abl описана не так хорошо. Существуют предположения о его роли в морфогенезе и динамике F-актина, а также роли в сигнальных реакциях, вызванных внеклеточными стимулами, такими как факторы роста и лиганды интегринов. Цитоплазматический c-Abl, как сообщалось,способствует митогенезу. Митогенные субстраты C-Abl еще не были идентифицированы, но они, скорее всего, включают регуляторы малых ГТФаз семейства Rho, в частности члены Vav и Sos. Связывающая активность ДНК повсеместно экспрессированной ABL1-тирозинкиназы регулируетсяCDC2-опосредованным фосфорилированием, позволяя сделать предположение о функции ABL1 в клеточном цикле. Активность белка c-Abl регулируется отрицательно ее доменом SH3, и делеция доменаSH3 превращает ABL1 в онкоген. Нерецепторная тирозинкиназа c-Abl регулирует реакции актина в некроветворных клетках. В некоторых исследованиях c-Abl была идентифицирована как ведущий участник реакций сигнального каскада, приводящих к реорганизации актина во время Т-клеточной активации(Huang и соавт., 2008). Мутации гена ABL1 ассоциируются с хронической миелоидной лейкемией (ХМЛ). При ХМЛ ген активируется посредством транслокации внутри гена BCR (область локализации сайта инициации реаранжировки) на хромосоме 22. Новый слитый ген BCR-ABL кодирует нерегулируемую тирозинкиназу,направленную в цитоплазму, которая позволяет клеткам пролиферировать без цитокиновой регуляции. Это, в свою очередь, позволяет клетке стать канцерогенной (Zhao и соавт., 2009). Активированная с-Abl тирозинкиназа, не как слитый белок, играет важную роль в злокачественных клетках солидных опухолей легких и молочной железы (Lin и Arlinghaus, 2008). Последние наблюдения указывают на то, что c-Abl также дерегулирован в клетках солидных опухолей. Высокая активность цитоплазматической киназы была обнаружена в клетках карцином молочной железы и NSCLC. Гиперэкспрессии, однако, недостаточно, и для конститутивной киназной активности требуется фосфорилирование белка. В клетках рака молочной железы фосфорилирование c-Abl вызывается тирозинкиназами плазматической мембраны, включая членов семейств SFK, EGFR и рецептор IGF1. Слитые белки ABL не были обнаружены в солидных опухолях.ABL1 и рак желудка - в иммуногистохимическом исследовании экспрессии ABL1 анализу подвергали широкий спектр нормальных эмбриональных тканей и тканей взрослых людей и различные виды опухолей. Большинство опухолей проявляло фокальную или слабую иммунореактивность ABL. Наиболее интенсивное окрашивание было заметно в клетках хондросаркомы, липосаркомы и диффузной (перстневидного типа) аденокарциномы желудка. В двух последних случаях ABL экспрессировался также на микрососудах опухоли, указывая на возможную роль в ангиогенезе. В рамках последних исследований было выявлено, что инфекция cagA-положительными Helicobacter pylori играет существенную роль в развитии карциномы желудка. Н. pylori блокирует эндоцитозEGFR и деградацию рецепторов после длительной инфекции эпителиальных клеток желудка. Более того,это ингибирование возникает посредством CagA-зависимой, но не зависимой от фосфорилированияCagA, активации нерецепторной киназы c-Abl, которая, в свою очередь, фосфорилирует сайт-мишеньEGFR - pY1173 (Bauer и соавт., 2009). Селективное ингибирование активности c-Abl-киназы ингибиторами STI571 или shRNA отменяет устойчивое фосфорилирование цитотоксин-ассоциированного гена A(CagA) и миграцию эпителиальных клеток, указывая на ключевую роль c-Abl в инфекции Н. pylori и патогенности (Рорре и соавт., 2007). Примером блокаторов киназного пути является иматиниб (иматиниба мезилат, Gleevec, STI571),ингибитор онкобелка Bcr/Abl, который стал терапевтическим средством первой линии для хронической миелоидной лейкемии (Pytel и соавт., 2009). Иматиниб получил одобрение для лечения пациентов, имеющих стромальные опухоли желудочно-кишечного тракта (GIST) на поздних стадиях, при которых наблюдается аномальное повышение экспрессии KIT, рецептора тирозинкиназы (Croom и Perry, 2003). Другим ингибитором киназы, используемым в последнее время при лечении рака, является дазатиниб(BMS-354825), который является специфическим для ABL нерецепторного цитоплазматического типа(Pytel и соавт., 2009). Нилотиниб является тирозинкиназным ингибитором bcr-abl, средством второго- 18022743 поколения для орального применения, прописываемым для лечения Ph-положительной ХМЛ хронической и ускоренной фазы у взрослых с резистентностью или непереносимостью иматиниба (Deremer и соавт., 2008).SEQ ID NO 13, SEQ ID NO 14 и SEQ ID NO 15 раскрыты в патенте WO 2007/028574, CDC42 (цикл клеточного деления 42) является белком, вовлеченным в регуляцию клеточного цикла. Белок является малой ГТФазой подсемейства Rho, которая регулирует сигнальные пути, контролирующие различные клеточные функции, включая клеточную морфологию, миграцию, эндоцитоз и прохождение клеточного цикла. Как было установлено, CDC42 высоко гиперэкспрессирован при глиобластоме. В патенте WO 2004/067023 описываются пептиды, рестриктированные по МНС I класса, образованные из опухолеассоциированного антигена сурвивина, пептиды из которого способны связываться с молекулами I класса HLA с высокой аффинностью. Секретированный фосфопротеин 1 (SPP1), также известный как костный сиалопротеин I (BSP-1),ранний активатор Т-лимфоцитов (ЕТА-1) и под наиболее известным названием - остеопонтин (OPN),является генным продуктом на основе человеческих генов, который также сохраняет свои функции и у других видов. Остеопонтин участвует в качестве важного фактора при ремоделировании костей. В частности, исследования указывают на то, что он играет роль в фиксации остеокластов к минеральному матриксу костной ткани. Органическая часть кости составляет около 20% сухой массы и включает, кроме остеопонтина, коллаген типа I, остеокальцин, остеонектин, костный сиалопротеин и щелочную фосфатазу. На коллаген типа I приходится 90% белковой массы.OPN связывается с несколькими рецепторами интегрина, включая 41, 91 и 94, экспрессируемыми лейкоцитами. Для этих рецепторов была хорошо обоснована их функция в клеточной адгезии,миграции и выживаемости в этих клетках. Поэтому последние исследования были сосредоточены на роли OPN в опосредовании таковых ответов. Остеопонтин экспрессирован в ряде иммунных клеток, включая макрофаги, нейтрофилы, дендритные клетки и Т- и В-клетки с разнообразной кинетикой. Об OPN сообщалось, что он выступает в качестве иммунного модулятора с разнообразием способов действия. Во-первых, он имеет хемотактические свойства, которые способствуют рекрутингу клеток к местам воспаления. Он также действует как белок адгезии, участвуя в прикреплении клеток и заживлении ран. Помимо этого, OPN опосредует клеточную активацию и выработку цитокинов, а также способствует выживаемости клеток при содействии регуляции апоптоза. Активированные Т-клетки стимулируются ИЛ-12 для дифференциации до типа Th1 с выработкой цитокинов, включая ИЛ-12 и IFN. OPN ингибирует выработку Th2 цитокина ИЛ-10, который приводит к усиленному ответу Th1. OPN влияет на опосредованную клетками иммунность и имеет функции цитокина ТЫ. Он усиливает выработку В-клетками иммуноглобулина и их пролиферацию. В последних исследованиях 2008 г. делается предположение, что OPN также вызывает дегрануляцию мастоцитов. [Nagasaka A, Matsue H, Matsushima H, et al. (February 2008). "Osteopontin is produced by mast cells and affectsIgE-mediated degranulation and migration of mast cells". Eur. J. Immunol. 38 (2): 489-99]. Исследователи заметили, что IgE-опосредованная анафилаксия была значительно снижена у OPN-нокаутных мышей по сравнению с мышами дикого типа. Роль OPN в активации макрофагов рассматривалась также в исследовании рака, когда исследователи обнаружили, что OPN-вырабатывающие опухоли были способны индуцировать активацию макрофагов по сравнению с опухолями с недостатком OPN.OPN является важным антиапоптическим фактором при многих обстоятельствах. OPN блокирует вызванную активацией клеточную смерть макрофагов и Т-клеток, в равной степени как и фибробластов и эндотелиальных клеток, подверженных действию вредных факторов. OPN предупреждает незапрограммированную смерть клетки при воспалительном колите. Тот факт, что OPN взаимодействует со множеством рецепторов на поверхности клетки, которые повсеместно экспрессированы, делает его активным участником многих физиологических и патологических процессов, включая заживление ран, ремоделирование кости, онкогенез, воспаление, ишемию и иммунные ответы. Поэтому манипуляция плазменными уровнями OPN может быть полезна при лечении аутоиммунных заболеваний, раковых метастазов, остеопороза и некоторых форм стресса. Было показано, что OPN стимулирует выработку ИЛ-17; OPN гиперэкспрессирован в различных видах рака, включая рак легких, рак молочной железы, колоректальный рак, рак желудка, рак яичника,меланому и мезотелиому; OPN играет роль в развитии гломерулонефрита и тубулоинтерстициального нефрита, и OPN был обнаружен в атеросклеротических бляшках внутри артерий. Таким образом, манипуляция плазменными уровнями OPN может быть полезна при лечении аутоиммунных заболеваний, раковых метастазов, остеопороза и некоторых форм стресса. Рецептор 3 человеческого эпидермального фактора роста (ERBB3)ERBB3 кодирует члена семейства рецепторов эпидермального фактора роста (EGFR) рецепторных тирозинкиназ. Он активируется нейрегулинами, другими ERBB и рецепторами, не принадлежащими кERBB, в равной степени как и другими киназами и новыми механизмами. По нисходящей он взаимодействует, главным образом, с фосфоинозитол-3-киназой/АКТ-каскадом, определяющим выживание клеток/- 19022743 митогенным каскадом, но и также с GRB, SHC, SRC, ABL, rasGAP, SYK и регулятором транскрипции ЕВР 1 (Sithanandam и Anderson 413-48). Исследования экспрессии ERBB3 в клетках первичного рака и механизмов его воздействия в культуре клеток показали, с различной степенью уверенности, его причастность к возникновению или поддержанию рака молочной железы, яичника, предстательной железы, конкретных клеток головного мозга,сетчатки глаза, меланоцитов, толстой кишки, поджелудочной железы, желудка, ротовой полости и легких (Sithanandam и Anderson 413-48). Белок ERBB3 был обнаружен с помощью иммуногистохимического анализа в эпителиальных клетках по всему желудочно-кишечному тракту, включая плоскоклеточный эпителий ротоглотки и пищевода, париетальные клетки желудка и поверхностные энтероциты тонкого и толстого кишечника. ERBB3 проявлял повышенную экспрессию в клетках рака желудка (Poller и соавт. 275-80; Sanidas и соавт. 935-40). Все клеточные линии рака желудка экспрессировали ERBB3 и усеченный, секретированный продукт. Убедительное подтверждение ключевой роли ERBB3 при злокачественных заболеваниях желудка пришло из исследования слабо дифференцированных карцином желудка перстневидно-клеточного типа (Kobayashi и соавт. 1294-301). Zhang и соавт. исследовали экспрессиюERBB3 в клетках раковой опухоли желудка двух патологических типов (диффузного и кишечного типа) с помощью иммуногистохимического анализа (IHC). РЖ диффузного типа имел значительно более высокий уровень гиперэкспрессии ERBB3, чем кишечный тип (26,2% в сравнении с 5,0%, р 0,01). Селективная гиперэкспрессия ERBB3 в двух гистологических типах рака желудка тесно взаимосвязана с плохим прогнозом (Zhang и соавт. 2112-18). Экспрессия ERBB3 была в значительной степени связана с параметрами, определяющими прогрессию опухоли, включая глубину инвазии опухоли, поражение лимфатических узлов, отдаленные метастазы, стадию опухоли и рецидивы заболевания (Hayashi и соавт. 784349). Экспрессия и совместная экспрессия EGFR, с-erbB-2 и с-erbB-3 в 21 случае рака желудка и 20 случаях хронического гастрита были исследованы с помощью иммуногистохимического анализа на свежезамороженных пробах тканей с учетом клинико-патологических переменных величин. В целом, у пациентов, больных раком желудка, встречалась более высокая частота гиперэкспрессии EGFR, с-erbB-2 и derbB-З, чем у группы больных хроническим гастритом (81 и 43%; 38 и 45%; 35 и 20%, соответственно),однако, статистически значимые различия были установлены только для экспрессии EGFR (p = 0,01)(Slesak и соавт. 2727-32). Экспериментально испробованы были несколько терапевтических подходов к нацеливанию наERBB3. РНК-аптамеры к внеклеточному домену ERBB3 ингибировали NRG-индуцированную гетеродимеризацию ERBB3/ERBB2, фосфорилирование ERBB2 и рост раковых клеток молочной железы MCF7(Chen и соавт. 9226-31). Синтетический фактор транскрипции с доменом типа "цинковые пальцы", ингибирующий экспрессию гена ERBB3 в клетках А 431 плоскоклеточной карциномы, приводил к снижению пролиферации и миграции, и подавление экспрессии ERBB3 имело большее воздействие, чем изменениеERBB2 (Lund и соавт. 9082-91). Изомер витамина Е -токотриенол ингибировал пролиферацию клеток молочной железы за счет специфической блокировки активации ERBB3 и стимуляции сигнального путиPI3K/AKT по нисходящей (Samant и Sylvester 563-74). Микро-РНК 125 а снижала уровень РНК ERBB3 и белка, активацию АКТ и клеточный рост и инвазивность клеток SKBR3 карциномы молочной железы(Scott и соавт. 1479-86). Снижение уровня ERBB3 с помощью siPHK в клетках рака молочной железы устранило их вторичную резистентность к ингибиторам тирозинкиназы и дало возможность осуществления индукции апоптоза (Sergina и соавт. 437-41). Малая РНК (siPHK), ингибиторная к ERBB3 или АКТ,подает надежды в качестве терапевтического подхода для лечения аденокарциномы легких (Sithanandam и соавт. 1847-59). Сурвивин (BIRC5) Экспрессия BIRC5 (сурвивина), члена семейства белков-ингибиторов апоптоза (IAP), происходит в повышенном количестве в эмбриональных тканях и различных видах рака человека. В патенте WO 2004/067023 описываются пептиды, рестриктированные по МНС класса I, образованные из опухолеассоциированного антигена сурвивина, пептиды из которого способны связываться с молекулами I классаHLA с высокой аффинностью. Предполагается, что сурвивин способен к регуляции как клеточной пролиферации, так и отмирания апоптических клеток. Особенно в глиобластоме обнаруживаются очень высокие уровни экспрессии сурвивина (Angileri и соавт., 2008). Предполагается, что гиперэкспрессия сурвивина в глиомах головного мозга может играть важную роль в злокачественной пролиферации, антиапоптозе и ангиогенезе (Zhen и соавт., 2005; Liu и соавт., 2006). В особенности для глиобластомы, но и также для других видов опухолей экспрессия сурвивина была существенно ассоциирована со степенью злокачественности (с наибольшим уровнем экспрессии сурвивина в глиобластоме) и более короткими общими сроками выживаемости по сравнению с пациентами, у которых были сурвивин-негативные опухоли (Kajiwara и соавт, 2003; Saito и соавт., 2007; Uematsu и соавт., 2005; Mellai и соавт., 2008; Grunda и соавт., 2006; Xie и соавт., 2006; Sasaki и соавт., 2002; Chakravarti и соавт., 2002). Коровый антиген вируса гепатита В Для корового белка НВс вируса гепатита В (HBV) иммуногенные пептиды хорошо известны (Bertoletti и соавт., 1993; Livingston и соавт., 1997). Пептид из НВс, состоящий из десяти аминокислот, может быть включен в качестве положительного контроля в противораковые вакцины, основанные на настоя- 20022743 щем изобретении, для контроля иммунокомпетентности и успешной иммунизации пациентов. Таблица 6. Связанные с раком функции исходных белков. Категория "-""(+)""+"; означает, что ситуация на данный момент не известна Как видно из табл. 6, специалист данной области может легко привести композицию данной патентной заявки в соответствие с пациентом и/или специфической опухолью и выбрать соответствующие опухолеассоциированные пептиды. В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, один из которых содержит аминокислотную последовательность в соответствии с SEQ ID NO 1, и дополнительно включает пептид, содержащий аминокислотную последовательность в соответствии с SEQ ID NO 11. В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, причем один содержит аминокислотную последовательность в соответствии с SEQ ID NO 1 и аминокислотную последовательность в соответствии с SEQ ID NO 2 и/или SEQ IDNO 11. В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, содержащих аминокислотную последовательность в соответствии с SEQID NO 3 и аминокислотную последовательность в соответствии с SEQ ID NO 2 и/или SEQ ID NO 11. В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, содержащих аминокислотную последовательность в соответствии с SEQ- 21022743 В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, содержащих аминокислотную последовательность в соответствии с SEQNO 11. В предпочтительном варианте осуществления изобретения фармацевтическая композиция включает по меньшей мере два пептида, содержащих аминокислотную последовательность в соответствии с SEQNO 11. В еще более предпочтительном воплощении фармацевтическая композиция включает по меньшей мере еще один пептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 2 по SEQ ID NO 10 и с SEQ ID NO 11 по SEQ ID NO 22 и SEQ ID NO 24, и/или аминокислотную последовательность, которая по меньшей мере на 85% идентична SEQ ID NO 2 по SEQSEQ ID NO 22 и SEQ ID NO 24, или вариантную аминокислотную последовательность, и фармацевтически приемлемый носитель. Другие предпочтительные варианты осуществления изобретения включают по меньшей мере 3, 4,5, 6, 7, 8, 9, 10, 11 12, 13, 14, 15, 16, 17 или 18 пептидов, содержащих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO 1 по SEQ ID NO 10 и с SEQ ID NO 11 по SEQ IDNO 22 и та SEQ ID No 24, и/или аминокислотную последовательность, которая по меньшей мере на 85% идентична последовательности с SEQ ID NO 1 по SEQ ID NO 10, и/или полинуклеотид, содержащий нуклеиновую кислоту, кодирующую последовательности с SEQ ID NO 1 по SEQ ID NO 10 и с SEQ IDNO 11 по SEQ ID No 22 и SEQ ID NO 24, или вариантную аминокислотную последовательность и фармацевтически приемлемый носитель. Фармацевтическая композиция может дополнительно содержать дополнительные пептиды и/или вспомогательные вещества для большей эффективности, как это будет пояснено ниже."Вариантной аминокислотной последовательностью" данной аминокислотной последовательности изобретатели обозначают, что боковые цепи, например, одного или двух аминокислотных остатков изменены (например, при их замещении боковой цепью другого встречающегося в природе аминокислотного остатка или какой-либо другой боковой цепью), так что пептид по-прежнему способен связываться с молекулой HLA, по существу, таким же путем, как и пептид, состоящий из данной аминокислотной последовательности. Например, пептид может быть модифицирован таким образом, что он по меньшей мере сохранит, если не улучшит, способность взаимодействовать и связываться с подходящей молекулой МНС, такой как HLA-A или -DR, и так что он по меньшей мере сохранит, если не улучшит, способность генерировать активированные ЦТЛ, которые могут распознавать и уничтожать клетки, которые экспрессируют полипептид, содержащий аминокислотную последовательность, как определено в аспектах данного изобретения. Как может быть извлечено из банка данных, определенные позиции связывающихся сHLA-A пептидов являются типичными "якорными" остатками, образующими ключевую последовательность, подходящую к связывающему мотиву HLA-связывающей бороздки. Те аминокислотные остатки, которые не обязательны для взаимодействия с Т-клеточным рецептором, могут быть модифицированы замещением другой аминокислотой, чье включение, по существу, не влияет на реактивность Т-клетки и не устраняет связывание с соответствующим МНС. Таким образом,помимо данного условия, пептид по изобретению может быть любым пептидом (в понятие которого изобретатели включают олигопептиды или полипептиды), который включает аминокислотные последовательности или их участок или их вариант, как представлено в настоящем изобретении. Дополнительно известно, что пептиды, презентированные МНС класса II, образованы "коровой последовательностью", имеющей конкретный HLA-специфический аминокислотный мотив и, факультативно, N- и/или С-терминальные удлиняющие сегменты, которые не препятствуют функции коровой последовательности (т.е. считаются нерелевантными для взаимодействия пептида и Т-клетки). N- и/или С-терминальные удлиняющие сегменты могут иметь длину, например, от 1 до 10 аминокислот, соответственно. Эти пептиды могут быть использованы как непосредственно для нагрузки молекул МНС классаII, так и последовательность может быть клонирована в векторы в соответствии с описанием ниже. Так как эти пептиды образуют конечный продукт процессинга более длинных пептидов внутри клетки, то более длинные пептиды могут использоваться в равной степени. Пептиды по изобретению могут быть любого размера, но, как правило, они могут иметь молекулярную массу менее чем 100000, предпочтительно менее чем 50000, более предпочтительно менее чем 10000, более предпочтительно менее чем 5000, более предпочтительно менее чем 2500 и, как правило, около 1000 и до 2000. В отношении числа аминокислотных остатков, пептиды по изобретению могут иметь менее чем 1000 остатков, предпочтительно менее чем 500 остатков, более предпочтительно менее чем 100 остатков. Соответственно, в настоящем изобретении предложены также композиции из пептидов и их вариантов, в которых пептид или вариант имеет общую длину между 8 и 100, предпочтительно между 8 и 30, и, наиболее предпочтительно, между 8 и 17, а именно, 8, 9, 10, 11, 12, 13, 14, 15 или 16 аминокислот.- 22022743 Предпочтительными являются пептиды с коровой последовательностью, выбранной из группы, состоящей из SEQ ID NO 11 по SEQ ID NO 22 и SEQ ID NO 24 с удлиняющими сегментами длиной от 1 до 10 аминокислот на С-конце и/или N-конце, более предпочтительно, если общее число данных примыкающих аминокислот составляет от 1 до 12, более предпочтительно от 1 до 10, более предпочтительно от 1 до 8, более предпочтительно от 1 до 6, где примыкающие аминокислоты могут быть распределены в любом соотношении к С-концу и N-концу (например, все примыкающие аминокислоты могут быть добавлены к одному концу, или же аминокислоты могут быть добавлены в равном количестве к обоим концам или в любой другой пропорции), при условии, что пептид по-прежнему способен связываться с молекулой HLA таким же путем, как и указанный пептид в соответствии с любой из последовательностей с SEQ ID NO 11 по SEQ ID NO 22 и SEQ ID NO 24. В соответствии с этим, варианты, которые индуцируют Т-клеточную перекрестную реакцию с пептидом по изобретению, часто являются вариантами по длине. Если пептид длиннее, чем около 12 аминокислотных остатков, он непосредственно используется для связывания с молекулой МНС II класса. Предпочтительно, чтобы остатки, которые примыкают к центральному HLA-связывающему участку, по существу, не влияли на способность пептида специфически связываться со связывающей бороздкой молекулы МНС II класса или презентировать пептид ЦТЛ. Тем не менее, как уже было указано выше, преимущество имеет использование более крупных пептидов,в особенности, если они закодированы полинуклеотидом, потому что такие крупные пептиды могут быть разделены на фрагменты подходящими антигенпрезентирующими клетками. Кроме того, примыкающие аминокислоты могут также снижать скорость деградации пептидов in vivo, так что количество фактического пептида, находящегося в распоряжении ЦТЛ, выше по сравнению с пептидом без примыкающих аминокислот. Также возможно, чтобы эпитопы МНС I класса, хотя они обычно имеют длину между 8-10 аминокислотами, генерировались при процессинге пептидов из более длинных пептидов или белков, включающих истинный эпитоп. Также как и в случае с эпитопами МНС II класса, предпочтительно, чтобы примыкающие остатки удлиненных пептидов-предшественников за и/или перед N- и С-концом истинного эпитопа существенно не влияли на презентацию пептида ЦТЛ и не маскировали сайты для протеолитического расщепления, необходимые для получения истинного эпитопа, опосредованного процессингом удлиненного пептида. Предпочтительными являются пептиды с коровой последовательностью, состоящие из SEQ ID NO 1 по SEQ ID NO 10 и SEQ ID NO 11 с удлиняющими сегментами из 1 до 10 аминокислот на С-и/или Nконце, более предпочтительно, если общее число данных примыкающих аминокислот составляет от 1 до 12, более предпочтительно от 1 до 10, более предпочтительно от 1 до 8, более предпочтительно от 1 до 6,где примыкающие аминокислоты могут быть распределены в любом соотношении к С-концу и N-концу(например, все примыкающие аминокислоты могут быть добавлены к одному концу, или же аминокислоты могут быть добавлены в равном количестве к обоим концам или в любой другой пропорции), при условии, что пептид по-прежнему способен связываться с молекулой HLA таким же путем, как и указанный пептид в соответствии с любой из последовательностей с SEQ ID NO 1 по SEQ ID NO 10 и SEQ IDNO 11. Соответственно, в настоящем изобретении предлагаются также пептиды и варианты эпитопов МНСI класса, имеющие общую длину между 8 и 100, предпочтительно между 8 и 30 и наиболее предпочтительно между 8 и 18, а именно 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 аминокислот. Разумеется, пептид или вариант в соответствии с настоящим изобретением будет обладать способностью связываться с молекулой МНС I или II класса человека. Связывание пептида или варианта с комплексом МНС может быть проверено методами, известными из уровня техники, например, теми, что описываются в примерах настоящего изобретения или в литературе для различных аллелей МНС II класса (например, Vogt AB, Kropshofer H, Kalbacher H, Kalbus M, Rammensee HG, Coligan JE, Martin R; Ligandmice and HLA-DQ transgenic mice; Int Immunol. 1998 (12):1765-1776). Пептиды, предложенные в настоящем изобретении, могут иметь дополнительные фрагменты аминокислот, находящиеся на N- и/или С-конце, которые не обязательно образуют часть пептида, который- 23022743 функционирует как истинный эпитоп для молекул МНС, но могут, тем не менее, быть важны для обеспечения эффективного введения пептида в соответствии с настоящим изобретением в клетки (см. выше). В одном варианте осуществления настоящего изобретения пептид настоящего изобретения является слитым белком, который включает, например, 80 N-терминальных аминокислот HLA-DR антигенассоциированной инвариантной цепи (р 33, в дальнейшем "Ii"), полученной из банка данных NCBI, инвентарный номер (GenBank Accession-number) X00497 (Strubin, M., Mach, В. and Long, E.O. The completesequence of the mRNA for the HLA-DR-associated invariant chain reveals a polypeptide with an unusual transmembrane polarity EMBO J. 3 (4), 869-872 (1984. В настоящем изобретении также предложена фармацевтическая композиция, включающая по меньшей мере один из пептидов настоящего изобретения, где пептиды имеют общую длину между 8 и 100, предпочтительно между 8 и 30, и, особенно предпочтительно, между 8 и 17 или 9, 10, 11, 12, 13, 14,15 или 16 аминокислот. Кроме того, пептид или вариант может быть дополнительно модифицирован для улучшения стабильности и/или связывания с молекулами МНС в целях получения более сильного иммунного ответа. Методы для такой оптимизации пептидной последовательности хорошо известны из уровня техники и включают, например, введение реверсированных пептидных или непептидных связей. Таким образом, в соответствии с другим аспектом в изобретении предложена фармацевтическая композиция, в которой по меньшей мере один пептид или вариант включает непептидные связи. В реверсированной пептидной связи аминокислотные остатки присоединены не пептидными связями (-CO-NH-), а пептидная связь реверсируется. Такие ретроинвертированные пептидомиметики могут быть получены методами, известными из уровня техники, например, такими, как описано в работе Meziere et al. (1997) J. Immunol. 159, 3230-3237, включенной сюда путем ссылки. Этот принцип охватывает получение псевдопептидов, содержащих изменения, которые охватывают остов, но не ориентацию боковых цепей. Meziere и соавторы (1997) показывают, что эти псевдопептиды пригодны для ответов МНС и Т-хелперных клеток. Ретро-инвертированные пептиды, содержащие связи NH-CO вместо пептидных связей СО-NH, намного более устойчивы к протеолизу. Непептидной связью является, например, -CH2-NH, -CH2S-, -СН 2 СН 2-, -СН=СН-, -СОСН 2-,-СН(ОН)СН 2- и -CH2SO-. В патенте США 4897445 предложен метод твердофазного синтеза непептидных связей (-CH2-NH) в полипептидных цепях, которые включают полипептиды, синтезированные с использованием стандартной методики, и непептидную связь, синтезированную при реакции аминоальдегида и аминокислоты в присутствии NaCNBH3. Пептиды, включающие последовательности по изобретению, описанные выше, могут быть синтезированы с дополнительными химическими группами, находящимися на их аминном и/или карбоксильном концах, для увеличения, например, стабильности, биологической доступности и/или аффинности пептидов. Например, гидрофобные группы, такие как карбобензоксильные, данзильные или третбутилоксикарбонильные группы, могут быть добавлены к аминным окончаниям пептидов. Подобным образом, ацетильная группа или 9-фторенилметоксикарбонильная группа может быть введена в аминные окончания пептидов. Кроме того, гидрофобная группа, трет-бутилоксикарбонильная или амидная группа может быть, например, добавлена к карбоксильным окончаниям пептидов. Далее, все пептиды по изобретению могут быть синтезированы в целях изменения их пространственной конфигурации. Например, может быть использован D-изомер одного или более аминокислотных остатков пептида, а не обычный L-изомер. Более того, по меньшей мере один из аминокислотных остатков пептидов по изобретению может быть замещен одним из хорошо известных не встречающихся в природе аминокислотных остатков. Изменения, такие как данные, могут служить для повышения стабильности, биологической доступности и/или связывающих свойств пептидов по изобретению. Подобным образом, пептид или вариант по изобретению может быть модифицирован химическим способом посредством реакции отдельных аминокислот как до, так и после синтеза пептида. Примеры таких модификаций хорошо известны из уровня техники и обобщаются, например, в работе R. Lundblad,Chemical Reagents for Protein Modification, 3rd ed. CRC Press, 2005, которая включена сюда путем ссылки. Химическая модификация аминокислот включает, но без ограничения, модификацию с помощью ацилирования, амидинирование, пиридоксилирование лизина, восстановительное алкилирование, тринитробензилирование аминных групп 2,4,6-тринитробензолсульфоновой кислотой (TNBS), амидную модификацию карбоксильных групп и сульфгидрильную модификацию с помощью окисления надмуравьиной кислотой цистеина до цистеиновой кислоты, образование ртутных производных, образование смешанных дисульфидов с другими тиоловыми соединениями, реакцию с малеимидом, карбоксиметилирование йодуксусной кислотой или йодацетамидом и карбамоилирование цианатом при щелочном уровне рН,хотя не ограничиваясь ими. В этой связи специалист данной области может проконсультироваться с главой 15 в Current Protocols In Protein Science, Eds. Coligan et al. (John WileySons NY 1995-2000) для получения более обширной информации о методах, связанных с химической модификацией белков. Успешная модификация терапевтических белков и пептидов с PEG (полиэтиленгликолем), которая часто ассоциируется с увеличением полупериода циркуляции при поперечной сшивке белков с глутаральдегидом, полиэтиленгликольдиакрилатом и формальдегидом используется для приготовления гид- 24022743 рогелей. Химическая модификация аллергенов для иммунотерапии часто достигается при карбамоилировании цианатом калия. В целом, пептиды и варианты (по меньшей мере те, что содержат пептидные связи между аминокислотными остатками) могут быть синтезированы, к примеру, Fmoc-полиамидным способом твердофазного пептидного синтеза, как раскрыто у Lu et al. (1981) J. Org. Chem. 46, 3433 и в прилагающихся ссылках. Очистка может быть произведена любой методикой или комбинацией таких методик как рекристаллизация, эксклюзивная хроматография, ионообменная хроматография, хроматография гидрофобного взаимодействия и (обычно) обращено-фазовая высокоэффективная жидкостная хроматография с использованием, к примеру, градиентного разделения в системе ацетонитрил/вода. Анализ пептидов может быть произведен при использовании тонкослойной хроматографии, электрофореза, в частности, капиллярного электрофореза, твердофазной экстракции (ТФЭ), обращенофазовой высокоэффективной жидкостной хроматографии, аминокислотного анализа после кислотного гидролиза и масс-спектрометрического анализа при бомбардировке быстрыми атомами (FAB), а также масс-спектрометрического анализа MALDI и ESI-Q-TOF. В еще одном аспекте изобретения предложена нуклеиновая кислота (например, полинуклеотид),кодирующая пептид или вариант по изобретению. Полинуклеотид может быть, к примеру, ДНК, кДНК,ПНК, ЦНК, РНК, как одно-, так и/или двухнитевыми; природными или стабилизированными формами полинуклеотидов, таких как, к примеру, полинуклеотиды с фосфоротиоатным остовом, или их комбинациями и может содержать или не содержать интроны при условии, что полинуклеотид кодирует пептид. Разумеется, только пептиды, содержащие встречающиеся в природе аминокислотные остатки, присоединенные природными пептидными связями, могут кодироваться полинуклеотидом. Еще в одном аспекте изобретения предложен вектор экспрессии, способный экспрессировать полипептид в соответствии с изобретением. Векторы экспрессии для различных видов клеток хорошо известны из уровня техники и могут быть выбраны без проведения излишних экспериментов. Как правило, ДНК вводится в вектор экспрессии, такой как плазмида, с соответствующей ориентацией и корректной рамкой считывания экспрессии. Если необходимо, то ДНК может быть сцеплена с адекватными нуклеотидными последовательностями, обеспечивающими координацию транскрипции и трансляции, распознающимися желательным хозяином, хотя такие контрольные элементы обычно имеются в векторе экспрессии. Вектор вводится затем хозяину стандартными способами. С руководством можно ознакомиться, к примеру, в работе Sambrook et al (1989) Molecular Cloning, A Laboratory Manual,Cold Spring Harbor Laboratory, Cold Spring Harbor, NY. В особенно предпочтительном варианте осуществления изобретения, однако, фармацевтическая композиция включает по меньшей мере два пептида, состоящих из аминокислотных последовательностей в соответствии с SEQ ID NO 1 по SEQ ID NO 12. Оптимальное количество каждого пептида, включаемого в вакцину, и оптимальная схема дозировки может быть определена специалистом данной области без проведения излишних экспериментов. Например, пептид или его вариант может приготавливаться для внутривенной (i. v.) инъекции, подкожной (s. с.) инъекции, внутрикожной (i. d.) инъекции, внутрибрюшинной (i. p.) инъекции, внутримышечной (i. m.) инъекции. Предпочтительные пути введения пептидной инъекции - s.c, i.d., i.p., i.m. и i.v. Предпочтительными путями введения инъекции ДНК являются i.d., i.m., s.c, i.p. и i.v. Вводиться могут дозы, к примеру, между 1 и 500 мг, и 50 мкг и 1,5 мг, предпочтительно от 125 до 500 мкг пептида или ДНК, в зависимости от соответствующего пептида или ДНК. Дозы в данных пределах успешно использовались в предыдущих клинических исследованиях (Brunsvig PF, Aamdal S, Gjertsen MK, Kvalheim G,Markowski-Grimsrud CJ, Sve I, Dyrhaug M, Trachsel S, Mller M, Eriksen JA, Gaudemack G; Telomerase peptide vaccination: a phase I/II study in patients with non-small cell lung cancer; Cancer Immunol Immunother. 2006; 55(12):1553-1564; M. Staehler, A. Stenzl, P. Y. Dietrich, T. Eisen, A. Haferkamp, J. Beck, A. Mayer, S.peptide based cancer vaccine IMA901, ASCO meeting 2007; Abstract No 3017). Фармацевтические композиции, предложенные в изобретении, могут быть составлены так, что выбор, число и/или количество пептидов, присутствующих в композиции является/являются ткане-, раковои/или пациентспецифической/ими. Например, руководством для точного отбора пептидов могут служить профили экспрессии родительских белков в данной ткани во избежание побочных эффектов. Выбор может зависеть от конкретного вида рака, от которого страдает пациент, которому предназначено лечение,в равной степени, как и от статуса заболевания, ранних схем лечения, иммунного статуса пациента и,естественно, от HLA-гаплотипа пациента. Кроме того, вакцина в соответствии с изобретением может содержать индивидуализированные компоненты, соответствующие личным потребностям отдельного пациента. Примерами являются различные количества пептидов в соответствии с экспрессией связанных с ними ТАА у конкретного пациента, нежелательными побочными эффектами в связи с аллергиями или другими видами лечения и согласованием для вторичного лечения, следующего за первым циклом или схемой лечения. Для композиции, предназначенной для использования в качестве вакцины против глиобластомы,- 25022743 например, будут игнорироваться пептиды, родительские белки которых экспрессированы в больших количествах в нормальных тканях, или они будут присутствовать в малых количествах в композиции по изобретению. С другой стороны, если известно, что опухоль пациента экспрессирует большие количества конкретного белка, то соответствующая фармацевтическая композиция для лечения данного вида рака может быть представлена в больших количествах и/или может включать более одного пептида, специфичного для данного конкретного белка или сигнального пути данного белка. Специалист данной области будет способен выбрать предпочтительные комбинации иммуногенных пептидов при проверке, например, популяции Т-клеток in vitro в равной степени, как их эффективности и общего присутствия, пролиферации, аффинности и размножения конкретных Т-клеток для конкретных пептидов, и функциональных свойств Т-клеток, например, при анализе выработки IFN-гамма (см. также примеры ниже). Обычно наиболее эффективные пептиды комбинируются затем в состав вакцины в соответствии с целями, описанными выше. Подходящая вакцина будет предпочтительно содержать от 1 до 20 пептидов, более предпочтительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 различных пептидов, еще более предпочтительно 6, 7, 8, 9, 10 11, 12, 13 или 14 различных пептидов и, наиболее предпочтительно, 10, 11, 12, 13 или 14 различных пептидов. Длина пептида для применения в вакцине против рака может быть любой подходящей длиной, как это раскрыто в контексте данного изобретения. В частности, он может быть подходящим пептидом из 9 аминокислотных остатков или подходящим пептидом из 8 или 9 или 10 или 11 аминокислотных остатков или 12, 13, 14 или 15 аминокислотных остатков. Более длинные пептиды могут быть также подходящими; пептиды из 9 или 10 аминокислотных остатков, как описано в приложенных Таблицах 4 и 5, являются предпочтительными для пептидов МНС I класса, в то время как 12-15 аминокислотных остатков предпочтительны для пептидов МНС II класса. Пептид(ы) представляет(ют) собой вакцину против опухоли или рака. Она может вводиться непосредственно пациенту в пораженный орган или системно, или вноситься ex vivo в клетки, полученные от пациента, или в человеческую клеточную линию, которые затем могут вводиться пациенту или использоваться in vitro для селекции субпопуляции из иммунных клеток, полученных от пациента, которые после этого вновь вводятся пациенту. Пептид может быть, по существу, чистым или комбинированным с иммуностимулирующим адъювантом (см. ниже) или использоваться в комбинации с иммуностимулирующими цитокинами или может вводиться с подходящей системой доставки, например, липосомами. Пептид может быть также конъюгирован с подходящим носителем, таким как гемоцианин фиссуреллы (KLH) или маннан (см. заявку WO 95/18145 и Longenecker et al (1993) Ann. NY Acad. Sci. 690,276-291). Пептид может быть также меченым или быть слитым белком или гибридной молекулой. Пептиды, последовательность которых представлена в настоящем изобретении, как ожидается, стимулируют CD4 Т-клетки или CD8 ЦТЛ. Тем не менее,стимуляция более эффективна в присутствии поддержки, предоставляемой Т-клетками, положительными для противоположного CD. Таким образом, для эпитопов МНС II класса, которые стимулируют CD4 Тклетки, партнеры в слиянии или участки гибридной молекулы надлежащим образом предоставляют эпитопы, которые стимулируют CD8-положительные Т-клетки. С другой стороны, для эпитопов МНС I класса, которые стимулируют CD8 ЦТЛ, партнер в слиянии или участки гибридной молекулы надлежащим образом предоставляют эпитопы, которые стимулируют CD4-положительные Т-клетки. CD4- иCD8-стимулирующие эпитопы хорошо известны из уровня техники и включают те, что были идентифицированы в настоящем изобретении. Фармацевтически приемлемые носители хорошо известны и обычно представляют собой жидкости,в которых приготавливается активное терапевтическое вещество. Носитель обычно не обеспечивает состав никакой фармакологической активностью, хотя он может обеспечивать химическую и/или биологическую стабильность, характеристики высвобождения и т.п. Примеры составов рассматриваются, например, в работе Alfonso R. Gennaro. Remington: The Science and Practice of Pharmacy, 20th Edition. Baltimore,MD: Lippincott WilliamsWilkins, 2000 и включают, но без ограничения, физиологический раствор, воду, воду с буфером, 0,3% глицин, гиалуроновую кислоту, глюкозу и т.п. Недавно было обнаружено, что определенные жировые эмульсии, которые в течение многих лет использовались для внутривенного питания людей, могут также выступать в роли носителя для пептидов. Два примера таких эмульсий представляют собой имеющиеся в продаже жировые эмульсии, известные как Интралипид и Липофундин."Интралипид" является зарегистрированной торговой маркой фирмы Kabi Pharmacia, Швеция, и представляет собой жировую эмульсию для внутривенного питания и описывается в патенте США 3 169 094."Липофундин" - это зарегистрированная торговая марка фирмы В. Braun Melsungen, Германия. Обе эмульсии в качестве жира содержат масло соевых бобов (100 или 200 г на 1000 мл дистиллированной воды: 10% или 20%, соответственно). Фосфолипиды яичного желтка используются в качестве эмульгатора в Интралипиде (12 г/л дистиллированной воды) и лецитин яичного желтка - в Липофундине (12 г/л дистиллированной воды). Изотоничность является результатом добавления глицерина (25 г/л) как в Интралипид, так и в Липофундин. Чтобы вызвать иммунный ответ, обычно необходимо включить адъюванты, что приводит к большей иммуногенности композиции. Таким образом, в предпочтительном варианте осуществления изобре- 26022743 тения фармацевтическая композиция включает дополнительно по меньшей мере один подходящий адъювант. Подходящие адъюванты включают, но без ограничения, 1018 ISS, соли алюминия, Amplivax, AS 15, BCG, CP-870,893, CpG7909, CyaA, dSLIM, флагеллин или лиганды TLR5, полученные из флагеллина,лиганд FLT3, GM-CSF, IC30, IC31, имиквимод (ALDARA), резиквимод, ImuFact IMP321, интерлейкины, такие как ИЛ-2, ИЛ-13, ИЛ-21, интерферон-альфа или бета или их пегилированные производные, ISISA-51, эмульсии "вода в масле" и "масло в воде", ОК-432, ОМ-174, ОМ-197-МР-ЕС, ONTAK, OspA, векторная система PepTel, основанные на поли(лактид когликолиде) [PLG] и декстране микрочастицы,талактоферрин SRL172, виросомы и другие вирусоподобные частицы, YF-17D, VEGF trap, R848, бетаглюкан, Pam3Cys, стимулон Aquila QS21, который получают из сапонина, микобактериальные экстракты и синтетические имитаторы бактериальных клеточных стенок и другие запатентованные адъюванты,такие как Detox компании Ribi, Quil или Superfos. Предпочтительными адъювантами являются такие как адъювант Фрейнда или GM-CSF. Несколько иммунологических адъювантов (например, MF59), специфических для дендритных клеток, и их приготовление были описаны ранее (Aucouturier и соавт., 2001;Allison и Krummel, 1995). Также могут использоваться цитокины. Несколько цитокинов были непосредственно соотнесены с влиянием на миграцию дендритных клеток к лимфоидным тканям (например, TNFальфа), ускоряя созревание дендритных клеток до эффективных, презентирующих антиген Тлимфоцитам, клеток (например, GM-CSF, ИЛ-1 и ИЛ-4) (патент США 5 849 589, отдельно включенный сюда в полном объеме путем ссылки) и действуя как иммуноадъюванты (например, ИЛ-12, ИЛ-15, ИЛ 23, ИЛ-7, IFN-альфа, IFN-бета) (Gabrilovich и соавт. 1996). Об иммуностимулирующих олигонуклеотидах CpG также сообщалось, что они усиливают эффекты адъювантов в составе вакцин. Теоретически не связанные, CpG-олигонуклеотиды при активации врожденной (не приобретенной) иммунной системы действуют с помощью Toll-подобных рецепторов (TLR),в основном TLR9. Вызванная CpG активация TLR9 усиливает антиген-специфические гуморальные и клеточные ответы на широкий спектр антигенов, включая пептидные или белковые антигены, живые или убитые вирусы, вакцины из дендритных клеток, аутологичные клеточные вакцины и полисахаридные конъюгаты как в профилактических, так и терапевтических вакцинах. Более важно то, что улучшается созревание и дифференциация дендритных клеток, приводя к повышенной активации TH1-клеток и интенсивной выработке цитотоксических Т-лимфоцитов (ЦТЛ) даже при отсутствии помощи CD4 Тклеток. Активация TH1, вызванная стимуляцией TLR9, сохраняется даже в присутствии вакцинных адъювантов, таких как квасцы или неполный адъювант Фрейнда (IFA), которые обычно способствуют активации TH2. CpG-олигонуклеотиды проявляют даже большую адъювантную активность, если они входят в состав или вводятся в организм вместе с другими адъювантами или в таких составах как микрочастицы,наночастицы, липидные эмульсии или подобных составах, которые в особенности необходимы для инициации сильного ответа, если антиген относительно слаб. Они также ускоряют иммунную реакцию и позволяют снизить дозы антигена приблизительно на два порядка в сравнении с ответами антитела на полную дозу вакцины без CpG в некоторых экспериментах (Krieg, 2006). В патенте США 6406705 В 1 описывается комбинированное применение CpG-олигонуклеотидов, адъювантов, не включающих нуклеиновые кислоты, и антигена для вызывания антиген-специфического иммунного ответа. АнтагонистомCpG TLR9 является dSLIM (иммуномодулятор со структурой типа двуцепочечный стебель-петля) компании "Mologen" (Берлин, Германия), который является предпочтительным компонентом фармацевтической композиции настоящего изобретения. Также могут быть использованы другие молекулы, связывающиеся с TLR, такие как РНК, связывающаяся с TLR 7, TLR 8 и/или TLR 9. Другие примеры пригодных к использованию адъювантов включают, но без ограничения, химически модифицированные CpG (например, CpR, Idera), аналоги dsPHK, такие как poly(I:C), и их производные (например, AmpliGen, Hiltonol, поли-(ICLC), поли(IC-R), поли(I:С 12U), бактериальные ДНК или РНК, отличные от CpG, a также иммуноактивные малые молекулы и антитела, такие как циклофосфамид, сунитиниб, бевацизумаб, целебрекс, NCX-4016, силденафил, тадалафил, варденафил, сорафениб,темозоломид, темсиролимус, XL-999, СР-547632, пазопаниб, VEGF Trap, ZD2171, AZD2171, антиCTLA4, другие антитела, нацеленные на основные структуры иммунной системы (например, антитела кCD40, TGF-бета, рецептору TNF-альфа) и SC58175, которые могут действовать терапевтически и/или как адъюванты. Количества и концентрации адъювантов и добавок, пригодных для использования в контексте настоящего изобретения, могут быть легко определены опытным специалистом без проведения излишних экспериментов. Предпочтительными адъювантами являются имиквимод, резимиквимод, GM-CSF, циклофосфамид,сунитиниб, бевацизумаб, интерферон-альфа, CpG-олигонуклеотиды и производные, поли-(I:С) и производные, РНК, силденафил и составы из твердых частиц с PLG или виросомами. В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювант выбран из группы, состоящей из колониестимулирующих факторов, таких как гра- 27022743 нулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF, сарграмостим), имиквимод,резиквимод и интерферон-альфа. В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювантом является имиквимод и резиквимод. В предпочтительном варианте осуществления фармацевтической композиции в соответствии с изобретением адъювантом является комбинация из GM-CSF и имиквимода. Композиции настоящего изобретения могут быть использованы для парентерального введения, такого как подкожное, внутрикожное, внутримышечное, внутрибрюшинное или для орального введения. Для этого пептиды и факультативно другие молекулы растворяются или суспендируются в фармацевтически приемлемом, предпочтительно водном носителе. Помимо того, композиция может содержать вспомогательные вещества, такие как буферы, связующие агенты, балластные агенты, разбавители, ароматизаторы, смазывающие вещества и т.д. Пептиды могут быть также введены вместе с иммуностимулирующими веществами, такими как цитокины. Пространный список вспомогательных веществ, которые могут быть использованы в такой композиции, может быть взят, например, из работы A. Kibbe, "Handbook of Pharmaceutical Excipients", 3rd Ed., 2000, American Pharmaceutical Association and pharmaceuticalpress. Композиция может применяться для предупреждения, профилактики и/или лечения аденоматозных или раковых заболеваний, предпочтительно CRC. Предпочтительные составы могут быть взяты, например, из ЕР 2113253. Цитотоксические Т-клетки (ЦТЛ) распознают антиген в форме пептида, связанного с молекулой МНС, а не интактный чужеродный антиген сам по себе. Сама молекула МНС находится на клеточной поверхности антигенпрезентирующей клетки. Таким образом, активация ЦТЛ возможна только, если имеется в наличии тримерный комплекс из пептидного антигена, молекулы МНС и АПК. Соответственно, иммунный ответ может быть усилен, если для активации ЦТЛ использован не только пептид, а если,кроме того, добавлены АПК с соответствующей молекулой МНС. Поэтому в предпочтительном варианте осуществления фармацевтическая композиция в соответствии с настоящим изобретением дополнительно содержит по меньшей мере одну антигенпрезентирующую клетку. Антигенпрезентирующая клетка (или клетка-стимулятор) обычно имеет молекулу МНС I или II класса на своей поверхности и в одном варианте осуществления является, по существу, не способной самостоятельно нагружать на молекулу МНС I или II класса выбранный антиген. Как более подробно описано ниже, молекула МНС I или II класса может быть легко нагружена выбранным антигеном in vitro. Предпочтительно, если в клетке млекопитающих отсутствует или имеется пониженный уровень или пониженная функция пептидного транспортера ТАР. Подходящие клетки, в которых не хватает пептидного транспортера ТАР, включают Т 2 - не способную нагружать пептидом клеточную линию человека,которая имеется в наличии в American Type Culture Collection, 12301 Parklawn Drive, Rockville, Maryland 20852, США под каталоговымCRL 1992; клеточные линии, в которых не хватает ТАР, такие как Т 2,могут быть использованы в качестве АПК, и из-за недостатка ТАР практически все пептиды, презентируемые МНС I класса, будут пептидами для загрузки извне пустых молекул МНС I класса этих клеточных линий, следовательно, все эффекты будут определенно приписываться использованным пептидам. Предпочтительно, чтобы антигенпрезентирующие клетки являлись дендритными клетками. Подходящим образом, дендритные клетки являются аутологичными дендритными клетками, на которые нагружен антигенный пептид. Антигенный пептид может быть любым подходящим антигенным пептидом,который вызывает адекватный Т-клеточный ответ. Т-клеточная терапия с использованием аутологичных дендритных клеток с нагруженными пептидами из опухолеассоциированного антигена раскрывается в работе Murphy et al (1996) The Prostate 29, 371-380 и Tjua et al (1997) The Prostate 32, 272-278. Таким образом, в предпочтительном варианте осуществления настоящего изобретения в фармацевтическую композицию, содержащую по меньшей мере одну антигенпрезентирующую клетку с введенным в нее импульсным методом или нагруженным на нее пептидом, к примеру, методом, представленном в примере 5. В качестве альтернативы, антигенпрезентирующая клетка включает экспрессионную конструкцию,кодирующую пептид. Полинуклеотид может быть любым соответствующим полинуклеотидом, и, предпочтительно, чтобы он был способен к трансдукции дендритной клетки, таким образом, приводя к презентации пептида и индукции иммунитета. Представляет удобство то, что нуклеиновая кислота по изобретению может быть включена в вирусный полинуклеотид или вирус. Например, показано, что аденовирус-трансдуцированные дендритные клетки проявляли способность индуцировать антиген-специфический противоопухолевый иммунитет по отношению к MUCl (см. Gong et al. (1997) Gene Ther. 4, 1023-1028). Подобным образом могут быть использованы системы, основанные на аденовирусе (см., например, Wan et al (1997) Hum. Gene Ther. 8,1355-1363); могут быть использованы ретровирусные системы (Koch et al (2006) J. Exp. Med. 186, 12131221 и Szabolcs и соавт. (1997), также может быть использован опосредованный частицами крови перенос в дендритные клетки (Tuting и соавт. (1997) Eur. J. Immunol. 27, 2702-2707); а также может быть использована РНК (Ashley et al (2007) J. Exp. Med. 186, 1177-1182).- 28022743 В целом, фармацевтическая композиция по изобретению, содержащая (а) нуклеиновую(ые) кислоту(ы) по изобретению, может вводиться подобным образом, как и те, что содержат пептид(ы) по изобретению, например, внутривенно, внутриартериально, внутрибрюшинно, внутримышечно, внутрикожно,внутрь опухоли, орально, дермально, назально, буккально, ректально, вагинально, с помощью ингаляции или посредством топического введения. По причине действия механизмов уклонения опухоль часто вырабатывает резистентность к медикаменту. Резистентность к медикаменту может появиться во время лечения, и она проявляется в метастазах и рецидивах опухоли. Во избежание таковой медикаментозной резистентности опухоль обычно лечат комбинацией медикаментов, и для лечения метастазов и опухоли, возвращающейся повторно после периода ремиссии, часто требуется комбинация, отличающаяся от первой. Поэтому в одном аспекте изобретения фармацевтическая композиция вводится в соединении со вторым противораковым средством. Второе противораковое средство может вводиться до, после или одновременно с фармацевтической композицией по изобретению. Одновременное введение может быть достигнуто, например, при смешивании фармацевтической композиции по изобретению со вторым противораковым средством при условии совместимости их химических свойств. Другая возможность для одновременного введения - это введение композиции и противоракового средства в один и тот же день, независимо от способа введения, так что фармацевтическая композиция по изобретению может быть, например, инъецирована, в то время как второе противораковое средство вводится, например, орально. Фармацевтическая композиция и второе противораковое средство могут также вводиться в рамках одного и того же курса лечения, но в разные дни и/или в рамках отдельных курсов лечения. В другом аспекте настоящего изобретения предложен метод лечения или предупреждения рака у пациента, включающий введение пациенту терапевтически эффективного количества любой из фармацевтических композиций по изобретению. Терапевтически эффективным количеством будет количество, достаточное для вызывания иммунного ответа, в частности, активации субпопуляции ЦТЛ. Специалист данной области может легко определить, будет то или иное количество эффективным, при использовании стандартных иммунологических методов, таких как те, что приводятся в примерах к настоящему описанию. Другим способом мониторинга эффекта от конкретного количества фармацевтической композиции является наблюдение за ростом опухоли, подвергающейся лечению, и/или ее рецидива. В особенно предпочтительном варианте осуществления настоящего изобретения фармацевтическая композиция применяется в виде противораковой вакцины. Композиция, содержащая пептиды или кодирующие пептиды нуклеиновые кислоты, может также составлять вакцину против опухоли или рака. Она может вводиться непосредственно пациенту в пораженный орган или системно, или вноситься ex vivo в клетки, полученные от пациента, или в человеческую клеточную линию, которые затем могут вводиться пациенту, или использоваться in vitro для селекции субпопуляции из иммунных клеток, полученных от пациента, которые после этого вновь вводятся пациенту. Композиция по изобретению может использоваться в методе лечения или в качестве вакцины против рака. Рак может быть карциномой предстательной железы, карциномой полости рта, плоскоклеточной карциномой полости рта (OSCC), острой миелоидной лейкемией (AML) (Qian и соавт., 2009), вызываемой Н. pylori MALT-лимфомой (Banerjee и соавт., 2000), карциномой толстого кишечника/колоректальным раком, глиобластомой, немелкоклеточным раком легких (NSCLC), карциномой шейки матки, раком молочной железы человека, раком предстательной железы, раком толстого кишечника,раком поджелудочной железы, протоковой аденокарциномой поджелудочной железы, раком яичника,гепатоклеточной карциномой, раком печени, опухолями головного мозга различных фенотипов; лейкемиями, такими как острая лимфобластная лейкемия, ALL; раком легких, саркомой Юинга, эндометриальным раком, плоскоклеточной карциномой головы и шеи, эпителиальным раком гортани, карциномой пищевода, карциномой ротовой полости, карциномой мочевого пузыря, карциномами яичника, почечноклеточной карциномой, атипической менингиомой, папиллярной карциномой щитовидной железы, опухолями головного мозга, карциномой слюнного протока, экстранодальными T/NK-клеточными лимфомами, нехожкинскими лимфомами и злокачественными солидными опухолями легких и молочной железы, предпочтительным видом рака является рак желудка. В наиболее предпочтительном варианте осуществления метода лечения или вакцины в соответствии с изобретением вакцина является противоопухолевой вакциной из нескольких пептидов для лечения РЖ. Предпочтительно, чтобы вакцина включала комплекс опухолеассоциированных пептидов, выбранных из последовательностей с SEQ ID NO 1 по SEQ ID NO 11, которые локализованы и были идентифицированы на клетках первичного РЖ. Этот комплекс включает пептиды HLA класса I и II. Пептидный комплекс может также содержать по меньшей мере один пептид, например, из корового антигена HBV(SEQ ID 23), используемый в качестве пептида положительного контроля, служащего как иммунный маркер для проверки эффективности внутрикожного введения. В одном конкретном варианте осуществления вакцина состоит из 11 отдельных пептидов (в соответствии с SEQ ID NO 1 по 11) с массой каждого пептида от около 1500 мкг до около 75 мкг, предпочтительно от около 1000 мкг до около 175 мкг, и бо- 29
МПК / Метки
МПК: C07K 7/06, A61K 39/00, A61P 35/00
Метки: вакцина, относящаяся, рака, пептидов, ним, видов, других, желудка, композиция, опухолеассоциированных, противораковая, лечения
Код ссылки
<a href="https://eas.patents.su/30-22743-kompoziciya-opuholeassociirovannyh-peptidov-i-otnosyashhayasya-k-nim-protivorakovaya-vakcina-dlya-lecheniya-raka-zheludka-i-drugih-vidov-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция опухолеассоциированных пептидов и относящаяся к ним противораковая вакцина для лечения рака желудка и других видов рака</a>
Предыдущий патент: Система и способ безопасных операций управления скважиной
Следующий патент: Изделие, в частности шина, с наружной резиновой смесью, содержащей соль лантаноида
Случайный патент: Средство для лечения болезней суставов