Замещенные ароматические соединения, композиции на их основе и их фармацевтические применения
Номер патента: 22445
Опубликовано: 29.01.2016
Авторы: Зашари Було, Бьенвеню Жан-Франсуа, Пенни Кристофер, Груи Брижитт, Перрон Валери, Ганьон Лин
Формула / Реферат
1. Соединение, представленное формулой II
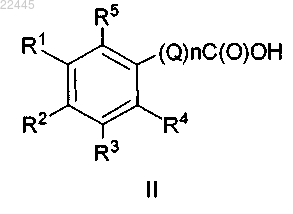
или его фармацевтически приемлемая соль, где
n равно 1;
Q представляет собой С1-С4алкил, необязательно замещенный одним заместителем Ra;
R1 представляет собой С5-С6алкил, С5-С6алкенил или С5-С6алкинил,
R2 представляет собой Н, атом галогена, галогенС1-С4алкил, ORb, SRb или NRcRd;
R3 представляет собой Н, атом галогена, галогенС1-С4алкил, С1-С4алкил, ORb, SRb или NRcRd;
R4 представляет собой Н, атом галогена, галогенС1-С4алкил, С1-С4алкил, ORb, SRb или NRcRd;
R5 представляет собой Н или ORb;
Ra представляет собой ORb, SRb или NRcRd;
Rb представляет собой Н и
Rc и Rd независимо выбраны из Н или С1-С4алкила.
2. Соединение по п.1, в котором фармацевтически приемлемая соль представляет собой основно-аддитивную соль, и основно-аддитивная соль содержит противоион металла, выбранного из группы, состоящей из натрия, магния, кальция, калия и лития.
3. Соединение по п.2, в котором противоион металла представляет собой натрий.
4. Соединение по любому из пп.1-3, где соединение выбрано из группы, состоящей из
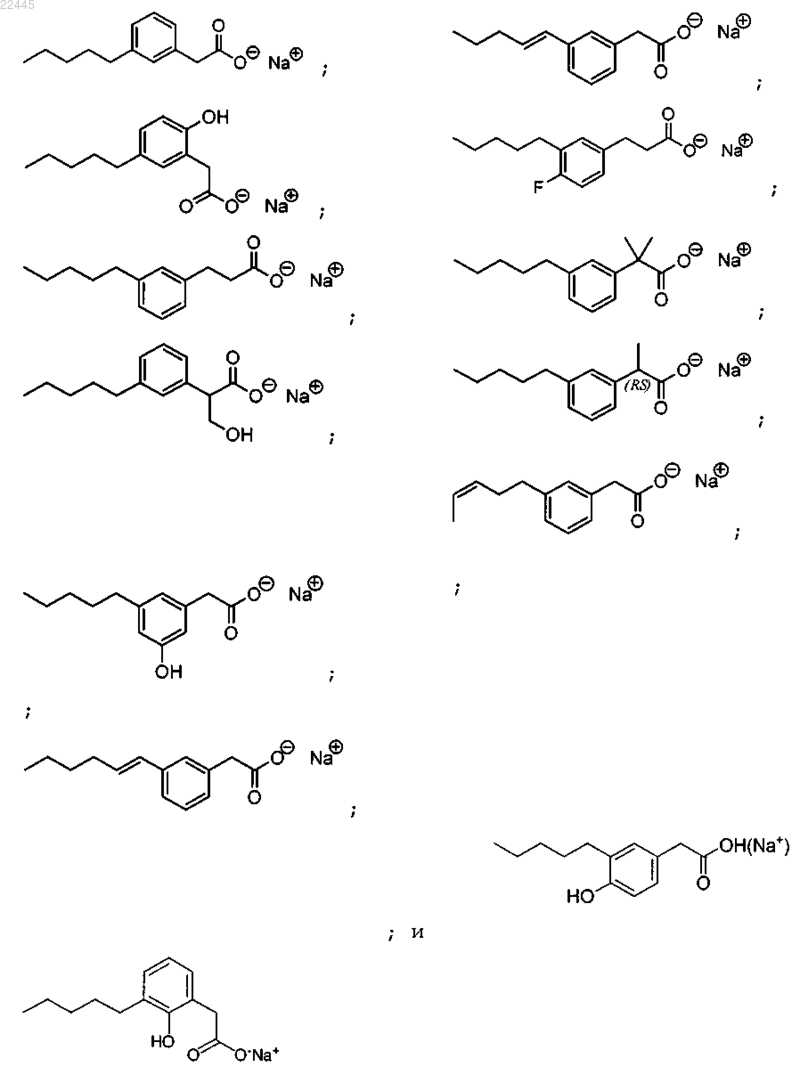
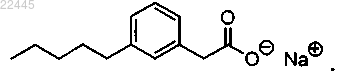
5. Соединение по п.4, которое представляет собой
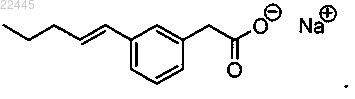
6. Соединение по п.4, которое представляет собой
7. Соединение по п.4, которое представляет собой
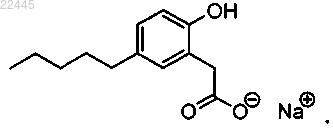
8. Соединение по п.4, которое представляет собой
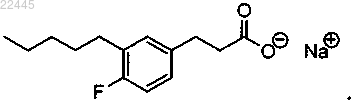
9. Соединение по п.4, которое представляет собой
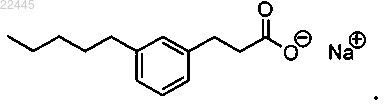
10. Соединение по п.4, которое представляет собой
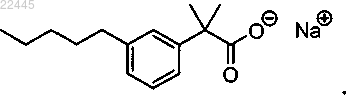
11. Соединение по п.4, которое представляет собой
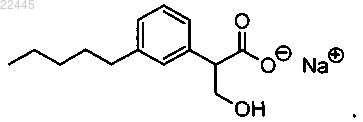
12. Соединение по п.4, которое представляет собой
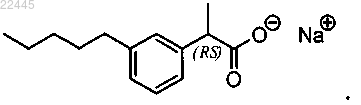
13. Соединение по п.4, которое представляет собой
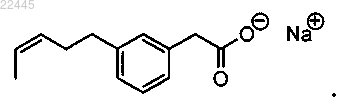
14. Соединение по п.4, которое представляет собой
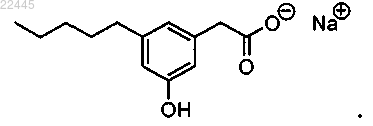
15. Соединение по п.4, которое представляет собой
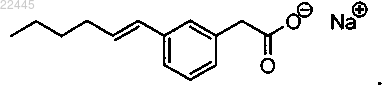
16. Соединение по п.4, которое представляет собой
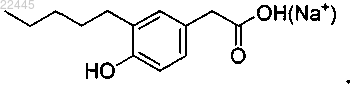
17. Соединение по п.4, которое представляет собой

18. Фармацевтическая композиция, содержащая соединение, которое определено в любом из пп.1-17, и фармацевтически приемлемый носитель.
19. Применение соединения для получения лекарственного средства для предупреждения и/или лечения состояния, выбранного из группы, состоящей из (i) нарушений системы крови, (ii) почечных нарушений, нефропатий и/или осложнений почечного нарушения; (iii) связанных с воспалением заболеваний и (iv) нарушений, связанных с окислительным стрессом, где указанное соединение представляет собой соединение формулы II, определенное в любом из пп.1-17.
20. Применение по п.19, в котором нарушение системы крови представляет собой анемию или нейтропению.
21. Применение по п.19, в котором почечное нарушение представляет собой нефропатию.
22. Применение по п.19, где связанное с воспалением заболевание представляет собой иммуноопосредованное воспалительное заболевание или аутоиммунное заболевание.
23. Применение по п.19, в котором связанное с воспалением заболевание выбирают из группы, состоящей из артрита, системной красной волчанки (SLE), идиопатической тромбоцитопенической пурпуры (ITP), гломерулонефрита, васкулита, псориатического артрита, псориаза, болезни Крона, воспалительного заболевания кишечника, анкилозирующего спондилита, синдрома Шегрена, болезни Стилла, увеита, склеродермии, миозита, синдрома Рейтера и синдрома Вегенера.
24. Применение по п.19, в котором нарушение, связанное с окислительным стрессом, выбирают из группы, состоящей из сердечно-сосудистых заболеваний, рака, сахарного диабета, артрита, атеросклероза, болезни Паркинсона, сердечной недостаточности, инфаркта миокарда, болезни Альцгеймера, синдрома хронической усталости и аутоиммунных заболеваний.
25. Применение по п.19, в котором почечное нарушение является результатом нефрэктомии, химиотерапии, артериальной гипертензии, сахарного диабета, застойной сердечной недостаточности, волчанки, серповидно-клеточной анемии, воспаления, инфекционных заболеваний, аутоиммунных заболеваний или ВИЧ-ассоциированной нефропатии.
26. Применение по п.19, в котором почечное нарушение включает трансплантат почки; нефропатию; хроническую почечную недостаточность (CKD); гломерулонефрит; поликистоз почек; нефромегалию; нефротический синдром; терминальную стадию почечной недостаточности (ESRD); острую почечную недостаточность; хроническую почечную недостаточность; заболевание интерстиция; нефрит; склероз, индурацию; уплотнение тканей или сосудов; фиброз почки; рубцевание и почечно-ассоциированные пролиферативные заболевания.
27. Применение по п.19, в котором нефропатия представляет собой фиброз почки, гломерулярное заболевание, хроническую почечную недостаточность, гипертензивную нефропатию, диабетическую нефропатию, аналгезирующую нефропатию, иммуноопосредованные гломерулопатии, IgA нефропатию, болезнь Бергера, волчаночный нефрит, ишемическую нефропатию, ВИЧ-ассоциированную нефропатию, мембранную нефропатию, гломерулонефрит, гломерулосклероз, индуцированную радиоконтрастом нефропатию, токсическую нефропатию, индуцированную анальгетиками нефротоксичность, цисплатиновую нефропатию, трансплантатную нефропатию, гломерулярную аномалию, гломерулярное повреждение, гломерулярное капиллярное повреждение или тубулярный фиброз.
28. Применение по п.19, в котором осложнение почечного нарушения представляет собой заболевание сосудов, макроваскулярные осложнения, микроваскулярные осложнения, сердечно-сосудистые заболевания, артериосклероз, атеросклероз, болезнь коронарных артерий, застойную сердечную недостаточность, инсульт, стенокардию, ишемическую болезнь сердца, инфаркт миокарда, диабетическую дислипидемию, гиперлипидемию, гиперхолестеринемию, гипертриглицеридемию, гиперлипопротеинемию, метаболический синдром, ожирение, анемию, отеки, панкреатит, слабость костей, недостаточное питание и повреждение нервов.
29. Применение по п.19, в котором нефропатия представляет собой апоптоз клеток почки, фиброз, склероз или накопление белков в тубулярных областях.
30. Применение по п.26, в котором почечное нарушение представляет собой фиброз почки.
Текст
ЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯChemistry, 2007, 50(26), pp. 6554-6569 (реферат) [онлайн] Найдено из БД ACS on STN, CA: 148:168473,соединение с RN 1002101-19-0poly(3-n-alkyl-4-oxybenzoate)s". Polymer, 1991, 32(11),pp. 2096-2105 (реферат) [он-лайн] Найдено из БД ACS onJournal of Pharmacy and Pharmacology, 1991, 43(3), pp. 204-206 (реферат) [он-лайн] Найдено из БД ACS on STN,CA: 114:1240576, соединение с RN 134028-01-6[он-лайн] Найдено из БД ACS on STN, CA: 70:88188,соединение с RN 23298-98-8Chemistry (1971), 14(3), 265 (реферат) [он-лайн] Найдено из БД ACS on STN, CA: 74:87558, соединение с RN 30762-15-3sodium n-alkylsalicylates". Applied Microbiology (1971),21(4), 565-8 (реферат) [он-лайн] Найдено из БД ACS on[он-лайн] Найдено из БД ACS on STN, CA: 34:2670,соединение с RN 855470-20-1derivatives of gentisyl alcohol". Helvetica Chimica Acta,1947, 30, pp. 124-39 (реферат) [он-лайн] Найдено из БД ACS on STN, CA: 41:20625, соединение с RN 858251-02-2Chemistry, 2005,48(13), 4312-4331 (реферат) [он-лайн] Найдено из БД ACS on STN, CA: 143:145782, соединения с RN 859828-37-8, 859828-39-0Zeitschrift, 1927, 181, pp. 350-365 (реферат) [он-лайн] Найдено из БД ACS on STN, CA: 21:18844, соединение с RN 860505-06-2BIOCATALYSIS AND BIOTRANSFORMATION, vol. 12,no. 4, 1995, pp. 241-254 (реферат) [он-лайн] Найдено из БД ACS on STN, CA: 143:145782, соединения с RN 934-60-1, RN 4434-13-3, 64362-34-1, 64362-35-2PHARMAZEUTISCHEN GESELLSCHAFT, 1965, vol. 298, no. 6, pp. 342 - 350 (реферат) [он-лайн] Найдено из БД ACS on STN, CA:63:54546, соединения с RN 66909-27-1, 30529-70-5, 3222-51-3, 3222-53-5 Настоящее изобретение относится к замещенным ароматическим соединениям формулы (II) и их фармацевтическим применениям. Конкретные аспекты настоящего изобретения относятся к применению указанных соединений для предупреждения и/или лечения различных заболеваний и состояний у субъектов, включая предупреждение и/или лечение (i) нарушений системы крови,(ii) почечных нарушений, нефропатий или осложнений почечного нарушения; (iii) связанных с воспалением заболеваний и/или (iv) нарушений, связанных с окислительным стрессом. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям и их фармацевтическим применениям. Более конкретно, настоящее изобретение относится к замещенным ароматическим соединениям, к содержащим их композициям и к их применению для предупреждения или лечения различных заболеваний и состояний у пациентов. Предпосылки создания изобретения Нарушения системы крови. Гемопоэз (hema = кровь) относится к процессу формирования, развития и дифференцировки всех типов клеток крови. Все клеточные компоненты крови происходят от гемопоэтических стволовых клеток, включая лейкоциты и эритроциты. Лейкоциты, или белые клетки крови (WBC), представляют собой клетки иммунной системы, защищающие организм как от инфекционного заболевания, так и от инородных веществ. Эритроциты представляют собой безъядерные двояковогнутые дискообразные клетки, содержащие гемоглобин, и указанные клетки необходимы для транспорта кислорода. Уменьшение числа белых клеток крови называют лейкопенией, тогда как анемией называют состояние, существующее при снижении ниже нормы числа эритроцитов, содержания гемоглобина или объема эритроцитарной массы в крови. Заболевания крови и несколько видов лейкопении и анемии могут быть вызваны целым рядом лежащих в основе причин, включая химиотерапию (например, индуцированная химиотерапией анемия) и рак (например, связанная с раком анемия). Поэтому существует потребность в новых композициях и способах стимуляции гемопоэза и устранения нежелательных побочных эффектов миелосупрессии, индуцированной химиотерапией и лучевой терапией. Заболевания почек. Почки представляют собой структурно сложный орган, который эволюционировал для выполнения целого ряда важных функций: выведения конечных продуктов метаболизма, регуляции содержания воды и соли в организме, поддержания должного кислотно-щелочного равновесия и секреции различных гормонов и физиологически активных веществ. Заболевания почки являются такими же сложными, как и структура почек, но их исследование облегчается разделением их по их воздействиям на четыре основных морфологических компонента: клубочки, канальцы, интерстиций и кровеносные сосуды. К сожалению, некоторые нарушения влияют более чем на одну структуру, и анатомическая взаимозависимость структур в почках подразумевает, что повреждение одной почти всегда вторично затрагивает другие. Таким образом, при любом происхождении для всех форм почечного заболевания существует тенденция к разрушению, в конечном счете, всех четырех компонентов почки, оканчивающемуся хронической почечной недостаточностью. Например, при аутоиммунных заболеваниях, таких как сахарный диабет, почки представляют собой первичные мишени, подвергающиеся повреждению тканей или паталогическим изменениям. Нефрэктомия, или удаление почки, процедура, иногда проводящаяся у пациентов с раком почки (например, почечно-клеточная карцинома), может негативно влиять на работу оставшейся почки. Химиотерапия и иммуносупрессивная терапия также представляют собой источник вредного воздействия на почки. Поэтому существует потребность в лекарствах с хорошим профилем безопасности, которые могут быть введены пациентам с заболеванием почек. Также существует потребность в фармацевтических соединениях, которые могут продлевать здоровое функционирование почки или предохранять ее от разрушения до того момента, когда почка не сможет более выполнять свою функцию. Воспаление. Иммуноопосредованное воспалительное заболевание (IMID) относится к любому из группы состояний или заболеваний, при которых отсутствует точно определенная этиология, но которые характеризуются общими воспалительными каскадами реакций, приводящими к воспалению, и которые могут являться результатом нарушения регуляции нормального иммунного ответа, или индуцироваться им. Аутоиммунное заболевание относится к любому из группы заболеваний или нарушений, при которых повреждение тканей ассоциировано с гуморальным и/или клеточно-опосредованным иммунным ответом на компоненты организма или, в более широком смысле, иммунным ответом на самого себя. Современные методы лечения аутоиммунных заболеваний могут быть грубо разделены на две группы: на лекарства, которые ослабляют или подавляют иммунный ответ на самого себя, и на лекарства, которые устраняют симптомы, возникающие в результате хронического воспаления. Подробнее, общепринятые способы лечения аутоиммунных заболеваний (например, первичного артрита) представляют собой (1) нестероидные противовоспалительные лекарства (NSAID), такие как аспирин, ибупрофен, напроксен, этодолак и кетопрофен; (2) кортикостероиды, такие как преднизон и дексаметазон; (3) модифицирующие заболевание противоревматические препараты (DMARD), такие как метотрексат, азатиоприн, циклофосфамид,циклоспорин A, Sandimmune, Neoral и FK506 (такролимус); (4) биологические препараты, такие как рекомбинантные белки Remicade, Enbrel и Humira. Хотя доступно множество способов лечения, общепринятые способы лечения являются необязательно эффективными. Более проблематичной является сопутствующая токсичность, которая часто препятствует длительному применению, необходимому при хроническом заболевании. Поэтому существует потребность в соединениях, которые применимы для лечения заболеваний, связанных с воспалением, включая хроническое и не хроническое аутоиммунное-1 022445 заболевание. Окислительный стресс. Окислительный стресс вызван дисбалансом между производством активных форм кислорода и способностью биологической системы быстро обезвреживать активные промежуточные продукты или легко восстанавливать полученное в результате повреждение. Хотя активные формы кислорода могут быть полезными, поскольку они используются при передаче сигналов в клетке и иммунной системой, они также принимают активное участие во многих заболеваниях. Поэтому все еще существует потребность в соединениях, которые могут способствовать поддержанию должного баланса в содержании активных форм кислорода для предотвращения повреждения клетки или ее компонентов, которое может быть вызвано токсичными эффектами таких активных форм. Настоящее изобретение удовлетворяет указанным потребностям в новых способах лечения, соединениях и фармацевтических композициях. Более того, до настоящего изобретения было неизвестно, что замещенные ароматические соединения, определенные в этом документе, могут являться терапевтически эффективными средствами для предупреждения и/или лечения (i) нарушений системы крови; (ii) почечных нарушений, нефропатии и/или осложнения почечного нарушения; (iii) связанного с воспалением заболевания; и/или (iv) заболевания, связанного с окислительным стрессом. Дополнительные черты настоящего изобретения станут очевидны из обзора описания, фигур и описания настоящего изобретения, представленных ниже. Краткое описание сущности изобретения Настоящее изобретение относится к соединениям, представленным формулой II или их фармацевтически приемлемым солям, гдеQ представляет собой С 1-С 4 алкил, необязательно замещенный одним заместителем Ra;Rc и Rd независимо выбраны из Н или С 1-С 4 алкила. В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим вышеуказанные соединения формулы (II) и фармацевтически приемлемый носитель. В ещ одном аспекте настоящее изобретение относится к применению вышеуказанных соединений формулы (II) для получениения лекарственного средства для предупреждения и/или лечения состояния,выбранного из группы, состоящей из (i) нарушений системы крови, (ii) почечных нарушений, нефропатий и/или осложнений почечного нарушения; (iii) связанных с воспалением заболеваний и (iv) нарушений, связанных с окислительным стрессом. Дополнительные аспекты настоящего изобретения станут очевидны специалисту в данной области техники из последующего описания, из формулы изобретения и обобщений, содержащихся в них. Краткое описание фигур С целью облегчения понимания настоящего изобретения варианты осуществления настоящего изобретения проиллюстрированы посредством примеров в прилагаемых чертежах. Фиг. 1 представляет собой точечный график, показывающий эффект соединения I на общее число клеток костного мозга у мышей в контроле и у мышей, обработанных циклофосфамидом. Фиг. 2 представляет собой точечный график, показывающий эффект соединения I на общее число клеток костного мозга у мышей в контроле и у мышей с иммуносупрессией. Фиг. 3 представляет собой точечный график, показывающий эффект соединения I на продукциюPGE2 у крыс с воспалением, индуцированным LPS. Фиг. 4 представляет собой гистограмму, показывающую эффект соединений I, V и XIII на продукцию NO в клетках RAW264.7, стимулированных LPS/интерфероном. Фиг. 5 представляет собой гистограмму, показывающую эффект соединения I на GFR (выведение креатина) у крыс с 5/6 нефрэктомией. Фиг. 6 представляет собой линейчатый график, показывающий эффект соединения I на выраженное-2 022445 в процентах улучшение GFR у крыс с 5/6 нефрэктомией в течение 190-суточного периода лечения. Фиг. 7 представляет собой линейчатый график, показывающий кардиопротекторный эффект соединения I на кровяное давление у NX крыс. Фиг. 8 представляет собой линейчатый график, показывающий нефропротекторный эффект соединения I на пониженную концентрацию сывороточного альбумина, индуцированную доксорубицином у мышей. Фиг. 9 представляет собой линейчатый график, показывающий нефропротекторный эффект соединения I на повышенную концентрацию сывороточного креатинина, индуцированную доксорубицином у мышей. Фиг. 10 представляет собой гистограмму, показывающую нефропротекторный эффект соединения I на гистологические повреждения почек (канальцев), индуцированные доксорубицином у мышей. Фиг. 11 представляет собой изображения, показывающие гистологические микрофотографии (40) у мышей в контроле и у мышей, обработанных соединением I, в модели индуцированной доксорубицином нефротоксичности. Фиг. 12 представляет собой изображение ауторадиограммы, показывающей эффект соединения I на экспрессию кодирующей CTGF мРНК в почках обработанных доксорубицином мышей. Фиг. 13 представляет собой изображение ауторадиограммы, показывающей эффект соединения I на экспрессию кодирующей TGF- мРНК в почках обработанных доксорубицином мышей. Подробное описание изобретенияA) Общий обзор изобретения. Авторы настоящего изобретения обнаружили соединения, которые обладают полезными фармацевтическими свойствами, в силу чего указанные соединения могут быть эффективны для применения при развитии клеток крови, при защите почек, при воспалительных заболеваниях, при заболеваниях, ассоциированных с высоким кровяным давлением, и против нарушений, связанных с окислительным стрессом.B) Соединения по изобретению. Соединение по настоящему изобретению представлено формулой II или его фармацевтически приемлемлой солью, гдеQ представляет собой С 1-С 4 алкил, необязательно замещенный одним заместителем Ra;Rc и Rd независимо выбраны из Н или С 1-С 4 алкила. Далее представлены варианты осуществления, группы и заместители в соответствии с формулой II,которые описаны выше. В одном из вариантов настоящего изобретения фармацевтически приемлемая соль соединения формулы (II) представляет собой основно-аддитивную соль, и основно-аддитивная соль содержит противоион металла, выбранного из группы, состоящей из натрия, магния, кальция, калия и лития. В наиболее предпочтительном варианте противоион металла представляет собой натрий. В другом варианте настоящего изобретения соединение выбрано из группы, состоящей из В некоторых вариантах осуществления соединение в соответствии с формулой II ограничено фармацевтически приемлемыми солями, а кислая форма соединения исключена из объема настоящего изобретения. В некоторых вариантах осуществления соединения табл. 2 ограничены фармацевтически приемлемыми солями, а кислая форма соединений исключена из объема настоящего изобретения. Используемая в данном документе стрелка , если используется с Су, означает, что Су ковалентно связан с Q, если n равно 1, или ковалентно связан с С(О)ОН, если n равно 0. Подразумевается, что используемый в настоящем документе термин "алкил" включает насыщенные алифатические углеводородные группы как с разветвленной, так и с неразветвленной цепью, содержащей определенное число атомов углерода, например C1-С 6, как в термине С 1-С 6 алкил, определяется как включающий группы, содержащие 1, 2, 3, 4, 5 или 6 атомов углерода в неразветвленной или разветвленной структуре, или, например, С 1-С 4, как в С 1-С 4 алкиле, определяется как включающий группы, содержащие 1, 2, 3 или 4 атома углерода в неразветвленной или разветвленной структуре. Примеры определенного выше алкила включают без ограничения метил, этил, н-пропил, и-пропил, н-бутил, трет-бутил и и-бутил. Подразумевается, что используемый в данном документе термин "алкенил" означает ненасыщенные углеводородные группы с неразветвленной или разветвленной цепью, содержащие определенное число атомов углерода, в которых по меньшей мере два из атомов углерода связаны друг с другом посредством двойной связи, характеризующиеся или Е-, или Z- региохимической конфигурацией и их комбинациями. Например, С 2-С 6, как в термине С 2-С 6 алкенил, определяется как включающий группы, содержащие 2, 3,4, 5 или 6 атомов углерода в неразветвленной или разветвленной структуре, причем по меньшей мере два из атомов углерода являются связанными посредством двойной связи. Примеры алкенила включают этенил (винил), 1-пропенил, 2-пропенил, 1-бутенил и т.п., как проиллюстрировано соединениями II и XI. Подразумевается, что используемый в данном документе термин "алкинил" означает ненасыщен-4 022445 ные углеводородные группы с неразветвленной цепью, содержащие определенное число атомов углерода, в которых по меньшей мере два атома углерода связаны друг с другом посредством тройной связи. Например, С 2-С 6, как в термине С 2-С 6 алкинил, определяется как включающий группы, содержащие 2, 3,4, 5 или 6 атомов углерода в цепи, причем по меньшей мере два из атомов углерода являются связанными посредством тройной связи. Примеры таких алкинилов включают этинил, 1-пропинил, 2-пропинил и т.п. Подразумевается, что используемый в данном документе термин "галоген-" или "атом галогена" означает атом фтора, хлора, брома и йода. Подразумевается, что используемый в данном документе термин "галогеналкил" означает определенный выше алкил, в котором каждый атом водорода может быть последовательно замещен атомом галогена. Примеры галогеналкилов включают без ограничения CH2F, CHF2 и CF3. Подразумевается, что используемый в данном документе термин "необязательно замещенный одним заместителем" означает, что далее описанное событие или ситуации могут иметь место или могут не иметь место и что описание включает случаи, в которых событие или ситуация имеет место, и случаи, в которых этого не происходит. Определение означает от нуля до одного заместителя. Если заместители сами по себе несовместимы со способами синтеза данного изобретения, то заместитель может быть защищен подходящей защитной группой, которая является устойчивой к реакционным условиям, применяемым в этих способах. Защитная группа может быть удалена в подходящей точке последовательности реакции способа с получением желаемого промежуточного химического соединения или целевого соединения. Подходящие защитные группы и способы защиты и снятия защиты с различных заместителей с применением таких подходящих защитных групп хорошо известныспециалистам в данной области техники; их примеры можно найти в Т. Greene and P. Wuts, Protecting Groups in ChemicalSynthesis (3-е изд.), John WileySons, NY (1999), которая включена в данный документ посредством ссылки во всей своей полноте. В некоторых случаях заместитель может быть специально выбран для участия в реакции в реакционных условиях, применяемых в способах по настоящему изобретению. В этих обстоятельствах выбранный заместитель превращается в реакционных условиях в другой заместитель, который или используется в промежуточном химическом соединении в способах по настоящему изобретению, или является желаемым заместителем в требуемом целевом соединении. Соединения по настоящему изобретению или их фармацевтически приемлемые соли могут содержать один или несколько асимметричных центров, хиральных осей и хиральных плоскостей и, таким образом, могут образовывать в результате энантиомеры, диастереомеры и другие стереоизомерные формы и могут быть определены терминами абсолютной стереохимии, такими как (R)- или (S)-, или как (D)или (L)- для аминокислот. Настоящее изобретение подразумевает включение всех таких возможных изомеров, а также их рацемических и оптически чистых форм. Оптически активные (+) и (-), (R)- и (S)- или(D)- и (L)-изомеры могут быть получены с применением хиральных синтонов или хиральных реагентов или разделены с применением традиционных методик, таких как ВЭЖХ с обращенной фазой. Рацемические смеси могут быть получены и впоследствии разделены на отдельные оптические изомеры, или эти оптические изомеры могут быть получены путем хирального синтеза. Энантиомеры могут быть разделены при помощи способов, известных специалистам данной области техники, например путем образования диастереоизомерных солей, которые затем могут быть разделены кристаллизацией, газо-жидкостной или жидкостной хроматографией, селективной реакцией одного энантиомера с энантиомерно специфическим реагентом. Специалистам в данной области техники также будет понятно, что если желаемый энантиомер превращается в другую химическую единицу при помощи методики отделения, то тогда необходима дополнительная стадия для образования желаемой энантиомерной формы. В качестве альтернативы, конкретные энантиомеры могут быть синтезированы асимметрическим синтезом с применением оптически активных реагентов, субстратов, катализаторов или растворителей или путем превращения одного энантиомера в другой асимметрическим преобразованием. Некоторые соединения по настоящему изобретению могут существовать в цвиттерионной форме, и настоящее изобретение включает цвиттерионные формы этих соединений и их смеси. Соли. Используемый в данном документе термин "фармацевтически приемлемая соль" означает основноаддитивные соли. Предполагается, что используемый в данном документе термин "фармацевтически приемлемая основно-аддитивная соль" означает такие соли, которые сохраняют биологическую эффективность и свойства свободных кислот, которые не являются биологически или иным образом нежелательными. Эти соли получают путем добавления неорганического основания или органического основания к свободной кислоте. Соли, полученные из неорганических оснований, включают без ограничения соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п. Соли, полученные из органических оснований, включают без ограничения соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламинная, триметиламинная, диэтиламинная, триэтиламинная, трипропиламинная, этаноламинная, 2-диметиламиноэтанольная, 2-диэтиламиноэтанольная,-5 022445 дициклогексиламинная, лизиновая, аргининовая, гистидиновая, кофеиновая, прокаиновая, гидрабаминная, холиновая, бетаиновая, этилендиаминная, глюкозаминная, метилглюкаминная, теоброминовая, пуриновые, пиперазиновая, пиперидиновая, N-этилпиперидиновая, полиаминная смолы и т.п. Пример фармацевтически приемлемых солей также описан, например, в Berge et al., "PharmaceuticalSalts", J. Pharm. Sci. 66, 1-19 (1977). Фармацевтически приемлемые соли могут быть синтезированы традиционными химическими способами из исходного вещества, которое содержит кислотный фрагмент. Как правило, такие соли получают путем осуществления взаимодействия форм свободной кислоты этих веществ со стехиометрическим количеством соответствующего основания в воде или в органическом растворителе или в их смеси. Соли могут быть получены in situ во время окончательного выделения или очистки средства или путем осуществления отдельного взаимодействия очищенного соединения по настоящему изобретению в его форме свободной кислоты с желаемым соответствующим основанием и путем выделения образованной тем самым соли. Все описанные кислотные, солевые и другие ионные и неионные формы соединений включены как соединения по настоящему изобретению. Например, если соединение представлено в данном документе как кислота, то также включены солевые формы этого соединения. По аналогии, если соединение представлено как соль, то также включены и кислотные формы. С) Способы получения. В общем, все соединения по настоящему изобретению могут быть получены традиционными способами с использованием легкодоступных и/или традиционно получаемых исходных веществ, реагентов и традиционных методик синтеза. Особенный интерес представляет работа Hundertmark, Т.; Littke, A.F.;Buchwald, S.L; Fu, G.С. Org. Lett. 2000, 12, pp. 1729-1731. Авторы настоящего изобретения обнаружили, что для синтеза соединений настоящего изобретения может быть использовано модифицированное сочетание по Соногашира. По существу говоря, реакции сочетания по Соногашира могут быть представлены следующим образом: Как правило, для этой реакции необходимы два катализатора: комплекс палладия с нулевой валентностью и галогенидная соль меди(I). Комплекс палладия активирует органические галогениды, а галогениды меди(I) взаимодействуют с концевым алкином и образуют ацетилид меди(I), который действует в качестве активированных частиц для реакций соединения. Реакционная среда должна быть основной для нейтрализации галогенводорода, получаемого в качестве побочного продукта этой реакции сочетания,поэтому в качестве растворителей иногда применяют соединения алкиламина, такие как триэтиламин и диэтиламин, а также в качестве растворителей могут быть использованы DMF или эфир. В данной модифицированной методике авторы изобретения применяли Pd(II), а применение второго катализатора (галогениды меди(I и алкиламина (триэтиламин) было исключено. Эта методика обеспечивает преимущество практического способа масштабирования получения этих соединений простой обработкой. Используемый в этом документе термин "фармацевтически приемлемый носитель, разбавитель или наполнитель" предназначен для обозначения без ограничения любого адъюванта, носителя, наполнителя,глиданта, подсластителя, разбавителя, консерванта, пигмента/красителя, усилителя вкуса и запаха, поверхностно-активного вещества, увлажнителя, вещества, способствующего диспергированию, вещества,способствующего суспендированию, стабилизатора, изотонического вещества, растворителя, эмульгатора или инкапсулирующего вещества, такого как липосома, циклодекстринов, инкапсулирующих полимерных систем доставки или полиэтиленгликолевых матриц, который является приемлемым для использования у пациента, предпочтительно для людей.D) Фармацевтические применения. Как указано выше в этом документе и представлено на примерах далее в этом документе, соединения по настоящему изобретению обладают полезными фармацевтическими свойствами, и эти соединения могут быть фармацевтически применимы для предупреждения и/или лечения различных заболеваний и состояний у пациента. Предполагаемые авторами изобретения медицинские и фармацевтические применения включают без ограничения применения, которые устраняют нарушения системы крови, почечную недостаточность, связанные с воспалением заболевания и нарушения, связанные с активными формами кислорода. Термин "субъект" включает живые организмы, у которых могут случаться нарушения системы крови, почечная недостаточность, связанные с воспалением заболевания и/или заболевания, связанные с окислительным стрессом, или которые предрасположены к таким состояниям. Термин "субъект" включает животных, таких как млекопитающие или птицы. Предпочтительно субъект представляет собой млекопитающее. Более предпочтительно субъект представляет собой человека. Наиболее предпочтительно субъект представляет собой пациента-человека, нуждающегося в лечении. Используемый в этом документе термин "профилактический" или "предупреждение" предназначен-6 022445 для обозначения, по меньшей мере, уменьшения вероятности риска развития (или предрасположенности к развитию) заболевания или нарушения (т.е. не вызывать по меньшей мере один из клинических симптомов заболевания у пациента, который может быть подвержен или предрасположен к заболеванию, но еще не испытывал или не проявлял симптомы заболевания). Биологические и физиологические параметры для идентификации таких пациентов приведены в этом документе, а также хорошо известны врачам. Термины "обработка" или "лечение" пациента включают наружное применение или введение соединения по настоящему изобретению пациенту (или наружное применение или введение соединения по настоящему изобретению в клетку или ткань пациента) с целью замедлить, стабилизировать, вылечить,исцелить, облегчить, ослабить, преобразовать, ликвидировать, ослабить ухудшение, улучшить, скорректировать или воздействовать на заболевание или состояние, на симптом заболевания или состояния или на риск развития (или предрасположенность к развитию) заболевания или нарушения. Термин "лечение" относится к любому признаку успешности лечения или улучшения повреждения, патологии или состояния, включая любые объективные или субъективные параметры, такие как ослабление; ремиссия; снижение скорости ухудшения; снижение тяжести заболевания; стабилизация, уменьшение числа симптомов или приведение повреждения, патологии или состояния в более приемлемую для пациента форму; замедление скорости дегенерации или ухудшения; обеспечение меньшего истощения в конечной точке деградации или улучшение физического или умственного здоровья пациента. В некоторых вариантах осуществления термин "лечение" может включать увеличение средней продолжительности жизни пациента и/или отсрочку до момента, когда потребуются дополнительные виды лечения (например, диализ или пересадка почки). Нарушения системы крови и гемопоэз. Устранение нарушений системы крови входят в число медицинских и фармацевтических применений, рассматриваемых настоящим изобретением. Термин "нарушение системы крови" относится к любому изменению в нормальной физиологии, строении, пролиферации и/или функционировании эритроцитов, лейкоцитов и/или тромбоцитов. Таким образом, в одном из аспектов настоящее изобретение относится к соединениям и композициям для стимуляции гемопоэза у пациента, предпочтительно нуждающегося в этом пациента-человека. Соответственно, один аспект настоящего изобретения относится к применению соединений, описанных в этом документе, для стимуляции продукции лейкоцитов у пациента и/или для ингибирования снижения количества лейкоцитов (т.е. лейкопении или лейкоцитопении) у пациента. Родственные аспекты включают применение этих соединений для стимуляции иммунной системы пациента или снижения риска инфекции у пациента. В определенном варианте осуществления лейкоциты представляют собой нейтрофильные гранулоциты, и заболевание представляет собой нейтропению. Как известно, низкое число лейкоцитов часто связано с химиотерапией, лучевой терапией, лейкозом, миелофиброзом и апластической анемией. Кроме того, многие обычные лекарственные средства могут вызывать лейкопению(например, миноциклен, часто прописываемый антибиотик). Соответственно, настоящее изобретение также относится к применению соединений, описанных в этом документе, для предупреждения и/или лечения этих конкретных заболеваний или состояний. Для того чтобы определить, оценить и/или подтвердить эффективность способа, соединений и/или композиций по настоящему изобретению могут проводиться серийные измерения. Количественная оценка числа клеток крови, гемопоэза и эритропоэза хорошо известна в данной области техники. Обычно нормальное общее число белых клеток крови у людей находится в пределах от 4300 до 10000 на мм 3 (или мл), со средним значением, принятым за 7000 на 1 мм 3. Нормальное число нейтрофилов в крови человека находится в пределах от 1800 до 7200 на 1 мм 3. Таким образом, лейкопения относится к такому состоянию, при котором число белых клеток крови или лейкоцитов снижено до 5000 на 1 мм 3 или менее. В некоторых вариантах осуществления субъект представляет собой пациента-человека, у которого общее число белых клеток крови составляет приблизительно 8000 на 1 мм 3, или приблизительно 5000 на 1 мм 3, или приблизительно 4000 на 1 мм 3, или ниже чем 3000 на 1 мм 3. В некоторых вариантах осуществления субъект представляет собой пациента-человека, у которого общее число нейтрофильных гранулоцитов составляет приблизительно 5000 на 1 мм 3, или приблизительно 4000 на 1 мм 3, или приблизительно 3000 на 1 мм 3, или приблизительно 2000 на 1 мм 3, или приблизительно 1000 на 1 мм 3. В некоторых вариантах осуществления способы, соединения или композиции по настоящему изобретению являются эффективными для увеличения общего числа белых клеток крови пациента (и/или количества нейтрофильных гранулоцитов), по меньшей мере на 500 на 1 мм 3, по меньшей мере на 1000 на 1 мм 3, или по меньшей мере на 2000 на 1 мм 3 или более. Другой аспект настоящего изобретения относится к применению соединений, описанных в этом документе, для стимуляции продукции эритроцитов (т.е. эритропоэза) у пациента и/или для ингибирования снижения количества эритроцитов (т.е. анемии) у пациента. Родственные аспекты включают применение этих соединений для компенсации избыточной потери крови (например, кровотечения или хронической потери малых объемов), избыточного разрушения клеток крови (например, гемолиза) или недостаточной продукции красных клеток крови (например, неэффективного гемопоэза). Родственные аспекты включают применение этих соединений для дифференцировки клеток крови, включая стимуляцию продукции-7 022445 эритроцитов из эритроидных клеток-предшественниц. Особый интерес для авторов изобретения представляет устранение анемии, связанной с применением химиотерапии или лучевой терапии при лечении рака. Также особый интерес представляет устранение анемии, связанной с терминальной стадией почечной недостаточности, как в случае пациентов, которым для выживания требуется регулярный диализ или пересадка почки. Таким образом, некоторые аспекты настоящего изобретения относятся к соединениям и композициям для стимуляции гемопоэтической системы человека, например, для лечения миелосупрессивных эффектов химиотерапии и/или лучевой терапии и любой другой ситуации, при которой стимуляция гемопоэтической системы может иметь терапевтическое значение, такой как без ограничения анемия. Дополнительные аспекты настоящего изобретения относятся к эффективному способу увеличения эффективности химиотерапии и/или лучевой терапии у пациентов-людей. Способы, соединения и композиции по настоящему изобретению могут быть также применимы для использования увеличивающейся дозы химиотерапевтических композиций,необходимой для достижения лучшего терапевтического эффекта, избегая при этом усиленных побочных эффектов. Дополнительные аспекты относятся к соединениям и композициям по настоящему изобретению для уменьшения или устранения анемии, индуцированной химиотерапией у людей. Обычно у обычных взрослых людей средние значения числа красных клеток (миллионы/мм 3), гемоглобина (г/100 мл) и гематокрита или объема эритроцитарной массы (мл/100 мл) для женщин и мужчин(на уровне моря) составляют 4,80,6 и 5,40,9, 14,02,0 и 16,02,0, 52,05,0 и 47,05,0 соответственно. Анемия относится к состоянию, которое существует, когда присутствует снижение ниже нормы числа эритроцитов, количества гемоглобина или объема эритроцитарной массы в крови, что характеризуется определением гематокрита. В некоторых вариантах осуществления субъект представляет собой пациента-человека с гематокритом от 40 до 30 или приблизительно 40. В некоторых вариантах осуществления способы, соединения и композиции по настоящему изобретению эффективны для замедления снижения или сохранения общего числа красных клеток крови пациента и/или гематокрита. В некоторых вариантах осуществления способы, соединения и композиции по настоящему изобретению эффективны для стабилизации гематокрита пациента и/или увеличения гематокрита приблизительно на 5, или приблизительно на 10, или насколько это необходимо для достижения нормального значения. В некоторых вариантах осуществления способы, соединения и композиции по настоящему изобретению эффективны для уменьшения необходимости трансфузии(ий) крови. Защита почек. В некоторых аспектах настоящее изобретение относится к соединениям и композициям для предупреждения и/или лечения почечного нарушения у нуждающегося в этом пациента. Термины "почечное нарушение", "болезнь почек" или "заболевание почек" означают любое изменение в нормальной физиологии и функционировании почки. Это может являться результатом широкого спектра острых и хронических состояний и событий, включая физическое, химическое или биологическое повреждение, инсульт, травму или заболевание, такие как, например, нефрэктомия, химиотерапия, артериальная гипертензия, сахарный диабет, застойная сердечная недостаточность, волчанка, серповидно-клеточная анемия и различные воспаления, инфекции и аутоиммунные заболевания, ВИЧ-ассоциированные нефропатии и тому подобное. Этот термин включает без ограничения заболевания и состояния, такие как трансплантат почки, нефропатию; хроническую почечную недостаточность (CKD); гломерулонефрит; наследственные заболевания, такие как поликистоз почек; нефромегалию (чрезмерная гипертрофия одной или обеих почек); нефротический синдром; терминальную стадию почечной недостаточности (ESRD); острую и хроническую почечную недостаточность; заболевание интерстиция; нефрит; склероз, уплотнение или склерозирование тканей и/или сосудов в результате причин, которые включают, например, воспаление в связи с заболеванием или повреждением; фиброз почки и рубцевание; почечно-ассоциированные пролиферативные заболевания; и другие первичные или вторичные патологические состояния. Также включают фиброз, ассоциированный с диализом, сопровождающим почечную недостаточность, и постановкой катетера, например перитонеальный фиброз и фиброз сосудистого доступа. В некоторых вариантах осуществления настоящее изобретение более конкретно относится к соединениям и композициям для защиты почек. Используемый в этом документе термин "защита почек" относится к процессу, посредством которого скорость прогрессирования заболевания в почке замедляется или останавливается, и таким образом почка оказывается, соответственно, защищенной. В предпочтительных вариантах осуществления (например, лекарственная защита почек) соединения формулы I вводятся перед, во время или после введения цитотоксического средства или противовоспалительного или иммуносупрессивного лекарства. Термин "цитотоксическое средство" относится к средству, которое убивает клетки с высокой пролиферации; например клетки опухолей, инфицированные вирусами клетки, или гемопоэтические клетки. Примеры цитотоксического средства включают, без ограничения, циклофосфамид, доксорубицин,даунорубицин, винбластин, винкристин, блеомицин, этопозид, топотекан, иринотекан, таксотер, таксол,5-фторурацил, метотрексат, гемцитабин, цисплатин, карбоплатин или хлорамбуцил и агонист любого из вышеперечисленных соединений. Цитотоксическое средство также может представлять собой противовирусное средство, например AZT (т.е. 3'-азидо-3'-деокситимидин) или 3 ТС/ламивудин (т.е. 3 триацитидин). Такие лекарства могут индуцировать анемию у млекопитающих, включая пациента-8 022445 человека. В некоторых вариантах осуществления защита почек относится к обеспечению защиты млекопитающего от токсических эффектов, возникающих в результате лечения млекопитающего химиотерапевтическими средствами. Например, соединения формулы I могут быть использованы для защиты млекопитающего или способствования его выздоровлению от токсических эффектов, вызванных лечением химиотерапевтическими средствами. В некоторых вариантах осуществления почечное нарушение или заболевание почки могут быть в общем смысле определены как "нефропатия" или "нефропатии". Термины "нефропатия" или "нефропатии" охватывают все клинико-патологические изменения в почке, которые могут привести к фиброзу почки и/или гломерулярным заболеваниям (например, гломерулосклероз, гломерулонефрит) и/или хронической почечной недостаточности и которые могут привести к терминальной стадии болезни почек и/или почечной недостаточности. Некоторые аспекты настоящего изобретения относятся к композициям и их применению для предупреждения и/или лечения гипертензивной нефропатии, диабетической нефропатии и других типов нефропатии, таких как аналгезирующая нефропатия, иммуноопосредованные гломерулопатии (например, IgA нефропатия или болезнь Бергера, волчаночный нефрит), ишемическая нефропатия, ВИЧ-ассоциированная нефропатия, мембранная нефропатия, гломерулонефрит, гломерулосклероз, индуцированная радиоконтрастом нефропатия, токсическая нефропатия, индуцированная анальгетиками нефротоксичность, цисплатиновая нефропатия, трансплантатная нефропатия и другие формы гломерулярных аномалий или повреждений; гломерулярное капиллярное повреждение (тубулярный фиброз). В некоторых вариантах осуществления термины "нефропатия" или "нефропатии" относятся конкретно к нарушению или заболеванию, при котором у пациента наблюдается как наличие белков в моче (т.е. протеинурия), так и наличие почечной недостаточности. Настоящее изобретение также относится к соединениям и композициям для предупреждения и/или лечения осложнения почечного нарушения. Термин "осложнение почечного нарушения" относится к вторичному состоянию, связанному с почечным нарушением, общим состоянием здоровья, осложнением или негативной реакцией, возникающей в течение развития почечного нарушения, которое может стать более тяжелым. Термин "осложнение почечного нарушения" обычно связан с нарастающей тяжестью почечного нарушения у субъектов, страдающих от симптомов или патологических изменений, которые могут распространяться по всему организму или отрицательно сказываться на других системах органов. Используемый в этом документе термин "осложнение почечного нарушения" охватывает без ограничения заболевания сосудов (например, макроваскулярные осложнения, микроваскулярные осложнения и т.д.), сердечно-сосудистые заболевания (например, артериосклероз, атеросклероз, болезнь коронарных артерий, застойная сердечная недостаточность, инсульт, стенокардия, ишемическая болезнь сердца, инфаркт миокарда и т.д.), диабетическую дислипидемию, гиперлипидемию (например, гиперхолестеринемия, гипертриглицеридемия, гиперлипопротеинемия), метаболический синдром, ожирение, анемию, отеки, панкреатит, слабость костей, недостаточное питание и повреждение нервов. В соответствии с некоторыми вариантами осуществления настоящее изобретение относится к соединениям и композициям для предупреждения или лечения характерных аспектов или симптомов нефропатии, включая гломерулосклероз, изменение сосудистой структуры почки и тубулоинтерстициальное заболевание. Среди характерных аспектов нефропатии, рассмотренных в настоящем изобретении, является профилактика апоптоза клеток почки, фиброза, склероза и/или накопление белков в тубулярных областях. Таким образом, в некоторых аспектах настоящее изобретение относится к способу профилактики апоптоза клеток почки, фиброза, склероза и/или накоплению белков в тубулярных областях. Родственные аспекты относятся к применению соединений и фармацевтических композиций, определенных в этом документе, для снижения экспрессии кодирующей CTGF мРНК и/или экспрессии кодирующейTGF- мРНК в клетках почек. В некоторых вариантах осуществления субъект может страдать заболеванием, таким как, например,сахарный диабет, прогрессирующая болезнь почек и фиброзная болезнь почек, и/или любым из болезней почек, почечных нарушений или осложнений почечного нарушения, описанных в этом документе. В некоторых вариантах осуществления субъект представляет собой пациента-человека с имеющимися проблемами с клубочковой фильтрацией (или с предрасположенностью к ним) и/или с почечной недостаточностью. В некоторых вариантах осуществления субъект представляет собой пациента-человека, который получает или получил лечение в виде химиотерапии или лучевой терапии. Соответственно, родственные аспекты относятся к применению соединения или фармацевтической композиции, определенных в этом документе, для защиты почек от химиотерапевтических средств, включая, без ограничения, доксорубицин, даунорубицин, винбластин, винкристин, блеомицин, таксол, 5-фторурацил, метотрексат,гемцитабин, цисплатин, карбоплатин и хлорамбуцил. Способы по настоящему изобретению могут включать введение пациенту, например нуждающемуся в этом пациенту-человеку, профилактически или терапевтически эффективного количества соединения или фармацевтической композиции, определенных в этом документе. Для того чтобы определить, оценить и/или подтвердить эффективность способа, соединений и/или композиций по настоящему изобретению, могут проводиться серийные измерения. Количественная оценка функции почек и параметров почечной дисфункции хорошо известна в данной области техники и-9 022445 может быть найдена, например, у Levey (Am. J. Kidney Dis. 1993, 22(1):207-214). Примерами методов анализа для определения почечной функции/дисфункции являются уровень креатинина сыворотки крови; скорость выведения креатинина; скорость выведения цистатина С, суточное выведение креатинина в моче, суточная секреция белка в моче; скорость клубочковой фильтрации (GFR); соотношение альбумин/креатинин в моче (ACR); скорость выведения альбумина (AER) и биопсия почки. Соответственно, в некоторых аспектах настоящее изобретение относится к способу увеличения выведения креатинина, к способу увеличения секреции инсулина и/или увеличения чувствительности к инсулину, к способу снижения инсулиновой резистентности путем введения соединения формулы I нуждающемуся в этом пациенту. В некоторых вариантах осуществления у пациента имеется риск нефропатии, или она уже диагностирована. Обычно нормальная скорость клубочковой фильтрации (GFR) у человека составляет приблизительно от 100 приблизительно до 140 мл/мин. В некоторых вариантах осуществления субъект представляет собой пациента-человека с прогрессирующей нефропатией (т.е. GFR менее 75 мл/мин). В некоторых вариантах осуществления субъект представляет собой пациента-человека с ESRD (т.е. GFR менее чем 10 мл/мин). В некоторых вариантах осуществления способы, соединения или композиции по настоящему изобретению эффективны для увеличения значения GFR у пациентов по меньшей мере на 1, 5,10, 15, 20, 25 мл/мин или более. В некоторых вариантах осуществления у пациента имеется риск заболевания почек, или оно уже диагностировано. В различных вариантах осуществления субъект представляет собой пациента-человека с заболеванием почек на I стадии, II стадии, III стадии, IV стадии или V стадии либо прогрессирующим к ним. В некоторых вариантах осуществления способы, соединения или композиции по настоящему изобретению эффективны для стабилизации или улучшения болезни почек пациента (например, от стадии V к стадии IV, или от стадии IV к стадии III, или от стадии III к стадии II, или от стадии II к стадии I). Одним из первых клинических признаков нефропатии является наличие альбуминурии или протеинурии. К микроальбуминурии относят состояние, когда количество альбумина в моче меньше или равно 300 мг/сутки, и к протеинурии, когда общее количество белка в моче превышает 1 г/сутки. В соответствии с некоторыми аспектами настоящее изобретение относится к способу профилактики или снижения протеинурии путем введения нуждающемуся в этом пациенту соединения формулы I. В некоторых вариантах осуществления у пациента имеется риск протеинурии, или она уже диагностирована. В некоторых вариантах осуществления субъект представляет собой пациента-человека, у которого продуцируется приблизительно менее чем 300 мг/сутки белка в моче. В некоторых вариантах осуществления субъект представляет собой пациента-человека, у которого продуцируется приблизительно более чем 1 г/сутки белка в моче. В некоторых вариантах осуществления субъект представляет собой пациента-человека с микроальбуминурией. В некоторых вариантах осуществления субъект представляет собой пациентачеловека с содержанием альбумина в моче свыше 200 мкг/мин. В некоторых вариантах осуществления способы, соединения или композиции по настоящему изобретению эффективны для снижения альбуминурии у пациента по меньшей мере на 10, 25, 50, 75, 100, 150, 200 мкг/мин или более. Эффективность соединений и композиций по настоящему изобретению может быть определена по снижению нежелательных симптомов. Такое снижение может быть определено, например, посредством улучшения функции почек по сравнению с функцией до лечения. Такое восстановление может быть выражено в отсрочке начала почечной недостаточности (включая диализ и пересадку) или в уменьшении скорости ухудшения функции почек, определенной, например, путем замедления скорости нарастания протеинурии или замедления скорости нарастания креатинина в сыворотке крови или путем уменьшения параметра выведения креатинина или GFR, или снижения процента госпитализации или смертности. Воспаление. Другой аспект настоящего изобретения относится к использованию соединений по настоящему изобретению для предупреждения и/или лечения связанных с воспалением заболеваний. Термин "связанное с воспалением заболевание" относится ко всем без исключения аномалиям, ассоциированным с воспалением, включая хронические и острые воспалительные заболевания, включая, без ограничения,иммуноопосредованные воспалительные заболевания (IMID) и аутоиммунные заболевания, артрит, ITP,гломерулонефрит, васкулит, псориатический артрит, системную красную волчанку (SLE), идиопатическую тромбоцитопеническую пурпуру (ITP), псориаз, болезнь Крона, воспалительное заболевание кишечника, анкилозирующий спондилоартрит, синдром Шегрена, болезнь Стилла (гематофагоцитарный синдром), увеит, склеродермию, миозит, синдром Рейтера и синдром Вегенера. В целом, профилактическое и терапевтическое применение охватывает введение соединения, как описано в этом документе,пациенту, предпочтительно пациенту-человеку, нуждающемуся в этом. Соединения по настоящему изобретению могут быть введены вместе с любыми общепринятыми средствами, более конкретно, включая современные средства, определенные ранее в этом документе в разделе "Предпосылки создания изобретения". Для того чтобы определить, оценить и/или подтвердить эффективность способа, соединений и/или композиций по настоящему изобретению могут проводиться серийные измерения. Количественные способы и методики оценки воспаления хорошо известны в данной области техники и включают,например, способы, аналогичные представленным в разделе "Примеры".- 10022445 Дополнительно или в качестве альтернативы, соединения по настоящему изобретению могут ингибировать продукцию простагландинов, включая без ограничения PGE2, и тем самым могут быть применимы для снижения жара, боли, ригидности и отека. Окислительный стресс. Другой аспект настоящего изобретения относится к соединениям и композициям по настоящему изобретению для предупреждения и/или лечения нарушений, связанных с окислительным стрессом. Термин "нарушения, связанные с окислительным стрессом" относится к любому заболеванию, при котором существует дисбаланс между продукцией активных форм кислорода и способностью биологической системы легко нейтрализовать реакционноспособные промежуточные продукты или легко восстанавливать вызванное повреждение. Примеры таких заболеваний включают без ограничения сердечнососудистые заболевания, рак, сахарный диабет, артрит, атеросклероз, болезнь Паркинсона, сердечную недостаточность, инфаркт миокарда, болезнь Альцгеймера, синдром хронической усталости и аутоиммунные заболевания. В целом, профилактическое и терапевтическое применение охватывает введение соединения, как описано в этом документе, пациенту, предпочтительно пациенту-человеку, нуждающемуся в этом. В некоторых вариантах осуществления у пациента имеется риск определенного выше в этом документе нарушения, связанного с окислительным стрессом, или оно уже диагностировано. Родственный аспект по настоящему изобретению относится к соединениям и композициям для поддержания адекватного баланса уровней активных форм кислорода, и более конкретно оксида азота(NO), с целью предотвращения повреждения клетки или ее компонентов. Дополнительный родственный аспект относится к соединениям и композициям для предотвращения повреждения клетки или ее компонентов (включая без ограничения белки, липиды и ДНК), которое может быть вызвано активными формами, и более конкретно NO. Еще один аспект по настоящему изобретению относится к применению соединений и композиций по настоящему изобретению для ингибирования продукции NO и/или для ингибирования фермента синтазы оксида азота. Эти применения включают приведение клетки, компонента или фермента в контакт с определенным в этом документе соединением и/или композицией. Количественные способы и методики оценки содержания активных форм кислорода in vitro и in vivo хорошо известны в данной области техники. В целом, профилактическое и терапевтическое применения охватывают введение описанного в этом документе соединения пациенту, предпочтительно пациенту-человеку, нуждающемуся в этом. Е) Фармацевтические композиции и составы. Родственный аспект настоящего изобретения относится к фармацевтическим композициям, содержащим одно или несколько соединений по настоящему изобретению, описанных в этом документе. Как указано выше в этом документе, соединения по настоящему изобретению могут быть применимы (i) для предупреждения и/или лечения нарушений системы крови (например, посредством стимуляции гемопоэза); (ii) для предупреждения и/или лечения почечного нарушения, нефропатии и/или осложнения почечного нарушения; (iii) для предупреждения и/или лечения связанного с воспалением заболевания (например, аутоиммунное заболевание) и/или (iv) для предупреждения и/или лечения нарушения, связанного с окислительным стрессом. Используемый в этом документе термин "терапевтически эффективное количество" означает такое количество соединения, которое при введении пациенту для лечения или предупреждения конкретного нарушения, заболевания или состояния, является достаточным для получения результата такого лечения или предупреждения такого нарушения, заболевания или состояния. Дозировки и терапевтически эффективные количества могут варьировать, например, в зависимости от ряда факторов, включая активность конкретно используемого средства, возраст, вес тела, общее состояние здоровья, пол и рацион питания пациента, время введения, путь введения, скорость выведения и любое сочетание лекарств, если оно применимо, эффект, который практикующий врач желает получить от соединения у пациента, и свойства соединений (например, биодоступность, стабильность, активность, токсичность и т.д.), и конкретное(ые) нарушение(я), от которого(ых) страдает субъект. Кроме того, терапевтически эффективное количество может зависеть от показателей крови пациента (например, липидный профиль, уровни инсулина, гликемия), тяжести течения заболевания, функционирования органов, или основного заболевания или осложнений. Такие приемлемые дозы могут быть определены с использованием любых доступных методов анализа, включая методы анализа, описанные в этом документе. Если людям подлежит вводить одно или несколько из соединений по настоящему изобретению, то сначала терапевт может, например, прописать относительно низкую дозу, последовательно увеличивая дозу до получения подходящего ответа. Используемый в этом документе термин "фармацевтическая композиция" относится к наличию по меньшей мере одного соединения по настоящему изобретению, соответствующего формуле II, определенной в этом документе, и по меньшей мере одной фармацевтически приемлемой основы. Примеры типичных соединений по настоящему изобретению включают соединения, представленные в табл. 2, и их фармацевтически приемлемые соли. Термин "фармацевтически приемлемая основа" относится к разбавителю, адъюванту, наполнителю или носителю, вместе с которым вводится соединение. Термин "фармацевтически приемлемый" относит- 11022445 ся к препаратам, лекарственным средствам, инертным ингредиентам и т.д., которые являются подходящими для использования в контакте с тканями человека и низших животных без проявления чрезмерной токсичности, несовместимости, нестабильности, раздражения, аллергической реакции и т.д., соразмерно с приемлемым соотношением польза/риск. Термин предпочтительно относится к соединению или композиции, которая является разрешенной или одобренной регулирующим органом Федерального правительства или правительства штата или входит в список Фармакопеи США или другой общеизвестной фармакопеи для примененияна животных и, более предпочтительно, на человеке. Фармацевтически приемлемая основа может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их приемлемые смеси и растительные масла. Дополнительные примеры фармацевтически приемлемых основ включают. без ограничения, воду для инъекций USP; водные основы, такие как, без ограничения, инъекционный раствор хлорида натрия, инъекционный раствор Рингера, инъекционный раствор декстрозы,инъекционный раствор декстрозы и хлорида натрия и инъекционный раствор Рингера с лактатом; водорастворимые основы, такие как без ограничения этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные основы, такие как, без ограничения, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. Профилактика действия микроорганизмов может быть достигнута путем добавления антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и тому подобных. Во многих случаях в композицию включают изотонические средства, например сахара, хлорид натрия или полиспирты, такие как маннит и сорбит. Пролонгированная абсорбция инъекционных композиций может быть осуществлена путем включения в композицию средства, которое задерживает абсорбцию, например моностеарата алюминия или желатина. В некоторых вариантах осуществления композиции по настоящему изобретению включают эффективное количество соединения формулы II, описанной выше в этом документе. Особенно предпочтительными являются натриевые соли 3-пентилфенилуксусной кислоты, 3-гидрокси-5-пентилфенилуксусной кислоты и 3-гексилбензойной кислоты. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтическим композициям для предупреждения и/или лечения нарушений системы крови, которые содержат одно или несколько соединений формулы II, определенной в этом документе. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтическим композициям для предупреждения и/или лечения почечного нарушения, нефропатии и/или осложнения почечного нарушения, причем композиция содержит одно или несколько соединений формулы II, определенной в этом документе. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтическим композициям для предупреждения и/или лечения связанного с воспалением заболевания, причем композиция содержит одно или несколько соединений формулы II, определенной в этом документе. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтическим композициям для предупреждения, замедления и/или лечения нарушения, связанного с окислительным стрессом, причем композиция содержит одно или несколько соединений формулы II, определенной в этом документе. Перед введением соединения по настоящему изобретению могут быть включены в состав фармацевтических композиций с использованием доступных методик и процедур. К примеру, фармацевтические композиции могут быть составлены таким образом, чтобы они были приемлемы для введения пероральным, внутривенным (в/в), внутримышечным (в/м) путями, в виде внутримышечного депо, подкожным (п/к) путем, в виде подкожного депо, сублингвальным, интраназальным, интратекальным, местным или ректальным путями. Предпочтительно соединение(я) по настоящему изобретению может(гут) быть введено(ны) перорально. Лекарственные формы могут быть удобно представлены в виде стандартной лекарственной формы и могут быть приготовлены посредством любыми способами, хорошо известными в области фармацевтики. Способы приготовления указанных лекарственных форм или композиций включают этап приведения соединения по настоящему изобретению в контакт с фармацевтически приемлемой основой (например, с инертным разбавителем или усваиваемым пищевым носителем) и, необязательно, с одним или несколькими дополнительными ингредиентами. В целом, лекарственные формы приготавливают посредством равномерного и тщательного приведения соединения по настоящему изобретению в контакт с жидкими носителями, или с мелкодисперсными твердыми носителями, или с обоими и далее, при необходимости, формования конечного продукта. Количество терапевтического средства в таких терапевтически применимых композициях таково, что достигается приемлемая дозировка. Лекарственные формы по настоящему изобретению, применимые для перорального введения, могут принимать форму капсул (например, желатиновая капсула с твердой или мягкой оболочкой), крахмальных капсул, пилюль, таблеток, рассасываемых таблеток, порошков, гранул, пеллетов, драже, например, с покрытием (например, покрытые кишечнорастворимой оболочкой), или без покрытия, или в виде раствора или суспензии в водных или неводных жидкостях, или в виде жидких эмульсий типа "масло-в- 12022445 воде" или "вода-в-масле", или в виде эликсира или сиропа, или в виде пастилок, или в виде жидкости для полоскания рта и т.п., причем каждая форма содержит предопределенное количество соединения по настоящему изобретению в качестве активного ингредиента. Соединение по настоящему изобретению также может быть введено в виде болюса, электуария или пасты или напрямую введено в рацион питания пациента. Кроме того, в конкретных вариантах осуществления указанные пеллеты могут быть составлены для (а) обеспечения мгновенного или быстрого высвобождения лекарственного средства (т.е. не содержать покрытия на них); (b) наличия покровного вещества, например, для обеспечения непрерывного высвобождения лекарственного средства в течение длительного времени или (с) наличия покровного вещества с кишечнорастворимой оболочкой для лучшей желудочно-кишечной переносимости. Нанесение покрытия может быть осуществлено посредством общепринятых способов, обычно покрытиями,зависящими от рН или времени, так, чтобы соединение(я) по настоящему изобретению высвобождалось(лись) приблизительно в желаемой области или неоднократно для продления желаемого действия. Такие лекарственные формы обычно включают, без ограничения, одно или несколько из ацетатфталата целлюлозы, поливинилацетатфталата, фталата гидроксипропилметилцеллюлозы, этилеллюлозы, воска и шеллака. В твердых лекарственных формах для перорального введения соединение по настоящему изобретению может быть смешано с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальция фосфат, или с любым из следующего: начинки или разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит или кремниевая кислота; связующие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза или камедь; увлажнители, такие как глицерин; разрыхлители, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; замедлители растворения, такие как парафин; усилители всасывания, такие как соединения четвертичного аммония; увлажнители, такие как, например, цетиловый спирт и глицеролмоностеарат; абсорбенты, такие как каолин и бентонитовая глина; смазки, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и красители. В случае капсул, таблеток и пилюль фармацевтические композиции также могут содержать буферные вещества. Твердые композиции аналогичного типа также могут быть использованы в качестве начинки в мягких и твердых желатиновых капсулах, с использованием таких наполнителей, как лактоза или молочные сахара, а также высокомолекулярные полиэтиленгликоли и тому подобное. Пероральные композиции обычно включают жидкие растворы, эмульсии, суспензии и т.п. Фармацевтически приемлемые основы, подходящие для составления таких композиций, хорошо известны в данной области техники. Стандартные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. Для суспензии стандартные вещества для суспендирования включают метилцеллюлозу, карбоксиметилцеллюлозу натрия, трагакант и альгинат натрия; стандартные увлажнители включают лецитин и полисорбат 80; и стандартные консерванты включают метилпарабен и бензоат натрия. Пероральные жидкие композиции также могут содержать один или несколько компонентов, таких как подсластители,вкусоароматизаторы и красители, раскрытые выше. Фармацевтические композиции, приемлемые для инъекционного применения, могут содержать стерильные водные растворы (если водорастворимые) или коллоидные растворы и стерильные порошки для немедленного приготовления стерильных инъекционных растворов или дисперсий. В любых случаях композиция должна быть стерильной и должна быть жидкой до такой степени, чтобы введение было легким. Она должна быть стабильной в условиях приготовления и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Стерильные инъекционные растворы могут быть приготовлены посредством включения терапевтического средства в необходимое количество приемлемого раствора с одним или несколькими перечисленными выше ингредиентами, при необходимости, с последующей стерилизацией фильтрованием. Как правило, коллоидные растворы приготавливают путем включения терапевтического средства в стерильную основу, которая содержит основную коллоидную среду и другие необходимые ингредиенты из числа перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов способы приготовления представляют собой вакуумную сушку и лиофилизацию, при которых получают порошок активного ингредиента (т.е. терапевтического средства) плюс любого дополнительного желаемого ингредиента из их стерильного предварительно отфильтрованного раствора. Также предоставляются фармацевтические лекарственные формы, которые приемлемы для введения в виде аэрозоля путем ингаляции. Указанные лекарственные формы включают раствор или суспензию желаемого соединения любой представленной в этом документе формулы или множество твердых частиц такого(их) соединения(ий). Например, соли металлов соединений по настоящему изобретению,но не формы свободных кислот указанных соединений, предположительно обладают физикохимическими свойствами, подходящими для приготовления высокодисперсных частиц активного фармацевтического ингредиента (API) для введения путем ингаляции. Желаемая лекарственная форма может быть помещена в маленькую емкость и распылена. Распыление может быть осуществлено посредст- 13022445 вом сжатого воздуха или посредством ультразвуковой энергии для образования множества жидких капель или твердых частиц, содержащих средства или соли. Жидкие капли или твердые частицы должны иметь размеры в пределах приблизительно от 0,5 приблизительно до 5 мкм. Твердые частицы могут быть получены посредством обработки твердого вещества любой формулы, описанной в этом документе, или его соли, любым приемлемым способом, известным в данной области техники, таким как микронизация. Размер твердых частиц или капель может составлять, например, приблизительно от 1 приблизительно до 2 мкм. В этой связи коммерческие небулайзеры пригодны для достижения этой цели. Фармацевтические лекарственные формы, подходящие для введения в виде аэрозоля, могут принимать форму жидкости, и лекарственная форма будет включать водорастворимое средство любой формулы, описанной в этом документе, или его соль в носителе, который содержит воду. Может содержаться поверхностно-активное вещество, которое при распылении снижает поверхностное натяжение лекарственной формы настолько,чтобы привести к формированию капель в пределах желаемого размера. Композиции по настоящему изобретению также могут быть введены пациенту местно, например,посредством прямого нанесения или распыления композиции на эпидермальные или эпителиальные ткани пациента или чрескожно посредством "пластыря". Такие композиции включают, например, лосьоны,крема, растворы, гели и сухие вещества. Указанные местные композиции могут включать эффективное количество, обычно по меньшей мере приблизительно 0,1% или даже приблизительно от 1% приблизительно до 5% соединения по настоящему изобретению. Подходящие носители для местного введения обычно остаются на участке кожи в виде сплошной пленки и препятствуют ее удалению путем испарения или погружения в воду. В целом, носитель является органическим по своему характеру и способен содержать в себе диспергированное или растворенное терапевтическое средство. Носитель может включать фармацевтически приемлемые смягчители, эмульгаторы, загустители, растворители и т.п. Другие композиции, применимые для достижения системной доставки рассматриваемых веществ,могут включать сублингвальные, буккальные и назальные лекарственные формы. Такие композиции обычно включают одно или несколько растворимых веществ-наполнителей, таких как сахароза, сорбит или манит, и связующие вещества, такие как акация, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены регуляторы сыпучести,смазки, подсластители, красители, антиоксиданты и вкусоароматизаторы, раскрытые выше. Соединение(я) по настоящему изобретению может(гут) быть введено(ны) парентерально, интраперитонеально, интраспинально или интрацеребрально. Для таких композиций соединение(я) по настоящему изобретению может(гут) быть приготовлено(ны) в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В стандартных условиях хранения и применения эти препараты могут содержать консервант для предотвращения роста микроорганизмов.F) Наборы. Соединение(я) по настоящему изобретению может(гут) быть оформлены как часть набора, необязательно включающего контейнер (например, упаковка, коробка, ампула и т.п.). Набор может быть коммерчески используемым в соответствии со способами, описанными в этом документе, и может содержать инструкции по применению способа по настоящему изобретению. Дополнительные компоненты набора могут включать кислоты, основания, буферные вещества, неорганические соли, растворители, антиоксиданты, консерванты или хелаторы металлов. Дополнительные компоненты набора присутствуют в виде чистых композиций или в виде водных или органических растворов, включающих один или несколько дополнительных компонентов комплекта. Любой или каждый из компонентов набора необязательно дополнительно содержит буферы. Соединение(я) по настоящему изобретению может(гут) быть введено(ы) или не введено(ы) пациенту в одно и то же время или посредством того же пути введения. Кроме того, способы по настоящему изобретению охватывают наборы, которые при применении врачом-терапевтом могут упростить введение пациенту подходящих количеств двух или нескольких активных ингредиентов. Наборы по настоящему изобретению могут дополнительно содержать устройства, применяемые для введения активных ингредиентов. Примеры таких устройств включают без ограничения шприцы, капельницы, пластыри, ингаляторы, спринцовки и дозаторы для введения лекарственных форм в виде суппозиториев. Комплекты по настоящему изобретению могут дополнительно содержать фармацевтически приемлемые основы, которые могут применяться для введения одного или нескольких активных ингредиентов. Например, если активный ингредиент представлен в твердой форме, которая должна быть преобразована для парентерального ведения, то комплект может включать герметичный контейнер с приемлемой основой, в которой активный ингредиент может быть растворен с образованием однородного стерильного раствора, подходящего для парентерального введения. Примеры фармацевтически приемлемых основ представлены выше в этом документе. Заголовки включены в этот документ для ссылки и с целью облегчения поиска определенных разделов. Эти заголовки не предназначены для ограничения объема понятий, описанных под ними, и эти понятия могут быть применимы и в других разделах по всему описанию. Таким образом, не подразумевается ограничение настоящего изобретения вариантами осуществления, представленными в этом доку- 14022445 менте, но ему должен быть предоставлен наиболее широкий объем в соответствии с принципами и новыми признаками, раскрытыми в этом документе. Формы единственного числа включают соответствующие ссылки во множественном числе, кроме случаев, если в контексте иное не указано особо. Если иное не указано особо, то все используемые в описании и формуле изобретения числа, выражающие количества ингредиентов, реакционные условия, концентрации, свойства и т.д., следует понимать как модифицированные во всех случаях термином "приблизительно". В крайнем случае, каждый числовой параметр, по меньшей мере, должен быть интерпретирован в свете числа изложенных значащих цифр и путем применения обычных методов округления. Соответственно, если не указано обратное,то числовые параметры, изложенные в настоящем описании и приложенной формуле изобретения, представляют собой приблизительные величины, которые могут изменяться в зависимости от свойств, намеченных к достижению. Несмотря на то, что числовые диапазоны и параметры, отражающие широкий объем вариантов осуществления, являются приблизительными, числовые значения, изложенные в конкретных примерах, представлены как можно точнее. Однако любое числовое значение, по существу, содержат некоторые ошибки, возникающие в результате вариаций в экспериментах, измерениях при испытаниях, статистических анализах и т.п. Специалисты в данной области техники определят или смогут установить путем проведения всего лишь обычных экспериментов многочисленные эквиваленты конкретных методик, вариантов осуществления, формулы изобретения и примеров, описанных в этом документе. Считается, что такие эквиваленты подпадают под объем настоящего изобретения и охватываются формулой изобретения, приложенной к этому документу. Настоящее изобретение далее проиллюстрировано следующими примерами, которые не должны истолковываться как дополнительно ограничивающие. Примеры В примерах, приведенных ниже в этом документе, представлены типичные способы получения некоторых типичных соединений, охватываемых общей формулой I. В некоторых примерах представлены типичные применения некоторых типичных соединений по настоящему изобретению. Также представлены типичные методы анализа соединений по настоящему изобретению для оценки эффективности invitro и in vivo. Пример 1. Подробные экспериментальные методики получения натриевой соли 3-пентилфенилуксусной кислоты (здесь и далее в этом документе соединение I). Оборудование. Все ВЭЖХ-хроматограммы и масс-спектры регистрировали на приборе HP 1100 LC-MS Agilent с использованием аналитической колонки С 18 (2504,6 мм, 5 мкм) с использованием в течение 5 мин градиента 15-99% CH3CN/H2O+0,01% TFA в качестве элюента со скоростью потока 2 мл/мин. Соединение I. Синтез с использованием модифицированной методики по Соногашира Стадия 1. К раствору/суспензии 3-бромфенилуксусной кислоты (5,02 г, 23,33 ммоль) в этаноле (100 мл) при комнатной температуре добавляли концентрированную серную кислоту (1 мл). Бесцветное твердое вещество затем перемешивали в течение ночи при 80 С. Раствор концентрировали в условиях пониженного давления. Остаток разбавляли этилацетатом (25 мл), водой (25 мл) и разделяли два слоя. Водный слой дважды экстрагировали этилацетатом (25 мл) и солевым раствором (20 мл). Объединенные органические слои дважды промывали насыщенным раствором NaHCO3 (25 мл), солевым раствором (25 мл) и сушили над сульфатом натрия. После фильтрации раствор упаривали досуха. Получали светло-желтое масло (5,4 г,95%). 1H-ЯМР (400 МГц, CDCl3):1,26 (т, J=4,7 Гц, 3 Н), 3,57 (с, 2 Н), 4,15 (кв., J=7,0 и 14,3 Гц, 2 Н), 7,177,26 (м, 2 Н), 7,38-7,44 (м, 1 Н), 7,44 (д, J=1,56 Гц, 1 Н). Стадия 2. Смесь этил-(3-бромфенил)ацетата (0,3 г, 1,24 ммоль) и гидрата фторида тетрабутиламмония (0,97 г,3,72 ммоль) обрабатывали PdCl2(PPh3)2 (26 мг, 0,037 ммоль; 3 мол.%) и 1-пентином (367 мкл, 3,72 ммоль)- 15022445 в герметичной пробирке. Пробирку нагревали при 80 С в течение 2 ч. Смесь обрабатывали водой и экстрагировали диэтиловым эфиром. Органический экстракт сушили над сульфатом натрия, фильтровали и упаривали в условиях вакуума с получением неочищенного продукта. Путем очистки на колонке Biotage 25M (силикагель), элюируя этилацетатом/гексаном (0/12/98), получали этил-(3-(пентин-1 ил)фенил)ацетат в виде бледно-желтого масла (0,23 г, 79%). Стадия 3. К этил-[3-[пентин-1-ил]фенил]ацетату (0,23 г, 0,98 ммоль) в этаноле (5 мл) в атмосфере азота добавляли Pd на угле (10%, 25 мг, 10% об./об.). Смесь энергично перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Раствор фильтровали и промывали палладий-на-угле этанолом(20 мл). Фильтрат концентрировали на силикагеле. Неочищенный продукт очищали по методу флэшхроматографии с использованием смеси 10% гексанов/этилацетата. Получали чистое масло (0,21 г, 90%). Стадия 4. К раствору сложного эфира (0,2 г, 0,9 ммоль) в тетрагидрофуране (5 мл), метаноле (1,5 мл) и воде(1,5 мл) при 0 С добавляли гидроксид лития (0,09 г, 3,6 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Нерастворимые вещества фильтровали и концентрировали фильтрат в условиях пониженного давления. Затем осуществляли взаимодействие остатка с 2 М HCl и экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия и упаривали в условиях пониженного давления. Неочищенное вещество очищали на колонке Biotage 40L (силикагель) с использованием в качестве элюента этилацетата/гексанов (0/104/6). Получали чистую (3-пентилфенил)уксусную кислоту (0,19 г, 99%) в виде белого смолистого твердого вещества. 1H ЯМР (400 МГц, CD3OD):0,90 (т, J=7,0 Гц, 3 Н), 1,28-1,38 (м, 4 Н), 1,61 (кв.т, J=7,6 Гц, 15,0 Гц,2 Н), 2,58 (т, J=7,6 Гц, 2 Н), 3,56 (с, 2 Н), 7,07 (м, 3 Н), 7,20 (м, 1 Н); МСНР (ИЭР): m/z 207 (МН+); ВЭЖХ: 4,3 мин. Стадия 5. К перемешанному раствору кислоты (0,19 г, 0,82 ммоль) в этаноле (4 мл) и воде (1 мл) добавляли бикарбонат натрия (0,07 г, 0,82 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, белое смолистое твердое вещество растворяли в воде, и лиофилизировали раствор. Получали чистую натриевую соль (3-пентилфенил)уксусной кислоты (0,17 г, 92%) в виде белого твердого вещества, т.пл. 110-112 С; 1H ЯМР (400 МГц, CD3OD):0,89 (т, J=6,8 Гц, 3 Н), 1,28-1,37 (м, 4 Н), 1,60 (кв.т, J=7,4 Гц, 15,0 Гц,2 Н), 2,56 (т, J=7,6 Гц, 2 Н), 3,43 (с, 2 Н), 6,96 (м, 1 Н), 7,12 (м, 3 Н); МСНР (ИЭР): m/z 207 (МН+); ВЭЖХ: 4,3 мин. Соединение II. Натриевая соль Е-(3-пент-1-енилфенил)уксусной кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества сложный метиловый эфир Е-(3-пент-1-енилфенил)уксусной кислоты. Последний получали путем осуществления взаимодействия сложного метилового эфира 3 бромфенилуксусной кислоты со сложным пинаколовым эфиром транс-1-пентенилбороновой кислоты в условиях Сузуки, белое твердое вещество; 1H ЯМР (400 МГц, CD3OD):7,32 (с, 1 Н), 7,11-7,18 (м, 3 Н), 6,35 (д, J=15,7 Гц, 1 Н), 6,20-6,27 (м,1 Н), 3,44 (с, 2 Н), 2,19 (м, 2 Н), 1,45-1,54 (м, 2 Н), 0,96 (т, J=7,4, 3 Н); 13 С ЯМР (101 МГц, CD3OD):179,26, 138,25, 137,92, 130,32, 130,04, 128,06, 127,59, 126,60, 123,52,45,21, 35,06, 22,52, 12,89; МСНР (ИЭР): m/z 205 (МН+); ВЭЖХ: 4,1 мин. Соединение III. Натриевая соль (2-гидрокси-5-пентилфенил)уксусной кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества сложный метиловый эфир 5-бром-2-метоксифенилуксусной кислоты. Деметилирование метоксигруппы осуществляли с использованием раствора трибромида бора(1 М/CH2Cl2) при -78 С в течение 1 ч, а затем при 0 С в течение 20 мин. Белое твердое вещество; 1 Н ЯМР (400 МГц, CD3OD):6,88 (м, 2 Н), 6,71 (д, J=8,6 Гц, 1 Н), 3,50 (с, 2 Н), 2,49 (т, J=7,6 Гц, 2 Н),1,54-1,62 (м, 2 Н), 1,29-1,38 (м, 4 Н), 0,91 (т, J=7,0 Гц, 3 Н); 13 С ЯМР (101 МГц, CD3OD)180,08, 154,04, 134,03, 130,26, 127,36, 124,15, 116,57, 42,48, 34,91,31,60, 31,42, 22,45, 13,24; МСНР (ИЭР): m/z 177 (MH+-CO-NaOH); ВЭЖХ: 3,7 мин. Соединение IV. Натриевая соль 3-(4-фтор-3-пентилфенил)пропионовой кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества Е-метил-3-(3-бром-4-фторфенил)акрилат. Последний получали путем смешивания при комнатной температуре раствора 3-бром-4-фторбензальдегида и этоксикарбонилметилентрифенилфосфорана в безводном дихлорметане. Белое твердое вещество; 1 Н ЯМР (400 МГц, CD3OD)6,67-6,74 (м, 2 Н), 6,58 (м, 1 Н), 2,49 (т, J=7,6 Гц, 2 Н), 2,23 (т, J=7,4 Гц,2 Н), 2,15 (м, 2 Н), 1,25 (м, 2 Н), 0,99-1,06 (м, 4 Н), 0,61 (т, J=6,7 Гц, 3 Н); 13 С ЯМР (101 МГц, D2O)182,38, 160,69, 158,28, 137,37, 130,34, 129,58, 126,84, 114,99, 39,68, 31,51,- 16022445 29,92, 28,90, 22,31, 16,66; МСНР (ИЭР): m/z 221 (МН+-Н 2 О); ВЭЖХ: 4,5 мин. Соединение V. Натриевая соль 3-(3-пентилфенил)пропионовой кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества сложный этиловый эфир 3-оксо-3-бромфенилпропионовой кислоты. Кетонную группу и двойную связь восстанавливали одновременно с использованием палладия на угле в этаноле под давлением водорода. Белое твердое вещество; 1 Н ЯМР (400 МГц, CDCl3)7,14-7,10 (м, 1 Н), 7,04-7,00 (м, 2 Н), 6,95-6,93 (м, 1 Н), 2,88-2,84 (м, 2 Н),2,55 (т, J=7,4 Гц, 2 Н), 2,44-2,40 (м, 2 Н), 1,63-1,55 (м, 2 Н), 1,35-1,28 (м, 4 Н), 0,90 (м, 3 Н); 13 С ЯМР (101 МГц, CD3OD)179,3, 141,2, 140,8, 126,7, 126,4, 124,0, 123,8, 38,6, 34,2, 31,2, 29,9,29,8, 20,9, 11,7; МСНР (ИЭР): m/z 203 (МН+-СО-NaOH); ВЭЖХ: 4,5 мин. Соединение VI. Натриевая соль 2-метил-2-(3-пентилфенил)пропионовой кислоты Стадия 1. Суспензию гидрида натрия (60% об./об. в минеральном масле; 0,5 г, 13,6 ммоль) в безводном THF(8 мл) охлаждали до 0 С и обрабатывали раствором метил-[3-пентилфенил]ацетата (1,0 г, 4,5 ммоль) в безводном THF (4 мл). Реакционную смесь перемешивали при 0 С в течение 60 мин, а затем обрабатывали метилйодидом (0,7 мл, 11,3 ммоль). Реакционную смесь оставляли медленно нагреваться до комнатной температуры и перемешивали при этой температуре в течение ночи. Реакционную смесь гасили добавлением насыщенного водного хлорида аммония (10 мл) и экстрагировали смесь эфиром (320 мл). Объединенные экстракты сушили над сульфатом магния и упаривали досуха. Путем очистки на слое силикагеля, элюируя этилацетатом/гексаном (1/99, затем 2/98), получали метил-2-метил-2-(3 пентилфенил)пропионат в виде бесцветного масла (0,68 г, 60%). 1 Н ЯМР (400 МГц, CD3OD):7,18-7,22 (м, 1 Н), 7,08-7,13 (м, 2 Н), 7,02-7,05 (м, 1 Н), 3,62 (с, 3 Н), 2,58(т, J=7,6 Гц, 2 Н), 1,55-1,62 (м, 2 Н), 1,53 (с, 6 Н), 1,28-1,36 (м, 4 Н), 0,90 (т, J=7,1 Гц, 3 Н); ВЭЖХ: 5,5 мин. Стадия 2. Раствор сложного эфира в THF (8 мл), метаноле (2 мл) и воде (2 мл) обрабатывали гидроксидом лития (0,2 г, 8,2 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение ночи, а затем при 50 С в течение 2 суток и при комнатной температуре в течение 10 суток. Реакционную смесь фильтровали и промывали воронку метанолом (220 мл). Объединенный фильтрат и смывы обрабатывали 2 М HCl (7 мл) и экстрагировали смесь этилацетатом (340 мл). Объединенные экстракты промывали водой (230 мл), сушили над сульфатом натрия, фильтровали и упаривали в условиях вакуума с получением 2-метил-2-(3-пентилфенил)пропионовой кислоты в виде бледно-желтого сиропа (0,64 г, 99%). Указанное вещество использовали без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3):7,19-7,27 (м, 3 Н), 7,07-7,10 (м, 1 Н), 2,60 (т, J=7,8 Гц, 2 Н), 1,60 (с, 6 Н),1,58-1,63 (м, 2 Н), 1,30-1,37 (м, 4 Н), 0,89 (т, J=7,0 Гц, 3 Н); МСНР (ИЭР): m/z 257 (MNa+); ВЭЖХ: 4,7 мин. Стадия 3. Раствор кислоты в этаноле (16 мл) обрабатывали водой (4 мл) и бикарбонатом натрия (0,2 г, 2,7 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 3 суток. Растворитель выпаривали в условиях вакуума и растворяли остаток в воде, фильтровали и лиофилизировали с получением 2-метил-2-[3-пентилфенил]пропионата натрия в виде белого твердого вещества (0,7 г, 96%). 1 Н ЯМР (400 МГц, CD3OD):7,19-7,23 (м, 2 Н), 7,13 (дд, J=7,6, 7,6 Гц, 1 Н), 6,91-6,95 (м, 1 Н), 2,56 (т,J=7,7 Гц, 2 Н), 1,56-1,63 (м, 2 Н), 1,46 (с, 6 Н), 1,28-1,39 (м, 4 Н), 0,90 (т, J=7,0 Гц, 3 Н); 13 С ЯМР (101 МГц, CD3OD):184,35, 148,62, 142,13, 127,51, 126,14, 125,32, 123,16, 36,01, 31,57,31,40, 27,45, 22,44, 13,22; МСНР (ИЭР): m/z 235; (M-Na2 Н+); ВЭЖХ: 4,6 мин. Соединение VII. Натриевая соль 3-гидрокси-2-(3-пентилфенил)пропионовой кислоты. Указанное выше соединение получали, как описано для соединения VI, за исключением того, что гидрид натрия заменяли диизопропиламином/н-бутиллитием и метилйодид - гидроксиметил-1 Нбензотриазолом. Белое твердое вещество; Н ЯМР (400 МГц, CDCl3):7,19-7,14 (м, 3 Н), 7,01-6,98 (м, 1 Н), 4,01-3,96 (м, 1 Н), 3,72-3,57 (м, 1 Н),3,31-3,30 (м, 1 Н), 2,58-2,55 (м, 2 Н), 1,64-1,56 (м, 2 Н), 1,37-1,29 (м, 4 Н), 0,90 (т, 3 Н, J=7,0 Гц); 13 С ЯМР (101 МГц, CD3OD):179,7, 142,7, 139,8, 128,4, 127,9, 126,3, 125,6, 65,2, 57,5, 35,8, 31,5,31,3, 22,4, 13,2; МСНР (ИЭР): m/z 473 (2M-2Na3H+); ВЭЖХ: 3,5 мин. Соединение VIII. Натриевая соль 2-(3-пентилфенил)пропионовой кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества сложный диэтиловый эфир 2-метил-2-(3-пентилфенил)малоновой кислоты. Последний получали путем осуществления взаимодействия сложного диэтилового эфира 2-(3-бромфенил)малоновой кислоты с метилйодидом в условиях сочетания по Сузуки с использованием сложного пинаколового эфира транс-1-пентенил-1-бороновой кислоты с последующим восстановлением двойной связи путем гидрирования. Белое твердое вещество; 1 Н ЯМР (400 МГц, CD3OD):7,19-6,95 (м, 4 Н), 3,54 (кв., J=7,0 Гц, 1 Н), 2,56 (т, J=7,6 Гц, 2 Н), 1,641,56 (м, 2 Н), 1,38 (д, J=7,2 Гц, 3 Н), 1,37-1,20 (м, 4 Н), 0,90 (т, J=7,0 Гц, 3 Н); 13 С ЯМР (CD3OD):182,2, 144,4, 142,5, 127,8, 127,6, 125,8, 124,7, 49,2, 35,9, 31,5, 31,3, 22,4, 19,0,13,2; МСНР (ИЭР): m/z 221 (M-Na2H+); ВЭЖХ: 4,5 мин. Соединение IX. Натриевая соль 3-(3-бутилфенил)пропионовой кислоты. Указанное выше соединение получали, как описано для соединения IV, используя в качестве исходного вещества Е-метил-3-(3-бут-1-енилфенил)акрилата. Последний получали путем осуществления взаимодействия изофталевого альдегида с карбометоксиметилентрифенилфосфораном с последующим проведением реакции Виттига с использованием н-бутилтрифенилфосфония бромида. Белое твердое вещество; 1 Стадия 1. К раствору (3-бромфенил)уксусной кислоты (12,2 г, 56,8 ммоль) в метаноле (150 мл) добавляли паратолуолсульфоновую кислоту (5,4 г, 28,4 ммоль). Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 3 ч. Растворитель выпаривали и растворяли остаток в смеси этилацетата/воды (3/2). Органический слой сушили над сульфатом натрия и концентрировали. Остаток очищали с использованием слоя силикагеля, элюируя смесью гексанов/этилацетата (9/1). Получали сложный метиловый эфир (3-бромфенил)уксусной кислоты в виде бесцветного масла (11,7 г, 90%).H ЯМР (400 МГц, CD3OD):7,46 (м, 1 Н), 7,41 (м, 1 Н), 7,22 (м, 2 Н), 3,68 (с, 3 Н), 3,65 (с, 2 Н); МСНР (ИЭР): m/z=229 (MH+); ВЭЖХ: 3,8 мин. Стадия 2. К раствору сложного эфира (6,0 г, 26,2 ммоль) в трет-бутаноле (24 мл) в атмосфере азота добавляли йодид натрия (7,8 г, 52,4 ммоль), N,N'-диметилэтилендиамин (0,3 мл, 2,6 ммоль) и йодид меди (0,3 г, 1,3 ммоль). Реакционную смесь нагревали в микроволновой печи при 145 С в течение 1 ч. Добавляли воду(100 мл) и экстрагировали продукт этилацетатом (350 мл). Органический слой сушили над сульфатом натрия и концентрировали. Остаток очищали по методу флэш-хроматографии на силикагеле с использованием смеси гексанов/этилацетата (8/2). Получали сложный метиловый эфир 3-йодфенилуксусной кислоты в виде бесцветного масла (6,6 г, 86%). 1 Н ЯМР (400 МГц, CDCl3):7,63 (м, 1 Н), 7,58-7,61 (м, 1 Н), 7,23-7,26 (м, 1 Н), 7,05 (дд, J=7,8 Гц, 1 Н),3,69 (с, 3 Н), 3,56 (с, 2 Н); МСНР (ИЭР): m/z=277 (MH+). Стадия 3. Йодэфир (6,2 г, 22,5 ммоль) смешивали с хлоридом палладия (0,16 г, 0,22 ммоль), трифенилфосфином (59,0 мг, 0,22 ммоль) и диэтиламином (60 мл) в атмосфере азота. К этой смеси добавляли йодид меди(I) (43 мг, 0,22 ммоль) и пропаргиловый спирт (1,57 г, 28,1 ммоль) и перемешивали реакционную смесь в течение ночи при 45 С. Диэтиламин удаляли в условиях пониженного давления и добавляли 100 мл воды. Затем смесь экстрагировали этилацетатом (330 мл) и очищали неочищенный продукт по методу флэш-хроматографии с использованием смеси этилацетата/гексанов (30%). Получали чистый сложный метиловый эфир [3-(3-гидроксипроп-1-инил)фенил]уксусной кислоты в виде коричневатого маслаH ЯМР (400 МГц, CDCl3):7,33-7,37 (м, 2 Н), 7,23-7,30 (м, 2 Н), 4,49 (д, J=6,1 Гц, 2 Н), 3,69 (с, 3 Н),3,60 (с, 2 Н), 1,68 (т, J=6,3 Гц, 1 Н); МСНР (ИЭР): m/z=227 (MNa+); ВЭЖХ: 2,7 мин. Стадия 4. К сложному метиловому эфиру (3,8 г, 18,7 ммоль) в этаноле (70 мл) в атмосфере азота добавляли 10% палладий на угле (0,30 г). Атмосферу заменяли водородом. Смесь энергично перемешивали при комнатной температуре в течение ночи. Раствор фильтровали и промывали палладий на угле этанолом (50 мл). Фильтрат концентрировали и очищали неочищенный продукт по методу флэшхроматографии с использованием смеси гексанов/этилацетата (3/2). Получали чистый сложный метиловый эфир 3-(3-гидроксипропил)фенил]уксусной кислоты в виде бесцветного масла (3,20 г, 82%). 1H ЯМР (400 МГц, CD3OD):7,21 (т, J=7,6 Гц, 1 Н), 7,11 (с, 1 Н), 7,07 (м, 2 Н), 3,67 (с, 3 Н), 3,61 (с,2 Н), 3,56 (т, J=7,6 Гц, 2 Н), 2,66 (т, J=7,6 Гц, 2 Н), 1,78-1,85 (м, 2 Н); МСНР (ИЭР): m/z=209 (MH+); ВЭЖХ: 2,6 мин. Стадия 5. При 0 С в атмосфере азота к раствору сложного метилового эфира (0,9 г, 4,4 ммоль) в безводном дихлорметане (20 мл) добавляли пиридиния хлорхромат (1,44 г, 6,70 ммоль) и молекулярные сита. Реакционную смесь перемешивали в течение 20 мин при 0 С и 3 ч при комнатной температуре. Добавляли эфир (20 мл), а осадок фильтровали и промывали эфиром (40 мл). Фильтрат упаривали с получением сложного метилового эфира [3-(3-оксопропил)фенил]уксусной кислоты в виде коричневатого масла (0,9 г, 97%). Альдегид использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):9,82 (т, J=1,4 Гц, 1 Н), 7,24-7,28 (м, 2 Н), 7,11 (м, 2 Н), 3,69 (с, 3 Н), 3,60(с, 2 Н), 2,95 (т, J=7,6 Гц, 2 Н), 2,80 (т, J=7,0 Гц, 2 Н). Стадия 6. Альдегид (0,9 г, 4,3 ммоль) растворяли в тетрагидрофуране (9 мл). В отдельный сосуд, содержащий раствор бромида (этил)трифенилфосфония (2,1 г, 5,6 ммоль) в безводном тетрагидрофуране (17 мл) при-10 С добавляли 2,3 М раствор н-бутиллития (1,94 мл, 5,8 ммоль). Оранжевый раствор перемешивали при этой температуре в течение 20 мин и при 0 С в течение 40 мин. К этому раствору добавляли альдегид и перемешивали смесь в течение 1 ч при 0 С и при комнатной температуре в течение ночи. Затем добавляли воду (30 мл) и экстрагировали органический слой эфиром (330 мл). Объединенные эфирные слои промывали солевым раствором и сушили. Растворитель выпаривали и остаток очищали с использованием смеси петролейного эфира/этилацетата (95%) в качестве элюента. Получали чистый сложный метиловый эфир E/Z-(3-пент-3-енилфенил)уксусной кислоты в виде бесцветного масла (0,25 г, 27%). 1(д, J=7,2 Гц, 2 Н), 2,57 (т, J=7,8 Гц, 2 Н), 2,25-2,31 (м, 2 Н), 1,57 (дд, J=3,3, 1,4 Гц, 3 Н). Стадия 7. К раствору олефина (0,13 г, 0,60 ммоль) в тетрагидрофуране (3 мл), метаноле (1,5 мл) и воде (1,5 мл) при 0 С добавляли гидроксид лития (73 мг, 3,1 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель концентрировали, подкисляли добавлением 2 М HCl и экстрагировали этилацетатом (315 мл). Органическую фазу сушили и упаривали в условиях высокого вакуума. Неочищенный продукт очищали на слое силикагеля с использованием этилацетата/гексанов(м, 2 Н), 3,65 (с, 2 Н), 2,67-2,71 (м, 2 Н), 2,33-2,42 (м, 2 Н), 1,58-1,68 (м, 3 Н). Стадия 8. К перемешанному раствору кислоты (0,12 г, 0,6 ммоль) в этаноле (3 мл) и воде (2 мл) добавляли бикарбонат натрия (50 мг, 0,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель концентрировали, разбавляли остаток водой (70 мл) и лиофилизировали раствор. Получали чистую натриевую соль E/Z-(3-пент-3-енилфенил)уксусной кислоты в виде белого твердого вещества (0,14 г, 90%). 1 Н ЯМР (400 МГц, D2O): (главный, Е-изомер)7,12 (дд, J=7,4 Гц, 1 Н), 7,00 (с, 1 Н), 6,99 (д, J=7,4 Гц,1 Н), 6,95 (д, J=7,6 Гц, 1 Н), 5,27-5,38 (м, 2 Н), 3,33 (с, 2 Н), 2,53-2,48 (м, 2 Н), 2,13-2,24 (м, 2 Н), 1,35-1,44 (м,3 Н). Соединение XI. Натриевая соль [3-гидрокси-5-пентилфенил]уксусной кислоты Стадия 1. Раствор метил-[3,5-дигидроксифенил]ацетата (2,1 г, 11,5 ммоль) в ацетоне (100 мл) обрабатывали карбонатом калия (2,4 г, 17,4 ммоль), йодидом калия (0,38 г, 2,31 ммоль) и бензилбромидом (1,5 мл, 12,7 ммоль), перемешивали смесь при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном (3). Объединенные органические экстракты сушили над сульфатом натрия и упаривали в условиях вакуума. Неочищенное вещество очищали на колонке Biotage 40M (силикагель), элюируя 40% этилацетатом/гексаном, с получением метил-[3-бензилокси-5 гидроксифенил]ацетата (1,0 г, 33%). 1- 20022445 Стадия 2. Раствор бензилового эфира (1,04 г, 3,8 ммоль) в CH2Cl2 (15 мл) при 0 С обрабатывали Nфенилбис(трифторсульфонил)имидом (1,40 г, 3,9 ммоль), а затем медленно добавляли триэтиламин (0,6 мл, 4,1 ммоль). Реакционную смесь перемешивали при 0 С в течение 1 ч, а затем при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли водой, а затем экстрагировали диэтиловым эфиром(2). Объединенные органические экстракты промывали 1 М водным гидроксидом натрия, водой (2) и насыщенным водным хлоридом натрия, а затем сушили над сульфатом натрия, фильтровали и упаривали в условиях вакуума с получением неочищенного продукта. Путем очистки на колонке Biotage 40 М(0/11/4), получали метил-[3-бензилокси-5 трифторметансульфонилоксифенил]ацетат (1,2 г, 79%). 1 Н ЯМР (400 МГц, CDCl3):7,36-7,46 (м, 5 Н), 6,98 (с, 1 Н), 6,97 (с, 1 Н), 6,84 (с, 1 Н), 5,06 (с, 2 Н),3,72 (с, 3 Н), 3,63 (с, 2 Н). Стадия 3. Раствор сложного пинаколового эфира Е-1-пентен-1-илбороновой кислоты (0,8 г, 3,9 ммоль) в диметоксиэтане (5 мл) обрабатывали раствором трифлата (1,2 г, 3,0 ммоль) в диметоксиэтане (5 мл). Раствор обрабатывали палладием(0) (0,7 г, 0,6 ммоль) и 2 М водным карбонатом натрия (1,3 мл, 2,6 ммоль). Затем смесь нагревали при 90 С в течение 3 суток. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат упаривали в условиях вакуума, и очищали неочищенное вещество на колонке Biotage 25M (силикагель), элюируя этилацетатом/гексаном (0/15/95), с получением метил-[3-бензилокси-5-[пент-1-енил]фенил]ацетата (0,4 г, 40%). 1H ЯМР (400 МГц, CDCl3):7,36-7,47 (м, 5 Н), 6,90-6,92 (м, 2 Н), 6,79 (дд, J=2,0, 2,0 Гц, 1 Н), 6,35 (д,J=15,9 Гц, 1 Н), 6,24 (дт, J=15,9, 6,8 Гц, 1 Н), 5,07 (с, 2 Н), 3,70 (с, 3 Н), 3,59 (с, 2 Н), 2,20 (тд, J=7,4, 6,8 Гц,2 Н), 1,51 (дт, J=7,4 Гц, 2 Н), 0,98 (т, J=7,4 Гц, 3 Н). Стадия 4. Раствор алкена (0,4 г, 1,2 ммоль) в этаноле (13 мл) обрабатывали 1% палладием на угле (40 мг). Смесь перемешивали под давлением водорода 1 атм. при комнатной температуре в течение ночи. Реакционную смесь фильтровали, упаривали в условиях вакуума и очищали на колонке Biotage 25S (силикагель), элюируя этилацетатом/гексаном (0/115/85), с получением метил-[3-гидрокси-5 пентилфенил]ацетата (0,3 г, 93%). 1 Н ЯМР (400 МГц, CDCl3):6,64 (с, 1 Н), 6,58-6,60 (м, 2 Н), 3,70 (с, 3 Н), 3,55 (с, 2 Н), 2,51 (т, J=7,7 Гц, 2 Н), 1,55-1,59 (м, 2 Н), 1,28-1,34 (м, 4 Н), 0,88 (т, J=7,0 Гц, 3 Н). Стадия 5. Раствор сложного эфира (0,3 г, 1,3 ммоль) в этаноле (12 мл) обрабатывали водой (3 мл), гидроксидом лития (155 мг, 6,4 ммоль) и энергично перемешивали смесь при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (100 мл), промывали дихлорметаном, а затем подкисляли до рН 1 добавлением 1 М водной HCl и экстрагировали дихлорметаном (3). Объединенные органические экстракты сушили над сульфатом натрия (0,3 г, 95%). Это вещество использовали без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):6,66 (с, 1 Н), 6,58-6,59 (м, 2 Н), 3,55 (с, 2 Н), 2,52 (т, J=7,7 Гц, 2 Н), 1,551,59 (м, 2 Н). Стадия 6. Раствор кислоты (0,27 г, 1,23 ммоль) в этаноле (6 мл) и воде (6 мл) обрабатывали бикарбонатом натрия (0,1 г, 1,2 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение нескольких часов. Растворитель концентрировали в условиях вакуума, раствор разбавляли водой, фильтровали (0,2 мкм) и лиофилизировали с получением [3-гидрокси-5-пентилфенил]ацетата натрия в виде белого твердого вещества (0,3 г, 95%), т.пл. 63-66 С; 1H ЯМР (400 МГц, CD3OD):6,63 (с, 1 Н), 6,58 (с, 1 Н), 6,42 (с, 1 Н), 3,36 (с, 2 Н), 2,48 (т, J=7,6 Гц,2 Н), 1,55-1,62 (м, 2 Н), 1,26-1,38 (м, 4 Н), 0,89 (т, J=6,8 Гц, 3 Н); 13 С ЯМР (101 МГц, CD3OD):177,79, 155,31, 142,36, 137,62, 119,08, 111,66, 111,18, 43,70, 34,17,29,95, 29,56, 20,87, 11,64; МСНР (ИЭР): m/z 445,2 (2M-2Na3H+), m/z 223 (M-Na2H+); ВЭЖХ: 3,5 мин. Соединение XII. Натриевая соль 4-пентилбензойной кислоты. Указанное выше соединение получали, как описано для соединения I, используя в качестве исходного вещества 4-пентилбензойную кислоту. Белое твердое вещество; 1 Н ЯМР (400 МГц, D2O):7,61 (д, J=8,3 Гц, 2 Н), 7,12 (д, J=8,5 Гц, 2 Н), 2,46 (т, J=7,5 Гц, 2 Н), 1,381,45 (м, 2 Н), 1,04-1,15 (м, 4 Н), 0,65 (т, J=7,0 Гц, 3 Н); 13 С ЯМР (101 МГц, D2O):175,79, 147,29, 133,55, 129,15, 128,47, 35,07, 30,81, 30,45, 22,00, 13,42; МСНР (ИЭР): m/z 193 (M-Na2H+); ВЭЖХ: 4,3 мин. Соединение XIII. Натриевая соль 3-гексилбензойной кислоты. Указанное выше соединение получали, как описано для соединения IX, используя в качестве исходного вещества 3-[гекс-1-енил]бензоат. Последний получали путем осуществления взаимодействия Стадия 1. К раствору индан-2-карбоновой кислоты (2,50 г) в этаноле (77 мл) при 25 С добавляли концентрированную H2SO4 (9 мл). Бесцветный раствор перемешивали при 75 С в течение 48 ч. Растворитель удаляли в условиях пониженного давления и разбавляли остаток дихлорметаном (10 мл) и водой (10 мл). Значение рН раствора корректировали с 1 до 14. Разделяли два слоя и экстрагировали водную фазу этилацетатом (30 мл). Органические слои объединяли, сушили над сульфатом магния, фильтровали и концентрировали в условиях высокого вакуума. Полученное твердое вещество очищали на колонке Biotage 40M (силикагель, гексаны/этилацетат (1/097/3 с получением сложного этилового эфира индан-2 карбоновой кислоты. Не совсем белое масло; 1 Н ЯМР (400 МГц, CDCl3):7,22-7,14 (м, 4 Н), 4,19 (кв., J=7,04 Гц, 4 Н), 3,36-3,10 (м, 5 Н), 1,29 (т,J=7,04 Гц, 3 Н); МСНР (ИЭР): m/z 190 (МН+); ВЭЖХ: 4,3 мин. Стадия 2. К смеси сложного этилового эфира и AlCl3 (2,5 г, 18,5 ммоль) в дихлорметане (20 мл) добавляли бутирилхлорид (0,8 мл, 7.9 ммоль). После перемешивания при комнатной температуре в течение 5 ч реакционную смесь вливали в смесь льда и 1 н. HCl. Водную фазу экстрагировали дихлорметаном (30 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и упаривали в условиях пониженного давления. Неочищенный остаток очищали на колонке Biotage 40L (силикагель, гексаны/этилацетат (1/08/2 с получением сложного этилового эфира 5-бутирилиндан-2-карбоновой кислоты в виде бесцветного масла (1,0 г, 50%); 1H ЯМР (400 МГц, CDCl3):7,80-7,77 (м, 2 Н), 7,27 (д, J=8,61 Гц, 1 Н), 4,18 (кв., J=7,04 Гц, 4 Н), 3,363.10 (м, 5 Н), 2,91 (т, J=7,24 Гц, 2 Н), 1,78-1,65 (м, 2 Н), 1,28 (т, J=7,04 Гц, 3 Н), 0,99 (т, J=7,24 Гц, 3 Н); МСНР (ИЭР): m/z 261 (МН+); ВЭЖХ: 4,5 мин. Стадия 3. К перемешанному раствору кетона (0,56 г, 2,17 ммоль) в 1,2-дихлорэтане (11 мл) при комнатной температуре добавляли йодид цинка (1,04 г, 3,25 ммоль) и цианборгидрид натрия (1,0 г, 16,3 ммоль). Реакционную смесь перемешивали при 25 С в течение 20 ч. Реакционную смесь фильтровали через слой целита и выпаривали растворитель в условиях пониженного давления. Неочищенный остаток очищали на колонке Biotage 25M (силикагель, гексаны/этилацетат (1/08/2 с получением сложного этилового эфира 5-бутилиндан-2-карбоновой кислоты (0,4 г, 77%). 1- 22022445 Гц, 3 Н); ВЭЖХ: 5,5 мин. Стадия 4. К раствору сложного эфира (0,4 г, 1,65 ммоль) в смеси ацетонитрила/метанола/воды (5 мл, 3/1/1) добавляли гидроксид лития (0,3 г, 10,7 ммоль). Реакционную смесь перемешивали при 25 С в течение 15 ч. После выпаривания растворителя остаток экстрагировали дихлорметаном (30 мл). Водную фазу подкисляли добавлением 1 н. HCl до рН 4, а затем экстрагировали дихлорметаном (225 мл). Органические экстракты сушили над сульфатом магния, фильтровали и упаривали в условиях пониженного давления. Неочищенный остаток очищали на колонке Biotage 12M (силикагель, гексаны/этилацетат (1/07/3 с получением 5-бутилиндан-2-карбоновой кислоты (0,3 г, 90%). ВЭЖХ: 4,3 мин. К раствору кислоты (0,32 г, 1,49 ммоль) в смеси ацетонитрила/воды (5 мл, 2/3) добавляли бикарбонат натрия. Реакционную смесь перемешивали в течение ночи при комнатной температуре. После выпаривания ацетонитрила остаток разбавляли водой (4 мл). Раствор фильтровали через 0,45 мкм фильтр и лиофилизировали. Получали чистую натриевую соль 5-бутилиндан-2-карбоновой кислоты. Белое твердое вещество; 1 Н ЯМР (400 МГц, CD3OD):7,02 (д, J=7,63 Гц, 1 Н), 6,96 (с, 1 Н), 6,88 (д, J=7,63 Гц, 1 Н), 3,18-3,04(м, 5 Н), 2,54 (т, J=7,63 Гц, 2 Н), 1,59-1,51 (м, 2 Н), 1,37-1,28 (м, 2 Н), 0,92 (т, J=7,24 Гц, 3 Н); 13 С ЯМР (101 МГц CD3OD):183,2, 143,1, 140,7, 140,2, 126,2, 123,9, 123,6, 37,2, 36,9, 35,4, 34,1,22,1, 13,1; МСНР (ИЭР): m/z 201 (MH+-NaOH); ВЭЖХ: 4,3 мин. Пример 2. Исследования хемозащиты. Самок мышей C57BL/6 в возрасте от 6 до 8 недель иммуносупрессировали путем обработки 200 мг/кг фосфамида, вводимого внутривенно на 0 сутки. Для исследования иммунопротективного эффекта соединения I мышей предварительно перорально обрабатывали соединением на -3, -2 и -1 сутки. Мышей умерщвляли на +5 сутки путем прокалывания сердца и смещения шейных позвонков. Затем проводили полное макроскопическое исследование бедренных костей (как источника клеток костного мозга). После умерщвления ткани измельчали в буфере PBS и подсчитывали клетки на гемоцитометре. При пероральной предобработке соединением I мышей, обработанных циклофосфамидом, наблюдали значительное увеличение общего числа клеток костного мозга (фиг. 1). Кроме того, при пероральной предобработке соединением I иммуносупрессированных циклофосфамидом мышей наблюдали увеличение числа клеток костного мозга, предшественников белых клеток крови (фиг. 2). Кроме того, при пероральной предобработке соединением I мышей, иммуносупрессированных циклофосфамидом, наблюдали увеличение числа клеток костного мозга, предшественников красных клеток крови (табл. 1). Кроме того, соединение I увеличивает содержание циркулирующих эритроцитов. Таблица 1 Эффект соединения I на число красных клеток костного мозга и эритроцитов Дополнительные соединения, относящиеся к соединению I, также получали и тестировали на биологическую активность. В табл. 2 суммирована активность таких дополнительных соединений. Результаты в данной таблице выражены в зависимости от уровня активности в отношении гемопоэза/эритропоэза по сравнению с активностью соединения I, гдеозначает большую чем у соединения I активность, означает от 70 до 100% активности соединения I,означает 40-70% активности соединения I, + обозначает 5-40% активности соединения I, и "н/д" означает, что соединение не было тестировано.- 23022445 Таблица 2 Эффект выбранных соединений на гемопоэз/эритропоэз- 24022445 Пример 3. Эффект соединений на модель воспаления "воздушный мешок". Считается, что индуцированное LPS воспаление в модели "воздушного мешка" у крыс имитирует патологический процесс, происходящий при заболеваниях суставов, таких как артрит. Причина этого в том, что соединительные ткани, формируемые вдоль воздушного мешка, подобны тем, которые обнаруживаются при хронических заболеваниях суставов. Индуцированное LPS воспаление и хронические заболевания суставов обладают другими схожими чертами, включая заметно повышенные содержаниеPGE2, инфильтрацию нейтрофилами, образование цитокинов и повреждение ткани. Воздушную полость создавали на -6 сутки путем подкожной инъекции 20 мл стерильного воздуха в интракапсулярную область спины самцов крыс Lewis (175-200 г). Добавочные 10 мл вводили в полость на -3 сутки для поддержания полости открытой. На 0 сутки внутривенно вводили соединения и спустя 1 ч в мешок вводили липополисахарид (LPS: 2,5 мл, 2 мкг/мл в PBS) для индукции воспалительной реакции. Спустя 2 ч после обработки LPS, животных подвергали эвтаназии путем индукции асфиксии СО 2 и вводили в мешок 5 мл PBS/гепарин (10 ед./мл)/индометацина (36 мкг/мл). Жидкость из мешка собирали и определяли содержание PGE2 в экссудатах мешка по методу ELISA. Как представлено на фиг. 3, пероральное введение соединения I вызывает значительное ингибирование PGE2 спустя 2 ч после введения LPS. Ингибирование, достигнутое с помощью соединения I, было аналогично таковому, полученному в положительном контроле с индметацином. Пример 4. Эффект соединений на продукцию окиси азота в клетках RAW264.7. Окислительный стресс и воспаление относятся к некоторым хроническим заболеваниям, включая без ограничения сердечно-сосудистые заболевания, рак, сахарный диабет, артрит, болезнь Альцгеймера и аутоиммунные заболевания. Окись азота (NO), производимая синтазой оксида азота, была идентифицирована как важная молекула, принимающая активное участие в воспалении и сепсисе. Индуцируемая синтаза оксида азота (iNOS) не экспрессируется в нормальных условиях. Однако после воздействия эндогенных и экзогенных стимулов она может индуцироваться в различных клетках, таких как макрофаги,гладкомышечные клетки и гепатоциты, с инициированием некоторых неблагоприятных клеточных реакций, таких как воспаление. Следовательно, содержание iNOS может отражать степень воспаления, позволяя тем самым количественно оценить эффекты лекарств на воспалительный процесс. Эффект выбранных соединений на продукцию окиси азота определяли на клетках RAW264.7 (макрофагоподобных). Клетки RAW264.7 выращивали с 1 мкг/мл LPS и 0,5 нг/мл интерферона в присутствии или отсутствие соединений в течение 16 ч в условиях увлажненной атмосферы с 95% воздуха/5% углекислого газа при 37 С. Измерения окиси азота в культуральной среде проводили с помощью реагента Грисса после инкубации в течение 30 мин при комнатной температуре. Считывали поглощение при 548 нм и сравнивали со стандартными растворами NaNO2. Жизнеспособность клеток оценивали с добавлением 50 мкл МТТ. После инкубации в течение 4 ч среду удаляли, и добавляли 150 мкл ДМСО для растворения кристаллических веществ. Оптическую плотность считывали при 570 нм относительно контроля,полученного из лунок, не содержащих клеток. На фиг. 4 представлен эффект выбранных типичных соединений на продукцию NO. Все соединения индуцируют значительное ингибирование продукции NO, зависящее от дозы. Пример 5. Эффект защиты почек соединением I in vivo в модели на крысах после 5/6 нефрэктомии. Демонстрацию защитного эффекта соединения I in vivo в отношении почечной ткани проводили в модели на крысах после 5/6 нефрэктомии (Nx) с использованием следующей методики. Самцов крысWistar в возрасте 6 недель подвергали 5/6 нефрэктомии или имитации операции. Иссечение почки проводили при анестезии флюотаном путем удаления двух третей левой почки с последующей односторонней нефрэктомией спустя 7 суток. При имитации операции крысы подвергались обнажению почек и удалению периренального жира. Спустя двадцать одни сутки после первой операции крыс рандомизировали в исследовании по сниженной скорости клубочковой фильтрации (GFR) ими креатинина, что указывает на дисфункцию почки. Животным, подвергшимся имитации операции, вводили носитель (физиологический раствор) и использовали их в качестве контроля. Животных с Nx разделяли на группы, получавшие носитель или соединение I. Физиологический раствор или соединение I вводили через желудочный зонд ежесуточно вплоть до умерщвления. GFR измеряли каждые три недели для оценки тяжести в данной модели с терминальной стадией заболевания почек. Крыс умерщвляли на 190 сутки. На фиг. 5 представлено GFR (выведение креатинина) у крыс с Nx и у крыс с Nx, обработанных соединением I, по сравнению с животными, подвергшимися имитации операции. Соединение I улучшаетGFR в два раза на 190 сутки. На фиг. 6 представлено улучшение GFR у крыс с Nx и у крыс с Nx, обработанных соединением I, в течение периода лечения по сравнению с первоначальным GFR (до обработки) на 21 сутки. Наблюдали 50% улучшение GFR у крыс с Nx, обработанных соединением I, по сравнению с 50% ухудшением GFR у крыс с Nx (контроль). Пример 6. Эффект защиты сердца соединением I in vivo у крыс после 5/6 нефрэктомии. Демонстрацию эффекта защиты сердца соединения I in vivo проводили в модели на крысах после 5/6 нефрэктомии (Nx) с использованием методики, описанной в примере 1. Вкратце, с помощью аппаратаRTBP 2000 (Kent Scientific) регистрировали кровяное давление у крыс после 5/6 нефрэктомии для де- 25022445 монстрации того, что соединение I оказывает защитный эффект на сердце у крыс с тяжелыми нарушениями после 5/6 нефрэктомии. Наблюдали значительное снижение кровяного давления у крыс с Nx, обработанных соединением I (фиг. 7). Пример 7. Эффект защиты почек соединением I in vivo в модели индуцированной доксорубицином нефротоксичности. Демонстрацию защитного эффекта соединения I in vivo при пероральном введении проводили в модели индуцированной доксорубицином нефротоксичности с использованием следующей методики. Мышей C57BL/6 (в возрасте 6-10 недель) подвергали профилактической обработке соединением I с -3 суток до 10 суток или терапевтической обработке с 1 по 10 сутки. Нефротоксичность индуцировали внутривенной инъекцией 10 мг/кг доксорубицина на 0 сутки. Контролировали содержание сывороточного альбумина и креатинина на 4, 7, 9 и 11 сутки. Профилактическая обработка соединением I ингибирует индуцированное доксорубицином снижение содержания сывороточного альбумина. Терапевтическая обработка соединением I не оказывает эффекта на индуцированное доксорубицином содержание сывороточного альбумина (фиг. 8). Профилактическая обработка соединением I ингибирует индуцированное доксорубицином повышение содержания сывороточного креатинина. Терапевтическая обработка соединением I также ингибирует индуцированное доксорубицином повышение содержания сывороточного креатинина (фиг. 9). Хорошо известно, что доксорубицин вызывает нефро- и кардиотоксичность. На фиг. 10 представлен показатель гистологического повреждения почек, определенный гистохимически в модели индуцированной доксорубицином нефротоксичности. Как представлено на фиг. 9, доксорубицин индуцирует значительные повреждения почек на 7 и 11 сутки. Профилактическая (до введения доксорубицина) и терапевтическая (после введения доксорубицина) обработки соединением I уменьшают индуцированные доксорубицином повреждения почек на уровне канальцев. Доксорубицин вызывает ранние повреждения, главным образом, в области канальцев. В дальнейшем токсичность распространяется на клубочек (приблизительно на 11 сутки после введения доксорубицина). На фиг. 11 представлены гистологические микрофотографии индуцированных доксорубицином повреждений у мышей в контроле и у мышей, обработанных соединением I (профилактическая обработка). Доксорубицин индуцирует апоптоз клеток почек, фиброз, склероз и накопление белков в пораженных областях клубочков. Профилактическая или терапевтическая обработка соединением I защищает почки от токсичности доксорубицина. Механизм, по которому соединение I, по-видимому, защищает от индуцированной доксорубицином нефротоксичности, включает ингибирование фиброза, что демонстрируется путем значительного ингибирования экспрессии CTGF в почках, обработанных соединением I. На фиг. 12 представлена экспрессия кодирующей CTGF мРНК. Доксорубицин увеличивает экспрессию кодирующей CTGF мРНК в почках на 24,1%. Предобработка соединением I вызывает значительное снижение экспрессии CTGF, демонстрируя тем самым противофиброзную активность соединения I.CTGF также регулируется TGF-. На фиг. 13 представлена экспрессия кодирующей TGF- мРНК в почках. Доксорубицин увеличивает экспрессию кодирующей TGF- мРНК в почках на 73%. Предобработка соединением I вызывает снижение экспрессии TGF- на 26%. Заголовки включены в этот документ для ссылки и с целью облегчения поиска определенных разделов. Эти заголовки не предназначены для ограничения объема понятий, описанных под ними, и эти понятия могут быть применимы и в других разделах по всему описанию. Таким образом, не подразумевается ограничение настоящего изобретения вариантами осуществления, представленными в этом документе, но ему должен быть предоставлен наиболее широкий объем в соответствии с раскрытыми в этом документе принципами и новыми признаками. Используемые в этом документе и в приложенной формуле изобретения формы единственного числа относятся к ссылкам во множественном числе, если в контексте иное не указано особо. Так, например,ссылка на "соединение" относится к одному или нескольким таким соединениям, а ссылка на "способ" включает ссылку на эквивалентные стадии и способы, известные средним специалистам в данной области техники, которые могут быть модифицированы или заменены на способы, описанные в этом документе. Если иное не указано особо, то все используемые в описании и формуле изобретения числа, выражающие количества ингредиентов, реакционные условия, концентрации, свойства и т.д., следует понимать как модифицированные во всех случаях термином "приблизительно". По крайней мере, каждый числовой параметр, по меньшей мере, должен быть интерпретирован в свете числа изложенных значащих цифр и путем применения обычных методов округления. Соответственно, если не указано обратное,то числовые параметры, изложенные в настоящем описании и приложенной формуле изобретения, представляют собой приблизительные величины, которые могут изменяться в зависимости от свойств, намеченных к достижению. Несмотря на то, что числовые диапазоны и параметры, отражающие широкий объем вариантов осуществления, являются приблизительными, числовые значения, изложенные в конкретных примерах, представлены как можно точнее. Однако любое числовое значение, по существу, со- 26022445 держит некоторые ошибки, возникающие в результате вариаций в экспериментах, измерениях при испытаниях, статистических анализах и т.п. Понятно, что примеры и варианты осуществления, описанные в этом документе, предназначены исключительно для иллюстративных целей и что в свете этого специалистам в данной области техники будут предложены различные модификации или изменения, и они подлежат включению в настоящее изобретение и объем приложенной формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой II или его фармацевтически приемлемая соль, гдеQ представляет собой С 1-С 4 алкил, необязательно замещенный одним заместителем Ra;Rc и Rd независимо выбраны из Н или С 1-С 4 алкила. 2. Соединение по п.1, в котором фармацевтически приемлемая соль представляет собой основноаддитивную соль, и основно-аддитивная соль содержит противоион металла, выбранного из группы, состоящей из натрия, магния, кальция, калия и лития. 3. Соединение по п.2, в котором противоион металла представляет собой натрий. 4. Соединение по любому из пп.1-3, где соединение выбрано из группы, состоящей из
МПК / Метки
МПК: A61K 31/44, C07D 257/04, C07C 57/30, A61K 31/41, A61P 29/00, A61P 13/12, A61K 31/192, C07C 59/52, C07C 61/39, C07C 59/48, C07C 57/58, C07D 213/55
Метки: основе, соединения, композиции, применения, замещенные, ароматические, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-22445-zameshhennye-aromaticheskie-soedineniya-kompozicii-na-ih-osnove-i-ih-farmacevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные ароматические соединения, композиции на их основе и их фармацевтические применения</a>
Предыдущий патент: Устройство для измерения плотности текучей среды
Следующий патент: Система оштукатуривания фасада здания












