Применение toll-подобного рецептора и агониста для лечения рака
Формула / Реферат
1. Экспрессирующий вектор, содержащий первую и вторую нуклеиновую кислоту, где первая нуклеиновая кислота кодирует Toll-подобный рецептор 5 (TLR5), а вторая - флагеллин.
2. Вектор по п.1, где вектор представляет собой экспрессионный вектор млекопитающих.
3. Вектор по п.1, где вектор экспрессируется с аденовируса, лентивируса или липосомы.
4. Вектор по п.1, где первая нуклеиновая кислота представляет собой секретируемую форму Toll-подобного рецептора.
5. Вектор по п.1, где флагеллин представляет собой секретируемую форму флагеллина.
6. Вектор по п.5, где секретируемая форма флагеллина содержит тринадцать консервативных аминокислот флагеллина, показанных на фиг. 5, которые могут быть важны для активности TLR5.
7. Вектор по п.1, где первая нуклеиновая кислота содержит последовательность, как показано на фиг. 7, и вторая нуклеиновая кислота содержит последовательность, как показано на фиг. 9.
8. Способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, содержащего вектор по п.1.
9. Способ по п.8, где рак представляет собой опухоль.
10. Способ по п.9, где опухоль имеет происхождение из группы, состоящей из простаты, молочной железы, ободочной кишки, пищевода, желудка, легкого, поджелудочной железы, почки, щитовидной железы, яичников, гортани или шейки матки.
11. Способ по п.9, где опухоль имеет происхождение из группы, состоящей из сарком, меланом, лейкозов и лимфом.
12. Способ по п.9, где агент вводят in trans по отношению к опухоли млекопитающего.
13. Способ по п.9, где агент вводят непосредственно в опухоль млекопитающего.
14. Способ по п.8, где агент вводят в комбинации с иммуностимулятором.
15. Способ по п.8, где иммуностимулятор выбран из группы, состоящей из гормона роста, пролактина и витамина D.
16. Способ по п.15, где гормон роста представляет собой соматотропин.
17. Способ по п.8, где агент вводят в комбинации с цитокином.
18. Способ по п.17, где цитокин представляет собой фактор стволовых клеток.
19. Способ лечения инфекции у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, содержащего вектор по п.1.
20. Способ по п.19, где инфекция представляет собой инфекцию, вызванную организмом, выбранным из группы, состоящей из вируса, бактерии, простейших паразитов и гриба.
Текст
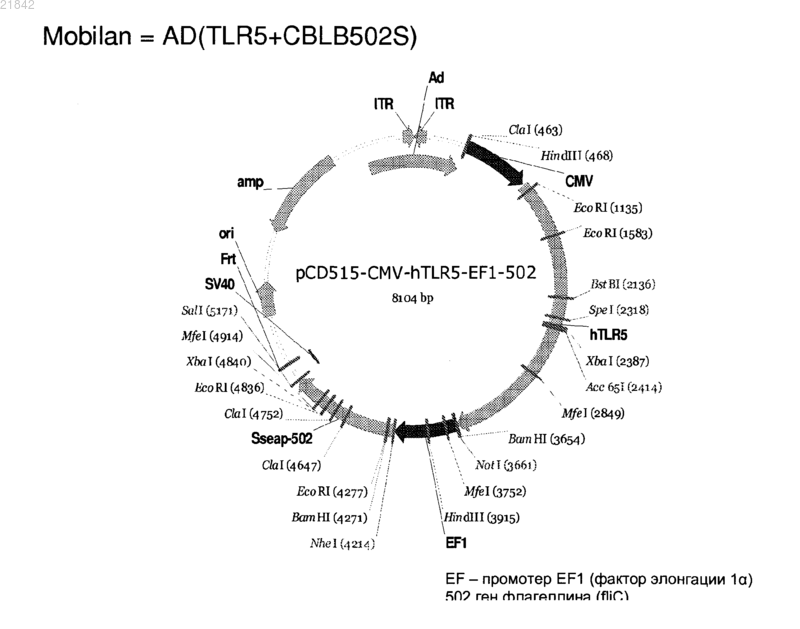
ПРИМЕНЕНИЕ TOLL-ПОДОБНОГО РЕЦЕПТОРА И АГОНИСТА ДЛЯ ЛЕЧЕНИЯ РАКА Настоящее изобретение направлено на способы и агенты, применяемые для лечения рака или инфекционных заболеваний путем обеспечения toll-подобными рецепторами, такими как tollподобный рецептор 5 (TLR-5), в комбинации с обеспечением агонистами toll-подобных рецепторов,такими как флагеллин, что приводит в результате к цис- и транс-эффекту, который рекрутирует клетки, вовлеченные как во врожденный (цис-эффект), так и в адаптивный (транс-эффект) иммунный ответ, для специфичного уничтожения раковых клеток и клеток, инфицированных патогеном, посредством биохимического пути апоптоза NF-kB."ПАНАЦЕЛА ЛАБС" (RU); РОСВЕЛЛ ПАРК КЭНСЕР ИНСТИТЬЮТ (US) Область изобретения Данное изобретение относится к способам лечения рака и инфекционных заболеваний. Предшествующий уровень техникиToll-подобные рецепторы ответственны за распознавание большинства общих паттернов бактериальных и вирусных патогенов. Их активация приводит в результате к рекрутменту врожденного, а впоследствии адаптивного иммунного ответа. Рецепторные клетки иммунной системы к сайту присутствия антигенов являются ключевой стадией в эффективном иммунном ответе. Именно поэтому в иммунизацию вовлечено применение различных типов адъювантов. Хотя большинство опухолей экспрессирует опухолеспецифические антигены, они используют ряд механизмов, позволяющих им избежать иммунного распознавания. Недавно было продемонстрировано в мышиных моделях, что активация TLR5 его лигандом и агонистом, бактериальным флагеллином, приводит в результате к индукции противоопухолевого эффекта против тех опухолей, которые экспрессируют функциональный TLR5. Это открывает широкую возможность для рассмотрения агонистов TLR5 для иммунотерапии рака. На пути доведения этой идеи до практики существует два основных препятствия. Во-первых, это редкая встречаемость опухолей,экспрессирующих функциональный TLR5, ограничивающая применимость данного подхода лишь к небольшой подгруппе опухолей. Во-вторых, системное введение агониста TLR5 приводит к активации передачи сигнала TLR5 во всех клетках, которые имеют функциональный рецептор, делая этот ответ не сфокусированным и не опухолеспецифическим. Соответственно, в данной области техники существует потребность в механизме или способе аутокринной активации передачи сигнала рецептором TLR в инфицированных или опухолевых клетках при минимальном системном эффекте, обеспечивающем, таким образом, привлечение врожденного иммунного ответа специфично к инфицированной клетке или опухоли. Краткое изложение сущности изобретения Настоящее изобретение может быть направлено на вектор, содержащий первую и вторую нуклеиновые кислоты, где первая нуклеиновая кислота кодирует toll-подобный рецептор, а вторая нуклеиновая кислота кодирует агонист toll-подобного рецептора. Первая нуклеиновая кислота может кодировать секретируемую форму toll-подобного рецептора. Вторая нуклеиновая кислота может кодировать секретируемую форму флагеллина. Агонист toll-подобного рецептора может представлять собой флагеллин. Вектор может представлять собой экспрессионный вектор млекопитающих. Вектор может экспрессироваться с аденовируса, лентивируса или липосомы. Секретируемой формой флагеллина может бытьCBLB502S. Toll-подобный рецептор может представлять собой TLR-5. Настоящее изобретение может быть направлено на способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, включающего вектор, содержащий первую и вторую нуклеиновые кислоты, где первая нуклеиновая кислота кодирует toll-подобный рецептор, а вторая нуклеиновая кислота кодирует агонист toll-подобного рецептора. Рак может представлять собой опухоль. Опухоль может иметь происхождение из группы, состоящей из простаты, молочной железы, ободочной кишки, пищевода, желудка, легкого, поджелудочной железы, почки, щитовидной железы, яичников, гортани или шейки матки. Опухоль может иметь происхождение из группы, состоящей из сарком, меланом, лейкозов и лимфом. Агент можно вводить in trans или вне опухоли млекопитающего. Агент можно вводить непосредственно в опухоль млекопитающего. Агент можно вводить в комбинации с иммуностимулятором. Иммуностимулятор может быть выбран из группы, состоящей из гормона роста,пролактина и витамина D. Гормон роста может представлять собой соматотропин. Агент можно вводить в комбинации с цитокином. Цитокин может представлять собой фактор стволовых клеток. Настоящее изобретение также направлено на способ лечения инфекции у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, включающего вектор, содержащий первую и вторую нуклеиновую кислоту, где первая нуклеиновая кислота кодирует toll-подобный рецептор, а вторая нуклеиновая кислота кодирует агонист toll-подобного рецептора. Рак может представлять собой опухоль. Инфекция может иметь происхождение из группы, состоящей из вирусов, бактерий, простейших паразитов. Краткое описание графических материалов На фиг. 1 А-1 С изображены схематические карты аденовирусных векторов, экспрессирующихTLR5, CBLB502S и их комбинацию (TLR5 + CBLB502S). На фиг. 2 изображены результаты отношения объема опухоли у мышей за число суток в опухолевых клетках (А 549), трансдуцированных контрольным вектором (без TLR5) или вектором, экспрессирующим TLR5, где мышей обрабатывали трое суток либо CBLB502, либо ФСБ. На фиг. 3 изображена супрессия опухолевого роста инъекцией вектора, содержащего аденовирус,совместно экспрессирующего CBLB502S и toll-подобный рецептор, где аденовирус инъецируют изогенным мышам с опухолью, представляющей собой карциному ободочной кишки СТ 26, и исследование эффектов in-cis и in-trans аденовирусных векторных конструкций. На фиг. 4 показана доменная структура бактериального флагеллина. Запись Са скелета, распределение гидрофобной сердцевины и структурная информация F41. Четыре отдельные гидрофобные сердцевины, которые определяют домены D1, D2a, D2b и D3. Все атомы гидрофобных боковых цепей выявле-1 021842 ны с Са скелетом. Атомы боковых цепей имеют цветовой код: Ala, желтый; Leu, Ile или Val, оранжевый;Phe и Tyr, пурпурный (атомы углерода) и красный (атомы кислорода), с, положение и область различных структурных признаков в аминокислотной последовательности флагеллина. Показаны сверху вниз: фрагмент F41 синим цветом; три складки -листа коричневым цветом; распределение вторичной структуры с -спиралью желтым цветом, -структуры зеленым цветом и -изгиб пурпурным цветом; периодическая метка на каждом 50-м остатке синим цветом; домены D0, D1, D2 и D3; область осевого контакта субъединиц без прото-элемента голубым цветом; высоко консервативная аминокислотная последовательность красным цветом и вариабельная область фиолетовым цветом; точечные мутации в F41, которые продуцируют элементы различных суперспиралей. Буквами снизу указана морфология мутантных элементов: L (D107E, R124A, R124S, G426A), прямая L-типа; R (A449V), прямая R-типа; С (D313Y,A414V, A427V, N433D), скрученный 33. На фиг. 5 показано схематическое изображение доменов Salmonella, их фрагментов и взаимодействия с TLR5. Темные полосы обозначают участки гена флагеллина, использованные для конструирования фрагментов, содержащих А, В, С, А' и В'. На фиг. 6 изображены производные флагеллина. Доменная структура и примерные границы (координаты аминокислот) избранных производных флагеллина (перечисленных справа). Домен FliC флагеллина Salmonella dublin обозначен в пределах 505 аминокислот (ак). На фиг. 7 показаны нуклеиново-кислотная и аминокислотная последовательность для нижеследующих вариантов флагеллина: АА' (SEQ ID NO: 7-8), АВ' (SEQ ID NO: 9-10), BA' (SEQ ID NO: 11-12),BB' (SEQ ID NO: 13-14), CA' (SEQ ID NO: 15-16), CB' (SEQ ID NO: 17-18), A (SEQ ID NO: 19- 20), ВAB'n1-70 (SEQ ID NO: 55-56). Лидерная последовательность pRSETb показана курсивом (лидер включает Met, который также является аминокислотой 1 FliC). N-концевой константный домен подчеркнут. Аминокислотная линкерная последовательность выделена жирным шрифтом. С-концевой константный домен подчеркнут. GST, если присутствует, выделен. На фиг. 8 показано сравнение аминокислотных последовательностей консервативного амино (фиг. 8 А) и карбокси (фиг. 8 В) конца из 21 вида бактерий. 13 Консервативных аминокислот, важных для активности TLR5, показаны затенением. Аминокислотные последовательности идентифицируют по их номерам по каталогу TrEMBL (первая буква = Q) или Swiss-Prot (первая буква = Р). На фиг. 9 показаны нуклеиново-кислотная и аминокислотная последовательность для белка tollподобного рецептора 5 человека. Подробное описание Авторы изобретения сделали неожиданное открытие, что обеспечение toll-подобным рецептором,таким как toll-подобный рецептор 5 (TLR-5), в комбинации с агонистом toll-подобного рецептора, таким как флагеллин, приводит в результате к цис- и транс-эффекту, который рекрутирует клетки, вовлеченные как во врожденный (цис-эффект), так и в адаптивный (транс-эффект) иммунный ответ, для специфичного уничтожения раковых клеток и клеток, инфицированных патогеном, посредством биохимического пути апоптоза NF-B. Не являясь связанной теорией, идея, примененная в данном изобретении, состояла в (i) преодолении зависимости TLR-опосредованных стратегий иммунизации от предсуществующей экспрессии TLR в опухоли путем трансдукции опухоли конструкцией, направляющей экспрессию TLR; и (ii) направлении иммунного ответа на опухоль за счет создания локального пула агониста TLR. Например,лекарственные препараты, содержащие TLR, одновременно индуцируют экспрессию и активируют TLR,подвергая посредством этого опухолевые клетки воздействию иммунной системы хозяина, имитирующему ситуацию массивного проникновения бактерий через стенку тонкого кишечника. За счет обеспечения TLR, таким как TLR5, и агонистом TLR, таким как флагеллин, для взаимодействия и активации как врожденной, так и адаптивной иммунной системы, этот способ можно применять для лечения опухолей, имеющих происхождение от рака простаты, молочной железы, ободочной кишки,пищевода, желудка, легкого, поджелудочной железы, почки, щитовидной железы, яичников, гортани или шейки матки, а также для лечения сарком, меланом, лейкозов и лимфом. Применения данного способа не ограничены терапиями рака, поскольку данный способ можно также применять для лечения инфекций,имеющих происхождение от вирусов, бактерий, простейших паразитов и грибов. Варианты обеспечения TLR и агонистом TLR могут включать векторы, совместно экспрессирующие рецептор TLR и секретируемую форму флагеллина, который активирует активность TLR в одной и той же аномальной клетке млекопитающего. Способ по настоящему изобретению может также включать векторные конструкции, которые экспрессируют рецептор TLR в клетке млекопитающего и агонистTLR, которые вводят в клетку in trans. Например, для аденовирусного вектора может требоваться модификация флагеллина, чтобы дос-2 021842 тичь его эффективного синтеза и секреции клетками млекопитающего. 1. Определения Терминология, используемая в данной заявке, предназначена только для цели описания конкретных форм осуществления и не должна истолковываться как ограничивающая. Как используют в описании и прилагаемой формуле изобретения, формы единственного числа включают соответствующие формы множественного числа, если контекстом четко не продиктовано иное. Для перечисления в данной заявке числовых интервалов в прямой форме рассматривают каждое промежуточное число между ними с такой же степенью точности. Например, для интервала 6-9 числа 7 и 8 рассматривают в дополнение к 6 и 9, а для интервала 6,0-7,0 в прямой форме рассматривают числа 6,0,6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 и 7,0."Введение" может означать однократную дозу или многократные дозы агента или агент."Аналог" может означать, в контексте пептида или полипептида, пептид или полипептид, содержащий одну или более чем одну нестандартную аминокислоту или другие структурные вариации по сравнению с общепринятым набором аминокислот."Антитело" может означать антитело классов IgG, IgM, IgA, IgD или IgE, либо его фрагменты или производные, включая Fab, F(ab')2, Fd и одноцепочечные антитела, диатела, биспецифические антитела,бифункциональные антитела и их производные. Антитело может представлять собой моноклональное антитело, поликлональное антитело, аффинно-очищенное антитело или их смеси, которые проявляют достаточную связывающую специфичность к желаемому эпитопу или последовательности, имеющей происхождение от него. Антитело может также представлять собой химерное антитело. Антитело может быть дериватизировано присоединением одной или более чем одной химической, пептидной или полипептидной группировки, известной в данной области техники. Антитело может быть конъюгировано с химической группировкой."Производное" может означать пептид или полипептид, отличающийся в ином, чем первичная структура (аминокислоты и аналоги аминокислот). Производные могут отличаться тем, что они гликозилированы, что представляет собой одну из форм посттрансляционной модификации. Например, пептиды или полипептиды могут проявлять паттерны гликозилирования вследствие экспрессии в гетерологичных системах. Если по меньшей мере одна биологическая активность сохраняется, то эти пептиды или полипептиды являются производными в соответствии с изобретением. Другие производные могут включать слитые белки или слитые полипептиды, имеющие ковалентно модифицированный N- или С-конец, пэгилированные пептиды или полипептиды, пептиды или полипептиды, ассоциированные с липидными группировками, алкилированные пептиды или полипептиды, пептиды или полипептиды, сшитые через функциональную группу аминокислоты боковой цепи с другими пептидами, полипептидами или химическими веществами, и дополнительные модификации, которые должны быть понятны специалистам в данной области техники."Фрагмент" может означать участок соответствующего пептида или полипептида."Гомолог" может означать пептид или полипептид, имеющий общего эволюционного предшественника."Лидерная последовательность" может представлять собой нуклеиновую кислоту, кодирующую какую-либо пептидную последовательность, которая сшита и транслируется с интересующим пептидом или полипептидом, давая возможность интересующему пептиду или полипептиду правильно пройти через эндоплазматический ретикулум и комплексы Гольджи эукариотической клетки с целью внеклеточной секреции из мембраны клетки. Лидерная пептидная последовательность может иметь происхождение от щелочной фосфатазы. Лидерная пептидная последовательность может иметь последовательность ДНК, включающую"Липосома" может означать крошечный пузырек (везикулу), состоящий из того же вещества, что и клеточная мембрана. Липосому заполняют лекарственными средствами и используют для доставки лекарственных средств для рака и других заболеваний. Липосома может быть заполнена вектором. Мембрана липосомы может состоять из фосфолипидов, которые представляют собой молекулы, имеющие группу головки и группу хвоста. Головка липосомы может притягиваться к воде, а хвост, который состоит из длинной углеводородной цепи, отталкивается водой. Хвосты могут отталкиваться водой и выстраиваться с образованием поверхности, отталкиваемой от воды. Липиды плазматической мембраны могут представлять собой, главным образом, фосфолипиды, такие как фосфатидилэтаноламин и фосфатидилхолин. Липосомы могут состоять из фосфолипидов природного происхождения со смешанными липидными цепями (таких как фосфатидилэтаноламин куриного яйца) или из чистых сурфактантных компонентов, таких как DOPE"Пептид" или "полипептид" может означать связанную последовательность аминокислот и может быть природным, синтетическим, либо представлять собой модификацию или комбинацию природного и синтетического."По существу, идентичный" может означать, что первая и вторая аминокислотная последовательность идентичны по меньшей мере на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% на протяжении участка 10, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 300,400, 500, 600, 700, 800, 900, 1000, 1100 аминокислот. Каждое из "лечение", "терапия" или "лечить" может означать облегчать, подавлять, ингибировать,устранять, предупреждать или замедлять появление симптомов, клинических признаков или лежащей в основе патологии состояния или расстройства на временной или постоянной основе. Предупреждение состояния или расстройства включает введение агента по настоящему изобретению субъекту до начала заболевания. Подавление состояния или расстройства включает введение агента по настоящему изобретению субъекту после индукции состояния или расстройства, но до его клинического проявления. Ингибирование состояния или расстройства включает введение агента по настоящему изобретению субъекту после клинического проявления заболевания."Вариант" может означать пептид или полипептид, который отличается по аминокислотной последовательности инсерцией, делецией или консервативной заменой аминокислот, но сохраняет по меньшей мере одну биологическую активность. Репрезентативные примеры "биологической активности" включают способность к связыванию с toll-подобным рецептором и к связыванию специфичным антителом. Вариант может также означать белок с аминокислотной последовательностью, которая, по существу,идентична соответствующему белку с аминокислотной последовательностью, который сохраняет по меньшей мере одну биологическую активность. Консервативная замена аминокислоты, то есть замещение аминокислоты другой аминокислотой подобных свойств (например, гидрофильности, степени и распределения заряженных участков), признана в данной области техники как типично включающая минорное изменение. Эти минорные изменения могут быть идентифицированы отчасти путем учета гидропатического индекса аминокислот, как понятно в данной области техники (Kyte et al., J. Mol. Biol. 157: 105132 (1982. Гидропатический индекс аминокислоты основан на учете ее гидрофобности и заряда. В данной области техники известно, что аминокислоты подобных гидропатических индексов могут быть заменены и все же сохраняют функцию белка. В одном аспекте заменяют аминокислоты, имеющие гидропатические индексы 2. Гидрофильность аминокислот можно также использовать для выявления замен,которые приведут в результате к белкам, сохраняющим биологическую функцию. Учет гидрофильности аминокислот в контексте пептида дает возможность вычисления самой высокой локальной средней гидрофильности этого пептида, полезной меры, которая, как сообщалось, хорошо коррелирует с антигенностью и иммуногенностью. Патент США 4554101 полностью включен в данную заявку посредством ссылки. Замена аминокислот, обладающих подобными значениями гидрофильности, может привести в результате к пептидам, сохраняющим биологическую активность, например, иммуногенность, как понятно в данной области техники. Замены можно осуществлять аминокислотами, имеющими значения гидрофильности в пределах 2 друг от друга. Как на индекс гидрофобности, так и на значение гидрофильности аминокислот влияет определенная боковая цепь данной аминокислоты. В соответствии с этим наблюдением понятно, что замены аминокислот, которые совместимы с биологической функцией, зависят от относительного подобия аминокислот, и, в частности, от боковых цепей этих аминокислот, как выявлено на основании гидрофобности, гидрофильности, заряда, размера и других свойств."Вектор" может означать нуклеиново-кислотную последовательность, содержащую точку начала репликации. Вектор может представлять собой плазмиду, искусственную хромосому дрожжей или млекопитающих. Вектор может представлять собой РНК или ДНК вектор. Вектор может представлять собой либо автономно реплицирующийся экстрахромосомный вектор, либо вектор, который интегрирует в геном хозяина. 2. Toll-подобный рецептор В данной заявке предложен toll-подобный рецептор (TLR), который может относиться к типу рецепторов образования структур (PRR). TLR может распознавать молекулы, которые представляют собой консервативные молекулярные продукты, имеющие происхождение от патогенов, которые включают грамположительные, грамотрицательные бактерии, грибы и вирусы, но являются отличимыми от молекул хозяина, которые все вместе называют патоген-ассоциированными молекулярными паттернами(PAMP). TLR могут также распознавать эндогенные молекулы, высвобождаемые из поврежденных или умирающих клеток, которые все вместе называют молекулярными паттернами, ассоциированными с повреждением (DAMP). PAMP или DAMP могут быть агонистом TLR, как дополнительно описано ниже.TLR может представлять собой фрагмент, вариант, аналог, гомолог или производное, которые рекрутируют адаптерные молекулы в пределах цитоплазмы клеток с целью распространения сигнала. TLR может иметь происхождение от человека или других видов млекопитающих, таких как макак резус, мышь или крыса. TLR может быть по меньшей мере на 30-99% идентичен TLR, который рекрутирует адаптерные молекулы в пределах цитоплазмы клеток с целью распространения сигнала.TLR может представлять собой один из типов TLR в количестве от десяти до пятнадцати, которые по оценкам существуют в большинстве видов млекопитающих. TLR может представлять собой один из 13 TLR (называемых просто TLR1-TLR13), которые идентифицированы совместно у людей и мышей,либо может представлять собой эквивалентную форму, которая обнаружена у других видов млекопи-4 021842 тающих. TLR может представлять собой один из 11 членов (TLR1-TLR11), которые идентифицированы у людей.TLR может экспрессироваться различными типами иммунных клеток и может быть локализован на клеточной поверхности или в цитоплазме клетки. TLR может экспрессироваться на раковых клетках.TLR может экспрессироваться нормальными эпителиальными клетками в пищеварительной системе,нормальными кератиноцитами в коже, альвеолярными и бронхиальными эпителиальными клетками и эпителиальными клетками женских половых путей. Эти клетки, выстилающие орган, могут быть первой линией защиты против инвазии микроорганизмов, и TLR, экспрессирующиеся в эпителиальных клетках,могут играть критическую роль в регуляции пролиферации и апоптоза.TLR-экспрессирующая раковая клетка может быть выбрана из приведенной ниже табл. 1. Таблица 1. Экспрессия TLR в раковых клетках человекаTLR, экспрессирующиеся на раковых клетках, могут осуществлять повышающую регуляцию каскада NF-B и продуцировать антиапоптические белки, которые вносят вклад в канцерогенез и пролиферацию раковых клеток. Известно, что четыре адаптерные молекулы TLR вовлечены в передачу сигнала. Эти белки известны как фактор миелоидной дифференцировки 88 (MyD88), Tirap (также называемый Mai), Trif и Tram. Адаптеры активируют другие молекулы внутри клетки, включая некоторые протеинкиназы (IRAK1,IRAK4, TBK1 и IKKi), которые амплифицируют сигнал, и, в конечном счете, приводят к индукции или супрессии генов, которые управляют воспалительным ответом. Биохимические пути передачи сигналаTLR в процессе распознавания патогена могут индуцировать иммунные реакции посредством внеклеточных и внутриклеточных биохимических путей, опосредованных MyD88, ядерным фактором - энхансером легкой цепи каппа активированных В клеток (NF-В) и митоген-ассоциированной протеинкиназой(MAPK). В целом, тысячи генов активируются передачей сигнала TLR, и все вместе TLR составляют один из наиболее плейотропных, хотя и строго регулируемых шлюзов для модулирования генов.TLR вместе с рецепторами интерлейкина-1 образует надсемейство рецепторов, известное как "надсемейство рецепторов интерлейкина-1/toll-подобных рецепторов". Все члены этого семейства имеют общий так называемый домен TIR (toll-IL-1 рецептор). Может существовать три подгруппы доменов TIR. Белки с доменами TIR подгруппы I являются рецепторами интерлейкинов, которые продуцируются макрофагами, моноцитами и дендритными клетками и все имеют внеклеточные домены иммуноглобулина(Ig). Белки с доменами TIR подгруппы II представляют собой классические TLR и связываются непосредственно или опосредованно с молекулами микробного происхождения. Третья подгруппа белков,содержащих домены TIR (III), состоит из адаптерных белков, которые являются исключительно цитозольными и опосредуют передачу сигнала от белков подгрупп 1 и 2. TLR может представлять собой фрагмент, вариант, аналог, гомолог или производное, которые сохраняют домен TIR подгруппы I, доменTLR может функционировать в виде димера. Например, хотя большинство TLR, по-видимому,функционирует в виде гомодимеров, TLR2 образует гетеродимеры с TLR1 или TLR6, где каждый димер имеет отличающуюся лигандную специфичность. TLR может также зависеть от других корецепторов для полной лигандной специфичности, как, например, в случае распознавания TLR4 ЛПС, для которого требуются MD-2. CD14 и ЛПС-связывающий белок (LBP), который, как известно, способствует презентированию ЛПС MD-2. а) TLR1TLR может представлять собой TLR1, который распознает РАМР со специфичностью к грамположительным бактериям. TLR1 также обозначен как CD281. б) TLR5TLR может представлять собой toll-подобный рецептор 5. Белок, кодируемый TLR-5, может играть фундаментальную роль в распознавании патогена и активации врожденного иммунитета. TLR-5 может распознавать РАМР, которые экспрессируются на инфекционных агентах, и опосредует продуцирование цитокинов, необходимых для развития эффективного иммунитета. TLR-5 может распознавать бактериальный флагеллин, основной компонент жгутиков бактерий и фактор вирулентности. Активация TLR может мобилизовать ядерный фактор NF-В и стимулировать продуцирование фактора некроза опухоли альфа. 3. Агонист toll-подобного рецептора В данной заявке также предложен агонист TLR. Агонист TLR может представлять собой РАМР, который может представлять собой консервативный молекулярный продукт, имеющий происхождение от патогена. Патоген может представлять собой грамположительную бактерию, грамотрицательную бактерию, гриб или вирус. Агонист TLR может представлять собой лиганд молекулярного паттерна, ассоциированного с повреждением (DAMP), который может представлять собой эндогенную молекулу, высвобождаемую из поврежденных или умирающих клеток. DAMP или РАМР может инициировать иммунный ответ посредством сигналов TLR и рекрутировать адаптерные молекулы внутри цитоплазмы клеток с целью распространения сигнала. Агонист TLR может быть агонистом для TLR, который может представлять собой лиганд из приведенных в табл. 2. Таблица 2. TLR и лиганды Агонист TLR может представлять собой фрагмент, вариант, аналог, гомолог или производное, либо РАМР или DAMP, которые связывают TLR и индуцируют TLR-опосредованную активность, такую как активация активности NF-В. Фрагмент, вариант, аналог, гомолог или производное агониста TLR могут быть идентичны по меньшей мере на 30-99% аминокислотам агониста TLR и индуцируют TLRопосредованную активность. Мишенью агониста TLR может быть TLR, такой как TLR-5. Агонист TLR может представлять собой агонист TLR-5 и стимулировать активность TLR-5. Агонист TLR может представлять собой антитело анти-TLRS или другую малую молекулу. Агонист TLR может представлять собой флагеллин. Флагеллин может также представлять собой флагеллин или полипептид, родственный флагеллину. Флагеллин может иметь происхождение из любого источника, включая ряд видов грамположительных и грамотрицательных бактерий. Флагеллин может представлять собой полипептид флагеллина из любого вида грамположительных или грамотрицательных бактерий, включая, но не ограничиваясь ими, полипептид флагеллина, раскрытый в публикации патента США 2003/000044429, содержание которой полностью включено в данную заявку посредством ссылки. Например, флагеллин может иметь аминокислотную последовательность из вида бактерий, изображенную на фиг. 7 публикации патента США 2003/000044429, нуклеотидные последовательности полипептидов флагеллина, перечисленные на фиг. 7 публикации патента США 2003/000044429, общедоступны из источников, включающих базу данныхNCBI GenBank. Флагеллин может также представлять собой пептид флагеллина, соответствующий номеру по каталогу, указанному в результатах BLAST, представленных на фиг. 25 публикации патента США 2003/000044429, или его вариант. Флагеллин может также представлять собой полипептид флагеллина, который раскрыт в заявке на патент США 2009/0011982, содержание которой полностью включено в данную заявку посредством ссылки. Флагеллин может представлять собой любой из полипептидов флагеллина, которые раскрыты на фиг. 6 и 7 данной заявки. Флагеллин может представлять собой фрагмент, вариант, аналог, гомолог или производное флагеллина, которые связывают TLR5 и индуцируют TLR5-опосредованную активность, такую как активация активности NF-B. Фрагмент, вариант, аналог, гомолог или производное флагеллина может быть по меньшей мере на 30-99% идентичен аминокислотам флагеллина, который связывает TLR5 и индуцируетTLR5-опосредованную активность. Флагеллин может иметь происхождение из вида Salmonella, репрезентативным примером которых является S. dublin (кодируемый номером по каталогу GenBank M84972). Полипептид, родственный флагеллину, может представлять собой фрагмент, вариант, аналог, гомолог или производное М 84972, либо их комбинацию, которые связывают TLR5 и индуцируют TLR5-опосредованную активность, такую как активация активности NF-B. Фрагмент, вариант, аналог, гомолог или производное флагеллина можно получить путем рационального конструирования на основе доменной структуры флагеллина и консервативной структуры, распознаваемой TLR5. Флагеллин может содержать по меньшей мере 10, 11, 12 или 13 из 13 консервативных аминокислот,показанных на фиг. 5 (положения 89, 90, 91, 95, 98, 101, 115, 422, 423, 426, 431, 436 и 452). Флагеллин может быть по меньшей мере на 30-99% идентичен аминокислотам 1174 и 418505 М 84972. На фиг. 26 публикации заявки на патент США 2009/0011982, содержание которой полностью включено в данную заявку, представлен процент идентичности амино- и карбокси-конца флагеллина с известной TLR-5 стимулирующей активностью по сравнению с М 84972. Флагеллин может быть основным компонентом жгутика бактерий. Флагеллин может состоять из трех доменов (фиг. 4). Домен 1 (D1) и домен 2 (D2) могут быть прерывистыми и могут образоваться, когда остатки в амино-конце и карбокси-конце соединяются посредством образования шпилечной структуры. Амино- и карбокси-конец, содержащие домены D1 и D2, могут быть наиболее консервативными,тогда как средний гипервариабельный домен (D3) может быть высоко вариабельным. Исследования с рекомбинантным белком, содержащим амино-D1 и D2 и карбокси-D1 и D2, разделенные шарниром Escherichia coli (ND1-2/ECH/CD2), показывают, что D1 и D2 могут обладать биологической активностью при спаривании с элементом ЕСН. Данная химера, но не отдельная шарнирная область, может индуцировать расщепление IBa, активацию NF-B и продуцирование NO и IL-8 в двух линиях эпителиальных клеток тонкого кишечника. Неконсервативный домен D3 может находиться на поверхности нити жгутика и может содержать основные антигенные эпитопы. Сильная провоспалительная активность флагеллина может находиться в высококонсервативных областях N- и С- D1 и D2 (см. фиг. 4). Флагеллин может индуцировать активность NF-В посредством связывания с toll-подобным рецептором 5 (TLR5). TLR может распознавать консервативную структуру, которая специфична для флагеллина. Консервативная структура может состоять из большой группы остатков, которые являются некоторым образом пермиссивными для вариации в аминокислотном содержании. В статье Smith et al., Nat Immunol. 4:1247-53 (2003), содержание которой включено в данную заявку посредством ссылки, идентифицировано 13 консервативных аминокислот в флагеллине, которые являются частью консервативной структуры, распознаваемой TLR5. Эти 13 консервативных аминокислот флагеллина, которые могут быть важны для активности TLR5, показаны на фиг. 5. Получены различные делеционные мутанты флагеллина, которые сохраняют по меньшей мере некоторую TLR5-стимулирующую активность. Флагеллин может представлять собой такой делеционный мутант, и он представлять собой делеционный мутант, раскрытый в примерах данной заявки. Флагеллин может включать последовательность, транслируемую с номера по каталогу GenBank D13689, в которой отсутствуют аминокислоты 185-306 или 444-492, или с номера по каталогу GenBank M84973, в которой отсутствуют аминокислоты 179-415, либо ее вариант. Флагеллин может включать инсерции транспозона и изменения в вариабельном домене D3. ДоменD3 может быть заменен, частично или полностью, шарнирным или линкерным полипептидом, который позволяет доменам D1 и D2 правильно укладываться, так что этот вариант стимулирует активностьTLR5. Варианты шарнирных элементов можно найти в белке MukB Е. coli, и он может иметь последовательность, как представлено в SEQ ID NO: 3 и 4, либо ее вариант. Флагеллин, как описано выше, может дополнительно содержать лидерную последовательность. Флагеллин, дополнительно содержащий лидерную последовательность, может представлять собойCBLB502S. 4. Агент Данное изобретение также относится к агенту, содержащему терапевтически эффективное количество TLR и агониста TLR. Этот агент может доставлять TLR отдельно от агониста TLR. Агент может представлять собой вектор. Этот вектор может содержать первую нуклеиновую кислоту, кодирующуюTLR, и вторую нуклеиновую кислоту, включающую агонист TLR. Вектор может обладать способностью к трансдукции клеток млекопитающих. Вектор может обладать способностью к бицистронной экспрессии TLR и/или агониста TLR, используя сильные промоторы. Вектор может включать только ген, кодирующий TLR, который может находиться под контролем сильного промотора. Вектор может быть доставлен в клетку млекопитающих посредством вируса или векторной системы, связанной с липосомами. Вирусная векторная система может представлять собой аденовирус или цитомегаловирус. Агент может представлять собой липосому, несущую вектор. Липосома может обладать способностью к трансдукции клеток млекопитающих и к доставке вектора для экспрессии. Агент может представлять собой лекарственный препарат, который одновременно индуцирует экс-7 021842 прессию и активирует TLR, посредством чего опухолевые или инфицированные клетки подвергаются воздействию иммунной системы хозяина, имитируя ситуацию массового проникновения через клетку тонкого кишечника. Агент может представлять собой лекарственный препарат, который экспрессируетTLR в комбинации с агонистом TLR и может быть доставлен системно в растворе для введения, например внутримышечно. Агент может представлять собой лекарственный препарат, который экспрессируетTLR в комбинации с агонистом TLR, который может экспрессироваться с того же вектора, такого как аденовирусная или цитомегаловирусная векторная система. Агент может представлять собой лекарственный препарат, который экспрессирует TLR в комбинации с агонистом TLR, экспрессируемым в форме наночастицы, которая может переносить функциональный агонист к клеточной поверхности клетки млекопитающего. Агент может представлять собой фармацевтический агент, содержащий вышеописанный лекарственный препарат, который может быть получен с использованием способов, хорошо известных в данной области техники. Агент может также включать соагент. Вектор может содержать первую нуклеиновую кислоту, кодирующую TLR, и вторую нуклеиновую кислоту, включающую флагеллин. Вектор может обладать способностью к экспрессии TLR5 и/или флагеллина, используя сильный промотор. Экспрессионный вектор может дополнительно содержать лидерную последовательность, клонированную выше гена, кодирующего TLR или TLR5 и/или флагеллин. Экспрессионный вектор может представлять собой векторную систему на основе pCD515. Экспрессионный вектор может представлять собой pCD515-CMV-hTLR5-EF1-502, как описано на фиг. 1 А. Экспрессионный вектор может представлять собой pCD515-CMV-hTLR5, как описано на фиг. 1 В. Экспрессионный вектор может представлять собой pCD515-CMV-Sseap-502, как описано на фиг. 1 С. Агент может представлять собой лекарственный препарат, который одновременно индуцирует экспрессию и активирует TLR, посредством чего опухолевые или инфицированные клетки подвергаются воздействию иммунной системы хозяина, имитируя ситуацию массового проникновения через клетку тонкого кишечника. Этот лекарственный препарат может находиться в форме вирусной экспрессионной системы, несущей вектор. Этот лекарственный препарат может представлять собой аденовирусную экспрессионную систему функционального TLR5 человека в комбинации с агонистом TLR, доставляемым системно в растворе для введения, например внутримышечно; агонистом TLR, экспрессируемым с того же экспрессионного вектора, что и TLR; или агонистом TLR, экспрессируемым в форме наночастиц, несущих функциональный агонист TLR, такой как флагеллин, который может доставляться из CBLB502 на их поверхность. Наночастица может быть основана на бактериофаге 17 или полностью образована так, что сохраняет его биологическую активность. Нанопрепарат может обеспечивать дозозависимую, NF-В-реактивную репортерную активацию и может приводить в результате к клеточной интернализации посредством эндоцитоза для эффективного подхода к иммунизации (Mobian AP-A). а) Введение Введение агентов с использованием способа, описанного в данной заявке, может быть пероральным, парентеральным, подъязычным, чрескожным, ректальным, через слизистую оболочку, местным,посредством ингаляции, посредством трансбуккального введения, либо представлять собой их комбинации. Парентеральное введение включает, но не ограничено этим, внутривенное, внутриартериальное,внутрибрюшинное, подкожное, внутримышечное, подоболочечное и внутрисуставное. Для ветеринарного применения агент можно вводить в виде соответствующего приемлемого препарата в соответствии с обычной ветеринарной практикой. Ветеринар может легко определить режим дозировки и путь введения,который является наиболее подходящим для конкретного животного. Агенты можно вводить пациентучеловеку, кошке, собаке, крупному животному или птице. Агент можно вводить одновременно или метрономическим путем с другими терапиями. Термин"одновременный" или "одновременно", как используют в данной заявке, означает, что агент и другую терапию вводят в пределах 48 ч, предпочтительно 24 ч, более предпочтительно 12 ч, еще более предпочтительно 6 ч и наиболее предпочтительно 3 ч или менее друг от друга. Термин "метрономическим путем", как используют в данной заявке, означает введение агента в моменты времени, отличные от другой терапии, и с определенной частотой в отношении повторного введения. Агент можно вводить в любой момент перед другой терапией, включая примерно 120 ч, 118 ч, 116 ч, 114 ч, 112 ч, 110 ч, 108 ч, 106 ч, 104 ч, 102 ч, 100 ч, 98 ч, 96 ч, 94 ч, 92 ч, 90 ч, 88 ч, 86 ч, 84 ч, 82 ч, 80 ч,78 ч, 76 ч, 74 ч, 72 ч, 70 ч, 68 ч, 66 ч, 64 ч, 62 ч, 60 ч, 58 ч, 56 ч, 54 ч, 52 ч, 50 ч, 48 ч, 46 ч, 44 ч, 42 ч, 40 ч,38 ч, 36 ч, 34 ч, 32 ч, 30 ч, 28 ч, 26 ч, 24 ч, 22 ч, 20 ч, 18 ч, 16 ч, 14 ч, 12 ч, 10 ч, 8 ч, 6 ч, 4 ч, 3 ч, 2 ч, 1 ч, 55 мин, 50 мин, 45 мин, 40 мин, 35 мин, 30 мин, 25 мин, 20 мин, 15 мин, 10 мин, 9 мин, 8 мин, 7 мин, 6 мин,5 мин, 4 мин, 3 мин, 2 мин и 1 мин. Агент можно вводить в любой момент перед вторым введением агента, включая примерно 120 ч, 118 ч, 116 ч, 114 ч, 112 ч, 110 ч, 108 ч, 106 ч, 104 ч, 102 ч, 100 ч, 98 ч, 96 ч,94 ч, 92 ч, 90 ч, 88 ч, 86 ч, 84 ч, 82 ч, 80 ч, 78 ч, 76 ч, 74 ч, 72 ч, 70 ч, 68 ч, 66 ч, 64 ч, 62 ч, 60 ч, 58 ч, 56 ч,54 ч, 52 ч, 50 ч, 48 ч, 46 ч, 44 ч, 42 ч, 40 ч, 38 ч, 36 ч, 34 ч, 32 ч, 30 ч, 28 ч, 26 ч, 24 ч, 22 ч, 20 ч, 18 ч, 16 ч,14 ч, 12 ч, 10 ч, 8 ч, 6 ч, 4 ч, 3 ч, 2 ч, 1 ч, 55 мин, 50 мин, 45 мин, 40 мин, 35 мин, 30 мин, 25 мин, 20 мин,15 мин, 10 мин, 9 мин, 8 мин, 7 мин, 6 мин, 5 мин, 4 мин, 3 мин, 2 и 1 мин. Агент можно вводить в любой момент после другой терапии, включая примерно 1 мин, 2 мин, 3 мин, 4 мин, 5 мин, 6 мин, 7 мин, 8 мин, 9 мин, 10 мин, 15 мин, 20 мин, 25 мин, 30 мин, 35 мин, 40 мин, 45 мин, 50 мин, 55 мин, 1 ч, 2 ч, 3 ч, 4 ч, 6 ч, 8 ч, 10 ч, 12 ч, 14 ч, 16 ч, 18 ч, 20 ч, 22 ч, 24 ч, 26 ч, 28 ч, 30 ч,32 ч, 34 ч, 36 ч, 38 ч, 40 ч, 42 ч, 44 ч, 46 ч, 48 ч, 50 ч, 52 ч, 54 ч, 56 ч, 58 ч, 60 ч, 62 ч, 64 ч, 66 ч, 68 ч, 70 ч,72 ч, 74 ч, 76 ч, 78 ч, 80 ч, 82 ч, 84 ч, 86 ч, 88 ч, 90 ч, 92 ч, 94 ч, 96 ч, 98 ч, 100 ч, 102 ч, 104 ч, 106 ч, 108 ч,110 ч, 112 ч, 114 ч, 116 ч, 118 ч и 120 ч. Агент можно вводить в любой момент после второго введения агента, включая примерно 120 ч, 118 ч, 116 ч, 114 ч, 112 ч, 110 ч, 108 ч, 106 ч, 104 ч, 102 ч, 100 ч, 98 ч, 96 ч, 94 ч, 92 ч, 90 ч, 88 ч, 86 ч, 84 ч, 82 ч, 80 ч, 78 ч, 76 ч, 74 ч, 72 ч, 70 ч, 68 ч, 66 ч, 64 ч, 62 ч, 60 ч, 58 ч, 56 ч, 54 ч, 52 ч, 50 ч, 48 ч, 46 ч, 44 ч, 42 ч, 40 ч, 38 ч, 36 ч, 34 ч, 32 ч, 30 ч, 28 ч, 26 ч, 24 ч, 22 ч, 20 ч, 18 ч, 16 ч, 14 ч, 12 ч, 10 ч, 8 ч, 6 ч, 4 ч, 3 ч, 2 ч, 1 ч, 55 мин, 50 мин, 45 мин, 40 мин, 35 мин, 30 мин, 25 мин, 20 мин, 15 мин, 10 мин, 9 мин, 8 мин, 7 мин, 6 мин, 5 мин, 4 мин, 3 мин, 2 и 1 мин. б) Препарат Способ может включать введение агента. Агенты, предложенные в данной заявке, могут находиться в форме таблеток или лепешек, приготовленных общепринятым способом. Например, таблетки и капсулы для перорального введения могут содержать общепринятые эксципиенты, которые могут представлять собой связующие агенты, наполнители, смазывающие агенты, разрыхлители и увлажняющие агенты. Связующие агенты включают, но не ограничены этим, сироп, аравийскую камедь, желатин, сорбит,трагакант, клей из крахмала и поливинилпирролидон. Наполнители могут представлять собой лактозу,сахар, микрокристаллическую целлюлозу, кукурузный крахмал, фосфат кальция и сорбит. Смазывающие агенты включают, но не ограничены ими, стеарат магния, стеариновую кислоту, тальк, полиэтилен гликоль и кремнезем. Разрыхлители могут представлять собой картофельный крахмал и натриевую соль гликолята крахмала. Увлажняющие агенты могут представлять собой лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в данной области техники. Агенты, предложенные в данной заявке, могут также представлять собой жидкие препараты, такие как водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры. Агенты можно также включать в препараты в виде сухого препарата для восстановления водой или другим подходящим растворителем перед применением. Такие жидкие препараты могут содержать добавки, такие как суспендирующие агенты, эмульгирующие агенты, неводные растворители и консерванты. Суспендирующий агент может представлять собой сироп сорбита, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия и гидрогенизированные пищевые жиры. Эмульгирующие агенты могут представлять собой лецитин, сорбитан моноолеат и аравийскую камедь. Неводные растворители могут представлять собой пищевые масла, миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, пропиленгликоль и этиловый спирт. Консерванты могут представлять собой метил- или пропил-пара-гидроксибензоат и сорбиновую кислоту. Агенты, предложенные в данной заявке, можно также включать в препараты в виде суппозиториев,которые могут содержать основы суппозиториев, такие как масло какао или глицериды. Агенты, предложенные в данной заявке, можно также включать в препараты для ингаляции, которые могут находиться в форме, такой как раствор, суспензия или эмульсия, которые можно вводить в виде сухого порошка или в форме аэрозоля, используя пропеллент, такой как дихлордифторметан или трихлорфторметан. Агенты, предложенные в данной заявке, можно также включать в препараты в виде чрескожных препаратов, содержащих водные или неводные растворители, такие как кремы, мази, лосьоны, пасты, лекарственный пластырь, повязка или мембрана. Агенты, предложенные в данной заявке, можно также включать в препараты для парентерального введения, такого как, например, путем инъекции, внутриопухолевой инъекции или непрерывной инфузии. Препараты для инъекций могут находиться в форме суспензий, растворов или эмульсий в масляных или водных растворителях и могут содержать агенты для приготовления препаратов, включающие, но не ограниченные ими, суспендирующие, стабилизирующие и диспергирующие агенты. Агент может быть также предложен в форме порошка для восстановления подходящим растворителем, включающим, но не ограниченным, стерильную апирогенную воду. Агенты, предложенные в данной заявке, можно также включать в препараты в виде депо-препарата,которые можно вводить путем имплантации или путем внутримышечной инъекции. Агенты можно готовить с подходящими полимерными или гидрофобными материалами (как, например, эмульсия в приемлемом масле), ионообменными смолами или в виде слаборастворимых производных (таких как, например, слаборастворимая соль). в) Дозировка Способ может включать введение терапевтически эффективного количества агента пациенту, нуждающемуся в этом. Терапевтически эффективное количество, требующееся для применения в терапии,варьируют в зависимости от природы состояния, подлежащего лечению, продолжительности времени,желаемой для активации TLR, и возраста/состояния пациента. Как правило, однако, дозы, применяемые для лечения взрослого человека, типично находятся в диапазоне от 0,001 мг/кг до примерно 200 мг/кг в сутки. Доза может составлять от примерно 1 мг/кг до примерно 100 мг/кг в сутки. Желаемую дозу можно удобно вводить в виде однократной дозы или в виде многократных доз, вводимых через подходящие интервалы, например, в виде двух, трех, четырех или большего числа субдоз в сутки. Многократные дозы могут быть желательны или необходимы. Дозировка может составлять любую дозировку, такую как примерно 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг,0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг,125 мг/кг, 150 мг/кг, 175 мг/кг, 200 мг/кг, 225 мг/кг, 250 мг/кг, 275 мг/кг, 300 мг/кг, 325 мг/кг, 350 мг/кг,375 мг/кг, 400 мг/кг, 425 мг/кг, 450 мг/кг, 475 мг/кг, 500 мг/кг, 525 мг/кг, 550 мг/кг, 575 мг/кг, 600 мг/кг,625 мг/кг, 650 мг/кг, 675 мг/кг, 700 мг/кг, 725 мг/кг, 750 мг/кг, 775 мг/кг, 800 мг/кг, 825 мг/кг, 850 мг/кг,875 мг/кг, 900 мг/кг, 925 мг/кг, 950 мг/кг, 975 или 1 мг/кг. 5. Способ лечения рака В данной заявке предложен способ лечения рака путем введения агента млекопитающему, нуждающемуся в этом. Этот способ обеспечивает иммунотерапию против рака путем преобразования опухолевых клеток в состояние, реагирующее на агонист TLR, направленной внутриопухолевой стимуляциейTLR, фокусируя посредством этого иммунный ответ на опухоли. Этот способ можно применять для лечения первичных опухолей перед их хирургическим удалением в целях снижения риска развития метастазов, а также для лечения других узлов опухоли. Этот способ может включать внутриопухолевую инъекцию. Этот способ может иметь стадию инъецирования агента в первичную опухоль перед ее хирургическим удалением для снижения риска развития метастазов, а также для лечения других узлов опухоли. Этот способ можно применять для лечения любой опухоли, которая доступна для внутриопухолевой инъекции аденовируса. В соответствии с настоящим изобретением можно лечить ряд раков, включая карциному, рак мочевого пузыря (включая ускоренный и метастатический рак мочевого пузыря), молочной железы, ободочной кишки (включая колоректальный рак), почки, печени, легкого (включая мелкоклеточный и немелкоклеточный рак легкого и аденокарциному легкого), яичника, простаты, семенников, мочеполовых путей,лимфатической системы, прямой кишки, гортани, поджелудочной железы (включая экзокринную карциному поджелудочной железы), пищевода, желудка, желчного пузыря, шейки матки, щитовидной железы и кожи (включая чешуйчато-клеточный рак); гемопоэтические опухоли лимфоидной линии, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Тклеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, ретикулоэндотелиоз, гистиоцитарную лимфому и лимфому Беркитта; гемопоэтические опухоли миелоидной линии, включая острые и хронические миелогенные лейкозы, миелодиспластический синдром, миелоидный лейкоз и промиелоцитарный лейкоз; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриномы; опухоли мезенхимного происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, пигментную ксеродерму, кератоакантому, семиному, фолликулярный рак щитовидной железы, тератокарциному и раки желудочнокишечного тракта или полости живота и таза. Способ можно комбинировать с другими способами лечения рака, включая применение иммуностимулятора, цитокина или химиотерапевтического агента. Иммуностимулятор может представлять собой гормон роста, пролактин или витамин D. 6. Лечение инфицированных клеток В данной заявке предложен способ лечения инфекционного заболевания путем одновременной доставки клеток, трансдуцированных агентом. Этот способ можно применять для лечения вирусной, бактериальной инфекции, инфекции простейшими паразитами или грибковой инфекции. Этот способ можно применять для лечения любого инфекционного заболевания посредством применения внутриклеточной инъекции, приводящей в результате к аутокринной активации передачи сигнала TLR инфицированных клеток при минимальном системном эффекте, и посредством этого обеспечивающей привлечение врожденного иммунного ответа, специфичного к инфицированным клеткам. Этот способ можно комбинировать с другими терапиями для лечения вирусных, бактериальных инфекций, инфекций простейшими паразитами или грибковых инфекций. Этот способ может включать введение агента. Этот способ может включать введение вакцины, содержащей агент, и может применяться в комбинации с другой вакцинацией, которая может включать конструкцию, экспрессирующую выбранный антиген. Пример 1. Синтез бицистронного экспрессионного вектора TLR5/флагеллин и обработка опухолевых клеток Были созданы векторные конструкции для экспрессии toll-подобного рецептора 5 (TLR-5) и флагеллина CBLB502. Вектор pCD515 использовали в качестве каркаса для этих конструкций. Последовательность кДНК TLR-5 человека и ДНК, кодирующую агонист toll-подобного рецептора CBLB502, были индивидуально слиты с лидерным пептидом, имеющим происхождение от щелочной фосфатазы, обеспечивая путь экспрессированного белка через эндоплазматический ретикулум (ЭР) и аппарат Гольджи в направлении внеклеточной секреции. Векторная конструкция pCD515-CMV-hTLR5-EFI-502s экспрессировала секретируемую форму флагеллина CBLB502 (CBLB502S) и toll-подобный рецептор 5 (TLR5) на клеточной поверхности. Для этого аденовирусного вектора требовалась модификация CBLB502 для достижения его эффективного синтеза и секреции клетками млекопитающих. Аденовирусная конструкция содержит лидерную нуклеиново-кислотную последовательность (Atgctgctgctgctgctgctgctgggcctgaggctacagctctccctgggc), имеющую происхождение от щелочной фосфатазы, и она была клонирована выше укороченного гена флагеллинаSalmonella (fliC) (см. Burdelya et al., Science 320:226-230 (2008, чтобы кодировать секретируемую форму флагеллина (то есть CBLB502S). Промотор EF1 (фактора элонгации 1) был клонирован выше этой кассеты, кодирующей CBLB502S. Ген TLR5 имеет происхождение от человека и имеет аминокислотную последовательность, как показано на фиг. 9. Промотор CMV был клонирован выше гена TLR5. Данная конструкция совместно экспрессирует TLR5 и CBLB502S. Данная конструкция показана на фиг. 1 А. Экспрессионный вектор pCD515-CMV-hTLR5 был сконструирован для экспрессии формы TLR-5 человека (см. фиг. 9). Аденовирусная конструкция содержит сильный промотор CMV, клонированный выше кассеты hTLR5. Данная конструкция показана на фиг. 1 В. Экспрессионный вектор pCD515-CMV-Sseap-502 был сконструирован для экспрессии секретируемого флагеллина CBLB502 и toll-подобного рецептора. Аденовирусная конструкция содержит сильный промотор CMV, клонированный выше лидерной последовательности SEAP 502 гена флагеллина (fliC). Данная конструкция показана на фиг. 1 С. [Необходима информация о клонировании]. Пример 2. Синтез бицистронного экспрессионного вектора TLRS/флагеллин и обработка опухолевых клеток Две репортерные клеточные линии млекопитающих, обе экспрессирующие NF-В-реактивный GFP и отличающиеся по их состоянию TLR5, были трансдуцированы векторными конструкциями pCD515,pCD515-CMV-hTLR5-EFI-502s, pCD515-CMV-hTLR5-502, pCD515-CMV-hTLR5 и pCD515-CMV-Sseap502 (см. табл. 3 ниже). Таблица 3. Активность аденовирусных конструкций в качестве активаторов передачи сигнала TLR5 Вектор, совместно экспрессирующий TLR5 и агонист TLR5 CBLB502S, был достаточен для индукции экспрессии репортера NF-В в клетках 293-null, которые не экспрессируют ни один из известныхTLR и которые не могут активироваться одним агонистом TLR5. Данный эксперимент демонстрирует,что TLR5 и флагеллин CBLB502S могут действовать in trans или in cis по активации передачи сигналаTLR5. Пример 3 Для тестирования противоопухолевых эффектов бицистронного аденовируса (pCD515-CMVhTLR5-EFI-502s) 10 мл аденовирусной суспензии (1012-1011 МЕ/мл) инъецировали в одну из двух выращенных подкожно изогенных опухолей у мышей BaIb/c, имеющих происхождение от клеток карциномы ободочной кишки мыши СТ 26, когда опухоли достигали 3-5 мм в диаметре, и мониторинг размера опухоли проводили до тех пор, пока контрольные не инъецированные опухоли не достигали предельного размера, требующего окончания эксперимента. Контрольных мышей (опять же, одну опухоль из двух на мышь) инъецировали аденовирусным вектором, экспрессирующим красный флуоресцентный белок(RFP). Результаты репрезентативного эксперимента показаны на фиг. 4. Почти полное отсутствие роста опухолей, инъецированных (pCD515-CMV-hTLR5-EFI-502s), сопровождалось сниженным ростом неинъецированной опухоли у одного и того же животного по сравнению с опухолями у контрольных животных, инъецированных RFP-экспрессирующим аденовирусом. Этот результат показывает (i) сильный эффект in-cis и (ii) видимый эффект in-trans pCD515-CMV-hTLR5-EF1-502s, что является показателем рекрутмента как врожденного (цис-эффект), так и адаптивного (транс-эффект) иммунного ответа. Ни один из других контрольных вирусов, перечисленных в табл. 1 (то есть AD5 (контроль) и Ad5 (TLR5, инъецированных отдельно, не обладали эффектами подавления роста в отношении опухолей. Таким образом, усиленная эктопическая экспрессия TLR5 делает типы опухолевых клеток, которые исходно были дефицитными по TLR5, высоко реактивными на стимуляцию TLR5, приводящую в результате к разрушению иммунотолерантности опухоли, сильному привлечению врожденного иммунного ответа, который стимулирует эффективное развитие адаптивного иммунного ответа с последующим об- 11021842 щим противоопухолевым эффектом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Экспрессирующий вектор, содержащий первую и вторую нуклеиновую кислоту, где первая нуклеиновая кислота кодирует Toll-подобный рецептор 5 (TLR5), а вторая - флагеллин. 2. Вектор по п.1, где вектор представляет собой экспрессионный вектор млекопитающих. 3. Вектор по п.1, где вектор экспрессируется с аденовируса, лентивируса или липосомы. 4. Вектор по п.1, где первая нуклеиновая кислота представляет собой секретируемую форму Tollподобного рецептора. 5. Вектор по п.1, где флагеллин представляет собой секретируемую форму флагеллина. 6. Вектор по п.5, где секретируемая форма флагеллина содержит тринадцать консервативных аминокислот флагеллина, показанных на фиг. 5, которые могут быть важны для активности TLR5. 7. Вектор по п.1, где первая нуклеиновая кислота содержит последовательность, как показано на фиг. 7, и вторая нуклеиновая кислота содержит последовательность, как показано на фиг. 9. 8. Способ лечения рака у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, содержащего вектор по п.1. 9. Способ по п.8, где рак представляет собой опухоль. 10. Способ по п.9, где опухоль имеет происхождение из группы, состоящей из простаты, молочной железы, ободочной кишки, пищевода, желудка, легкого, поджелудочной железы, почки, щитовидной железы, яичников, гортани или шейки матки. 11. Способ по п.9, где опухоль имеет происхождение из группы, состоящей из сарком, меланом,лейкозов и лимфом. 12. Способ по п.9, где агент вводят in trans по отношению к опухоли млекопитающего. 13. Способ по п.9, где агент вводят непосредственно в опухоль млекопитающего. 14. Способ по п.8, где агент вводят в комбинации с иммуностимулятором. 15. Способ по п.8, где иммуностимулятор выбран из группы, состоящей из гормона роста, пролактина и витамина D. 16. Способ по п.15, где гормон роста представляет собой соматотропин. 17. Способ по п.8, где агент вводят в комбинации с цитокином. 18. Способ по п.17, где цитокин представляет собой фактор стволовых клеток. 19. Способ лечения инфекции у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, агента, содержащего вектор по п.1. 20. Способ по п.19, где инфекция представляет собой инфекцию, вызванную организмом, выбранным из группы, состоящей из вируса, бактерии, простейших паразитов и гриба.
МПК / Метки
МПК: C12N 15/63
Метки: применение, рецептора, рака, агониста, толл-подобного, лечения
Код ссылки
<a href="https://eas.patents.su/30-21842-primenenie-toll-podobnogo-receptora-i-agonista-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Применение toll-подобного рецептора и агониста для лечения рака</a>
Предыдущий патент: Бимодальный полиэтилен для использований в литье под давлением с раздувом и вытяжкой
Следующий патент: Способ полимеризации олефина
Случайный патент: Ингибиторы трипсиноподобных сериновых протеаз, их получение и применение












