Рекомбинантные антигены rsv
Номер патента: 21393
Опубликовано: 30.06.2015
Авторы: Ро Патрик, Бле Норман, Рюэль Жан-Луи, Боду Ги Жан Мари Фернан Пьер
Формула / Реферат
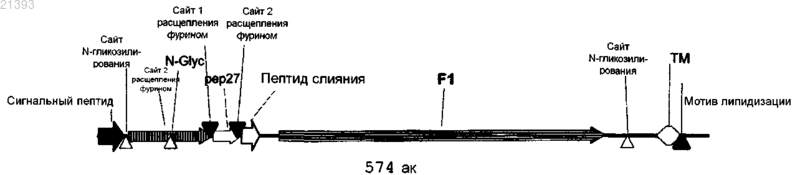
1. Рекомбинантный антиген респираторно-синцитиального вируса (RSV), содержащий полипептид, который содержит F2-домен белка F RSV, содержащий полипептидную последовательность, соответствующую аминокислотам 26-105 ссылочного полипептида-предшественника (F0) белка F с последовательностью SEQ ID NO: 2, соединенный с F1-доменом белка F RSV, содержащим полипептидную последовательность, соответствующую аминокислотам 137-516 ссылочного полипептида-предшественника (F0) белка F с последовательностью SEQ ID NO: 2, где между F2-доменом и F1-доменом нет сайта расщепления фурином и где рекомбинантный антиген RSV дополнительно содержит гетерологичный домен тримеризации, находящийся на С-конце F1-домена, где антиген стабилизирован в конформации белка F RSV до его слияния с клеткой-хозяином.
2. Рекомбинантный антиген RSV по п.1, имеющий последовательность, выбранную из группы, состоящей из:
a) полипептида, содержащего SEQ ID NO: 6;
b) полипептида, кодируемого нуклеиновой кислотой, содержащей полинуклеотидную последовательность SEQ ID NO: 5, или нуклеиновой кислотой, которая гибридизуется в жестких условиях, по существу, по всей длине с нуклеиновой кислотой, содержащей полинуклеотидную последовательность SEQ ID NO: 5; и
c) полипептида с последовательностью, по меньшей мере на 95% идентичной SEQ ID NO: 6.
3. Рекомбинантный антиген RSV по п.1 или 2, дополнительно содержащий сигнальный пептид.
4. Рекомбинантный антиген RSV по любому из пп.1-3, в котором гетерологичный домен тримеризации содержит биспиральный домен.
5. Рекомбинантный антиген RSV по п.4, в котором гетерологичный домен тримеризации содержит ²изолейциновую молнию².
6. Рекомбинантный антиген RSV по п.5, который содержит тример полипептидов.
7. Иммуногенная композиция, содержащая эффективное количество рекомбинантного антигена RSV по любому из пп.1-6 и фармацевтически приемлемый носитель или эксципиент, где иммуногенная композиция снижает или предотвращает инфекцию, вызванную респираторно-синцитиальным вирусом (RSV).
8. Иммуногенная композиция по п.7, в которой носитель или эксципиент содержат буфер.
9. Иммуногенная композиция по п.8, дополнительно содержащая адъювант.
10. Иммуногенная композиция по любому из пп.7-9, в которой адъювант выбран из группы, состоящей из 3D-MPL, QS21, эмульсии типа ²масло-в-воде², квасцов или комбинации указанного.
11. Иммуногенная композиция по любому из пп.7-10, дополнительно содержащая по меньшей мере один дополнительный антиген патогенного организма, отличного от RSV, где патогенным организмом является вирус или бактерия, которая инфицирует респираторный тракт.
12. Рекомбинантная нуклеиновая кислота, содержащая полинуклеотидную последовательность, кодирующая рекомбинантный антиген RSV по любому из пп.1-6.
13. Рекомбинантная нуклеиновая кислота по п.12, в которой полинуклеотидная последовательность, которая кодирует антиген RSV, оптимизирована в отношении кодонов для экспрессии в выбранной клетке-хозяине.
14. Клетка-хозяин, содержащая нуклеиновую кислоту по п.12 или 13.
15. Применение антигена RSV по любому из пп.1-6 для получения лекарственного средства для применения в лечении RSV инфекции.
16. Применение антигена RSV по п.15 в профилактическом лечении RSV инфекции.
17. Иммуногенная композиция по любому из пп.7-10 для профилактики или лечения связанных с RSV заболеваний.
Текст
Боду Ги Жан Мари Фернан Пьер (BE),Бле Норман, Ро Патрик (CA), Рюэль Жан-Луи (BE) Медведев В.Н. (RU) Изобретение предоставляет рекомбинантные антигены респираторно-синцитиального вируса(RSV) и способы их получения и применения, в том числе иммуногенные композиции (например,вакцины) для лечения и/или предупреждения RSV инфекции. Перекрестная ссылка на родственную заявку Данная заявка притязает на приоритет с более ранними датами подачи согласно предварительной заявке на патент США 61/016524, поданной 24 декабря 2007 г., и предварительной заявке на патент США 61/056206, поданной 27 мая 2008 г., описания которых включены в данное описание посредством ссылки. Уведомление об авторском праве согласно 1.71(Е) разделу 37 свода федеральных правил Часть описания этого патентного документа содержит материал, который подлежит охране согласно авторскому праву. Владелец авторского права не имеет возражений в отношении факсимильного воспроизведения кем-либо патентного документа или описания патента, поскольку оно присутствует в файле с данными о патентах или регистрациях патентов Ведомства по регистрации патентов и товарных знаков, но в остальных случаях сохраняет абсолютно все авторские права. Предпосылки создания изобретения Описание этого изобретения касается области иммунологии. Конкретнее, описание этого изобретения относится к композициям и способам, вызывающим иммунный ответ, специфичный для респираторно-синцитиального вируса (RSV). Респираторно-синцитиальный вирус (RSV) является самой частой в мировом масштабе причиной инфекций нижних дыхательных путей (LRI) у младенцев возрастом менее 6 месяцев и недоношенных детей, родившихся на сроке беременности, равном 35 неделям, или до этого срока. Характеристика вызываемого RSV заболевания включает широкий набор респираторных симптомов от ринита и отита до пневмонии и бронхиолита, при этом два последних из названных заболеваний сопровождаются значительными клиническими проявлениями и смертностью. Люди являются единственным известным резервуаром RSV. Распространение вируса из зараженных выделений в носовой полости происходит через большие респираторные капельки, значит, для передачи необходим близкий контакт с инфицированным индивидуумом или зараженной поверхностью. RSV может сохраняться в течение нескольких часов на игрушках или других предметах, что объясняет высокую степень внутрибольничных RSV инфекций,особенно в педиатрический палатах. По оценкам цифры для инфицирования и смертности ежегодно по всему миру для RSV составляют 64 миллионов и 160000 соответственно. По оценкам только в США RSV является виновником 1800075000 госпитализаций и 90-1900 смертей ежегодно. Достаточно подтверждено документально, что в умеренных климатах RSV является причиной ежегодных зимних эпидемий острой LRI, включающей бронхиолит и пневмонию. В США почти все дети инфицированы RSV к возрасту, составляющему два года. По расчетам коэффициент заболеваемости связанной с RSV LRI у здоровых в других отношениях детей составляет 37 на 1000 детей/год в первые два года жизни (45 на 1000 детей/год у младенцев возрастом менее 6 месяцев), а риск госпитализации составляет 6 на 1000 детей/год (на 1000 детей/год в первые шесть месяцев жизни). Заболеваемость выше у детей с сердечно-легочным заболеванием и у недоношенных детей, которые составляют почти половину связанных с RSV госпитализаций в США. Дети, подвергающиеся более тяжелой LRI, вызванной RSV, позже имеют повышенную заболеваемость астмой. Эти исследования демонстрируют широко распространенную потребность в вакцинах против RSV, а также в их применении в промышленно развитых странах, в которых затраты на уход за пациентами с тяжелойLRI и осложнениями у них являются значительными. Во все большей мере подтверждается, что RSV также является важной причиной заболеваемости гриппоподобной болезнью у пожилого. Различные подходы были проверены в попытках получить безопасную и эффективную вакцину против RSV, которая вызывает долговременные и защитные иммунные ответы в здоровых и подверженных риску популяциях. Однако ни один из проверенных до настоящего времени кандидатов не признан безопасным и эффективным в качестве вакцины с целью предупреждения RSV инфекции и/или ослабления или предупреждения RSV заболевания, включающего инфекции нижних дыхательных путей (LRI). Краткое изложение сущности изобретения Описание этого изобретения касается рекомбинантных антигенов респираторно-синцитиального вируса (RSV). Конкретнее, раскрытие этого изобретения имеет отношение к антигенам, включающим рекомбинантный белок F, который был модифицирован для стабилизации трехмерной конформации до его слияния. Описываемые в настоящем описании рекомбинантные антигены проявляют более высокую иммуногенность и особенно предпочтительно используются в качестве компонентов иммуногенных композиций (например, вакцин) для защиты от RSV инфекции и/или заболевания. Также раскрыты нуклеиновые кислоты, кодирующие рекомбинантные антигены, иммуногенные композиции, содержащие антигены, и способы продуцирования и применения антигенов. Краткое описание фигур Фиг. 1 А является схематической иллюстрацией, указывающей на структурные признаки белка FRSV. Фиг. 1 В является схематической иллюстрацией приводимых в качестве примеров антигенов на основе белка F до слияния (PreF) RSV. Фиг. 2 является графиком в виде ломаной, иллюстрирующей репрезентативные результаты анализаPreF с помощью фракционирования потоков асимметричных полей (AFF-MALS). Фиг. 3 является столбчатой диаграммой, демонстрирующей подавление нейтрализующей активно-1 021393 сти сыворотки человека с помощью PreF антигена. Фиг. 4 А и В являются столбчатыми диаграммами, демонстрирующими титры IgG в сыворотках,индуцированные у мышей в ответ на PreF антиген. Фиг. 5 А и В являются столбчатыми диаграммами, иллюстрирующими титры нейтрализующих антител, специфичных для RSV, индуцированные в ответ на PreF антиген. Фиг. 6 А и В являются графиками, на которых показана защита от заражения, обеспечиваемая PreF антигеном RSV, у мышей. Фиг. 7 является графиком, оценивающим лейкоциты при BAL после иммунизации и заражения. Подробное описание изобретения Введение Разработка вакцин для предупреждения RSV инфекции затруднялась тем фактом, что иммунные ответы хозяина, по-видимому, играют роль в патогенезе заболевания. В результате ранних исследований в 1960 годах установлено, что дети, вакцинированные вакциной на основе инактивированного формалином RSV, страдают более тяжелым заболеванием вследствие последующего воздействия вируса по сравнению с невакцинированными контрольными субъектами. Результатом этих начальных испытаний явились госпитализация 80% вакцинированных пациентов и две смерти. Увеличенная тяжесть заболевания была воспроизведена в моделях на животных и, как полагают, является следствием неадекватных уровней нейтрализующих антител в сыворотке, отсутствия локального иммунитета и чрезмерной индукции,характерного для Т-клеток-хелперов типа 2 (Th2), иммунного ответа с легочной эозинофилией и увеличенной продукцией цитокинов IL-4 и IL-5. В противоположность, результативная вакцина, защищающая от RSV инфекции, вызывает иммунный ответ со сдвигом в направлении Th1-типа, характеризующегося продукцией IL-2 и -интерферона (IFN). Раскрытие настоящего изобретения имеет отношение к рекомбинантным антигенам респираторносинцитиального вируса (RSV), которые разрешают проблемы, обнаруженные с антигенами RSV, используемыми ранее в вакцинах, и улучшают иммунологические, а также относящиеся к производству свойства антигена. Описываемые в настоящем описании рекомбинантные антигены RSV включают аналог белка слияния (F), который включает растворимый полипептид белка F, который был модифицирован для стабилизации конформации белка F до его слияния, т.е. конформации зрелого собранного белка F до слияния с мембраной клетки-хозяина. Эти аналоги белка F названы PreF или PreF антигены с целью ясности и упрощения. Описываемые в настоящем описании PreF антигены основаны на непредвиденном открытии того, что растворимые аналоги белка F, которые были модифицированы путем включения гетерологичного домена тримеризации, проявляют улучшенные иммуногенные характеристики и являются безопасными и высокопротективными после введения субъекту in vivo. Детали структуры белка F RSV предоставлены в настоящем описании с учетом терминологии и обозначений, широко распространенных в данной области техники, и схематически иллюстрируются на фиг. 1 А. Схематическая иллюстрация приводимых в качестве примеров PreF антигенов представлена на фиг. 1 В. Квалифицированным в данной области техники специалистам будет понятно, что любой белок FRSV может быть модифицирован для стабилизации конформации до его слияния в соответствии с предоставленными в настоящем описании идеями. Поэтому для облегчения понимания принципов, определяющих продукцию PreF антигенов, индивидуальные структурные компоненты будут указываться с учетом приводимого в качестве примера белка F, полинуклеотидная и аминокислотная последовательности которого представлены в SEQ ID NO: 1 и 2 соответственно. Подобным образом, когда это применимо, Gбелковые антигены описываются с учетом приводимого в качестве примера белка G, полинуклеотидная и аминокислотная последовательности которого представлены в SEQ ID NO: 3 и 4 соответственно. С учетом первичной аминокислотной последовательности полипептида белка F (фиг. 1 А) следующие термины используются для описания структурных признаков PreF антигенов. Термин F0 относится к полноразмерному транслированному предшественнику белка F. Полипептид F0 можно разбить на F2- и F1-домены, разделенные находящимся между ними пептидом, названным рер 27. Во время созревания полипептид F0 подвергается протеолитическому расщеплению в двух сайтах для фурина, расположенных между F2 и F1 и фланкирующих рер 27. Для цели последующего обсуждения F2-домен включает по крайней мере часть, и вплоть до всех, аминокислот 1-109, а растворимая частьF1-домена включает по крайней мере часть, и вплоть до всех, аминокислот 137-526 белка F. Как обсуждалось выше, эти положения аминокислот (и все последующие положения аминокислот, названные в настоящем описании) даны с учетом приводимого в качестве примера полипептида-предшественника белка F (F0) SEQ ID NO: 2. Антиген на основе белка F до его слияния (или PreF) является растворимым (т.е. не связанным с мембраной) аналогом белка F, который включает по крайней мере одну модификацию, которая стабилизирует конформацию белка F до его слияния, из условия, чтобы антиген RSV сохранял по крайней мере один иммунодоминантный эпитоп конформации белка F до его слияния. Растворимый полипептид белкаF включает F2-домен и F1-домен белка F RSV (но не включает трансмембранный домен белка F RSV). В приводимых в качестве примеров вариантах осуществления F2-домен включает аминокислоты 26-105, аF1-домен включает аминокислоты 137-516 белка F. Однако можно использовать меньшие части, если сохраняется трехмерная конформация стабилизированного PreF антигена. Подобным образом, полипептиды, которые включают дополнительные структурные компоненты (например, слитые полипептиды),могут также использоваться вместо приводимых в качестве примеров F2- и F1-доменов, если дополнительные компоненты не нарушают трехмерную конформацию или иначе не оказывают неблагоприятное воздействие на стабильность, продукцию или процессирование или не снижают иммуногенность антигена. F2- и F1-Домены находятся в ориентации от N-конца к С-концу, предназначенной для воспроизведения укладки и сборки аналога белка F в зрелую конформацию до его слияния. Для усиления продукции Р 2-домену может предшествовать секреторный сигнальный пептид, такой как сигнальный пептид встречающего в природе белка F или гетерологичный сигнальный пептид, выбранный для усиления продукции и секреции в клетках-хозяинах, в которых экспрессируется рекомбинантный PreF антиген.PreF антигены стабилизируют (в трехмерной конформации до слияния) путем введения одной или нескольких модификаций, например, добавления, делеции или замены одной или нескольких аминокислот. Одной такой стабилизирующей модификацией является добавление аминокислотной последовательности, включающей гетерологичный стабилизирующий домен. В приводимых в качестве примеров вариантах осуществления гетерологичным стабилизирующим доменом является домен мультимеризации белков. Одним особенно предпочтительным примером такого домена мультимеризации белков является биспиральный домен, такой как домен, богатый остатками изолейцина (изолейциновая молния), который активирует тримеризацию множества полипептидов, имеющих такой домен. Приводимый в качестве примера домен изолейциновая молния представлен в SEQ ID NO: 11. Как правило, гетерологичный стабилизирующий домен находится на С-конце F1-домена. Необязательно домен мультимеризации соединен с F1-доменом через короткую аминокислотную линкерную последовательность, такую как последовательность GG. Линкером может также быть более длинный линкер (например, включающий последовательность GG, такой как аминокислотная последовательность GGSGGSGGS; SEQ ID NO: 14). В данной области техники известны многочисленные конформационно нейтральные линкеры, которые могут использоваться в этой связи без нарушения конформации PreF антигена. Другой стабилизирующей модификацией является исключение сайта распознавания и расщепления фурином, находящегося между F2- и F1-доменами в природном белке F0. Один или оба сайта распознавания фурином, находящиеся в положениях 105-109 и положениях 133-136, могут быть исключены путем делеции или замены одной или нескольких аминокислот в сайтах распознавания фурином из условия, чтобы протеаза не была способна к расщеплению полипептида PreF в составляющих его доменах. Необязательно находящийся между ними пептид рер 27 может также быть удален или заменен, например,линкерным пептидом. Дополнительно или необязательно, сайт расщепления не фурином (например, сайт для металлопротеиназы в положениях 112-113) вблизи от пептида слияния может быть удален или заменен. Другим примером стабилизирующей мутации является добавление гидрофильной аминокислоты или замена не нее в гидрофобный(ом) домен(е) белка F. Как правило, заряженную аминокислоту, такую как лизин, будут добавлять, или ее будет замещать нейтральный остаток, такой как лейцин, в гидрофобном районе. Например, гидрофильную аминокислоту можно добавить, или ее можно заместить гидрофобной или нейтральной аминокислотой в биспиральном HRB-домене экстраклеточного домена белка F. В качестве примера, заряженным аминокислотным остатком, таким как лизин, можно заместить лейцин,присутствующий в положении 512 белка F. Альтернативно или дополнительно, гидрофильную аминокислоту можно добавить, или ее можно заместить гидрофобной или нейтральной аминокислотой в HRAдомене белка F. Например, одну или несколько заряженных аминокислот, таких как лизин, можно вставить в положение 105-106 или вблизи этого положения (например, после аминокислоты, соответствующей остатку 105 ссылочной SEQ ID NO: 2, например, между аминокислотами 105 и 106) PreF антигена. Необязательно гидрофильные аминокислоты можно добавить или ими заместить аминокислоты как вHRA-домене, так и HRB-домене. Альтернативно, один или несколько гидрофобных остатков можно делетировать, если на общую конформацию PreF антигена не оказывается неблагоприятное воздействие. Любые и/или все стабилизирующие модификации могут использоваться отдельно и/или в комбинации с любой из других стабилизирующих модификаций, описываемых в настоящем описании, для получения PreF антигена. В приводимых в качестве примеров вариантах осуществления белок PreF включает полипептид, включающий F2-домен и F1-домен без находящегося между F2- и F1-доменами сайта расщепления фурином и с гетерологичным стабилизирующим доменом (например, доменом тримеризации),находящимся на С-конце F1-домена. В определенных вариантах осуществления PreF антиген также включает одно или несколько добавлений гидрофильных остатков и/или замен на них в гидрофобномHRA- и/или HRB-домене. Необязательно PreF антиген имеет модификацию по крайней мере одного сайта расщепления не фурином, например, сайта для металлопротеиназы.PreF антиген может необязательно включать дополнительный полипептидный компонент, который включает, по крайней мере, иммуногенную часть белка G RSV. Т.е. в определенных вариантах осущест-3 021393 вления PreF антиген является химерным белком, который включает как компонент белка F, так и компонент белка G. Компонент белка F может быть любым из PreF антигенов, описанных выше, а компонент белка G выбирают из иммунологически активной части белка G RSV (вплоть до и/или в том числе полноразмерный G-белок). В приводимых в качестве примеров вариантах осуществления полипептид белкаG включает аминокислоты 149-229 белка G (где положения аминокислот указаны с учетом последовательности белка G, представленной в SEQ ID NO: 4). Квалифицированный в данной области техники специалист определит, что можно использовать меньшую часть или фрагмент белка G, если выбранная часть сохраняет доминантные иммунологические признаки более большого фрагмента белка G. В частности, выбранный фрагмент сохраняет иммунологически доминантный эпитоп между приблизительно положениями аминокислот 184-198 (например, аминокислотами 180-220) и является достаточно длинным для укладки и сборки в стабильную конформацию, которая демонстрирует иммунодоминантный эпитоп. Могут также использоваться более длинные фрагменты, например, от приблизительно аминокислоты 128 до приблизительно аминокислоты 229, вплоть до полноразмерного белка G, если выбранный фрагмент укладывается в стабильную конформацию в условиях химерного белка и не вносит помехи в продукцию, процессирование или стабильность после продуцирования рекомбинантно в клеткаххозяинах. Необязательно, компонент белка G соединен с компонентом белка F через короткую аминокислотную линкерную последовательность, такую как последовательность GG. Линкером может также быть более длинный линкер (такой как аминокислотная последовательность GGSGGSGGS; SEQ ID NO: 14). В данной области техники известны многочисленные конформационно нейтральные линкеры, которые могут использоваться в этой связи без нарушения конформации PreF антигена. Необязательно компонент белка G может включать одну или несколько аминокислотных замен, которые ослабляют или предотвращают усиленное вирусное заболевание в модели вызванного RSV заболевания на животном. Т.е. белок G может включать аминокислотную замену из условия, чтобы при введении субъекту, выбираемому из принятой модели на животном (например, модели RSV на мышах), иммуногенной композиции, включающей химерный PreF-G антиген, субъект не демонстрировал или демонстрировал ослабленные симптомы вирусного заболевания, в отношении которого вакцина является активной, (например, эозинофилию, нейтрофилию) по сравнению с контрольным животным, которому вводят вакцину, которая содержит немодифицированный белок G. Ослабление и/или предотвращение вирусного заболевания, в отношении которого вакцина является активной, может наблюдаться, когда иммуногенные композиции вводятся в отсутствие адъюванта (но не когда, например, антигены вводятся в присутствии сильного Th1-индуцирующего адъюванта). Дополнительно аминокислотная замена может ослабить или предотвратить вирусное заболевание, в отношении которого вакцина является активной,после введения являющемуся человеком субъекту. Примером подходящей аминокислотной замены является замена аспарагина в положении 191 аланином (AsnAla в положении аминокислоты 191: N191A). Необязательно описываемый в настоящем описании PreF антиген может включать дополнительную последовательность, которая служит в качестве вспомогательного средства для очистки. Одним примером является полигистидиновая метка. Такую метку можно удалить из конечного продукта, при желании. После экспрессии PreF антигены подвергаются внутримолекулярной укладке и сборке в зрелый белок, который включает мультимер полипептидов. Предпочтительно, когда полипептиды PreF антигена собираются в триммер, который имеет сходство с конформацией зрелого, подвергнутого процессированию белка F RSV до его слияния. Любой из описываемых в настоящем описании PreF антигенов (в том числе PreF-G антигены) может предпочтительно использоваться в иммуногенных композициях с целью вызова защитного иммунного ответа против RSV. Такие иммуногенные композиции обычно включают фармацевтически приемлемый носитель и/или эксципиент, такой как буфер. Для усиления иммунного ответа, вызываемого после введения, иммуногенная композиция обычно также включает адъювант. В случае иммуногенных композиций для вызова защитного иммунного ответа против RSV (например, вакцин) композиция предпочтительно включает адъювант, который преимущественно вызывает иммунный ответ Th1-типа (адъювант со сдвигом в направлении Th1-типа). Как правило, адъювант выбирают так, чтобы он подходил для введения целевой популяции, которой должна вводиться композиция. Следовательно, в зависимости от применения адъювант выбирают так, чтобы он подходил для введения, например, новорожденным или пожилым. Описываемые в настоящем описании иммуногенные композиции предпочтительно используют в качестве вакцин для уменьшения или предотвращения инфицирования RSV, без вызова патологической ответной реакции (такой как вирусное заболевание, в отношении которого вакцина является активной) после введения или воздействия RSV. В некоторых вариантах осуществления иммуногенная композиция включает PreF антиген (такой как приводимый в качестве примера вариант, иллюстрируемый SEQ ID NO: 6) и второй полипептид, который включает компонент белка G. Компонент G-белка обычно включает, по крайней мере, аминокислоты 149-229 белка G. Хотя могут использоваться меньшие части белка G, такие фрагменты должны включать, как минимум, иммунологически доминантный эпитоп из аминокислот 184-198. Альтернатив-4 021393 но, белок G может включать большую часть белка G, например аминокислоты 128-229 или 130-230, необязательно в виде элемента большего белка, например, полноразмерного белка G, или химерного полипептида. В других вариантах осуществления иммуногенная композиция включает PreF антиген, являющийся химерным белком, который также включает компонент белка G (такой как приводимые в качестве примеров варианты, иллюстрируемые SEQ ID NO: 8 и 10). Компонент белка G такого химерного PreF (илиPreF-G) антигена обычно включает, по крайней мере, аминокислоты 149-229 белка G. Как отмечено выше, могут также использоваться меньшие или большие фрагменты (например, аминокислоты 129-229 или 130-230) белка G, если сохраняются иммунодоминантные эпитопы, и не оказывается неблагоприятное воздействие на конформацию PreF-G антигена. Необязательно иммуногенные композиции могут также включать по крайней мере один дополнительный антиген патогенного организма, отличного от RSV. Например, патогенным организмом является вирус, отличный от RSV, такой как вирус парагриппа (PIV), кори, гепатита В, полиовирус или вирус гриппа. Альтернативно, патогенным организмом может быть бактерия, такая как возбудитель дифтерии,столбняка, коклюша, Haemophilus influenzae и Pneumococcus. Рекомбинантные нуклеиновые кислоты, кодирующие любой из PreF антигенов (в том числе PreF-G антигены), являются также отличительным признаком описания этого изобретения. В некоторых вариантах осуществления полинуклеотидная последовательность нуклеиновой кислоты, кодирующей PreF антиген, оптимизирована для экспрессии в выбранном хозяине (таком как клетки СНО, другие клетки млекопитающих или клетки насекомых). Соответственно векторы, в том числе экспрессионные векторы (в том числе векторы для экспрессии в прокариотических и эукариотических клетках), являются отличительным признаком описания этого изобретения. Подобным образом, клетки-хозяины, включающие такие нуклеиновые кислоты и векторы, являются отличительным признаком описания этого изобретения. Такие нуклеиновые кислоты могут также использоваться в связи с иммуногенными композициями для введения субъекту для вызова иммунного ответа, специфичного для RSV.PreF антигены предпочтительно используют для предупреждения и/или лечения RSV инфекции. Таким образом, другой аспект описания этого изобретения имеет отношение к способу вызова иммунного ответа против RSV. Способ включает введение иммунологически эффективного количества композиции, содержащей PreF антиген, субъекту (такому как являющийся человеком или животным субъект). Введение иммунологически эффективного количества композиции вызывает иммунный ответ, специфичный для эпитопов, присутствующих в PreF антигене. Такой иммунный ответ может включать гуморальные иммунные ответы (например, продукцию нейтрализующих антител) и/или Т-клеточные иммунные реакции (например, продукцию цитокинов). Предпочтительно, когда иммунный ответ, вызванныйPreF антигеном, включает элементы, которые являются специфичными для по крайней мере одного конформационного эпитопа, присутствующего в конформации белка F RSV до его слияния. PreF антигены и композиции могут вводиться субъекту без усиления вирусного заболевания после контактирования сRSV. Предпочтительно, когда описываемые в настоящем описании PreF антигены и соответственно составленные иммуногенные композиции вызывают иммунный ответ со сдвигом в направлении Th1-типа,который уменьшает или предотвращает инфицирование RSV и/или ослабляет или предотвращает патологическую ответную реакцию после инфицирования RSV. Иммуногенные композиции можно вводить рядом путей, включающих такие пути, как интраназальный, при котором PreF антиген непосредственно приводится в контакт со слизистой оболочной верхних дыхательных путей. Альтернативно, можно использовать более традиционные пути введения,такие как внутримышечный путь введения. Таким образом, также предусматривается применение любого из описываемых в настоящем описании антигенов RSV (или нуклеиновых кислот) для приготовления лекарственного средства для леченияRSV инфекции (например, профилактического лечения или предупреждения RSV инфекции). Соответственно, в описании этого изобретения предоставляются описываемые в настоящем описании рекомбинантные антигены RSV или иммуногенные композиции для применения в медицине, а также их применение для предупреждения или лечения связанных с RSV заболеваний. Дополнительные детали в отношении PreF антигенов и способы их применения представлены ниже в описании и примерах. Термины Для облегчения рассмотрения различных вариантов осуществления этого изобретения предоставляются следующие объяснения терминов. Дополнительные термины и объяснения могут быть предоставлены в контексте описания этого изобретения. Если не приведено иных объяснений, все технические и научные термины, используемые в настоящем описании, имеют значение, одинаковое со значением, в котором они обычно понимаются специалистом со средним уровнем компетентности в области техники, к которой относится описание этого изобретения. Определения общепринятых в молекулярной биологии терминов можно найти (см. Benjamin 9), и у Robert A. Meyers (ed.) в Molecular Biology and Biotechnology: a Comprehensive Desk Reference, изданной VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8. Термины в единственном числе включают объекты во множественном числе, кроме случаев, когда контекст говорит об ином. Подобным образом, предполагается, что слово или включает и, кроме случаев, когда контекст говорит об ином. Термин множество относится к двум или более. Кроме того,должно быть понятно, что все размеры в основаниях или размеры в аминокислотах и все значения молекулярных масс, приведенные для нуклеиновых кислот или полипептидов, являются приблизительными и предоставлены для описания. Кроме того, предполагается, что численные ограничения, приведенные по отношению к концентрациям или уровням вещества, например, антигена, являются приблизительными. Таким образом, если указано, что концентрация составляет, по крайней мере, (например) 200 пг, предполагается, что концентрация составляет по крайней мере приблизительно (или ) 200 пг. Хотя способы и материалы, схожие или эквивалентные способам или материалам, описанным в настоящем описании, могут использоваться при осуществлении на практике или проверке этого изобретения, подходящие способы и материалы описываются ниже. Термин включает означает включать. Таким образом, если контекст не диктует иное, будет подразумеваться, что слово включает и такие варианты, как включают и включающий, означают включение указанного соединения или композиции (например, нуклеиновой кислоты, полипептида, антигена) или стадии, или группы соединений или стадий, а не исключение любых других соединений, композиций, стадий или их групп. Сокращение т.е происходит от латинского выражения exempli gratia и используется в настоящем описании для обозначения не ограничивающего примера. Следовательно, сокращение т.е. является синонимом термина например. Респираторно-синцитиальный вирус (RSV) является патогенным вирусом семейства Paramyxoviridae, подсемейства Pneumovirinae, рода Pneumovirus. Геном RSV является молекулой отрицательносмысловой РНК, которая кодирует 11 белков. Тесная связь РНК-генома с вирусным белком N образует нуклеокапсид, упакованный внутри оболочки вируса. Были описаны две группы штаммов RSV человека,группы А и В, на основе различий в антигенности гликопротеина G. На данное число выделены многочисленные штаммы RSV. Приводимые в качестве примеров штаммы, обозначенные с помощью входящих номеров в GenBank и/или EMBL, можно найти в заявке WO 2008114149, которая включена в данное описание посредством ссылки с целью описания последовательностей нуклеиновых кислот и полипептидных последовательностей белков F и G, подходящих для использования в PreF антигенах (в том числе химерных PreF-G антигенах). Дополнительные штаммы RSV надеются выделить и включить в род RSV. Так же род RSV включает варианты, возникающие из встречающихся в природе (например, ранее или впоследствии идентифицированных) штаммов с помощью генетического дрейфа или искусственного синтеза и/или рекомбинации. Термин белок F или белок слияния, или полипептид белка F или полипептид белка слияния относится к полипептиду или белку, имеющему всю или часть аминокислотной последовательности полипептида белка слияния RSV. Подобным образом, термин белок G или полипептид белка G относится к полипептиду или белку, имеющему всю или часть аминокислотной последовательности полипептида белка прикрепления RSV. Многочисленные белки слияния и прикрепления RSV были описаны и известны квалифицированным в данной области техники специалистам. В WO 2008114149 изложены приводимые в качестве примеров варианты белков F и G (например, встречающие в природе варианты),общедоступные на дату подачи этой заявки. Вариант со ссылкой на нуклеиновую кислоту или полипептид (например, нуклеиновую кислоту или полипептид белка F или G RSV или нуклеиновую кислоту или полипептид PreF) является нуклеиновой кислотой или полипептидом, который отличается от ссылочной нуклеиновой кислоты или полипептида. Обычно различие(я) между вариантом и ссылочной нуклеиновой кислотой или полипептидом составляет пропорционально небольшое число различий по сравнению с референтом. Доменом полипептида или белка является структурно определенный элемент внутри полипептида или белка. Например, домен тримеризации является аминокислотной последовательностью внутри полипептида, который активирует сборку полипептида в тримеры. Например, домен тримеризации может активировать сборку в тримеры через объединения с другими доменами тримеризации (дополнительных полипептидов с одинаковыми или различными аминокислотными последовательностями). Термин также используется для ссылки на полинуклеотид, который кодирует такой пептид или полипептид. Термины природный или встречающийся в природе относятся к такому элементу, как белок,полипептид или нуклеиновая кислота, который присутствует в таком же состоянии, в котором он находится в природе. Т.е. элемент не был модифицирован искусственно. Будет понятно, что в контексте описания этого изобретения существуют многочисленные природные/встречающиеся в природе варианты белков или полипептидов RSV, например, полученных из различных встречающихся в природе штаммов или изолятов RSV. Термин полипептид относится к полимеру, в котором мономерами являются аминокислотные остатки, соединенные вместе благодаря амидным связям. Предполагается, что используемые в настоящем описании термины полипептид или белок охватывают любую аминокислотную последовательность и включают модифицированные последовательности, такие как гликопротеины. В частности, предполагается, что термин полипептид охватывает встречающиеся в природе белки, а также белки, которые продуцированы рекомбинантно или синтетически. Термин фрагмент со ссылкой на полипептид относится к части (т.е. подпоследовательности) полипептида. Термин иммуногенный фрагмент относится ко всем фрагментам полипептида, которые сохраняют по крайней мере один предоминантный иммуногенный эпитоп полноразмерного ссылочного белка или полипептида. Ориентацию внутри полипептида обычно представляют в направлении от N-конца к С-концу, определяемом ориентацией амино-составляющей и карбоксильной составляющей индивидуальных аминокислот. Полипептиды транслируются от N- или амино-конца в направлении к С-концу или карбоксильному концу. Сигнальный пептид является короткой аминокислотной последовательностью (например, длиной приблизительно 18-25 аминокислот), которая направляет вновь синтезированные секреторные или мембранные белки в мембраны или через них, например, мембраны эндоплазматического ретикулума. Сигнальные пептиды часто, но не везде находятся на N-конце полипептида и часто отщепляются сигнальными пептидазами после пересечения белком мембраны. Сигнальные последовательности обычно имеют три общих структурных признака: N-концевой полярный основной район (n-район), гидрофобный центральный район и гидрофильный с-район. Термины полинуклеотид и последовательность нуклеиновой кислоты относятся к полимерной форме нуклеотидов длиной по крайней мере 10 оснований. Нуклеотиды могут быть рибонуклеотидами,дезоксирибонуклеотидами или модифицированными формами того или другого нуклеотида. Термин включает одно- и двухцепочечные формы ДНК. Под выделенным полинуклеотидом подразумевается полинуклеотид, который не граничит непосредственно с обеими из кодирующих последовательностей, с которыми он непосредственно граничит (одной на 5'-конце и другой на 3'-конце) во встречающемся в природе геноме организма, из которого он происходит. В одном варианте осуществления полинуклеотид кодирует полипептид. 5' и 3' Направление нуклеиновой кислоты определяется относительно связности индивидуальных нуклеотидных единиц и присваивается в соответствии с положениями атомов углеродов сахарного (дезоксирибозного или рибозного) кольца. Информационный (кодирующий) объем полинуклеотидной последовательности читают в направлении от 5' к 3'. Рекомбинантная нуклеиновая кислота является нуклеиновой кислотой, которая имеет последовательность, которая не встречается в природе, или имеет последовательность, которая получена путем искусственного объединения двух в остальных случаях разделенных сегментов последовательности. Это искусственное объединение может быть осуществлено с помощью химического синтеза или чаще с помощью искусственной манипуляции с выделенными сегментами нуклеиновых кислот, например, с использованием методов генной инженерии. Рекомбинантный белок является белком, который кодируется гетерологичной (например, рекомбинантной) нуклеиновой кислотой, которая была введена в клеткухозяина, такую как бактериальная или эукариотическая клетка. Нуклеиновую кислоту можно ввести в составе экспрессионного вектора, имеющего сигналы, допускающие экспрессию белка, кодируемого введенной нуклеиновой кислотой, или нуклеиновая кислота может интегрироваться в хромосому клеткихозяина. Термин гетерологичная(ый) в отношении нуклеиновой кислоты, полипептида или другого клеточного компонента означает, что компонент встречается там, где он обычно не обнаруживается в природе, и/или что он происходит из отличного источника или вида. Термин очистка (например, в отношении патогена или содержащей патоген композиции) относится к процессу удаления из композиции компонентов, присутствие которых является нежелательным. Очистка является относительным термином и не подразумевает удаление из композиции всех остатков нежелательного компонента. В условиях получения вакцины очистка включает такие способы, как центрифугирование, диализ, ионообменную хроматографию и гель-хроматографию, аффинную очистку или преципитацию. Таким образом, термин очищенный не подразумевает абсолютную чистоту, скорее, как предполагается, он является относительным термином. Следовательно, например, очищенный препарат нуклеиновой кислоты представляет собой препарат, в котором определенного белка больше, чем в случае, когда нуклеиновая кислота находится в ее репродуцирующем окружении, например, внутри клетки или в рабочем пространстве биохимических реакций. Препарат в значительной степени чистой нуклеиновой кислоты или белка может быть получен из условия, чтобы требуемая нуклеиновая кислота представляла по крайней мере 50% от общего содержания нуклеиновых кислот препарата. В определенных вариантах осуществления в значительной степени чистая нуклеиновая кислота будет представлять по крайней мере 60%, по крайней мере 70%, по крайней мере 80%, по крайней мере 85%, по крайней мере 90% или по крайней мере 95% или больше от общего содержания нуклеиновых кислот или белков препарата. Выделенный биологический компонент (такой как молекула нуклеиновой кислоты, белок или органелла) был в значительной степени отделен или очищен от других биологических компонентов в клетке организма, в которой компонент встречается в природе, таких как другие хромосомные или внехромо-7 021393 сомные ДНК и РНК, белки и органеллы. Нуклеиновые кислоты и белки, которые были выделены,включают нуклеиновые кислоты и белки, очищенные с помощью стандартных способов очистки. Термином также охватываются нуклеиновые кислоты и белки, приготовленные с помощью рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные нуклеиновые кислоты и белки. Антигеном является соединение, композиция или вещество, в том числе композиции, инъецируемые, абсорбируемые или иначе вводимые животному, которые могут стимулировать продукцию антител и/или Т-клеточную иммунную реакцию у животного. Термин антиген включает все связанные с ним антигенные детерминанты. Термин эпитоп или антигенная детерминанта относится к месту на антигене, на которое реагируют В- и/или Т-клетки. Доминантными антигенными детерминантами или доминантным эпитопом являются такие эпитопы, против которых создается функционально значимый иммунный ответ хозяина, например, продукция антител или Т-клеточная иммунная реакция. Таким образом, относительно защитного иммунного ответа против патогена, доминантными антигенными детерминантами являются такие составляющие антигена, которые после распознавания иммунной системой хозяина приводят к защите от заболевания, вызываемого патогеном. Термин Т-клеточный эпитоп относится к эпитопу, который после связывания с соответствующей молекулой МНС специфически связывается Т-клеткой (через рецептор Т-клетки). В-клеточный эпитоп является эпитопом, который специфически связывается антителом (или молекулой рецептора В-клетки). Адъювантом является агент, который усиливает создание иммунного ответа неспецифическим образом. Обычные адъюванты включают суспензию минеральных веществ (квасцов, алюминия гидроокиси, алюминия фосфата), на которых адсорбируется антиген; эмульсии, включающие эмульсии типа вода-в-масле и масло-в-воде (и их варианты, включающие двойные эмульсии и обратимые эмульсии), липосахариды, липополисахариды, иммуностимулирующие нуклеиновые кислоты (такие как олигонуклеотиды CpG), липосомы, агонисты Toll-подобных рецепторов (в частности, агонисты TLR2, TLR4,TLR7/8 и TLR9) и различные комбинации таких компонентов. Иммуногенной композицией является рассматриваемая композиция, подходящая для введения субъекту, являющемуся человеком или животным (например, в экспериментальном исследовании), которая способна к вызову специфического иммунного ответа, например, против патогена, такого как RSV. Как таковая иммуногенная композиция включает один или несколько антигенов (например, полипептидных антигенов) или антигенных детерминант. Иммуногенная композиция может также включать один или несколько дополнительных компонентов, способных к вызову или усилению иммунного ответа, таких как эксципиент, носитель и/или адъювант. В определенных случаях иммуногенные композиции вводят для вызова иммунного ответа, который защищает субъекта от симптомов или состояний, вызываемых патогеном. В некоторых случаях вызываемые патогеном симптомы или заболевание предотвращаются (или уменьшаются, или ослабляются) путем ингибирования репликации патогена (например, RSV) после подвергания субъекта воздействию патогена. В контексте описания этого изобретения будет подразумеваться, что термин иммуногенная композиция охватывает композиции, которые предназначены для введения субъекту или популяции субъектов с целью вызова защитного или паллиативного иммунного ответа против RSV (т.е. вакцинные композиции или вакцины). Иммунный ответ представляет собой реакцию клетки иммунной системы, такой как В-клетка, Тклетка или моноцит, на стимул. Иммунный ответ может быть гуморальным ответом, который приводит к продукции специфичных антител, таких как антигенспецифичные нейтрализующие антитела. Иммунный ответ может также быть Т-клеточной иммунной реакцией, такой как CD4+ или CD8+ Т-клеточная иммунная реакция. В некоторых случаях ответ является специфичным для конкретного антигена (т.е. антигенспецифичным ответом). Если антиген происходит из патогена, антигенспецифичный ответ является патогенспецифичным ответом. Защитным иммунным ответом является иммунный ответ, который подавляет наносящую вред функцию или активность патогена, уменьшает инфицирование патогеном или ослабляет симптомы (в том числе смерть), которые являются следствием инфицирования патогеном. Защитный иммунный ответ можно измерить, например, по ингибированию репликации вирусов или бляшкообразования в анализе уменьшения количества бляшек или анализе нейтрализации с использованием ELISA, или с помощью измерения устойчивости к заражению патогеном in vivo. Иммунный ответ со сдвигом в направлении Th1-типа характеризуется присутствием Т-клетокхелперов CD4+, которые продуцируют IL-2 и IFN-, и, следовательно, секрецией или присутствием IL-2 и IFN-. Напротив, иммунный ответ со сдвигом в направлении Th2-типа характеризуется преобладанием Т-клеток-хелперов CD4+, которые продуцируют IL-4, IL-5 и IL-13. Иммунологически эффективное количество представляет собой количество композиции (обычно иммуногенной композиции), используемое для вызова иммунного ответа у субъекта на композицию или антиген в композиции. Обычно желаемым результатом является продукция специфичного для антигена(например, патогена) иммунного ответа, который способен к защите или вносит вклад в защиту субъекта от патогена. Однако для создания защитного иммунного ответа против патогена могут потребоваться многократные введения иммуногенной композиции. Таким образом, в контексте описания этого изобре-8 021393 тения термин иммунологически эффективное количество охватывает дробную дозу, которая в сочетании с предшествующими или последующими введениями вносит вклад в достижение защитного иммунного ответа. Прилагательное фармацевтически приемлемый означает, что референт подходит для введения субъекту (например, являющемуся человеком или животным субъекту). В Remington's PharmaceuticalSciences (by E.W. Martin, Mack Publishing Co., Easton, PA, 15th Edition (1975 описываются композиции и составы (в том числе разбавители), подходящие для фармацевтической доставки терапевтических и/или профилактических композиций, в том числе иммуногенных композиций. Термин модулировать со ссылкой на ответ, такой как иммунный ответ, означает изменять или регулировать начало, величину, продолжительность или характеристики ответа. Агент, модулирующий иммунный ответ, изменяет по крайней мере одно из следующего: начала, величины, продолжительности или характеристик иммунного ответа - после его введения, или изменяет по крайней мере одно из следующего: начала, величины, продолжительности или характеристик - по сравнению с контрольным агентом. Термин уменьшает (ослабляет) является относительным термином, так что агент ослабляет ответную реакцию или состояние, если ответная реакция или состояние уменьшается количественно после введения агента, или она ослабляется после введения агента по сравнению с контрольным агентом. Подобным образом, термин предотвращает не означает обязательно, что агент полностью исключает ответную реакцию или состояние при условии, что исключается по крайней мере одна характеристика ответа. Таким образом, иммуногенная композиция, которая уменьшает или предотвращает инфекцию или ответную реакцию, такую как патологическая реакция, например, вирусное заболевание, в отношении которого вакцина является активной, может, но необязательно, полностью исключить такую инфекцию или ответную реакцию, лишь бы инфекция или ответная реакция заметно уменьшалась, например, на по крайней мере приблизительно 50%, например, на по крайней мере приблизительно 70% или приблизительно 80%, или даже на приблизительно 90% (т.е. составляла 10% или меньше) от инфекции или ответной реакции в отсутствие агента или по сравнению с контрольным агентом. Субъектом является живой многоклеточный организм позвоночного. В контексте описания этого изобретения субъект может быть экспериментальным субъектом, таким как не являющееся человеком животное, например, мышь, хлопковая крыса или не являющийся человеком примат. Альтернативно,субъектом может быть являющийся человеком субъект.PreF антигены В природе белок F RSV экспрессируется в виде одного полипептида-предшественника длиной 574 аминокислот, названного F0. In vivo F0 подвергается олигомеризации в эндоплазматическом ретикулуме и протеолически расщепляется протеазой фурином в двух консервативных консенсусных последовательностях для фурина (сайтах расщепления фурином), RARR109 (SEQ ID NO: 15) и RKRR136 (SEQ IDNO: 16), с созданием олигомера, состоящего из двух связанных дисульфидной связью фрагментов. Меньший из этих фрагментов называют F2, и он происходит из N-концевой части предшественника F0. Квалифицированные в данной области техники специалисты определят, что сокращения F0, F1 и F2 являются часто обозначаемыми в научной литературе F0, F1 и F2. Более большой С-концевой F1-фрагмент закрепляет белок F в мембране благодаря последовательности из гидрофобных аминокислот, которая примыкает к 24-аминокислотнотному цитоплазматическому хвосту. Три димера F2-F1 объединяются с образованием зрелого белка F, который принимает нестабильную конформацию до его слияния, которая начинает подвергаться конформационному изменению после контактирования с мембраной клеткимишени. Это конформационное изменение экспонирует гидрофобную последовательность, известную как пептид слияния, которая объединяется с мембраной клетки-хозяина и активирует слияние мембраны вируса, или инфицированной клетки, с клеточной мембраной клетки-мишени.F1-фрагмент содержит по крайней мере два домена из семи повторов, названных HRA и HRB и находящихся вблизи от пептида слияния и трансмембранных якорных доменов соответственно. В конформации до слияния димер F2-F1 образует глобулярную головку и структуру ножки, при этом HRAдомены находятся в сегментированной (растянутой) конформации в глобулярной головке. Напротив,HRB-домены образуют трехспиральную ножку, протягивающуюся от района головки. Во время перехода конформации до слияния в конформацию после слияния HRA-домены разрушаются и сближаютHRB-домены с образованием узла в виде антипараллельных шестерных спиралей. В последующей за слиянием фазе пептид слияния и трансмембранные домены сближены для облегчения слияния с мембраной. Хотя предоставленное выше описание конформации основывается на молекулярном моделировании данных кристаллографии, структурные различия между конформациями до и после слияния можно наблюдать без обращения к кристаллографии. Например, электронную микроскопию можно использовать для проведения различий между конформациями до и после слияния, как продемонстрировано Calder и др. (Virology, 271: 122-131 (2000 и Morton и др. (Virology, 311: 275-288), которые включены в данное описание посредством ссылки с целью технологических уроков. Конформацию до слияния можно также отличить от конформации после слияния с помощью анализов объединения липосом (см. Connollyet al., Proc. Natl. Acad. Sci. USA, 103: 17903-17908 (2006), который также включен в данное описание посредством ссылки с целью технологических уроков). Кроме того, между конформациями до и после слияния можно провести различия, используя антитела (например, моноклональные антитела), которые специфически распознают конформационные эпитопы, присутствующие в одной или другой форме конформации до слияния или после слияния белка F RSV, но не в другой форме. Такие конформационные эпитопы могут быть обусловлены предпочтительным экспонированием антигенной детерминанты на поверхности молекулы. Альтернативно, конформационные эпитопы могут возникнуть в результате сближения аминокислот, которые являются несмежными в линейном полипептиде. Описываемые в настоящем описании PreF антигены предназначены для стабилизации и поддержания конформации белка F RSV до его слияния, так что в количестве экспрессированного белка значительная часть количества экспрессированного белка находится в конформации до слияния (например, по предсказанию с помощью структурного и/или термодинамического моделирования или по оценке с помощью одного или нескольких способов, описанных выше). Стабилизирующие модификации вводят в природный (не синтетический) белок F, такой как приводимый в качестве примера белок F SEQ ID NO: 2, из условия, чтобы основные иммуногенные эпитопы конформации белка F до его слияния сохранялись после введения PreF антигена в клеточное или внеклеточное окружение (например, in vivo, например,после введения субъекту). Во-первых, гетерологичный стабилизирующий домен можно поместить на С-конце конструкции для того, чтобы заменить домен закрепления в мембране полипептида F0. Теоретически найдено, что этот стабилизирующий домен компенсирует нестабильность HRB, что помогает стабилизировать конформацию до слияния. В приводимых в качестве примеров вариантах осуществления гетерологичным стабилизирующим доменом является домен мультимеризации белков. Одним особенно предпочтительным примером такого домена мультимеризации белков является домен тримеризации. Приводимые в качестве примеров домены тримеризации сворачиваются в биспираль, которая активирует сборку в тримеры множества полипептидов, имеющих такие биспиральные домены. Одним предпочтительным примером домена тримеризации является изолейциновая молния. Приводимым в качестве примера доменом изолейциновая молния является сконструированный вариант изолейциновой молнии GCN4 дрожжей (см. Harbury et al. Science 262: 1401-1407(1993. Последовательность одного подходящего домена изолейциновая молния представлена SEQ ID NO: 11, хотя в равной степени подходят варианты этой последовательности, которые сохраняют способность к образованию биспирального стабилизирующего домена. Альтернативные стабилизирующие биспиральные домены тримеризации включают TRAF2 (входящийв GENBANK - Q12933 [gi:23503103]; аминокислоты 299-348), тромбоспондин 1 (входящийРО 7996 [gi:135717]; аминокислоты 291-314), матрилин-4 (входящий 095460 [gi:14548117]; аминокислоты 594-618), СМР (матрилин-1) (входящийNP 002370 [gi:4505111]; аминокислоты 463-496), HSF1 (входящийААХ 42211 [gi:61362386]; аминокислоты 165-191) и кубилин(входящийNP001072 [gi:4557503]; аминокислоты 104-138). Ожидается, что подходящий домен тримеризации приведет к сборке значительной части экспрессированного белка в тримеры. Например, по крайней мере 50% рекомбинантного полипептида PreF, имеющего домен тримеризации, будет собираться в триммер(например, по оценке с помощью рассеяния света под множеством углов при использовании фракционирования потоков асимметричных полей (AFF-MALS. Как правило, по крайней мере 60%, более предпочтительно по крайней мере 70% и наиболее желательно по крайней мере приблизительно 75% или более экспрессированного полипептида существует в виде тримера. Для еще большей стабилизации HRB остаток лейцина, находящийся в положении 512 (относительно природного белка F0) PreF замещают лизином (L4 82K приводимого в качестве примера полипептидаPreF антигена с SEQ ID NO: 6). Эта замена улучшает периодичность гидрофобных остатков в биспирали. Подобным образом, после аминокислоты в положении 105 можно добавить лизин. Во-вторых, можно исключить рер 27. Анализ структурной модели белка F RSV в предшествующей слиянию фазе наводит на мысль, что рер 27 создает большую не ограниченную связями петлю между F1 и F2. Эта петля не способствует стабилизации предшествующей слиянию фазы и удаляется после расщепления природного белка фурином. В-третьих, можно делетировать один или оба мотива расщепления фурином. При таком конструировании пептид слияния не отщепляется от F2, что предотвращает освобождение от глобулярной головки предшествующего слиянию конформационного варианта структуры и доступ в расположенные поблизости мембраны. Теоретически найдено, что взаимодействие между пептидом слияния и мембранной поверхностью является основной предпосылкой нестабильности предшествующей слиянию фазы. Во время процесса слияния взаимодействие между пептидом слияния и мембраной-мишенью приводит к экспонированию пептида слияния на поверхности структуры глобулярной головки, усиливая нестабильность предшествующей слиянию фазы и укладку в последующий за слиянием конформационный вариант структуры. Конформационное изменение делает возможным процесс слияния с мембраной. Ожидается, что удаление одного или обоих сайтов расщепления фурином предотвратит доступ мембраны к Nконцевой части пептида слияния, стабилизируя предшествующую слиянию фазу. Необязательно может быть также исключен по крайней мере один сайт расщепления не фурином,например, путем замены одной или нескольких аминокислот. Например, экспериментальные данные говорят о том, что в условиях, благоприятных для расщепления определенными металлопротеиназами,PreF антиген может быть расщеплен вблизи аминокислот 110-118 (например, с расщеплением, происходящим между аминокислотами 112 и 113 PreF антигена; между лейцином в положении 142 и глицином в положении 143 ссылочного полипептида белка F SEQ ID NO: 2). Соответственно, модификация одной или нескольких аминокислот в пределах этого района может уменьшить расщепление PreF антигена. Например, лейцин в положении 112 можно заменить отличной аминокислотой, такой как изолейцин или триптофан. Альтернативно или дополнительно, глицин в положении 113 можно заменить серином или аланином. Полипептид природного белка F может быть выбран из любого белка F штамма A RSV или штамма В RSV или их вариантов (определенных в настоящем описании). В определенных, приводимых в качестве примеров вариантах осуществления полипептидом белка F является белок F, представленный SEQ IDNO: 2. Для облегчения понимания описания этого изобретения все положения аминокислотных остатков,независимо от штамма, приведены относительно положения (т.е. положение аминокислотного остатка соответствует положению) аминокислоты приводимого в качестве примера белка F. Сопоставимые положения аминокислот любого штамма, отличного от штамма А или В RSV, могут быть без труда определены специалистами со средним уровнем компетентности в данной области техники путем совмещения аминокислотной последовательности выбранного штамма RSV с приводимой в качестве примера последовательностью, используя легкодоступные и широко известные алгоритмы для совмещения (такие какBLAST, например, используя параметры по умолчанию). Многочисленные дополнительные примеры полипептидов белка F из различных штаммов RSV описываются в заявке WO 2008114149 (которая включена в данное описание посредством ссылки с целью предоставления дополнительных примеров последовательностей белков F и G RSV). Дополнительные варианты могут возникнуть благодаря генетическому дрейфу или могут быть получены искусственно, используя сайт-направленный или неспецифический мутагенез, или с помощью рекомбинации двух или более предсуществующих вариантов. Такие дополнительные варианты также подходят в связи с описываемыми в настоящем описании PreF (и PreFG) антигенами. При выборе F2- и F1-доменов белка F квалифицированный в данной области техники специалист определит, что включение целого F2- и/или F1-домена не является строго обязательным. Как правило,конформационные соображения имеют важное значение при выборе подпоследовательности (или фрагмента) F2-домена. Поэтому F2-домен обычно включает часть F2-домена, которая способствует сборке и стабильности полипептида. В определенных, приводимых в качестве примеров вариантах F2-домен включает аминокислоты 26-105. Однако также возможны варианты, имеющие минорные модификации по длине (путем добавления или делеции одной или нескольких аминокислот). Как правило, по крайней мере, подпоследовательность (или фрагмент) F1-домена выбирают и конструируют так, чтобы она поддерживала стабильную конформацию, которая включает иммунодоминатные эпитопы белка F. Например, обычно желательным является выбор подпоследовательности полипептида F1-домена, которая включает эпитопы, распознаваемые нейтрализующими антителами, в районах аминокислот 262-275 (при нейтрализации паливизумабом) и 423-436 (мАв Ch101F Centocor). Кроме того,желательным является включение Т-клеточных эпитопов, например, в районе аминокислот 328-355. Чаще всего, когда одна непрерывная часть F1-субъединицы (например, охватывающая аминокислоты 262436), за исключение эпитопов, могла бы сохраняться в синтетической последовательности, которая включает эти иммунодоминантные эпитопы в виде дискретных элементов, собираемой в стабильную конформацию. Следовательно, полипептид F1-домена включает, по крайней мере, приблизительно аминокислоты 262-436 полипептида белка F RSV. В одном не ограничивающем примере, предоставленном в настоящем описании, F1-домен включает аминокислоты 137-516 полипептида природного белка F. Квалифицированный в данной области техники специалист определит, что дополнительные более короткие подпоследовательности могут использоваться по усмотрению практикующего специалиста. При выборе подпоследовательности F2- или F1-домена (или, как будет обсуждаться ниже, компонента белка G некоторых PreF-G антигенов), помимо конформационного соображения, может быть желательным выбор последовательностей (например, вариантов, подпоследовательностей и подобных) на основе включения дополнительных иммуногенных эпитопов. Например, дополнительные Т-клеточные эпитопы можно идентифицировать, используя якорные мотивы или другие способы, такие как определения с использованием разветвленной компьютерной сети или полиноминальных определений, известные в данной области техники(имеющийся во Всемирной паутине на сайтеwwwbimas.dcrt.nih.gov/molbi/hlabind/index.html) и SYFPEITH (имеющийся в Интернете на сайте syfpeithi.bmiheidelberg.com/scripts/MHCServer/dll/home.htm. Например, для определения порога связывания пептидов и выбора пептидов с показателями, которые дают им высокую вероятность связывания с МНС или антителом при определенной аффинности, используют алгоритмы. Алгоритмы основаны или на эффектах на связывание с МНС конкретной аминокислоты в конкретном положении, эффектах на связывание с антителом конкретной аминокислоты в конкретном положении, или на эффектах на связывание конкретной замены в содержащем мотив пептиде. В контексте иммуногенного пептида консервативным остатком является остаток, который обнаруживается значительно чаще, чем можно было бы ожидать при случайном распределении в конкретном положении в пептиде. Якорные остатки являются консервативными остатки, которые обеспечивают точку контакта с молекулой МНС. Т-клеточные эпитопы, идентифицированные с помощью таких прогнозирующих способов, можно подтвердить с помощью измерения их связывания со специфическим белком МНС и по его способности к стимулированию Т-клеток после представления в области белка МНС. Предпочтительно, когда PreF антигены (в том числе обсуждаемые ниже PreF-G антигены) включают сигнальный пептид, соответствующий системе экспрессии, например, сигнальный пептид млекопитающего или вируса, такой как природная сигнальная последовательность F0 RSV (например, аминокислоты 1-25 SEQ ID NO: 2 или аминокислоты 1-25 SEQ ID NO: 6). Как правило, сигнальный пептид выбирают так, чтобы он был совместим с клетками, выбранными для рекомбинантной экспрессии. Например,для экспрессии в клетках насекомых замененным может быть сигнальный пептид (например, бакуловирусный сигнальный пептид или сигнальный пептид мелиттина). Если предпочтительной является система экспрессии в растениях, подходящие сигнальные пептиды растений известны в данной области техники. Многочисленные, приводимые в качестве примеров сигнальные пептиды известны в данной области техники (см., например, ZhangHenzel. Protein Sci., 13: 2819-2824 (2004), которые описывают многочисленные сигнальные пептиды человека) и каталогизируются, например, в базе данных, касающихся сигнальных пептидов, SPdb, которая включает сигнальные последовательности архебактерий, прокариот и эукариот (http://proline.bic.nus.edu.sg/spdb/). Необязательно любой из предшествующих антигенов может включать дополнительную последовательность или метку, такую как His-метка, для облегчения очистки. Необязательно PreF антиген может включать дополнительные иммуногенные компоненты. В определенных особенно предпочтительных вариантах осуществления PreF антиген включает антигенный компонент белка G RSV. Приводимые в качестве примеров химерные белки, имеющие PreF и компонентG, включают следующие белки: PreFV1 (представленный SEQ ID NO: 7 и 8) и PreFV2 (представленный SEQ ID NO: 9 и 10). В PreF-G антигенах антигенная часть белка G (например, усеченный белок G, например, аминокислоты 149-229) добавлена к С-концу конструкции. Как правило, компонент белка G соединен с компонентом белка F через гибкую линкерную последовательность. Например, в приводимой в качестве примера конструкции PreFV1 белок G соединен с компонентом PreF с помощью линкера -GGSGGSGGS- (SEQPreFV2 имеет 2 глицина (-GG-) в качестве линкера. Если присутствует, полипептидный домен белка G может включать всю или часть белка G, выбираемого из любого штамма А или В RSV. В определенных, приводимых в качестве примеров вариантах осуществления белок G является (или является идентичным ему на 95%) белком G, представленным SEQID NO: 4. Дополнительные примеры подходящих последовательностей белка G можно найти в заявкеWO 2008114149 (которая включена в данное описание посредством ссылки). Компонент в виде полипептида белка G выбирают так, чтобы он включал, по крайней мере, подпоследовательность (или фрагмент) белка G, которая сохраняет иммунодоминантный Т-клеточный эпитоп(ы), например, в районе аминокислот 183-197, такую как фрагменты белка G, которые включают аминокислоты 151-229, 149-229 или 128-229 природного белка G. В одном приводимом в качестве примера варианте осуществления полипептидом белка G является подпоследовательность (или фрагмент) полипептида природного белка G, которая включает все или часть аминокислотных остатков 149-229 полипептида природного белка G. Квалифицированный в данной области техники специалист без труда определит, что могут также использоваться более длинные или более короткие части белка G, если выбранная часть конформационно не дестабилизирует или не нарушает экспрессию, укладку или процессирование PreF-G антигена. Необязательно домен белка G включает аминокислотную замену в положении 191, которое, как ранее было установлено, вовлечено в ослабление и/или предотвращение усиленного заболевания, характеризующегося эозинофилией, связанного с вакцинами на основе инактивированных формалином RSV. Через описание признаков встречающиеся в природе и замещенные (N191A) белки G можно найти, например, в публикации заявки на патент США 2005/0042230, которая включена в данное описание посредством ссылки. Например, что касается выбора последовательностей, соответствующих встречающимся в природе штаммам, один или несколько доменов могут соответствовать по последовательности штамму А или ВRSV, например, обычным лабораторным изолятам, названным А 2 или Long, или любому другому встречающемуся в природе штамму или изоляту (описанному в вышеупомянутой заявке WO 2008114149). Помимо таких встречающихся в природе и изолированных вариантов, сконструированные варианты,которые имеют схожесть последовательностей с вышеупомянутыми последовательностями, могут также использоваться в связи с PreF (в том числе PreF-G) антигенами. Квалифицированным в данной области техники специалистам будет понятно, что схожесть между полипептидами (и описываемыми ниже полинуклеотидными последовательностями) PreF антигенов, что касается полипептида (и нуклеотидных последовательностей в общем), можно выразить через схожесть между последовательностями, в остальных случаях именуемую идентичностью последовательностей. Идентичность последовательностей часто определяют через процент идентичности (или схожести); чем выше процент, тем более схожими являются первичные структуры двух последовательностей. В общем, чем более схожими являются первичные структуры двух аминокислотных (или полинуклеотидных) последовательностей, тем более схожими являются структуры более высокого порядка, происходящие в результате укладки и сборки. Варианты полипептидных (и полинуклеотидных) последовательностей PreF обычно имеют одну или небольшое число делеций, добавлений или замен аминокислот, но, тем не менее, будут иметь очень высокий процент идентичных аминокислот и обычно идентичности их полинуклеотидных последовательностей. Более важно, чтобы варианты сохраняли структурные и, следовательно, конформационные признаки ссылочных последовательностей, описываемых в настоящем описании. Способы определения идентичности последовательностей широко известны в данной области техники и применимы к полипептидам PreF антигенов, а также нуклеиновым кислотам, кодирующим их(например, описываемым ниже). Различные программы и алгоритмы для совмещения описаны (см. Smithand Sharp, Gene 73: 237, 1988; Higgins and Sharp, CABIOS 5: 151, 1989; Corpet et al., Nucleic Acids Research 16: 10881, 1998; и Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85: 2444, 1988). Altschul и др. (Nature Genet. 6: 119, 1994) представляют детальное рассмотрение способов совмещения последовательностей и расчетов гомологии. Основное средство поиска, основанное на локальных совмещениях, (BLAST)NCBI (Altschul et al., J. Mol. Biol. 215: 403, 1990) доступно из нескольких источников, включающих Национальный центр биотехнологической информации (NCBI, Bethesda, MD), и в Интернете, для применения в соединении с программами анализа последовательностей blastp, blastn, blastx, tblastn и tblastx. Описание того, каким образом определить идентичность последовательностей, используя эту программу,имеется на Web-сайте NCBI в Интернете. В некоторых случаях PreF антигены имеют одну или несколько модификаций аминокислот относительно аминокислотной последовательности встречающегося в природе штамма, из которого она происходит (например, помимо вышеупомянутых стабилизирующих модификаций). Такими различиями могут быть добавление, делеция или замена одной или нескольких аминокислот. Вариант обычно отличается,но не более чем приблизительно 1%, или 2%, или 5%, или 10%, или 15%, или 20% аминокислотных остатков. Например, полипептидная последовательность варианта PreF антигена (в том числе PreF-G) может включать 1, или 2, или до 5, или до приблизительно 10, или до приблизительно 15, или до приблизительно 50, или до приблизительно 100 различий в аминокислотах по сравнению с приводимыми в качестве примеров полипептидными последовательностями PreF антигенов - SEQ ID NO: 6, 8 и/или 10. Таким образом, вариант белка F или G RSV или PreF антигена (в том числе PreF-G) обычно идентичен по последовательности на по крайней мере 80 или 85%, чаще на по крайней мере приблизительно 90% или более, например, 95% или даже 98% или 99% ссылочному белку, например, ссылочным последовательностям, проиллюстрированным в SEQ ID NO: 2, 4, 6, 8 и/или 10, или любому из приводимых в качестве примеров PreF антигенов, описываемых в настоящем описании. Дополнительными вариантами, включенными в качестве характерного признака описания этого изобретения, являются PreF антигены (в том числе PreF-G антигены), которые включают всю или часть нуклеотидной или аминокислотной последовательности, выбираемой из встречающихся в природе вариантов, описанных в WO 2008114149. Дополнительные варианты могут возникнуть благодаря генетическому дрейфу или могут быть получены искусственно, используя сайт-направленный или неспецифический мутагенез, или с помощью рекомбинации двух или более предсуществующих вариантов. Такие дополнительные варианты также подходят в связи с описываемыми в настоящем описании PreF (и PreF-G) антигенами. Например, модификацией может быть замена одной или нескольких аминокислот (например, двух аминокислот, трех аминокислот, четырех аминокислот, пяти аминокислот, вплоть до приблизительно десяти аминокислот или более), которые не изменяют конформацию или иммуногенные эпитопы результирующего PreF антигена. Альтернативно или дополнительно, модификация может включать делецию одной или нескольких аминокислот и/или добавление одной или нескольких аминокислот. Действительно, если желательно,одним или несколькими полипептидными доменами может быть синтетический полипептид, который не соответствует какому-либо одному штамму, а включает составные подпоследовательности из множества штаммов или даже из консенсусной последовательности, полученной при совмещении полипептидов множества штаммов вируса RSV. В определенных вариантах осуществления один или несколько полипептидных доменов модифицированы путем добавления аминокислотной последовательности, которая является меткой, которая облегчает последующее процессирование или очистку. Такая метка может быть антигенной или эпитопной меткой, ферментной меткой или полигистидиновой меткой. Обычно метка находится на одном или другом конце белка, например, на С-конце или N-конце антигена или слитого белка. Нуклеиновые кислоты, кодирующие PreF антигены Другой аспект описания этого изобретения имеет отношение к рекомбинантным нуклеиновым кислотам, которые кодируют описанные выше PreF антигены. В определенных вариантах осуществления рекомбинатные нуклеиновые кислоты оптимизированы в отношении частот использования кодонов для экспрессии в выбранной прокариотической или эукариотической клетке-хозяине. Например, SEQ ID NO: 5 и 12 являются двумя иллюстративными, не ограничивающими, примерами последовательностей, кодирующих PreF антиген, которые были оптимизированы в отношении частот использования кодонов для экспрессии в клетках млекопитающих, например, клетках СНО. Для способствования репликации и экспрессии нуклеиновые кислоты могут быть встроены в вектор, такой как вектор для экспрессии в прокариотических или эукариотических клетках. Клетки-хозяины, включающие рекомбинантные, кодирующие PreF антигены нуклеиновыекислоты, также являются отличительным признаком описания этого изобретения. Предпочтительные клетки-хозяины включают прокариотические (т.е. бактериальные) клетки-хозяины, такие как E.coli, а также многочисленные эукариотические клетки-хозяины, включающие клетки грибов (например, дрожжей), клетки насекомых и клетки млекопитающих (такие как клетки СНО,VERO и HEK293). Для способствования репликации и экспрессии нуклеиновые кислоты могут быть встроены в вектор, такой как вектор для экспрессии в прокариотических или эукариотических клетках. Хотя описываемые в настоящем описании нуклеиновые кислоты могут быть встроены в любой из ряда векторов (включающих, например, бактериальные плазмиды, фаговую ДНК, бакуловирус, дрожжевые плазмиды, векторы, являющиеся результатом комбинаций плазмид и фаговой ДНК, вирусную ДНК, такую как вирус коровьей оспы, аденовирус, поксвирус птиц, вирус псевдобешенства, аденовирус, аденоассоциированный вирус, ретровирус и многие другие), чаще всего вектором будет экспрессионный вектор, подходящий для образования полипептидных продуктов экспрессии. В экспрессионном векторе нуклеиновая кислота,кодирующая PreF антиген, обычно располагается близко и ориентирована относительно соответствующей контролирующей транскрипцию последовательности (промотора и необязательно одного или нескольких энхансеров) для управления синтезом мРНК. Т.е. представляющая интерес полинуклеотидная последовательность функционально связана с соответствующей контролирующей транскрипцию последовательностью. Примеры таких промоторов включают непосредственно ранний промотор CMV, LTR или промотор SV40, промотор полиэдрина бакуловируса, промотор lac или trp E.coli, промотор фага Т 7 и лямбда PL и другие промоторы, которые, которые, как известно, контролируют экспрессию генов в прокариотических или эукариотических клетках или других вирусах. Экспрессионный вектор обычно также содержит сайт связывания рибосом для инициации трансляции и терминатор транскрипции. Вектор необязательно включает соответствующие для усиления экспрессии последовательности. Кроме того, экспрессионные векторы необязательно включают один или несколько генов маркеров селекции для обеспечения фенотипического признака для отбора трансформированных клеток-хозяинов, таких как дигидрофолатредуктаза, или устойчивость к неомицину для культивирования эукариотических клеток или таких как устойчивость к канамицину, тетрациклину или ампициллину в E.coli. Экспрессионный вектор может также включать дополнительные экспрессионные элементы, например, для увеличения эффективности трансляции. Эти сигналы могут включать, например, инициирующий кодон ATG и примыкающие последовательности. В некоторых случаях, например, инициирующий трансляцию кодон и связанные элементы последовательности (например, природный кодон начала трансляции) встраивают в соответствующий экспрессионный вектор одновременно с представляющей интерес полинуклеотидной последовательностью. В таких случаях дополнительные, контролирующие трансляцию сигналы не требуются. Однако в тех случаях, когда встраивают только кодирующую полипептид последовательность или ее часть, экзогенные контролирующие трансляцию сигналы, включающие инициирующий кодон ATG, обеспечивают для трансляции нуклеиновой кислоты, кодирующей PreF антиген. Инициирующий кодон располагают в правильной рамке считывания для обеспечения трансляции, представляющей интерес полинуклеотидной последовательности. Экзогенные транскрипционные элементы и инициирующие кодоны могут иметь различные происхождения, как природное, так и синтетическое. При желании, эффективность экспрессии можно дополнительно увеличить с помощью включения энхансеров, подходящих для используемой клеточной системы (Scharf et al. (1994) Results Probl.Cell Differ 20: 125-162; Bitter et al. (1987) Methods in Enzymol. 153: 516-544). В некоторых случаях нуклеиновая кислота (такая как вектор), которая кодирует PreF антиген,включает один или несколько дополнительных элементов-последовательностей, выбираемых для увеличения и/или оптимизации экспрессии кодирующей PreF нуклеиновой кислоты после введения в клеткухозяина. Например, в определенных вариантах осуществления нуклеиновые кислоты, кодирующие PreF антиген, включают последовательность интрона, такую как последовательность интрона герпесвируса 5 человека (см., например, SEQ ID NO: 13). Неоднократно было продемонстрировано, что интроны усиливают экспрессию гомологичных и гетерологичных нуклеиновых кислоты после их размещения соответствующим образом в рекомбинантной конструкции. Другой класс усиливающих экспрессию последовательностей включает связанные с эпигенезом элементы, такие как район прикрепления к матриксу (или элементы STAR, описанные в Otte et al., Biotechnol. Prog. 23: 801-807, 2007). Без ограничения какой-либо теорией полагают, что MAR опосредуют прикрепление целевой последовательности ДНК к ядерному матриксу, создавая домены в виде петлевых участков хроматина, которые ответвляются от ядер гетерохроматина. Несмотря на то что MAR не содержат какой-либо явной консенсусной или распознаваемой последовательности, их самым стойким признаком, по-видимому, является общее высокое содержание А/Т и основания С, преобладающие на одной цепи. Эти районы, по-видимому, образуют изогнутые вторичные структуры, которые могут быть склонны к разделению цепей, и могут включать раскручивающий ядро элемент (CUE), который может служить в качестве точки в образовании ядра для разделения цепей. С последовательностями MAR было связано несколько простых АТ-богатых последовательностей-мотивов, например, А-бокс, Т-бокс, ДНК-раскручивающие мотивы, сайты связывания SATB1 (Нбокс, А/Т/С 25) и консенсусные сайты для топоизомеразы II для позвоночных и дрозофилы. Приводимые в качестве примеров последовательности MAR описываются в публикации заявки на патент США 20070178469 и в международной заявке на патентWO 02/074969 (которые включены в данное описание посредством ссылки). Дополнительные последовательности MAR, которые могут использоваться для усиления экспрессии нуклеиновой кислоты, кодирующей PreF антиген, включают MAR лизоцима цыпленка, MARp1-42, MARp1-6, MARp1-68 и MARpx-29, описанные в Girod et al., Nature Methods, 4: 747753, 2007 (с входящимив GenBank EA423306, DI107030, DI106196, DI107561 и DI106512 соответственно). Квалифицированный специалист определит, что экспрессию можно, кроме того, модулировать путем выбора MAR, которая создает промежуточный уровень усиления, как это сообщено для MAR 1-9. Если желательно, альтернативные последовательности MAR для увеличения экспрессии PreF антигена можно идентифицировать путем перебора базы данных, касающихся последовательностей, например,используя такое программное обеспечение, как MAR-Finder (имеющееся на Web-сайте: futuresoft.org/MarFinder), SMARTest (имеющееся на Web-сайте: genomatix.de) или SMARScan I (Levitsky etal., Bioinformatics 15: 582-592, 1992). В некоторых вариантах осуществления MAR вводится (например,подвергается трансфекции) в клетку-хозяина на той же нуклеиновой кислоте (например, векторе), что и кодирующая PreF антиген последовательность. В альтернативном варианте осуществления MAR вводится на отдельной нуклеиновой кислоте (например, при передаче) и может необязательно коинтегрироваться с кодирующей антиген PreF полинуклеотидной последовательностью. Приводимые в качестве примеров методики, надлежащие для того, чтобы служить ориентиром для специалиста со средним уровнем компетентности в данной области техники на протяжении получения рекомбинантных нуклеиновых кислот PreF антигенов, можно найти (см. Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratory Press, 1989; Sambrook et al., Molecularal., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, 4th ed., WileySons, 1992). Приводимые в качестве примеров нуклеиновые кислоты, кодирующие полипептиды PreF антигенов, представлены SEQ ID NO: 5, 7, 9, 12 и 13. Дополнительные варианты можно получить путем компоновки аналогичных полипептидных последовательностей белков F и G, выбираемых из любого из известных (или впоследствии) обнаруженных штаммов RSV, например, описанных в WO 2008114149. Квалифицированные в данной области техники специалисты могут получить дополнительные варианты последовательностей, имеющие некую идентичность с приводимыми в качестве примеров вариантами. Как правило, варианты нуклеиновых кислот будут кодировать полипептиды, которые отличаются но не более чем 1%, или 2%, или 5%, или 10%, или 15%, или 20% аминокислотных остатков. Т.е. последовательности кодируемых полипептидов идентичны на по крайней мере 80 или 85%, чаще на по крайней мере приблизительно 90% или более, например, 95% или даже 98% или 99%. Квалифицированным в данной области техники специалистам будет сразу же понятно, что полинуклеотидные последовательности, кодирующие полипептиды PreF, могут сами иметь меньшую идентичность вследствие избыточности генетического кода. В некоторых случаях PreF антигены имеют одну или несколько модификаций аминокислот относительно аминокислотной последовательности встречающегося в природе штамма, из которого она происходит (например, помимо вышеупомянутых стабилизирующих модификаций). Такими различиями могут быть добавление, делеция или замена одного или нескольких нуклеотидов или аминокислот соответственно. Вариант обычно отличается, но не более чем приблизительно 1%, или 2%, или 5%, или 10%, или 15%, или 20% нуклеотидных остатков. Например, нуклеиновая кислота варианта PreF антигена (в том числе PreF-G) может включать 1, или 2, или до 5, или до приблизительно 10, или до приблизительно 15,или до приблизительно 50, или до приблизительно 100 различий в нуклеотидах по сравнению с приводимыми в качестве примеров нуклеиновыми кислотами PreF антигена - SEQ ID NO: 5, 7, 9, 12 и/или 13. Таким образом, вариант нуклеиновой кислоты белка F или G RSV или PreF антигена (в том числе PreFG) обычно идентичен по последовательности на по крайней мере 80 или 85%, чаще на по крайней мере приблизительно 90% или более, например, 95% или даже 98% или 99% ссылочной последовательности,например, ссылочным последовательностям, проиллюстрированным в SEQ ID NO: 1, 3, 5, 7, 9, 12 и/или 13, или любой из приводимых в качестве примеров нуклеиновых кислот PreF антигенов, описываемых в настоящем описании. Дополнительными вариантами, включенными в качестве характерного признака описания этого изобретения, являются PreF антигены (в том числе PreF-G антигены), которые включают всю или часть нуклеотидной последовательности, выбираемой из встречающихся в природе вариантов,описанных в WO 2008114149. Дополнительные варианты могут возникнуть благодаря генетическому дрейфу или могут быть получены искусственно, используя сайт-направленный или неспецифический мутагенез, или с помощью рекомбинации двух или более предсуществующих вариантов. Такие дополнительные варианты также подходят в связи с описываемыми в настоящем описании PreF (и PreF-G) антигенами. Помимо ранее описанных вариантов нуклеиновых кислот нуклеиновые кислоты, которые гибридизуются с одной или несколькими из приводимых в качестве примеров нуклеиновых кислот, представленных SEQ ID NO: 1, 3, 5, 7, 9, 12 и 13, можно использовать для кодирования PreF антигенов. Квалифицированный в данной области техники специалист определит, что помимо обсуждавшегося выше показателя идентичности последовательностей в % другим показателем схожести по последовательностям между нуклеиновыми кислотами является способность к гибридизации. Чем более схожими являются последовательности двух нуклеиновых кислот, тем более жесткими являются условиями, при которых они будут гибридизоваться. Жесткость условий гибридизации зависит от последовательностей и является различной при различных параметрах окружающей среды. Таким образом, условия гибридизации,дающие в результате конкретные степени жесткости, будут меняться в зависимости от природы выбранного способа гибридизации и состава и длины последовательностей гибридизующихся нуклеиновых кислот. Как правило, температура гибридизации и ионная сила (особенно концентрация Na+ и/или Mg) буфера для гибридизации будут определять жесткость гибридизации, хотя время отмывки также оказывает влияние на жесткость. Как правило, жесткие условия выбирают так, чтобы температура была на приблизительно 5-20 С ниже температуры плавления (Tm) для конкретной последовательности при определенных ионной силе и рН. Tm является температурой (при определенной ионной силе и рН), при которой 50% последовательностей-мишеней гибридизуется с полностью соответствующим зондом. Условия для гибридизации нуклеиновых кислот и расчет жесткостей можно найти (см., например, в Sambrookal., Short Protocols in Molecular Biology, 4th ed., John WileySons, Inc., 1999). С целью раскрытия настоящего изобретения жесткие условия охватывают условия, при которых гибридизация будет происходить только, если между гибридизационной молекулой или последовательностью мишени существует менее 25% несоответствий. Для более точного определения жесткие условия можно подразделить на конкретные уровни жесткости. Таким образом, условия умеренной жесткости, как в настоящем описании используются, являются условиями, при которых молекулы с более 25% несоответствий в последовательностях не будут гибридизоваться; условия средней жесткости являются условиями, при которых молекулы с более 15% несоответствий в последовательностях не будут гибридизоваться; и условия высокой жесткости являются условиями, при которых последовательности с более 10% несоответствий не будут гибридизоваться. Условиями очень высокой жесткости являются условия, при которых последовательности с более 6% несоответствий не будут гибридизоваться. Напротив,нуклеиновые кислоты, которые гибридизуются в условиях низкой жесткости, включают нуклеиновые кислоты с гораздо меньшей идентичностью последовательностей или с идентичностью последовательностей в пределах только коротких подпоследовательностей нуклеиновой кислоты. Поэтому будет понятно, что различные варианты нуклеиновых кислот, которые охватываются этим изобретением, способны к гибридизации с по крайней мере одной из SEQ ID NO: 1, 3, 5, 7, 9 и/или 12, по существу, по всей их длине. Способы продуцирования полипептидных антигенов RSV Описываемые в настоящем описании PreF антигены (в том числе PreF-G антигены и также, если применимо, G антигены) продуцируют, используя прочно установившиеся методики для экспрессии и очистки рекомбинантных белков. Методики, надлежащие для того, чтобы служить ориентиром для квалифицированного в данной области техники специалиста, можно найти в следующих ссылочных документах (см. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press,Cold Spring Harbor, NY, 2001; и Ausubel et al., Short Protocols in Molecular Biology, 4th ed., John WileySons, 1992). Дополнительные и конкретные детали предоставлены ниже. Рекомбинантные нуклеиновые кислоты, которые кодируют PreF антигены, вводят в клетки-хозяины с помощью любого из ряда широко известных способов, таких как электропорация, трансфекция с использованием липосом (например, с использованием имеющегося в продаже липосомного реагента для трансфекции, такого как LIPOFECTAMINE 2000 или TRANSFECTIN), преципитация фосфатом кальция, инфекция, трансфекция и подобные, в зависимости от выбора векторов и клеток-хозяинов. Приводимые в качестве примеров нуклеиновые кислоты, которые кодируют PreF антигены (в том числеPreF-G антигены), приведены в SEQ ID NO: 5, 7, 9, 12 и 13. Квалифицированный в данной области техники специалист определит, что SEQ ID NO: 5, 7, 9, 12 и 13 являются иллюстративными и, как предпола- 16021393 гается, не ограничивающими. Например, полинуклеотидные последовательности, кодирующие такие же белки, как и SEQ ID NO: 5, 7 и 9 (например, белки, представленные SEQ ID NO: 6, 8 и 10), но отличающиеся только согласно избыточности генетического кода (например, согласно оптимизации частот использования альтернативных кодонов, как представлено в SEQ ID NO: 12), могут беспрепятственно использоваться вместо приводимых в качестве примеров последовательностей SEQ ID NO: 5, 7 и 9. Подобным образом, могут использоваться полинуклеотидные последовательности, которые включают усиливающие экспрессию элементы, такие как внутренне размещенные интроны (или при добавлении промотора, энхансера, интрона или других подобных элементов), как проиллюстрировано в SEQ ID NO: 13. Специалист со средним уровнем компетентности в данной области техники определит, что также подходят комбинации таких модификаций. Подобным образом, для экспрессии PreF антигенов могут также использоваться гомологичные последовательности, выбираемые из штамма А или В RSV, и/или другие последовательности со значительной идентичностью последовательностей, как обсуждалось выше. Действительно, любой из ранее описанных вариантов нуклеиновых кислот можно соответственно ввести в клетки-хозяины и использовать для продукции PreF антигенов (в том числе PreF-G антигенов) и, если применимо, полипептидов G. Клетки-хозяины, которые включают рекомбинантные нуклеиновые кислоты, кодирующие PreF антигены, являются, следовательно, также отличительным признаком описания этого изобретения. Предпочтительные клетки-хозяины включают прокариотические (т.е. бактериальные) клетки-хозяины, такие как E.coli, а также многочисленные эукариотические клетки-хозяины, включающие клетки грибов (например, дрожжей, таких как Saccharomyces cerevisiae и Picchia pastoris), клетки насекомых, клетки растений и клетки млекопитающих (такие как клетки СНО и HEK293). Рекомбинантные нуклеиновые кислотыPreF антигенов вводят (например, подвергают трансдукции, трансформации или трансфекции) в клеткихозяины, например, посредством вектора, такого как экспрессионный вектор. Как обсуждалось выше,вектором чаще всего является плазмида, но такими векторами может также быть, например, вирусная частица, фаг и т.п. Примеры подходящих для экспрессии хозяинов включают бактериальные клетки, такие как E.coli, Streptomyces и Salmonella typhimurium, клетки грибов, такие как Saccharomyces cerevisiae,Picchia pastoris и Neurospora crassa, клетки насекомых, таких как Drosophila и Spodoptera frugiperda, клетки млекопитающих, такие как клетки 3 Т 3, COS, CHO, BHK, HEK293 или меланомы Bowes, клетки растений, включающие клетки водорослей и т.п. Клетки-хозяины можно культивировать в общепринятых питательных средах, модифицированных соответствующим образом для активации промоторов, отбора трансформантов или амплификации введенных полинуклеотидных последовательностей. Условия культивирования, такие как температура, рН и подобные, являются обычно такими, которые ранее использовались с клеткой-хозяином, выбранной для экспрессии, и будут очевидны специалистам, квалифицированным в данной области техники, и в приведенных в настоящем описании ссылках, включающих (см., например, Freshney (1994) Culture of AnimalCells, a Manual of Basic Technique, third edition, Wiley-Liss, New York и приведенные там ссылки). Продукты экспрессии, соответствующие нуклеиновым кислотам настоящего изобретения, можно также продуцировать в клетках не животных, таких как растения, дрожжи, грибы, бактерии и подобные. ПомимоSambrook, Berger и Ausubel, подробности в отношении культивирования клеток можно найти (см. PayneMedia (1993) CRC Press, Boca Raton, FL). В бактериальных системах ряд экспрессионных векторов можно выбрать в зависимости от предполагаемого для экспрессированного продукта применения. Например, когда большие количества полипептида или его фрагментов необходимы для продукции антител, предпочтительно используют векторы,которые управляют экспрессией на высоком уровне слитых белков, которые легко очищаются. Такие векторы включают, но без ограничения, многофункциональные векторы для клонирования и экспрессии в E.coli, такие как BLUESCRIPT (Stratagene), в которых представляющая интерес кодирующая последовательность, например, описанный выше полинуклеотид настоящего изобретения, может быть лигирована в вектор в рамке считывания с последовательностями для амино-концевого метионина, инициирующего трансляцию, и последующих 7 остатков бета-галактозидазы, продуцируя каталитически активный,слитый с бета-галактозидазой белок; векторы pIN (Van HeekeSchuster (1989) J. Biol. Chem. 264: 55035509), векторы pET (Novagen, Madison WI), в которых амино-концевой метионин лигирован в рамке с гистидиновой меткой, и подобные. Подобным образом, в дрожжах, таких как Saccharomyces cerevisiae, ряд векторов, содержащих конститутивные или индуцибельные промоторы, например, альфа-фактора, алкогольоксиды и PGH, могут использоваться для продукции желаемых продуктов экспрессии (см. Berger, Ausubel и, например, Grantet al. (1987; Methods in Enzymology 153: 516-544. В клетках-хозяинах млекопитающих можно использовать ряд систем экспрессии, включающих и плазмиды, и системы на основе вирусов. Клетку-хозяина необязательно выбирают по ее способности модулировать экспрессию введенных последовательностей или подвергать процессированию экспрессированный белок желательным образом. Такие модификации белка включают, но без ограничения, гликозилирование (а также, например, ацетилирование, карбоксилирование, фосфорилирование, липидизацию и ацетилирование). Посттрансляционное процессирование, например, при котором форма предшественника превращается в результате расщепления (например, под действием протеазы фурина) в зрелую форму белка, необязательно осуществляется в условиях клетки-хозяина. Различные клетки-хозяины, такие как 3 Т 3, COS, CHO, HeLa, BHK,MDCK, 293, WI38 и т.п., имеют специфический клеточный аппарат и характерные механизмы для таких посттрансляционных активностей и могут быть выбраны для обеспечения правильной модификации и процессирования введенного, чужеродного белка. Для длительной продукции с высоким выходом рекомбинантных PreF антигенов, описываемых в настоящем описании, обычно используют устойчивые системы экспрессии. Например, нуклеиновые кислоты, которые стабильно экспрессируют полипептид PreF антигена, вводят в клетку-хозяина, используя экспрессионные векторы, содержащие вирусные начала репликации или эндогенные экспрессионные элементы и ген маркера селекции. После введения вектора клеткам предоставляют возможность расти в течение 1-2 дней в богатых питательных средах до их перевода на селективные среды. Назначением маркера селекции является придание устойчивости к отбору, и его присутствие делает возможным рост и извлечение клеток, которые с успехом экспрессируют введенные последовательности. Например, устойчивые группы или колонии устойчиво трансформированных клеток можно подвергнуть пролиферации,используя методы для культуры тканей, соответствующие типу клеток. Клетки-хозяины, трансформированные нуклеиновой кислотой, кодирующей PreF антиген, необязательно культивируют в условиях, подходящих для экспрессии и извлечения кодируемого белка из клеточной культуры. После трансдукции подходящей линии клеток-хозяинов и роста клеток-хозяинов до соответствующей плотности клеток индуцируют соответствующим образом (например, с помощью температурного сдвига или химической индукции) выбранный промотор, и клетки культивируют в течение дополнительного периода времени. Необязательно среда включает компоненты и/или добавки, которые уменьшают деструкцию экспрессированных белков протеазами. Например, среда, используемая для культивирования клеток для продукции PreF антигена, может включать ингибитор протеаз, такой как хелатообразующий агент или ингибитор в виде небольшой молекулы (например, AZ11557272, AS111793 и т.п.), для уменьшения или исключения нежелательного расщепления клеточными и экстраклеточными (например,матриксными) протеазами. Секретированный полипептидный продукт затем извлекают из культуральной среды. Альтернативно, клетки можно собрать с помощью центрифугирования, разрушить физическим или химическим способом, и результирующий неочищенный экстракт сохранить для дальнейшей очистки. Эукариотические или микробные клетки, используемые для экспрессии белков, можно разрушить с помощью любого общепринятого способа, включающего повторение последовательности замораживание-оттаивание, разрушение ультразвуком, механическое разрушение или использование агентов для лизиса клеток, или других способов, которые хорошо известны квалифицированным в данной области техники специалистам. Экспрессированные PreF антигены можно извлечь и очистить из культур рекомбинантных клеток с помощью любого из ряда способов, широко известных в данной области техники, включающих осаждение сульфатом аммония или этанолом, экстракцию кислотой, фильтрацию, ультрафильтрацию, центрифугирование, анионо- или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, хроматографию на основе гидрофобных взаимодействий, аффинную хроматографию (например, используя любую из систем мечения, отмеченных выше), хроматографию на гидроксилапатите и хроматографию на лектине. Если желательно, можно использовать стадии рефолдинга белка для довершения конфигурации зрелого белка. Наконец, на конечных стадиях очистки можно использовать жидкостную хроматографию высокого разрешения (HPLC). Помимо отмеченных выше ссылок, в данной области техникихорошо известен ряд способов очистки, включающих, например, способы, изложенные в Sandana 1997) Bioseparation of Proteins, Academic Press, Inc.; Bollag et al. (1996) Protein Methods, 2nd Edition, Wiley-Liss, NY; Walker (1996) The Protein Protocols Handbook, Humana Press, NJ, Harris and Angal (1990) Protein PurificationProtocols on CD-ROM, Humana Press, NJ). В некоторых примерах нуклеиновые кислоты вводят в клетки посредством векторов, подходящих для введения и экспрессии в прокариотических клетках, например, клетках E.coli. Например, нуклеиновую кислоту, включающую полинуклеотидную последовательность, кодирующую PreF антиген, можно встроить в любой из ряда имеющихся в продаже или запатентованных векторов, таких как серия экспрессионных векторов рЕТ (например, рЕТ 9b и pET2d). Экспрессию кодирующей последовательности индуцируют с помощью IPTG, что приводит к высоким уровням экспрессии белка. Полинуклеотидная последовательность, кодирующая PreF антиген, транскрибируется под контролем промотора фага Т 7. Также подходят альтернативные векторы, такие как pURV22, которые включают индуцируемый при увеличении температуры промотор лямбда pL. Экспрессионный вектор вводят (например, путем электропорации) в подходящий бактериальный хозяин. Многочисленные подходящие штаммы E.coli имеются в наличии и могут быть выбраны квалифицированным в данной области техники специалистом, например, доказано, что штаммы Rosetta иBL21 (DE3) являются предпочтительными для экспрессии рекомбинантных векторов, содержащих полинуклеотидные последовательности, кодирующие PreF антигены. Чаще полинуклеотиды, кодирующие PreF антигены, встраивают в экспрессионные векторы, которые подходят для введения и экспрессии в эукариотах (например, клетках насекомых или млекопитающих). Предпочтительно такие нуклеиновые кислоты оптимизированы в отношении частот использования кодонов для экспрессии в выбранном векторе/клетке-хозяине (например, проиллюстрированные в SEQID NO: 5, 7, 9 и 12 последовательности оптимизированы в отношении частот использования кодонов для экспрессии в клетках СНО). В одном приводимом в качестве примера варианте осуществления полинуклеотидную последовательность, которая кодирует PreF антиген, встраивают в вектор, такой как вектор рЕЕ 14, разработанный фирмой Lonza Biologicals. Полипептид экспрессируется под контролем конститутивного промотора, такого как непосредственно ранний промотор CMV (цитомегаловируса). Отбор устойчиво трансфецированных клеток, экспрессирующих полипептид, осуществляют на основе способности трансфецированных клеток к росту в отсутствие источника глютамина. Клетки, которые успешно интегрировали рЕЕ 14, способы к росту в отсутствие экзогенного глютамина, поскольку вектор рЕЕ 14 экпрессирует фермент GS (глютаминсинтетазу). Отобранные клетки можно клонально размножить и охарактеризовать на экспрессию желаемого полипептида PreF. В другом примере полинуклеотидную последовательность, которая кодирует PreF антиген, вводят в клетки насекомых, используя систему экспрессионного вектора в виде бакуловируса (BEVS). Рекомбинантный бакуловирус, способный к инфицированию клеток насекомых, можно создать, используя имеющиеся в продаже векторы, наборы и/или системы, такие как система BD BaculoGold от BD BioScience. Вкратце, полинуклеотидную последовательность, кодирующую антиген, встраивают в вектор для трансфекции pAcSG2. Затем клетки-хозяины SF9 (Spodoptera frugiperda) подвергают котрансфекции pAcSG2 химерной плазмидой и BD BaculoGold, содержащей линеаризованную геномную ДНК бакуловируса вируса ядерного подиэдроза Autographa californica (AcNPV). После трансфекции происходит гомологичная рекомбинация между плазмидой pAcSG2 и геном бакуловируса с созданием рекомбинантного вируса. В одном примере PreF антиген экспрессируется под регуляторным контролем промотора полиэдрина(рН). Схожие векторы для трансфекции можно получить, используя другие промоторы, такие как основной (Ва) промотор и промотор р 10. Также можно использовать альтернативные клетки насекомых, такие как SF21, которые являются близкородственными Sf9, и линию клеток High Five, происходящую из совки ни, Trichoplusia ni. После трансфекции и индукции экспрессии (в соответствии с выбранным промотором и/или энхансерами или другими регуляторными элементами) экспрессированные полипептиды извлекают (например, очищают или обогащают) и ренатурируют для обеспечения укладки в антигенно активную конформацию до слияния. Иммуногенные композиции и способы Также предоставляются иммуногенные композиции, включающие любой из описываемых вышеPreF антигенов (такие как те, которые представлены в качестве примеров SEQ ID NO: 6, 8 и 10) и фармацевтически приемлемый носитель или эксципиент. В определенных вариантах осуществления, обычно вариантах осуществления, в которых PreF антиген не включает компонент белка G (например, SEQ ID NO: 6), иммуногенная композиция может включать выделенный, рекомбинантный и/или очищенный белок G. Многочисленные подходящие белки G описаны в данной области техники и включают полноразмерные рекомбинатные белки G и химерные белки, составленные из части белка G (например, аминокислот 128-229 или 130-230) и партнера по слиянию (такого как тиоредоксин) или сигнальной и/или лидерной последовательности, которая облегчает экспрессию и/или очистку. Приводимые в качестве примеров белки G для применения в смеси с PreF антигеном можно найти в WO 2008114149, патенте США 5149650, патенте США 6113911, опубликованной заявке на патент США 20080300382 и патенте США 7368537, все из которых включены в данное описание посредством ссылки. Как указано в отношении химерных PreF-G белков, меньший фрагмент белка G, такой как часть между аминокислотами 149-229 или часть между аминокислотой в приблизительно 128 положении и аминокислотой в приблизительно 229 положении, можно предпочтительно использоваться в условиях смесей, включающих PreF (без G) и G. Как обсуждалось выше, важным соображением является присутствие иммунодоминантных эпитопов, например, включенных в район аминокислот 183-197. Альтернативно, в таких композициях может использоваться полноразмерный белок G. Фармацевтически приемлемые носители и эксципиенты хорошо известны и могут быть выбраны квалифицированными в данной области техники специалистами. Например, носитель или эксципиент может предпочтительно включать буфер. Необязательно носитель или эксципиент также содержит по крайней мере один компонент, который делает растворимость и/или стабильность устойчивой. Примеры солюбилизаторов/стабилизирующих агентов включают детергенты, например, лаурилсаркозин и/или Твин. Альтернативные солюбилизаторы/стабилизирующие агенты включают аргинин и стеклообразующие полиолы (такие как сахароза, трегалоза и подобные). Многочисленные фармацевтически приемлемые носители и/или фармацевтически приемлемые эксципиенты известны в данной области техники и описываются (см., например, в Remington's Pharmaceutical Sciences, by E.W. Martin, Mack Publishing Co.,Easton, PA, 5th Edition (1975. Соответственно, подходящие эксципиенты и носители могут быть выбраны квалифицированными в данной области техники специалистами для получения композиции, подходящей для доставки субъекту с использованием выбранного пути введения. Подходящие эксципиенты включают, без ограничения глицерин, полиэтиленгликоль (PEG), сорбит,трегалозу, N-лауроилсаркозин натрий, L-пролин, не являющийся детергентом сульфобетаин, гуанидина гидрохлорид, мочевину, триметиламиноксид, KCl, родственные соли Са 2+, Mg2+, Mn2+, Zn2+ и других двухвалентных катионов, дитиотрейтол, дитиоэритрол и -меркаптоэтанол. Другие эксципиенты могут быть детергентами (включающими Твин-80, Твин-20, Тритон Х-00, NP-40, эмпиген ВВ, октилглюкозид,лауроилмальтозид, цвиттергент 3-0, цвиттергент 3-2, цвиттергент 3-4, цвиттергент 3-6, CHAPS, натрия дезоксихолат, натрия додецилсульфат, цетилтриметиламмония бромид). Необязательно иммуногенные композиции также включают адъювант. Для иммуногенной композиции, подходящей для введения субъекту с целью вызова защитного иммунного ответа против RSV,адъювант выбирают так, чтобы он вызывал иммунный ответ со сдвигом в направлении Th1-типа. Адъювант обычно выбирают для усиления иммунного ответа со сдвигом в направлении Th1-типа у субъекта или популяции субъектов, которым вводится композиция. Например, когда иммуногенная композиция должна вводиться субъекту конкретной возрастной группы, восприимчивому (или подверженному повышенному риску) к RSV инфекции, адъювант выбирают так, чтобы он был безопасным и эффективным для субъекта или популяции субъектов. Таким образом, при составлении иммуногенной композиции, содержащей PreF антиген RSV, для введения пожилому субъекту (такому как субъект возрастом больше 65 лет) адъювант выбирают так, чтобы он был безопасным и эффективным для пожилых субъектов. Подобным образом, когда иммуногенная композиция, содержащая PreF антиген RSV, предназначена для введения являющемуся новорожденным или младенцем субъекту (такому как субъекты от рождения до возраста двух лет), адъювант выбирают так, чтобы он был безопасным и эффективным для новорожденных или младенцев. Кроме того, адъювант обычно выбирают так, чтобы он усиливал иммунный ответ Th1-типа после введения путем введения, с помощью которого вводится иммуногенная композиция. Например, при составлении иммуногенной композиции, содержащей PreF антиген RSV, для введения в нос предпочтительными сдвигающими в направлении Th1-типа адъювантами являются протеосома и протоллин. Напротив, при составлении иммуногенной композиции для внутримышечного введения предпочтительно выбирают адъюванты, включающие один или несколько из 3D-MPL, сквалена (например, QS21), липосом и/или эмульсий масло-в-воде. Одним адъювантом, подходящим для применении в комбинации с PreF антигенами, является нетоксичное производное бактериального липополисахарида. Примером подходящего нетоксичного производного липида А является монофосфориллипид А или конкретнее 3-деацилированый монофосфориллипид A (3D-MPL). 3D-MPL продается под названием MPL GlaxoSmithKline Biologicals N.A. и упоминается по всему документу как MPL или 3D-MPL (см., например, патенты США 4436727, 4877611, 4866034 и 4912094). 3D-MPL, главным образом, активирует CD4+ Т-клеточную реакцию INF- (Th1)-фенотипа. 3DMPL можно получить в соответствии со способами, описанными в GB222 0211 А. Химически он представляет собой смесь 3-деацилированого монофосфориллипида А с 3-, 4-, 5-или 6-ацилированными цепями. В композициях настоящего изобретения можно использовать 3D-MPL с меньшим размером частицы. 3D-MPL с меньшим размером частицы имеют такой размер частицы, что она может проходить при стерилизации фильтрованием через 0,22-мкм фильтр. Такие препараты описываются в WO 94/21292. Липополисахарид, такой как 3D-MPL, можно использовать в количествах между 1 и 50 мкг в каждой дозе иммуногенной композиции для человека. Такой 3D-MPL можно использовать на уровне, составляющем приблизительно 25 мкг, например, между 20 и 30 мкг, соответственно между 21 и 29 мкг,или между 22 и 28 мкг, или между 23 и 27 мкг, или между 24 и 26 мкг, или 25 мкг. В другом варианте осуществления доза иммуногенной композиции для человека включает 3D-MPL на уровне, составляющем приблизительно 10 мкг, например, между 5 и 15 мкг, соответственно между 6 и 14 мкг, например,между 7 и 13 мкг, или между 8 и 12 мкг, или между 9 и 11 мкг, или 10 мкг. В дальнейшем варианте осуществления доза иммуногенной композиции для человека включает 3D-MPL на уровне, составляющем приблизительно 5 мкг, например, между 1 и 9 мкг, или между 2 и 8 мкг, или соответственно между 3 и 7 мкг, или 4 мкг, или 5 мкг. В других вариантах осуществления липополисахаридом может быть дисахарид(1-6)глюкозамин,описанный в патенте США 6005099 и Европейском патенте 0729473 В 1. Квалифицированный в данной области техники специалист сможет без труда получить различные липополисахариды, такие как 3D-MPL, основываясь на идеях, приведенных в этих ссылках. Тем не менее, каждая из этих ссылок включена в данное описание посредством ссылки. Помимо вышеупомянутых иммуностимулирующих средств (которые схожи по структуре с LPS или MPL или 3D-MPL) подходящими адъювантами также являются ацилированные производные моносахаридов и дисахаридов, которые являются субфрагментом указанной выше структуры MPL. В других вариантах осуществления адъювантом являются синтетические производные липида А, некоторые из которых описываются как агонисты TLR-4 и включают, но без ограничения, ОМ 174 (2-дезокси-6-о-[2-дезокси-2-[(R)-3-додеканоилокситетра-деканоиламино]-4-офосфоноD-глюкопиранозил]-2-[(R)-3-гидрокситетрадеканоиламино]D-глюкопиранозилдигидрогенфосфат) (WO 95/14026); ОМ 294 DP (3S,9R)-3-[(R)-додеканоилокситетрадеканоиламино]-4-оксо-5-аза 9(R)-[(R)-3-гидрокситетрадеканоиламино]декан-1,10-диол,1,10-бис(дигидрогенфосфат) (WO 99/64301 и(WO 01/46127). Другими лигандами TLR-4, которые могут использоваться, являются алкилированные глюкокозаминиды фосфаты (AGP), такие как те, которые описаны в WO 98/50399 или патенте США 6303347(также описываются способы приготовления AGP), соответственно RC527 или RC529 или фармацевтически приемлемые соли AGP, описанные в патенте США 6764840. Некоторые AGP являются агонистами TLR-4, а некоторые - антагонистами TLR4. Полагают, что и те, и другие применимы в качестве адъювантов. Другими подходящими лигандами TLR-4, способными к вызову ответа сигнальной системы черезTLR-4 (Sabroe et al., JI 2003, pl630-5), являются, например, липополисахарид из грамотрицательных бактерий и его производные, или его фрагменты, в частности, нетоксичные производные LPS (такие как 3DMPL). Другими подходящими агонистами TLR являются белок теплового шока (HSP) 10, 60, 65, 70, 75 или 90, поверхностно-активный белок А, олигосахариды в виде гуалуроновой кислоты, фрагменты гепарансульфата, фрагменты фибронектина, пептиды фибриногена и -дефенсин-2, и мурамил-дипептид(MDP). В одном варианте осуществления агонистом TLR является HSP 60, 70 или 90. Другие подходящие лиганды TLR-4 описаны в WO 2003/011223 и в WO 2003/099195, такие как соединение I, соединениеII и соединение III, описанные на с. 4-5 WO 2003/011223 или на с. 3-4 WO 2003/099195, и особенно такие соединения, описанные в WO 2003/011223, как ER803022, ER803058, ER803732, ER804053, ER804057,ER804058, ER804059, ER804442, ER804680 и ER804764. Например, одним подходящим лигандом TLR-4 является ER804057. В качестве адъювантов также применимы дополнительные агонисты TLR. Термин агонист TLR относится к агенту, который способен к вызову ответа сигнальной системы через путь передачи сигналов с участием TLR, или в качестве прямого лиганда, или опосредованно через образование эндогенного или экзогенного лиганда. Такие природные или синтетические агонисты TLR можно использовать в качестве альтернативных или дополнительных адъювантов. Краткий обзор роли TLR в качестве рецепторов адъювантов представлен в KaishoAkira, Biochimica et Biophysica Acta 1589: 1-13, 2002. Эти возможные адъюванты включают, но без ограничения, агонисты TLR2, TLR3, TLR7, TLR8 и TLR9. Соответственно,в одном варианте осуществления адъювант и иммуногенная композиция дополнительно включает адъювант, который выбран из группы, состоящей из агониста TLR-1, агониста TLR-2, агониста TLR-3, агониста TLR-4, агониста TLR-5, агониста TLR-6, агониста TLR-7, агониста TLR-8, агониста TLR-9 или их комбинации. В одном варианте осуществления настоящего изобретения используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-1. Соответственно, когда агонист TLR, способный к вызову ответа сигнальной системы через TLR-1, выбирают из триацилированных липопептидов (LP),фенол-растворимого модулина, LP Mycobacterium tuberculosis, S-(2,3-бис(пальмитоилокси)-(2-RS)пропил)-N-пальмитоил-(R)-Cys-(S)-Ser-(S)-Lys(4)-ОН, тригидрохлорида (Pam3Cys) LP, который воспроизводит ацетилированный амино-конец бактериального липопротеина и LP Osp из Borrelia burgdorferi. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-2. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-2, является один или несколько из липопротеина, пептидогликана,бактериального липопептида из М. tuberculosis, В. burgdorferi или Т. pallidum, пептидогликанов из видов,включающий Staphylococcus aureus, липотейхоевых кислот, маннуроновых кислот, поринов Neisseria,бактериальных пилусов, факторов вирулентности Yersina, вирионов CMV, коревого гемагглютинина и зимозана из дрожжей. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-3. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-3, является двухцепочечная РНК или полиинозиноваяполицитидиловая кислота (поли IC), молекулярный тип нуклеиновых кислот связан с вирусной инфекцией. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-5. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-5, является бактериальный флагеллин. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-6. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-6, является микобактериальный липопротеин, диацилированныйLP и фенол-растворимый модулин. Дополнительные агонисты TLR-6 описаны в WO 2003/043572. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-7. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-7, является одноцепочечная РНК, локсорибин, аналог гуанозина по положениям N7 и С 8 или соединение имидазохинолин или его производное. В одном варианте осуществления агонистом TLR является имиквимод. Дополнительные агонисты TLR-7 описаны в WO 2002/085905. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-8. Соответственно, когда агонистом TLR, способным к вызову ответа сигнальной системы через TLR-8, является одноцепочечная РНК, молекула имидазохинолина с противовирусной активностью, например, резиквимод (R849); резиквимод также может распознаватьсяTLR-7. Другие агонисты TLR-8, которые могут использоваться, включают те, которые описаны в WO 2004/071459. В альтернативном варианте осуществления используют агонист TLR, который способен к вызову ответа сигнальной системы через TLR-9. В одном варианте осуществления агонистом TLR, способным к вызову ответа сигнальной системы через TLR-9, является HSP90. Альтернативно, агонистом TLR, способным к вызову ответа сигнальной системы через TLR-9, является бактериальная или вирусная ДНК,ДНК, содержащая неметилированные нуклеотиды CpG, в частности, случаи последовательностей, известные как CpG-мотивы. CpG-содержащие олигонуклеотиды индуцируют преимущественно ответ Th1 типа. Такие олигонуклеотиды широко известны и описаны, например, в WO 96/02555, WO 99/33488 и патентах США 6008200 и 5856462. Соответственно, когда нуклеотиды CpG являются CpGолигонуклеотидами. Олигонуклеотидами, подходящими для применения в иммуногенных композициях настоящего изобретения, являются CpG-содержащие олигонуклеотиды, необязательно содержащие два или более динуклеотидных CpG мотивов, разделенных по крайней мере тремя, соответственно по крайней мере шестью или более нуклеотидами. CpG-мотив представляет собой нуклеотид цитозин, за которым следует нуклеотид гуанин. CpG-олигонуклеотиды настоящего изобретения обычно представляют собой дезоксинуклеотиды. В конкретном варианте осуществления межнуклеотидной связью в олигонуклеотиде является фосфородитиоат или соответственно фосфоротиоатная связь, хотя в объеме настоящего изобретения находятся фосфодиэфирные и другие межнуклеотидные связи. В объем настоящего изобретения также включены олигонуклеотиды со смешанными межнуклеотидными связями. Способы получения олигонуклеотидов с фосфоротиоатными связями или фосфородитиота описаны в патентах США 5666153,5278302 и WO 95/26204. Другими адъювантами, которые могут использоваться в иммуногенных композициях с PreF антигенами, сами по себе или в комбинации с 3D-MPL или другим адъювантом, описанным в настоящем описании, являются сапонины, такие как QS21. О сапонинах сообщают Lacaille-Dubois M. и Wagner H. (1996. A Review of the biological and pharmacological activities of saponins. Phytomedicine, vol. 2, pp. 363-386). Сапонины являются стероидными или тритерпеновыми гликозидами, широко распространенными в царствах растений и морских животных. Замечено, что сапонины образуют коллоидные растворы в воде, которые пенятся при встряхивании и вызывают преципитацию холестерина. Когда сапонины находятся вблизи клеточных мембран, они создают пороподобные структуры в мембране, которые вызывают разрыв мембраны. Гемолиз эритроцитов является примером этого явления, которое является свойством некоторых, но не всех сапонинов. Сапонины известны в качестве адъювантов в вакцинах для системного введения. Адъювантная и гемолитическая активность отдельных сапонинов была тщательно изучена в данной области техники(Lacaille-Dubois и Wagner, выше). Например, Квил А (Quil А) (полученный из коры дерева Южной Америки Quillaja Saponaria Molina) и его фракции описываются в патенте США 5057540 и в Saponins asB1. Корпускулярные структуры, названные иммуностимулирующими комплексами (ISCOMS), включающие фракции Квил А, являются гемолитическими и использовались при производстве вакцин(Morein, В., ЕР 0109942 B1; WO 96/11711; WO 96/33739). Гемолитические сапонины QS21 и QS17 (очищенные с помощью HPLC фракции Квил А) были описаны как сильные адъюванты при системном введении, и способ их получения описан в патенте США 5057540 и ЕР 0362279 В 1, которые включены в данное описание посредством ссылки. Другие сапонины, которые использовались в исследованиях вакцинации с помощью системного введения, включают те, которые получают из других видов растений,таких как Gypsophila и Saponaria (Bomford et al., Vaccine. 10(9): 572-577, 1992).QS21 представляет собой очищенную с помощью HPLC, нетоксичную фракцию, полученную из коры Quillaja Saponaria Molina. Способ получения QS21 описан в патенте США 5057540. Нереактогенные адъювантные композиции, содержащие QS21, описаны в WO 96/33739. Вышеупомянутые ссылки включены в данное описание посредством ссылки. Указанный иммунологически активный сапонин, такой как QS21, можно использовать в количествах между 1 и 50 мкг в каждой дозе иммуногенной композиции для человека. Преимущественно QS21 используют на уровне, составляющем приблизительно 25 мкг, например, между 20 и 30 мкг, соответственно между 21 и 29 мкг, или между 22 и 28 мкг, или между 23 и 27 мкг, или между 24 и 26 мкг, или 25 мкг. В другом варианте осуществления доза иммуногенной композиции для человека включает QS21 на уровне, составляющем приблизительно 10 мкг, например,между 5 и 15 мкг, соответственно между 6 и 14 мкг, например, между 7 и 13 мкг, или между 8 и 12 мкг,или между 9 и 11 мкг, или 10 мкг. В дальнейшем варианте осуществления доза иммуногенной композиции для человека включает QS21 на уровне, составляющем приблизительно 5 мкг, например, между 1 и 9 мкг, или между 2 и 8 мкг, или соответственно между 3 и 7 мкг, или между 4 и 6 мкг, или 5 мкг. Установлено, что такие композиции, включающие QS21 и холестерин, являются результативными, Th1 стимулирующими адъювантами после составления вместе с антигеном. Таким образом, например, полипептиды PreF можно предпочтительно использовать в иммуногенных композициях с адъювантом, включающим комбинацию QS21 и холестерина. Необязательно адъювант может также включать минеральные соли, такие как соли алюминия или кальция, в частности, алюминия гидроокись, алюминия фосфат и кальция фосфат. Например, адъювант,содержащий 3D-MPL в комбинации с солью алюминия (например, алюминия гидроокисью или квасцами), подходит для включения в состав иммуногенной композиции, содержащей PreF антиген,для введения являющемуся человеком субъекту. Другой класс сдвигающих в направлении Th1-типа адъювантов, подходящих для применения в композициях с PreF антигенами, включает иммуностимулирующие композиции на основе ОМР. Иммуностимулирующие композиции на основе ОМР особенно подходят в качестве адъювантов для введения через слизистую оболочку, например, для интраназального введения. Иммуностимулирующие композиции на основе ОМР являются классом препаратов внешних мембранных белков (ОМР, в том числе некоторых поринов) из грамотрицательных бактерий, таких как, но без ограничения, видов Neisseria (см., например, Lowell et al., J. Exp. Med. 167: 658, 1988; Lowell et al., Science 240: 800, 1988; Lynch et al., Biophys.Kong, page 193, 1997; патент США 5726292, патент США 4707543), которые применимы в качестве носителей или в композициях для иммуногенов, таких как бактериальные или вирусные антигены. Некоторые иммуностимулирующие композиции на основе ОМР называют протеосомами, которые являются гидрофобными и безопасными для применения для человека. Протеосомы обладают способностью к самосборке в везикулярные или подобные везикулам скопления ОМР диаметром от приблизительно 20 нм до приблизительно 800 нм и к нековалентному включению, координированию, связи (например, электростатической или гидрофобной) или иному взаимодействию с белковыми антигенами (Аг), особенно антигенами, имеющими гидрофобную составляющую. Любой способ приготовления, который дает в результате компонент внешних мембранных белков в везикулярной или подобной везикулам форме,включающей многомолекулярные, напоминающие мембрану структуры или жидкие композиции шаровидных ОМР из одного или нескольких ОМР, включен в определение протеосома. Протеосомы можно приготовить, например, как описано в данной области техники (см., например, патент США 5726292 или патент США 5985284). Протеосомы могут также содержать эндогенный липополисахарид или липоолигосахарид (LPS или LOS соответственно), происходящие из бактерий, используемых для получения поринов в качестве ОМР (например, видов Neisseria), которые обычно будут составлять менее 2% общего препарата ОМР. Протеосомы состоят, главным образом, из химически выделенных внешних мембранных белков(ОМР) из Neisseria meningitidis (главным образом, поринов А и В, а также ОМР класса 4), сохраняемых в растворе с помощью детергента (Lowell G.H. Proteosomes for Improved Nasal, Oral, or Injectable Vaccines.Dekker, Inc. 1997; 193-206). Протеосомы можно приготовить с использованием ряда антигенов, таких как очищенные или рекомбинантные белки, происходящие из вирусных источников, в том числе полипептидов PreF, описываемых в настоящем описании, например, с помощью диафильтрации или обычных способов диализа. Постепенное удаление детергента делает возможным образование корпускулярных гидрофобных комплексов диаметром приблизительно 100-200 нм (Lowell G.H. Proteosomes for Improved Nasal, Oral, or Injectable Vaccines. In: Levine M.M., Woodrow G.C., Kaper J.B, Cobon G.S., eds., New Generations Vaccines. New York: Marcel Dekker, Inc. 1997; 193-206). Как используют в настоящем описании, протеосомы:LPS или протоллин относятся к препаратам протеосом, смешанных, например, при экзогенном добавлении, с по крайней мере одним видом липополисахарида для получения композиции OMP-LPS (которая может функционировать в качестве иммуностимулирующей композиции). Таким образом, композиция OMP-LPS может состоять из по крайней мере двух основных компонентов протоллина, которые включают (1) протеосомный препарат внешних мембранных белков (например, проювант), приготовленный из грамотрицательных бактерий, таких какNeisseria meningitidis, и (2) препарат одного или нескольких липосахаридов. Липоолигосахарид может быть эндогенным (например, природно содержащимся вместе с протеосомным препаратом ОМР), может быть смешан или объединен с препаратом ОМР, исходя из экзогенно приготовленных липоолигосахаридов (например, приготовленных из культуры или микроорганизма,отличных от таковых для препарата ОМР), или может быть их комбинацией. Такие экзогенно добавляемые LPS могут происходить из грамотрицательной бактерии, одинаковой с бактерией, их которой получен препарат ОМР, или происходить из отличной грамотрицательной бактерии. Должно быть также понятно, что протоллин необязательно включает липиды, гликолипиды, гликопротеины, небольшие молекулы или подобные, и их комбинации. Протоллин можно приготовить, например, как описано в публикации заявки на патент США 2003/0044425. В композициях с PreF антигенами могут также использоваться комбинации различных адъювантов,таких как те, которые упоминались выше. Например, как уже отмечалось, QS21 можно составить вместе с 3D-MPL. Отношение QS21:3D-MPL будет обычно на уровне от 1:10 до 10:1, например, от 1:5 до 5:1, и часто, по существу, 1:1. Как правило, отношение находится на уровне от 2,5:1 до 1:1 3D-MPL:QS21. Другая комбинированная адъювантная композиция включает 3D-MPL и соль алюминия, такую как алюминия гидроокись. После составления в комбинацию эта комбинация может усиливать антигенспецифический иммунный ответ Th1-типа. В некоторых случаях адъювантная композиция включает эмульсию типа масло-в-воде или минеральные соли, такие как соли кальция или алюминия, например, кальция фосфат, алюминия фосфат или алюминия гидроокись. Один пример эмульсии типа масло-в-воде включает преобразующееся в ходе метаболизма масло,такое как сквален, токол, такой как токоферол, например, альфа-токоферол, и поверхностно-активное вещество, такое как полисорбат 80 или Твин 90, в водном носителе или не содержит какое-либо дополнительное иммуностимулирующее средство (а), в частности, он не содержит нетоксичное производное липида А (такое как 3D-MPL) или сапонин (такой как QS21). Водным носителем может быть, например,забуференный фосфатом физиологический раствор. Кроме того, эмульсия типа масло-в-воде может содержать Спан 85 и/или лецитин и/или трикаприлин. В другом варианте осуществления настоящего изобретения предоставляется вакцинная композиция, включающая антиген или композицию антигенов и адъювантную композицию, включающую эмульсию типа масло-в-воде и необязательно один или несколько дополнительных иммуностимулирующих средств, причем указанная эмульсия типа масло-в-воде включает 0,5-10 мг преобразующегося в ходе метаболизма масла (соответственно сквалена), 0,5-11 мг токола (соответственно токоферола, такого как альфа-токоферол) и 0,4-4 мг эмульгатора. В одном конкретном варианте осуществления адъювантная композиция включает 3D-MLP, приготовленный в форме эмульсии, такой как эмульсия типа масло-в-воде. В некоторых случаях эмульсия имеет маленький размер частиц, составляющий менее 0,2 мкм в диаметре, как описывается в WP 94/21292. Например, частицы 3D-MPL могут быть достаточно маленькими, чтобы проходить при стерилизации фильтрованием через 0,22-мкм мембрану (как описано в Европейском патенте 0689454). Альтернативно, 3D-MPL могут быть приготовлены в липосомной композиции. Необязательно адъювант,содержащий 3D-MPL (или его производное), также включает дополнительный иммуностимулирующий компонент. Например, когда иммуногенную композицию с полипептидным PreF антигеном составляют для введения младенцам, дозу адъюванта устанавливают так, чтобы она была эффективной и относительно нереактогенной для являющегося младенцем субъекта. Как правило, доза адъюванта в композиции для введения младенцу ниже дозы, используемой в композициях, предназначенных для введения взрослому(например, взрослым возрастом 65 лет или старше). Например, количество 3D-MPL обычно находится в диапазоне 1-200 мкг, например, 10-100 мкг или 10-50 мкг в каждой дозе. Доза для младенца обычно находится в нижнем конце этого диапазона, например, составляет от приблизительно 1 мкг до приблизительно 50 мкг, например, от приблизительно 2 мкг, или приблизительно 5 мкг, или приблизительно 10 мкг до приблизительно 25 мкг или до приблизительно 50 мкг. Как правило, если в композиции используется QS21, диапазоны являются аналогичными (и находятся в соответствии с указанными выше отношениями). Для популяций взрослых и пожилых композиции обычно включают больше адъювантного компонента, чем обычно находится в композиции для младенцев. В конкретных композициях, в которых используется эмульсия типа масло-в-воде, такая эмульсия может включать дополнительные компоненты, например, такие как холестерин, сквален, альфа-токоферол и/или детергенты, такие как Твин 80 или Спан 85. В приводимых в качестве примеров композициях такие компоненты обычно присутствуют в следующих количествах: от приблизительно 1 до 50 мг холестерина, от 2 до 10% сквалена, от 2 до 10% альфа-токоферола и от 0,3 до 3% Твин 80. Как правило, отношение сквалена к альфа-токоферолу равно или меньше 1, поскольку это дает более стабильную эмульсию. В некоторых случаях композиция может также содержать стабилизатор. Если присутствуют квасцы, например, в комбинации с 3D-MPL, количе- 24021393 ство обычно находится между приблизительно 100 мкг и 1 мг, например, от приблизительно 100 мкг или приблизительно 200 мкг до приблизительно 750 мкг, например, приблизительно 500 мкг в каждой дозе. Иммуногенная композиция обычно содержит иммунопротективное количество (или его дробную дозу) антигена и может быть приготовлена с помощью общепринятых методов. Приготовление иммуногенных композиций, в том числе композиций для введения являющимся людьми субъектам, в общих чертах описано в Pharmaceutical Biotechnology, vol. 61, Vaccine Design-the subunit and adjuvant approach,edited by Powell and Newman, Plenum Press, 1995, New Trends and Developments in Vaccines, edited by Voller et al., University Park Press, Baltimore, Maryland, U.S.A. 1978. Инкапсуляция в липосомы описана, например, Fullerton в патенте США 4235877. Конъюгирование белков с макромолекулами описано, например, Likhite в патенте США 4372945 и Armor и др. в патенте США 4474757. Как правило, количество белка в каждой дозе иммуногенной композиции выбирают так, чтобы оно было количеством, которое вызывает иммунопротективный ответ без значительных, неблагоприятных побочных эффектов у обычного субъекта. Иммунопротективный в этом контексте не означает обязательно полностью защитный от инфекции; этот термин подразумевает защиту от симптомов или заболевания, особенно тяжелого заболевания, связанного с вирусом. Количество антигена может меняться в зависимости от того, какой конкретный иммуноген используется. Как правило, предполагается, что каждая доза для введения человеку будет включать 1-1000 мкг белка, например, от приблизительно 1 мкг до приблизительно 100 мкг, например, от приблизительно 1 мкг до приблизительно 50 мкг, например, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 40 мкг или приблизительно 50 мкг. Количество, используемое в иммуногенной композиции, выбирают, основываясь на популяции субъектов (например, младенцев или пожилых). Оптимальное количество для конкретной композиции может быть установлено с помощью стандартных исследований, включающих измерение титров антител и других ответных реакций у субъектов. После первоначальной вакцинации субъекты могут получить бустер-инъекцию через приблизительно 4 недели. Следует отметить, что независимо от выбранного адъюванта концентрацию в конечной композиции рассчитывают так, чтобы она была безопасной и эффективной для целевой популяции. Например, иммуногенные композиции для вызова иммунного ответа против RSV у людей предпочтительно вводят младенцам (например, младенцам возрастом от рождения до 1 года, например, между 0 и 6 месяцами, для первоначальной дозы). Иммуногенные композиции для вызова иммунного ответа против RSV также предпочтительно вводят пожилым людям (например, отдельно или в комбинации с антигенами других патогенов, связанных с COPD). Будет понятно, что выбор адъюванта может быть различным для этих различных применений, и квалифицированные в данной области техники специалисты могут эмпирически определить оптимальные для каждой ситуации адъювант и концентрацию. В определенных вариантах осуществления иммуногенные композиции представляют собой вакцины, которые уменьшают или предотвращают инфицирование RSV. В некоторых вариантах осуществления иммуногенные композиции представляют собой вакцины, которые ослабляют или предотвращают патологическую ответную реакцию после инфицирования RSV. Необязательно иммуногенные композиции, содержащие PreF антиген, составляют с по крайней мере одним дополнительным антигеном патологического организма, отличного от RSV. Например, патогенным организмом может быть патоген дыхательных путей (такой как вирус или бактерия, которые вызывают инфекцию дыхательных путей). В определенных случаях иммуногенная композиция содержит антиген, происходящий из патогенного вируса,отличного от RSV, такого как вирус, который вызывает инфекцию дыхательных путей, такую как грипп или парагрипп. В других вариантах осуществления дополнительные антигены выбирают для способствования введению или уменьшения числа иммунизации, требуемого для защиты субъекта от множества инфекционных организмов. Например, антиген может происходить из любого одного или нескольких следующих организмов: вируса гриппа, гепатита В, возбудителя дифтерии, столбняка, коклюша, Haemophilus influenzae, полиовируса, Streptococcus или Pneumococcus, среди прочих. Соответственно, применение PreF антигенов или кодирующих их нуклеиновых кислот для приготовления лекарственного средства для лечения от воздействия или инфицирования RSV (или терапевтически после него или профилактически перед ним) является также отличительным признаком описания этого изобретения. Так же способы вызова иммунного ответа против RSV у субъекта являются отличительным признаком описания этого изобретения. Такие способы включает введение иммунологически эффективного количества композиции, включающей PreF антиген, субъекту, такому как являющийся человеком субъект. Обычно композиция включает адъювант, который вызывает иммунный ответ со сдвигом в направлении Th1-типа. Композицию составляют так, чтобы она вызывала иммунный ответ,специфичный для RSV, без усиления вирусного заболевания после контактирования с RSV. Т.е. композиция приводит к иммунному ответу со сдвигом в направлении Th1-типа, который уменьшает или предотвращает инфицирование RSV и/или ослабляет или предотвращает патологическую ответную реакции после инфицирования RSV. Хотя композицию можно вводить с использованием ряда различных путей,чаще всего иммуногенные композиции доставляют с использованием внутримышечного или интраназального пути введения. Иммуногенная композиция обычно содержит иммунопротективное количество (или его дробную дозу) антигена и может быть приготовлена с помощью общепринятых методов. Приготовление иммуногенных композиций, в том числе композиций для введения являющимся людьми субъектам, в общих чертах описано в Pharmaceutical Biotechnology, vol. 61, Vaccine Design-the subunit and adjuvant approach,edited by Powell and Newman, Plenum Press, 1995, New Trends and Developments in Vaccines, edited by Voller et al., University Park Press, Baltimore, Maryland, U.S.A. 1978. Инкапсуляция в липосомы описана, например, Fullerton в патенте США 4235877. Конъюгирование белков с макромолекулами описано, например, Likhite в патенте США 4372 945 и Armor и др. в патенте США 4474757. Как правило, количество белка в каждой дозе иммуногенной композиции выбирают так, чтобы оно было количеством, которое вызывает иммунопротективный ответ без значительных, неблагоприятных побочных эффектов у обычного субъекта. Иммунопротективный в этом контексте не означает обязательно полностью защитный от инфекции; этот термин подразумевает защиту от симптомов или заболевания, особенно тяжелого заболевания, связанного с вирусом. Количество антигена может меняться в зависимости от того, какой конкретный иммуноген используется. Как правило, предполагается, что каждая доза для введения человеку будет включать 1-1000 мкг белка, например, от приблизительно 1 мкг до приблизительно 100 мкг, например, от приблизительно 1 мкг до приблизительно 50 мкг, например, приблизительно 1 мкг, приблизительно 2 мкг, приблизительно 5 мкг, приблизительно 10 мкг, приблизительно 15 мкг, приблизительно 20 мкг, приблизительно 25 мкг, приблизительно 30 мкг, приблизительно 40 мкг или приблизительно 50 мкг. Количество, используемое в иммуногенной композиции, выбирают, основываясь на популяции субъектов (например, младенцев или пожилых). Оптимальное количество для конкретной композиции может быть установлено с помощью стандартных исследований, включающих измерение титров антител и других ответных реакций у субъектов. После первоначальной вакцинации субъекты могут получить бустер-инъекцию через приблизительно 4-12 недель. Например, при введении иммуногенной композиции, содержащей PreF антиген, являющемуся младенцем субъекту, первоначальная и последующие иммунизации могут осуществляться с совмещением с другими вакцинами, вводимыми во время этого периода времени. Следующие примеры предоставлены для иллюстрации некоторых конкретных отличительных признаков и/или вариантов осуществления. Не следует истолковывать, что эти примеры ограничивают настоящее изобретение описанными конкретными признаками или вариантами осуществления. Примеры Пример 1. Приводимые в качестве примеров PreF антигеныPreF антиген был модифицирован по сравнению с природным белком F RSV для стабилизации белка в его конформации до слияния, основываясь на предсказании того, что иммунный ответ, созданный против конформации белка F до его слияния, будет, возможно, предпочтительно включать антитела, которые могли бы предотвратить связывание, конформационный переход и/или другие события, вовлеченные в слияние с мембранной, увеличивая, тем самым, эффективность защитного ответа. На фиг. 1 А и В схематически иллюстрируются отличительные признаки F0 RSV и приводимых в качестве примеров PreF антигенов. Фиг. 1 А является представлением белка F0 RSV. F0 является пребелком, состоящим из 574 аминокислот. Пребелок F0 подвергается протеолическому расщеплению и гликозилированию после трансляции. Сигнальный пептид, который впоследствии удаляется с помощью сигнальной пептидазы, задает трансляцию пребелка F0 в эндоплазматическом ретикулуме (RE). Возникающий в RE пептид затем N-гликозилируется во множестве сайтов (представленных треугольниками). В результате расщепления F0 фурином образуются F2- и F1-пептидные домены, которые укладываются и собираются вместе в тримеры гетеродимеров F2-F1 (т.е. 3 раза F2-F1). В этом природном состоянии белок F закрепляется в мембране с помощью трансмембранной спирали в С-концевой области. Дополнительные отличительные признаки полипептида F0 включают 15 остатков цистеина, 4 характерных нейтрализующих эпитопа, 2 биспиральных района и мотив липидизации. На фиг. 1 В иллюстрируются отличительные признаки приводимых в качестве примеров PreF антигенов. Для конструирования PreF антигена полипептид F0 был модифицирован для стабилизации конформации белка F до его слияния, сохраняя в связи с этим предоминантные иммуногенные эпитопы белка F, презентируемые вирусом RSV до связывания и слияния с клетками-хозяинами. Следующие стабилизирующие мутации были введены вPreF антиген относительно полипептида F0. Во-первых, стабилизирующий биспиральный домен был размещен на С-конце экстраклеточного домена полипептида F0, заменяя домен закрепления в мембранеF0. Во-вторых, был удален пептид р 27 (находящийся между F2- и F1-доменами в природном белке). Втретьих, были исключены оба мотива для фурина. В альтернативных вариантах осуществления (названных PreFV1 и PreFV2) к С-концевому домену добавлена иммунологически активная часть (например,аминокислоты 149-229) белка G RSV. Пример 2. Продукция и очистка рекомбинанного белка PreF из клеток СНО Рекомбинантная полинуклеотидная последовательность, кодирующая приводимый в качестве примера PreF антиген, была введена в клетки СНО-хозяины для продукции PreF антигена. Транзиторно трансфецированные клетки-хозяины или размноженные устойчивые популяции, включающие введенную полинуклеотидную последовательность, выращивали в питательной среде и в условиях, подходящих для роста в масштабе, подходящем для желаемой цели (например, как в общих чертах описано в Freshney(1994) Culture of Animal Cells, a Manual of Basic Technique, third edition, Wiley-Liss, New York и в приведенных там ссылках). Обычно клетки выращивали в бессывороточной среде во встряхиваемых колбах при 37 С с 5% CO2 и пассировали с интервалами в 2-3 дня, или в биореакторах при 29 С с поддержаниемpO2 на уровне 20%. Для извлечения рекомбинантного PreF антигена культуру клеток подвергали центрифугированию, и супернатант культуры клеток хранили при -80 С до дальнейшего использования. Для дальнейшего анализа двухлитровые аликвоты супернатанта культуры клеток разводили в 2 раза очищенной водой и доводили до рН 9,5 с помощью NaOH. Супернатант загружали со скоростью 14 мл/мин на колонку для ионообменной хроматографии Q Sepharose FF (60 мл, 11,3 см), уравновешенную 20 мМ пиперазином, рН 9,5. После промывки колонки начальным буфером проводили элюцию с использованием 0-0,5 М градиента NaCl в 20 объемах колонки (с размером фракций - 10 мл). Фракции анализировали в геле после электрофореза в SDS-ПААГ с помощью окрашивания серебром и вестерн-блоттинга. Фракции, содержащие значительные количества белка PreF, затем объединяли до дальнейшей обработки. Объединенный смыв стадии Q (130 мл) подвергали обмену буфера на 10 мМ фосфат, рН 7,0, используя лабораторную систему TFF от Millipore с мембранной кассетой Pellicon XL PES Biomax 100 (с номинальным отсечением по молекулярной массе - 10000 Да). Получаемый в результате материал имел рН 7,0 и электропроводность 1,8 мСм/см. 100 мл Этого образца загружали со скоростью 5 мл/мин на 10 мл геля гидроксиапатита типа II (НА TII) (ХК 16, высотой = 5 см), уравновешенного 10 мМ РО 4 (Na) буфером, рН 7,0. После промывки колонки начальным буфером проводили элюцию с использованием 10-200 мМ градиента PO4 (Na) в 20 объемах колонки. Фракции снова анализировали с помощью электрофореза в SDS-ПААГ с окрашиванием серебром и кумасси синим, и положительные фракции объединяли. После аффинной хроматографии объединенные фракции концентрировали и подвергали обмену буфера на DPBS (рН 7,4), используя концентрационную единицу Vivaspin 20, с номинальным отсечением по молекулярной массе - 10000 Да. Объем конечного продукта составлял приблизительно 13 мл. Концентрация белка составляла 195 мкг/мл, по оценке с помощью способа Лоури. Чистота составляла более 95%. Этот препарат очищенного PreF антигена стерилизовали фильтрованием и хранили при -20 С до использования. Пример 3. Характеристика рекомбинанного белка PreF, продуцированного в клетках СНО Рекомбинантный белок PreF, продуцированный в клетках СНО, характеризовали с помощью фракционирования потоков асимметричных полей (AFF-MALS) и сравнивали с химерным антигеном, включающим компоненты белков F и G RSV. AFF-MALS позволяет разделить ряд белков в соответствии с их молекулярными массами в жидком потоке с минимальным взаимодействием с матрицей и в дальнейшем проанализировать с помощью рассеяния света под множеством углов для точного определения молекулярных масс. На фиг. 2 А демонстрируется, что более 65% очищенного материала FS, как установлено,является высокомолекулярными олигомерами (1000-100000 кДа) в конечном буфере PBS, в то время как 3% остается в мономерной форме. На фиг. 2 В демонстрируется, что очищенный белок PreF уложен в свою трехмерную форму в доле,составляющей 73%, в буфере PBS. Установлено, что 10% материала является олигомерами с М.м. 100020000 кДа. Эти результаты означают, что рекомбинантный белок PreF, экспрессированный в клетках СНО, уложен в тример, предсказанный для природного состояния. Очищенный белок PreF также подвергли сшиванию с помощью глутаральдегида с двойной целью подтверждения растворимой природы белка в фосфатном буферном растворе и создания агрегатов для сравнительной in vivo оценки с белком FG (см. пример 7 ниже). Сшивание с помощью глутаральдегида,как известно, обеспечивает достаточно хорошее определение четвертичной структуры белка и описывается в Biochemistry, 36: 10230-10239 (1997); Eur. J. Biochem. 271: 4284-4292 (2004. Белок инкубировали с 1, 2 и 5% сшивающего агента глутаральдегида в течение 4 ч при 4 С, и реакцию блокировали добавлением NaBH4. Избыточный глутаральдегид удаляли с помощью обессоливания на колонке в буфере PBS. Получаемый в результате белок количественно определяли по оптической плотности при 280 нм и оценивали с помощью электрофореза в SDS-ПААГ в денатурирующих и не денатурирующих условиях. Определено, что большая часть очищенного рекомбинантного белка PreF мигрирует как триммер в растворе PBS. Увеличение температуры инкубации до 23 С требовалось для превращения большей части трехмерных белков в высокомолекулярные агрегаты, что подтверждено с помощью электрофореза в SDS-ПААГ. Пример 4. In vitro подавление PreF антигеном нейтрализующей активности Полученные от добровольцев-людей сыворотки скринировали на реакционную способность против штамма A RSV с помощью ELISA и использовали в анализе подавления нейтрализующей активности(NI) при соответствующем разведении, основанном на предварительном титровании способности к нейтрализации RSV, устанавливаемой для каждого образца сыворотки. Вкратце, сыворотку смешивали с белками-ингибиторами (PreF или контрольным белком, соответствующим, по существу, химерному FC,- 27021393 описанному в патенте США 5194595, названному RixFG) в концентрации 25 мкг/мл в DMEM с 50% среды 199-Н с 0,5% FBS, 2 мМ глютамина, 50 мкг/мл генамицина (все от Invitrogen) и инкубировали в течение 1,5-2 ч при 37 С на вращающемся механизме. 20 мкл Серийных разведений сывороток и белков смешивали в планшете с 96 круглодоными лунками со штаммом А RSV, подвергнутом титрованию для оптимизации диапазона подавления для каждого образца сыворотки. Получаемые в результате смеси инкубировали в течение 20 мин при 33 С при 5% СО 2 для поддержания рН. Смеси сыворотка-ингибитор-вирус затем помещали в предварительно засеянные клетками Vero планшеты с 96 плоскодонными лунками и инкубировали в течение 2 ч при 33 С перед добавлением 160 мкл питательной среды. Планшеты далее инкубировали в течение 5-6 дней при 33 С с 5% СО 2 до иммунофлуоресцентного анализа для определения титра NI. После фиксации в течение 1 ч с использованием 1% параформальдегида в забуференном фосфатом физиологическом растворе (PBS) планшеты блокировали с использованием буфера для блокирования - 2% молока/PBS. Козье антитело против RSV (Biodesign Internation; 1:400) добавляли в каждую лунку без промывки и инкубировали в течение 2 ч при комнатной температуре. Образцы разводили в 2 раза PBS и в лунки добавляли конъюгированное с FITS антитело против IgG козы (Sigma, 1:400) в буфере для блокирования. Планшеты снова инкубировали в течение 2 ч при комнатной температуре и промывали дважды, как указано выше, перед считыванием. Лунка считалась положительной, когда определялось 1 флуоресцентного синцития. Расчеты дозы заражения 50% культуры тканей (TCID50) проводили, используя способ Спирмана-Карбера (SK), и процентыNI рассчитали следующим образом: [ (Титр NI при 0 мкг/мл ингибитора - Титр NI при 25 мкг/мл ингибитора)/Титр NI при 0 мкг/мл]100. Приводимые в качестве примеров результаты, продемонстрированные на фиг. 3, означают, что PreF лучше FG по NI у 16/21 проверенных доноров. Пример 5. PreF антиген является иммуногенным Для демонстрации иммуногенности PreF антигена мышей иммунизировали внутримышечно дважды с двухнедельным интервалом PreF (6,5, 3,1, 0,63, 0,13 и 0,025 мкг/мл) и Th1-стимулирующим адъювантом, содержащим 3D MPL и QS21, из расчета 1/20 от дозы для человека (AS01E), или PreF (1, 0,2 и 0,04 мкг/мл) и Th1-стимулирующим адъювантом, содержащим 3D MPL и квасцы, из расчета 1/10 от дозы для человека (AS04C), и сыворотку собирали спустя три недели. Титры антигенспецифических антител IgG определяли в образцах объединенных сывороток с помощью ELISA в соответствии со стандартными методиками. Коротко, 96-луночные планшеты покрывали очищенным, инактивированным штаммов A RSV, штаммом В RSV и гомологичным белком PreF и инкубировали в течение ночи при 4 С. Образцы сыворотки серийно разводили в буфере для блокирования, начиная с исходной концентрации 1:50, вместе с очищенными мышиными IgG (Sigma, ON) в начальной концентрации 200 нг/мл, и инкубировали в течение 2 ч при комнатной температуре. Связанное антитело выявляли с использованием конъюгированных с пероксидазой хрена (HRP) антител против Ig мыши (Sigma, ON). В качестве субстрата для HRP использовали 3,3 А,5,5 А-тетраметилбензидин (ТМВ,BD Opt EIATM, BD Biosciences, ON). 50 мкл 1 М H2SO4 Добавляли в каждую лунку для остановки реакции. Значения оптических плотностей для каждой лунки определяли при 450 нм с использованием считывающего устройства для микропланшетов Molecular Devices (Molecular Devices, США). Репрезентативные результаты, детализированные на фиг. 4 А и 4 В, показывают, что высокие титры были индуцированы против как штамма A RSV, так штамма В RSV после иммунизации PreF антигеном. Пример 6. PreF индуцирует нейтрализующие антитела Наличие и количество нейтрализующих антител определяли в образцах сывороток мышей, иммунизированных, как описано выше в примере 5. Объединенные сыворотки от иммунизированных животных серийно разводили, начиная с начального разведения 1:8, в среде для RSV в 96-луночных планшетах (20 мкл/лунку). Контрольные лунки содержали только среду для RSV или козье антитело против RSV в разведении 1:50 (Biodesign International). В лунки добавляли 500-1000 инфекционных доз репрезентативного штамма А или В RSV и планшеты инкубировали в течение 20 мин при 33 С, 5% СО 2, прежде чем смесь переносили в планшеты с 96 плоскодонными лунками, предварительно засеянными клетками Vero 1105 клеток/мл. Клетки инкубировали в течение приблизительно 2 ч при 33 С, 5% СО 2 и повторно обеспечивались питательной средой перед инкубацией в течение 5-6 дней при той же температуре. Супернатанты удаляли, планшеты промывали PBS и прикрепившиеся клетки фиксировали с использованием 1% параформальдегида в PBS в течение 1 ч с последующим непрямым иммунофлуоресцентным анализом (IFA), используя первые антитела в виде козьих антител против RSV и конъюгированные с FITC антитела против IgG козы для выявления. Репрезентативные результаты, детализированные на фиг. 5 А и 5 В соответственно, показывают, что значительное количество нейтрализующих антител против обоих штаммов RSV выявляется в сыворотках животных, иммунизированных PreF. Пример 7. PreF защищает от заражения RSV Мышей иммунизировали дважды внутримышечно с двухнедельным интервалом, как описано выше,и заражали спустя три недели от второй инъекции штаммом A RSV. Защиту против RSV оценивали с помощью измерения вируса, присутствующего в легких после заражения. Вкратце, легкие иммунизированных животных асептически извлекали после эвтаназии и промывали в среде для RSV, используя 2 объема 10 мл/легкое в 15-мл пробирках. Легкие затем взвешивали и гомогенизировали по отдельности в среде для RSV с использованием автоматического гомогенизатора Potter (Fisher, Nepean ON) и центрифугировали при 2655g в течение 2 мин при 4 С. Присутствующий в супернатантах вирус подвергали титрованию с помощью серийного разведения (восемь двойных разведений, начиная с 1:10) на монослое предварительно засеянных клеток Vero (ATCCCCL-81) в 96-луночных планшетах и инкубировали в течение 6 дней. RSV выявляли с помощью непрямого IFA после фиксации в 1% параформальдегида/PBS,рН 7,2, используя первое антитело в виде козьих антител против RSV и второе антитело в виде меченныхFITS антител против IgG козы. Репрезентативные результаты, продемонстрированные на фиг. 6 А и 6 В, показывают, что дозы, равные или превышающие 0,04 мкг, после введения в присутствии адъюванта индуцируют сильную защиту от RSV. Пример 8. PreF не индуцирует привлечение эозинофилов в легкие после заражения Для оценки способности PreF антигена вызывать ухудшение болезни после иммунизации и последующего заражения группы мышей (5 мышей/группу) иммунизировали дважды каждую (а) 10 мкг обработанного глутаральдегидом PreF, (b) 10 мкг PreF или (с) 10 мкг FG без адъюванта. Мышей заражали штаммом A RSV спустя 3 недели после бустер-иммунизации, и бронхоальвеолярный лаваж (BAL) проводили спустя 4 дня после заражения. Для каждой мыши были осуществлены подсчеты инфильтратов всех лейкоцитов при BAL, а также дифференциальные подсчеты (300 клеток) на основе морфологии клеток: макрофагов/моноцитов, нейтрофилов, эозинофилов и лимфоцитов. Числа всех клеток умножали на различные проценты эозинофилов для каждого животного. Представлены средние геометрические для группы с 95% доверительными интервалами. Репрезентативные результаты, продемонстрированные на фиг. 7, показывают, что эозинофилы не привлекаются в легкие после иммунизации PreF и заражения. Более того, эти результаты говорят о том, что растворимая природа PreF антигена, по сравнению с преднамеренно агрегированной формой PreF (в результате обработки глутаральдегидом) или FG антигена (природно-агрегированного), не является предпочтительной для эозинофилов.
МПК / Метки
МПК: A61K 39/155, A61K 39/00, A61K 9/127, C07K 19/00, C07K 14/135, C12N 15/45, A61K 9/107, C12N 15/62, A61P 37/04, A61P 31/14, A61K 39/295
Метки: рекомбинантные, антигены
Код ссылки
<a href="https://eas.patents.su/30-21393-rekombinantnye-antigeny-rsv.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантные антигены rsv</a>
Предыдущий патент: Бездымный табачный продукт
Следующий патент: Стекло
Случайный патент: Жидкие фармацевтические композиции фолликулостимулирующего гормона ( фсг ) и лютеинизирующего гормона (лг), содержащие неионогенное поверхностно-активное вещество












