Производное инденона и содержащая его фармацевтическая композиция
Номер патента: 21353
Опубликовано: 29.05.2015
Авторы: Хванг Еун Соок, Хео Дзунг Ниоунг, Йоо Сунг Еун, Бае Миунг-Ае, Чанг Сунг Иоун, Канг Нам Соок, Ким Нак Дзеонг
Формула / Реферат
1. Производное инденона формулы (1) или его фармацевтически приемлемая соль
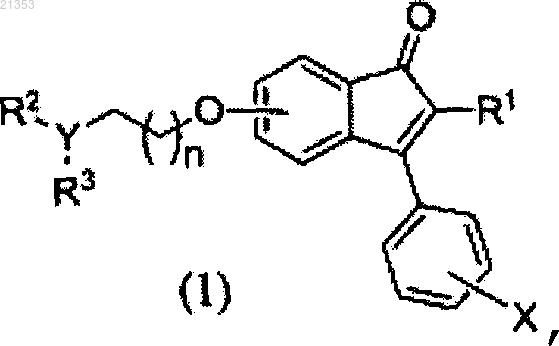
где n равно 0, 1 или 2;
X представляет собой один или несколько заместителей, введенных в орто-, мета- или пара-положение фенильной группы, причем каждый независимо выбран из группы, состоящей из водорода, галогена, -CN,
-CF3, С1-6алкила, С1-6алкокси, С3-10циклоалкила и С3-8циклоалкокси;
R1 представляет собой С6-10арил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, оксогруппы, -CF3, -CN, амино, гидрокси, карбокси, карбамоила, нитро, тиола, С1-6алкила, С2-6алкенила, С1-6алкокси, С3-10циклоалкила, С3-8циклоалкокси, С6-10арила, С6-10арилокси, С(О)R4, С(О)OR4, -C(O)NR4R5, -S(O)R4, -S(O2)R4, -S(O2)NR4R5, -NR4R5 и -NR4C(O)R5, где каждый R4 и R5 независимо является водородом, C1-6алкилом или С3-10циклоалкилом, или 5-10-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О;
Y представляет собой СН, N, N+(-С1-6алкил) или N+(-O-); и
каждый из R2 и R3 независимо представляет собой водород, С1-6алкил, С1-6алкокси, С6-10арил или 5-10-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, или они конденсированы вместе с Y с образованием С3-10циклоалкила или 5-10-членного гетероциклоалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О,
в котором каждый из С6-10арила из R2 и R3, 5-10-членного гетероарила, С3-10циклоалкила и 5-10-членного гетероциклоалкила независимо и необязательно замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, оксо, -CF3, -CN, амино, гидрокси, карбокси, карбамоила, нитро, тиола, С1-6алкила, С2-6алкенила, С1-6алкокси, С3-10циклоалкила, С3-8циклоалкокси, С6-10арила, С6-10арилокси, -C(O)R4,
-С(O)OR4, C(O)NR4R5, -S(O)R4, -S(O2)R4, -S(O2)NR4R5, -NR4R5 и -NR4C(O)R5, каждый из R4 и R5 независимо представляет собой водород, C1-6алкил или С3-10циклоалкил.
2. Соединение по п.1, где R1 представляет собой фенил, замещенный по меньшей мере одним заместителем, выбранным из галогена и С1-6алкокси, или 6-10-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, который не замещен или замещен по меньшей мере одним заместителем, выбранным из галогена и С1-6алкокси.
3. Соединение по п.2, где R1 представляет собой фенил, замещенный по меньшей мере одним заместителем, выбранным из фтора и метокси; или пиридил, пиримидил, хинолил или изохинолил, каждый из которых не замещен или замещен по меньшей мере одним заместителем, выбранным из фтора и метокси.
4. Соединение по п.1, где R2 и R3 конденсированы вместе с Y с образованием 5-10-членного гетероциклоалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, которая не замещена или замещена -S(O2)R4, причем R4 представляет собой С1-6алкил.
5. Соединение по п.4, где R2 и R3 конденсированы вместе с Y с образованием морфолинила;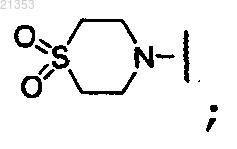 или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3.
или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3.
6. Соединение по п.1, где X представляет собой один или несколько заместителей, введенных в орто-, мета- или пара-положение фенильной группы, причем каждый независимо выбран из водорода и галогена.
7. Соединение по п.6, где X представляет собой водород, 2,4-дифтор или 3,5-дифтор.
8. Соединение по п.1, где n равно 1 или 2.
9. Соединение по п.1, где Y представляет собой СН или N.
10. Соединение по п.1, которое представляет собой производное инденона формулы (1а), или его фармацевтически приемлемая соль
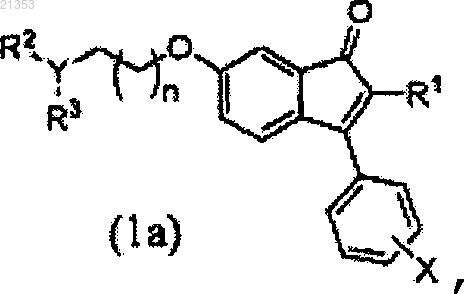
где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные по п.1.
11. Соединение по п.10, где R1 представляет собой фенил, замещенный по меньшей мере одним заместителем, выбранным из галогена и С1-6алкокси, или 6-10-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, который не замещен или замещен по меньшей мере одним заместителем, выбранным из галогена и С1-6алкокси.
12. Соединение по п.11, где R1 представляет собой фенил, замещенный по меньшей мере одним заместителем, выбранным из фтора и метокси; или пиридил, пиримидил, хинолил или изохинолил, каждый из которых не замещен или замещен по меньшей мере одним заместителем, выбранным из фтора и метокси.
13. Соединение по п.11, где R2 и R3 конденсированы вместе с Y с образованием 5-10-членного гетероциклоалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, который не замещен или замещен -S(O2)R4, причем R4 представляет собой С1-6алкил.
14. Соединение по п.13, где R2 и R3 конденсированы вместе с Y с образованием морфолинила;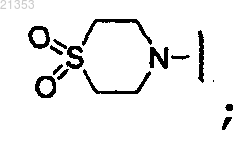 или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3.
или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3.
15. Соединение по п.11, где X представляет собой один или несколько заместителей, введенных в орто-, мета- или пара-положение фенильной группы, причем каждый независимо выбран из водорода и галогена.
16. Соединение по п.15, где X представляет собой водород, 2,4-дифтор или 3,5-дифтор.
17. Соединение по п.1, которое представляет собой производное инденона, выбранное из перечисленных соединений, или его фармацевтически приемлемая соль:
1) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
2) 6-(2-морфолиноэтокси)-2-(3-фтор-4-метоксифенил)-3-фенил-1Н-инден-1-он;
3) 6-(2-морфолиноэтокси)-3-фенил-2-(хинолин-3-ил)-1Н-инден-1-он;
4) 4-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1Н-инден-2-ил)бензамид;
5) 3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1Н-инден-2-ил)бензонитрил;
6) 6-(2-морфолиноэтокси)-2-(6-метоксипиридин-3-ил)-3-фенил-1Н-инден-1-он;
7) 6-(2-морфолиноэтокси)-3-фенил-2-(пиримидин-5-ил)-1Н-инден-1-он;
8) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-4-ил)-1Н-инден-1-он;
9) 6-(2-морфолиноэтокси)-2-(6-фторпиридин-3-ил)-3-фенил-1Н-инден-1-он;
10) 6-(2-морфолиноэтокси)-2-(4-(фенил)фенил)-3-фенил-1Н-инден-1-он;
11) 6-(2-морфолиноэтокси)-3-фенил-2-пара-толил-1Н-инден-1-он;
12) 2-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1Н-инден-2-ил)бензонитрил;
13) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-фенил-1Н-инден-1-он;
14) N-(3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1Н-инден-2-ил)фенил)ацетамид;
15) 6-(2-морфолиноэтокси)-2-(изохинолин-4-ил)-3-фенил-1Н-инден-1-он;
17) 6-(2-морфолиноэтокси)-2-(4-фторфенил)-3-фенил-1Н-инден-1-он;
18) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-фенил-1Н-инден-1-он;
19) 6-(2-морфолиноэтокси)-2-(3-фтор-4-метилфенил)-3-фенил-1Н-инден-1-он;
20) 6-(2-морфолиноэтокси)-2-(3-аминофенил)-3-фенил-1Н-инден-1-он;
21) 6-(2-морфолиноэтокси)-2-(4-феноксифенил)-3-фенил-1Н-инден-1-он;
22) 6-(2-морфолиноэтокси)-2-(4-метоксифенил)-3-фенил-1Н-инден-1-он;
23) 6-(2-морфолиноэтокси)-2-(4-хлорфенил)-3-фенил-1Н-инден-1-он;
24) 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
25) 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиримидин-5-ил)-1Н-инден-1-он;
26) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(4-фторфенил)-1Н-инден-1-он;
27) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(4-фторфенил)-1Н-инден-1-он;
28) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
29) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(3,4-дифторфенил)-1Н-инден-1-он;
30) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиримидин-5-ил)-1Н-инден-1-он;
31) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(4-(трифторметил)фенил)-1Н-инден-1-он;
32) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
33) 6-(2-морфолиноэтокси)-2,3-бис(4-(трифторметил)фенил)-1Н-инден-1-он;
34) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(3,4-дифторфенил)-1Н-инден-1-он;
35) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиримидин-5-ил)-1Н-инден-1-он;
36) 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
37) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(3,5-дифторфенил)-1Н-инден-1-он;
38) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-1Н-инден-1-он;
39) 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиримидин-5-ил)-1Н-инден-1-он;
40) 4-метил-4-(2-{[2-(1-метилпиридин-1-иний-3-ил)-1-оксо-3-фенил-1Н-инден-6-ил]окси}этил)морфолин-4-ия дийодид;
41) 1-метил-3-{6-[2-(морфолин-4-ил)этокси]-1-оксо-3-фенил-1Н-инден-2-ил}пиридин-1-ия йодид;
42) 4-оксидо-4-(2-{[1-оксо-3-фенил-2-(пиридин-3-ил)-1Н-инден-6-ил]окси}этил)морфолин-4-ий;
43) 4-оксидо-4-(2-{[2-(1-оксидопиридин-1-иний-3-ил)-1-оксо-3-фенил-1Н-инден-6-ил]окси}этил)морфолин-4-ий;
44) трет-бутил-4-(2-(1-оксо-3-фенил-2-(пиридин-3-ил)-1Н-инден-6-илокси)этил)пиперазин-1-карбоксилат;
45) 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
46) 6-(2-(пиперазин-1-ил)этокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
47) 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2,3-бис[4-(трифторметил)фенил]-1Н-инден-1-он;
48) 2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-3-(4-(трифторметил)фенил)-1Н-инден-1-он;
49) 6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-3-(4-(трифторметил)фенил)-1Н-инден-1-он;
50) 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(4-(трифторметил)фенил)-1Н-инден-1-он;
51) 2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1Н-инден-1-он;
52) 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-1Н-инден-1-он;
53) 3-(4-хлорфенил)-2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1Н-инден-1-он;
54) 3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-1Н-инден-1-он;
55) трет-бутил-4-(3-(1-оксо-3-фенил-2-(пиридин-3-ил)-1Н-инден-6-илокси)пропил)пиперазин-1-карбоксилат;
56) 6-(2-(диметиламино)этокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
57) 6-(3-(диметиламино)пропокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
58) трет-бутил-4-(2-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1Н-инден-6-илокси)этил)пиперазин-1-карбоксилат;
59) 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
60) 3-(3,5-дифторфенил)-6-(3-(диметиламино)пропокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
61) 3-(3,5-дифторфенил)-6-фенэтокси-2-(пиридин-3-ил)-1Н-инден-1-он;
62) 3-(3,5-дифторфенил)-6-(2-(пиридин-2-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
63) 3-(3,5-дифторфенил)-6-(2-(пиперидин-1-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
64) трет-бутил-4-(3-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1Н-инден-6-илокси)пропил)пиперазин-1-карбоксилат;
65) 6-(3-(4-метилпиперазин-1-ил)пропокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
66) 6-(3-(пиперазин-1-ил)пропокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
67) 6-(3-(4-ацетилпиперазин-1-ил)пропокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
68) 3-(3,5-дифторфенил)-6-(3-(4-(метилсульфонил)пиперазин-1-ил)пропокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
69) трет-бутил-4-(2-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1Н-инден-6-илокси)этил)пиперидин-1-карбоксилат;
70) 3-(3,5-дифторфенил)-6-(2-(пиперидин-4-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
71) 3-(3,5-дифторфенил)-6-(2-(1-метилпиперидин-4-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
72) 6-(2-(1-ацетилпиперидин-4-ил)этокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
73) 3-(3,5-дифторфенил)-6-(2-(1-(метилсульфонил)пиперидин-4-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
74) 6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
75) 3-(3,5-дифторфенил)-6-(изопентилокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
76) 6-(2-циклогексилэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
77) 6-(2-циклопентилэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
78) 3-(3,5-дифторфенил)-2-(пиридин-3-ил)-6-(2-(тетрагидро-2Н-пиран-4-ил)этокси)-1Н-инден-1-он;
79) 3-(3,5-дифторфенил)-2-(пиридин-3-ил)-6-((тетрагидрофуран-2-ил)метокси)-1Н-инден-1-он;
80) 6-(2-морфолиноэтокси)-3-(2-фторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
81) 6-(2-морфолиноэтокси)-3-(3-фторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
82) 6-(2-морфолиноэтокси)-3-(2,4-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
83) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-2-ил)-1Н-инден-1-он;
84) 2-(бензо[b]тиофен-3-ил)-6-(2-морфолиноэтокси)-3-фенил-1Н-инден-1-он;
85) 2-(бензо[1,3]диоксол-5-ил)-6-(2-морфолиноэтокси)-3-фенил-1Н-инден-1-он;
86) 2-(5-хлортиофен-2-ил)-6-(2-морфолиноэтокси)-3-фенил-1Н-инден-1-он;
87) 2-(1-метил-1Н-индол-5-ил)-6-(2-морфолиноэтокси)-3-фенил-1Н-инден-1-он;
88) 2-(1Н-индол-2-ил)-6-(2-морфолиноэтокси)-3-фенил-1Н-инден-1-он;
89) 6-(2-морфолиноэтокси)-2-(6-(морфолин-4-ил)пиридин-3-ил)-3-фенил-1Н-инден-1-он;
90) 6-(2-морфолиноэтокси)-3-фенил-2-(1Н-пиррол-2-ил)-1Н-инден-1-он;
91) 6-(2-морфолиноэтокси)-2-(бензофуран-2-ил)-3-фенил-1Н-инден-1-он;
92) 3-(3,5-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-2-(хинолин-3-ил)-1Н-инден-1-он;
93) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он;
94) 3-(3,5-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-2-пара-толил-1Н-инден-1-он;
95) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он;
96) 3-(3,5-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
97) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-1Н-инден-1-он;
98) 3-(3,5-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-2-пара-толил-1Н-инден-1-он;
99) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-1Н-инден-1-он;
100) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он;
101) 3-(3,5-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
102) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он;
103) 3-(3,5-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-2-пара-толил-1Н-инден-1-он;
104) 3-(3,5-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
105) 3-(3,5-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-2-пара-толил-1Н-инден-1-он;
106) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-1Н-инден-1-он;
107) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-1Н-инден-1-он;
108) 3-(2,4-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-2-пара-толил-1Н-инден-1-он;
109) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-1Н-инден-1-он;
110) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-1Н-инден-1-он;
111) 3-(2,4-дифторфенил)-6-{3-[4-(метилсульфонил)пиперазин-1-ил]пропокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
112) 3-(2,4-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-2-пара-толил-1Н-инден-1-он;
113) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он;
114) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он;
115) 3-(2,4-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-2-(хинолин-3-ил)-1Н-инден-1-он;
116) 3-(2,4-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-2-пара-толил-1Н-инден-1-он;
117) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-1Н-инден-1-он;
118) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-1Н-инден-1-он;
119) 3-(2,4-дифторфенил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
120) 3-(2,4-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-2-пара-толил-1Н-инден-1-он;
121) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он;
122) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он;
123) 3-(2,4-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-2-(хинолин-3-ил)-1Н-инден-1-он;
124) 3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил)этокси]-2-пара-толил-1Н-инден-1-он;
125) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(морфолин-4-ил)этокси]-1Н-инден-1-он;
126) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил)этокси]-1Н-инден-1-он;
127) 3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил)этокси]-2-(хинолин-3-ил)-1Н-инден-1-он;
128) 3-(3,5-дифторфенил)-5-[2-(морфолин-4-ил)этокси]-2-(пиридин-3-ил)-1Н-инден-1-он;
129) 5-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
130) 5-(2-морфолиноэтокси)-3-фенил-2-(пиридин-4-ил)-1Н-инден-1-он;
131) 5-(2-морфолиноэтокси)-3-фенил-2-пара-толил-1Н-инден-1-он;
132) 5-(2-морфолиноэтокси)-2-(3-фтор-4-метилфенил)-3-фенил-1Н-инден-1-он;
133) 3-(3,5-дифторфенил)-5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2-(пиридин-3-ил)-1Н-инден-1-он;
134) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
135) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-пара-толил-1Н-инден-1-он и
136) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2-(3-фтор-4-метилфенил)-3-фенил-1Н-инден-1-он.
18. Соединение по п.1, которое представляет собой производное инденона, выбранное из перечисленных соединений, или его фармацевтически приемлемая соль:
1) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
45) 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1Н-инден-1-он;
73) 3-(3,5-дифторфенил)-6-(2-(1-(метилсульфонил)пиперидин-4-ил)этокси)-2-(пиридин-3-ил)-1Н-инден-1-он;
74) 6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
82) 6-(2-морфолиноэтокси)-3-(2,4-дифторфенил)-2-(пиридин-3-ил)-1Н-инден-1-он;
97) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-{2-[4-(метилсульфонил)пиперазин-1-ил]этокси}-1Н-инден-1-он;
102) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он;
113) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он;
114) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-1Н-инден-1-он и
122) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-{2-[1-(метилсульфонил)пиперидин-4-ил]этокси}-1Н-инден-1-он.
19. Фармацевтическая композиция для профилактики или лечения болезней костей, содержащая соединение или соль по любому из пп.1-18 в качестве активного ингредиента.
20. Композиция по п.19, где болезнь костей выбирают из группы, состоящей из остеопороза, нарушения роста кости, переломов кости, периодонтита, болезни Педжета, метастатической карциномы или ревматоидного артрита.
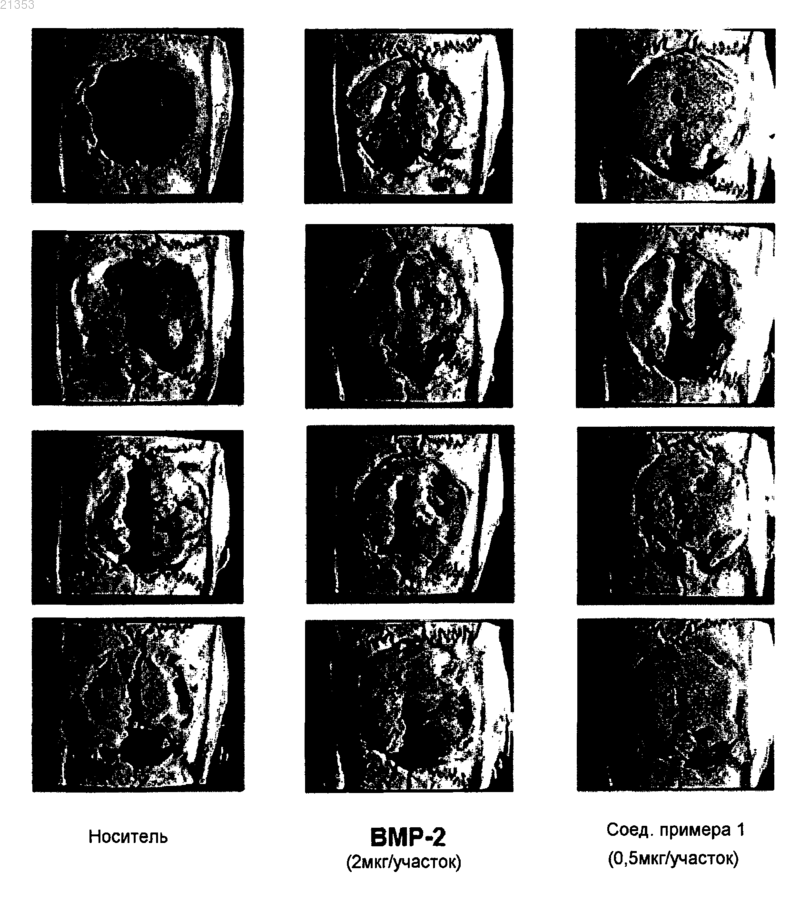
Текст
ПРОИЗВОДНОЕ ИНДЕНОНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Производное инденона формулы (1) Хео Дзунг Ниоунг, Бае Миунг-Ае, Ким Нак Дзеонг, Чанг Сунг Иоун, Канг Нам Соок, Йоо Сунг Еун, Хванг Еун Соок (KR) Медведев В.Н. (RU) обладает эффектами усиления активности остеобластов и ингибирования резорбции кости остеокластами, а фармацевтическая композиция, содержащая производное инденона или его фармацевтически приемлемую соль, применима для профилактики или лечения болезней костей,таких как остеопороз.(71)(73) Заявитель и патентовладелец: КОРЕЯ РИСЕРЧ ИНСТИТЬЮТ ОФ КЕМИКАЛ ТЕКНОЛОДЖИ (KR) Область техники, к которой относится изобретение Настоящее изобретение относится к производному инденона и содержащей его фармацевтической композиции, которая применяется для профилактики или лечения болезней костей, таких как остеопороз. Предпосылки создания изобретения Остеопороз вызывается снижением костной массы, что приводит к ослаблению прочности кости и повышенному риску перелома кости. Костная масса регулируется непрерывными процессами резорбции кости и остеогенеза. Максимальная костная масса у здоровых людей достигается приблизительно к 25 годам и с возрастом медленно снижается. У женщин костная масса обычно ниже, чем у мужчин, и потеря костной массы становится более выраженной после менопаузы. Предполагается, что в США десять миллионов людей страдают от остеопороза, а приблизительно тридцать четыре миллиона человек в мире сталкиваются с проблемой низкой костной массы и подвергаются риску остеопороза. Клинические исследования показали, что коэффициент смертности в пределах двух лет от проявления симптомов остеопороза составляет в настоящее время приблизительно 12%, и многие пациенты с остеопорозом (приблизительно 30%) вынуждены оставаться дома вследствие перелома кости. В последнее время число пациентов с остеопорозом увеличилось вследствие старения мирового населения, и, следовательно, существует потребность в разработке эффективного лекарственного препарата для профилактики и лечения остеопороза. Кость является живой тканью, которая состоит из нескольких различных типов клеток. У здоровых лиц объем кости, удаленной или резорбированной остеокластами, компенсируется новой костью, образованной остеобластами. Для поддержания постоянной костной массы суммарный остеогенез и резорбция кости затрагивают в течение года приблизительно 14% костей, но для лиц, страдающих от заболеваний с резорбцией кости, такое равновесие не может быть достигнуто. У женщин после менопаузы происходит потеря приблизительно 5% в год костной массы позвоночника. Такой симптом объяснялся дефицитом эстрогенов, связанным с менопаузой. Однако вопрос о том, какой механизм взаимосвязывает потерю эстрогенов и повышенную резорбцию кости, остается нерешенным. Для снижения риска перелома кости в настоящее время используются различные способы поддержания или увеличения костной массы путем снижения скорости резорбции кости, увеличения скорости остеосинтеза или их сочетания. В качестве терапевтических средств для блокирования резорбции кости были исследованы антагонисты интегрина v3, ингибиторы катепсина K и ингибиторы системыOPG/PANKL/RANK. Кроме того, в качестве терапевтических средств для усиления остеогенеза сообщалось о структуре паратиреоидных гормонов и их производных. Типичные терапевтические средства включают новые паратиреоидные гормональные продукты, антагонисты чувствительных к кальцию рецепторов, которые регулируют секрецию паратиреоидного гормона, селективные модуляторы андрогенных рецепторов (SARM), стимуляторы секреции гормонов роста, инсулиноподобные ростовые факторы,ингибиторы протеосом и статины. Используемые в настоящее время способы лечения потери костной массы, как правило, включают введение соединений, таких как эстроген, бисфосфонаты, кальцитонин и ралоксифен. Однако указанные соединения применяют, как правило, для длительных курсов лечения, и они вызывают нежелательные побочные эффекты. Кроме того, такие курсы лечения обычно направлены на активность зрелых остеокластов, а не на уменьшение их образования. Например, эстроген индуцирует апоптоз остеокластов, тогда как кальцитонин вызывает сжатие остеокластов и разрыв между ними и поверхностью кости (Hugheset al., Nat. Med. 2:1132-1136, 1996; Jilka et al., Exp. Hematol. 23:500-506, 1995). Подобным образом, бисфосфонаты снижают активность остеокластов, изменяют их морфологию и усиливают апоптоз остеокластов (Parfitt et al., J. Bone Miner Res. 11:150-159, 1996; Suzuki et al., Endocrinology 137:4685-4690, 1996). Доступные в настоящее время терапевтические средства для лечения остеопороза включают бисфосфонаты, гормональные лекарственные средства, витамин D и его аналоги, кальцитонин и кальций. Типичные бисфосфонаты включают алендронат (Merck Co., Ltd.), ризедронат (Hoffman-La Roche Ltd.),золедронат (Novartis AG; европейский патент 275821), ибандронат (Hoffman-La Roche Ltd.; патент США 4942157) и минодронат (Yamanouchi Pharmaceutical Co., Ltd.; европейский патент 354806). Однако бисфосфонаты страдают от проблематично низких значений скорости всасываемости в желудочно-кишечном тракте (10% или меньше) и тенденции к возникновению эзофагита при несоблюдении пациентами сложных правил введения. В частности, сообщалось, что алендронат вызывает некоторые побочные эффекты, например, желудочно-кишечные нарушения и остеонекроз челюсти, наряду с тем, что длительное введение бисфосфонатов приводит к остеонекрозу. Соответственно, необходимы новые терапевтические средства от остеопороза. Типичные гормональные лекарственные средства включают ралоксифен (Eli Lilly Co.), дролоксифен (Pfizer Inc.; европейский патент 54168), ласопоксифен (Pfizer Inc.; международная заявка WO 97/16434), FC-1271 (Homosmedical Co. и Orion Corp.; международная заявка WO 96/07402), TES-424 (Ligand Co. и Weyers Co.; патент США 5948755) и SERM, которые находятся на этапе клинических исследований. Однако эти лекарственные средства несут риск возникновения рака молочной железы или матки, и, следовательно, они не приемлемы для использования в качестве терапевтического средства от остеопороза, который требует продолжительного введения. Кроме того, витамин D и его аналоги являются дорогими, а их терапевтическая эффективность при остеопорозе четко не установлена; кальцитонин является относительно дорогим и требует сложной процедуры введения; а кальций эффективен только для профилактики остеопороза, не обладая терапевтическим эффектом. Краткое описание изобретения Соответственно, целью настоящего изобретения является обеспечение новым производным инденона и содержащей его фармацевтической композицией для эффективной профилактики или лечения болезней костей, таких как остеопороз. В соответствии с одним аспектом настоящее изобретение относится к производному инденона формулы (1) или его фармацевтически приемлемой солиX представляет собой один или несколько заместителей, введенных в орто-, мета- или параположение фенильной группы, причем каждый независимо выбран из группы, состоящей из водорода,галогена, -CN, -CF3, С 1-6 алкила, С 1-6 алкокси, С 3-10 циклоалкила и С 3-8 циклоалкокси;R1 представляет собой С 6-10 арил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, оксогруппы, -CF3, -CN, амино, гидрокси, карбоки, карбамоила, нитро,тиола, С 1-6 алкила, С 2-6 алкенила, С 1-6 алкокси, С 3-10 циклоалкила, С 3-8 циклоалкокси, С 6-10 рила,C6-10 арилокси, С(О)R4, С(О)OR4, -C(O)NR4R5, -S(O)R4, -S(O2)R4, -S(O2)NR4R5, -NR4R5 и -NR4C(O)R5, где каждый R4 и R5 независимо является водородом, C1-6 алкилом или С 3-10 циклоалкилом, или 5-10-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О;Y представляет собой СН, N, N+(-С 1-6 алкил) или N+(-O-); и каждый из R2 и R3 независимо представляет собой водород, C1-6 алкил, С 1-6 алкокси, С 6-10 арил или 510-членный гетероарил, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, или они конденсированы вместе с Y с образованием С 3-10 циклоалкила или 5-10-членного гетероциклоалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О,в котором каждый из С 6-10 арила из R2 и R3, 5-10-членного гетероарила, С 3-10 циклоалкила и 5-10 членного гетероциклоалкила независимо и необязательно замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, оксо, -CF3, -CN, амино, гидрокси, карбокси, карбамоила, нитро, тиола, С 1-6 алкила, С 2-6 алкенила, С 1-6 алкокси, С 3-10 циклоалкила, С 3-8 циклоалкокси, С 64 4 4 5 4 4 4 5 4 5 10 арила, С 6-10 арилокси, -C(O)R , -С(O)OR , C(O)NR R , -S(O)R , -S(O2)R , -S(O2)NR R , -NR R и 4 5 4 5NR C(O)R , каждый из R и R независимо представляет собой водород, С 1-6 алкил или С 3-10 циклоалкил. Производное инденона формулы (1) или его фармацевтически приемлемая соль обладает эффектами усиления активности остеобластов и ингибирования резорбции кости остеокластами, поэтому фармацевтическая композиция по настоящему изобретению применима для профилактики или лечения болезней костей, таких как остеопороз. Краткое описание графических материалов Вышеупомянутые и другие цели и признаки настоящего изобретения станут очевидными из последующего описания настоящего изобретения при рассмотрении в сочетании с сопровождающими графическими материалами, на которых соответственно представлено фиг. 1 - результаты окрашивания TRAP, демонстрирующие эффекты ингибирования производными инденона по настоящему изобретению активности остеокластов; фиг. 2 - микро-КТ изображения, демонстрирующие эффекты производных инденона на остеогенезin vivo; фиг. 3 А - значения плотности кости мышей DDY, измеренные in vivo с использованием микро-КТ системы с высоким разрешением ( Р 0,01 относительно контроля (носитель),Р 0,01 относительно стандарта (имитация операции), n=5) и фиг. 3 В - значения плотности кости крыс SD, измеренные in vivo с использованием микро-КТ системы с высоким разрешением ( Р 0,05 относительно контроля (носитель),Р 0,01 относительно стандарта (имитация операции), n=5). Подробное описание изобретения Настоящее изобретение относится к производному инденона формулы (1) и его фармацевтически приемлемой соли. Фармацевтически приемлемая соль соединения формулы (1) может быть получена с применением любого из традиционных способов, и это может быть соль неорганической кислоты, такой как соляная кислота, бромисто-водородная кислота, серная кислота, гидросульфат натрия, фосфорная кислота, азотная кислота и угольная кислота; соль органической кислоты, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, янтарная кислота, бензойная кислота, лимонная кислота, малеиновая кислота, малоновая кислота, винная кислота, глюконовая кислота, молочная кислота,гентизиновая кислота, фумаровая кислота, лактобионовая кислота, салициловая кислота и ацетилсалициловая кислота (аспирин); соль аминокислоты, такой как глицин, аланин, ванилин, изолейцин, серин, цистеин, цистин, аспарагиновая кислота, глутамин, лизин, аргинин, тирозин и пролин; соль сульфоновой кислоты, такой как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и толуолсульфоновая кислота; соль металла, образованная путем осуществления взаимодействия со щелочным металлом, таким как натрий и калий; или аммониевая соль. Используемый в этом документе термин арил включает ароматическую группу, такую как фенил и замещенный фенил, а также бициклическую ароматическую группу, такую как нафтил и фенантренил. Используемый в этом документе термин циклоалкил относится к циклоалкильной группе, такой как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклогептенил, бицикло[3.2.1]октанил и норборнанил. Используемый в этом документе термин гетероциклоалкил относится к кольцу, содержащему по меньшей мере один гетероатом, выбранный из группы, состоящей из N, S и О, например, пирролидинил,тетрагидрофуранил, дигидрофуранил, тетрагидропиранил, пиранил, тиопиранил, азиридинил, оксиранил,диоксоланил, хроменил, изоксазолидинил, 1,3-оксазолидин-3-ил, изотиазолидинил, 1,3-тиазолидин-3-ил,1,2-пиразолидин-2-ил, 1,3-пиразолидин-1-ил, пиперидинил, тиоморфолинил, 1,2-тетрагидротиазин-2-ил,1,3-тетрагидротиазин-3-ил, тетрагидротиадиазинил, морфолинил, 1,2-тетрагидродиазин-2-ил, 1,3 тетрагидродиазин-1-ил и пиперазинил. Используемый в этом документе термин гетероарил относится к ароматическому кольцу, содержащему по меньшей мере один гетероатом, выбранный из группы, включающей N, S и О, например, фурил, тиенил, тиазолил, пиразолил, изотиазолил, оксазолил, изооксазолил, пирролил, триазолил, тетразолил, имидазолил, 1,3,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-оксадиазолил, 1,3,5-тиадиазолил, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, пиридил, пиримидил, пиразинил, пиридазинил, 1,2,4-триазинил, 1,2,3 триазинил, 1,3,5-триазинил, пиразоло[3,4-b]пиридинил, циннолинил, птеридинил, пуринил, 6,7-дигидро 5 Н-[1]пиридинил, бензо[b]тиофенил, 5,6,7,8-тетрагидрохинолин-3-ил, бензооксазолил, бензо[d][1,3]диоксолил, бензотиазолил, бензизотиазолил, бензизооксазолил, бензимидазолил, тианафтенил, изотианафтенил, бензофуранил, изобензофуранил, изоиндолил, индолил, индолизинил, индазолил, изохинолил, хинолил, фталазинил, хиноксалинил, хиназолинил и бензоксазинил. Арильная, гетероарильная, циклоалкильная или гетероциклоалкильная группы могут быть необязательно замещены по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена,оксо, -CF3, -CN, амино, гидрокси, карбокси, карбамоила, нитро, тиола, С 1-6 алкила, С 2-6 алкенила,С 1-6 алкокси, С 3-10 циклоалкила, С 3-6 циклоалкокси, С 6-20 арила, С 6-20 арилокси, -C(O)R4, -С(О)OR4,-C(O)NR4R5, -S(O)R4, -S(O2)R4, -S(O2)NR4R5, -NR4R5 и -NR4C(O)R5, где каждый из R4 и R5 независимо представляет собой водород, С 1-6 алкил или С 3-8 циклоалкил. В соединении формулы (1) по настоящему изобретению R1 предпочтительно представляет собой С 6 арил или 6-10-членный гетероарил, который не замещен или замещен по меньшей мере одним заместителем, выбранным из галогена и С 1-6 алкокси. Более предпочтительно R1 представляет собой фенил,который замещен по меньшей мере одним заместителем, выбранным из фтора и метокси; или пиридил,пиримидил, хинолил или изохинолил, каждый из которых не замещен или замещен по меньшей мере одним заместителем, выбранным из фтора и метокси. Кроме того, R2 и R3 предпочтительно конденсированы вместе с Y с образованием 5-10-членной гетероциклоалкильной группы, которая не замещена или замещена -S(O2)R4, причем R4 представляет собой С 1-6 алкил. Более предпочтительно R2 и R3 конденсированы вместе с Y с образованием морфолинила; или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3. Кроме того, X представляет собой один или несколько заместителей, введенных в орто-, мета- или параположение фенильной группы, причем каждый независимо выбран из водорода и галогена. Более предпочтительно X представляет собой водород, 2,4-дифтор или 3,5-дифтор. Кроме того, n предпочтительно равно 1 или 2, и Y предпочтительно представляет собой СН или N. В соответствии с примером соединения по настоящему изобретению производное инденона предпочтительно характеризуется формулой (1 а)-3 021353 В соединении формулы (1 а) по настоящему изобретению R1 предпочтительно представляет собой С 6 арил или 6-10-членный гетероарил, который не замещен или замещен по меньшей мере одним заместителем, выбранным из галогена и C1-алкокси. Более предпочтительно R1 представляет собой фенил,который замещен по меньшей мере одним заместителем, выбранным из фтора и метокси; или пиридил,пиримидил, хинолил или изохинолил, каждый из которых не замещен или замещен по меньшей мере одним заместителем, выбранным из фтора и метокси. Кроме того, R2 и R3 предпочтительно конденсированы вместе с Y с образованием 5-10-членной гетероциклоалкильной группы, которая не замещена или замещена -S(O2)R4, R4 представлял собой С 1-6 алкил. Более предпочтительно R2 и R3 конденсированы вместе с Y с образованием морфолинила; или пиперидинильной или пиперазинильной группы, замещенной -S(O2)CH3. Кроме того, X предпочтительно представляет собой один или несколько заместителей, введенных в орто-, мета- или пара-положение фенильной группы, причем каждый независимо выбран из водорода и галогена. Более предпочтительно X представляет собой водород, 2,4-дифтор или 3,5-дифтор. Типичные соединения по настоящему изобретению представляют собой перечисленные ниже производные инденона и их фармацевтически приемлемые соли 1) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он; 2) 6-(2-морфолиноэтокси)-2-(3-фтор-4-метоксифенил)-3-фенил-1 Н-инден-1-он; 3) 6-(2-морфолиноэтокси)-3-фенил-2-(хинолин-3-ил)-1 Н-инден-1-он; 4) 4-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензамид; 5) 3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензонитрил; 6) 6-(2-морфолиноэтокси)-2-(6-метоксипиридин-3-ил)-3-фенил-1 Н-инден-1-он; 7) 6-(2-морфолиноэтокси)-3-фенил-2-(пиримидин-5-ил)-1 Н-инден-1-он; 8) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-4-ил)-1 Н-инден-1-он; 9) 6-(2-морфолиноэтокси)-2-(6-фторпиридин-3-ил)-3-фенил-1 Н-инден-1-он; 10) 6-(2-морфолиноэтокси)-2-(4-(фенил)фенил)-3-фенил-1 Н-инден-1-он; 11) 6-(2-морфолиноэтокси)-3-фенил-2-пара-толил-1 Н-инден-1-он; 12) 2-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензонитрил; 13) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-фенил-1 Н-инден-1-он; 14) N-(3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)фенил)ацетамид; 15) 6-(2-морфолиноэтокси)-2-(изохинолин-4-ил)-3-фенил-1 Н-инден-1-он; 16) 6-(2-морфолиноэтокси)-2-(нафталин-3-ил)-3-фенил-1 Н-инден-1-он; 17) 6-(2-морфолиноэтокси)-2-(4-фторфенил)-3-фенил-1 Н-инден-1-он; 18) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-фенил-1 Н-инден-1-он; 19) 6-(2-морфолиноэтокси)-2-(3-фтор-4-метилфенил)-3-фенил-1 Н-инден-1-он; 20) 6-(2-морфолиноэтокси)-2-(3-аминофенил)-3-фенил-1 Н-инден-1-он; 21) 6-(2-морфолиноэтокси)-2-(4-феноксифенил)-3-фенил-1 Н-инден-1-он; 22) 6-(2-морфолиноэтокси)-2-(4-метоксифенил)-3-фенил-1 Н-инден-1-он; 23) 6-(2-морфолиноэтокси)-2-(4-хлорфенил)-3-фенил-1 Н-инден-1-он; 24) 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиридин-3 ил)-1 Н-инден-1-он; 25) 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиримидин-5-ил)-1 Н-инден-1-он; 26) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(4-фторфенил)-1 Н-инден-1-он; 27) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(4-фторфенил)-1 Н-инден-1-он; 28) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он; 29) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(3,4-дифторфенил)-1 Н-инден-1-он; 30) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиримидин-5-ил)-1 Н-инден-1-он; 31) 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(4-(трифторметил)фенил)-1 Н-инден-1-он; 32) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиридин-3-ил)-1 Н-инден-1-он; 33) 6-(2-морфолиноэтокси)-2,3-бис(4-(трифторметил)фенил)-1 Н-инден-1-он; 34) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(3,4-дифторфенил)-1 Н-инден-1-он; 35) 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиримидин-5-ил)-1 Н-инден-1-он; 36) 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он; 37) 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(3,5-дифторфенил)-1 Н-инден-1-он; 38) 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-1 Н-инден-1-он; 39) 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиримидин-5-ил)-1 Н-инден-1-он; 40) 4-метил-4-(2-[2-(1-метилпиридин-1-иний-3-ил)-1-оксо-3-фенил-1 Н-инден-6-ил]оксиэтил)морфолин-4-ия дийодид; 41) 1-метил-3-6-[2-(морфолин-4-ил)этокси]-1-оксо-3-фенил-1 Н-инден-2-илпиридин-1-ия йодид; 42) 4-оксидо-4-(2-[1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-ил]оксиэтил)морфолин-4-ий; 43) 4-оксидо-4-(2-[2-(1-оксидопиридин-1-иний-3-ил)-1-оксо-3-фенил-1 Н-инден-6-ил]оксиэтил)морфолин-4-ий; окси-1 Н-инден-1-он; 123) 3-(2,4-дифторфенил)-6-2-[1-(метилсульфонил)пиперидин-4-ил]этокси-2-(хинолин-3-ил)-1 Нинден-1-он; 124) 3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил)этокси]-2-пара-толил-1 Н-инден-1-он; 125) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(морфолин-4-ил)этокси]-1 Н-инден-1-он; 126) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил) этокси]-1 Н-инден-1-он; 127) 3-(2,4-дифторфенил)-6-[2-(морфолин-4-ил)этокси]-2-(хинолин-3-ил)-1 Н-инден-1-он; 128) 3-(3,5-дифторфенил)-5-[2-(морфолин-4-ил)этокси]-2-(пиридин-3-ил)-1 Н-инден-1-он; 129) 5-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он; 130) 5-(2-морфолиноэтокси)-3-фенил-2-(пиридин-4-ил)-1 Н-инден-1-он; 131) 5-(2-морфолиноэтокси)-3-фенил-2-пара-толил-1 Н-инден-1-он; 132) 5-(2-морфолиноэтокси)-2-(3-фтор-4-метилфенил)-3-фенил-1 Н-инден-1-он; 133) 3-(3,5-дифторфенил)-5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2-(пиридин-3-ил)-1 Нинден-1-он; 134) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он; 135) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-пара-толил-1 Н-инден-1-он и 136) 5-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2-(3-фтор-4-метилфенил)-3-фенил-1 Н-инден 1-он. Более того, типичные соединения по настоящему изобретению представляют собой перечисленные ниже производные инденона и их фармацевтически приемлемые соли 1) 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он; 45) 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он; 73) 3-(3,5-дифторфенил)-6-(2-(1-(метилсульфонил)пиперидин-4-ил)этокси)-2-(пиридин-3-ил)-1 Нинден-1-он; 74) 6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1 Н-инден-1 он; 82) 6-(2-морфолиноэтокси)-3-(2,4-дифторфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он; 97) 3-(3,5-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-2-[4-(метилсульфонил)пиперазин-1-ил]этокси-1 Н-инден-1-он; 102) 2-(3-фтор-4-метоксифенил)-3-(3,5-дифторфенил)-6-2-[1-(метилсульфонил)пиперидин-4-ил]этокси-1 Н-инден-1-он; 113) 3-(2,4-дифторфенил)-2-(6-метоксипиридин-3-ил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]1 Н-инден-1-он; 114) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-[2-(1,1-диоксотиоморфолин-4-ил)этокси]1 Н-инден-1-он и 122) 2-(3-фтор-4-метоксифенил)-3-(2,4-дифторфенил)-6-2-[1-(метилсульфонил)пиперидин-4-ил]этокси-1 Н-инден-1-он. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики болезни костей, содержащей соединение или соль в соответствии с настоящим изобретением в качестве активного ингредиента. Композиция по настоящему изобретению может быть применима для профилактики или лечения остеопороза, нарушения роста кости, переломов кости, периодонтита, болезни Педжета, метастатической карциномы или ревматоидного артрита. Здесь и далее в этом документе подробно описаны способы получения производных инденона по настоящему изобретению. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1 а может быть получено, как представлено на схеме реакции 1. Схема реакции 1-7 021353 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). Стадия 1. 1-(3-Гидроксифенил)этанон формулы 2 растворяют в растворе NaOH и этаноле, а затем добавляют к нему бензальдегид формулы 3 (1-2 экв.). Полученную смесь выдерживают в течение 30 мин-1 ч при температуре не выше 10 С, а затем перемешивают в течение 22-36 ч при комнатной температуре с получением ,-ненасыщенного карбонильного соединения формулы 4. Стадия 2. ,-Ненасыщенное карбонильное соединение, полученное на стадии 1, оставляли нагреваться с обратным холодильником в течение 1-5 суток при перемешивании с использованием 10-30 экв. трифторуксусной кислоты в качестве растворителя с получением соединения инданона формулы 5. Стадия 3. Соединение инданона, полученное на стадии 2, растворяют в CH2Cl2, и на ледяной бане по каплям добавляют к нему пиридин (3-5 экв.) и уксусный ангидрид (3-5 экв.). Полученную смесь перемешивают в течение 1-8 ч с получением соединения формулы 6, которое защищено ацетильной группой. Стадия 4. Соединение инданона формулы 6, полученное на стадии 3, NBS (2-3 экв.) и AIBN (1-0,2 экв.) растворяют в CCl4. Затем смесь при перемешивании нагревают с обратным холодильником в течение 30 мин-1 ч, а затем при перемешивании дополнительно облучают лампой накаливания (375 Вт) в течение 1-2 ч с получением 2-бром-1 Н-инденона формулы 7. С другой стороны, во время облучения лампой накаливания(375 Вт) смесь может нагреваться с обратным холодильником в течение 2-9 ч при перемешивании с получением 2-бром-1 Н-инденона формулы 7. Стадия 5. 1-1,2 экв. 2-бром-1 Н-инденона, полученного на стадии 4, растворяют в МеОН, а затем добавляют к нему K2CO3 (1-2 экв.). Полученную смесь перемешивают при комнатной температуре в течение 2-7 ч с получением 2-бром-6-гидрокси-1 Н-инденона формулы 8, в котором ацетильная группа удалена. Стадия 6. 2-Бром-6-гидрокси-1 Н-инденон, полученный на стадии 5, PPh3 (1-2 экв.) и соединение формулы 9 (1-2 экв.) растворяют в THF. Смесь охлаждают до 0 С и перемешивают в течение 5-10 мин,добавляют к ней диизопропилазодикарбоксилат (DIAD, 1-2 экв.), а затем перемешивают при 0 С в течение 30 мин. Полученную смесь оставляют нагреваться до комнатной температуры, а затем перемешивают в течение 2 ч-7 суток с получением простого эфира формулы 10. Стадия 7. 2-Бром-3-фенил-1 Н-инден-1-он, полученный на стадии 6, бороновую кислоту формулы 11(1-1,5 экв.), Pd(PPh3)4 (5-6 мол.%) и Na2CO3 (2-3 экв.) растворяют в диоксане/H2O (4/1), а затем перемешивают в течение 10 мин. Полученную смесь помещают в микроволновый реактор и облучают при 150 С в течение 10-20 мин с получением соединения формулы 1 а. В соответствии с другим вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1 а может быть получено, как представлено на схеме реакции 2. Схема реакции 2 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). Стадия 1. 2-Бром-6-гидрокси-1 Н-инденон формулы 8, полученный на стадии 5 схемы реакции 1,подвергают реакции сочетания по Сузуки таким же образом, что и на стадии 7 схемы реакции 1, с получением замещенного R1 6-гидрокси-1 Н-инденона формулы 12. Стадия 2. Замещенный R1 6-гидрокси-1 Н-инденон формулы 12, полученный на стадии 1, подвергают реакции Мицунобу таким же образом, что и на стадии 6 схемы реакции 1, с получением соединения формулы 1 а. В соответствии с дополнительным вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1 а может быть получено, как представлено на схеме реакции 3. Схема реакции 3 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). Замещенный R1 6-гидрокси-1 Н-инденон формулы 12, полученный на стадии 1 схемы реакции 2,растворяют в ацетонитриле, а затем добавляют к нему K2CO3 (1-1,5 экв.) и соединение формулы 13 (1,5-2 экв.). Полученную смесь при перемешивании нагревают с обратным холодильником в течение 1-3 суток с получением соединения формулы 1 а. В соответствии с вариантом осуществления настоящего изобретения соединения по настоящему изобретению формул 1 с и 1d могут быть получены, как представлено на схеме реакции 4. 6-(2-Морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он формулы 1b, полученный по схеме реакции 1, растворяют в CH2Cl2, а затем к нему при комнатной температуре добавляют CH3I (5-10 экв.). Полученную смесь при перемешивании нагревают с обратным холодильником в течение 30 мин-1 ч с получением соединений формул 1 с и 1d. В соответствии с вариантом осуществления настоящего изобретения, соединения по настоящему изобретению формул 1 е и 1f могут быть получены при помощи схемы реакции 5. 6-(2-Морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он формулы 1b, полученный по схеме реакции 1, растворяют в CH2Cl2, а затем при 10 С добавляют к нему mCPBA (1-1,5 экв.). Реакционную смесь оставляют взаимодействовать в течение 2-3 ч при комнатной температуре с получением соединений формул 1 е и 1f. В соответствии с вариантом осуществления настоящего изобретения, соединение по настоящему изобретению формулы 1h может быть получено, как представлено на схеме реакции 6. Схема реакции 6 где X имеет те же значения, что и определенные в формуле (1); Z представляет собой СН или N; иm равно 1 или 2. Соединение формулы 1g, полученное по схеме реакции 1, растворяют в CH2Cl2, а затем добавляют к нему трифторуксусную кислоту (20-40 экв.). Полученную смесь перемешивают в течение 30 мин-2 ч при комнатной температуре с получением соединения формулы 1h. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1i может быть получено, как представлено на схеме реакции 7. Схема реакции 7 где X имеет те же значения, что и определенные в формуле (1); Z представляет собой СН или N; иm равно 1 или 2. Соединение формулы 1h, полученное по схеме реакции 6, растворяют в CH2Cl2, а затем добавляют к нему пиридин (1,2-1,5 экв.). Смесь охлаждают до 0 С, добавляют к ней уксусный ангидрид (1,2-1,5 экв.),а затем оставляют реакционную смесь взаимодействовать в течение 15-20 ч при комнатной температуре с получением соединения формулы 1i. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1j может быть получено, как представлено на схеме реакции 8. Схема реакции 8 где X имеет те же значения, что и определенные в формуле (1); Z представляет собой СН или N; иm равно 1 или 2. Соединение формулы 1g, полученное по схеме реакции 1, растворяют в CH2Cl2, а затем добавляют к нему триэтиламин (1,5-3 экв.). Смесь охлаждают до 0 С, к ней медленно в течение 10-15 мин добавляют метансульфонилхлорид (3-5 экв.), растворенный в CH2Cl2, а затем оставляют реакционную смесь взаи-9 021353 модействовать в течение 3-18 ч при комнатной температуре с получением соединения формулы 1j. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1k может быть получено, как представлено на схеме реакции 9. Схема реакции 9 где X имеет те же значения, что и определенные в формуле (1); Z представляет собой СН или N; иm равно 1 или 2. Соединение формулы 1h, полученное по схеме реакции 6, и формальдегид (37% водный раствор, 11,2 экв.) растворяют в CH2Cl2, а затем добавляют к ним триацетоксиборгидрид натрия (3-4 экв.). Реакционную смесь оставляют взаимодействовать в течение 2-3 ч при комнатной температуре с получением соединения формулы 1k. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1l может быть получено, как представлено на схеме реакции 10. Схема реакции 10 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). Соединение формулы 1 а, полученное по схемам реакции 1-3, растворяют в CH2Cl2, а затем добавляют к нему 1,0 М раствор HCl (растворенный в эфире, 1 экв.) с получением соединения в форме HClсоли формулы 1l. В соответствии с вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1m может быть получено, как представлено на схеме реакции 11. Схема реакции 11 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). Стадия 1. Ацетилхлорид (1-1,2 экв.) и AlCl3 (1-1,2 экв.) смешивают с дисульфидом углерода и добавляют к ним 3-броманизол, растворенный в дисульфиде углерода. Полученную смесь перемешивают в течение 10-16 ч при комнатной температуре с получением 1-(2-бром-4-метоксифенил)этанона формулы 14. Стадия 2. 1-(2-Бром-4-метоксифенил)этанон, полученный на стадии 1, растворяют в этаноле, к нему при 0 С последовательно добавляют 10 н NaOH (2-4 экв.) и бензальдегид формулы 3 (1-1,2 экв.). Полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 4-6 ч с получением ,-ненасыщенного карбонильного соединения формулы 15. Стадия 3. ,-Ненасыщенное карбонильное соединение формулы 15, полученное на стадии 2, растворяют в N,N-диметилформамиде, а затем добавляют к нему трифенилфосфин (0,2-0,3 экв.), карбонат калия (2-3 экв.) и дихлорид палладия (0,1-0,2 экв.). Полученную смесь перемешивают в течение 2-4 ч при 110 С с получением соединения инденона формулы 16. Стадия 4. Соединение инденона формулы 16, полученное на стадии 3, растворяют в CCl4, добавляют к нему N-бромсукцинимид (1-1,2 экв.) и 2,2'-азобисизобутиронитрил (10-15 вес.%). Полученную смесь нагревают с обратным холодильником в течение 2-3 ч при перемешивании с получением 2 броминденона формулы 17. Стадия 5. 2-Броминденон формулы 17, полученный на стадии 4, борную кислоту формулы 11 (1-1,5 экв.), Pd(PPh3)4 (5-6 мол.%) и Na2CO3 (2-3 экв.) растворяют в диоксане/H2O (4/1). Полученную смесь помещают в микроволновый реактор и облучают при 150 С в течение 10-20 мин с получением соединения инденона формулы 18. Стадия 6. Соединение инденона, полученное на стадии 5, смешивают с HBr/АсОН (1/2), а затем полученную смесь нагревают с обратным холодильником в течение 14-16 ч при перемешивании с получением 5-гидроксиинденона формулы 19. Стадия 7. Соединение формулы 19, полученное на стадии 6, растворяют в диметилформамиде, добавляют к нему K2CO3 (2-3 экв.) и соединение формулы 20 (1-2 экв.). Полученную смесь перемешивают в течение 3-5 ч при 80 С с получением соединения формулы 1m. В соответствии с другим вариантом осуществления настоящего изобретения соединение по настоящему изобретению формулы 1m может быть получено, как представлено на схеме реакции 12. Схема реакции 12 где n, X, Y, R1, R2 и R3 имеют те же значения, что и определенные в формуле (1). 5-Гидроксиинденон формулы 19, полученный на стадии 6 схемы реакции 11, растворяют в диметилформамиде, добавляют к нему K2CO3 (2-3 экв.) и замещенный метансульфонильной группой простой эфир формулы 21 (1-1,5 экв.). Полученную смесь перемешивают в течение 3-5 ч при 70-80 С с получением соединения формулы 1m. В соответствии с другим вариантом осуществления настоящего изобретения соединение формулы 17, 2-бром-5-метоксиинденон, может быть получено, как представлено на схеме реакции 13. Схема реакции 13 где X имеет те же значения, что и определенные в формуле (1). Стадия 1. 5-Метоксиинданон формулы 20 растворяют в CCl4, добавляют к нему N-бромсукцинимид (22,2 экв.) и 2,2'-азобисизобутиронитрил (0,2-0,3 экв.). Полученную смесь при перемешивании дополнительно облучают лампой накаливания (375 Вт) в течение 3-5 ч с получением 3-броминденона формулы 21. Стадия 2. 3-Броминденон формулы 21, полученный на стадии 1, растворяют в диметиловом эфире этиленгликоля, добавляют к нему бороновую кислоту формулы 22 (1-1,5 экв.), трифенилфосфин (0,1-0,2 экв.),трис(дибензилиденацетон)дипалладия (4-5 мол.%) и карбонат натрия (2-2,5 экв.). Полученную смесь при перемешивании нагревают с обратным холодильником в течение 3-4 ч с получением инденона формулы 23. Стадия 3. Инденон формулы 23, полученный на стадии 2, растворяют в CH2Cl2, добавляют к нему 1 М раствор Br2 (растворенный в CH2Cl2). Полученную смесь перемешивают в течение 2-3 ч при комнатной температуре с получением 2-броминденона формулы 17. Примеры Последующие примеры предназначены для дополнительного пояснения настоящего изобретения без ограничения его объема. Пример 1. Синтез гидрохлорида 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. (Е)-1-(3-Гидроксифенил)-3-фенилпроп-2-ен-1-он В круглодонную колбу емкостью 250 мл последовательно загружали водный раствор NaOH (7,1 гNaOH/50 мл H2O) и EtOH (40 мл). Раствор поддерживали при температуре ниже 10 С на бане со льдом. Добавляли 1-(3-гидроксифенил)этанон (20,0 г, 147 ммоль) и перемешивали в течение 30 мин при 10 С. Затем к полученной смеси добавляли бензальдегид (15 мл, 1,0 экв.). После перемешивания еще в течение 1 ч при 10 С реакционную смесь перемешивали при комнатной температуре еще в течение 26 ч. Раствор концентрировали на роторном испарителе в условиях пониженного давления. Остаток растворяли в EtOAc. Органический слой промывали 3 н HCl и H2O, сушили над MgSO4 и концентрировали в условиях вакуума с получением целевого продукта (32,5 г, 98%). 1(Е)-1-(3-Гидроксифенил)-3-фенилпроп-2-ен-1-он (48,7 г, 217 ммоль), полученный на стадии 1, иCF3COOH (161 мл, 10 экв.) помещали в колбу и перемешивали в течение 24 ч при 80 С. После охлаждения до комнатной температуры добавляли толуол (200 мл), и концентрировали раствор в условиях пониженного давления для удаления TFA. Остаток растворяли в EtOAc, промывали H2O, сушили над MgSO4 и концентрировали в условиях вакуума с получением целевого продукта (48,0 г, 99%). 1 Н-ЯМР (CDCl3, 300 МГц)7,3 (м, 5 Н), 7,1 (м, 3 Н), 4,5 (кв., J=3,8 Гц, 1 Н), 3,3 (дд, J=7,9 Гц, 19,2 Гц,1 Н), 2,7 (дд, J=3,7 Гц, 19,2 Гц, 1 Н). Стадия 3. 2,3-Дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетат 2,3-Дигидро-6-гидрокси-3-фенилинден-1-он (22,5 г, 100 ммоль), полученный на стадии 2, помещали в колбу и растворяли в CH2Cl2 (300 мл). К раствору при 0 С по каплям добавляли пиридин (40 мл, 5,0 экв.) и уксусный ангидрид (47 мл, 5,0 экв.). Смесь перемешивали в течение 8 ч при комнатной температуре. Реакционную смесь разбавляли EtOAc и промывали H2O. Органический слой сушили над MgSO4 и концентрировали в условиях вакуума с получением целевого продукта (20,0 г, 77%). 1 2,3-Дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетат (10,1 г, 37,9 ммоль), полученный на стадии 3,помещали в колбу и растворяли в CCl4 (200 мл). К полученному раствору добавляли NBS (14,8 г, 2,2 экв.) и AIBN (0,62 г, 10 мол.%). Полученную смесь оставляли нагреваться с обратным холодильником в течение 1 ч. Затем смесь дополнительно облучали светом лампы накаливания (375 Вт) в течение 1,5 ч. После охлаждения до комнатной температуры осадок собирали с использованием воронки Бюхнера. Твердое вещество растворяли в CH2Cl2 и промывали насыщенным Na2S2O3, H2O и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях вакуума с получением целевого продукта 2-Бром-1-оксо-3-фенил-1 Н-инден-6-илацетат (24 г, 70,0 ммоль), полученный на стадии 4, помещали в колбу и растворяли в МеОН (350 мл). В раствор загружали K2CO3 (11,64 г, 1,2 экв.), и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли EtOAc и промывали солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях вакуума с получением целевого продукта (19,5 г, 93%). 1 В колбу загружали 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-он (3,0 г, 10,0 ммоль), полученный на стадии 5, PPh3 (3,93 г, 1,5 экв.), 4-(2-гидроксиэтил)морфолин (1,8 мл, 1,5 зкв. ) и THF (33 мл, 0,3 М). Полученную смесь охлаждали до 0 С и добавляли диизопропилазодикарбоксилат (DIAD, 2,9 мл, 1,5 экв.). Реакционную смесь перемешивали при 0 С в течение 30 мин и оставляли нагреваться до температуры окружающей среды. После перемешивания в течение 2 ч раствор концентрировали на роторном испарителе в условиях пониженного давления. Остаток растворяли в EtOAc, промывали H2O и солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума. Неочищенный продукт очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 4/1) с получением целевого продукта В реакционную пробирку, пригодную для обработки микроволновым излучением, последовательно загружали 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-он (1,0 г, 2,5 ммоль), полученный на стадии 6, 3-пиридинилбороновую кислоту (470 мг, 3,8 ммоль, 1,5 экв.), Pd(PPh3)4 (180 мг, 6 мол.%), Na2CO3(800 мг, 3,0 экв.) и диоксан/H2O (4/1, 5 мл). Реакционную пробирку помещали в микроволновой реактор и обрабатывали при 150 С в течение 20 мин. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и сушили над MgSO4. Смесь фильтровали через слой целита, промывая EtOAc, a затем концентрировали в условиях вакуума. Остаток очищали по методу препаративной ВЭЖХ(CH3CN/H2O=1/1) с получением целевого продукта (640 мг, 64%). 1(м, 3 Н), 7,40-7,34 (м, 2 Н), 7,25-7,17 (м, 2 Н), 7,07 (д, J=8,1 Гц, 1 Н), 6,83 (дд, J=2,2, 8,0 Гц, 1 Н), 4,17 (т,J=5,5 Гц, 2 Н), 3,75 (т, J=4,5 Гц, 4 Н), 2,83 (т, J=5,5, 2 Н), 2,60 (т, J=4,5 Гц, 4 Н). Стадия 8. Гидрохлорид 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она 6-(2-Морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он (500 мг, 1,21 ммоль), полученный на стадии 7, помещали в колбу и растворяли в CH2Cl2 (4,0 мл). К полученному раствору добавляли 1,0 М HCl в диэтиловом эфире (1,21 мл, 1 экв.). Растворители удаляли на роторном испарителе в условиях пониженного давления с получением целевого продукта с количественным выходом. 1(2 Н, с), 3,2 (4 Н, с). Пример 2. Синтез 6-(2-морфолиноэтокси)-2-(3-фтор-4-метоксифенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3 фтор-4-метоксифенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (13%). 1 Н-ЯМР (CDCl3, 300 МГц)7,44-7,39 (3 Н, м), 7,37-7,36 (2 Н, м), 7,18 (1 Н, д, J=2,4 Гц), 7,04-6,96 (3 Н,м), 6,86 (1 Н, д, J=8,4 Гц), 6,80 (1 Н, дд, J=8,3 Гц, 2,6 Гц), 4,15 (2 Н, т, J=5,7 Гц), 3,86 (3 Н, с), 3,75 (4 Н, т,J=4,7 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,5 Гц). Пример 3. Синтез 6-(2-морфолиноэтокси)-3-фенил-2-(хинолин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3 хинолинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали с(2 Н, т, J=5,6 Гц), 2,61 (2 Н, т, J=5,6 Гц). Пример 4. Синтез 4-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензамида Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 карбамоилфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали сEtOAc с получением указанного в заголовке соединения (36%). 1 Н-ЯМР (CDCl3, 300 МГц)7,69 (2 Н, д, J=8,1 Гц), 7,42-7,30 (7 Н, м), 7,36-7,30 (4 Н, м), 7,20 (1 Н, д,J=0,75 Гц), 7,06 (1 Н, д, J=8,0 Гц), 6,82 (1 Н, дд, J=8,1 Гц, 1,8 Гц), 6,00 (2 Н, NH2, J=79 Гц), 4,16 (2 Н, т, J=5,4 Гц), 3,75 (4 Н, т, J=4,4 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,4 Гц). Пример 5. Синтез 3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензонитрила Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3 цианфенилбороновую кислоту (1,2 экв.) вместо 3-пиридинилбороновой кислоты, Pd(PPh3)4 (4 мол.%),Na2CO3 (2,4 экв.) и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/1) с получением указанного в заголовке соединения (67%). 1 7,21 (д, 1 Н, J=2,3 Гц), 7,06 (с, 1 Н, J=8,1 Гц), 6,83 (дд, 1 Н, J=8,1, 2,4 Гц), 4,16 (т, 2 Н, J=5,6 Гц), 3,74 (т, 4 Н,J=4,5 Гц), 2,82 (т, 2 Н, J=5,6 Гц), 2,59 (т, 4 Н, J=4,7 Гц). Пример 6. Синтез 6-(2-морфолиноэтокси)-2-(6-метоксипиридин-3-ил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 2 метокси-5-пиридинилбороновую кислоту (1,2 зкв.) вместо 3-пиридинилбороновой кислоты, Pd(PPh3)4 (4 мол.%), Na2CO3 (2,4 экв.) и очищали по методу колоночной хроматографии на силикагелеH-ЯМР (CDCl3, 300 МГц)8,09 (д, 1 Н, J=2,1 Гц), 7,48-7,36 (м, 6 Н), 7,18 (д, 1 Н, J=2,3 Гц), 7,01 (д,1 Н, J=8,0 Гц), 6,80 (дд, 1 Н, J=8,1, 2,4 Гц), 6,64 (д, 1 Н, J=8,6 Гц), 4,15 (т, 2 Н, J=5,6 Гц), 3,90 (2, 3 Н), 3,74 (т,4 Н, J=4,8 Гц), 2,81 (т, 2 Н, J=5,7 Гц), 2,58 (т, 4 Н, J=4,6 Гц). Пример 7. Синтез 6-(2-морфолиноэтокси)-3-фенил-2-(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 5 пиримидинилбороновую кислоту (1,2 экв.) вместо 3-пиридинилбороновой кислоты, Pd(PPh3)4 (4 мол.%),Na2CO3 (2,4 экв.) и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/1) с получением указанного в заголовке соединения (70%). 1 Н-ЯМР (CDCl3, 300 МГц)9,05 (с, 1 Н), 8,63 (с, 2 Н), 7,49-7,47 (м, 3 Н), 7,39-7,36 (м, 2 Н), 7,23 (д, 1 Н,J=2,4 Гц), 7,09 (д, 1 Н, J=8,1 Гц), 6,86 (дд, 1 Н, J=8,1, 2,3 Гц), 4,17 (т, 2 Н, J=5,6 Гц), 3,75 (т, 4 Н, J=4,5 Гц),2,83 (т, 2 Н, J=5,6 Гц), 2,59 (т, 4 Н, J=4,6 Гц). Пример 8. Синтез 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-4-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 пиридинилбороновую кислоту (1,2 экв.) вместо 3-пиридинилбороновой кислоты, Pd(PPh3)4 (4 мол.%),Na2CO3 (2,4 экв.) и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/1) с получением указанного в заголовке соединения (62%). 1H-ЯМР (CDCl3, 300 МГц)8,47 (д, 2 Н, J=5,6 Гц), 7,46-7,44 (м, 3 Н), 7,37-7,34 (м, 2 Н), 7,21 (д, 1 Н,J=2,1 Гц), 7,16 (д, 2 Н, J=5,6 Гц), 7,06 (д, 1 Н, J=8,0 Гц), 6,84 (дд, 1 Н, J=5,9, 2,1 Гц), 4,17 (т, 2 Н, J=5,6 Гц),3,74 (т, 4 Н, J=4,5 Гц), 2,83 (т, 2 Н, J=5,6 Гц), 2,59 (т, 4 Н, J=4,5 Гц). Пример 9. Синтез 6-(2-морфолиноэтокси)-2-(6-фторпиридин-3-ил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 2 фтор-5-пиридинилбороновую кислоту (1,2 экв.) вместо 3-пиридинилбороновой кислоты, Pd(PPh3)4 (4 мол.%), Na2CO3 (2,4 экв.) и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/1) с получением указанного в заголовке соединения (95%). 1(т, 4 Н, J=4,5 Гц), 2,83 (т, 2 Н, J=5,7 Гц), 2,59 (т, 4 Н, J=4,8 Гц). Пример 10. Синтез 6-(2-морфолиноэтокси)-2-(4-(фенил)фенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 бифенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали с CH3CN с получением указанного в заголовке соединения (88%). 1 Н-ЯМР (CDCl3, 300 МГц)7,57 (2 Н, д, J=8,0 Гц), 7,49 (2 Н, д, J=8,4 Гц), 7,44-7,32 (10 Н, м), 7,33(3 Н, д, J=7,8 Гц), 7,21 (1 Н, д, J=2,4 Гц), 7,04 (1 Н, д, J=8,1 Гц), 6,81 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,16 (2 Н, т,J=5,6 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,60 (4 Н, т, J=4,7 Гц). Пример 11. Синтез 6-(2-морфолиноэтокси)-3-фенил-2-пара-толил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали пара-толилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали сH-ЯМР (CDCl3, 300 МГц)7,42-7,36 (5 Н, м), 7,18 (1 Н, д, J=2,4 Гц), 7,15-7,12 (2 Н, м), 7,09 (2 Н, д,J=7,8 Гц), 7,02 (1 Н, д, J=8,1 Гц), 6,80 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,15 (2 Н, т, J=5,7 Гц), 3,75 (4 Н, т, J=4,2 Гц), 2,81 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц), 2,31 (3 Н, с). Пример 12. Синтез 2-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)бензонитрила Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 2 цианфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (4%). 1H-ЯМР (CDCl3, 300 МГц)7,52 (2 Н, д, J=8,4 Гц), 7,46-7,44 (3 Н, м), 7,37-7,30 (4 Н, м), 7,21 (1 Н, д,J=2,4 Гц), 7,07 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,17 (2 Н, т, J=5,6 Гц), 3,74 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 13. Синтез 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали с CH3CN с получением указанного в заголовке соединения (14%). 1 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 14. Синтез N-(3-(6-(2-морфолиноэтокси)-1-оксо-3-фенил-1 Н-инден-2-ил)фенил)ацетамида Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3(ацетамидо)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (27%). 1 Н-ЯМР (CDCl3, 300 МГц)7,64 (1 Н, д, J=8,7 Гц), 7,42-7,35 (5 Н, м), 7,35 (1 Н, с, NH), 7,23 (1 Н, с),7,18 (1 Н, д, J=2,4 Гц), 7,14 (1 Н, д, J=8,1 Гц), 7,04 (1 Н, д, J=8,1 Гц), 6,84-6,79 (2 Н, м), 4,16 (2 Н, т, J=5,4 Гц),3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,4 Гц), 2,59 (4 Н, т, J=4,7 Гц), 2,12 (3 Н, с). Пример 15. Синтез 6-(2-морфолиноэтокси)-2-(изохинолин-4-ил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 изохинолинилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (36%). 1H-ЯМР (CDCl3, 300 МГц)9,18 (1 Н, с), 8,26 (1 Н, с), 7,97 (1 Н, кв., J=3,2 Гц), 7,70-7,49 (4 Н, м), 7,337,13 (6 Н, м), 6,91-6,80 (1 Н, м), 4,19 (2 Н, т, J=5,6 Гц), 3,76 (4 Н, т, J=4,5 Гц), 2,84 (2 Н, т, J=5,6 Гц), 2,60 (4 Н,т, J=4,5 Гц). Пример 16. Синтез 6-(2-морфолиноэтокси)-2-(нафталин-3-ил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 2 нафтилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (64%). 1H-ЯМР (CDCl3, 300 МГц)7,91 (1 Н, с), 7,76 (2 Н, дт, J=6,2 Гц, 3,2 Гц), 7,64 (1 Н, д, J=8,7 Гц), 7,477,39 (7 Н, м), 7,23 (1 Н, д, J=2,4 Гц), 7,17 (1H, дд, J=8,6 Гц, 1,7 Гц), 7,08 (1 Н, д, J=8,1 Гц), 6,83 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,17 (2 Н, т, J=5,6 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,83 (2 Н, т, J=5,6 Гц), 2,60 (4 Н, т, J=4,7 Гц). Пример 17. Синтез 6-(2-морфолиноэтокси)-2-(4-фторфенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 фторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (80%). 1 Н-ЯМР (CDCl3, 300 МГц)7,44-7,40 (3 Н, м), 7,38-7,35 (2 Н, м), 7,26-7,20 (3 Н, м), 7,04 (1 Н, д, J=8,1 Гц), 6,95 (2 Н, дт, J=7,8 Гц, 2,0 Гц), 6,82 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,17 (2 Н, т, J=5,7 Гц), 3,75 (4 Н, т, J=4,7 Гц), 3,50 (3 Н, с), 2,83 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 18. Синтез 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали сCH3CN с получением указанного в заголовке соединения (11%). 1 Н-ЯМР (CDCl3, 300 МГц)7,45-7,43 (3 Н, м), 7,38-7,30 (2 Н, м), 7,20 (1 Н, д, J=2,4 Гц), 7,10 (1 Н, ддд,J=7,8 Гц, 11,7 Гц, 2,0 Гц), 7,04 (1 Н, с), 7,01 (1 Н, д, J=2,1 Гц), 6,98-6,96 (1 Н, с), 6,81 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,16 (2 Н, т, J=5,6 Гц), 3,75 (4 Н, т, J=4,8 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 19. Синтез 6-(2-морфолиноэтокси)-2-(3-фтор-4-метилфенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3 фтор-4-метилфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали с CH3CN с получением указанного в заголовке соединения (25%). 1 Н-ЯМР (CDCl3, 300 МГц)7,40 (5 Н, м), 7,19 (1 Н, д, J=2,4 Гц), 7,07-7,01 (2 Н, м), 6,95-6,89 (2 Н, м),6,80 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,15 (2 Н, т, J=5,7 Гц), 3,74 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н,т, J=4,7 Гц), 2,23 (3 Н, с). Пример 20. Синтез 6-(2-морфолиноэтокси)-2-(3-аминофенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 3 аминофенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и перекристаллизовывали с(1 Н, дд, J=2,4 Гц, 8,1 Гц), 6,64 (1 Н, т, J=11,8 Гц), 6,58-6,55 (1 Н, м), 4,15 (2 Н, т, J=5,7 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 21. Синтез 6-(2-морфолиноэтокси)-2-(4-феноксифенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 феноксифенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (28%). 1H-ЯМР (CDCl3, 300 МГц)7,40 (5 Н, м), 7,33 (2 Н, т, J=7,8 Гц), 7,23-7,19 (3 Н, м), 7,11 (1 Н, т, J=7,1 Гц), 7,04-7,00 (3 Н, м), 6,88 (2 Н, д, J=8,3 Гц), 6,825-6,79 (1 Н, м), 4,16 (2 Н, т, J=5,6 Гц), 3,75 (4 Н, т, J=4,4 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,2 Гц). Пример 22. Синтез 6-(2-морфолиноэтокси)-2-(4-метоксифенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 метоксифенилбороновую кислоту вместо 3-пиридинилбороновой кислоты, с получением указанного в заголовке соединения (94%).H-ЯМР (CDCl3, 300 МГц)7,40 (5 Н, м), 7,19 (3 Н, д, J=8,7 Гц), 7,00 (1 Н, д, J=7,8 Гц), 6,79 (3 Н, д,J=8,7 Гц), 4,15 (2 Н, т, J=5,6 Гц), 3,78 (3 Н, с), 3,74 (4 Н, т, J=4,5 Гц), 2,81 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,4 Гц). Пример 23. Синтез 6-(2-морфолиноэтокси)-2-(4-хлорфенил)-3-фенил-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали 4 хлорфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединенияH-ЯМР (CDCl3, 300 МГц)7,43-7,35 (5 Н, м), 7,24-7,16 (5 Н, м), 7,03 (1 Н, д, J=7,8 Гц), 6,81 (1 Н, дд,J=2,4 Гц, 8,1 Гц), 4,15 (2 Н, т, J=5,7 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 24. Синтез 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. (Е)-3-(4-Фторфенил)-1-(3-гидроксифенил)проп-2-ен-1-он Повторяли методику, описанную на стадии 1 примера 1, за исключением того, что в качестве исходного вещества использовали 4-фторбензальдегид вместо бензальдегида, с получением указанного в заголовке соединения (99%). 1H-ЯМР (CDCl3, 300 МГц)7,8 (1 Н, с, ОН), 8,0 (2 Н, дд, J=5,7 Гц, 8,7 Гц), 7,8 (2 Н, кв., J=18,2 Гц),7,6 (1 Н, д, J=7,8 Гц), 7,4 (1 Н, т, J=2,0 Гц), 7,35 (1 Н, т, J=7,9 Гц), 7,3 (2 Н, т, J=8,8 Гц), 7,0 (1 Н, дд, J=7,8 Гц,2,1 Гц). Стадия 2. 3-(4-Фторфенил)-2,3-дигидро-6-гидроксиинден-1-он Повторяли методику, описанную на стадии 2 примера 1, за исключением того, что в качестве исходного вещества использовали (Е)-3-(4-фторфенил)-1-(3-гидроксифенил)проп-2-ен-1-он, полученный на стадии 1, вместо (Е)-1-(3-гидроксифенил)-3-фенилпроп-2-ен-1-она, перемешивали в течение 5 суток и удаляли TFA на роторном испарителе с получением указанного в заголовке соединения (47%). 1(1 Н, дд, J=7,8 Гц, 19,2 Гц), 2,45 (1 Н, дд, J=3,3 Гц, 19,2 Гц). Стадия 3. 1-(4-Фторфенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат Повторяли методику, описанную на стадии 3 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(4-фторфенил)-2,3-дигидро-6-гидроксиинден-1-он, полученный на стадии 2, вместо 2,3-дигидро-6-гидрокси-3-фенилинден-1-она и перемешивали в течение 2 ч с получением указанного в заголовке соединения (99%). 1(1 Н, дд, J=7,8 Гц, 3,8 Гц), 3,3 (1 Н, дд, J=7,8 Гц, 19,1 Гц), 2,7 (1 Н, дд, J=3,9 Гц, 19,1 Гц), 2,3 (3 Н, с). Стадия 4. 2-Бром-3-(4-фторфенил)-1-оксо-1 Н-инден-6-илацетат Повторяли методику, описанную на стадии 4 примера 1, за исключением того, что в качестве исходного вещества использовали 1-(4-фторфенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат, полученный на стадии 3, вместо 2,3-дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетата и кипятили с обратным холодильником в течение 5 суток при облучении светом лампы накаливания (375 Вт) с получением указанного в заголовке соединения (99%). 1H-ЯМР (ДМСО, 300 МГц)7,82-7,78 (1 Н, м), 7,5 (1 Н, дд, J=2,3 Гц, 20,1 Гц), 7,5-7,4 (1 Н, м), 7,417,36 (2 Н, м), 7,3 (1 Н, д, J=8,9 Гц), 7,21-7,20 (1 Н, м), 2,3 (3 Н, с). Стадия 5. 2-Бром-3-(4-фторфенил)-6-гидрокси-1 Н-инден-1-он Повторяли методику, описанную на стадии 5 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-фторфенил)-1-оксо-1 Н-инден-6-илацетат, полученный на стадии 4, вместо 2-бром-1-оксо-3-фенил-1 Н-инден-6-илацетата и перемешивали в течение 7 ч с получением указанного в заголовке соединения (45%). 1H-ЯМР (ДМСО, 300 МГц)10,2 (1 Н, с, ОН), 7,8-7,7 (1 Н, м), 7,4 (2 Н, т, J=8,9 Гц), 7,0 (2 Н, дд, J=5,0 Гц, 11 Гц), 6,8 (1 Н, дд, J=2,3 Гц, 8,0 Гц). Стадия 6. 6-(2-Морфолиноэтокси)-2-бром-3-(4-фторфенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-фторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (EtOAc 100%) с получением указанного в заголовке соединения (80%). Стадия 7. 6-(2-Морфолиноэтокси)-3-(4-фторфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-фторфенил)-1 Н-инден-1-он, полученный на стадии 6, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (52%). 1 Пример 25. Синтез 6-(2-морфолиноэтокси)-3-(4-фторфенил)-2-(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-фторфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 24, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 5 пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (96%). 1H-ЯМР (CDCl3, 300 МГц)9,07 (1 Н, с), 8,63 (2 Н, с), 7,41-7,37 (2 Н, м), 7,23 (1 Н, д, J=2,4 Гц), 7,217,15 (2 Н, м), 7,07 (1 Н, д, J=8,1 Гц), 6,87 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,11 (2 Н, т, J=5,6 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,83 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 26. Синтез 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(4-фторфенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-фторфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 24, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 3,4 дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 2/3) с получением указанного в заголовке соединения (81%). 1(4 Н, т, J=4,6 Гц). Пример 27. Синтез 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(4-фторфенил)-1 Н-инден 1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-фторфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 24, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 4(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/4) с получением указанного в заголовке соединения (57%). 1H-ЯМР (CDCl3, 300 МГц)7,53 (2 Н, д, J=8,4 Гц), 7,39-7,34 (4 Н, м), 7,21 (1 Н, д, J=2,4 Гц), 7,13 (2 Н,т, J=8,5 Гц), 7,05 (1 Н, д, J=8,1 Гц), 6,83 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,18 (2 Н, т, J=5,6 Гц), 3,76 (4 Н, т, J=4,6 Гц), 2,83 (2 Н, т, J=6,0 Гц), 2,60 (4 Н, т, J=4,6 Гц). Пример 28. Синтез 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. (Е)-3-(4-Хлорфенил)-1-(3-гидроксифенил)проп-2-ен-1-он Повторяли методику, описанную на стадии 1 примера 1, за исключением того, что в качестве исходного вещества использовали 4-хлорбензальдегид (1 экв.) вместо бензальдегида и перемешивали в течение 36 ч с получением указанного в заголовке соединения (99%). 1(1 Н, д, J=7,8 Гц), 7,5 (2 Н, д, J=4,3 Гц), 7,5 (1 Н, т, J=2,0 Гц), 7,3 (1 Н, т, J=7,2 Гц), 7,1 (1 Н, дд, J=8,0 Гц, 2,5 Гц). Стадия 2. 3-(4-Хлорфенил)-2,3-дигидро-6-гидроксиинден-1-он Повторяли методику, описанную на стадии 2 примера 1, за исключением того, что в качестве исходного вещества использовали (Е)-3-(4-хлорфенил)-1-(3-гидроксифенил)проп-2-ен-1-он, полученный на стадии 1, вместо (Е)-1-(3-гидроксифенил)-3-фенилпроп-2-ен-1-она и перемешивали в течение 4 суток с получением указанного в заголовке соединения (48%). 1H-ЯМР (ДМСО, 300 МГц)9,9 (1 Н, с, ОН), 7,4 (2 Н, дд, J=2,4 Гц, 6,7 Гц), 7,2 (2 Н, дд, J=1,8 Гц, 14,8 Гц), 7,09-7,08 (2 Н, м), 7,0 (1 Н, т, J=1,4 Гц), 4,6 (1 Н, дд, J=3,4 Гц, 7,9 Гц), 3,2 (1 Н, дд, J=6,7 Гц, 17,6 Гц),2,5 (1 Н, дд, J=2,8 Гц, 16,5 Гц). Стадия 3. 1-(4-Хлорфенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат Повторяли методику, описанную на стадии 3 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(4-хлорфенил)-2,3-дигидро-6-гидроксиинден-1-он, полученный на стадии 2, вместо 2,3-дигидро-6-гидрокси-3-фенилинден-1-она и перемешивали в течение 1,5 ч с получением указанного в заголовке соединения (99%). 1H-ЯМР (ДМСО, 300 МГц)7,4 (1 Н, т, J=2,0 Гц), 7,4 (2 Н, д, J=2,4 Гц), 7,4 (1 Н, д, J=2,1 Гц), 7,317,27 (1 Н, м), 7,26-7,21 (2 Н, м), 4,7 (1 Н, дд, J=3,8 Гц, 8,0 Гц), 3,3 (1 Н, дд, J=21 Гц, 5,7 Гц), 2,66 (1 Н, дд,J=2,3 Гц, 21 Гц). Стадия 4. 2-Бром-3-(4-хлорфенил)-1-оксо-1 Н-инден-6-илацетат Повторяли методику, описанную на стадии 4 примера 1, за исключением того, что в качестве исходного вещества использовали 1-(4-хлорфенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат, полученный на стадии 3, вместо 2,3-дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетата и кипятили с обратным холодильником в течение 9 ч при облучении светом лампы накаливания (375 Вт) с получением указанного в заголовке соединения (49%).(3 Н, с). Стадия 5. 2-Бром-3-(4-хлорфенил)-6-гидрокси-1 Н-инден-1-он Повторяли методику, описанную на стадии 5 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-хлорфенил)-1-оксо-1 Н-инден-6-илацетат, полученный на стадии 4, вместо 2-бром-1-оксо-3-фенил-1 Н-инден-6-илацетата и перемешивали в течение 7 ч с получением указанного в заголовке соединения (57%). 1H-ЯМР (ДМСО, 300 МГц)10,3 (1 Н, с, ОН), 7,72-7,65 (4 Н, м), 7,0 (1 Н, д, J=8,0 Гц), 7,0 (1 Н, д,J=2,3 Гц), 6,8 (1 Н, дд, J=2,4 Гц, 8,0 Гц). Стадия 6. 6-(2-Морфолиноэтокси)-2-бром-3-(4-хлорфенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-хлорфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (EtOAc 100%) с получением указанного в заголовке соединения (67%). Стадия 7. 6-(2-Морфолиноэтокси)-3-(4-хлорфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-хлорфенил)-1 Н-инден-1-он, полученный на стадии 6, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (67%). 1H-ЯМР (CDCl3, 300 МГц)8,47 (1 Н, дд, J=4,9 Гц, 1,7 Гц), 8,40 (1 Н, Д, J=2,1 Гц), 7,63 (1H, дт, J=8,0 Гц, 1,8 Гц), 7,43-7,39 (2 Н, м), 7,33-7,30 (2 Н, м), 7,24-7,21 (2 Н, м), 7,03 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,16 (2 Н, т, J=5,6 Гц), 3,74 (4 Н, т, J=4,8 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,6 Гц). Пример 29. Синтез 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(3,4-дифторфенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-хлорфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 28, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 3,4 дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/4) с получением указанного в заголовке соединения (43%). 1H-ЯМР (CDCl3, 300 МГц)7,44-7,41 (2 Н, м), 7,32-7,29 (2 Н, м), 7,20 (1 Н, д, J=2,4 Гц), 7,14-6,99 (3 Н,м), 6,95-6,83 (1 Н, м), 6,82 (1 Н, дд, J=2,0 Гц, 7,7 Гц), 4,16 (2 Н, т, J=5,6 Гц), 3,74 (4 Н, т, J=4,7 Гц), 2,82 (2 Н,т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 30. Синтез 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-хлорфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 28, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 5 пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 2/3) с получением указанного в заголовке соединения (71%). 1H-ЯМР (CDCl3, 300 МГц)9,07 (1 Н, с), 8,63 (2 Н, с), 7,46 (2 Н, д, J=8,3 Гц), 7,30 (2 Н, д, J=8,3 Гц),7,24 (1 Н, д, J=2,3 Гц), 7,05 (1 Н, д, J=8,1 Гц), 6,86 (1 Н, дд, J=2,3 Гц, 8,1 Гц), 4,18 (2 Н, т, J=5,6 Гц), 3,75 (4 Н,т, J=4,6 Гц), 2,84 (2 Н, т, J=5,6 Гц), 2,66 (4H, т, J=6,1 Гц). Пример 31. Синтез 6-(2-морфолиноэтокси)-3-(4-хлорфенил)-2-(4-(трифторметил)фенил)-1 Н-инден 1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-хлорфенил)-1 Н-инден-1-он, полученный на стадии 6 примера 28, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 4(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (14%). 1H-ЯМР (CDCl3, 300 МГц)7,53 (2 Н, д, J=8,3 Гц), 7,43-7,40 (2 Н, м), 7,30-7,29 (4 Н, м), 7,22 (1 Н, д,J=2,2 Гц), 7,03 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,17 (2 Н, т, J=5,6 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 32. Синтез 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиридин-3-ил)-1 Н-инден 1-она Стадия 1. (Е)-3-(4-(Трифторметил)фенил)-1-(3-гидроксифенил)проп-2-ен-1-он Повторяли методику, описанную на стадии 1 примера 1, за исключением того, что в качестве исходного вещества использовали 4-(трифторметил)бензальдегид вместо бензальдегида и перемешивали в течение 28 ч с получением указанного в заголовке соединения (99%). 1 Стадия 2. 3-(4-(Трифторметил)фенил)-2,3-дигидро-6-гидроксиинден-1-он Повторяли методику, описанную на стадии 2 примера 1, за исключением того, что в качестве исходного вещества использовали (Е)-3-(4-(трифторметил)фенил)-1-(3-гидроксифенил)проп-2-ен-1-он, полученный на стадии 1, вместо (Е)-1-(3-гидроксифенил)-3-фенилпроп-2-ен-1-она и перемешивали в течение 5 суток с получением указанного в заголовке соединения (38%). 1H-ЯМР (ДМСО, 300 МГц)7,7 (2 Н, д, J=14,8 Гц), 7,4 (2 Н, д, J=16,1 Гц), 7,1 (2 Н, д, J=6,8 Гц), 7,06,1 (1 Н, м), 4,6 (1 Н, дд, J=3,4 Гц, 7,9 Гц), 3,2 (1 Н, дд, J=6,7 Гц, 17,6 Гц), 2,5 (1 Н, дд, J=2,8 Гц, 16,5 Гц). Стадия 3. 1-(4-(Трифторметил)фенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат Повторяли методику, описанную на стадии 3 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(4-(трифторметил)фенил)-2,3-дигидро-6-гидроксиинден-1-он, полученный на стадии 2, вместо 2,3-дигидро-6-гидрокси-3-фенилинден-1-она и перемешивали в течение 3 ч с получением указанного в заголовке соединения (99%). 1H-ЯМР (ДМСО, 300 МГц)7,7 (2 Н, д, J=8,0 Гц), 7,5-7,4 (4 Н, м), 7,3 (1 Н, д, J=8,2 Гц), 4,8 (1 Н, дд,J=3,7 Гц, 7,9 Гц), 3,3 (1 Н, дд, J=8,0 Гц, 3,7 Гц), 2,7 (1 Н, дд, J=3,8 Гц, 19 Гц). Стадия 4. 2-Бром-3-(4-(трифторметил)фенил)-1-оксо-1 Н-инден-6-илацетат Повторяли методику, описанную на стадии 4 примера 1, за исключением того, что в качестве исходного вещества использовали 1-(4-(трифторметил)фенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат,полученный на стадии 3, вместо 2,3-дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетата и кипятили с обратным холодильником в течение 6 ч при облучении светом лампы накаливания (375 Вт) с получением указанного в заголовке соединения (67%). 1(3 Н, с). Стадия 5. 2-Бром-3-(4-(трифторметил)фенил)-6-гидрокси-1 Н-инден-1-он Повторяли методику, описанную на стадии 5 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-(трифторметил)фенил)-1-оксо-1 Н-инден-6-илацетат, полученный на стадии 4, вместо 2-бром-1-оксо-3-фенил-1 Н-инден-6-илацетата и перемешивали в течение 7 ч с получением указанного в заголовке соединения (67%). 1H-ЯМР (ДМСО, 300 МГц)10,3 (1 Н, с, ОН), 7,9 (4 Н, дд, J=8,4 Гц, 16,7 Гц), 7,0-6,9 (2 Н, м), 6,8 (1 Н,дд, J=2,4 Гц, 8,3 Гц). Стадия 6. 6-(2-Морфолиноэтокси)-2-бром-3-(4-(трифторметил)фенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-(трифторметил)фенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 4/1) с получением указанного в заголовке соединенияH-ЯМР (CDCl3, 300 МГц)7,79 (4 Н, кв., J=7,6 Гц), 7,21 (1 Н, д, J=2,4 Гц), 6,97 (1 Н, д, J=8,1 Гц),6,79 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,14 (2 Н, т, J=5,7 Гц), 3,74 (4 Н, т, J=4,7 Гц), 2,81 (2 Н, т, J=5,7 Гц), 2,58 (4 Н,т, J=4,7 Гц). Стадия 7. 6-(2-Морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-(трифторметил)фенил)-1 Н-инден-1 он, полученный на стадии 6, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 2/1) с получением указанного в заголовке соединения (75%). 1H-ЯМР (CDCl3, 300 МГц)8,48 (2 Н, д, J=3,6 Гц), 8,38 (1 Н, с), 7,71 (2 Н, д, J=8,1 Гц), 7,64 (1 Н, тд,J=2,0 Гц, 7,9 Гц), 7,50 (2 Н, т, J=8,1 Гц), 7,25 (2 Н, дд, J=3,5 Гц, 8,3 Гц), 7,00 (1 Н, д, J=8,1 Гц), 6,85 (1 Н, дд,J=2,4 Гц, 8,1 Гц), 4,17 (2 Н, т, J=5,6 Гц), 3,7 (4 Н, т, J=4,7 Гц), 2,8 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 33. Синтез 6-(2-морфолиноэтокси)-2,3-бис(4-(трифторметил)фенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-(трифторметил)фенил)-1 Н-инден-1 он, полученный на стадии 6 примера 32, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 4-(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O = 7/3) с получением указанного в заголовке соединения (40%). 1(2 Н, д, J=8,2 Гц), 7,23 (1 Н, д, J=2,4 Гц), 7,00 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,17 (2 Н, т,J=5,6 Гц), 3,75 (4 Н, т, J=4,7 Гц), 2,83 (2 Н, т, J=5,6 Гц), 2,60 (4 Н, т, J=4,6 Гц). Пример 34. Синтез 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(3,4-дифторфенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-(трифторметил)фенил)-1 Н-инден-1 он, полученный на стадии 6 примера 32, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O = 7/3) с получением указанного в заголовке соединения (31%). 1H-ЯМР (CDCl3, 300 МГц)7,71 (2 Н, д, J=8,1 Гц), 7,49 (2 Н, д, J=8,0 Гц), 7,22 (1 Н, д, J=2,3 Гц), 7,117,00 (2 Н, м), 6,96 (1 Н, д, J=8,1 Гц), 6,94-7,87 (1 Н, м), 6,83 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,16 (2 Н, т, J=5,7 Гц),3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 35. Синтез 6-(2-морфолиноэтокси)-3-(4-(трифторметил)фенил)-2-(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(4-(трифторметил)фенил)-1 Н-инден-1 он, полученный на стадии 6 примера 32, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 5-пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (25%). 1H-ЯМР (CDCl3, 300 МГц)9,08 (1 Н, с), 8,62 (2 Н, с), 7,75 (2 Н, д, J=8,1 Гц), 7,52 (2 Н, д, J=8,0 Гц),7,26 (1 Н, д, J=2,4 Гц), 7,02 (1 Н, д, J=8,1 Гц), 6,87 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,18 (2 Н, т, J=5,6 Гц), 3,75 (4 Н,т, J=4,7 Гц), 2,83 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 36. Синтез гидрохлорида 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)1 Н-инден-1-она Стадия 1. (Е)-3-(3,5-Дифторфенил)-1-(3-гидроксифенил)проп-2-ен-1-он Повторяли методику, описанную на стадии 1 примера 1, за исключением того, что в качестве исходного вещества использовали 3,5-дифторбензальдегид вместо бензальдегида и перемешивали в течение 22 ч с получением указанного в заголовке соединения (80%). 1H-ЯМР (ДМСО, 300 МГц)9,8 (1 Н, с, ОН), 8,0 (1 Н, д, J=15,6 Гц), 7,73-7,65 (3 Н, м), 7,5-7,3 (3 Н, м),7,2-7,0 (2 Н, м). Стадия 2. 3-(3,5-Дифторфенил)-2,3-дигидро-6-гидроксиинден-1-он Повторяли методику, описанную на стадии 2 примера 1, за исключением того, что в качестве исходного вещества использовали (Е)-3-(3,5-дифторфенил)-1-(3-гидроксифенил)проп-2-ен-1-он, полученный на стадии 1, вместо (Е)-1-(3-гидроксифенил)-3-фенилпроп-2-ен-1-она и перемешивали в течение 5 суток с получением указанного в заголовке соединения (99%). 1 Н-ЯМР (ДМСО, 300 МГц)9,9 (1 Н, с, ОН), 7,11-7,05 (3 Н, м), 7,0 (1 Н, дд, J=1,8 Гц, 14,8 Гц), 6,9(2 Н, м), 4,6 (1 Н, дд, J=3,6 Гц, 7,8 Гц), 3,2 (1 Н, дд, J=19 Гц, 7,8 Гц), 2,6 (1 Н, дд, J=3,8 Гц, 19 Гц). Стадия 3. 1-(3,5-Дифторфенил)-2,3-дигидро-3-оксо-1H-инден-5-илацетат Повторяли методику, описанную на стадии 3 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-2,3-дигидро-6-гидроксиинден-1-он, полученный на стадии 2, вместо 2,3-дигидро-6-гидрокси-3-фенилинден-1-она и перемешивали в течение 2 ч с получением указанного в заголовке соединения (83%). 1(3 Н, с). Стадия 4. 2-Бром-3-(3,5-дифторфенил)-1-оксо-1 Н-инден-6-илацетат Повторяли методику, описанную на стадии 4 примера 1, за исключением того, что в качестве исходного вещества использовали 1-(3,5-дифторфенил)-2,3-дигидро-3-оксо-1 Н-инден-5-илацетат, полученный на стадии 3, вместо 2,3-дигидро-1-оксо-3-фенил-1 Н-инден-6-илацетата и кипятили с обратным холодильником в течение 2 ч при облучении светом лампы накаливания (375 Вт) с получением указанного в заголовке соединения (67%). 1H-ЯМР (ДМСО, 300 МГц)7,56-7,41 (4 Н, м), 7,26-7,24 (2 Н, м), 2,3 (3 Н, с). Стадия 5. 2-Бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он Повторяли методику, описанную на стадии 5 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-1-оксо-1 Н-инден-6-илацетат, полученный на стадии 4, вместо 2-бром-1-оксо-3-фенил-1 Н-инден-6-илацетата и перемешивали в течение 2,5 ч с получением указанного в заголовке соединения (64%). 1H-ЯМР (ДМСО, 300 МГц)7,53-7,45 (1 Н, м), 7,42-7,35 (2 Н, м), 6,99 (1 Н, д, J=8,1 Гц), 6,96 (1 Н, д,J=2,1 Гц), 6,8 (1 Н, дд, J=2,4 Гц, 8,1 Гц). Стадия 6. 6-(2-Морфолиноэтокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он (700 мг, 2,1 ммоль), полученный на стадии 5, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (67%). 1 Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он,полученный на стадии 6, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (40%). 1(4 Н, т, J=4,7 Гц), 2,83 (2 Н, т, J=5,7 Гц), 2,59 (4 Н, т, J=4,7 Гц). Стадия 8. Гидрохлорид 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1 Н-инден-1 она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиридин-3-ил)-1 Н-инден-1-он (500 мг, 1,21 ммоль), полученный на стадии 7, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она с получением указанного в заголовке соединения с количественным выходом. 1(2 Н, ушир.с), 3,96 (2 Н, ушир.с), 3,83 (2 Н, ушир.с), 3,57 (2 Н, ушир.с), 3,49 (2 Н, ушир.с), 3,23 (2 Н, ушир.с). Пример 37. Синтез 6-(2-морфолиноэтокси)-2-(4-(трифторметил)фенил)-3-(3,5-дифторфенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он,полученный на стадии 6 примера 36, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она, 4(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/2) с получением указанного в заголовке соединения (55%). 1(4 Н, т, J=4,7 Гц). Пример 38. Синтез 6-(2-морфолиноэтокси)-2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-1 Н-инден-1 она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он,полученный на стадии 6 примера 36, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (47%). 1(2 Н, м), 6,89 (1 Н, д, J=1,8 Гц), 6,87 (1 Н, д, J=2,1 Гц), 6,84 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,16 (2 Н, т, J=5,8 Гц),3,75 (4 Н, т, J=4,7 Гц), 2,82 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,7 Гц). Пример 39. Синтез 6-(2-морфолиноэтокси)-3-(3,5-дифторфенил)-2-(пиримидин-5-ил)-1 Н-инден-1 она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве, исходного вещества использовали 6-(2-морфолиноэтокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он,полученный на стадии б примера 36, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 5 пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (36%). 1H-ЯМР (CDCl3, 300 МГц)9,10 (1 Н, с), 8,64 (2 Н, с), 7,25 (1 Н, д, J=2,4 Гц), 7,04 (1 Н, д, J=8,1 Гц),7,00-6,87 (4 Н, м), 4,17 (2 Н, т, J=5,0 Гц), 3,74 (4 Н, т, J=4,7 Гц), 2,83 (2 Н, т, J=5,6 Гц), 2,59 (4 Н, т, J=4,6 Гц). Пример 40. Синтез дийодида 4-метил-4-(2-[2-(1-метилпиридин-1-иний-3-ил)-1-оксо-3-фенил-1 Нинден-6-ил]оксиэтил)морфолин-4-ия К раствору 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она (40 мг, 0,097 ммоль),полученного на стадии 7 примера 1, в CH2Cl2 (0,5 мл) добавляли MeI (60 мкл, 0,96 ммоль, 10 экв.). Смесь кипятили с обратным холодильником в течение 30 мин. Осадок собирали при помощи воронки Бюхнера,промывали CH2Cl2 (5 мл), а затем сушили в условиях высокого вакуума с получением указанного в заголовке соединения (4 мг, 59%). 1H-ЯМР (ДМСО, 300 МГц)8,91 (1 Н, с), 8,88 (1 Н, д, J=5,8 Гц), 8,09-7,99 (2 Н, м), 7,62-7,46 (5 Н, м),7,37 (1 Н, д, J=2,4 Гц), 7,30 (1 Н, д, J=8,2 Гц), 7,12 (1 Н, дд, J=2,4 Гц, 8,2 Гц), 4,66-4,60 (2 Н, м), 4,33 (3 Н, с),3,99-3,96 (м, 6 Н), 3,60-3,53 (4 Н, м), 3,28 (3 Н, с). Пример 41. Синтез йодида 1-метил-3-6-[2-(морфолин-4-ил)этокси]-1-оксо-3-фенил-1 Н-инден-2 илпиридин-1-ия Маточный раствор, полученный в примере 40, очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/MeOH=5/1) с получением указанного в заголовке соединения (9 мг, 17%). 1 м), 7,56 (5 Н, с), 7,25 (1 Н, д, J=1,8 Гц), 7,14 (1 Н, д, J=8,1 Гц), 6,89 (1 Н, дд, J=1,8 Гц, 8,1 Гц), 4,61 (3 Н, с),4,19 (2 Н, т, J=5,5 Гц), 3,75 (4 Н, д, J=4,4 Гц), 2,84 (2 Н, т, J=5,5 Гц), 2,59 (т, J=4,3 Гц, 4 Н). Пример 42. Синтез 4-оксидо-4-(2-[1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-ил]оксиэтил)морфолин-4-ия К раствору 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она (100 мг, 0,24 ммоль),полученного на стадии 7 примера 1, в CH2Cl2 (2 мл) при 10 С добавляли МСРВА (21 мг, 1 экв.). Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли EtOAc и промывали насыщенным NaHCO3, H2O и солевым раствором. Органический слой сушили над MgSO4 и концентрировали в условиях вакуума. Остаток очищали по методу колоночной хроматографии на силикагеле (MC/MeOH/NH4OH=92/7/1) с получением указанного в заголовке соединения (14 мг, 13%). 1(4 Н, т, J=4,7 Гц), 2,75 (2 Н, т, J=5,6 Гц), 2,52 (4 Н, т, J=4,7 Гц). Пример 43. Синтез 4-оксидо-4-(2-[2-(1-оксидопиридин-1-иний-3-ил)-1-оксо-3-фенил-1 Н-инден-6 ил]оксиэтил)морфолин-4-ия В процессе проведения колоночной хроматографии на силикагеле, описанной в примере 42, указанное в заголовке соединение получали в виде минорного продукта (7 мг, 7%). 1H-ЯМР (ДМСО, 300 МГц)8,44 (1 Н, дд, J=1,6 Гц, 4,8 Гц), 8,31 (1 Н, д, J=1,5 Гц), 7,59 (1 Н, дт, J=1,8 Гц, 7,9 Гц), 7,51-7,33 (6 Н, м), 7,22 (1 Н, д, J=2,2 Гц), 7,13 (1 Н, д, J=8,0 Гц), 7,07 (1 Н, ддт, J=2,3 Гц, 7,0 Гц),4,67 (2 Н, т, J=4,4 Гц), 4,16 (2 Н, т, J=11 Гц), 3,66 (2 Н, д, J=12 Гц), 3,58 (2 Н, т, J=4,4 Гц), 3,48 (2 Н, дт, J=12 Гц, 3,1 Гц), 2,89 (2 Н, д, J=11 Гц). Пример 44. Синтез трет-бутил-4-(2-(1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-илокси)этил)пиперазин-1-карбоксилата Стадия 1. 6-Гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-он, полученный на стадии 5 примера 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и перекристаллизовывали сH-ЯМР (ДМСО, 300 МГц)8,4 (1 Н, дд, J=2,5 Гц, 6,2 Гц), 8,2 (1 Н, д, J=1,6 Гц), 7,55-7,51 (1 Н, м),7,44-7,29 (5 Н, м), 6,98-6,96 (2 Н, м), 6,7 (1 Н, дд, J=2,2 Гц, 7,9 Гц). Стадия 2. трет-Бутил-4-(2-(1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-илокси)этил)пиперазин-1 карбоксилат Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 6-гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и трет-бутил-4-(2-гидроксиэтил)пиперазин 1-карбоксилат вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 19 ч и перекристаллизовывали с EtOAc с получением указанного в заголовке соединения (51%). 1(2 Н, т, J=5,6 Гц), 3,46 (4 Н, т, J=4,8 Гц), 2,84 (2 Н, т, J=5,6 Гц), 2,53 (4 Н, т, J=4,8 Гц), 1,47 (9 Н, с). Пример 45. Синтез гидрохлорида 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. 2-Бром-6-[2-(4-метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что использовали 24-метилсульфонил)пиперазин-1-ил)этан-1-ол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 6 ч и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/2) с получением указанного в заголовке соединения (81%). 1H-ЯМР (CDCl3, 300 МГц)7,65-7,53 (5 Н, м), 7,2 (1 Н, д, J=2,4 Гц), 7,04 (1 Н, д, J=8,1 Гц), 6,74 (1 Н,дд, J=2,4 Гц, 8,1 Гц), 4,12 (2 Н, т, J=5,4 Гц), 3,28 (4 Н, т, J=4,9 Гц), 2,87 (2 Н, т, J=5,4 Гц), 2,8 (3 Н, с), 2,7 (4 Н,т, J=4,9 Гц). Стадия 2. 6-[2-(4-(Метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1 он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-[2-(4-метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-1 Нинден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она, и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (70%). 1 Н-ЯМР (CDCl3, 300 МГц)8,5 (1 Н, дд, J=4,8 Гц, 1,5 Гц), 8,4 (1 Н, д, J=1,5 Гц), 7,6 (1 Н, тд, J=1,5 Гц,7,8 Гц), 7,44-7,35 (5 Н, м), 7,24-7,20 (2 Н, м), 7,1 (1 Н, д, J=8,1 Гц), 6,8 (1 Н, дд, J=2,1 Гц, 8,1 Гц), 4,2 (2 Н, т,J=5,6 Гц), 3,4 (4 Н, т, J=4,8 Гц), 2,8 (2 Н, т, J=5,6 Гц), 2,5 (4 Н, т, J=4,8 Гц), 1,5 (9 Н, с). Стадия 3. Гидрохлорид 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3- 22021353 ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-фенил-2-(пиридин-3 ил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. 1 Н-ЯМР (D2O, 300 МГц)8,44-8,42 (2 Н, м), 8,03 (1 Н, д, J=8,4 Гц), 7,64 (1 Н, дд, J=8,1 Гц, 6,3 Гц),7,44-7,34 (3 Н, м), 7,31-7,28 (2 Н, м), 7,11-7,09 (2 Н, м), 6,87 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,31 (2 Н, т, J=4,35 Гц), 3,57 (2 Н, т, J=4,65 Гц), 3,46 (8 Н, м), 2,95 (3 Н, с). Пример 46. Синтез 6-(2-(пиперазин-1-ил)этокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она К раствору трет-бутил-4-(2-(1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-илокси)этил)пиперазин 1-карбоксилата (0,38 ммоль, 200 мг), полученного на стадии 2 примера 44, в CH2Cl2 (0,3 М) добавлялиTFA (20 экв.). Полученную смесь перемешивали при комнатной температуре в течение 40 мин и разбавляли CH2Cl2. Раствор подщелачивали до рН 9 добавлением 3 н NaOH. Смесь промывали H2O, сушили надMgSO4 и концентрировали в условиях вакуума. Остаток очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (75%). 1 Н-ЯМР (CDCl3, 300 МГц)8,50-8,41 (2 Н, м), 7,64 (1 Н, д, J=7,3 Гц), 7,44-7,37 (5 Н, м), 7,27-7,21 (2 Н,м), 7,07 (1 Н, дд, J=2,8 Гц, 8,2 Гц), 6,83 (1 Н, дд, J=2,9 Гц, 7,8 Гц), 4,15 (2 Н, д, J=20 Гц), 2,94 (2 Н, д, J=7,6 Гц), 2,83 (2 Н, д, J=7,6 Гц), 2,69-2,53 (6 Н, м), 2,04 (1 Н, с). Пример 47. Синтез 6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-2,3-бис[4-(трифторметил)фенил]-1 Н-инден-1-она Стадия 1. 2-Бром-6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-[4-(трифторметил)фенил]-1 Нинден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-(трифторметил)фенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 32, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-4-метилсульфонил)пиперазин-1-ил)этан-1-ол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 2/1) с получением указанного в заголовке соединения (36%). 1 Н-ЯМР (CDCl3, 300 МГц)7,71 (2 Н, д, J=8,2 Гц), 7,53 (2 Н, д, J=8,7 Гц), 7,49 (2 Н, д, J=8,4 Гц), 7,33(2 Н, д, J=8,4 Гц), 7,24 (1 Н, д, J=2,4 Гц), 7,01 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,16 (2 Н, т,J=5,4 Гц), 3,29 (4 Н, т, J=4,9 Гц), 2,89 (2 Н, т, J=5,4 Гц), 2,79 (3 Н, с), 2,72 (4 Н, т, J=4,9 Гц). Стадия 2. 6-[2-(4-(Метилсульфонил)пиперазин-1-ил)этокси]-2,3-бис[4-(трифторметил)фенил]-1 Нинден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-[4-(трифторметил)фенил]-1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3 фенил-1 Н-инден-1-она и 4-(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (21%). 1 Н-ЯМР (CDCl3, 300 МГц)7,71 (2 Н, д, J=8,2 Гц), 7,53 (2 Н, д, J=8,7 Гц), 7,49 (2 Н, д, J=8,4 Гц), 7,33(2 Н, д, J=8,4 Гц), 7,24 (1 Н, д, J=2,4 Гц), 7,01 (1 Н, д, J=8,1 Гц), 6,84 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,16 (2 Н, т,J=5,4 Гц), 3,29 (4 Н, т, J=4,9 Гц), 2,89 (2 Н, т, J=5,4 Гц), 2,79 (3 Н, с), 2,72 (4 Н, т, J=4,9 Гц). Пример 48. Синтез 2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-3-(4(трифторметил)фенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-[4-(трифторметил)фенил]-1 Н-инден-1-он, полученный на стадии 1 примера 47, вместо 6-(2-морфолиноэтокси)-2 бром-3-фенил-1 Н-инден-1-она и 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (49%). 1 Н-ЯМР (CDCl3, 300 МГц)7,72 (2 Н, д, J=8,5 Гц), 7,49 (2 Н, д, J=8,4 Гц), 7,22 (1 Н, д, J=2,4 Гц), 7,127,03 (2 Н, м), 6,97 (1 Н, д, J=8,1 Гц), 6,93-6,87 (1 Н, м), 6,82 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,15 (2 Н, т, J=5,5 Гц),3,29 (4 Н, т, J=4,9 Гц), 2,89 (2 Н, т, J=5,5 Гц), 2,79 (3 Н, с), 2,71 (4 Н, т, J=4,9 Гц). Пример 49. Синтез 6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-3-(4-(трифторметил)фенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-3-[4-(трифторметил)фенил]-1 Н-инден-1-он, полученный на стадии 1 примера 47, вместо 6-(2-морфолиноэтокси)-2 бром-3-фенил-1 Н-инден-1-она и 5-пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (14%). Н-ЯМР (CDCl3, 300 МГц)9,09 (1 Н, с), 8,62 (2 Н, с), 7,75 (2 Н, д, J=8,1 Гц), 7,52 (2 Н, д, J=8,1 Гц),7,26 (1 Н, д, J=2,4 Гц), 7,03 (1 Н, д, J=8,1 Гц), 6,87 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,17 (2 Н, т, J=5,4 Гц), 3,29 (4 Н,т, J=4,8 Гц), 2,90 (2 Н, т, J=5,4 Гц), 2,80 (3 Н, с), 2,72 (4 Н, т, J=4,8 Гц). Пример 50. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(4-(трифторметил)фенил)-1 Н-инден-1-она Стадия 1. 2-Бром-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден 1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 36, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-4-метилсульфонил)пиперазин-1-ил)этан-1-ол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/4) с получением указанного в заголовке соединения (52%). 1H-ЯМР (CDCl3, 300 МГц)7,21-7,17 (4 Н, м), 7,02 (2 Н, д, J=8,1 Гц), 6,98 (2 Н, тд, J=8,0 Гц, 2,4 Гц),6,80 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,13 (2 Н, т, J=5,4 Гц), 3,28 (4 Н, т, J=4,8 Гц), 2,87 (2 Н, т, J=5,4 Гц), 2,79 (3 Н,с), 2,70 (4 Н, т, J=4,8 Гц). Стадия 2. 3-(3,5-Дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(4-(трифторметил)фенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1 ил)этокси)-1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Нинден-1-она и 4-(трифторметил)фенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (69%). 1 Н-ЯМР (CDCl3, 300 МГц)7,55 (2 Н, д, J=8,6 Гц), 7,35 (2 Н, д, J=8,7 Гц), 7,23 (1 Н, д, J=2,2 Гц), 7,03(3 Н, с), 2,72 (4 Н, т, J=4,8 Гц). Стадия 3. Гидрохлорид 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(4(трифторметил)фенил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)2-(4-(трифторметил)фенил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3 фенил-2-(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 51. Синтез гидрохлорида 2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-она Стадия 1. 2-(3,4-Дифторфенил)-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-[2-(4-(метилсульфонил)пиперазин-1 ил)этокси]-1 Н-инден-1-он, полученный на стадии 1 примера 50, вместо 6-(2-морфолиноэтокси)-2-бром-3 фенил-1 Н-инден-1-она и 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (57%). 1 Н-ЯМР (CDCl3, 300 МГц)7,21 (1 Н, д, J=2,3 Гц), 7,14-7,03 (2 Н, м), 6,99 (1 Н, д, J=8,1 Гц), 6,96-6,87(4 Н, м), 6,83 (1 Н, дд, J=2,4 Гц, 8,1 Гц), 4,15 (2 Н, т, J=5,4 Гц), 3,28 (4 Н, т, J=4,8 Гц), 2,88 (2 Н, т, J=5,4 Гц),2,79 (3 Н, с), 2,71 (4 Н, т, J=4,8 Гц). Стадия 2. Гидрохлорид 2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 2-(3,4-дифторфенил)-3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 52. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-1 Н-инден-1-она Стадия 1. 3-(3,5-Дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5 ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-[2-(4-(метилсульфонил)пиперазин-1 ил)этокси]-1 Н-инден-1-он, полученный на стадии 1 примера 50, вместо 6-(2-морфолиноэтокси)-2-бром-3- 24021353 фенил-1 Н-инден-1-она и 5-пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (34%). 1 Н-ЯМР (CDCl3, 300 МГц)9,11 (1 Н, с), 8,64 (2 Н, с), 7,25 (1 Н, д, J=2,4 Гц), 7,05 (1 Н, д, J=8,1 Гц),6,94-6,86 (4 Н, м), 4,17 (2 Н, т, J=5,4 Гц), 3,29 (4 Н, т, J=4,9 Гц), 2,9 (2 Н, т, J=5,4 Гц), 2,80 (3 Н, с), 2,73 (4 Н,т, J=4,9 Гц). Стадия 2. Гидрохлорид 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)2-(пиримидин-5-ил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 53. Синтез гидрохлорида 3-(4-хлорфенил)-2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-она Стадия 1. 2-Бром-3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-хлорфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 28, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-4-метилсульфонил)пиперазин-1-ил)этан-1-ол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 20 ч и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 2/3) с получением указанного в заголовке соединения (44%). 1H-ЯМР (CDCl3, 300 МГц)7,57 (4 Н, кв., J=12,2 Гц), 7,20 (1 Н, д, J=2,4 Гц), 7,00 (1 Н, д, J=8,1 Гц),6,78 (1 Н, дд, J=8,3 Гц, 2,3 Гц), 4,12 (2 Н, т, J=5,4 Гц), 3,28 (4 Н, т, J=4,8 Гц), 2,87 (2 Н, т, J=5,4 Гц), 2,79 (3 Н,с), 2,70 (4 Н, т, J=4,8 Гц). Стадия 2. 3-(4-Хлорфенил)-2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Нинден-1-она и 3,4-дифторфенилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения(50%). 1 Н-ЯМР (CDCl3, 300 МГц)7,43 (2 Н, д, J=8,7 Гц), 7,31 (2 Н, д, J=8,0 Гц), 7,20 (1 Н, д, J=2,1 Гц), 7,156,99 (3 Н, м), 6,96-6,91 (1 Н, м), 6,82 (1 Н, дд, J=8,1 Гц, 2,4 Гц), 4,15 (2 Н, т, J=4,8 Гц), 3,29 (4 Н, т, J=15,4 Гц),2,89 (2 Н, т, J=4,8 Гц), 2,80 (3 Н, с), 2,72 (4 Н, т, J=5,4 Гц). Стадия 3. Гидрохлорид 3-(4-хлорфенил)-2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин 1-ил)этокси)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(4-хлорфенил)-2-(3,4-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 54. Синтез гидрохлорида 3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-1 Н-инден-1-она Стадия 1. 3-(4-Хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-1 Н-инден-1-он, полученный на стадии 1 примера 53, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и 5-пиримидинилбороновую кислоту вместо 3-пиридинилбороновой кислоты и очищали по методу препаративной ВЭЖХ (CH3CN/H2O=7/3) с получением указанного в заголовке соединения (50%). 1H-ЯМР (CDCl3, 300 МГц)9,08 (1 Н, с), 8,63 (2 Н, с), 7,46 (2 Н, д, J=8,7 Гц), 7,33 (2 Н, д, J=8,5 Гц),7,24 (1 Н, д, J=2,3 Гц), 7,06 (1 Н, д, J=8,0 Гц), 6,86 (2 Н, дд, J=2,5 Гц, 8,1 Гц), 4,16 (2 Н, т, J=4,8 Гц), 3,29 (4 Н,т, J=5,4 Гц), 2,89 (2 Н, т, J=4,8 Гц), 2,79 (3 Н, с), 2,72 (4 Н, т, J=5,4 Гц). Стадия 2. Гидрохлорид 3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиримидин-5-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(4-хлорфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2(пиримидин-5-ил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2- 25021353(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 55. Синтез трет-Бутил-4-(3-(1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-илокси)пропил)пиперазин-1-карбоксилата Стадия 1. 6-Гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-он, полученный на стадии 1 примера 5, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и перекристаллизовывали сEtOAc с получением указанного в заголовке соединения (34%). 1 Н-ЯМР (ДМСО, 300 МГц)8,4 (1 Н, дд, J=2,5 Гц, 6,2 Гц), 8,2 (1 Н, д, J=1,6 Гц), 7,55-7,51 (1 Н, м),7,44-7,29 (5 Н, м), 6,98-6,96 (2 Н, м), 6,7 (1 Н, дд, J=2,2 Гц, 7,9 Гц). Стадия 2. трет-Бутил-4-(3-(1-оксо-3-фенил-2-(пиридин-3-ил)-1 Н-инден-6-илокси)пропил)пиперазин-1-карбоксилат Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 6-гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и трет-бутил-4-(3-гидроксипропил)пиперазин-1-карбоксилат вместо 4-(2-гидроксиэтил)морфолина перемешивали в течение 19 ч и перекристаллизовывали с EtOAc с получением указанного в заголовке соединения (45%). 1(2 Н, т, J=6,3 Гц), 3,45 (4 Н, т, J=5,0 Гц), 2,53 (2 Н, т, J=7,2 Гц), 2,41 (4 Н, т, J=5,0 Гц), 2,02 (2 Н, т, J=8,7 Гц),1,46 (9 Н, с). Пример 56. Синтез гидрохлорида 6-(2-(диметиламино)этокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден 1-она Стадия 1. 6-(2-(Диметиламино)этокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 6-гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1 примера 55, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-(диметиламино)этанол вместо 4-(2-гидроксиэтил)морфолина и перекристаллизовывали с EtOAc с получением указанного в заголовке соединения (45%). 1 Н-ЯМР (CDCl3, 300 МГц)8,42 (2 Н, с), 7,64 (1 Н, д, J=7,9 Гц), 7,44-7,38 (5 Н, м), 7,22 (2 Н, д, J=1,3 Гц), 7,06 (1 Н, д, J=8,1 Гц), 6,85 (1 Н, дд, J=2,5 Гц, 8,1 Гц), 4,13 (2 Н, т, J=5,5 Гц), 2,71 (2 Н, т, J=5,5 Гц), 2,36(6 Н, с). Стадия 2. Гидрохлорид 6-(2-(диметиламино)этокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(2-(диметиламино)этокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он,полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 57. Синтез гидрохлорида 6-(3-(диметиламино)пропокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. 6-(3-(Диметиламино)пропокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 6-гидрокси-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1 примера 55, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 3-(диметиламино)пропанол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и перекристаллизовывали сH-ЯМР (CDCl3, 300 МГц)8,44 (1 Н, дд, J=1,4 Гц, 4,9 Гц), 8,42 (1 Н, д, J=2,2 Гц), 7,64 (1 Н, тд, J=1,7 Гц, 9,7 Гц), 7,44-7,35 (5 Н, м), 7,21 (2 Н, кв., J=4,3 Гц), 7,05 (1 Н, д, J=8,1 Гц), 6,82 (1 Н, дд, J=2,3 Гц, 8,02 Гц), 4,08 (2 Н, т, J=6,4 Гц), 2,46 (2 Н, т, J=7,2 Гц), 2,26 (6 Н, с), 1,98 (2 Н, т, J=7,0 Гц). Стадия 2. Гидрохлорид 6-(3-(диметиламино)пропокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(3-(диметиламино)пропокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1 он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 58. Синтез трет-бутил-4-(2-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1 Н-инден-6-илокси)этил)пиперазин-1-карбоксилата Стадия 1. трет-Бутил-4-(2-(2-бром-3-(3,5-дифторфенил)-1-оксо-1 Н-инден-6-илокси)этил)пиперазин 1-карбоксилат Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 36, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и трет-бутил-4-(2-гидрокси- 26021353 этил)пиперазин-1-карбоксилат вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и очищали по методу колоночной хроматографии на силикагеле (EtOAc/гексаны = 1/4) с получением указанного в заголовке соединения. 1 Н-ЯМР (CDCl3, 300 МГц)7,18-7,16 (3 Н, м), 7,02-6,94 (2 Н, м), 6,80 (1 Н, дд, J=8,1 Гц, 2,5 Гц), 4,13(1 Н, т, J=5,6 Гц), 3,46 (2 Н, т, J=5,0 Гц), 2,83 (4 Н, т, J=5,6 Гц), 1,47 (9 Н, с). Стадия 2. трет-Бутил-4-(2-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1 Н-инден-6-илокси)этил)пиперазин-1-карбоксилат Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что использовали в качестве исходного вещества трет-бутил-4-(2-(2-бром-3-(3,5-дифторфенил)-1-оксо-1 Н-инден-6-илокси)этил)пиперазин-1-карбоксилат, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3 фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаныH-ЯМР (CDCl3, 300 МГц)8,50 (1 Н, дд, J=1,5 Гц, 4,8 Гц), 8,4 (1 Н, д, J=2,0 Гц), 7,65 (1 Н, тд, J=2,0 Гц, 7,9 Гц), 7,27 (1 Н, д, J=4,1 Гц), 7,22 (1 Н, д, J=2,3 Гц), 7,02 (1 Н, д, J=8,1 Гц), 6,90-6,84 (4 Н, м), 4,16 (2 Н,т, J=5,6 Гц), 3,47 (4 Н, т, J=4,9 Гц), 2,84 (2 Н, т, J=5,6 Гц), 2,54 (4 Н, т, J=4,9 Гц), 1,47 (9 Н, с). Пример 59. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиридин-3-ил)-1 Н-инден-1-она Стадия 1. 2-Бром-3-(3,5-дифторфенил)-6-[2-(4-(метилсульфонил)пиперазин-1-ил)этокси]-1 Н-инден 1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 36, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-(4-(метилсульфонил)пиперазин-1-ил)этанол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/EtOAc = 1/2) с получением указанного в заголовке соединения (99%). 1(2 Н, т, J=5,5 Гц), 3,28 (4 Н, т, J=4,8 Гц), 2,88 (2 Н, т, J=5,4 Гц), 2,79 (3 Н, с), 2,71 (4 Н, т, J=4,9 Гц). Стадия 2. 3-(3,5-Дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2-(пиридин-3-ил)1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-[2-(4-(метилсульфонил)пиперазин-1 ил)этокси]-1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Нинден-1-она и очищали по методу колоночной хроматографии на силикагеле (ацетон/гексаны = 1/1) с получением указанного в заголовке соединения (79%). 1H-ЯМР (CDCl3, 300 МГц)8,50 (1 Н, д, J=4,6 Гц), 8,4 (1 Н, с), 7,65 (1 Н, дд, J=1,5 Гц, 7,8 Гц), 7,297,23 (2 Н, м), 7,03 (1 Н, д, J=8,0 Гц), 6,89-6,87 (4 Н, м), 4,16 (2 Н, т, J=5,4 Гц), 3,29 (4 Н, т, J=4,8 Гц), 2,89 (2 Н,т, J=5,4 Гц), 2,79 (3 Н, с), 2,72 (4 Н, т, J=4,8 Гц). Стадия 3. Гидрохлорид 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)-2(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(2-(4-(метилсульфонил)пиперазин-1-ил)этокси)2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 60. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(3-(диметиламино)пропокси)-2-(пиридин 3-ил)-1 Н-инден-1-она Стадия 1. 6-(3-(Диметиламино)пропокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 36, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 3-(диметиламино)пропанол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 4 суток и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/EtOAc=1/1) с получением указанного в заголовке соединения(2 Н, т, J=6,4 Гц), 2,44 (2 Н, т, J=7,2 Гц), 2,25 (6 Н, с), 1,98-1,96 (2 Н, м). Стадия 2. 3-(3,5-Дифторфенил)-6-(3-(диметиламино)пропокси)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 6-(3-(диметиламино)пропокси)-2-бром-3-(3,5-дифторфенил)-1 Н-инден-1 он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-2-бром-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/МеОН=9/1) с получением указанного в заголовке соединения (52%).H-ЯМР (CDCl3, 300 МГц)8,49 (1 Н, дд, J=4,8 Гц, 1,6 Гц), 8,40 (1 Н, д, J=1,8 Гц), 7,65 (1 Н, тд, J=1,8 Гц, 8,0 Гц), 7,29-7,25 (1 Н, м), 7,22 (1 Н, д, J=2,3 Гц), 7,01 (1 Н, д, J=8,1 Гц), 6,92-6,82 (4 Н, м), 4,08 (2 Н, т,J=6,4 Гц), 2,48 (2 Н, т, J=7,2 Гц), 2,27 (6 Н, с), 2,05-1,96 (2 Н, м). Стадия 3. Гидрохлорид 3-(3,5-дифторфенил)-6-(3-(диметиламино)пропокси)-2-(пиридин-3-ил)-1 Нинден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(3-(диметиламино)пропокси)-2-(пиридин-3-ил)1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Нинден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 61. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-фенэтокси-2-(пиридин-3-ил)-1 Н-инден-1 она Стадия 1. 3-(3,5-Дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 7 примера 1, за исключением того, что в качестве исходного вещества использовали 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он, полученный на стадии 5 примера 36, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/EtOAc=2/1) с получением указанного в заголовке соединения(76%). 1 Н-ЯМР (ДМСО, 300 МГц)10,25 (1 Н, с, ОН), 8,41 (1 Н, дд, J=1,5 Гц, 4,7 Гц), 8,27 (1 Н, д, J=1,7 Гц),7,52 (1 Н, тд, J=1,9 Гц, 7,9 Гц), 7,39-7,29 (2 Н, м), 7,10-7,07 (2 Н, м), 6,97-6,94 (2 Н, м), 6,76 (1 Н, дд, J=2,2 Гц,8,1 Гц). Стадия 2. 3-(3,5-Дифторфенил)-6-фенэтокси-2-(пиридин-3-ил)-1 Н-инден-1-он К раствору 3-(3,5-дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-она (0,15 моль, 50 мг),полученного на стадии 1, в CH3CN добавляли K2CO3 (1,5 экв.). По каплям добавляли 1-(2-бромэтил)бензол (1,5 экв.) и кипятили полученную смесь с обратным холодильником в течение 3 суток. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc. Органический слой промывали H2O, сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения (30%). 1 Н-ЯМР (CDCl3, 300 МГц)8,50 (1 Н, д, J=3,7 Гц), 8,39 (1 Н, с), 7,65 (1 Н, тд, J=1,8 Гц, 8,0 Гц), 7,347,20 (8 Н, м), 7,00 (1 Н, д, J=8,1 Гц), 6,88-6,81 (3 Н, м), 4,23 (2 Н, т, J=7,0 Гц), 3,12 (2 Н, т, J=7,0 Гц). Стадия 3. Гидрохлорид 3-(3,5-дифторфенил)-6-фенэтокси-2-(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-фенэтокси-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 2, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 62. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(2-(пиридин-2-ил)этокси)-2-(пиридин-3 ил)-1 Н-инден-1-она Стадия 1. 3-(3,5-Дифторфенил)-6-(2-(пиридин-2-ил)этокси)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1 примера 61, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-(пиридин-2 ил)этанол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 7 суток и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/EtOAc=1/4) с получением указанного в заголовке соединения (45%). 1H-ЯМР (CDCl3, 300 МГц)8,57 (1 Н, д, J=4,6 Гц), 8,5 (1 Н, д, J=4,4 Гц), 8,39 (1 Н, с), 7,67-7,63 (2 Н,м), 7,28-7,16 (4 Н, м), 7,00 (1 Н, д, J=8,1 Гц), 6,88-6,83 (4 Н, м), 4,43 (2 Н, т, J=6,6 Гц), 3,29 (2 Н, т, J=6,6 Гц). Стадия 2. Гидрохлорид 3-(3,5-дифторфенил)-6-(2-пиридин-2-ил)этокси)-2-(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(2-(пиридин-2-ил)этокси)-2-(пиридин-3-ил)-1 Нинден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Н-инден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 63. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(2-(пиперидин-1-ил)этокси)-2-(пиридин-3 ил)-1 Н-инден-1-она Стадия 1. 3-(3,5-Дифторфенил)-6-(2-(пиперидин-1-ил)этокси)-2-(пиридин-3-ил)-1 Н-инден-1-он Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1 примера 61, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и 2-(пиперидин-1 ил)этанол вместо 4-(2-гидроксиэтил)морфолина, перемешивали в течение 3 ч и очищали по методу колоночной хроматографии на силикагеле (CH2Cl2/EtOAc=1/4) с получением указанного в заголовке соединения (37%). 1 Гц, 7,4 Гц), 7,28-7,24 (1 Н, м), 7,22 (1 Н, д, J=2,4 Гц), 7,01 (1 Н, д, J=8,1 Гц), 6,90-6,83 (4 Н, м), 4,16 (2 Н, т,J=5,9 Гц), 2,79 (2 Н, т, J=5,9 Гц), 2,52 (4 Н, т, J=5,1 Гц), 1,64-1,59 (4 Н, м), 1,27-1,25 (2 Н, м). Стадия 2. Гидрохлорид 3-(3,5-дифторфенил)-6-(2-(пиперидин-1-ил)этокси)-2-(пиридин-3-ил)-1 Нинден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(2-(пиперидин-1-ил)этокси)-2-(пиридин-3-ил)1 Н-инден-1-он, полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2-(пиридин-3-ил)-1 Нинден-1-она, с получением указанного в заголовке соединения с количественным выходом. Пример 64. Синтез трет-бутил-4-(3-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1 Н-инден-6-илокси)пропил)пиперазин-1-карбоксилата Стадия 1. 3-(3,5-Дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он В реакционную пробирку, пригодную для обработки микроволновым излучением, последовательно добавляли 2-бром-3-(3,5-дифторфенил)-6-гидрокси-1 Н-инден-1-он (302,7 мг, 0,90 ммоль), полученный на стадии 5 примера 36, 3-пиридинилбороновую кислоту (165,5 мг, 1,5 экв.), Pd(PPh3)4 (62,4 мг, 6 мол.%),Na2CO3 (286,1 мг, 3,0 экв.) и диоксан/H2O (4/1, 5 мл). Смесь помещали в микроволновой реактор и обрабатывали при 150 С в течение 20 мин. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc. Смесь сушили над MgSO4 и фильтровали через слой целита. Жидкость концентрировали на роторном испарителе в условиях пониженного давления. Остаток растворяли в CH2Cl2 и удаляли нерастворимые твердые вещества путем фильтрования. Раствор концентрировали в условиях вакуума с получением указанного в заголовке соединения (230 мг, 76%). 1H-ЯМР (ДМСО, 300 МГц)8,41 (1 Н, д, J=5,1 Гц), 8,27 (1 Н, д, J=2,4 Гц), 7,53 (1 Н, д, J=8,1 Гц),7,35-7,30 (2 Н, м), 7,10 (2 Н, д, J=3,6 Гц), 6,97-6,93 (2 Н, м), 6,78-6,73 (1 Н, м). Стадия 2. трет-Бутил-4-(3-(3-(3,5-дифторфенил)-1-оксо-2-(пиридин-3-ил)-1 Н-инден-6-илокси)пропил)пиперазин-1-карбоксилат Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и трет-бутил-4-(3-гидроксипропил)пиперазин-1-карбоксилат (2,0 экв.) вместо 4-(2-гидроксиэтил)морфолина, с использованием 2 эквивалентов PPh3 и DIAD и перемешивали в течение 19 ч с получением указанного в заголовке соединения (85%). 1H-ЯМР (CDCl3, 300 МГц)8,50 (1 Н, дд, J=4,65 Гц, 1,35 Гц), 8,40 (1 Н, д, J=2,1 Гц), 7,65 (2 Н, д,J=8,1 Гц), 7,25-7,22 (1 Н, м), 7,22 (1 Н, д, J=3 Гц), 7,02 (1 Н, д, J=7,8 Гц), 6,91-6,83 (3 Н, м), 4,09 (2 Н, т, J=6 Гц), 3,45 (4 Н, т, J=4,95 Гц), 2,54 (2 Н, т, J=7,2 Гц), 2,42 (4 Н, т, J=4,8 Гц), 2,04-1,95 (2 Н, м), 1,47 (9 Н, с). Пример 65. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(3-(4-метилпиперазин-1-ил)пропокси)-2(пиридин-3-ил)-1 Н-инден-1-она Повторяли методику, описанную на стадии 6 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-гидрокси-2-(пиридин-3-ил)-1 Н-инден-1-он, полученный на стадии 1 примера 64, вместо 2-бром-6-гидрокси-3-фенил-1 Н-инден-1-она и трет-бутил-3-(4 метилпиперазин-1-ил)пропан-1-ол (2,0 экв.) вместо 4-(2-гидроксиэтил)морфолина, с использованием 2 эквивалентов PPh3 и DIAD, перемешивали в течение 34 ч и очищали по методу препаративной ВЭЖХ(20% H2O/CH3CN) с получением 3-(3,5-дифторфенил)-6-(3-(4-метилпиперазин-1-ил)пропокси)-2-(пиридин-3-ил)-1 Н-инден-1-она, который обрабатывали HCl/диоксаном в соответствии с методикой, описанной на стадии 8 примера 1 (50% в 2 этапа). 1H-ЯМР (CDCl3, 300 МГц)8,52 (1 Н, с), 8,40 (1 Н, д, J=5,7 Гц), 7,98 (1 Н, д, J=8,1 Гц), 7,65-7,55 (1 Н,м), 7,25-7,20 (1 Н, м), 7,10-7,00 (2 Н, м), 6,91-6,85 (3 Н, м), 4,17 (2 Н, т, J=5,7 Гц), 3,52-3,38 (6 Н, м), 3,11 (2 Н,м), 2,93-2,85 (5 Н, м), 2,23 (2 Н, м). Пример 66. Синтез гидрохлорида 3-(3,5-дифторфенил)-6-(3-(пиперазин-1-ил)пропокси)-2-(пиридин 3-ил)-1 Н-инден-1-она Стадия 1. 3-(3,5-Дифторфенил)-6-(3-(пиперазин-1-ил)пропокси)-2-(пиридин-3-ил)-1 Н-инден-1-он В круглодонную колбу емкостью 10 мл загружали трет-бутил-4-(3-(3-(3,5-дифторфенил)-1-оксо-2(пиридин-3-ил)-1 Н-инден-6-илокси)пропил)пиперазин-1-карбоксилат (107,5 мг, 0,19 ммоль), полученный на стадии 2 примера 64, и CH2Cl2 (2 мл, 0,1 М). При 0 С по каплям в течение 5 мин добавляли трифторуксусную кислоту (0,6 мл, 40,0 экв.). После перемешивания в течение 2 ч реакционную смесь гасили добавлением H2O и промывали CH2Cl2. Водный слой подщелачивали до рН 9 добавлением 15% раствораNaOH и экстрагировали CH2Cl2. Экстракты концентрировали в условиях вакуума с получением указанного в заголовке соединения (80 мг, 93%). Стадия 2. Гидрохлорид 3-(3,5-дифторфенил)-6-(3-(пиперазин-1-ил)пропокси)-2-(пиридин-3-ил)-1 Нинден-1-она Повторяли методику, описанную на стадии 8 примера 1, за исключением того, что в качестве исходного вещества использовали 3-(3,5-дифторфенил)-6-(3-(пиперазин-1-ил)пропокси)-2-(пиридин-3-ил)1 Н-инден-1-он (4,7 мг, 0,01 ммоль), полученный на стадии 1, вместо 6-(2-морфолиноэтокси)-3-фенил-2- 29
МПК / Метки
МПК: C07D 265/33
Метки: содержащая, композиция, производное, инденона, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/30-21353-proizvodnoe-indenona-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Производное инденона и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Способ получения липосомальной формы кверцетина
Следующий патент: Устройство, регулирующее подачу сжатого воздуха для аппарата сипап и соответствующей системы сипап
Случайный патент: Узел иглы в системе предварительно заполненного шприца












