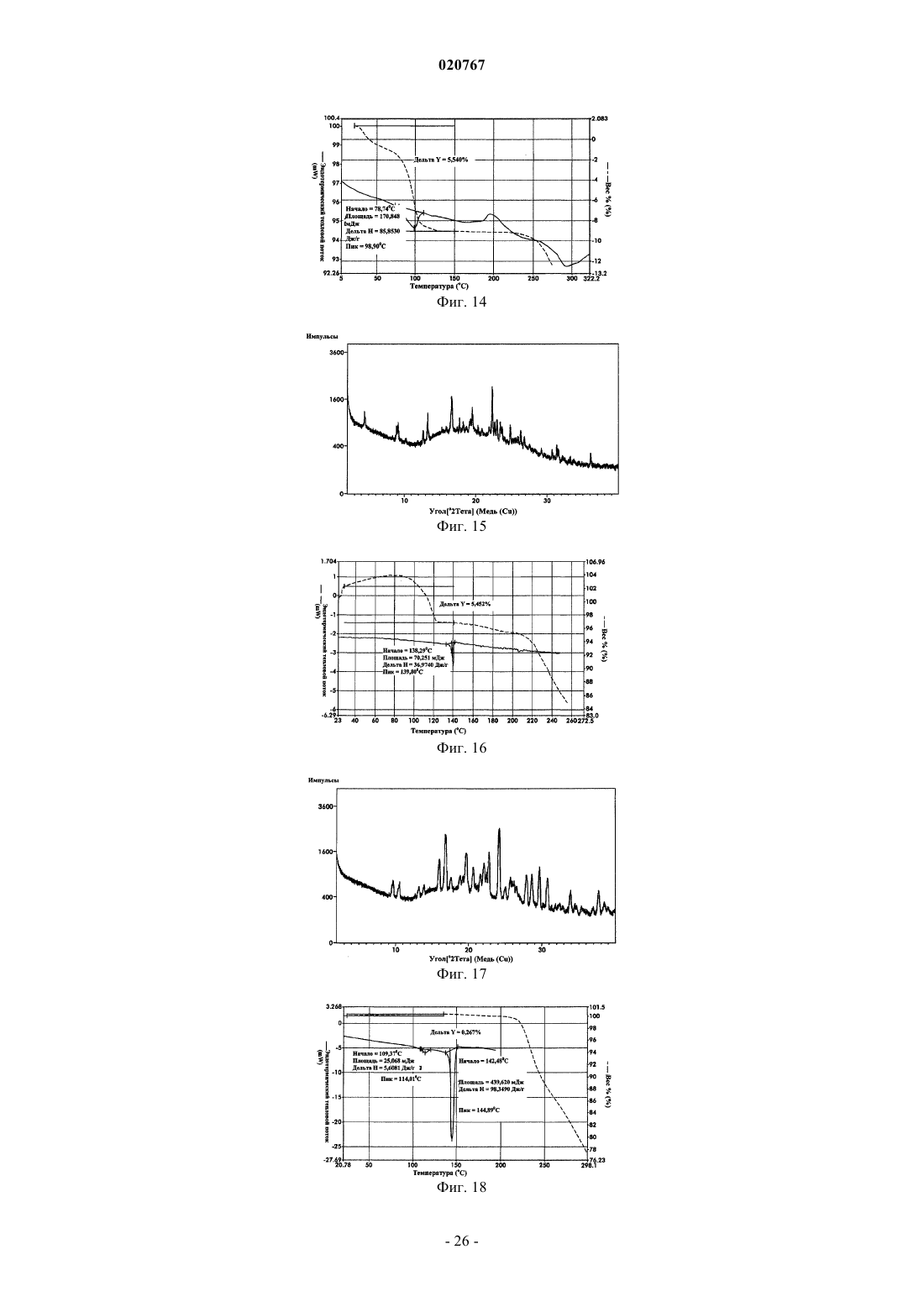
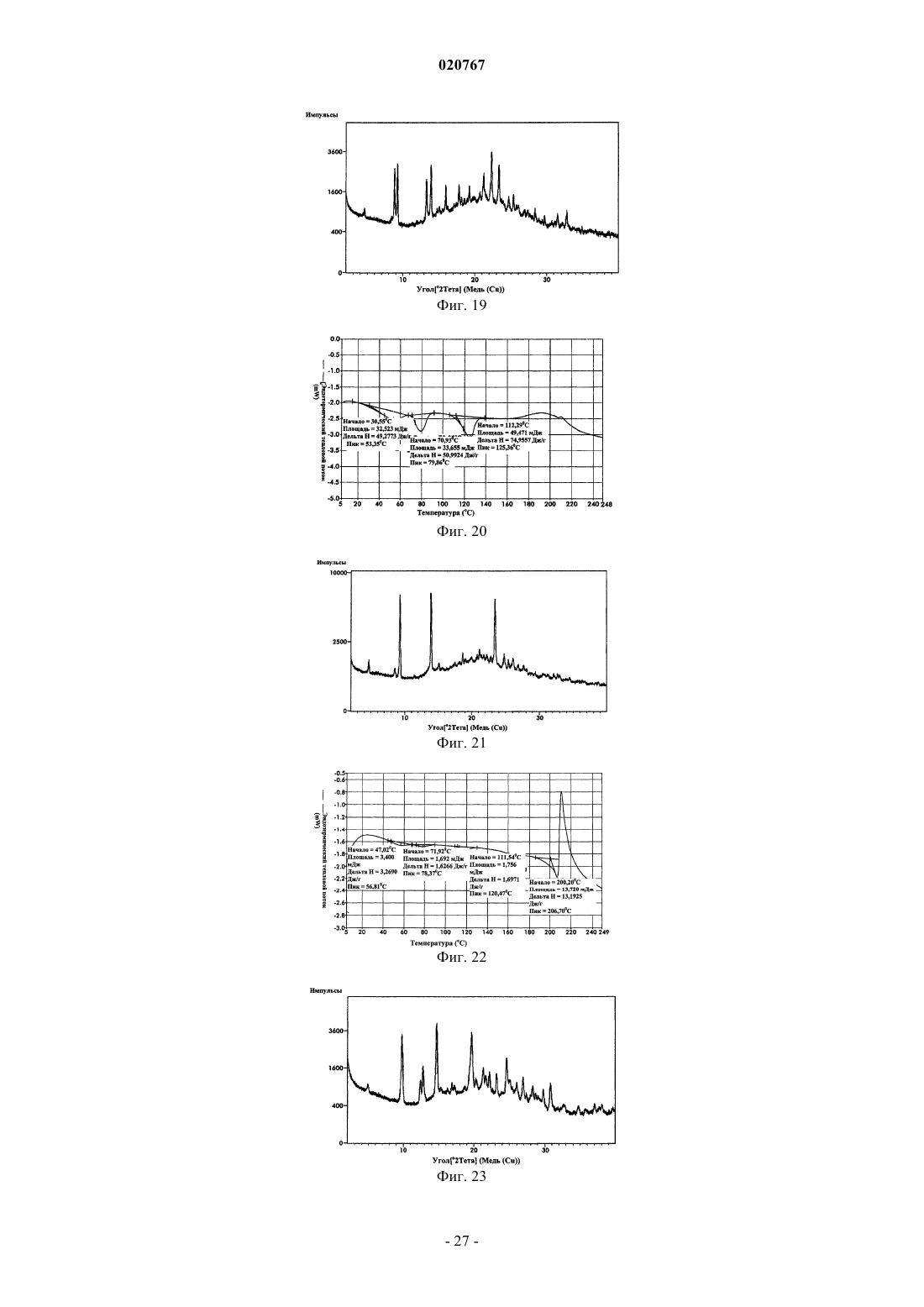
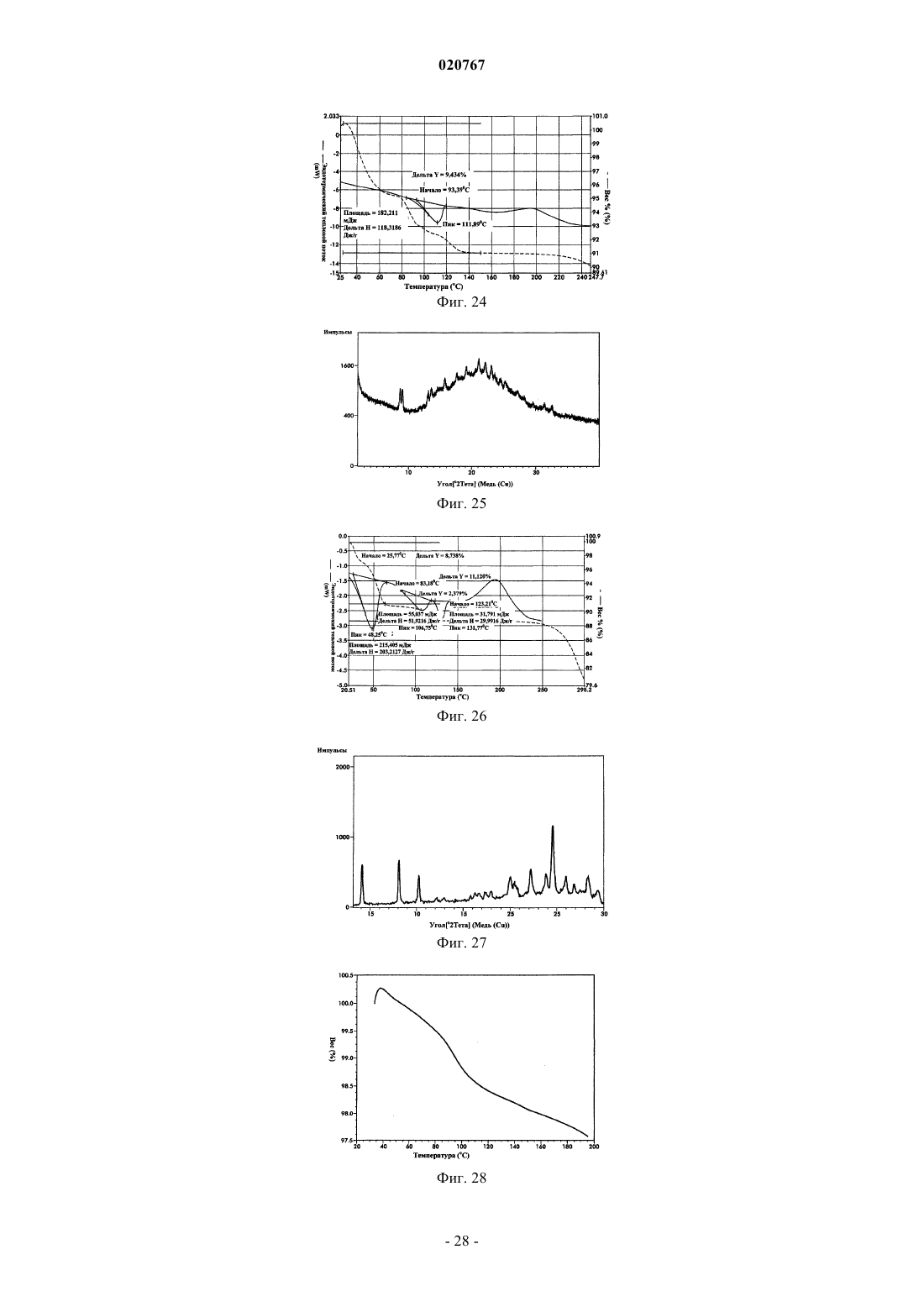
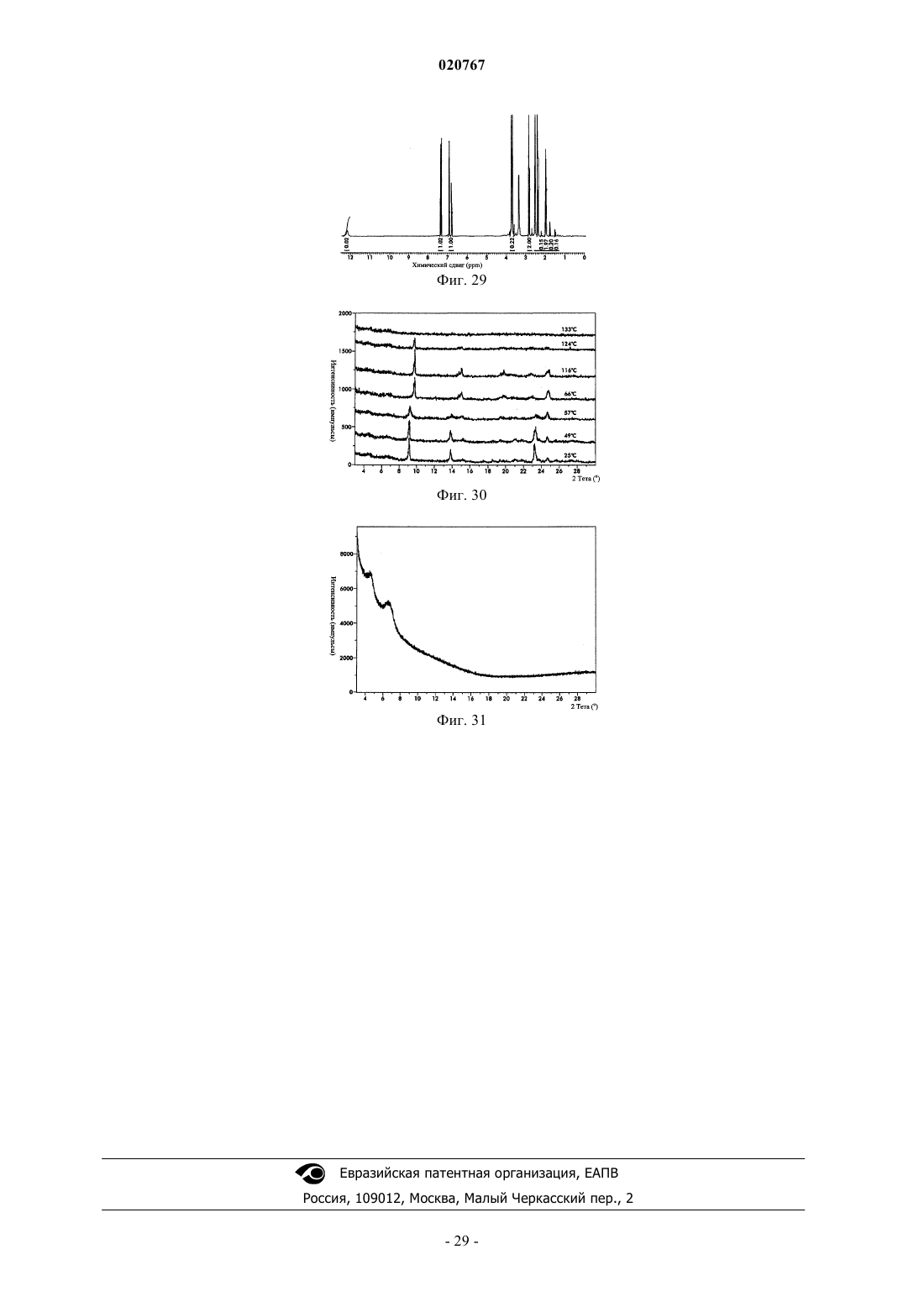
Новые формы свободного основания бендамустина
Номер патента: 20767
Опубликовано: 30.01.2015
Авторы: Холтиванджер Кертис Р., Курвуазье Лоран Д., Эддлстоун Марк, Маккин Роберт Э.
Формула / Реферат
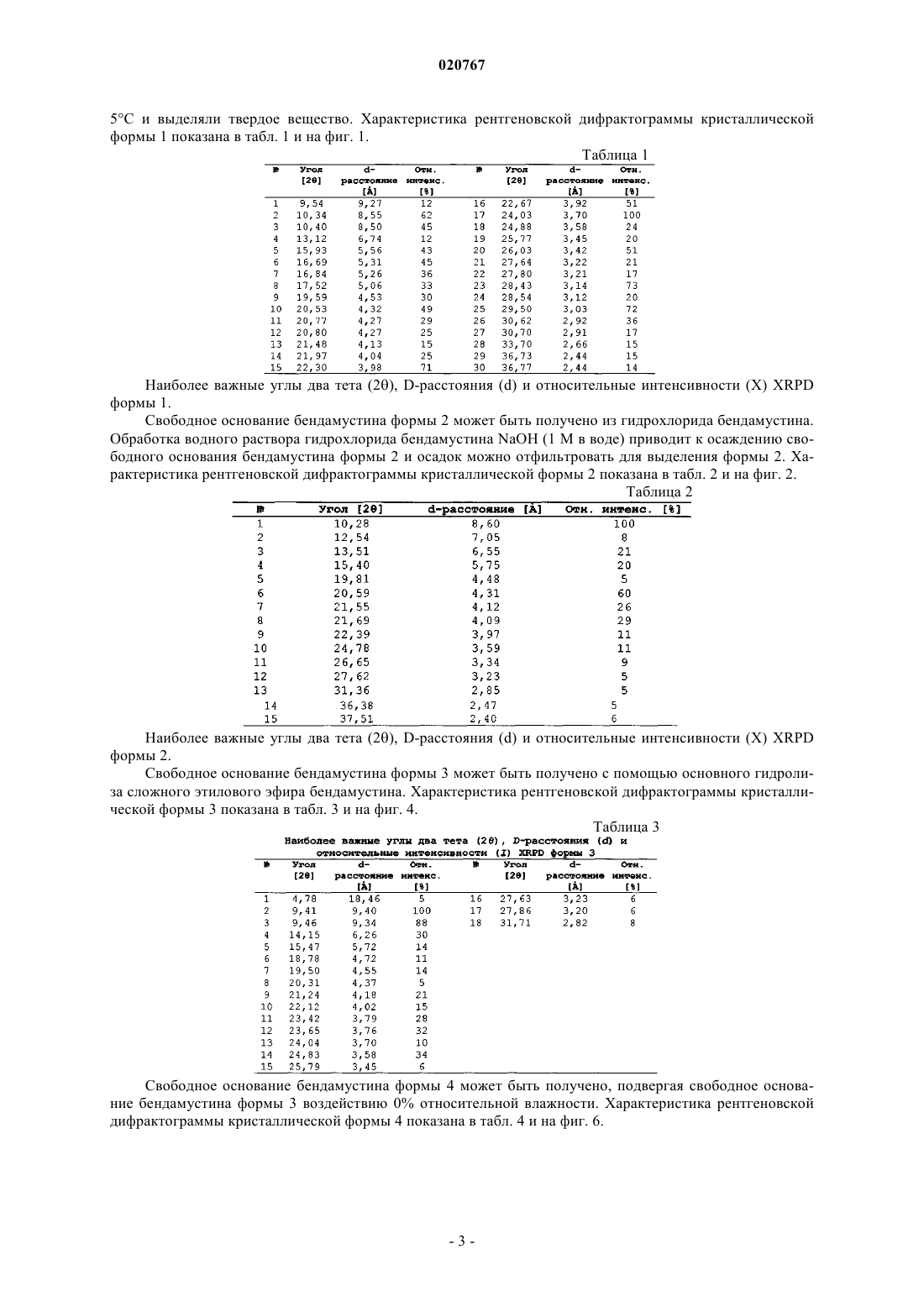
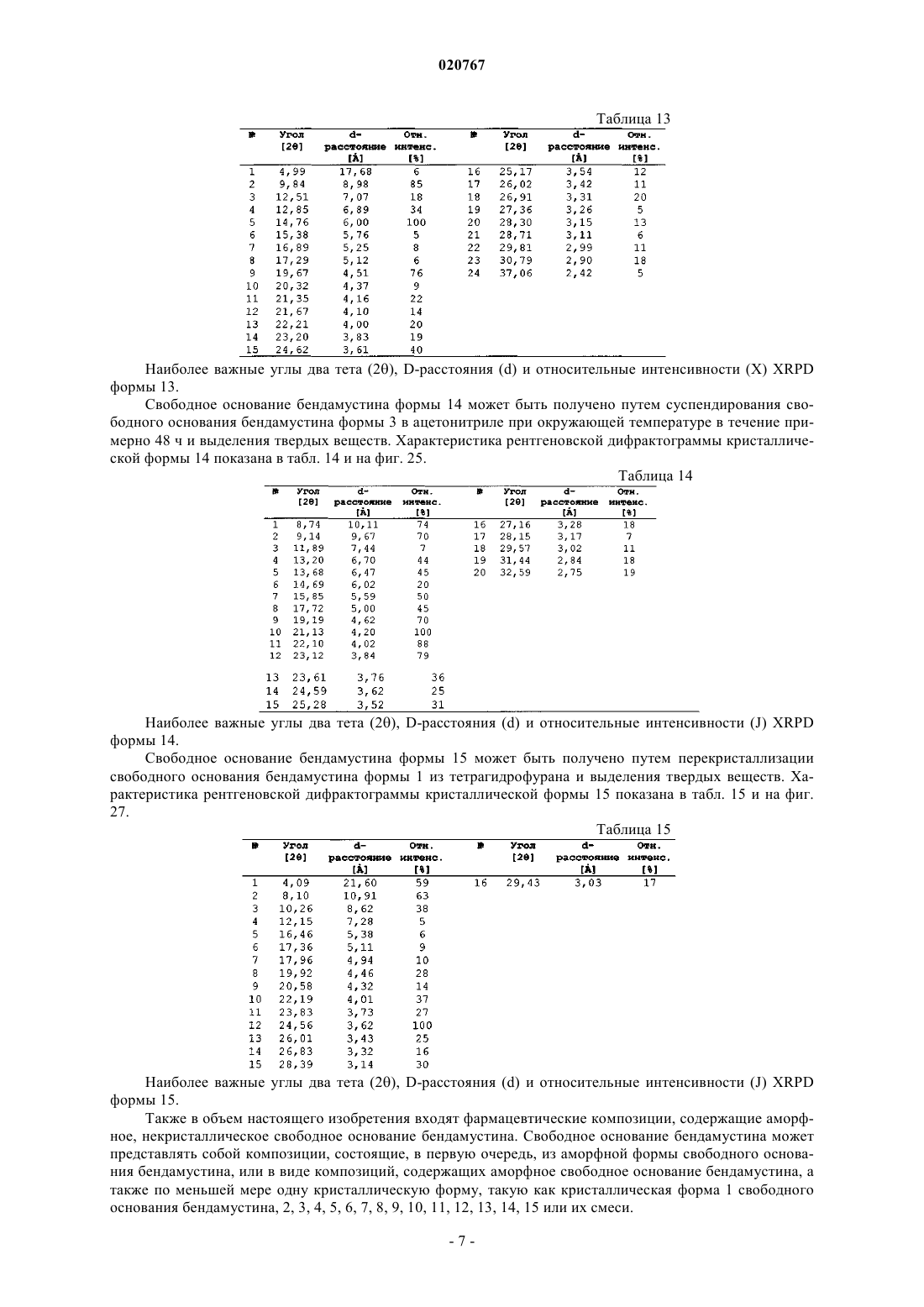
1. Кристаллическая форма 1 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 10,34, 22,30, 24,03, 28,43 и 29,50±0,2° 2θ.
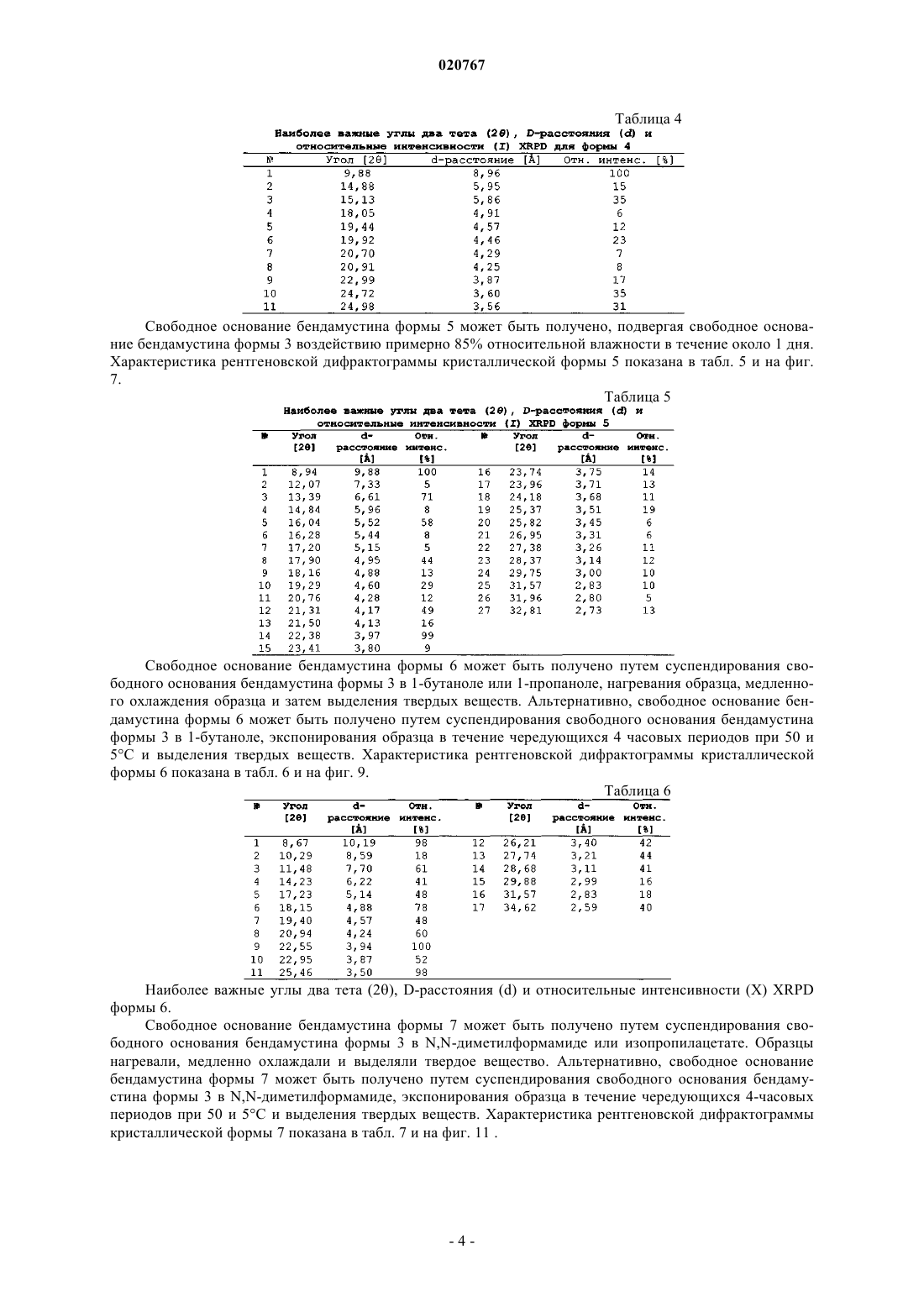
2. Кристаллическая форма 2 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 10,28, 20,59, 21,55, 21,69 и 24,78±0,2° 2θ.
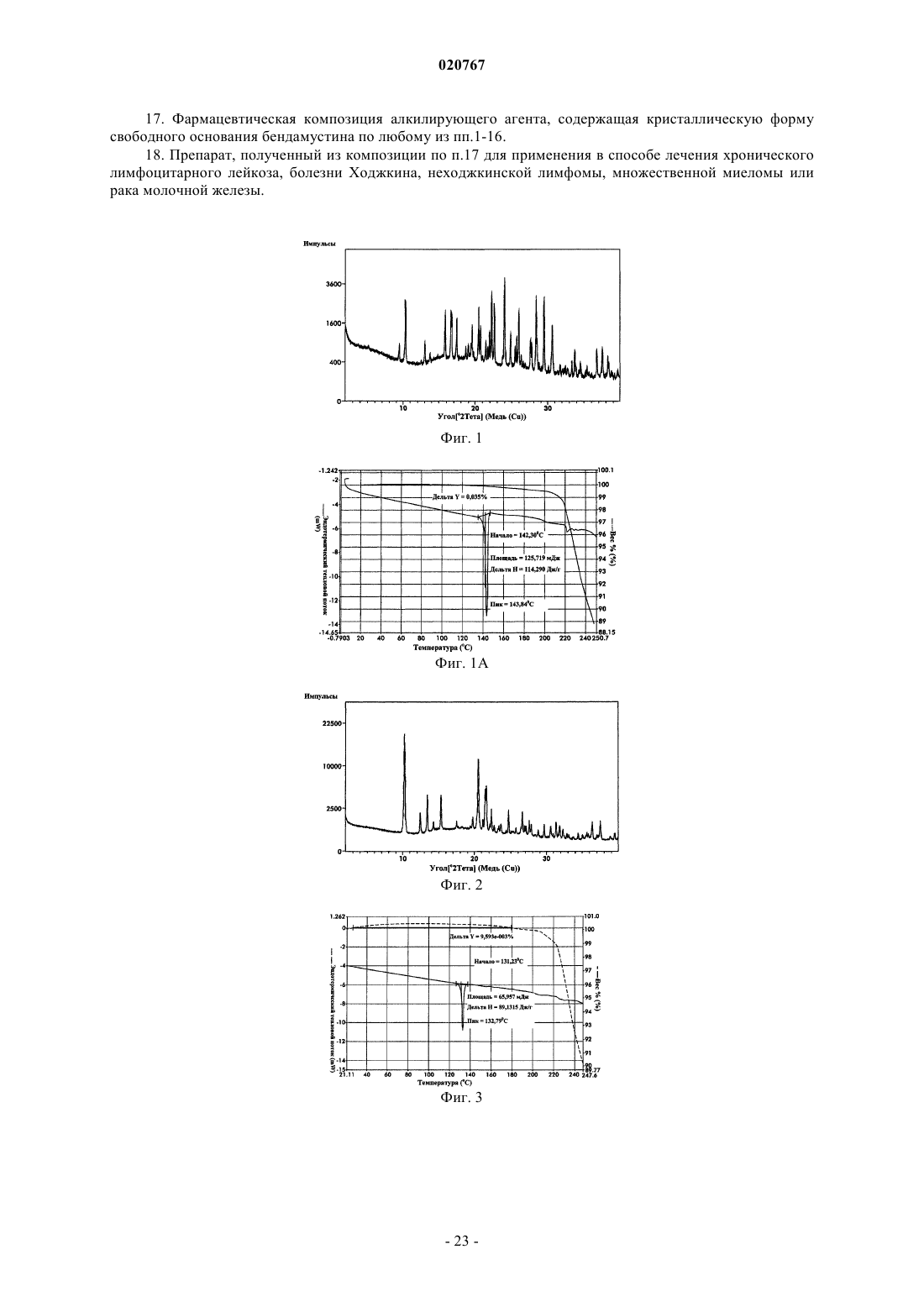
3. Кристаллическая форма 3 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,41, 9,46, 14,15, 23,42 и 23,65±0,2° 2θ.
4. Кристаллическая форма 4 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,88, 15,13, 19,92, 22,99, 24,72 и 24,98±0,2° 2θ.
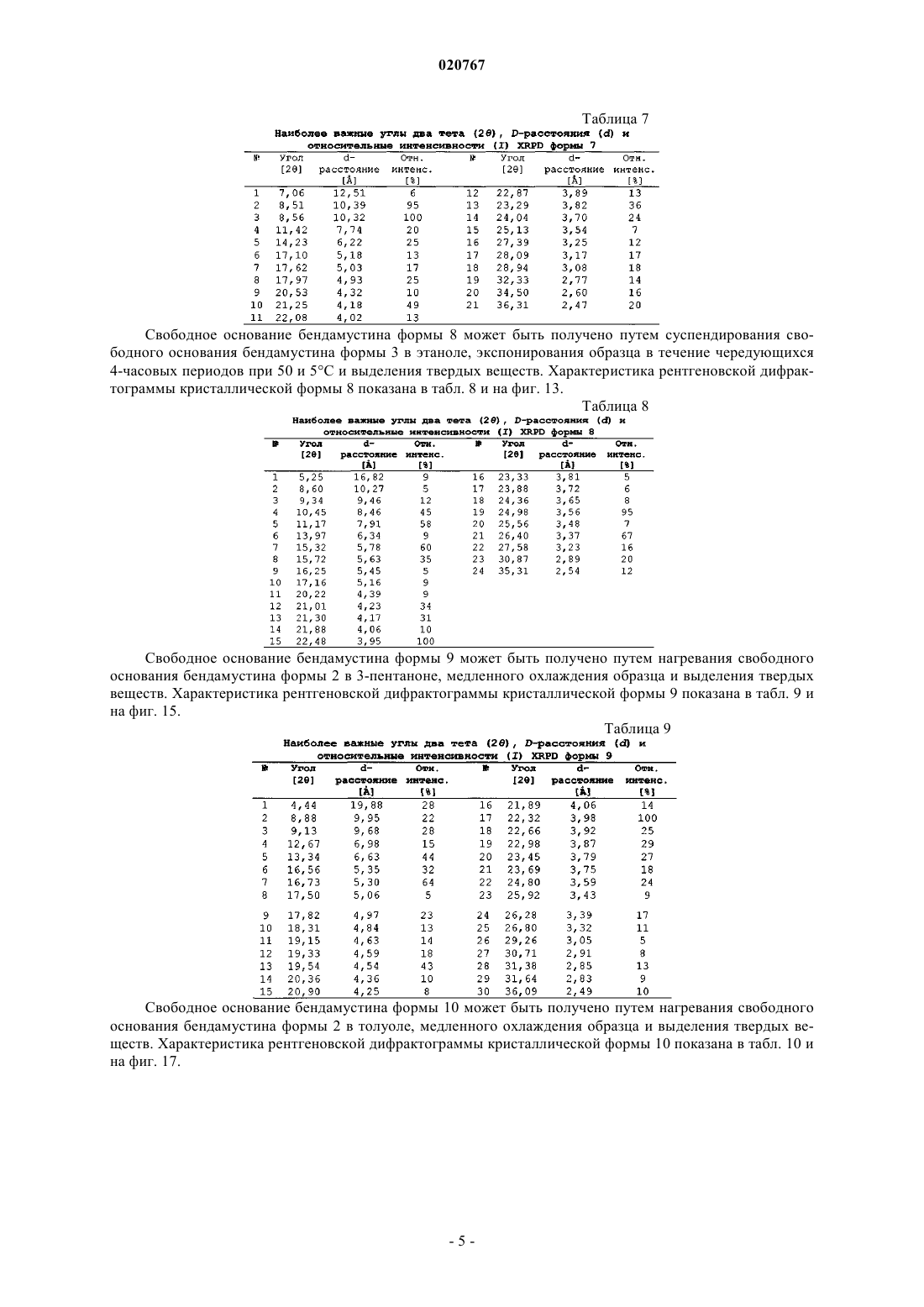
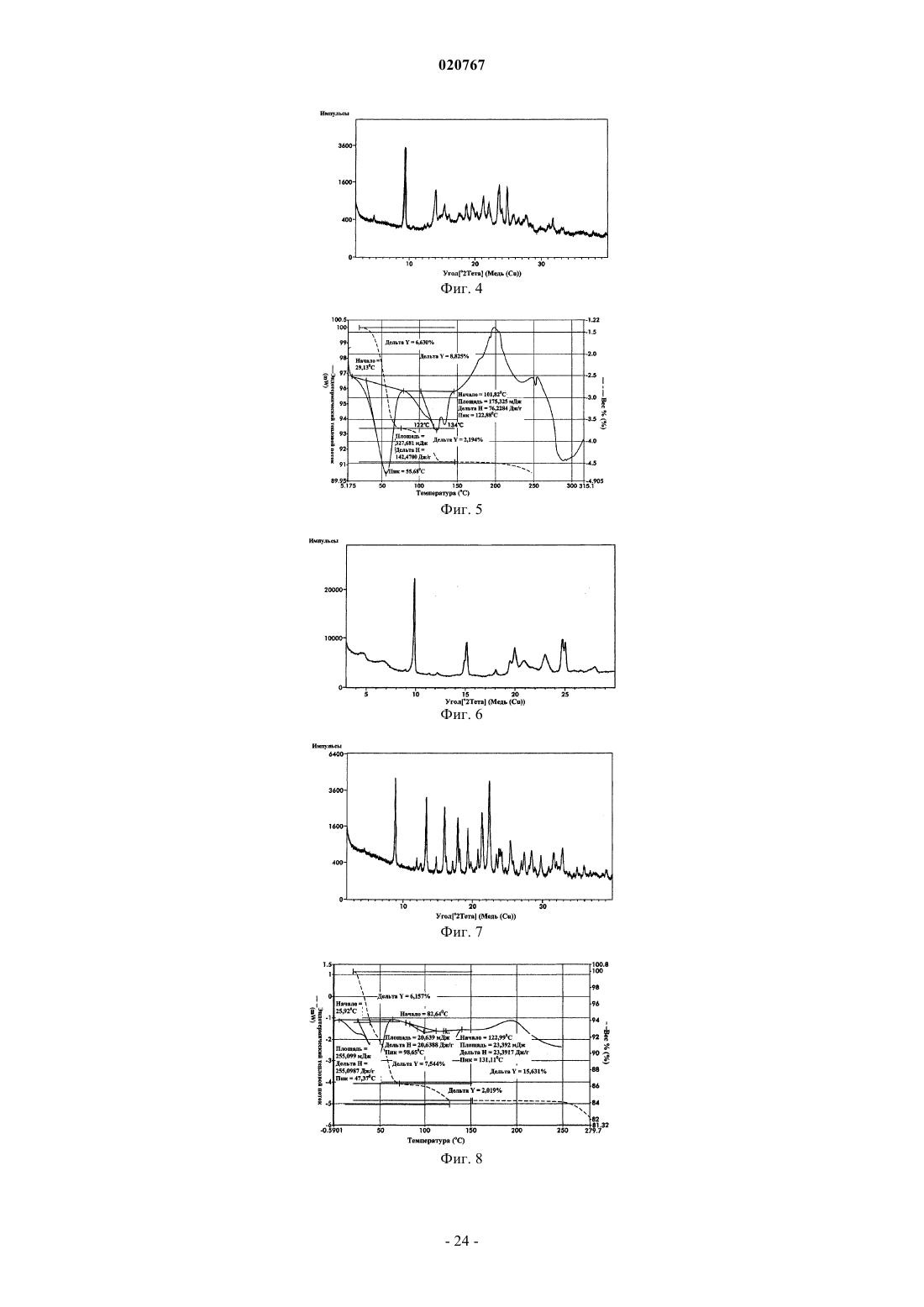
5. Кристаллическая форма 5 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,94, 13,39, 16,04, 21,31 и 22,38±0,2° 2θ.
6. Кристаллическая форма 6 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,67, 18,15, 20,94, 22,55 и 25,46±0,2° 2θ.
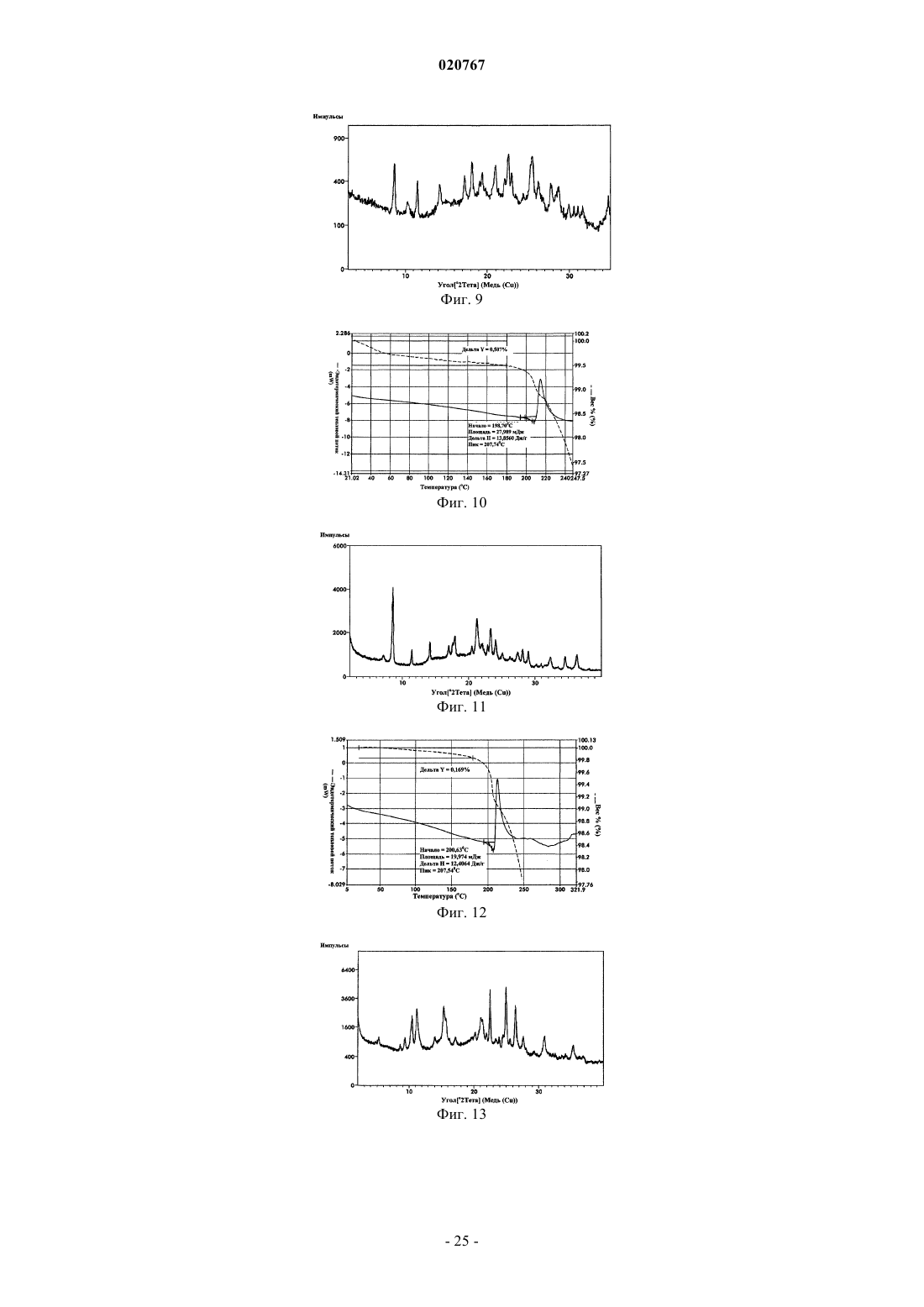
7. Кристаллическая форма 7 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,51, 17,97, 21,25, 28,09 и 36,31±0,2° 2θ.
8. Кристаллическая форма 8 сольватной формы свободного основания бендамустина с этанолом, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 и 26,40±0,2° 2θ.
9. Кристаллическая форма 9 сольватной формы свободного основания бендамустина с 3-пертаноном, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 4,44, 13,34, 16,73, 19,54 и 22,32±0,2° 2θ.
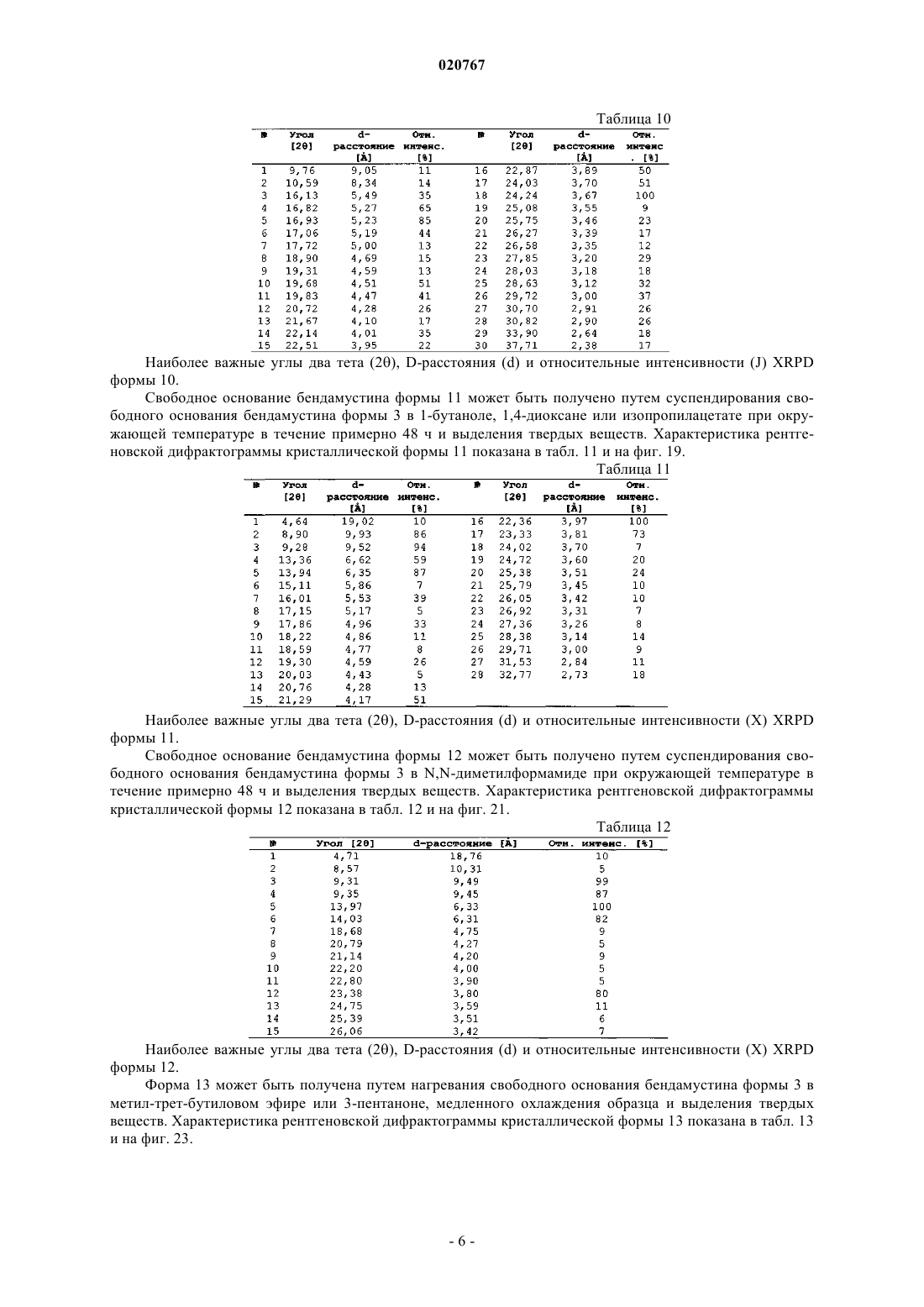
10. Кристаллическая форма 10 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 и 29,72±0,2° 2θ.
11. Кристаллическая форма 11 сольватной формы свободного основания бендамустина с 1-бутанолом, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,90, 9,28, 13,94, 22,36 и 23,33±0,2° 2θ.
12. Кристаллическая форма 12 сольватной формы свободного основания бендамустина с N,N-диметилформамидом, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,31, 9,35, 13,97, 14,03 и 23,38±0,2° 2θ.
13. Кристаллическая форма 13 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,84, 14,76, 19,67 и 24,62±0,2° 2θ.
14. Кристаллическая форма 14 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 и 23,61±0,2° 2θ.
15. Кристаллическая форма 15 сольватной формы свободного основания бендамустина с тетрагидрофураном, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 24,56, 19,92, 10,26, 8,10 и 4,09±0,2° 2θ.
16. Состав, содержащий аморфное свободное основание бендамустина и по меньшей мере одну кристаллическую форму по любому из пп.1-15.
17. Фармацевтическая композиция алкилирующего агента, содержащая кристаллическую форму свободного основания бендамустина по любому из пп.1-16.
18. Препарат, полученный из композиции по п.17 для применения в способе лечения хронического лимфоцитарного лейкоза, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы или рака молочной железы.
Текст
НОВЫЕ ФОРМЫ СВОБОДНОГО ОСНОВАНИЯ БЕНДАМУСТИНА В изобретении описаны новые полиморфные формы свободного основания бендамустина, включая аморфное свободное основание бендамустина, шесть безводных кристаллических форм, четыре гидратные формы и пять сольватных форм, а также описаны способы их получения и применения. Область изобретения Настоящее изобретение относится к композициям, содержащим свободное основание бендамустина, фармацевтическим композициям, содержащим свободное основание бендамустина, способам их воспроизводимого получения и способам лечения пациентов с их использованием. Предпосылки изобретения Активные фармацевтические ингредиенты (АФИ) могут быть получены в виде различных форм,например химических производных, сольватов, гидратов, сокристаллов или солей. АФИ также могут быть аморфными, могут иметь различные кристаллические полиморфы или могут иметь различные сольваты или гидраты. Путем изменения формы АФИ возможно изменение их физических свойств. Например, кристаллические полиморфы обычно имеют различные значения растворимости, причем более термодинамически стабильный полиморф является менее растворимым, чем менее термодинамически стабильный полиморф. Полиморфы также могут отличаться по таким свойствам, как срок хранения,биодоступность, морфология, давление пара, плотность, цвет и сжимаемость. Соответственно изменение кристаллического состояния АФИ является одним из способов, которыми моделируют его физические и фармакологические свойства. Бендамустин, 4-5-[бис-(2-хлорэтил)амино]-1-метил-2-бензимидазолилмасляная кислота первоначально был синтезирован в 1963 г. в ГДР и был там доступен с 1971 по 1992 гг. в виде гидрохлоридной соли под торговой маркой Cytostasan. С того времени он продается в Германии под торговой маркой Ribomustin. Ribomustin представляет собой аморфный, некристаллический порошок. Гидрохлорид бендамустина в форме для инъекции доступен в США под торговой маркой Treanda. Бендамустин представляет собой алкилирующее средство, которое имеет терапевтическое применение при лечении заболеваний, таких как хронический лимфоцитарный лейкоз, болезнь Ходжкина, неходжкинская лимфома, множественная миелома и рак молочной железы. Он выпускается в форме лиофилизированной лепешки гидрохлоридной соли бендамустина. Непосредственно перед лечением лиофилизированную лепешку растворяют в фармацевтически приемлемом разбавителе, предпочтительно хлориде натрия для инъекции. Обычно желательно, чтобы композиции для инъекций выпускались в форме свободного основания,а не в форме соли, для минимизации любых побочных эффектов, которые может оказывать противоион. Ранее описанные формы свободного основания бендамустина, однако, были нестабильными и не подходящими для коммерческого получения, доставки и введения. В результате имеется потребность в стабильных формах свободного основания бендамустина. Краткое описание настоящего изобретения В данном описании описаны пятнадцать новых, кристаллических полиморфных форм свободного основания бендамустина. Также описаны фармацевтические композиции, содержащие одну или более из описанных полиморфных форм свободного основания бендамустина, а также фармацевтические композиции, дополнительно содержащие аморфное свободное основание бендамустина. Также описаны, например, способы применения предпочтительных форм и композиций для лечения лейкоза, лимфомы,миеломы и рака молочной железы. Краткое описание чертежей Фиг. 1 представляет собой спектр порошковой рентгеновской дифрактограммы (XRPD) формы 1 свободного основания бендамустина; фиг. 1 А - наложение данных дифференциальной сканирующей калориметрии/термогравиметрического анализа (DSC/TGA) для формы 1; фиг. 2 - XRPD спектр формы 2 свободного основания бендамустина; фиг. 3 - наложение данных DSC/TGA для формы 2 свободного основания бендамустина; фиг. 4 - XRPD спектр формы 3 свободного основания бендамустина; фиг. 5 - наложение данных DSC/TGA для формы 3 свободного основания бендамустина; фиг. 6 - XRPD спектр формы 4 свободного основания бендамустина; фиг. 7 - XRPD спектр формы 5 свободного основания бендамустина; фиг. 8 - наложение данных DSC/TGA для формы 5 свободного основания бендамустина; фиг. 9 - XRPD спектр формы 6 свободного основания бендамустина; фиг. 10 - наложение данных DSC/TGA для формы 6 свободного основания бендамустина; фиг. 11 - XRPD спектр формы 7 свободного основания бендамустина; фиг. 12 - наложение данных DSC/TGA для формы 7 свободного основания бендамустина; фиг. 13 - XRPD спектр формы 8 свободного основания бендамустина; фиг. 14 - наложение данных DSC/TGA для формы 8 свободного основания бендамустина; фиг. 15 - XRPD спектр формы 9 свободного основания бендамустина; фиг. 16 - наложение данных DSC/TGA для формы 9 свободного основания бендамустина; фиг. 17 - XRPD спектр формы 10 свободного основания бендамустина; фиг. 18 - наложение данных DSC/TGA для формы 10 свободного основания бендамустина; фиг. 19 - XRPD спектр формы 11 свободного основания бендамустина; фиг. 20 - наложение данных DSC/TGA для формы 11 свободного основания бендамустина; фиг. 21 - XRPD спектр формы 12 свободного основания бендамустина; фиг. 22 - наложение данных DSC/TGA для формы 12 свободного основания бендамустина; фиг. 23 - XRPD спектр формы 13 свободного основания бендамустина; фиг. 24 - наложение данных DSC/TGA для формы 13 свободного основания бендамустина; фиг. 25 - XRPD спектр формы 14 свободного основания бендамустина; фиг. 26 - наложение данных DSC/TGA для формы 14 свободного основания бендамустина; фиг. 27 - XRPD спектр формы 15 свободного основания бендамустина; фиг. 28 - данные TGA для формы 15 свободного основания бендамустина, с размером образца 1,4590 мг, который анализируют от окружающей температуры до 200 С при 10 С в 1 мин; фиг. 29 - 1 Н ЯМР формы 15 свободного основания бендамустина; фиг. 30 - XRPD при переменной температуре для формы 3; фиг. 31 - XRPD спектр аморфного свободного основания бендамустина. В настоящее время обнаружены стабильные формы свободного основания бендамустина. В данном описании описано шесть полиморфных форм безводного свободного основания бендамустина (формы 1,2, 4, 6, 7, 10), а также четыре гидратные формы (формы 3, 5, 13, 14) и пять сольватных форм свободного основания бендамустина (формы 8, 9, 11, 12, 15). Аморфное свободное основание бендамустина также входит в объем настоящего изобретения. В предпочтительных вариантах осуществления изобретение относится к кристаллическим формам свободного основания бендамустина, которые представляют собой форму 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12,13, 14, 15 или их смеси. Эти полиморфы могут быть определены с помощью порошковой рентгеновской дифракции и характеризоваться одним, двумя, тремя, четырьмя, пятью или более пиками отражения,которые являются характеристикой каждой полиморфной формы. 15 кристаллических полиморфов(формы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15) также могут быть определены на основании их порошковых рентгеновских дифрактограмм (XRPD), термограмм дифференциальной сканирующей калориметрии (DSC), термограмм термогравиметрического анализа (TGA) и/или следов гравиметрической сорбции пара (GVS), которые представлены на фиг. 1-29. Способы создания каждого полиморфа или смеси полиморфов могут быть осуществлены с использованием методик, описанных в данном описании. В другом варианте осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим формы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или их смеси свободного основания бендамустина. В других вариантах осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим одну или более из форм 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 с аморфным (т.е. некристаллическим) бендамустином. В еще одном варианте осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим формы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или их смеси свободного основания бендамустина и по меньшей мере один фармацевтически приемлемый эксципиент или носитель. В других вариантах осуществления настоящее изобретение относится к фармацевтическим композициям,содержащим одну или более из форм 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 с аморфным (т.е. некристаллическим) бендамустином и по меньшей мере один фармацевтически приемлемый эксципиент или носитель. Методики исследования, такие как термический анализ (DSC, TGA/MS) и рентгеновская дифракция, являются общепринятыми как для определения параметров, так и для количественного анализа различных кристаллических форм. Общепринято, что для однозначного определения параметров всех различных кристаллических форм необходимо использовать дополнительные аналитические методики. Проводится серия экспериментов по кристаллизации для исследования эффектов растворителя, способа кристаллизации и температуры с целью идентификации и определения параметров полиморфов и сольватов свободного основания бендамустина. Свободное основание бендамустина формы 1 может быть получено путем суспендирования свободного основания бендамустина формы 2 в 2-бутаноле, ацетонитриле, циклогексане, этилацетате, метил-трет-бутиловом эфире, н-бутилацетате, пропионитриле или тетрагидропиране, нагревания образца,медленного охлаждения образца и выделения твердых веществ. Альтернативно, свободное основание бендамустина формы 1 может быть получено путем суспендирования свободного основания бендамустина формы 2 в 1-бутаноле, 1,4-диоксане, 1-пропаноле, ацетоне, хлороформе, циклогексане, этаноле,метилизобутилкетоне, метил-трет-бутиловом эфире, н-бутилацетате, пропионитриле, тетрагидропиране или толуоле. Образец суспендировали в течение 48 ч с чередующимися 4-часовыми периодами при 50 и 5 С и выделяли твердое вещество. Характеристика рентгеновской дифрактограммы кристаллической формы 1 показана в табл. 1 и на фиг. 1. Таблица 1 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 1. Свободное основание бендамустина формы 2 может быть получено из гидрохлорида бендамустина. Обработка водного раствора гидрохлорида бендамустина NaOH (1 M в воде) приводит к осаждению свободного основания бендамустина формы 2 и осадок можно отфильтровать для выделения формы 2. Характеристика рентгеновской дифрактограммы кристаллической формы 2 показана в табл. 2 и на фиг. 2. Таблица 2 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 2. Свободное основание бендамустина формы 3 может быть получено с помощью основного гидролиза сложного этилового эфира бендамустина. Характеристика рентгеновской дифрактограммы кристаллической формы 3 показана в табл. 3 и на фиг. 4. Таблица 3 Свободное основание бендамустина формы 4 может быть получено, подвергая свободное основание бендамустина формы 3 воздействию 0% относительной влажности. Характеристика рентгеновской дифрактограммы кристаллической формы 4 показана в табл. 4 и на фиг. 6. Свободное основание бендамустина формы 5 может быть получено, подвергая свободное основание бендамустина формы 3 воздействию примерно 85% относительной влажности в течение около 1 дня. Характеристика рентгеновской дифрактограммы кристаллической формы 5 показана в табл. 5 и на фиг. 7. Таблица 5 Свободное основание бендамустина формы 6 может быть получено путем суспендирования свободного основания бендамустина формы 3 в 1-бутаноле или 1-пропаноле, нагревания образца, медленного охлаждения образца и затем выделения твердых веществ. Альтернативно, свободное основание бендамустина формы 6 может быть получено путем суспендирования свободного основания бендамустина формы 3 в 1-бутаноле, экспонирования образца в течение чередующихся 4 часовых периодов при 50 и 5 С и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 6 показана в табл. 6 и на фиг. 9. Таблица 6 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 6. Свободное основание бендамустина формы 7 может быть получено путем суспендирования свободного основания бендамустина формы 3 в N,N-диметилформамиде или изопропилацетате. Образцы нагревали, медленно охлаждали и выделяли твердое вещество. Альтернативно, свободное основание бендамустина формы 7 может быть получено путем суспендирования свободного основания бендамустина формы 3 в N,N-диметилформамиде, экспонирования образца в течение чередующихся 4-часовых периодов при 50 и 5 С и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 7 показана в табл. 7 и на фиг. 11 . Свободное основание бендамустина формы 8 может быть получено путем суспендирования свободного основания бендамустина формы 3 в этаноле, экспонирования образца в течение чередующихся 4-часовых периодов при 50 и 5 С и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 8 показана в табл. 8 и на фиг. 13. Таблица 8 Свободное основание бендамустина формы 9 может быть получено путем нагревания свободного основания бендамустина формы 2 в 3-пентаноне, медленного охлаждения образца и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 9 показана в табл. 9 и на фиг. 15. Таблица 9 Свободное основание бендамустина формы 10 может быть получено путем нагревания свободного основания бендамустина формы 2 в толуоле, медленного охлаждения образца и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 10 показана в табл. 10 и на фиг. 17. Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (J) XRPD формы 10. Свободное основание бендамустина формы 11 может быть получено путем суспендирования свободного основания бендамустина формы 3 в 1-бутаноле, 1,4-диоксане или изопропилацетате при окружающей температуре в течение примерно 48 ч и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 11 показана в табл. 11 и на фиг. 19. Таблица 11 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 11. Свободное основание бендамустина формы 12 может быть получено путем суспендирования свободного основания бендамустина формы 3 в N,N-диметилформамиде при окружающей температуре в течение примерно 48 ч и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 12 показана в табл. 12 и на фиг. 21. Таблица 12 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 12. Форма 13 может быть получена путем нагревания свободного основания бендамустина формы 3 в метил-трет-бутиловом эфире или 3-пентаноне, медленного охлаждения образца и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 13 показана в табл. 13 и на фиг. 23. Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (X) XRPD формы 13. Свободное основание бендамустина формы 14 может быть получено путем суспендирования свободного основания бендамустина формы 3 в ацетонитриле при окружающей температуре в течение примерно 48 ч и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 14 показана в табл. 14 и на фиг. 25. Таблица 14 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (J) XRPD формы 14. Свободное основание бендамустина формы 15 может быть получено путем перекристаллизации свободного основания бендамустина формы 1 из тетрагидрофурана и выделения твердых веществ. Характеристика рентгеновской дифрактограммы кристаллической формы 15 показана в табл. 15 и на фиг. 27. Таблица 15 Наиболее важные углы два тета (2), D-расстояния (d) и относительные интенсивности (J) XRPD формы 15. Также в объем настоящего изобретения входят фармацевтические композиции, содержащие аморфное, некристаллическое свободное основание бендамустина. Свободное основание бендамустина может представлять собой композиции, состоящие, в первую очередь, из аморфной формы свободного основания бендамустина, или в виде композиций, содержащих аморфное свободное основание бендамустина, а также по меньшей мере одну кристаллическую форму, такую как кристаллическая форма 1 свободного основания бендамустина, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или их смеси. В предпочтительных вариантах осуществления изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одну из формы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, и необязательно аморфное свободное основание бендамустина, а также по меньшей мере один фармацевтически приемлемый эксципиент. Фармацевтически приемлемые эксципиенты известны в данной области и включают такие, как описано, например, в патентной заявке США 11/267010. Эти фармацевтические композиции могут быть получены в форме инъекционных препаратов либо жидких растворов, либо суспензии, а также твердых форм, например капсул, таблеток, ромбовидных лепешек, пастилок, порошков, суспензий и подобных. В предпочтительных вариантах осуществления фармацевтические композиции являются сублимированными, предпочтительно высушенными замораживанием или лиофилизированными композициями. В других вариантах осуществления предоставлены способы получения таких сублимированных, предпочтительно высушенных замораживанием или лиофилизированных препаратов свободного основания бендамустина, которые содержат форму 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или их смесь. Лиофилизация включает добавление воды к соединению с последующим замораживанием полученной суспензии или раствора и сублимации воды из соединения. В предпочтительных вариантах осуществления по меньшей мере один органический растворитель добавляют к суспензии/раствору. В других предпочтительных вариантах осуществления суспензия/раствор дополнительно содержит эксципиент для лиофилизации. Лиофилизированные препараты свободного основания бендамустина настоящего изобретения могут дополнительно содержать аморфное свободное основание бендамустина. В обычной процедуре лиофилизации воду, фармацевтически приемлемый эксципиент для лиофилизации, органический растворитель и свободное основание бендамустина комбинируют предпочтительно в стерильных условиях для образования раствора. Предпочтительно готовят раствор и стерилизуют фильтрацией. Этот раствор затем лиофилизируют, используя стандартное стерильное оборудование для лиофилизации. Несмотря на то что предпочтительные варианты осуществления настоящего изобретения включают лиофилизацию свободного основания бендамустина, предполагают, что другие методы сублимации также могут быть использованы. Например, одна или более из описанных форм свободного основания бендамустина может быть растворена, диспергирована или суспендирована в растворителе, полученная смесь (которая является раствором, дисперсией или суспензией) заморожена и растворитель удален сублимацией. Эксципиент для лиофилизации может быть любым фармацевтически приемлемым эксципиентом,который при использовании в ходе процесса лиофилизации дает в результате лиофилизированный продукт, который обладает улучшенными свойствами, например улучшенными технологическими свойствами, свойствами растворимости и подобное. Эксципиент для лиофилизации может быть, например,объемообразующим средством; подходящие объемообразующие средства известны в данной области. Примеры подходящих эксципиентов для лиофилизации включают, например, фосфат натрия, фосфат калия, лимонную кислоту, винную кислоту, желатин, глицин, маннит, лактозу, сахарозу, мальтозу, глицерин, декстрозу, декстран, трегалозу, гидроксиэтилкрахмал или их смеси. Эксципиент для лиофилизации может также содержать фармацевтически приемлемый антиоксидант, такой как, например, аскорбиновая кислота, ацетилцистеин, цистеин, гидросульфит натрия, бутилгидроксиланизол, бутилгидрокситолуол или ацетат альфа-токоферола. Предпочтительным эксципиентом для лиофилизации является маннит. Растворители для применения в настоящем изобретении включают воду и органические растворители, которые образуют стабильные растворы со свободным основанием бендамустина без значительного разложения бендамустина и которые могут быть удалены лиофилизацией. Примеры подходящих органических растворителей включают, например, метанол, этанол, н-пропанол, изопропанол, н-бутанол,трет-бутанол или их смеси. Предпочтительным органическим растворителем является трет-бутанол. Также в объем настоящего изобретения входят способы лечения заболеваний, таких как, например,хронический лимфоцитарный лейкоз, болезнь Ходжкина, неходжкинская лимфома, множественная миелома или рак молочной железы, фармацевтической композицией настоящего изобретения. В определенных вариантах осуществления способ включает введение терапевтически эффективного количества фармацевтической композиции настоящего изобретения непосредственно пациенту. В других вариантах осуществления способ включает модификацию фармацевтической композиции настоящего изобретения до введения, например, путем растворения композиции в воде или другом растворителе до введения. В этих вариантах осуществления способ включает введение пациенту терапевтически эффективного количества препарата, полученного из фармацевтической композиции настоящего изобретения. Предпочтительно препарат представляет собой инъекционный препарат. Инъекционный препарат может быть введен подкожно, внутрикожно, внутривенно, внутримышечно, интраартрикулярно, внутрисуставно, внутристернально, интратекально, внутрь пораженных тканей, интракраниально или посредством инфузии. Другие состояния, которые поддаются лечению с использованием композиций и инъекционных препаратов настоящего изобретения, включают мелкоклеточный рак легкого, гиперпролиферативные расстрой-8 020767 ства и аутоиммунные заболевания, такие как ревматоидный артрит, рассеянный склероз и красная волчанка. Инъекционные препараты, описанные в данном описании, находятся в форме стерильного инъекционного препарата, например в виде стерильной, инъекционной водной или маслосодержащей суспензии, составленной согласно методикам, известным в данной области. Обычно фармацевтические композиции настоящего изобретения, содержащие по меньшей мере одну из форм 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15 или аморфное свободное основание бендамустина, составляют в виде лиофилизированных порошков, которые могут быть предоставлены, например, в ампулах, содержащих 100 мг лекарственного средства на 50 мл ампулу. Инъекционный препарат может быть получен путем восстановления высушенной замораживанием или лиофилизированной композиции стерильной водой для инъекций и затем дополнительного разведения фармацевтически приемлемым внутривенным раствором, таким как, например, 0,9% хлорид натрия, 5% декстроза в воде (D5W), раствор Рингера с лактатом или 0,45% хлорида натрия/2,5% декстрозы. Предпочтительно фармацевтические композиции свободного основания бендамустина, описанные в данном описании, восстанавливают в инъекционный препарат, например, с помощью стерильной воды в течение менее чем около 20 мин. Более предпочтительно восстановление проводят менее чем за около 10 мин, наиболее предпочтительно около 5 мин. Конкретный способ восстановления будет включать воссоздание предпочтительно в стерильных условиях 100 мг свободного основания бендамустина с помощью 20 мл стерильной воды для инъекций. Это дает на выходе прозрачный раствор от бесцветного до бледно-желтого цвета, имеющий концентрацию бендамустина 5 мг/мл. Если восстанавливают лиофилизированное свободное основание бендамустина, то оно должно полностью раствориться приблизительно за 5 мин. Объем, необходимый для требуемой дозы (на основе 5 мг/мл концентрации), может быть в стерильных условиях извлечен и перенесен в 500 мл инфузионный мешок с 0,9% хлорида натрия (или другого фармацевтически приемлемого внутривенного раствора) для инъекции. Предпочтительно восстановленный раствор переносят в инфузионный мешок за 30 мин восстановления. После переноса содержимое инфузионного мешка тщательно перемешивают. Введение с помощью внутривенной инфузии обычно проводят в течение периода времени от около 30 до около 60 мин. Предусматривается, что фармацевтические композиции настоящего изобретения могут быть введены в комбинации с одним или несколькими антинеопластическими средствами, где антинеопластическое средство дают до, одновременно с или последовательно после введения композиции настоящего изобретения. Фармацевтически приемлемые антинеопластические средства известны в данной области. Предпочтительные антинеопластические средства являются такими, как описано в одновременно рассматриваемой патентной заявке США 11/330868, поданной 12 января 2006 г., описание которой во всей своей полноте включено в данное описание посредством ссылки. Терапевтически эффективные количества бендамустина могут быть без труда определены лечащим диагностом с помощью применения общепринятых методик. Эффективная доза может изменяться в зависимости от ряда факторов, включая тип и степень прогрессирования заболевания или нарушения, общего состояния здоровья конкретного пациента, биологической эффективности бендамустина, состава бендамустина и пути введения форм бендамустина. Бендамустин также может быть введен в более низких уровнях дозы с постепенным увеличением, пока не будет достигнут необходимый эффект. Терминология"Полиморфизм", как используется в данном описании, определяют как существование различных кристаллических конфигураций для одинаковых молекул. "Сольват", как используется в данном описании, представляет собой кристаллическое вещество, которое содержит молекулы растворителя, например воды, этанола, 3-пентанона, этилацетата, дихлорметана, диэтилового эфира и подобного, в кристаллической структуре. Выражение "растворитель", как используется в данном описании, означает вещество, обычно жидкость, которое способно полностью или частично растворять другое вещество, обычно твердое. Следующие растворители использовали в экспериментах, описанных в данном описании: Выражение "кристаллический", как используется в данном описании, означает присутствие регулярно повторяющейся группы молекул или граней внешней поверхности. "Некристаллический", как используется в данном описании, относится к аморфному веществу, не имеющему обнаруживаемой регулярно повторяющейся группы молекул или граней внешней поверхности. Выражение "кристаллическая композиция", как используется здесь, относится к твердому химическому соединению или смеси соединений, который обеспечивает характерную картину пиков, когда проводят анализ с помощью порошковой рентгеновской дифракции; она включает, но не ограничивается ими: полиморфы, сольваты, гидраты, сокристаллы и десольватированные сольваты. Выражение "выделение", как используется в данном описании, означает отделение соединения от растворителя для обеспечения твердого, полутвердого вещества или сиропа. Его обычно осуществляют путем, например, центрифугирования, фильтрования с или без вакуума, фильтрования при положительном давлении, дистилляции, выпаривания или их комбинации. Выделение может сопровождаться или нет очисткой, во время которой химическая, хиральная или химическая и хиральная чистота выделенного вещества повышается. Очистку обычно проводят путем, например, кристаллизации, дистилляции, экстракции, фильтрования через кислотный, основный или нейтральный оксид алюминия, фильтрования через кислотный, основный или нейтральный древесный уголь, колоночной хроматографии на колонке,заполненной хиральной стационарной фазой, фильтрования через пористую бумагу, пластиковый или стеклянный барьер, колоночной хроматографии на силикагеле, ионообменной хроматографии, перекристаллизации, высокоэффективной жидкостной хроматографии с нормальными фазами, высокоэффективной жидкостной хроматографии с обращенными фазами, растирания и подобного. Выражение "фармацевтически приемлемый эксципиент", как используется в данном описании,включает любой и все растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые средства, изотонические средства и средства, задерживающие абсорбцию, и подобное, приемлемые для фармацевтического применения, например, такие, которым был предоставлен статус "Признанные безопасными" (GRAS) Управлением США по надзору за качеством пищевых продуктов и лекарственных средств. Применение таких сред и средств для фармацевтических активных веществ хорошо известно в данной области, например в Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro, A.R., Ed.; Lippincott WilliamsWilkins: Philadelphia, PA, 2000. За исключением случаев, когда любые общепринятые среды или средство является несовместимым с активным ингредиентом, их применение предусматривается в терапевтических композициях. Дополнительные активные ингредиенты также могут быть включены в композиции. Выражение "раствор", как используется в данном описании, относится к смеси, содержащей по меньшей мере один растворитель и по меньшей мере одно соединение, которое по меньшей мере частично растворяется в растворителе. Выражение "сублимация", как используется в данном описании, относится к переходу из твердой фазы в газообразную фазу без промежуточной жидкой стадии. Выражение "по существу, свободные", как используется в данном описании в отношении композиций, которые содержат конкретную форму бендамустина, в то же время являются "по существу, свободными" от других форм соединения, означает, что указанная форма связана с менее чем 10%, предпочтительно менее чем 5%, особенно менее чем 2% и наиболее предпочтительно менее чем 1% других перечисленных форм бендамустина. Выражение "терапевтически эффективное количество", как используется в данном описании, относится к количеству, которое, как определили, является необходимым для того, чтобы вызвать физиологический эффект, предполагаемый и связанный с данным лекарственным средством, что измеряется согласно общепринятым фармакокинетическим способам и методикам для данного пути введения. Приемлемые и специфические терапевтически эффективные количества могут быть без труда определены лечащим диагностом как специалистом в данной области с помощью применения общепринятых методик. Эффективная доза будет изменяться в зависимости от ряда факторов, включая тип и степень прогрессирования заболевания или нарушения, общее состояние здоровья конкретного пациента, относительную биологическую эффективность выбранного соединения, состав активного средства с приемлемыми эксципиентами и путь введения. Экспериментальная часть Измерительные приборы. Порошковая рентгеновская дифракция.PANalytical X Pert Pro. Порошковые рентгеновские дифрактограммы записывали на PANalytical X Pert Pro дифрактометре,оснащенном индикатором X celerator, используя CuK излучение при 40 кВ и 40 мА. K1 излучение получали с монохроматором падающего луча высокоориентированного кристалла (Ge111). 10 мм лучевую маску и фиксированные (1/4) щели расходимости и отсеивающие (1/8) щели вставляли на сторону падающего луча. Фиксированную 0,10 мм приемную щель вставляли на сторону дифрагированного луча. Сканирование порошковой рентгенограммы проводили приблизительно от 2 до 40 2 с 0,0080 размером шага и 96,06 с временем счета, что приводит к скорости сканирования приблизительно 0,5/мин. Образцы распыляли на силиконовую пластину нулевого фона (ZBG) для измерения. Образец вращали при 4/мин на PANalytical PW3064 Spinner. Измерение Si стандартного образца до сбора данных давало в результате значения для 2 и интенсивности, которые были в пределах допусков 28,44228,50 и существенно больше, чем высота минимального пика, равная 150 имп/с.Bruker AXS/Siemens D5000. Порошковые рентгеновские дифрактограммы записывали на Siemens D5000 дифрактометре, используя CuK излучение (40 кВ, 40 мА), 600 нм гониометр, автоматические щели расходимости и приемные щели, графитовый вторичный монохроматор и сцинтилляционный счетчик. Проверку технических характеристик инструмента проводят с использованием сертифицированного стандарта корунда(NIST 1976). Внешние условия. Образцы, полученные при внешних условиях, готовили в виде плоских пластин, используя порошок непосредственно после получения. Приблизительно 35 мг образца аккуратно вкладывали в разрез полости в отполированную (510) кремниевую пластину нулевого фона и покрытие MYLAR помещали над образцом. Образец вращали в собственной плоскости во время анализа.Bruker AXS C2 GADDS. Порошковые рентгеновские дифрактограммы записывали на Bruker AXS C2 GADDS дифрактометре, используя CuK излучение (40 кВ, 40 мА), автоматизированную XYZ стадию, лазерный видеомикроскоп для установки автосамплера и HiStar 2-мерный площадной индикатор. Рентгеновские оптические приборы состоят из одного многослойного зеркала Gbel, соединенного с точечным коллиматором 0,3 мм. Расходимость луча, т.е. эффективный размер рентгеновского луча на образце, составляла приблизительно 5 мм. - метод непрерывного сканирования применяли с расстоянием образец - индикатор 20 см,что дает эффективный 2 диапазон 3,2-29,7. Обычно образец подвергают воздействию рентгеновского луча в течение 120 с. Внешние условия. Образцы, полученные при внешних условиях, готовили в виде плоских пластин, используя порошок непосредственно после получения без помола. Приблизительно 1-2 мг образца слегка придавливали на предметном стекле для получения плоской поверхности. Порошковая рентгеновская дифракция с переменной температурой (VT-XRPD). Исследования с переменной температурой проводили с Anton Paar TTK450 температурной камерой при компьютерном контроле посредством Anton Paar TCU100 единицы температурного контроля. Обычно измерения проводили при продувании камеры азотом. Использовали две схемы измерений, ограниченную и непрерывную. В ограниченном методе измерения делали только после того, как TK450 камера достигала необходимой температуры. В непрерывном методе образец нагревали при 10 С/мин и измеряли быстрые сканирования, так как температура менялась. После того как достигалась предварительно выбранная температура, образец охлаждали при 35 С/мин. Для контроля изменений во время охлаждения снова измеряли быстрые сканирования. При 25 С измеряли медленное сканирование. Выбранные температуры основывались на результатах DSC. Для установки дифрактометра 10-мм лучевую маску,0,04 радиана щели Соллера, фиксированные (1/4) щели расходимости и отсеивающие (1/8) щели вставляли на сторону падающего луча. Фиксированную 0,10-мм приемную щель, 0,04 радиана щели Соллера и 0,02-мм никелевый фильтр вставляли на сторону дифрагированного луча. Медленные сканирования подбирали приблизительно от 3 до 30 2 с 0,0080 размером шага и 100,97 с временем счета, что приводило к скорости сканирования приблизительно 0,5/мин. Быстрые сканирования подбирали приблизительно от 3 до 30 2 с 0,0167 размером шага и 1,905 с временем счета, что приводило к скорости сканирования приблизительно 44/мин. Как только выключали подачу газообразного азота, камера возвращалась к условиям внешней среды. Влажность в состоянии в условиях внешней среды изменяется с влажностью в лаборатории обычно 30-40% и с температурой в камере. Если температура поднимается,то относительная влажность будет падать. Дифференциальная сканирующая калориметрия (DSC). Термические кривые получали, используя Perkin-Elmer Sapphire DSC единицу, оснащенную автосамплером, работающую в версии 6,0 программного обеспечения Pyris, откалиброванную с индием до анализа. Твердые образцы 1-11 мг взвешивали в 20 мкл алюминиевых открытых кюветах для образцов.DSC ячейку затем продували азотом и температуру нагревали от 0 до 275 С при 10 С/мин. Термогравиметрическая масс-спектрометрия (TGA/MS). Термические кривые получали с использованием Perkin-Elmer Pyris 1 TGA единицы, работающей по версии 6,0 программного обеспечения Pyris, откалиброванной с моногидратом оксалата кальция. TGA образцы 1-5 мг проверяли на процентную потерю массы, нагревая от 25 до 300 С при 10 С/мин в печи,продуваемой гелием приблизительно 50 мл/мин. Для одновременного отслеживания за образованием газообразных продуктов распада в исследуемом диапазоне температур термовесы соединяли с ThermoStar Масс-спектрометром (Asslar, Германия). Поточная линия для введения газообразных продуктов распада в масс-спектрометр была деактивированной капиллярной из плавленого кварца, контролируемой по температуре до 200 С, чтобы избежать возможной конденсации выделяющихся газов. Таким образом,термогравиметрические (TG) и масс-спектрометрические кривые ионной интенсивности выбранных ионных видов могут быть записаны одновременно. Термогравиметрический анализ (TGA).TGA данные собирали на ТА Instruments Q500 TGA, оснащенном 16-позиционным автосамплером. Прибор был откалиброван по температуре с использованием сертифицированного алюмеля. Обычно 1-2 мг каждого образца загружали в герметически запаянную алюминиевую DSC на предварительно тарированный платиновый тигель и нагревали при 10 Смин-1 от окружающей температуры до 200 С. Продувку азотом поддерживали над образцом при 60 млмин-1. Программное обеспечение системы управления прибором представляло собой Thermal Advantage v4.6.6 и данные анализировали с использованием Universal Analysis v4.3A. 1H ЯМР. Спектры 1 Н ЯМР записывали на Bruker 400MHz приборе, оснащенном автосамплером и контролируемом с помощью DRX400 пульта управления. Автоматизированные эксперименты получали, используя ICON-NMR v4.0.4 (конфигурация 1), который работает с Topspin v1.3 (уровень пятна 6), используя стандартные Bruker загруженные эксперименты. Для нерутинной спектроскопии данные получали, используя только Topspin. Образцы готовили в d6-ДМСО, если не указано иное. Анализ в автономном режиме проводили, используя ACD SpecManager v 9.09 (конфигурация 7703). Скрининг полиморфов. Исследования кристаллизации проводили на свободном основании бендамустина для изучения полиморфизма в 24 различных растворителях. Растворители выбирали на основании переносимости (ICH класс 3 и 2) и чтобы получить диапазон диэлектрических констант, дипольных моментов и функциональных групп. Созревание, медленное охлаждение и кристаллизацию взвесей также использовали для получения различных форм свободного основания бендамустина. Когда это возможно, полную характеризацию проводили на новых формах, которые образовывались во время скрининга полиморфизма на свободном основании бендамустина. Такая характеризация состоит из следующего: порошковая рентгеновская дифракция; термический анализ; GVS и чистота с помощью ВЭЖХ. Эксперименты кристаллизации при созревании. Приблизительно 40 мг свободного основания бендамустина (свободное основание бендамустина формы 2 или свободное основание бендамустина формы 3) в 800 мкл растворителя (25 об.) суспендировали в 24 различных растворителях. Полученные смеси суспендировали в течение 48 ч с чередующимися 4-часовыми периодами при 50 и 5 С (-0,5 С/мин). Твердые вещества выделяли фильтрованием и анализировали с помощью XRPD и термического анализа. Вещества сушили при 40 С в течение 3 ч. Результаты показаны в табл. 16 и 17 ниже. Таблица 16 Кристаллизация медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина (форма 2 или 3) в 800 мкл растворителя(25 об.) суспендировали в 24 различных растворителях. Образцы нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с медленной скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества из каждой ампулы отделяли фильтрованием и оценивали с помощью XRPD и термического анализа. Твердое вещество сушили при 40 С в течение 3 ч. Результаты показаны в табл. 18 и 19 ниже. Таблица 18 Эксперименты кристаллизации суспендированием. Суспензии (40 мг свободного основания бендамустина в 400 мкл) встряхивали при 25 С в течение 48 ч. Твердое вещество отделяли фильтрованием и сушили при 40 С в течение 3 ч. XRPD результаты выделенного твердого вещества представлены в табл. 20. Таблица 20 Форма 1. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 2 в 800 мкл растворителя (20 об.) суспендировали в 2-бутаноле, ацетонитриле, циклогексане, этилацетате, метил-трет-бутиловом эфире, н-бутилацетате, пропионитриле и тетрагидропиране. Образцы нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Эксперименты кристаллизации при созревании. Приблизительно 40 мг свободного основания бендамустина формы 2 в 800 мкл растворителя (20 об.) суспендировали в 1-бутаноле, 1,4-диоксане, 1-пропаноле, ацетоне, хлороформе, циклогексане, этаноле, метилизобутилкетоне, метил-трет-бутиловом эфире, н-бутилацетате, пропионитриле, тетрагидропиране и толуоле. Полученные смеси суспендировали в течение 48 ч с чередующимися 4-часовыми периодами при 50 и 5 С (-0,5 С/мин). Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 1 показана в табл. 1 (выше) и на фиг. 1. Характеризация формы 1 с помощью термического анализа. Форма 1 показывает единичный пик приблизительно при 142,3 С с энтальпией плавления (HFus) 114,3 Дж/г. Отсутствие потери массы определяют с помощью TGA. Существование процесса десольватации не принимали во внимание, так как отсутствие потери массы определяли с помощью TGA (фиг. 1 А). Форма 2. Получение. Эксперименты медленного охлаждения. 1,08 г гидрохлорида бендамустина растворяли в 100 мл деионизированной воды. Эквивалент 1 мольNaOH (1 мол. в воде) добавляли по каплям, вызывая осаждение. Твердое вещество затем быстро отделяли фильтрованием и промывали на фильтре с 2 ч. деионизированной воды и 2 ч. гептана для удаления избытка воды. Твердое вещество сушили в вакууме при окружающей температуре в течение 18 ч. 752 мг твердого вещества получали и анализировали с помощью XRPD. Характеристика рентгеновской дифрактограммы кристаллической формы 2 показана в табл. 2 (выше) и на фиг. 2. Характеризация формы 2 с помощью термического анализа. Свободное основание бендамустина формы 2 показывает единичный пик приблизительно при 132,8 С с энтальпией плавления (HFus) 89,1 Дж/г. Отсутствие потери массы определяют с помощьюTGA. Существование процесса десольватации не принимали во внимание, так как отсутствие потери массы определяли с помощью TGA (фиг. 3). Форма 3. Получение. Эксперименты с медленным охлаждением. Свободное основание бендамустина получали основным гидролизом этилового сложного эфира бендамустина. После того как гидролиз был завершен, реакционную смесь нейтрализовали водной хлористо-водородной кислотой. При рН 6-7 продукт, осажденный в виде твердого вещества, отделяли фильтрованием и промывали водой. Сырой продукт растирали в смеси ацетона (20 мл) и метил-третбутилового эфира (5 мл). После фильтрования твердое вещество сушили при 60 С. Характеристика рентгеновской дифрактограммы кристаллической формы 3 показана в табл. 3 (выше) и на фиг. 4. Характеризация формы 3 с помощью термического анализа. Форма 3 показывает многократные начала приблизительно при 29,1 и 101,8 с энтальпией плавления(HFus) 142,5 и 76,2 Дж/г (фиг. 5). Эксперимент TGA снижает среднюю массу на 8,8% от 20 до 150 С. Теоретическое значение для включения 2 моль воды с 1 моль свободного основания бендамустина составляет 9,1% (фиг. 5). Форма. 4. Получение с помощью перехода твердое вещество-твердое вещество. Приблизительно 100 мг свободного основания бендамустина формы 3 подвергали воздействию 0% относительной влажности (RH) при 25 С в течение 30 мин. Характеристика рентгеновской дифрактограммы кристаллической формы 4 показана в табл. 4 (выше) и на фиг. 6. Форма 5. Получение с помощью перехода твердое вещество-твердое вещество. Приблизительно 100 мг свободного основания бендамустина формы 3 подвергали воздействию 85%RH (относительной влажности) при 25 С в течение 1 дня. Характеристика рентгеновской дифрактограммы кристаллической формы 5 показана в табл. 5 (выше) и на фиг. 7. Характеризация формы 5 с помощью термического анализа. Форма 5 показывает многократные начала приблизительно при 25,9, 82,6 и 123,0 с энтальпией плавления (HFus) 255,1, 20,6 и 23,4 Дж/г (фиг. 23). Эксперимент TGA снижает среднюю массу на 15,6% от 20 до 150 С. Теоретическое значение для включения 4 моль воды с 1 моль свободного основания бендамустина составляет 16,7% (фиг. 8). Форма 6. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 3 в 800 мкл растворителя (20 об.) суспендировали в 1-бутаноле или 1-пропаноле. Образцы нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Эксперименты кристаллизации при созревании. Приблизительно 40 мг свободного основания бендамустина формы 3 в 800 мкл растворителя (20 об.) суспендировали в 1-бутаноле. Смеси суспендировали в течение 48 ч с чередующимися 4-часовыми периодами при 50 и 5 С (-0,5 С/мин). Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 6 показана в табл. 6 (вы- 14020767 ше) и на фиг. 9. Характеризация формы 6 с помощью термического анализа. Форма 6 показывает единичное начало приблизительно при 207,8 С с энтальпией плавления (HFus) 28,0 Дж/г. Отсутствие потери массы определяют с помощью TGA. Существование процесса десольватации не принимали во внимание, так как отсутствие потери массы определяли с помощью TGA (фиг. 10). Форма 7. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 3 в 800 мкл растворителя (20 об.) суспендировали в N,N-диметилформамиде или изопропилацетате. Образцы нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Эксперименты кристаллизации при созревании. Приблизительно 40 мг свободного основания бендамустина формы 3 в 800 мкл растворителя (20 об.) суспендировали в N,N-диметилформамиде. Полученные смеси суспендировали в течение 48 ч с чередующимися 4-часовыми периодами при 50 и 5 С (-0,5 С/мин). Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 7 показана в табл. 7 (выше) и на фиг. 11. Характеризация формы 7 с помощью термического анализа. Форма 7 показывает единичное начало приблизительно при 200,6 С с энтальпией плавления (HFus) 12,7 Дж/г. Отсутствие потери массы определяют с помощью TGA. Существование процесса десольватации не принимали во внимание, так как отсутствие потери массы определяли с помощью TGA (фиг. 12). Форма 8. Получение. Эксперименты кристаллизации при созревании. Приблизительно 40 мг свободного основания бендамустина формы 3 добавляли в 800 мкл этанола(-0,5 С/мин). Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 8 показана в табл. 8 (выше) и на фиг. 13. Характеризация формы 8 с помощью термического анализа. Форма 8 показывает единичное начало приблизительно при 77,6 С с энтальпией плавления (HFus) 94,6 Дж/г. Форма 8 в эксперименте TGA снижает среднюю массу на 5,5% от 20 до 150 С. Теоретическое значение для включения 1 моль этанола с 2 моль свободного основания бендамустина составляет 5,4%(фиг. 14). Форма 9. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 2 добавляли в 800 мкл 3 пентанона (20 об.). Образец нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 9 показана в табл. 9 (выше) и на фиг. 15. Характеризация формы 9 с помощью термического анализа. Форма 9 показывает единичное начало приблизительно при 138,3 С с энтальпией плавления (HFus) 37,0 Дж/г. Форма 9 в эксперименте TGA снижает среднюю массу на 5,5% от 20 до 140 С. Теоретическое значение для включения 1 моль 3-пентанона с 4 моль свободного основания бендамустина составляет 5,7% (фиг. 16). Форма 10. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 2 добавляли в 800 мкл толуола(20 об.). Образец нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 10 показана в табл. 10 Характеризация формы 10 с помощью термического анализа. Форма 10 показывает два начала приблизительно при 109,3 и 144,9 С с энтальпией плавления(HFus) 5,6 и 98,3 Дж/г (фиг. 18). Отсутствие потери массы определяют с помощью TGA. Существование процесса десольватации не принимали во внимание, так как отсутствие потери массы определяли с помощью TGA. Форма 11. Получение. Эксперименты кристаллизации суспендированием. Приблизительно 40 мг свободного основания бендамустина формы 3 в 400 мкл 1-бутанола или 1,4 диоксана или изопропилацетата перемешивали при 25 С в течение 48 ч. Твердое вещество отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 11 показана в табл. 11(выше) и на фиг. 19. Характеризация формы 11 с помощью термического анализа. Форма 11 показывает многократные начала приблизительно при 30,5, 70,9 и 112,3 С с энтальпией плавления (HFus) 49,3, 51,0 и 74,9 Дж/г (фиг. 20). Форма 12. Получение. Эксперименты кристаллизации суспендированием. Приблизительно 40 мг свободного основания бендамустина формы 3 добавляли в 400 мкл N,Nдиметилформамида. Суспензию перемешивали при 25 С в течение 48 ч. Твердое вещество отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 12 показана в табл. 12(выше) и на фиг. 21. Характеризация формы 12 с помощью термического анализа. Форма 12 показывает многократные начала приблизительно при 56,8, 72,0, 111,5 и 206,7 с энтальпией плавления (HFus) 3,3, 1,6, 1,7 и 13,2 Дж/г (фиг. 22). Форма 13. Получение. Эксперименты с медленным охлаждением. Приблизительно 40 мг свободного основания бендамустина формы 3 в 800 мкл растворителя (20 об.) суспендировали в метил-трет-бутиловом эфире, 3-пентаноне и 1-пропаноле. Образцы нагревали от 20 до 80 С со скоростью 4,8 С/мин, через 30 мин охлаждали с низкой скоростью (0,25 С/мин) до конечной температуры 5 С и выдерживали при этой температуре в течение 18 ч. Твердые вещества отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 13 показана в табл. 13(выше) и на фиг. 23. Характеризация формы 13 с помощью термического анализа. Форма 13 показывает единичное начало приблизительно при 93,4 С с энтальпией плавления (HFus) 118,2 Дж/г. Эксперимент TGA снижает среднюю массу на 9,4% от 20 до 150 С. Теоретическое значение для включения 2 моль воды с 1 моль свободного основания бендамустина составляет 9,1% (фиг. 24). Форма 14. Получение. Эксперименты кристаллизации суспендированием. Приблизительно 40 мг свободного основания бендамустина формы 3 в 400 мкл ацетонитрила встряхивали при 25 С в течение 48 ч. Твердое вещество отделяли фильтрованием и сушили при 40 С в течение 3 ч. Продукт анализировали с помощью XRPD и термического анализа. Характеристика рентгеновской дифрактограммы кристаллической формы 14 показана в табл. 14(выше) и на фиг. 25. Характеризация формы 14 с помощью термического анализа. Форма 14 показывает многократные начала приблизительно при 25,8, 83,2 и 123,2 с энтальпией плавления (HFus) 215,4, 51,9 и 30,0 Дж/г. Эксперимент TGA снижает среднюю массу на 11,1% от 20 до 150 С. Теоретическое значение для включения 5 моль воды с 2 моль свободного основания бендамустина составляет 11,2% (фиг. 26). Форма 15. Получение. Эксперименты кристаллизации суспендированием. Приблизительно 25 мг свободного основания бендамустина формы 1 в 1,25 мл тетрагидрофурана растворяли при 50 С. При охлаждении до окружающей температуры происходило осаждение. Твердое вещество выделяли и быстро анализировали с помощью XRPD. Характеристика рентгеновской дифрактограммы кристаллической формы 15 показана в табл. 15 Характеризация формы 15 с помощью термогравиметрического анализа. Термогравиметрический анализ соответствует сольвату тетрагидрофурана (ТГФ) свободного основания бендамустина (фиг. 28). Характеризация формы 15 с помощью 1 Н ЯМР. 1 Н ЯМР спектр подтвердил, что присутствует ТГФ (0,05 экв.) (фиг. 29). Аморфное свободное основание бендамустина. Получение. Во время характеризации формы 3 с помощью VT-XRPD образовывалось аморфное свободное основание бендамустина. Значительные трансформации твердое вещество-твердое вещество не имели места в температурном диапазоне от 25 до 50 С для формы 3. Дегидратация гидрата формы 4 имеет место в температурном диапазоне от 50 до 66 С. Кристалличность исчезает в температурном диапазоне от 124 до 133 С, фиг. 30. После 133 С образец превращается в аморфный продукт, фиг. 31. Первый вариант осуществления настоящего изобретения обеспечивает фармацевтическую композицию, содержащую свободное основание бендамустина, выбранное из группы, включающей аморфное свободное основание бендамустина, форму 1 свободного основания бендамустина, форму 2 свободного основания бендамустина, форму 3 свободного основания бендамустина, форму 4 свободного основания бендамустина, форму 5 свободного основания бендамустина, форму 6 свободного основания бендамустина, форму 7 свободного основания бендамустина, форму 8 свободного основания бендамустина, форму 9 свободного основания бендамустина, форму 10 свободного основания бендамустина, форму 11 свободного основания бендамустина, форму 12 свободного основания бендамустина, форму 13 свободного основания бендамустина, форму 14 свободного основания бендамустина, форму 15 свободного основания бендамустина или их смесь. Второй вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой аморфное свободное основание бендамустина. Третий вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 1 свободного основания бендамустина. Четвертый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 2 свободного основания бендамустина. Пятый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 3 свободного основания бендамустина. Шестой вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 4 свободного основания бендамустина. Седьмой вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 5 свободного основания бендамустина. Восьмой вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 6 свободного основания бендамустина. Девятый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 7 свободного основания бендамустина. Десятый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 8 свободного основания бендамустина. Одиннадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 9 свободного основания бендамустина. Двенадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 10 свободного основания бендамустина. Тринадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 11 свободного основания бендамустина. Четырнадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 12 свободного основания бендамустина. Пятнадцатый вариант осуществления обеспечивает фармацевтическую композицию первого вари- 17020767 анта осуществления, где свободное основание бендамустина представляет собой форму 13 свободного основания бендамустина. Шестнадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 14 свободного основания бендамустина. Семнадцатый вариант осуществления обеспечивает фармацевтическую композицию первого варианта осуществления, где свободное основание бендамустина представляет собой форму 15 свободного основания бендамустина. Восемнадцатый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, где указанное свободное основание бендамустина выбрано из группы, включающей формы 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 свободного основания бендамустина или их смесь. Девятнадцатый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 1 свободного основания бендамустина. Двадцатый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 2 свободного основания бендамустина. Двадцать первый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 3 свободного основания бендамустина. Двадцать второй вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 4 свободного основания бендамустина. Двадцать третий вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 5 свободного основания бендамустина. Двадцать четвертый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 6 свободного основания бендамустина. Двадцать пятый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 7 свободного основания бендамустина. Двадцать шестой вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 8 свободного основания бендамустина. Двадцать седьмой вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 9 свободного основания бендамустина. Двадцать восьмой вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 10 свободного основания бендамустина. Двадцать девятый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 11 свободного основания бендамустина. Тридцатый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 12 свободного основания бендамустина. Тридцать первый вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 13 свободного основания бендамустина. Тридцать второй вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 14 свободного основания бендамустина. Тридцать третий вариант осуществления обеспечивает кристаллическую форму восемнадцатого варианта осуществления, где свободное основание бендамустина представляет собой форму 15 свободного основания бендамустина. Тридцать четвертый вариант осуществления обеспечивает кристаллическую форму по любому из вариантов осуществления от восемнадцатого до тридцать третьего, дополнительно содержащий аморфное свободное основание бендамустина. Тридцать пятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 10,34, 22,30, 24,03, 28,43 и 29,500,2 2. Тридцать шестой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно тридцать пятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 16,69, 20,53 и 22,670,2 2. Тридцать седьмой вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 1. Тридцать восьмой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от тридцать пятого до тридцать седьмого. Тридцать девятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 10,28, 20,59, 21,55, 21,69 и 24,780,2 2. Сороковой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно тридцать девятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 12,54, 13,51, 15,40 и 22,390,2 2. Сорок первый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 2. Сорок второй вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от тридцать восьмого до сорок первого. Сорок третий вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,41, 9,46, 14,15, 23,42 и 23,650,2 2. Сорок четвертый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно сорок третьему варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 14,15, 18,78 и 24,830,2 2. Сорок пятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 4. Сорок шестой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от сорок третьего до сорок пятого. Сорок седьмой вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,88, 15,13, 19,92, 22,99, 24,72 и 24,980,2 2. Сорок восьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно сорок седьмому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 19,44 и 20,700,2 2. Сорок девятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 6. Пятидесятый вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от сорок седьмого до сорок девятого. Пятьдесят первый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 8,94, 13,39, 16,04, 21,31 и 22,380,2 2. Пятьдесят второй вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно пятьдесят первому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 17,90, 19,29 и 25,370,2 2. Пятьдесят третий вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 7. Пятьдесят четвертый вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от пятьдесят первого до пятьдесят третьего. Пятьдесят пятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 8,67, 18,15, 20,94, 22,55 и 25,460,2 2. Пятьдесят шестой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно пятьдесят пятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 19,40, 22,95,26,21, 27,74 и 34,620,2 2. Пятьдесят седьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 9. Пятьдесят восьмой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от пятьдесят пятого до пятьдесят седьмого. Пятьдесят девятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 8,51, 17,97, 21,25, 28,09 и 36,310,2 2. Шестидесятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно пятьдесят девятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 11,42, 14,23,23,29, 24,04 и 28,090,2 2. Шестьдесят первый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 11. Шестьдесят второй вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от пятьдесят девятого до шестьдесят первого. Шестьдесят третий вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 и 26,400,2 2. Шестьдесят четвертый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно шестьдесят третьему варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 15,72,21,01, 21,30 и 30,870,2 2. Шестьдесят пятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 13. Шестьдесят шестой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от шестьдесят третьего до шестьдесят пятого. Шестьдесят седьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 4,44, 13,34, 16,73, 19,54 и 22,320,2 2. Шестьдесят восьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно шестьдесят седьмому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 22,98,23,45 и 24,800,2 2. Шестьдесят девятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 15. Семидесятый вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от шестьдесят седьмого до шестьдесят девятого. Семьдесят первый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 и 29,720,2 2. Семьдесят второй вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно семьдесят первому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 16,13, 25,75 и 37,710,2 2. Семьдесят третий вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 17. Семьдесят четвертый вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от семьдесят первого до семьдесят третьего. Семьдесят пятый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 8,90, 9,28, 13,94, 22,36 и 23,330,2 2. Семьдесят шестой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно семьдесят пятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 16,01, 19,30,21,29 и 25,380,2 2. Семьдесят седьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 19. Семьдесят восьмой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от семьдесят пятого до семьдесят седьмого. Семьдесят девятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,31, 9,35, 13,97, 14,03 и 23,380,2 2. Восьмидесятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно семьдесят девятому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 4,71, 24,75 и 26,060,2 2. Восемьдесят первый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 21. Восемьдесят второй вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от семьдесят девятого до восемьдесят первого. Восемьдесят третий вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,84, 14,76, 19,67 и 24,620,2 2. Восемьдесят четвертый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина согласно восемьдесят третьему варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 21,35, 22,21, 23,20 и 26,910,2 2. Восемьдесят пятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 23. Восемьдесят шестой вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от восемьдесят третьего до восемьдесят пятого. Восемьдесят седьмой вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 и 23,610,2 2. Восемьдесят восьмой вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно восемьдесят седьмому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 8,74, 15,85, 24,59, 25,28 и 27,160,2 2. Восемьдесят девятый вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 25. Девяностый вариант осуществления обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от восемьдесят седьмого до восемьдесят девятого. Девяносто первый вариант осуществления настоящего изобретения обеспечивает кристаллическую форму свободного основания бендамустина, которая имеет порошковую рентгенограмму, содержащую одно или несколько следующих отражений: 24,56, 19,92, 10,26, 8,10 и 4,090,2 2. Девяносто второй вариант осуществления обеспечивает кристаллическую форму свободного основания бендамустина согласно девяносто первому варианту осуществления, которая имеет порошковую рентгенограмму, дополнительно содержащую одно или несколько следующих отражений: 17,96, 23,83,26,01, 28,39 и 29,430,2 2. Девяносто третий вариант осуществления изобретения обеспечивает кристаллическую форму свободного основания бендамустина, имеющую порошковую рентгенограмму, по существу, как изображено на фиг. 27. Девяносто четвертый вариант осуществления изобретения обеспечивает фармацевтическую композицию, содержащую кристаллическую форму свободного основания бендамустина согласно любому из вариантов осуществления от девяносто первого до девяносто третьего. Девяносто пятый вариант осуществления изобретения обеспечивает способ лечения хронического лимфоцитарного лейкоза, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы или рака молочной железы, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества препарата, полученного из композиции согласно любому из вариантов осуществления от первого до девяносто четвертого. Как будет очевидно специалистам в данной области, многочисленные модификации и изменения настоящего изобретения возможны ввиду вышеизложенных сведений. Следовательно, понятно, что в пределах объема прилагаемой формулы изобретения настоящее изобретение может быть реализовано практически иным образом, чем конкретно описано в данном описании, и подразумевается, что объем настоящего изобретения включает все такие изменения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма 1 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 10,34, 22,30, 24,03, 28,43 и 29,500,2 2. 2. Кристаллическая форма 2 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 10,28, 20,59, 21,55, 21,69 и 24,780,2 2. 3. Кристаллическая форма 3 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,41, 9,46, 14,15, 23,42 и 23,650,2 2. 4. Кристаллическая форма 4 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,88, 15,13, 19,92, 22,99, 24,72 и 24,980,2 2. 5. Кристаллическая форма 5 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,94, 13,39, 16,04, 21,31 и 22,380,2 2. 6. Кристаллическая форма 6 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,67, 18,15, 20,94, 22,55 и 25,460,2 2. 7. Кристаллическая форма 7 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,51, 17,97, 21,25, 28,09 и 36,310,2 2. 8. Кристаллическая форма 8 сольватной формы свободного основания бендамустина с этанолом,которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,34, 10,45, 11,17, 15,32, 22,48, 24,98 и 26,400,2 2. 9. Кристаллическая форма 9 сольватной формы свободного основания бендамустина с 3 пертаноном, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 4,44, 13,34, 16,73, 19,54 и 22,320,2 2. 10. Кристаллическая форма 10 безводного свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 16,82, 16,93, 17,06, 19,68, 19,83, 22,87, 24,24, 28,63 и 29,720,2 2. 11. Кристаллическая форма 11 сольватной формы свободного основания бендамустина с 1 бутанолом, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 8,90, 9,28, 13,94, 22,36 и 23,330,2 2. 12. Кристаллическая форма 12 сольватной формы свободного основания бендамустина с N,Nдиметилформамидом, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,31, 9,35, 13,97, 14,03 и 23,380,2 2. 13. Кристаллическая форма 13 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,84, 14,76, 19,67 и 24,620,2 2. 14. Кристаллическая форма 14 гидратной формы свободного основания бендамустина, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 9,14, 17,72, 19,19, 21,13, 22,10, 23,12 и 23,610,2 2. 15. Кристаллическая форма 15 сольватной формы свободного основания бендамустина с тетрагидрофураном, которая имеет порошковую рентгеновскую дифрактограмму, содержащую одно или несколько следующих отражений: 24,56, 19,92, 10,26, 8,10 и 4,090,2 2. 16. Состав, содержащий аморфное свободное основание бендамустина и по меньшей мере одну кристаллическую форму по любому из пп.1-15. 17. Фармацевтическая композиция алкилирующего агента, содержащая кристаллическую форму свободного основания бендамустина по любому из пп.1-16. 18. Препарат, полученный из композиции по п.17 для применения в способе лечения хронического лимфоцитарного лейкоза, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы или рака молочной железы.
МПК / Метки
МПК: A61K 31/4184, A61P 35/00, C07D 235/16, A61P 35/02
Метки: свободного, основания, формы, бендамустина, новые
Код ссылки
<a href="https://eas.patents.su/30-20767-novye-formy-svobodnogo-osnovaniya-bendamustina.html" rel="bookmark" title="База патентов Евразийского Союза">Новые формы свободного основания бендамустина</a>
Предыдущий патент: Ингибиторы пролиферации и активации переносчика сигнала и активатора транскрипции (stats)
Следующий патент: Устройство и способ удаления примесей с помощью жидкостной экстракции меди
Случайный патент: Инертный анод для электролиза алюминия