7-([1,2,4]триазоло[1,5-α]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин, фармацевтическая композиция на его основе и способы лечения неврологических и психических расстройств
Формула / Реферат
1. Соединение формулы (I)
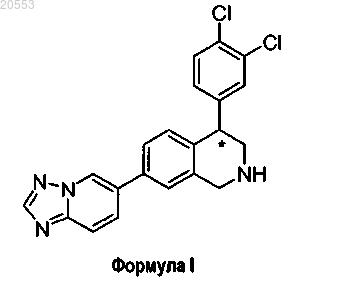
где атом углерода, обозначенный *, находится в R- или S-конфигурации;
или его фармацевтически приемлемая соль либо сольват.
2. Соединение по п.1, которое является (+)-стереоизомером.
3. Соединение по п.1, которое является (-)-стереоизомером.
4. Соединение по п.1, которое находится в S-конфигурации.
5. Соединение по п.1, которое находится в R-конфигурации.
6. Соединение по п.1, которое является (S)(+)-стереоизомером.
7. Соединение по п.1, которое является (R)(-)-стереоизомером.
8. Фармацевтическая композиция для лечения расстройства, которое вызвано или зависит от снижения доступности норадреналина, дофамина или серотонина, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по п.1.
9. Способ лечения расстройства, которое вызвано или зависит от снижения доступности норадреналина, дофамина или серотонина, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
10. Способ по п.9, где расстройство выбирают из группы, состоящей из синдрома гиперактивности с дефицитом внимания (СГДВ), когнитивного расстройства, тревожных расстройств, генерализованного тревожного расстройства (ГТР), панического расстройства, биполярного расстройства или маниакальной депрессии или маниакально-депрессивного расстройства, обсессивно-компульсивного расстройства (ОКР), посттравматического стрессового расстройства (ПТСР), острого стрессового расстройства, социальной фобии, простых фобий, предменструального дисфорического расстройства (ПДР), социального тревожного расстройства (СТР), тяжелого депрессивного расстройства (ТДР), послеродовой депрессии, дистимии, депрессии, связанной с болезнью Альцгеймера, болезнью Паркинсона, или психотических расстройств, надъядерного паралича, расстройств питания, ожирения, нервной анорексии, булимии, компульсивного обжорства, сахарного диабета, ишемической болезни, боли, расстройств, связанных со злоупотреблением психоактивными веществами, химической зависимости, никотиновой зависимости, кокаиновой зависимости, амфетаминной зависимости, алкоголизма, синдрома Леш-Найхена, нейродегенеративных заболеваний, болезни Паркинсона, синдрома поздней фазы лютеинизации или нарколепсии, психиатрических симптомов, гневливости, потери чувствительности, нарушений движений, экстрапирамидного синдрома, тиковых расстройств, синдрома беспокойных ног (СБН), поздней дискинезии, надъядерного паралича, расстройства питания, связанного со сном, синдрома ночного питания (СНП), стрессового недержания мочи (СНМ), мигрени, невропатической боли, диабетической невропатии, люмбаго, синдрома фибромиалгии (СФ), боли при остеоартрите, боли при артрите, синдрома хронической усталости (СХУ), сексуальной дисфункции, преждевременной эякуляции, мужской импотенции, терморегуляторных расстройств (например, приливы, связанные с менопаузой) и синдрома раздраженного кишечника (СРК).
11. Способ по п.9, где соединение является (+)-стереоизомером.
12. Способ по п.9, где соединение является (-)-стереоизомером.
13. Способ по п.9, где соединение находится в S-конфигурации.
14. Способ по п.9, где соединение находится в R-конфигурации.
15. Способ по п.9, где соединение является (S)(+)-стереоизомером.
16. Способ по п.9, где соединение является (R)(-)-стереоизомером.
17. Способ ингибирования обратного захвата синаптического норадреналина у пациента, включающий введение пациенту терапевтически эффективного ингибирующего количества соединения по п.1 или его фармацевтически приемлемой соли.
18. Способ по п.17, где соединение является (+)-стереоизомером.
19. Способ по п.17, где соединение является (-)-стереоизомером.
20. Способ по п.17, где соединение является (S)(+)-стереоизомером.
21. Способ по п.17, где соединение является (R)(-)-стереоизомером.
22. Способ ингибирования обратного захвата синаптического серотонина у пациента, включающий введение пациенту терапевтически эффективного ингибирующего количества соединения по п.1 или его фармацевтически приемлемой соли.
23. Способ по п.22, в котором соединение является (+)-стереоизомером.
24. Способ по п.22, где соединение является (-)-стереоизомером.
25. Способ по п.22, где соединение является (S)(+)-стереоизомером.
26. Способ по п.22, где соединение является (R)(-)-стереоизомером.
27. Способ ингибирования обратного захвата синаптического дофамина у пациента, включающий введение пациенту терапевтически эффективного ингибирующего количества соединения по п.1 или его фармацевтически приемлемой соли.
28. Способ по п.27, где соединение является (+)-стереоизомером.
29. Способ по п.27, где соединение является (-)-стереоизомером.
30. Способ по п.27, где соединение является (S)(+)-стереоизомером.
31. Способ по п.27, где соединение является (R)(-)-стереоизомером.
32. Способ подавления у людей тяги к курению, включающий введение человеку, нуждающемуся в таком подавлении, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
33. Способ по п.32, где соединение является (+)-стереоизомером.
34. Способ по п.32, где соединение является (-)-стереоизомером.
35. Способ по п.32, где соединение является (S)(+)-стереоизомером.
36. Способ по п.32, где соединение является (R)(-)-стереоизомером.
37. Способ подавления у людей тяги к употреблению алкоголя, включающий введение человеку, нуждающемуся в таком подавлении, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
38. Способ по п.37, где соединение является (+)-стереоизомером.
39. Способ по п.37, где соединение является (-)-стереоизомером.
40. Способ по п.37, где соединение является (S)(+)-стереоизомером.
41. Способ по п.37, где соединение является (R)(-)-стереоизомером.
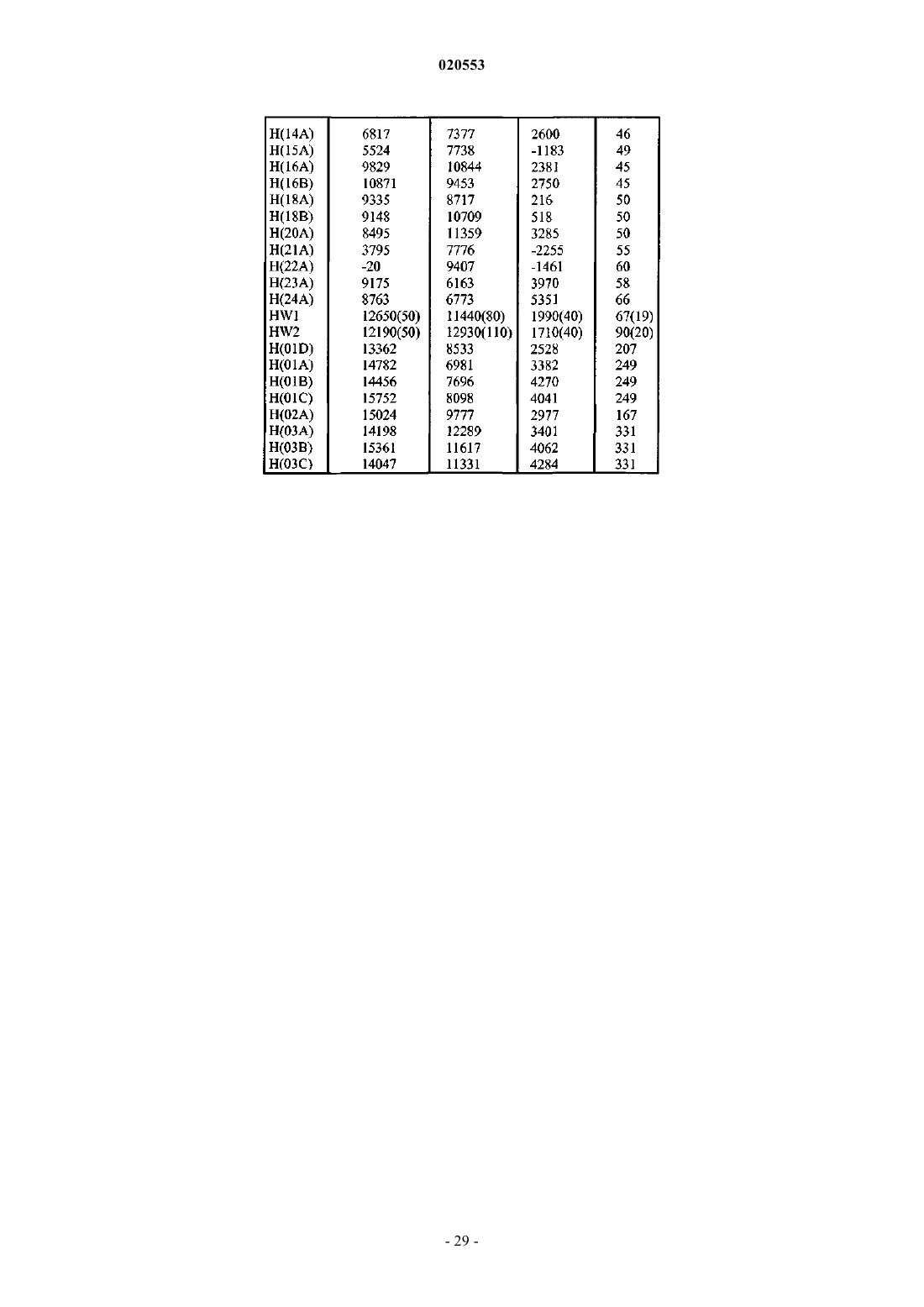
Текст
7-([1,2,4]ТРИАЗОЛО[1,5-]ПИРИДИН-6-ИЛ)-4-(3,4-ДИХЛОРФЕНИЛ)-1,2,3,4 ТЕТРАГИДРОИЗОХИНОЛИН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ И ПСИХИЧЕСКИХ РАССТРОЙСТВ Изобретение относится к новым [1,2,4]триазоло[1,5-]пиридинил-6-ил замещенным производным тетрагидроизохинолинов формулы (I) где атом углерода, обозначенный , находится в R- или S-конфигурации; или их фармацевтически приемлемой соли или сольвату и фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его соли либо сольвата для лечения различных неврологических и психических расстройств. Изобретение также относится к способу лечения расстройства, которое вызвано или зависит от снижения доступности норадреналина,дофамина или серотонина, к способам ингибирования обратного захвата синаптических норадреналина, серотонина или дофамина у пациента, к способу подавления у людей тяги к курению и к способу подавления желания людей к употреблению алкоголя, включающим введение терапевтически эффективного количества соединения формулы (I) или его соли либо сольвата. 020553 Заявка на данный патент заявляет о приоритете предварительной заявки на патентную заявку США,регистрационный 61/177474, поданной 12 мая 2009 г., которая включена в настоящее изобретение путем ссылки в полном объеме. Область техники Настоящее изобретение относится к соединениям, композициям и способам лечения различных неврологических и психических расстройств. В частности, предлагаемое изобретение относится к таким соединениям, композициям и способам, где соединения являются новыми [1,2,4]триазоло[1,5]пиридинил-6-ил-замещенными производными тетрагидроизохинолина. В настоящем изобретении описаны также способы получения данных соединений. Уровень техники Ингибиторы обратного захвата моноаминов повышают внеклеточные уровни серотонина (5-НТ),норадреналина (НА) и/или дофамина (ДА) в мозге посредством связывания с одним или более транспортерами, ответственными за обратный захват, называемыми транспортером серотонина (СЕРТ), транспортером норадреналина (HAT) и транспортером дофамина (ДАТ), посредством этого блокируя обратный захват нейротрансмиттера(ов) от синаптической щели. Ингибиторы обратного захвата моноаминов являются признанным классом лекарств, которые зарекомендовали себя в качестве эффективного средства лечения расстройств ЦНС, особенно большого депрессивного расстройства (БДР). После внедрения трициклических антидепрессантов (ТЦА) более 50 лет назад ингибиторы обратного захвата моноаминов со значительно улучшенными показателями безопасности в значительной степени усовершенствовали лечение депрессии. Несмотря на то что ТЦА являются очень эффективными антидепрессантами, сердечно-сосудистые,антихолинергические и седативные побочные действия являются обычными вследствие взаимодействия ТЦА с мускариновым, гистаминовым и адренергическим рецепторами. Революционное внедрение селективных ингибиторов обратного захвата серотонина (СИОЗС) в 1980-х годах позволило большему количеству пациентов вылечиться благодаря улучшенным показателям безопасности. За последние десятилетия ингибиторы, которые селективно блокируют обратный захват НА или ДА, или два из трех нейротрансмиттеров одновременно, стали доступными для лечения расстройств ЦНС, включая депрессию,страх, обсессивно-компульсивное расстройство (ОКР), синдром гиперактивности с дефицитом внимания(СГДВ), боль и непроизвольное мочеиспускание. Два недавних репрезентативных обзора (Liu andMolino, Annual Reports in Medicinal Chemistry, 42:13 (2007); Walter, Drug Dev. Res., 65:97 (2005 по ингибиторам обратного захвата моноаминов резюмировали историю и новейшие разработки в области ингибиторов обратного захвата моноаминов. В настоящее время основные усилия в области ингибиторов обратного захвата моноаминов сосредоточены на увеличении эффективности антидепрессанта, поскольку 30-40% пациентов не реагируют на лечение существующими антидепрессантами. Дополнительной основной целью является усиление начала действия. Существующие антидепрессанты обычно требуют 2-6-недельного применения до того, как наблюдается эффективность применяемого лечения. Клинические испытания, исследующие стратегии усиления, в которых ингибитор обратного захвата ДА или двойной ингибитор обратного захвата НА/ДА сочетается с СИОЗС, привели к повышению эффективности лечения только СИОЗС, не поддающихся лечению депрессивных пациентов (Patkar et al., J. Clin. Psychopharmacol., 26:653 (2006); Zisook et al., Biol.Psychiat., 59:203 (2006. Улучшенные результаты клинических исследований, таких как эти, служат оправданием значительного сосредоточения на развитии ингибиторов, которые одновременно блокируют обратный захват 5-НТ, НА и ДА. Из-за сохраняющейся потребности в улучшенных лекарственных средствах для лечения депрессии и возможностей для новых клинических показаний, усилия, направленные на открытие новых ингибиторов обратного захвата моноаминов, не ослабевают. Известно, что метилфенидат, в настоящее время использующийся для лечения синдрома гиперактивности с дефицитом внимания, является селективным для ингибирования ДАТ. Кроме того, в патенте США 5444070 представлена информация о селективных ингибиторах обратного захвата дофамина в качестве средства лечения болезни Паркинсона, привыкания или злоупотребления наркотиками, включая кокаин и амфетамины. Также представлена информация о селективных ингибиторах обратного захвата норадреналина(ИОЗН). В патенте США 6352986 описаны способы лечения синдрома гиперактивности с дефицитом внимания (СГДВ), аддиктивных расстройств и расстройств, связанных с употреблением психоактивного вещества с ребоксетином. Кроме того, в настоящее время продается атомоксетин (Страттера) в качестве селективного ингибитора обратного захвата HAT для СГДВ. Использование селективных ингибиторов обратного захвата серотонина (СИОЗС) показало эффективность лечения депрессивных расстройств. Сертралин, циталопрам, эсциталопрам, пароксетин, флуоксетин и флувоксамин являются хорошо известными примерами использования СИОЗС для лечения расстройств, таких как депрессия, обсессивно-компульсивное расстройство и приступы паники. Существуют некоторые известные проблемы с классом СИОЗС при лечении, включая медленное начало действия,нежелательные побочные эффекты, а также наличие значительной группы населения, которая не реаги-1 020553 рует на терапию СИОЗС. Последнее клиническое испытание новых СИОЗС было сосредоточено на лечении преждевременной эякуляции (ПЭ) путем использования задержки эякуляции побочными эффектами СИОЗС. Хотя СИОЗС были прописаны не по прямому назначению для лечения этого состояния,СИОЗС с быстрым началом действия и быстрым клиренсом может быть предпочтительным для лечения ПЭ при необходимости. Дапоксетин (LY210448, 6), СИОЗС, структурно родственный с флуоксетином с более коротким периодом полувыведения, как сообщается, при клинических исследованиях являлся эффективным и обычно хорошо переносимым лечением для мужчин, страдающих ПЭ в умеренной и тяжелой форме (Feret, Formulary, 40:227 (2005); Pryor et al., Lancet, 368:929 (2006. Селективные ингибиторы обратного захвата ДАТ, HAT и СЕРТ могут также совместно вводиться друг с другом или с другими лекарственными препаратами. В патенте США 5532244 представлена информация об использовании ингибиторов обратного захвата серотонина в сочетании с антагонистом серотонина 1 А для лечения обсессивно-компульсивного расстройства, депрессии и ожирения. В патенте США 6121261 представлена информация об использовании ингибитора обратного захвата серотонина или норадреналина в сочетании с антагонистом рецептора нейрокинина-1 для лечения СГДВ. В патенте США 4843071 представлена информация об использовании ингибитора обратного захвата норадреналина в сочетании с предшественником норадреналина при лечении ожирения, наркомании или нарколепсии. В патенте США 6596741 представлена информация об использовании ингибитора НА, ДА или 5 НТ с любым антагонистом рецептора нейрокинина-1 или антагонистом серотонина-1 А для лечения самых разнообразных состояний. Также преимущественным является использование соединений, которые ингибируют одни или несколько нейротрансмиттеров одновременно. В Европейском патенте ЕР 273658 приводится информация о преимуществах антидепрессанта двойного ингибитора обратного захвата HAT и СЕРТ дулоксетина. В патенте США 4535186 приводится информация о венлафаксине, как об ингибиторе обратного захвата и НА, и 5-НТ для лечения депрессивных расстройств. В патенте США 6635675 представлена информация об использовании двойного ингибитора обратного захвата НА и 5-НТ милнаципрана для лечения синдрома хронической усталости и синдрома фибромиалгии. Кроме того, в патенте США 6136083 также представлена информация о двойных ингибиторах обратного захвата НА и 5-НТ для лечения депрессии. В нем также подтверждается, что соединения, которые ингибируют обратный захват НА, ДА и 5-НТ в различных соотношениях, конкретно не упоминающиеся здесь, также будут полезными. После признания первого препарата ИОЗСН, венлафаксин стал одним из первоочередных средств курса лечения депрессии и тревожного расстройства. Активный метаболит, десвенлафаксин, находится также в стадии клинических испытаний для лечения тяжелых депрессивных расстройств. Доклинические исследования также показывают, что десвенлафаксин может быть эффективным в ослаблении вазомоторных симптомов, связанных с менопаузой (например, приливы и ночная потливость) (Sorbera, et al.,Drugs of Future., 31:304 (2006), Albertazzi, J. Br. Menopause Soc., 12:7 (2006. Десвенлафаксин, как сообщается, находится в стадии клинических испытаний для лечения фибромиалгии и нейропатической боли,а также вазомоторных симптомов, связанных с менопаузой. Наряду с лечением тяжелого депрессивного расстройства, дулоксетин был одобрен в качестве первого средства для лечения тяжелой диабетической невропатии в США. Он также использовался для лечения стрессового недержания мочи у женщин в Европе. В 2007 г. дулоксетин был одобрен для лечения генерализованного тревожного расстройства в США. Совсем недавно он был одобрен Управлением по контролю над продуктами и лекарствами для лечения фибромиалгии. Милнаципран в настоящее время доступен для использования в качестве антидепрессанта в нескольких странах за пределами США. Он также находится в стадии клинического исследования для оценки его потенциальной роли в лечении синдрома фибромиалгии. После более десяти лет использования бупропион считается безопасным и эффективным антидепрессантом, пригодным для использования в качестве первоочередного лечения. Кроме того, он одобрен в качестве средства для лечения курения и сезонного аффективного расстройства. Он также предписан для применения не по прямому назначению для лечения сексуальной дисфункции стимулированием СИОЗС. Бупропион часто относят к атипичным антидепрессантам. Он имеет намного меньшее сходство с транспортерами моноаминов по сравнению с другими ингибиторами обратного захвата моноаминов. Механизм действия бупропиона все еще не определен, но может быть связан с ингибированием транспортеров обратного захвата дофамина и норадреналина в результате действия активных метаболитов. По последнему отчету клинического испытания бупропион пролонгированного действия (XL) имел значительно лучший профиль сексуальной переносимости, чем у эсциталопрама с такой же степенью ремиссии и общей суммой баллов по Госпитальной шкале тревоги и депрессии (ГШТД) у пациентов с тяжелым депрессивным расстройством (Clayton et al., J. Clin. Psychiatry, 67:736 (2006. Лечение заболеваний путем ингибирования обратного захвата всех трех моноаминов либо посредством комбинированной терапии, или "тройных ингибиторов", также может иметь клинические результаты. Тройные ингибиторы считаются новым поколением антидепрессантов (Liang and Richelson, PrimaryPsychiatry, 15(4):50 (2008. Обоснование для включения улучшенного компонента дофамина в антиде-2 020553 прессантную терапию включает в себя полученные опытным путем недостатки дофаминергической функции, успех комбинированной терапии с антагонистами дофамина и традиционными антидепрессантами, а также повышенную чувствительность к дофаминовым рецепторам вследствие продолжительного применения антидепрессантов (Skolnick et al., Life Sciences, 73:3175-3179 (2003. Было показано, что комбинированная терапия СИОЗС с ингибитором обратного захвата норадреналина и дофамина является более эффективной при лечении пациентов с резистентностью к лечению депрессии (Lam et al., J. Clin.Psychiatry, 65 (3):337-340 (2004. Клинические исследования с использованием сочетания бупропиона и СИОЗС или ИОЗСН показали улучшение эффективности при лечении ТДР у пациентов, резистентных к монотерапии СИОЗС, ИОЗСН или бупропионом (Zisook et al., Biol. Psychiat., 59:203 (2006); Papkostas,Depression and Anxiety, 23:178-181 (2006); Trivedi et al., New Engl. J. Med., 354:1243 (2006. Другие исследования с использованием метилфенидата как с немедленным высвобождением, так и продленным высвобождением активного вещества, показали его эффективность как усилителя препарата при резистентности к лечению депрессии (Patkar et al., J. Clin. Psychopharmacol., 26:653 (2006), Masand et al., Depression and Anxiety, 7:89 (1998. Кроме того, сочетание бупропиона SR с СИОЗС или ингибиторами обратного захвата норадреналина и дофамина позволило определить его меньшее участие в вызывании сексуальной дисфункции, чем при монотерапии (Kennedy et al., J. Clin. Psychiatry, 63 (3):181-186 (2002. Таким образом, ингибирующая активность в отношении обратного захвата ДА, дополнительно к обратному захвату НА и 5-НТ, как ожидается, обеспечит более быстрое развитие начала эффекта антидепрессанта, чем другие смешанные ингибиторы, которые являются более селективными для HAT и СЕРТ, чем для ДАТ. В международных публикациях РСТ WO 03/101453 и WO 97/30997 представлена информация о классе соединений, которые активны в отношении всех трех транспортеров моноаминов. В международной публикации РСТ WO 03/049736 представлена информация о классе 4-замещенных пиперидинов,каждый из которых отображает подобную активность в отношении транспортеров ДА, НА и 5-НТ. В качестве тройных ингибиторов трех транспортеров моноаминов описываются также бицикло[2.2.1]гептаны (Axford et al., Bioorg. Med. Chem. Lett., 13:3277-3280 (2003 и азабицикло[3.1.0]гексаны(Skolnick et al., Eur. J. Pharm., 461:99-104 (2003. Показано, что 1-(3,4-дихлорфенил)-3 азабицикло[3.1.0]гексан является эффективным при лечении депрессии в клинических испытаниях (Beeret al., J. Clin. Pharmacol., 44:1360-1367 (2004. Широко использующийся в настоящее время препарат против ожирения сибутрамин, как полагают, работает посредством ингибирования всех трех транспортеров ДАТ, СЕРТ и HAT (Ryan, Pharmacotherapy of Obesity, 245-266 (2004. Последние одобренные лекарственные препараты с ИОЗСН для лечения фибромиалгии и диабетической невропатии подтвердили полезность этого класса лекарственных препаратов при лечении нейропатической боли. Другие значительные неизученные области, в которых все еще используется данный класс лекарственных препаратов, включают сексуальную дисфункцию, такую как преждевременная эякуляция, синдром раздраженного кишечника, ожирение, нейродегенеративные заболевания, такие как болезнь Паркинсона, синдром беспокойных ног, токсикоманию и наркоманию. По-прежнему существует большая потребность в соединениях, которые блокируют обратный захват норадреналина, дофамина и серотонина и являются средством лечения различных неврологических и психических расстройств. Настоящее изобретение направлено на достижение данной цели. Сущность изобретения Настоящее изобретение относится к соединению формулы (I) где атом углерода, обозначенный , находится в R- или S-конфигурации; или его фармацевтически приемлемой соли или сольвату, к фармацевтической композиции, для лечения расстройства, которое вызвано или зависит от снижения доступности норадреналина, дофамина или серотонина, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли либо сольвата. Настоящее изобретение также относится к способам лечения расстройства, которое вызвано или зависит от снижения доступности норадреналина, дофамина или серотонина, включающим введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по формулы (I) или его фармацевтически приемлемой соли либо сольвата, где расстройство выбирают из группы,состоящей из синдрома гиперактивности с дефицитом внимания (СГДВ), когнитивного расстройства,-3 020553 тревожных расстройств, генерализованного тревожного расстройства (ГТР), панического расстройства,биполярного расстройства или маниакальной депрессии или маниакально-депрессивного расстройства,обсессивно-компульсивного расстройства (ОКР), посттравматического стрессового расстройства(ПТСР), острого стрессового расстройства, социальной фобии, простых фобий, предменструального дисфорического расстройства (ПДР), социального тревожного расстройства (СТР), тяжелого депрессивного расстройства (ТДР), послеродовой депрессии, дистимии, депрессии, связанной с болезнью Альцгеймера, болезнью Паркинсона, или психотических расстройств, надъядерного паралича, расстройств питания, ожирения, нервной анорексии, булимии, компульсивного обжорства, сахарного диабета, ишемической болезни, боли, расстройств, связанных со злоупотреблением психоактивными веществами,химической зависимости, никотиновой зависимости, кокаиновой зависимости, амфетаминной зависимости, алкоголизма, синдрома Леш-Найхена, нейродегенеративных заболеваний, болезни Паркинсона, синдрома поздней фазы лютеинизации или нарколепсии, психиатрических симптомов, гневливости, потери чувствительности, нарушений движений, экстрапирамидного синдрома, тиковых расстройств, синдрома беспокойных ног (СБН), поздней дискинезии, надъядерного паралича, расстройства питания, связанного со сном, синдрома ночного питания (СНП), стрессового недержания мочи (СНМ), мигрени, невропатической боли, диабетической невропатии, люмбаго, синдрома фибромиалгии (СФ), боли при остеоартрите,боли при артрите, синдрома хронической усталости (СХУ), сексуальной дисфункции, преждевременной эякуляции, мужской импотенции, терморегуляторных расстройств (например, приливы, связанные с менопаузой) и синдрома раздраженного кишечника (СРК). Изобретение также относится к способу ингибирования обратного захвата синаптического норадреналина у пациента, к способу ингибирования обратного захвата синаптического серотонина у пациента и к способу ингибирования обратного захвата синаптического дофамина у пациента, включающим введение пациенту терапевтически эффективного ингибирующего количества соединения по п.1 или его фармацевтически приемлемой соли, где соединение является (+)-стереоизомером или (-)-стереоизомером или (S)(+)-стереоизомером или (R)(-)стереоизомером. Изобретение также относится к способу подавления у людей тяги к курению и к способу подавления у людей тяги к алкоголю, включающим введение человеку терапевтически эффективного ингибирующего количества соединения по п.1 или его фармацевтически приемлемой соли. При этом соединение является (+)-стереоизомером или (-)-стереоизомером или (S)(+)-стереоизомером или (R)(-)стереоизомером. Краткое описание чертежей На фиг. 1 представлены диаграммы экспериментальной и смоделированной порошковой рентгеновской дифракции (ПРД) (CuK =1,54178 при Т=комнатная температура) формы SA-1. На фиг. 2 представлена диаграмма дифференциальной сканирующей калориметрии (ДСК) формыSA-1. На фиг. 3 представлены результаты термогравиметрического анализа (ТГА) формы SA-1. Подробное описание изобретения Настоящее изобретение относится к соединению формулы (I) где атом углерода, обозначенный , находится в R- или S-конфигурации; или его фармацевтически приемлемой соли либо сольвату. Во всем описании сущности изобретения следующие термины должны пониматься в следующих значениях, если не указано иное. Термин "соединения изобретения" и аналогичные термины включают соединения общей формулы(I), описанной выше, где термин включает выражение фармацевтически приемлемые соли и сольваты,например гидраты, если это допускается контекстом. Подобным образом, ссылка на промежуточные продукты, заявленные самостоятельно или нет, означает использование их солей и сольватов, если это допускается контекстом. Во избежание сомнений, отдельные предложения, если это допускается контекстом, иногда выделяются в тексте, но эти предложения являются исключительно иллюстративными, и данное действие не предназначено для исключения других предложений, если это допускается контекстом. Термин "фармацевтически приемлемые соли" означает относительно нетоксичные, неорганические и органические кислотно-аддитивные соли и основно-аддитивные соли соединений настоящего изобре-4 020553 тения. Эти соли могут быть получены in situ в условиях окончательного выделения в чистом виде и при очистке соединений. В частности, кислотно-аддитивные соли могут быть получены отдельной реакцией очищенного соединения в форме свободного основания с соответствующей органической или неорганической кислотой и выделением образовавшейся соли. Типичные кислотно-аддитивные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат,нафтилат, мезилат, глюкогептонат, лактобионат, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-b-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинатлаурилсульфонаты и т.п. (см., например, Berge et al., "Pharmaceutical Salts", J. Pharm. Sci. 66:1-9 (1977) и Remington'sPharmaceutical Sciences, 17th ed., Mack Publishing Company, Истон, штат Пенсильвания, 1985, с. 1418,которые включены в настоящее изобретение путем ссылки в полном объеме). Основно-аддитивные соли также могут быть получены отдельной реакцией очищенного соединения в его кислотной форме с соответствующим органическим или неорганическим основанием и выделением образовавшейся соли. Основно-аддитивные соли включают фармацевтически приемлемые соли металлов и аминов. Соответствующие соли металлов включают соли натрия, калия, кальция, бария, цинка, магния и алюминия. Предпочтительными являются соли натрия и калия. Соответствующие неорганические основно-аддитивные соли получают из оснований металлов, к которым относятся, например, гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния и гидроксид цинка. Соответствующие основно-аддитивные соли аминов получают из аминов, которые имеют достаточную основность для образования стабильной соли, и преимущественно к ним относятся те амины, которые часто применяются в медицинской химии из-за их низкой токсичности и возможности применения в медицине, такие как аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенэтиламин,диэтиламин, пиперазин, трис(гидроксиметил)аминометан, гидроксид тетраметиламмония, триэтиламин,дибензиламин, эфенамин, дегидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний,тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например лизин и аргинин, дициклогексиламин и т.п. Термин "практически чистая" относится к химической чистоте и чистоте формы. Например, практически чистая форма SA-1 (или форма N-2) содержит по меньшей мере около 95 мас.%, предпочтительно по меньшей мере около 98 мас.%, более предпочтительно по меньшей мере около 99 мас.% формыSA-1 и менее 5 мас.%, предпочтительно менее 2 мас.% и более предпочтительно менее 1 мас.% других соединений, имеющих отличную от S-энантиомера формулы (I) химическую структуру. Кроме того,практически чистая форма SA-1 (или форма N-2) содержит по меньшей мере около 95 мас.%, предпочтительно по меньшей мере около 98 мас.%, более предпочтительно по меньшей мере около 99 мас.% формы SA-1 и менее 5 мас.%, предпочтительно менее 2 мас.% и более предпочтительно менее 1 мас.% любой другой кристаллической формы S-энантиомера формулы (I). Это означает, что форма SA-1 (или форма N-2) преимущественно содержит менее 5 мас.% других соединений и менее 5 мас.% любой другой формы (также упоминается как "гомогенность фаз"). Термин "терапевтически эффективные количества" подразумевает описание количества соединений настоящего изобретения, эффективно повышающего уровень серотонина, норадреналина, дофамина в синапсе, и тем самым производящего желаемый терапевтический эффект. Такое количество обычно варьируется в соответствии с рядом факторов, известных специалистам в данной области, дающих описание, приводимое в настоящем документе для разъяснения и принятия во внимание. Они включают, не ограничиваясь: индивидуального пациента, а также его возраст, вес, рост, общее физическое состояние и историю болезни, в частности, используемое соединение, а также носитель, в котором оно находится, и способы приема, выбранные для него; характер и тяжесть состояния пациента, подлежащего лечению. Термин "лекарственный препарат" означает препарат, содержащий соединение формулы (I), и хотя бы один компонент, содержащий фармацевтически приемлемые носители, разбавители, вспомогательные лекарственные вещества, субстанции или наполнители, такие как консерванты, наполнители, вещества для улучшения распадаемости таблеток, смачивающие вещества, эмульгаторы, суспендирующие вещества, подсластители, вкусовые добавки, ароматизирующие вещества, антибактериальные вещества,противогрибковые средства, смазывающие вещества и распределяющие вещества, в зависимости от способа введения и лекарственной формы. Примеры суспендирующих веществ включают этоксилированные изостеариловые спирты, полиоксиэтилен сорбит и эфиры сорбитана, микрокристаллическую целлюлозу,метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ. Предотвращение действия микроорганизмов может быть обеспечено различными антибактериальными и противогрибковыми веществами, например парабенами, хлорбутанолом, фенолом, сорбиновой кислотой и т.п. Может быть также желательно включать изотонические агенты, например сахара, хлорид натрия и др. Пролонгированное всасывание инъецируемой лекарственной формы может быть достигнуто посредством веществ, замедляющих всасывание, например моностеарата алюминия и желатина. Примерами применяемых носителей, разбавителей, растворителей или наполнителей являются вода, этанол, полиолы, их со-5 020553 ответствующие смеси, растительные масла (например, оливковое масло) и инъецируемые органические сложные эфиры, такие как этилолеат. Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция и дикальцийфосфат. Примерами веществ для улучшения распадаемости таблеток являются крахмал, альгиновая кислота и некоторые сложные силикаты. Примерами смазочных веществ являются стеарат магния, лаурилсульфат натрия, тальк, а также высокомолекулярные полиэтиленгликоли. Термин "фармацевтически приемлемый" означает, что препарат в полном объеме по результатам тщательной медицинской оценки является пригодным для использования в контакте с клетками человека и низших животных без чрезмерной токсичности, раздражения, аллергических реакций и т.п. и обладает целесообразным соотношением польза/риск. Термин "фармацевтически приемлемые лекарственные формы" подразумевает лекарственные формы соединения изобретения и включает, к примеру, таблетки, драже, порошки, эликсиры, сиропы, жидкие средства, в том числе суспензии, спреи, летучие таблетки, пастилки, эмульсии, растворы, гранулы,капсулы и суппозитории, а также жидкие препараты для инъекций, включая липосомальные препараты. Методики и композиции, как правило, можно найти в издании Remington's Pharmaceutical Sciences, MackPublishing Co., Истон, штат Пенсильвания, последнее издание. В одном из предпочтительных вариантов осуществления настоящего изобретения соединение формулы (I) является (+)-стереоизомером. В другом предпочтительном варианте настоящего изобретения соединение формулы (I) является(-)-стереоизомером. Другим более предпочтительным вариантом настоящего изобретения является соединение формулы (I), в котором атом углерода, обозначенный , находится в R-конфигурации. Другим более предпочтительным вариантом настоящего изобретения является соединение формулы (I), в котором атом углерода, обозначенный , находится в S-конфигурации. В другом более предпочтительном варианте настоящего изобретения соединение формулы (I) является (S)(+)-стереоизомером. В еще одном предпочтительном варианте настоящего изобретения соединение формулы (I) является (R)(-)-стереоизомером. Другой предпочтительный вариант настоящего изобретения является смесью стереоизомерных соединений формулы (I), где атом углерода, обозначенный , находится в S- или R-конфигурации. Отдельные энантиомеры, любые смеси энантиомеров, включая рацемические смеси, или диастереомеры (отдельно или в смеси) соединений настоящего изобретения также являются частью изобретения. Настоящее изобретение также включает активные метаболиты представленных соединений. Настоящее изобретение также включает соединения формулы (I), в которых один или более атомов,например С или Н, замещены соответствующими радиоактивными изотопами этого атома (например, С замещен С 14 и Н замещен 3 Н), или стабильным изотопом этого атома (например, С замещен 13 С или Н замещен 2 Н). Такие соединения имеют множество потенциальных областей применения, например, в качестве стандартов и реагентов при определении способностей потенциального лекарственного препарата связываться с белками нейротрансмиттерами. Кроме того, в случае стабильных изотопов, такие соединения могут иметь потенциал для благоприятного изменения биологических свойств, например фармакологических и/или фармакокинетических свойств, соединений формулы (I). Специалистам в данной области известны детали, касающиеся выбора подходящих центров внедрения радиоактивных изотопов в соединения. Другой аспект настоящего изобретения относится к кристаллической форме 7-([1,2,4]триазоло[1,5]пиридинил-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина, в частности, форме SA-1 или форме N-2, описанных в данном документе. С целью разъяснения, рацемат свободного основания рац-7([1,2,4]триазоло[1,5-]пиридинил-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина представлен формулой (I). Формы SA-1 и N-2 являются особыми кристаллическими формами S-энантиомера формулы (I) S)-7-([1,2,4]триазоло[1,5-]пиридинил-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин),описанного в данном документе. Таким образом, один из вариантов осуществления настоящего изобретения относится к форме SA1. Один из аспектов этого варианта осуществления настоящего изобретения относится к форме SA-1,характеризующейся следующими параметрами элементарной ячейки: Размеры ячейки:c=15,3927(14)альфа=90 бета=100,594(7) гамма=90 Группа симметрии кристаллической решетки: моноклинная, Р 21Z, Расчетное значение плотности: 2, 1,363 мг/м 3 Другой аспект данного варианта осуществления настоящего изобретения относится к форме SA-1,характеризующейся дробными атомными координатами внутри элементарной ячейки, перечисленными в табл. 6, атомные координаты. Еще один аспект данного варианта осуществления настоящего изобретения относится к форме SA-1 с характерными пиками на диаграммах порошковой рентгеновской дифракции при значениях тета 5,80,1, 8,10,1, 9,10,1, 10,80,1, 11,70,1, 13,00,1, 13,30,1, 14,50,1, 15,10,1, 15,40,1, 16,20,1 и 16,80,1, при температуре от 20 до 25C, основанными на высоком качестве диаграммы, полученной при помощи дифрактометра (CuK) с вращающейся капиллярной трубкой, откалиброванного по 20 значениям Национальным институтом стандартов и технологий (НИСТ), или посредством другого пригодного стандарта. Другой аспект данного варианта осуществления настоящего изобретения относится к форме SA-1,характеризующейся эндотермой расплава с разложением с началом процесса обычно при температуре около 85C. Еще один аспект данного варианта осуществления настоящего изобретения относится к практически чистой форме SA-1. Другой вариант осуществления настоящего изобретения относится к форме N-2. Один из аспектов данного варианта осуществления настоящего изобретения относится к форме N-2, характеризующейся следующими параметрами элементарной ячейки: Размеры ячейки:c=26,3602(9)альфа=90 бета=90 гамма=90 Группа симметрии кристаллической решетки: орторомбическая, Р 212121 Объем: 3981,0(2) 3Z, Расчетное значение плотности: 8, 1,441 мг/м 3 Другой аспект данного варианта осуществления настоящего изобретения относится к форме N-2,характеризующейся дробными атомными координатами внутри элементарной ячейки, перечисленными в табл. 8, атомные координаты. Еще один аспект данного варианта осуществления настоящего изобретения относится к форме N-2 с характерными пиками на диаграммах порошковой рентгеновской дифракции при значениях тета 8,30,1, 8,90,1, 10,90,1, 14,20,1, 14,70,1, 16,70,1, 17,30,1, 18,00,1, 18,40,1, 18,80,1, 20,20,1, и 21,90,1, при температуре от 20 до 25C, основанными на высоком качестве диаграммы, полученной при помощи дифрактометра (CuK) с вращающейся капиллярной трубкой, откалиброванного по 20 значениям Национальным институтом стандартов и технологий (НИСТ), или посредством другого пригодного стандарта. Другой аспект данного варианта осуществления настоящего изобретения относится к форме N-2,характеризующейся эндотермой расплава с разложением, с началом процесса обычно при температуре около 250C. Еще один аспект данного варианта осуществления настоящего изобретения относится к практически чистой форме N-2. Другим аспектом настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или кристаллической формы, описанных в данном документе, и фармацевтически приемлемый носитель. Другой аспект настоящего изобретения относится к способу лечения расстройства, которое возникает или зависит от сокращения наличия серотонина, норадреналина или дофамина. Способ включает введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I), кристаллической формы соединения формулы (I) или его фармацевтически приемлемой соли. Способ настоящего изобретения является эффективным для лечения пациентов, страдающих от различных неврологических и психических расстройств, включающих, не ограничиваясь: синдром гиперактивности с дефицитом внимания (СГДВ), когнитивное расстройство, тревожные расстройства, генерализованное тревожное расстройство (ГТР), паническое расстройство, биполярное расстройство или маниакальную депрессию или маниакально-депрессивное расстройство, обсессивно-компульсивное расстройство (ОКР), посттравматическое стрессовое расстройство (ПТСР), острые стрессовые расстройства,социальную фобию, простые фобии, предменструальное дисфорическое расстройство (ПДР), социальное тревожное расстройство (СТР), тяжелое депрессивное расстройство (ТДР), послеродовую депрессию,дистимию, депрессию, связанную с болезнью Альцгеймера, болезнью Паркинсона, или психотические-7 020553 расстройства, надъядерный паралич, расстройства питания, ожирение, нервную анорексию, булимию,компульсивное обжорство, сахарный диабет, ишемическую болезнь, боль, расстройства, связанные со злоупотреблением психоактивными веществами, химическую зависимость, никотиновую зависимость,кокаиновую зависимость, амфетаминную зависимость, алкоголизм, синдром Леш-Найхена, нейродегенеративные заболевания, болезнь Паркинсона, синдром поздней фазы лютеинизации или нарколепсию,психиатрические симптомы, гневливость, потерю чувствительности, нарушение движений, экстрапирамидный синдром, тиковые расстройства, синдром беспокойных ног (СБН), позднюю дискинезию, надъядерный паралич, расстройство питания, связанное со сном, синдром ночного питания (СНП), стрессовое недержание мочи (СНМ), мигрень, невропатическую боль, диабетическую невропатию, люмбаго, синдром фибромиалгии (СФ), боль при остеоартрите, боль при артрите, синдром хронической усталости(СХУ), сексуальную дисфункцию, преждевременную эякуляцию, мужскую импотенцию, терморегуляторные расстройства (например, приливы, связанные с менопаузой) и синдром раздраженного кишечника (СРК). Соединения/кристаллические формы, представленные в настоящем документе, особенно полезны при лечении этих и других расстройств, обусловленных, по крайней мере частично, их способностью избирательно связываться с белками-транспортерами определенных нейрохимических веществ в большей степени, чем с белками-транспортерами других нейрохимических веществ. Другим вариантом осуществления настоящего изобретения является способ ингибирования у пациента синаптического обратного захвата норадреналина, при необходимости. Способ включает введение терапевтически эффективного ингибирующего количества соединения формулы (I) или кристаллической формы, как описано выше. Другим вариантом осуществления настоящего изобретения является способ ингибирования у пациента синаптического обратного захвата серотонина, при необходимости. Способ включает введение терапевтически эффективного ингибирующего количества соединения формулы (I) или кристаллической формы, как описано выше. Другим вариантом осуществления настоящего изобретения является способ ингибирования у пациента синаптического обратного захвата дофамина, при необходимости. Способ включает введение терапевтически эффективного ингибирующего количества соединения формулы (I) или кристаллической формы, как описано выше. Другим вариантом осуществления настоящего изобретения является терапевтический способ, описанный выше, в котором используется (+)-стереоизомер соединения формулы (I). Другим вариантом осуществления настоящего изобретения является терапевтический способ, описанный выше, в котором используется (-)-стереоизомер соединения формулы (I). Другой вариант осуществления настоящего изобретения относится к лечению у пациентов расстройства, относящегося к вышеуказанным осуществлениям изобретения, при необходимости. Способ включает ингибирование обратного захвата норадреналина, дофамина и серотонина посредством введения терапевтически эффективного ингибирующего количества соединения формулы (I) или кристаллической формы, как описано выше, который действует как ингибитор тройного действия обратного захвата норадреналина, дофамина и серотонина. Другой вариант осуществления настоящего изобретения относится к способу ингибирования обратного захвата серотонина у млекопитающих. Способ включает введение млекопитающим, нуждающимся в повышении нейротрансмиссии серотонина, терапевтически эффективного количества соединения формулы (I) или кристаллической формы, как описано выше. Другой вариант осуществления настоящего изобретения относится к способу ингибирования обратного захвата дофамина у млекопитающих. Способ включает введение млекопитающим, нуждающимся в повышении нейротрансмиссии дофамина, терапевтически эффективного количества соединения формулы (I) или кристаллической формы, как описано выше. Другой вариант осуществления настоящего изобретения относится к способу ингибирования обратного захвата норадреналина у млекопитающих. Способ включает введение млекопитающим, нуждающимся в повышении нейротрансмиссии норадреналина, терапевтически эффективного количества соединения формулы (I) или кристаллической формы, как описано выше. Другой вариант осуществления настоящего изобретения относится к способу подавления тяги человека к курению. Способ включает введение человеку в случае необходимости определенной эффективной дозы соединения формулы (I) или кристаллической формы, как описано выше, для подавления тяги к курению. Другой вариант осуществления настоящего изобретения относится к способу подавления алкогольной зависимости человека. Способ включает введение человеку в случае необходимости определенной эффективной дозы соединения формулы (I) или кристаллической формы, как описано выше, для подавления алкогольной зависимости. Соединения согласно изобретению, например исходные вещества, промежуточные соединения или продукты, получают, как описано в данной публикации, или при применении или усовершенствовании известных способов, под которыми подразумевают способы, применяемые ранее или описанные в лите-8 020553 ратуре. Соединения, применимые согласно изобретению, могут быть получены применением или усовершенствованием известных способов, под которыми подразумевают способы, применяемые ранее или описанные в литературе, например способы, описанные в работе Larock Comprehensive Organic Transformations, Wiley-VCH publishers, Нью-Йорк (1989), которые включены в настоящее изобретение путем ссылки в полном объеме. Соединение формулы I, включающее группу, содержащую один или более атомов азота в кольце,может быть преобразовано в аналогичное соединение, в котором один или более входящих в кольцо атомов азота группы окисляют до оксида азота, преимущественно при взаимодействии с перкислотой, например перуксусной кислотой в уксусной кислоте или мета-хлорпероксибензойной кислотой в инертном растворителе, таком как дихлорметан, при температуре примерно от комнатной до температуры дефлегмирования, преимущественно при повышенной температуре. В реакциях, описанных ниже, может быть необходима защита реакционноспособных функциональных групп, например гидрокси-, амино-, имино-, тио- или карбоксигрупп, в случае, когда они необходимы в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Традиционные защитные группы могут быть использованы в соответствии со стандартной методикой (например, Wuts et al.,Protective Groups in Organic Chemistry (4th Edition), Wiley (2006), и McOmie, Protective Groups in OrganicChemistry, Plenum Press (1973), которые включены в настоящее изобретение путем ссылки в полном объеме). Новые тетрагидроизохинолиновые ингибиторы обратного захвата формулы I настоящего изобретения могут быть получены по схеме синтеза, изображенной на схеме 1. Схема 1 1-(3-Метоксифенил)-N-метилметанамин реагирует с 3,4-дихлорофенацил бромидом в присутствии триэтиламина, с получением 1-(3,4-дихлорфенил)-2-3-метоксибензил)(метил)амино)этанона. Восстановление кетона боргидридом натрия дает 1-(3,4-дихлорфенил)-2-3-метоксибензил)(метил)амино)этанол, который подвергается кислотно-опосредованной циклизации до 4-(3,4-дихлорфенил)-7-метокси 2-метил-1,2,3,4-тетрагидроизохинолина. Данные рацемические производные тетрагидроизохинолина могут быть разделены посредством хиральной ВЭЖХ или сверхкритической жидкостной хроматографии(СФХ) для получения отдельных энантиомеров. Кроме того, хиральное разделение может быть достигнуто путем перекристаллизации с использованием хиральных кислот, таких как ди-п-толуоил-D-винная кислота или ди-п-толуоил-L-винная кислота. 4-(3,4-Дихлорфенил)-7-метокси-2-метил-1,2,3,4-тетрагидроизохинолин превращается в соответствующий фенол при обработке 48% HBr при дефлегмировании. Полученный фенол затем превращается в-9 020553 соответствующий трифлат, который далее преобразуется в соответствующее производное пинаколового эфира борной кислоты 4-(3,4-дихлорфенил)-2-метил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)1,2,3,4-тетрагидроизохинолин. Результатом деметилирования с использованием 1-хлорэтил хлорформиата с последующей защитой трет-бутоксикарбонилом является трет-бутил 4-(3,4-дихлорфенил)-7-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-тетрагидроизохинолин-2(1 Н)-карбоксилат. Реакция данного защищенного трет-бутоксикарбонилом тетрагидроизохинолина с 6-бром-[1,2,4]триазоло[1,5]пиридином в соответствии с условиями реакции перекрестного связывания Сузуки дает трет-бутил 7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-3,4-дигидроизохинолин-2(1 Н)-карбоксилат, с которого затем снимается защита посредством трифторуксусной кислоты для получения 7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина или соединения формулы (I). Альтернативный синтетический способ получения соединений формулы (I) данного изобретения отображен на схеме 2. Схема 2 По реакции связывания Сузуки из 3-формилфенилборной кислоты и 6-бром-[1,2,4]триазоло[1,5]пиридина получают 3-([1,2,4]триазоло[1,5-]пиридин-6-ил)бензальдегид. Данный альдегид подвергают восстановительному аминированию для получения 2-(3-([1,2,4]триазоло[1,5-]пиридин-6 ил)бензиламино)-1-(3,4-дихлорфенил)этанола, который затем подвергают непосредственной циклизации действием серной кислоты для получения 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)1,2,3,4-тетрагидроизохинолина. Синтетический способ получения солей L-винной кислоты настоящего изобретения отображен на схеме 3. Схема 3 Соединения формулы (I) могут быть получены в энантиомерно обогащенной (R) и (S) форме по- 10020553 средством кристаллизации с хиральными солями, что также известно специалистам данной области, или,альтернативно, могут быть выделены при помощи хиральной ВЭЖХ с использованием хиральных колонок, имеющихся в продаже. Следует иметь в виду, что соединения настоящего изобретения могут содержать асимметричные центры. Эти асимметричные центры могут независимо находиться в R- или S-конфигурации, и такие соединения способны вращать плоскость поляризации света в поляриметре. Если соединение вращает упомянутую плоскость поляризации света в направлении против часовой стрелки, то соединение называют (-)-стереоизомером. Если соединение вращает упомянутую плоскость поляризации света в направлении по часовой стрелке, соединение называется (+)-стереоизомером. Для специалистов в данной области очевидно, что некоторые соединения, применимые в соответствии с изобретением, могут также проявлять геометрическую изомерию. Следует понимать, что настоящее изобретение включает в себя отдельные геометрические изомеры и стереоизомеры и их смеси, включая рацемические смеси вышеупомянутых соединений формулы (I). Такие изомеры могут быть выделены из их смесей применением или усовершенствованием известных способов, например методом хроматографии и методом перекристаллизации, или их отдельно получают из соответствующих изомеров их промежуточных продуктов. Меченные радиоактивным изотопом соединения настоящего изобретения синтезируются способами, хорошо известными специалистам в данной области, например, из исходных веществ, включив в них один или несколько радиоизотопов. Соединения настоящего изобретения, где синтетически введен стабильный радиоизотоп, такой как углерод-14, тритий, йод-121, или другой радиоизотоп, являются полезным диагностическим средством для определения областей мозга или центральной нервной системы,которые могут находиться под влиянием расстройств, при которых задействованы транспортеры норадреналина, дофамина или серотонина и механизм их обратного захвата. Кристаллические формы могут быть получены различными способами, включая, например, кристаллизацию или перекристаллизацию из соответствующего растворителя, сублимацию, кристаллизацию из расплава, получение твердого состояния из другой фазы, кристаллизацию из сверхкритической среды и струйным распылением. Методы кристаллизации или перекристаллизации кристаллических форм из растворителей включают, например, испарение растворителя, уменьшение температуры растворителя,затравливание кристалла пересыщенного растворителя молекулы и/или соли, сушки растворителя при температуре ниже 0, а также добавление антирастворителей (контр-растворителей) к растворителю. Высокопроизводительные методы кристаллизации могут применяться для получения кристаллических форм, включая полиморфы. Кристаллы лекарственных препаратов, в том числе полиморфы, способы получения, а также характеристика кристаллов лекарственных препаратов представлены в работе Bryn etal., Solid-State Chemistry of Drugs, 2nd Edition, SSCI, Западный Лафайет, штат Индиана (1999), которая включена в настоящее изобретение путем ссылки в полном объеме. Для способов кристаллизации, которые используют растворитель, выбор растворителя или растворителей, как правило, зависит от одного или нескольких факторов, таких как растворимость соединения,способ кристаллизации и давление паров растворителя, или от возможности получения практически чистой кристаллической формы. Могут использоваться сочетания растворителей, например, соединение может повышать растворимость в первом растворителе для получения раствора, за которым следует добавление антирастворителя для уменьшения растворимости соединения в растворе и формирования кристаллов. Антирастворителем является растворитель, в котором соединение имеет низкую растворимость. В одном из способов получения кристаллов соединение суспендируется и/или перемешивается в соответствующем растворителе для получения суспензии, которая может быть нагрета для ускорения полного или частичного растворения. Термин "суспензия", используемый здесь, означает насыщенный раствор соединения, который может также содержать дополнительное количество соединений для получения гетерогенной смеси соединения и растворителя при заданной температуре. Затравочные кристаллы могут быть добавлены к любой кристаллизационной смеси для ускорения кристаллизации. Затравка раствора кристаллами может быть использована для контроля роста отдельных полиморф или для контроля гранулометрического состава кристаллического продукта и/или получения практически чистой кристаллической формы. Соответственно, расчет необходимого количества затравочных кристаллов зависит от размера доступных затравочных кристаллов и желаемого среднего размера частиц продукта, как описано, например, в работе Mullin et al., "Programmed Cooling of Batch Crystallizers," Chemical Engineering Science, 26:369-377 (1971), которая включена в настоящее изобретение путем ссылки в полном объеме. Как правило, затравочные кристаллы небольшого размера необходимы для контроля эффективности роста кристаллов партии. Затравочные кристаллы небольшого размера могут быть получены путем просеивания, перемалывания, или измельчения крупных кристаллов, или путем микрокристаллизации растворов. Следует проявлять осторожность, чтобы перемалывание или измельчение кристаллов не привело к изменениям в кристалличности заданной кристаллической формы (например, изменения в гидрате или другом полиморфе). Охлажденная кристаллизационная смесь может быть отфильтрована в вакууме, и отделенные твердые вещества могут быть промыты соответствующим растворителем, таким как холодный растворитель перекристаллизации, и высушен при помощи продувки сжатым азотом для получения заданной кристал- 11020553 лической формы. Отделенные твердые вещества могут быть определены при помощи соответствующего спектроскопического или аналитического метода, такого как ядерный магнитный резонанс твердого вещества, рентгеновская порошковая дифрактометрия и т.п., для гарантированного образования предпочтительной кристаллической формы продукта. Конечную кристаллическую форму обычно получают в количестве более чем 70 мас.% отделенного продукта, преимущественно более 90 мас.% отделенного продукта от веса первоначально используемого соединения в процессе кристаллизации. При необходимости продукт может быть перемолот или просеян через ячеечное сито для разбивания комьев продукта. Кристаллические формы могут быть получены, например, непосредственно из реакционной среды процесса для получения соединения формулы (I). Это может быть достигнуто, например, за счет использования на окончательной стадии процесса растворителя или смеси растворителей, из которых может выкристаллизоваться форма SA-1 или форма N-2. Альтернативно, кристаллические формы могут быть получены посредством дистилляции или способа добавки растворителя. К соответствующим растворителям для достижения данных целей относятся, например, неполярные и полярные растворители, в том числе протонные полярные растворители, такие как спирты, и апротонные полярные растворители, такие как кетоны, детали и выбор которых известны специалистам данной области. Наличие более одного полиморфа в образце может быть определено методами, такими как порошковая рентгеновская дифракция (ПРД) или спектроскопия ядерного магнитного резонанса твердого тела(СЯМР). Например, наличие дополнительных пиков на диаграмме экспериментально измеренной ПРД,по сравнению с моделируемой диаграммой ПРД, может указывать на наличие более одного полиморфа в образце. Смоделированная ПРД может быть вычислена из рентгенометрических данных монокристаллаLaboratory, Ливермор, Калифорния, UCRL-7196 (апрель, 1963), которая включена в настоящее изобретение путем ссылки в полном объеме. С одной стороны, форма SA-1 или форма N-2 имеет фазу гомогенности, занимающую менее 5%, предпочтительно менее 2% и более предпочтительно менее 1% от общей площади пика на диаграмме экспериментально измеренной ПРД, возникающей из дополнительных пиков, которые отсутствуют на моделируемой картине ПРД. Преимущественно способы кристаллизации предусматривают получение продукта, содержащего практически чистую форму SA-1 или форму N-2. Кристаллизованное вещество преимущественно содержит по меньшей мере 95% по массе формы SA-1/формы N-1, исходя из общего веса соединения формулы (I). Остаточный материал может содержать другую форму(ы) соединения и/или примеси, образовавшиеся в результате реакции, и/или примеси процесса, возникающие в ходе получения соединения. Наличие примесей, образующихся в результате реакции и/или примесей, процесса может быть определено аналитическими методами, известными в данной области, такими как, например, хроматография, спектроскопия ядерного магнитного резонанса, масс-спектрометрия или инфракрасная спектроскопия. Форма SA-1 и форма N-1 может быть охарактеризована при помощи различных способов, которые хорошо известны специалистам в данной области. Примеры способов определения характеристик включают, не ограничиваясь, рентгеновскую дифракцию монокристалла, порошковую рентгеновскую дифракцию (ПРД), смоделированные порошковые рентгенограммы (работа Yin et al., American Pharmaceutical Review, 6(2):80 (2003), которая включена в настоящее изобретение путем ссылки в полном объеме),дифференциальную сканирующую калориметрию (ДСК), ЯМР твердого состояния 13 С (работа Earl et al.,J. Magn. Reson., 48:35-54 (1982), которая включена в настоящее изобретение путем ссылки в полном объеме), КР-спектроскопию, инфракрасную спектроскопию, изотермы поглощения влаги, термогравиметрический анализ (ТГА), и высокотемпературные методы. Формы могут быть охарактеризованы и распознаны посредством рентгеновской дифракции монокристалла, которая основана на измерениях элементарной ячейки монокристалла формы SA-1 или формы N-2. Подробное описание элементарных ячеек приводится в работе Stout et al., X-Ray Structure Determination: A Practical Guide, Macmillan Co., Нью-Йорк (1968), глава 3, которая включена в настоящее изобретение путем ссылки в полном объеме. Кроме того, уникальное расположение атомов в пространстве внутри кристаллической решетки может быть охарактеризовано в соответствии с зафиксированными относительными атомными координатами. Еще одним способом, характеризующим кристаллические структуры, является анализ порошковой рентгеновской дифракции, в котором кривая дифракции сравнивается с моделируемой кривой, представляющей чистый порошковый материал, оба испытания проводят при одинаковой аналитической температуре, и измерения формы характеризуемого объекта составляют серию из 20 значений. Для специалистов данной области необходимо принимать во внимание, что диаграмма рентгеновской дифракции может быть получена при измерении ошибки, которая зависит от используемых условий измерений. В частности, общеизвестно, что интенсивность диаграммы рентгеновской дифракции может колебаться в зависимости от используемых условий измерений. Следует также понимать, что относительная интенсивность может меняться в зависимости от условий эксперимента, и, соответственно, точный порядок интенсивности не должен приниматься во внимание. Кроме того, погрешность измерения угла дифракции для общепринятой картины рентгеновской дифракции составляет, как правило, около 5% или меньше, и такая степень погрешности измерений должна приниматься во внимание в области- 12020553 вышеупомянутых углов дифракции. Следовательно, должно быть понятно, что кристаллические формы настоящего открытия не ограничиваются кристаллическими формами, которые представляют диаграммы рентгеновской дифракции, полностью идентичные диаграммам рентгеновской дифракции, изображенным на представленных в данном документе фигурах. Любая кристаллическая форма, которая создает диаграмму рентгеновской дифракции и термограмму ДСК, в основном идентичные тем, которые отображены в представленных в данном документе фигурах, входит в сферу применения настоящего изобретения. Возможность установления вещественной идентичности диаграмм рентгеновской дифракции находится в пределах компетенции специалиста в данной области. Настоящее изобретение позволяет получить препараты, содержащие вышеописанные соединения/кристаллические формы, включая, в частности, лекарственные препараты, содержащие терапевтически эффективное количество соединений/кристаллических форм и фармацевтически приемлемых носителей. Дополнительной целью изобретения является предоставление набора, имеющего множество действующих веществ (с носителем или без него), которые совместно могут быть эффективно использованы для реализации нового комбинированного лечения при помощи настоящего изобретения. Другой целью изобретения является предоставление нового лекарственного препарата, который является эффективным в монотерапии, для использования в комплексной лечебной терапии, поскольку он включает в себя множество активных веществ, которые могут быть использованы в соответствии с настоящим изобретением. Настоящее изобретение также представляет наборы или отдельные упаковки, объединяющие два или более активных вещества, используемых при лечении заболевания. Набор представляет (отдельно или в сочетании с фармацевтически приемлемым разбавителем или носителем) соединения формулы (I) или кристаллическую форму, как описано в данном документе, и дополнительное активное вещество(отдельно или в сочетании с разбавителем или носителем), выделенное из антагониста серотониновых рецепторов 1 А, селективного антагониста рецепторов нейрокинина-1 и предшественника норадреналина. На практике соединения/кристаллические формы настоящего изобретения обычно применяются парентерально, внутривенно, подкожно, внутримышечно, интраперитонеально, назально, внутрибрюшинно, ректально или перорально. Продукция в соответствии с данным изобретением может быть представлена путем лицензирования области применения наиболее подходящим образом, а также изобретение относится к лекарственным препаратам, содержащим хотя бы один продукт настоящего изобретения, который пригоден для использования в медицине или в ветеринарии. Эти препараты могут быть приготовлены в соответствии с общепринятыми способами с использованием одного или нескольких фармацевтически приемлемых вспомогательных веществ или наполнителей. К вспомогательным лекарственным веществам относятся, в частности, разбавители, стерильные водные среды и различные нетоксичные органические растворители. Препараты могут быть представлены в виде таблеток, драже, гранул, порошков, водных растворов или суспензий, растворов для инъекций, эликсиров или сиропов, и могут содержать одно или несколько веществ, выбранных из группы, включающей подсластители, ароматизаторы, красители или стабилизаторы с целью получения фармацевтически приемлемых препаратов. Выбор среды и содержание активного вещества в этой среде обычно определяется в соответствии с растворимостью и химическими свойствами продукта, индивидуальным способом применения и соблюдения мер предосторожности в фармацевтической практике. Например, вспомогательные вещества, такие как лактоза, цитрат натрия, карбонат кальция, дикальцийфосфат, и вещества для улучшения распадаемости таблеток, такие как крахмал, альгиновые кислоты и некоторые комплексные силикаты в сочетании со смазывающими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк, могут быть использованы для получения таблеток. Для получения капсул преимущественным является применение лактозы и высокомолекулярных полиэтиленгликолей. При использовании водных суспензий они могут содержать эмульгаторы или вещества, которые способствуют суспендированию. Также могут быть использованы такие разбавители, как сахароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин и хлороформ или их смеси. Для парентерального введения продуктов настоящего изобретения используются эмульсии, суспензии или растворы в растительном масле, например кунжутном масле, арахисовом масле или оливковом масле, или водно-органические растворы, такие как растворы в воде и пропиленгликоле, готовые к употреблению органические эфиры, такие как этилолеат, а также стерильные водные растворы фармацевтически приемлемых солей. Растворы солей продуктов настоящего изобретения являются наиболее применимыми при внутримышечном или подкожном введении. Водные растворы, также содержащие растворы солей в дистиллированной воде, могут использоваться для внутривенного введения при условии, что уровень их pH является соответственно отрегулированным, что они обладают буферными свойствами и они являются изотоническими с достаточным количеством глюкозы или хлористого натрия, что они стерилизуются нагреванием, облучением или микрофильтрацией. Соответствующие композиции, содержащие соединения/кристаллические формы настоящего изобретения, могут быть получены традиционными способами. Например, соединения/кристаллические- 13020553 формы настоящего изобретения могут быть растворены или суспендированы в соответствующем носителе для использования в аэрозольном аппарате, или в аэрозоле суспензии, или в аэрозоле раствора, или могут быть абсорбированы или адсорбированы на соответствующем твердом носителе для использования в порошковом ингаляторе. Твердые композиции для ректального введения включают суппозитории, полученные в соответствии с известными способами и содержащие по меньшей мере одно соединение формулы(I)/кристаллическую форму. Процент активного вещества в композициях настоящего изобретения может варьироваться, при этом он должен составлять такое соотношение, которое позволит получить соответствующую дозировку. Очевидно, что несколько видов лекарственных форм могут быть введены примерно в одно время. Доза введения должна определяться врачом и зависит от желаемого терапевтического эффекта, способов применения, длительности лечения и состояния пациента. Для взрослых доза должна составлять, как правило, от 0,01 до 100 мг/кг массы тела, преимущественно от 0,01 до 10 мг/кг массы тела в сутки при ингаляции, примерно от 0,01 до 100 мг/кг массы тела, преимущественно от 0,1 до 70 мг/кг массы тела, особенно от 0,1 до 10 мг/кг массы тела в день при приеме внутрь перорально; от 0,01 до 50 мг/кг массы тела, преимущественно от 0,01 до 10 мг/кг массы тела в день при внутривенном введении. В каждом конкретном случае, дозы определяются в соответствии с индивидуальными факторами для каждого пациента, подлежащего лечению, такими как возраст, вес, общее состояние здоровья, и другими характеристиками, которые могут влиять на эффективность лекарственного препарата. Продукты настоящего изобретения могут применяться столько, сколько это будет необходимо для получения желаемого терапевтического эффекта. Некоторые пациенты могут быстро реагировать на более высокие или более низкие дозы, и для них наиболее приемлемыми будут более слабые поддерживающие дозы. Другие пациенты могут нуждаться в долгосрочном лечении с применением от 1 до 4 доз в день, в соответствии с физиологическими потребностями каждого конкретного пациента. Как правило,активный продукт может применяться перорально от 1 до 4 раз в день. Само собой разумеется, что для некоторых пациентов необходимо назначать не более одной или двух доз в день. Настоящее изобретение предоставляет соединения, которые ингибируют синаптический обратный захват норадреналина, дофамина и серотонина, а следовательно, как полагают, являются полезными при лечении расстройств, полученных в результате или зависящих от сокращения наличия серотонина, норадреналина или дофамина. Хотя соединения формулы (I) ингибируют синаптический обратный захват норадреналина, дофамина и серотонина, в каждом конкретном соединении эти ингибирующие эффекты могут проявляться в одинаковых или совершенно разных концентрациях или дозах. В результате, соединения формулы (I) являются полезными в лечении таких расстройств с применением доз, при которых синаптический обратный захват норадреналина может быть существенно ингибирован, но, при которых синаптический обратный захват серотонина или дофамина не может быть существенно ингибирован, или наоборот. Также, соединения формулы (I) являются полезными при лечении таких расстройств с применением доз, при которых синаптический обратный захват дофамина может быть существенно ингибирован, но при которых обратный синаптический захват норадреналина или серотонина не может быть существенно ингибирован, или наоборот. И наоборот, соединения формулы (I) являются полезными при лечении таких расстройств с применением доз, при которых синаптический обратный захват серотонина может быть существенно ингибирован, но при которых синаптический обратный захват норадреналина или дофамина не может быть существенно ингибирован, или наоборот. Соединения формулы (I) могут также быть полезными при лечении таких расстройств с применением доз, при которых синаптический обратный захват норадреналина, дофамина и серотонина может быть существенно ингибирован. Концентрации или дозы, при которых испытуемое соединение ингибирует синаптический обратный захват норадреналина, дофамина и серотонина, легко определяются с помощью стандартного анализа и способов, хорошо известных и высоко ценимых любым специалистом в данной области. Например, степень ингибирования при определенной дозе у крыс может быть определена методом Dudley, J. PharmacolExp Ther, 217:834-840 (1981), который включен в данное изобретение путем ссылки в полном объеме. Терапевтически эффективной ингибирующей дозой является доза, которая является эффективной при значительном ингибировании синаптического обратного захвата норадреналина, синаптического обратного захвата дофамина, или синаптического обратного захвата серотонина, или ингибировании синаптического обратного захвата двух или более обратных захватов норадреналина, дофамина и серотонина. Терапевтически эффективная ингибирующая доза может быть без труда определена специалистом в данной области с помощью общепринятых способов определения диапазона доз и аналогичных результатов, полученными в системах испытаний, описанных выше. Соединения настоящего изобретения обеспечивают чрезвычайно благоприятный терапевтический индекс по сравнению с другими соединениями, имеющимися для лечения сходных расстройств. Не намереваясь ограничиваться теорией, предполагается, что это, по меньшей мере, частично является следствием того, что некоторые соединения обладают более высокими связывающими способностями по отношению к одному или двум нейротрансмиттерам, например селективность по отношению к белкутранспортеру серотонина ("СЕРТ") по сравнению с транспортерами для других нейрохимических ве- 14020553 ществ, например, белка-транспортера дофамина ("ДАТ") и белка-транспортера норадреналина ("HAT"). Связывающие способности демонстрируют рядом способов, хорошо известных специалистам в данной области, включая, не ограничиваясь, способы, описанные ниже в разделе примеров. Коротко,например, содержащие белок экстракты из клеток, например, клеток HEK293E, экспрессирующих белкипереносчики, инкубируют с радиоактивно меченными лигандами белков. Связывание радиоактивных лигандов с белками обратимо в присутствии других лигандов белков, например соединений настоящего изобретения; указанная обратимость, как описано ниже, обеспечивает средства для измерения связывающей способности соединений с белками (IC50 или Ki). Более высокое значение IC50/Ki для соединения является показателем того, что соединение имеет меньшую связывающую способность по отношению к белку, чем соединение с меньшей IC50/Ki; наоборот, меньшие значения IC50/Ki являются показателем более высоких связывающих способностей. Соответственно, различие в избирательности соединений по отношению к белкам показано более низким значением IC50/Ki по отношению к белку, к которому соединение является более избирательным,и более высоким значением IC50/Ki по отношению к белку, к которому соединение менее избирательно. Таким образом, чем больше отношение значений Ki соединения по отношению к белку А по сравнению с белком В, тем выше избирательность соединений по отношению к последнему по сравнению с первым(первый имеет более высокое значение IC50/Ki, а последний более низкое значение IC50/Ki по отношению к данному соединению). Соединения ("триактивные ингибиторы обратного захвата транспортеров") настоящего изобретения обладают высокой связывающей способностью по отношению к каждому из переносчиков биогенных аминов HAT, ДАТ или СЕРТ. Например, соединения настоящего изобретения обладают потенциальными значениями IC50/Ki связывающей способности менее 200 нМ для HAT, ДАТ и СЕРТ. В естественных условиях связывающие способности соединений с тремя белками-транспортерами СЕРТ, ДАТ и HAT демонстрируются с помощью хорошо известных специалистам в данной области способов, включая, не ограничиваясь, описанные ниже в разделе "Примеры". Таким образом, разница в селективности соединения в естественных условиях для белка определяется по более высокому значению процента заполнения (или процентом ингибирования лиганда [3 Н],используемого в разделе "Примеры") в белке-транспортере, для которого соединение является более селективным, а также более низким процентом заполнения (или процентом ингибирования лиганда [3 Н],используемого в разделе "Примеры") для белка, для которого соединение менее селективно. Соединения настоящего изобретения при введении фармацевтически допустимой дозы следующими способами, включающими, не ограничиваясь, пероральный, внутривенный, подкожный, внутрибрюшинный и внутримышечный, имеют статистически важное значение(я) процента заполнения для одного,двух или всех транспортеров биогенных аминов HAT, ДАТ или СЕРТ. Соединения настоящего изобретения при введении фармацевтически допустимой дозы следующими способами, включающими, не ограничиваясь, пероральный, внутривенный, подкожный, внутрибрюшинный и внутримышечный, имеют значения заполнения от 10-100% для одного, двух или всех транспортеров биогенных аминов HAT, ДАТ или СЕРТ. В предпочтительном варианте изобретения соединения настоящего изобретения имеют значение(я) заполнения от 40-100% хотя бы в одном из транспортеров биогенных аминов HAT, ДАТ или СЕРТ. Примеры Пример 1. Получение 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолина L-тартрата. Стадия А. К раствору 3-метоксибензальдегида (180 г, 1,32 моль) в метаноле (1 л) добавили 40% водный раствор метиламина (113 мл, 1,31 моль) с последующим перемешиванием в течение 1 ч при температуре 0C. Боргидрид натрия (75 г, 1,98 моль) добавили порциями при температуре 0C и перемешивали реакционную смесь в течение 1 ч. Раствор концентрировали до меньшего объема, затем разбавили водой (200 мл) и полученный раствор экстрагировали с метиленхлоридом (3500 мл). Объединенные органические экстракты высушили над сульфатом натрия, отфильтровали и концентрировали при пониженном давлении для получения неочищенного N-метилбензиламина (220 г, количественно) в виде прозрачного маслянистого вещества, которое использовали на следующей стадии без дополнительной очистки. 1H ЯМР (CDCl3, 500 МГц)7,23 (т, J=8,0 Гц, 1 Н), 6,92-6,88 (м, 2 Н), 6,81-6,78(м, 1 Н), 3,80 (с, 3H),3,73 (с, 2 Н), 2,45 (с, 3H), 2,07 (ушир.с, 1 Н). Стадия В. К раствору вышеприведенного амина (6,2 г, 41,00 ммоль), полученного на стадии А, в метиленхлориде (100 мл) добавили 3,4-дихлорфенацил бромид (10,0 г, 37,3 ммоль) и перемешивали полученную смесь при температуре 0C в течение 1 ч, а затем добавили триэтиламин (5,20 мл, 37,31 ммоль) с последующим перемешиванием в течение 1 ч при 0C. Реакционную смесь разбавили водой (100 мл),затем водную фазу экстрагировали с дополнительным количеством метиленхлорида (375 мл). Объединенные экстракты высушили над сульфатом натрия, отфильтровали и концентрировали для получения 1(3,4-дихлорфенил)-2-3-метоксибензил)(метил)амино)этанола (15,08 г) в виде маслянистого вещества- 15020553 светло-желтого цвета, которое использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (500 МГц, CDCl3)8,08 (д, J=2,0 Гц, 1 Н), 7,78 (дд, J=8,5 Гц; 2,0 Гц, 1 Н), 7,50 (д, J=8,5 Гц,1 Н), 7,25 (д, J=8,5 Гц, 1 Н), 6,90 (д, J=7,5 Гц, 1 Н), 6,87 (д, J=2,5 Гц, 1 Н), 6,82 (дд, J=8,0 Гц, 2,5 Гц, 1 Н), 3,79(с, 3H), 3,66 (с, 2 Н), 3,60 (с, 2 Н), 2,33 (с, 3H). Стадия С. К раствору кетона (37 ммоль), полученного на стадии В, в метаноле (150 мл) порциями добавили боргидрид натрия (2,11 г, 55,79 ммоль) при температуре 0C. Реакционную смесь сначала перемешивали в течение 2 ч, затем разбавили водой (100 мл) и экстрагировали с метиленхлоридом (3300 мл). Объединенные экстракты высушили над сульфатом натрия, отфильтровали и концентрировали до сухости при пониженном давлении для получения неочищенного спирта (14,14 г) в виде маслянистого вещества светло-желтого цвета, который использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (500 МГц, CDCl3)7,45 (д, J=2,0 Гц, 1 Н), 7,38 (д, J=8,0 Гц, 1 Н), 7,28-7,23 (м, 1 Н), 7,16 (дд,J=8,0 Гц; 2,0 Гц, 1 Н), 6,90-6,81 (м, 3H), 4,70-4,65 (м, 1 Н), 3,81 (с, 3H), 3,70 (д, J=13,0 Гц, 1 Н), 3,50 (д,J=13,0 Гц, 1 Н), 2,54-2,49 (м, 2 Н), 2,32 (с, 3H). Стадия D. К раствору спирта (37 ммоль), полученного на стадии С, в метиленхлориде (200 мл) добавили концентрированную серную кислоту (12 мл, 235 моль) и перемешивали смесь при температуре 0C в течение 28 ч. Реакцию завершили добавлением 6 н. раствора NaOH до достижения рН 9. Водную фазу экстрагировали с дополнительным количеством метиленхлорида (3). Объединенные органические экстракты промыли насыщенным солевым раствором (3), высушили над сульфатом натрия, отфильтровали и концентрировали. Остаток очистили с помощью флэш-хроматографии (от 1:1:1: до 1:1:2 дихлорметан/гексан/этилацетат) и получили 4-(3,4-дихлорфенил)-7-метокси-2-метил-1,2,3,4 тетрагидроизохинолин (7,0 г, 59% за 3 стадии) в виде светло-желтого маслянистого вещества. 1 Н ЯМР (500 МГц, CDCl3)7,33 (д, J=8,0 Гц, 1 Н), 7,29 (д, J=2,0 Гц, 1 Н), 7,03 (дд, J=8,5 Гц; 2,0 Гц,1 Н), 6,76 (д, J=8,5 Гц, 1 Н), 6,66 (дд, J=8,5 Гц; 3,0 Гц, 1 Н), 6,61 (д, J=2,5 Гц, 1 Н), 4,16-4,11 (м, 1 Н), 3,77 (с,3H), 3,67-3,59 (м, 2 Н), 2,92 (дд, J=11,5 Гц; 5,5 Гц, 1 Н), 2,55 (дд, J=11,5 Гц; 7,0 Гц, 1 Н), 2,39 (с, 3H). Также выделили нежелательный 5-метоксиизомер (1,20 г, 10% за 3 стадии). Стадия Е. Рацемический 4-(3,4-дихлорфенил)-7-метокси-2-метил-1,2,3,4-тетрагидроизохинолин (7,0 г), полученный на вышеуказанной стадии D, разложили с помощью препаративной хиральной ВЭЖХ(колонка Chiralpak AD, используя в качестве элюента 80:20:0,1 гептан/2-пропанол/диэтиламин), для получения (+)-энантиомера ([]25D +31,9 (с 0,49/ метанол (3,68 г) в виде бесцветного маслянистого вещества и (-)-энантиомера (3,99 г) в виде бесцветного маслянистого вещества. Стадия F. Раствор (+)-4-(3,4-дихлорфенил)-7-метокси-2-метил-1,2,3,4-тетрагидроизохинолина (3,68 г, 11,42 ммоль) в смеси уксусной кислоты (20 мл) и 48% водного раствора бромисто-водородной кислоты(50 мл) дефлегмировали в течение 8 ч. Ледяную реакционную смесь подщелачивали концентрированным водным раствором гидроксида натрия и насыщенным водным раствором бикарбоната натрия до достижения pH около 8-9 и экстрагировали с дихлорметаном (3). Объединенные экстракты высушили над сульфатом натрия, отфильтровали и концентрировали в вакууме для получения неочищенного спирта(2,6 г) в виде желтого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3)7,32 (д, J=8,5 Гц, 1 Н), 7,26 (д, J=2,0 Гц, 1 Н), 7,01 (дд, J=8,0 Гц; 2,0 Гц,1 Н), 6,65 (д, J=8,0 Гц, 1 Н), 6,54 (д, J=8,5 Гц, 1 Н), 6,49 (ушир.с, 1 Н), 4,15-4,10 (м, 1 Н), 3,60 (д, J=15,0 Гц,1 Н), 3,56 (д, J=15,0 Гц, 1 Н), 2,96 (дд, J=11,5 Гц; 5,7 Гц, 1 Н), 2,52 (дд, J=11,5 Гц, 8,0 Гц, 1 Н), 2,39 (с, 3H). Стадия G. К раствору фенола из вышеописанной стадии F (2,1 г, 6,81 ммоль) и пиридина (0,72 мл,8,85 ммоль) в дихлорметане (60 мл) добавили ангидрид трифторметансульфоновой кислоты (1,37 мл,8,14 ммоль) при температуре -78C. Реакционную смесь нагрели до 0C и помешивали в течение 1 ч. Реакционную смесь разбавили водой (20 мл) и экстрагировали с дихлорметаном (3). Объединенные экстракты высушили над сульфатом натрия, отфильтровали и концентрировали для получения неочищенного трифлата в виде желтого маслянистого вещества. 1 Н ЯМР (500 МГц, CDCl3)7,36 (д, J=8,5 Гц, 1 Н), 7,30 (д, J=2,0 Гц, 1 Н), 7,03-6,98 (м, 3H), 6,94 (д,J=8,5 Гц, 1 Н), 4,19-4,15 (м, 1 Н), 3,68 (с, 2 Н), 2,96 (дд, J=11,7 Гц; 5,5 Гц, 1 Н), 2,60 (дд, J=11,7 Гц, 7,5 Гц,1 Н), 2,42 (с, 3H). Стадия Н. Смесь трифлата, полученная на стадии G, описанной выше, (6,8 ммоль) бис(пинаколато)дибора (2,07 г, 8,15 ммоль) и ацетата калия (2,05 г, 20,8 ммоль) в диметилсульфоксиде (35 мл) дегазировали аргоном. К данной смеси добавили дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) (0,40 г, 0,55 ммоль). Полученную смесь дегазировали аргоном,а затем нагревали при температуре 85C в течение 2 ч. Холодную реакционную смесь разбавили этилацетатом (150 мл). Полученный раствор промыли водой (240 мл), насыщенным солевым раствором(140 мл), высушили над сульфатом натрия, отфильтровали и концентрировали в вакууме. В результате очистки колоночной флэш-хроматографией (элюент, 1:1:1 к 1:1:2 дихлорметан/гексаны/этилацетат) получили желаемый боронатный эфир (2,6 г, 91% после 2 стадий) в виде желтого твердого вещества. 1(с, 12 Н). Стадия I. К раствору боронатного эфира (2,6 г, 6,22 ммоль), полученного на стадии F, и протонной губки (2,6 г, 12,1 ммоль) в дихлорэтане (80 мл) при температуре 0C добавили 1-хлорэтил хлорформиат(2,4 мл, 22,1 ммоль). Смесь перемешивали при температуре 0C в течение 15 мин, затем дефлегмировали в течение 40 мин и концентрировали в вакууме. Остаток отфильтровали через тонкий слой силикагеля(элюент, 1:1:1 дихлорметан/гексаны/этилацетат) и концентрировали фильтрат в вакууме. Остаток разбавили метанолом (160 мл), нагревали до дефлегмирования в течение 1 ч и концентрировали в вакууме для получения 4-(3,4-дихлорфенил)-7-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)-1,2,3,4 тетрагидроизохинолина в виде коричневой пены. Стадия J. Раствор продукта, полученного на стадии I, (6,2 ммоль), (Вос)2O (3,60 г, 16,4 ммоль),триэтиламина (1,5 мл, 10,7 ммоль) и ДМАП (0,26 г, 2,20 ммоль) в дихлорметане (120 мл) перемешивали при комнатной температуре в течение 4 ч. Реакцию остановили путем добавления воды (50 мл), затем водную фазу экстрагировали дополнительным количеством дихлорметана (2100 мл). Объединенные экстракты высушили над сульфатом натрия, отфильтровали и концентрировали в вакууме. В результате очистки колоночной флэш-хроматографией (элюент, от 47,5:47,5:5 до 1:1:1 дихлорметан/гексаны/этилацетат) получили трет-бутоксикарбонил-защищенный тетрагидроизохинолин (1,82 г,58% после 3 стадий) в виде белой пены. 1 Н ЯМР (500 МГц, CDCl3)7,65 (с, 1 Н), 7,58 (д, J=7,5 Гц, 1 Н), 7,32 (д, J=8,0 Гц, 1 Н), 7,13 (с, 1 Н),6,95 (д, J=7,0 Гц, 1 Н), 6,97-6,93 и 6,83-6,78 (м, 1 Н), 5,01-4,95 и 4,48-4,43 (м, 1 Н), 4,56-4,52 (м, 1 Н), 3,95 (с,1 Н), 3,83-3,44 (м, 2 Н), 1,43 и 1,26 (2 с, 9 Н), 1,33 (с, 12 Н). Стадия K. В сухую колбу поместили боронатный эфир (0,8 г, 1,59 ммоль), полученный на стадии J,6-бром-[1,2,4]триазоло[1,5-]пиридин (0,35 г, 1,78 ммоль), карбонат цезия (0,97 г, 2,98 ммоль) и аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) и дихлорметана (87 мг, 0,12 ммоль). Колбу продули аргоном, затем добавили ДМФА (20 мл) и воду (4 мл) с последующей короткой обработкой ультразвуком. Реакционную смесь нагрели до 80C в течение 1 ч. Холодную реакционную смесь разбавили водой (20 мл) и экстрагировали водный слой дихлорметаном (360 мл). Объединенные органические фазы концентрировали в вакууме. В результате очистки колоночной флэш-хроматографией (элюент, от 1:1:1 до 1:1:2 дихлорметан/гексаны/этилацетат) получили трет-бутоксикарбонил-защищенный 7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин (0,86 г, количественно) в виде белой пены; ([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолин (0,86 г, количественный) в виде белой пены. Стадия L. Раствор трет-бутоксикарбонил-защищенного 7-([1,2,4] триазоло[1,5-]пиридин-6-ил)-4(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина (0,85 г, 1,72 ммоль) и концентрированной соляной кислоты (4,0 мл) в этаноле (10 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали досуха в вакууме. Остаток растворили в смеси дихлорметана (14 мл) и ТФУК (10 мл), перемешивали при комнатной температуре в течение 1 ч, затем концентрировали в вакууме. Концентрированный раствор, полученный таким образом, разбавили дихлорметаном и обработали насыщенным водным раствором бикарбоната натрия до pH 8-9. Водную фазу экстрагировали дополнительным количеством дихлорметана (3) и высушили органические фазы над сульфатом натрия, отфильтровали и концентрировали в вакууме до получения 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4 дихлорфенил)-1,2,3,4-тетрагидроизохинолина (0,59 г, 87%) в виде белой пены. Стадия М. К раствору продукта (0,59 г, 1,49 ммоль), полученного на стадии В, в этаноле добавилиL-винную кислоту (0,22 г, 1,49 ммоль). Суспензию отфильтровали. Осадок на фильтре промыли этанолом и высушили, получив 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолина L-тартрат (0,49 г, 59%, ПФК ВЭЖХ 99%) в виде белого твердого вещества.ESI MC m/z 395 [М+Н]+. Аналогично рассчитано для C21H16Cl2N4 С 4 Н 6 О 60,5 Н 2 О: С, 54,16; Н, 4,18; N, 10,11. Обнаружено: С,54,07; Н 3,92; N, 9,97.(-)-4-(3,4-дихлорфенил)-7-метокси-2-метил-1,2,3,4 тетрагидроизохинолин, выполняя те же стадии, описанные для синтеза (+)-7-([1,2,4]триазоло[1,5]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина L-тартрата ([]24D -6,0 (с 0,10, метанол.- 17020553 Пример 2. Альтернативный синтез примера 1. Стадия А. К раствору трифлата, полученного на стадии G в примере 1, и бис-(пинаколато)дибора(6,6 г, 25,9 ммоль) в диметилсульфоксиде (200 мл) добавили ацетат калия (6,4 г, 64,8 ммоль). Раствор дегазировали аргоном в течение 5 мин, а затем к нему добавили дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) (1,6 г, 2,2 ммоль). Реакционную смесь дегазировали аргоном в течение 5 мин, нагревали при 80C в течение 1 ч, а затем охладили до комнатной температуры. К этому раствору добавили 6-бром-[1,2,4]триазоло[1,5-]пиридин (4,8 г, 23,8 ммоль) и водный раствор карбоната цезия (21,1 г, 64,8 ммоль в 87 мл воды). Полученный раствор дегазировали аргоном, а затем к нему добавили дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) (0,8 г, 1,1 ммоль). Реакционную смесь дегазировали аргоном и нагревали при 80C в течение 1 ч. В процессе реакции образовалось темное густое маслянистое вещество. Темный отстоявшийся слой раствора слили, разбавили водой и экстрагировали этилацетатом (3), затем высушили над сульфатом натрия и концентрировали в вакууме. Оставшееся маслянистое вещество растворили в дихлорметане, полученный раствор промыли водой, высушили над сульфатом натрия и концентрировали в вакууме. Объединенный неочищенный продукт очистили колоночной флэш-хроматографией (от 100% этилацетата до 92:7,2:0,8 этилацетат/метанол/гидроксид аммония), чтобы получить 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-2-метил-1,2,3,4 тетрагидроизохинолин (7,7 г, 87%, ПФК ВЭЖХ 97,6%) в виде коричневой пены. 1H ЯМР (500 МГц, CDCl3)8,77 (с, 1 Н), 8,37 (с, 1 Н), 7,82 (д, J=9,0 Гц, 1 Н), 7,76 (д, J=9,0 Гц, 1 Н),7,39-7,32 (м, 4 Н), 7,09 (д, J=8,0 Гц, 1 Н), 7,01 (д, J=8,5 Гц, 1 Н), 4,26 (т, J=6,5 Гц, 1 Н), 3,75 (явный с, 2 Н),3,01 (дд, J=11,5 Гц, 5,5 Гц, 1 Н), 2,64 (дд, J=11,5, 6,5 Гц, 1 Н), 2,46 (с, 3H). Стадия В. К раствору 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорофенил)-2-метил-1,2,3,4 тетрагидроизохинолина (7,2 г, 17,6 ммоль), полученному на вышеуказанной стадии А, в 1,2-дихлорэтане(180 мл) при 0C добавили протонную губку (3,8 г, 17,6 ммоль), с последующим добавлением 1-хлорэтил хлорформиата (2,3 мл, 21,1 ммоль). После добавления реакционный раствор перемешивали при температуре 0C в течение 20 мин и комнатной температуре в течение 14 ч. К реакционной смеси добавили дополнительное количество 1-хлорэтил хлорформиата (0,5 мл, 4,6 ммоль). Реакционный раствор перемешивали еще 3 ч и затем охладили до 0C, промыли водным раствором соляной кислоты (1 н.). Во время промывки кислотой образовался осадок. Органический экстракт отделили, высушили над сульфатом натрия и концентрировали в вакууме. Полученный остаток очистили колоночной флэш-хроматографией(от дихлорметана до 95:4,5:0,5 дихлорметан/метанол/гидроксид аммония) для получения двух партий частично очищенных промежуточных продуктов карбаматов, которые растворили в метаноле и дефлегмировали в течение 1 ч. Реакционные растворы концентрировали в вакууме и полученный неочищенный продукт очистили сочетанием колоночной флэш-хроматографии (от этилацетата до 88:10,2:0,8 зтилацетат/метанол/гидроксид аммония) и препаративной тонкослойной хроматографии (этилацетат/метанол/гидроксид аммония 90:9:1) для получения желаемого дез-метилтетрагидроизохинолина (3,8 г, 54%, ПФК ВЭЖХ 98,7%), в виде светло-розовой пены. 1H ЯМР (500 МГц, CDCl3)8,78-8,77 (м, 1 Н), 8,37 (с, 1 Н), 7,83 (дд, J=9,5 Гц, 1,0 Гц, 1H), 7,77 (дд,J=9,0 Гц, 1,5 Гц, 1 Н), 7,39 (д, J=8,5 Гц, 1 Н), 7,36-7,26 (м, 3H), 7,05-7,00 (м, 2 Н), 4,24 (д, J=16,5 Гц, 1 Н),4,17 (д, J=16,5 Гц, 1 Н), 4,13-4,11 (м, 1 Н), 3,44 (дд, J=12,5 Гц, 5,0 Гц, 1 Н), 3,11 (дд, J=13,0 Гц, 6,0 Гц, 1 Н). Стадия С. К раствору дез-метилтетрагидроизохинолина (3,75 г, 9,48 ммоль), полученному на стадии В, которая описана выше, в этаноле (80 мл) добавили активированный уголь (3,0 г) и перемешивали при комнатной температуре в течение 30 мин. Уголь удалили фильтрацией, а полученный фильтрат концентрировали в вакууме. Полученное маслянистое вещество растворили в этаноле (60 мл) и добавили раствор L-винной кислоты (1,44 г, 9,5 ммоль) в этаноле (20 мл). После этого сразу образовался белый осадок. Суспензию перемешивали при комнатной температуре в течение 10 мин и отфильтровали. Осадок на фильтре перемешивали в горячем этаноле (70C) в течение 3 ч и отфильтровали. Осадок на фильтре высушили в вакууме при температуре 50-60C в течение 40 ч для получения L-тартрата (+)-7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина (3,7 г, 73%,ПФК ВЭЖХ 99,4% при 250 нм) в виде грязно-белого твердого вещества ([]23D +16,8 (с, 0,13, метанол. 1ESI MC m/z 395 [М+Н]+. Аналогично рассчитано для C21H16Cl2N4C4H6O60,5 Н 2 О: С, 54,16; Н, 4,18; N, 10,11. Обнаружено: С,53,96; Н 3,98; N, 9,94.- 18020553 Пример 3. Альтернативный синтез примера 1 (гидрохлорид). Стадия А. В 1-л круглодонную колбу поместили 2-амино-5-бромпиридин (100 г, 578 ммоль),ДМФА-ДМА (101 мл, 751 ммоль) и 2-пропанол (200 мл). Смесь нагревали до дефлегмирования в течение 3 ч для получения прозрачного темного раствора. Затем его охладили до 50C и добавили гидроксиламина гидрохлорид (52,2 г, 751 ммоль). Смесь перемешивали в течение ночи при температуре 50C для получения желтой суспензии. Осадок собрали фильтрацией. Черный фильтрат концентрировали и перемешивали остаток в этаноле (20 мл) в течение 20 мин. Твердое вещество собрали фильтрацией. Объединенные твердые вещества высушили в печи для получения N-(5-бромпиридин-2-ил)-N'гидроксиформимидамида в виде твердого вещества песчаного цвета (94 г, выход 75%). Стадия В. N-(5-бромпиридин-2-ил)-N'-гидроксиформимидамид растворили в ТГФ (1 л). К раствору при температуре 10C медленно добавили трифторуксусную кислоту (106 мл, 751 ммоль), поддерживая температуру реакции ниже 20C. После окончания добавления смесь нагрели до комнатной температуры и перемешивали в течение 2 ч. После того как реакция была завершена, ее погасили водным растворомNa2CO3 до достижения рН 7. Органический растворитель удалили при пониженном давлении и затем продукт экстрагировали ДХМ (4300 мл). Объединенные органические слои высушили над Na2SO4 и концентрировали досуха. Остаток перемешивали в этиловом эфире (100 мл) и фильтрацией собрали продукт 6-бром-[1,2,4]триазоло[1,5-]пиридин в виде грязно-белого твердого вещества (50 г, выход 58%). Стадия С. К смеси 3-формилфенилбороновой кислоты (21,41 г, 143 ммоль), 6-бром[1,2,4]триазоло[1,5-]пиридина (28,27 г, 143 ммоль) в ДМСО (600 мл) и воде (50 мл) добавилиPd(dppf)Cl2 (5,83 г, 7,14 ммоль) и Cs2CO3 (116 г, 357 ммоль). После добавления температура реакции достигла 45C. ВЭЖХ показала, что исходные материалы были израсходованы в течение 15 мин. Реакционную смесь разбавили водой (400 мл). Черный осадок собрали фильтрованием и растворили в ДХМ (300 мл), затем промыли насыщенным солевым раствором (200 мл). Водный слой обратно экстрагировали ДХМ (100 мл). Объединенные органические слои отфильтровали через целитовую подушку и концентрировали фильтрат для получения смеси черных твердых веществ. Продукт перекристаллизовали в метаноле для получения 3-([1,2,4]триазоло[1,5-]пиридин-6-ил)бензальдегида (27,4 г, 123 ммоль, выход 8 6%) в виде бледно-серого твердого вещества: m/z=224,0 [М+1]. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 7,74 (т, J=7,68 Гц, 1 Н), 7,91-8,02 (м, 2 Н), 8,11 (дд, J=9,19 Гц,1,89 Гц, 1 Н), 8,17 (д, J=7,81 Гц, 1 Н), 8,36 (с, 1 Н), 8,57 (с, 1 Н), 9,45 (с, 1 Н), 10,11 (с, 1 Н). Стадия D. Смесь -бром-3,4'-дихлорацетофенона (26,7 г, 100 ммоль), гексаметилентетрамина(ГМТА) (13,97 г, 100 ммоль) и NaI (0,5 г) перемешивали при комнатной температуре в течение ночи. ВЭЖХ анализ указал на расход исходных материалов. Промежуточное аммониевое соединение собрали фильтрацией в виде белого твердого вещества, промыли ацетоном и высушили (36 г, выход 89%). К раствору промежуточного соединения (36 г, 88 ммоль) в EtOH (500 мл) добавляют 12 н. растворHCl (75 мл, 0,9 моль). Смесь перемешивали при 76C в течение ночи, а затем охладили до комнатной температуры. Продукт 2-амино-1-(3,4-дихлорфенил)этанона гидрохлорид получили в виде кристаллического твердого вещества путем фильтрации (20,2 г, выход 95%). 1H ЯМР (400 МГц, ДМСО-d6)м.д. 4,62 (с, 2 Н), 7,79-7,94 (м, 1 Н), 7,98 (дд, J=8,56 Гц, 2,01 Гц, 1 Н),8,26 (д, J=2,01 Гц, 1 Н), 8,48 (с, 3H). Стадия Е. К раствору 2-амино-1-(3,4-дихлорфенил)этанона гидрохлорида (50 г, 208 ммоль) в метаноле (200 мл) медленно добавили боргидрид натрия (7,86 г, 208 ммоль) при температуре 0C. ВЭЖХ указала на 100% превращение через 10 мин. К предыдущему раствору одной частью добавили раствор 3([1,2,4]триазоло[1,5-]пиридин-6-ил)бензальдегида (46,4 г, 208 ммоль) в ДХМ/МеОН (180 мл/50 мл) при комнатной температуре. Перемешанный раствор перемешивали при комнатной температуре в течение 2 ч, затем добавили боргидрид натрия (7,86 г, 208 ммоль). ВЭЖХ указала на 100% превращение через 10 мин. Большую часть растворителя удалили и остаточный продукт растворили в ДХМ/NH4OH (4 н.) (1 л/1 л). Органический слой промыли насыщенным солевым раствором, высушили над Na2SO4 и концентрировали до 250 мл. Раствор продукта 2-(3-([1,2,4]триазоло[1,5-]пиридин-6-ил)бензиламино)-1-(3,4 дихлорфенил)этанола в ДХМ использовали на следующей стадии без дополнительной очистки (площадь ВЭЖХ 92%): m/z=413,1 [М+1]. 1H ЯМР (400 МГц, хлороформ-D)м.д. 2,72 (дд, J=12,21 Гц, 8,69 Гц, 1 Н), 2,96 (дд, J=12,34 Гц, 3,53 Гц, 1 Н), 3,85-3,98 (м, 2 Н), 4,69 (дд, J=8,56 Гц, 3,53 Гц, 1 Н), 7,18 (дд, J=8,31 Гц, 1,76 Гц, 1 Н), 7,34-7,42 (т,2 Н), 7,43-7,56 (м, 4 Н), 7,72-7,88 (м, 2 Н), 8,36 (с, 1 Н), 8,78 (с, 1 Н). Стадия F. Раствор концентрированной серной кислоты (500 г, 5,0 моль) охладили на ледяной бане в 3-л круглодонной колбе до 0C. В колбу по каплям добавили раствор 2-(3-([1,2,4]триазоло[1,5]пиридин-6-ил)бензиламино)-1-(3,4-дихлорфенил) этанола (79 г, 0,191 моль) в ДХМ (250 мл). Добавление закончили через 30 мин, в течение которых температуру реакции поддерживали в диапазоне 10-20C. ДХМ в это время выдували азотом. Испарение ДХМ помогало снизить температуру реакции. Смесевой раствор перемешивали при комнатной температуре в течение ночи. ВЭЖХ указала на отсутствие исходного материала. Соотношения площадей 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)1,2,3,4-тетрагидроизохинолина и 5-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4- 19020553 тетрагидроизохинолина по ВЭЖХ составило 75:25. Реакционную смесь охладили до 0C. В раствор медленно добавили изопропанол (2 л), поддерживая температуру 0C. Твердое вещество (желаемый изомер чистотой 92%) получили фильтрацией. Твердое вещество растворили в AcOEt (1 л) и довели pH до 10 при помощи NH4OH. Водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промыли водой, высушили над Na2SO4 и концентрировали. Остаток растворили в этаноле (250 мл), а затем добавили 1,1 экв. метансульфоновой кислоты (20,20 г, 0,21 моль), и перемешивали раствор в течение ночи. Полученный осадок соли метансульфоновой кислоты (98% чистоты) отфильтровали. Его растворили в воде и довели pH до 10 при помощи NH4OH, затем дважды экстрагировали этилацетатом. Объединенные экстракты промывали водой и высушили над Na2SO4. После удаления растворителя получили 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин в аморфном состоянии (40,8 г, выход 54%: m/z=395,0 [М+1]. 1H ЯМР (400 МГц, хлороформ-D)м.д. 3,05 (дд, J=12,00, 8,00 Гц, 1 Н), 3,40 (дд, J=12,00 Гц, 4,00 Гц,1 Н), 4,05-4,25 (м, 3H), 6,96 (т, 2 Н), 7,25-7,35 (м, 4 Н), 7,70-7,80 (м, 2 Н), 8,32 (с, 1 Н), 8,74 (с, 1 Н). Стадия G. К раствору 7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолина (25,2 г, 63,8 ммоль) в ДМФА (30 мл) добавили ди-трет-бутилдикарбонат (13,91 г,63,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавили этилацетат (500 мл). Раствор промыли насыщенным солевым раствором и водой. Органический слой высушили над Na2SO4. После удаления растворителя получили твердый рац-трет-бутил 7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-3,4-дигидроизохинолин-2(1 Н)-карбоксилат(30,6 г, 61,8 ммоль, выход 97%) путем перекристаллизации из МеОН; m/z=495,1 [М+1]. 1(м, 2 Н), 7,13 (д, J=1,51 Гц, 1 Н), 7,35 (т, 3H), 7,78 (дд, J=8,31, 1,77 Гц, 2 Н), 8,31 (с, 1 Н), 8,72 (с, 1 Н). Стадия Н. В результате хирального разделения высокоэффективной жидкостной хроматографией при сверхвысоких температурах на колонке Chiralpak AS-H (325 см, 5 мкм; элюент: СО 2/(МеОН/ТЭА=100/0,2 (об./об.=75/25; 220 нм) получили (+)-трет-бутил 7-([1,2,4]триазоло[1,5]пиридин-6-ил)-4-(3,4-дихлорфенил)-3,4-дигидроизохинолин-2(1 Н)-карбоксилат (э.и. 99,7%). Стадия I. К раствору (+)-энантиомера, полученного на стадии Н, (32,41 г, 65,43 ммоль) в ДХМ (150 мл) добавили раствор хлороводорода-этанола (2,5 н., 250 мл) и 500 мл EtOH. Реакционную смесь перемешивали при 70C в течение 2 ч. После удаления растворителя остаток дефлегмировали в 1000 мл AcOEt в течение 1 ч. Продукт (+)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолина гидрохлорид (27,4 г, выход 97%) получили после фильтрации и сушки.H ЯМР (400 МГц, ДМСО-d6)м.д. 3,70 (т, 2 Н), 4,40-4,65 (м, 3H), 6,90 (д, 7,80 Гц, 1 Н), 7,35 (дд,J=7,8 Гц, 2 Гц, 1 Н), 7,68 (м, 4 Н), 8,58 (с, 1 Н), 9,38 (с, 1 Н), 9,8 (ушир.с, 2 Н). Пример 4. Анализ первичного связывания. Получение мембран. Рекомбинантные клетки HEK-293, экспрессирующиеся белками hCEPT, hДАТ или hHAT, собрали из колб Т-175 следующим образом. Среду удалили из колб и промыли клетки ССРХ без Ca и без Mg. Затем клетки инкубировали в течение 5-10 мин в 10 мМ буфере Трис-Cl, pH 7,5, 5 мМ ЭДТК до тех пор,пока клетки не поднялись в сочетании с отмериванием пипеткой и выскабливанием, по мере необходимости. Клеточную суспензию собрали в колбы для центрифуги и гомогенизировали в течение 30 с при помощи гомогенизатора Polytron. Суспензию центрифугировали в течение 30 мин при 32000g, 4C. Надосадочную жидкость слили, повторно суспендировали гранулы и гомогенизировали в 50 мМ буфере Трис-Cl, pH 7,5, 1 мМ ЭДТК в течение 10 с. Суспензию снова центрифугировали в течение 30 мин при 32000g, 4C. Надосадочную жидкость слили и повторно суспендировали гранулы в 50 мМ Трис-Cl, pH 7,5, 1 мМ ЭДТК и быстро гомогенизировали. Выполнили анализ Брэдфорда (Bio-Rad), и получили мембраны разбавлением до концентрации 2 мг/мл 50 мМ буфером Трис-Cl, pH 7,5, 1 мМ ЭДТК. Приготовили аликвоты, а затем их заморозили и хранили при температуре -80C. Анализ связывания радиолигандов СЕРТ. Соединения растворили в 100% ДМСО в концентрации, в 100 раз превышающей максимальную концентрацию для анализа, серийно разбавили в соотношении 1:3 в 100% ДМСО и разлили по 1,0 мкл/лунку каждого раствора в 384-луночный полипропиленовый планшет Nunc с круглым дном. 100% ингибирование определили при помощи добавления в каждую лунку 0,4 мкл/лунку 1 мМ раствора флуоксетина, растворенного в ДМСО. 20 мкл/лунку 2 полученной мембраны (15 мкг/мл в 50 мМ Трис-Cl,pH 7,5, 120 мМ NaCl, 5 мМ KCl) и 20 мкл/лунку 2 раствора радиолиганда (520 пМ [125I]RTI-55 в 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl) и инкубирования реакции в течение 1 ч при комнатной температуре. Содержание анализируемого планшета затем переместили на пластину фильтра GF MilliporeMultiscreenHTS, которую предварительно обработали 0,5% PEI по меньшей мере в течение 1 ч. Фильтровали на пластине под вакуумом и промыли 7 раз по 100 мкл/лунку раствором 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl, охлажденным до 4C. Фильтрацию и промывание завершили менее чем за 90 с. Пластины высушили на воздухе в течение ночи, добавили 12 мкл/лунку сцинтилляционной текучей сре- 20020553 ды MicroScint, и подсчитали пластины в Trilux. Анализ связывания радиолигандов ДАТ. Соединения растворили в 100% ДМСО в концентрации, в 100 раз превышающей максимальную концентрацию для анализа, серийно разбавили в соотношении 1:3 в 100% ДМСО и разлили по 0,4 мкл/лунку каждого раствора в 384-луночный полипропиленовый планшет Nunc с круглым дном. 100% ингибирование определили при помощи добавления в каждую лунку 0,4 мкл/лунку 1 мМ раствора GBR12935, растворенного в ДМСО. 20 мкл/лунку 2 полученной мембраны (12,5 мкг/мл в 30 мМ буфера фосфата натрия, pH 7,9 при 4C) и 20 мкл/лунку 2 раствора радиолиганда (250 пМ [125I]RTI-55 в 30 мМ буфера фосфата натрия, pH 7,9 при температуре 4C) и инкубирования реакции в течение 1 ч при комнатной температуре. Содержание анализируемого планшета затем переместили на пластину фильтра GFMillipore MultiscreenHTS, которую предварительно обработали 0,5% PEI по меньшей мере в течение 1 ч. Фильтровали на пластине под вакуумом и промыли 7 раз по 100 мкл/лунку раствором 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl, охлажденным до 4C. Фильтрацию и промывание завершили менее чем за 90 с. Пластины высушили на воздухе в течение ночи, добавили 12 мкл/лунку сцинтилляционной текучей среды MicroScint, и подсчитали пластины в Trilux. Анализ связывания радиолигандов HAT. Соединения растворили в 100% ДМСО в концентрации, в 100 раз превышающей максимальную концентрацию для анализа, серийно разбавили в соотношении 1:3 в 100% ДМСО и разлили по 0,4 мкл/лунку каждого раствора в 384-луночный полипропиленовый планшет из Nunc с круглым дном. 100% ингибирование определили при помощи добавления в каждую лунку 1,0 мкл/лунку 10 мМ раствора дезипрамина, растворенного в ДМСО. В каждую лунку добавили 50 мкл/лунку 2 полученную мембрану(0,4 мг/мл в 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl) и 50 мкл/лунку 2 раствора радиолиганда (4 нМ [3 Н]низоксетина в 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl) и инкубировали реакцию в течение 1 ч при комнатной температуре. Содержание анализируемого планшета затем переместили на пластину фильтра GF Millipore MultiscreeriHTS, которую предварительно обработали 0,5% PEI по меньшей мере в течение 1 ч. Фильтровали на пластине под вакуумом и промыли 7 раз по 100 мкл/лунку раствором 50 мМ Трис-Cl, pH 7,5, 120 мМ NaCl, 5 мМ KCl, охлажденным до 4C. Фильтрацию и промывание завершили менее чем за 90 с. Пластины высушили на воздухе в течение ночи, добавили 12 мкл/лунку сцинтилляционной текучей среды MicroScint и подсчитали пластины в Trilux. Анализ данных. Исходные данные привели к проценту ингибирования, используя контрольные лунки, устанавливающие 0% (только ДМСО) и 100% (селективный ингибитор) ингибирования, которые выполнялись на каждом планшете. Каждый планшет обрабатывали три раза, и кривая концентрации, полученная таким образом, стала соответствовать использованию четырехпараметрового уравнения "доза - ответная реакция", Y=Нижняя+(Верхняя-Нижняя)/(1+10LogIC50-X)Наклон с целью определения значения IC50 для каждого соединения. Концентрация радиолиганда, выбранная для каждого анализа, соответствует концентрации Kd, определенной посредством анализа насыщения связывания для каждого анализа. Пример 5. Анализ заполнения. Общий порядок отбора тканей головного мозга и оценки заполнения транспортера можно кратко описать следующим образом. Мышей убивают при помощи асфиксии в CO2, крыс путем обезглавливания и собак путем внутривенного введения эвтаназийного раствора. У мышей и крыс, после извлечения мозга из черепа, ткани переднего мозга (удаление ствола мозга и мозжечка) используют для оценки заполнения СЕРТ, HAT и ДАТ. У собак стриатум разрезают для заполнения ДАТ, а оставшиеся ткани переднего мозга (без стриатума, ствола мозга и мозжечка) используют для оценки заполнения СЕРТ иHAT. Ткани мозга замораживают в охлажденном изопентане и хранят при температуре -80C до гомогенизации. Ткани мозга размораживают и затем гомогенизируют, используя гомогенизатор Polytron (Kinematica). Аликвоты образцов немедленно замораживают и хранят при температуре 80C. Содержание белка измеряют для каждого образца с помощью набора белковых спектров Кумасси (Pierce). В день связывания вне организма для оценки заполнения, замороженные аликвоты образцов размораживают и гомогенизируют иглой, и 100 мкг ткани инкубируют для связывания СЕРТ, HAT и ДАТ в соответствии с условиями анализа, приведенными в табл. 1. После инкубации реакции прекращают добавлением ледяного буфера и быстрой фильтрацией через клеточный коллектор Брандела, используя фильтры FPXLR-196. Фильтры дважды промывают ледяным инкубационным буфером, компостируют в чистый планшет перед добавлением 200 мкл сцинтилляционной жидкости на лунку. Радиолиганд измеряют с помощью счетчика жидкостной сцинтилляции Wallac Microbeta.- 21020553 Таблица 1 Условия анализа связывания вне организма для заполнения транспортерами серотонина, норадреналина и дофамина Специфическое связывание рассчитывают путем вычитания значения неспецифического связывания от общего связывания каждого образца. Процент заполнения рассчитывают как (1 - специфическое связывание в применяемом лекарственном препарате/специфическое связывание в применяемом переносчике)100%. Для оценки заполнения EC50 в естественных условиях (общая концентрация плазмы соединения, дающая 50% заполнения) значения заполнения единиц опыта по сравнению с концентрациями плазмы устанавливают на модели одной области связывания с использованием криволинейной регрессии в соответствии со следующим уравнением:% Заполнения=EmaxС/(ЕС 50+С),где Emax является максимальным специфическим связыванием; С является концентрацией препарата и ЕС 50 является общей плазменной концентрацией, необходимой для заполнения 50% области связывания. Криволинейная регрессия проводилась с использованием призмы GraphPad версии 3,00 (GraphPad Пример 6. Анализы поведения в естественных условиях. Для всех тестов. Со всеми животными обходились в соответствии с руководством Комитета по животным Компании Бристол-Майерс Сквибб и руководством по содержанию и использованию лабораторных животных, Институт ресурсов лабораторных животных, 1996 года, которые включены в настоящее изобретение путем ссылки в полном объеме. Протоколы исследований одобрены Комитетом по институциональному уходу за животными и их использованию Компании Бристол-Майерс Сквибб. Анализ подвешиванием мышиного хвоста. Самцов швейцарских мышей Webster помещали по 3-4 особи в клетку в помещения с поддерживаемой постоянной температурой (21-23C) и влажностью (5010%) на 12-часовой цикл дня и ночи. Животные имели неограниченный доступ к воде и пище на протяжении исследования. В день исследования их доставили в комнату для исследования и дали акклиматизироваться в течение 1 ч. В начале исследования хвост прикрепляется к куску ленты, который затем прикрепляется к крюку на потолке шумопоглощающей клетки. Неподвижность автоматически записывалась при помощи программного обеспечения MedAssociates. Соединения вводились через строго фиксированные интервалы подготовки к лечению до начала эксперимента. Минимальной эффективной дозой примера 1-(+)-энантиомера в изучении подвешивания мышиного хвоста была доза 10 мг/кг. Анализ принудительного плавания крыс. Самцов крыс Sprague Dawley размещали попарно в помещения с поддерживаемой постоянной температурой (21-23C) и влажностью (5010%) на 12-часовой цикл дня и ночи. Животные получали неограниченный доступ к воде и пище на протяжении исследования. Животных обрабатывали в течение 2- 22020553 мин ежедневно за два дня до начала эксперимента. В первый день исследования крыс помещали в резервуар для плавания (пирексный цилиндр 46 см высотой 21 см в диаметре, наполненный 30 см воды в диапазоне температур от 24-26C) на 15 мин (процедура предварительного плавания). В конце 15 минутного сеанса крыс сушили и помещали в свою родную клетку. Соединения вводились три раза в последующие 24 ч (23,5, 5 и 1 ч), до второго теста плавания. Этот тест плавания длился 5 мин и поведение животных записывалось на видеопленку и оценивалось активное поведение (неподвижность, плавание, лазание). В конце каждого 5-секундного периода в течение 5-минутной процедуры тестирования поведение крыс оценивалось, как одно из следующих действий: неподвижность (крыса продолжала плавать в воде без борьбы и делала только те движения, которые необходимы для того, чтобы держать голову над водой), плавание (крыса делала активные плавательные движения больше, чем нужно, чтобы просто сохранить свою голову над водой, например передвигалась по кругу в резервуаре), или лазание (крыса делала активные движения передними лапами в и вне воды, как правило, направленными против стенки резервуара). Соединения определяли лишь путем заранее определенных кодов, и экспериментатор оставался в неведении в течение всего эксперимента (в том числе, в то время, когда шла запись видеокассеты). Двигательная активность крыс и мышей. Животных размещают в соответствии с условиями, описанными выше для двух видов. Прибор для испытания состоит из камер из оргстекла, оснащенных мониторами активности Digiscan (Omnitech Electronics, Колумбус, штат Огайо), которые обнаруживают прерывания восьми фотоэлементов. Горизонтальная активность записывается в 5-минутных гистограммах для всех 60 мин и выражается в виде общего преодоленного расстояния (в см). Соединения вводятся через строго фиксированные интервалы подготовки к лечению до начала эксперимента. Пример 7. Получение монокристаллов L-тартрата (S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4 дихлорфенил)-1,2,3,4-тетрагидроизохинолина (соли L-винной кислоты). В колбе растворили соль L-винной кислоты (S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4 дихлорфенил)-1,2,3,4-тетрагидроизохинолина в метаноле (8 мл) при нагревании. Затем к вышеуказанному прозрачному раствору добавили дистиллированную воду (2 мл). Полученный раствор накрыли и оставили при комнатной температуре. Игольчатые кристаллы L-тартрата (S)-7-([1,2,4]триазоло[1,5]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина получили после медленного испарения на воздухе в течение нескольких дней. Пример 8. Получение монокристаллов моногидрата моноизопропанолата моногидрохлорида (S)-7([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина (соль HCl; форма SA-1). В колбе растворили соль моно-HCl (S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)1,2,3,4-тетрагидроизохинолина (20 мг) в изопропаноле (10 мл) при нагревании. К вышеуказанному прозрачному раствору затем добавили дистиллированную воду (2 мл). Полученный раствор накрыли и оставили при комнатной температуре. Длинные игольчатые кристаллы соли моно-HCl моноизопропанолата моногидрата(S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4 тетрагидроизохинолина получили после медленного испарения на воздухе в течение нескольких дней. Игольчатые кристаллы отделили от маточного раствора фильтрованием и влажный осадок высушили в печи в течение 16 ч при температуре 45C и давлении 100 мм рт. ст. Пример 9. Получение монокристаллов моногидрохлорида (S)-7-([1,2,4]триазоло[1,5-]пиридин-6 ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина (соль HCl; форма N-2). В колбе растворили соль моно-HCl (S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4-дихлорфенил)1,2,3,4-тетрагидроизохинолина (20 мг) в метаноле (8 мл) при нагревании. Затем к вышеуказанному прозрачному раствору добавили дистиллированную воду (2 мл). Полученный раствор накрыли и оставили при комнатной температуре. Длинные игольчатые кристаллы соли моно-HCl (S)-7-([1,2,4]триазоло[1,5]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина получили после медленного испарения на воздухе в течение нескольких дней. Пример 10. Анализ монокристаллов методом рентгенокристаллографии. Данные кристаллов L-тартрата (соли L-винной кислоты) (S)-7-([1,2,4]триазоло[1,5-]пиридин-6 ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина и моногидрохлорида (S)-7-([1,2,4]триазоло[1,5]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолина (соль HCl; форма N-2) регистрировали на дифрактометре SMART CCD, оснащенном графитовым монохроматическим излучением Cu K(=1,54178 ) при температуре 225 К и при комнатной температуре соответственно. Данные кристаллов моногидрохлорида моноизопропанолата моногидрата (S)-7-([1,2,4]триазоло[1,5-]пиридин-6-ил)-4-(3,4 дихлорфенил)-1,2,3,4-тетрагидроизохинолина (соль HCl; форма SA-1) регистрировали на дифрактометреX8-ApexII, оснащенном графитовым монохроматическим излучением Cu K (=1,54178 ) при комнатной температуре (APEX-II 1.0-28, Программное обеспечение регистрации данных для устройств CCD фирмы Bruker. Bruker AXS Inc, Мэдисон, штат Висконсин, США. SAINT PLUS, программное обеспечение для обработки устройств BrukerCCD, Bruker AXS Inc, Мэдисон, штат Висконсин, США). Оконча- 23020553 тельные параметры элементарной ячейки были определены с использованием полного набора данных. Все структуры были получены прямыми методами и уточнены методами наименьших квадратов полной матрицы, с помощью пакета программного обеспечения SHELXTL (Sheldrick, G.M. 1997,SHELXTL. Программы определения структуры. Версия 5.10, Bruker AXS, Мэдисон, штат Висконсин,США). Функция, минимизированная при уточнении, - W(FO-FC)2. R определяется как FO-FC/FO, в то время как RW=[W(FO-FC)2/WFO2]1/2, где w - это соответствующая весовая функция, основанная на погрешностях экспериментально измеренных интенсивностей. Разницу карт Фурье изучали на всех этапах уточнения. В форме L-тартрата один из атомов хлора в боковой цепи фенилового кольца является нерегулируемым по двум позициям на 50% заполнения каждого из них. Молекулы винной кислоты являются также нерегулируемыми, так как не могут быть хорошо смоделированы. Количество молекул метанола не может быть определено из-за нерегулируемости. Все атомы, не являющиеся атомами водорода, уточняли при помощи параметров анизотропной тепловой деформации. Атомы водорода, связанные водородной связью, располагали в окончательной разнице карт Фурье, в то время как позиции других атомов водорода рассчитывали по идеализированной геометрии стандартных длин связей и углов. Их выделяли изотропными факторами температуры и включали в состав фактора расчетов с фиксированными параметрами. Данные кристалла формы L-тартрата приведены в табл. 3, дробные координаты атомов перечислены в табл. 4. Данные кристалла формы SA-1 приведены в табл. 5, дробные координаты атомов перечислены в табл. 6. Данные кристалла формы N-2 приведены в табл. 7, дробные координаты атомов перечислены в табл. 8. Любой из специалистов в этой области должен иметь в виду, что возможны небольшие изменения в координатах, и они обсуждаются в рамках настоящего изобретения.- 24020553 Таблица 3 Данные кристалла формы L-тартрата- 25020553 Таблица 4 Атомные координаты формы L-тартрата. Координаты атомов (104) и эквивалентные изотропные параметры смещения(2103) для формы L-тартрата. U (экв.) определяется как одна треть следа ортогонализованного тензора Uij- 26020553 Таблица 5 Данные кристалла соли HCl: форма SA-1- 27020553 Таблица 6 Атомные координаты соли HCl: форма SA-1. Координаты атомов (104) и эквивалентные изотропные параметры смещения (2103) для формы SA-1.U (экв.) определяется как одна треть следа ортогонализованного тензора Uij
МПК / Метки
МПК: A01N 43/60
Метки: фармацевтическая, композиция, основе, неврологических, лечения, способы, психических, 7-([1,2,4]триазоло[1,5-α]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин, расстройств
Код ссылки
<a href="https://eas.patents.su/30-20553-7-124triazolo15-alphapiridin-6-il-4-34-dihlorfenil-1234-tetragidroizohinolin-farmacevticheskaya-kompoziciya-na-ego-osnove-i-sposoby-lecheniya-nevrologicheskih-i-psihicheskih-rasstr.html" rel="bookmark" title="База патентов Евразийского Союза">7-([1,2,4]триазоло[1,5-α]пиридин-6-ил)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидроизохинолин, фармацевтическая композиция на его основе и способы лечения неврологических и психических расстройств</a>
Предыдущий патент: Способ получения производных дезоксирибофуранозы
Следующий патент: Система запирания двери
Случайный патент: Полихромные вещества и их применение