Замещенное производное этилендиамина для лечения микобактериальных заболеваний и фармацевтическая композиция на его основе
Номер патента: 20307
Опубликовано: 30.10.2014
Авторы: Протопопова Марина Николаевна, Слэйден Ричард Эллан, Ли Ричард Эдвард, Берри III Клифтон Е., Эйнк Лео
Формула / Реферат
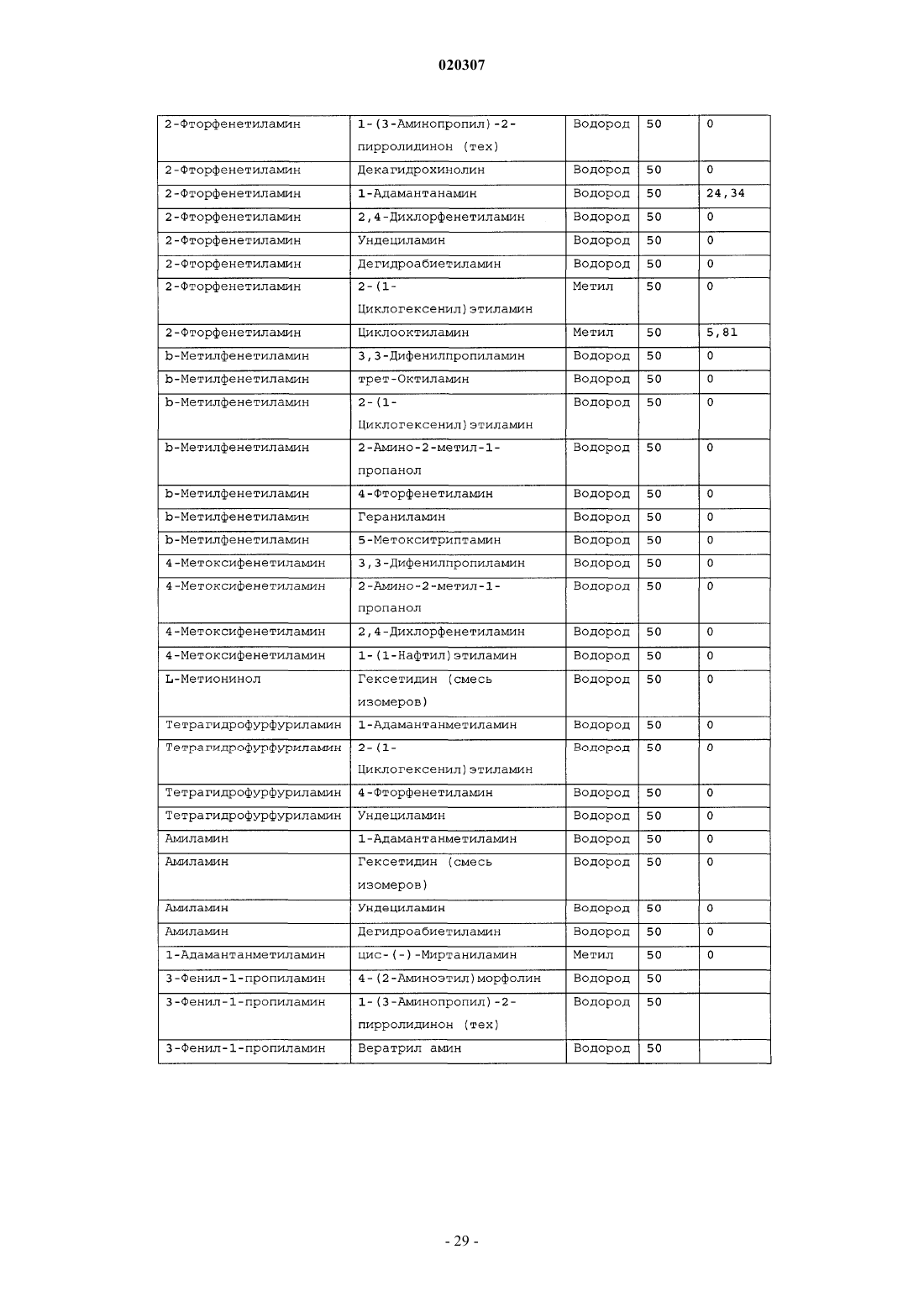
1. Замещенное производное этилендиамина формулы
где R4 выбран из Н, С2-С8алкила, С2-С4алкенила, С2-С4алкинила, С4-С6циклоалкила, С4-С8циклоалкенила, фенила, толила, ксилила, бензила и нафтила;
и где R1, R2 и R3 независимо выбраны из Н, С1-С8алкила, С2-С4алкенила, С2-С4алкинила, С4-С6циклоалкила и С8циклоалкила, С4-С6циклоалкенила, галогенида, толила, ксилила, бензила, нафтила, пиридинила, фуранила, тетрагидро-1-нафтила, пиперидинила, индолила, индолинила, пирролидинила, 2-(метоксиметил)пирролидинила, пиперазинила, хинолинила, хинолила, алкилированного 1,3-диоксолана, триазинила, морфолинила, фенила, пиразолила, инданила, индонила, тиадиазолила, роданинила, тиолактонила, дибензофуранила, бензотиазолила, гомопиперидинила, тиазолила, хинонуклидинила, изоксазолидинонила, изопинокамфенила, борнила, норборнила, адамантанететила, цис-(-)миртанила, 6-азабицикло[3,2,1]октана, экзонорборнана или их комбинации и/или
где NR2R3 представляет собой 4-бензилпиперидин; 3-пиперидинметанол; пиперидин; триптамин; морфолин; 4-пиперидинопиперидин; этил 1-пиперазин карбоксилат; 1-(2-аминоэтил)пиперазин; декагидрохинолин; 1,2,3,4-тетрагидропиридоиндол; 3-амино-5-фенилпиразол; 3-аминопиразол; 1-(2-фторфенил)пиперазин; 1-пролинметиловый эфир; гистидинол; 1-пиперонилпиперазин; гексаметилимин; 4-гидроксипиперидин; 2-пиперидинметанол; 1,3,3-триметил-6-азабицикло[3,2,1]октан; 3-пирролидинол; 1-метилпиперазин; (S)-(+)-(2-пиролидинилметил)пирролидин; 1-метилгомопиперазин; 2-этилпиперидин; 1,2,3,4-тетрагидроизохинолин; 1-(4-фторфенил)пиперазин; метиловый эфир d,1-триптофана; трет-бутил (15,45)-(-)-2,5-диазабицикло[2,2,1]гептан-2-карбоксилат; изонипекотамид; гептаметиленимин; альфа-метилтриптамин; 6,7-диметокси-1,2,3,4-тетрагидроизохинолин; 3-аминопирролидин; 3,5-диметилпиперидин; 2,6-диметилморфолин; 1,4-диоксо-8-азаспиро[4,5]декан; 1-метил-6,7-дигидрокси-1,2,3,4-азаспиро[4,5]декан; 1-метил-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолин; 1,3,4,6,7,8-гексагидро-2Н-пиридо(1,2-А)пиримидин; 1,2,3,4-тетрагидрохинолин; 1-(2-метоксифенил)пиперазин; 1-(2-(2-гидроксиэтокси)этил)пиперазин; (S)-(+)-2-(аминометил)пирролидин; (3S(3а,4Ab),8Ab)-N-трет-бутил-D-экагидро-3-изохинолинкарбоксамид; (R)-циклосерин; гомопиперазин; 2,6-диметилпиперазин; иминодибензил; 5-метокситриптамин; 4,4'-бипиперидин; 1-(2-гидроксиэтил)пиперазин; 4-метилпиперидин; 1-гистидинметиловый эфир или метилпипеколат, 1-адамантанметиламин, 2,2-дифенилэтиламин, 3,3-дифенилпропиламин, 2-амино-1-бутанол, цис-(-)миртаниламин, циклооктиламин, адамантамин, (+)-борниламин, циклогексилэтиламин, ундециламин, гераниламин, (+)-изопинокамфенил или (-)-изопинокамфенил;
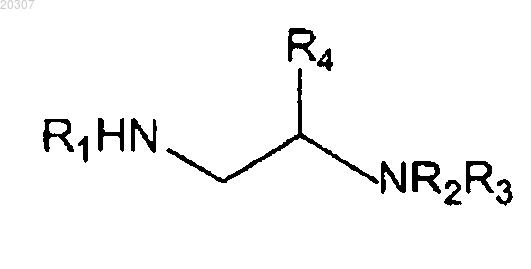
где NHR1 или NR2R3, но не оба, могут иметь следующие химические структуры:
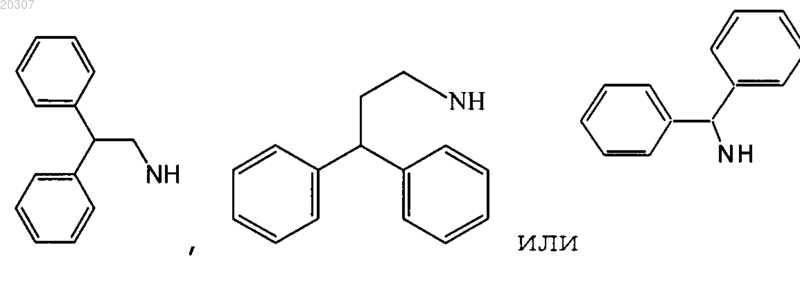
при условии, что если NHR1 или NR2R3 представляет собой
 или
или
то R1, R2 и R3 не являются аралкилом или циклическим алкилом, и если NHR1 или NR2R3 представляет собой
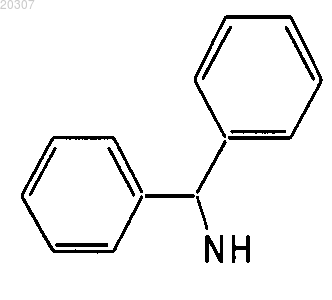 ,
,то R1, R2 и R3 не являются алкилом, содержащим 1-3 атома углерода;
и где, если R1, R2 или R3 представляют собой третичный алкил, то оставшиеся из R1, R2 и R3 не являются водородом или алкилом, содержащим более 4 атомов углерода, или алкенилом, содержащим менее 10 атомов углерода;
и где, если R2 или R3 представляет собой водород, то R1 и оставшийся из R2 или R3 не являются низшим алкилом или циклоалкилом, состоящим из 6 или менее атомов углерода;
и где R1, R2 и R3 не являются алкилом, содержащим 1-6 атомов углерода, -СН(С2Н5)-СН2-O-Н,
-СН(С2Н5)-СН2-O-СН3, -СН(С2Н5)-СН2-O-С2Н5 или -СН(С2Н5)-СН2-O-С6Н5;
и если R4 представляет собой Н, производное этилендиамина не является соединением формулы
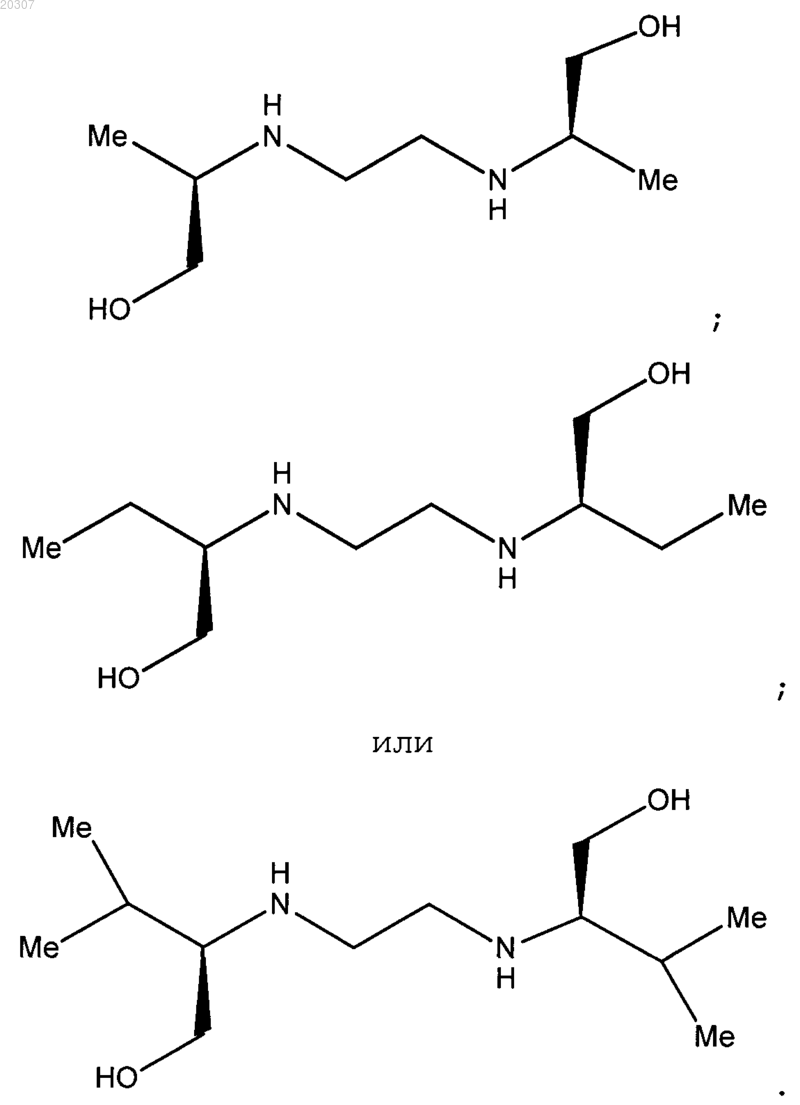
2. Соединение по п.1, где NHR1 или NR2R3 имеет формулу
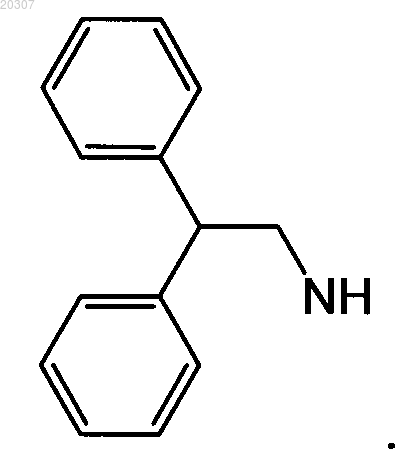
3. Соединение по п.1, где NHR1 или NR2R3 замещенного производного этилендиамина имеет формулу
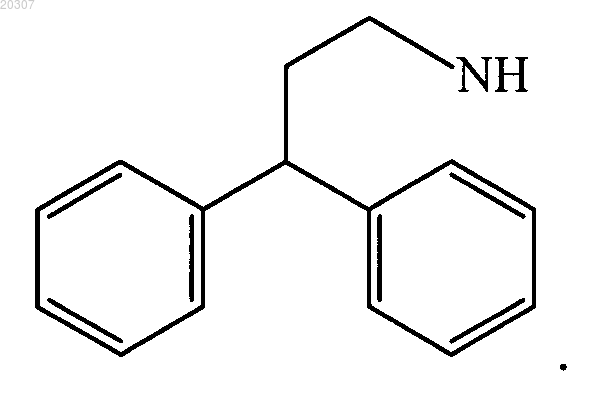
4. Соединение по п.1, где NHR1 или NR2R3 имеет формулу
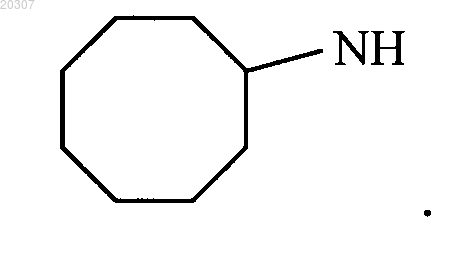
5. Соединение по п.1, где NHR1 или NR2R3 замещенного производного этилендиамина имеет формулу
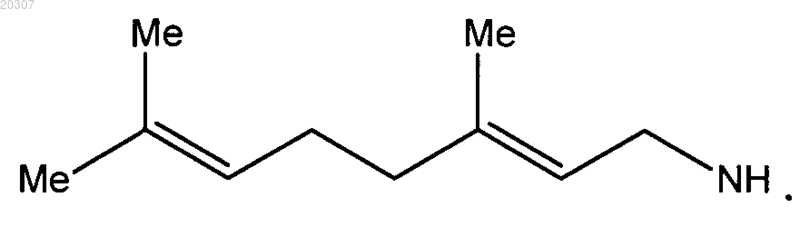
6. Соединение по п.5, где замещенное производное этилендиамина представляет собой
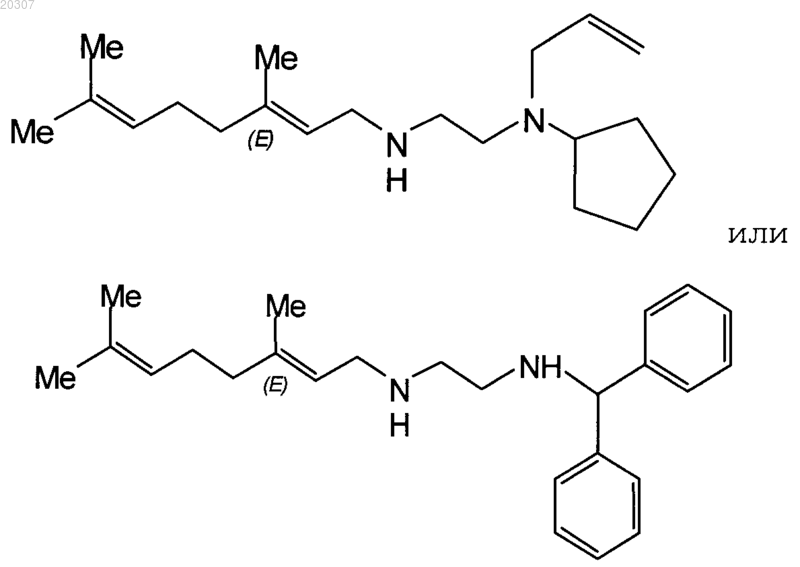
7. Соединение по п.1, где R1 выбран из 1-адамантанметиламина, 2,2-дифенилэтиламина, 3,3-дифенилпропиламина, 2-амино-1-бутанола, цис-(-)миртаниламина, циклооктиламина, 2-адамантанамина, (+)-борниламина, циклогексэтиламина, ундециламина, гераниламина, (+)-изопинокамфеиламина, (-)-изокамфеиламина или их комбинации.
8. Соединение по п.1, где NR2R3 выбран из 1-адамантанметиламина, 2,2-дифенилэтиламина, 3,3-дифенилпропиламина, 2-амино-1-бутанола, цис-(-)миртаниламина, циклооктиламина, 2-адамантанамина, (+)-борниламина, циклогексэтиламина, ундециламина, гераниламина, (+)-изопинокамфеиламина, (-)-изопинокамфеиламина или их комбинации.
9. Соединение по п.1, где R1, R2 и R3 выбраны из изопинокамфенила, борнила, норборнила, цис-(-)миртанила, 6-азабицикло[3.2.1]октана или экзонорборана.
10. Замещенное производное этилендиамина, выбранное из группы, состоящей из
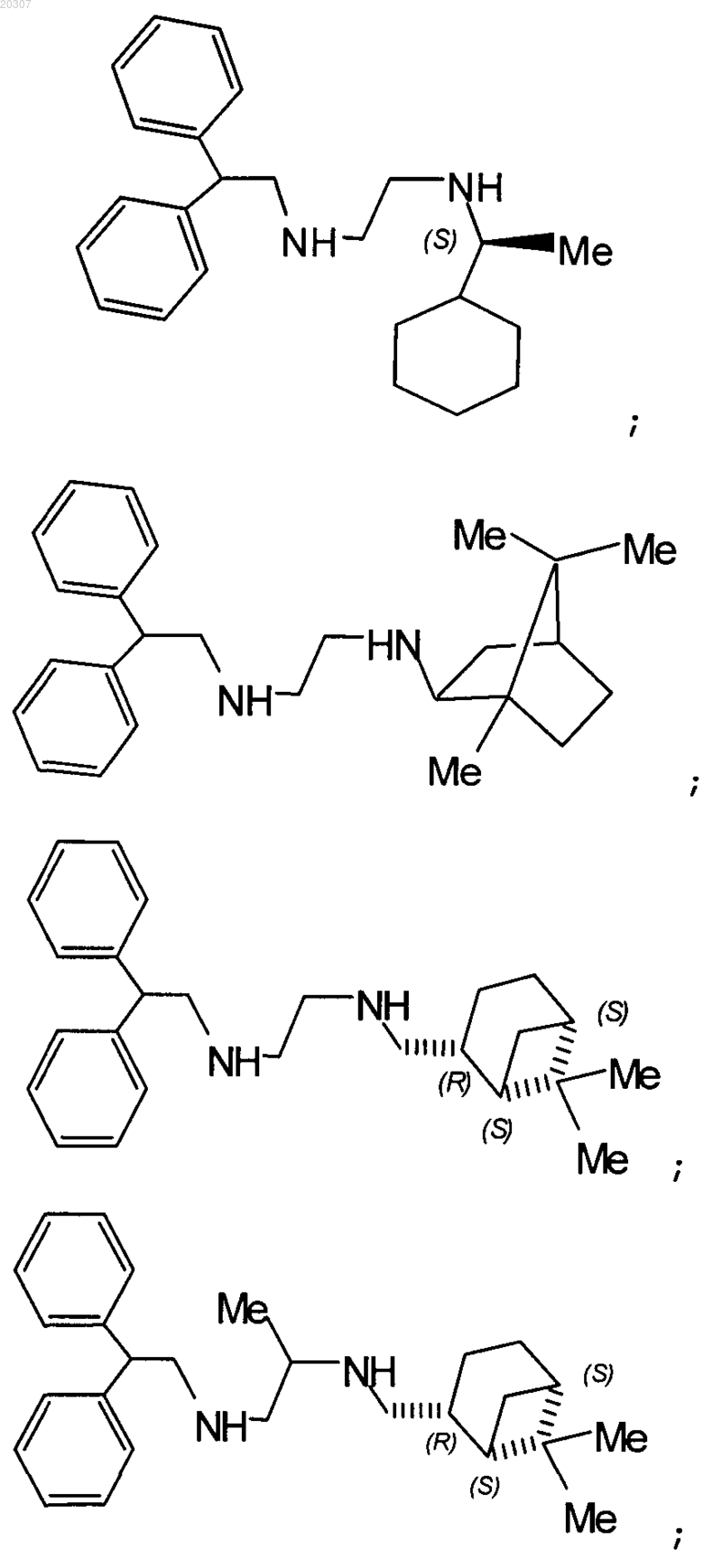
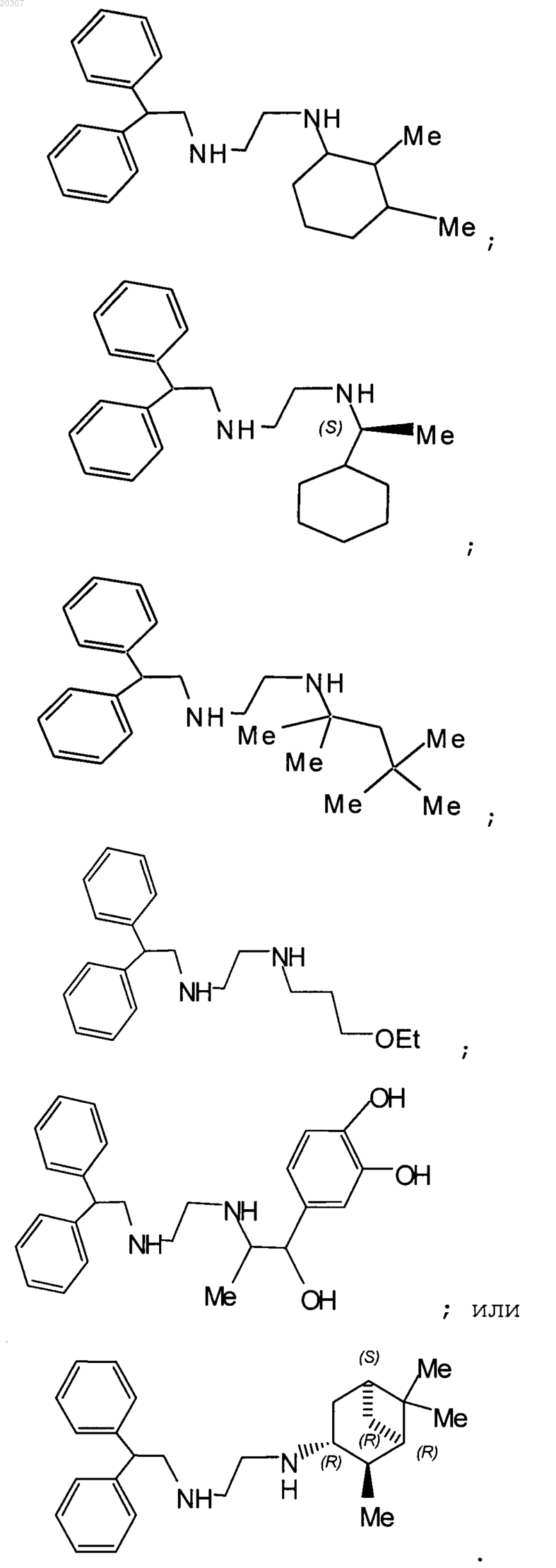
11. Замещенное производное этилендиамина, выбранное из группы, состоящей из
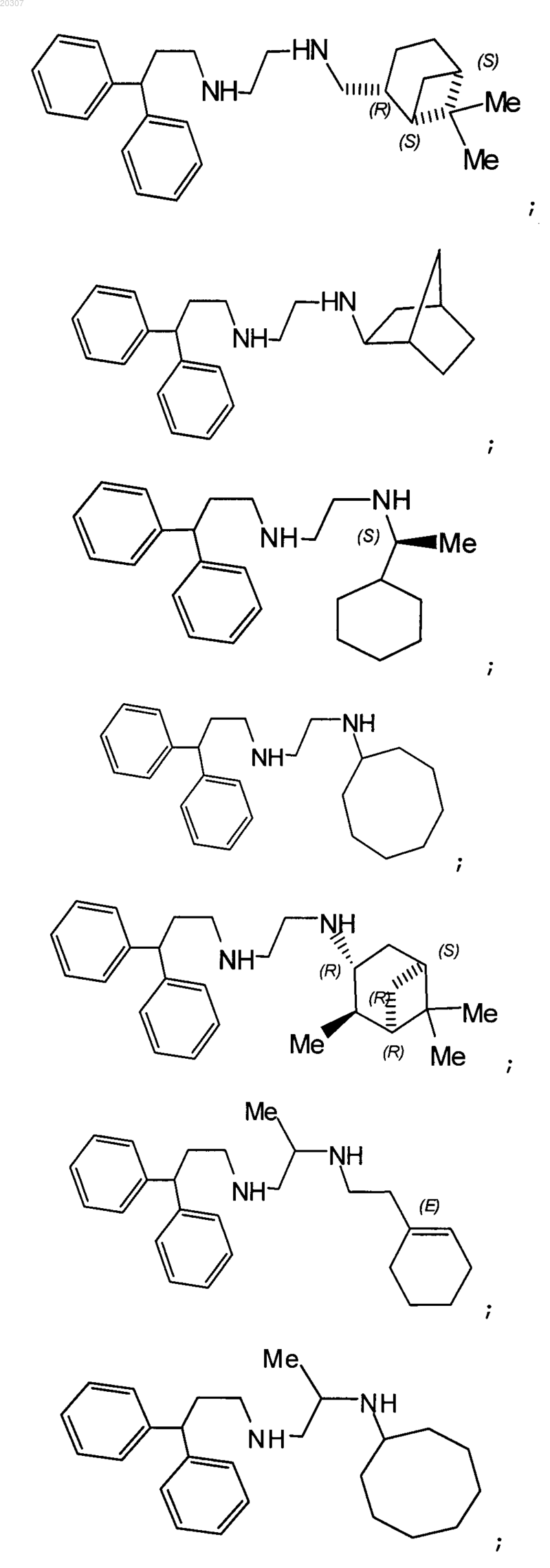
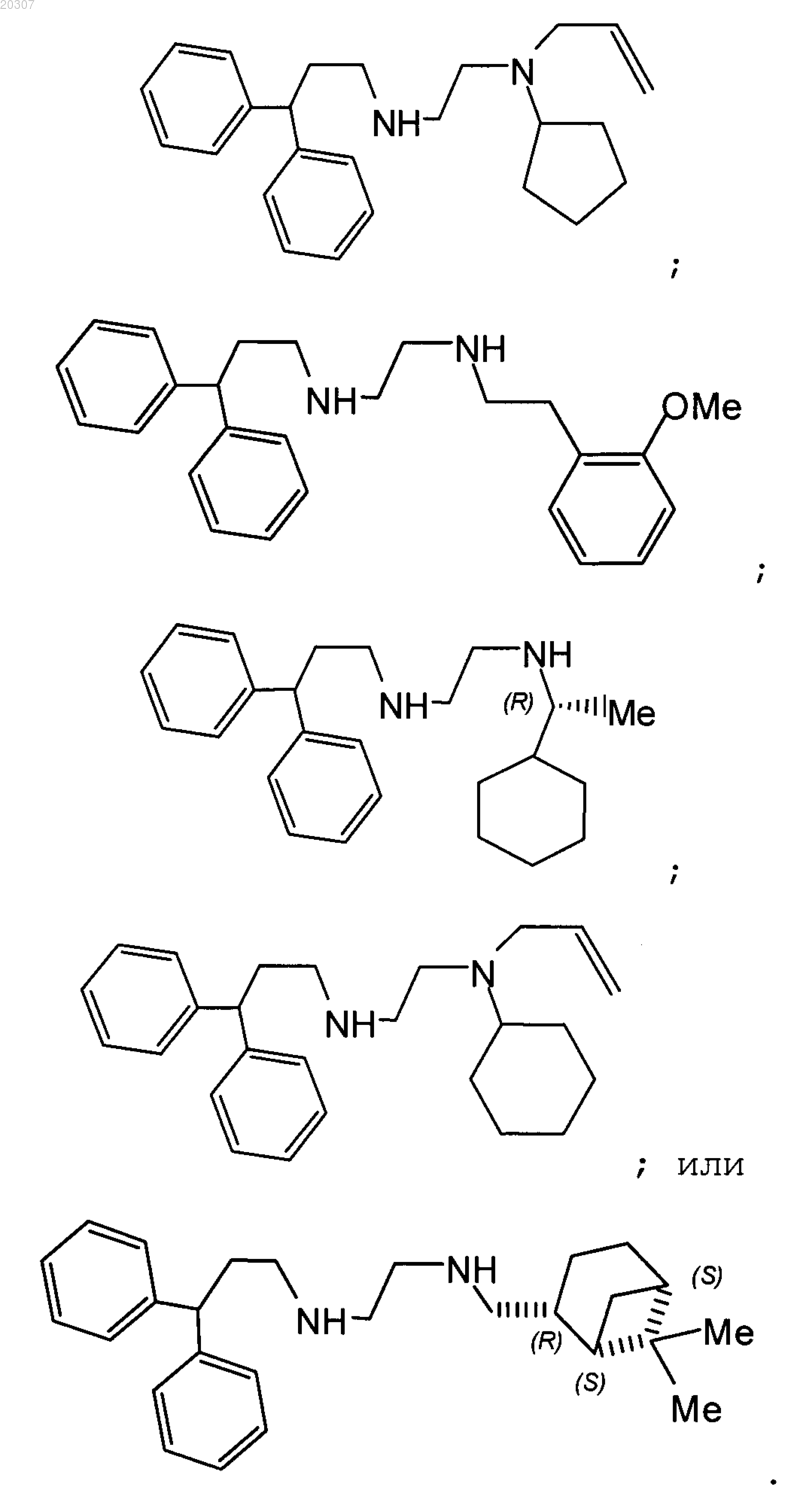
12. Замещенное производное этилендиамина, выбранное из группы, состоящей из
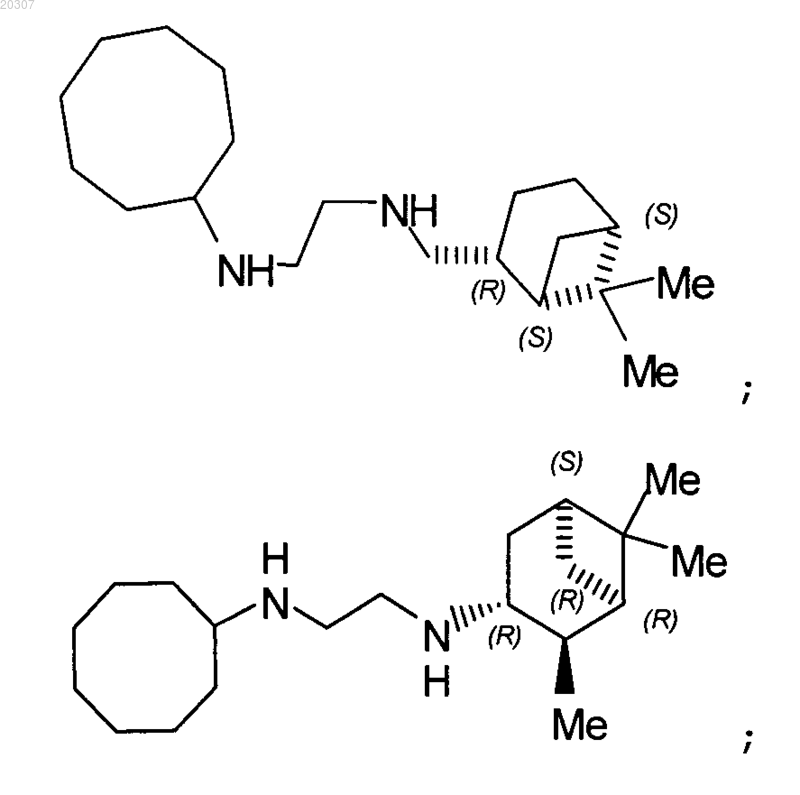
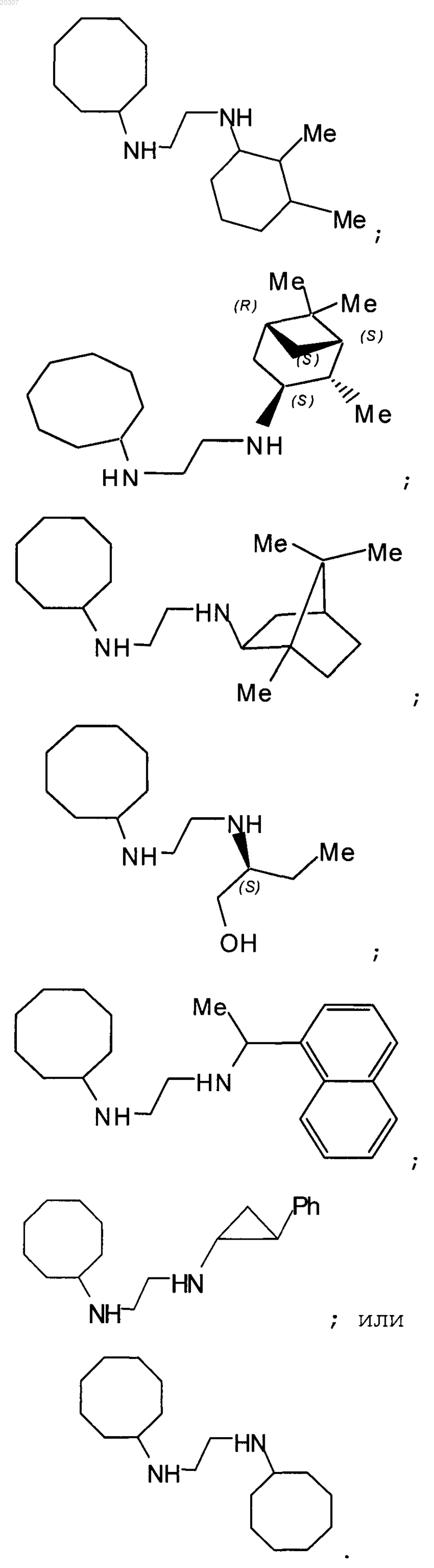
13. Замещенное производное этилендиамина, выбранное из группы, состоящей из

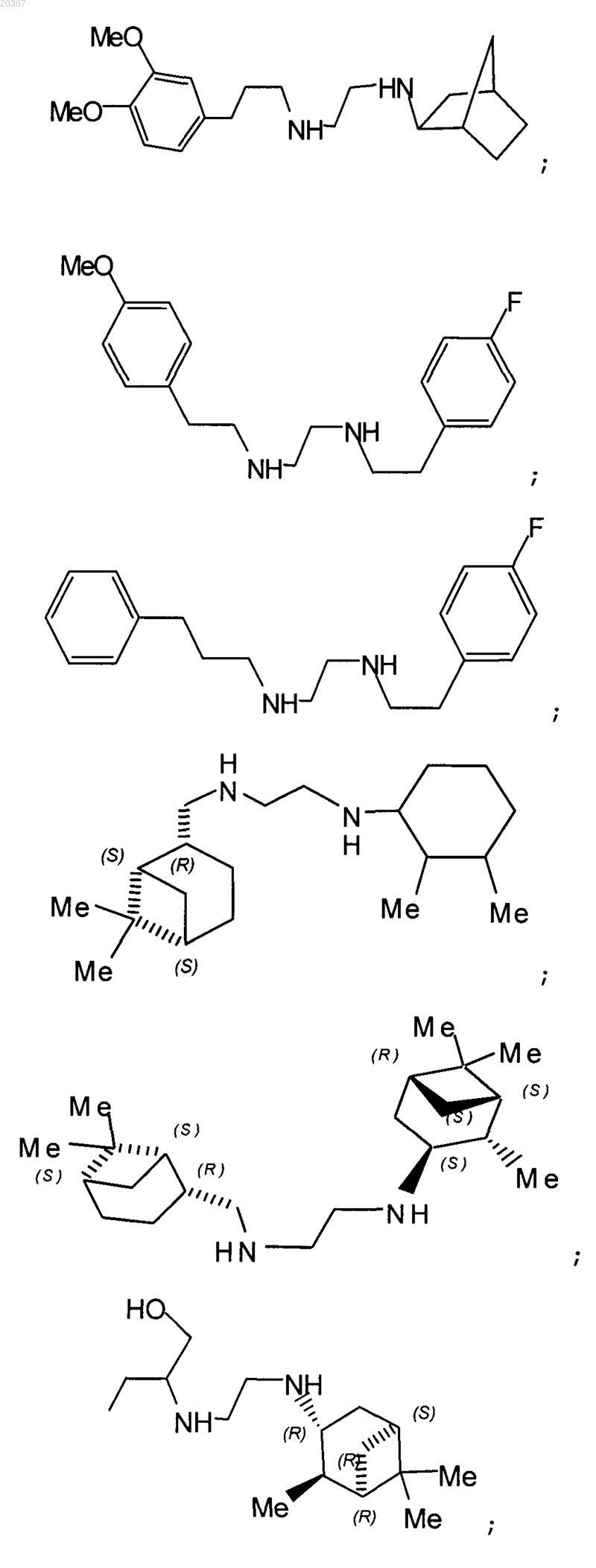
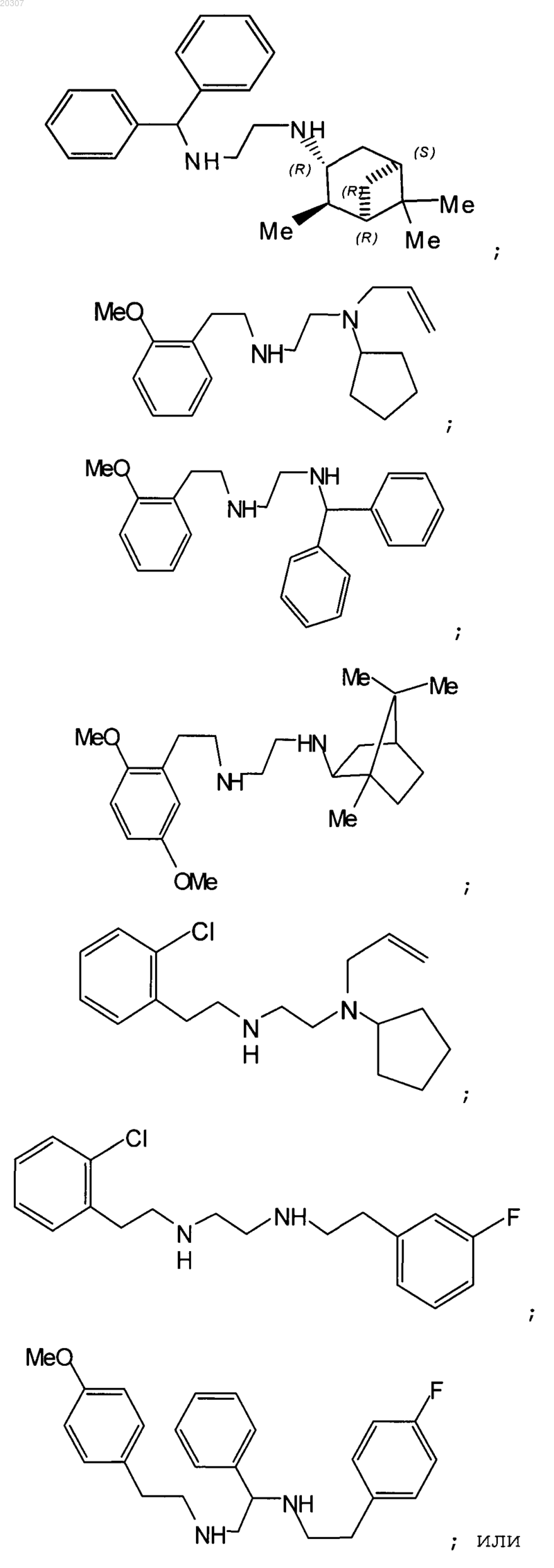
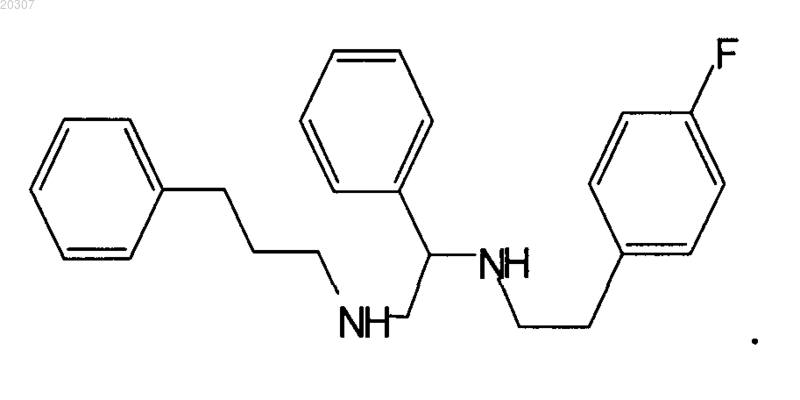
14. Фармацевтическая композиция для лечения микобактериальных заболеваний, включающая эффективное количество соединения по любому из пп.1-13 в комбинации с фармацевтически приемлемым носителем.
15. Применение соединения по любому из пп.1-13 для получения лекарственного средства для лечения микобактериальных заболеваний.
16. Фармацевтическая композиция по п.14, пригодная для местного применения, перорального применения, внутрибрюшинного применения, подкожного применения, внутримышечного применения, внутриглазного применения, внутриартериального применения, внутривенного применения или местного введения, используя имплантируемые лекарственные формы.
17. Фармацевтическая композиция по п.14, где композиция находится в форме аэрозоля, жидкой форме или твердой форме.
18. Фармацевтическая композиция по п.14, содержащая от 1 до 1000 мг замещенного производного этилендиамина.
19. Лекарственное средство для лечения инфекционных заболеваний, включающее эффективное количество соединения по любому из пп.1-13, необязательно в комбинации с фармацевтически приемлемым носителем.
20. Лекарственное средство по п.19, где инфекционные заболевания вызваны бактериальным, микологическим, паразитическим или вирусным возбудителем.
21. Лекарственное средство по п.20, где бактериальный возбудитель представляет собой микобактерию.
22. Лекарственное средство по п.21, где микобактерия представляет собой микобактериальный штамм, устойчивый к лекарственным средствам.
Текст
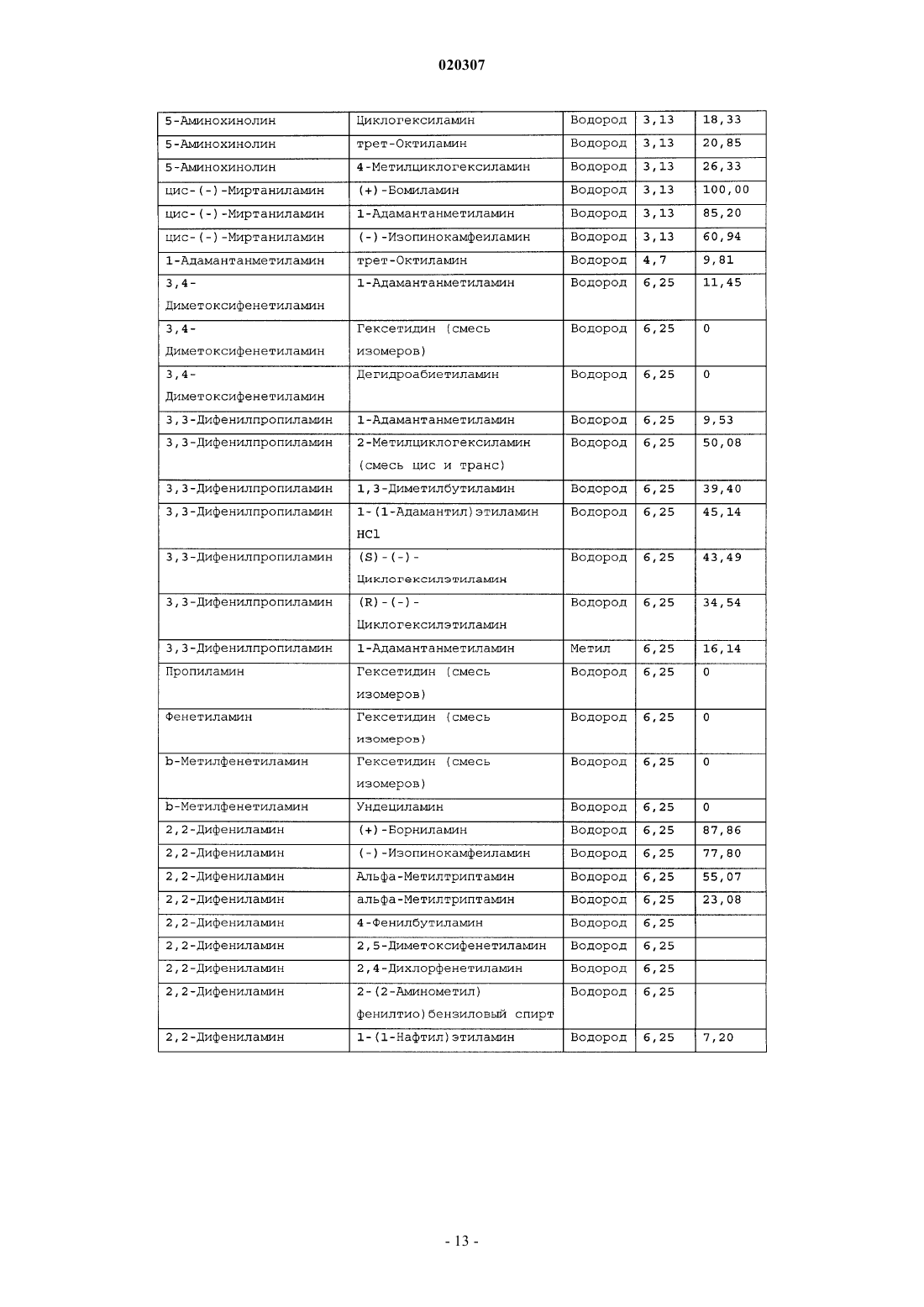
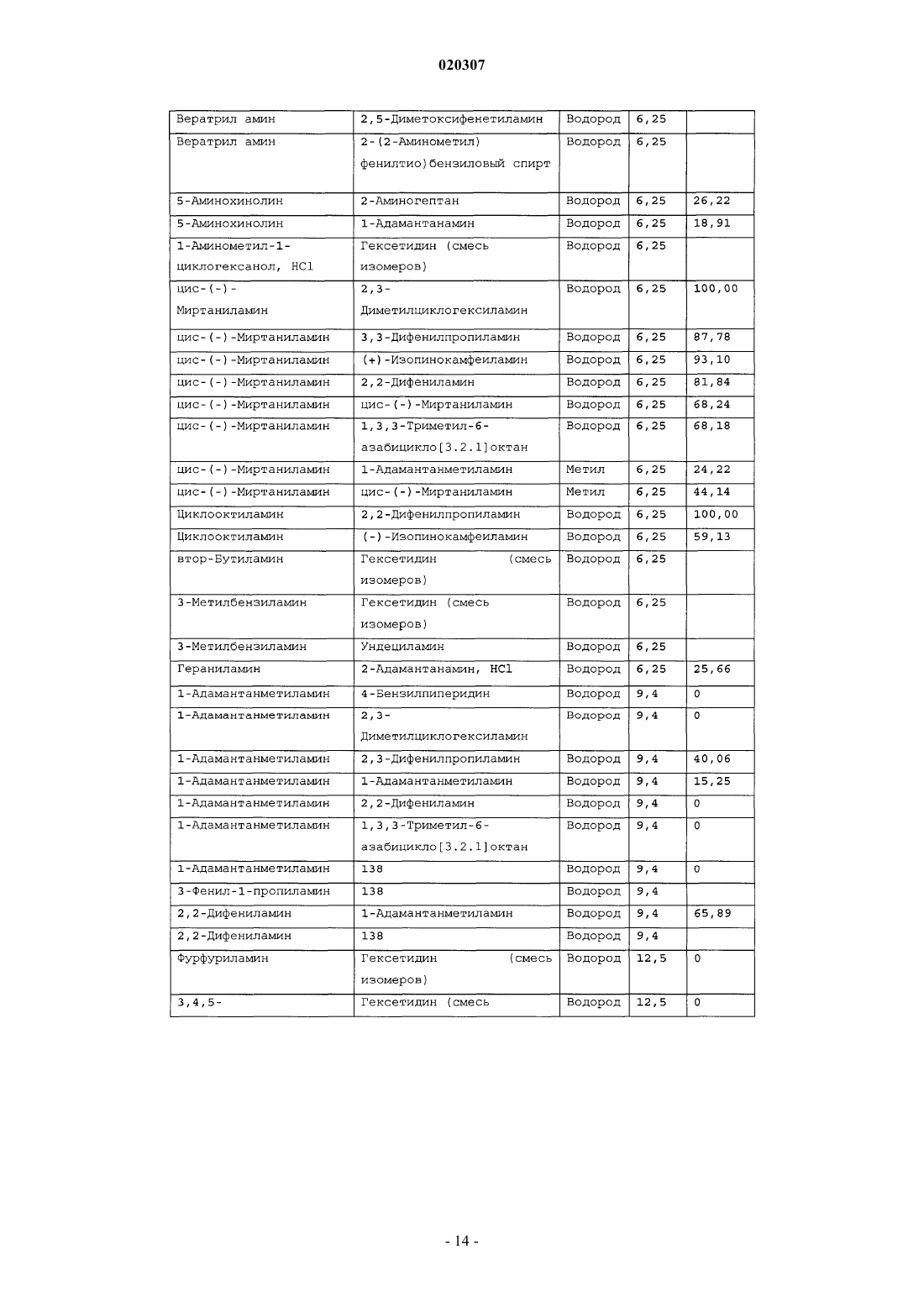
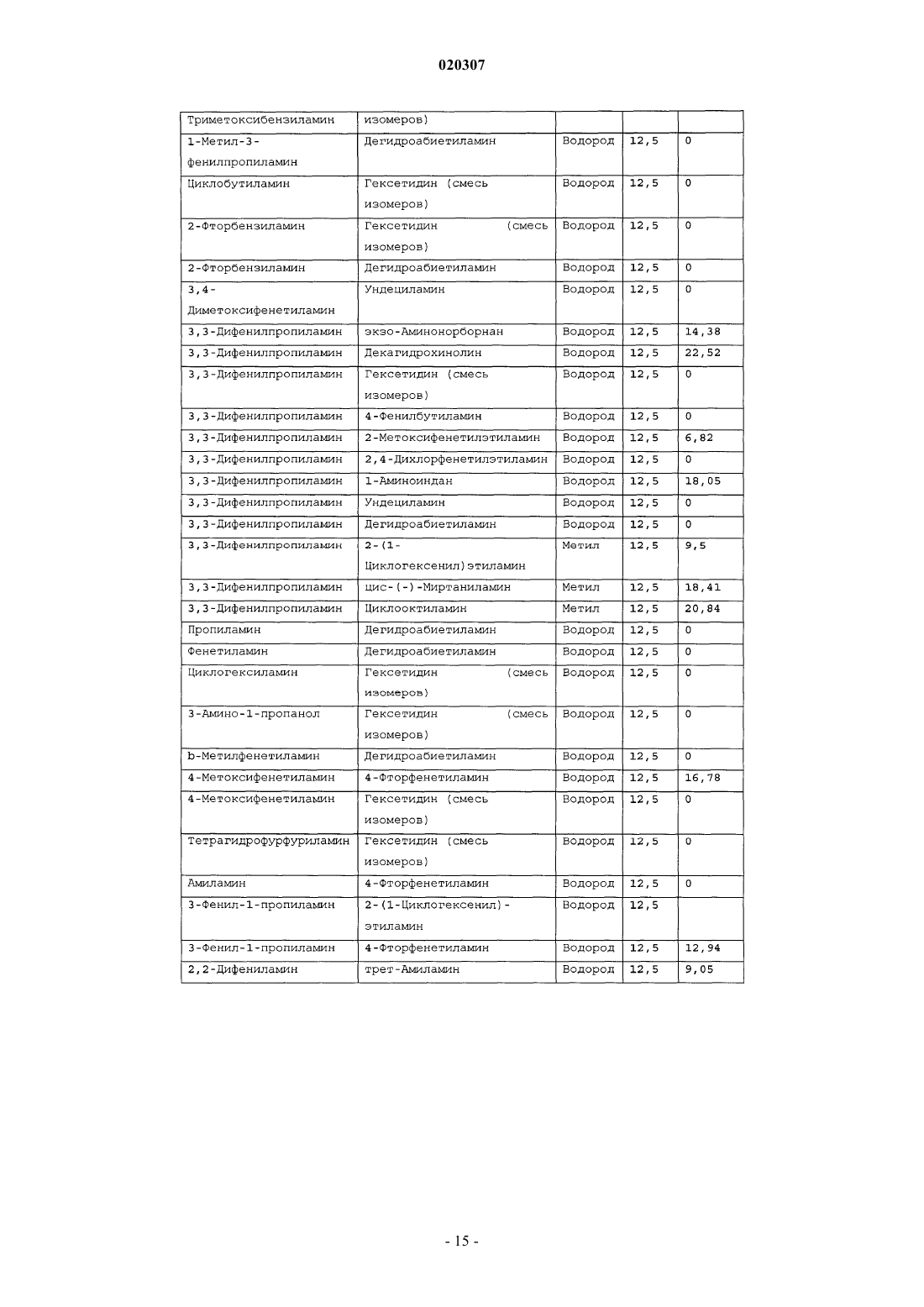
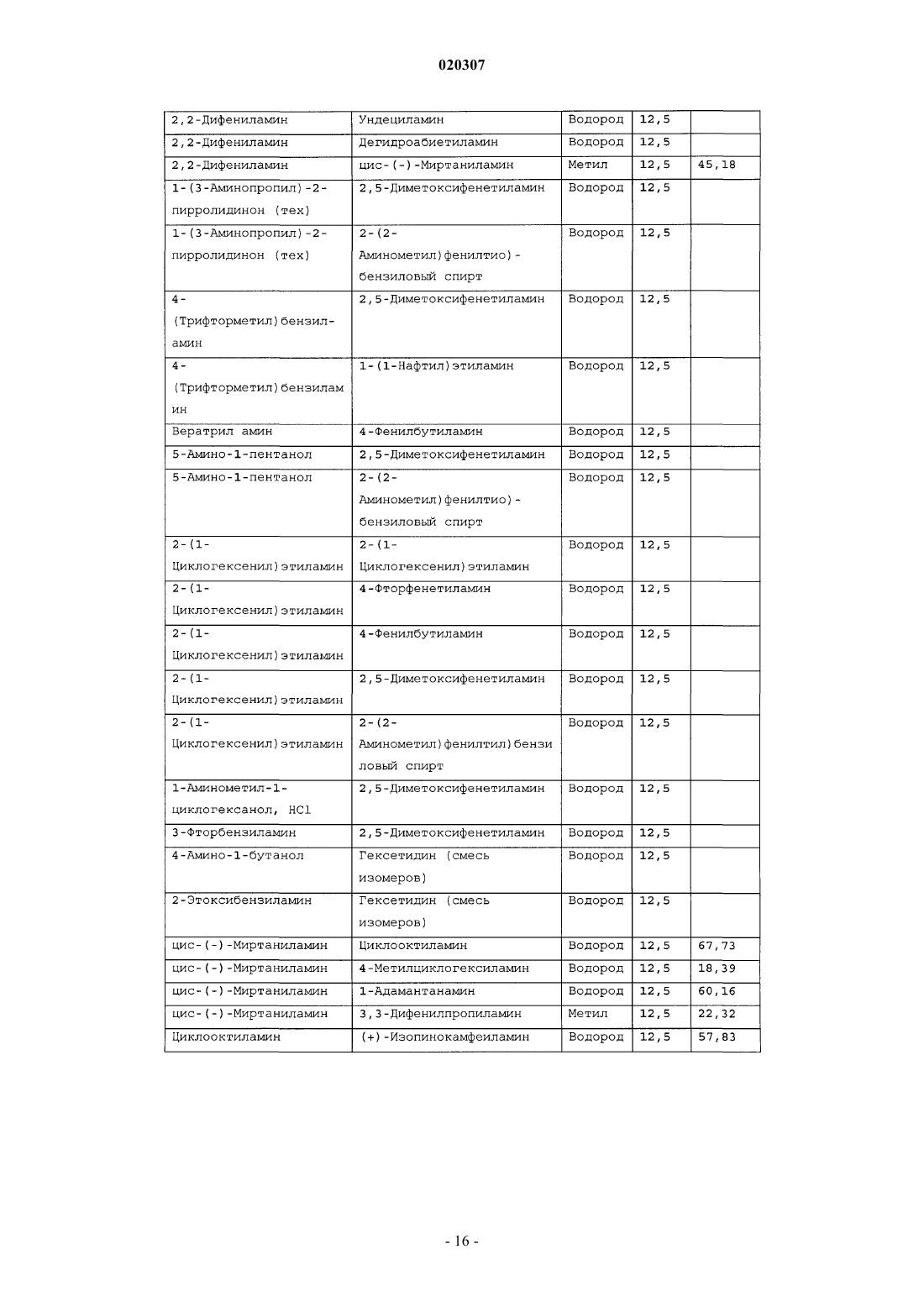
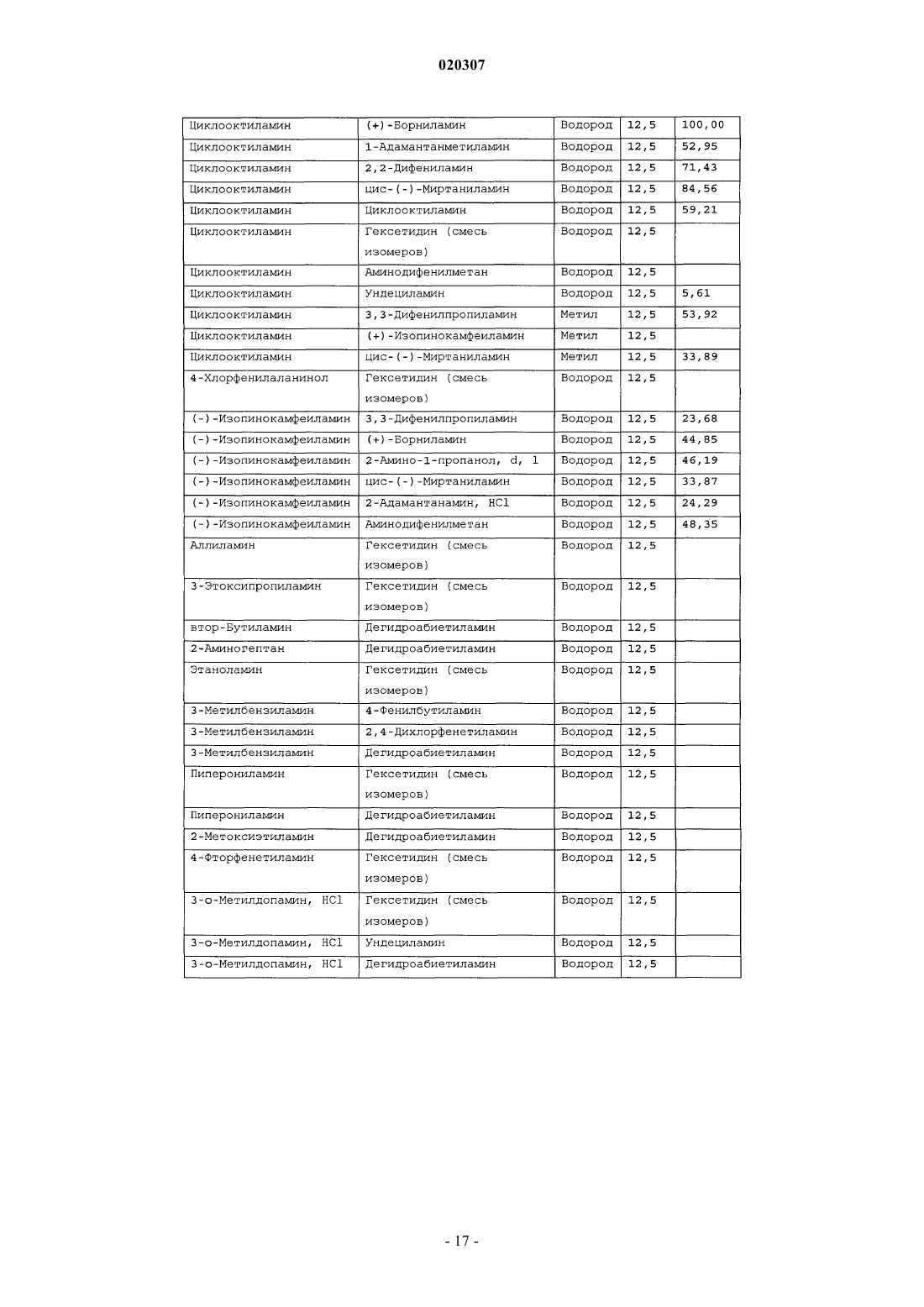
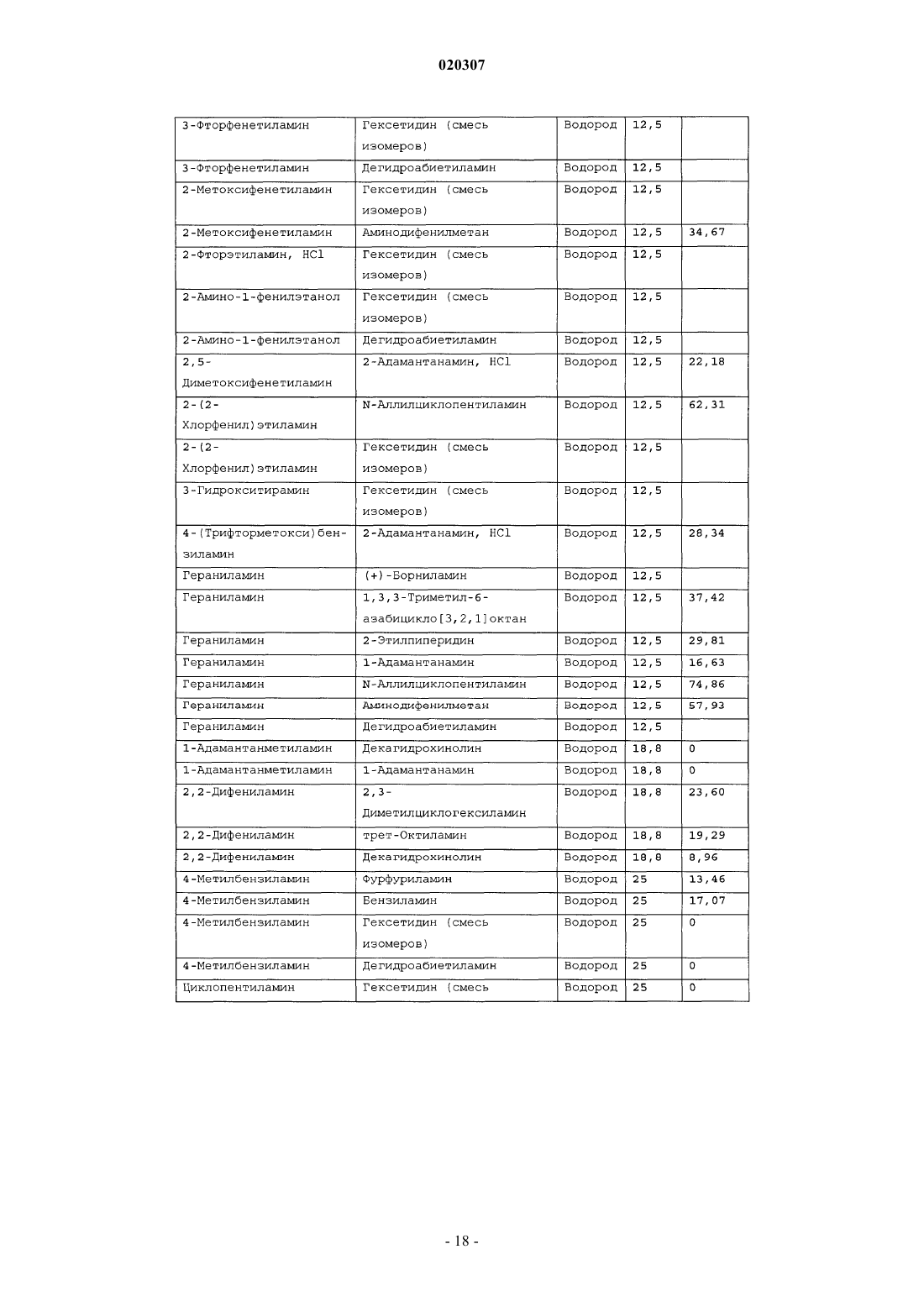
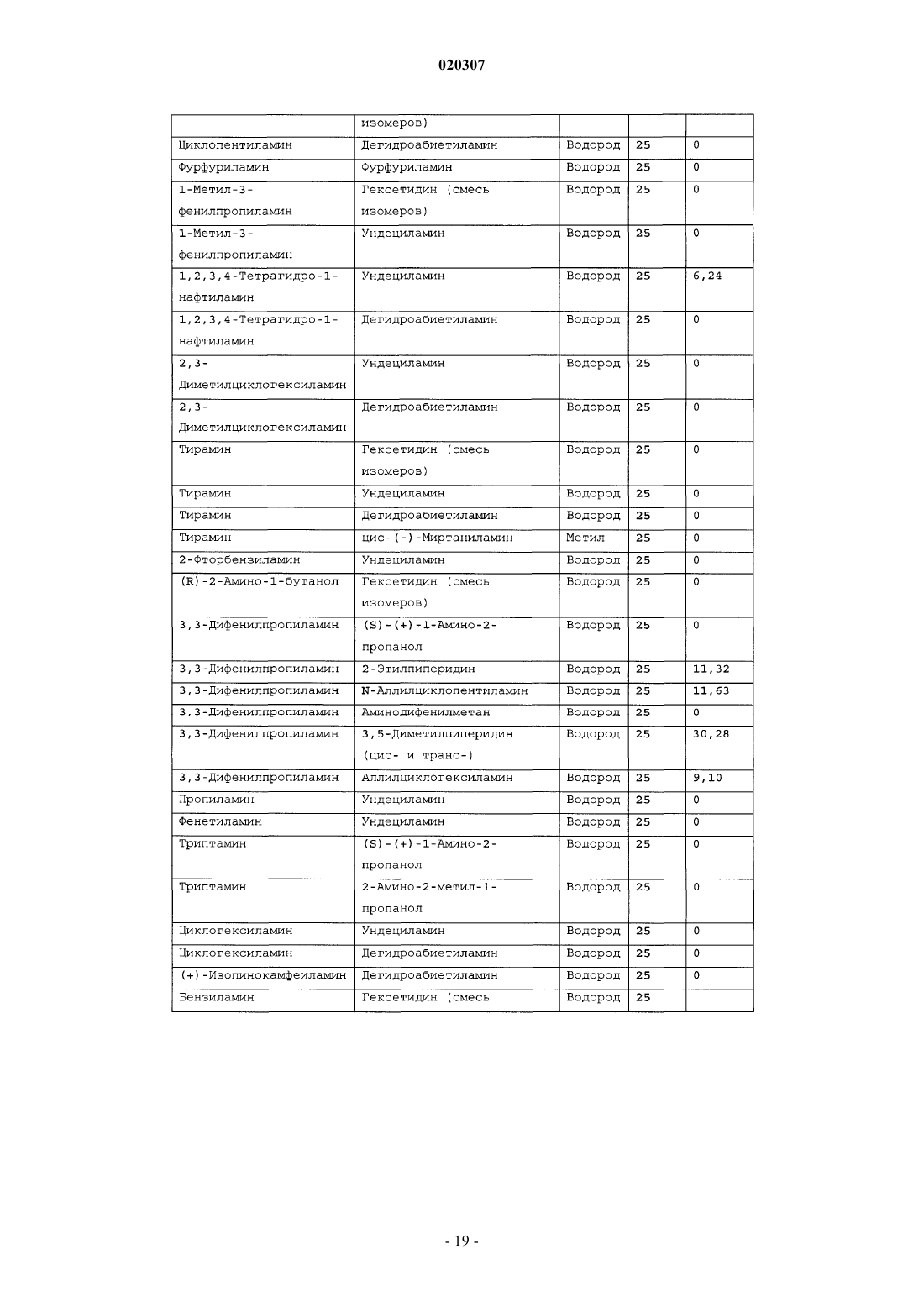
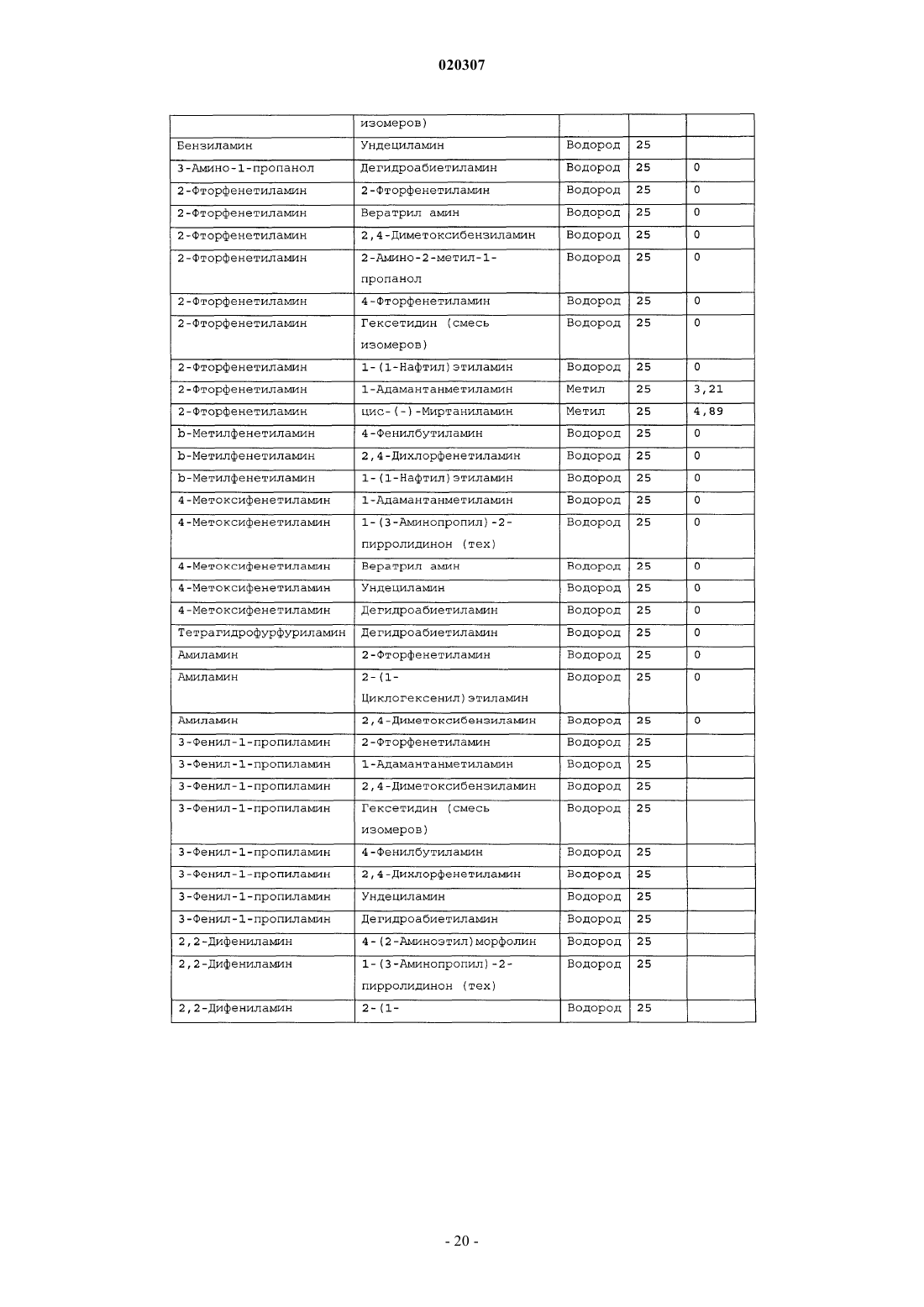
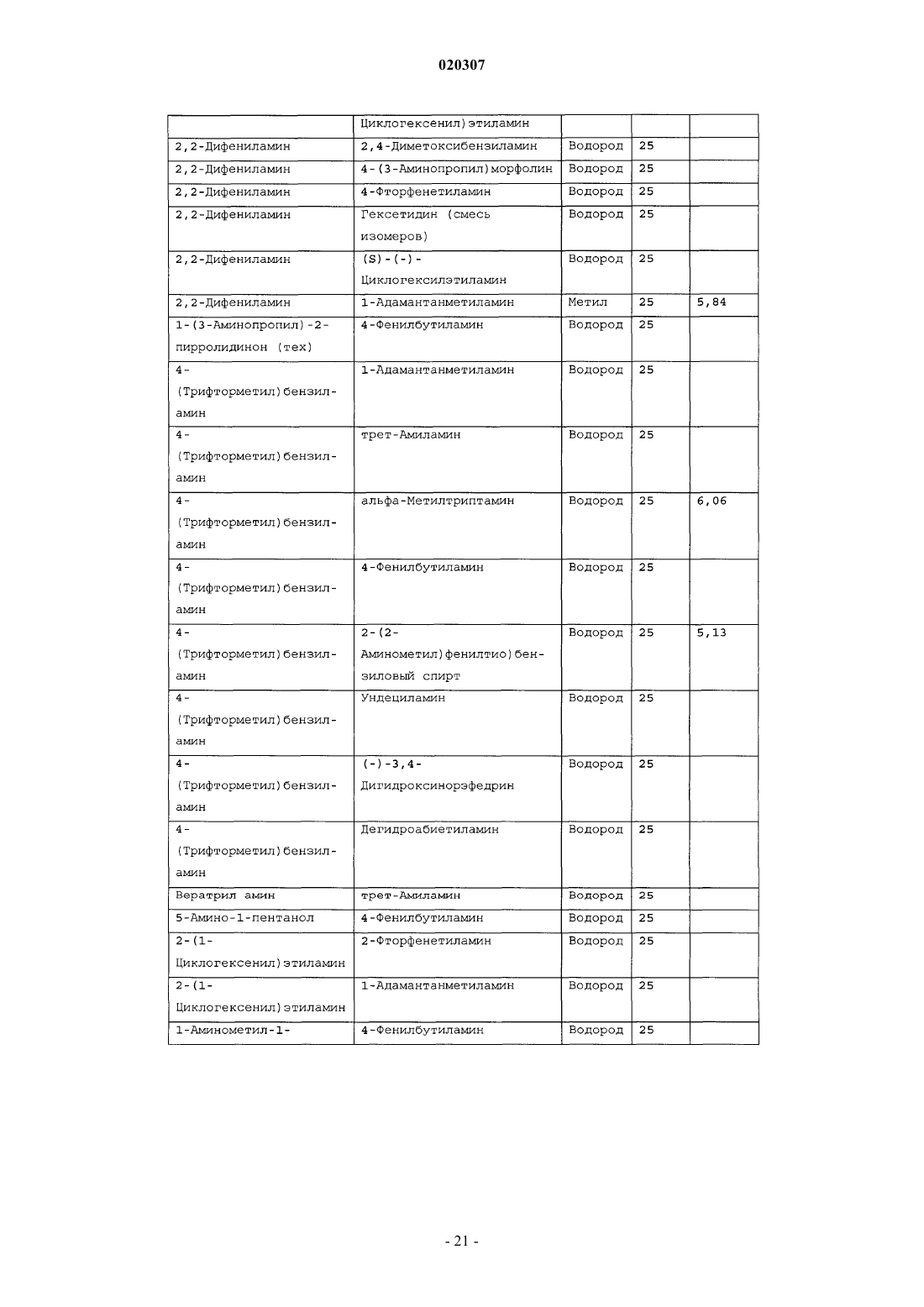
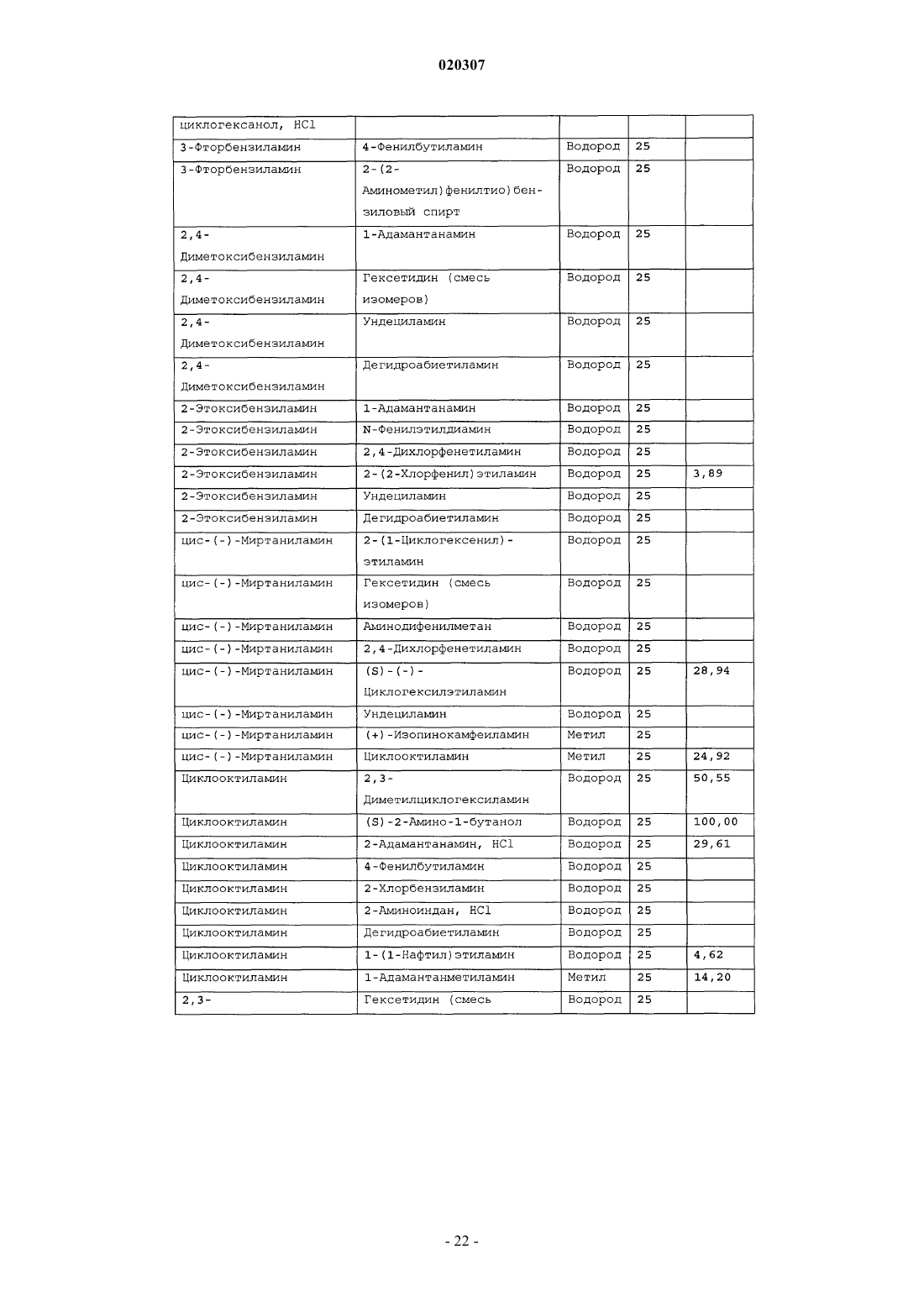
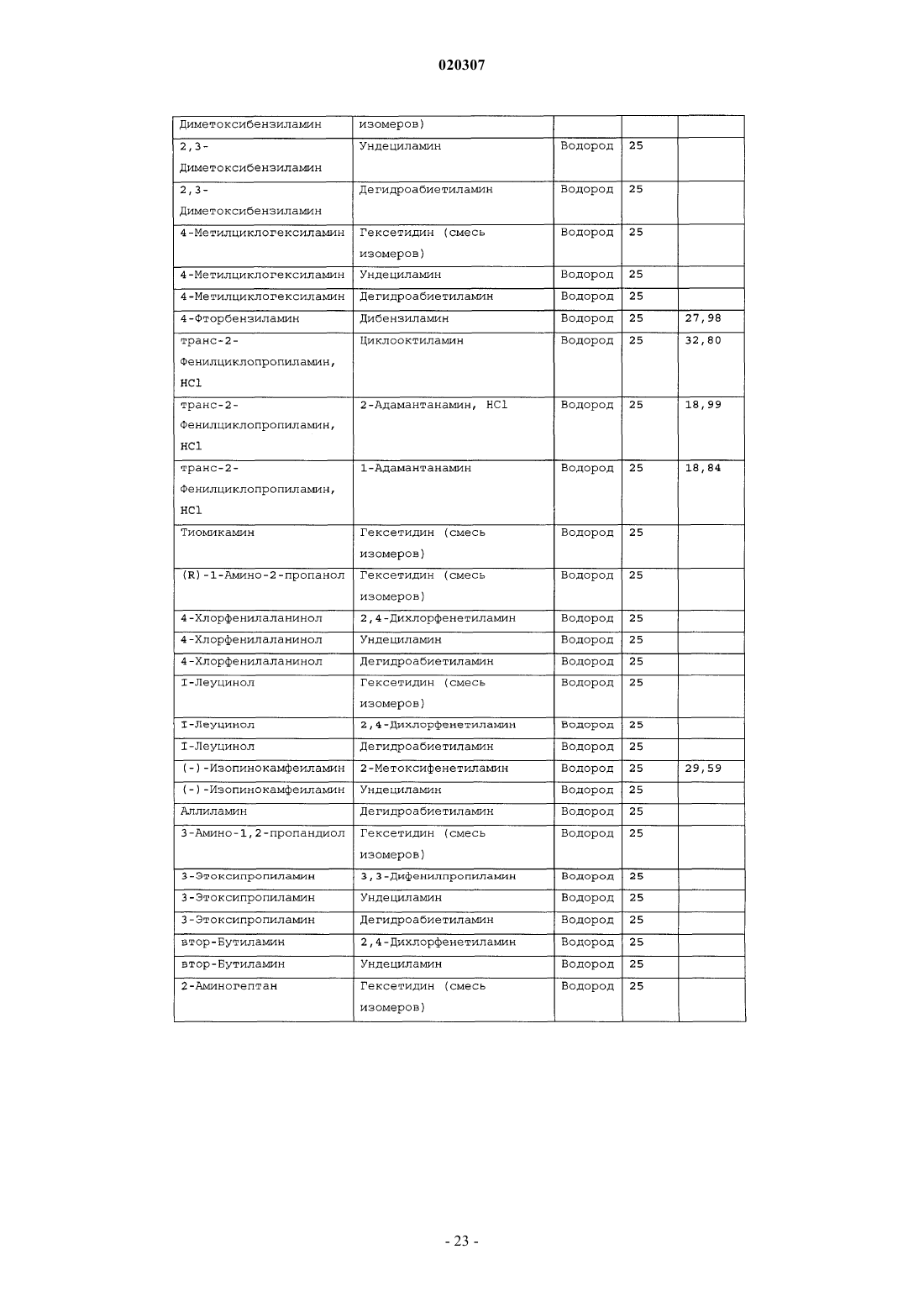
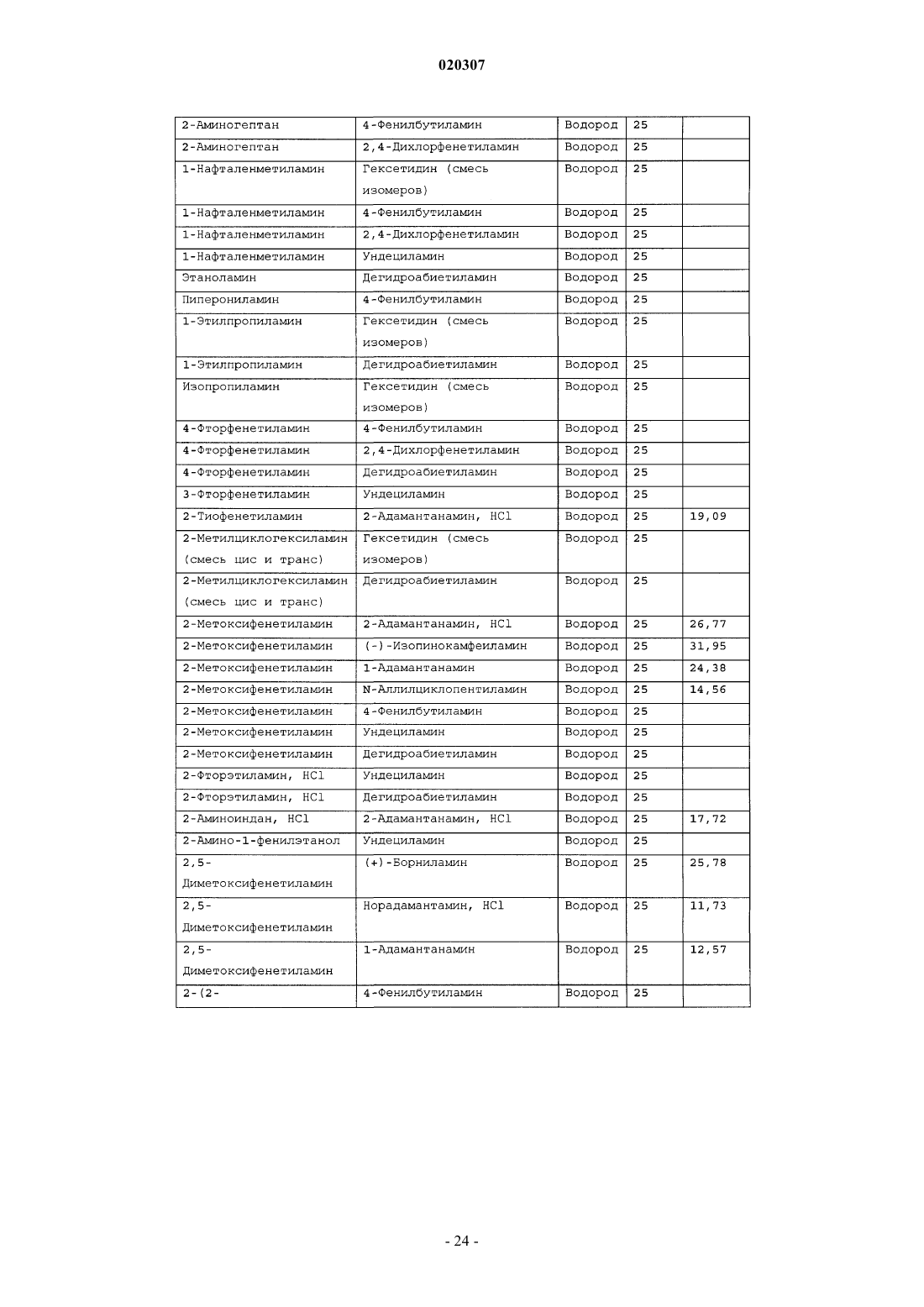
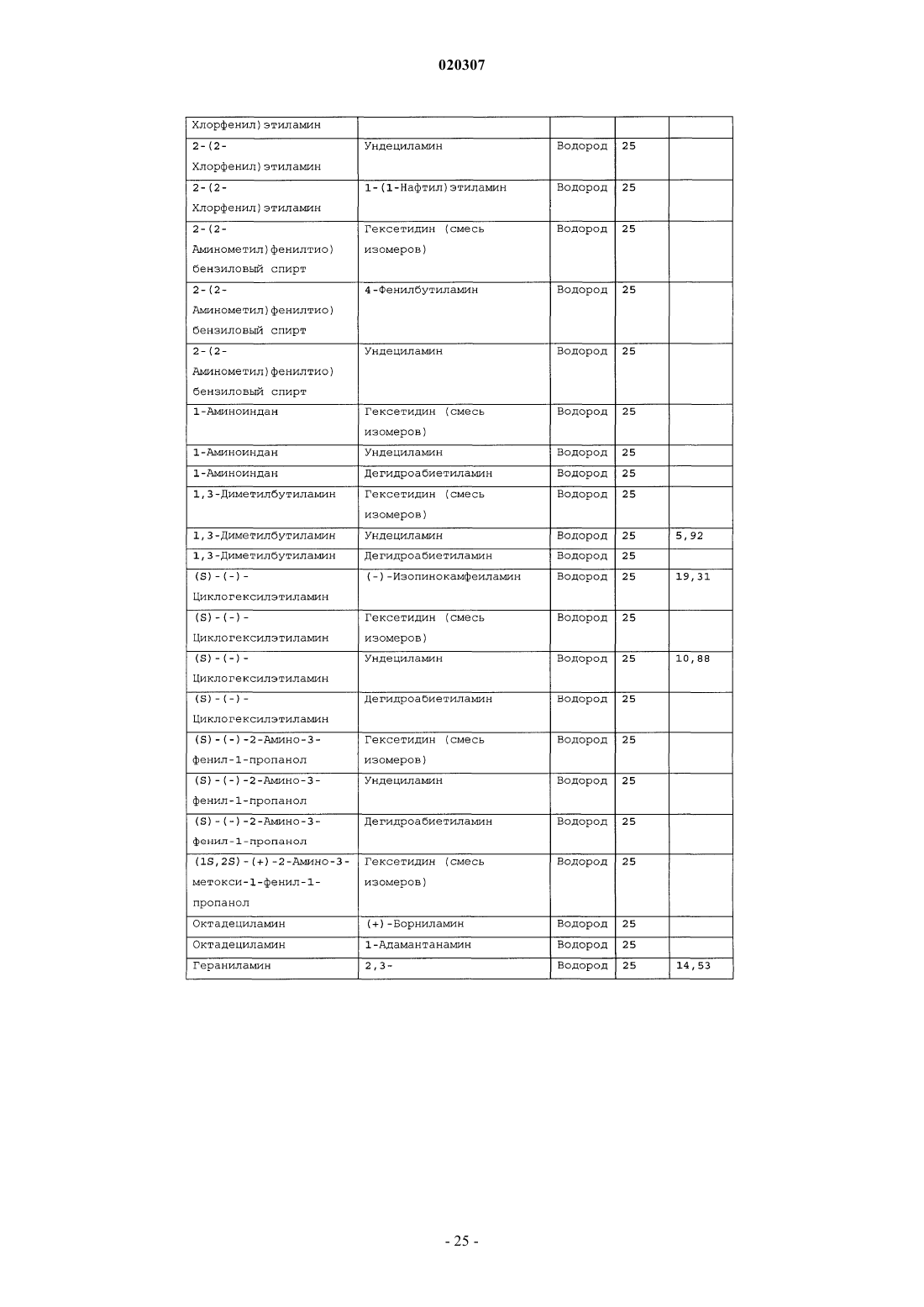
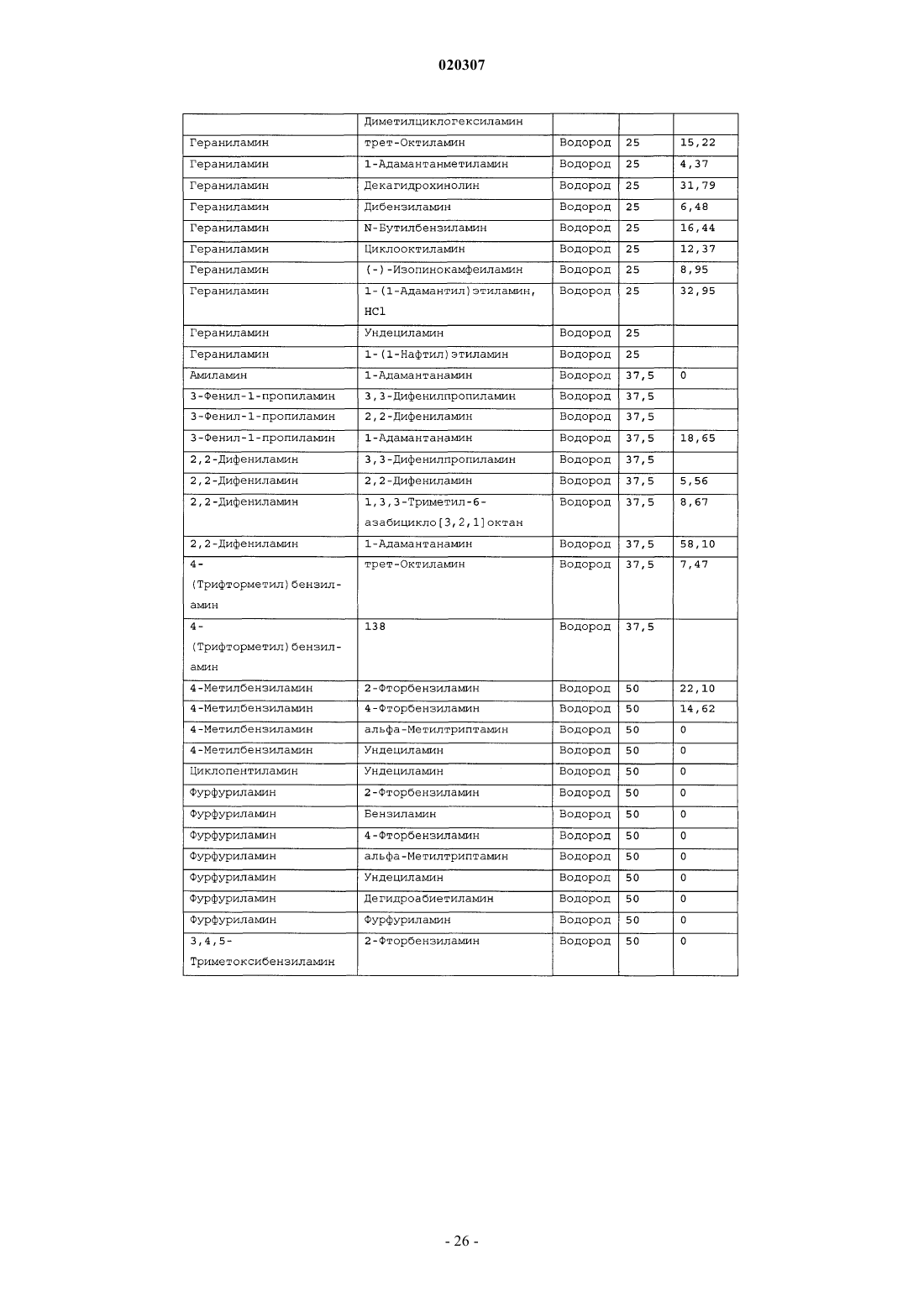
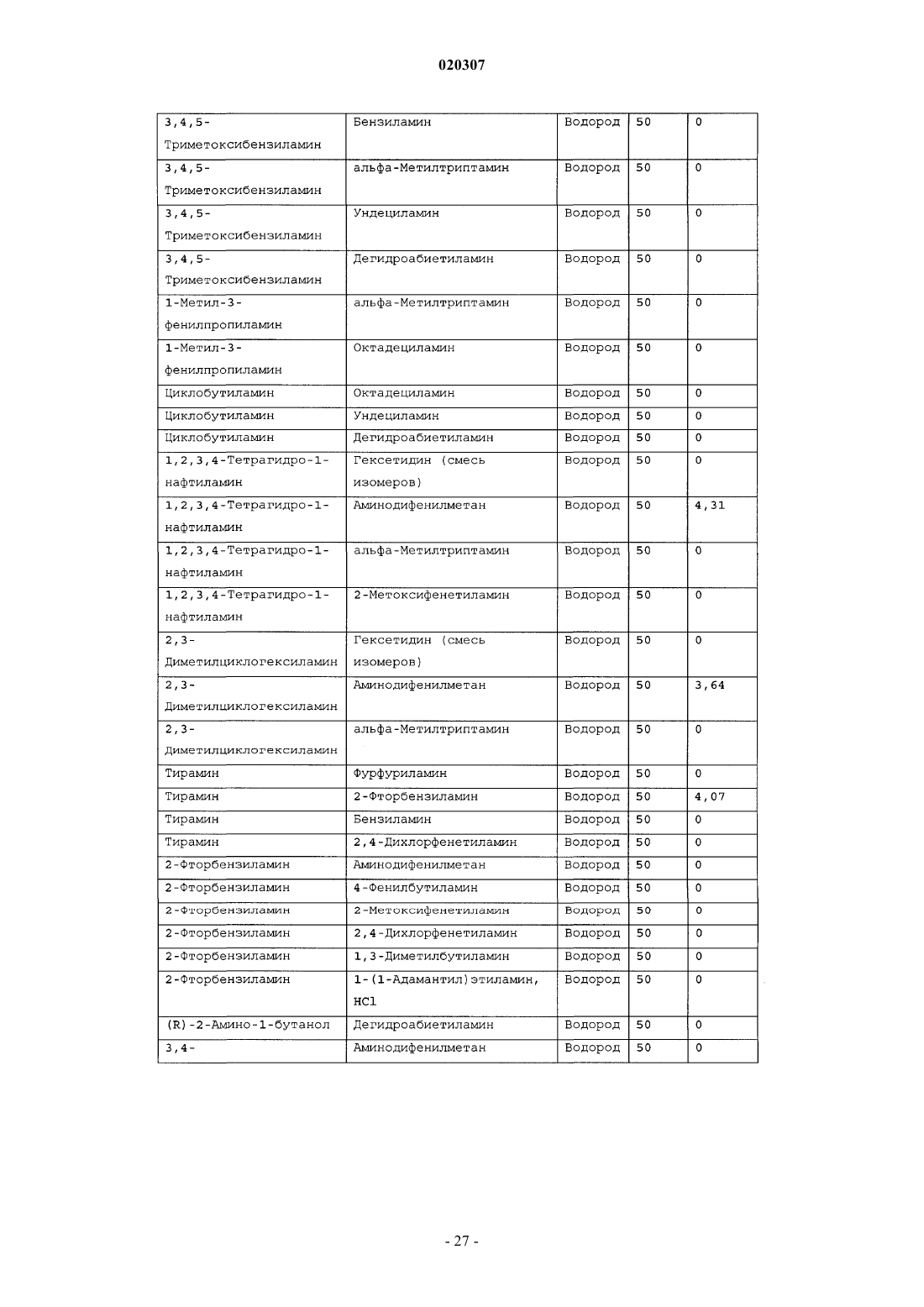
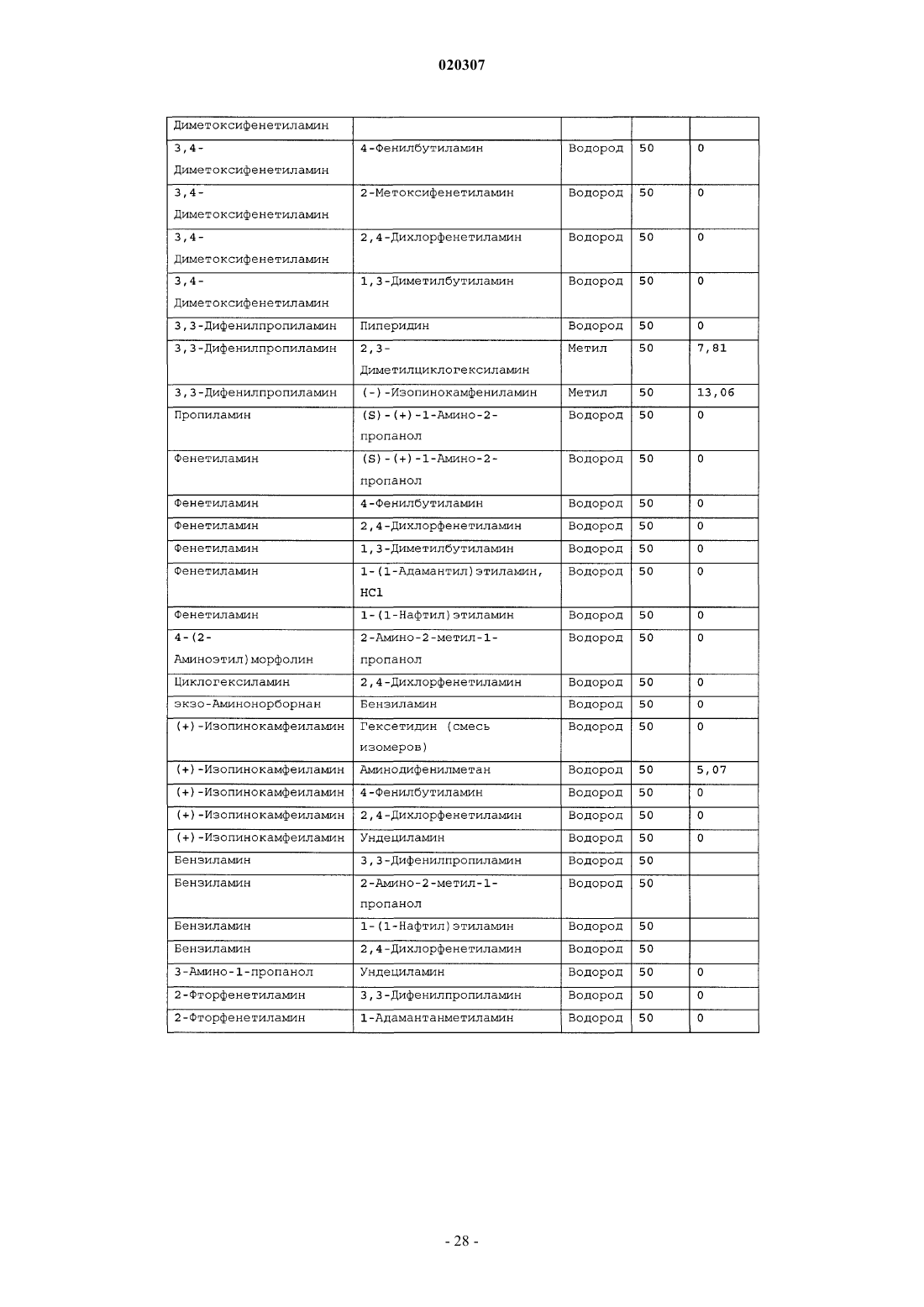
ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ЭТИЛЕНДИАМИНА ДЛЯ ЛЕЧЕНИЯ МИКОБАКТЕРИАЛЬНЫХ ЗАБОЛЕВАНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ Изобретение относится к замещенным производным этилендиамина формулы где значения радикалов раскрыты в формуле изобретения, к фармацевтическим композициям,содержащим упомянутые выше соединения для лечения микобактериальных инфекций, и к медикаментам для лечения инфекционных заболеваний, включающим эффективное количество упомянутых соединений необязательно в комбинации с фармацевтически приемлемым носителем.(71)(73) Заявитель и патентовладелец: ДИПАРТМЕНТ ОФ ХЕЛТ ЭНД ХЬЮМАН СЕРВИСЕЗ; СИКВИЛЛА,ИНК. (US) Область техники Настоящее изобретение относится к способам и композициям для лечения заболевания, вызванного микроорганизмами, в частности туберкулеза. Настоящее изобретение также относится к способам и композициям, обладающим улучшенной противомикобактериальной активностью, а именно, к композициям,содержащим новые замещенные производные этилендиамина. Предпосылки изобретения Микобактериальные инфекции часто проявляются в виде заболеваний, таких как туберкулез. Инфекции человека, вызванные микобактериями, широко распространены с древних времен и на сегодняшний день туберкулез остается главной причиной смертности. Хотя параллельно с повышением стандартов жизни с середины девятнадцатого века число случаев заболевания уменьшилось, микобактериальные заболевания до сих пор являются основной причиной заболеваемости и смертности в странах с ограниченными медицинскими возможностями. Кроме того, микобактерильные заболевания могут вызывать сильнейшее диссеминированное заболевания у больных с нарушениями иммунной системы. Несмотря на многократные попытки многочисленных всемирных организаций здравоохранения ни разу не удалось добиться уничтожения микобакериальных инфекций, а также ликвидировать угрозу заражения. Около одной третьей населения планеты инфицировано комплексом Mycobacterium tuberculosis, обычно называемым туберкулез (ТБ), при этом ежегодно с туберкулезом связывают приблизительно 8 млн новых случаев и от двух до трех миллионов смертей. Туберкулез (ТБ) является причиной наибольшего числа смертей, вызыванных одним этилогическим агентом (см. Dye et al., J Am. Med. Association, 282, 677-686,(1999) и 2000 WHO/ОМС Press Release). После уменьшения количества заболеваний в течение нескольких десятилетий в настоящее время число больных туберкулезом увеличивается. В Соединенных Штатах заражены, вероятно, до 10 млн человек. В 1990 сообщалось о почти 28000 новых случаях, что составляет увеличение на 9,4% по сравнению с 1989. С 1985 по 1990 наблюдалось увеличение числа случаев тубрекулеза на шестнадцать процентов. Проживание в перенаселенных условиях и общее воздушное пространство особенно способствуют распространению туберкулеза, содействуя в некоторых случаях росту заболеваемости, наблюдающемуся среди заключенных тюрем и среди бездомных в больших городах США. Приблизительно половина всех пациентов с синдромом приобретенного иммунодефицита (СПИД) приобретут микобактериальную инфекцию, а туберкулез у таких пациентов является особенно изнуряющим осложнением. Больные СПИДом в наибольшей степени подвержены риску развития клинического туберкулеза, и противотуберкулезное лечение представляется менее эффективным, чем у пациентов, не больных СПИДом. Поэтому инфекция часто прогрессирует до фатального диссемированного заболевания. Микобактерии, отличные от М. tuberculosis, все чаще и чаще обнаруживаются при оппортунистических инфекциях, которые поражают больных СПИДом. Организмы комплекса М. avium-intracellulare(MAC), особенно серотипы четыре и восемь, составляют 68% микобактериальных штаммов, выделенных у больных СПИДом. У больных СПИДом было обнаружено огромное количество MAC (до 1010 кислотоустойчивых бацилл на грамм ткани), и, следовательно, прогноз для таких больных является неудовлетворительным. Всемирная организация здравоохранения (ВОЗ) продолжает содействовать борьбе против туберкулеза, предлагая профилактические инициативы, такие как Expanded Program on Immunization (EPI)(Расширенная программа иммунизации) и программы по соблюдению курса лечения Directly ObservedTreatment Short-Course (DOTS) (Контролируемое краткосрочный курс лечения). Для уничтожения туберкулеза в равной мере значимыми являются диагностика, лечение и профилактика. Быстрое обнаружение больных туберкулезом приведет к раннему лечению, при котором предполагается приблизительно 90% излечение. Таким образом, ранняя диагностика крайне важна для борьбы с туберкулезом. Кроме того, соблюдение курса лечения будет гарантировать не только уничтожение инфекции, но также снижение опасности появления штаммов с устойчивостью к лекарственным препаратам. Появление штаммов М. tuberculosis, устойчивых к лекарственным препаратам, является черезвычайно тревожным феноменом. Доля новых случаев туберкулеза ТБ с подтвержденной устойчивостью, по крайней мере, к одному стандартному препарату, увеличилась на 10% в начале 1980-х и на 23% в 1991. Соблюдение курса лечения, следовательно, также является важным компонентом в стремлении уничтожить туберкулез и предотвратить появление штаммов, устойчивых к действию лекарственных препаратов. В равной степени важна разработка новых терапевтических агентов, которые эффективны в качестве вакцины и в качестве лекарственных средств при заболевании, вызванном штаммами микобактерий, устойчивых к лекарственным препаратам. Хотя было идентифицировано более 37 видов микобактерий, более 95% всех инфекций человека вызывают шесть видов микобактерий: М. tuberculosis, M. Avium intracellulare, M kansasii, M fortuitum, M.chelonae и М. leprae. Наиболее распространенным микобактериальным заболеванием человека является туберкулез (ТБ), который преимущественно вызывают виды микобактерий, включающие М. tuberculosis,M. bovis или М. africanum (Merck Manual 1992). Инфекция обычно возникает при вдыхании инфекционных частиц, которые, в конце концов, попадают в легкие. После того как бациллы поглощаются альвео-1 020307 лярными макрофагами, они могут легко реплицироваться, в конечном итоге, разрушая фагоцитарные клетки. Происходит каскадный эффект, при котором деструкция фагоцитарных клеток вызывает миграцию дополнительных макрофагов и лимфоцитов к месту инфекции, что, в конечном счете, также приводит к их уничтожению. На начальных стадиях заболевание далее диссеминируется, инфицируя макрофаги, которые попадают в местные лимфоузлы, а также в поток крови и другие ткани, такие как костный мозг, селезенка, почки, кости и центральная нервная система (см. Murray et al. Medical Microbiology, The С. V. Mosby Company 219-230 (1990. До сих пор до конца не известны факторы, которые вносят вклад в вирулентность микобактерий. Многие исследователи полагают, что в морфологию колоний и вирулентность вносят вклад липиды клеточной стенки и поверхности бактерий. Имеющиеся данные показывают, что С-микозиды, находящиеся на поверхности некоторых микобактериальных клеток, играют важную роль в выживании организма внутри макрофагов. Другие микобактерии содержат трегалозу 6,6' димиколат, фактор жгутообразования. Взаимосвязь между морфологией колонии и вирулентностью особенно явно прослеживается у бацилл М. avium. М. avium по нескольким различиям в формах колоний. Бациллы, которые растут как прозрачные, или шероховатые, колонии на обычных лабораторных средах, способны размножаться в макрофагах в тканевой культуре, вирулентны при введении восприимчивым мышам и устойчивы к антибиотикам. Шероховатые или бесцветные колонии бацилл, которые растут на лабораторной культуральной среде, часто спонтанно становятся непрозрачными колониями, R-форма колонии, при этом они не способны размножаться в макрофагах, не вируленты у мышей и очень чувствительны к антибиотикам. Различие морфологии колоний у бесцветных, шероховатых и матовых штаммов М. avium почти всегда связано с наличием гликолипидного слоя на поверхности бесцветных и шероховатых бактерий, который действуют как защитная капсула. Эта капсула или слой, прежде всего, состоит из С-микозидов, которые, вероятно, защищают вирулентные бактерии М. avium от лизосомальных ферментов и антибиотиков. Напротив,неверулентные, непрозрачные формы М. avium имеют очень мало С-микозида на своей поверхности. И резистентность к антибиотикам, и устойчивость к уничтожению макрофагами характерны для гликолипидного барьера на поверхности М. avium. Диагноз микобактериальная инфекции подтверждается путем выделения и идентификации патогена, хотя обычная диагностика основывается на мазке мокроты, рентгеновском исследовании грудной клетки (CXR) и клинических симптомах. Выделение микобактерий в среде занимает от четырех до восьми недель. Идентификация вида занимает более двух недель. Существует несколько других способов определения микобактерии, например, полимеразная цепная реакция (PCR), прямой метод определения микобактерии туберкулеза или прямой метод определения амплифицированных микобактерий туберкулеза(MTD) и анализы определения, в которых используются радиоактивные метки. Одним из диагностических тестов, который широко используется для определения инфекционных заболеваний, вызванных М. tuberculosis, является проба Манту. Хотя существует большое количество вариаций этого теста, проводимого на коже, обычно используется один из двух препаратов туберкулиновых антигенов: старый туберкулин (ОТ) или очищенное производное белка (PPD). Препарат антигена либо вводят в кожу чрезкожным путем, либо наносят местно, и затем инвазивно транспортируют в кожу,используя специальный ланцет (тест Tine инъекционная кожная проба). При проведении диагностического кожного теста сталкиваются с несколькими трудностями. Например, тест Tine не может широко применяться, так как количество вводимого антигена в интрадермальный слой нельзя точно контролировать (см. Murray et al. Medical Microbiology, The C. V. Mosby Company 219-230 (1990. Хотя туберкулиновые пробы широко используются, для получения их результатов обычно требуется два, три дня, и часто результаты бывают ошибочны из-за ложноположительных результатов, которые иногда наблюдают у пациентов, которые подвергаются действию микобактериальной инфекции, но при этом здоровы. Кроме того, часто встречаются случаи ошибочного диагностирования, так как положительный результат наблюдается не только у пациентов с активным ТБ, но также и у людей, привитых бациллами Кальметта-Герена (BCG), и у людей, зараженных микобактериями, но у которых нет проявлений заболевания. Следовательно, с помощью туберкулиновой пробы сложно отличить пациентов с активным ТБ от других, например от пациентов, контактирующих с зараженными ТБ на бытовом уровне. Кроме того, туберкулиновая проба часто дает перекрестную реакцию у тех пациентов, которые инфицированы другими микобактериями, не М. tuberculosis (MOTT). Следовательно, в настоящее время доступная диагностика с использованием кожных проб часто дает ошибку и погрешности. Стандартное лечение туберкулеза, вызванного чувствительными к лекарственному препарату бактериями, представляет собой шестимесячный курс, заключающийся во введении четырех препаратов,назначаемых в течение двух месяцев, а затем двух препаратов, назначаемых в течение четырех месяцев. Двумя самыми важными препаратами, назначаемыми на протяжении шестимесячного курса, являются изониазид и рифампин. Хотя курс относительно прост, его осуществление является весьма сложным. В течение первой фазы терапии часто требуется ежедневный прием восьми или девяти пилюль; трудная и неприятная перспектива. Даже у пациентов в тяжелейшем состоянии после нескольких недель лечения часто исчезают симптомы, а через несколько месяцев кажется, что они почти здоровы. Однако, если ле-2 020307 чение не продолжается до полного завершения, у пациента может развиться рецидив, и степень рецидива у пациента, не получившего полный курс лечения, является высокой. Для того, чтобы обеспечить строгое соблюдение курса лечения, используются различные виды помощи, ориентированной на пациента. Самым эффективным способом, гарантирующим лечение пациентов, является контролируемая терапия,которая заключается в том, что член медицинской бригады следит за приемом пациентом каждой дозы каждого препарата. Контролируемая терапия может осуществляться в клинике, по месту жительства пациента, или в любом месте, определяемом по взаимному согласию. Почти все больные туберкулезом,вызванным бактериями, чувствительными к лекарственным препаратам и которые прошли полный курс лечения, будут вылечены и риск рецидива у них очень низкий (Ending Neglect: The Elimination of Tuberculosis in the United States ed. L. Geiter Committee on the Elimination of Tuberculosis in the United StatesDivision of Health Promotion and Disease Prevention, Institute of Medicine. Неопубликовано.). Необходимы эффективные курсы лечения, которые включают в себя усовершенствованную вакцинацию и протоколы лечения. На сегодняшний день доступные способы лечения не всегда эффективны из-за трудностей с проведением полного курса лечения, и эти трудности способствуют появлению штаммов микобактерий, устойчивых к действию лекарственных препаратов. Этамбутол (ЕМВ) представляет собой антибиотик, широко применяющийся для лечения ТБ, более 300 миллион доз которого было использовано для лечения туберкулеза в 1988. Этамбутол, разработанный лабораториями Lederle Laboratories в 1950-ых годах, обладает низкой токсичностью и хорошими фармакокинетическими свойствами. Однако этамбутол имеет относительно высокую минимальную концентрацию ингибирования (MIC), приблизительно 5 мкг/мл, и может вызывать неврит зрительного нерва. Таким образом, существует нарастающая необходимость в новых, более эффективных терапевтических композициях (см. например, патент США 3176040, патент США 4262122; патент США 4006234; патент США 3931157; патент США 3931152; патент США Re. 29358 и Hausler et al., BioorganicMedicinal Chemistry Letters 11 (2001) 1679-1681). 3a десятилетия после обнаружения лечебных эффектов этамбутола был достигнут небольшой прогресс в фармакологическом лечении ТБ. Кроме того, в связи с одновременным появлением штаммов, устойчивых к лекарственным препаратам, и большим распространением микобактериальной инфекции, становится очевидно, что наиболее значимыми в борьбе против туберкулеза являются новые терапевтические композиции. Необходимы абсолютно эффективные курсы лечения, которые включают в себя усовершенствованную вакцинацию и протоколы лечения. Желательно получение терапевтической вакцины, которая могла бы предотвратить появление туберкулеза, и таким образом исключить необходимость лечения. Хотя в настоящее время доступные терапевтические средства, такие как этамбутол, являются эффективными,появление штаммов, устойчивых к лекарственным препаратам, требует разработки новых фармацевтических препаратов и композиций, более универсальных, чем этамбутол. В данный момент доступные терапевтические средства не всегда эффективны из-за сложностей проведения полного курса лечения, что дает возможность появлению штаммов микобактерий, устойчивых к лекарственным препаратам. Необходимы новые противотуберкулезные препараты, которые обеспечат высокоэффективное лечение и сократят или упростят химиотерапию при туберкулезе. Сущность изобретения Настоящее изобретение относится к способам и композициям, содержащим производные этилендиамина, эффективные для лечения инфекционного заболевания. Настоящее изобретение также относится к способам и композициям, содержащим производные этилендиамина, с улучшенной активностью против микобактерий, включая замещенные этилендиамины, обладающие улучшенной противотуберкулезной активностью. Настоящее изобретение охватывает замещенные этилендиамины, которые могут быть производными различных аминосоединений. В настоящем изобретении замещенные этилендиамины основаны на следующей структуре: Замещенные производные этилендиамина, описанные здесь, синтезированы и подвергнуты скринингу на их активность следующим образом. Химическую библиотеку замещенных этилендиаминов получали на твердой полистирольной подложке, используя методы смешения и разделения. Этот метод позволяет синтезировать разнообразные замещенные этилендиамины. Эти диамины подвергают скринингу на противотуберкулезную активность, используя биологические анализы in vitro, включая технологию высокоэффективного скрининга (HTS), основанную на недавно расшифрованной геномной последовательности М. tuberculosis, и анализе минимальной концентрации ингибирования (MIC). Способы и композиции, описанные здесь, включают в себя замещенные этилендиамины, которые являются эффективными в отношении заболевания, вызванного инфекционными агентами, включая, но этим не ограничиваясь, бактерии и вирусы. Один из вариантов осуществления данного изобретения относится к способам и композициям, содержащим замещенные этилендиамины, которые являются эффективными в отношении микобактериальной инфекции. Другой вариант осуществления данного изобретения относится к способам и композициям для лечения микобактериальной инфекции, содержащим замещенные этилендиамины, имеющим MIC, равную 50 мкМ или меньше. Другой вариант осуществления настоящего изобретения относится к замещенным этилендиаминам для лечения микобактериальной инфекции, имеющим MIC 25 мкМ или меньше. Еще один вариант осуществления настоящего изобретения относится к замещенным этилендиаминам для лечения микобактериальной инфекции, имеющим MIC 12,5 мкМ или меньше. Другой вариант осуществления настоящего изобретения относится к замещенным этилендиаминам для лечения микобактериальной инфекции, имеющим MIC 5 мкМ или меньше. В другом варианте осуществления настоящего изобретения, способы и композиции содержат замещенные этилендиамины с активностью Luc HTS равной 10% или больше. В еще одном варианте осуществления настоящего изобретения способы и композиции содержат замещенные этилендиамины, где одна аминогруппа получена из первичного амина, а другая аминогруппа получена из первичного или вторичного амина. В другом варианте осуществления настоящего изобретения способы и композиции содержат замещенные этилендиамины, где один амин получен из цис-(-)миртаминламина, циклооктиламина, 2,2 дифенилэтиламина,3,3-дифенилпропиламина,(+)-борниламина,1-адамантанметиламина,(+)изопинокамфеиламина или (-)-изопинокамфеиламина. Настоящее изобретение охватывает различные комплексы солей и другие замещенные производные замещенных этилендиаминов. Настоящее изобретение также охватывает энантиомеры и другие стереоизомеры замещенных этилендиаминов и их замещенных производных. Настоящее изобретение также включает в себя лечение животных, включая, но этим не ограничиваясь, людей. Соответственно, объектом настоящего изобретения являются способы и композиции для лечения и профилактики заболеваний, вызванных микроорганизмами. Соответственно, объектом настоящего изобретения являются способы и композиции для лечения и профилактики инфекционных заболеваний. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики микобактериальной инфекции, включая, но этим не ограничиваясь, туберкулез. Еще одним объектом настоящего изобретения являются способы и композиции для лечения и профилактики инфекционных заболеваний, использующие композиции, содержащие замещенные этилендиамины. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики микобактериальной инфекции, использующие композиции, содержащие замещенные этилендиамины. Еще одним объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где диамин имеет MIC, равную 50 мкМ или меньше. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где диамин имеет MIC, равную 25 мкМ или меньше. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где диамин имеет MIC, равную 12,5 мкМ или меньше. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где диамин имеет MIC, равную 5 мкМ или меньше. Еще одним объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где диамин имеет активность HTS/Luc, равную 10% или больше. Другим объектом настоящего изобретения являются способы и композиции для лечения и профилактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где одна аминогруппа получена из первичного амина, а другая аминогруппа получена из первичного или вторичного амина. Еще одним объектом настоящего изобретения являются способы и композиции для лечения и про-4 020307 филактики туберкулеза, использующие композиции, содержащие замещенные этилендиамины, где один амин получен из цис-(-)миртаниламина,циклооктиламина,2,2-дифенилэтиламина,3,3 дифенилпропиламина, (+)-борниламина, 1-адамантанметиламина, (+)-изопинокамфеиламина; или (-)изопинокамфеиламина. Еще одним объектом настоящего изобретения являются композиции для терапевтического препарата для лечения и профилактики микобактериальной инфекции. Другим объектом настоящего изобретения являются композиции для терапевтического препарата для лечения и профилактики микобактериальной инфекции, вызванной М. tuberculosis complex, М. Avium intracellulare, M kansarii, M fortuitum, M. Chelonae, М. leprae, M. africanum, M. microti или М. bovis. Эти и другие объекты, особенности и преимущества настоящего изобретения будут понятны после рассмотрения следующего далее подробного описания вариантов осуществления и прилагаемой формулы изобретения. Краткое описание фигур На фиг. 1 представлена схема процесса, показывающая различные варианты твердофазного синтеза,использующегося для получения замещенных этилендиаминов. На фиг. 2(a)-2(c) показаны химические структуры различных первичных аминов. На фиг. 3(a)-3(f) показаны химические структуры различных нециклических вторичных аминов. На фиг. 4(a)-4(i) показаны химические струкутуры различных циклических вторичных аминов. На фиг. 5 представлена схема характерной реакционной смеси десяти замещенных этилендиаминов. На фиг. 6 представлен график обсчета люминисценции в секунду (LCPS) относительно концентрации, показывающий результаты анализа HTS Luc для объединенных замещенных соединений этилендиамина. На фиг. 7 представлен график LCPS относительно концентрации, показывающий результаты анализа HTS Luc для каждого замещенного производного этилендиамина. На фиг. 8 представлен график LCPS относительно концентрации, показывающий результаты анализа HTS Luc для каждого замещенного производного этилендиамина. На фиг. 9 представлена гистограмма, показывающая суммарные MIC активности для определенных замещенных производных этилендиаминов. На фиг. 10 представлена гистограмма, показывающая суммарную люциферазную активность некоторых замещенных этилендиаминов с активностью по крайней мере 10% относительно этамбутола при 3,1 мкМ. На фиг. 11 представлена гистограмма, показывающая частоту встречаемости выбранных аминомономеров в замещенных производных этилендиамина, которые были активны против туберкулеза. Аминомономеры представлены цифровым обозначением. На фиг. 12 представлен технологически процесс, схематически показывающий синтез N-геранилN'-(2-адамантил)этан-1,2-диамина (соединения 109). На фиг. 13 представлен технологический процесс, схематически показывающий синтез N(циклооктил)-N'-(1R,2R,3R,5S)-(-)-изопинокармфеилэтан-1,2-диамина в виде гидрохлорида (соединение 59). На фиг. 14 показаны параметры масс-спектра одного характерного образца в лунке, содержащей объединенные замещенные производные этилендиаминов. На фиг. 15 показаны параметры масс-спектра соединения 109, N-геранил-N'-(2-адамантил)этан-1,2 диамина. На фиг. 16 показаны данные протонного ЯМР для соединения 109, N-геранил-N'-(2-адамантил)этан 1,2-диамина. На фиг. 17 представлена гистограмма данных анализа колониеобразующих единиц/легкие(CFU/легкие), показывающая увеличение CFU/легкие в течение времени в днях для различных соединений. На фиг. 18 представлена гистограмма данных анализа CFU/легкие, показывающая увеличениеCFU/легкие в течение времени в днях для различных соединений. На фиг. 19 представлена гистограмма данных анализа CFU/легкие, показывающая увеличениеCFU/легкие в течение времени в днях для различных соединений. На фиг. 20 представлена гистограмма данных анализа поражения, показывающая видимые поражения в течение времени после лечения различными соединениями. На фиг. 21 представлена схема, демонстрирующая идентификацию кандидатного лекарственного препарата. На фиг. 22 представлены соединения, которые исследовали на эффективность in vivo. На фиг. 23 представлен график, показывающий результаты исследований in vivo соединений 73 и 109 при дозах 1 и 10 мг/кг (селезенка). На фиг. 24 представлен график, показывающий результаты исследований in vivo соединений 73 и 109 при дозах 1 и 10 мг/кг (легкие). На фиг. 25 представлен график, показывающий исследования in vivo соединений 59 и 111 при дозе 1 и 10 мг/кг (селезенка). На фиг. 26 показан график, показывающий исследования in vivo соединений 59 и 111 при дозе 1 и 10 мг/кг (легкие). На фиг. 27 показан график, показывающий результаты исследования эффективности соединений 58,73, 109 и 111 у мышей C57BL.6, инфицированных М. tuberculosis H37Rv (селезенка). Мышей в. в. инфицировали 5106 CFU M. tuberculosis H37RV; лечение лекарственными препаратами начинали через 18 дней после инфицирования. Ранний контроль ЕС-ЕС, CFU в легких мышей в день начала химиотерапии. Мыши получали: 1 - необработанная мышь, 2 - INH (25 мг/кг), 3 - ЕМВ (100 мг/кг), 4 - соед. 109 (25 мг/кг), 4 - соед. 109 (10 мг/кг), 4 - соед. 109 (0,1 мг/кг), 5 - соед. 58 (25 мг/кг), 6 - соед. 73 (25 мг/кг), 7 соед. 111 (25 мг/кг). На фиг. 28 представлен график, показывающий результаты исследования эффективности соединений 58, 73, 109 и 111 у мышей C57BL.6, инфицированных М. tuberculosis H37Rv (легкие). Мышей в. в. инфицировали 5106 CFU M. tuberculosis H37Rv; лечение лекарственными препаратами начинали через 18 дней после инфицирования. Ранний контроль ЕС-ЕС, CFU в легких мышей в день начала химиотерапии. Мыши получали: 1 - необработанная мышь, 2 -INH (25 мг/кг), 3 - ЕМВ (100 мг/кг), 4 - соед. 109 (25 мг/кг), 4 - соед. 109 (10 мг/кг), 4 - соед. 109 (0,1 мг/кг), 5 -соед. 58 (25 мг/кг), 6 - соед. 73 (25 мг/кг), 7 соед. 111 (25 мг/кг). На фиг. 29 представлены данные LC/MC исследуемых соединений. На фиг. 30 представлен график, показывающий результаты фармако-кинетических (ФК) анализов с кассетным введением исследуемых препаратов мышам. Пероральное введение. Соединение NSC 722039 в исследовании показано как соединение 37, NSC 722040 - соединение 59, NSC 722041 - соединение 109. На фиг. 31 представлен график, показывающий результаты фармако-кинетических (ФК) анализов с кассетным введением исследуемых препаратов мышам. Внутрибрюшинное введение. Соединение NSC 722039 в исследовании показано как соединение 37, NSC 722040 - соединение 59, NSC 722041 - соединение 109. На фиг. 32 представлен график, показывающий результаты фармако-кинетических (ФК) анализов с кассетным введением исследуемых препаратов мышам. Внутривенное введение. Соединение NSC 722039 в исследовании показано как соединение 37, NSC 722040 - соединение 59, NSC 722041 - соединение 109. На фиг. 33 представлен график, показывающий результаты фармако-кинетических (ФК) анализов соединения 109 у мышей. Фиг. 34 - тканевое распределение соединения 109 у мышей (в.в., 3 мг/кг). Фиг. 35 - тканевое распределение соединения 109 у мышей (п.о., 25 мг/кг). Фиг. 36 - метаболизм соединения 109 в моче мыши. Фиг. 37 - в моче мыши не было обнаружено глюкоронидазных метаболитов соединения 109. Фиг. 41 - схема 1. Синтез библиотеки 100000 соединений аналогов этамбутол на твердой подложке. Фиг. 41 - схема 2. Эксперименты синтеза SQBisAd на твердой подложке. На фиг. 42 представлена структура характерных заданных диаминов, полученных путем ацилирования аминокислот. На фиг. 43 представлена табл. 25, суммирующая данные плашек с синтезированными диаминами для получения библиотеки 20000 заданных аналогов этамбутола. На фиг. 44 представлена схема 5, показывающая синтез библиотеки диамина, используя в качестве линкеров аминокислоты. На фиг. 45 схематически показано положение аминомономеров в соединениях с физиологической эффективностью, которые были получены в основной библиотеке 100000 соединений аналогов ЕМВ. На фиг. 46 схематически показано структурное разнообразие первичных аминов. На фиг. 47 представлена табл. 26, в которой перечислены аминокислоты, которые использовались при получении библиотеки диаминов. На фиг. 48 представлены карбонильные соединения, которые используются в качестве агентов в синтезе библиотеки диаминов. На фиг. 49 представлена табл. 27, в которой показаны карбонильные соединения, используемые в плашках для синтеза библиотеки диаминов. На фиг. 50 представлены представительные примеры данных MIC и Lux для библиотеки диаминов. На фиг. 51 схематически показано расположение алкилированных мономеров в конечных диаминовых продуктах с противотуберкулезной активностью. На фиг. 52 представлено расположение на характерной 96-луночной плашке для разделения. На фиг. 53 предоставлен список целевых соединений и их структуры для диаминовой библиотеки с модифицированным линкером. Подробное описание изобретения Настоящее изобретение будет более понятно из следующего далее подробного описания приведен-6 020307 ных здесь конкретных осуществлений. Однако, хотя настоящее изобретение описано со ссылками на конкретные детали некоторых его осуществлений, эти детали не следует рассматривать как ограничивающие объем данного изобретения. Текст указанных здесь ссылок включен здесь в полном объеме,включая патентную заявку США, серийный 10/147587, поданную 17 мая 2002, и предварительную заявку США, серийный 60/381220 поданную 17 мая 2002. Заболеваемость микобактериальными инфекциями, такими как инфекции, вызывающие туберкулез,которая, как казалось, уменьшилась, снова увеличивается и составляет серьезную угрозу для здоровья. Туберкулез (ТБ) является наиболее частой причиной смерти людей при заражении одним этилогическим агентом, ежегодно умирает от двух до трех миллионов человек, зараженных туберкулезом. В местах скопления большого числа людей, или местах проживания в помещениях, не соответствующих стандартам проживания, все чаще можно обнаружить лиц, страдающих микобактериальной инфекцией. Люди с пораженной иммунной системой подвержены большему риску заражения микобактериальной инфекцией и гибели от нее. Кроме того, появление штаммов микобактерий, устойчивых к лекарственным препаратам,привело к трудностям лечения таких инфицированных людей. Много людей, зараженных микобактериями, являются бедными, или проживают в областях с ограниченными медицинскими возможностями. В результате различных проблем (экономические проблемы,низкий уровень образования и тому подобное), многие из этих индивидуумов не способны соблюдать предписанный курс лечения. В конечном счете, непрерывное несоблюдение этими и другими индивидуумами курса лечения привело к распространению болезни. Такое несоблюдение курса лечения часто приводит к возникновению штаммов микобактерий, устойчивых к лекарственным препаратам. Необходимы эффективные композиции и вакцины, направленные на различные штаммы микобактерий, для того, чтобы взять под контроль возрастающее количество заболеваний туберкулезом. Химиотерапия является обычным способом лечения туберкулеза. В настоящее время при некоторых используемых способах химиотерапии требуется сочетание трех или четырех препаратов, вводимых ежедневно в течение двух месяцев, или введение два раза в неделю в течение от четырех до двенадцати месяцев. На табл. 1 показано несколько схем лечения при стандартных курсах лечения туберкулеза. Таблица 1. Схемы лечения при стандартных курсах лечения туберкулеза Десятилетия неправильного приема существующих антибиотиков и недостаточное соблюдение длительных и сложных курсов лечения привели к мутациям микобактерий туберкулеза и возникновению эпидемии туберкулеза, устойчивого к лекарственным препаратам, которая угрожает контролю над туберкулезом во всем мире. В период от 1950 до 1970-ых гг. было разработано огромное количество использующихся в настоящее время лекарственных препаратов, включая наиболее активно применяемые препараты, такие как изониазид, рифампин, пиразинамид, этамбутол и стрептомицин. Таким образом,ранее разработанная химиотерапия туберкулеза не использует участие геномной последовательностиMycobacterium tuberculosis, революцию, свершившуюся в последние десять лет в разработке фармацевтических препаратов, и применение национальных программ тестирования лекарств и комбинаторной химии. Следовательно, для лечения больных со штаммами М. tuberculosis, устойчивых к действию лекарственного препарата, и скрытыми туберкулезными инфекциями требуются новые противотуберкулезные препараты, которые обеспечивают высокоэффективное лечение и сокращают и упрощают химиотерапию туберкулеза. Кроме того, желательно, чтобы эти препараты можно было бы синтезировать недорогим способом, так как демографические данные болезни показывают, что цена является существенным фактором. Настоящее изобретение относится к способам и композициям, содержащим класс замещенных этилендиаминовых соединений, эффективных для лечения и профилактики заболевания, вызванного микроорганизмами, включая, но не ограничиваясь, бактерии. В частности, способы и композиции по настоящему изобретению эффективны для ингибирования роста микроорганизмов, М. tuberculosis. Способы и композиции по настоящему изобретению предназначены для лечения микобактериальных инфекций у человека, а также животных. Например, настоящее изобретение может, в частности, использоваться для лечения коров, инфицированных М. bovis. Как используется здесь, термин туберкулез включает в себя заболевания, обычно связанные с инфекциями, вызванными видами микобактерий, включая М. tuberculosis comlex. Термин "туберкулез" также связан с микобактериальными инфекциями, вызванными микобактериями, иначе чем М. tuberculosis (MOTT). Другие виды микобактерий включают в себя М. avium-intracellulars, M. kansarii, M. fortuitum,M. chelonae, M. leprae, M. africanum и М. microti, M. avium paratuberculosis, M. intracellulare, M. scrofulaceum, M. xenopi, M. marinum, M. ulcerans. Настоящее изобретение, кроме того, относится к способам и композициям, эффективным для лечения инфекционного заболевания, включая, но ими не ограничиваясь, заболевания, которые вызваны бактериальными, микологическими, паразитическими и вирусными агентами. Примеры таких инфекционных агентов включают в себя следующие: стафилококки, стрептококки, нейссерии, кокки, энтеробактерии, псевдомонады, вибрионы, кампилобактер, представители семейства Pasteurellaceae, бордетелла,франциселла, бруцелла, легионеллы, бактероиды, грамотрицательные бациллы, клостридии, коринебактерии, пропионобактерии, грамположительные бациллы, бацилла сибирской язвы, актиномицеты, нокардия, микобактерии, трептонема, боррелии, лептоспира, микоплазма, уреплазма, рикеттсии, хламидии,системные микозы, оппортунистические микозы, протозоя, нематоды, трематоды, цестодии, аденовирусы, вирусы герпеса, поксвирусы, паповирусы, вирусы гепатита, ортомиксовирусы, парамиксовирусы,коронавирусы, пикорнавирусы, реовирусы, тогавирусы, флавивирусы, бунья-вирусы, рабдовирусы, вирусы иммунодефицита человека и ретровирусы. Настоящее изобретение также относится к способам и композициям, которые эффективны для лечения инфекционного заболевания, включая, но ими не ограничиваясь, туберкулез, лепра, болезнь Крона,синдром приобретенного иммунодефицита, болезнь Лима, болезнь от кошачьих царапин, пятнистая лихорадка Скалистых гор и грипп. Способы и композиции для лечения инфекций по настоящему изобретению содержат одно или несколько замещенных производных этилендиамина. В частности, эти производные охватывают большое разнообразие замещенных производных этилендамина со следующей общей формулой: где RiNH обычно является производным первичного амина, и R2R3N обычно является производным перичного или вторичного амина. Этилендиамины по настоящему изобретению получали с помощью модульного подхода, используя в качестве строительных блоков первичные и вторичные амины,и путем взаимодействия аминогрупп со строительным блоком этиленового линкера. Характерные первичные амины, нециклические вторичные амины и циклические вторичные амины показаны на фиг. 2, 3 и 4 соответственно. Обычно химические группы R1, R2 и R3 производных этилендиамина по настоящему изобретению независимо выбраны из Н, С 1-С 8 алкила; фенила; толила; ксилила; бензила; нафтила; С 2-С 4 алкенила; С 2 С 4 алкинила; аралкенила; аралкинила; С 4-С 6 циклоалкила и С 8 циклоалкила; С 4-С 6 циклоалкенила; гетероалкила; пиридинила; фуранила; тетрагидро-1-нафтила; пиперидинила; индолила; индолинила; пирролидинила; пиперазинила; хинолинила; хинолила; галогена; 2-(метоксиметил)пирролидинила; триазинила; морфолинила; пиразолила; инданила; индолила; пиразолила; тиадиазолила; роданинила; тиолактонила; дибензофуранила; бензотиазолила; гомопиперидинила; тиазолила; хинонуклидинила; изоксазолидинонила; изопинокамфенила; борнила; норборнила; алкилированного 1,3-диоксолана и тому подобное,включая их производные с прямой или разветвленной цепью, их циклические производные, их замещенные производные, их производные, содержащие гетероатом, их гетероциклические производные, их производные с функциональными группами, их соли, включая, но ими не ограничиваясь, например, гидрохлориды и ацетаты, их изомеры или их сочетания. Например, гетероциклические группы, содержащие азот, включают в себя, но ими не ограничиваются, группы, такие как пиридинил (полученный из пиридина и присоединенные через углерод кольца), пиперидинил (полученный из пиперидина и присоединенный атом азота кольца или углерода кольца) и пирролидинил (полученный из пирролидина и присоединенный через атом азота кольца или углерода кольца). Примеры химических групп R1, R2 и R3 по настоящему изобретению включают в себя, но ими не ограничиваются, Н; метил; этил; пропил; бутил; пентил; гексил; гептил; октил; этенил; пропенил; бутенил; этинил; пропинил; бутинил; циклопропил; циклобутил; циклопентил; циклогексил; циклооктил; циклобутенил; циклопентенил; циклогексенил; фенил; толил; ксилил; бензил; нафтил; пиридинил; фуранил; тетрагидро-1-нафтил; пиперидинил; индолил; индолинил; пирролидинил; 2(метоксиметил)пирролидинил; пиперазинил; хинолинил; хинолил; алкилированный 1,3-диоксолан; триа-8 020307 зинил; морфолинил; фенилпиразолил; инданил; индонил; пиразолил; тиадиазолил; роданинил; тиолактонил; дибензофуранил; бензотиазолил; гомопиперидинил; тиазолил; хинонуклидинил; изоксазолидинонил; любые его изомеры, производные или замещенные аналоги; или любые замещенные или незамещенные химические радикалы, такие как спирт, простой эфир, тиол, тиоэфир, третичный амин, вторичный амин, первичный амин, сложный эфир, сложный тиоэфир, карбоновая кислота, диол, диэфир, акриловая кислота, акриловый эфир, этиловый эфир метионина, этиловый эфир бензил-1-цистеина, имин,альдегид, кетон, амид или диен. Другие примеры химических групп R1, R2 и R3 по настоящему изобретению включают в себя, но ими не ограничиваются, следующие радикалы или замещенные или алкилированные производные следующих радикалов, ковалентно связанных с азотом амина: фуран; тетрагидрофуран; индол; пиперазин; пирролидин; пирролидинон; пиридин; хинолин; антрацен; тетрагидрохинолин; нафтален; пиразол; имидазол; тиофен; пирролидин; морфолин; и тому подобное. Характерной чертой указанных радикалов или замещенных или алкилированных производных этих радикалов является то,что они могут ковалентно связываться с азотом амина любым путем, включая через заместитель или алкильную группу, через гетероатом, если он присутствует, или через атом кольца, если он присутствует,что понятно специалисту в данной области. Химические группы R1, R2 и R3 по настоящему изобретению также включают в себя, но ими не ограничиваются, циклические алканы и циклические алкены, и включают в себя кольца с внутренним мостиком или без него. Примеры колец с внутренним мостиком включают в себя, но ими не ограничиваются, следующие группы: изопинокамфенил; борнил; норборнил; адамантанететил; цис-(-)миртанил; адамантил; норадамантил; 6-азабицикло[3,2,1]октан; экзонорборнан и тому подобное. В одном из воплощений настоящего изобретения, NR2R3 получены из циклического вторичного амина. Примеры циклической химической группы, NR2R3, по настоящему изобретению включают в себя,но ими не ограничиваются, 4-бензилпиперидин; 3-пиперидинметанол; пиперидин; триптамин; морфолин; 4-пиперидинопиперидин; этил 1-пиперазин карбоксилат; 1-(2-аминоэтил)пиперазин; декагидрохинолин; 1,2,3,4-тетрагидропиридоиндол (взаимодействие на любом амине); 3-амино-5-фенилпиразол; 3 аминопиразол; 1-(2-фторфенил)пиперазин; 1-пролинметиловый эфир; гистидинол; 1 пиперонилпиперазин; гексаметилимин; 4-гидроксипиперидин; 2-пиперидинметанол; 1,3,3-триметил-6 азабицикло[3,2,1]октан; 3-пирролидинол; 1-метилпиперазин; (S)-(+)-(2-пиролидинилметил)пирролидин; 1-метилгомопиперазин; 2-этилпиперидин; 1,2,3,4-тетрагидроизохинолин; 1-(4-фторфенил)пиперазин; метиловый эфир d,1-триптофана; трет-бутил (15,45)-(-)-2,5-диазабицикло[2,2,1]гептан-2-карбоксилат; изонипекотамид; гептаметиленимин; альфа-метилтриптамин; 6,7-диметокси-1,2,3,4 тетрагидроизохинолин; 3-аминопирролидин; 3,5-диметилпиперидин; 2,6-диметилморфолин; 1,4-диоксо 8-азаспиро[4,5]декан; 1-метил-6,7-дигидрокси-1,2,3,4-тетрагидроизохинолин; 1,3,4,6,7,8-гексагидро-2 Нпиридо(1,2-А)пиримидин; 1,2,3,4-тетрагидрохинолин; 1-(2-метоксифенил)пиперазин; 1-(2-(2-гидроксиэтокси)этил)пиперазин; (S)-(+)-2-(аминометил)пирролидин; (3S(3 а,4Ab),8Ab)-N-трет-бутил-D-экагидро 3-изохинолинкарбоксамид; (R)-циклосерин; гомопиперазин; 2,6-диметилпиперазин (взаимодействие на любом амине); иминодибензил; 5-метокситриптамин; 4,4'-бипиперидин; 1-(2-гидроксиэтил)пиперазин; 4 метилпиперидин; 1-гистидинметиловый эфир; или метил пипеколат. Заместитель R1HN получали из первичного амина. Заместитель R2R3N обычно получали из первичного или вторичного амина, но также может быть получен из аминокислоты или предшественника аминокислоты. Аминокислота может преобразовываться в аминоспирт. Если в качестве источника R2R3N группы используется аминокислота, соединение-предшественник может быть выбрано, среди прочих, из следующих соединений и их производных: метиловый эфир d,1-триптофана; этиловый эфир 1 метионина; метиловый эфир 1-лизина (посредством взаимодействия любого первичного амина); этиловый эфир (S)-бензил-1-цистеина; метиловый эфир 1-аргинина (посредством реакции любого первичного амина); этиловый эфир 1-глютаминовой кислоты; метиловый эфир 1-гистидина; или (3S(3 а,4Ab),8Ab)-Nтрет-бутил-D-экагидро-3-изохинолинкарбоксамида. Группа R4 у замещенных производных зтилендиамина по настоящему изобретению обычно выбрана из Н, С 1-С 8 алкила или фенила, но R4 также может быть С 2-С 4 алкенилом, С 2-С 4 алкинилом, толилом,ксилилом, бензилом, нафтилом, С 4-С 8 циклоалкилом, С 4-С 8 циклоалкенилом. Примеры химической группы R4 включают в себя, но ими не ограничиваются: Н; метил; этил; пропил; бутил; пентил; гексил; гептил; октил; этенил; пропенил; бутенил; этинил; пропинил; бутинил; циклобутил; циклопентил; циклогексил; циклобутенил; циклопентенил; циклогексенил; фенил; толил; ксилил; бензил; нафтил; их производные с прямой или разветвленной цепью. Обычно R4 выбран из Н, метила, этила, бутила или фенила. Однако, если R4 представляет собой Н, то этилендиамин не охватывает соединений следующих формул: Большинство производных этилендиамина, описанных здесь, получали, используя твердофазный синтез, как указано на одной из характерных схем взаимодействия, показанных на фиг. 1. Однако, когдаR4 представляет собой Н, то взаимодействие проходит неудовлетворительно, если для R1NH2 используются пространственно затрудненные амины, или если для R1NH2 используются диамины, такие как аминоалкиленморфолин или аминоалкиленпиперидины. Если R4 является метилом или фенилом, то использование пространственно затрудненных аминов для R3R2NH является нежелательным из-за пространственного затруднения на участке взаимодействия реакции. В этом случае конкурентная реакция гидролиза с получением соответствующих аминоспиртов, и неполное восстановление амидоэтилендиаминов будут препятствовать прохождению реакции по схеме. В результате выход желаемых продуктов диаминов будет низким. Получение этилендиаминов предпочтительно осуществляют в шесть стадий, используя кислую смолу Ринка. На первой стадии синтеза происходит превращение кислой смолы Ринка в хлорид смолы Ринка путем обработки трифенилфосфином и гексахлорэтаном в тетрагидрофуране (ТГФ). После этой стадии следует добавление первичного амина в присутствии основания Хунига (EtN(i-Pr)2) в дихлорэтане. На третьей стадии происходит ацилирование амина, присоединенного к смоле, используя любой из двух путей ацилирования, показанных на фиг. 1. Стадию ацилирования предпочтительно проводить, используя любое соединение из следующих: хлорид -хлорацетила, ацетилбромид -бромметила, бромид -бромэтилацетила, ацетилбромид -бромбутила или ацетилхлорид -хлорфенила, каждый в присутствии пиридина в ТГФ. Также могут быть использованы другие агенты ацилирования, известные специалистам в данной области, однако галогениды -бромацетила дают низкий выход продуктов,что может быть связано с элиминированием HBr. Ацилирование также можно осуществлять путем механизма пептидного присоединения, используя -бромметилуксусную кислоту или -хлор-метилуксусную кислоту в присутствии гексафторфосфата бензотриазола-1-илокси-триспирролидинофосфония (PyBrop) и N1N-диизопропилэтиламина (EtN(i-Pr)2) в дихлорметане (ДХМ) и диметилформамиде (ДМФ). Опять же, можно использовать другие агенты ацилирования, известные специалисту в данной области. Стадию ацилирования предпочтительно осуществлять дважды для большего выхода ацилированных продуктов. Введение вторичной аминогруппы предпочтительно осуществляли в присутствии основания Хунига в диметилформамиде (ДМФ). Восстановление промежуточного амин-амида проводили, используяRed-Al (3,4 М раствор бис(2-метоксиэтокси)алюмогидрида натрия в толуоле). Конечный продукт отщепляли от полимерной подложки, используя 10% раствор (по объему) трифторуксусной кислоты (ТФУ) в дихлорметане (ДХМ). Растворитель упаривали, и полученную соль ТФУ диаминовых продуктов анализировали с помощью масс-спектроскопии, и подвергали скринингу на активность против М. tuberculosis. Некоторые замещенные этилендиамины, полученные вышеописанным методом твердофазного синтеза,также получали, используя синтез в жидкой фазе, как описано ниже. Получение библиотеки замещенных этилендиаминов Для получения библиотеки замещенных этилендиаминов предпочтительно используют твердофазный синтез, показанный на фиг. 1. Твердофазный синтез дает по крайней мере три основных преимущества: (i) сокращает необходимость использования хроматографических методов, (ii) использует избыток реагентов для проведения реакции с большим выходом и (iii) использует методы объединения и разделения для синтеза большого количества соединений. Твердофазный синтез библиотек 1,2-диамина ранее проводили путем восстановления коротких пептидов (Cuervo et al., Peptides 1994: Proceedings of the European Peptide Symposium; Maia HSL Ed., Esom: Leiden, 1995, 465-466). Однако, как описано здесь, библиотеку этиленаминов получали, используя амины, а не простые аминокислоты, для большего разнообразия блоков мономеров для строительства. Первые три стадии каждого твердофазного синтеза: активацию кислой смолы Ринка, добавление первого амина и стадию ацилирования, проводили в 10 мл-ых пробирках на синтезаторе QUEST 210, производство ARGONAUT TECHNOLOGIES, Inc., Foster City, California. В синтезаторе осуществляется до двадцати одновременных взаимодействий в 5 или 10 мл-ых ре- 10020307 акционных сосудах для быстрого синтеза целевых соединений. В синтезаторе предусмотрен программируемый температурный контроль и перемешивание, и автоматизированная доставка растворителей в реакционные сосуды. Добавление второго амина, восстановление с помощью Red-Al и отщепление от твердой подложки осуществляли в 2 мл-ых лунках 96-луночной химически устойчивой плашки. До твердофазного синтеза каждый амин с номерами 1-288, как показано на фиг. 2, 3 и 4, растворяли в ДМФ как одномолярный раствор и помещали в три 96-луночные плашки (один амин на лунку) с получением трех основных плашек этих аминов. В первых трех стадиях твердофазного синтеза из каждого первичного амина образовывались отдельные галогенацетиламиды и особая R4 группа. Отдельные галогенацетиламиды затем объединяли в группы из десяти или тридцати. Суспензию объединенных полимеров в смеси 2:1 ДХМ/ТГФ равномерно распределяли в одной, двух или трех реакционных плашках с получением 15-20 мг суспензии на лунку. Число используемых реакционных плашек соответствовало числу имеющихся суспензий. Объединенные полимеры в каждой лунке взаимодействовали с соответствующим амином из основных плашек. На фиг. 5 показана схема характерного объединения. Каждое взаимодействие осуществляется в отдельной лунке в присутствии основания Хунига в ДМФ при 70-75 С в течение 16-20 ч. Каждый получаемый амин-амид восстанавливали, используя 65 + мас.% Red-Al при комнатной температуре. После восстановления проводили отщепление 10% об. ТФУ в ДХМ. Растворители в каждой реакционной лунке упаривали и соли ТФУ диаминов анализировали (масс-спектр) и проводили скрининг на активность против М. tuberculosis. Одну из плашек с объединенными диаминами скринировали на активность против М. smegmatis. Два наугад выбранных ряда каждой плашки; то есть 24 образца на 96-луночную плашку или 25% библиотеки анализировали с помощью масс-спектроскопии. Конкретные методики и подробное описание способов даны в примерах ниже. Скрининг на активность против М. tuberculosis Всю библиотеку синтезированных замещенных этилендиаминов (заданное число соединение составляет около 100000), полученную как описано выше, подвергали скринингу in vitro на активность против М. tuberculosis в этамбутоле (ЕМВ) в чувствительном Luc-анализе. Также определяли MIC (минимальную ингибирующую концентрацию). MIC представляет собой минимальную ингибирующую концентрацию ингибитора роста, в данном случае замещенного этилендиамина, при которой не происходит размножения микроорганизмов при исследовании. Скрининг проводили, используя технологию высокоэффективного скрининга Luc (HTS) с рекомбинантной микобактерией, содержащей промоторную конструкцию люциферазы под ЕВ-индуцибильным геном (Luc-анализ). Luc-анализ и анализ MIC подробно описаны ниже. Эти анализы хорошо известны специалисту в данной области. На основании этого первоначального скрининга была показана противотуберкулезная активность смеси 300+ соединений. На фиг. 6 показаны характерные данные анализа в штамме с репортерным геном люциферазы, содержащемRv0341 ЕМВ-индуцибильный промотор. На фиг. 6 показан процент максимального числа импульсов люминисценции в секунду (% Max. LCPS) для смеси объединенных соединений в одном ряду (ряд D) в одной из 96-луночных плашек. Разделение реакционных плашек Скрининг на активность против М. tuberculosis выявил смеси приблизительно 300 активных соединений, которые были отобраны для исследований. В частности, лунки с активностью, равной приблизительно 12,5 мкМ в HTS Luc-анализе и/или с MIC, равной приблизительно 12,5 мкМ, были отобраны общим числом 336 лунок. Разделение осуществляли путем отдельного повторного синтеза каждого замещенного производного этилендиамина в каждой активной смеси соединений. Объединенные соединения в каждой активной лунке синтезировали отдельно и подвергали скринингу. Синтез заданных производных диамина в каждой активной лунке выполняли в 96-луночных плашках, используя хранящийся архив галогенацетиламидов (полимеры с присоединенными галогенациламидами), в соответствии с ранее описанными стадиями реакции (добавление второго амина, восстановление с помощью Red-Al и отщепление от твердой подложки). Полимеры архива хранили в виде отдельных соединений при 4 С. 96-луночные плашки использовали для оставшихся стадий синтеза, как описано выше. Каждое полученное разделением соединение подвергали скринингу, анализу MIC и HTS Lucанализу. Характерные данные люминисценции полученных разделением соединений показаны на фиг. 7 и 8. На фиг. 7 и 8 показано количество импульсов люминисценции в секунду (LCPS) для каждого соединения. Краткое описание результатов скрининга В целом результаты скрининга разделенных производных показали, что приблизительно 2000 производных этилендиамина обладают ингибиторной активностью в отношении М. tuberculosis. Более 150 из этих соединений демонстрируют значения MIC, равные или меньше приблизительно 12,5 мкМ. На фиг. 9 суммированы данные MIC для всех синтезированных отдельных соединений с MIC, равной 50 мкМ или ниже. На фиг. 10 суммированы данные Luc-анализа для всех соединений, которые демонстрируют по крайней мере 10%-ную активность при каждой концентрации (результаты не кумулятивны). Значение MIC и Luc активности получали для неочищенных образцов с химическим выходом, равным приблизительно 20%, на основании предполагаемого 80% выхода на каждой стадии реакции. В Lucанализе 32 соединения показали активность при 1,56 мкМ и в анализе MIC по крайней мере 11 соединений имели MIC, равную 3,13 мкм. Частота встречаемости основных тринадцати аминов, которые усиливают активность замещенных этилендиаминов, показана на фиг. 11, где каждый амин показан со своим цифровым обозначением. Эти амины включают в себя следующие соединения: 11 2,3 -Диметилциклогексиламины 18 3,3-Дифенилпропиламин 44 1-Адамантанметилметиламин 47 2,2-Дифенилэтиламин 63 (S)-2-Амино-1-бутанол 74,1 (-)-цис-Миртаниламин 77,1 Циклооктиламин 78,1 2-Адамантамин 105 а (1R,2R,3R,5S)-(-)-Изопинокамфеиламин 231 2-Метоксифенетиламин 255 (S)-Циклогексилэтиламин 266 Ундециламин 272 Гераниламин Другие амины, которые усиливают активность замещенных этилендиаминов, показаны на табл. 2. Соединения в табл. 2 расположены по результатам своей MIC. Некоторые соединения, синтезированные в больших количествах (2-60 мг) на синтезаторе Quest и очищенные с помощью ВЭЖХ, используя полупрепаративную колонку С 18, показаны в табл. 3. Как правило, конечная чистота каждого соединения в табл. 3 составляла по крайней мере 90%. Таблица 2. Синтезированные замещенные диэтилендиамины, классифицированные по минимальной ингибирующей концентрации
МПК / Метки
МПК: C07D 333/38
Метки: заболеваний, замещенное, фармацевтическая, основе, микобактериальных, композиция, лечения, производное, этилендиамина
Код ссылки
<a href="https://eas.patents.su/30-20307-zameshhennoe-proizvodnoe-etilendiamina-dlya-lecheniya-mikobakterialnyh-zabolevanijj-i-farmacevticheskaya-kompoziciya-na-ego-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенное производное этилендиамина для лечения микобактериальных заболеваний и фармацевтическая композиция на его основе</a>
Предыдущий патент: Сетевой элемент, выполненный с возможностью распределения соединений данных
Следующий патент: Высокоэффективный антиокислитель на основе трегалулозы
Случайный патент: Подшипник чистого качения