Полициклические антагонисты рецепторов лизофосфатидной кислоты
Номер патента: 20139
Опубликовано: 29.08.2014
Авторы: Хатчинсон Джон Ховард, Ропп Джеффри Роджер, Ванг Боуэл, Арруда Дженни М., Сейдерс Томас Джон, Парр Тимоти
Формула / Реферат
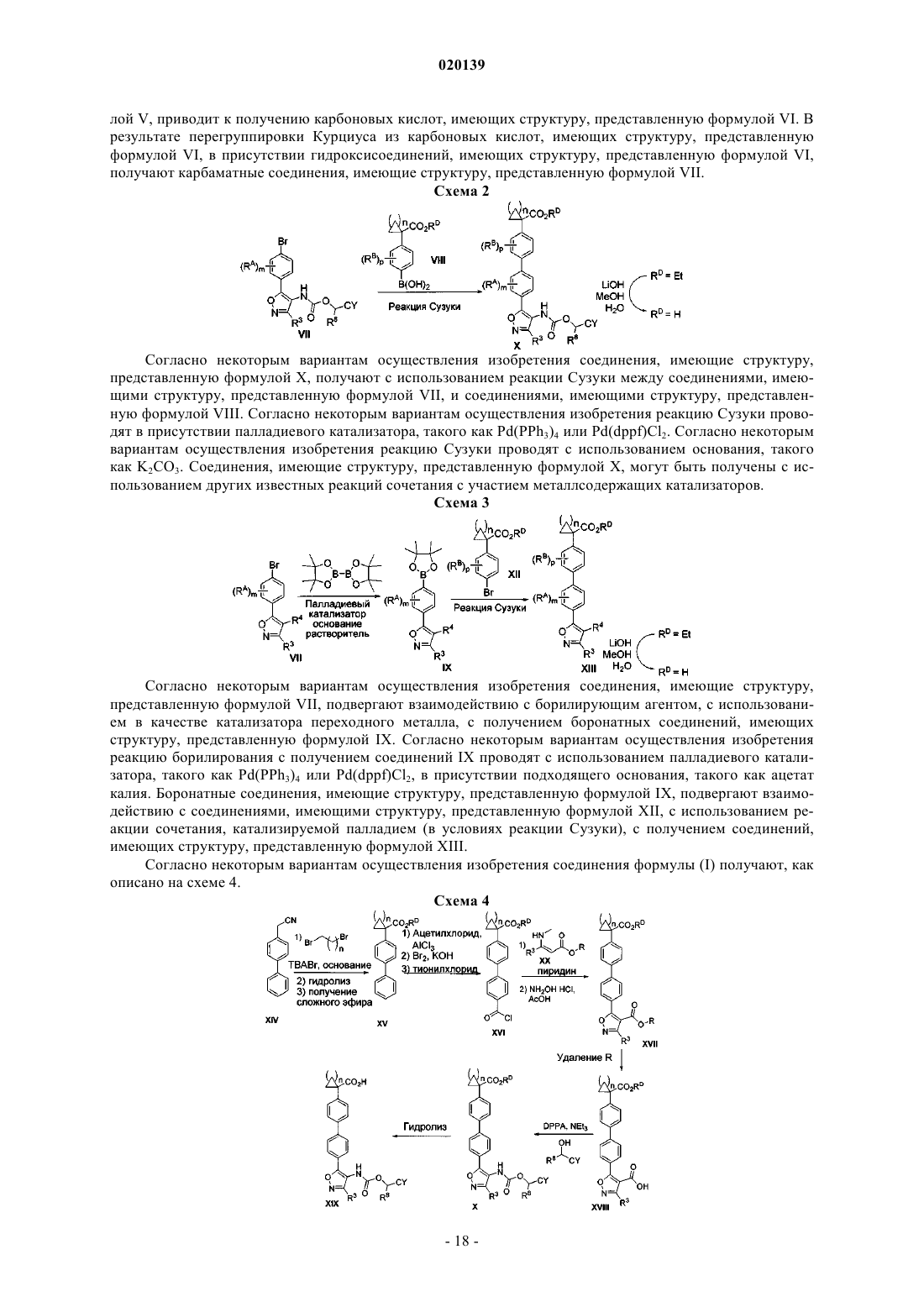
1. Соединение, имеющее структуру, представленную формулой (I)
где R1 представляет собой -СО2Н, -CO2RD, -CN, -C(=O)NHSO2R10, тетразолил или 5-оксо-2,5-дигидро[1,2,4]оксадиазол-3-ил;
RD представляет собой H или C1-C4-алкил;
R3 представляет собой H или C1-C4-алкил;
R4 представляет собой -NR7C(=O)OCH(R8)-CY;
R7 представляет собой H или C1-C4-алкил;
R8 представляет собой H или C1-C4-алкил;
CY представляет собой замещенный или незамещенный С3-С6-циклоалкил или замещенный или незамещенный фенил при условии, что, когда CY является замещенным, CY имеет в качестве заместителей 1 или 2 RC;
R10 представляет собой C1-C6-алкил или незамещенный фенил;
каждый из RA, RB и RC независимо выбран из Cl, Br, -CN, -ОН, C1-C4-алкила, C1-C4-фторалкила и C1-C4-алкокси;
m имеет значение 0 или 1;
n имеет значение 1, 2 или 3;
р имеет значение 0,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R1 представляет собой -СО2Н, -CO2RD, -C(=O)NHSO2R10 или тетразолил;
R7 представляет собой H;
R8 представляет собой H или -CH3;
R10 представляет собой C1-C6-алкил или незамещенный фенил;
каждый RA представляет собой -OCH3;
каждый RC независимо выбран из Cl, Br, -ОН, -CH3, -CF3 и -OCH3;
m имеет значение 0 или 1;
n имеет значение 1, 2 или 3;
р имеет значение 0.
3. Соединение по п.2, в котором
R1 представляет собой -СО2Н или -CO2RD;
RD представляет собой H, -CH3 или -CH2CH3;
R3 представляет собой H, -CH3 или -CH2CH3;
R4 представляет собой -NHC(=O)OCH(R8)-CY;
R8 представляет собой H или -CH3;
CY представляет собой замещенный или незамещенный фенил при условии, что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC.
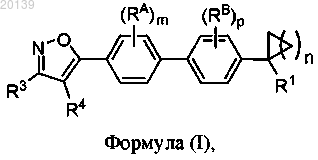
4. Соединение по п.3, которое представляет собой соединение формулы (I) следующей структуры:
5. Соединение по любому из пп.1-4, в котором
R4 представляет собой 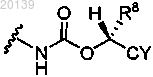
R8 представляет собой -CH3;
CY представляет собой замещенный или незамещенный фенил при условии, что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC;
RC представляет собой F, Cl, -ОН, -CH3, -CF3 или -OCH3;
n имеет значение 1.
6. Соединение по п.5, в котором CY представляет собой фенил, 2-хлорфенил, 3-хлорфенил, 2-метилфенил, 3-метилфенил, 2-трифторметилфенил или 3-трифторметилфенил.
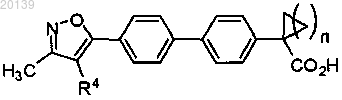
7. Соединение по любому из пп.1-5, которое представляет собой соединение формулы (I) следующей структуры:

8. Соединение по п.7, в котором
R1 представляет собой -СО2Н;
CY представляет собой фенил, 2-хлорфенил, 3-хлорфенил, 2-метилфенил, 3-метилфенил, 2-трифторметилфенил или 3-трифторметилфенил.
9. Соединение по п.1, в котором
R1 представляет собой -СО2Н, -CO2RD, -C(=O)NHSO2R10, тетразолил или 5-оксо-2,5-дигидро[1,2,4]оксадиазол-3-ил;
R3 представляет собой H или C1-C4-алкил;
R7 представляет собой H;
R8 представляет собой H или -CH3;
R10 представляет собой С1-С6-алкил или незамещенный фенил;
CY представляет собой циклопропил, циклобутил, циклогексил, циклогекс-1-енил, 2-хлорциклогекс-1-енил, фенил, 2-хлорфенил, 3-бромфенил, 3-гидроксифенил, 3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил, 2-цианофенил, 3-цианофенил или 4-цианофенил.
10. Соединение по п.9, в котором
каждый RA независимо выбран из F, Cl, -CH3, -CF3, -ОН, -OCF3 и -OCH3;
m имеет значение 0 или 1;
n имеет значение 1;
р имеет значение 0 или 1.
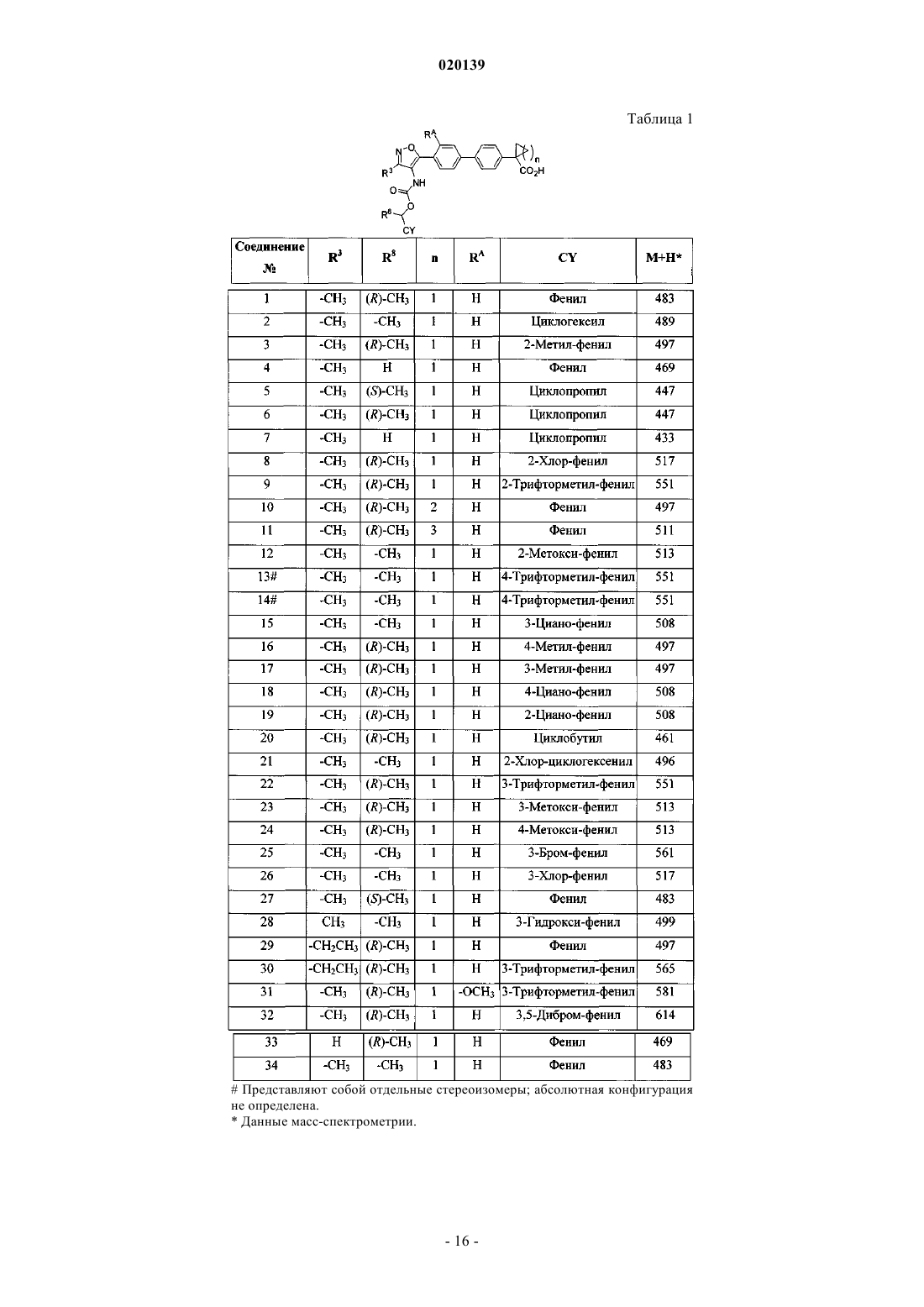
11. Соединение по п.1, выбранное из
1-{4'-[3-метил-4-((R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 1);
1-{4'-[4-(1-циклогексилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 2);
1-{4'-[3-метил-4-((R)-1-ортотолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 3);
1-[4'-(4-бензилоксикарбониламино-3-метилизоксазол-5-ил)бифенил-4-ил]циклопропанкарбоновой кислоты (соединение 4);
(S)-1-{4'-[4-(1-циклопропилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 5);
(R)-1-{4'-[4-(1-циклопропилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 6);
1-[4'-(4-циклопропилметоксикарбониламино-3-метилизоксазол-5-ил)бифенил-4-ил]циклопропанкарбоновой кислоты (соединение 7);
1-(4'-{4-[(R)-1-(2-хлорфенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 8);
1-(4'-{3-метил-4-[(R)-1-(2-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 9);
1-{4'-[3-метил-4-((R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклобутанкарбоновой кислоты (соединение 10);
1-{4'-[3-метил-4-((R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопентанкарбоновой кислоты (соединение 11);
1-(4'-{4-[1-(2-метоксифенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 12);
1-(4'-{3-метил-4-[1-(4-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 13);
1-(4'-{3-метил-4-[1-(4-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 14);
1-(4'-{4-[1-(3-цианофенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 15);
1-{4'-[3-метил-4-((R)-1-паратолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 16);
1-{4'-[3-метил-4-((R)-1-метатолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 17);
1-(4'-{4-[(R)-1-(4-цианофенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 18);
1-(4'-{4-[(R)-1-(2-цианофенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 19);
1-{4'-[4-((R)-1-циклобутилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 20);
1-(4'-{4-[1-(2-хлорциклогекс-1-енил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 21);
1-(4'-{3-метил-4-[(R)-1-(3-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 22);
1-(4'-{4-[(R)-1-(3-метоксифенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 23);
1-(4'-{4-[(R)-1-(4-метоксифенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 24);
1-(4'-{4-[1-(3-бромфенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 25);
1-(4'-{4-[1-(3-хлорфенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 26);
1-{4'-[3-метил-4-((S)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 27);
1-(4'-{4-[1-(3-гидроксифенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 28);
1-{4'-[3-этил-4-((R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 29);
1-(4'-{3-этил-4-[(R)-1-(3-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 30);
1-(3'-метокси-4'-{3-метил-4-[(R)-1-(3-трифторметилфенил)этоксикарбониламино]изоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 31);
1-(4'-{4-[(R)-1-(3,5-дибромфенил)этоксикарбониламино]-3-метилизоксазол-5-ил}бифенил-4-ил)циклопропанкарбоновой кислоты (соединение 32);
1-{4'-[4-((R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 33);
1-{4'-[3-метил-4-(1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-ил}циклопропанкарбоновой кислоты (соединение 34);
{5-[4'-(1-метансульфониламинокарбонилциклопропил)бифенил-4-ил]-3-метилизоксазол-4-ил}карбаминовой кислоты (R)-1-фенилэтилового эфира (соединение 35);
{5-[4'-(1-бензолсульфониламинокарбонилциклопропил)бифенил-4-ил]-3-метилизоксазол-4-ил}карбаминовой кислоты (R)-1-фенилэтилового эфира (соединение 36);
{5-[4'-(1-цианоциклопропил)бифенил-4-ил]-3-метилизоксазол-4-ил}карбаминовой кислоты (R)-1-фенилэтилового эфира (соединение 37);
(3-метил-5-{4'-[1-(5-оксо-2,5-дигидро[1,2,4]оксадиазол-3-ил)циклопропил]бифенил-4-ил}изоксазол-4-ил)карбаминовой кислоты (R)-1-фенилэтилового эфира (соединение 38);
(3-метил-5-{4'-[1-(1H-тетразол-5-ил)циклопропил]бифенил-4-ил}изоксазол-4-ил)карбаминовой кислоты (R)-1-фенилэтилового эфира (соединение 39);
{5-[4'-(1-метансульфониламинокарбонилциклопропил)бифенил-4-ил]-3-метилизоксазол-4-ил}карбаминовой кислоты (R)-1-(3-трифторметилфенил)этилового эфира (соединение 40);
{5-[4'-(1-метансульфониламинокарбонилциклопропил)-3-метоксибифенил-4-ил]-3-метилизоксазол-4-ил}карбаминовой кислоты (R)-1-(3-трифторметилфенил)этилового эфира (соединение 41),
или фармацевтически приемлемая соль указанного соединения.
12. Фармацевтическая композиция для применения в лечении, предупреждении или диагностики заболеваний или состояний, ассоциированных с рецепторами лизофосфатидной кислоты (LPA), содержащая терапевтически эффективное количество соединения по любому из пп.1-11 или его фармацевтически приемлемой соли.
13. Способ лечения рака у млекопитающего, включающий введение терапевтически эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему.
14. Способ лечения или предупреждения фиброза у млекопитающего, включающий введение терапевтически эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему.
15. Способ лечения или предупреждения фиброза легких, астмы, хронического обструктивного заболевания легких (ХОЗЛ), фиброза почек, острой травмы почки, хронической почечной недостаточности, фиброза печени, фиброза кожи, фиброза пищеварительного тракта, рака молочной железы, рака поджелудочной железы, рака яичника, рака предстательной железы, глиобластомы, злокачественного новообразования костей, рака толстой кишки, колоректального рака, злокачественного новообразования головы и шеи, меланомы, множественной миеломы, хронического лимфоцитарного лейкоза, боли, вызванной злокачественным новообразованием, метастазирования опухолей, отторжения трансплантированного органа, склеродермии, фиброза глазных мышц (ocular fibrosis), возрастной дегенерации желтого пятна (AMD), диабетической ретинопатии, коллагенового сосудистого заболевания, атеросклероза, феномена Рейно или невропатической боли у млекопитающего, включающий введение терапевтически эффективного количества соединения по любому из пп.1-11 или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему.
Текст
ПОЛИЦИКЛИЧЕСКИЕ АНТАГОНИСТЫ РЕЦЕПТОРОВ ЛИЗОФОСФАТИДНОЙ КИСЛОТЫ В изобретении описаны соединения, которые являются антагонистами лизофосфатидного(ых) рецептора(ов), фармацевтические композиции и лекарства, которые содержат соединения,описанные в данном изобретении, а также способы применения таких антагонистов, одних и в комбинации с другими соединениями, в лечении LPA-зависимых или LPA-опосредованных состояний или заболеваний. Родственные заявки Заявка на данное изобретение испрашивает приоритет по предварительной заявке на патент США 61/183785 "Антагонисты рецепторов лизофосфатидной кислоты", поданной 3 июня 2009 г., которая включена в данное описание посредством ссылки. Область техники изобретения Настоящее изобретение относится к описанным в данном документе соединениям, способам получения указанных соединений, фармацевтическим композициям и лекарствам, содержащим указанные соединения, и способам применения указанных соединений для лечения, предупреждения или диагностики заболеваний, расстройств или состояний, ассоциированных с одним или более чем одним рецептором лизофосфатидной кислоты (LPA). Уровень техники изобретения Лизофосфолипиды являются биоактивными липидными медиаторами мембранного происхождения. Лизофосфолипиды воздействуют на основные клеточные функции, которые включают пролиферацию, дифференцировку, выживаемость, миграцию, адгезию, инвазию и морфогенез. Данные функции оказывают влияние на многие биологические процессы, которые включают нейрогенез, ангиогенез, заживление ран, фиброз, иммунитет и онкогенез, но не ограничены ими. Лизофосфатидная кислота (LPA) представляет собой лизофосфолипид, который, как показано, оказывает аутокринное и паракринное действие через ряд специфических G-белок-сопряженных рецепторов(GPCR). Связывание LPA со своими GPCR (LPA1, LPA2, LPA3, LPA4, LPA5, LPA6) активирует внутриклеточные сигнальные пути, что вызывает ряд ответных биологических реакций. Антагонисты LPAрецепторов находят применение в лечении заболеваний, расстройств или состояний, в развитии которых участвует LPA. Сущность изобретения В соответствии с одним из аспектов данного изобретения предложены соединения формулы (I), которые ингибируют физиологическую активность лизофосфатидной кислоты (LPA) и поэтому могут быть использованы в качестве агентов для лечения или предупреждения заболеваний, при которых ингибирование физиологической активности LPA является полезным, например таких заболеваний, при которыхLPA-рецептор участвует в развитии заболевания, вовлечен в этиологию или патологию заболевания или иным образом ассоциирован по меньшей мере с одним симптомом заболевания. В соответствии с одним из аспектов изобретения соединения формулы (I) могут быть использованы в лечении фиброза различных органов (печени, почки, легкого, сердца и т.д.), заболеваний печени (острого гепатита, хронического гепатита, фиброза печени, цирроза печени, портальной гипертензии, регенеративной недостаточности, неалкогольного стеатогепатита (NASH), гипофункции печени, нарушения печеночного кровотока и т.п.), пролиферативного заболевания (рака (солидной опухоли, метастаза солидной опухоли, ангиофибромы, миеломы, множественной миеломы, саркомы Капоши, лейкемии, хронического лимфоцитарного лейкоза (CLL) и т.п.) и инвазивного метастаза раковых клеток и т.п.), воспалительного заболевания (псориаза, нефропатии, пневмонии и т.п.), заболевания желудочно-кишечного тракта (синдрома раздраженного кишечника (IBS), воспалительного заболевания кишечника (IBD), аномальной секреции поджелудочной железы и т.п.), поражения почек, заболевания мочевых путей (доброкачественной гиперплазии предстательной железы или симптомов, ассоциированных с нейрогенным мочевым пузырем, опухолью спинного мозга, грыжей межпозвоночного диска, стенозом позвоночного канала, симптомов, являющихся следствием диабета, заболевания нижних отделов мочевых путей (непроходимости нижних отделов мочевых путей и т.п.), воспалительного заболевания нижних отделов мочевых путей, дизурии, учащенного мочеиспускания и т.п.), заболевания поджелудочной железы, заболевания, связанного с аномальным ангиогенезом (артериальной обструкции и т.п.), склеродермии, заболевания головного мозга (церебрального инфаркта, внутримозгового кровоизлияния и т.п.), невропатической боли, периферической невропатии и т.п., глазного заболевания (возрастной дегенерации желтого пятна(AMD), диабетической ретинопатии, пролиферативной витреоретинопатии (PVR), рубцующегося пемфигоида, рубцевания после антиглаукомной фильтрующей операции и т.п.). В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении фиброзных заболеваний или состояний. Один из аспектов данного изобретения относится к соединениям формулы (I), фармацевтически приемлемым солям, сольватам и пролекарствам указанных соединений. Соединения формулы (I) являются антагонистами по меньшей мере одного из LPA-рецепторов, выбранных из LPA1, LPA2, LPA3,LPA4, LPA5 и LPA6. Согласно одному из вариантов осуществления изобретения соединения формулы (I) являются антагонистами LPA1. Согласно одному из вариантов осуществления изобретения соединения формулы (I) являются антагонистами LPA1 и/или LPA3. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) являются антагонистами LPA1 и/или LPA2. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) являются селективными антагонистами в отношении одного из LPA-рецепторов по сравнению с другими LPA-рецепторами. Согласно некоторым вариантам осуществления изобретения такой селективный антагонист является селективным в отношении рецептора LPA1. Согласно некоторым вариантам осуществления изобретения такой селективный антагонист является селективным в отношении рецептора LPA2. Согласно некоторым вариантам осуществления изобретения такой селективный антагонист является селективным в отношении рецептораLPA3. Соединения формулы (I) применяют в лечении заболеваний, расстройств или состояний, характеризующихся тем, что активация по меньшей мере одного из LPA-рецепторов в результате действия LPA вносит вклад в симптоматику или прогрессирование заболевания, расстройства или состояния. В соответствии с одним из аспектов изобретения способы, соединения, фармацевтические композиции и лекарства, описанные в данном документе, включают антагонисты LPA-рецептора(ов). В соответствии с одним из аспектов изобретения способы, соединения, фармацевтические композиции и лекарства, описанные в данном документе, включают антагонисты LPA1, LPA2 или LPA3 или их комбинации. В соответствии с одним из аспектов данного изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль:CY представляет собой замещенный или незамещенный C3-C6-циклоалкил или замещенный или незамещенный фенил при условии, что, когда CY является замещенным, CY имеет в качестве заместителей 1 или 2 RC;R10 представляет собой C1-C6-алкил или незамещенный фенил; каждый из RA, RB и RC независимо выбран из Cl, Br, -CN, -ОН, С 1-С 4-алкила, C1-C4-фторалкила иn имеет значение 1, 2 или 3; р имеет значение 0. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н, -CO2RD,-C(=O)NHSO2R10 или тетразолил; R7 представляет собой H; R8 представляет собой H или -CH3; R10 представляет собой C1-C6-алкил или незамещенный фенил; каждый RA представляет собой -OCH3; каждый RC независимо выбран из Cl, Br, -ОН, -CH3, -CF3 и -OCH3; m имеет значение 0 или 1; n имеет значение 1, 2 или 3; р имеет значение 0. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н или -CO2RD; RD представляет собой H, -CH3 или -CH2CH3; R3 представляет собой H, -CH3 или -CH2CH3;R4 представляет собой -NHC(=O)OCH(R8)-CY; R8 представляет собой H или -CH3; CY представляет собой замещенный или незамещенный фенил при условии, что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет следующую структуру: Согласно некоторым вариантам осуществления изобретения R4 представляет собой; CY представляет собой замещенный или незамещенный фенил при условии что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC; RC представляет собойF, Cl, -ОН, -CH3, -CF3 или -OCH3; n имеет значение 1. Согласно некоторым вариантам осуществления изобретения R1 представляет собой-C(=O)NHSO2R10; R3 представляет собой -CH3 или -CH2CH3; R8 представляет собой H или -CH3; R10 представляет собой -CH3 или -CH2CH3. Согласно некоторым вариантам осуществления изобретения R4 представляет собой-NHC(=О)OCH(CH3)-(замещенный или незамещенный фенил) при условии, что, когда фенил является замещенным, данный фенил имеет в качестве заместителей RC, RC представляет собой F, Cl, -CH3 или Согласно некоторым вариантам осуществления изобретения R4 представляет собой; R8 представляет собой -CH3, CY представляет собой замещенный или незамещенный фенил при условии,что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC, RC представляет собой F, Cl, -ОН, -CH3, -CF3 или -OCH3; n имеет значение 1 Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-хлорфенил,3-хлорфенил,2-метилфенил,3-метилфенил,2-трифторметилфенил или 3-трифторметилфенил Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет следующую структуру: Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н, -CO2RD,-C(=O)NHSO2R10, тетразолил или 5-оксо-2,5-дигидро[1,2,4]оксадиазол-3-ил; R3 представляет собой H или С 1-С 4-алкил; R7 представляет собой H; R8 представляет собой H или -CH3; R10 представляет собойC1-C6-алкил или незамещенный фенил, CY представляет собой циклопропил, циклобутил, циклогексил,циклогекс-1-енил, 2-хлорциклогекс-1-енил, фенил, 2-хлорфенил, 3-бромфенил, 3-гидроксифенил,3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил,2-метилфенил, 3-метилфенил, 4-метилфенил, 2-цианофенил, 3-цианофенил или 4-цианофенил Согласно некоторым вариантам осуществления изобретения каждый RA независимо выбран из F,Cl, -CH3, -CF3, -ОН, -OCF3 и -OCH3; m имеет значение 0 или 1; n имеет значение 1; р имеет значение 0 или 1. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н, -CO2RD,-C(=O)NHSO2R10, тетразолил или 5-оксо-2,5-дигидро[1,2,4]оксадиазол-3-ил; R3 представляет собой H илиC1-С 6-алкил или замещенный или незамещенный фенил; CY представляет собой циклопропил, циклобутил, циклопентил, циклопент-1-енил, 2-хлорциклопент-1-енил, циклогексил, циклогекс-1-енил,2-хлорциклогекс-1-енил, фенил, 2-хлорфенил, 2,6-дихлорфенил, 2-бромфенил, 3-бромфенил,2,4-дихлорфенил, 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-метилфенил, 3-метилфенил и, 4-метилфенил. В данном описании предполагается, что могут быть использованы любые комбинации групп, указанных выше в определениях различных переменных. Специалисту в данной области техники понятно,что группы и их заместители, указанные в данном описании, выбраны таким образом, чтобы группировки и соединения являлись стабильными. В соответствии с одним из аспектов изобретения предложены соединения, представленные в табл. 1, 2, на фиг. 1-5. Соединения формулы (I) являются антагонистами по меньшей мере одного из LPA-рецепторов. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) является антагонистом LPA1. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) является антагонистом LPA2. Согласно некоторым вариантам осуществления изобретения соединение формулы(I) является антагонистом LPA3. Согласно некоторым вариантам осуществления изобретения соединения, описанные в данном документе, выбраны из фармацевтически приемлемых солей соединения формулы (I). Согласно некоторым вариантам осуществления изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I). Согласно некоторым вариантам осуществления изобретения данная фармацевтическая композиция также содержит по меньшей мере один фармацевтически приемлемый инертный ингредиент. Согласно некоторым вариантам осуществления изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый инертный ингредиент. В соответствии с одним из аспектов изобретения данную фармацевтическую композицию изготавливают в виде препарата для внутривенной инъекции, подкожной инъекции, перорального введения, ингаляции,назального введения, местного введения, введения в глаз или введения в ухо. Согласно некоторым вариантам осуществления изобретения данная фармацевтическая композиция представляет собой таблетку,пилюлю, капсулу, жидкость, средство для ингаляции, раствор назального спрея, суппозиторий, суспензию, гель, коллоидный раствор, дисперсию, суспензию, раствор, эмульсию, мазь, лосьон, глазные капли или ушные капли. Согласно некоторым вариантам осуществления изобретения указанная фармацевтическая композиция дополнительно содержит один или более чем один дополнительный терапевтически активный агент,отличный от соединения формулы (I). Согласно некоторым вариантам осуществления изобретения предложен способ, включающий введение соединения формулы (I) человеку, имеющему LPA-зависимое или LPA-опосредованное заболевание или состояние. Согласно некоторым вариантам осуществления изобретения данному человеку уже вводят один или более чем один дополнительный терапевтически активный агент, отличный от соединения формулы (I). Согласно некоторым вариантам осуществления изобретения данный способ дополнительно включает введение одного или более чем одного дополнительного терапевтически активного агента, отличного от соединения формулы (I). Согласно некоторым вариантам осуществления изобретения один или более чем один дополнительный терапевтически активный агент, отличный от соединения формулы (I), выбран из кортикостероидов, иммунодепрессантов, анальгетиков, противораковых агентов, противовоспалительных средств,антагонистов рецепторов хемокинов, бронходилататоров, антагонистов лейкотриеновых рецепторов,ингибиторов образования лейкотриенов, ингибиторов моноацилглицеринкиназы, ингибиторов фосфолипазы А 1, ингибиторов фосфолипазы А 2 и ингибиторов лизофосфолипазы D (lysoPLD), ингибиторов аутотаксина, противоотечных средств, антигистаминных средств, муколитиков, антихолинергических средств, противокашлевых средств, отхаркивающих средств и -2-агонистов. Другой аспект изобретения относится к применению соединения формулы (I) в лечении заболевания, расстройства или состояния, которые характеризуются тем, что активность по меньшей мере одного из LPA-рецепторов вносит вклад в патологию и/или симптоматику данного заболевания или состояния. Согласно одному из вариантов осуществления данного аспекта изобретения LPA-рецептор выбран изLPA1, LPA2, LPA3, LPA4, LPA5 и LPA6. Согласно некоторым вариантам осуществления изобретения LPAрецептор представляет собой LPA1, или LPA2, или LPA3. Согласно некоторым вариантам осуществления изобретения данное заболевание или состояние представляет собой любое из заболеваний или состояний, указанных в данном описании. Также предложен способ ингибирования физиологической активности LPA у млекопитающего,включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в таком ингибировании. Один из аспектов изобретения относится к способу лечения или предупреждения LPA-зависимого или LPA-опосредованного заболевания или состояния у млекопитающего, который включает введение терапевтически эффективного количества соединения формулы (I). В соответствии с одним из аспектов изобретения LPA-зависимые или LPA-опосредованные заболевания или состояния включают фиброз органов или тканей, рубцевание, заболевания печени, дерматологические состояния, рак, сердечно-сосудистое заболевание, респираторные заболевания или состояния,воспалительное заболевание, заболевание желудочно-кишечного тракта, поражение почек, заболевание мочевых путей, воспалительное заболевание нижних отделов мочевых путей, дизурию, учащенное мочеиспускание, заболевание поджелудочной железы, артериальную обструкцию, церебральный инфаркт,внутримозговое кровоизлияние, боль, периферическую невропатию и фибромиалгию, но не ограничены ими. Согласно некоторым вариантам осуществления изобретения LPA-зависимое или LPAопосредованное заболевание или состояние выбрано из идиопатического легочного фиброза; других диффузных паренхиматозных заболеваний легких различной этиологии, включая ятрогенный лекарственный фиброз, фиброз, вызванный производственными факторами риска или факторами окружающей среды, гранулематозные заболевания (саркоидоз, гиперсенситивный пневмонит), коллагеновое сосудистое заболевание, альвеолярный протеиноз, лангергансоклеточный гистиоцитоз, лимфангиолейомиоматоз, наследственные заболевания (синдром Хермански-Пудлака, туберозный склероз, нейрофиброматоз,болезни накопления, семейное интерстициальное легочное заболевание); лучевого фиброза; хронического обструктивного заболевания легких (ХОЗЛ); склеродермии; фиброза легких, вызванного блеомицином; хронической астмы; силикоза; фиброза легких, вызванного асбестом; синдрома острой дыхательной недостаточности (ARDS); почечного фиброза; тубулоинтерстициального фиброза; гломерулярного нефрита; фокально-сегментарного гломерулосклероза; IgA-нефропатии; гипертензии; синдрома Альпорта; фиброза пищеварительного тракта; фиброза печени; цирроза печени; фиброза печени, вызванного употреблением алкоголя; токсического/лекарственного фиброза печени; гемохроматоза; неалкогольного стеатогепатита (NASH); повреждения желчных протоков; билиарного первичного цирроза печени; фиброза печени, вызванного инфекцией; фиброза печени, вызванного вирусом; и аутоиммунного гепатита; рубцевания роговицы; гипертрофического рубцевания; болезни Дюпюитрена, келоидоза, фиброза кожи; кожной склеродермии; повреждения/фиброза спинного мозга; миелофиброза; рестеноза сосудов; атеросклероза; артериосклероза; гранулематоза Вегенера; болезни Пейрони, хронического лимфоцитарного лейкоза, метастазирования опухолей, отторжения трансплантированного органа, эндометриоза, респираторного дистресс-синдрома новорожденных и невропатической боли. Один из аспектов изобретения относится к способу лечения или предупреждения рака у млекопитающего, который включает введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему. Один из аспектов изобретения относится к способу лечения или предупреждения фиброза у млекопитающего, который включает введение терапевтически эффективного количества соединения формулы(I) или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему. Один из аспектов изобретения относится к способу лечения или предупреждения фиброза легких,астмы, хронического обструктивного заболевания легких (ХОЗЛ), фиброза почек, острой травмы почки,хронической почечной недостаточности, фиброза печени, фиброза кожи, фиброза пищеварительного тракта, рака молочной железы, рака поджелудочной железы, рака яичника, рака предстательной железы,глиобластомы, злокачественного новообразования костей, рака толстой кишки, колоректального рака,злокачественного новообразования головы и шеи, меланомы, множественной миеломы, хронического лимфоцитарного лейкоза, боли, вызванной злокачественным новообразованием, метастазирования опухолей, отторжения трансплантированного органа, склеродермии, фиброза глазных мышц (ocular fibrosis),возрастной дегенерации желтого пятна (AMD), диабетической ретинопатии, коллагенового сосудистого заболевания, атеросклероза, феномена Рейно или невропатической боли у млекопитающего, который включает введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему. В соответствии с одним из аспектов изобретения предложен способ лечения или предупреждения фиброза органов у млекопитающего, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли нуждающемуся в этом млекопитающему. Согласно некоторым вариантам осуществления изобретения фиброз органов включает фиброз легких, фиброз почек или фиброз печени. В соответствии с одним из аспектов изобретения предложен способ улучшения функционирования легких у млекопитающего, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в таком улучшении. В соответствии с одним из аспектов изобретения у млекопитающего предварительно диагностирован фиброз легких. В соответствии с одним из аспектов изобретения соединения, раскрытые в данном описании, применяют в лечении идиопатического легочного фиброза (обычно интерстициальной пневмонии) у млекопитающего. В соответствии с одним из аспектов изобретения соединения, раскрытые в данном описании, применяют в лечении феномена Рейно. Феномен Рейно включает как болезнь Рейно (которую диагностируют в том случае, когда данный феномен является идиопатическим), так и синдром Рейно, когда данный феномен вызван некоторым другим инициирующим фактором. Согласно некоторым вариантам осуществления изобретения соединения, раскрытые в данном описании, применяют в лечении диффузных паренхиматозных интерстициальных заболеваний легких у млекопитающего, а именно ятрогенных заболеваний, вызванных применением лекарственных средств,заболеваний, вызванных производственными факторами риска или факторами окружающей среды (легкое фермера), гранулематозных заболеваний (саркоидоза, гиперсенситивного пневмонита), коллагенового сосудистого заболевания (склеродермии и других заболеваний), альвеолярного протеиноза, лангергансоклеточного гистиоцитоза, лимфангиолейомиоматоза, синдрома Хермански-Пудлака, туберозного склероза, нейрофиброматоза, болезней накопления, семейного интерстициального легочного заболевания. Согласно некоторым вариантам осуществления изобретения соединения, раскрытые в данном описании, применяют в лечении посттрансплантационного фиброза, ассоциированного с хроническим отторжением, у млекопитающего, а именно облитерирующего бронхиолита при трансплантации легкого. Согласно некоторым вариантам осуществления изобретения соединения, раскрытые в данном описании, используют в лечении фиброза кожи у млекопитающего, а именно кожной склеродермии, болезни Дюпюитрена, келоидоза. В соответствии с одним из аспектов изобретения соединения, раскрытые в данном описании, применяют в лечении фиброза печени с развитием или без развития цирроза печени у млекопитающего, а именно токсического/лекарственного фиброза печени (гемохроматоза), алкогольного заболевания печени, вирусного гепатита (гепатита, вызванного вирусом гепатита В, гепатита, вызванного вирусом гепатита С, ВГС), неалкогольного заболевания печени (NASH), метаболического и аутоиммунного (гепатита). В соответствии с одним из аспектов изобретения соединения, раскрытые в данном описании, применяют в лечении фиброза почек у млекопитающего, а именно тубулоинтерстициального фиброза, гломерулосклероза. Любой из вышеупомянутых аспектов изобретения, относящихся к лечению LPA-зависимых заболеваний или состояний, предполагает дополнительные варианты осуществления изобретения, включающие наряду с введением соединения, имеющего структуру, представленную формулой (I), введение по меньшей мере одного дополнительного агента. В различных вариантах осуществления изобретения каждый из агентов вводят в любом порядке, включая их одновременное введение. Согласно любому из вариантов осуществления изобретения, раскрытых в данном описании, млекопитающее представляет собой человека. Согласно некоторым вариантам осуществления изобретения соединения по изобретению вводят человеку. Согласно некоторым вариантам осуществления изобретения соединения по изобретению вводят перорально человеку. Согласно некоторым вариантам осуществления изобретения соединения по изобретению применяют в качестве антагонистов по меньшей мере одного из LPA-рецепторов. Согласно некоторым вариантам осуществления изобретения соединения по изобретению применяют для ингибирования активности по меньшей мере одного из LPA-рецепторов или для лечения заболевания или состояния, при которых ингибирование активности по меньшей мере одного из LPA-рецепторов могло бы дать положительный результат. В соответствии с одним из аспектов изобретения LPA-рецептор представляет собой LPA1. Согласно другим вариантам осуществления изобретения соединения по изобретению применяют для изготовления лекарства, предназначенного для ингибирования активности LPA1. Другие цели, признаки и преимущества соединений, способов и композиций, раскрытых в данном описании, будут понятны из следующего далее подробного описания изобретения. Однако следует понимать, что данное подробное описания и конкретные примеры, демонстрирующие конкретные варианты осуществления изобретения, приведены исключительно в качестве иллюстрации, и специалистам в данной области техники из приведенного подробного описания очевидно, что возможны различные изменения и модификации, не выходящие за пределы существа и объема настоящего изобретения. Краткое описание чертежей Фиг. 1. Типичные примеры соединений, описанных в данном документе. Фиг. 2. Типичные примеры соединений, описанных в данном документе. Фиг. 3. Типичные примеры соединений, описанных в данном документе. Фиг. 4. Типичные примеры соединений, описанных в данном документе. Фиг. 5. Типичные примеры соединений, описанных в данном документе. Подробное описание изобретения Лизофосфолипиды (такие как лизофосфатидная кислота (LPA воздействуют на основные клеточные функции, которые включают пролиферацию, дифференцировку, выживаемость, миграцию, адгезию,инвазию и морфогенез клеток. Данные функции оказывают влияние на многие биологические процессы,которые включают нейрогенез, ангиогенез, заживление ран, иммунитет и онкогенез.LPA оказывает аутокринное и паракринное действие через ряд специфических G-белоксопряженных рецепторов (GPCR). Связывание LPA со своими GPCR (LPA1, LPA2, LPA3, LPA4, LPA5,LPA6) активирует внутриклеточные сигнальные пути, что вызывает ряд ответных биологических реакций.LPA является биологической эффекторной молекулой и оказывает действие на целый ряд физиологических процессов, таких как, например, кровяное давление, активация тромбоцитов и сокращение гладких мышц, и на ряд клеточных процессов, включая клеточный рост, округление клеток, ретракцию неврита и образование актина стрессорного волокна и миграцию клеток. Действие LPA преимущественно опосредовано через рецептор. Активация LPA-рецепторов в результате действия LPA запускает, в свою очередь, ряд сигнальных каскадов. Конкретный путь передачи сигнала и его конечная реализация зависят от ряда переменных,которые включают используемый рецептор, тип клетки, уровень экспрессии рецептора или сигнального белка и концентрацию LPA. Почти все клетки млекопитающих, ткани и органы экспрессируют несколько подтипов LPA-рецепторов, этот факт указывает на то, что LPA-рецепторы участвуют в передаче сигнала совместно. LPA1, LPA2 и LPA3 имеют высокое сходство аминокислотных последовательностей.LPA регулирует многие важные функции фибробластов, имеющие отношение к заживлению ран,включая пролиферацию, миграцию, дифференцировку и сокращение. Пролиферация фибробластов необходима при заживлении ран для заполнения открытой раны. Напротив, фиброз характеризуется интенсивной пролиферацией и накоплением миофибробластов, которые активно синтезируют ВКМ (внеклеточный матрикс) и провоспалительные цитокины. LPA может либо увеличивать, либо подавлять пролиферацию тех типов клеток, которые являются важными для заживления ран. Повреждение ткани инициирует комплекс ответных реакций организма, направленных на заживление раны; в случае успеха ответные реакции организма приводят к восстановлению нормальной структуры и функции ткани. В случае неуспеха ответные реакции могут вызывать фиброз ткани и потерю ее функции. Ряд мышечных дистрофий характеризуется прогрессирующей слабостью и истощением мышц и обширным фиброзом. Показано, что обработка культуры миобластов с помощью LPA индуцирует значительную экспрессию фактора роста соединительной ткани (CTGF). CTGF, в свою очередь, индуцирует экспрессию коллагена, фибронектина и интегрина и индуцирует дедифференцировку обработанных миобластов. Обработка некоторых типов клеток с помощью LPA индуцирует воспроизводимый и высокий уровень экспрессии CTGF. CTGF представляет собой профиброзный цитокин, передающий сигнал дальше и действующий параллельно с TGF (трансформирующим фактором роста ).LPA и LPA1 играют ключевую роль в развитии патологического процесса при фиброзе легких. Активность хемоаттрактантов для фибробластов играет важную роль в легких пациентов, страдающих фиброзом легких. Профиброзное действие стимуляции рецептора LPA1 объясняется двумя событиями, LPA1 опосредованными проницаемостью сосудов и повышенным рекрутингом фибробластов, каждое из которых может быть характеризовано как профиброзное. LPA-LPA1-путь передачи сигнала участвует в опосредованной миграции фибробластов и проницаемости сосудов при IPF (интерстициальном легочном фиброзе). Конечный результат представляет собой процесс аберрантного заживления, который характеризует данное фиброзное состояние.LPA-LPA2-путь передачи сигнала вносит вклад в активацию TGFпути передачи сигнала при фиброзе легких. Согласно некоторым вариантам осуществления изобретения соединения, которые ингибируют LPA2, показывают эффективность в лечении фиброза легких. Согласно некоторым вариантам осуществления изобретения соединения, которые ингибируют как LPA1, так и LPA2, показывают более высокую эффективность в лечении фиброза легких по сравнению с соединениями, которые ингибируют только LPA1 или только LPA2.(LPA1 (-/- развитие почечного фиброза сильно замедлено. Развитие фиброза у мышей с односторонней обструкцией мочеточника (UUO; экспериментальная модель почечного фиброза), получавших в качестве лечения антагонист LPA-рецепторов Ki16425, очень сходно с развитие фиброза у мышей с рецепторомLPA вовлечена в заболевание печени и фиброз. У пациентов, страдающих гепатитом, и у животных с экспериментальной моделью травмы печени уровни LPA в плазме и аутотоксина в сыворотке повышены и коррелируют с уровнем фиброза. LPA также регулирует функцию клеток печени. Рецепторы LPA1 иLPA2 экспрессируются звездчатыми клетками печени мышей, и LPA стимулирует миграцию миофибробластов печени.LPA вовлечена в заживление ран при повреждении глаза. У здорового кролика рецепторы LPA1 иLPA3 обнаружены в эпителиальных клетках роговицы, кератоцитах и эндотелиальных клетках и после травмы экспрессия LPA1 и LPA3 в эпителиальных клетках роговицы повышена.LPA присутствует во внутриглазной жидкости и в жидкости слезных желез кролика, и данные уровни LPA повышены у кролика с экспериментальной моделью травмы роговицы.LPA индуцирует образование актина стрессорного волокна в эндотелиальных и эпителиальных клетках роговицы кролика и стимулирует сокращение фибробластов роговицы. LPA также стимулирует пролиферацию пигментированных эпителиальных клеток сетчатки человека.LPA вовлечена в инфаркт миокарда и фиброз сердца. У пациентов после инфаркта миокарда (ИМ) повышен уровень LPA в сыворотке, и LPA стимулирует пролиферацию фибробластов в тканях сердца крысы и продукцию коллагена данными клетками (фиброз). Уровень экспрессии рецепторов LPA1 иLPA3 в тканях сердца человека является высоким. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для лечения или предупреждения фиброза у млекопитающего. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для лечения или предупреждения фиброза органа или ткани у млекопитающего. Термины "фиброз" или "фиброзное расстройство" в контексте данного описания относятся к состояниям, которые ассоциированы с аномальным накоплением клеток, и/или фибронектина, и/или коллагена и/или повышенным рекрутингом фибробластов и включают, без ограничения, фиброз отдельных органов или тканей, таких как сердце, почка, печень, суставы, легкое, плевральная ткань, перитонеальная ткань, кожа, роговица, сетчатка, скелетно-мышечная ткань и желудочно-кишечный тракт. Типичные заболевания, расстройства или состояния, которые сопровождаются фиброзом, включают заболевания легких, ассоциированные с фиброзом, например идиопатический легочный фиброз, фиброз легких, вторичный к системному воспалительному заболеванию, такому как ревматоидный артрит,склеродермия, обыкновенная волчанка, криптогенный фиброзирующий альвеолит, лучевой фиброз, хроническое обструктивное заболевание легких (ХОЗЛ), склеродермию, хроническую астму, силикоз, фиброз легких или плевры, вызванный асбестом, острую травму легкого и острый респираторный дистресс(включая острый респираторный дистресс, вызванный бактериальной пневмонией, вызванный травмой,вызванный вирусной пневмонией, вентилятор-индуцированный, вызванный нелегочным сепсисом и вызванный аспирацией); хронические нефропатии, ассоциированные с травмой/фиброзом (почечным фиброзом), например гломерулонефрит, вторичный к системным воспалительным заболеваниям, таким как обыкновенная волчанка и склеродермия, диабет, гломерулярный нефрит, фокально-сегментарный гломерулосклероз, IgA-нефропатию, гипертензию, аллотрансплантат и синдром Альпорта; фиброз пищеварительного тракта, например склеродермию и лучевой фиброз пищеварительного тракта; фиброз печени,например цирроз печени, фиброз печени, вызванный употреблением алкоголя, неалкогольный стеатогепатит (NASH), повреждение желчных протоков, билиарный первичный цирроз печени, фиброз печени,вызванный вирусом или другой инфекцией (например, хронической ВГС-инфекцией), и аутоиммунный гепатит; фиброз головы и шеи, например лучевой; рубцевание роговицы, например вследствие ЛАСИК(лазерного кератомилеза), трансплантации роговицы и трабекулэктомии; гипертрофическое рубцевание и келоидоз, например вызванные ожогом или хирургическим вмешательством; и другие фиброзные заболевания, например саркоидоз, склеродермию, повреждение спинного мозга/фиброз, миелофиброз, рестеноз сосудов, атеросклероз, артериосклероз, гранулематоз Вегенера, смешанное заболевание соединительной ткани и болезнь Пейрони, но не ограничены ими. В соответствии с одним из аспектов изобретения терапия с использованием соединения формулы(I) может дать положительный результат при лечении млекопитающего, страдающего одним из следующих типичных заболеваний, расстройств или состояний, которые включают атеросклероз, тромбоз, заболевание сердца, васкулит, образование рубцовой ткани, рестеноз, флебит, ХОЗЛ (хроническое обструктивное заболевание легких), легочную гипертензию, фиброз легких, воспаление легких, спайки кишечника, фиброз мочевого пузыря и цистит, фиброз носовых ходов, синусит, воспаление, опосредованное нейтрофилами, и фиброз, опосредованный фибробластами, но не ограничены ими. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении дерматологических нарушений у млекопитающего. Дерматологические нарушения включают пролиферативные или воспалительные нарушения кожи, такие как атопический дерматит, буллезные нарушения,коллагенозы, псориаз, псориатические поражения, дерматит, контактный дерматит, экзема, крапивница,красные угри, заживление ран, рубцевание, гипертрофическое рубцевание, келоидоз, болезнь Кавасаки,синдром Шегрена-Ларссона, крапивница, но не ограничены ими.LPA высвобождается после повреждения ткани. LPA1 участвует в инициации невропатической боли. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении боли у млекопитающего. Согласно одному аспекту изобретения данная боль представляет собой острую боль или хроническую боль. Согласно другому аспекту изобретения данная боль представляет собой невропатическую боль. Согласно другому аспекту изобретения данная боль представляет собой боль, вызванную злокачественным новообразованием. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении фибромиалгии. Путь передачи сигнала через рецепторы лизофосфолипидов вовлечен в этиологию рака. Лизофосфатидная кислота (LPA) и ее G-белок, сопряженные рецепторы (GPCR) LPA1, LPA2 и/или LPA3 участвуют в развитии некоторых типов рака.LPA вносит вклад в онкогенез путем увеличения подвижности и инвазивности клеток. LPA вовлечена в стимулирование развития или прогрессирование рака яичника. LPA присутствует в значительной концентрации (2-80 мкМ) в асцитической жидкости у пациентов с раком яичника. Повышенная экспрессия LPA-рецепторов (LPA2 и LPA3) обнаружена в клетках рака яичника на фоне экспрессии LPAрецепторов в нормальных эпителиальных клетках на поверхности яичников. LPA также вовлечена в стимулирование развития или прогрессирования рака предстательной железы, рака молочной железы, меланомы, злокачественных новообразований головы и шеи, злокачественных новообразований толстой кишки (колоректального рака), рака щитовидной железы, глиобластомы и других типов рака.LPA-рецепторы опосредуют как миграцию, так и инвазию клеток рака поджелудочной железы ряда клеточных линий: Ki16425 и LPA1-специфичные siRNA (малые интерферирующие РНК) эффективно блокируют in vitro миграцию в ответ на LPA и перитонеальную (асцитическую) жидкость, взятую у пациентов с раком поджелудочной железы; кроме того, Ki16425 блокирует LPA-индуцированную и асцитиндуцированную инвазивную активность линии клеток рака поджелудочной железы с высокоэффективным перитонеальным метастазированием (Yamada et al., J. Biol. Chem., 279, 6595-6605, 2004). Линии клеток колоректальной карциномы характеризуются значительной экспрессией мРНК рецептора LPA1, кроме того, LPA индуцирует миграцию данных клеток и продукцию ангиогенных факторов. Сверхэкспрессия LPA-рецепторов играет роль в патогенезе рака щитовидной железы. Впервые LPA3 клонировали из клеток рака предстательной железы, что находится в соответствии со способностью LPA индуцировать аутокринную пролиферацию клеток рака предстательной железы.LPA играет стимулирующую роль в прогрессировании многих типов рака. LPA продуцируется линиями клеток рака предстательной железы и индуцирует пролиферацию данных клеток. LPA индуцирует через LPA1-путь передачи сигнала пролиферацию, миграцию и адгезию клеток карциномы толстой кишки человека клеточной линии DLD1, а также секрецию ангиогенных факторов данными клетками. В других линиях клеток карциномы толстой кишки человека (НТ 29 и WiDR) LPA повышает клеточную пролиферацию и секрецию ангиогенных факторов. В других линиях клеток рака толстой кишки активация рецепторов LPA2 и LPA3 вызывает клеточную пролиферацию. Рецептор LPA1 вовлечен в костный метастаз (Boucharaba et al., Proc. Natl. Acad. Sci USA, 103, 9643-9648, 2006). В соответствии с одним из аспектов изобретения соединение формулы (I) применяют в лечении рака. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении злокачественного и доброкачественного пролиферативного заболевания. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для предотвращения или уменьшения пролиферации опухолевых клеток, инвазии и метастаза карцином, мезотелиомы плевры или перитонеальной мезотелиомы, боли, вызванной злокачественным новообразованием, костных метастазов. Один из аспектов изобретения относится к способу лечения рака у млекопитающего, включающему введение млекопи-8 020139 тающему соединения формулы (I) и второго терапевтического агента, согласно которому второй терапевтический агент представляет собой противораковый агент. Согласно некоторым вариантам осуществления изобретения также используют рентгенотерапию. Данные типы рака включают солидные опухоли (такие как солидные опухоли мочевого пузыря,пищеварительного тракта, головного мозга, молочной железы, эндометрия, сердца, почки, легкого, лимфатической ткани (лимфома), яичника, поджелудочной железы или других эндокринных органов (щитовидной железы), предстательной железы, кожи (меланома или базально-клеточный рак или гематологические опухоли (такие как лейкоз) на любой стадии заболевания с метастазами или без метастазов, но не ограничены ими. В соответствии с одним из аспектов изобретения LPA вносит вклад в патогенез респираторных заболеваний. Провоспалительные действия LPA включают дегрануляцию тучных клеток, сокращение гладкомышечных клеток и высвобождение цитокинов из дендритных клеток. LPA индуцирует секрециюIL-8 бронхиальными эпителиальными клетками человека. IL-8 найден в повышенной концентрации в пробах жидкости, взятых для анализа с использованием БАЛ (бронхоальвеолярного лаважа) у пациентов,страдающих астмой, хроническим обструктивным заболеванием легких, легочным саркоидозом и синдромом острой дыхательной недостаточности, также показано, что IL-8 усиливает воспаление дыхательных путей и ремоделирование дыхательных путей у астматиков. Показано, что рецепторы LPA1, LPA2 иLPA3 вносят вклад в LPA-индуцированную продукцию IL-8. Введение LPA in vivo индуцирует гиперчувствительность дыхательных путей, расчесывание в ответ на зуд, инфильтрацию и активацию эозинофилов и нейтрофилов, ремоделирование сосудов и ноцицептивные флексорные ответы. LPA также индуцирует высвобождение гистаминов мышиными и крысиными тучными клетками. В соответствии с одним из аспектов изобретения действие LPA опосредовано через LPA1 и/или LPA3. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении различных аллергических нарушений у млекопитающего. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении респираторных заболеваний, расстройств или состояний у млекопитающего. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении астмы у млекопитающего. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют в лечении хронической астмы у млекопитающего. Термин " респираторное заболевание " в контексте данного описания относится к заболеваниям,поражающим органы, которые вовлечены в процесс дыхания, такие как нос, горло, гортань, евстахиевы трубы, трахея, бронхи, легкие, соответствующие мышцы (например, диафрагма и межреберные мышцы) и нервы. Респираторные заболевания включают астму, респираторный дистресс-синдром у взрослых и аллергическую (экзогенную) астму, неаллергическую (эндогенную) астму, острую тяжелую астму, хроническую астму, клиническую астму (clinical asthma), ночную астму, астму, вызванную аллергеном, аспириновую астму, астму физического усилия, изокапническую гипервентиляцию, астму с началом в детском возрасте, астму с началом в зрелом возрасте, кашлевой вариант астмы, профессиональную астму,стероид-резистентную астму, сезонную астму, сезонный аллергический ринит, круглогодичный аллергический ринит, хроническое обструктивное заболевание легких, включая хронический бронхит или эмфизему, легочную гипертензию, интерстициальный фиброз легких и/или воспаление дыхательных путей,кистозный фиброз и гипоксию, но не ограничены ими. В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для лечения или предупреждения хронического обструктивного заболевания легких у млекопитающего, включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). Кроме того, хроническое обструктивное заболевание легких включает, без ограничения, хронический бронхит или эмфизему, легочную гипертензию, интерстициальный фиброз легких и/или воспаление дыхательных путей и кистозный фиброз. Нервная система является основным локусом экспрессии LPA1. В соответствии с одним из аспектов изобретения предложено соединение формулы (I) для применения в лечении или предупреждении расстройства нервной системы у млекопитающего. Термин "расстройство нервной системы" в контексте данного описания включает, без ограничения, болезнь Альцгеймера, отек мозга, церебральную ишемию,инсульт, рассеянный склероз, невропатии, болезнь Паркинсона, рассеянный склероз, ишемию сетчатки,послеоперационную когнитивную дисфункцию,мигрень,периферическую невропатию/невропатическую боль, повреждение спинного мозга, отек мозга и травму головы. Ангиогенез, образование новой сети капилляров из уже существующей сосудистой сети, в норме связан с заживлением ран, тканевым ростом и миокардиальным ангиогенезом после ишемического повреждения. Пептидные факторы роста и лизофосфолипиды контролируют координированную пролиферацию, миграцию, адгезию, дифференцировку и сборку эндотелиальных клеток сосудов (VEC) и окружающих гладкомышечных клеток сосудов (VSMC). В соответствии с одним из аспектов изобретения дисрегуляция процессов, которые опосредуют ангиогенез, приводит к развитию атеросклероза, гипертензии, опухолевому росту, к развитию ревматоидного артрита и диабетической ретинопатии. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для лечения или предупреждения сердечно-сосудистого заболевания у млекопитающего, включая, без ограничения,-9 020139 аритмию (предсердную, или желудочковую, или обе); атеросклероз и его осложнения; стенокардию; нарушения сердечного ритма; ишемию миокарда; инфаркт миокарда; аневризму сердца или сосудов; васкулит, инсульт; периферическую обструктивную артериопатию конечности, органа или ткани; реперфузионное повреждение после ишемии головного мозга, сердца, почки или другого органа или ткани; эндотоксический, хирургический или травматический шок; гипертензию, порок клапана сердца, сердечную недостаточность, аномальное кровяное давление; шок; вазоконстрикцию (включая вазоконстрикцию,ассоциированную с мигренью); сосудистое нарушение, воспаление, недостаточность, ограниченные одним органом или тканью. В соответствии с одним из аспектов данного изобретения предложены способы предупреждения или лечения вазоконстрикции, атеросклероза и его осложнений, ишемии миокарда, инфаркта миокарда,аневризмы аорты, васкулита и инсульта, включающие по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I) или фармацевтической композиции или лекарства, которые включают соединение формулы (I). Согласно некоторым вариантам осуществления данного изобретения предложены способы предупреждения или лечения феномена Рейно. В соответствии с одним из аспектов данного изобретения предложены способы уменьшения реперфузионного повреждения сердца после ишемии миокарда и/или эндотоксического шока, включающие по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов данного изобретения предложены способы уменьшения сужения кровеносных сосудов у млекопитающего, включающие по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов данного изобретения предложены способы снижения или предупреждения повышения кровяного давления у млекопитающего, включающие по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I).LPA ассоциирована с различными воспалительными/иммунологическими заболеваниями. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для лечения или предупреждения воспаления у млекопитающего. В соответствии с одним из аспектов изобретения антагонисты рецепторов LPA1 и/или LPA3 применяют для лечения или предупреждения воспалительных/иммунологических нарушений у млекопитающего. Примеры воспалительных/иммунологических нарушений включают псориаз, ревматоидный артрит,васкулит, воспалительное заболевание кишечника, дерматит, остеоартрит, астму, миозит, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, экзему, аллогенную или ксеногенную трансплантацию (органа, костного мозга, стволовых клеток и других клеток и тканей), отторжение трансплантата, реакцию "трансплантат против хозяина", красную волчанку, воспалительное заболевание, диабет 1 го типа, фиброз легких, дерматомиозит, синдром Шегрена, тиреоидит (например, тиреоидит Хашимото и аутоиммунный тиреоидит), злокачественную миастению, аутоиммунную гемолитическую анемию, рассеянный склероз, кистозный фиброз, хронический рецидивирующий гепатит, билиарный первичный цирроз печени, аллергический конъюнктивит и атопический дерматит. Один из аспектов изобретения относится к способам лечения, предупреждения, преломления тенденции, остановки или замедления прогрессирования клинически выраженных LPA-зависимых или LPAопосредованных заболеваний или состояний или лечения симптомов, ассоциированных с LPAзависимыми или LPA-опосредованными заболеваниями или состояниями или относящихся к ним, путем введения млекопитающему соединения формулы (I). Согласно некоторым вариантам осуществления изобретения во время введения субъект уже имеет LPA-зависимое или LPA-опосредованное заболевание или состояние или подвержен риску развития LPA-зависимого или LPA-опосредованного заболевания или состояния. Некоторые аспекты изобретения относятся к способам предупреждения или лечения рекрутинга эозинофилов, и/или базофилов, и/или дендритных клеток, и/или нейтрофилов, и/или моноцитов, и/или Тклеток, включающим по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). Некоторые аспекты изобретения относится к способам лечения цистита, в том числе, например, интерстициального цистита, включающим по меньшей мере однократное введение млекопитающему терапевтически эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов изобретения способы, описанные в данном документе, включают установление диагноза или установление факта, имеется или нет у пациента LPA-зависимое илиLPA-опосредованное заболевание или состояние, путем введения субъекту терапевтически эффективного количества соединения формулы (I) и определения, присутствует или нет положительный результат в ответ на данное лечение. В соответствии с одним из аспектов данного изобретения предложены соединения формулы (I),фармацевтически приемлемые соли, фармацевтически приемлемые пролекарства и фармацевтически приемлемые сольваты данных соединений, которые являются антагонистами по меньшей мере одного изLPA-рецепторов (например, рецептора LPA1, LPA2, LPA3), и применение указанных соединений, солей,пролекарств и сольватов в лечении пациентов, имеющих одно или более чем одно LPA-зависимое илиLPA-опосредованное состояние или заболевание, включая, без ограничения, фиброз легких, почечный фиброз, фиброз печени, рубцевание, астму, ринит, хроническое обструктивное заболевание легких, легочную гипертензию, интерстициальный фиброз легких, артрит, аллергию, псориаз, воспалительное заболевание кишечника, респираторный дистресс-синдром у взрослых, инфаркт миокарда, аневризму, инсульт, рак, боль, пролиферативные нарушения и воспалительные состояния. Согласно некоторым вариантам осуществления изобретения LPA-зависимые состояния или заболевания включают состояния или заболевания, при которых присутствует и/или наблюдается абсолютный или относительный избытокLPA. В соответствии с любым из вышеупомянутых аспектов изобретения LPA-зависимые или LPAопосредованные заболевания или состояния включают, без ограничения, фиброз органов, астму, аллергические нарушения, хроническое обструктивное заболевание легких, легочную гипертензию, фиброз легких или плевры, перитонеальный фиброз, артрит, аллергию, рак, сердечно-сосудистое заболевание,респираторный дистресс-синдром у взрослых, инфаркт миокарда, аневризму, инсульт и рак. В соответствии с одним из аспектов изобретения соединения формулы (I) применяют для улучшения чувствительности роговицы, сниженной в результате операций на роговице, таких как лазерный кератомилез (ЛАСИК), или в результате удаления катаракты, для улучшения чувствительности роговицы,сниженной в результате дегенерации роговицы, и для лечения симптома сухого глаза, вызванного теми же причинами. В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для лечения или предупреждения воспалительного заболевания глаз и аллергического конъюнктивита, весеннего кератоконъюнктивита и папиллярного конъюнктивита у млекопитающего,включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для лечения или предупреждения болезни Шегрена или воспалительного заболевания, сопровождающегося сухостью глаз, у млекопитающего, включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов изобретения LPA и LPA-рецепторы (например, LPA1) вовлечены в патогенез остеоартрита. В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для лечения или предупреждения остеоартрита у млекопитающего,включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов изобретения LPA-рецепторы (например, LPA1, LPA3) вносят вклад в патогенез ревматоидного артрита. В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для лечения или предупреждения ревматоидного артрита у млекопитающего, включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). В соответствии с одним из аспектов изобретения LPA-рецепторы (например, LPA1) вносят вклад в липогенез. В соответствии с одним из аспектов данного изобретения предложено применение соединений формулы (I) для стимулирования образования жировой ткани у млекопитающего, включающее по меньшей мере однократное введение млекопитающему эффективного количества по меньшей мере одного соединения формулы (I). Соединения В соответствии с одним из аспектов данного изобретения предложено соединение, имеющее структуру, представленную формулой (I), или его фармацевтически приемлемая сольCY представляет собой замещенный или незамещенный С 3-С 6-циклоалкил или замещенный или незамещенный фенил при условии, что, когда CY является замещенным, CY имеет в качестве заместителейR10 представляет собой C1-C6-алкил или незамещенный фенил; каждый из RA, RB и RC независимо выбран из Cl, Br, -CN, -ОН, C1-C4-алкила, C1-C4-фторалкила иn имеет значение 1, 2 или 3; р имеет значение 0. Во всех без исключения вариантах осуществления изобретения заместители выбраны из подмножества перечисленных выше заместителей. Например, согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н или -CO2(RD). Согласно некоторым вариантам осуществления изобретения RD представляет собой H, -CH3 или -CH2CH3. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -C(=O)NHSO2R10. Согласно некоторым вариантам осуществления изобретения R1 представляет собой биоизостер карбоновой кислоты. Согласно некоторым вариантам осуществления изобретения R3 представляет собой H илиC1-C4-алкил. Согласно некоторым вариантам осуществления изобретения R3 представляет собойC1-C4-алкил. Согласно некоторым вариантам осуществления изобретения R3 представляет собой H, -CH3 или -CH2CH3. Согласно некоторым вариантам осуществления изобретения R3 представляет собой -CH3 или -CH2CH3. Согласно некоторым вариантам осуществления изобретения R3 представляет собой -CH3. Согласно некоторым вариантам осуществления изобретения R3 представляет собой H. Согласно некоторым вариантам осуществления изобретения R7 представляет собой H. Согласно некоторым вариантам осуществления изобретения R8 представляет собой H, C1-C4-алкил. Согласно некоторым вариантам осуществления изобретения R8 представляет собой H. Согласно некоторым вариантам осуществления изобретения R8 представляет собой H или -CH3. Согласно некоторым вариантам осуществления изобретения R8 представляет собой -CH3. Согласно некоторым вариантам осуществления изобретения R8 представляет собой -CH2CH3. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н, -CO2RD,-C(=O)NHSO2R10 или тетразолил; R3 представляет собой C1-C4-алкил; R7 представляет собой H; R8 представляет собой H, -CH3; R10 представляет собой C1-C6-алкил или незамещенный фенил; каждый RA независимо выбран из Cl, Br, -OH, -CH3, -CF3 и -OCH3; каждый RB независимо выбран из Cl, Br, -ОН, -CH3,-CF3 и -OCH3; каждый RC независимо выбран из Cl, Br, -ОН, -CH3, -CF3 и -OCH3; m имеет значение 0 или 1; n имеет значение 1, 2 или 3; р имеет значение 0. Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н или-CO2RD; RD представляет собой H, -CH3 или -CH2CH3; R3 представляет собой -CH3 или -CH2CH3; R4 представляет собой -NHC(=O)OCH(R8)-CY; R8 представляет собой H или -CH3; CY представляет собой замещенный или незамещенный фенил при условии, что, когда CY представляет собой замещенный фенил,данный фенил имеет в качестве заместителей 1 или 2 RC. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет следующую структуру: Согласно некоторым вариантам осуществления изобретенияCY представляет собой замещенный или незамещенный фенил при условии, что, когда CY представляет собой замещенный фенил, данный фенил имеет в качестве заместителей 1 или 2 RC;n имеет значение 1. Согласно некоторым вариантам осуществления изобретения CY представляет собой незамещенный фенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-хлорфенил, 2,6-дихлорфенил, 2-бромфенил, 3-бромфенил, 2,4-дихлорфенил, 2-метоксифенил,3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил,2-метилфенил, 3-метилфенил, 4-метилфенил, 2-цианофенил, 3-цианофенил или 4-цианофенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-хлорфенил, 2,6-дихлорфенил, 2-бромфенил, 3-бромфенил, 2,4-дихлорфенил, 2-гидроксифенил,3-гидроксифенил, 4-гидроксифенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил, 4-трифторметилфенил, 2-метилфенил, 3-метилфенил, 4-метилфенил,- 12020139 2-цианофенил, 3-цианофенил или 4-цианофенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-хлорфенил, 2,6-дихлорфенил, 2,4-дихлорфенил, 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил,2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 2-трифторметилфенил, 3-трифторметилфенил,4-трифторметилфенил, 2-фтор-4-метоксифенил, 2-метилфенил, 3-метилфенил или 4-метилфенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-хлорфенил, 3-хлорфенил, 2-метилфенил, 3-метилфенил, 2-трифторметилфенил или 3-трифторметилфенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил,2-гидроксифенил, 3-гидроксифенил или 4-гидроксифенил. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет следующую структуру: Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет одну из следующих структур: Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н; CY представляет собой фенил,2-хлорфенил,3-хлорфенил,2-метилфенил,3-метилфенил,2-трифторметилфенил или 3-трифторметилфенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой С 3-С 6-циклоалкил, замещенный или незамещенный фенил при условии, что, когда CY является замещенным, CY имеет в качестве заместителей RC; RC представляет собой Cl, -CH3 или CF3. Согласно некоторым вариантам осуществления изобретения CY представляет собой С 3-С 6-циклоалкил. Согласно некоторым вариантам осуществления изобретения R4 представляет собой-NHC(=O)OCH(R8)-CY. Согласно некоторым вариантам осуществления изобретения R4 представляет собой-NHC(=O)OCH2-(циклопропил),-NHC(=O)OCH(CH3)-(циклопропил),-NHC(=O)OCH2(замещенный или незамещенный фенил) или -NHC(=O)OCH(CH3)-(замещенный или незамещенный фенил) при условии, что, когда CY является замещенным, CY имеет в качестве заместителей RC; RC представляет собой Cl, -CH3 или CF3. Согласно некоторым вариантам осуществления изобретения R4 представляет собой -NHC(=O)OCH(CH3)-(циклопропил). Согласно некоторым вариантам осуществления изобретения R4 представляет собой -NHC(=O)OCH(CH3)-(фенил). Согласно некоторым вариантам осуществления изобретения CY представляет собой циклопропил,циклобутил, циклопентил, циклогексил, незамещенный пентенил, незамещенный циклогексенил или замещенный или незамещенный фенил при условии, что, когда CY является замещенным, CY имеет в качестве заместителей RC; RC представляет собой Cl, -CH3 или CF3. Согласно некоторым вариантам осуществления изобретения CY представляет собой замещенный или незамещенный фенил при условии,что, когда CY представляет собой замещенный фенил, данный замещенный фенил имеет в качестве заместителей RC; RC представляет собой Cl, -CH3 или CF3. Согласно некоторым вариантам осуществления изобретения CY представляет собой циклопропил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой замещенный или незамещенный фенил при условии, что, когда CY является замещенным, каждый из заместителей наCY представляет собой H или RC; каждый RC независимо выбран из Н, C1-C4-алкила, C1-C4-фторалкила,C1-C4-алкокси. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl, -CH3, -CF3, -OCH3. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил или 2-хлорфенил. Согласно некоторым вариантам осуществления изобретения CY представляет собой фенил. Согласно некоторым вариантам осуществления изобретения RC представляет собой H, Cl, -CH3 или CF3. Согласно некоторым вариантам осуществления изобретения CY является незамещенным или является однозамещенным и имеет в качестве заместителя RC.- 13020139 Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R8 представляет собой -CH3 или -CF3. Согласно некоторым вариантам осуществления изобретения R8 представляет собой -CH3. Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R4 представляет собой Согласно некоторым вариантам осуществления изобретения R10 представляет собой C1-C6-алкил или незамещенный фенил. Согласно некоторым вариантам осуществления изобретения R10 представляет собой C1-C6-алкил. Согласно некоторым вариантам осуществления изобретения R10 представляет собой-CH3 или -CH2CH3. Согласно некоторым вариантам осуществления изобретения R10 представляет собой незамещенный фенил. Согласно некоторым вариантам осуществления изобретения R10 представляет собой C1-C4-алкил или фенил. Согласно некоторым вариантам осуществления изобретения каждый RA независимо выбран из Cl,Br, -CH3, -CF3, -ОН и -OCH3. Согласно некоторым вариантам осуществления изобретения каждый RA независимо выбран из Cl, -CH3, -CF3, -ОН и -OCH3. Согласно некоторым вариантам осуществления изобретения каждый RA независимо выбран из Cl, -CH3, -CF3 и -ОН. Согласно некоторым вариантам осуществления изобретения каждый RA независимо выбран из Cl, -CH3 и -ОН. Согласно некоторым вариантам осуществления изобретения каждый RB независимо выбран из Cl,Br, -CH3, -CF3, -ОН и -OCH3. Согласно некоторым вариантам осуществления изобретения каждый RB независимо выбран из Cl, -CH3, -CF3 и -ОН. Согласно некоторым вариантам осуществления изобретения каждый RB независимо выбран из Cl, -CH3 и -ОН. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl,Br, I, -CH3, -CF3, -ОН и -OCH3. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl, -CH3, -CF3, -ОН и -OCH3. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl, -CH3, -CF3 и -ОН. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl, -CH3 и -CF3. Согласно некоторым вариантам осуществления изобретения каждый RC независимо выбран из Cl и -ОН. Согласно некоторым вариантам осуществления изобретения m имеет значение 0 или 1. Согласно некоторым вариантам осуществления изобретения m имеет значение 0. Согласно некоторым вариантам осуществления изобретения m имеет значение 1. Согласно некоторым вариантам осуществления изобретения n имеет значение 1, 2 или 3. Согласно некоторым вариантам осуществления изобретения n имеет значение 1. Согласно некоторым вариантам осуществления изобретения n имеет значение 2. Согласно некоторым вариантам осуществления изобретения n имеет значение 3. Согласно некоторым вариантам осуществления изобретения соединение формулы (I) имеет одну из следующих структур: Согласно некоторым вариантам осуществления изобретения R1 представляет собой -СО 2 Н; m имеет значение 0; р имеет значение 0; n имеет значение 1; CY представляет собой фенил. Согласно некоторым вариантам осуществления изобретения R8 представляет собой -CH3; n имеет значение 1; CY представляет собой фенил. Согласно некоторым вариантам осуществления изобретения CY является таким, как описано в табл. 1 и/или 2. В данном описании предполагается, что могут быть использованы любые комбинации групп, указанных выше в определениях различных переменных. Специалисту в данной области техники понятно,что группы и их заместители, указанные в данном описании, выбраны таким образом, чтобы группировки и соединения являлись стабильными. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) включают, но не ограничены ими, соединения, приведенные в табл. 1 и 2 и на фиг. 1-5. Представляют собой отдельные стереоизомеры; абсолютная конфигурация не определена.Данные масс-спектрометрии. Синтез соединений. Соединения формулы (I), описанные в данном документе, синтезированы с использованием стандартных методик синтеза или с использованием методик, известных в данной области техники, в комбинации с методиками, приведенными в данном описании. Кроме того, растворители, температура и другие условия реакции, приведенные в данном описании, могут быть изменены. Исходные вещества, использованные для синтеза соединений формулы (I), либо синтезированы,либо имеются в продаже и получены от таких производителей, как, например, Sigma-Aldrich, Fluka,Acros Organics, Alfa Aesar и т.п. Общие методики получения соединений могут быть модифицированы путем использования подходящих реагентов и условий для введения различных группировок, присутствующих в структурных формулах соединений, как предложено в данном описании. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) получают с использованием методик, описанных ниже. Схема 1 В соответствии с одним из аспектов изобретения синтез соединений формулы (I) начинают с взаимодействия алкил ацетоацетата с метиламином с получением соединения, имеющего структуру, представленную формулой II. Соединения, имеющие структуру, представленную формулой II, подвергают взаимодействию с замещенным или незамещенным хлористым 4-галогенбензоилом (имеющим структуру, представленную формулой III) с получением соединений, имеющих структуру, представленную формулой IV. В результате обработки соединений, имеющих структуру, представленную формулой IV, гидроксиламином и уксусной кислотой, получают изоксазолы, имеющие структуру, представленную формулой V. Гидролиз сложноэфирной группы изоксазолов, имеющих структуру, представленную форму- 17020139 лой V, приводит к получению карбоновых кислот, имеющих структуру, представленную формулой VI. В результате перегруппировки Курциуса из карбоновых кислот, имеющих структуру, представленную формулой VI, в присутствии гидроксисоединений, имеющих структуру, представленную формулой VI,получают карбаматные соединения, имеющие структуру, представленную формулой VII. Схема 2 Согласно некоторым вариантам осуществления изобретения соединения, имеющие структуру,представленную формулой X, получают с использованием реакции Сузуки между соединениями, имеющими структуру, представленную формулой VII, и соединениями, имеющими структуру, представленную формулой VIII. Согласно некоторым вариантам осуществления изобретения реакцию Сузуки проводят в присутствии палладиевого катализатора, такого как Pd(PPh3)4 или Pd(dppf)Cl2. Согласно некоторым вариантам осуществления изобретения реакцию Сузуки проводят с использованием основания, такого как K2CO3. Соединения, имеющие структуру, представленную формулой X, могут быть получены с использованием других известных реакций сочетания с участием металлсодержащих катализаторов. Схема 3 Согласно некоторым вариантам осуществления изобретения соединения, имеющие структуру,представленную формулой VII, подвергают взаимодействию с борилирующим агентом, с использованием в качестве катализатора переходного металла, с получением боронатных соединений, имеющих структуру, представленную формулой IX. Согласно некоторым вариантам осуществления изобретения реакцию борилирования с получением соединений IX проводят с использованием палладиевого катализатора, такого как Pd(PPh3)4 или Pd(dppf)Cl2, в присутствии подходящего основания, такого как ацетат калия. Боронатные соединения, имеющие структуру, представленную формулой IX, подвергают взаимодействию с соединениями, имеющими структуру, представленную формулой XII, с использованием реакции сочетания, катализируемой палладием (в условиях реакции Сузуки), с получением соединений,имеющих структуру, представленную формулой XIII. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) получают, как описано на схеме 4. Схема 4 Согласно некоторым вариантам осуществления изобретения бифенильные соединения, имеющие структуру, представленную формулой XIV, превращают в полициклические соединения в соответствии с методикой, приведенной на схеме 4. Бифенильные соединения, имеющие структуру, представленную формулой XIV, обрабатывают дигалогеналкильным соединением, таким как 1,2-дибромэтан, с получением циклоалкильной группы. Цианогруппу гидролизируют с получением кислоты и затем данную кислоту превращают в сложный эфир с получением трициклических соединений, имеющих структуру, представленную формулой XV. Согласно некоторым вариантам осуществления изобретения RD представляет собой этил. Согласно некоторым вариантам осуществления изобретения RD представляет собой изопропил. Затем трициклические соединения, имеющие структуру, представленную формулой XV, обрабатывают ацетилхлоридом в присутствии подходящей кислоты Льюиса, затем ацетильную группу превращают в карбоксильную и полученную карбоновую кислоту обрабатывают тионилхлоридом с получением хлорангидридов, имеющих структуру, представленную формулой XVI. Затем хлорангидриды, имеющие структуру, представленную формулой XVI, используют для получения изоксазолов, имеющих структуру, представленную формулой XVII, в соответствии с методикой, приведенной на схеме 1. Согласно некоторым вариантам осуществления изобретения R представляет собой алкильную группу. Согласно некоторым вариантам осуществления изобретения R представляет собой метил, в этом случае у изоксазолов, имеющих структуру, представленную формулой XVII, R удаляют путем гидролиза. Согласно некоторым вариантам осуществления изобретения R представляет собой бензил, в этом случае у изоксазолов,имеющих структуру, представленную формулой XVII, R удаляют путем гидрогенизации (например, с использованием Н 2, Pd/C). В результате перегруппировки Курциуса из карбоновых кислот, имеющих структуру, представленную формулой XVIII, в присутствии гидроксисоединений CY-CH(R8)-OH получают карбаматные соединения, имеющие структуру, представленную формулой X. В соответствии с одним из аспектов изобретения соединения формулы (I) получают с использованием методик, описанных в примерах. Дополнительные формы соединений. В соответствии с одним из аспектов изобретения соединения формулы (I) имеют один или более чем один стереоцентр, и каждый стереоцентр существует независимо в R- или S-конфигурации. Соединения, представленные в данном описании, включают все диастереоизомерные и энантиомерные формы соединений. Стереоизомеры получают, при желании, с использованием таких методик, как стереоселективный синтез и/или разделение стереоизомеров на колонках для хиральной хроматографии. Способы и препараты, описанные в данном документе, включают использование соединений, имеющих структуру, представленную формулой (I), в виде N-оксидов (при необходимости), в кристаллических формах (также известных как полиморфы), в аморфном состоянии и/или в виде фармацевтически приемлемых солей, а также использование метаболитов и активных метаболитов указанных соединений,имеющих тот же тип активности. В некоторых случаях соединения могут существовать в виде таутомеров. Соединения, представленные в данном описании, включают все таутомерные формы соединений. Согласно конкретным вариантам осуществления изобретения соединения, описанные в данном документе, существуют в форме сольватов, образованных с фармацевтически приемлемыми растворителями,такими как вода, этанол и т.п. Согласно другим вариантам осуществления изобретения соединения, описанные в данном документе, существуют в несольватированной форме. Согласно некоторым вариантам осуществления изобретения соединения, описанные в данном документе, получают в виде пролекарств. Термин "пролекарство" относится к агенту, который in vivo превращается в исходное лекарство. Согласно некоторым вариантам осуществления изобретения после invivo введения пролекарство превращается в биологически, фармацевтически или терапевтически активную форму соединения в результате химических реакций. Согласно некоторым вариантам осуществления изобретения пролекарство превращается в биологически, фармацевтически или терапевтически активную форму соединения в результате метаболических ферментативных одностадийных или многостадийных реакций или процессов. Согласно некоторым вариантам осуществления изобретения сайты ароматической структуры соединений формулы (I) являются чувствительными к различным метаболическим реакциям. Введение подходящих заместителей в структуру ароматического кольца может уменьшить, минимизировать или исключить данное метаболическое превращение. Согласно конкретным вариантам осуществления изобретения в качестве заместителей, подходящих для уменьшения или исключения чувствительности ароматического кольца к различным метаболическим реакциям, могут быть использованы, например, дейтерий, атом галогена или алкильная группа. Согласно другому варианту осуществления изобретения соединения, описанные в данном документе, метят с помощью изотопов или другими способами, включая, без ограничения, использование хромофоров или флуоресцентных группировок, биолюминесцентных меток или хемилюминесцентных меток. В соответствии с одним из аспектов изобретения замещение изотопами, такими как дейтерий, позволяет получить некоторые терапевтические преимущества, являющиеся следствием более высокой метаболической стабильности, такие как, например, увеличение in vivo времени полужизни или умень- 19020139"Фармацевтически приемлемый" в контексте данного описания относится к веществу, такому как носитель или разбавитель, которое не аннулирует биологическую активность или свойства соединения и является относительно нетоксичным, - данное вещество может быть введено индивидууму и при этом не оказывает нежелательное биологическое действие или не взаимодействует нежелательным образом ни с одним из компонентов композиции, в состав которой оно входит. Согласно некоторым вариантам осуществления изобретения фармацевтически приемлемые соли получают в результате взаимодействия соединения формулы (I) с кислотой. Фармацевтически приемлемые соли также получают в результате взаимодействия соединения формулы (I) с основанием, которое может образовывать соль. Соединения, описанные в данном документе, могут быть получены и/или использованы в виде фармацевтически приемлемых солей. Типы фармацевтически приемлемых солей включают (1) соли присоединения кислот, образованные путем взаимодействия соединения в форме свободного основания с фармацевтически приемлемой неорганической кислотой (например, с соляной, бромистоводородной,серной, фосфорной и подобными кислотами) или с органической кислотой (например, уксусной, пропионовой, гликолевой, пировиноградной, молочной, малоновой, янтарной, яблочной, малеиновой, фумаровой, трифторуксусной, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой,этансульфоновой, 1,2-этандисульфоновой, 2-гидроксиэтансульфоновой, бензолсульфоновой, толуолсульфоновой, 2-нафталинсульфоновой, салициловой, стеариновой, муконовой, масляной, фенилуксусной, фенилмасляной, вальпроевой и подобными кислотами); (2) соли, образованные путем замещения кислого протона, присутствующего в исходном соединении, ионом металла, например ионом щелочного металла (например, ионом лития, натрия, калия), ионом щелочно-земельного металла (например, ионом магния или кальция) или ионом алюминия; но не ограничены указанными типами. В некоторых случаях соединения, описанные в данном документе, могут образовывать координационные связи с органическим основанием, таким как (без ограничения) этаноламин, диэтаноламин, триэтаноламин, трометамин,N-метилглюкамин, дициклогексиламин, трис-(гидроксиметил)метиламин. В других случаях соединения,описанные в данном документе, могут образовывать соли с аминокислотами, такими как (без ограничения) аргинин, лизин и т.п. Приемлемые неорганические основания, которые используют для получения солей с соединениями, содержащими кислый протон, включают (без ограничения) гидроксид алюминия,гидроксид кальция, гидроксид калия, карбонат натрия, гидроксид натрия и т.п. Согласно некоторым вариантам осуществления изобретения получают натриевую соль соединения формулы (I). Следует понимать, что ссылка на фармацевтически приемлемую соль включает формы, образованные в результате присоединения растворителя, или кристаллические формы указанной соли, в особенности сольваты или полиморфы. Сольваты содержат либо стехиометрическое, либо нестехиометрическое количество растворителя и могут быть образованы в процессе кристаллизации с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Когда в качестве растворителя используется вода, образуются гидраты, когда растворителем является спирт, образуются алкоголяты. Кроме того, соединения, предложенные в данном изобретении, могут существовать как в несольватированных, так и сольватированных формах. В общем случае соединения и способы, предложенные в данном изобретении, включают сольватированные формы и несольватированные формы как эквивалентные. Соединения, описанные в данном документе, такие как соединения формулы (I), могут присутствовать в различных формах, включая (без ограничения) аморфные формы, измельченные формы и наночастицы. Кроме того, соединения, описанные в данном документе, включают кристаллические формы соединения, также называемые полиморфами. Полиморфы включают различные кристаллические структуры соединения, имеющего один и тот же элементный состав. Терминология. Если не указано иное, следующие термины, использованные в данном документе, в том числе в описании изобретения и формуле изобретения, имеют определения, приведенные ниже. Следует отметить, что в контексте описания изобретения и прилагаемой формулы изобретения формы единственного числа существительного включают формы множественного числа данного существительного, если из контекста явно не следует иное. Если не указано иное, использованы стандартные методики массспектроскопии, ЯМР, ЖХВД, химии белка, биохимии, методы рекомбинантных ДНК и фармакологии. В данном описании использование "или" или "и" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других его форм, таких как "включают", "включает" и "включенный", не указывает на ограничение. Заголовки разделов, использованные в данном описании, служат только для структуризации текста и не должны быть истолкованы как ограничение описанных объектов изобретения. Термин "алкил" относится к алифатическому углеводороду. Алкил может быть насыщенным или ненасыщенным. Алкил, насыщенный или ненасыщенный, представляет собой алкил с разветвленной или нормальной цепью. Типичные алкильные группы включают, без ограничения, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, неопентил, гексил, аллил, бут-2-енил,бут-3-енил и т.п. Термин "алкоксигруппа" относится к группе (алкил)О-, где алкил является таким, как определено в данном описании. Термин "циклоалкил" относится к циклопропилу, циклопропенилу, циклобутилу, циклобутенилу,циклопентилу, циклопентенилу, циклогексилу или циклогексенилу. Термин "галоген" или, альтернативно, "атом галогена" или "галогенид" означает атом фтора, хлора,брома или йода. Термин "фторалкил" относится к алкилу, у которого один или более чем один атом водорода заменен атомом фтора. Термин "гетероалкил" относится к алкильной группе, у которой один или более чем один скелетный атом алкила выбран из атомов, отличных от атома углерода, например из атома кислорода, азота(например, в виде NH или N-алкила), серы или их комбинаций. Согласно некоторым вариантам осуществления изобретения, в соответствии с одним из аспектов изобретения, гетероалкил относится к алкильной группе, у которой один из скелетных атомов алкила представляет собой атом кислорода. Термин "необязательно замещенный" или "замещенный" означает, что указанная группа может иметь в качестве заместителей одну или более чем одну дополнительную группу, индивидуально и независимо выбранную из атома галогена, -CN, -NH2, -ОН, -NH(CH3), -N(CH3)2, алкила, циклоалкила,фторалкила, гетероалкила, алкокси, фторалкокси, -S-алкила или -S(=О)2 алкила. Согласно некоторым вариантам осуществления изобретения, если группа является необязательно замещенной, заместитель выбран из атома галогена, -CN, -NH2, -ОН, -NH(CH3), -N(CH3)2, -CH3, -CH2CH3, -CF3, -OCH3 и -OCF3. Согласно некоторым вариантам осуществления изобретения замещенные группы имеют в качестве заместителей одну или две из перечисленных выше групп. Согласно некоторым вариантам осуществления изобретения замещенные группы имеют в качестве заместителей одну из перечисленных выше групп. Термин "приемлемый" в отношении препарата, композиции или ингредиента в контексте данного описания означает не оказывающий никакого стойкого вредного действия на общее состояние здоровья субъекта, которого лечат. Термин "модулировать" в контексте данного описания означает взаимодействовать с мишенью прямо или косвенно, с тем чтобы изменить активность данной мишени, включая, только в качестве примера, увеличение активности мишени, ингибирование активности мишени, ограничение активности мишени или пролонгирование активности мишени. Термин "модулятор" в контексте данного описания относится к молекуле, которая взаимодействует с мишенью прямо или косвенно. Данные взаимодействия включают, без ограничения, взаимодействия агониста, частичного агониста, обратного агониста и антагониста. Согласно одному из вариантов осуществления изобретения модулятор представляет собой антагонист. Термин "агонист" в контексте данного описания относится к молекуле, такой как соединение, лекарство, фермент-активатор или гормон-модулятор, которая связывается со специфическим рецептором и запускает клеточный ответ. Агонист имитирует действие эндогенного лиганда (такого как LPA, простагландин, гормон или нейромедиатор), который связывается с тем же самым рецептором. Термин "антагонист" в контексте данного описания относится к молекуле, такой как соединение,которая уменьшает, ингибирует или предотвращает действие другой молекулы или активность рецепторного сайта. Антагонисты включают конкурентные антагонисты, неконкурентные антагонисты, бесконкурентные антагонисты, частичные агонисты и обратные агонисты, но не ограничены ими. Термин "LPA-зависимый" в контексте данного описания относится к состояниям или расстройствам, которые бы в отсутствии LPA не возникали или степень тяжести которых в отсутствии LPA была бы меньше. Термин "LPA-опосредованный" в контексте данного описания относится к состояниям или расстройствам, которые могли бы иметь место в отсутствии LPA, но могут иметь место в присутствии LPA. Подразумевается, что термин "совместное введение" или подобные термины в контексте данного описания включают введение выбранных терапевтических агентов одному и тому же пациенту и включают схемы лечения, согласно которым агенты вводят, используя одинаковые или разные пути введения,или одновременно, или в разное время. Термины "эффективное количество" или "терапевтически эффективное количество" в контексте данного описания относятся к такому количеству агента или соединения, введение которого является достаточным для того, чтобы облегчить до некоторой степени один или более чем один симптом заболевания или состояния, которое лечат. Результат может выражаться в ослаблении и/или смягчении признаков болезни, симптомов или причин заболевания или в любом другом желаемом изменении биологической системы. Например, "эффективное количество" в случае терапевтического использования представляет собой количество композиции, содержащей соединение, такое, как раскрыто в данном описании,требуемое для обеспечения клинически значимого ослабления симптомов заболевания. В каждом конкретном случае подходящее "эффективное" количество может быть определено с использованием таких методик, как исследование с увеличением дозы. Термин "фармацевтическая комбинация" в контексте данного описания означает продукт, который получают в результате смешивания или объединения двух и более активных ингредиентов, и включает как фиксированные, так и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например соединение формулы (I) и соагент, вводят пациенту одновременно как единое целое или в форме однократной дозы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение формулы (I) и соагент, вводят пациенту в виде отдельных доз одновременно, параллельно или последовательно (что не предполагает конкретные временные интервалы), и такое введение обеспечивает эффективный уровень обоих соединений в организме пациента. Последнее также применимо к "коктейль"-терапии (cocktail therapy), например к введению трех или более активных ингредиентов. Термин "субъект" или "пациент" включает млекопитающих. Примеры млекопитающих включают,без ограничения, человека, шимпанзе, человекообразных обезьян, обезьян, крупный рогатый скот, лошадей, овец, коз, свиней, кроликов, собак, кошек, грызунов, крыс, мышей, морских свинок и т.п. Согласно одному из вариантов осуществления изобретения млекопитающее представляет собой человека. Термины "лечить", "получать лечение" или "лечение" в контексте данного описания включают смягчение, ослабление или уменьшение интенсивности по меньшей мере одного симптома заболевания или состояния, предотвращение появления дополнительных симптомов, подавление заболевания или состояния, например задержку развития заболевания или состояния, облегчение заболевания или состояния, регрессию заболевания или состояния, облегчение состояния, вызванного другим заболеванием или состоянием, или остановку развития симптомов заболевания или состояния профилактическим и/или терапевтическим путем. Фармацевтические композиции/препараты и пути введения. Согласно некоторым вариантам осуществления изобретения соединения, описанные в данном документе, используют для изготовления фармацевтических композиций. Фармацевтические композиции изготавливают в виде препарата с помощью стандартных методик с использованием одного или более чем одного фармацевтически приемлемого инертного ингредиента, который облегчает процесс изготовления препаратов на основе данные активных соединений, которые могут быть использованы в качестве фармацевтических средств. Надлежащий препарат выбирают в зависимости от пути введения. Обзор фармацевтических композиций, описанных в данном документе, можно найти, например, в Remington:Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott WilliamsWilkins, 1999),все из указанных публикаций включены в данное описание посредством ссылки. Термин "фармацевтическая композиция" в контексте данного описания относится к смеси соединения формулы (I) с другими химическими компонентами (т.е. фармацевтически приемлемыми инертными ингредиентами), такими как носители, эксципиенты, связующие вещества, наполнители, суспендирующие агенты, корригенты, подслащивающие агенты, разрыхлители, диспергирующие агенты, поверхностно-активные вещества, смазывающие вещества, красящие вещества, разбавители, солюбилизаторы, увлажняющие агенты, пластификаторы, стабилизаторы, вещества, способствующие проникновению, увлажняющие агенты, противопенные агенты, антиоксиданты, консерванты или комбинация указанных компонентов. Фармацевтическая композиция способствует введению соединения в организм. Фармацевтические препараты, описанные в данном документе, могут быть введены субъекту разными способами с использованием различных путей введения, включая, без ограничения, пероральный путь, парентеральный путь (например, внутривенную, подкожную, внутримышечную, внутрикостную инъекции, интратекальную, прямую внутрижелудочковую, внутрибрюшинную, внутрилимфатическую,интраназальную инъекции), интраназальный, трансбуккальный, местный или трансдермальный путь введения. Фармацевтические препараты, описанные в данном документе, включают водные жидкие дисперсии, самоэмульгирующиеся дисперсии, твердые растворы, липосомные дисперсии, аэрозоли, твердые лекарственные формы, порошки, препараты немедленного высвобождения, препараты контролируемого высвобождения, быстроплавящиеся препараты, таблетки, капсулы, пилюли, препараты отсроченного высвобождения, препараты пролонгированного высвобождения, препараты пульсирующего высвобождения, препараты, состоящие из множества частиц, и смешанные препараты немедленного и контролируемого высвобождения, но не ограничены ими. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) вводят перорально. Согласно некоторым вариантам осуществления изобретения для введения соединений формулы (I) используют местный путь введения. Согласно таким вариантам осуществления изобретения соединение формулы (I) используют для получения ряда композиций для местного введения, таких как растворы,суспензии, лосьоны, гели, пасты, шампуни, отшелушивающие средства, средства для втирания, средства для смазывания, лечебные карандаши, лечебные бандажи, бальзамы, кремы или мази. В соответствии с одним из аспектов изобретения для введения соединений формулы (I) используют местный путь введения путем нанесения на кожу. Согласно другому аспекту изобретения соединения формулы (I) вводят путем ингаляции. Другой аспект изобретения относится к соединениям формулы (I) в виде препарата для интраназального введения. Такие препараты включают назальные спреи, назальные аэрозоли и т.п. Другой аспект изобретения относится к соединениям формулы (I) в виде препарата в форме глазных капель. Любой из вышеупомянутых аспектов изобретения предполагает дополнительные варианты осуществления изобретения, согласно которым эффективное количество соединения формулы (I) (а) вводят млекопитающему, используя системный путь введения; и/или (b) вводят млекопитающему перорально; и/или (с) вводят млекопитающему внутривенно; и/или (d) вводят млекопитающему путем ингаляции; и/или (е) вводят млекопитающему, используя назальный путь введения; и/или (f) вводят млекопитающему путем инъекции; и/или (g) вводят млекопитающему, используя местный путь введения; и/или (h) вводят в глаз; и/или (i) вводят млекопитающему ректально; и/или (j) вводят млекопитающему, используя несистемный или локальный путь введения. Любой из вышеупомянутых аспектов изобретения предполагает дополнительные варианты осуществления изобретения, которые включают однократные введения эффективного количества соединения,в том числе дополнительные варианты осуществления изобретения, согласно которым (i) соединение вводят один раз; (ii) соединение вводят млекопитающему несколько раз на протяжении одних суток; (iii) введение является повторяющимся или (iv) непрерывным. Любой из вышеупомянутых аспектов изобретения предполагает дополнительные варианты осуществления изобретения, которые включают многократные введения эффективного количества соединения,в том числе дополнительные варианты осуществления изобретения, согласно которым (i) соединение вводят непрерывно или сперерывами как однократную дозу; (ii) интервал времени между введениями доз при многократном введении составляет 6 ч; (iii) соединение вводят млекопитающему каждые 8 ч; (iv) соединение вводят млекопитающему каждые 12 ч; (v) соединение вводят млекопитающему каждые 24 ч. Согласно дополнительным или альтернативным вариантам осуществления изобретения методика введения включает "лекарственные каникулы", когда введение соединения на время приостанавливают или дозу вводимого соединения на время уменьшают; по окончании "лекарственных каникул" введение соединения возобновляют. Согласно одному из вариантов осуществления изобретения продолжительность"лекарственных каникул" варьирует от 2 суток до 1 года. Согласно некоторым вариантам осуществления изобретения для введения соединения, такого как определено в данном описании, используют локальный, а не системный путь введения. Согласно некоторым вариантам осуществления изобретения для введения соединения, описанного в данном документе, используют местный путь введения. Согласно некоторым вариантам осуществления изобретения для введения соединения, описанного в данном документе, используют системный путь введения. Согласно некоторым вариантам осуществления изобретения фармацевтический препарат изготовлен в форме таблетки. Согласно другим вариантам осуществления изобретения фармацевтический препарат соединений формулы (I) изготовлен в форме капсулы. В соответствии с одним из аспектов изобретения жидкие лекарственные формы препаратов для перорального введения представлены водными суспензиями или растворами, выбранными из группы,включающей, без ограничения, водные пероральные дисперсии, эмульсии, растворы, эликсиры, гели и сиропы. Соединение формулы (I), предназначенное для введения путем ингаляции, представлено в виде препарата в форме аэрозоля, тумана или порошка. Композиции, предназначенные для трансбуккального или сублингвального введения, могут быть представлены в форме таблеток, лепешек или гелей, изготовленных с использованием стандартных методик. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) представлены в виде трансдермальных лекарственных форм. Один из аспектов изобретения относится к соединению формулы (I) в виде фармацевтической композиции, подходящей для внутримышечной, подкожной или внутривенной инъекции. Согласно некоторым вариантам осуществления изобретения для введения соединений, описанных в данном документе, может быть использован местный путь введения и данные соединения могут быть представлены в виде различных композиций, предназначенных для местного введения, таких как растворы, суспензии, лосьоны, гели, пасты, лечебные карандаши, бальзамы, кремы или мази. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) представлены в виде ректальных композиций, таких как клизмы, ректальные гели, ректальные пены, ректальные аэрозоли, суппозитории, гелевые суппозитории или удерживающие клизмы. Методики введения и схемы лечения. Согласно одному из вариантов осуществления изобретения соединения формулы (I) используют для получения лекарств для лечения LPA-зависимых или LPA-опосредованных заболеваний или состояний. Кроме того, способ лечения любых заболеваний или состояний, описанных в данном документе, у субъекта, нуждающегося в таком лечении, включает введение указанному субъекту фармацевтических композиций, которые содержат по меньшей мере одно соединение формулы (I) или фармацевтически приемлемую соль, активный метаболит, пролекарство или сольват данного соединения в терапевтически эффективных количествах. Согласно некоторым вариантам осуществления изобретения композиции, содержащие соединение(я), описанное(ые) в данном документе, вводят в целях профилактического и/или терапевтического лечения. В терапевтических целях композиции вводят пациенту, который уже имеет определенное заболевание или состояние, в количестве, достаточном для лечения или по меньшей мере для частичного купирования по меньшей мере одного из симптомов данного заболевания или состояния. Количество, эффективное в конкретном случае, определяется решением лечащего врача и зависит от тяжести и динамики заболевания или состояния, предшествующей терапии, состояния здоровья пациента, массы тела и ответа на введение лекарств. Терапевтически эффективные количества определяют (но необязательно) с использованием методик, включая, без ограничения, клиническое исследование с увеличением дозы. В профилактических целях композиции, содержащие соединения, описанные в данном документе,вводят пациенту, восприимчивому к данному заболеванию, расстройству или состоянию или подверженному риску развития данного заболевания, расстройства или состояния по другой причине. Согласно некоторым вариантам осуществления изобретения доза вводимого лекарства может быть временно уменьшена или введение лекарства может быть временно приостановлено на некоторый период времени (т.е. могут быть назначены "лекарственные каникулы"). Дозы, используемые для лечения взрослого человека, обычно находятся в диапазоне от 0,01 до 5000 мг/сутки или от приблизительно 1 до приблизительно 1000 мг/сутки. Согласно одному из вариантов осуществления изобретения желаемую дозу обычно вводят в виде однократной дозы или в виде дробной дозы. Выбор пациентов. Любой из вышеупомянутых аспектов изобретения, относящихся к предупреждению или лечениюLPA-опосредованных заболеваний или состояний, предполагает дополнительные варианты осуществления изобретения, включающие идентификацию пациентов путем скрининга с целью выявления SNP (однонуклеотидного полиморфизма) в генах LPA-рецепторов. Выбор пациентов может быть дополнительно основан на повышенной экспрессии LPA-рецепторов в интересующей ткани. Уровень экспрессии LPAрецепторов определяют с использованием методик, которые включают нозерн-блоттинг, вестернблоттинг, количественный PCR-анализ (qPCR; полимеразная цепная реакция), проточную цитометрию,радиоаутографию (с использованием низкомолекулярного радиолиганда или лиганда для ПЭТ (позитронно-эмиссионной томографии, но не ограничены ими. Согласно некоторым вариантам осуществления изобретения выбор пациентов основан на концентрации LPA в сыворотке или ткани, измеряемой с использованием масс-спектрометрии. Согласно некоторым вариантам осуществления изобретения выбор пациентов основан на комбинации вышеупомянутых маркеров (повышенной концентрации LPA и повышенной экспрессии LPA-рецепторов). Комбинированная терапия. В некоторых случаях целесообразно вводить по меньшей мере одно соединение формулы (I) в комбинации с другим терапевтическим агентом. Согласно одному конкретному варианту осуществления изобретения соединение формулы (I) вводят совместно со вторым терапевтическим агентом при условии, что соединение формулы (I) и второй терапевтический агент модулируют разные аспекты заболевания, расстройства или состояния, которые лечат, что дает больше преимуществ, чем введение любого одного из терапевтических агентов. Дозы совместно вводимых соединений в различных вариантах комбинированной терапии, описанных в данном документе, варьируют в зависимости от того, какой тип лекарств(а) используют при совместном введении, конкретно какое(ие) лекарство(а) используют, а также в зависимости от заболевания или состояния, которые лечат, и т.д. Согласно дополнительным вариантам осуществления изобретения при совместном введении с одним или более чем одним другим терапевтическим агентом соединение,предложенное в данном изобретении, вводят либо одновременно с одним или более чем одним другим терапевтическим агентом, либо последовательно. При одновременном введении несколько терапевтических агентов (только в качестве примера) входят в состав одной стандартной лекарственной формы или представлены несколькими лекарственными формами. Согласно другому варианту осуществления изобретения, описанному в данном документе, способы лечения пролиферативных нарушений, в том числе рака, включают введение млекопитающему соединения формулы (I) в комбинации с одним или более чем одним противораковым агентом и/или в комбинации с рентгенотерапией. Один из аспектов изобретения относится к соединениям формулы (I) для лечения или ослабления фиброза у млекопитающего. В соответствии с одним из аспектов изобретения соединения формулы (I) вводят в комбинации с одним или более чем одним иммунодепрессантом. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) вводят с кортикостероидами. Согласно еще одному варианту осуществления изобретения, описанному в данном документе, способы лечения LPA-зависимых или LPA-опосредованных состояний или заболеваний, такие как терапия респираторных расстройств (например, фиброза легких, астмы, ХОЗЛ, ринита), включают введение пациенту соединений, фармацевтических композиций или лекарств, описанных в данном документе, в комбинации по меньшей мере с одним агентом, используемым в лечении респираторных состояний. Согласно некоторым вариантам осуществления изобретения соединения формулы (I) вводят пациенту в комбинации с противовоспалительными агентами. Согласно одному из вариантов осуществления изобретения соединения формулы (I) вводят пациенту в комбинации с ингаляционными кортикостероидами. Примеры Данные примеры приведены только для иллюстрации и не ограничивают объем прилагаемой формулы изобретения. Синтез соединений.(R)-2'-Хлор-альфа-метилбензиловый спирт получали путем восстановления 2'-хлорацетофенона(Aldrich) с использованием методики, описанной Meier et al. (Tetrahedron, 1996, 52, 589; Method 3). Энантиомерный избыток (%) определяли путем ЖХВД-анализа ацетатного производного (полученного в результате взаимодействия смеси энантиомеров бензилового спирта с ацетилхлоридом и триэтиламином в дихлорметане) на колонке Chiralcel OD с использованием для элюирования смеси гексан:этанол (99:1). Время удержания R-изомера: 4,3 мин.(S)-2'-Хлор-альфа-метилбензиловый спирт получали путем восстановления 2'-хлорацетофенона(Aldrich) с использованием методики, описанной Meier et al. (Tetrahedron, 1996, 52, 589; Method 3). Энантиомерный избыток (%) определяли путем ЖХВД-анализа ацетатного производного (полученного в результате взаимодействия смеси энантиомеров бензилового спирта с ацетилхлоридом и триэтиламином в дихлорметане) на колонке Chiralcel OD с использованием для элюирования смеси гексан:этанол (99:1). Время удержания S-изомера: 5,3 мин.(R)-2'-Фтор-альфа-метилбензиловый спирт получали путем восстановления 2'-фторацетофенона(Aldrich) с использованием методики, описанной Meier et al. (Tetrahedron, 1996, 52, 589; Method 3). Энантиомерный избыток (%) определяли путем ЖХВД-анализа ацетатного производного (полученного в результате взаимодействия смеси энантиомеров бензилового спирта с ацетилхлоридом и триэтиламином в дихлорметане) на колонке Chiralcel OD с использованием для элюирования смеси гексан:этанол(S)-2'-Фтор-альфа-метилбензиловый спирт получали путем восстановления 2'-фторацетофенона(Aldrich) с использованием методики, описанной Meier et al. (Tetrahedron, 1996, 52, 589; Method 3). Энантиомерный избыток (%) определяли путем ЖХВД-анализа ацетатного производного (полученного в результате взаимодействия смеси энантиомеров бензилового спирта с ацетилхлоридом и триэтиламином в дихлорметане) на колонке Chiralcel OD с использованием для элюирования смеси гексан:этанол(99,8:0,2). Время удержания S-изомера: 6,7 мин. Пример 1. Синтез 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновой кислоты (соединение 1). Стадия 1. 3-Метиламино-бут-2-еновой кислоты метиловый эфир. К раствору ацетоуксусной кислоты метилового эфира (29,4 г, 253 ммоль) в МеОН (30 мл) добавляли по каплям метиламин (33 мас.% в EtOH; 48 мл, 385 ммоль) при комнатной температуре. Данную реакционную смесь перемешивали в течение 1 ч и затем концентрировали и сушили с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества. Стадия 2. 2-(4-Бромбензоил)-3-оксомасляной кислоты метиловый эфир. К раствору 3-метиламино-бут-2-еновой кислоты метилового эфира (5,0 г, 39,1 ммоль) в ТГФ (70 мл) добавляли пиридин (3,7 мл). Данную смесь охлаждали до 0 С и добавляли по каплям в течение 2 мин хлористый 4-бромбензоил (8,55 г, 39,1 ммоль) в ТГФ (30 мл). Реакционную смесь нагревали до комнатной температуры в течение 1 ч и затем перемешивали в течение ночи при комнатной температуре. После водной обработки получали указанное в заголовке соединение. Стадия 3. 5-(4-Бромфенил)-3-метилизоксазол-4-карбоновой кислоты метиловый эфир. 2-(4-Бромбензоил)-3-оксомасляной кислоты метиловый эфир (11 г, 39 ммоль) и гидроксиламина гидрохлорид (2,66 г, 39 ммоль) смешивали в уксусной кислоте (50 мл) и данную реакционную смесь перемешивали в течение 1 ч при 115 С. Затем смесь охлаждали и после водной обработки получали указанное в заголовке соединение. Стадия 4. 5-(4-Бромфенил)-3-метилизоксазол-4-карбоновая кислота. К раствору 5-(4-бромфенил)-3-метилизоксазол-4-карбоновой кислоты метилового эфира (7 г,23,6 ммоль) в МеОН (50 мл) и H2O (10 мл) добавляли гидроксид лития (2 г, 47,7 ммоль) и данную реак- 25020139 ционную смесь перемешивали в течение 1 ч при 60 С. После обработки кислотой получали указанное в заголовке соединение. Стадия 5. [5-(4-Бромфенил)-3-метилизоксазол-4-ил]карбаминовой кислоты (R)-1-фенилэтиловый эфир. 5-(4-Бромфенил)-3-метилизоксазол-4-карбоновую кислоту (2,0 г, 7,09 ммоль) и триэтиламин(0,99 мл, 7,09 ммоль) растворяли в толуоле (50 мл). Добавляли дифенилфосфорилазид (1,5 мл,7,09 ммоль) и затем (R)-(+)-1-фенилэтиловый спирт (0,865 г, 7,09 ммоль; имеющийся в продаже или полученный с использованием методик, описанных в данном документе или в литературе, например вE.J. Corey et al. J. Am. Chem. 1987, 109, 5551-5553) и данную реакционную смесь перемешивали в течение 4 ч при 80 С. Затем смесь концентрировали и остаток очищали путем хроматографии на силикагеле с получением указанного в заголовке соединения. Стадия 6. 1-4'-[3-Метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновая кислота.(0,248 г, 0,62 ммоль), 4-(1'-карбоксилциклопропил)фенилбороновую кислоту (0,160 г, 0,62 ммоль) и карбонат натрия (0,155 г, 1,85 ммоль) растворяли в смеси ДМЭ (диметоксиэтан):H2O (2:1). Полученный раствор продували N2 в течение 10 мин и затем добавляли бис-(трифенилфосфин)палладия(II) дихлорид(0,047 г, 0,06 ммоль). Данную реакционную смесь продували N2 дополнительно в течение 10 мин и затем перемешивали в герметично закрытой пробирке в течение 2 ч при 80 С. Затем смесь распределяли междуEtOAc и Н 2 О и водный слой экстрагировали EtOAc. Объединенные органические слои сушили надMgSO4, фильтровали и концентрировали и остаток очищали путем хроматографии на силикагеле с получением указанного в заголовке соединения. Пример 1 а. Альтернативный синтез 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол 5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 1). Стадия 1. 1-(Бифенил-4-ил)циклопропанкарбонитрил. 4-Фенилфенилацетонитрил (VWR Scientific, 55,7 г, 289 ммоль) добавляли к раствору KOH (161,6 г,2890 ммоль) в воде (170 мл) и толуолу (550 мл) при комнатной температуре. Добавляли тетрабутиламмония бромид (9,2 г, 29 ммоль) и затем 1,2 дибромэтан (64,9 г, 347 ммоль) и данный раствор нагревали до 65 С в течение ночи. Согласно ТСХ-анализу (10% EtOAc/гексан) реакция была завершена. Органический слой 2 раза экстрагировали разбавленной соляной кислотой, сушили и упаривали с получением 63 г 1-(бифенил-4-ил)циклопропанкарбонитрила. Стадия 2. 1-(Бифенил-4-ил)циклопропанкарбоновая кислота. 1-(Бифенил-4-ил)циклопропанкарбонитрил (63 г, 288 ммоль), KOH (1130 ммоль) и этиленгликоль(350 мл) нагревали до 160 С в течение 6 ч (согласно ЖХ/МС-анализу (жидкостная хроматография/массспектрометрия) реакция была завершена). Полученный раствор охлаждали до комнатной температуры,добавляли воду (1,5 л) и затем раствор подкисляли для осаждения продукта. Данный продукт фильтровали в течение ночи на широкой воронке Бюхнера (продукт получали в виде гелеобразной суспензии). Полученное влажное твердое вещество экстрагировали CH2Cl2 (2 л) и водой, сушили и упаривали с получением 1-(бифенил-4-ил)циклопропанкарбоновой кислоты (60 г), которую использовали как есть на следующей стадии. Стадия 3. 1-(Бифенил-4-ил)циклопропанкарбоновой кислоты этиловый эфир. 1-(Бифенил-4-ил)циклопропанкарбоновую кислоту (10 г, 42 ммоль), этанол (100 мл) и серную кислоту (40 мл) нагревали до 65 С в течение 4 ч. Полученный продукт экстрагировали CH2Cl2 и водой (2 Х),сушили и упаривали с выходом 1-(бифенил-4-ил)циклопропанкарбоновой кислоты этилового эфира(9,5 г). Стадия 4. 1-(4'-Ацетилбифенил-4-ил)циклопропанкарбоновой кислоты этиловый эфир. К 1-(бифенил-4-ил)циклопропанкарбоновой кислоты этиловому эфиру (9 г, 33,8 ммоль) в CH2Cl2(100 мл) добавляли хлорид алюминия (9,4 г, 71 ммоль) и затем ацетилхлорид (5,5 г, 71 ммоль). Данный раствор перемешивали в течение 1,5 ч при комнатной температуре, затем медленно вливали в воду. Органический слой отделяли и 2 раза экстрагировали водой. Затем органический слой сушили и упаривали с получением указанного в заголовке соединения (11,3 г). Стадия 5. 4'-(1-(Этоксикарбонил)циклопропил)бифенил-4-карбоновая кислота. К 1-(4'-ацетилбифенил-4-ил)циклопропанкарбоновой кислоты этиловому эфиру (10,1 г, 33 ммоль) в диоксане (200 мл) при 10 С добавляли раствор брома (26,4 г, 165 ммоль) и гидроксида натрия (22,4 г,561 ммоль) в воде (150 мл). Полученный раствор перемешивали в течение 30 мин при комнатной температуре, вливали в воду (500 мл) и подкисляли путем добавления разбавленной соляной кислоты. Добавляли метабисульфит натрия до тех пор, пока не исчезала коричневая окраска брома. Полученный продукт фильтровали и сушили в вакуумной печи в течение ночи при 40 С с выходом 4'-(1-(этоксикарбонил)циклопропил)бифенил-4-карбоновой кислоты (10 г). Стадия 6. 3-Метиламино-бут-2-еновой кислоты бензиловый эфир. К ацетоуксусной кислоты бензиловому эфиру (29 г, 151 ммоль) в этаноле (30 мл) добавляли метиламин (33% в этаноле, 7,02 г, 226 ммоль). Данный раствор перемешивали в течение 2 ч при комнат- 26020139 ной температуре и затем упаривали с получением желтого масла (30 г). Стадия 7. Этил 1-(4'-(2-(бензилоксикарбонил)-3-(метиламино)бут-2-еноил)бифенил-4 ил)циклопропанкарбоксилат. 4'-(1-(Этоксикарбонил)циклопропил)бифенил-4-карбоновую кислоту (4,47 г, 14,4 ммоль), дихлорэтан (50 мл), ДМФА (N,N-диметилформамид) (0,1 мл), тионилхлорид (2,3 мл, 32 ммоль) нагревали до 80 С в течение 1 ч. Образование хлорангидрида контролировали путем добавления небольшой аликвоты(100 мкл) к раствору бензиламина в ацетонитриле и анализа образования бензиламида с использованием ЖХ/МС; согласно данным ЖХ/МС исходное вещество отсутствовало. Полученный раствор упаривали на роторном испарителе и добавляли ТГФ (10 мл). К раствору 3-метиламино-бут-2-еновой кислоты бензилового эфира (3,23 г, 15,8 ммоль) и пиридина (2,4 мл, 30,2 ммоль) в ТГФ (50 мл) через шприц добавляли раствор полученного хлорангидрида в ТГФ. Данный раствор перемешивали в течение 2 ч при 50 С, затем, используя роторный испаритель, выпаривали летучие компоненты с получением желаемого неочищенного продукта. Стадия 8. Бензил 5-(4'-(1-(этоксикарбонил)циклопропил)бифенил-4-ил)-3-метилизоксазол-4 карбоксилат. К неочищенному веществу, полученному на предыдущей стадии реакции, добавляли гидроксиламина гидрохлорид (1,5 г, 21,6 ммоль) и уксусную кислоту (50 мл). Данный раствор нагревали до 95 С в течение 30 мин, охлаждали до комнатной температуры, экстрагировали CH2Cl2 и водой (4 раза,второй и третий раз подщелачивали бикарбонатом натрия). Сушили, упаривали и очищали на колонке(0-20% EtOAc/гексаны) с получением продукта (3,3 г). Стадия 9. 5-(4'-(1-(Этоксикарбонил)циклопропил)бифенил-4-ил)-3-метилизоксазол-4-карбоновая кислота. Сложный бензиловый эфир, полученный на стадии 8 (1 г, 2,1 ммоль), смешивали с этилацетатом(10 мл) и дегазировали азотом в течение 10 мин. Добавляли 10% палладий на активированном угле (0,2 г,0,2 ммоль) и данный раствор барботировали водородом из баллона. Баллон с водородом подсоединяли к верхней свободной от жидкости части реактора и находящийся в нем раствор перемешивали в течение 1,5 ч. Реакционную смесь разбавляли этанолом и ацетоном (для растворения продукта), фильтровали через целит и упаривали с получением продукта (700 мг). Стадия 10. 1-4'-[3-Метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновой кислоты этиловый эфир. К смеси кислоты, полученной на стадии 9 (0,5 г, 1,28 ммоль), с толуолом (5 мл) добавляли(R)-1-фенилэтанол (0,16 г, 1,34 ммоль), триэтиламин (0,26 г, 2,56 ммоль) и азид дифенилового эфира фосфорной кислоты (0,39 г, 1,4 ммоль). Данный раствор нагревали до 80 С в течение 1 ч, охлаждали до комнатной температуры и экстрагировали 3 раза водой. Органический слой сушили и упаривали с получением продукта (0,61 г). Полученный продукт дополнительно очищали путем колоночной хроматографии (0-40% EtOAc/гексан) с выходом 0,42 г чистого продукта (65%) в виде масла, которое вспенивалось в процессе сушки под вакуумом. Стадия 11. 1-4'-[3-Метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновая кислота. К полученному этиловому эфиру (22,7 г, 44 ммоль) в метаноле (300 мл) добавляли гидроксид лития(9,1 г, 222 ммоль). Данный раствор нагревали до 65 С в течение 2 ч, экстрагировали в метиленхлорид и промывали разбавленной соляной кислотой. Органический слой сушили и упаривали с получением продукта (20,8 г). Пример 1b. Альтернативный синтез 1-4'-[3-метил-4-R)-1-фенилэтоксикарбониламино)изоксазол 5-ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 1. Стадия 1. 1-(Бифенил-4-ил)циклопропанкарбоновой кислоты изопропиловый эфир. 1-(Бифенил-4-ил)циклопропанкарбоновую кислоту (10 г, 42 ммоль), изопропанол (100 мл), тионилхлорид (6,8 мл, 92 ммоль) нагревали до 65 С в течение 4 ч. Добавляли серную кислоту (20 мл) и нагревали при 65 С в течение ночи. Полученный продукт экстрагировали CH2Cl2 и водой (2 Х), сушили и упаривали с получением указанного в заголовке соединения (10,8 г). Стадия 2. 1-(4'-Ацетилбифенил-4-ил)циклопропанкарбоновой кислоты изопропиловый эфир. К 1-(бифенил-4-ил)циклопропанкарбоновой кислоты изопропиловому эфиру (10,2 г, 36 ммоль) вCH2Cl2 (100 мл) добавляли хлорид алюминия (10,2 г, 76,5 ммоль) и затем ацетилхлорид (5,97 г,76,5 ммоль). Данный раствор перемешивали в течение 1,5 ч при комнатной температуре, затем медленно вливали в воду. Органический слой отделяли и 1 раз экстрагировали раствором тартрата калия-натрия(20 г в 250 мл воды). Затем органический слой сушили и упаривали с получением указанного в заголовке соединения (12,6 г). Стадия 3. 4'-(1-(Изопропоксикарбонил)циклопропил)бифенил-4-карбоновая кислота. К 1-(4'-ацетилбифенил-4-ил)циклопропанкарбоновой кислоты изопропиловому эфиру (11,6 г,36 ммоль) в диоксане (200 мл) при 10 С добавляли раствор брома (28,8 г, 180 ммоль) и гидроксида натрия (24,5 г, 612 ммоль) в воде (150 мл). Данный раствор перемешивали в течение 30 мин при комнатной температуре, вливали в воду (500 мл) и подкисляли путем добавления разбавленной соляной кислоты. Добавляли метабисульфит натрия до тех пор, пока не исчезала коричневая окраска брома. Данный продукт фильтровали и сушили в вакуумной печи в течение ночи при 40 С с получением указанного в заголовке соединения (10 г). Стадия 4. Изопропил 1-(4'-(2-(бензилоксикарбонил)-3-(метиламино)бут-2-еноил)бифенил-4 ил)циклопропанкарбоксилат. 4'-(1-(Изопропоксикарбонил)циклопропил)бифенил-4-карбоновую кислоту (9,2 г, 28 ммоль), дихлорэтан (50 мл), ДМФА (0,1 мл), тионилхлорид (5,5 мл, 62 ммоль) нагревали до 75 С в течение 1,5 ч (образование хлорангидрида контролировали путем добавления небольшой аликвоты (100 мкл) к раствору бензиламина в ацетонитриле и анализа бензиламида с использованием ЖХ/МС; согласно данным ЖХ/МС исходное вещество отсутствовало). Полученный раствор упаривали на роторном испарителе и добавляли ТГФ (10 мл). К раствору 3-метиламино-бут-2-еновой кислоты метилового эфира (4,0 г,31,2 ммоль) и пиридина (5,5 мл, 70 ммоль) в ТГФ (50 мл) через шприц добавляли раствор полученного хлорангидрида в ТГФ. Данный раствор перемешивали в течение ночи при комнатной температуре. Летучие компоненты выпаривали на роторном испарителе с получением неочищенного продукта. Стадия 5. Метил 5-(4'-(1-(изопропоксикарбонил)циклопропил)бифенил-4-ил)-3-метилизоксазол-4 карбоксилат. К неочищенному веществу, полученному на предыдущей стадии реакции, добавляли гидроксиламина гидрохлорид (2,9 г, 42 ммоль) и уксусную кислоту (50 мл). Данный раствор нагревали до 100 С в течение 30 мин, охлаждали до комнатной температуры, экстрагировали CH2Cl2 и водой(4 раза, второй и третий раз подщелачивали бикарбонатом натрия). Органическую фазу сушили, выпаривали и очищали на колонке силикагеля (220 г; 0-20% EtOAc/гексаны) с получением продукта (6 г). Стадия 6. 5-(4'-(1-(Пропоксикарбонил)циклопропил)бифенил-4-ил)-3-метилизоксазол-4-карбоновая кислота. К сложному метиловому эфиру, полученному на стадии 5, (5,2 г, 12,4 ммоль) в ТГФ (100 мл) и этаноле (20 мл) добавляли раствор гидроксида натрия (1,5 г, 37,2 ммоль) в воде (40 мл). Данный раствор перемешивали при комнатной температуре в течение 3 ч. Выпаривали 50 мл растворителя и добавляли 200 мл воды. Продукт осаждали из раствора разбавленной соляной кислотой, доводя значение рН до 2. Данный продукт выделяли путем фильтрования с получением указанного в заголовке соединения (4,6 г). Стадия 7. 1-4'-[3-Метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновой кислоты изопропиловый эфир. К кислоте, полученной на стадии 6 (4,0 г, 10 ммоль), в толуоле (50 мл) добавляли R-1-фенилэтанол(1,33 г, 11 ммоль), триэтиламин (2,02 г, 20 ммоль) и азид дифенилового эфира фосфорной кислоты(3,16 г, 11,5 ммоль). Данный раствор нагревали до 80 С в течение 1 ч, охлаждали до комнатной температуры и 3 раза экстрагировали водой. Органический слой сушили и упаривали с получением указанного в заголовке соединения (5,7 г). Стадия 8. 1-4'-[3-Метил-4-R)-1-фенилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновая кислота. К изопропиловому эфиру, полученному на стадии 7, (5,2 г, 10 ммоль) в ТГФ (30 мл) и МеОН(10 мл) добавляли NaOH (2 г, 50 ммоль) в воде (10 мл). Данный раствор нагревали до 65 С в течение 5 ч. Затем раствор охлаждали до комнатной температуры, экстрагировали дихлорметаном и разбавляли соляной кислотой. Органический растворитель сушили и выпаривали и полученный продукт очищали путем колоночной хроматографии (0-60% EtOAc/гексаны) с выходом продукта (3,5 г). Пример 2. Синтез 1-4'-[3-Метил-4-R)-1-ортотолилэтоксикарбониламино)изоксазол-5 ил]бифенил-4-илциклопропанкарбоновая кислота (соединение 3). Стадия 1. 1-(4-Бромфенил)циклопропанкарбонитрил. Гидроксид калия (14,3 г, 255 ммоль) растворяли в смеси Н 2 О (5 мл) и толуола (40 мл). Добавляли 4 бромфенилацетонитрил (5,0 г, 25,5 ммоль) и тетрабутиламмония бромид (0,41 г, 1,3 ммоль) и затем по каплям в течение 10 мин 1,2-дибромэтан (3,25 мл, 38 ммоль). Данную реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем выделяли указанное в заголовке соединение. Стадия 2. 1-(4-Бромфенил)циклопропанкарбоновая кислота. 1-(4-Бромфенил)циклопропанкарбонитрил (5 г, 22,5 ммоль) и гидроксид калия (5 г, 89,3 ммоль) смешивали в этиленгликоле (70 мл) и данную реакционную смесь перемешивали в течение 4 ч при 180 С. Затем смесь вливали в H2O, подкисляли и фильтровали с получением указанного в заголовке соединения. Стадия 3. 1-(4-Бромфенил)циклопропанкарбоновой кислоты этиловый эфир. 1-(4-Бромфенил)циклопропанкарбоновую кислоту (5 г, 20,7 ммоль) в EtOH (50 мл) обрабатывали серной кислотой (2 мл) и данную реакционную смесь перемешивали в течение 1 ч при 75 С. Затем из полученной смеси выделяли указанное в заголовке соединение. Стадия 4. 1-[4-(4,4,5,5-Тетраметил[1,3,2]диоксаборолан-2-ил)фенил]циклопропанкарбоновой кислоты этиловый эфир. 1-(4-Бромфенил)циклопропанкарбоновой кислоты этиловый эфир (3,6 г, 13,4 ммоль),бис-(пинаколато)дибор (3,37 г, 16,1 ммоль) и ацетат калия (2,8 г, 29 ммоль) смешивали в 1,4-диоксане(30 мл). Данный раствор продували N2 в течение 10 мин и затем добавляли(1,1'-бис-(дифенилфосфино)ферроцен)дихлорпалладий(II) (0,50 г, 0,65 ммоль) и данную реакционную смесь нагревали до 80 С в течение 2 ч. Указанное в заголовке соединение получали в результате водной обработки с последующей хроматографией на силикагеле (0-30% EtOAc в гексанах). Стадия 5. (R)-Ортотолилэтанол.(S)-(-)-2-Метил-CBS-оксазаборолидин (3,72 г, 13,4 ммоль) растворяли в ТГФ (60 мл). Добавляли боргидрид-диметилсульфидный комплекс (2 M в ТГФ; 36,6 мл, 73,3 ммоль) и данную смесь охлаждали до 0 С. В течение 1 ч добавляли 2'-метилацетофенон (15 г, 111 ммоль) в ТГФ (30 мл) и затем из полученной смеси выделяли продукт в виде жидкости, содержащей белый осадок. Добавляли гексаны, данную суспензию фильтровали с целью удаления осадка и полученный фильтрат концентрировали с получением указанного в заголовке соединения (энантиомерный избыток: 93%). Стадия 6. [5-(4-Бромфенил)-3-метилизоксазол-4-ил]карбаминовой кислоты (R)-1-ортотолилэтиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1(R)-1-ортотолилэтанола. Стадия 7. 1-4'-[3-Метил-4-R)-1-ортотолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1(R)-1-ортотолилэтилового эфира, 1-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]циклопропанкарбоновой кислоты этилового эфира и тетракис-(трифенилфосфин)палладия(0). Стадия 8. 1-4'-[3-Метил-4-R)-1-ортотолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4 илциклопропанкарбоновая кислота. К 1-(4'-[3-метил-4-R)-1-ортотолилэтоксикарбониламино)изоксазол-5-ил]бифенил-4-илциклопропанкарбоновой кислоты этиловому эфиру (0,36 ммоль) в смеси МеОН:Н 2 О (2:1) добавляли гидроксид лития (1,1 ммоль) и данную реакционную смесь перемешивали при комнатной температуре до тех пор,пока согласно данным аналитической ЖХ/МС не было полностью израсходовано исходное вещество. Затем смесь подкисляли 1 н. водным раствором HCl и экстрагировали EtOAc. Объединенные органические слои сушили, фильтровали и концентрировали с получением указанного в заголовке соединения. Пример 3a. Синтез(R)-1-4'-[4-(1-циклопропилэтоксикарбониламино)-3-метилизоксазол-5 ил]бифенил-4-илциклопропанкарбоновой кислоты (соединение 6). Стадия 1. [5-(4-Бромфенил)-3-метилизоксазол-4-ил]карбаминовой кислоты 1-циклопропилэтиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1(стадия 5), с использованием 5-(4-бромфенил)-3-метилизоксазол-4-карбоновой кислоты и альфаметилциклопропанметанола. Стадия 2. 1-4'-[4-(1-Циклопропилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4 илциклопропанкарбоновой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1(стадия 6), с использованием [5-(4-бромфенил)-3-метилизоксазол-4-ил]карбаминовой кислоты 1-циклопропилэтилового эфира и 1-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]циклопропанкарбоновой кислоты этилового эфира; затем выделенное вещество очищали путем препаративной ЖХВД с использованием колонки Chiracel OD (гексаны:EtOH (97:3 с получением энантиомера А и энантиомера В. Время удержания энантиомера А составляло 27 мин, время удержания энантиомера В составляло 33 мин. Стадия 3. (R)-1-4'-[4-(1-Циклопропилэтоксикарбониламино)-3-метилизоксазол-5-ил]бифенил-4 илциклопропанкарбоновая кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 2(R)-альфа-Метилциклопропанметанол получали путем восстановления циклопропилметилкетона(Aldrich) с использованием методики, аналогичной методике, описанной Meier et al. (Tetrahedron, 1996,52, 589; Method 3). Стадия 2. 1-(R)-[5-(4-Бромфенил)-3-метилизоксазол-4-ил]карбаминовой кислоты 1-циклопропилэтиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1
МПК / Метки
МПК: A61P 35/00, C07D 261/08, A61K 31/42, C07D 261/14
Метки: рецепторов, кислоты, лизофосфатидной, антагонисты, полициклические
Код ссылки
<a href="https://eas.patents.su/30-20139-policiklicheskie-antagonisty-receptorov-lizofosfatidnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Полициклические антагонисты рецепторов лизофосфатидной кислоты</a>
Предыдущий патент: Арилпиридины в качестве ингибиторов альдостеронсинтазы
Следующий патент: Модуляторы tgr5 и способы их применения
Случайный патент: Направленное детектирование короткого замыкания на землю с помощью единственного датчика