Составы, содержащие пептиды, стимулирующие рецептор эритропоэтина и их применение
Номер патента: 14528
Опубликовано: 30.12.2010
Авторы: Лезер Керстин, Насо Роберт Барнетт, Вудберн Катерин, Стед Ричард, Делиг Анне-Мария
Формула / Реферат
1. Способ лечения пациента, имеющего расстройство, которое характеризуется недостаточностью эритропоэтина или низким либо недостаточным уровнем красных кровяных клеток, который включает назначение указанному пациенту один раз каждые 3-4 недели терапевтически эффективного количества соединения, которое связывается с рецептором эритропоэтина (EPO-R) и активирует его, при этом терапевтически эффективное количество представляет собой дозу от 0,025 до 0,5 мг соединения на 1 кг веса тела пациента, причем указанное соединение отличается тем, что содержит:
(a) димерную пептидную субъединицу, которая включает первый пептидный мономер и второй пептидный мономер, отличающиеся тем, что указанные первый и второй пептидные мономеры содержат аминокислотную последовательность (AcG)GLYACHMGPIT(1-nal)VCQPLR;
(b) линкер, ковалентно связывающий вышеуказанные пептидные мономеры;
(c) по меньшей мере один остаток полиэтиленгликоля (ПЭГ), включающий линейный, неразветвленный ПЭГ, имеющий молекулярную массу от 10000 до 60000 Да; и
(d) спейсер, ковалентно соединяющий вышеуказанный по меньшей мере один остаток ПЭГ с вышеуказанным линкером, который имеет формулу, выбранную из группы, включающей

где каждый из R4 независимо выбран из группы, состоящей из NH, NHCO, СО, СОО и NHCOO.
2. Способ по п.1, отличающийся тем, что указанная аминокислотная последовательность дополнительно содержит (MeG), K или (MeG)K.
3. Способ по п.2, отличающийся тем, что указанная аминокислотная последовательность представляет собой последовательность (AcG)GLYACHMGPIT(l-nal)VCQPLRK.
4. Способ по п.2, отличающийся тем, что указанная аминокислотная последовательность представляет собой последовательность (AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG).
5. Способ по п.2, отличающийся тем, что аминокислотная последовательность представляет собой последовательность (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K.
6. Способ по п.1, отличающийся тем, что спейсер представляет собой иминодиацетатный линкер.
7. Способ по п.1, отличающийся тем, что спейсер представляет собой Ten-atom-ПЭГ (2,2'-(этилендиокси-(бис-(этиламин)).
8. Способ по п.1, отличающийся тем, что линкер представляет собой лизин.
9. Способ по п.1, отличающийся тем, что ПЭГ имеет молекулярную массу от 10000 до 60000 Да.
10. Способ по п.9, отличающийся тем, что ПЭГ имеет молекулярную массу от 20000 до 40000 Да.
11. Способ по п.1, отличающийся тем, что указанный способ включает применение фармацевтически приемлемого носителя.
12. Способ по п.1, отличающийся тем, что указанное расстройство представляет собой почечную недостаточность или диализ.
13. Способ по п.12, отличающийся тем, что терапевтически эффективное количество представялет собой дозу от 0,025 до 0,2 мг соединения на 1 кг веса тела пациента.
14. Способ по п.13, отличающийся тем, что указанная доза составляет от 0,05 до 0,1 мг соединения на 1 кг веса тела пациента.
15. Способ по п.1, отличающийся тем, что указанное расстройство представляет собой анемию, связанную со злокачественной опухолью.
16. Способ по п.15, отличающийся тем, что терапевтически эффективное количество представляет собой дозу от 0,075 до 05 мг соединения на 1 кг веса тела пациента.
17. Способ по п.16, отличающийся тем, что указанная доза составляет от 0,2 до 0,4 мг соединения на 1 кг веса тела пациента.
18. Способ по п.1, отличающийся тем, что указанное расстройство представляет собой эритроцитарную аплазию обусловленную антителами (ЭА).
19. Способ по п.1, отличающийся тем, что указанный линкер представляет собой линкер на основе третичного амида.
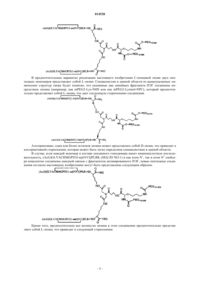
20. Способ по пп.1, 2, 5, 6, 8-17 и 18-19, отличающийся тем, что соединение представляет собой
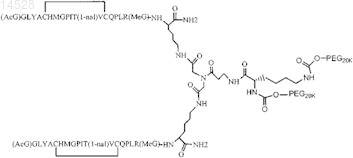
Текст
СОСТАВЫ, СОДЕРЖАЩИЕ ПЕПТИДЫ, СТИМУЛИРУЮЩИЕ РЕЦЕПТОР ЭРИТРОПОЭТИНА И ИХ ПРИМЕНЕНИЕ Делиг Анне-Мария, Стед Ричард, Лезер Керстин, Вудберн Катерин, Насо Роберт Барнетт (US) Представитель: Настоящее изобретение относится к соединениям на основе пептидов, которые представляют собой агонисты рецептора эритропоэтина (EPO-R). Изобретение также относится к способам терапии, в которых указанные пептидные соединения применяют для лечения расстройств, связанных с низким или недостаточным кроветворением. Изобретение также распространяется на фармацевтические составы, которые содержат указанные пептидные соединения, и формы их дозирования. 014528 Данная заявка испрашивает приоритет на основании заявки US60/687655, поданной 3 июня 2005 г. Содержание этой приоритетной заявки включено в настоящую заявку во всей своей полноте посредством ссылки. Область техники Настоящее изобретение относится к соединениям на основе пептидов, которые представляют собой агонисты рецептора эритропоэтина (EPO-R). Изобретение также относится к способам терапии, в которых указанные пептидные соединения применяют для лечения расстройств, связанных с низким или недостаточным кроветворением. Изобретение также распространяется на фармацевтические составы, которые содержат указанные пептидные соединения. Предшествующий уровень техники Эритропоэтин (ЕРО) представляет собой гликопротеидный гормон, состоящий из 165 аминокислот с молекулярной массой около 34 килодальтон (кДа) и предпочтительными сайтами гликозилирования в положениях аминокислот 24, 38, 83 и 126. Эритропоэтин первоначально синтезируется в виде белка предшественника с сигнальным пептидом из 23 аминокислот. ЕРО может существовать в трех формах:,и несиалированной форме.иформы немного отличаются своими углеводными компонентами,но обладают одинаковым действием, биологической активностью и молекулярным весом. Несиалированная форма представляетилиформу, у которой удален концевой углевод (сиаловая кислота). Последовательности ДНК, кодирующие ЕРО, описаны в [US Pat.4703008 to Lin]. ЕРО стимулирует митотическое деление и дифференцировку клеток-предшественников эритроцитов и таким образом обеспечивает образование эритроцитов. ЕРО синтезируется в почках в случае преобладания условий гипоксии. В ходе вызванной ЕРО дифференцировки клеток-предшественников эритроцитов индуцируется синтез глобина; стимулируется синтез комплекса гема и увеличивается число ферритиновых рецепторов. Эти изменения позволяют клетке получать больше железа и синтезировать функциональный гемоглобин, который связывает кислород в зрелых эритроцитах. Таким образом, эритроциты и их гемоглобин играют ключевую роль в снабжении тела кислородом. Указанные изменения инициируются взаимодействием ЕРО с соответствующим рецептором на поверхности клетокпредшественников эритроцитов [См. н.р. Graber and Krantz (1978) Ann. Rev. Med. 29.51-66]. ЕРО присутствует в плазме крови в очень низкой концентрации, когда организм находится в здоровом состоянии, при этом ткани получают достаточное снабжение кислородом от существующего количества эритроцитов. Такая нормальная низкая концентрация достаточна для того, чтобы стимулировать замещение красных клеток крови, которые в норме стареют и гибнут. Количество ЕРО в крови повышается в условиях гипоксии, когда уменьшается транспорт кислорода циркулирующими клетками крови. Гипоксия может быть вызвана, например, существенной кровопотерей из-за кровотечения, разрушением красных кровяных клеток под действием излучения, уменьшением поступления кислорода из-за высокой высоты или продолжительного беспамятства, или различных форм анемии. В ответ на такой гипоксический стресс повышение уровня ЕРО усиливает образование красных кровяных клеток за счет стимуляции пролиферации клеток-предшественников эритроидного ряда. Если количество циркулирующих красных кровяных клеток больше, чем это необходимо для потребностей в кислороде нормальной ткани, уровень ЕРО в крови уменьшается. Поскольку ЕРО необходим для процесса образования красных кровяных клеток, этот гормон имеет потенциально полезные приложения, как в диагностике, так и в лечении гематологических заболеваний,характеризующихся низким или недостаточным формированием красных кровяных клеток. Исследования последних лет предоставили позволяют предположить эффективность терапии ЕРО для ряда болезненных состояний, расстройств и нарушений кровеносной системы, включая бета-талассемию [см. Vedovato, et al. (1984) Acta. Haematol. 71:211-213]; кистозный фиброз [см. Vichinsky et al. (1984) J. Pediatric 105:15-21]; беременность и нарушения менструального цикла [см. Cotes et al. (193) Brit. J. Ostet. Gyneacol. 90:304-311]; раннюю подростковую анемию [см. Haga, et al. (1983) Acta Pediatr. Scand. 72; 827-831]; повреждение спинного мозга [см. Claus-Walker, et al. (1984) Arch. Phys. Med. Rehabil. 65:370-374]; космический полет [см. Dunn, et al. (1984) Eur. J. Appl. Physiol. 52:178-182]; острое малокровие [см. Miller et al.(1982) Brit J. Haematol. 52:545-590]; старение [см. Udupa et al. (1984) J. Lab. Clin. Med. 103:574-580 и 581588 and Lipschitz et al. (1983) Blood 63:502-509]; различные новообразования, сопровождающиеся нарушениями эритропоэза [см. Dainiak et al. (1983) Cancer 5:1101-1106 и Schwartz et al. (1983) Otolaryngol. 109:269-272]; и почечную недостаточность [см. Eschbach. et al. (1987) N. Eng. J. Med. 316:73-78]. Очищенный гомогенный ЕРО был описан в [US Pat.4677195 to Hewick]. ПоследовательностьDNA, кодирующая ЕРО, очистили, клонировали и экспрессировали для получения рекомбинантного белка с теми же биохимическими и иммунологическими свойствами, что и нативный ЕРО. Также были получены молекулы рекомбинантного ЕРО с олигосахаридами, идентичным олигосахаридам нативного ЕРО [см. Sasaki, et al. (1987) J. Biol. Chem. 262:12059-12076]. Биологическое действие ЕРО по-видимому частично обусловлено взаимодействием с рецептором,находящимся на мембране клетки. В первоначальных исследованиях с использованием незрелых клеток эритроидного ряда, выделенных из селезнки мыши, было показано, что поверхностные белки ЕРО-1 014528 связывающих клеток включают два полипептида, которые имеют молекулярную массу примерно 85000 Да и 100000 Да, соответственно [Sawyer et al. (1987) Proc. Natl. Acad. Sci. США 84:3690-3694]. По оценкам число ЕРО-связывающих сайтов на поверхности одной клетки составляет в среднем от 800 до 1000. Из числа этих связывающих сайтов приблизительно 300 связывают ЕРО с Kd приблизительно 90 пМ (пикомоль), тогда как остальные связывают ЕРО с уменьшенной аффинностью приблизительно 570 пМ[Sawyer, et al. (1987) J. Biol. Chem. 262:5554-5562]. В независимых исследованиях было показано, что ЕРО-чувствительные эритробласты селезенки, выделенные из мышей, которым инъенцировали вызывающий анемию вирус лейкемии Friend-a (FVA), содержали в итоге приблизительно 400 связывающих ЕРО сайтов высокой и низкой аффинности со значениями Kd приблизительно 100 и 800 пМ, соответственно [Landschulz, et al. (1989) Blood 73:1476-1486]. Последующие исследования показали, что две формы рецептора ЕРО (EPO-R) кодируются единственным геном. Этот ген был клонирован [См., н.р., Jones, et al. (1990) Blood 76, 31-35; Noguchi, et al.(1991) Blood 78:2548-2556; Maouche, et al. (1991) Blood 78:2557-2563]. Например, последовательности ДНК и кодируемые ими последовательности белка EPO-R мыши и человека описаны в РСТ Pub.WO 90/08822 to D'Andrea, et al. Современные модели предполагают, что связывание ЕРО с EPO-R приводит к димеризации и активации двух молекул EPO-R, что запускает последующие этапы передачи сигнала[см., н.р., Watowich, et al. (1992) Proc. Natl. Acad. Sci. USA 89:2140-2144]. Доступность клонированных генов EPO-R облегчает поиск агонистов и антагонистов этого важного рецептора. Доступность рекомбинантного белка рецептора позволяет изучать взаимодействия рецепторлиганд в ряде систем случайной и полуслучайной генерации разнообразия пептидов. Такие системы включают в себя систему "пептиды на плазмиде" [описана в US Pat.6270170]; систему "пептиды на бактериофаге" [описана в US Pat.5432018 и Cwirla, et al. (1990) Proc. Natl. Acad. Sci. USA 87:63786382]; систему "кодирующая синтетическая библиотека" ("encoded synthetic library", ESL) [описана в патентном приложении США Ser.946239, подано 16 сентября 1992 г.]; и систему "широкомасштабного синтеза иммобилизованных полимеров" [описана в US Pat.5143854; РСТ Pub.90/15070; Fodor et al.(1991) Science 251:767-773; Dower and Fodor (1991) Ann. Rep. Med. Chem. 26:271-180; и US Pat5424186]. Пептиды, которые хотя бы в некоторой степени взаимодействуют с EPO-R, были идентифицированы и описаны, например, в патентах US Pat. - 5773569; 5830851; и 5986047 to Wrighton, et al.; РСТPCT Pub.WO 01/38342 to Balu; иWO 01/91780 to Smith-Swintosky et al. В частности, была выявлена группа пептидов, содержащих общий пептидный мотив, члены которой связываются с EPO-R и стимулируют ЕРО-зависимую клеточную пролиферацию. Однако идентифицированные к настоящему времени пептиды содержат мотив, стимулирующий ЕРО-зависимую пролиферацию клеток in vitro с величиной ЕС 50 от около 20 наномолей/л (нМ) до около 250 нМ. Таким образом, для стимулирования 50% от максимальной клеточной пролиферации, стимулируемой ЕРО, требуется концентрация пептида от 20 нМ до 250 нМ. Также были описаны другие пептиды и конструкции, которые связываются с рецептором ЕРО,например, в предварительных заявках US Serial - 60/470244, 60/470245, и 60/469993, все поданы 12 мая 2003 г.; предварительных заявках US Serial - 60/627432 и 60/627433, оба поданы 11 ноября 2004 г.; заявке US Serial310/844968, подано 12 мая 2004 г.; и Международные заявки PCT/US2004/14886 иPCT/US2004/014889, поданы 12 мая 2004 г., опубликованы как WO 2004/101611 и WO 2004/101606, соответственно. Содержание каждой из указанных заявок полностью включено в настоящее описание посредством ссылки. Поскольку агонисты EPO-R обладают огромным потенциалом, как для исследований важных биологичесих активностей, опосредованных этим рецептором, так и для лечения заболеваний, остается необходимость в обнаружении пептидных агонистов EPO-R, которые обладают усиленными действием и активностью. Настоящее изобретение обеспечивает такие соединения. Цитирование и/или обсуждение приведенных в этом разделе и на протяжении всего настоящего текста ссылок предложено лишь для того, чтобы пояснить описание настоящего изобретения, но не допускает трактовки, что одна из приведенных ссылок, представляет собой "предшествующий уровень техники" для настоящего изобретения. Краткое описание изобретения Настоящее изобретение обеспечивает новые пептидные соединения, которые представляют собой агонисты EPO-R существенно увеличенной силы действия и активности. Указанные пептидные соединения представляют собой гомодимеры мономеров пептида, который имеет аминокислотную последовательность: (AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO: 1), или гомодимерами мономеров пептида, который имеет аминокислотную последовательность (AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K(SEQ ID NO: 2), гомодимерами мономеров пептида, который имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG) (SEQ ID NO: 3); в которых каждая аминокислота обозначена стандартным однобуквенным сокращением, "(AcG)" обозначает N-ацетилглицин, "(1-nal)" обозначает 1 нафтилаланин, и "(MeG)" обозначает N-метилглицин, также известный как саркозин. Каждый пептидный мономер димера содержит внутримолекулярную дисульфидную связь между остатками цистеина ука-2 014528 занного мономера. Пептидные мономеры можно димеризовать с применением ковалентно присоединенного линкера на основе третичного разветвленного амида. Линкерный третичный амид может быть представлен как где X является NCO-(CH2)2-N1H-; С 1 атом линкера образует амидную связь с -аминогруппой Сконцевого остатка лизина первого пептидного мономера; С 2 атом линкера образует амидную связь с аминогруппой С-концевого остатка лизина второго пептидного мономера; и атом N1 группировки X соединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля(polyethylene glycol, PEG, ПЭГ), причем ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да(слово "примерно" означает, что после получения ПЭГ некоторые его молекулы обладают молекулярным весом больше, а некоторые меньше, чем указанный молекулярный вес). В случае, если каждый мономер в составе гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO:1) и атом N1 линкера соединен карбаматной связью с фрагментом активированного полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO:1) и атом N1 линкера соединен амидной связью с фрагментом активированного полиэтиленгликоля, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT (l-nal) VCQPLR(MeG)K (SEQ ID NO: 2) и атом N1 линкера соединен карбаматной связью с фрагментом активированного полиэтиленгликоля, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и атом N1 линкера соединен амидной связью с фрагментом активированного полиэтиленгликоля, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Пептидные мономеры также можно димеризовать с применением ковалентно присоединенного третичного разветвленного амида в качестве линкера. Линкерный третичный амид может быть представлен как: где X является NCO-(CH2)2-NH-C3O-; С 1 атом линкера образует амидную связь с -аминогруппой С-концевого остатка лизина первого пептидного мономера; С 2 атом линкера образует амидную связь с -аминогруппой С-концевого остатка лизина второго пептидного мономера. Пептидный димер согласно настоящему изобретению дополнительно содержит спейсерный фрагмент следующей структуры: где атом С 4 спейсера ковалентно связан с С 3 групы X; атом N1 спейсера ковалентно соединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля; и атом N2 спейсера соединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля, причем указанный ПЭГ имеет молекулярную массу примерно от 10000 до 50000 Да (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). Каждая субъединица ПЭГ может иметь молекулярную массу, соответственно, 10000 Да (10 кДа), 20, 30, 40 или 50 кДа. В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO:1) и как N1, так и N2 атомы спейсера ковалентно соединены карбаматной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть изображены следующим образом: В предпочтительных вариантах реализации настоящего изобретения С-концевой лизин двух пептидных мономеров представляет собой L-лизин. Специалистам в данной области из вышеуказанных химических структур также будет понятно, что указанные два линейных фрагмента ПЭГ соединены посредством лизина (например, как mPEG2-Lys-NHS или как mPEG2-Lysinol-NPC), который предпочтительно представляет собой L-лизин, что дает следующую стереохимию соединения. Альтернативно, один или более остатков лизина может представлять собой D-лизин, что приводит к альтернативной стереохимии, которая может быть легко определена специалистами в данной области. В случае, если каждый мономер в составе указанного гомодимера имеет аминокислотную последовательность, (AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO:1) и как атом N1, так и атом N2 спейсера ковалентно соединены амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Кроме того, предподтительно все молекулы лизина в этом соединении предпочтительно представляют собой L-лизин, что приводит к следующей стереохимии. В качестве альтернативы, один или более из остатков лизина может представлять собой D-лизин,что приводит к альтернативной стереохимии, которая может быть легко определена специалистами в данной области. В случае, если каждый мономер гомодимера имеет аминокислотную последовательность, (AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и как атом N1, так и атом N2 спейсера ковалентно соединены карбаматной связью с фрагментом активированного ПЭГ, где Y является карбаматной группой, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Предподтительно, все остатки лизина, соединяющие пептидные мономеры и линейные фрагменты ПЭГ в указанной молекуле, представляют собой L-лизин, что приводит к следующей стереохимии. Кроме того, один или более из остатков лизина может представлять собой D-лизин, что приводит к альтернативной стереохимиии, которая может быть легко определена специалистами в данной области. В случае, если каждый мономер указанного гомодимера имеет аминокислотную последовательность, (AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и как атом N1, так и атом N2 спейсера ковалентно соединены амидной связью с фрагментом активированного ПЭГ, где Y является карбаматной группой, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Предпочтительно все остатки лизина, объединяющие пептидные мономеры и линейные субъединицы ПЭГ в этой молекуле, представляют собой L-лизин, что приводит к следующей стереохимии. В другом варианте реализации настоящего изобретения один или более остатков лизина может представлять собой D-лизин, что приводит к альтернативной стереохимии, которая может быть легко определена специалистами в данной области. Пептидные мономеры также можно димеризовать посредством присоединения лизинового линкера,в который связан через -аминогруппу лизина с С-концом одного пептидного мономера и через аминогруппу лизина с С-концом второго пептидного мономера. Пептидный димер согласно настоящему изобретению может дополнительно содержать фрагмент спейсера следующей структуры: На одном конце спейсера атом N1 соединен амидной связью с карбонильным углеродом лизинового линкера. На противоположном конце спейсера атом N2 соединен карбаматной или амидной связью с сфрагментом активированного полиэтиленгликоля, причем указанный ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). В случае, когда спейсер соединен карбаматной связью с фрагментом активированного полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно настоящему изобретению (SEQ ID NO: 3) могут быть представлены следующим образом: В случае, когда спейсер соединен амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению (SEQ ID NO: 3) могут быть представлены следующим образом: Изобретение также обеспечивает способы лечения различных медицинских состояний с применением указанных пептидных соединений. Указанные способы включают лечение пациента, имеющего расстройство, которое характеризуется недостаточным содержанием эритропоэтина или низким или недостаточным уровнем красных кровяных клеток, посредством назначения пациенту терапевтически эффективного количества одного из вышеуказанных соединений. В определенных вариантах реализации настоящего изобретения расстройство представляет собой конечную стадию почечной недостаточности или диализа; связанную со СПИДом анемию, аутоиммунное заболевание или злокачественнуюопухоль; бета-талассемию; кистозный фиброз; раннюю подростковую анемию; анемию, связанную с хроническим воспалительным заболеванием; повреждение спинного мозга; острое малокровие; старение; или состояния опухолевых заболеваний, сопровождающиеся нарушениями кроветворения. Кроме того, в некоторых другом вариантах реализации настоящего изобретения, указанное расстройство представляет собой почечную недостаточность или диализ, а терапевтически эффективное количество соответствует дозировке от 0,025 до 0,2 мг вещества на 1 кг веса тела пациента. В других вариантах реализации настоящего изобретения, расстройство представляет собой почечную недостаточность или диализ, и терапевтически эффективное количество соответствует дозировке от 0,05 до 0,1 мг вещества на 1 кг веса тела пациента. В некоторых вариантах реализации настоящего изобретения расстройство представляет собой анемиею,связанную со злокачественной опухолью, а терапевтически эффективное количество соответствует дозировке от 0,075 до 0,5 мг вещества на 1 кг веса тела пациента. В других вариантах реализации настоящего изобретения расстройство является анемией, связанной со злокачественной опухолью, а терапевтически эффективное количество представляет собой дозировку от 0,2 до 0,4 мг вещества на 1 кг веса тела пациента. Терапевтически эффективную дозу можно однократно каждые 3 до 4 недели. Изобретение также охватывает фармацевтические составы, которые содержат указанные пептидные соединения. В некоторых вариантах реализации настоящего изобретения ПЭГ имеет молекулярную массу около 20000 Да. В других вариантах реализации настоящего изобретения, фармацевтический состав содержит любое из вышеназванных соединений и фармацевтически приемлемый носитель. Подробное описание изобретения Определения: Аминокислотные остатки в пептидах обозначены следующим образом: фенилаланин - Phe или F; лейцин - Leu или L; изолейцин - Ilе или I; метионин или М; валин - Val или V; серин - Ser или S; пролин Pro или Р; треонин - Thr или Т; аланин - Ala или А; тирозин - Туг или Y; гистидин - His или Н; глутамин Gln или Q; аспарагин - Asn или N; лизин - Lys или К; аспарагиновая кислота - Asp или D; глутаминовая кислота - Glu или Е; цистеин - Cys или С; триптофан - Trp или W; аргинин - Arg или R; и глицин - Gly или G. Неканонические аминокислоты в пептидах сокращены следующим образом: 1-нафтилаланин - 1nal или Np; N-метилглицин (так называемый саркозин), - MeG или Sc; и ацетилированный глицин (Nацетилглицин) - AcG. При использовании в настоящем описании термины "полипептид" или "белок" относятся к полимеру, состоящему из аминокислотных мономеров, в котором альфа-аминокислоты соединены вместе посредством пептидной связи. Следовательно, полипептиды имеют в длину, по меньшей мере, два аминокислотных остатка, но обычно больше. В целом, термин "пептид" относится к полипептиду, который имеет в длину только несколько аминокислотных остатков. Новые пептиды - агонисты EPO-R, согласно настоящему изобретению, предпочтительно имеют в длину не более, чем примерно 50 аминокислотных остатков. Наиболее предпочтительно, длина составляет от 17 до 40 аминокислотных остатков. Полипептид, по сравнению с пептидом, может содержать любое количество аминокислотных остатков. Следовательно, термин "полипептид" включает в себя пептиды, а также более длинные аминокислотные последовательности. При использовании в настоящем описании характеристика "фармацевтически приемлемый" относится к веществам и составам, которые "считают в целом безопасными", например, тем, что являются физиологически приемлемыми и, обычно, при назначении их человеку не вызывают аллергических или аналогичных нежелательных реакций, таких как расстройство желудка, головокружение и тому подобное. Термин "фармацевтически приемлемый" в данном тексте преимущественно означает одобренный полномочным агентством Федерального правительства или правительства штата США, или то, что указанное вещество или состав включены в US Pharmacopeia, или другую общепризнанную фармакопею,разрешающую их использование на животных, и в особенности на человеке. Термин "носитель" относится к растворителю, адъюванту, наполнителю или переносчику, совместно с которым назначают состав. Таким фармацевтическим носителем могут быть стерильные жидкости, такие как вода и масло, включая-8 014528 масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. В качестве носителей преимущественно применяют воду или водные растворы, солевые растворы и водные растворы декстрозы и глицерина, в особенности в растворах для инъекций. Пригодные фармацевтические носители описаны в"Remington's Pharmaceutical Sciences" под редакцией E.W. Martin. В данном тексте термин "агонист" относится к биологически активному лиганду, который связывается с соответствующим ему биологически активным рецептором и активирует последний, вызывая биологический ответ рецептора, или повышая уже существующую биологическую активность рецептора. Новые пептиды, которые представляют собой агонисты EPO-R Настоящее изобретение обеспечивает новые пептидные соединения, которые являются агонистамиEPO-R существенно увеличенной силы и активности. Указанные пептидные соединения представляют собой гомодимеры мономеров пептида, имеющего аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO: 1), или гомодимерами мономеров пептида, имеющего аминокислотную последовательность (AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2),гомодимерами мономеров пептида,имеющего аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG) (SEQ ID NO: 3); где каждая аминокислота обозначена стандартным однобуквенным сокращением, "(AcG)" обозначает N-ацетилглицин, "(1-nal)" обозначает 1 нафтилаланин, и "(MeG)" обозначает N-метилглицин, также известный как саркозин. Каждый пептидный мономер димера содержит внутримолекулярную дисульфидную связь между остатками цистеина указанного мономера. Такие мономеры могут быть схематически изображены следующим образом: Пептидные мономеры димеризуют, что обеспечивает пептидному димеру повышенную активность в качестве агониста EPO-R. Линкерный участок (LK) представляет собой разветвленный третичный амид,который соединяет С-концы двух пептидных мономеров, посредством одновременного присоединения к С-концевым остаткам лизина каждого из мономеров. Линкерный третичный амид может быть изображен как где X представляет собой NCO-(CH2)2-N1H-; атом С 1 линкера образует амидную связь с -аминогруппой С-концевого остатка лизина первого пептидного мономера; атом С 2 линкера образует амидную связь с -аминогруппой С-концевого остатка лизина второго пептидного мономера; и атом N1 группы X присоединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля (polyethylene glycol, ПЭГ), причем ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). Линкерный третичный амид также может быть изображен как где X представляет собой NCO-(CH2)2-NH-C3O-; атом С 1 линкера образует амидную связь с аминогруппой С-концевого остатка лизина первого пептидного мономера; атом С 2 линкера образует амидную связь с -аминогруппой С-концевого остатка лизина второго пептидного мономера. Пептидный димер согласно настоящему изобретению кроме того содержит спейсерный участок следующей структуры: где атом С 4 спейсера ковалентно связан с С 3 группы X; атом N1 спейсера ковалентно присоединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля; и атомN2 спейсера соединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля, причем ПЭГ имеет молекулярный вес примерно от 10000 до 60000 Да (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). Таким образом, новые пептиды согласно настоящему изобретению также могут содержать субъединицу ПЭГ, которая ковалентно соединена карбаматной или амидной связью с линкером на основе третичного амида указанного пептидного димера. ПЭГ представляет собой фармацевтически приемлемый водорастворимый полимер. ПЭГ, при использовании в настоящем изобретении, может быть линейным,-9 014528 неразветвленным полиэтиленгликолем, имеющим молекулярную массу от примерно 20 килодальтон (20 кДа), до примерно 60 кДа (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). Наиболее предпочтительно, ПЭГ имеет молекулярную массу в интервале от 30 до 40 кДа. Специалист в данной области может выбрать желаемый размер полимера, основываясь на таких соображениях, как желаемая дозировка; время циркуляции в крови; устойчивость к протеолизу; влияние, если таковое имеется, на биологическую активность; простота в применении; степень или отсутствие антигенности; и другие известные эффекты влияния ПЭГ на терапевтический пептид. Пептиды, димеры пептидов и другие молекулы на основе пептидов согласно настоящему изобретению могут быть присоединены к водорастворимым полимерам (например, ПЭГ) с применением любой из ряда химических реакций, позволяющих связать водорастворимый полимер(ы) с рецепторсвязывающей частью молекулы (например, пептид + спейсер). В типичном варианте реализации настоящего изобретения применяют единственную сшивку для ковалентного соединения водорастворимого полимер(ов) с рецептор-связывающей частью молекулы, однако в альтернативных вариантах реализации настоящего изобретения могут быть использованы множественные сшивки, включая дополнительные варианты, в которых с рецепторсвязывающей частью по различным положениям присоединены различные виды водорастворимого полимера(ов), указанные места присоединения могут включать ковалентные связи со спейсером и/или с одной или обеими пептидными цепями. В некоторых вариантах реализации настоящего изобретения димер или мультимер более высокого порядка содержит пептидные цепи различного вида (то есть гетеродимер или гетеромультимер). Исключительно в качестве примера, но не ограничения, указанный димер может содержать первую пептидную цепь, которая содержит сайт присоединения ПЭГ, и вторую пептидную цепь, у которой может отсутствовать соединение с ПЭГ или может быть использован другой вид связи, чем для первой пептидной цепи, и в некоторых вариантах реализации настоящего изобретения, спейсер может либо содержать, либо не содержать сайт присоединения ПЭГ, для вышеназванного спейсер, в случае связи с полиэтиленгликолем, могут применять другой тип связи, чем способ связи первой и/или второй пептидной цепи. Альтернативный вариант реализации настоящего изобретения предполагает фрагмент ПЭГ, который связан со спейсерной частью рецепторсвязывающей части, тогда как с боковой цепью одной из аминокислот пептидной части молекулы соединен другой водорастворимый полимер природы (например, углевод). Широкое разнообразие видов полиэтиленгликоля может быть использовано для присоединения ПЭГ (ПЭГилирования) к рецепторсвязывающей части молекулы (пептиды + спейсер). По существу,можно использовать любой подходящий реакционноспособный реагент ПЭГ. В предпочтительных вариантах реализации настоящего изобретения применение реакционноспособного реагента ПЭГ приводит к образованию карбаматной или амидной связи с рецепторсвязывающей частью молекулы. Подходящие реакционноспособные виды ПЭГ включают, но не ограничиваются, коммерчески доступными видами согласно каталогам: Drug Delivery Systems catalog (2003) корпорации NOF (Yebisu Garden Place Tower,20-3 Ebisu 4-chome, Shibuya-ku, Tokyo 150-6019) и Molecular Engineering catalog (2003) от Nektar Therapeutics (490 Discovery Drive, Huntsville, Alabama 35806). В качестве примера, но не для ограничения, приведены следующие реагенты полиэтиленгликоля, часто являющиеся предпочтительными в различных вариантах реализации настоящего изобретения: mPEG2-NHS, mPEG2-ALD, multi-Arm PEG,mPEG(MAL)2, mPEG2(MAL), mPEG-NH2, mPEG-SPA, mПЭГ-SBA, тПЭГ-тиоэфиры, mPEG-двойные эфиры, mPEG-BTC, mPEG-ButyrALD, mPEG-ACET, гетерофункциональные полиэтиленгликоли (NH2PEG-COOH, Boc-PEG-NHS, Fmoc-PEG-NHS, NHS-PEG-VS, NHS-PEG-MAL), акрилаты полиэтиленгликоля (ACRL-PEG-NHS), ПЭГ-фосфолипиды (например, mPEG-DSPE), химически активированные, способами, известными специалистам в данной области, разветвленные полиэтиленгликоли серии SUNBRITE, включая серию GL, основывающуюся на глицерине. Любой из активированных полиэтиленгликолей SUNBRITE, включая, но не ограничиваясь: карбоксил-ПЭГ, p-NP-ПЭГ, трезил-ПЭГ, альдегидПЭГ, ацеталь-ПЭГ, амино-ПЭГ, тиол-ПЭГ, малеимидо-ПЭГ, гидроксил-ПЭГ-амин, амино-ПЭГ-СООН,гидроксил-ПЭГ-альдегид, ПЭГ типа кислотного ангидрида, функциональные ПЭГ-фосфолипиды, и другие аналогичные и/или пригодные реактивы ПЭГ, которые могут быть выбраны специалистами в данной области для их конкретного применения и использования. Новые пептиды согласно настоящему изобретению также могут содержать две субъединицы ПЭГ,которые ковалентно соединены карбаматными или амидными связями со спейсерным фрагментом, который соединен с линкером пептидного димера на основе третичного амида. Каждая из двух субъединиц ПЭГ, использумых в подобных вариантах реализации настоящего изобретения, может быть линейной,они могут быть связаны вместе в единственной точке прикрепления. Каждая субъединица ПЭГ, используемого в настоящем изобретении, имеет желательную молекулярную массу от примерно 10 килодальтон (10 кДа), до примерно 60 кДа (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указанный молекулярный вес). Особенно предпочтительны линейные субъединицы ПЭГ. Наиболее предпочтительно, чтобы каждая из двух субъединиц ПЭГ имела молекулярную массу в интервале от 20 до 40 кДа, а еще более желательно - в интервале от 30 до 40 кДа. Специалист в данной области может выбрать желаемый размер полимера, основываясь- 10014528 на таких соображениях, как желаемая дозировка; время циркуляции в крови; устойчивость к протеолизу; влияние, если таковое имеется, на биологическую активность; простота в применении; степень или отсутствие антигенности; и другие известные эффекты влияния ПЭГ на терапевтический пептид. Настоящее изобретение также охватывает пептиды-агонисты, которые представляют собой гомодимеры пептидных мономеров, имеющих аминокислотную последовательность (AcG)GLYACHMGPIT(lnal)VCQPLR(MeG) (SEQ ID NO: 3); где каждая аминокислота обозначена стандартным однобуквенным сокращением, "(AcG)" обозначает N-ацетилглицин, "(1-nal)" обозначает 1-нафтилаланин, и "(MeG)" обозначает N-метилглицин, также известный как саркозин. Каждый пептидный мономер указанного димера содержит внутримолекулярную дисульфидную связь между остатками цистеина мономера. Такие мономеры могут быть схематически представлены следующим образом: Указанные мономерные пептиды связаны таким образом, что образуют пептидный димер с повышенной активностью в качестве агониста EPO-R. Линкерная субъединица (LK) представляет собой остаток лизина, который соединяет С-концы двух пептидных мономеров, одновременно связываясь с Сконцевыми аминокислотами каждого из мономеров. Первый пептидный мономер связан своим С-концом с -аминогруппой лизина и второй пептидный мономер также связан своим С-концом с -аминогруппой лизина. Например, подобный димер может быть описан структурной формулой I и схематично формулой II В формулах I и II, N2 означает атом азота -аминогруппы лизина и N1 означает атом азота аминогруппы лизина. Пептидный димер согласно настоящему изобретению также содержит спейсерный фрагмент следующей структуры: На одном конце атом N1 спейсера ковалентно соединен посредством карбаматной или амидной связи с фрагментом активированного полиэтиленгликоля; на противоположном конце атом N2 спейсера присоединен посредством карбаматной или амидной связи к субъединице активированного полиэтиленгликоля, причем ПЭГ имеет молекулярную массу примерно от 10000 до 60000 Да (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше,чем указанный молекулярный вес). Предпочтительно ПЭГ имеет молекулярную массу от 20000 до 40000 Да. Таким образом, пептиды согласно настоящему изобретению содержат фрагмент ПЭГ, который ковалентно связан с пептидным димером. ПЭГ представляет собой фармацевтически приемлемый водорастворимый полимер. ПЭГ, при использовании в настоящем изобретении, может быть линейным, неразветвленным полиэтиленгликолем, имеющим молекулярную массу от примерно 20 килодальтон (20 кДа),до примерно 60 кДа (слово "примерно" означает, что после получения ПЭГ некоторые его молекулы имеют вес больше, а некоторые меньше, чем указаный молекулярный вес). Наиболее предпочтительно,ПЭГ имеет молекулярную массу в интервале от 20 до 40 кДа, а еще более желательно ПЭГ имеет молекулярную массу в интервале от 30 до 40 кДа. Специалист в данной области может выбрать желаемый размер полимера, основываясь на таких соображениях, как желаемая дозировка; время циркуляции в крови; устойчивость к протеолизу; влияние, если оно есть, на биологическую активность; простота в применении; степень или отсутствие антигенности и другие известные эффекты влияния ПЭГ на терапевтический пептид. В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO: 1) и атом N1 линкера ковалентно присоединен карбаматной связью к фрагменту активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO:1) и атом N1 линкера ковалентно соединен амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и атом N1 линкера ковалентно соединен карбаматной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и атом N1 линкера ковалентно соединен амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Предпочтительные пептидные димеры в соответствии с настоящим изобретением включают, но не ограничиваются: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO: 1) и как N1, так и N2 атомы спейсера ковалентно соединены карбаматной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLRK (SEQ ID NO: 1) и как N1, так и N2 атомы спейсера ковалентно соединены амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и как N1, так и N2 атомы спейсера ковалентно соединены карбаматной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: В случае, если каждый мономер гомодимера имеет аминокислотную последовательность(AcG)GLYACHMGPIT(l-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и как N1, так и N2 атомы спейсера ковалентно соединены амидной связью с фрагментом активированного ПЭГ, новые пептидные соединения согласно настоящему изобретению могут быть представлены следующим образом: Предпочтительные пептидные димеры в соответствии с настоящим изобретением включают, но не ограничиваются: Спейсер соединен карбаматной связью с фрагментом активированного полиэтиленгликоля (ПЭГ),новые пептидные соединения согласно настоящему изобретению (SEQ ID NO: 3) могут быть представлены следующим образом: Спейсер соединен амидной связью с фрагментом активированного полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно настоящему изобретению (SEQ ID NO: 3) могут быть представлены следующим образом: Такая структура димера может быть обозначена как [Ас-пептид, дисульфидный мостик]2Lys спейсер-ПЭГ 20-40 кД, где обозначены ацетилированные на N-конце пептиды, связанные с обеими, ии аминогруппами лизина соответственно, содержащие внутримолекулярные дисульфидные связи, и молекула спейсера, образующая ковалентную связь между С-концом лизина и фрагментом ПЭГ, которая имеет молекулярную массу примерно от 20000 до 40000 Да. Предпочтительные пептидные димеры согласно настоящему изобретению включают, но не ограничиваются: Стереоизомеры двадцати стандартных аминокислот (например, D-аминокислоты), не встречающиеся в природе аминокислоты, такие как ,-двузамещенные аминокислоты, N-алкил-аминокислоты, молочная кислота, и другие неканонические аминокислоты также могут быть пригодными компонентами соединений, относящихся к настоящему изобретению. Примеры неканонических аминокислот включают, но не ограничиваются: -аланин, 3-пиридилаланин, 4-гидроксипролин, О-фосфосерин, Nметилглицин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, nor-лейцин и другие аналогичные аминокислоты и иминокислоты. Также возможны другие модификации, включая модификации N- и С-концов, замена одной или более из естественных генетически кодируемых аминокислот на неканонические аминокислоты, модификации боковой цепи одного или более аминокислотных остатков, фосфорилирование пептида, и тому подобное. Последовательности пептидов из соединения согласно настоящему изобретению представляют собой только указанные последовательности или их аналоги, дополненные пептидами на N-конце и/или на С-конце. Подобными дополнениями могут служить последовательности, кодирующие природные пептиды, дополненные последовательностями неприродного происхождения или в значительной степени без таковых; дополнения могут включать любые вставки, делеции, точковые мутации или другие модификации последовательности либо их комбинации по желанию специалиста в данной области. Для примера,но не для ограничения, естественно возникшие последовательности могут быть полноразмерными или- 25014528 частичной длины и могут содержать замены аминокислот, обеспечивающие сайты присоединения углеводов, ПЭГ, других полимеров, или тому подобного, посредством соединения с боковой цепью. В качестве варианта, аминокислотные замены приводят к гуманизированной последовательности, которая является совместимой с иммунной системой человека. Предусмотрены гибридные белки всех типов, включая последовательности иммуноглобулинов, расположенные в непосредственной близости от EPO-R активирующей последовательности согласно настоящему изобретению или смежные с ней с применением или без последовательности неиммуноглобулинового спейсера. Одним из вариантов реализации настоящего изобретения предусмотрена иммуноглобулиновая цепь, которая содержит EPO-R активирующую последовательность вместо вариабельного региона (V) тяжелой и/или легкой цепи. Получение пептидов, относящихся к настоящему изобретению Синтез пептидов Пептиды, относящиеся к настоящему изобретению, могут быть получены с помощью классических способов, известных в данной области. Указанные стандартные способы включают полностью твердофазный синтез, способы частично твердофазного синтеза, конденсацию фрагментов, классический синтез в растворе, и технологию рекомбинантных ДНК [см., например, Merrifield J. Am. Chem. Soc. 1963 85:2149]. В одном варианте реализации настоящего изобретения пептидные мономеры димера синтезируют отдельно и димеризуют после завершения синтеза. В другом варианте реализации настоящего изобретения пептидные мономеры димера связаны через их С-концы с применением линкерной субъединицы LK на основе третичного разветвленного амида,имеющего две функциональные группы, способные служить сайтами инициации для синтеза пептида, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая способна связываться с другой молекулярным фрагментом (который, например, может присутствовать на поверхности твердого носителя). В этом случае два пептидных мономера можно синтезировать непосредственно на двух реакционноспособных азотсодержащих группах линкерной субъединицы LK с вариацией техники твердофазного синтеза. Такой синтез может быть последовательным или одновременным. В другом варианте реализации настоящеего изобретения два пептидных мономера могут быть синтезированы непосредственно на двух реакционноспособных азотсодержащих группах линкерной субъединицы LK с применением варианта техники твердофазного синтеза. Такой синтез может быть последовательным или одновременным. В этом варианте реализации настоящего изобретения субъединица лизинового линкера (LK) содержит две аминогруппы, способные служить сайтами инициации для синтеза пептида, и третью функциональную группу (например, карбоксильную группу лизина; или аминогруппу амида лизина, карбоксильная группа остатка лизина в котором преобразована в амидогруппу CONH2),которая способна связываться с другой молекулярной субъединицей (которая, например, может присутствовать на поверхности твердого носителя). В случае если производят последовательный синтез цепей пептидного димера на линкере, две функциональные аминогруппы в молекуле линкера защищают двумя другими независимо удаляемыми аминозащитными группами. Защищенный линкер связан с твердым носителем посредством третьей функциональной группы линкера. Первую аминозащитную группу удаляют и синтезируют первый пептид димера на первой реакционноспособной аминогруппе. Затем удаляют вторую аминозащитную группу и синтезируют второй пептид димера на второй реакционноспособной аминогруппе. Например, первая аминогруппа линкера может быть защищена группой Alloc (аллилоксикарбонил), а вторая - защищена группой Fmoc (флуоренилметилоксикарбонил). В этом случае группа Fmoc (но не группа Alloc), может быть удалена обработкой мягким основанием [например, 20% пиперидином в диметилформамиде(DMF)], после чего синтезируют первую пептидную цепь. Затем с помощью пригодных реагентов [например, Pd(PPh3)/4-метил морфолин и хлороформ] можно удалить группу Аllос и синтезировать вторую пептидную цепь. Следует отметить, что для цистеина должны быть использованы различные тиолзащитные группы, чтобы управлять образованием дисульфидных связей (как обсуждается ниже), данную технологию нужно применять, даже если конечные аминокислотные последовательности пептидных цепей димера идентичны. В случае, если осуществляется одновременный синтез цепей пептидного димера на линкере, две функциональные аминогруппы в молекуле линкера защищают двумя одинаково удаляемыми аминозащитными группами. Защищенный линкер связан с твердым носителем посредством третьей функциональной группы линкера. В этом случае одновременно снимают защиту с двух защищенных функциональных групп молекулы линкера, и две пептидные цепи одновременно синтезируют на реакционоспособных группах. Следует отметить, что, применяя данный способ, получают идентичные последовательности пептидных цепей димера и используют одинаковые тиолзащитные группы для остатков цистеина. Предпочтительным способом пептидного синтеза является твердофазный синтез. Процедура твердофазного синтеза хорошо известна в данной области техники [см., например, Stewart Solid Phase PeptideDiego, USA; Goodman Synthesis of Peptides and Peptidomimetics (Houben-Weyl, Stuttgart) 2002]. В твердофазном синтезе синтез обычно начинают с С-конца пептида с использованием -аминозащитной смолы.- 26014528 Пригодный исходный материал может быть подготовлен, например, присоединением необходимой аминокислоты к хлорметилированной смоле, гидроксиметилированной смоле, полист ирольной смоле,бензидриламиновой смоле, или тому подобным. Одна из таких хлорметилированных смола продается под фирменным названием BIO-BEADS SX-1 от Bio Rad Laboratories (Richmond, CA). Подготовка гидроксиметилированной смолы описана в [Bodonszky, et al. (1966) Chem. Ind. London 38:1597]. Бензидриламиновая смола (ВНА) описана в [Pietta and Marshall (1970) Chem. Commun. 650], ее гидрохлоридная форма коммерчески доступна в Beckman Instruments, Inc. (Palo Alto, CA). Например, аминозащищенная-аминокислота может быть связана с хлорметилированной смолой с помощью катализатора бикарбоната цезия, в соответствии с методом, описанным Gisin (1973) Helv. Chim. Acta 56:1467. После образования начальной связи с -аминогруппы удаляют защиту, например, используя растворы в органических растворителях трифторуксусной кислоты (trifluoroacetic acid, TFA) или хлороводородной кислоты (HCl) при комнатной температуре. В соответствии с этим аминокислоты с защищенной-аминогруппой последовательно присоединяют к связанной с носителем растущей пептидной цепи. Защитные группы для -аминогрупп могут представлять собой любые, которые могут быть использованы в области пошагового синтеза пептидов, включая: защитные группы ацильного типа (например, формил, трифторацетил, ацетил), защитные группы типа ароматических уретанов [например, бензилоксикарбинол (Cbz) и замещенные Cbz], защитные группы типа алифатических уретанов [например, третбутилоксикарбонил (Вос), изопропилоксикарбонил, циклогексилоксикарбонил] и защитные группы алкильного типа (например, бензил, трифенилметил), флуоренилметилоксикарбонил (Fmoc), аллилоксикарбонил (Alloc) и 1-(4,4-диметил-2,6-диокоциклогекс-1-илиден)этил (Dde). Группы, защищающие боковую цепь (обычно простые и сложные эфиры, тритил, РМС, и тому подобное), остаются интактными в течение образования связи и не отщепляются ни в процессе снятия защиты с аминоконцевой группы, ни во время образования связи. Защитная группа для боковой цепи должна быть отщепляемой по завершению синтеза конечного пептида и при условиях реакции, которые не влияют на полученный пептид. Защитные группы для боковой цепи тирозина включают тетрагидропиранил, трет-бутил, тритил, бензил, Cbz, Z-Br-Cbz, и 2,5-дихлорбензил. Защитные группы для боковой цепи аспарагиновой кислоты включают бензил, 2,6-дихлорбензил, метил, этил и циклогексил. Защитные группы для боковой цепи серина и треонина включают ацетил, бензоил, тритил, тетрагидропиранил, бензил, 2,6-дихлорбензил и Cbz. Защитные группы для боковой цепи аргинина включают нитрогруппу, тозил (Tos), Cbz, адамантилоксикарбонил, мезитоилсульфанил (Mts), 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил (Pbf), 4-метокси-2,3,6-триметилбензензульфонил (Mtr) или Boc. Защитные группы для боковой цепи лизина включают Cbz, 2-хлоробензилоксикарбонил (2-Cl-Cbz), 2 бромобензилоксикарбонил (2-Br-Cbz), Tos или Boc. После удаления защиты с -аминогруппы остальные защищенные аминокислоты пошагово добавляют в желаемом порядке. Каждую защищенную аминокислоту обычно вводят в реакцию примерно в трехкратном избытке, используя подходящий активатор карбоксильной группы, как, например, 2-(1Hбензотриазол-1-ил)-1,1,3,3 тетраметилмочевины гексафлуорофосфат 2-(1 Н-benzotriazol-l-yl)-1,1,3,3(dicyclohexylcarbodimide, DCC) растворенный, например, в метиленхлориде (CH2Cl2), N-метил пирролидоне, диметилформамиде (dimethyl formamide, DMF), или их смеси. После того как синтез желаемой аминокислотной последовательности завершен, желаемый пептид отделяют от несущей смолы после обработки соответствующим реагентом, таким как трифторуксусная кислота или фтороводород HF, которые не только отделяют пептид от смолы, но также снимают остальные защитные группы с боковых цепей. В случае использования хлорметилированной смолы обработка фтороводородом приводит к образованию свободного пептида в форме кислоты. В случае использования бензидриламиновой смолы обработка фтороводородом приводит к образованию свободного пептида в форме амида. Напротив, в случае использования хлорметилированной смолы пептид с защищенными группами боковых цепей можно снять при помощи обработки смолы аммиаком, и таким образом получить желаемый амид с защищенными боковыми цепями, или алкиламином, таким образом получить алкиламиды или диалкиламиды с защищенными боковыми цепями. Защиту с боковых цепей затем удаляют обычным способом при помощи фтороводорода, получая свободные амиды, алкиламиды, или диалкиламиды. При получении сложных эфиров в соответствии с настоящим изобретением применяют смолу для получения пептида в форме кислоты, и пептид с защищенными боковыми цепями отщепляют с помощью основания и подходящего спирта (например, метанола). Защитные группы боковых цепей затем удаляют обычным способом, обработкой фтороводородом, и получают желаемый сложный эфир. Эти процедуры также могут быть использованы для того, чтобы синтезировать пептиды, в которых присутствуют другие аминокислоты, помимо двадцати аминокислот природного происхождения, в одном, двух или более положениях любого из соединений согласно настоящему изобретению ими заменяют генетически кодируемые аминокислоты. Синтетические аминокислоты, которые могут входить в состав пептидов согласно настоящему изобретению, включают, но не ограничиваются, N-метил, Lгидроксипролил, L-3,4-дигидроксифенилаланил, -аминокислоты, такие как Lгидроксилизил и D 27014528 метилаланил, Lметилаланин, -аминокислоты и изохинолил. D-аминокислоты и синтетические аминокислоты неприродного происхождения также могут быть входить в состав пептидов согласно настоящему изобретению. Модификации пептидов Концевые аминогруппы и/или карбоксильные группы пептидных веществ согласно настоящему изобретению также можно модифицировать для того, чтобы получить другие вещества согласно настоящему изобретению. Например, концевую аминогруппу можно ацетилировать уксусной кислотой или ее галогенпроизводными, такими как например, -хлоруксусная кислота, -бромуксусная кислота или иодуксусная кислота). Боковые цепи 20 природных генетически кодируемых аминокислот (или стереоизомеры D аминокислот) можно заменить другими боковыми цепями, например, такими группами, как алкилы, низшие алкилы, циклические 4-, 5-, 6- и 7-членные алкилы, амиды низших алкилов, диамиды (низших алкилов),алкокси-, гидрокси-, карбоксипроизводные низших алкилов и их сложные эфиры, 4-, 5-, 6-, 7-членные гетероциклы. В частности, можно применять аналоги пролина, в которых размер цикла в остатке пролина заменен с 5- на 4-, 6- или 7-членный. Циклические группы могут быть насыщенными или ненасыщенными, в случае если они ненасыщенные, то могут быть ароматическими или неароматическими. Гетероциклические группы предпочтительно содержат один или более гетероатом азота, кислорода и/или серы. Примеры таких групп включают фуразанил, фурил, имидазолинил, имидазолил, имидозолинил, изотиазолил, изооксазолил, морфолинил (например, морфолиногруппа), оксазолил, пиперазинил (например, 1 пиперазинил), пиперидил (например, 1-пипередил, пиперидиногруппа), пиранил, пиразинил, пиразолидинил, пиразолинил, пиарзолил, пиридазинил, пиридил, пиримидинил, пирролидинил (например, 1 пирролидинил), пирролинил, пирролил, тиадиазолил, тиазолил, тиенил, тиоморфолинил (например, тиоморфолиногруппа) и триазолил. Эти гетероциклические группы могут быть замещенными или незамещенными. В случае если группа является замещенной, заместитель может быть алкилом, простым эфиром, галогеном, кислородом или замещенным, или незамещенным фенилом. Можно также легко модифицировать пептиды путем фосфорилирования и другими способами [например, как описано в Hruby, et al. (1990) Biochem J. 268:249-262]. Пептидные соединения согласно настоящему изобретению также служат в качестве структурных моделей для непептидных соединений с аналогичной биологической активностью. Специалисты в данной области признают, что для создания соединений с той же или аналогичной желаемой биологической активностью, такой же, как у указанного пептида, но с более желательными свойствами, чем у указанного пептида, в отношении растворимости, стабильности и устойчивости к гидролизу и протеолизу, доступен ряд способов [см. Morgan and Gainor (1989) Ann. Rep. Med. Chem. 24:243-252]. Эти методы включают замещение остова пептида остовом, сформированным фосфонатами, амидатами, карбаматами, сульфонамидами, вторичными аминами и N-метиламинокислотами. Образование дисульфидных связей Соединения ссогласно настоящему изобретению содержат две внутримолекулярные дисульфидные связи. Такие дисульфидные связи могут быть получены окислением остатков цистеина каждого пептидного мономера. В одном способе реализации настоящего изобретения контроль образования межцистеиновых связей осуществляют посредства выбора типа окисляющего агента и его эффективной концентрации, чтобы оптимизировать образование желаемого изомера. Например, окисление пептидного димера, в котором образуются две внутримолекулярные дисульфидные связи (по одной в каждой пептидной цепи), предпочтительно достигается (по отношению к образованию межмолекулярных дисульфидных связей), когда окисляющим агентом является DMSO или иод (I2). В других вариантах реализации настоящего изобретения образование межцистеиновых связей контролируют благодаря избирательному использованию тиолзащитных групп в течение синтеза пептида. Например, в случае когда желательным является димер с двумя внутримолекулярными дисульфидными связями, первую пептидную цепь мономера синтезируют с двумя остатками цистеина основной последовательности, защищенными первой тиолзащитной группой [например, тритил (Trt), алкилоксикарбонил(Alloc), и 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил (Dde) или тому подобному], затем синтезируют второй пептидный мономер, два остатка цистеина основной последовательности которого защищены второй тиол-защитной группой, отличной от первой группы [например, ацетамидометил (Acm), третбутил (tBu), или тому подобное]. Согласно этому первую тиолзащитную группу удаляют, производя бисульфидную циклизацию первого мономера, а затем удаляют вторую тиолзащитную группу, производя бисульфидную циклизацию второго мономера. Другие варианты реализации настоящего изобретения предусматривают в качестве аналогов пептидов их дисульфидные производные, в которых один из атомов серы заменен СН 2 группой или другой аналогичной группой для серы. Такие аналоги могут быть получены из соединений согласно настоящему изобретению, в которых каждый пептидный мономер содержит по крайней мере один остаток цистеина или гомоцистеина и -аминомасляную кислоту вместо второго остатка цистеина, посредством внут- 28014528 римолекулярного или межмолекулярного замещения, с использованием способов, известных в данной области [см., например, Barker, et al. (1992) J. Med. Chem. 35:2040-2048 и Or, et al. (1991) J. Org. Chem. 56:3146-3149]. Специалист в данной области легко поймет, что такое замещение можно также произвести с использованием других гомологов -аминомасляной кислоты и гомоцистеина. Дополнительно к предыдущей стратегии циклизации могут быть применены другие стратегии циклизации пептидов без участия дисульфидных связей. Такие альтернативные стратегии циклизации включают, например, амидную стратегию циклизации, а также образование тиоэфирных связей. Таким образом, соединения согласно настоящему изобретению могут существовать в циклической форме с внутримолекулярными амидными либо тиоэфирными связями. Например, может быть синтезирован пептид, в котором один цистеин основной последовательности заменен на лизин и второй цистеин заменен на глутаминовую кислоту. В соответствии с этим циклический мономер может быть получен посредством амидной связи между боковыми цепями этих двух остатков. Кроме того, может быть синтезирован пептид, в котором один цистеин основной последовательности заменен на лизин (или серин). Циклический мономер может быть затем получен посредством образования тиоэфирной связи между боковыми цепями остатков лизина (или серина) и вторым остатком цистеина основной последовательности. В дополнение к дисульфидным стратегиям циклизации, для циклизации соединений согласно настоящему изобретению легко могут быть использованы амидная и тиоэфирная стратегии циклизации. Кроме того, аминоконцевой остаток пептида может быть закрыт -замещенной уксусной кислотой, в которой заместитель у-атома является удаляемой группой, такой как -галогенуксусная кислота, например -хлоруксусная кислота, -бромуксусная кислота или -иодуксусная кислота. Добавление линкера на основе третичного разветвленного амида Пептидные мономеры можно димеризовать с применением линкера, представляющего собой третичный разветвленный амид. В одном способе реализации настоящего изобретения линкер включают в пептид в ходе синтеза пептида. Например, в случае, если субъединица линкера LK содержит две функциональные группы, способные служить в качестве сайтов инициации для синтеза пептида, и одну или более другую функциональную группу (например, карбоксильную или аминогруппу), что позволяет связываться с одной или более другими молекулярными субъединицами, линкер может быть конъюгирован с твердым носителем. Таким образом, два пептидных мономера могут быть синтезированы непосредственно на двух реакционноспособных азотсодержащих группах субъединицы линкера LK согласно модифицированной методике твердофазного синтеза. В альтернативных вариантах реализации настоящего изобретения линкер может быть конъюгирован с двумя пептидными мономерами димера после синтеза пептида. Такое соединение может быть достигнуто хорошо известными в данной области техники методами. В одном способе реализации настоящего изобретения, линкер содержит две функциональные группы, пригодные для присоединения к функциональным группам-мишеням синтезированных пептидных мономеров. Например, линкер, содержащий две карбоксильные группы, либо предактивированные, либо в присутствии подходящих связующих агентов, может прореагировать с аминогруппами-мишенями боковой цепи лизина каждого из двух пептидных мономеров. Например, мономеры пептида могут быть химически связаны с линкером - третичным амидом,где X представляет собой NCO-(CH2)2-NH-Y, a Y - подходящая защитная группа, как например,трет-бутилоксикарбонил (Вое) защитная группа; А - пригодная функциональная группа, такая как Nоксисукцинимид, используемая для связи атома С 1 линкера с -аминогруппой С-концевого остатка лизина первого пептидного мономера; и В - пригодная функциональная группа, такая как Nоксисукцинимид, используемая для связи атома С 2 линкера с -аминогруппой С-концевого остатка лизина второго пептидного мономера. Дополнительно, например, мономеры пептида могут химически связаны линкером на основе третичного амида где X представляет собой NCO-(CH2)2-NH-C3O-; A - пригодная функциональная группа, такая какN-оксисукцинимид, используемая для связи атома С 1 линкера с- аминогруппой С-концевого остатка лизина первого пептидного мономера; и В - пригодная функциональная группа, такая как Nоксисукцинимид, используемая для связи атома С 2 линкера -аминогруппой С-концевого остатка лизина второго пептидного мономера; и линкер на основе третичного амида химически связан со спейсерным фрагментом где атом С 3X связан ковалентной связью с атомом С 4 спейсера; aY - пригодная защитная группа, как например, трет-бутилоксикарбонил защитная группа (Вос). Добавление лизинового линкера Мономеры пептида можно димеризовать с применением субъединицы лизинового линкера LK. В одном способе реализации настоящего изобретения лизиновый линкер включают в пептид в ходе его
МПК / Метки
МПК: A61P 7/06, A61K 38/05
Метки: пептиды, применение, содержащие, стимулирующие, составы, эритропоэтина, рецептор
Код ссылки
<a href="https://eas.patents.su/30-14528-sostavy-soderzhashhie-peptidy-stimuliruyushhie-receptor-eritropoetina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Составы, содержащие пептиды, стимулирующие рецептор эритропоэтина и их применение</a>
Предыдущий патент: Вакцины против хламидиоза
Следующий патент: Полипептидные маркеры для диагностики и оценки сосудистых заболеваний
Случайный патент: Использование обломков выбуренной породы для прогнозирования затухания в реальном времени