Арилсульфонамидные аминосоединения и их применение в качестве лигандов 5-ht6
Номер патента: 19496
Опубликовано: 30.04.2014
Авторы: Бхирапунени Геопинадх, Джасти Венкатесварлу, Нироджи Рамакришна, Схинде Анил Карбхари, Джаяраджан Прадип, Камбхампати Рама Састри
Формула / Реферат
1. Соединение общей формулы (I)
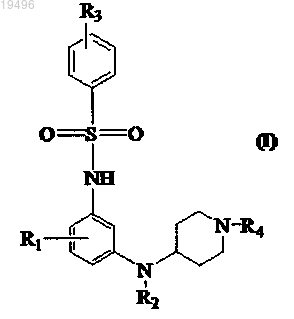
или его фармацевтически приемлемая соль,
где R1 представляет собой водород, хлор, метокси или метил;
R2 представляет собой водород или метил;
R3 представляет собой водород, хлор, бром, фтор, метил или изопропил;
R4 представляет собой водород или метил.
2. Соединение по п.1, которое выбирают из группы, включающей
N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-фтор-N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-метил-N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-изопропил-N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
2-бром-N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-фтор-N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
2-бром-N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-изопропил-N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-метил-N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
2-бром-N-[3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-изопропил-N-[3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-фтор-N-[3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-метил-N-[3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
2-бром-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-фтор-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
4-метил-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
N-[3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид;
5-хлор-3-метил-N-[4-метокси-3-(1-метилпиперидин-4-иламино)фенил]бензо[b]тиофен-2-илсульфонамид;
N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамидгидрохлорид;
4-изопропил-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамидгидрохлорид;
2-бром-N-{4-метокси-3-[N-метил-N-(1-метилпиперидин-4-ил)амино]фенил}бензолсульфонамид
или их фармацевтически приемлемые соли.
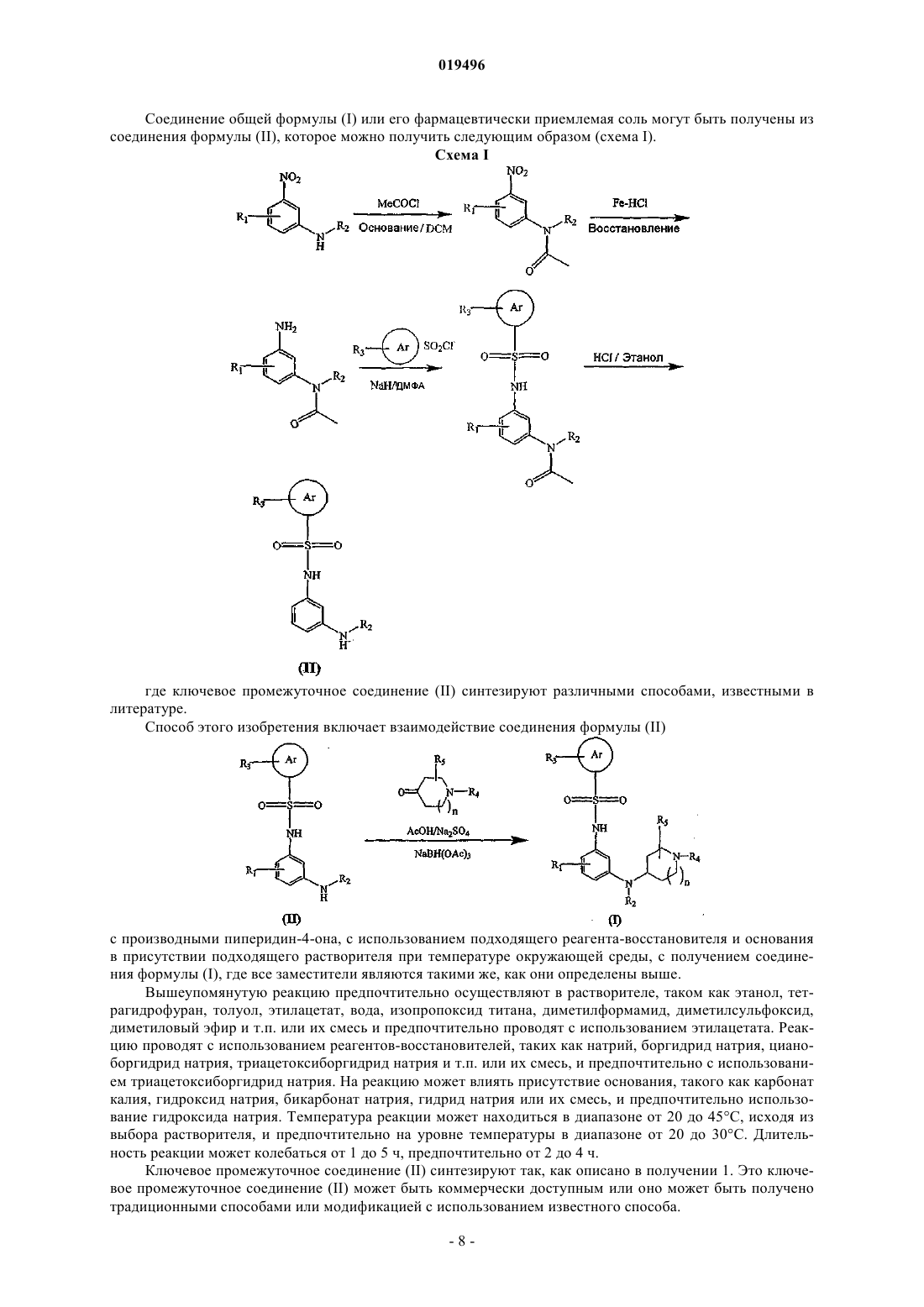
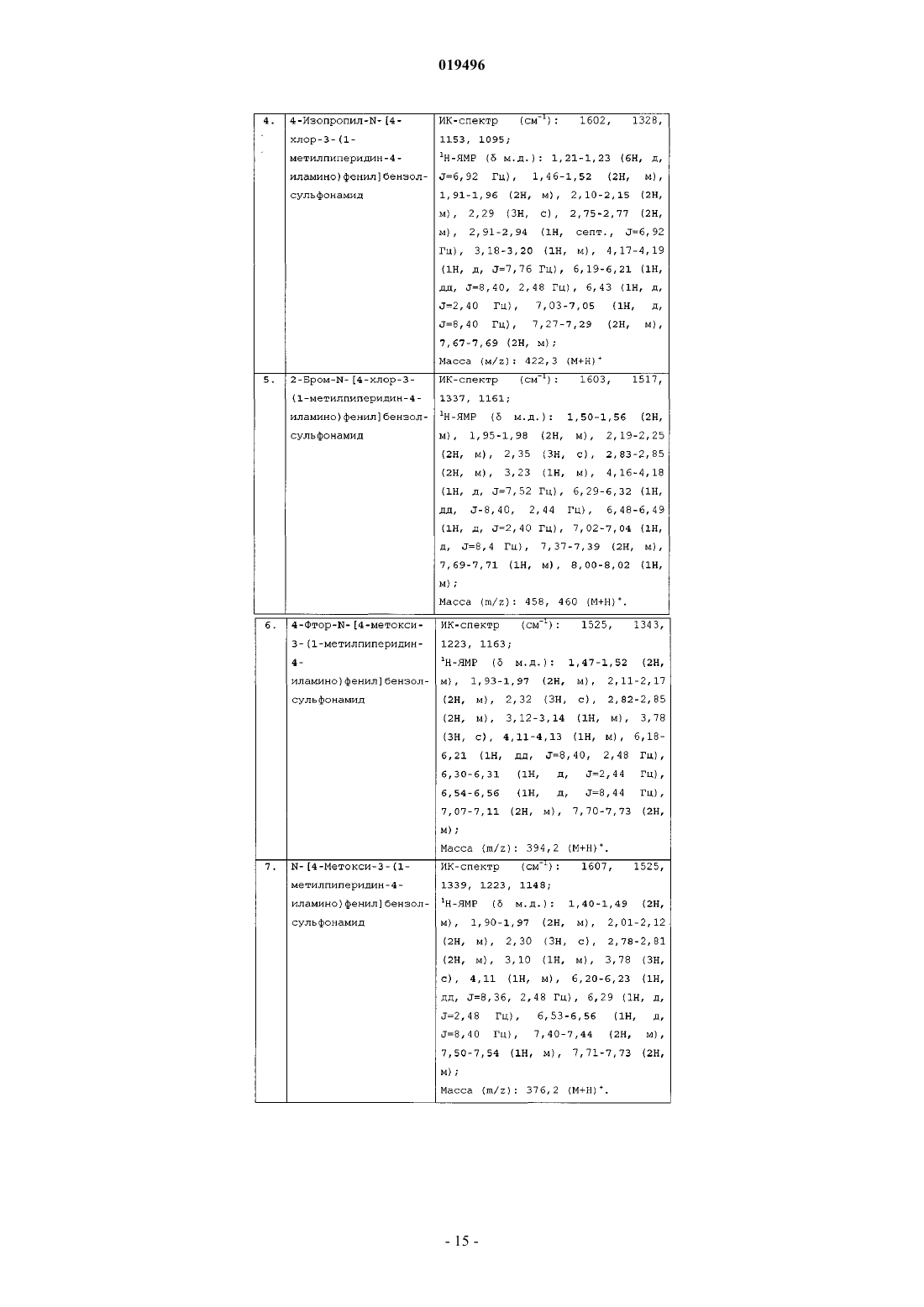
3. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (II)
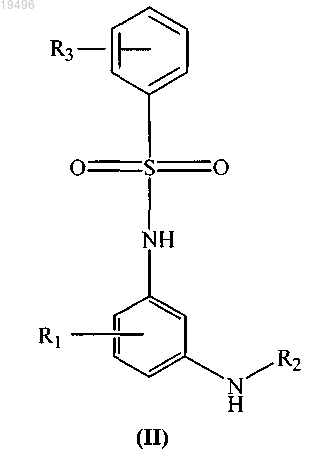
с производным пиперидин-4-она с использованием подходящего реагента-восстановителя и основания в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45°С, с получением соединения формулы (I), где все заместители являются такими же, как они определены в п.1.
4. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (III)
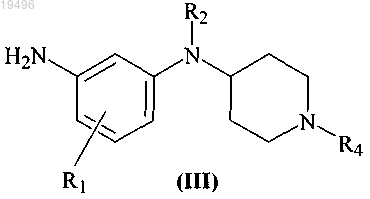
с производным бензолсульфонилхлорида, в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45°С, с получением соединения формулы (I), где все заместители являются такими же, как они определены в п.1.
5. Применение соединения по п.1 в изготовлении лекарственного средства для лечения и/или предупреждения заболеваний, связанных с серотониновым 5-НТ6-рецептором.
6. Применение по п.5 для лечения клинического состояния, такого как тревога, болезнь Альцгеймера, депрессия, нарушения когнитивных способностей и памяти, ADHD (синдром дефицита внимания/синдром гиперактивности), психотическая депрессия, болезнь Паркинсона, шизофрения, слабовыраженное когнитивное нарушение или нейродегенеративные расстройства.
Текст
Изобретение относится к новым арилсульфонамидным аминосоединениям формулы (I), их фармацевтически приемлемым солям, описанным в этом документе, к способам их получения и применению соединений формулы (I) в изготовлении лекарственного средства для лечения и/или предупреждения заболеваний, связанных с серотониновым 5-НТ 6-рецептором.(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) Область техники, к которой относится изобретение Настоящее изобретение относится к новым арилсульфонамидным аминосоединениям формулы (I),их фармацевтически приемлемым сольватам, описанным в этом документе, и применению их в качестве лигандов 5-НТ 6 Настоящее изобретение также относится к способу получения вышеупомянутых новых соединений,их фармацевтически приемлемых солей, описанных в этом документе. Эти соединения являются полезными в лечении или предупреждении различных нарушений, которые связаны с функциями 5-НТ 6-рецепторов. Предпосылки создания изобретения Различные нарушения центральной нервной системы, такие как тревога, депрессия, моторные расстройства и т.д., как полагают, включают отклонение от нормы функций нейротрансмиттерного 5-гидрокситриптамина (5-НТ) или серотонина. Серотонин локализован в центральной и периферической нервной системах и, как известно, оказывает воздействие на многие типы состояний, включающих, среди прочих, психические расстройства, моторную активность, пищевое поведение, сексуальную активность и нейроэндокринную регуляцию. Подтипы 5-НТ-рецепторов регулируют различные эффекты серотонина. Семейство известных 5-НТ-рецепторов включает семейство 5-НТ 1-рецепторов (например, 5-HT1A), семейство 5-НТ 2-рецепторов (например, 5-HT2A и 5-HT2C), подтипы 5-НТ 3-, 5-НТ 4-, 5-НТ 5-, 5-НТ 6- и 5-НТ 7-рецепторов. Подтип 5-НТ 6-рецептора был сначала клонирован из ткани крысы в 1993 г. (Monsma, F.J.; Shen, Y.;Ward, R.P.; Hamblin, M.W., Sibley, D.R., Molecular Pharmacology, 1993, 43, 320-327) и впоследствии из ткани человека (Kohen, R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal ofNeurochemistry, 1996, 66, 47-56). Рецептор представляет собой сопряженный с G-белками рецептор(GPCR), позитивно связанный с аденилатциклазой (Ruat, M.; Traiffort, E.; Arrang, J.-M.; Tardivel-Lacombe,L.; Diaz, L.; Leurs, R.; Schwartz, J.-C., Biochemical Biophysical Research Communications, 1993, 193, 268276). Этот рецептор обнаружен почти исключительно в областях центральной нервной системы (CNS) как у крыс, так и у людей. Исследования гибридизации in situ 5-НТ 6-рецепторов на мозге крыс с использованием мРНК показывают основную локализацию в областях проекции 5-НТ-рецепторов, включающих полосатое тело,прилежащее ядро, обонятельный бугорок и гиппокампальную формацию (Ward, R.P.; Hamblin, M.W.;Lachowicz, J.E.; Hoffman, B.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Самые высокие уровни мРНК 5-НТ 6-рецепторов наблюдали в обонятельном бугорке, в полосатом теле, в прилежащем ядре и в зубчатой извилине медиальной и нижней поверхности полушария большого мозга, а также в СА 1-, СА 2- и СА 3-зонах гиппокампа. Нижние уровни мРНК 5-НТ 6-рецепторов наблюдали в зернистом слое мозжечка, в нескольких диэнцефальных ядрах, в миндалине и в кортикальном слое. Методы Нозерн-блоттинга позволили выявить, что мРНК 5-НТ 6-рецепторов, как оказывается, присутствует исключительно в мозге, с небольшим подтверждением ее присутствия в периферических тканях. Высокая аффинность ряда антипсихотических средств по отношению к 5-НТ 6-рецептору, локализация его мРНК в полосатом теле, в обонятельном бугорке и в прилежащем ядре позволяют предположить,что некоторые клинические действия этих соединений могут быть опосредованы через этот рецептор. Его способность связывать широкий ряд терапевтических соединений, используемых в психиатрии, в сочетании с его привлекательным распределением в мозге стимулировала значительный интерес к новым соединениям, которые способны взаимодействовать с упомянутым рецептором (Sleight, A.J. et al. 5-HT6- and 5HT7-receptors: molecular biology, functional correlates and possible therapeutic indications, DrugNews Perspective. 1997, 10, 214-224). Значительные усилия прикладываются к тому, чтобы понять возможную роль 5-НТ 6-рецептора в психиатрии, в когнитивной дисфункции, в двигательной/моторной функции и двигательном контроле, в памяти, настроении и т.п. Соединения, которые демонстрируют аффинность к связыванию 5-НТ 6-рецептора, являются важными искомыми как в качестве вспомогательного средства в изучении 5-НТ 6-рецептора, так и в качестве потенциальных терапевтических средств в лечении расстройств центральной нервной системы, например, см. публикацию: Reavill С. andMonsma F.J. et al. (1993) и Kohen, R. et al. (2001) показали, что несколько трициклических соединений-антидепрессантов, таких как амитриптилин, и атипичных соединений-антидепрессантов, таких как мианзерин, имеют высокую аффинность к 5-НТ 6-рецептору. Эти установленные данные привели к гипотезе того, что 5-НТ 6-рецептор является вовлеченным в патогенез и/или в лечение аффективных расстройств. Экспериментальные модели на грызунах поведения, обусловленного тревогой, дают противоречивые результаты в отношении роли 5-НТ 6-рецептора в формировании тревоги. Лечение посредством антагонистов 5-НТ 6-рецепторов повышает судорожный порог в испытании максимального электроконвульсивного шока на крысах [Stean, Т. et al. Anticonvulsant properties of the selective 5-HT6-receptororally active 5-HT6 receptor antagonist. British Journal of Pharmacology, 2000, 130, 1606-1612]. Хотя это указывает на то, что 5-НТ 6-рецепторы могли бы регулировать судорожный порог, однако этот эффект не столь ярко выражен, как эффект от известных противосудорожных лекарственных средств. Понимание роли лигандов 5-НТ 6-рецепторов наиболее продвинулось по двум терапевтическим показаниям, в которых этот рецептор, вероятно, имеет главную роль: при нарушении обучения и памяти и при аномальном пищевом поведении. Точная роль 5-НТ 6-рецептора еще должна быть установлена в других показаниях центральной нервной системы (CNS), таких как тревога, хотя один агонист 5-НТ 6-рецептора недавно прошел клинические испытания I Фазы. Существует много потенциальных терапевтических применений лигандов 5-НТ 6-рецептора на людях на основе непосредственных эффектов и показаний из доступных научных исследований. Эти исследования включают локализацию рецептора,аффинность лигандов с известной активностью in vivo и различные исследования на животных, проведенные до настоящего времени. Предпочтительно соединения-антагонисты 5-НТ 6-рецепторов востребованы в качестве терапевтических средств. Одно потенциальное терапевтическое применение модуляторов функций 5-НТ 6-рецептора заключается в улучшении когнитивных способностей и памяти в терапии заболеваний людей, таких как болезнь Альцгеймера. Высокие уровни рецептора, обнаруженные в структурах, таких как передний мозг, включая хвостатое ядро/путамен, гиппокамп, прилежащее ядро и кортикальный слой, позволяют предположить роль рецептора в формировании памяти и когнитивных способностей, так как эти области, как известно, играют жизненно важную роль в формировании памяти (Gerard, С.; Martres, M.P.; Lefevre, K.;Miquel, M.C.; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; E.I. Mestikawy, S., Brain Research, 1997, 746,207-219). Способность известных лигандов 5-НТ 6-рецептора улучшать холинергическую трансмиссию также подтверждает потенциальное применение в формировании когнитивных способностейPharmacology, 1999, 126(7), 1537-1542). Исследования показали, что известный селективный антагонист 5-НТ 6-рецептора значительно увеличил уровни глутамата и аспартата в лобной коре без повышения уровней норадреналина, допамина или 5-НТ. Такое селективное повышение некоторых нейрохимических соединений, которое отмечают во время формирования памяти и когнитивных способностей, позволяет с уверенностью предположить роль лигандов 5-НТ 6-рецептора в формировании когнитивных способностей (Dawson, L.A.; Nguyen, H.Q.;Li, P. British Journal of Pharmacology, 2000, 130(1), 23-26). Исследования на животных памяти и обучения посредством известного селективного антагониста 5-НТ 6-рецептора показывают некоторые позитивные эффекты (Rogers, D.C.; Hatcher, P.D.; Hagan, J.J. Society of Neuroscience, Abstracts, 2000, 26, 680). Соответствующее потенциальное терапевтическое применение лигандов 5-НТ 6-рецепторов заключается в лечении синдромов дефицита внимания (ADD, также называемого как синдром гиперактивности с дефицитом внимания или ADHD) у детей, а также у взрослых. Поскольку антагонисты 5-НТ 6-рецепторов, как оказывается, усиливают активность нигростриарного допаминового пути, а синдром гиперактивности с дефицитом внимания связали с патологиями/изменениями хвостатого ядра(Ernst, M.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M., Journal of Neuroscience, 1998, 18(15),5901-5907), то антагонисты 5-НТ 6-рецепторов могут ослаблять синдромы дефицита внимания. К настоящему моменту доступными являются несколько полностью селективных агонистов. Агонист WAY-181187 (Wyeth) в текущий момент проходит испытания I Фазы, для выявления мишени в лечении тревоги [Cole, D.C. et al. (2005), Discovery of a potent, selective and orally active 5-HT6 receptor agonist, WAY-181187. 230th ACS Natl. Meet. (Aug 28-Sept 1, Washington DC), Abstract MEDI 17]. Международная патентная публикация WO 03/066056 A1 сообщает, что антагонизм 5-НТ 6-рецептора может способствовать нейрональному росту в пределах центральной нервной системы млекопитающего. В другой международной патентной публикации WO 03/065046 А 2 раскрывают новый вариант 5-НТ 6-рецептора человека и делают предположение, что 5-НТ 6-рецептор связан с многочисленными другими нарушениями. Первые исследования, изучающие аффинность различных лигандов CNS-рецепторов с известной терапевтической полезностью или с сильным структурным сходством с известными лекарственными средствами, позволяют предположить роль лигандов 5-НТ 6-рецепторов в лечении шизофрении и депрессии. Например, клозапин (эффективное клиническое антипсихотическое средство) имеет высокую аф-2 019496 финность к подтипу 5-НТ 6-рецептора. Также, равным образом несколько клинических антидепрессантов имеют высокую аффинность в отношении рецептора и действуют в качестве антагонистов на этом центре (Branchek, T.A.; Blackburn, T.P., Annual Reviews in Pharmacology and Toxicology, 2000, 40, 319-334). Дополнительно, недавние исследования in vivo на крысах показывают, что модуляторы 5-НТ 6-рецепторов могут быть полезными в лечении нарушений движения, включая эпилепсию (Stean, Т.;Upton, N.; Clarke, S.E.; Brown, A.M.; British Journal of Pharmacology, 2000, 30(7), 1606-1612). В своей совокупности, вышеупомянутые исследования позволяют с уверенностью предположить,что соединения, которые являются модуляторами 5-НТ 6-рецепторов, т.е. лигандами, могут быть полезными для терапевтических показаний, включающих лечение заболеваний, связанных с нарушением памяти, когнитивных способностей и обучения, таких как болезнь Альцгеймера и синдром дефицита внимания; лечение расстройств личности, таких как шизофрения; лечение нарушений поведения, например тревожные состояния, депрессия и синдромы навязчивых состояний; лечение двигательных или моторных нарушений, таких как болезнь Паркинсона и эпилепсия; лечение заболеваний, сопутствующих нейродегенерации, таких как инсульт или травма головы; или снятие привыкания к чрезмерному употреблению лекарственных или наркотических средств, включая привыкание к никотину, алкоголю и другим веществам, вызывающим болезненное пристрастие или болезненную зависимость. Также полагают, что такие соединения должны иметь применение в лечении некоторых желудочнокишечных (GI) расстройств, таких как функциональное нарушение кишечника. См., например, публикацию: Roth, B.L.; et al., Journal of Pharmacology and Experimental Therapeutics, 1994, 268, 1403-1412;Sibley, D.R.; et al., Molecular Pharmacology, 1993, 43, 320-327, Sleight, A.J.; et al., Neurotransmission, 1995,11, 1-5; and Sleight, A.J.; et al., Serotonin ID Research Alert, 1997, 2(3), 115-118. Кроме того, сделано сообщение об эффекте антагониста 5-НТ 6-рецептора и антисмысловых олигонуклеотидов 5-НТ 6-рецептора в отношении снижения потребления пищи крысами, что потенциально может быть полезным в лечении ожирения. См., например, публикации Bentley, J.C.; Boursson, A.;strategies to 5-HT6 receptor ligands as potential cognitive enhancers and antiobesity agents, дает тщательно продуманную дискуссию об эволюции лигандов 5-НТ 6-рецептора. Были обобщены фармакологические средства и доклинические варианты-кандидаты, используемые при проведении оценки 5-НТ 6-рецепторов в заболеваниях, таких как шизофрения, другие связанные с допамином нарушения и депрессия, и для получения профиля нейрохимических и электрофизиологических эффектов либо в отношении блокады,либо в отношении активации 5-НТ 6-рецепторов. Недавно, в обзоре Heal D.J. et. al. Pharmacology and therapeutics, 2008, 117, 207-231, Selective 5-HT6 receptor ligands: Progress in the development of a novel pharmacological approach to the treatment of the obesity and related metabolic disorders, описаны главные разработки в области медицинской химии и фармакологии лигандов 5-НТ 6-рецепторов, с особым акцентом внимания на их потенциальном применении в качестве новых лекарственных средств против ожирения. Кроме того, они были использованы для охарактеризовывания 5-НТ 6-рецептора и для исследования его распределения. Сделано сообщение о кандидате-антагонисте II Фазы от компании GlaxoSmithKline, SB-742457 для терапевтического показания дисфункции когнитивных способностей, сопутствующей болезни Альцгеймера [Ahmed, M. et al. (2003), Novel compounds. WO patent 2003080580] и о соединении LY-483518 от компании Lilly [Filla, S.A. et al. (2002), Preparation of benzenesulfonic acid indol-5-yl esters as antagonists ofthe 5-HT6 receptor, WO 2002060871]. SB-271046, первый антагонист 5-НТ 6-рецептора, который прошел на клиническую разработку в I Фазе, был исключен из исследования (вероятно, из-за низкого проникновения через гематоэнцефалический барьер). К тому же, селективный антагонист SB-271046 5-НТ 6-рецептора является неактивным в испытаниях на животных, имеющих отношение либо к позитивным, либо к негативным симптомам шизофрении [Pouzet, В. et al. Effects of the 5-НТ 6 receptor antagonist,SB-271046, in animal models for schizophrenia. Pharmacol. Biochem. Behav. 2002, 71, 635-643]. Международные патентные публикации WO 2007/046112, WO 2007/020653, WO 2007/138611,WO 2005/066157, WO 2004/108671, WO 2004/048331, WO 2004/048330 и WO 2004/048328 (все принадлежащие компании Suven Life Sciences Limited) описывают соответствующий известный уровень техники. Дополнительно международные патентные публикации WO 98/27081, WO 99/02502, WO 99/37623,WO 99/42465 и WO 01/32646 (все принадлежащие компании Glaxo SmithKline Beecham PLC) раскрывают ряд арилсульфонамидных и сульфоксидных соединений в качестве антагонистов 5-НТ 6-рецептора, которые, как заявлено, являются полезными в лечении различных расстройств центральной нервной системы. Хотя некоторые модуляторы 5-НТ 6-рецепторов были раскрыты, продолжает сохраняться потребность в соединениях, которые являются полезными в модулировании 5-НТ 6-рецепторов. В исследовании авторов изобретения 5-НТ 6-рецепторов авторы обнаружили, что арилсульфонамидные аминосоединения формулы (I) демонстрируют очень высокую аффинность к 5-НТ 6-рецептору. Таким образом, целью этого изо-3 019496 бретения является предоставление соединений, которые являются полезными в качестве терапевтических средств в лечении/предупреждении ряда нарушений центральной нервной системы или расстройств, обусловленных действием 5-НТ 6-рецептора. Краткое изложение сущности изобретения Настоящее изобретение относится к новым арилсульфонамидным аминосоединениям формулы (I) и их фармацевтически приемлемым солям:R2 представляет собой водород или метил;R4 представляет собой водород или метил. Настоящее изобретение относится к применению соединения формулы (I) для изготовления лекарственного средства для лечения и/или предупреждения различных заболеваний, которые связаны с функциями 5-НТ 6-рецептора. Конкретно, соединения этого изобретения являются полезными в лечении различных клинических состояний, таких как тревога, болезнь Альцгеймера, депрессия, нарушения когнитивных способностей и памяти, ADHD (синдром дефицита внимания/синдром гиперактивности), психотическая депрессия, болезнь Паркинсона, шизофрения, слабовыраженное когнитивное нарушение и нейродегенеративные расстройства. В другом аспекте изобретение относится к способу получения соединений формулы (I), который включает взаимодействие соединения формулы (II) с производным пиперидин-4-она, с использованием подходящего реагента-восстановителя и основания в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45 С, с получением соединения формулы (I), где все заместители являются такими же, как они определены выше. В еще одном аспекте изобретение относится к способу получения соединения формулы (I), который включает взаимодействие соединения формулы (III) с производным бензолсульфонилхлорида, в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45 С, с получением соединения формулы (I), где все заместители являются такими же, как они определены выше. Следующее представляет собой неполный перечень предпочтительных соединений, соответствующих общей формуле (I):N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамидгидрохлорид; 4-изопропил-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамидгидрохлорид; 2-бром-N-4-метокси-3-[N-метил-N-(1-метилпиперидин-4-ил)амино]фенилбензолсульфонамид и их фармацевтически приемлемые соли. Подробное описание изобретения Если не указано иное, следующие термины, используемые в описании изобретения и в пунктах формулы, имеют значения, приведенные ниже."(C1-C3)алкил" означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие 1-3 атома углерода, и включает метил, этил, н-пропил или изопропил."(C1-C3)алкоксигруппа" означает алкильные радикалы с неразветвленной или разветвленной цепью,содержащие 1-3 атома углерода, и включает метоксигруппу, этоксигруппу, пропилоксигруппу или изопропилоксигруппу."Цикло(С 3-С 6)алкил" означает циклические или разветвленные циклические алкильные радикалы,содержащие 3-6 атомов углерода, и включает циклопропил, циклобутил, циклопентил, циклопропилметил, цикло(С 3-С 6)алкилметил или циклогексил, которые могут быть замещены или незамещены, и необязательно заместители могут быть выбраны из галогена, (C1-C3)алкила или (C1-C3)алкоксигруппы."Цикло(С 3-С 6)алкоксигруппа" означает циклические и разветвленные циклические алкильные радикалы, содержащие 3-6 углерода, и включает циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу или циклогексилоксигруппу."Галоген(C1-C3)алкил" означает алкильные радикалы с неразветвленной или разветвленной цепью,содержащие 1-3 атома углерода, и включает фторметил, дифторметил, трифторметил, трифторэтил,фторэтил, дифторэтил и т.п."Галоген(C1-C3)алкоксигруппа" означает алкильные радикалы с неразветвленной или разветвленной цепью, содержащие 1-3 атома углерода, и включает фторметоксигруппу, дифторметоксигруппу,трифторметоксигруппу, трифторэтоксигруппу, фторэтоксигруппу, дифторэтоксигруппу и т.п."Гетероцикл" означает органические соединения, которые содержат кольцевую структуру, содержащую в составе кольца, в дополнение к углероду такие атомы, как сера, кислород или азот. Они могут представлять собой либо простые ароматические кольца, либо неароматические кольца и включают пиридин, пиримидин, бензотиофен и т.п."Арил" означает моноциклическую ароматическую кольцевую систему, которая необязательно может быть замещена водородом,галогеном,(C1-C3)алкилом,галоген(C1-C3)алкилом,(С 1-С 3)алкоксигруппой или галоген(C1-C3)алкоксигруппой."Арилалкил" означает бензил или гетероциклилметил и т.п. Термин "шизофрения" означает шизофрению, шизофреноформное и щизоаффективное расстройство. Термин "психотическое расстройство" относится к бредовым идеям, заметным галлюцинациям, к беспорядочной речи или дезорганизованному или кататоническому поведению. См. Diagnostic and Фраза "фармацевтически приемлемый" указывает на то, что вещество или композиция должны быть совместимыми химически и/или токсикологически с другими ингредиентами, входящими в состав,посредством которого лечат млекопитающее."Терапевтически эффективное количество" определяют как количество соединения настоящего изобретения, которое (i) лечит или предупреждает конкретное заболевание, состояние или нарушение;(ii) ослабляет, уменьшает интенсивность или исключает один или более симптомов конкретного заболевания, состояния или нарушения; (iii) предупреждает или отсрочивает проявление одного или более симптомов конкретного заболевания, состояния или нарушения, описанного в этом документе. Термин "процедура лечения", "лечить" или "лечение" охватывают все значения, такие как превентивный, профилактический и паллиативный. Термин "стереоизомеры" представляет собой общий термин для всех изомеров индивидуальных молекул, которые отличаются только ориентацией их атомов в пространстве. Он включает изомеры зеркального отображения (энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальными отображениями друг друга (диастереомеры). Термин "ADHD" означает синдром гиперактивности с дефицитом внимания. Некоторые соединения формулы (I) могут находиться в стереоизомерных формах (например, диастереомеры и энантиомеры), в их смесях, включая рацематы. Различные стереоизомерные формы могут быть отделены друг от друга с помощью традиционных способов или любой данный изомер может быть получен посредством стереоспецифического или асимметрического синтеза. Стереоизомеры, как правило, обычно получают в виде рацематов, которые могут быть разделены на оптически активные изомеры известным по сути способом. В случае соединений общей формулы (I), имеющих асимметрический атом углерода, они могут находиться в D-форме, L-форме и D,L-смесях. Те соединения общей формулы (I),которые имеют асимметрический атом углерода и которые, как правило, получают в виде рацематов,могут быть отделены друг от друга традиционными способами или любой данный изомер может быть получен посредством стереоспецифического или асимметрического синтеза. Однако также является возможным применение с самого начала оптически активного соединения и, соответственно, затем получение оптически активного энантиомерного или диастереомерного соединения в качестве конечного соединения. Стереоизомеры соединений общей формулы (I) могут быть получены одним или несколькими путями, представленными ниже:i) один или более реагентов могут быть использованы в их оптически активной форме;ii) оптически чистый катализатор или хиральные лиганды наряду с металлическим катализатором могут быть применены в восстановительном процессе. Металлический катализатор может представлять собой родий, рутений, индий и т.п. Хиральные лиганды предпочтительно могут представлять собой хиральные фосфины (Principles of Asymmetric synthesis, J.E. Baldwin Ed., Tetrahedron series, 14, 311-316);iii) смесь стереоизомеров может быть разделена традиционными способами, такими как образование диастереомерных солей посредством хиральных кислот, или хиральных аминов, или хиральных аминоспиртов, или хиральных аминокислот. Получающаяся в результате смесь диастереомеров затем может быть разделена такими способами, как фракционированная кристаллизация, хроматография и т.п.,после чего следует дополнительная стадия выделения оптически активного продукта гидролизом производного (Jacques et al., "Enantiomers, Racemates and Resolution", Wiley Interscience, 1981);iv) смесь стереоизомеров может быть разделена традиционными способами, такими как разделение микробиологическими методами, разделение диастереомерных солей, образованных с помощью хиральных кислот или хиральных оснований. Хиральные кислоты, которые могут быть применены, могут представлять собой винную кислоту,миндальную кислоту, молочную кислоту, камфорсульфокислоту, аминокислоты и т.п. Хиральные основания, которые могут быть применены, могут представлять собой алкалоиды хинного дерева, бруцин или основную аминокислоту, такую как лизин, аргинин и т.п. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают фармацевтически приемлемые соли, описанные в публикации: J. Pharm. Sci., 1977, 66,1-19, такие как соли присоединения кислоты, образованные посредством неорганических кислот, например хлористо-водородной, бромисто-водородной, серной, азотной или фосфорной кислоты, и посредством органических кислот, например янтарной, малеиновой, уксусной, фумаровой, лимонной, винной,бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислоты. Настоящее изобретение включает, в пределах своего объема, все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, образующие часть этого изобретения, могут быть получены путем обработки соединения формулы (I) посредством 1-6 эквивалентов основания, такого как гидрид натрия, метоксид натрия, этоксид натрия, гидроксид натрия, трет-бутоксид калия, гидроксид кальция,ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и т.п. Могут быть использованы растворители, такие как вода, ацетон, простой эфир, тетрагидрофуран (THF), метанол, этанол, трет-бутанол,-6 019496 диоксан, изопропанол, изопропиловый эфир или их смеси. Соединения формулы (I) могут быть получены в кристаллической или в некристаллической форме,и, если в кристаллической форме, могут быть необязательно сольватированы, например, в форме гидрата. Соединения изобретения могут быть использованы в комбинации, с каждым другим или с другими терапевтическими средствами или методами, используемыми для лечения или предупреждения состояний, перечисленных выше. Такие средства или методы включают ингибиторы бета-секретазы; ингибиторы гамма-секретазы; ингибиторы амилоидной агрегации (например, Alzhemed); действующие прямо или опосредованно нейропротективные соединения; антиоксиданты, такие как витамин Е и гинкголиды; противовоспалительные средства, такие как ингибиторы ЦОГ-2 или NSAID's (нестероидные противовоспалительные лекарственные средства); ингибиторы ГМГ-КоА-редуктазы (ингибиторы гидроксиметилглутарил-кофермент А-редуктазы = статины); ингибиторы ацетилхолинэстеразы, такие как донепезил, ривастигмин, такрин, галантамин; антагонисты NMDA(N-метил-D-аспартат)-рецептора (например, мемантин); агонисты АМРА(2-амино-3-(5-метил-3-оксо-1,2-оксазол-4-ил)пропановая кислота)-рецептора; соединения, которые модулируют высвобождение или концентрацию нейротрансмиттеров (например,NS-2330); соединения, индуцирующие высвобождение гормонов роста (например, ибутаморен-мезилат и капроморелин); антагонисты СВ 1-рецептора или обратные агонисты; антибиотики, подобные миноциклину или рифампицину; ингибиторы фосфодиэстеразы PDE-IV и PDE-IX; обратные агонистыGABAA-рецептора; никотиновые агонисты: антагонисты гистаминовых Н 3-рецепторов, агонисты или частичные агонисты 5-НТ 4-рецептора; антагонисты 5-НТ 6-рецептора; антагонисты а 2-адренорецептора; агонисты мускариновых М 1-рецепторов; антагонисты мускариновых М 2-рецепторов; позитивные модуляторы метаботропных глутаматных рецепторов 5 и соединения, которые модулируют рецепторы - ферменты запаха таким образом, что эффективность и/или безопасность соединений настоящего изобретения повышаются или побочные эффекты снижаются. Предпочтительными являются такие комбинации, содержащие одно или более соединений настоящего изобретения и один или более дополнительных активных ингредиентов, выбранных из группы, состоящей из Alzhemed, витамина Е, гинкголида, донепезила, ривастигмина, такрина, галантамина, мемантина, NS-2330, ибутаморен-мезилата, капроморелина, миноциклина и рифампицина. В комбинации соединения настоящего изобретения и вышеупомянутые "участники" комбинации могут быть введены по отдельности (например, набор, состоящий из частей) или совместно в одной фармацевтической композиции (например, капсула или таблетка). Кроме того, введение одного элемента комбинации настоящего изобретения может быть выполнено до, единовременно или после введения другого элемента комбинации настоящего изобретения. Если соединения настоящего изобретения и один или более дополнительных активных ингредиентов находятся в отдельно взятых составах, то эти отдельные составы могут быть введены одновременно или последовательно. Для лечения или предупреждения вышеупомянутых заболеваний и состояний соединения изобретения могут быть использованы в комбинации с иммунологическими методами, такими как, например,иммунизация посредством А-бета-пептида или его производных или введение антител к А-бета-пептиду(анти-А-бета-пептид-антитела). Многочисленные радиоизотопы являются легко доступными, включая изотопы водорода, углерода,азота, кислорода, фосфора, серы, йода, фтора, брома и хлора, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O,17O, 18O, 31P, 32P, 35S, 123I, 124I, 125I, 131I, 18F, 75Br, 76Br, 77Br, 82Br и 36Cl. Соединение общей формулы (I) может быть помечено радиоактивным изотопом с использованием стандартных методов, известных в органической химии. Альтернативно, соединение формулы (I) может быть помечено радиоактивным изотопом, являющимся заместителем в одном из исходных веществ или в промежуточном соединении, используемых в синтезе соединения формулы (I). Например, см. публикацию: Arthur Murry III, D. Lloyd Williams; Organic Synthesis with Isotopes, vol. I and II, IntersciencePublishers Inc., N.Y. (1958) and Melvin Calvin et al. Isotopic Carbon John Wiley and Sons Inc., N.Y. (1949). Синтез меченных радиоактивным изотопом соединений обычно может быть осуществлен поставщиком радиоактивного изотопа, специализирующемся на заказном синтезе меченных радиоактивным изотопом соединений-зондов, таким как Amersham Corporation, Arlington Heights, IL; Cambridge IsotopesLaboratories, Inc. Andover, MA; Wizard Laboratories, West Sacramento, CA; ChemSyn Laboratories, Lexena,KS; American Radiolabeled Chemicals, Inc.St. Louis, MO. Меченные радиоактивным изотопом аналоги соединения формулы (I) могут быть использованы в клинических исследованиях для проведения оценки роли лигандов 5-НТ 6-рецепторов в ряде зон, затронутых заболеванием, в которые, как полагают, лиганды 5-НТ 6-рецептора являются вовлеченными. Меченные радиоактивным изотопом соединения формулы (I) являются полезными в качестве средства визуализации и биомаркера для медицинской терапии и диагностики. Такие меченные радиоактивным изотопом соединения также являются полезными в качестве фармакологических инструментов для изучения функций и активности 5-НТ 6-рецепторов. Например, изотопно меченые соединения являются особенно полезными в технологиях SPECT (однофотонная эмиссионная компьютерная томография) и Соединение общей формулы (I) или его фармацевтически приемлемая соль могут быть получены из соединения формулы (II), которое можно получить следующим образом (схема I). Схема I где ключевое промежуточное соединение (II) синтезируют различными способами, известными в литературе. Способ этого изобретения включает взаимодействие соединения формулы (II) с производными пиперидин-4-она, с использованием подходящего реагента-восстановителя и основания в присутствии подходящего растворителя при температуре окружающей среды, с получением соединения формулы (I), где все заместители являются такими же, как они определены выше. Вышеупомянутую реакцию предпочтительно осуществляют в растворителе, таком как этанол, тетрагидрофуран, толуол, этилацетат, вода, изопропоксид титана, диметилформамид, диметилсульфоксид,диметиловый эфир и т.п. или их смесь и предпочтительно проводят с использованием этилацетата. Реакцию проводят с использованием реагентов-восстановителей, таких как натрий, боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия и т.п. или их смесь, и предпочтительно с использованием триацетоксиборгидрид натрия. На реакцию может влиять присутствие основания, такого как карбонат калия, гидроксид натрия, бикарбонат натрия, гидрид натрия или их смесь, и предпочтительно использование гидроксида натрия. Температура реакции может находиться в диапазоне от 20 до 45 С, исходя из выбора растворителя, и предпочтительно на уровне температуры в диапазоне от 20 до 30 С. Длительность реакции может колебаться от 1 до 5 ч, предпочтительно от 2 до 4 ч. Ключевое промежуточное соединение (II) синтезируют так, как описано в получении 1. Это ключевое промежуточное соединение (II) может быть коммерчески доступным или оно может быть получено традиционными способами или модификацией с использованием известного способа. Настоящее изобретение также обеспечивает альтернативный способ для получения соединения общей формулы (I) или его фармацевтически приемлемой соли, который составляет следующий путь (схема II), где ключевое промежуточное соединение (III) синтезируют различными способами, известными в литературе. Схема II Способ этого изобретения включает взаимодействие соединения формулы (III) с производными арилсульфонилхлорида в присутствии подходящего растворителя при температуре окружающей среды, с получением соединения формулы (I), где все заместители являются такими же, как они определены выше. Вышеупомянутую реакцию предпочтительно осуществляют в растворителе, таком как этанол, тетрагидрофуран, толуол, этилацетат, вода, пиридин, дихлорметан, диметилсульфоксид, диметиловый эфир и т.п. или их смесь, и предпочтительно проводят с использованием пиридина и дихлорметана. Температура реакции может находиться в диапазоне от 20 до 45 С, исходя из выбора растворителя, и предпочтительно на уровне температуры в диапазоне от 25 до 30 С. Длительность реакции может колебаться от 1 до 5 ч, предпочтительно составляет период времени 4 ч. Ключевое промежуточное соединение (III) синтезируют так, как описано в получении 2. Это ключевое промежуточное соединение (III) может быть коммерчески доступным или оно может быть получено традиционными способами или модификациями с использованием известного способа. Соединения, полученные вышеупомянутым способом получения настоящего изобретения, могут быть превращены в другое соединение этого изобретения с помощью дополнительных химических модификаций с использованием общеизвестных реакций, таких как окисление, восстановление, введение защиты, снятие защиты, реакция с перегруппировкой, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование,О-алкилирование, О-ацилирование, N-алкилирование,N-алкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция сочетания с использованием переходных металлов и т.п. При необходимости, любая одна или более чем одна из следующих стадий может быть выполнена:i) превращение соединения формулы (I) в другое соединение формулы (I);(ii) удаление любых защитных групп или(iii) образование его фармацевтически приемлемой соли. Процесс (i) может быть осуществлен с использованием традиционных методик взаимопревращения,таких как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение и гидролиз сложных эфиров или образование амидной связи. В процессе (ii) примеры защитных групп и средства для их удаления могут быть обнаружены в публикации: T.W. Greene "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящие защитные группы для аминогрупп включают сульфонил (например, тозил), ацил (например, ацетил,2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например,бензил), которые могут быть удалены посредством гидролиза (например, с использованием кислоты,такой как хлористо-водородная или трифторуксусная кислота) или восстановительного процесса (например,гидрогенолиз бензильной группы или восстановительное удаление 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте), по необходимости. Другие подходящие защитные группы для аминогрупп включают трифторацетил, который может быть удален с помощью катализируемого основанием гидролиза, или бензильную группу, связанную со смолой в результате твердофазного синтеза, такую как 2,6-диметоксибензильная группа, связанная со смолой Merrifield (Ellman linker), которая может быть удалена с помощью катализируемого кислотой гидролиза, например, посредством трифторуксусной кислоты. В процессе (iii) галогенирование, гидроксилирование, алкилирование и/или получение фармацевтически приемлемых солей может быть проведено традиционно посредством реакции с соответствующей кислотой или с соответствующим производным кислоты так, как подробно описано ранее. Для того чтобы применять соединения формулы (I) в терапии, они обычно будут введены в состав с получением фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции могут быть составлены обычным способом с использованием одного или более фармацевтически приемлемых носителей. Так, активные соединения изобретения могут быть введены в состав для перорального, буккального, интраназального, парентерального (например,внутривенное, внутримышечное или подкожное) или ректального введения или в форме, подходящей для введения ингаляцией или инсуффляциями. Для перорального введения фармацевтические композиции могут иметь форму, например, таблеток или капсул, изготовленных традиционным способом с помощью фармацевтически приемлемых эксципиентов, таких как связующие вещества (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натрия гликолят крахмала) или смачивающие реагенты (например, натрия лаурилсульфат). Таблетки могут быть покрыты оболочкой способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь форму, например, растворов, сиропов или суспензий или они могут быть представлены в виде сухого продукта для восстановления водой или другой подходящей средой для лекарства перед применением. Такие жидкие препараты могут быть изготовлены традиционным способом с помощью фармацевтически приемлемых добавок, таких как суспендирующие вещества (например, сорбитовый сироп, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующие вещества (например, лецитин или аравийская камедь); неводные среды для лекарства (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может иметь форму таблеток или пастилок для рассасывания (лекарственный леденец), состав которых получен традиционным способом. Активные соединения изобретения могут быть введены в состав для парентерального введения инъекцией, в том числе с использованием обычных методов катетеризации или инфузии. Составы для инъекции могут быть представлены в единичной дозированной форме, например в ампулах или в контейнерах с множественными дозами, с добавленным консервантом. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в маслянистых или водных средах для лекарства, и могут содержать вещества, способствующие приготовлению составов, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может находиться в порошковой форме, готовой для перевода в жидкую форму путем повторного разбавления в подходящей среде для лекарства, например в апирогенной воде, перед применением. Активные соединения изобретения также могут быть введены в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащих обычные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или для введения ингаляцией активные соединения изобретения обычно доставляются в форме аэрозольного спрея из находящегося под давлением контейнера, или небулайзера, или из капсулы с использованием ингалятора или инсуффляторов. В случае находящегося под давлением аэрозоля подходящий газ-вытеснитель, например дихлордифторметан, трихлорфторметан,дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и единица дозировки могут быть определены путем обеспечения клапана для доставки дозированного количества. Лекарственный препарат для находящегося под давлением контейнера или небулайзера может содержать раствор или суспензию активного соединения, тогда как лекарственный препарат для капсулы предпочтительно должен быть в форме порошка. Могут быть составлены капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или в инсуффляторе, которые содержат порошковую смесь соединения изобретения и подходящей основы для порошка, такой как лактоза или крахмал. Аэрозольные составы для лечения упоминаемых выше состояний (например, мигрень) у стандартного взрослого человека предпочтительно приготавливают так, что каждая отмеренная доза аэрозоля или"струя аэрозоля при одном нажатии распылительного клапана" содержит 20-1000 мкг соединения изобретения. Общая суточная доза при использовании аэрозоля будет находиться от 100 мкг до 10 мг. Вве- 10019496 дение можно производить несколько раз в сутки, например 2, 3, 4 или 8 раз, давая каждый раз, например,1, 2 или 3 дозы. Эффективное количество соединения общей формулы (I) или его производных, которые определены выше, взятое вместе с традиционными фармацевтическими вспомогательными веществами, носителями и добавками, может быть использовано для изготовления лекарственного средства. Такая терапия включает методики множественного выбора: например, введение двух совместимых соединений одновременно в одной дозированной форме или введение каждого соединения индивидуально в отдельно взятой дозированной форме; или, при необходимости, в один и тот же интервал времени или с отсрочкой по времени с тем, чтобы максимально увеличить полезный эффект или минимизировать возможные побочные эффекты лекарственных средств в соответствии с известными принципами фармакологии. Доза активных соединений может варьироваться в зависимости от факторов, таких как путь введения, возраст и вес пациента, природа и тяжесть заболевания, которое подлежит вылечиванию, и подобные факторы. Таким образом, любое обращение в этом документе к фармакологически эффективному количеству соединений общей формулы (I) относится к вышеупомянутым факторам. Предложенная доза активных соединений этого изобретения, либо для перорального, парентерального, назального либо буккального введения, для стандартного взрослого человека, для лечения состояний, упоминаемых выше,составляет 0,1-200 мг активного ингредиента на единичную дозу, которая может быть введена, например, за 1-4 раза в день. Промышленно выпускаемые реагенты были использованы без дополнительной очистки. Комнатная температура относится к 25-30 С. Исследования методом ИК-спектроскопии были выполнены с использованием KBr и в твердом состоянии. Если не установлено иное, то все масс-спектры были выполнены с использованием условий ионизации электрораспылением (ESI). 1 Н-ЯМР-спектры были записаны при 400 МГц на приборе Bruker. Дейтерированный хлороформ (99,8% D) был использован в качестве растворителя. TMS (тетраметилсилан) был использован в качестве внутреннего эталонного стандарта. Значения химических сдвигов выражены в виде значений в частях на миллион . Следующие сокращения используют для мультиплетности ЯМР-сигналов: с = синглет, ш.с. = широкий синглет, д = дуплет, т = триплет, кв = квартет, квин = квинтет, г = гептет, дд = двойной дуплет, дт= двойной триплет, тт = триплет триплетов, м = мультиплет. Хроматография относится к колоночной хроматографии, выполняемой с использованием силикагеля размером 100-200 меш, и осуществляется в условиях давления азота (флэш-хроматография). Примеры Новые соединения настоящего изобретения получены в соответствии со следующими методиками,с использованием соответствующих веществ, и проиллюстрированы дополнительно с помощью следующих конкретных примеров. Наиболее предпочтительными соединениями изобретения являются любые соединения или все из тех соединений, которые особо описаны в этих примерах. Однако эти соединения не следует рассматривать как образующие единственный класс объектов, который считают изобретением, и любая комбинация соединений или их фрагментов может сама по себе образовывать класс объектов. Следующие примеры дополнительно иллюстрируют подробности получения соединений настоящего изобретения. Специалистам в данной области будет легко понять то, что для получения этих соединений могут быть использованы известные вариации условий и способа выполнения следующих препаративных методик. Получение 1. Получение N-(4-хлор-3-аминофенил)бензолсульфонамида. Стадия (I). Получение 2-хлор-5-нитроацетанилида. 2-Хлор-5-нитроанилин (12 г, 70 ммоль) помещают в 500-миллилитровую трехгорлую круглодонную колбу, содержащую дихлорметан (110 мл), при перемешивании. Затем к реакционной массе добавляют в течение 15 мин по каплям триэтиламин (14,9 мл, 105 ммоль) при комнатной температуре. Реакционную массу охлаждают до 0 С при перемешивании и добавляют ацетилхлорид (6,8 мл, 84 ммоль) при 0 С в течение 10 мин. Затем реакционную массу дополнительно перемешивают при 20-25 С в течение 3 ч. Реакционную массу разлагают посредством 150 мл воды и продукт экстрагируют избытком дихлорметана. Объединенные органические слои промывают насыщенным соляным раствором (225 мл), сушат над безводным сульфатом натрия и отфильтровывают соли и концентрируют под вакуумом с получением маслянистой массы (7,8 г). ИК-спектр (см-1): 1550, 1335, 1190; 1(1 Н, д, J=2,46 Гц); Масса (m/z): 215,6 (М+Н)+. Стадия (II). Получение 2-хлор-5-аминоацетанилида. В 500-миллилитровую трехгорлую круглодонную колбу добавляют 2-хлор-5-нитроацетанилид(34,0 г, 158,5 ммоль), полученный на стадии (I), и метанол (100 мл). Массу перемешивают до получения прозрачного раствора и затем добавляют медленно и осторожно ренеевский никелевый катализатор(3,4 г) с использованием метанола (20 мл). Добавляют по каплям гидразин-гидрат (39,6 мл, 792,5 ммоль) в атмосфере азота при поддерживании температуры массы при 25-30 С. Во время добавления реакция является экзотермической. Реакционную массу дополнительно перемешивают при 25-30 С в течение 2 ч. Реакционную массу фильтруют через многоячеистый слой Hyflow и промывают метанолом (50 мл). Фильтрат концентрируют до получения маслянистой массы. Добавляют воду (200 мл) и корректируют рН с доведением до 10 с использованием 40% водного раствора гидроксида натрия. Продукт экстрагируют этилацетатом (3100 мл). Объединенные органические слои промывают насыщенным соляным раствором (225 мл), сушат над безводным сульфатом натрия, отфильтровывают соли и концентрируют под вакуумом с получением маслянистого продукта (18,48 г). ИК-спектр (см-1): 3310, 1535, 1331, 1153; 1H-ЯМР ( м.д.): 2,15 (3 Н, с), 3,68 (2 Н, ш.с), 6,34-6,37 (1 Н, дд, J=2,48, 8,56 Гц), 6,70 (1 Н, д,J=2,46 Гц), 6,90-6,92 (1 Н, д, J=8,56 Гц); Масса (m/z): 185,6 (М+Н)+. Стадия (III). Получение N-(4-хлор-3-ацетамидофенил)бензолсульфонамида. В сухую 100-миллилитровую трехгорлую круглодонную колбу, содержащую дихлорэтан (20 мл),добавляют 2-хлор-5-аминоацетанилид (1,5 г, 8 ммоль), полученный на стадии (II), с последующим добавлением пиридина (0,7 мл, 8 ммоль) в атмосфере азота. Реакционную массу перемешивают в течение 1 ч, затем добавляют по каплям бензолсульфонилхлорид (1,6 мл, 9,2 ммоль) при комнатной температуре в течение 20 мин и дополнительно перемешивают реакционную массу в течение 2 ч. После завершения реакции реакционную массу разлагают, перемещая в 100 мл воды, и экстрагируют продукт дихлорэтаном(3350 мл). Объединенные органические слои промывают насыщенным соляным раствором (225 мл),сушат над безводным сульфатом натрия, отфильтровывают соли и концентрируют под вакуумом с получением маслянистой массы, которую дополнительно очищают колоночной хроматографией с использованием этилацетата и гексана в качестве элюентов с получением 2,1 г продукта. ИК-спектр (см-1): 1652, 1522, 1310, 1155; 1N-(4-Хлор-3-ацетамидофенил)бензолсульфонамид (4,5 г, 13,8 ммоль), полученный на стадии (III),добавляют в 100-миллилитровую трехгорлую круглодонную колбу, содержащую этанол (50 мл), при перемешивании. Добавляют водный раствор концентрированной хлористо-водородной кислоты (4,2 мл,30 мл) и греют реакционную массу при кипячении с обратным холодильником (75-80 С) в течение 5 ч. Этанол отгоняют под вакуумом и получающуюся в результате массу разлагают, помещая в воду (100 мл),и ощелачивают (повышают основность) триэтиламином. Продукт экстрагируют этилацетатом(4100 мл). Объединенные органические слои промывают насыщенным соляным раствором (225 мл),сушат над безводным сульфатом натрия, отфильтровывают соли и концентрируют под вакуумом с получением маслянистой массы, которую дополнительно очищают колоночной хроматографией с использованием этилацетата и гексана (смесь 1:1) с получением 3,1 г продукта. ИК-спектр (см-1): 1603, 1520, 1325, 1151; 1 Н-ЯМР ( м.д.): 3,96 (2 Н, ш.с), 6,35-6,38 (1 Н, дд, J=8,56, 2,48 Гц), 6,62 (1 Н, д, J=2,46 Гц), 6,86-6,88(1 Н, д, J=8,56 Гц), 7,25-7,39 (3 Н, м), 7,66-7,68 (2 Н, м), 9,41 (1 Н, с); Масса (m/z): 283,7 (М+Н)+. Получение 2. Получение 4-метокси-N-метил-N-(1-метилпиперидин-4-ил)бензол-1,3-диамина. Стадия (I). Получение 2-метокси-5-нитро-N-(1-бутоксикарбонилпиперидин-4 ил)фениламина. Добавляют 2-метокси-5-нитрофениламин (8,0 г, 47,61 ммоль) в круглодонную колбу с последующим добавлением 1-бутоксикарбонил-4-пиперидона (28,42 г, 142,83 ммоль), сульфата натрия (67,6 г,476 ммоль) и уксусной кислоты (80 мл). Вышеупомянутую реакционную массу перемешивают в течение 8 ч при температуре окружающей среды. Затем добавляют триацетоксиборгидрид натрия (30,28 г,142,83 ммоль) при 20-25 С в течение 5 мин и перемешивают реакционную массу в течение дополнительных 3 ч. Реакционную массу разлагают, выливая в воду (100 мл), и подщелачивают до рН 9 посредством 50% водного раствора гидроксида натрия. Продукт экстрагируют этилацетатом (450 мл). Объединенные органические слои промывают насыщенным соляным раствором (100 мл), сушат над безводным сульфатом натрия и концентрируют с получением маслянистой массы. Продукт дополнительно очищают колоночной хроматографией, где элюент представляет собой этилацетат, н-гексан и триэтиламин, с получением 24,01 г чистого продукта. ИК-спектр (см-1): 3418, 2950, 1685, 1264, 1172; 1(II). Получение 2-метокси-5-нитро-N-метил-N-(1-бутоксикарбонилпиперидин-4 ил)фениламина. Помещают 2-метокси-5-нитро-N-(1-бутоксикарбонилпиперидин-4-ил)фениламин (5 г, 14,24 ммоль),полученный на стадии (I), в круглодонную колбу, содержащую метанол (10 мл), и перемешивают при 25-30 С в течение 5 мин. Добавляют цианоборгидрид натрия (1,06 г, 17,09 ммоль) и муравьиную кислоту(1,96 г, 42,7 ммоль) и перемешивают реакционную массу в течение 10 мин. Отделяют белую твердую массу. Затем реакционную массу охлаждают до 0-5 С на ледяной бане и добавляют формальдегид(2,84 мл, 28,4 ммоль, 30-50%). Получают прозрачный раствор. Эту массу дополнительно перемешивают в течение 6 ч при 20-25 С. После завершения реакции (подтверждено тонкослойной хроматографией) растворитель отгоняют с получением маслянистой массы. Добавляют воду (100 мл) и подщелачивают с доведением рН до 8 с использованием насыщенного раствора бикарбоната натрия. Продукт экстрагируют этилацетатом (3100 мл) и слои разделяют. Объединенные органические слои промывают насыщенным соляным раствором (100 мл) и сушат над безводным сульфатом натрия. Органический слой концентрируют с получением 5,86 г масла темно-желтого цвета. ИК-спектр (см-1): 3425, 2959, 1680, 1176; 1 Н-ЯМР ( м.д.): 1,45 (9H, с), 1,60-1,69 (4H, м), 2,66 (2H, м), 2,75 (3 Н, с), 3,34-3,37 (1 Н, м), 3,94 (3 Н,с), 4,14-4,19 (2 Н, ш.с), 6,88-6,90 (1 Н, д, J=8,98 Гц), 7,79-7,80 (1 Н, д, J=2,72 Гц), 7,90-7,93 (1 Н, дд,J=8,95, 2,72 Гц); Масса (m/z): 366,5 (М+Н)+. Стадия (III). Получение 2-метокси-5-нитро-N-метил-N-(пиперидин-4-ил)фениламина. В 250-миллилитровую трехгорлую круглодонную колбу добавляют 2-метокси-5-нитро-N-метил-N(1-трет-бутоксикарбонилпиперидин-4-ил)фениламин (3 г, 8,21 ммоль), полученный на стадии (II), с последующим добавлением изопропилового спирта (20 мл) и оставляют перемешиваться в течение 10 мин. Реакционную массу нагревают до 40-45 С и перемешивают в течение 5 мин с получением прозрачного раствора. К вышеупомянутой реакционной массе добавляют раствор (15,99 мл, 65,75 ммоль) хлористого водорода в изопропаноле (20%), по каплям в течение периода времени 10 мин. Дополнительно реакционную массу греют при 60-63 С в течение 2 ч. Твердые частицы, которые отделяются, отфильтровывают и смывают в воду (20 мл), подщелачивают раствором аммиака и экстрагируют этилацетатом (350 мл). Объединенные органические слои промывают насыщенным соляным раствором (20 мл), сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении с получением 2,5 г указанного в заглавии продукта. ИК-спектр (см-1): 3410, 2956, 1650, 1174; 1 Н-ЯМР ( м.д.): 1,65-1,72 (4 Н, м), 2,55-2,61 (2 Н, м), 2,78 (3 Н, с), 3,14-3,17 (2 Н, м), 3,31-3,34 (1 Н, м),3,94 (3 Н, с), 6,87-6,89 (1 Н, д, J=8,96 Гц), 7,79-7,80 (1 Н, д, J=2,74 Гц), 7,88-7,91 (1 Н, дд, J=8,98, 2,68 Гц); Масса (m/z): 266,1 (М+Н)+. Стадия (IV). Получение 2-метокси-5-нитро-N-метил-N-(1-метилпиперидин-4-ил)фениламина. В 250-миллилитровую трехгорлую круглодонную колбу добавляют 2-метокси-5-нитро-N-метил-N(пиперидин-4-ил)фениламин (1,93 г, 7,33 ммоль), полученный на стадии (III), с последующим добавлением метанола (20 мл) и перемешивают при 25-30 С в течение 5 мин. Добавляют цианоборгидрид натрия(0,548 г, 8,80 ммоль) и муравьиную кислоту (1,08 мл, 22,01 ммоль) и реакционную массу перемешивают в течение 10 мин. Реакционную массу охлаждают до 0-5 С на ледяной бане и добавляют формальдегид(1,46 мл, 14,6 ммоль, 30-50%) посредством шприца. Получают прозрачный раствор. Реакционную массу дополнительно перемешивают в течение 6 ч при 20-25 С. После завершения реакции (подтверждено тонкослойной хроматографией) растворитель отгоняют при пониженном давлении. К остаточной маслянистой массе добавляют воду (100 мл) и проводят подщелачивание до pH 8 с использованием насыщенного раствора бикарбоната натрия. Продукт экстрагируют этилацетатом (3100 мл). Объединенные органические слои промывают насыщенным соляным раствором (100 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении с получением 1,96 г маслянистой массы темно-желтого цвета. ИК-спектр (см-1): 2956, 1650, 1515, 1180; 1 Н-ЯМР ( м.д.): 1,68-1,71 (2 Н, м), 1,86-1,92 (2 Н, м), 1,98-2,04 (2 Н, м), 2,17 (3 Н, с), 2,78 (3 Н, с), 2,942,97 (2 Н, м), 3,25-3,28 (1 Н, м), 3,96 (3 Н, с), 6,87-6,91 (1 Н, д, J=8,98 Гц), 7,80 (1 Н, д, J=2,68 Гц), 7,88-7,92(1 Н, дд, J=8,96, 2,64 Гц); Масса (m/z): 280,2 (М+Н)+. Стадия (V). Получение 4-метокси-N-метил-N-(1-метилпиперидин-4-ил)бензол-1,3-диамина. В 250-миллилитровую трехгорлую круглодонную колбу добавляют железный порошок (1,99 г,6,81 ммоль) и 10 мл деминерализованной воды. Перемешивают массу в течение 5 мин и добавляют по каплям концентрированную хлористо-водородную кислоту (12 мл). Реакция является экзотермической. Далее, реакционную массу нагревают до 50 С и добавляют раствор 2-метокси-5-нитро-N-метил-N-(1 метилпиперидин-4-ил)фениламина (1,9 г, 6,81 ммоль), полученного на стадии (IV) и растворенного в этаноле (20 мл), по каплям через капельную воронку. Реакционную массу греют при 78-80 С в течение 4 ч. После завершения реакции (подтверждено тонкослойной хроматографией) этанол отгоняют полностью при пониженном давлении с получением маслянистой массы. Добавляют воду (50 мл) и подщелачивают до pH 9 с использованием 50% водного раствора гидроксида натрия. Отфильтровывают неорганические соединения и промывают осадок на фильтре (лепешку) этилацетатом (250 мл). Органический слой отделяют и сушат над безводным сульфатом натрия и затем концентрируют с получением 2,31 г маслянистого продукта. ИК-спектр (см-1): 3415, 2970, 1625, 1532, 1171; 1 Н-ЯМР ( м.д.): 1,24-1,25 (2 Н, м), 1,68-1,81 (2 Н, м), 1,92-1,98 (2 Н, м), 2,26 (3 Н, с), 2,26-2,27 (2 Н, м),2,68 (3 Н, с), 2,88-2,91 (1 Н, м), 3,77 (3 Н, с), 4,70 (2 Н, ш.с), 6,29-6,31 (1 Н, дд, J=8,40, 2,53 Гц), 6,38 (1 Н, д,J=2,72 Гц), 6,68-6,70 (1 Н, д, J=8,61 Гц); Масса (m/z): 250,2 (М+Н)+. Пример 1. Получение N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамида.N-(4-Хлор-3-аминофенил)бензолсульфонамид (1 г, 3,5 ммоль), полученный на стадии получения 1,добавляют в 100-миллилитровую трехгорлую круглодонную колбу с последующим добавлением 1-метил-4-пиперидона (0,81 г, 7,18 ммоль), сульфата натрия (3,49 г, 35 ммоль) и уксусной кислоты(20 мл). Реакционную массу перемешивают в течение 8 ч при комнатной температуре (30 С), затем в реакционную массу добавляют триацетоксиборгидрид натрия (2,23 г, 10,5 ммоль) при 20-25 С в течение 5 мин. Эту реакционную смесь дополнительно перемешивают в течение 3 ч при комнатной температуре. Реакционную смесь разлагают, выливая в 100 мл воды, подщелачивают до pH 9 посредством 50% водного раствора гидроксида натрия и экстрагируют продукт этилацетатом (450 мл). Объединенные органические слои промывают насыщенным соляным раствором (250 мл), сушат над безводным сульфатом натрия и отфильтровывают соли и концентрируют под вакуумом с получением маслянистой массы. Дополнительно очищают колоночной хроматографией с использованием этилацетата и н-гексана и триэтиламина в качестве элюентов с получением 0,86 г указанного в заглавии продукта. ИК-спектр (см-1): 1603, 1324, 1148, 1092; 1 Пример 21. Получение N-[4-хлор-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамидгидрохлорид. Продукт (0,86 г), полученный по методике примера 1, превращают в его гидрохлорид путем использования следующей методики. Полученное основание смывают диэтиловым эфиром (25 мл) и добавляют 1 мл 10% раствора хлористого водорода в изопропаноле. Реакционную массу перемешивают в течение 3 ч при 25-30 С и отфильтровывают гидрохлорид с получением указанного в заглавии продукта(0,8 г). ИК-спектр (см-1): 1605, 1326, 1152, 1095; 1 Н-ЯМР ( м.д.): 1,46-1,50 (2 Н, м), 1,94-1,97 (2 Н, м), 2,12-2,15 (2 Н, м), 2,32 (3 Н, с), 2,75-2,78 (2 Н, м),3,19-3,21 (1H, м), 4,15-4,17 (1 Н, д), 6,19-6,21 (1 Н, дд, J=8,39, 2,44 Гц), 6,44-6,45 (1 Н, д, J=2,40 Гц), 7,087,10 (1 Н, д, J=8,39 Гц), 7,44-7,48 (2 Н, м), 7,54-7,56 (1 Н, м), 7,78-7,80 (2 Н, м); Масса (m/z): 380 (М+Н)+. Пример 22. Получение 4-изопропил-N-[4-метил-3-(1-метилпиперидин-4 иламино)фенил]бензолсульфонамидгидрохлорида. 4-Изопропил-N-[4-метил-3-(1-метилпиперидин-4-иламино)фенил]бензолсульфонамид получают путем использования той же методики, что упомянута в примере 1, с некоторыми некритичными вариациями. Основание, таким образом полученное, смывают диэтиловым эфиром (25 мл) и добавляют 1 мл 10% раствора хлористого водорода в изопропаноле. Реакционную массу перемешивают в течение 3 ч при 25-30 С и отфильтровывают гидрохлорид с получением указанного в заглавии продукта (0,78 г). ИК-спектр (см-1): 1592, 1528, 1166, 1156; 1 Н-ЯМР ( м.д.): 1,22-1,24 (6 Н, д, J=6,92), 1,43-1,48 (2 Н, м), 1,95-1,97 (2 Н, м), 2,02 (3 Н, с), 2,10-2,15(2 Н, м), 2,30 (3 Н, с), 2,77-2,79 (2 Н, м), 2,91-2,94 (1 Н, септ., J=6,92 Гц), 3,20 (1 Н, м), 3,40 (1 Н, ш.с), 6,206,23 (1 Н, дд, J=8,40, 2,40 Гц), 6,36-6,37 (1 Н, д, J=2,40 Гц), 6,85-6,87 (1 Н, д, J=8,40 Гц), 7,26-7,28 (2 Н, м),7,67-7,70 (2 Н, м); Масса (m/z): 402,3 (M+Н)+. Пример 23. Получение 2-бром-N-4-метокси-3-[N-метил-N-(1-метилпиперидин-4 ил)амино]фенилбензолсульфонамида. 4-Метокси-N-метил-N-(1-метилпиперидин-4-ил)бензол-1,3-диамин (2 г, 8,03 ммоль), полученный по методике получения 2, растворяют в дихлорметане (25 мл) в 100-миллилитровой колбе. В колбу добавляют пиридин (1,29 мл, 16,06 ммоль) и перемешивают реакционную массу в атмосфере азота в течение 30 мин. Добавляют по каплям раствор 2-бромбензолсульфонилхлорида (2,45 г, 9,63 ммоль) в дихлорметане (10 мл), через капельную воронку при 25-30 С. Реакционную массу дополнительно перемешивают в течение 4 ч. Добавляют воду (80 мл) и экстрагируют продукт дихлорметаном (360 мл). Объединенные органические слои сушат и растворитель удаляют при пониженном давлении с получением маслянистой массы. Дополнительно, ее очищают колоночной хроматографией с использованием этилацетата и гексана в качестве элюентов с получением указанного в заглавии продукта (1,65 г). Диапазон температур плавления: 119,2-121,3 С; ИК-спектр (см-1): 2951, 1503, 1330, 1235, 1164; 1 Н-ЯМР ( м.д.): 1,46-1,49 (2 Н, м), 1,64-1,71 (2 Н, м), 1,83-1,89 (2 Н, м), 2,24 (3 Н, с), 2,54 (3 Н, с), 2,832,86 (2 Н, м), 3,08 (1 Н, м), 3,76 (3 Н, с), 6,64-6,68 (2 Н, м), 6,75-6,78 (1 Н, дд, J=8,60, 2,53 Гц), 7,28-7,36 (2H,м), 7,70-7,72 (1 Н, дд, J=7,6, 1,6 Гц), 7,89-7,99 (1 Н, дд, J=7,42, 2,08 Гц); Масса (m/z): 468,2, 470,2 (М+Н)+. Пример 24-47. Специалист в данной области может получить следующие соединения примеров 24-47 в соответствии с методиками, описанными выше. Пример 48. Таблетка, содержащая соединение формулы (I). Ингредиенты объединяют и гранулируют с использованием растворителя, такого как метанол. Затем состав сушат и придают форму таблеток (содержание активного соединения составляет приблизительно 20 мг) с помощью таблетирующей машины. Пример 49. Композиция для перорального введения. Ингредиенты смешивают и распределяют по капсулам по 100 мг композиции на каждую капсулу,где одна капсула может содержать приблизительно общую суточную дозировку. Пример 50. Жидкая композиция для перорального введения. Ингредиенты смешивают с получением суспензии для перорального введения. Пример 51. Композиция для парентерального введения. Активный ингредиент растворяют в пропорции с водой для получения инъекционного раствора. Затем добавляют достаточное количество хлорида натрия при перемешивании для получения изотонического раствора. Раствор доводят до заданной массы посредством оставшегося количества воды для получения инъекционного раствора, фильтруют через 0,2-микронный мембранный фильтр и упаковывают в стерильных условиях. Пример 52. Композиция суппозитория. Ингредиенты расплавляют вместе и смешивают на паровой бане и затем выливают в формы, распределяя по 2,5 г общей массы. Пример 53. Композиция для местного введения. Все ингредиенты, за исключением воды, объединяют и нагревают приблизительно до 60 С при перемешивании. Затем добавляют достаточное количество воды приблизительно при 60 С при энергичном перемешивании с получением эмульсии из ингредиентов и затем добавляют воду по необходимости,приблизительно 100 г. Пример 54. Анализ связывания для 5-НТ 6-рецептора человека. Соединения могут быть испытаны в соответствии со следующими методиками. Материалы и способы. Источник рецептора: рекомбинантный источник, экспрессированный в клетках HEK 293 человека. лизиргиновой кислоты (ЛСД) Радиолиганд(60-80 Ки/ммоль). Конечная концентрация лиганда - [1,5 нМ]. Неспецифическая детерминанта (сайт связывания): метиотепинмезилат - [0,1 мкМ]. Эталонное соединение: метиотепинмезилат. Позитивный контроль: метиотепинмезилат. Условия инкубирования. Реакции проводят в 50 мкМ растворе TRIS-HCl (рН 7,4), содержащем 10 мкМ MgCl2, 0,5 мМ EDTA(этилендиаминтетрауксусная кислота) в течение 60 мин при 37 С. Реакцию прерывают быстрой вакуумной фильтрацией на стекловолоконных фильтрах. Радиоактивность, захваченную на фильтрах, определяют и сравнивают с контрольными значениями для того, чтобы выявить любые взаимодействия испытуемого(ых) соединения(ий) с сайтом связывания клонированных серотониновых 5-НТ 6-рецепторов.for Tricyclic Psychotropic Drugs. Mol. Pharmacol. 1993, 43, 320-327. Пример 55. Функциональный анализ 5-НТ 6-рецепторов с использованием циклического аденозинмонофосфата (сАМР). Антагонистическое свойство соединений на 5-НТ 6-рецепторах человека определяют путем испытания их действия в отношении аккумуляции циклического аденозинмонофосфата (сАМР) в стабильно трансфицированных клетках HEK 293. Связывание агониста с 5-НТ 6-рецептором человека будет приводить к увеличению активности аденилциклазы. Соединение, которое является агонистом, будет показывать увеличение продуцирования сАМР, и соединение, которое является антагонистом, будет блокиро- 22019496 вать агонистический эффект. 5-НТ 6-рецепторы человека клонируются и стабильно экспрессируются в клетках HEK 293. Эти клетки высевают в 6-луночные планшеты в среде DMEM/F12 с 10% FCS (фетальная телячья сыворотка) и 500 мкг/мл G418 и инкубируют при 37 С в инкубаторе с СО 2. Клеткам дают возможность вырасти приблизительно до 70% конфлюэнтности прежде, чем инициировать эксперимент. В день проведения эксперимента культуральную среду удаляют и клетки промывают однократно бессывороточной питательной средой (SFM). Добавляют 2 мл среды SFM+IBMX (3-isobutyl-1-methylxanthine) и инкубируют при 37 С в течение 10 мин. Эту среду удаляют и в соответствующие лунки добавляют свежеприготовленную средуSFM+IBMX, содержащую различные соединения и 1 мкМ серотонина (в качестве антагониста), и инкубируют в течение 30 мин. После инкубирования среду удаляют и клетки промывают однократно посредством 1 мл PBS (забуференный фосфатом физиологический раствор). Каждую лунку обрабатывают посредством 1 мл холодного 95% этанола и 5 мкМ EDTA (этилендиаминтетрауксусная кислота) (2:1) при 4 С в течение 1 ч. Затем клетки соскребают и переносят в пробирки Эппендорфа. Пробирки центрифугируют в течение 5 мин при 4 С и супернатанты хранят при 4 С до момента проведения анализа. Содержание сАМР определяют посредством EIA (ферментативный иммуноанализ) с использованием набора реагентов для ферментативного иммуноанализа сАМР, выпускаемого Amersham Biotrak(Amersham RPN 225). Используют методику, которая описана для этого набора реагентов. Кратко, сАМР определяют, исходя из принципа конкуренции между немеченым сАМР и фиксированным количеством меченного перксидазой сАМР в отношении сайтов связывания на антителах против сАМР. Антитело иммобилизовано на лунках полистирольного титрационного микропланшета, поверхность которых предварительно покрыта вторым антителом. Реакцию начинают путем добавления 50 мкл меченного пероксидазой сАМР к образцу (100 мкл), предварительно инкубированному с антисывороткой (100 мл) в течение 2 ч при 4 С. По истечении 1 ч инкубирования при 4 С несвязанный лиганд отделяют путем простой процедуры промывки. Затем добавляют ферментный субстрат, триметилбензидин (1) и инкубируют при комнатной температуре в течение 60 мин. Реакцию прерывают путем добавления 100 мл 1,0 М серной кислоты и получающийся в результате колориметрический цвет считывают с помощью спектрофотометра титрационного микропланшета на 450 нм в пределах 30 мин. В функциональном методе анализа аденилатциклазы некоторые соединения этого изобретения, как обнаружено, являются конкурентными антагонистами с хорошей селективностью относительно ряда других рецепторов, включающих другие серотониновые рецепторы, такие как 5-HT1A и 5-НТ 7. Пример 56. Фармакокинетическое исследование на грызунах. В качестве экспериментального животного используют крыс-самцов линии Wistar (230-280 г), полученных из N.I.N. (Национальный институт питания, Хайдарабад, Индия). В каждую клетку помещают по три-пять экспериментальных животных. В течение ночи животным не дают пищи и поддерживают в режиме 12-часового цикла смены свет/темнота. Трем крысам вводят дозу NCE (лекарственная субстанция с неизвестными клиническими, токсикологическими, физическими и химическими свойствами) (10 мг/кг) перорально и внутривенно в 0- и на 2-й день. В каждый назначенный момент времени отбирают кровь из яремной вены. Плазму хранят замороженной при -20 С до момента проведения анализа. Концентрации соединения NCE в плазме определяют с использованием метода жидкостной хроматографии/тандемной масс-спектрометрии (LC-MS/MS). Назначенные моменты времени отбора крови в случае предварительного введения дозы: через 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после введения дозы (n=3). Соединения NCE определяют количественно в плазме посредством валидированного способа LC-MS/MS с использованием метода твердофазной экстракции. Количество соединений NCE в плазме определяют в диапазоне градуировки 2-2000 нг/мл. Исследуемые образцы анализируют с использованием калибровочных образцов в серии и образцов контроля качества, сделанных для всей серии. Фармакокинетические параметры: Cmax, Tmax, AUCt (площадь под фармакокинетической кривой),AUCinf, время полужизни (период полувыведения), объем распределения, клиренс, среднее время удержания препарата в организме и, с помощью этого, биодоступность при пероральном введении препарата вычисляют посредством некомпартментной модели с использованием версии 5.1 программного обеспечения WinNonlin. Пример 57. Исследование проникновения в мозг грызунов. В качестве экспериментальных животных используют крыс-самцов линии Wistar (230-280 г), полученных из N.I.N. (Национальный институт питания, Хайдарабад, Индия). В каждую клетку помещают по три экспериментальных животных. Животным дают воду и пищу ad libitum (неограниченно) на протяжении всего эксперимента и поддерживают в режиме 12-часового цикла смены свет/темнота. Проникновение в мозг определяют у крысы в состоянии равновесия. За один день до введения дозы крысам-самцам линии Wistar (225-250 г) делают анестезию галотаном для установки катетеров в яремную и бедренную вены путем хирургического вмешательства. После хирургического вмешательства крыс помещают в отдельные клетки для проведения инфузии, соединенные с компонентами раствора для инфузии (Instech Solomon; Plymouth Meeting, PA. USA), и предоставляют свободный доступ к пище и воде. Соединение NCE (лекарственная субстанция с неизвестными клиническими, токсикологическими,физическими и химическими свойствами) растворяют в воде и вводят с постоянной скоростью инфузии(5 мл/кг/ч) в течение 6-10 ч со скоростью введения запланированной к исследованию дозы 1,0 мг свободного основания/кг/ч. Образцы крови удаляют во время последней фазы инфузии для подтверждения равновесных концентраций в крови мозг и кровь собирают и оценивают. Для сбора плазмы и мозговой ткани и последующего ее гомогенизирования животные будут умерщвлены. Плазму и мозг хранят замороженными при -20 С до проведения анализа. Концентрации соединения NCE в плазме и в мозгу определяют с использованием способа жидкостной хроматографии-тандемной масс-спектрометрии(LC-MS/MS). Соединения NCE количественно определяют в плазме и в гомогенате мозга посредством валидированного способа LC-MS/MS с использованием метода твердофазной экстракции. Соединения NCE количественно определяют в диапазоне градуировки 1-500 нг/мл в плазме и в гомогенате мозга. Исследуемые образцы анализируют с использованием калибровочных образцов в серии и образцов контроля качества,сделанных для всей серии. Величины соотношения мозг-кровь вычисляют (Cb/Cp). Пример 58. Исследование мозга грызунов методом микродиализа на предмет возможной модуляции нейротрансмиттеров. В качестве экспериментальных животных используют крыс-самцов линии Wistar (230-280 г), полученных из N.I.N. (Национальный институт питания, Хайдарабад, Индия). Распределение групп: группа 1: среда для лекарства (вода; 5 мл/кг; перорально),группа 2: NCE (лекарственная субстанция с неизвестными клиническими, токсикологическими, физическими и химическими свойствами) (3 мг/кг; перорально),группа 3: NCE (10 мг/кг/ перорально). Хирургическая процедура: крысам делают анестезию хлоралгидратом и помещают в стереотаксическую рамку. Направляющий катетер (CMA/12) помещают в точку со стереотаксическими координатами АР: -5,2 мм, ML: +5,0 мм от брегмы и DV: -3,8 мм от поверхности мозга в соответствии с атласом Паксиноса и Ватсона (1986). В то время, когда животное еще находится под анестезией, через направляющий катетер вводят зонд для микродиализа (СМА/12, 4 мм, PC = поликарбонат) и закрепляют в соответствующем месте. После хирургического вмешательства выдерживают восстановительный период 48-72 ч перед тем, как подвергать животное исследованию. За день до исследования животных перемещают в привычные для проживания клетки для акклиматизации и имплантированный зонд перфузируют в течение ночи модифицированным раствором Рингера,содержащим 1,3 мкМ CaCl2 (Sigramsa), 1,0 мкМ MgCl2 (Sigramsa), 3,0 мкМ KCl (Sigramsa), 147,0 мкМ(PicoPlus, Harward). В день эксперимента скорость перфузии изменяют до 1,2 мкл/мин и дают возможность стабилизироваться в течение 3 ч. После периода стабилизации до введения дозы с интервалом 20 мин отбирают четыре базальные среды. Образцы диализата собирают в стеклянные пробирки с использованием коллектора охлажденных частиц CMA/170. После отбора четырех фракций вводят, используя чреззондовое питание, среду для лекарства или соединение NCE (3 или 10 мг/кг). Перфузат собирают впредь до 6 ч после введения. Концентрации ацетилхолина в образцах диализата измеряют посредством способа LC-MS/MS(ионизатор API 4000, системы детектирования MDS SCIEX). Ацетилхолин количественно определяют в диапазоне градуировки 0,250-8,004 нг/мл в диализатах. По завершении экспериментов по микродиализу животных умерщвляют и удаляют их мозги и хранят в 10% растворе формалина. Каждый мозг разрезают, делая срезы на расстоянии 50 мкм друг от друга,на криостате (Leica), окрашивают и исследуют на микроскопе для подтверждения размещения зонда. Данные от животных с некорректным размещением зонда отбрасывают. Данные микродиализа выражают в виде изменений, выраженных в процентах, (среднее значениестандартная погрешность среднего) относительно исходного уровня, который определяют в виде среднего абсолютного значения (в фемто-моль/10 мкл) по четырем образцам-пробам, полученным до введения лекарственного средства. Действия обработок соединением NCE (3 и 10 мг/кг) и средой для лекарства оценивают статистическими методами: посредством однофакторного дисперсионного анализа с последующим использованием критериев множественного сравнения Dunnett. Во всех статистических измерениях р 0,05 считают значимым. Данные статистически оценивают с помощью программы Graph Pad Prism. Пример 59. Измерение потребления пищи. Используют крыс-самцов линии Wistar (120-140 г), полученных из N.I.N. (Национальный институт питания, Хайдабард, Индия). Хронический эффект соединений общей формулы (I) в отношении потребления пищи у хорошо откормленных крыс определяют следующим образом. Крыс помещают в клетки, предназначенные для одного животного, на 28 дней. В течение этого периода времени крысам вводят перорально или интраперитонеально дозу либо композиции, содержащей соединение формулы (1), либо соответствующей композиции (среда для лекарства) без упомянутого соединения (контрольная группа), один раз в день, и крысам предоставляют пищу и воду ad libitum (неограниченно). В 0-, 1-, 7-, 14-, 21- и 28-й день крысам оставляют предварительно взвешенные количества пищи. Потребление пищи и увеличение массы (привес) измеряют в соответствии с обычными процедурами. Также способ исследования с учетом приема пищи раскрыт в литературе (Kask et al., European Journal ofPharmacology, 414, 2001, 215-224 и Tunball et al., Diabetes, 2002, 51, 2441-2449, с некоторыми своими модификациями). Соответственные части описаний включены в этот документ путем ссылки, и они образуют часть раскрытия. Некоторые репрезентативные соединения показали статистически достоверное снижение потребления пищи при введении вышеупомянутым способом либо в дозах 10 или 30 мг/кг, либо в обеих дозах. Пример 60. Экспериментальная модель решения задачи распознавания объектов. Улучшающие когнитивную способность (познание) свойства соединений этого изобретения оценивают с использованием экспериментальной модели когнитивных способностей животных: экспериментальная модель решения задачи распознавания объектов. В качестве экспериментальных животных используют крыс-самцов линии Wistar (230-280 г), полученных из N.I.N. (Национальный институт питания, Хайдарабад, Индия). В каждую клетку помещают по четыре экспериментальных животных. Животных содержат в условиях 20% пищевой депривации за один день до проведения эксперимента и дают воду ad libitum (неограниченно) на протяжении всего эксперимента и поддерживают в режиме 12-часового цикла смены свет/темнота. Также у крыс вырабатывают привыкание к индивидуальным аренам в течение 1 ч в отсутствие любых объектов. Одна группа из 12 крыс получает среду для лекарства (1 мл/кг) перорально и другая группа животных получает соединение формулы (I) либо перорально, либо интраперитонеально за 1 ч до испытания с проведением "ознакомления" (Т 1) и с выполнением "задачи выбора" (Т 2). Эксперимент выполняют в камере "открытое поле" размером 505050 см, изготовленной из акрилового полимера. В фазе ознакомления, (Т 1), крыс помещают отдельно в камеру "открытое поле" на 3 мин, в которой два идентичных предмета (пластиковые бутылки высотой 12,5 см и диаметром 5,5 см),покрытых желтой маскировочной липкой лентой как таковой (a1 и а 2), размещают в двух смежных углах, в 10 см от стен. По истечении 24 ч испытания (Т 1) для тестирования долговременной памяти тех же самых крыс помещают в ту же самую арену, в которой они пребывали в испытании Т 1. Крысам в фазе выбора (Т 2) дают возможность обследовать камеру "открытое поле" в течение 3 мин при наличии одного знакомого предмета (а 3) и одного нового предмета (b) (стеклянная бутылка цвета янтаря высотой 12 см и диаметром 5 см). Знакомые предметы имеют сходные текстуры, цвета и размеры. Во время испытаний Т 1 и Т 2 обследования каждого предмета (определены как обнюхивание, облизывание, разжевывание или наличие шевелящихся вибрисс тогда, когда нос направлен в сторону предмета на расстоянии менее чем 1 см) регистрируют отдельно посредством секундомера с остановом. Сидение на предмете не рассматривают как исследовательскую активность, однако это наблюдают редко. Т 1 представляет собой общее время, потраченное на обследование знакомых предметов (a1+a2). Т 2 представляет собой время, потраченное на обследование знакомого предмета и нового предмета(а 3+b). Тест распознавания предмета выполняют так, как описано в публикации: Ennaceur, A., Delacour, J.,A new one-trial test for neurobiological studies of memory in rats - Behavioural data, Behav. Brain Res., 1988,31, 47-59. Некоторые репрезентативные соединения проявляют позитивные эффекты, показывающие более длительное распознавание нового предмета, а именно увеличенное время обследования нового предмета и более высокий индекс различения. Пример 61. Водный лабиринт. Аппарат водный лабиринт состоит из круглого бассейна (диаметром 1,8 м, высотой 0,6 м), построенного из листового акрилового черного оргстекла Black Perspex (системы TSE, Германия), заполненного водой (242 С), и установленной снизу широкоугольной видеокамеры для слежения за животным. Платформу из оргстекла Perspex площадью 10 см 2, лежащую на 1 см ниже поверхности воды, помещают в центре одного из четырех воображаемых квадрантов, которые остаются неизменными для всех крыс. Листовое акриловое черное оргстекло Black Perspex, используемое в конструкции лабиринта и платформы, не представляет собой раздражитель, относящийся к лабиринту, который управляет поведением избегания опасности. В противоположность этому, помещение для обучения предоставляет несколько сильных визуальных раздражителей, не относящихся к лабиринту, которые способствуют формированию трехмерной схемы (соответствие), необходимой для научения избеганию. Применяют автоматическую систему слежения [Videomot 2 (5.51), системы TSE, Германия]. Эта программа анализирует видеоизображения, полученные с помощью цифровой камеры и панелей получения изображений, которые позволяют определить длину траектории, скорость плавания и число входов в каждый квадрант водного лабиринта и продолжительность периода времени, затраченного в ходе плавания в каждом квадранте водного лабиринта. Пример 62. Индукция жевательных функций/зевательных функций/потягивания посредством антагонистов 5-НТ 6-рецепторов. Используют крыс-самцов линии Wistar, имеющих массу 200-250 г. Крысам делают инъекции, содержащие среду для лекарства, и помещают в отдельные прозрачные камеры на 1 ч каждый день за 2 дня до дня испытания, для выработки привыкания крыс к камерам для наблюдения и к процедуре проведения испытания. В день испытания крыс помещают в камеры для наблюдения непосредственно после введения лекарственного средства и непрерывно наблюдают за поведением, касающимся зевательных функций, потягивания и жевательных функций, в течение 60-90 мин после введения инъекционных растворов,содержащих лекарственное средство или среду для лекарства. За 60 мин до введения лекарственного средства всем животным вводят психостиграмсин, 0,1 мг/кг интраперитонеально. Регистрируют среднее число проявлений зевоты, потягиваний и бесцельных жевательных движений во время 30-минутного периода наблюдения. Ссылка:of Pharmacology, 1999, 126(7), 1537-1542). Пример 3. Пассивное избегание. Животных обучают в соответствии с концепциями теста пассивного избегания "свет-темнота" в единичном испытании, выполняемом поэтапно. Аппарат для обучения состоит из камеры длиной 300 мм,шириной 260 мм и высотой 270 мм, построенной в соответствии со стандартными проектами. Передняя сторона и верхняя часть являются прозрачными, что позволяет экспериментатору наблюдать за поведением животного внутри аппарата. Камера поделена на две зоны, разделяемые с помощью центрального затвора, который имеет небольшой проем шириной 50 мм и высотой 75 мм и который установлен рядом с передней стороной камеры. Меньшая из зон имеет размер в ширину 9 мм и содержит источник подсветки низкой мощности (6 В). Большая зона имеет размер в ширину 210 мм и не освещается. Пол этой темной зоны представляет собой решетку из 16 горизонтальных стержней из нержавеющей стали, которые имеют диаметр 5 мм и расположены на расстоянии друг от друга 12,5 мм. Генератор тока подает 0,75 мА на пол решетки, который скремблируют однократно каждые 0,5 с по всем 16 стержням. Диапазон измерения сопротивления 40-60 мкОм вычисляют для контрольной группы крыс, и соответственно тому калибруют аппарат. Электронная схема, детектирующая сопротивление животного, надежно обеспечивает точную подачу тока посредством автоматического изменения напряжения при изменении сопротивления. Экспериментальная методика. Это проводят так, как описано ранее. Используют взрослых крыс-самцов линии Wistar, имеющих массу 200-230 г. Животных приносят в лабораторию за 1 ч до эксперимента. В день проведения обучения животных помещают обращенными в сторону тыловой поверхности светлой зоны аппарата. Таймер запускают сразу, как только животное оказывается полностью обращенным в сторону передней поверхности камеры. Регистрируют латентный период, необходимый для вступления в темную камеру (обычно 20 с), и после вхождения в темную зону полностью животные получают неизбегаемое электроболевое раздражение лап током 0,75 мА в течение 3 с. Затем животных возвращают в их клетки-жилище. В промежутке между каждой сессией обучения обе зоны камеры чистят для удаления любых усугубляющих(сбивающих с толку) обонятельных раздражителей. Вспоминание этого ингибирующего стимула (тормозящий раздражитель) оценивают через 24, 72 ч и на 7 день после обучения посредством возвращения животного в светлую камеру и регистрирования латентного периода, необходимого ему для вхождения в темную камеру, и применяют предполагаемое минимальное время 300 с. Ссылка:(B) Fox G.B., Connell A.W.U., Murphy K.J., Regan C.М., Journal of Neurochemistry, 1995, 65, 6, 27962799. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) или его фармацевтически приемлемая соль,где R1 представляет собой водород, хлор, метокси или метил;R2 представляет собой водород или метил;R4 представляет собой водород или метил. 2. Соединение по п.1, которое выбирают из группы, включающей 2-бром-N-4-метокси-3-[N-метил-N-(1-метилпиперидин-4-ил)амино]фенилбензолсульфонамид или их фармацевтически приемлемые соли. 3. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (II) с производным пиперидин-4-она с использованием подходящего реагента-восстановителя и основания в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45 С, с получением соединения формулы (I), где все заместители являются такими же, как они определены в п.1. 4. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (III) с производным бензолсульфонилхлорида, в присутствии подходящего растворителя при температуре в диапазоне от 20 до 45 С, с получением соединения формулы (I), где все заместители являются такими же, как они определены в п.1. 5. Применение соединения по п.1 в изготовлении лекарственного средства для лечения и/или предупреждения заболеваний, связанных с серотониновым 5-НТ 6-рецептором. 6. Применение по п.5 для лечения клинического состояния, такого как тревога, болезнь Альцгеймера, депрессия, нарушения когнитивных способностей и памяти, ADHD (синдром дефицита внимания/синдром гиперактивности), психотическая депрессия, болезнь Паркинсона, шизофрения, слабовыраженное когнитивное нарушение или нейродегенеративные расстройства.
МПК / Метки
МПК: C07D 333/62, C07D 295/30
Метки: арилсульфонамидные, качестве, 5-ht6, аминосоединения, применение, лигандов
Код ссылки
<a href="https://eas.patents.su/30-19496-arilsulfonamidnye-aminosoedineniya-i-ih-primenenie-v-kachestve-ligandov-5-ht6.html" rel="bookmark" title="База патентов Евразийского Союза">Арилсульфонамидные аминосоединения и их применение в качестве лигандов 5-ht6</a>
Предыдущий патент: Спирогетероциклические n-оксипиперидины в качестве пестицидов
Следующий патент: Разделительное устройство для отделения частиц песка и породы
Случайный патент: Быстро закрепляемая накладка из волос, снабжённая плетёной лентой, полностью сливающаяся с основными волосами, и способ её прикрепления