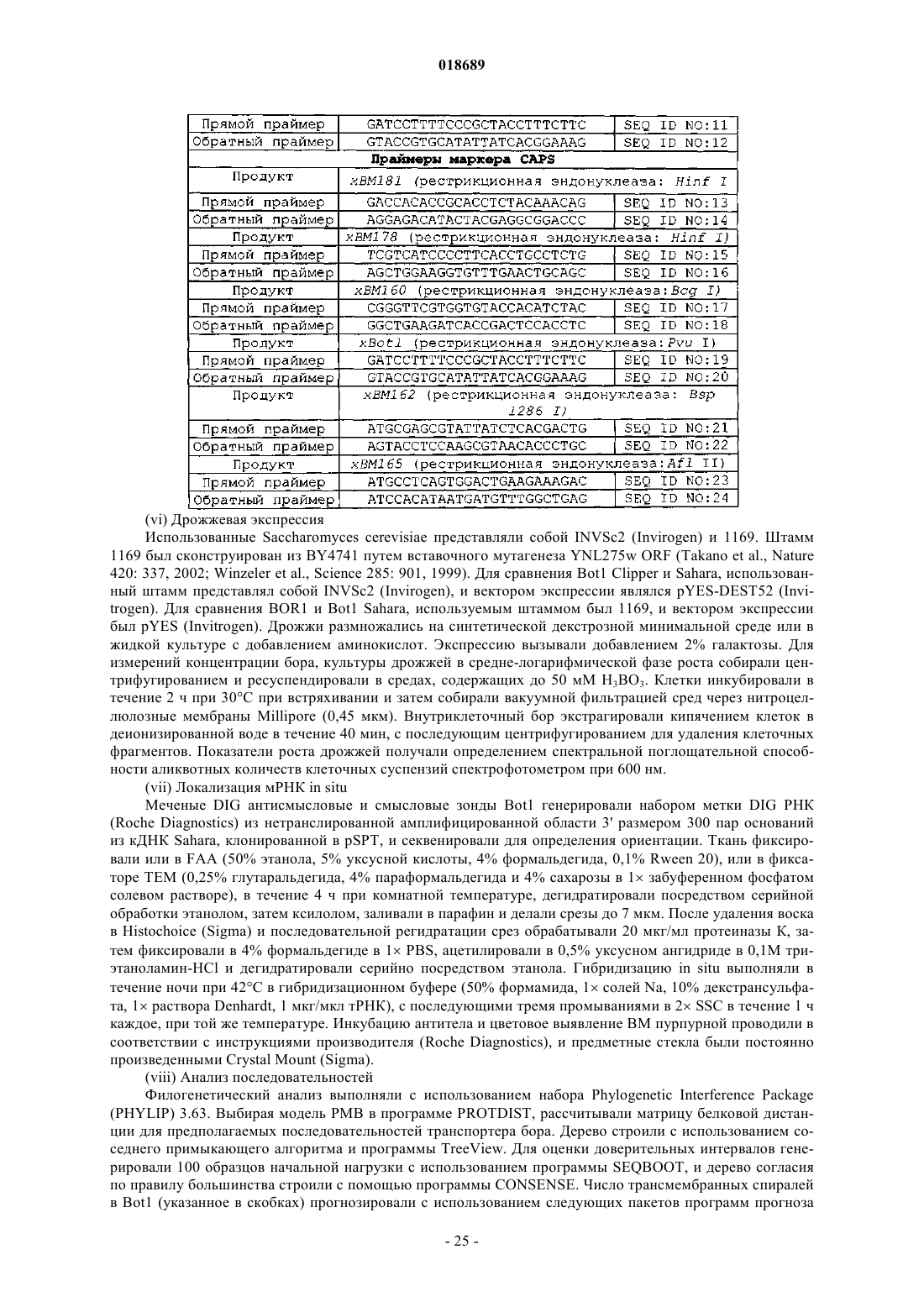
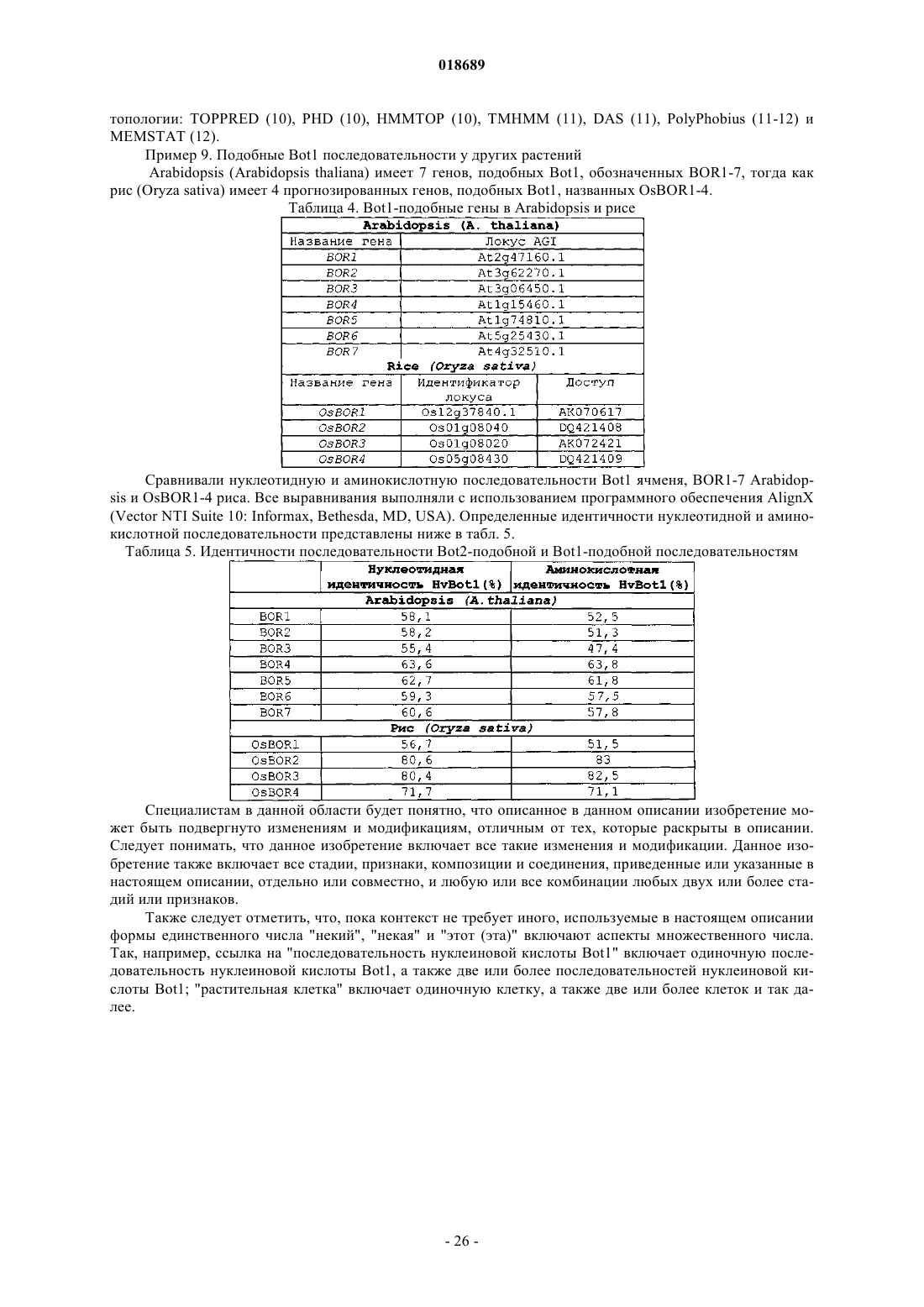
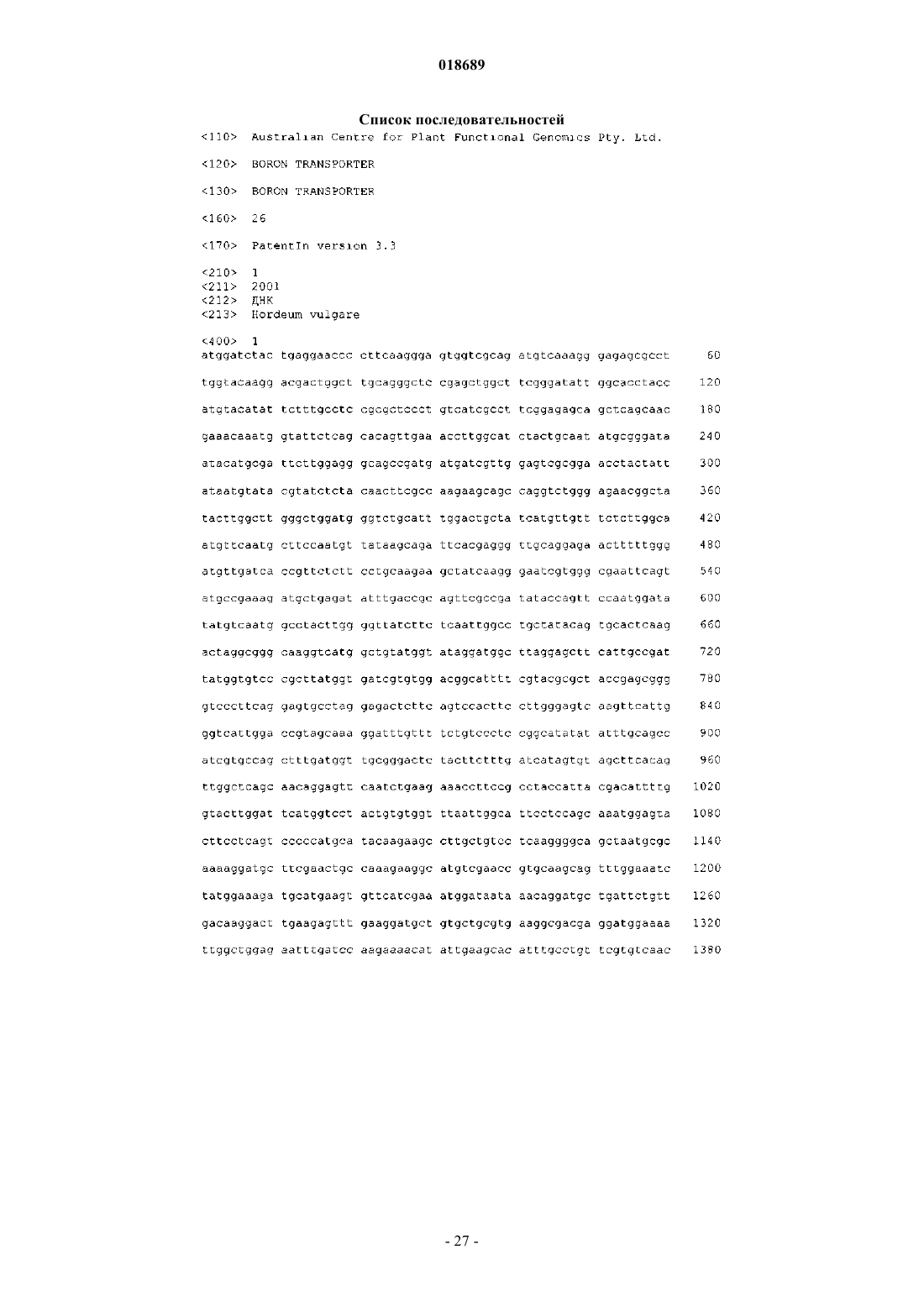
Полипептид, представляющий собой транспортер бора, кодирующая его нуклеиновая кислота и их применение
Номер патента: 18689
Опубликовано: 30.09.2013
Авторы: Хейз Джули, Саттон Тим, Лэнгридж Питер, Бауманн Уте
Формула / Реферат
1. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность, выбранную из группы, состоящей из:
(i) нуклеотидной последовательности, которая кодирует полипептид, содержащий аминокислотную последовательность SEQ ID NO:2;
(ii) нуклеотидной последовательности, которая кодирует функциональный гомолог полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO:2, где указанный функциональный гомолог по меньшей мере на 84% идентичен SEQ ID NO:2 по аминокислотной последовательности;
(iii) нуклеотидной последовательности, которая является комплементом или обратным комплементом нуклеотидной последовательности, указанной в подпункте (i) или (ii); и
(iv) фрагмента нуклеотидной последовательности, указанной в любом из подпунктов (i), (ii) или (iii),
где нуклеиновая кислота кодирует полипептид транспортера бора.
2. Нуклеиновая кислота по п.1, где выделенная нуклеиновая кислота содержит нуклеотидную последовательность, выбранную из группы, состоящей из:
(i) нуклеотидной последовательности SEQ ID NO:1;
(ii) нуклеотидной последовательности, которая по меньшей мере на 81% идентична нуклеотидной последовательности SEQ ID NO:1;
(iii) нуклеотидной последовательности, которая гибридизуется с нуклеотидной последовательностью SEQ ID NO:1, в жестких условиях;
(iv) нуклеотидной последовательности, которая комплементарна или обратно комплементарна любой из последовательностей (i)-(iii); и
(v) фрагмента любой из последовательностей (i), (ii), (iii) или (iv).
3. Нуклеиновая кислота по п.1 или 2, полученная из растения.
4. Нуклеиновая кислота по п.3, полученная из однодольного растения.
5. Нуклеиновая кислота по п.4, полученная из злакового растения.
6. Нуклеиновая кислота по п.5, полученная из растения ячменя.
7. Конструкция нуклеиновой кислоты, содержащая нуклеиновую кислоту по любому из пп.1-6.
8. Генетически модифицированная клетка, содержащая нуклеиновую кислоту по пп.1-6 или конструкцию по п.7.
9. Клетка по п.8, представляющая собой клетку гриба.
10. Клетка по п.8, представляющая собой клетку дрожжей.
11. Клетка по п.10, представляющая собой клетку Saccharomyces cerevisae.
12. Клетка по п.8, представляющая собой растительную клетку.
13. Клетка по п.12, представляющая собой клетку однодольного растения.
14. Клетка по п.13, представляющая собой клетку злакового растения.
15. Клетка по п.14, представляющая собой клетку ячменя.
16. Многоклеточная структура, содержащая одну или более клеток по любому из пп.8-15.
17. Многоклеточная структура по п.16, представляющая собой растение, ткань растения, орган растения, часть растения, репродуктивный материал растения или культивируемую ткань растения.
18. Выделенный полипептид, выбранный из группы, состоящей из:
(i) полипептида, содержащего аминокислотную последовательность SEQ ID NO:2;
(ii) полипептида, который является функциональным гомологом (i), где указанный функциональный гомолог по меньшей мере на 84% идентичен SEQ ID NO:2 по аминокислотной последовательности; и
(iii) фрагмента (i) или (ii),
где полипептид представляет собой полипептид транспортера бора.
19. Полипептид по п.18(ii) или (iii), где полипептид содержит один или более эпитопов полипептида по п.18(i).
20. Антитело или его связывающий эпитоп фрагмент, направленные к полипептиду по п.18 или 19.
21. Способ модуляции скорости, уровня и/или типа выходящего тока бора из клетки, включающий изменение активности и/или экспрессии полипептида по п.18 или 19 в клетке.
22. Способ по п.21, где клетка представляет собой клетку гриба.
23. Способ по п.21, где клетка представляет собой дрожжевую клетку.
24. Способ по п.23, где клетка представляет собой клетку Saccharomyces cerevisae.
25. Способ по п.21, где клетка представляет собой растительную клетку.
26. Способ по п.25, где клетка представляет собой клетку однодольного растения.
27. Способ по п.26, где клетка представляет собой клетку злакового растения.
28. Способ по п.27, где клетка представляет собой клетку ячменя.
29. Способ по пп.21-28, где уровень и/или активность полипептида изменяется путем модуляции экспрессии нуклеиновой кислоты по п.1 или 2 в клетке.
30. Способ по пп.21-29, где уровень и/или активность полипептида в клетке увеличивается.
31. Способ по п.30, где экспрессия нуклеиновой кислоты по п.1 или 2 в клетке увеличивается.
32. Клетка с модулированными скоростью, уровнем и/или типом выходящего тока бора, полученными в соответствии со способом по любому из пп.21-31.
33. Клетка по п.32, имеющая повышенную скорость и/или уровень выходящего тока бора относительно клетки дикого типа.
34. Многоклеточная структура, содержащая одну или более клеток по п.32 или 33.
35. Способ определения чувствительности или толерантности организма к бору, включающий определение уровня экспрессии последовательности нуклеиновой кислоты по п.1 или 2 и/или полипептида по п.18 в одной или более клетках организма, где относительно высокий уровень экспрессии связан с толерантностью организма к бору и относительно низкий уровень экспрессии связан с чувствительностью организма к бору.
36. Способ по п.35, где уровень экспрессии определяется определением числа копий нуклеиновой кислоты по п.1 или 2, присутствующих в геномной ДНК одной или более клеток организма.
37. Способ по п.36, где клетка представляет собой растительную клетку.
38. Способ по п.37, где клетка представляет собой клетку однодольного растения.
39. Способ по п.38, где клетка представляет собой клетку злакового растения.
40. Способ по п.39, где клетка представляет собой клетку ячменя.
41. Способ по любому из пп.35-40, где способ дополнительно включает выбор отдельных организмов на основании установленного уровня чувствительности или толерантности к бору.
Текст
ПОЛИПЕПТИД, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ТРАНСПОРТЕР БОРА,КОДИРУЮЩАЯ ЕГО НУКЛЕИНОВАЯ КИСЛОТА И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к транспортерам бора, в частности к транспортерам бора,полученным из растений. Настоящее изобретение также относится к способам, в которых используются транспортеры бора, таким как способы моделирования транспорта бора в клетках и способы определения скорости транспорта бора в клетке или организме на основании уровня экспрессии одного или более транспортеров бора.(71)(73) Заявитель и патентовладелец: ОСТРЭЙЛИАН СЕНТР ФОР ПЛАНТ ФАНКШЕНЛ ДЖЕНОМИКС ПТИ ЛТД. (AU) По настоящей заявке испрашивается приоритет предварительной заявки на патент Австралии 2007900157, содержание которой включено в настоящее описание путем ссылки. Область, к которой относится изобретение Настоящее изобретение относится к транспортерам бора и, в частности, к транспортерам бора, полученным из растений. Настоящее изобретение также относится к способам, в которых используются транспортеры бора, таким как способы моделирования транспорта бора в клетках, на основании уровня экспрессии одного или более транспортеров бора. Предшествующий уровень техники Бор представляет существенный питательный микроэлемент растений, который является токсичным в высоких концентрациях в почве. Диапазон между недостаточностью и токсичностью бора для растений узок, и нарушения баланса питания бором часто встречаются в сельском хозяйстве. Хотя недостаточность легко устранить путем применения обогащенных бором удобрений, с токсичностью бора труднее справиться агрономическими способами. Уровни бора в целом выше в подпочвах, чем в поверхностной корневой зоне, затрудняя и делая непрактичной амелиорацию посредством модификации почвы. Токсичность бора является основным ограничением выращиванию злаковых культур в южной Австралии, а также представляет проблему в засушливых и полузасушливых частях света, включая Азию и Африку. Снижение урожая ячменя, достигающее 17%, между прилегающими зонами, были отнесены на счет различий концентрации бора в ростках. Об аналогичных цифрах (11%) сообщалось для пшеницы в южной Австралии. Почвы с высоким содержанием бора имеют тенденцию быть связанными со средами с низким выпадением дождей (250-450 мм в год) и в первую очередь вызваны богатыми глиной отложениями морского происхождения. Токсичность бора все в большей степени становится связанной с орошаемыми средами, где использование грунтовой воды содействует избыточному накоплению бора. Бор часто обнаруживается в высоких концентрациях в соленых почвах. Известно, что бор функционирует в растениях в качестве структурного и функционального компонента клеточных стенок и плазматической мембраны. В растениях бор существует, главным образом, в виде борной кислоты [B(ОН)3] и, в меньшей степени, при нейтральном и щелочном рН, в виде бората[В(ОН)4]. При адекватной доставке бора захват из почвы в корни растений через плазматическую мембрану представляет собой пассивный процесс, который происходит быстро. Полупериод входящего тока в корни ячменя составляет приблизительно 6 мин. Проводились обширные исследования способности бора образовывать устойчивые комплексы внутри растительной клетки. Примеры молекул, которые образуют комплексы с борной кислотой, включают рибозу, апиозу, сорбит и другие полиолы, гликопротеины и гликолипиды. Связывание бора с апиозой, центральным компонентом комплекса рамногалактуронана-II в стенках первичной растительной клетки, необходимо для поддержания нормальных физических свойств клеточных стенок. В сосудистых растениях бор движется от корней внутри потока транспирации и накапливается на кончиках более старых листьев. Резкий градиент концентрации наблюдается внутри листа, и симптомы токсичности прямо коррелируют с распределением бора. Симптомы появляются сначала на кончиках более старых листьев, где высокая концентрация бора ведет хлорозу и некрозу, причем первый распространяется вниз по краям листа. У ячменя это обычно происходит при клеточных концентрациях, превышающих 23 мМ. Вариация устойчивости к токсичности бора существует как между видами, так и в пределах видов. Представляется, что первичный механизм устойчивости аналогичен для всех изученных видов: способность поддерживать низкие концентрации бора в тканях растений. Однако молекулярная основа для этого в настоящее время неизвестна. Устойчивые к бору генотипы обычно накапливают меньшие концентрации бора, чем неустойчивые генотипы, свидетельствуя о том, что работают скорее механизмы исключения, чем внутренней устойчивости. Однако вероятно, что в растениях присутствуют другие механизмы, связанные с внутренней устойчивостью к бору, и они играют существенную роль. Картированием интервала регрессии как у пшеницы, так и у ячменя была идентифицирована хромосомная локализация нескольких локусов QTL для различных признаков непереносимости бора. В ячмене были идентифицированы 4 локуса QTL (на 2HS, 3HS, 4HL, 6HL), которые оказывают выявляемые эффекты на толерантность к бору у ячменя. Они представляют собой экспрессию листовых симптомов(измерение опасности симптомов на основе повреждений листа), относительную длину корня (длина корня при концентрации бора 100 мг/л-1, выраженная как процентная доля длины корня при концентрации бора 0 мг/л-1), концентрация бора во всем ростке (концентрация бора в ростке 5-недельных растений,по данным измерения индукционно связанной плазменной спектрометрии, ICP) и продукции сухого вещества (сухой массы). Было бы желательно идентифицировать нуклеотид и аминокислотную последовательность, которые кодируют транспортеры бора, и путь, которым они могут быть экспрессированы в растительных тканях, во избежание токсичности бора. Идентификация таких последовательностей позволит наряду с другими вещами ввести, удалить или модулировать активность транспорта бора в диапазоне клеток и/или организмов, включая растительные клетки и растения. Ссылка на любой документ предшествующего уровня техники в настоящем описании не должна восприниматься как признание или любая форма предположения, что предшествующий уровень техники составляет часть общеизвестной информации в любой стране. Краткое описание сущности изобретения Настоящее изобретение частично основано на идентификации полипептидов и их соответствующих нуклеиновых кислот, которые кодируют молекулы транспортера бора. По всему тексту слово "бор" используется в качестве сокращенного обозначения содержащих бор соединений, таких как борная кислота (Н 3 ВО 3), анион бората (Н 4 ВО 4) и различные содержащие бор органические соединения, в частности, в отличие от элементного В. В частности, настоящее изобретение частично основано на выделении полипептидной последовательности из ячменя (Hordeum vulgare), которая кодирует транспортер бора, связанный с увеличенной толерантностью к бору, по меньшей мере, у сортов ячменя Sahara 3771. Этот полипептид был обозначенHvBot1 и содержит аминокислотную последовательность, представленную в SEQ ID NO:2. Была также определена последовательность нуклеиновой кислоты открытой рамки считывания, которая кодирует полипептид HvBot1. Эта нуклеотидная последовательность обозначена как HvBot1 и содержит аминокислотную последовательность, представленную в SEQ ID NO:1. Соответственно, в первом аспекте настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей нуклеотидную последовательность, выбранную из списка, состоящего из:(ii) нуклеотидной последовательности, которая кодирует функциональный гомолог полипептида,содержащего аминокислотную последовательность, представленную в SEQ ID NO:2;(iii) нуклеотидной последовательности, которая является комплементом или обратным комплементом нуклеотидной последовательности, указанной в подпункте (i) или (ii); и(iv) фрагмента нуклеотидной последовательности, указанной в любом из подпунктов (i), (ii) или (iii). Нуклеотидные последовательности первого аспекта изобретения также именуются в настоящем описании "нуклеиновыми кислотами Bot1" или "последовательностями нуклеиновых кислот Bot1". Как правило, нуклеиновые кислоты Bot1 настоящего изобретения кодируют полипептиды транспортера бора. В определенных вариантах осуществления выделенная нуклеиновая кислота Bot1 содержит нуклеиновую кислоту, выбранную из списка, состоящего из:(ii) нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая по меньшей мере на 81% идентична нуклеотидной последовательности, представленной в SEQ ID NO:1;(iv) нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая представляет собой комплемент или обратный комплемент любой из (i)-(iii); и(v) фрагмента любой из (i), (ii), (iii) или (iv). Нуклеиновые кислоты Bot1 настоящего изобретения могут быть получены из любого источника. Например, нуклеиновые кислоты Bot1 могут быть получены из организма, такого как растение. Во втором аспекте настоящее изобретение относится к конструкту нуклеиновой кислоты или вектору, содержащему нуклеиновую кислоту первого аспекта изобретения. В третьем аспекте настоящее изобретение относится к генетически модифицированной клетке, содержащей введенную нуклеиновую кислоту, выбранную из списка, состоящего из:(i) выделенной нуклеиновой кислоты Bot1 первого аспекта изобретения; и(ii) конструкта нуклеиновой кислоты или вектора второго аспекта изобретения. Кроме того, в четвертом аспекте настоящее изобретение относится к многоклеточной структуре,-2 018689 содержащей одну или более клеток третьего аспекта изобретения. Указанная в настоящем описании "многоклеточная структура" включает любую агрегацию одной или более клеток. По существу, многоклеточная структура, в частности, охватывает ткани, органы, целые организмы и их части. Кроме того, следует также понимать, что многоклеточная структура охватывает многоклеточные агрегации культивированных клеток, такие как колонии, каллюсы растений, суспензионные культуры и тому подобное. В пятом аспекте настоящее изобретение относится к выделенному полипептиду, выбранному из списка, состоящего из:(ii) полипептида, который является функциональным гомологом (i); и(iii) фрагмента (i) или (ii). Полипептиды настоящего изобретения также именуются в настоящем описании полипептидамиBot1. Как правило, полипептиды Bot1 настоящего изобретения содержат полипептиды транспортера бора. Выделенные полипептиды и их фрагменты настоящего изобретения могут также использоваться,например, в генерировании антител, которые связываются с полипептидами Bot1. Соответственно, в шестом аспекте настоящее изобретение относится к антителу или его связывающему эпитоп фрагменту,выработанному или против полипептида Bot1, или полипептида, содержащего эпитоп Bot1. В седьмом аспекте настоящее изобретение относится к способу модуляции скорости, уровня и/или типа выходящего тока бора из клетки, включающему модуляцию активности и/или экспрессии полипептида Bot1 в указанной клетке. В одном из вариантов осуществления уровень и/или активность полипептида Bot1 модулируется путем модуляции экспрессии нуклеиновой кислоты Bot1 в клетке. В восьмом аспекте настоящее изобретение относится к клетке с модулированной скоростью, уровнем и/или типом выходящего тока бора. В одном из вариантов осуществления клетка восьмого аспекта изобретения получена в соответствии со способом седьмого аспекта изобретения. В девятом аспекте настоящее изобретение также относится к многоклеточной структуре, где многоклеточная структура содержит одну или более клеток восьмого аспекта изобретения. В десятом аспекте настоящее изобретение относится к способу определения чувствительности организма к бору или толерантности к нему, включающему определение уровня экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 в одной или более клетках организма, где относительно высокий уровень экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 связан с толерантностью организма к бору, и относительно низкий уровень экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 связан с чувствительностью организма к бору. По всему настоящему описанию, пока контекст не требует иного, слово содержать или его варианты, такие как "содержит" или "содержащий", следует понимать как подразумевающее включение указанного элемента или целого числа или группы элементов или целых чисел, но не исключением любого другого элемента или целого числа или группы элементов или целых чисел. В настоящем описании нуклеотидные и аминокислотные последовательности представлены идентификационным номером последовательности (SEQ ID NO:). SEQ ID NO: по цифрам соответствуют идентификаторам последовательностей 400 1 (SEQ ID NO:1), 400 2 (SEQ ID NO:2) и т.д. Идентификаторы последовательностей суммированы в табл. 2. Список последовательностей представлен в конце описания. Описание иллюстративных вариантов осуществления Следует понимать, что дальнейшее описание предназначено только для иллюстрации определенных вариантов осуществления и не предназначено для ограничения представленного выше описания. Настоящее изобретение частично основано на идентификации полипептидов и их соответствующих нуклеиновых кислот, которые кодируют белки транспортера бора. В иллюстративном варианте осуществления изобретения полипептид был выделен из ячменя (Hordeum vulgaris), который кодирует транспортер бора и который связан с повышенной толерантностью к бору, по меньшей мере, у культивара ячменя Сахара 3771. Этот полипептид был обозначен HvBot1 и содержит аминокислотную последовательность, представленную SEQ ID NO:2. Была также определена последовательность нуклеиновой кислоты открытой рамки считывания, которая кодирует полипептид HvBot1. Нуклеотидная последовательность обозначена как HvBot1 и содержит нуклеотидную последовательность, представленную SEQ ID NO:1. Настоящее изобретение также частично основано на обнаружении того, что толерантный к бору культивар ячменя Сахара 3771 экспрессирует HvBot1 на более высоком уровне, чем чувствительные к бору культивары ячменя. Кроме того, было также установлено, что культивар ячменя Сахара 3771 имеет увеличенное количество копий последовательностей нуклеиновой кислоты HvBot1 в своем геноме, по сравнению с чувствительными к бору культиварами ячменя. Соответственно, в первом аспекте настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей нуклеотидную последовательность, выбранную из списка, состоящего из:(ii) нуклеотидной последовательности, которая кодирует функциональный гомолог полипептида,содержащего аминокислотную последовательность, представленную в SEQ ID NO:2;(iii) нуклеотидной последовательности, которая является комплементом или обратным комплементом нуклеотидной последовательности, указанной в подпункте (i) или (ii); и(iv) фрагмента нуклеотидной последовательности, указанной в любом из подпунктов (i), (ii) или (iii). Нуклеотидные последовательности первого аспекта изобретения также именуются в настоящем описании "нуклеиновыми кислотами Bot1" или "последовательностями нуклеиновых кислот Bot1". Как правило, нуклеиновые кислоты Bot1 настоящего изобретения кодируют полипептиды транспортера бора. Используемый в настоящем описании термин "транспортер бора" относится к любому полипептиду, который отдельно или в сочетании с другой молекулой участвует в выходящем токе, перемещении или захвате бора в клетку, ткань, орган, целый организм или их часть. В одном из вариантов осуществления термин "транспортер бора" относится к полипептиду, который участвует в выходящем токе бора из клетки и в некоторых вариантах осуществления растительной клетки. В некоторых вариантах осуществления полипептиды транспортера бора, предусмотренные настоящим изобретением, включают одну или более трансмембранных спиралей. В других вариантах осуществления изобретения полипептиды транспортера бора содержат по меньшей мере 2, по меньшей мере 3,по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 трансмембранных спиралей. В одном определенном варианте осуществления транспортер бора, предусмотренный настоящим изобретением, содержит 10, 11 или 12 трансмембранных спиралей. В настоящем изобретении термин "выделенный" относится к материалу, удаленному из первоначальной среды (например, естественной среды, если он является встречающимся в природе) и, таким образом, измененному "рукой человека", относительно своего природного состояния. Например, выделенная нуклеиновая кислота может быть частью вектора или композиции вещества, или может содержаться внутри клетки, и все же быть "выделенной", потому что вектор, композиция вещества или определенная клетка не является первоначальной средой нуклеиновой кислоты. Также следует понимать, что"выделенная" молекула нуклеиновой кислоты включает молекулу синтетической нуклеиновой кислоты,включая такие, которые получены химическим синтезом с использованием способов, известных в данной области, или амплификацией in vitro (например, полимеразной цепной реакцией, PCR и тому подобное). Выделенные молекулы нуклеиновых кислот настоящего изобретения могут быть составлены из любого полирибонуклеотида или полидеоксирибонуклеотида, который может быть немодифицированной РНК или ДНК или модифицированной РНК или ДНК. Например, выделенные молекулы нуклеиновых кислот могут быть составлены из одно- и двухнитевой ДНК, ДНК, которая представляет смесь однои двухнитевых областей, одно- и двухнитевой РНК, и РНК, которая представляет собой смесь одно- и двухнитевых областей, гибридные молекулы, содержащие ДНК и РНК, которые могут быть однонитевыми, более конкретно, двухнитевыми или представляющими собой смесь одно- и двухнитевых областей. Кроме того, выделенные молекулы нуклеиновых кислот могут быть составлены из трехнитевых областей, содержащих РНК или ДНК, или как РНК, так и ДНК. Выделенные молекулы нуклеиновых кислот могут также содержать одно или более модифицированных оснований или основных цепей ДНК или РНК, модифицированных для стабильности или по другим причинам. "Модифицированные" основания включают, например, тритилированные основания и необычные основания, такие как ионзин. В ДНК и РНК могут быть внесены разнообразные модификации; таким образом, "нуклеиновая кислота" охватывает химически, ферментативно или метаболически модифицированные формы. Как изложено выше, настоящее изобретение предусматривает нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO:2, или нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую функциональный гомолог полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO:2. В одном из вариантов осуществления "функциональный гомолог" полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO:2, включает любой полипептид, где полипептид способен транспортировать бор через клеточную мембрану. В другом варианте осуществления функциональный гомолог способен транспортировать бор через мембрану растительной клетки. В еще одном из вариантов осуществления функциональный гомолог способен осуществлять выходящий ток бора из клетки, включая растительную клетку. Несмотря на указанное выше, функциональный гомолог может содержать, например, полипептид,который имеет одну или более аминокислотных вставок, делеций или замещений относительно полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO:2; мутантную форму или аллельный вариант полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO:2; ортолог полипептида, содержащего аминокислотную последовательность,представленную SEQ ID NO:2; аналог полипептида, содержащего аминокислотную последовательность,представленную SEQ ID NO:2; и тому подобное. В одном из вариантов осуществления "функциональный гомолог" полипептида, содержащего аминокислотную последовательность, представленную SEQ ID NO:2, также имеет по меньшей мере 84% идентичность аминокислотной последовательности, по меньшей мере 88% идентичность аминокислотной последовательности, по меньшей мере 92% идентичность аминокислотной последовательности или по меньшей мере 95, 96, 97, 98, 99 или 100% идентичность аминокислотной последовательности SEQ ID должны сравниваться по окну сравнения по меньшей мере 50 аминокислотных остатков, по меньшей мере 100 аминокислотных остатков, по меньшей мере 200 аминокислотных остатков, по меньшей мере 300 аминокислотных остатков или по полной длине SEQ ID NO:2. Окно сравнения может содержать добавления или делеции (т.е. гэпы) примерно 20% или меньше, по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для выравнивания окна сравнения можно проводить компьютеризированным обеспечением алгоритмов, таких как, например, семейство программBLAST, описанных Altschul et al. (Nucl. Acids Res. 25: 3389-2402, 1997). Подробное обсуждение анализа последовательностей можно найти в Unit 19. 3 of Ausubel et al. ("Current Protocols in Molecular Biology"John WileySons Inc, 1994-1998, Chapter 15, 1998). В одном определенном варианте осуществления функциональный гомолог SEQ ID NO:2 может представлять собой полипептид Bot1 из Hordeum vulgare cv. Clipper, который содержит аминокислотную последовательность, представленную SEQ ID NO:26. В другом определенном варианте осуществления функциональный гомолог SEQ ID NO:2 содержит полипептид Bot1, содержащий:(i) гибридную аминокислоту в аминокислотном остатке номер 305 полипептида Bot1; и/или(ii) полярную аминокислоту в аминокислотном остатке номер 592 полипептида Bot1. В некоторых вариантах осуществления выделенная нуклеиновая кислота Bot1 содержит нуклеиновую кислоту, выбранную из списка, состоящего из:(ii) нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая по меньшей мере на 81% идентична нуклеотидной последовательности, представленной в SEQ ID NO:1;(iv) нуклеиновой кислоты, содержащей нуклеотидную последовательность, которая представляет собой комплемент или обратный комплемент любой из (i)-(iii); и(v) фрагмента любой из (i), (ii), (iii) или (iv). Как указано выше, нуклеиновая кислота, указанная в пункте (ii), содержит нуклеотидную последовательность, имеющую по меньшей мере 81% идентичность нуклеотидной последовательности, представленной SEQ ID NO:1. В других вариантах осуществления нуклеиновая кислота, указанная в пункте(ii), содержит нуклеотидную последовательность, имеющую по меньшей мере 85% идентичность нуклеотидной последовательности, по меньшей мере 89% идентичность нуклеотидной последовательности,по меньшей мере 92% идентичность нуклеотидной последовательности или по меньшей мере 95, 96, 97,98, 99 или 100% идентичность нуклеотидной последовательности, представленной SEQ ID NO:1. При сравнении с последовательностями нуклеиновых кислот с SEQ ID NO:1, для расчета идентичности в процентах, сравниваемые нуклеотидные последовательности должны сравниваться по окну сравнения по меньшей мере 100 нуклеотидных остатков, по меньшей мере 200 нуклеотидных остатков,по меньшей мере 500 нуклеотидных остатков, по меньшей мере 1000 нуклеотидных остатков или по полной длине SEQ ID NO:1. Окно сравнения может содержать добавления или делеции (т.е. гэпы) примерно 20% или меньше, по сравнению с эталонной последовательностью (которая не содержит добавления или делеции) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для выравнивания окна сравнения можно проводить компьютеризированным обеспечением алгоритмов, таких как, например, семейство программ BLAST, описанных Altschul et al.(Nucl. Acids Res. 25: 3389-2402, 1997). Подробное обсуждение анализа последовательностей можно найти в Unit 19.3 of Ausubel et al. ("Current Protocols in Molecular Biology" John WileySons Inc, 1994-1998,Chapter 15, 1998). Как указано выше, изобретение также предусматривает нуклеиновую кислоту, которая в жестких условиях гибридизуется в нуклеиновую кислоту, содержащую нуклеотидную последовательность, представленную SEQ ID NO:1. Используемый в настоящем описании термин "жесткие" условия гибридизации относится к таким условиям, при которых концентрация соли составляет менее чем примерно 1,5 М иона Na, обычно, концентрация иона Na (или других солей) составляет примерно от 0,01 до 1,0 М при рН от 7,0 до 8,3, и температура составляет по меньшей мере 30 С. Жесткие условия могут быть также достигнуты добавлением дестабилизирующих агентов, таких как формамид. Жесткие условия гибридизации могут являться условиями с низкой жесткостью требований их соблюдения, со средней жесткостью требований их соблюдения или условиями с высокой жесткостью требований их соблюдения. Иллюстративные условия с низкой жесткостью требований их соблюдения включают гибридизацию буферным раствором 30-35% формамида, 1 М NaCl, 1% SDS (додецилсульфата натрия) при 37 С и промыванием в от 1 до 2SSC (20SSC=3,0M NaCl/0,3M тринатрийцитрата) при температуре от 50 до 55 С. Иллюстративные условия со средней жесткостью требований их соблюдения включают гибридизацию в 40-45% формамиде, 1,0 М NaCl, 1% SDS при 37 С и промыванием в от 0,5 до 1SSC при температуре от 55 до 60 С. Иллюстративные условия с высокой жесткостью требований их соблюдения включают гибридизацию в 50% формамиде, 1 М NaCl, 1% SDS при 37 С и промыванием в 0,1SSC при температуре от 60 до 65 С. Необязательно промывные буферы могут содержать примерно от 0,1 до примерно 1% SDS. Длительность гибридизации в целом составляет менее чем примерно 24 ч, обычно примерно от 4 до примерно 12 ч. На специфичность гибридизации также воздействуют условия промывания после гибридизации,причем решающими факторами являются ионная сила и температура раствора конечного промывания. Для гибридов ДНК-ДНК, Tm можно аппроксимировать из уравнения Meinkoth и Wahl (Anal. Biochem. 138: 267-284, 1984), т.е. Tm=81,5 С+16,6 (log M)+0,41 (% GC)-0,61 (% форм)-500/л; где М представляет молярность одновалентных катионов, % GC представляет процентное содержание гуанозин- и цитозиннуклеотидов в ДНК, % форм представляет процентное содержание формамида в гибридизационном растворе, и L представляет длину гибрида в парах основании. Tm представляет температуру (при определенной ионной силе и рН), при которой 50% комплементарной последовательности-мишени гибридизуется в точно подобранный зонд. Tm снижается примерно на 1 С для каждого 1% ошибочного спаривания оснований; таким образом, Tm, условия гибридизации и/или промывания могут подбираться для гибридизации в последовательности различной степени комплементарности. Например, последовательности с идентичностью 90% могут гибридизоваться уменьшением Tm примерно на 10 С. Как правило, требующие жесткого соблюдения условия выбирают таким образом, чтобы температура была примерно на 5 С ниже, чем термическая точка плавления (Tm) для определенной последовательности и ее комплемента при определенной ионной силе и рН. Однако в требующих жесткого соблюдения условиях может использоваться гибридизация и/или промывание, например, при температуре на 1, 2, 3 или 4 С ниже, чем термическая точка плавления (Tm); в условиях средней жесткости требований исполнения может использоваться гибридизация и/или промывание, например, при температуре на 6, 7, 8, 9 или 10 С ниже, чем термическая точка плавления (Tm); в условиях низкой жесткости требований исполнения может использоваться гибридизация и/или промывание, например, при температуре на 11, 12, 13, 14, 15 или 20 С ниже, чем термическая точка плавления (Tm). При использовании уравнения гибридизационные и промывные композиции и желательную Tm средним специалистам в данной области будет понятно, что описаны присущие изменения строгости соблюдения условий составления композиций гибридизационных и/или промывных растворов. При желании, степень ошибки побора приводит к Tm менее чем 45 С (водный раствор) или 32 С (раствор формамида), концентрация SSC может быть увеличена, чтобы можно было использовать более высокую температуру. Обширное руководство по гибридизации нуклеиновых кислот можно найти у Tijssen (Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization withNucleic Acid Probes, Pt I, Chapter 2, Elsevier, New York, 1993), Ausubel et al., eds. (Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, New York, 1995) и Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, Plainview, NY, 1989). Нуклеиновые кислоты Bot1 настоящего изобретения могут быть получены из любого источника. Например, нуклеиновые кислоты Bot1 могут быть получены из организма, такого как растение. Подходящие растения включают, например, односемядольные покрытосемянные растения (односемядольные),двусемядольные покрытосемянные растения (двусемядольные), голосемянные растения и тому подобное. В одном из вариантов осуществления нуклеиновая кислота Bot1 получена из растения зерновой культуры. Используемый в настоящем описании термин "растение зерновой культуры" включает членов семейства трав Роасеае, которые продуцируют съедобное зерно для пищи человека и животных. Примеры растений зерновой культуры Роасеае, которые ни в коей мере не ограничивают настоящее изобретение, включают ячмень пшеницу, рис, маис, просо, сорго, рожь, гибрид пшеницы и риса, овес, тэфф, дикий рис, спельта и тому подобное. Однако следует понимать, что термин "растение зерновой культуры" включает ряд видов, не относящихся к Роасеае, которые тоже продуцируют съедобные зерна и известны как "псевдозлаковые", такие как амарант, гречиха и лебеда квиноа. В одном определенном варианте осуществления нуклеиновая кислота Bot1 получена из растения ячменя. В другом варианте осуществления нуклеиновая кислота Bot1 включает нуклеиновую кислотуBot1, как описано в настоящем описании. В еще одном из вариантов осуществления нуклеиновая кислота Bot1 может быть также получена из двусемядольных растений. Иллюстративные двусемядольные растения включают, например, видыArabidopsis, виды Nicotiana, виды Medicago, соевые бобы, канолу, масличное семя рапса, сахарную свеклу, горчицу, подсолнечник, картофель, сафлор, тапиоку, ямсы, батат, другие представители вида Brassicaceae, такие как, среди прочих, Thellungiella halophila. В дополнительных вариантах осуществления нуклеиновая кислота Bot1 настоящего изобретения может быть получена из толерантного к бору вида или культивара растения. Альтернативно, нуклеиновая кислота Bot1 может представлять собой синтетическую нуклеиновую кислоту. Характерные примеры дополнительных нуклеиновых кислот Bot1, предусмотренных настоящим изобретением, включают ортологи нуклеиновой кислоты Bot1 SEQ ID NO:1, такие как нуклеиновые кислоты, содержащие нуклеотидную последовательность, представленную в SEQ ID NO:25. SEQ ID NO:25 получена из Hordeum vulgare культивара Clipper. Однако как будет очевидно для специалистов в данной области, другие ортологи могут быть получены из других культиваров Hordeum vulgare, других видов внутри рода Hordeum, других растений в семействе Роасеае или отряда Poales, других односемядольных растений, других двусемядольных растений, других членов растительного мира или других не растительных эукариотических или прокариотических организмов. Нуклеиновые кислоты Bot1, предусмотренные настоящим изобретением, могут также содержать одну или более нетранслированных областей, таких как нетранслированные области 3' и 5' и/или интроны. Например, нуклеиновые кислоты Bot1, предусмотренные настоящим изобретением, могут также содержать, например, последовательности мРНК или геномные нуклеотидные последовательности. Например, иллюстративные нуклеотидные последовательности, которые содержат нуклеиновую кислотуBot1, включают геномную нуклеотидную последовательность, представленную в SEQ ID NO:3, или последовательность мРНК, представленную в SEQ ID NO:4. Как указано выше, настоящее изобретение также предусматривает фрагменты выделенных нуклеиновых кислот Bot1 первого аспекта изобретения."Фрагменты" нуклеотидной последовательности могут иметь длину по меньшей мере 10 нуклеотидов (nt), по меньшей мере 20 nt, по меньшей мере 50 nt или по меньшей мере 100, 150, 200, 250, 300, 350,400, 450, 500, 550 или 600 nt. Эти фрагменты могут иметь многочисленные виды применения, которые будут очевидны для специалиста в данной области, и включают, но без ограничения, диагностические зонды и праймеры. Конечно, могут также использоваться более крупные фрагменты, такие как фрагменты, соответствующие большинству, если не всем, из нуклеотидных последовательностей SEQ ID NO:1. Под фрагментами длиной по меньшей мере 10 nt, например, подразумевается фрагмент, который включает 10 или более смежных оснований, например, из нуклеотидной последовательности SEQ ID NO:1. Нуклеиновая кислота по первому аспекту изобретения может также содержать множество последовательностей нуклеиновой кислоты Bot1. Например, в некоторых вариантах осуществления изобретения нуклеиновая кислота по первому аспекту изобретения может также включать множество копий нуклеиновой кислоты, кодирующей транспортер бора. Соответственно, в некоторых вариантах осуществления нуклеиновая кислота по первому аспекту изобретения может включать по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 копий последовательности нуклеиновой кислоты Bot1. В дополнительных вариантах осуществления нуклеиновая кислота, кодирующая множественные копии последовательности нуклеиновой кислоты Bot1, может включать выделенную геномную нуклеотидную последовательность, определяющую кластер нуклеиновых кислот Bot1. Такие нуклеиновые кислоты могут быть получены, например, из аллелей из толерантных бору растений, которые включают множество копий нуклеиновой кислоты Bot1. В одном определенном варианте осуществления нуклеиновая кислота по первому аспекту изобретения может включать выделенную геномную нуклеотидную последовательность, определяющую кластер нуклеиновых кислот Bot1 из Hordeum vulgaris cv. Sahara 3771. Во втором аспекте настоящее изобретение относится к конструкту нуклеиновой кислоты или вектору, содержащему нуклеиновую кислоту первого аспекта изобретения. Вектор или конструкт настоящего изобретения могут, кроме того, содержать один или более из: источника репликации для одного или более хозяев; выбираемого маркерного гена, который активен у одного или более хозяев, и/или одной или более транскрипционных контрольных последовательностей. Используемый в настоящем описании термин выбираемый маркерный ген включает любой ген,который придает фенотип клетке, в которой он экспрессирован, для облегчения идентификации и/или отбора клеток, которые трансфецированы или трансформированы генетическим конструктом настоящего изобретения."Выбираемые маркерные гены" включают любые нуклеотидные последовательности, которые при экспрессии клеткой придают клетке фенотип, который облегчает идентификацию и/или отбор этих трансформированных клеток. Диапазон нуклеотидных последовательностей, кодирующих подходящие выбираемые маркеры, известен в данной области. Иллюстративные нуклеотидные последовательности,которые кодируют выбираемые маркеры, включают гены устойчивости к антибиотикам, такие как гены устойчивости к ампициллину, гены устойчивости к тетрациклину, гены устойчивости к канамицину, генAURI-C, который придает устойчивость к антибиотику ауреобазидину А, гены фосфотрансферазы неомицина (например, nptI и nptII) и гены фосфотрансферазы гигромицина (например, hpt); гены устойчивости к гербицидам, включая гены устойчивости к глуфосинату, фосфинотрицину или биалафосу, такие как гены, кодирующие ацетилтрансферазу фосфинотрицина (например, bar), гены устойчивости к глифосату, включая гены, кодирующие 3-эноилпирувилшикимат-5-фосфатсинтазу (например, aroA), гены устойчивости к бромикснилу, включая гены, кодирующие бромикснил-нитрилазу, гены утойчивости к сульфонамидам, включая гены, кодирующие дигидроптерат-синтазу (например, sul), и гены устойчивости к сульфонилмочевине, включая гены, кодирующие ацетолактат-синтазу; кодирующие ферменты ре-8 018689 портерные гены, такие как гены, кодирующие GUS и хлорамфениколацетилтрансферазу (CAT); флюоресцентные репортерные гены, такие как гены, кодирующие флюоресцентный белок; и основанные на люминесценции репортерные гены, такие как, среди прочих, ген люциферазы. Кроме того, следует отметить, что выбираемый маркерный ген может представлять определенную рамку считывания в конструкте или может быть экспрессирован как гибридный белок с другим полипептидом (например, полипептидом Bot1). Как указано выше, конструкт нуклеиновой кислоты или вектор может также содержать один или более транскрипционных контрольных последовательностей. Термин "транскрипционная контрольная последовательность" следует понимать как включающий любую последовательность нуклеиновой кислоты, которая осуществляет транскрипцию функционально связанной нуклеиновой кислоты. Транскрипционная контрольная последовательность может включать, например, лидер, последовательность полиаденилирования, промотор, энхансер или активирующую выше по ходу транскрипции последовательность и терминатор транскрипции. Обычно, транскрипционная контрольная последовательность, по меньшей мере, включает промотор. Используемый в настоящем описании термин "промотор" описывает любую нуклеиновую кислоту, которая придает, активирует или усиливает экспрессию молекулы нуклеиновой кислоты в клетке. В одном из вариантов осуществления по меньшей мере одна транскрипционная контрольная последовательность функционально соединена с последовательностью нуклеиновой кислоты первого аспекта изобретения. В целях настоящего описания, транскрипционная контрольная последовательность рассматривается как "функционально соединенная" с данным геном или другой нуклеотидной последовательностью, когда транскрипционная контрольная последовательность способна стимулировать, ингибировать или иным образом модулировать транскрипцию гена или другой нуклеотидной последовательности. Промотор может регулировать экспрессию функционально соединенной нуклеотидной последовательности конститутивно или дифференциально в отношении клетки, органа или стадии развития, на которой происходит экспрессия, в ответ на внешние стимулы, такие как, наряду с другими, физиологические стрессы, патогены или ионы металлов, или в ответ на один или более транскрипционных активаторов. Таким образом, промотор, используемый в соответствии со способами настоящего изобретения, может включать, например, конститутивный промотор, индуцируемый промотор, тканеспецифический промотор или активируемый промотор. Настоящее изобретение предусматривает применение любого промотора, который активен в представляющей интерес клетке. Таким образом, специалист в данной области может легко установить широкий ряд промоторов, которые активны в любой из бактерий, грибов, клеток животных или растительных клеток. Однако в некоторых вариантах осуществления используются клетки растений. Поэтому в таких вариантах осуществления могут использоваться активные в растениях конститутивные, индуцируемые, тканеспецифические или активируемые промоторы. В определенном варианте осуществления настоящее изобретение предусматривает применение нативного промотора Bot1 для запуска экспрессии нуклеиновой кислоты Bot1. Растительные конститутивные промоторы обычно направляют экспрессию почти во всех тканях растения и в значительной степени независимы от факторов, связанных с окружающей средой и развитием. Примеры конститутивных промоторов, которые можно использовать в соответствии с настоящим изобретением, включают промоторы, полученные из вирусов растений, таких как вирус мозаики цветной капусты 35S и 19S (CaMV 35S и CaMV 19S); промоторы, полученные из бактериальных патогенов растений, таких как опиновые промоторы, полученные из видов Agrobacterium spp, например, полученный из Agrobacterium промотор нопалинсинтазы (nos); и полученные из растений промоторы, такие как промотор гена малой субъединицы рибулозобифосфаткарбоксилазы (rbcS), промотор растительного убиквитина (Pubi) и промотор актина риса (Pact)."Индуцируемые" промоторы включают, но без ограничения, химически индуцируемые промоторы и физически индуцируемые промоторы. Химически индуцируемые промоторы включают промоторы,которые обладают активностью, которая регулируется химическими соединениями, такими как спирты,антибиотики, стероиды, ионы металлов или другие соединения. Примеры химически индуцируемых промоторов включают: промоторы, регулируемые спиртами (например, см. Европейский патент 637339); промоторы, регулируемые тетрациклином (см., например, патент США 5851796 и патент США 5464758); промоторы, реагирующие на стероиды, такие как промоторы глюкокортикоидных рецепторов (например,см. патент США 5512483), промоторы эстрогеновых рецепторов (например, см. заявку на Европейский патент 1232273), промоторы эедисоновых рецепторов (например, см. патент США 6379945) и тому подобное; реагирующие на металлы промоторы, такие как промоторы металлотионеина (см., например,патент США 4940661, патент США 4579821 и патент США 4601978); и промоторы, связанные с патогенезом, такие как промоторы хитиназы или лизоцима (например, см. патент США 5654414) или промоторы белка PR (например, см. патент США 5689044, патент США 5789214, патент Австралии 708850, патент США 6429362). В другом варианте осуществления индуцируемый промотор может представлять собой промотор,-9 018689 реагирующий на бор. Используемый в настоящем описании термин "реагирующий на бор" следует понимать как означающий, что уровень и/или скорость транскрипции, на которую воздействует последовательность, регулирующая транскрипцию, может модулироваться в ответ на концентрацию бора и/или концентрацию содержащего бор соединения. В одном из вариантов осуществления реагирующая на бор последовательность, регулирующая транскрипцию, является индуцируемой бором, то есть уровень и/или скорость транскрипции, на которую воздействует последовательность, регулирующая транскрипцию,увеличивается в ответ на увеличивающуюся концентрацию бора. Индуцируемый промотор может также представлять собой физически регулируемый промотор, который регулируется нехимическими факторами окружающей среды, такими как температура (как горячая, так и холодная), свет и тому подобное. Примеры физически регулируемых промоторов включают промоторы теплового шока (например, см. патент США 5447858, патент Австралии 732872, заявка на патент Канады 1324097); промоторы, индуцируемые холодом (например, см. патент США 6479260, патент США 6184443 и патент США 5847102); промоторы, индуцируемые светом (например, см. патент США 5750385 и патент Канады 1321563); промоторы, подавляемые светом (например, см. патент Новой Зеландии 508103 и патент США 5639952)."Тканеспецифические промоторы" включают промоторы, которые предпочтительно или специфически экспрессируются в одной или более специфических клетках, тканях или органах в организме,и/или одну или более стадий развития организма. Следует понимать, что тканеспецифические промоторы могут быть или конститутивными, или индуцируемыми. Примеры растительных тканеспецифических промоторов включают корнеспецифические промоторы, такие как промоторы, описанные в заявке на патент США 2001047525; плодоспецифические промоторы, включая промоторы, специфичные для завязи и ткани цветоложа, такие как промоторы, описанные в Европейском патенте 316441, патенте США 5753475 и заявке на Европейский патент 973922; и семяспецифические промоторы, такие как промоторы, описанные в патенте Австралии 612326 и заявке на Европейский патент 0781849 и патенте Австралии 746032. Промотор может также представлять промотор, который может активироваться одним или несколькими транскрипционными активаторами, именуемыми в настоящем описании "активируемым промотором". Например, активируемый промотор может содержать минимальный промотор, функционально соединенный с расположенной выше по ходу транскрипции активирующей последовательностью (UAS),который включает, наряду с другими, связывающий ДНК сайт для одной или более транскрипционных активаторов. Следует понимать, что используемый в настоящем описании термин "минимальный промотор" включает любой промотор, который содержит, по меньшей мере, сайт, связывающий РНК полимеразу, и,необязательно, бокс ТАТА и сайт инициации транскрипции и/или один или более боксов СААТ. В одном из вариантов осуществления, где клетка является растительной клеткой, минимальный промотор может быть получен из промотора вируса мозаики цветной капусты 35S (CaMV 35S). Минимальный промотор,полученный из CaMV 35S, может содержать, например, последовательность, которая по существу соответствует положениям (-90)-(+1) (сайт инициации транскрипции) промотора CaMV 35S (также именуемого минимальным промотором -90 CaMV), (-60)-(+1) промотора CaMV 35S (также именуемого минимальным промотором -60 CaMV 35S) или (-45)-(+1) промотора CaMV 35S (также именуемого минимальным промотором -45 CaMV 35S). Как указано выше, активируемый промотор может содержать минимальный промотор, слитый с активирующей последовательностью выше по ходу транскрипции (UAS). UAS может являться любой последовательностью, которая может связывать транскрипционный активатор, для активации минимального промотора. Иллюстративные транскрипционные активаторы включают, например, активаторы транскрипции, полученные из дрожжей, такие как Ga14, Pdr1, Gcn4 и Ace1; активатор транскрипции, полученный из вируса, VP16; Hapl (Hach et al., J Biol Chem 278: 248-254, 2000); Gafl (Hoe et al., Gene 215(2): 319-328, 1998); E2F (Albani et al., J Biol Chem 275: 19258-19267, 2000); HAND2 (Dai and Cserjesi, J Biol(Wu et al., Nat Genet 26: 484-489, 2000). В одном из вариантов осуществления UAS содержит нуклеотидную последовательность, которая способна связываться, по меньшей мере, с доменом, связывающим ДНК транскрипционного активатораGAL4. Последовательности UAS, которые могут связывать транскрипционные активаторы, содержащие,по меньшей мере, домен, связывающий ДНК GAL4, именуются в настоящем описании UASG. В другом варианте осуществления UASG содержит последовательность 5'-CGGAGTACTGTCCTCCGAG-3' или ее функциональный гомолог. Следует понимать, что указанный в настоящем описании "функциональный гомолог" последова- 10018689 тельности UASG относится к любой нуклеотидной последовательности, которая может связывать, по меньшей мере, домен, связывающий ДНК GAL4, и которая может содержать нуклеотидную последовательность, имеющую по меньшей мере 50% идентичность, по меньшей мере 65% идентичность, по меньшей мере 80% идентичность или по меньшей мере 95% идентичность с нуклеотидной последовательностью UASG. Последовательность UAS в активируемом промоторе может содержать множество тандемных повторов последовательности - мишени домена, связывающего ДНК. Например, UASG в своем нативном состоянии содержит 4 тандемных повторов последовательности-мишени домена, связывающего ДНК. Таким образом, следует понимать, что термин "множество", используемый в настоящем описании в отношении количества тандемных повторов последовательности-мишени домена, связывающего ДНК,включает, например, по меньшей мере 2 тандемных повтора, по меньшей мере 3 тандемных повтора или по меньшей мере 4 тандемных повтора. Как указано выше, контрольные последовательности могут также включать терминатор. Термин"терминатор относится к последовательности ДНК на конце транскрипционной единицы, которая сигнализирует о прекращении транскрипции. Терминаторы представляют 3'-нетранслированные последовательности ДНК, в целом содержащие сигнал полиаденилирования, которые содействуют добавлению полиаденилатных последовательностей к 3'-концу первичного транскрипта. Как и с промоторными последовательностями терминатором может быть любая терминаторная последовательность, которая функционирует в клетках, тканях или органах, в которых предполагается ее применение. Примеры подходящих терминаторных последовательностей, которые могут использоваться в растительных клетках, включают: терминатор нопалин-синтазы (nos), терминатор CaMV 35S, терминатор октопин-синтазы (ocs),терминаторы гена ингибитора картофельной протеиназы (pin), такие как терминаторы pinII и pinIII, и тому подобное. Настоящее изобретение охватывает все генетические конструкты, по существу как раскрыто в настоящем описании. Эти конструкты могут, кроме того, включать нуклеотидные последовательности,предназначенные для поддержания и/или репликации генетического конструкта в прокариотах или эукариотах и/или интеграции генетического конструкта или его части в геномэукароитическую или прокариотическую клетку. В одном из вариантов осуществления вектор или конструкт приспособлен по меньшей мере к частичному переносу в растительную клетку через трансформацию, опосредованную Agrobacterium. Соответственно, в другом варианте осуществления конструкт может содержать левую и/или правую пограничную последовательности Т-ДНК. Специалист в данной области сможет легко определить подходящие пограничные последовательности Т-ДНК. Однако следует понимать, что термин "пограничные последовательности Т-ДНК" включает, например, любые по существу гомологичные и по существу прямо повторяемые нуклеотидные последовательности, которые ограничивают молекулу нуклеиновой кислоты, перенесенную из клетки видаAgrobacterium в растительную клетку, восприимчивую к опосредованной Agrobacterium трансформации. В качестве примера, делается ссылка на статью Peralta and Ream (Proc. Natl. Acad. Sci. USA, 82(15): 51125116, 1985) и обзор Gelvin (Microbiology and Molecular Biology Reviews, 67(1): 16-37, 2003). В одном из вариантов осуществления вектор или конструкт приспособлен к переносу в растение через опосредованную Agrobacterium трансформацию, однако настоящее изобретение также предусматривает любые подходящие модификации в генетическом конструкте, которые облегчают бактериально опосредованную вставку в растительную клетку через бактерии, отличные от вида Agrobacterium, например, как описано в публикации Broothaerts et al. (nature 433: 629-633, 2005). Специалистам в данной области будет понятно, как получить конструкты, раскрытые в настоящем описании, и требования к получению их экспрессии, если она желательна, в определенной клетке или клеточном типе в желательных условиях. В частности, специалистам в данной области известно, что генетические манипуляции, требуемые для выполнения настоящего изобретения, могут потребовать размножения раскрытого в настоящем описании генетического конструкта или его производного в прокариотической клетке, такой как клетка Е. Coli или растительная клетка, или клетка животного. Иллюстративные способы клонирования молекул нуклеиновых кислот описаны в приведенной выше ссылке Sambrook et al. (2000). В третьем аспекте настоящее изобретение относится к генетически модифицированной клетке, содержащей введенную нуклеиновую кислоту, выбранную из списка, состоящего из:(i) выделенной нуклеиновой кислоты первого аспекта изобретения и(ii) конструкта нуклеиновой кислоты или вектора второго аспекта изобретения. Указанный в настоящем описании термин "генетически модифицированная клетка" означает клетку, которая генетически модифицирована относительно дикого типа клетки. Таким образом, генетически модифицированная клетка может представлять собой клетку, которая сама была генетически модифицирована, и/или потомство такой клетки. Нуклеиновая кислота может быть введена с использованием любого способа, известного в данной области, который подходит для используемого типа клеток, например, способов, описанных у Sambrookand Russell (Molecular Cloning - A Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press, 2000). В вариантах осуществления изобретения, где клетка представляет собой растительную клетку, подходящие способы для введения молекулы нуклеиновой кислоты могут включать, например, трансформацию, опосредованную Agrobacterium, другую бактериально опосредованную трансформацию (см. приведенную выше ссылку Broothaers et al., 2005), способы трансформации на основе микропроекционной бомбардировки и способы на основе прямого захвата ДНК. Roa-Rodriguez et al. (Agrobacterium-meditedtransformation of plants, 3rd Ed. CAMBIA Intellectual Property Resource, Canberra, Australia, 2003) проводят обзор широкого ряда подходящих способов трансформации растений, опосредованной Agrobacterium,для широкого диапазона видов растений. Микропроекционную бомбардировку можно также использовать для трансформации ткани растения, и обзор способов трансформации растений, в частности злаковых растений, проведен Casas et al. (Plant Breeding Rev. 13: 235-264, 1995). Протоколы проведения трансформации путем прямого захвата ДНК, такой как трансформация протопласта и электропорообразование, подробно описаны Galbraith et al. (eds.), Methods in Cell Biology, vol. 50, Academic Press, SanDiego, 1995). В дополнение к способам, указанным выше, можно также использовать ряд других протоколов проведения трансформации. Они включают инфильтрацию, электропорообразование клеток и тканей, электропорообразование зародышей, микроинъекцию, путь обмена пыльцевой трубки, трансформацию, опосредованную карбидом кремния и липосомами. Обзор способов, подобных выше, представленRakoczy-Trojanowska (Cell. Mol. Biol. Lett. 7: 849-858, 2002). Ряд других способов трансформации растений могут также быть очевидны для специалистов в данной области. Введенная нуклеиновая кислота может быть однонитевой или двухнитевой. Нуклеиновая кислота может быть транскрибирована в мРНК и транслирована в белок; может кодировать нетранслированную РНК, такую как конструкт иРНК, косупрессионный конструкт, антисмысловая РНК, РНК-переносчик,микро РНК, малая интерферентная РНК, нетранслированная РНК и тому подобное; или может действовать непосредственно в клетке. Введенная нуклеиновая кислота может представлять немодифицированную ДНК или РНК или модифицированную ДНК или РНК, которая может включать модификации в нуклеотидные основания, сахарные или фосфатные основные цепи, но которые сохраняют функциональную эквивалентность нуклеиновой кислоте. Введенная нуклеиновая кислота может необязательно быть реплицирована в клетке; интегрирована в хромосому или любые экстрахромосомные элементы клетки; и/или транскрибирована клеткой. Также, введенная нуклеиновая кислота может быть или гомологичной,или гетерологичной относительно клетки-хозяина. То есть, введенная нуклеиновая кислота может быть получена из клетки того же вида, что и генетически модифицированная клетка (т.е. гомологичной), или введенная нуклеиновая кислота может быть получена из другого вида (т.е. гетерологичной). Трансген может также представлять собой синтетический трансген. Указанная выше введенная нуклеиновая кислота может поддерживаться в клетке в виде молекулы ДНК, в виде части эписомы (например, плазмиды, космиды, искусственной хромосомы или тому подобное), или она может быть интегрирована в геномную ДНК клетки. Используемый в настоящем описании термин "геномная ДНК" следует понимать в самом широком контексте с включением любой и всей ДНК, которая составляет генетический комплемент клетки. Следует понимать, что сама геномная ДНК клетки включает хромосомы, митохондриальную ДНК, ДНК пластиды, ДНК хлоропласта, ДНК эндогенной плазмиды и тому подобное. По существу, термин "генетически интегрированная" предусматривает хромосомную интеграцию, интеграцию митохондриальной ДНК, интеграцию ДНК пластиды, интеграцию ДНК хлоропласта, интеграцию ДНК эндогенной плазмиды и тому подобное. Выделенная молекула нуклеиновой кислоты может быть функционально соединена с промотором,так что клетка может экспрессировать последовательность нуклеиновой кислоты Bot1. Следует понимать, что используемый в настоящем описании термин "клетка" включает любой тип клеток, включая бактерии, археоциты и эукариоцитные клетки, включая, например, клетки животных,растений и грибов. Клетка может включать, например, клетку растения, клетку односемядольного растения, клетку растения злаковой культуры или клетку ячменя. Кроме того, в четвертом аспекте настоящее изобретение относится к многоклеточной структуре,содержащей одну или более клеток третьего аспекта изобретения. Указанная в настоящем описании "многоклеточная структура" включает любую агрегацию одной или более клеток. Сама многоклеточная структура, в частности, охватывает ткани, органы, целые организмы и их части. Кроме того, следует также понимать, что многоклеточная структура охватывает многоклеточные агрегации культивированных клеток, такие как колонии, каллюсы растений, суспензионные культуры и тому подобное. Как указано выше, в одном из вариантов осуществления клетка представляет растительную клетку и, по существу, настоящее изобретение включает цельное растение, ткань растения, орган растения,часть растения, репродуктивный материал растения или культивируемую ткань растения (например, каллюсную или суспензионную культуру), содержащую одну или более растительных клеток в соответствии с третьим аспектом изобретения. В других вариантах осуществления клетка представляет собой односемядольную клетку, клетку злаковой культуры или клетку ячменя, и, таким образом, настоящее изобрете- 12018689 ние также, в частности, включает цельное растение, ткань растения, орган растения, часть растения, репродуктивный материал растения или культивируемую ткань растения (например, каллюсную или суспензионную культуру), содержащую одну или более клеток односемядольного, растения злаковой культуры или ячменя. В пятом аспекте настоящее изобретение относится к выделенному полипептиду, выбранному из списка, состоящего из:(ii) полипептида, который является функциональным гомологом (i); и(iii) фрагмента (i) или (ii). Полипептиды настоящего изобретения также называются в настоящем описании полипептидамиBot1. Как правило, полипептиды Bot1 настоящего изобретения содержат полипептиды транспортера бора, как определено выше в настоящем описании. Следует понимать, что используемый в настоящем описании термин "полипептид" включает полимер аминокислот любой длины. Таким образом, следует понимать, что термин "полипептид" охватывает,например, пептиды, полипептиды и белки. Полипептиды Bot1 настоящего изобретения могут быть получены из любого источника. Например,полипептиды Bot1 могут быть получены из организма, такого как растение. Подходящие растения включают, например, односемядольные покрытосемянные растения (однодольные), двусемядольные покрытосемянные растения (двухдольные), голосемянные растения и тому подобное. В одном из вариантов осуществления полипептид Bot1 получен из односемядольного растения. В другом варианте осуществления полипептид Bot1 получен из растения злаковой культуры. В одном определенном варианте осуществления полипептид Bot1 получен из растения ячменя. В другом варианте осуществления полипептид Bot1 включает полипептид HvBot1, как раскрыто в настоящем описании. В дополнительном варианте осуществления полипептид Bot1 может быть также получен из двусемядольных растений. Иллюстративные двусемядольные растения включают, например, виды Arabidopsis, виды Nicotiana, виды Medicago, соевые бобы, канолу, масличное семя рапса, сахарную свеклу, горчицу, подсолнечник, картофель, сафлор, тапиоку, ямсы, батат, другие представители вида Brassicaceae, такие как, среди прочих, Thellungiella halophila. В еще дополнительных вариантах осуществления полипептид Bot1 настоящего изобретения может быть получен из толерантного к бору вида или культивара растения. Полипептид Bot1 может быть также получен в рекомбинантной экспрессионной системе. Например, полипептид Bot1 может быть рекомбинантно получен введением в клетку нуклеиновой кислотыBot1 под контролем промотора, где клетка по существу экспрессирует нуклеиновую кислоту Bot1 и продуцирует полипептид Bot1. Огромное количество рекомбинантных экспрессионных систем, которые могут использоваться для экспрессии нуклеиновой кислоты Bot1, известно в данной области. Иллюстративные рекомбинантные экспрессионные системы включают: бактериальные экспрессионные системы, такие как экспрессионные системы Е. Coli (обзор в Baneyx, Curr. Opin. Biotechnol. 10: 411-421, 1999; см. также Gene expression inStatus and Future Trends, выше, глава 4) и Streptomyces spp. экспрессионные системы (см., например, Practical Streptomyces Genetics, Kieser et al., (Eds.), Chapter 17, John Innes Foundation, Norwich, UK, 2000); экспрессионные системы грибов, включая экспрессионные системы дрожжей, таких как экспрессионные системы видов Saccharomyces, Schizosaccharomyces pombe, Hansenula polymorpha и видов Pichia, и экспрессионные системы волокнистых грибов (см., например, Protein Expression Technologies: Current StatusCregg et al., Mol. Biotechnol. 16(1): 23-52, 2000; Cereghino and Cregg, FEMS Microbiology Reviews 24: 4566, 2000; Cregg et al., Bio/Technology 11: 905-910, 1993); экспрессионные системы клеток млекопитающих, включая экспрессионные системы на основе клеток яичников китайских хомячков (СНО) (см., например, Protein Expression Technologies: Current Status and Future Trends, см. ссылку выше, глава 9); культуры клеток насекомых, включая экспрессионные системы бакуловируса (например, см. Protein Expression Technologies: Current Status and Future Trends, выше, глава 8; Kost and Condreay, Curr. Opin. Biotechnol. 10: 428-433, 1999; Baculovirus Expression Vectors: A Laboratory Manual WH FreemanCo., New York,1992; и The Baculovirus Expression System: A Laboratory Manual, ChapmanHall, London, 1992); экспрессионные системы растительных клеток, такие как экспрессионные системы клеток табака, соевых бобов,риса и томатов (например, см. обзор Hellwig et al., Nat Biotechnol 22: 1415-1422, 2004); и тому подобное. Альтернативно, полипептид Bot1 может представлять собой синтетическую нуклеиновую кислоту. Полипептиды Bot1 настоящего изобретения могут быть составлены из аминокислот, соединенных друг с другом пептидными связями или модифицированными пептидными связями, т.е. пептидными изостерами, и могут содержать аминокислоты, отличные от аминокислот, кодируемых 20 генами. Выде- 13018689 ленные полипептиды настоящего изобретения могут быть модифицированы или природными способами,такими как пост-трансляционная обработка, или методами химической модификации, которые известны в данной области. Модификации могут происходить в любом участке в полипептиде, включая основную цепь пептида, аминокислотные боковые цепи и/или концы. Следует понимать, что одинаковый тип модификации может присутствовать в одинаковых или варьирующихся степенях в нескольких участках в данном выделенном полипептиде. Также выделенный полипептид настоящего изобретения может содержать более одного типа модификации. Полипептиды настоящего изобретения могут быть разветвленными, например, в результате убихитинирования, и/или они могут быть циклическими с разветвлением или без него. Циклические, разветвленные и разветвленные циклические полипептиды могут быть получены в результате посттрансляционных природных процессов или могут быть получены синтетическими способами. Иллюстративные модификации полипептидов включают ацетилирование, ацилирование АДФрибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение гемового фрагмента, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфатидилинозита, поперечную сшивку, циклизацию, образование дисульфидной связи, деметилирование, образование ковалентных поперечных сшивок, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование GPI (связанного с мембраной гликозилфосфатидилинозитола), гидроксилирование, йодинирование, метилирование, миристоилирование, окисление,ПЭГилирование, протеолитическую обработку, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфирование, опосредованное транспортной РНК добавление аминокислот к белкам,такое как аргинилирование и убихитинирование (см., например, Proteins-Structure And Molecular Properties 2nd Ed., Creighton (ed.), W.H. Freeman and Company, New York, 1993); Posttranslational Covalent Modification Of Proteins, Johnson (Ed.), Academic Press, New York, 1983; Seifter et al., Meth Enzymol 182: 626-646,1990); Rattan et ah, Ann NYAcad Sci 663: 48-62, 1992)."Функциональные гомологи", предусмотренные пятым аспектом изобретения, могут содержать функциональный гомолог SEQ ID NO:2, как раскрыто выше в настоящем описании. Как изложено выше, настоящее изобретение также относится к фрагментам полипептидов. Фрагменты полипептидов могут быть "свободно стоящими" или содержащимися внутри более крупного полипептида, часть или область которого образует фрагмент. Фрагменты полипептидов могут иметь длину по меньшей мере 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 15, 20,25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 200, 250 или 300 аминокислот. В одном из вариантов осуществления фрагмент содержит аминокислотную последовательность, которая является фрагментом последовательности, представленной в SEQ ID NO:2. В еще одном из вариантов осуществления фрагмент содержит функциональную активность транспортера бора. Однако даже если фрагмент не сохраняет одну или более биологических функций полипептида транспортера бора, могут еще сохраняться другие виды функциональной активности. Например,фрагменты могут сохранять способность вызывать продукцию и/или связывание с антителами, которые распознают полную или зрелую форму полипептида Bot1. Пептид, полипептид или фрагмент белка, который обладает способностью вызывать продукцию и/или связывание с антителами, которые распознают полные или зрелые формы выделенного полипептида Bot1, именуется в настоящем описании "эпитопомBot1". Эпитоп Bot1 может содержать всего лишь три или четыре аминокислотных остатка, но может также включать, например, по меньшей мере 5 аминокислотных остатков, по меньшей мере 10 аминокислотных остатков, по меньшей мере 20 аминокислотных остатков, по меньшей мере 50 аминокислотных остатков или по меньшей мере 100 аминокислотных остатков. Сохраняет ли определенный фрагмент полипептида Bot1 такие виды иммунологической активности, можно легко определить способами, известными в данной области. Таким образом, в некоторых вариантах осуществления фрагмент полипептида Bot1 может представлять собой, например, полипептид, содержащий один или более эпитопов Bot1. Полипептид, содержащий один или более эпитопов Bot1, может быть получен любыми обычными средствами для получения полипептидов, включая, например, синтетические и рекомбинантные способы, известные в данной области. В одном из вариантов осуществления полипептид, содержащий эпитопBot1, может быть синтезирован с использованием известных способов химического синтеза. Например,Houghten описал способ синтеза больших количеств пептидов (Houghten, Proc. Natl. Acad. Sci. USA 82: 5131-5135, 1985). Выделенные полипептиды и их фрагменты настоящего изобретения могут также использоваться,например, при генерировании антител, которые связываются с полипептидами Bot1. Такие антитела могут использоваться, например, при выявлении и определении локализации полипептидов Bot1 и при аффинной очистке полипептидов Bot1. Антитела могут также рутинно использоваться в разнообразных качественных или количественных иммуноанализах с использованием способов,известных в данной области. Например, см. руководство Harlow et al., Antibodies: A Laboratory Manual(Cold Spring Harbor Laboratory Press 2nd Ed., 1988). Соответственно, в шестом аспекте настоящее изобретение относится к антителу или его связывающему эпитоп фрагменту, выработанному или против полипептида Bot1, или полипептида, содержащего эпитоп Bot1. Антитела настоящего изобретения включают, но без ограничения, поликлональные, моноклональные, мультиспецифические, химерные антитела, одноцепочечные антитела, фрагменты Fab, фрагментыF(ab'), фрагменты, продуцируемые библиотекой экспрессии Fab, и связывающие эпитоп фрагменты любых из описанных выше антител. Термин антитело, используемый в настоящем описании, относится к молекулам иммуноглобулина, т.е. молекулам, которые содержат участок связывания, иммуноспецифически связывающий антиген. Молекулы иммуноглобулина настоящего изобретения могут относиться к любому типу (например, IgG,IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекулы иммуноглобулина. Антитела настоящего изобретения могут быть моноспецифическими, биспецифическими, триспецифическими или большей мультиспецифичности. Мультиспецифические антитела могут быть специфичными для различных эпитопов полипептида настоящего изобретения или могут быть специфичными и для полипептида настоящего изобретения, а также для гетерологического эпитопа, такого как гетерологический полипептид или твердый материал подложки. Например, см. публикации РСТ WO 93/17715;WO 92/08802; WO 91/00360; WO 92/05793; Tutt et al., J. Immunol. 147: 60-69, 1991; патенты США 4474893; 4714681; 4925648; 5573920; 5601819; и Kostelny et al. J. Immunol. 148: 1547-1553, 1992). В одном из вариантов осуществления антитела настоящего изобретения действуют в качестве агонистов или антагонистов полипептида Bot1. В других вариантах осуществления антитела настоящего изобретения могут использоваться, например, для очистки, выявления и нацеливания полипептидов настоящего изобретения, включая способы диагностики как in vitro, так и in vivo, и способы лечения. Например, антитела используются в иммуноанализах для качественного и количественного измерения уровней полипептида Bot1 в биологических образцах. См., например, руководство Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press 2nd Ed., 1988). Следует также понимать, что используемый в настоящем описании термин "антитело" охватывает производные, которые модифицированы, например, ковалентным присоединением любого типа молекулы к антителу, так что ковалентное присоединение не предотвращает связывание антитела с полипептидом Bot1 или его эпитопом. Например, производные антител включают антитела, которые были модифицированы, например, гликозилированием, ацетилированием, пэгилированием, фосфорилированием,амидированием, дериватизацией известными защитными/блокирующими группами, протеолитическим расщеплением, связыванием с клеточным лигандом или другим белком и т.д. Кроме того, любая из многочисленных химических модификаций может также производиться с использованием известных методик. Они включают специфическое химическое расщепление, ацетилирование, формилирование и т.д. Кроме того, производное может содержать одну или более неклассических аминокислот. Антитела могут быть генерированы с использованием способов, известных в данной области, таких как иммунизация in vivo, иммунизация in vitro, и способов представления фага. Например, см. Bittle et al.(J. Gen. Virol. 66: 23347-2354, 1985). Если используется иммунизация in vivo, животные могут иммунизироваться свободным пептидом; однако титр антитела против пептида может быть повышен стимуляцией соединением пептида с макромолекулярным носителем, таким как гемоцианин морской улитки (KLH) или токсоид столбняка. Например, пептиды, содержащие цистеиновые остатки, могут соединяться с носителем с использованием линкера, такого как сложный эфир малеимидбензоил-N-гидроксисукцинимида (MBS), тогда как другие пептиды могут быть соединены с носителями с использованием более общего связывающего агента, такого как глутаральдегид. Например, поликлональные антитела к полипептиду Bot1 или полипептиду, содержащему один или более эпитопов Bot1, могут быть получены с использованием способов, известных в данной области. Например, животные, такие как кролики, крысы или мыши, могут иммунизироваться или свободными,или связанными с носителем пептидами. Например, внутрибрюшинная и/или внутрикожная инъекция эмульсий, содержащих примерно 100 мкг пептида или белка-носителя, может использоваться для вызова продукции сывороток, содержащих поликлональные антитела, специфичные для антигена. Могут также использоваться различные адъюванты для увеличения иммунологической реакции, в зависимости от вида хозяина, например, минеральные гели Фрейнда (полные и неполные), такие как гидроксид алюминия,поверхностно-активные вещества, такие как лизолецитин, плюроновые полиолы, полианионы, пептиды,масляные эмульсии, гемоцианины морских улиток, динитрофенол, и потенциально используемые человеческие адъюванты, такие как BCG (БЦЖ, бацилла Кальметта-Жирена) и Corynebacterium parvum. Такие адъюванты также хорошо известны в данной области. Могут потребоваться несколько инъекций для повторной иммунизации, например, через интервалы примерно 2 недели, для обеспечения полезного титра антитела против пептида, который можно выявить, например, анализом ELISA с использованием свободного пептида, адсорбированного к твердой подложке. Титр антител против пептида в сыворотке от иммунизированного животного может быть увеличен выбором антител против пептидов, например,адсорбцией к пептиду на твердой подложке и элюированием выбранных антител, в соответствии со способами, известными в данной области. В качестве другого примера, моноклональные антитела могут быть получены с использованием широкого разнообразия методик, известных в данной области, включая использование гибридомной,рекомбинантной и методики представления фага или их комбинации. Например, моноклональные антитела могут также продуцироваться с использованием методик гибридомы, включая методики, известные в данной области и описанные, например, Harlow et al., Antibodies: A Laboratory Manual, (Cold SpringHarbor Laboratory Press, 2nd ed., 1988) и Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas (Elsevier, NY, 1981). Используемый в настоящем описании термин "моноклональное антитело" не ограничивается антителами, продуцируемыми посредством технологии гибридомы. Термин "моноклональное антитело" относится к антителу, которое получено из одного клона, включая любой эукариотический, прокариотический или фаговый клон, а не способом, которым оно продуцируется. Способы получения и скрининга специфических антител с использованием технологии гибридомы известны в данной области. Например, мышей можно иммунизировать полипептидом настоящего изобретения или клетками, экспрессирующими такой пептид. После выявления иммунного ответа, например, выявления антител, специфичных для антигена, в мышиной сыворотке, мышиную селезенку извлекают и спленоциты изолируют. Затем спленоциты сливают с любыми подходящими клетками миеломы,например, клетками из клеточной линии SP20, которая может быть получена из АТСС. Гибридомы выбирают и клонируют ограниченным разведением. Затем клоны гибридомы анализируют способами, известными в данной области, для клеток, которые секретируют антитела, способные связывать полипептид настоящего изобретения. Асцитическая жидкость, которая в целом содержит высокие уровни антител, может генерироваться иммунизацией мышей положительными клонами гибридомы. Фрагменты антител, которые распознают один или более эпитопов Bot1, могут также генерироваться известными методиками. Например, фрагменты Fab F(ab')2 могут быть получены протеолитическим расщеплением молекул иммуноглобулина с использованием ферментов, таких как папаин (для получения фрагментов Fab) или пепсина (для получения фрагментов F(ab')2. Фрагменты F(ab')2 содержат вариабельную область, константную область легкой цепи и домен СН 1 тяжелой цепи. Антитела настоящего изобретения могут быть также генерированы с использованием различных способов представления фага, известных в данной области. В способах представления фага, функциональные домены антитела представлены на поверхности частиц фага, которые несут последовательности нуклеотида, кодирующие их. В определенном варианте осуществления такой фаг может использоваться,например, для представления связывающих антиген домены, экспрессированные из репертуара или библиотеки комбинаторных антител (например, человеческих или мышиных). Экспрессирующий фаг и связывающий антиген домен, который связывает представляющий интерес антиген, может быть выбран или идентифицирован антигеном, например, с использованием меченого антигена или антигена, связанного или захваченного на твердую поверхность или шарик. Фаги, используемые в таких способах, обычно представляют волокнистый фаг, включающий домены, связывающие fd и М 13, экспрессированные из фага, стабилизированными Fab, Fv или дисульфидом домены Fv антитела, рекомбинантно слитые или с геном III фага, или белком гена VIII. Примеры способов представления фага, которые могут использоваться для получения антител настоящего изобретения, включают способы, раскрытые Brinkman et al. (J. Immunol. Methods 182: 41-50,1995), Ames et al. (J. Immunol. Methods 184: 177-186, 1995), Kettleborough et al. (Eur. J. Immunol. 24: 952958, 1994), Persic et al. (Gene 187: 9-18, 1997), Burton et al. (Advances in Immunology 57: 191-280, 1994); публикациях РСТ WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982;WO 95/20401 и патентах США 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108. После выбора фага, кодирующие антитело области из фага могут быть выделены и использованы для генерирования цельных антител или любого другого желаемого связывающего антиген фрагмента, и экспрессированы у любого желаемого хозяина, включая клетки млекопитающих, клетки насекомых,клетки растений, дрожжи и бактерии. Например, методики для рекомбинантного получения фрагментовFab, Fab', F(ab') также могут использоваться с применением способов, известных в данной области, таких как способы, раскрытые в публикации РСТ WO 92/22324; Mullinax et al. (BioTechniques 12(6): 864-869,1992); и Sawai et al. (AJRI 34:26-34, 1995); и Better et al. (Science 240: 1041-1043, 1988). Примеры методик, которые могут использоваться для получения одноцепочечных Pvs и антител,включают методики, описанные в патентах США 4946778 и 5258498; Huston et al. (Methods in Enzymology 203: 46-88, 1991); Shu et al. (Proc. Natl. Acad. Sci. USA 90: 7995-7999, 1993) и Skerra et al. (Science 240: 1038-1040, 1988). В седьмом аспекте настоящее изобретение относится к способу модуляции скорости, уровня и/или типа выходящего тока бора из клетки, включающему модуляцию активности и/или экспрессии полипептида Bot1 в указанной клетке. Как указано выше, "клетка" может представлять любую эукариотическую или прокариотическую клетку. По существу, "клетка", указываемая в настоящем описании, может представлять собой эукариотическую клетку, включая грибковую клетку, такую как дрожжевая клетка, или клетка мицелиевого гриба; животную клетку, такую как клетка млекопитающего или клетка насекомого; или растительную клетку. Альтернативно, клетка может также представлять собой прокариотическую клетку, такую как бактериальная клетка (например, клетка Е. Coli) или археоцит. В некоторых вариантах осуществления клетка может представлять, например, растительную клетку, клетку односемядольного или двусемядольные покрытосемянного растения или клетку голосемянного растения. В еще одном из вариантов осуществления растительная клетка представляет клетку односемядольного растения. В определенных вариантах осуществления клетка односемядольного растения может представлять собой растительную клетку злаковой культуры или клетку ячменя. Как указано выше, настоящее изобретение частично основано на модулировании уровня и/или активности полипептида Bot1 в клетке. Следует понимать, что указанное в настоящем описании модулирование "уровня" полипептидаBot1 включает увеличение или уменьшение уровня или количества полипептида Bot1 в клетке. Аналогичным образом, следует понимать, что модулирование "активности" полипептида Bot1 включает увеличение или уменьшение, например, общей активности, специфической активности, периода полувыведения и/или стабильности полипептида Bot1 в клетке. Под "увеличением" подразумевается увеличение уровня активности полипептида Bot1 в клетке, например, на 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 50 раз, в 100 раз. Под "уменьшением" подразумевается, например, снижение уровня активности полипептида Bot1 в клетке, например, на 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100%. Следует также понимать, что "модулирование" включает введение полипептида Bot1 в клетку, которая в норме не экспрессирует введенный фермент, или по существу полное ингибирование активности полипептида Bot1 в клетке, которая в норме обладает такой активностью. Настоящее изобретение предусматривает любое средство, с помощью которого может модулироваться уровень и/или активность полипептида Bot1 в клетке. Это включает, например, способы, такие как использование агентов, которые модулируют активность полипептида Bot1 в клетке, включая применение агониста или антагониста полипептида Bot1; использование агентов, которые имитируют активность полипептида Bot1 в клетке; модулирование экспрессии нуклеиновой кислоты Bot1, которая кодирует полипептид Bot1 в клетке; или воздействие на экспрессию измененной или мутированной нуклеиновой кислоты Bot1 в клетке, так что клетка экспрессирует полипептид Bot1 с увеличенной или уменьшенной специфической активностью, периодом полувыведения и/или стабильностью. В одном из вариантов осуществления уровень и/или активность полипептида Bot1 модулируется модулированием экспрессии нуклеиновой кислоты Bot1 в клетке. Термин "модулирование" в отношении экспрессии нуклеиновой кислоты Bot1 может включать увеличение или уменьшение транскрипции и/или трансляции нуклеиновой кислоты Bot1. Под "увеличением" подразумевается увеличение транскрипции и/или трансляции нуклеиновой кислоты Bot1, например,на 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100%, в 2 раза, в 5 раз, в 10 раз, в 20 раз, в 50 раз, в 100 раз или больше. Под "уменьшением" подразумевается, например, снижение транскрипции и/или трансляции нуклеиновой кислоты Bot1 полипептида Bot1 в клетке, например, на 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90,91, 92, 93, 94, 95, 96, 97, 98, 99, 100%. Модулирование также включает введение экспрессии нуклеиновой кислоты Bot1, в норме не обнаруживаемой в определенной клетке; или, по существу, полное ингибирование (например, нокаут) экспрессии нуклеиновой кислоты Bot1 в клетке, которая в норме обладает такой активностью. Настоящее изобретение предусматривает любое средство, которым может модулироваться экспрессия нуклеиновой кислоты Bot1. Например, иллюстративные способы модулирования экспрессии нуклеиновой кислоты Bot1 включают, но без ограничения генетическую модификацию клетки для стимуляции или подавления экспрессии эндогенной нуклеиновой кислоты Bot1 путем трансформации нуклеиновой кислотой Bot1; генетическую модификацию для увеличения числа копий последовательности нуклеиновой кислоты Bot1 в клетке; введение молекулы в клетку нуклеиновой кислоты, которая модулирует экспрессию эндогенной нуклеиновой кислоты Bot1 в клетке; и тому подобное. В одном из вариантов осуществления экспрессия нуклеиновой кислоты Bot1 модулируется генетической модификацией клетки. Следует понимать, что используемый в настоящем описании термин "генетически модифицированная" включает любую генетическую модификацию, которая осуществляет изменение в экспрессии нуклеиновой кислоты Bot1 в генетически модифицированной клетке относительно генетически немодифицированной формы клетки. Иллюстративные типы генетической модификации включают: случайный мутагенез, такой как траспосон, химический, УФ и фаговый мутагенез вместе с выбором мутантов, которые избыточно экспрессируют или недостаточно экспрессируют эндогенную нуклеиновую кислоту Bot1; транзиторное или стабильное введение одной или более молекул нуклеиновой кислоты в клетку, которое направляет экспрессию и/или избыточную экспрессию нуклеиновой кислоты Bot1 в клетке; ингибирование эндогенного полипептида Bot1 направленным на сайт мутагенезом эндогенной нуклеиновой кислоты Bot1; введение одной или более молекул нуклеиновой кислоты,- 17018689 которые ингибируют экспрессию эндогенной нуклеиновой кислоты Bot1 в клетке, например, косупрессионный конструкт или конструкт иРНК и тому подобное. В одном конкретном варианте осуществления настоящее изобретение предусматривает увеличение уровня полипептида Bot1 в клетке введением экспрессии нуклеиновой кислоты Bot1 в клетку, стимуляцией экспрессии нуклеиновой кислоты Bot1 в клетке и/или увеличением числа копий нуклеиновой кислоты Bot1 в клетке. В одном из вариантов осуществления введенная нуклеиновая кислота Bot1 может быть помещена под контроль транскрипционной контрольной последовательности, такой как нативный промотор Bot1 или гетерологичный промотор. В еще одном определенном варианте осуществления способ по седьмому аспекту изобретения предусматривает увеличение экспрессии нуклеиновой кислоты Bot1 в клетке введением выделенной геномной нуклеотидной последовательности, определяющей кластер нуклеиновых кислот Bot1 из толерантного к бору организма (например, культивара ячменя Сахара 3771), в обсуждаемую клетку. Способы трансформации растений и экспрессии введенной нуклеотидной последовательности известны в данной области, и настоящее изобретение предусматривает использование любого из подходящих способов. Однако, в качестве примера, делается ссылка на Zhao et al. (Mol Breeding DOI 10.1007/s11032-006-9005-6, 2006), Katsuhara et al. (Plant Cell Physiol 44(12): 1378-1383, 2003), Ohta et al.(FEBS Letters 532: 279-282, 2002) и Wu et al. (Plant Science 169: 65-73, 2005). В следующих вариантах осуществления настоящее изобретение также относится к способам подавления экспрессии нуклеиновой кислоты Bot1 в клетке. Например, с идентификацией нуклеиновой кислоты Bot1 настоящее изобретение также облегчает применение таких способов, как нокаут или нокдаун нуклеиновой кислоты Bot1 в клетке с использованием способов, включающих, например:(i) инсерционный мутагенез нуклеиновой кислоты Bot1 в клетке, включая нокаут или нокдаун нуклеиновой кислоты Bot1 в клетке гомологичной рекомбинацией конструктом нокаута (пример целевого разрушения гена в растениях см. Terada et al., Nat. Biotechnol. 20: 1030-1034, 2002);(iii) трансформацию клетки антисмысловым конструктом, направленным против нуклеиновой кислоты Bot1 (примеры антисмысловой суппрессии у растений см. van der Krol et al., Nature 333: 866-869;iv) трансформацию клетки косупрессионным конструктом, направленным против нуклеиновой кислоты Bot1 (примеры косупрессии у растений см. van der Krol et al., Plant Cell 2(4): 291-299);v) трансформацию клетки конструктом, кодирующим двухнитевую РНК направленным против нуклеиновой кислоты Bot1 (пример сайленсинга гена, опосредованного двухнитевой РНК см. Waterhouse et(vi) трансформацию клетки конструктом, кодирующим циркулярной интерферирующей РНК или"шпильку", направленным против нуклеиновой кислоты Bot1 (пример сайленсинга гена, опосредованного циркулярной интерферирующей РНК или "шпилькой", в растениях, см. Lu et al., Nucl. Acids Res. 32(21): e171; doi:10.1093/nar/gnh170, 2004). Настоящее изобретение также облегчает подавляющую регуляцию нуклеиновой кислоты Bot1 в клетке посредством использования синтетических олигонуклеотидов (примеры сайленсинга, опосредованного синтетической циркулярной интерферирующей РНК, см. Caplen et al., Proc. Natl. Acad. Sci. USA 98: 9742-9747, 2001; Elbashir et al., Genes Dev. 15: 188-200, 2001; Elbashir et al., Nature 411: 494-498, 2001;Elbashir et al., EMBO J. 20: 6877-6888, 2001; и Elbashir et al., Methods 26: 199-213, 2002) . В одном из вариантов осуществления нокдаун или нокаут нуклеиновой кислоты Bot1 в клетке или организме может вызвать снижение толерантности клетки или организма к бору. В еще одном из вариантов осуществления подавляющая регуляция, нокаут или нокдаун нуклеиновой кислоты Bot1 в клетке или организме могут вызвать увеличение чувствительности к бору или эффективности использования бора клеткой или организмом. Например, подавляющая регуляция, нокаут или нокдаун нуклеиновой кислотыBot1 в растении или в одной или более его клетках могут увеличить эффективность использования бора растением для роста в окружающей среде с дефицитом бора. В дополнение к представленным выше примерам, введенная нуклеиновая кислота может также содержать нуклеотидную последовательность, которая прямо не связана с нуклеиновой кислотой Bot1, но,тем не менее, может прямо или косвенно опосредовать экспрессию нуклеиновой кислоты Bot1 в клетке. Примеры включают молекулы нуклеиновой кислоты, которая кодирует транскрипционные факторы или другие белки, которые стимулируют или подавляют экспрессию эндогенной нуклеиновой кислоты Bot1 в клетке; и другие нетранслированные РНК, которые прямо или косвенно стимулируют или подавляют экспрессию эндогенного полипептида Bot1, и тому подобное. Для достижения экспрессии введенной нуклеиновой кислоты в генетически модифицированной клетке, при целесообразности, введенная нуклеиновая кислота может быть функционально соединена с одной или несколькими транскрипционными контрольными последовательностями и/или промоторами,как описано выше. В восьмом аспекте настоящее изобретение относится к клетке с модулированной скоростью, уров- 18018689 нем и/или типом выходящего тока бора. Следует понимать, что указанная в настоящем описании клетка, имеющая "модулированную" скорость, уровень и/или тип выходящего тока бора, включает любую клетку, в которой скорость, уровень и/или тип выходящего тока бора отличается от тока бора в форме клетки дикого типа (или немодифицированной). В одном из вариантов осуществления клетка имеет увеличенную скорость и/или уровень выходящего тока бора относительно формы клетки дикого типа. В одном из вариантов осуществления клетка по восьмому аспекту изобретения получена в соответствии со способом седьмого аспекта изобретения. В девятом аспекте настоящее изобретение также относится к многоклеточной структуре, где многоклеточная структура содержит одну или более клеток восьмого аспекта изобретения. В десятом аспекте настоящее изобретение относится к способу определения чувствительности организма к бору или толерантности к нему, включающему определение уровня экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 в одной или более клетках организма, где относительно высокий уровень экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 связан с толерантностью организма к бору и относительно низкий уровень экспрессии последовательности нуклеиновой кислоты Bot1 и/или полипептида Bot1 связан с чувствительностью организма к бору. Способы определения уровня и/или тип экспрессии нуклеиновой кислоты или полипептида известны в данной области. Иллюстративные способы выявления экспрессии РНК включают такие способы,как количественная или полуколичественная PCR обратной транскриптазы (например, см. Burton et al.,Plant Physiology 134: 24-236, 2004), гибридизация in situ (например, см. Linnestad et al., Plant Physiology 118: 1169-1180, 1998); нортерн блоттинг (например, см. Mizuno et al., Plant Physiology 132: 1989-1997,2003) и тому подобное. Иллюстративные способы экспрессии полипептида включают вестерн блоттингMolecular Biology 14: 575-583); иммуномикроскопию (например, см. Asghar et al., Protoplasma 177: 87-94,1994) и тому подобное. В другом варианте осуществления уровень экспрессии последовательности нуклеиновой кислотыBot1 и/или полипептида Bot1 может быть определен путем определения числа нуклеиновых кислот Bot1 в геномной ДНК одной или более клеток организма. В данном варианте осуществления множественные копии нуклеиновой кислоты Bot1 в геноме прогнозируют относительно высокий уровень экспрессии последовательности нуклеиновой кислоты Bot1 в клетке. В других конкретных вариантах осуществления на высокий уровень последовательности нуклеиновой кислоты Bot1 и/или экспрессии полипептида Bot1 указывает присутствие по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5,по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9 или по меньшей мере 10 копий нуклеиновой кислоты Bot1 в геноме одной или более клеток организма. В одном из вариантов осуществления способ по десятому аспекту изобретения адаптирован для установления чувствительности или толерантности растения к бору. В других вариантах осуществления способ по десятому аспекту изобретения адаптирован для установления чувствительности или толерантности растения к бору, например односемядольного растения или растения ячменя. В следующих вариантах осуществления способ по десятому аспекту изобретения может быть использован для установления чувствительности или толерантности организма к бору и последующего выбора отдельных организмов на основании установленного уровня чувствительности или толерантности организма к бору. Например, в случае растений, растения, имеющие повышенную толерантность к бору,могут быть выбраны для посадки в почвы с высоким содержанием бора, или могут быть выбраны для программ селекции для получения толерантных к бору культиваров растения. Наконец, приводится ссылка на стандартные руководства по молекулярной биологии, которые содержат способы проведения основных методик, охватываемых настоящим изобретением, включая рестрикцию и лигирование ДНК для генерирования различных генетических конструктов, описанных в настоящем описании. См., например, Maniatis et al., Molecular Cloning: A Laboratory Manual (Cold SpringHarbor Laboratory Press, New York, 1982) и Sambrook et al. (2000, выше). Настоящее изобретение далее описывается следующими неограничивающими примерами. Краткое описание фигур Фиг. 1. Генетическая изменчивость толерантности к бору у ячменя. (А) Симптомы токсичности бора в пластинках листа не переносящих бор (Clipper) и толерантных к бору (Sahara) растений ячменя. Приблизительно 8 самых старых пластинок листа из одиночных растений показаны через 14 дней после обработки бором. (В) Sahara накапливает меньше бора в пластинках листа после выращивания в течение 14 дней в диапазоне концентраций раствора. Данные являются средней величинойстандартная ошибка средней (n=3). Фиг. 2. Картирование и филогенетический анализ Bot1.(A) Сравнительное картирование локуса толерантности к токсичности бора ячменя-риса на хромосоме 4 Н. Цифры указывают на рекомбинанты, идентифицированные для каждого интервала маркера. Связанный интервал три (АР 008209) хромосомы риса образует промежуток между положением 1861805-1873065 пар оснований. Цветные стрелки I-VIII обозначают положение и ориентацию прогнозируемых генов риса, соответственно, Os03g0133300 (гипотетический белок),Os03g0133400 (белок, содержащий связывающий пептидогликан домен LysM), Os03g0133500 (связывающий АМФ белок 1 АМРВР 1), Os03g0133600 (белок, держащий домен АМФ-зависимой синтетазы и лигазы), Os03g0133800 (связывающий АМФ белок 1 АМРВР 1), Os03g0133900 (ацетилтрансфераза серина), Os03g0134000 (белок, содержащий домен транспосазы MuDR) и Os03g0134300 (фосфорибозилтрансфераза АТФ). Номерами доступа являются: xBot1, BV723959; xBM160, BV723960; ХВМ 165,BV723961; xBM178, BV723962; xBMWl, BV723963; xBM162, BV723964.(В) Филогенетическое дерево, включающее белок Bot1 и BOR1-подобный белок из риса (зеленый) иArabidopsis (синий), построенное с использованием программы PHYLIP. Цифры, разделяющие соединения, являются величинами начальной нагрузки. Ближайшим рисовым ортологом Bot1 являетсяOs01g08020. Доступы к локусу определяются в соответствии с Gramene. На фиг. 3 представлена толерантность к бору у дрожжей. Рост Saccharomycs cerevisae на твердой среде, содержащей 0 или 20 мМ добавленного Н 3 ВО 3. Каждая чашка показывает 2 независимых клона дрожжей, содержащих каждый пустой вектор, Bot1 Sahara или Bot1 Clipper (слева направо). Производились посевы аликвотных количеств 10 мкл 10-кратных серийных разведений на чашку (сверху вниз). Фиг. 4. Локализация мРНК Bot1 в ячмене. Локализация in situ мРНК Bot1 в поперечных (А-Н) и продольных (I, J) разрезах тканей ячменя Sahara (А, С, Е, G, I) и Clipper (В, DD, F, Н, J), выращенных в 1 мМ Н 3 ВО 3, зондированных антисмысловой Bot1. Окрашивание мРНК Bot1 сильное на кончиках пластинок листьев (А, В) в мезофилле, окружающей увеличенные сосуды (размерные стрелки на В). Относительно верхушки пластинки листа, окрашивание уменьшено в 2 см сзади от кончика (С, D), но остается специфичным для мезофилла, окружающего увеличенные сосуды у Sahara (размерная стрелка на С). В середине пластинки самого молодого полностью проросшего листа (Е, F) этот тип был не очевиден. Окрашивание мРНК Bot1 также сильное в самой молодой ткани цилиндрического влагалища (G, Н) и кончике корня (I, J). В корнях окрашивание распространялось в зрелую стелу (размерные стрелки на I, J). Очевидно количественное различие окрашивания между срезами ткани листьев Sahara и Clipper. (A-H) фиксатор ТЕМ. (I, J) фиксатор FAA. Смысловую гибридизацию выполняли для всех срезов ткани и не производили выявляемого сигнала. Растение в центре является 10-дневным сеянцем Clipper. Столбики шкалы: 100 мкм (A-F), 500 мкм (G-J). (K) Уровни мРНК Bot1 в 10-мм сегментах корней, взятых вдоль корня, анализировали QPCR (количественной PCR). Различные буквы над каждым столбцом представляют статистически значимые различия (ANOVA, вариационный анализ, Р 0,05, ретроспективный критерий Tukey). Данные являются средней величинойстандартная ошибка средней (n=3). Фиг. 5. Определение генотипов локуса толерантности к бору. Молекулярный маркер и генотипы толерантности к бору рекомбинантов F3 иллюстрируются со ссылкой на генетическую карту на фиг. 2 А в верхней части. Заштрихованные и незаштрихованные столбцы представляют сегменты хромосомы,полученные соответственно из Sahara и Clipper. Для каждого рекомбинанта F3 семейство потомства F4 выращивали в течение 21 дня в 2 мМ Н 3 ВО 3 и проводили балльную оценку индивидов F4 по концентрации бора в листьях и связанному молекулярному маркеру для прослеживания наследования рекомбинантных и нерекомбинантных хромосом. Показана концентрация бора у индивидов, гомозиготных по рекомбинантным и нерекомбинантным хромосомам (средняя величинастандартная ошибка средней(n=6 вместе с аллелью толерантности к бору, которую несут эти индивиды, по данным определения по накоплению бора, где Т представляет аллель толерантности, и IT представляет аллель нетолерантности. Гомозиготные нерекомбинанты служили в качестве внутренних контролей для учета генетической фоновой сегрегации и обеспечивали возможность точной балльной оценки QTL (локуса количественного признака). Два из четырех рекомбинантов для интервала хВМ 178-хВМ 160 не являлись испытанным потомством. Фиг. 6. Анализ генома Bot1 саузерн блоттингом и накопления бора в толерантных и нетолерантных к бору генотипах ячменя. (А) Геномная ДНК из толерантного к бору сорта Sahara (полоса 6) и толерантных к бору генотипов ячменя (полосы 1-5, 7), переваренных Xba (слева), зондировались меченым [32 Р] фрагментом из 559 пар оснований, полученным из сорта Clipper, из гена Bot1 (справа). (В) Концентрация бора в пластинке листа таких же генотипов ячменя, выращенных ТВ основном растворе гидропоники с добавлением Н 3 ВО 3 до 2 мМ в течение 21 дня. Пластинки листьев Sachara содержат значительно меньше бора, чем пластинки листьев не толерантных типов (ANOVA, Р 0,001, ретроспективный критерийTukey). Фиг. 7. Уровни транскриптов Bot1 выше в толерантном к бору ячменю. Уровни транскриптов Bot1 анализировали QPCR в пластинках листьев и корнях ячменя Clipper и Sahara, выращенного по диапазону концентраций Н 3 ВО 3. Данные являются средней величинойстандартная ошибка средней (n=3). Фиг. 8. Bot1 обеспечивает толерантность к бору и выходящий ток бора в дрожжах. (A) Sacchararomyces cerevisae, экспрессирующие Bot1 Sahara, растут быстрее, по сравнению с клетками, экспрессирующими Bot1 Clipper, при высокой концентрации бора в жидкой культуре. (ANOVA, Р 0,001). (В) Sacchararomyces cerevisae, экспрессирующие Bot1 Sahara или Clipper, поддерживают более низкую клеточ- 20018689 ную концентрацию бора, чем те, которые экспрессируют пустой вектор (ANOVA, P0,05, ретроспективный критерий Tukey). Различие между вектором+Bot1 Clipper и вектором+Bot1 Sahara статистически незначимое. Данные являются средней величинойстандартная ошибка средней (n=3). Фиг. 9. Сравнение роста и содержания бора дрожжевых мутантных клеток yn1275w, экспрессирующих BOR1 или Bor1 Sahara.(А) Клетки мутанта Saccharomyces cerevisiae yn1275w, экспрессирующие BOR1 или Bor1 Sahara,поддерживают рост при высокой концентрации бора в жидкой культуре. Рост клеток, экспрессирующихBot1, значимо отличается от клеток, экспрессирующих BOR1, через 44 ч. (Р 0,01, t критерий Стьюдента). (В) Концентрация бора в клетках, экспрессирующих Bot1 Sahara, значимо отличается от клеток, экспрессирующих BOR1 (Р 0,05, t критерий Стьюдента). Данные являются средней величинойстандартная ошибка средней (n=3). Фиг. 10. Последовательность Bot1. (А) кДНК Bot1 Sahara (толерантной к бору) и прогнозируемый белок. Серые и красные квадраты соответственно указывают на положения замещений нуклеотидов и аминокислот относительно аллеля Clipper. Синие линии показывают трансмембранные спирали, прогнозированные с использованием программного обеспечения ТМНММ Server, версии 2.0. (В) Структура гена Bot1. Заштрихованные и светлые квадраты указывают, соответственно, транслированные и нетранслированные последовательности эксона, тогда как интроны показаны в виде прилегающих линий. Фиг. 11. Выравнивание последовательности Bot1. Выравнивание Bot1 Sahara с BOR1 Arabidopsis(At2g47160.1) и другими подобными Arabidopsis и транспортеру бора риса последовательностями. Остатки, идентичные во всех или по меньшей мере шести из 12 последовательностей, соответственно заштрихованы черным и серым. Пример 1. Введение Как ограничивающие, так и токсические концентрации в почве незаменимого микроэлемента бора представляют существенные ограничения урожайности во всем мире. В данном случае идентифицируется Bot1, ортолог BOR1, в качестве гена, ответственного за более высокую толерантность к токсическому действию бора адаптированного к местным условиям алжирского ячменя Sahara 3771 ("Sahara"). Локализацию Bot1 определяли в локусе картированием с высоким разрешением. По сравнению с нетолерантными генотипами, Sahara содержит приблизительно в 4 раза больше копий гена Bot1, продуцирует гораздо больше транскрипта Bot1 и кодирует белок Bot1 с более высокой способностью обеспечения толерантности у дрожжей. Уровни транскрипта Bot1, идентифицированные в тканях ячменя, согласуются с ролью, ограничивающей чистое количество бора, входящего в корень, и удаление бора из листьев посредством гуттации гидатоды. Из всех питательных элементов растений бор имеет самый узкий диапазон между недостаточной и токсической концентрацией в почвенном растворе, и как недостаточность, так и токсичность бора резко ограничивают урожайность во всем мире. С токсичностью труднее справиться агрономическими способами, и лучшим способом ее преодоления является использование толерантных к бору разновидностей растений. Известно, что у ряда видов растительных культур имеется генетическая изменчивость в отношении толерантности к токсическому действию бора. Толерантность чаще всего связана со способностью поддерживать концентрации бора в побеге. У ячменя (Hordeum vulgare) не агрономический, но имеющий высокую толерантность к бору алжирский адаптированный к местным условиям сорт идентифицировали в качестве потенциального источника толерантности для улучшения сорта. У гибрида, полученного скрещиванием сорта Sahara и нетолерантного к бору Австралийского осолаживающего сортаClipper, было идентифицировано несколько локусов QTL, регулирующих толерантность. Основной локус на хромосоме 4 Н воздействует на экспрессию листовых симптомов (фиг. 1 А), накопление бора (фиг. 1 В), реакцию длины корней и продукцию сухого вещества в условиях токсического воздействия бора. Способность сорта Sahara поддерживать более низкое накопление бра в побегах по меньшей мере частично вызвана механизмом активного выходящего тока бора из корня. Пример 2. Картирование Bot1 Основанный на картировании подход использовали для выделения гена толерантности к бору 4 Н. Путем использования популяции, представляющей 6720 мейозов и солинейности гена с синтеновой областью на хромосоме три риса для генерирования маркеров, определяли положение локуса толерантности в интервале 0,15 сМ между маркерами xBM178 и xBM162 (фиг. 2 А и 5). Соответствующий интервал 11,2 т.п.о. в рисе содержит 2 интактные копии и одну 3'-усеченную версию гена, проявляющего сходство с семейством АМФ-зависимых синтетаз и лигаз, а не другой прогнозированный ген. EST ячменя, наиболее близко подходящие к одной из интактных копий, использовали для получения маркера хВМ 160, который совместно сегрегировался с локусом толерантности. В параллельном подходе также проводили картирование нескольких перспективных генов в ячмене. Они представляли собой гены ячменя, проявляющие подобие основному эндогенному белку NIP5;1 и транспортеру выходящего тока Arabidopsis BOR1, связанному с транспортерами бикарбоната у животных. Оба гена Arabidopsis требуются для здорового роста в условиях низкой доставки бора. Однако в растениях гены, участвующие в толерантности к токсическому действию бора, могут быть связаны с ге- 21018689 нами, которые, как показано, функционируют при эффективности бора. Сравнения меток экспрессированных последовательностей (EST) выявили 4 гена, связанных с BOR1 (At2g47160.1). Картирование определило локализацию одного из генов ячменя (Bot1) в области толерантности бора QTL на 4 Н. В последствии было обнаружено, что маркер, созданный из конца 3' Bot1, превосходно совместно сегрегировался с локусом толерантности в популяции картирования с высоким разрешением (фиг. 2 А), строго свидетельствуя о том, что Bot1 кодирует толерантность к бору из локуса 4 Н. Хотя было обнаружено, что солинейность гена ячменя-риса является высокой в данной области (фиг. 2 А), соответствующий интервал на хромосоме три не имеет ортолога BOR1 и гена риса, ближе всего напоминающий Bot1(Os01g08040; фиг. 2 В), находится на хромосоме один. Пример 3. Число копий Bot1 у ячменя Саузерн гибридизация с использованием зонда Bot1, полученного из сорта Clipper, давала более сильный сигнал у сорта Sahara, чем у сорта Clipper, и других нетолерантных к бору генотипов, указывая на возникновение дополнительных копий Bot1 у сорта Sahara (фиг. 6). Ряд рестрикционных ферментативных перевариваний выявил гибридизующие фрагменты Sahara преимущественно одного размера (например, Xba I, фиг. 6), свидетельствуя о том, что копии Bot1 у сорта Sahara очень похожи. При Dra I, который отличает копию Bot1 сорта Sahara, могут быть картированы все гены Bot1, и было обнаружено,что они совместно сегрегируются с толерантностью к бору у полученной из F1 удвоенной гаплоидной популяции ClipperSahara, указывая на то, что эти гены возникают в кластере. Количественный анализPCR в реальном масштабе времени (QPCR) с использованием геномной ДНК в качестве матрицы указывает на то, что сорт Sahara содержит приблизительно в четыре (3,80,17) раза больше копий гена, чем сорт Clipper. Пример 4. Уровни транскрипта Bot1 у ячменяQPCR, выполненный с использованием комплементарной ДНК (кДНК) в качестве матрицы, выявил, что уровни транскрипта Bot1 у сорта Sahara, были приблизительно в 18 раз выше в корнях и в пластинках листьев, по сравнению с сортом Clipper (фиг. 7). Интересно, что такое увеличение уровней транскрипта Bot1 превышает приблизительное четырехкратное увеличение числа копий Bot1 у сортаSahara, свидетельствуя о том, что факторы, дополнительные к дупликации гена, могут вносить вклад в увеличенные уровни транскрипта Bot1 у сорта Sahara. Был выполнен сравнительный промоторный анализ аллелей Bot1 сортов Sahara и Clipper для поиска различий, которыми можно объяснить наблюдаемую генотипную изменчивость уровней транскрипта. По области 1,3 т.п.о. 5' мРНК сайта начала транскрипции, области промотора Bot1 сорта Clipper и Sahara идентичны на 96%. На основании поисков в базах данных не были выявлены значимые различия известных регуляторных элементов. Потребуется дополнительная работа для определения действительного воздействия таких изменений на транскрипцию Bot1 у ячменя. В любом случае, более высокие уровни транскрипта у сорта Sahara относительно сорта Clipper предоставляет объяснение функционального различия между аллелями толерантности и непереносимости бора и предоставляет дополнительное доказательство, подтверждающее роль Bot1 в качестве гена,регулирующего толерантность к бору в локусе 4 Н. Как в корнях, так и в пластинках листьев уровни транскрипта не изменялись под воздействием диапазона концентраций бора (фиг. 7). Отсутствие транскрипционной активации механизма толерантности к бору согласуется с быстрым выходящим током бора из корней сорта Sahara, наблюдающимся после добавления или нетоксичных, или токсичных количеств бора, и аналогичным образом ранга накопления бора в ростках у различных генотипов, выращенных по диапазону концентраций бора. Пример 5. Активность Bot1 у дрожжей Способность Bot1 функционировать в качестве транспортера бора была подтверждена у дрожжей(Saccharomyces cerevisae). Сначала проводили скрининг приблизительно 2 миллионов клонов из библиотеки экспрессии кДНК корней сорта Sahara для выявления их способности придавать дрожжам толерантность к бору. Получали три клона, соответствующих Bot1, которые обеспечивали возможность роста дрожжей на средах с высоким содержанием бора. Клоны Bot1 содержали полные открытые рамки считывания (ORF) и были идентичны по последовательности. Затем сравнивали на дрожжах способностьBot1 сорта Sahara и Bot1 сорта Clipper или Bot1 Arabidopsis придавать толерантность к бору. Дрожжи,экспрессирующие Bot1 сорта Sahara, росли лучше, чем дрожжи, экспрессирующие Bot1 сорта Clipper, в присутствии высокой концентрации бора как на твердой среде (фиг. 3), так и на жидкой среде (фиг. 8). Клетки, экспрессирующие или Bot1 сорта Sahara, или Bot1 сорта Clipper, также поддерживали содержание клеточного бора приблизительно на 24 и 20%, соответственно, меньше, чем клетки, экспрессирующие контроль пустого вектора (фиг. 8). Это происходило, несмотря на то, что при физиологическом рН бор существует в основном в виде недиссоциированной борной кислоты (pKa1-pKa3=9,2-13,8), для которой мембраны являются относительно проницаемыми. Кроме того, по сравнению с BOR1 или Arabidopsis, было показано, что Bot1 сорта Sahara имеет более высокую транспортную активность выходящего тока бора и способность обеспечивать толерантность (фиг. 9). Эти результаты подтвердили, что Bot1,подобно BOR1 или Arabidopsis, кодирует функциональный транспортер выходящего тока бора, и чтоBot1 сорта Sahara имеет более высокую способность обеспечивать толерантность к бору у дрожжей, чемBot1 сорта Clipper или BOR1. Ни один из клонов, идентифицированных скринингом библиотеки, не соответствовал ко-сегрегирующему толерантность гену ВМ 160, дополнительно подтверждая мнение о том,что Bot1, а не ВМ 160, является геном толерантности. Пример 6. Анализ последовательности Bot1 Прогнозируется, что открытая рамка считывания Bot1 сорта Sahara (SEQ ID NO:1) кодирует белок из 666 аминокислот с 10-12 предположительными трансмембранными спиралями (фиг. 10). В пределахORF, Bot1 Clipper (SEQ ID NO:25) отличается 11 нуклеотидами, два из которых приводят к различиям транслируемого белка: L305S и D592G. Изменение остатка 305 (L; гидрофобного в S; полярный) в трансмембранной спирали восемь, может придать изменение конформации, и изменение остатка 592 (D; полярного в G; без боковой цепи), вероятно, локализуется в пределах внутриклеточного карбоксильного конца. Оба могут воздействовать на транспортер бора. Bot1 проявил большее сходство последовательности с несколькими другими белками, связанными с BOR11 Arabidopsis, чем сам BOR1 (фиг. 2 В и 11), что согласуется с другой ролью Bot1 для BOR1, которая требуется для эффективности бора. Избыточная экспрессия одного из этих связанных с BOR1 генов в Arabidopsis повышала толерантность к бору, дополнительно подтверждая гипотезу авторов. Геномная последовательность гена Bot1 (SEQ ID NO:3) была получена из клона (доступ EU176161) библиотеки бактериальной искусственной хромосомы (ВАС),которая была сконструирована из удвоенно-гаплоидной линии ячменя, содержащей аллель толерантности к бору Sahara 4H. Она была идентична кДНК в кодирующей последовательности и содержала 13 эксонов и 12 интронов, включая интрон 941 т.п.о. в нетранслированной области 5' (фиг. 10). Пример 7. Гибридизация in situ Локализацию мРНК Bot1 определяли гибридизацией in situ в срезы ткани корней и пластинок листьев ячменя (фиг. 4, A-J). В корнях окрашивание было самым сильным во всех типах клеток меристематической зоны и зоны удлинения на кончике (фиг. 4, I и J). В пределах тканей цилиндрического влагалища (фиг. 4, G и Н) окрашивание было сильным во всех клетках самых молодых пластинок листьев.QPCR из 10-мм сегментов, взятых вдоль корня, выявил, что уровень мРНК Bot1, выраженный в виде доли от общего содержания РНК, был значительно больше в более зрелых сегментах корня, чем в концевых сегментах, содержащих кончики корней (фиг. 4K). Более низкие уровни окрашивания в зрелом корне могут отражать пропорционально более низкий объем цитоплазмы в этих клетках, но значительные уровни транскрипта, тем не менее, наблюдавшиеся при QPCR в зрелом корне, указывают на роль для транспортера как в растущих, так и в зрелых срезах корня. мРНК Bot1, выявленная в молодых клетках,может потенциально служить для выполнения двойной роли ограничения симпластической концентрации бора и, следовательно, токсичности, и содействия поддержанию высокой доставки бора в стенки вновь формирующихся первичных клеток, где бор составляет существенный компонент пектинового полисахарида рамногалактуронана II. Возможно, что локализация мРНК Bot1 в зрелых корнях содействует выходящему току бора из корней. В пластинках более старых листьев, окрашивание мРНК Bot1 было сильным в мезофилле, примыкающем к увеличенным сосудам около краев, и было самым сильным на кончиках (фиг. 4, А и В). В ячмене кончики пластинок листьев являются участком гуттации гидатодами. Локализация здесь мРНК Bot1 свидетельствует о дополнительной роли Bot1 в содействии удалению бора из пластинок листьев через жидкость гуттации и, следовательно, в снижении токсичности бора в листьях. Ранее было показано, что гуттация является путем, которым из листьев могут быть удалены значительные количества бора. В полевых условиях выпадение дождей снижает концентрации бора в ростках ячменя и пшеницы. Пример 8. Материалы и методы(i) Растительные материалы, рост и анализ бора Семена линий популяций картирования сортов Clipper, Sahara и F3 проращивали на фильтровальной бумаге и выращивали с использованием гидропоники в основном растворе, заменяемом через каждые семь дней, содержащем 5 мМ NH4NO3, 5 мМ KNO3, 2 мМ Са(NO3)24H2O, 2 мМ MgSO47H2O, 0,1 мМCuSO45H2O, 0,1 мкМ Na2MoO3 при рН 5,0. Для тестирования потомства рассаду выращивали в основном растворе гидропоники с добавкой Н 3 ВО 3 до 2 мМ в теплице при температуре от 15 С (ночью) до 23 С(днем) при световом периоде 14 ч. Все пластинки листьев собирали через 21 день. Растения для QPCR,анализа накопления бора и гибридизации in situ выращивали в основном растворе гидропоники в помещении для роста с регулируемой средой при температуре от 22 С (днем) до 16 С (ночью) при световом периоде 12 ч. Для QPCR и анализа накопления бора в пластинках листьев, четыре пластинки самых старых листьев (исключая первую пластинку листа) и корни собирали у 21-дневных растений, выращенных в растворе, содержащем меняющиеся количества добавляемого Н 3 ВО 3, в течение 14 дней. Для гибридизации in situ и QPCR срезов корней, ствол и корни растений собирали от 10-дневных растений, выращенных в основном растворе гидропоники с добавлением Н 3 ВО 3 до конечной концентрации 1 мМ в течение 7 дней. Образцы анализировали на содержание бора индуктивно соединенной плазменной атомной эмиссионной спектрометрией с использованием анализа азометина-Н (Wolf, Comm. Soil Sci. Plant Anal. 5:39,1974).(ii) Тонкое картирование Bot1 Популяцию картирования F3 получали в результате скрещивания между двумя полученными из F1,удвоенными гаплоидами ClipperSahara, которые отличались по аллелям в локусе толерантности к бору на 4 Н, но не по аллелям в других известных локусах толерантности к бору. Растения F2, выбранные в качестве гетерозиготных к области локуса толерантности, использовали для генерирования семян F3 для рекомбинантного скрининга. Получали маркеры расщепленной амплифицированной полиморфной последовательности (CAPS) для Bot1 и путем использования EST ячменя, связанных с генами из соответствующего интервала на хромосоме три риса. Праймеры и рестрикционные ферменты для маркеров CAPS перечислены в табл. 2. Рекомбинантами F3 для области являлись выбранный маркер и его генотип толерантности, определенный измерением накопления бора в пластинках листа у индивидов потомства F4. Для обеспечения возможности точной балльной оценки локуса QTL проводили балльную оценку растений одного и того же потомства на маркер PCR для прослеживания наследования рекомбинантных и нерекомбинантных хромосом 4 Н, чтобы подтвердить, когда наблюдаемое изменение накопления бора регулировалось сегрегацией в локусе 4 Н (см. также фиг. 5).(iii) Анализ клона ВАС Была сконструирована библиотека ВАС из линии полученных из F1, удвоенных гаплоидов ClipperSahara, несущей аллели толерантности к бору Sahara для ранее описанных локусов, включая локус на 4 Н (Jefferies et al., Theor. Appl. Genet. 98: 1293, 1999). Фракционированную по размеру частично переваренную геномную ДНК Hind III лигировали в pIndigoBAC-5 (Invitrogen) и трансформировали в штаммDH10B Е. Coli. Библиотека представляет 5,3 эквивалентов генома, содержит 221184 клона и имеет средний размер вставки 120 т.п.о. Частично секвенированный клон ВАС, положительный по зонду Bot1,также содержал маркеры xBM160 и хВМ 162, которые совместно сегрегируются и фланкируются соответственно с локусом толерантности к бору 4 Н.(iv) Экстракция нуклеиновой кислоты, синтез кДНК и количественная PCR в реальном масштабе времени Для QPCR на кДНК с целью анализа уровней транскрипта Bot1 всю РНК экстрагировали из пластинок листа и корней растений, выращенных по технологии гидропоники, с использованием TRIzol (Invitrogen) с последующей очисткой на вращающееся колонке RNeasy, включающей обработку ДНазой I(Qiagen). Синтезировали первую нить кДНК, используя обратную транскриптазу Superscript III (Invitrogen), и использовали ее в качестве матрицы для амплификации транскриптов Bot1. QPCR также использовали для оценки числа копий Bot1 у сортов Sahara и Clipper. Для каждого генотипа выполняли три независимых реакции PCR после каждой из пяти независимых экстракций ДНК. Данные анализировали сравнением амплификации фрагмента Bot1 с фрагментом известной одиночной копии контрольного гена, который служил в качестве внутреннего стандарта (ингибитор альфа-амилазы/трипсина, номер доступа Х 13443). Праймеры, использованные для QPCR кДНК и геномной ДНК, не содержали ошибочных спариваний оснований к последовательностям Sahara или Clipper. Анализы QPCR выполняли, используя способы, описанные ранее (Burton et al., Plant Physiol. 134: 224, 2004).(v) Праймеры Праймеры, использованные для амплификации маркеров CAPS, продукты QPCR, геномные саузерн зонды и зонды гибридизации in situ перечислены в табл. 3. Таблица 3(vi) Дрожжевая экспрессия Использованные Saccharomyces cerevisiae представляли собой INVSc2 (Invirogen) и 1169. Штамм 1169 был сконструирован из BY4741 путем вставочного мутагенеза YNL275w ORF (Takano et al., Nature 420: 337, 2002; Winzeler et al., Science 285: 901, 1999). Для сравнения Bot1 Clipper и Sahara, использованный штамм представлял собой INVSc2 (Invirogen), и вектором экспрессии являлся pYES-DEST52 (Invitrogen). Для сравнения BOR1 и Bot1 Sahara, используемым штаммом был 1169, и вектором экспрессии был pYES (Invitrogen). Дрожжи размножались на синтетической декстрозной минимальной среде или в жидкой культуре с добавлением аминокислот. Экспрессию вызывали добавлением 2% галактозы. Для измерений концентрации бора, культуры дрожжей в средне-логарифмической фазе роста собирали центрифугированием и ресуспендировали в средах, содержащих до 50 мМ Н 3 ВО 3. Клетки инкубировали в течение 2 ч при 30 С при встряхивании и затем собирали вакуумной фильтрацией сред через нитроцеллюлозные мембраны Millipore (0,45 мкм). Внутриклеточный бор экстрагировали кипячением клеток в деионизированной воде в течение 40 мин, с последующим центрифугированием для удаления клеточных фрагментов. Показатели роста дрожжей получали определением спектральной поглощательной способности аликвотных количеств клеточных суспензий спектрофотометром при 600 нм.(vii) Локализация мРНК in situ Меченые DIG антисмысловые и смысловые зонды Bot1 генерировали набором метки DIG РНК(Roche Diagnostics) из нетранслированной амплифицированной области 3' размером 300 пар оснований из кДНК Sahara, клонированной в pSPT, и секвенировали для определения ориентации. Ткань фиксировали или в FAA (50% этанола, 5% уксусной кислоты, 4% формальдегида, 0,1% Rween 20), или в фиксаторе ТЕМ (0,25% глутаральдегида, 4% параформальдегида и 4% сахарозы в 1 забуференном фосфатом солевом растворе), в течение 4 ч при комнатной температуре, дегидратировали посредством серийной обработки этанолом, затем ксилолом, заливали в парафин и делали срезы до 7 мкм. После удаления воска в Histochoice (Sigma) и последовательной регидратации срез обрабатывали 20 мкг/мл протеиназы К, затем фиксировали в 4% формальдегиде в 1 PBS, ацетилировали в 0,5% уксусном ангидриде в 0,1 М триэтаноламин-HCl и дегидратировали серийно посредством этанола. Гибридизацию in situ выполняли в течение ночи при 42 С в гибридизационном буфере (50% формамида, 1 солей Na, 10% декстрансульфата, 1 раствора Denhardt, 1 мкг/мкл тРНК), с последующими тремя промываниями в 2 SSC в течение 1 ч каждое, при той же температуре. Инкубацию антитела и цветовое выявление ВМ пурпурной проводили в соответствии с инструкциями производителя (Roche Diagnostics), и предметные стекла были постоянно произведенными Crystal Mount (Sigma).(viii) Анализ последовательностей Филогенетический анализ выполняли с использованием набора Phylogenetic Interference Package(PHYLIP) 3.63. Выбирая модель РМВ в программе PROTDIST, рассчитывали матрицу белковой дистанции для предполагаемых последовательностей транспортера бора. Дерево строили с использованием соседнего примыкающего алгоритма и программы TreeView. Для оценки доверительных интервалов генерировали 100 образцов начальной нагрузки с использованием программы SEQBOOT, и дерево согласия по правилу большинства строили с помощью программы CONSENSE. Число трансмембранных спиралей в Bot1 (указанное в скобках) прогнозировали с использованием следующих пакетов программ прогнозаArabidopsis (Arabidopsis thaliana) имеет 7 генов, подобных Bot1, обозначенных BOR1-7, тогда как рис (Oryza sativa) имеет 4 прогнозированных генов, подобных Bot1, названных OsBOR1-4. Таблица 4. Bot1-подобные гены в Arabidopsis и рисе Сравнивали нуклеотидную и аминокислотную последовательности Bot1 ячменя, BOR1-7 Arabidopsis и OsBOR1-4 риса. Все выравнивания выполняли с использованием программного обеспечения AlignX(Vector NTI Suite 10: Informax, Bethesda, MD, USA). Определенные идентичности нуклеотидной и аминокислотной последовательности представлены ниже в табл. 5. Таблица 5. Идентичности последовательности Bot2-подобной и Bot1-подобной последовательностям Специалистам в данной области будет понятно, что описанное в данном описании изобретение может быть подвергнуто изменениям и модификациям, отличным от тех, которые раскрыты в описании. Следует понимать, что данное изобретение включает все такие изменения и модификации. Данное изобретение также включает все стадии, признаки, композиции и соединения, приведенные или указанные в настоящем описании, отдельно или совместно, и любую или все комбинации любых двух или более стадий или признаков. Также следует отметить, что, пока контекст не требует иного, используемые в настоящем описании формы единственного числа "некий", "некая" и "этот (эта)" включают аспекты множественного числа. Так, например, ссылка на "последовательность нуклеиновой кислоты Bot1" включает одиночную последовательность нуклеиновой кислоты Bot1, а также две или более последовательностей нуклеиновой кислоты Bot1; "растительная клетка" включает одиночную клетку, а также две или более клеток и так далее.
МПК / Метки
МПК: C12N 15/29, C07K 14/415
Метки: нуклеиновая, представляющий, транспортер, применение, полипептид, бора, кодирующая, кислота, собой
Код ссылки
<a href="https://eas.patents.su/30-18689-polipeptid-predstavlyayushhijj-sobojj-transporter-bora-kodiruyushhaya-ego-nukleinovaya-kislota-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Полипептид, представляющий собой транспортер бора, кодирующая его нуклеиновая кислота и их применение</a>
Предыдущий патент: Самосвал шахтный
Следующий патент: Нематоцидные композиции
Случайный патент: Фармацевтическая композиция, содержащая амлодипина бесилат и лизиноприла дигидрат, и способ её получения