Слитые конструкции и конъюгаты лекарственного средства
Номер патента: 18471
Опубликовано: 30.08.2013
Авторы: Жеспер Лоран, Хамилтон Брюс, Холт Люси Дж., Херринг Кристофер
Формула / Реферат
1. Композиция слитой конструкции или конъюгата, содержащая или состоящая из следующего: (а) лекарственное средство, выбранное из эксендинов, PYY (пептида YY), GLP (глюкагоноподобного пептида), ОХМ (окситомодулина), VIP (вазоактивного интестинального пептида) или РР (панкреатического полипептида), присутствующее в виде слитой конструкции или конъюгата с (б) однодоменным антителом (dAb) DOM 7h-14, которое связывает сывороточный альбумин и которое имеет аминокислотную последовательность, показанную на фиг. 1(h) (SEQ ID NO: 8).
2. Композиция по п.1, где лекарственным средством является молекула эксендина-4 или GLP-1 (глюкагоноподобного пептида 1).
3. Композиция по п.1 или 2, где лекарственное средство выбрано из (a) GLP-1 (7-37) A8G мутанта, который имеет аминокислотную последовательность, показанную на фиг. 1(i) (SEQ ID NO: 9), или (б) молекулы эксендина-4, которая имеет аминокислотную последовательность, показанную на фиг. 1(j) (SEQ ID NO: 10).
4. Композиция по любому из пп.1-3, которая содержит аминокислотный или химический линкер, соединяющий лекарственное средство и dAb.
5. Композиция по п.4, где аминокислотный линкер представляет собой спиральный линкер с аминокислотной последовательностью, показанной на фиг. 1(k) (SEQ ID NO: 11), или gly-ser-линкер с аминокислотной последовательностью, показанной на фиг. 1(l) (SEQ ID NO: 12).
6. Композиция по любому из пп.1-5, где лекарственное средство присутствует в качестве части слитой конструкции либо на N-конце, либо на С-конце dAb.
7. Композиция по п.6, которая содержит аминокислотную последовательность или состоит из аминокислотной последовательности, которая выбрана из следующего:
(а) слитая конструкция 2xGLP-1 A8G DOM7h-14 (DAT0114)

(б) слитая конструкция эксендин 4, (G4S)3-линкер, DOM7h-14 (DAT0115)

(в) слитая конструкция эксендин 4 DOM7h-14 (DAT0116)

(г) слитая конструкция эксендин 4, спиральный линкер, DOM7h-14 (DAT0117)

(д) слитая конструкция GLP-1 A8G, (G4S)3 линкер, DOM7h-14 (DAT0118)

(е) слитая конструкция GLP-1 A8G, PSS линкер, DOM7h-14 (DAT0119)
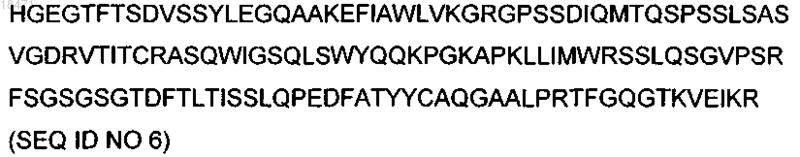
(ж) слитая конструкция GLP-1A8G, спиральный линкер, DOM7h-14 (DAT0120)

8. Композиция по любому из пп.1-7, где dAb дополнительно отформатировано для увеличения его гидродинамического размера посредством присоединения к dAb молекул(ы), выбранных(ой) из следующего: группа ПЭГ (полиэтиленгликоль), сывороточный альбумин, трансферрин, рецептор трансферрина или, по меньшей мере, его трансферринсвязывающий участок, Fc-область антитела, или посредством конъюгирования с доменом антитела.
9. Композиция по любому из пп.1-8, содержащая дополнительную пептидную или полипептидную группировку.
10. Композиция по любому из пп.1-9, содержащая дополнительные группировки dAb, которые имеют одинаковые или разные специфичности связывания с dAb Dom7h-14.
11. Композиция по любому из пп.1-10, имеющая период полувыведения из организма человека 12 ч или больше, например 12-21 день.
12. Композиция по любому из пп.1-11, которая связывает человеческий сывороточный альбумин с KD в диапазоне от примерно 5 мкмоль до примерно 1 пкмоль.
13. Фармацевтическая композиция, содержащая композицию по любому из пп.1-12 в комбинации с фармацевтически или физиологически приемлемым носителем, эксципиентом или разбавителем.
14. Фармацевтическая композиция по п.13, содержащая дополнительные терапевтические или активные агенты.
15. Композиция, содержащая (а) композицию по любому из пп.1-12 и (б) дополнительные терапевтические или активные агенты, для раздельного, последовательного или одновременного введения субъекту.
16. Композиция по любому из пп.1-15 для применения в лечении или предупреждении метаболического заболевания или расстройства.
17. Композиция по п.16, где заболевание или расстройство выбрано из гипергликемии, нарушенной толерантности к глюкозе, бета-клеточной недостаточности, диабета (диабета I или II типа или гестационного диабета), ожирения, заболеваний, характеризующихся перееданием.
18. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для лечения или предупреждения метаболического заболевания или расстройства.
19. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для доставки субъекту путем подкожной, внутривенной или внутримышечной инъекции.
20. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для парентеральной, пероральной, ректальной, трансмукозальной, глазной, легочной доставки или доставки через ЖК (желудочно-кишечный) тракт.
21. Способ лечения или предупреждения метаболического заболевания, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по любому из пп.1-15.
22. Пероральный, инъекционный, ингалируемый или распыляемый препарат, содержащий композицию по любому из пп.1-15.
23. Препарат с длительным высвобождением, например, в форме суппозитория, содержащий композицию по любому из пп.1-15.
24. Лиофильно высушенный препарат, содержащий композицию по любому из пп.1-15.
25. Выделенная или рекомбинантная нуклеиновая кислота, кодирующая композицию по любому из пп.1-7.
26. Нуклеиновая кислота, кодирующая композицию по п.7.
27. Вектор, содержащий нуклеиновую кислоту по п.25 или 26.
28. Клетка-хозяин, содержащая нуклеиновую кислоту по п.25 или 26 или вектор по п.27.
29. Способ получения слитого полипептида, содержащего или состоящего из следующего: (а) лекарственное средство, выбранное из эксендинов, PYY (пептида YY), GLP (глюкагоноподобного пептида), ОХМ (окситомодулина), VIP (вазоактивного интестинального пептида) или РР (панкреатического полипептида), присутствующее в виде слитой конструкции с (б) однодоменным антителом (dAb) DOM7h-14, которое связывает сывороточный альбумин и которое имеет аминокислотную последовательность, показанную на фиг. 1(h), включающий поддержание клетки-хозяина по п.28 в условиях, подходящих для экспрессии указанных нуклеиновой кислоты или вектора, в результате чего продуцируется слитый полипептид.
30. Способ лечения или предупреждения заболевания или расстройства, ассоциированного с повышенным содержанием глюкозы в крови у пациента, например пациента-человека, включающий введение указанному пациенту терапевтически или профилактически эффективного количества композиции по любому из пп.1-15.
31. Способ стимулирования продуцирования инсулина и/или увеличения чувствительности к инсулину у пациента, например пациента-человека, включающий введение указанному пациенту по меньшей мере одной дозы композиции по любому из пп.1-15.
Текст
Изобретение относится к слитым конструкциям лекарственного средства, обладающим улучшенными периодами полувыведения из сыворотки. Эти слитые конструкции и конъюгаты содержат полипептиды, единичные вариабельные домены иммуноглобулинов (антител) и молекулыGLP (глюкагоноподобного пептида) и/или эксендина. Изобретение также относится к применению,препаратам, композициям и устройствам, содержащим такие слитые конструкции и конъюгаты лекарственного средства.(71)(73) Заявитель и патентовладелец: ГЛАКСО ГРУП ЛИМИТЕД (GB) Настоящее изобретение относится к слитым конструкциям и конъюгатам лекарственного средства,обладающим улучшенными периодами полувыведения из сыворотки. Эти слитые конструкции и конъюгаты содержат единичные вариабельные домены иммуноглобулинов (антител) и молекулы GLP и/или эксендина. Изобретение также относится к применению, препаратам, композициям и устройствам, содержащим такие слитые конструкции и конъюгаты лекарственного средства. Предшествующий уровень техники Многие лекарственные средства, обладающие активностями, которые могли бы быть полезны для терапевтических и/или диагностических целей, имеют ограниченную ценность, поскольку они быстро выводятся из организма после введения. Например, многие полипептиды, обладающие терапевтически полезными активностями, быстро выводятся из кровотока через почки. Соответственно для достижения желаемого терапевтического эффекта должна быть введена большая доза. Существует потребность в улучшенных терапевтических и диагностических агентах, обладающих улучшенными фармакокинетическими свойствами. Одним из таких классов лекарственных средств, характеризующихся коротким периодом полувыведения из организма или системного кровотока, являются инкретиновые гормоны, такие как глюкагоноподобный пептид 1 (GLP) или пептид YY (PYY), а также эксендин, например эксендин-4. Глюкагоноподобный пептид (GLP)-1 представляет собой инкретиновый гормон, обладающий мощными глюкозозависимым инсулинотропным и глюкагоностатическим действиями, оказывающий трофические эффекты на -клетки поджелудочной железы и ингибирующие эффекты на желудочно-кишечную секрецию и моторику, совместно понижающие содержание глюкозы в плазме крови и ослабляющие гликемическую подвижность. Кроме того, благодаря своей способности усиливать чувство насыщения GLP1 снижает потребление пищи, ограничивая тем самым прирост массы, и может даже вызывать уменьшение массы. Взятые вместе, эти действия придают GLP-1 уникальный статус, считающийся весьма желательным для противодиабетического средства, в особенности ввиду глюкозозависимого характера его антигипергликемического действия, что должно свести к минимуму любой риск развития тяжелой гипогликемии. Однако фармакокинетический/фармакодинамический профиль таков, что природный GLP-1 не является терапевтически полезным. Так, в то время как GLP-1 является наиболее эффективным при непрерывном введении, единичные подкожные инъекции оказывают кратковременные эффекты. GLP-1 крайне чувствителен к ферментативному расщеплению in vivo и наиболее релевантным является расщепление под действием дипептидилпептидазы IV (DPP-IV), поскольку оно происходит быстро, и в результате образуется неинсулинотропный метаболит. Поэтому стратегии использования терапевтического потенциала GLP-1, основанные на понимании факторов, влияющих на его метаболическую стабильность и фармакокинетический/фармакодинамический профиль, находятся в центре интенсивных исследований. Проведена обширная работа с целью ингибирования пептидазы или модификации GLP-1 таким образом, чтобы замедлить его расщепление с сохранением при этом биологической активности. В WO 05/027978 описываются производные GLP-1, имеющие продолжительный профиль действия. В WO 02/46227 описываются гетерологичные слитые белки, содержащие полипептид (например, альбумин),слитый с GLP-1 или его аналогами (описание этих аналогов включено в данное описание посредством ссылки в качестве примеров аналогов GLP-1, которые могут быть использованы в настоящем изобретении). В WO 05/003296, WO 03/060071, WO 03/059934 описывается амино-слитый белок, в котором GLP1 слит с альбумином с целью увеличения периода полувыведения данного гормона. Однако, несмотря на эти усилия, GLP-1, активный в течение продолжительного периода времени,получен не был. В силу этого, особенно в отношении диабета и ожирения, существует огромная потребность в получении улучшенных пептидов GLP-1 или других агентов, таких как эксендин-4, которые аналогичным образом обладают инсулинотропным действием, пригодным для лечения диабета и ожирения, в частности. Таким образом, существует потребность в модификации GLP-1, эксендина-4 и других инсулинотропных пептидов для обеспечения более длительного периода действия in vivo при сохранении их низкой токсичности и терапевтических преимуществ. Краткое изложение сущности изобретения Согласно настоящему изобретению предложена композиция, которая представляет собой слитую конструкцию или конъюгат и которая содержит или состоит из следующего: (а) инсулинотропный(ая) агент или молекула либо лекарственное средство или молекула с инкретиновым эффектом, которыми могут быть, например, эксендин-4 или GLP-1, например A8G мутант GLP-1 (7-37), присутствующие в виде слитой конструкции или конъюгата с (б) однодоменным антителом (dAb) DOM 7h-14 (Vk), которое специфически связывает сывороточный альбумин (аминокислотная последовательность DOM 7h-14 показана на фиг. 1(h): SEQ ID NO: 8). Также, возможно, может присутствовать аминокислотный или химический линкер, соединяющий инсулинотропный агент или лекарственное средство с инкретиновым эффектом, например эксендин-4 и/или GLP-1, с dAb, например с DOM7h-14 dAb. Линкер может представлять собой, например, спиральный линкер, например спиральный линкер с последовательностью, показанной на фиг. 1(k): SEQ ID NO: 11, или он может представлять собой gly-ser-линкер, например, с аминокислотной последовательностью,-1 018471 показанной на фиг. 1(i): SEQ ID NO: 12. В некоторых воплощениях слитые конструкции (или конъюгаты) по изобретению могут содержать дополнительные молекулы, например дополнительные пептиды или полипептиды. Инсулинотропный агент или лекарственное средство с инкретиновым эффектом (например, эксендин и/или GLP-1) могут присутствовать в виде конструкции, слитой с N-концом или С-концом dAb (или конъюгата). В некоторых воплощениях изобретения предложен полипептид, содержащий слитую молекулу или состоящий из молекулы, которая выбрана из следующего:(а) слитая конструкция 2GLP-1 (7-37) A8G DOM7h-14 dAb (DAT0114, аминокислотная последовательность показана на фиг. 1(а): SEQ ID NO: 1),(б) слитая конструкция эксендин-4 (G4S-линкер)3 DOM7h-14 dAb (DAT0115, аминокислотная последовательность показана на фиг. 1(b): SEQ ID NO: 2),(в) слитая конструкция эксендин-4 DOM7h-14 dAb (DAT0116, аминокислотная последовательность показана на фиг. 1(с): SEQ ID NO: 3),(г) слитая конструкция эксендин-4, спиральный линкер, DOM7h-14 dAb (DAT0117, аминокислотная последовательность показана на фиг. 1(d): SEQ ID NO: 4),(д) слитая конструкция GLP-1 (7-37) A8G (G4S-линкер)3 DOM7h-14 dAb (DAT0118, аминокислотная последовательность показана на фиг. 1(е): SEQ ID NO: 5),(е) слитая конструкция GLP-1 (7-37) A8G DOM7h-14 dAb (DAT0119, аминокислотная последовательность показана на фиг. 1(f): SEQ ID NO: 6),(ж) слитая конструкция GLP-1 (7-37) A8G, спиральный линкер, DOM7h-14 dAb (DAT0120, аминокислотная последовательность показана на фиг. 1(g): SEQ ID NO: 7). Кроме того, согласно изобретению предложены конъюгированные молекулы, содержащие аминокислотные последовательности из числа описанных выше, то есть молекулы с аминокислотными последовательностями, показанными на SEQ ID NO: 1-7, или состоящие из них.DOM7h-14 представляет собой единичный вариабельный домен иммуноглобулина человека, илиdAb (Vk), который связывает сывороточный альбумин, и его аминокислотная последовательность показана на фиг. 1(h): SEQ ID NO: 8. CDR-участки DOM7h-14 dAb подчеркнуты в аминокислотной последовательности, показанной на фиг. 1(h): SEQ ID NO: 8. Как использовано в данном описании, "слитая конструкция" относится к слитому белку, содержащему в качестве первой группировки DOM7h-14 dAb, которое связывает сывороточный альбумин, и в качестве второй группировки инсулинотропный агент или лекарственное средство с инкретиновым эффектом. dAb, которое связывает сывороточный альбумин, и лекарственное средство или агент присутствуют в виде отдельных частей (группировок) единой непрерывной полипептидной цепи. Первая (dAb) и вторая (лекарственное средство с инкретиновым эффектом или инсулинотропный агент) группировки могут быть напрямую связаны друг с другом пептидной связью или соединены через подходящий аминокислотный либо пептидный или полипептидный линкер. При необходимости могут присутствовать дополнительные группировки, например пептиды или полипептиды (например, третий, четвертый),и/или линкерные последовательности. Первая группировка может находиться в N-концевом положении,С-концевом положении или внутри по отношению ко второй группировке. В некоторых воплощениях слитый белок содержит одну или более чем одну (например, от одной до примерно 20) группировку dAb. Как использовано в данном описании, "конъюгат" относится к композиции, содержащей dAb, связывающее сывороточный альбумин, к которому присоединен(о) ковалентной или нековалентной связью инсулинотропный агент или лекарственное средство с инкретиновым эффектом. Инсулинотропный агент или лекарственное средство с инкретиновым эффектом могут быть ковалентно связаны с dAb напрямую или опосредованно через подходящую линкерную группировку. Лекарственное средство или агент могут быть связаны с dAb в любом подходящем положении, таком как аминоконец, карбоксильный конец или через подходящие боковые цепи аминокислот (например, -аминогруппу лизина или тиольную группу цистеина). Альтернативно, лекарственное средство или агент могут быть нековалентно связаны с dAb напрямую (например, в результате электростатического взаимодействия, гидрофобного взаимодействия) или опосредованно (например, в результате нековалентного связывания между партнерами по комплементарному связыванию (например, биотин и авидин), при этом один из партнеров ковалентно связан с лекарственным средством или агентом, а партнер по комплементарному связыванию ковалентно связан сdAb). Кроме того, согласно изобретению предложен (по существу) чистый мономер любого из конъюгатов или любой из слитых конструкций по изобретению, например DAT0114, DAT0115, DAT0116,DAT0117, DAT0118, DAT0119 и DAT0120. В одном из воплощений он представляет собой по меньшей мере на 98, 99, 99,5% чистый или на 100% чистый мономер. Согласно изобретению также предложены нуклеиновые кислоты, кодирующие слитые конструкции, раскрытые в данном описании, например нуклеиновые кислоты, кодирующие DAT0114, DAT0115,DAT0116, DAT0117, DAT0118, DAT0119 и DAT0120 и, например, нуклеиновокислотные последователь-2 018471 ности которых показаны на фиг. 2 (SEQ ID NO: 13-23). Также предложены клетки-хозяева, содержащие эти нуклеиновые кислоты. Кроме того, согласно изобретению предложен способ получения слитой конструкции по настоящему изобретению, включающий поддержание клетки-хозяина, которая содержит рекомбинантную нуклеиновую кислоту и/или конструкцию, кодирующую слитую конструкцию по изобретению, в условиях,подходящих для экспрессии указанной рекомбинантной нуклеиновой кислоты, в результате чего продуцируется слитая конструкция. Согласно изобретению также предложены композиции (например, фармацевтические композиции),содержащие слитую конструкцию или конъюгат по изобретению. Согласно изобретению также предложен способ лечения индивидуума, имеющего такое заболевание или расстройство, как раскрыто в данном описании, например метаболическое заболевание, такое как гипергликемия, нарушенная толерантность к глюкозе, бета-клеточная недостаточность, диабет (например, диабет 1-го типа или 2-го типа или гестационный диабет) или ожирение, или заболевания, характеризующиеся перееданием, например, его можно применять для подавления аппетита, например,при синдроме Прадера-Вилли, и который включает введение указанному индивидууму терапевтически эффективного количества слитой конструкции или конъюгата по изобретению. Другие метаболические расстройства включают, но не ограничиваются этим, инсулинорезистентность, инсулиновую недостаточность, гиперинсулинемию, гипергликемию, дислипидемию, гиперлипидемию, гиперкетонемию, гипертензию, ишемическую болезнь сердца, атеросклероз, почечную недостаточность, невропатию (например, автономную невропатию, парасимпатическую невропатию и полиневропатию), ретинопатию, катаракты, метаболические расстройства (например, нарушения метаболизма инсулина и/или глюкозы), эндокринные расстройства, ожирение, уменьшение массы, расстройства печени (например, болезнь печени, цирроз печени и расстройства, ассоциированные с трансплантацией печени) и состояния, ассоциированные с этими заболеваниями или расстройствами. Кроме того, состояния, ассоциированные с диабетом, которые могут быть предупреждены или подвергнуты лечению соединениями по настоящему изобретению, включают, но не ограничиваются этим,гипергликемию, ожирение, диабетическую ретинопатию, мононевропатию, полиневропатию, атеросклероз, язвы, болезнь сердца, инсульт, анемию, гангрену (например, ног и рук), импотенцию, инфекцию,катаракту, ослабленную функцию почек, нарушенное функционирование автономной нервной системы,нарушенную функцию лейкоцитов, запястный синдром, контрактуру Дюпюитрена и диабетический кетоацидоз. Согласно изобретению также предложены способы лечения или предупреждения заболеваний, ассоциированных с повышенным содержанием глюкозы в крови, включающие введение по меньшей мере одной дозы слитых конструкций или конъюгатов и/или фармацевтических композиций по настоящему изобретению пациенту или субъекту. Кроме того, изобретение относится к способам регулирования чувствительности к инсулину у пациента, а также способам увеличения захвата глюкозы клеткой и способам регулирования чувствительности клетки к инсулину с использованием конъюгатов или слитых конструкций по изобретению. Также предложены способы стимулирования синтеза и высвобождения инсулина, повышения чувствительности жировой, мышечной или печеночной ткани в отношении захвата инсулина, стимулирования захвата глюкозы, замедления процесса переваривания пищи или блокирования секреции глюкагона у пациента,включающие введение указанному пациенту слитой конструкции или конъюгата по изобретению, например включающие введение по меньшей мере одной дозы лекарственного конъюгата или слитой конструкции и/или фармацевтической композиции по настоящему изобретению. Слитые конструкции или конъюгаты и/или фармацевтические композиции по изобретению могут быть введены сами по себе или в комбинации с другими молекулами или группировками, например полипептидами, терапевтическими белками и/или молекулами (например, инсулином и/или другими белками (включая антитела, пептидами или небольшими молекулами, которые регулируют чувствительность к инсулину, массу, болезнь сердца, гипертензию, невропатию, клеточный метаболизм и/или уровни глюкозы, инсулина или других гормонов у пациента. В конкретных воплощениях конъюгаты или слитые конструкции по изобретению вводят в комбинации с инсулином (или производным инсулина, аналогом, слитым белком или средством, усиливающим секрецию инсулина). Согласно изобретению также предложено применение конъюгата или слитой конструкции по изобретению для изготовления лекарственного средства для лечения заболевания или расстройства, например, любого из упомянутых выше, например метаболического расстройства, такого как гипергликемия,диабет (диабет 1-го или 2-го типа или гестационный диабет) или ожирение. Изобретение также относится к применению слитой конструкции или конъюгата, как они раскрыты в данном описании, для использования в терапии, диагностике или профилактике. Слитые конструкции или конъюгаты по изобретению, например dAb компонент слитой конструкции, далее могут быть представлены в формате с большим гидродинамическим размером для дополнительного увеличения периода полувыведения, например, посредством присоединения группы ПЭГ (полиэтиленгликоля), сывороточного альбумина, трансферрина, рецептора трансферрина или, по меньшей мере, его трансферринсвязывающей части, Fc-области антитела, или посредством конъюгирования с доменом антитела. Например, dAb, которое связывает сывороточный альбумин, может быть переведено в формат большего по размеру антигенсвязывающего фрагмента антитела (например, переведено в форматFab, Fab', F(ab)2, F(ab')2, IgG, scFv). В других воплощениях изобретения, изложенных на протяжении всего данного описания, вместо использования "dAb" в слитой конструкции по изобретению предполагается, что квалифицированный специалист может использовать домен, который содержит CDR из dAb, например CDR из Dom7h-14,связывающий сывороточный альбумин (например, CDR, "привитый" на подходящий белковый каркас или остов, например аффитело, каркас SpA (белок A Staphylococcus aureus), домен класса А рецепторовLDL (липопротеины низкой плотности) или домен EGF (эпидермального фактора роста). Соответственно данное описание в целом следует истолковывать в отношении описания таких доменов вместо dAb. В некоторых воплощениях изобретения предложены слитая конструкция или конъюгат по изобретению, которые содержат инсулинотропный агент или лекарственное средство с инкретиновым эффектом и лиганд с двойной специфичностью или лиганд с множественной специфичностью, содержащие первое dAb по изобретению, которое связывает сывороточный альбумин, например Dom7h-14, и второеdAb, которое имеет такую же или другую специфичность связывания по сравнению с первым dAb и возможно, в случае лигандов с множественной специфичностью, дополнительные dAb. Второе dAb (или дополнительные dAb) возможно может(гут) связываться с другой мишенью, например мишенью FgFr 1c или CD5. Таким образом, в одном из аспектов изобретения предложены слитые конструкции или конъюгаты по изобретению для доставки посредством парентерального введения, например, путем подкожной,внутримышечной или внутривенной инъекций, ингаляции, назальной доставки, трансмукозальной доставки, пероральной доставки, доставки в ЖК (желудочно-кишечный) тракт пациента, ректальной доставки или глазной доставки. В одном из аспектов изобретения предложено применение слитых конструкций или конъюгатов по изобретению в изготовлении лекарственного средства для доставки посредством подкожной инъекции, ингаляции, внутривенной доставки, назальной доставки, трансмукозальной доставки,пероральной доставки, доставки в ЖК тракт пациента, ректальной доставки или глазной доставки. В одном из аспектов изобретения предложен способ доставки пациенту посредством подкожной инъекции, легочной доставки, внутривенной доставки, назальной доставки, трансмукозальной доставки,пероральной доставки, доставки в ЖК тракт пациента, ректальной или глазной доставки, включающий введение пациенту фармацевтически эффективного количества слитой конструкции или конъюгата по изобретению. В одном из аспектов изобретения предложен пероральный, инъекционный, ингалируемый, распыляемый или глазной препарат, содержащий слитую конструкцию или конъюгат по изобретению. Такой препарат может представлять собой таблетку, пилюлю, капсулу, жидкость или сироп. В одном из аспектов композиции могут быть введены перорально, например в виде напитка, например, продаваемого в качестве напитка для уменьшения массы для лечения ожирения. В одном из аспектов изобретения предложен препарат для ректальной доставки пациенту, где этот препарат может быть представлен, например, в виде суппозитория. Композиция для парентерального введения GLP-1-содержащего соединения может быть изготовлена, например, как описано в WO 03/002136 (включенной в данное описание посредством ссылки). Композиция для назального введения некоторых пептидов может быть изготовлена, например, как описано в европейском патенте 272097 (принадлежащем Novo Nordisk A/S) или в WO 93/18785 (все это включено в данное описание посредством ссылки). Термин "субъект" или "индивидуум" определен в данном описании как включающий таких животных, как млекопитающие, в том числе, но этим не ограничиваясь, приматы (например, люди), крупный рогатый скот, овцы, козы, лошади, собаки, кошки, кролики, морские свинки, крысы, мыши или другие виды жвачных животных, овец, лошадей, псовых, кошачьих, грызунов или мышей. Согласно изобретению также предложен набор для применения при введении композиций по изобретению (например, конъюгатов или слитых конструкций по изобретению) субъекту (например, пациенту), содержащий композицию (например, конъюгат или слитую конструкцию по изобретению), устройство доставки лекарственного средства и, возможно, инструкции по применению. Композиция (например, конъюгат или слитая конструкция) может быть представлена в виде препарата, такого как лиофилизированный препарат. В некоторых воплощениях устройство доставки лекарственного средства выбрано из группы, состоящей из шприца, ингалятора, устройства для интраназального или глазного введения (например, капельницы с насадкой для мелкокапельного введения, пипетки для глаз или носа) и безыгольного инъекционного устройства. Композиции (например, конъюгаты или слитые конструкции) по данному изобретению могут быть лиофилизированы с целью хранения и повторного разведения в подходящем носителе перед применением. Можно использовать любой подходящий метод лиофилизации (например, распылительную сушку,сушку в слое) и/или любые подходящие методики повторного разведения. Специалистам в данной области техники будет очевидно, что лиофилизация и повторное разведе-4 018471 ние могут приводить к потере антителами активности в различной степени и что используемые уровни,возможно, следует подводить с целью компенсации. В конкретном воплощении изобретения предложена композиция, содержащая лиофилизированную (подвергнутую сублимационной сушке) композицию (например, конъюгат лекарственного средства, слитую конструкцию лекарственного средства), которая раскрыта в данном описании. Предпочтительно лиофилизированная (подвергнутая сублимационной сушке) композиция (например, конъюгат лекарственного средства, слитая конструкция лекарственного средства) теряет не более чем примерно 20%, или не более чем примерно 25%, или не более чем примерно 30%,или не более чем примерно 35%, или не более чем примерно 40%, или не более чем примерно 45%, или не более чем примерно 50% своей активности (например, связывающей активности в отношении сывороточного альбумина), когда ее подвергают регидратированию. Активность соответствует количеству композиции (например, конъюгата лекарственного средства, слитой конструкции лекарственного средства), необходимому для получения эффекта этой композиции до того, как она была подвергнута лиофилизации. Например, количеству конъюгата или слитой конструкции, необходимому для достижения и поддержания желаемой концентрации в сыворотке в течение желаемого периода времени. Активность композиции (например, конъюгата лекарственного средства, слитой конструкции лекарственного средства) можно определить, используя любой подходящий метод перед лиофилизацией, и активность можно определить, используя тот же метод после регидратации для определения количества потерянной активности. Согласно изобретению также предложены препараты с непрерывным высвобождением, содержащие слитые конструкции или конъюгаты по изобретению, причем такие препараты с непрерывным высвобождением могут содержать слитую конструкцию или конъюгат по изобретению в комбинации, например, с гиалуроновой кислотой, микросферами или липосомами и другими фармацевтически или фармакологически приемлемыми носителями, эксципиентами и/или разбавителями. Такие препараты с непрерывным высвобождением могут быть в форме, например, суппозиториев. В одном из аспектов изобретения предложена фармацевтическая композиция, содержащая слитую конструкцию или конъюгат по изобретению и фармацевтически или физиологически приемлемый носитель, эксципиент или разбавитель. Краткое описание чертежей Фиг. 1 представляет аминокислотные последовательности: (a) DAT0114 (SEQ ID NO: 1), (b)ID NO: 20), (i) DAT0119 (конструкция для млекопитающих) (SEQ ID NO: 21), (j) DAT0120 (конструкция для млекопитающих) (SEQ ID NO: 22), (k) Dom7h-14 (SEQ ID NO: 23). На фиг. 3(а) показано дозозависимое уменьшение массы тела в мышиной модели ожирения в результате введения DAT0115; (b) показано суточное потребление пищи в мышиной модели ожирения в результате введения DAT0115. На фиг. 4 показаны результаты DSC (дифференциальной сканирующей калориметрии) дляDAT0115: сплошная линия - кривая для DAT0115, пунктирная линия - подгонка к модели "non-2-state". На фиг. 5 показаны результаты DSC для лизоцима: сплошная линия - кривая для лизоцима, пунктирная линия - подгонка к модели "non-2-state" (кривые перекрываются, поэтому пунктирную кривую увидеть невозможно). На фиг. 6 показаны результаты SEC-MALLS (стерической эксклюзионной хроматографии/многоуглового лазерного светорассеяния) для DAT0115 (Mw - средневзвешенная молекулярная масса; Mn - среднечисленная молекулярная масса; Mz - "z-средняя" молекулярная масса). На фиг. 7 показаны результаты SEC-MALLS для DAT0117. На фиг. 8 показаны результаты SEC-MALLS для DAT0120. Подробное описание изобретения Данное изобретение раскрыто до известной степени в рамках этого описания со ссылкой на воплощения, что делает возможным составление ясного и четкого описания. Предполагается и должно быть очевидным, что данные воплощения можно различным образом комбинировать или разделять, не выходя за рамки изобретения. Если не указано иное, все технические и научные термины, применяемые в настоящем описании,используют то же значение, какое обычно понимается средним специалистом в данной области техникиWileySons, Inc., которые включены в данное описание посредством ссылки), и химических методов используют стандартные методики. Термин "инсулинотропный агент", как он использован в данном описании, означает соединение,которое способно стимулировать или вызывать стимуляцию синтеза или экспрессии либо активности гормона инсулина. Известные примеры инсулинотропных агентов включают, например, глюкозу, GIP(глюкозозависимый инсулинотропный полипептид), GLP, эксендин (например, эксендин-4 и эксендин 3), PYY и ОХМ (окситомодулин), но не ограничиваются этим. Термин "инкретин", как он использован в данном описании, означает тип желудочно-кишечного гормона, который вызывает увеличение количества инсулина, высвобожденного, когда уровни глюкозы находятся в норме или, в особенности, когда они повышены. Примеры включают GLP-1, GIP, ОХМ,PYY, VIP (вазоактивный интестинальный пептид) и РР (панкреатический полипептид). Термин "аналог", как он использован в данном описании в отношении полипептида, означает модифицированный пептид, где один или более аминокислотных остатков пептида заменены на другие аминокислотные остатки, и/или где один или более аминокислотных остатков делетированы из пептида,и/или где один или более аминокислотных остатков добавлены к пептиду. Такие вставка или делеция аминокислотных остатков могут происходить на N-конце пептида и/или на С-конце пептида или они могут быть внутри пептида. Для описания аналогов GLP-1 используют простую систему: например,GLP-1 A8G (аминокислоты 7-37) обозначает аналог GLP-1, в котором природный аланин в положении 8 заменен на остаток глицина. Формулы пептидных аналогов и производных изображают, используя стандартное однобуквенное обозначение для аминокислот, применяемое в соответствии с номенклатуройIUPAC-IUB (Международный союз теоретической и прикладной химии/Международный биохимический союз). Как он использован в данном описании, термин "фрагмент", когда его используют в отношении полипептида, представляет собой полипептид, имеющий аминокислотную последовательность, которая является такой же, как часть, но не вся аминокислотная последовательность целого природного полипептида. Фрагменты могут быть "автономными" или могут содержаться внутри большего по размеру полипептида, где они образуют часть или область в виде единой непрерывной области в едином большем по размеру полипептиде. В качестве примера фрагмент существующего в природе GLP-1 будет включать аминокислоты 7-36 природных аминокислот 1-36. Кроме того, фрагменты полипептида также могут представлять собой варианты природной частичной последовательности. Например, фрагмент GLP-1,содержащий аминокислоты 7-30 природного GLP-1, также может представлять собой вариант, имеющий аминокислотные замены внутри его частичной последовательности. Примеры подходящих инсулинотропных агентов по изобретению включают GLP-1, производныеGLP-1, аналоги GLP-1 или производное аналога GLP-1. В дополнение к этому они включают эксендин-4,аналоги эксендина-4 и производные или фрагменты эксендина-4 и эксендин-3, производные эксендина-3 и аналоги эксендина-3. Термин "GLP-1", как он использован в данном описании, означает GLP-1 (7-37), GLP-1 (7-36), GLP1 (7-35), GLP-1 (7-38), GLP-1 (7-39), GLP-1 (7-40), GLP-1 (7-41), аналог GLP-1, пептид GLP-1, производное или мутант GLP-1 или фрагмент или производное аналога GLP-1. Такие пептиды, мутанты, аналоги и производные представляют собой инсулинотропные агенты. Например, GLP-1 может представлять собой A8G мутант GLP-1 (7-37) с аминокислотной последовательностью, показанной на фиг. 1(i): SEQ ID NO: 9. Другие аналоги GLP-1 описаны в международной заявке на патент 90/11296 (The General HospitalCorporation), которая относится к пептидным фрагментам, содержащим GLP-1 (7-36) и его функциональные производные и обладающим инсулинотропной активностью, превышающей инсулинотропную активность GLP-1 (1-36) или GLP-1 (1-37), и к их применению в качестве инсулинотропных агентов (включена в данное описание посредством ссылки, в частности, путем предоставления примеров лекарственных средств для применения в настоящем изобретении). В международной заявке на патентWO 91/11457 (Buckley et al.) описываются аналоги активных пептидов 7-34, 7-35, 7-36 и 7-37 GLP1, которые также могут быть полезны в качестве GLP-1-содержащих лекарственных средств по настоящему изобретению (включена в данное описание посредством ссылки, в частности, путем предоставления примеров лекарственных средств или агентов для применения в настоящем изобретении). Термин "пептид эксендин-4", как он использован в данном описании, означает эксендин-4 (1-39),аналог эксендина-4, фрагмент пептида эксендина-4, производное эксендина-4 или производное аналога эксендина-4. Такие пептиды, фрагменты, аналоги и производные представляют собой инсулинотропные агенты. Аминокислотная последовательность эксендина-4 (1-39) показана на фиг. 1(j): SEQ ID NO: 10. Другие аналоги эксендина, которые полезны для настоящего изобретения, описаны в РСТ публикациях патентов WO 99/25728 (Beeley et al.), WO 99/25727 (Beeley et al.), WO 98/05351 (Young et al.), WO 99/40788 (Young et al.), WO 99/07404 (Beeley et al.) и WO 99/43708 (Knudsen et al.) (все они включены в данное описание посредством ссылки, в частности, путем предоставления примеров лекарственных средств для применения в настоящем изобретении). Как использовано в данном описании, "пептид" относится к аминокислотам в количестве от примерно двух до примерно 50, соединенным вместе посредством пептидных связей. Как использовано в данном описании, "полипептид" относится по меньшей мере к примерно 50 аминокислотам, соединенным вместе посредством пептидных связей. В большинстве случаев полипептиды имеют третичную структуру и свернуты в функциональные домены. Как использовано в данном описании, "дисплейная система" относится к системе, в которой коллекция полипептидов или пептидов доступна для селекции на основании желаемой характеристики, такой как физическая, химическая или функциональная характеристика. Дисплейная система может представлять собой подходящий репертуар полипептидов или пептидов (например, в растворе, иммобилизованный на подходящей подложке). Дисплейная система также может представлять собой систему, которая использует клеточную экспрессирующую систему (например, экспрессию библиотеки нуклеиновых кислот, например, в трансформированных, инфицированных, трансфицированных или трансдуцированных клетках, и экспонирование кодируемых полипептидов на поверхности этих клеток) или неклеточную экспрессирующую систему (например, компартментализацию с использованием эмульсии и дисплей). Типичные дисплейные системы связывают кодирующую функцию нуклеиновой кислоты и физические, химические и/или функциональные характеристики полипептида или пептида, кодируемого данной нуклеиновой кислотой. В случае использования такой дисплейной системы могут быть отобраны полипептиды или пептиды, имеющие желаемую физическую, химическую и/или функциональную характеристику, а нуклеиновая кислота, кодирующая выбранный полипептид или пептид, легко может быть выделена или извлечена. В данной области техники известен ряд дисплейных систем, которые связывают кодирующую функцию нуклеиновой кислоты и физические, химические и/или функциональные характеристики полипептида или пептида, например дисплей на основе бактериофагов (фаговый дисплей, например фагмидный дисплей), рибосомный дисплей, компартментализация с использованием эмульсии и дисплей, дисплей на основе дрожжевых клеток, дисплей с использованием пуромицина, дисплей на основе бактерий, дисплей на плазмиде, ковалентный дисплей и тому подобное (см., например,ЕР 0436597 (Dyax), патент США 6172197 (McCafferty et al.), патент США 6489103 (Griffiths et al Как использовано в данном описании, термин "функциональный" описывает полипептид или пептид, обладающий биологической активностью, такой как специфическая связывающая активность. Например, термин "функциональный полипептид" включает в себя антитело или его антигенсвязывающий фрагмент, который связывается с целевым антигеном посредством своего антигенсвязывающего сайта. Как использовано в данном описании, "целевой лиганд" относится к лиганду, который специфически или селективно связывается полипептидом или пептидом. Например, если полипептид представляетсобой антитело или его антигенсвязывающий фрагмент, то целевым лигандом может быть любой желаемый антиген или эпитоп. Связывание с целевым антигеном зависит от функциональности данного полипептида или пептида. Как использовано в данном описании, "антитело" относится к IgG, IgM, IgA, IgD или IgE или фрагменту (такому как Fab, F(ab')2, Fv, связанный дисульфидной связью Fv, scFv, полиспецифическое антитело с закрытой конформацией, связанный дисульфидной связью scFv, диатело), независимо от того,происходят ли они из какого-либо вида естественным образом продуцируемого антитела или созданы с использованием технологии рекомбинантной ДНК; независимо от того, выделены ли они из сыворотки крови, В-клеток, гибридом, трансфектом, дрожжей или бактерий. Как использовано в данном описании, "формат антитела" относится к любой подходящей полипептидной структуре, в которую могут быть инкорпорированы один или более вариабельных доменов антитела с тем, чтобы придать данной структуре специфичность связывания с антигеном. В данной области техники известен ряд подходящих форматов антител, таких как химерные антитела, гуманизированные антитела, человеческие антитела, одноцепочечные антитела, биспецифические антитела, тяжелые цепи антител, легкие цепи антител, гомодимеры и гетеродимеры тяжелых цепей и/или легких цепей антител,антигенсвязывающие фрагменты любого из перечисленного выше (например, Fv-фрагмент (например,одноцепочечный Fv (scFv), связанный дисульфидной связью Fv), Fab-фрагмент, Fab'-фрагмент, F(ab')2 фрагмент), единичный вариабельный домен антитела (например, dAb, VH, VHH, VL) и модифицированные версии любого из перечисленного выше (например, модифицированные посредством ковалентного присоединения полиэтиленгликоля или другого подходящего полимера или гуманизированные VHH). Фраза "иммуноглобулиновый единичный вариабельный домен" относится к вариабельному домену антитела (VH, VHH, VL), специфически связывающемуся с антигеном или эпитопом независимо от другихV-областей или доменов. Иммуноглобулиновый единичный вариабельный домен может быть представлен в формате (например, гомо- или гетеромультимер) с другими вариабельными областями или вариабельными доменами, где другие области или домены не требуются для связывания антигена с единичным иммуноглобулиновым вариабельным доменом (т.е. когда иммуноглобулиновый единичный вариабельный домен связывается с антигеном независимо от дополнительных вариабельных доменов). "Одно-7 018471 доменное антитело" или "dAb" представляет собой то же, что и "иммуноглобулиновый единичный вариабельный домен", как этот термин используется в данном описании. "Единичный иммуноглобулиновый вариабельный домен" представляет собой то же, что и "иммуноглобулиновый единичный вариабельный домен", как этот термин используется в данном описании. "Единичный вариабельный домен антитела" представляет собой то же, что и "иммуноглобулиновый единичный вариабельный домен", как этот термин используется в данном описании. Иммуноглобулиновый единичный вариабельный домен в одном из воплощений представляет собой вариабельный домен антитела человека, но также включает единичные вариабельные домены антител из других видов, как, например, VHH dAb грызунов (например,как описано в WO 00/29004, содержание которой включено в данное описание во всей своей полноте посредством ссылки), усатых акул и верблюдов. Верблюжьи VHH представляют собой полипептиды иммуноглобулинового единичного вариабельного домена, происходящие из видов, включающих верблюда,ламу, альпаку, дромедара и гуанако, которые продуцируют состоящие из тяжелых цепей антитела, по своей природе лишенные легких цепей. VHH может быть гуманизирован."Домен" представляет собой свернутую белковую структуру, сохраняющую свою третичную структуру независимо от остальной части белка. В большинстве случаев домены ответственны за отдельные функциональные свойства белков и во многих случаях могут быть добавлены, удалены или перенесены в другие белки без потери функции оставшейся части белка и/или домена. "Единичный вариабельный домен антитела" представляет собой свернутый полипептидный домен, содержащий последовательности,характерные для вариабельных доменов антител. Следовательно, он включает полные вариабельные домены антител и модифицированные вариабельные домены, например, в которых одна или более петель заменены на последовательности, нехарактерные для вариабельных доменов антител, или вариабельные домены антител, которые укорочены или содержат N- или С-концевые удлиняющие сегменты, а также свернутые фрагменты вариабельных доменов, которые сохраняют, по меньшей мере частично, связывающую активность и специфичность полноразмерного домена. Термин "библиотека" относится к смеси гетерогенных полипептидов или нуклеиновых кислот. Библиотека состоит из членов, каждый из которых имеет отдельную полипептидную или нуклеиновокислотную последовательность. До некоторой степени "библиотека" является синонимом "репертуару". Различия в последовательностях среди членов библиотеки ответственны за разнообразие, представленное в этой библиотеке. Библиотека может принимать форму простой смеси полипептидов или нуклеиновых кислот или может быть в форме микроорганизмов или клеток, например бактерий, вирусов, клеток животных и растений и т.п., трансформированных с использованием библиотеки нуклеиновых кислот. В одном из воплощений каждый индивидуальный микроорганизм или клетка содержит только один член библиотеки или ограниченное их количество. В одном из воплощений нуклеиновые кислоты инкорпорированы в экспрессирующие векторы для того, чтобы способствовать экспрессии полипептидов, кодируемых данными нуклеиновыми кислотами. Следовательно, в одном аспекте библиотека может принимать форму популяции микроорганизмов хозяина, при этом каждый микроорганизм содержит одну или более копий экспрессирующего вектора, содержащего единичный член библиотеки в форме нуклеиновой кислоты, которая может быть экспрессирована с целью получения соответствующего ей полипептидного члена. Таким образом, популяция микроорганизмов хозяина имеет возможность кодировать большой репертуар различающихся полипептидов. Как использовано в данном описании, термин "доза" относится к количеству слитой конструкции или конъюгата, вводимому субъекту полностью за один раз (стандартная доза) или посредством двух или более введений в течение определенного временного интервала. Например, доза может обозначать количество слитой конструкции или конъюгата, вводимое субъекту курсом, продолжающимся в течение одних суток (24 ч) (суточная доза), двух суток, одной недели, двух недель, трех недель или одного или более месяцев (например, путем однократного введения или путем двух или более введений). Интервал между дозами может быть равен любому желаемому количеству времени. Фраза "период полувыведения" относится ко времени, необходимому для уменьшения концентрации слитой конструкции или конъюгата в сыворотке или плазме крови на 50% in vivo, например, вследствие разрушения и/или выведения или удаления под действием природных механизмов. В результате связывания с молекулами сывороточного альбумина, например сывороточного альбумина человека(HSA), что препятствует разрушению и/или выведению или удалению, слитые конструкции или конъюгаты по изобретению стабилизируются in vivo, и их период полувыведения увеличивается. Эти молекулы сывороточного альбумина представляют собой природные белки, которые сами имеют длительный период полувыведения in vivo. Период полувыведения молекулы увеличивается, если ее функциональная активность продолжает сохраняться in vivo в течение более длительного периода времени по сравнению с похожей молекулой, которая не обладает специфичностью к молекуле, увеличивающей период полувыведения. Например, слитая конструкция или конъюгат по изобретению, содержащие dAb, специфичное к сывороточному альбумину человека (HSA), и лекарственное средство с инкретиновым эффектом или инсулинотропный агент, такой как GLP-1 или эксендин, сравнивают с тем же самым лигандом, где специфичность к HSA не присутствует, то есть который не связывается с HSA, а связывается с другой молекулой. Например, он может связываться с третьей мишенью на данной клетке. Обычно период по-8 018471 лувыведения увеличивается на 10, 20, 30, 40, 50% или более. Возможны увеличения периода полувыведения в диапазоне 2, 3, 4, 5, 10, 20, 30, 40, 50 или более. Альтернативно или в дополнение к этому, возможны увеличения периода полувыведения в диапазоне до 30, 40, 50, 60, 70, 80, 90,100, 150 включительно. Как использовано в данном описании, "гидродинамический размер" относится к кажущемуся размеру молекулы (например, белковой молекулы, лиганда), основанному на диффузии молекулы через водный раствор. Можно провести анализ диффузии или движения белка через раствор для выявления кажущегося размера белка, который задается "радиусом Стокса" или "гидродинамическим радиусом" белковой частицы. "Гидродинамический размер" белка зависит как от массы, так и формы (конформации), так что два белка, имеющие одну и ту же молекулярную массу, могут иметь различные гидродинамические размеры, если исходить из общей конформации белка. Вычисления "гомологии" или "идентичности" либо "сходства" между двумя последовательностями(эти термины используются в данном описании взаимозаменяемо) выполняют следующим образом. Последовательности выравнивают в целях оптимального сравнения (например, могут быть введены разрывы в одну или обе первую и вторую аминокислотную или нуклеиновокислотную последовательность для оптимального выравнивания, а негомологичными последовательностями можно пренебречь для сравнительных целей). В одном воплощении длина сравниваемой последовательности, выравненной для сравнительных целей, равна по меньшей мере 30%, или по меньшей мере 40%, или по меньшей мере 50%,или по меньшей мере 60%, или по меньшей мере 70, 80, 90, 100% длины последовательности сравнения. Затем проводят сравнение аминокислотных остатков или нуклеотидов в соответствующих аминокислотных положениях или нуклеотидных положениях. Если какое-либо положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом, что и соответствующее положение во второй последовательности, тогда молекулы являются идентичными по этому положению (как использовано в данном описании, аминокислотная или нуклеиновокислотная "гомология" эквивалентна аминокислотной или нуклеиновокислотной "идентичности"). Процент идентичности между двумя последовательностями является функцией количества идентичных положений, общих для этих последовательностей, с учетом количества разрывов и длины каждого разрыва, которые необходимы для введения с целью оптимального выравнивания двух последовательностей. Выравнивания аминокислотной и нуклеотидной последовательности и их гомология, сходство или идентичность, как определено в данном описании, могут быть проведены и определены с применением алгоритма BLAST 2 Sequences, используя параметры по умолчанию (Tatusova, Т.A. et al., FEMS Microbiol. Lett, 174: 187-188 (1999. Нуклеиновые кислоты, клетки-хозяева. Данное изобретение относится к выделенным и/или рекомбинантным нуклеиновым кислотам, кодирующим слитые конструкции по изобретению, раскрытые в данном описании, например кодируемыеSEQ ID NO: 13-23. Нуклеиновыми кислотами, обозначаемыми в данном описании как "выделенные", являются нуклеиновые кислоты, которые были отделены от другого материала (например, других нуклеиновых кислот, таких как геномная ДНК, кДНК и/или РНК) в их первоначальном окружении (например, в клетках или в смеси нуклеиновых кислот, такой как библиотека). Выделенная нуклеиновая кислота может быть выделена в виде части вектора (например, плазмиды). Нуклеиновыми кислотами, обозначенными в данном описании как "рекомбинантные", являются нуклеиновые кислоты, которые были получены с использованием методологии рекомбинантной ДНК,включая способы, в основе которых лежит искусственная рекомбинация, такая как клонирование в вектор или хромосому с использованием, например, рестрикционных ферментов, гомологичная рекомбинация, использование вирусов и т.п., и нуклеиновые кислоты, полученные с использованием полимеразной цепной реакции (ПЦР). Изобретение также относится к рекомбинантной клетке-хозяину, например клетке млекопитающих или микробной клетке, которая содержит (одну или более) рекомбинантную нуклеиновую кислоту или экспрессирующую конструкцию, содержащую нуклеиновую кислоту, кодирующую слитую конструкцию по изобретению, которая раскрыта в данном описании. Также предложен способ получения слитой конструкции по изобретению, которая раскрыта в данном описании, включающий поддержание рекомбинантной клетки-хозяина, например клетки млекопитающего или микробной клетки, по изобретению в условиях, подходящих для экспрессии слитого полипептида. Этот способ может дополнительно включать стадию выделения или извлечения слитой конструкции, если желательно. Например, молекулу нуклеиновой кислоты (то есть одну или более чем одну молекулу нуклеиновой кислоты), кодирующую слитый полипептид по изобретению, или экспрессирующую конструкцию (то есть одну или более чем одну конструкцию), содержащую такую(ие) молекулу(ы) нуклеиновой кислоты,можно ввести в подходящую клетку-хозяина для создания рекомбинантной клетки-хозяина, используя любой способ, соответствующий выбранной клетке-хозяину (например, трансформацию, трансфекцию,электропорацию, инфекцию), с тем чтобы данные молекулы нуклеиновой кислоты были функциональным образом связаны с одним или более элементами контроля экспрессии (например, в векторе, в конст-9 018471 рукции, созданной в результате процессов, протекающих в клетке, интегрированной в геном клеткихозяина). Полученную рекомбинантную клетку-хозяина можно поддерживать в условиях, подходящих для экспрессии (например, в присутствии индуктора, в подходящем животном, в подходящих культуральных средах, дополненных соответствующими солями, ростовыми факторами, антибиотиками, пищевыми добавками и т.д.), в результате чего продуцируется кодируемый пептид или полипептид. Если желательно, кодируемый пептид или полипептид может быть выделен или извлечен (например, из животного, клетки-хозяина, среды, молока). Этот способ охватывает экспрессию в клетке-хозяине трансгенного животного (см., например, WO 92/03918, GenPharm International). Слитые полипептиды по изобретению, раскрытые в данном описании, также могут продуцироваться в подходящей экспрессирующей системе in vitro, например, путем химического синтеза или посредством любого другого подходящего метода. Как изложено и приведено в качестве примера в данном описании, слитые конструкции или конъюгаты по изобретению обычно связывают сывороточный альбумин с высокой аффинностью. Например, слитые конструкции или конъюгаты по изобретению могут связывать сывороточный альбумин человека с аффинностью (KD; KD = Koff(kd)/Kon(ka) (как определено поверхностным плазмонным резонансом) от примерно 5 мкМ до примерно 100 пМ, например от примерно 1 мкМ до примерно 100 пМ, например 400-800 нМ, например примерно 600 нМ. Слитая конструкция или конъюгаты по изобретению могут быть экспрессированы в Е. coli или в видах Pichia (например, P. pastoris). В одном из воплощений слитая конструкция секретируется в количестве по меньшей мере примерно 0,5 мг/л при экспрессии в Е. coli или в видах Pichia (например, P.pastoris); или в культуре клеток млекопитающего (например, клетках СНО (яичника китайского хомячка) или НЕК 293 (почки человеческого эмбриона. Несмотря на то что слитые конструкции или конъюгаты,раскрытые в данном описании, могут секретироваться при экспрессии их в Е. coli, или в видах Pichia, или в клетках млекопитающих, они могут быть получены с использованием любого подходящего метода,такого как методы химического синтеза или методы биологического продуцирования, в которых не используют Е. coli или виды Pichia. В некоторых воплощениях слитые конструкции и конъюгаты по изобретению эффективны в таких животных моделях, как описанные в WO 2006/059106 (например, на с. 104, 105 опубликованной WO 2006/059106), или таких, которые раскрыты в данном описании в разделе "Примеры", когда вводят эффективное количество. Обычно эффективное количество составляет от примерно 0,0001 до примерно 10 мг/кг (например, от примерно 0,001 до примерно 10 мг/кг, например, от примерно 0,001 до примерно 1 мг/кг, например, от примерно 0,01 до примерно 1 мг/кг, например, от примерно 0,01 до примерно 0,1 мг/кг). Данные модели заболевания знакомы специалистам в данной области техники в качестве моделей, прогнозирующих терапевтическую эффективность у людей. В общем, представленные слитые конструкции и конъюгаты по изобретению будут использованы в очищенной форме вместе с фармакологически или физиологически приемлемыми носителями. Обычно эти носители могут включать водные или спиртовые/водные растворы, эмульсии или суспензии, каждое из которых включает физиологический раствор и/или буферные среды. Парентеральные разбавители могут включать раствор хлорида натрия, декстрозный раствор Рингера, декстрозу и хлорид натрия и раствор Рингера с лактатом. Подходящие физиологически приемлемые адъюванты, при необходимости хранения полипептидного комплекса в суспензии, могут быть выбраны из таких загустителей, как карбоксиметилцеллюлоза, поливинилпирролидон, желатин и альгинаты. Внутривенные разбавители включают жидкость, питательные добавки и электролитные добавки,например, на основе декстрозного раствора Рингера. Также могут присутствовать консерванты и другие добавки, такие как антимикробные средства, антиоксиданты, хелатирующие агенты и инертные газы(Mack (1982) Remington's Pharmaceutical Sciences, 16-e изд.). Можно использовать ряд подходящих композиций, включая композиции с продолжительным высвобождением. Способ введения фармацевтических композиций по изобретению может быть любым из способов,общеизвестных средним специалистам в данной области техники. Что касается терапии, то слитые конструкции или конъюгаты лекарственного средства по изобретению могут быть введены любому пациенту в соответствии со стандартными методиками. Введение может быть осуществлено любым приемлемым способом, в том числе парентерально,внутривенно, внутримышечно, внутрибрюшинно, перорально, трансдермально, через легочный путь или также соответственно посредством прямой инфузии с использованием катетера. Дозировка и частота введения будут зависеть от возраста, пола и состояния пациента, совместного введения с другими лекарственными средствами, противопоказаний и других параметров, которые должны быть учтены практикующим врачом. Введение может быть локальным или системным, по показаниям. В одном из воплощений изобретения предложена легочная композиция для доставки в легкое, содержащая (а) конъюгаты и слитые конструкции по изобретению и (б) фармацевтически приемлемый буфер, и где эта композиция содержит капельки жидкости и примерно 40% или более, например 50% или более, из этих капелек жидкости, присутствующих в композиции, имеют размер в диапазоне менее 6 мкм, например от примерно 1 до примерно 6 мкм, например менее примерно 5 мкм, например от при- 10018471 мерно 1 до примерно 5 мкм. Эти композиции особенно подходят для введения субъекту путем прямой доставки локально в легкое. Например, эти композиции могут быть введены непосредственно в легкое,например, путем ингаляции, например, с использованием распылительного устройства. Эти композиции для легочной доставки могут содержать физиологически приемлемый буфер, который имеет рН в диапазоне от примерно 4 до примерно 8, например от примерно 7 до примерно 7,5, и вязкость, примерно равную вязкости раствора ПЭГ 1000 в концентрации от примерно 2 до примерно 10% в 50 мМ фосфатном буфере, содержащем 1,2% (мас./об.) сахарозы. Слитые конструкции или конъюгаты по данному изобретению могут быть лиофилизированы с целью хранения и повторного разведения в подходящем носителе перед применением. Показано, что эта методика эффективна для традиционных иммуноглобулинов и что можно использовать известные в данной области методики лиофилизации и повторного разведения. Специалистам в данной области техники будет очевидно, что лиофилизация и повторное разведение могут приводить к потере антителами активности в различной степени (например, что касается традиционных иммуноглобулинов, то антитела IgM имеют тенденцию к большей потере активности, нежели антитела IgG), и что используемые уровни возможно следует увеличить с целью компенсации. Что касается профилактических применений, например, при введении индивидуумам с диагнозом предшествующего диабету состояния или инсулинорезистентности, то композиции, содержащие слитые конструкции или конъюгаты по настоящему изобретению, также можно вводить в аналогичных или немного пониженных дозировках для предупреждения, торможения или задержки начала заболевания (например, для поддержания ремиссии или состояния покоя либо для предупреждения острой фазы). Квалифицированный врач-клиницист будет способен определить соответствующий интервал дозирования для лечения, подавления или предупреждения заболевания. Если слитую конструкцию или конъюгат по изобретению вводят для лечения, подавления или предупреждения заболевания, то их можно вводить до четырех раз в сутки, два раза в неделю, один раз в неделю, один раз каждые две недели, один раз в месяц или один раз каждые два месяца в дозе, например, от примерно 0,0001 до примерно 10 мг/кг (например,от примерно 0,001 до примерно 10 мг/кг, например, от примерно 0,001 до примерно 1 мг/кг, например, от примерно 0,01 до примерно 1 мг/кг, например, от примерно 0,01 до примерно 0,1 мг/кг). Лечение или терапия, осуществляемые с использованием композиций, раскрытых в данном описании, считаются "эффективными", если происходит ослабление одного или более симптомов (например,по меньшей мере на 10% или по меньшей мере на один пункт по клинической оценочной шкале) по сравнению с такими симптомами, присутствующими до лечения, или по сравнению с такими симптомами у индивидуума (человека или модельного животного), не подвергаемого лечению такой композицией,или с другим подходящим контролем. Несомненно, симптомы будут варьировать в зависимости от точной природы заболевания или расстройства, на которое направлено лечение, но они могут быть определены врачом-клиницистом или специалистом средней квалификации. Аналогично, профилактика, осуществляемая с использованием композиций, раскрытых в данном описании, является "эффективной", если происходит задержка начала одного или более симптомов или тяжесть одного или более симптомов ослабляется или аннулируется по сравнению с таковыми симптомами у схожего индивидуума (человека или модельного животного), который не подвергается лечению композицией. Слитые конструкции и конъюгаты по настоящему изобретению могут быть использованы в виде отдельно вводимых композиций или они могут быть введены вместе с другими терапевтическими или активными агентами, например другими полипептидами или пептидами или небольшими молекулами. Эти дополнительные агенты могут включать различные лекарственные средства, такие как, например,метформин, инсулин, глитазоны (например, розаглитазон), иммуносупрессивные средства, иммуностимуляторы. Слитые конструкции и конъюгаты по изобретению могут быть введены и/или изготовлены вместе с одним или более чем одним дополнительным терапевтическим или активным агентом. Если слитую конструкцию или конъюгат по изобретению вводят вместе с дополнительным терапевтическим агентом, то слитая конструкция или конъюгат могут быть введены перед введением, одновременно с введением или после введения дополнительного агента. В большинстве случаев слитую конструкцию или конъюгат по изобретению и дополнительный агент вводят способом, который обеспечивает перекрывание терапевтического эффекта. Период полувыведения. Увеличенный период полувыведения инсулинотропного агента или лекарственного средства с инкретиновым эффектом, например лиганда GLP-1 или эксендина, полезен для применений in vivo. Эта проблема решается данным изобретением путем обеспечения увеличенного периода полувыведения invivo инсулинотропного агента или лекарственного средства с инкретиновым эффектом, например GLP и эксендина, и вследствие этого более продолжительного времени сохранения в организме функциональной активности этих молекул. Как раскрыто в данном описании, композиции по изобретению (то есть содержащие слитые конструкции или конъюгаты, раскрытые в данном описании) могут иметь значительно более пролонгирован- 11018471 ный период полувыведения из сыворотки или плазмы крови in vivo, и/или увеличенную AUC, и/или увеличенное среднее время удержания (MRT) по сравнению с одним инсулинотропным агентом или лекарственным средством с инкретиновым эффектом. К тому же, активность инсулинотропного агента или лекарственного средства с инкретиновым эффектом в большинстве случаев не изменяется в значительной степени в композиции по изобретению (например, конъюгате или слитой конструкции). Тем не менее, некоторое изменение в активности композиций по изобретению по сравнению с одним инсулинотропным агентом или лекарственным средством с инкретиновым эффектом приемлемо и в большинстве случаев компенсируется улучшенными фармакокинетическими свойствами конъюгатов или слитых конструкций по изобретению. Например, конъюгаты или слитые конструкции лекарственного средства по изобретению могут связываться с мишенью этого лекарственного средства с более низкой аффинностью,чем само лекарственное средство, но они имеют примерно эквивалентную или более высокую эффективность по сравнению с самим лекарственным средством благодаря улучшенным фармакокинетическим свойствам (например, пролонгированному периоду полувыведения из сыворотки крови in vivo, большейAUC) лекарственной композиции. Кроме того, благодаря увеличенному периоду полувыведения конъюгаты или слитые конструкции по изобретению можно вводить реже, чем один инсулинотропный агент или лекарственное средство с инкретиновым эффектом, например их можно давать пациентам один раз в месяц или один раз в неделю, и при их использовании также можно получить более постоянный уровень инсулинотропного агента или лекарственного средства с инкретиновым эффектом в крови, чем при введении одного инсулинотропного агента или лекарственного средства с инкретиновым эффектом, тем самым достигая желаемого терапевтического или профилактического эффекта. Методы фармакокинетического анализа и определения периода полувыведения лиганда знакомы специалистам в данной области техники. Подробности можно найти в Kenneth, A. et al. Chemical Stabilityof Pharmaceuticals: A Handbook for Pharmacists и в Peters et al., Pharmacokinetic analysis: A Practical Approach (1996). Также приведена ссылка на книгу "Pharmacokinetics", M. GibaldiD. Perron, опубликованную Marcel Dekker, 2-е перераб. и испр. изд. (1982), где описаны такие фармакокинетические параметры, как периоды полувыведения t-альфа и t-бета и площадь под кривой (AUC). Периоды полувыведения (t1/2 альфа и t1/2 бета), и AUC, и MRT можно определить из кривой зависимости концентрации лиганда в плазме или сыворотке крови от времени. Для определения формы кривой можно использовать аналитическое программное обеспечение WinNonlin (поставляемое PharsightCorp., Mountain View, CA94040, USA). На первой фазе (фазе альфа) происходит главным образом распределение лиганда в организме пациента с некоторым элиминированием. Вторая фаза (фаза бета) представляет собой конечную фазу, когда лиганд уже распределен и концентрация в сыворотке уменьшается по мере выведения лиганда из организма пациента. Период полувыведения t-альфа есть период полувыведения в первой фазе, а период полувыведения t-бета есть период полувыведения во второй фазе. Кроме того, для определения периода полувыведения также можно использовать некомпартментную модель подгонки, известную в данной области техники. В одном из воплощений настоящего изобретения предложены слитая конструкция или конъюгат по изобретению с периодом полувыведения, например, у людей в диапазоне от приблизительно 12 ч или более, например от приблизительно 12 ч до приблизительно 21 суток, например от приблизительно 24 ч до приблизительно 21 суток, например приблизительно 2-8 суток, например приблизительно 3-4 суток. Слитые конструкции или конъюгаты по изобретению далее могут быть представлены в формате с большим гидродинамическим размером, например, посредством присоединения группы ПЭГ, сывороточного альбумина, трансферрина, рецептора трансферрина или, по меньшей мере, его трансферринсвязывающей части, Fc-области антитела, или посредством конъюгирования с доменом антитела. Гидродинамический размер может быть определен с использованием способов, общеизвестных в данной области техники. Например, для определения гидродинамического размера лиганда можно использовать гельфильтрационную хроматографию. Матрицы, подходящие для гельфильтрационного определения гидродинамических размеров лигандов, такие как перекрестно сшитые агарозные матрицы,общеизвестны и легкодоступны. Композиции по изобретению, то есть композиции, содержащие слитые конструкции и конъюгаты,раскрытые в данном описании, дают несколько дополнительных преимуществ. Компонент "однодоменное антитело" является очень стабильным, небольшим по сравнению с антителами и другими антигенсвязывающими фрагментами антител, может быть получен с высокими выходами путем экспрессии в Е.coli или дрожжах (например, Pichia pastoris), и антигенсвязывающие фрагменты антител, которые связываются с сывороточным альбумином, могут быть легко отобраны из библиотек человеческого происхождения или из любого желаемого вида. Соответственно композиции по изобретению, содержащие dAb,которое связывается с сывороточным альбумином, могут быть получены с большей легкостью, чем терапевтические вещества, которые обычно получают в клетках млекопитающих (например, человеческие,гуманизированные или химерные антитела), и могут быть использованы dAb, которые не являются иммуногенными (например, человеческое dAb можно использовать для лечения или диагностирования заболевания у людей). Иммуногенность инсулинотропного агента или лекарственного средства с инкретиновым эффектом может быть снижена в том случае, когда инсулинотропный агент или инкретин представляет собой часть лекарственной композиции, содержащей dAb, которое связывается с сывороточным альбумином. Соответственно согласно изобретению предложены композиции конъюгатов или слитых конструкций, которые могут быть менее иммуногенными (чем, например, сам инсулинотропный агент или инкретин) или которые могут быть менее, по существу, неиммуногенными в контексте лекарственной композиции, содержащей dAb, которое связывается с сывороточным альбумином. Поэтому такие композиции можно вводить субъекту неоднократно с минимальной потерей эффективности из-за наработки антител против лекарственного средства иммунной системой субъекта. В дополнение к этому, композиции конъюгатов или слитых конструкций, раскрытые в данном описании, могут иметь повышенный профиль безопасности и меньше побочных эффектов по сравнению с самим инсулинотропным агентом или инкретином. Например, в результате того, что dAb обладает связывающей активностью в отношении сывороточного альбумина, слитые конструкции и конъюгаты по изобретению имеют увеличенное время удержания в сосудистом кровотоке. К тому же, слитые конструкции и конъюгаты по изобретению, по существу, не способны проникать через гематоэнцефалический барьер и аккумулироваться в центральной нервной системе после системного введения (например, внутрисосудистого введения). Соответственно слитые конструкции или конъюгаты по изобретению могут быть введены с большей безопасностью и сниженными побочными эффектами по сравнению с одним инсулинотропным агентом или лекарственным средством с инкретиновым эффектом. Аналогично, слитые конструкции или конъюгаты могут иметь сниженную токсичность в отношении конкретных органов(например, почки или печени), чем само лекарственное средство. Примеры Пример 1. Экспрессия слитых генетических конструкций GLP-1 (A8G) или эксендина-4 и DOM7h14 AlbudAb. Эксендин-4 или GLP-1 (7-37) с заменой аланина в положении 8 на глицин ([Gly8] GLP-1) клонировали в виде слитой конструкции с DOM7h-14 (однодоменным антителом (dAb), которое связывается с сывороточным альбумином (albudab) с аминокислотной последовательностью, показанной ниже) в вектор рТТ-5 (который можно получить в CNRC, Canada). В каждом случае GLP-1 или эксендин-4 находился на 5'-конце конструкции, a dAb на 3'-конце. Всего было получено 7 конструкций (DAT0114, DAT0115,DAT0116, DAT0117, DAT0118, DAT0119, DAT0120) с аминокислотными последовательностями, показанными на фиг. 1(a-g). Между GLP-1 или эксендином-4 и dAb либо не было никакого линкера, либо имелся gly-ser-линкер(G4S линкер) или спиральный линкер (Arai, R., Н. Ueda, et al. (2001) "Design of linkers which effectivelyseparate domains of a bifunctional fusion protein", Protein Eng. 14(8): 529-32.456), или линкер, состоящий из второй группировки GLP-1. Линкеры были введены в качестве спейсеров для пространственного отделения GLP-1 или эксендина-4 от dAb с целью предотвращения стерических препятствий связыванию между GLP-1 или эксендином-4 и рецептором GLP-1. Последовательности конструкций показаны на фиг. 1(a-g). ДНК, не содержащую эндотоксина, получали в Е. coli, используя щелочной лизис (с применениемGiga-набора для выделения не содержащей эндотоксина плазмиды, который можно получить в Qiagen,CA), и использовали для трансфекции клеток НЕК 293 Е (которые можно получить в CNRC, Canada). Трансфекцию осуществляли в колбе с 250 мл суспензии клеток НЕК 293 Е в концентрации 1,75106 клеток/мл, используя 333 мкл 293 фектина (293fectin) (Invitrogen) и 250 мкг ДНК на одну колбу, и экспрессию проводили при 30 С в течение 5 суток. Супернатант собирали центрифугированием и очистку осуществляли, используя аффинную очистку на белке L. Белок подвергали серийному связыванию со смолой, упаковывали в колонку и промывали PBS (забуференным фосфатом физиологическим раствором) в количестве 10 об. колонки. Белок элюировали 50 мл 0,1 М глицина, рН 2, и нейтрализовали трис, рН 8. Белок ожидаемого размера идентифицировали на геле после SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия), и размеры показаны ниже в табл. 1. Таблица 1 Молекулярные массы (Mw) конструкций DAT0114, DAT0115, DAT0116, DAT0117,DAT0118, DAT0119, DAT0120 Пример 2. Демонстрация того, что слитые конструкции AlbudAb с GLP-1 и эксендином-4 связываются с сывороточным альбумином. С целью получения информации об аффинности слитые конструкции GLP-1 и эксендин-4 AlbudAb анализировали посредством поверхностного плазмонного резонанса (на приборе Biacore AB, доступном в GE Healthcare). Анализ проводили, используя чип СМ 5 Biacore (матрица из карбоксиметилированного декстрана), который был покрыт сывороточным альбумином. Проводили иммобилизацию примерно 1000 единиц резонанса (RU) каждого из тестируемых сывороточных альбуминов (человека, крысы и мыши) в ацетатном буфере, рН 5,5. Проточную ячейку 1 прибора Biacore AB не покрывали ничем (блокированный отрицательный контроль), проточную ячейку 2 покрывали сывороточным альбумином человека (HSA) (815 RU), проточную ячейку 3 покрывали сывороточным альбумином крысы (RSA) (826 RU) и проточную ячейку 4 покрывали сывороточным альбумином мыши (MSA) (938 RU). Каждую тестируемую слитую молекулу экспрессировали в культуре тканей млекопитающих, как описано в приведенном выше примере. Готовили несколько концентраций слитой молекулы (в диапазоне от 16 нМ до 2 мкМ) путем разведения в HBS-EP-буфере (BIACORE) (0,01 М HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота); рН 7,4; 0,15 М NaCl; 3 мМ EDTA (этилендиаминтетрауксусная кислота); 0,005% поверхностноактивного вещества Р 20) и пропускали через чип BIACORE. Аффинность (KD) рассчитывали изBIACORE-кривых подгонкой кривых констант скоростей ассоциации и диссоциации к кривым, образованным dAb с концентрациями, лежащими в области KD. Величины аффинности (KD) суммированы в следующей далее табл. 2. Таблица 2 Связывание конструкций GLP-1- и эксендин-4-AlbudAb с сывороточным альбумином человека, крысы и мыши Приведенные выше результаты демонстрируют, что слитые молекулы сохраняют способность связываться со всеми типами сывороточного альбумина, и это указывает на то, что они, очевидно, обладают увеличенным периодом полувыведения in vivo. Пример 3. Слитые конструкции GLP-1 и эксендин-4 AlbudAb активны в анализе связывания с рецептором GLP-1 (GLP-1R ВА). Слитые конструкции переводили в буфер, содержащий 100 мМ NaCl, 20 мМ цитрата, рН 6,2. Одновременно клетки СНО 6CRE GLP1R (клетки СНО K1 (которые можно получить из Американской коллекции типовых культур (АТСС, стабильно трансфицированые 6 цАМФ-чувствительным элементом,управляющим люциферазным репортерным геном, а также рецептором GLP-1 человека) высевали в концентрации 2105 клеток/мл в суспендирующие среды. Суспензионную культуру поддерживали в течение 24 ч. Затем клетки разбавляли 15 мМ HEPES-буфером (который можно получить у Sigma), содержащим 2 мМ L-глутамина (2,5105 клеток/мл), и разливали по 384-луночным планшетам, содержащим анализируемое соединение в количестве 10 мкл/лунка. После добавления контроля для анализа планшеты возвращали в инкубатор на 3 ч при 37 С и 5% СО 2. После инкубации в лунки добавляли субстрат для люциферазы из набора Steady-Glo Luciferase (который можно получить у Promega) в соответствии с описанием набора и планшеты герметично закрывали самоклеющимися уплотнительными крышками ( по каталогу Weber Marking Systems Inc. 607780). Планшеты помещали в ридер (Viewlux, Perkin Elmer), проводили предварительную инкубацию в течение 5 мин, после чего прочитывали данные флуоресценции и результаты представляли в графическом виде. Соединение анализировали в диапазоне концентраций в присутствии и в отсутствие 10 мкМ альбумина, что позволяло провести подгонку кривой зависимости Таблица 3 Активность слитых конструкций с GLP-1 и эксендин-4 AlbudAb в анализе связывания с рецептором Приведенные выше результаты демонстрируют, что все протестированные слитые молекулы сохраняют способность к связыванию с рецептором GLP-1. Результаты также демонстрируют, что эта способность сохраняется в присутствии сывороточного альбумина. Следовательно, эти слитые молекулы с очевидностью сохраняют способность связываться с рецептором GLP-1 in vivo. Пример 4. Экспрессия DAT0115, DAT0116, DAT0117 и DAT0120 в культуре ткани млекопитающих НЕК 293 с последующей очисткой посредством аффинного связывания с белком L и ионообменной хроматографии. Цель этого эксперимента заключалась в получении белка для исследования in vivo и in vitro. Белок экспрессировали в культуре ткани млекопитающих в НЕК 293 Е-клетках из вектора рТТ-5, как описано ранее. Кратко, не содержащую эндотоксина ДНК получали, очищали и использовали для трансфекции НЕК 293 Е-клеток. Экспрессию белка проводили в течение 5 суток при 30 С в инкубаторе со встряхиванием, культуры осаждали центрифугированием и супернатант (содержащий интересующий белок) собирали. Белок очищали из супернатанта посредством аффинного захвата на белок L-аффинной агарозной смоле Streamline (смола от GE Healthcare, белок L пришит по месту). Затем смолу промывали PBS в количестве 10 об. колонки и после этого белок элюировали 0,1 М глицином, рН 2,0, в количестве 5 об. колонки. Нейтрализовали 1 М трис-глициновым буфером, рН 8,0, в количестве 1 об. колонки. В этом случае (в отличие от предыдущего примера) далее осуществляли дополнительную очистку белка. Белок (в трис-глициновом буфере) переводили в 20 мМ ацетат, рН 5,0, после чего наносили, используя устройство для нанесения Akta, на 1 (или 2, одновременно) 6 мл колонку Resource S (GE Healthcare), предварительно уравновешенную 20 мМ ацетатом, рН 5,0. После промывки тем же буфером белок элюировали с использованием градиента NaCl 0-0,75 М или 0-1 М в 20 мМ ацетате, рН 5,0. Фракции надлежащей молекулярной массы далее идентифицировали посредством SDS-PAGE элетрофореза и масс-спектрометрии(MS) и затем объединяли, получая окончательный образец белка. Затем белок переводили в 20-мМ цитрат, рН 6,2, 100 мМ NaCl и концентрировали до 0,5-5 мг/мл. Раствор белка фильтровали через 0,2-мкм фильтр для обеспечения стерильности. Далее белок использовали в описанных ниже примерах. Пример 5. Сравнение стабильности DAT0115, DAT0116, DAT0117 и DAT0120 после 1, 3 и 6 циклов замораживания-оттаивания. Цель этого исследования заключалась в сравнении стабильности DAT0115, DAT0116, DAT0117 иDAT0120 после 1, 3 и 6 циклов замораживания-оттаивания. Каждый белок экспрессировали в культуре ткани млекопитающих в НЕК 293 Е-клетках из вектора рТТ-5 и очищали на белок L-аффинной смоле с последующей ионообменной хроматографией, как описано выше. Белок переносили в 20-мМ цитратный буфер с 100 мМ NaCl и разбавляли до 0,5 мг/мл, используя тот же буфер. Аликвоты каждого белка по 0,5 мл (в пробирках Эппендорф) далее подвергали 0, 1, 3 или 6 циклам замораживания-оттаивания, при этом каждый цикл включал в себя 3 мин на сухом льду, затем 2 мин в водяной бане при 37 С (во время эксперимента было отмечено, что 2 мин при 37 С было достаточно, чтобы раствор белка полностью оттаял). После завершения необходимого количества циклов замораживания-оттаивания образцы белка хранили при 2-8 С до проведения последующего анализа. Затем белки анализировали посредством SDS-PAGEэлектрофореза, анализа связывания с GLP-1R, гель-хроматографии на колонке с Superdex 75 и массспектрометрии. Было установлено, что SDS-PAGE-профиль, эффективность в GLP-1R ВА и массспектрометрический профиль для всех четырех белков не изменялись существенным образом по сравне- 15018471 нию с исходными в результате 1, 3 или 6 циклов замораживания-оттаивания. После 6 циклов замораживания-оттаивания максимальная высота пика в SEC-анализе составляла 78, 86, 104 и 57% для DAT0115,DAT0116, DAT0117 и DAT0120 соответственно. Было сделано заключение, что DAT0120 менее стабилен в циклах замораживания-оттаивания, чем остальные три белка. Таблица 4 Результаты сравнения стабильности DAT0115, DAT0116, DAT0117 и DAT0120 после 1, 3 и 6 циклов замораживания-оттаивания Пример 6. Демонстрация продолжительности действия DAT0115 в модели диабета II типа на db/db мышах. Цель этого исследования заключалась в определении продолжительности действия DAT0115 на толерантность к перорально вводимой глюкозе у db/db мышей. Животных сортировали в соответствии с понижением уровня глюкозы за три дня до начала эксперимента и затем их объединяли в группы. По одному животному из каждой группы далее включали в состав каждой из 26 исследуемых групп. Это обеспечивало близкий средний начальный уровень глюкозы в каждой из исследуемых групп.DAT0115 (полученную в НЕК 293-клетках и очищенную, как описано выше) вводили подкожно в дозе 1, 0,3 или 0,1 мг/кг либо за 5, 24, 48, 72, 96 ч, либо за 120 ч перед пероральным приемом глюкозы(не все дозы вводили в каждую временную точку; для подробного изучения см. приведенную ниже таблицу). DAT0115 вызывала значительное уменьшение AUC для глюкозы в течение 2-часового периода времени прохождения теста на толерантность к глюкозе при пероральном приеме (OGTT) по сравнению с AUC в случае получавших растворитель db/db мышей во временные точки до 24 ч и включая 24 ч для доз 0,1 и 0,3 мг/кг и до 72 ч, и включая временную точку 72 ч для дозы 1 мг/кг. Эксендин-4, введенный в качестве положительного контроля в дозе 42 мкг/кг, также вызывал значительное уменьшение AUC для глюкозы согласно OGTT при введении его за 5 ч перед пероральным введением болюса глюкозы. В приведенной ниже табл. 5 показано процентное уменьшение AUC для каждой из исследуемых групп с обработкой DAT0115 по сравнению с растворителем. Звездочкой отмечены случаи Р 0,05, полученные при сравнении DAT0115 с растворителем с использованием коррекции по показателю ошибочных событий. Таблица 5 Демонстрация процента уменьшения AUC для каждой из исследуемых групп с обработкойDAT0115 по сравнению с растворителем (звездочкой отмечены случаи Р 0,05, полученные при сравнении DAT0115 с растворителем с использованием коррекции по показателю ошибочных событий) Пример 7. Демонстрация эффективности DAT0115 в мышиной модели индуцированного диетой ожирения (DIO). Цель этого исследования заключалась в применении традиционной модели кормления мышей (мыши с индуцированным диетой ожирением) для определения того, воздействует ли обработка DAT0115 на потребление пищи и, как следствие, на массу тела. Это может иметь предсказательную ценность для людей. Самцов С 57 В 1/6-мышей (приобретенных у Taconic) в течение 12 недель откармливали с помощью диеты с высоким содержанием жиров (до 60% ккал) и затем переносили в лабораторную установку собственного производства. По прибытии мышей размещали по отдельности на подстилке Альфа-Dri в комнате с контролируемой температурой и влажностью (70-72F (39-40C), влажность = 48-50%, световой цикл (5 утра/5 вечера. Диету меняли на диету с содержанием жиров 45% и животным давали акклиматизироваться в течение 18 суток. Перед введением тестируемого соединения мышам вводили подкожно физиологический раствор один раз в сутки в течение трех суток и проводили мониторинг потребления пищи. Мышей объединяли в группы и группы составляли таким образом, чтобы между группами или внутри групп не было различия в массе тела и потреблении пищи. В день исследования группам из 8 мышей делали подкожные инъекции в дозе 5 мл/кг, как указано ниже: трем группам вводили DAT0115(низкая, средняя и высокая доза), одной группе отрицательный контроль (молекулу AlbudAb DOM7h-14,но в отсутствие в составе конъюгата эксендина-4) и одной - эксендин-4 в качестве положительного контроля. Таблица 6 Протокол установления эффективности DAT0115 в мышиной модели индуцированного диетой ожирения (DIO) Ежедневное потребление пищи и массу тела измеряли каждые сутки в течение 10 суток. ДляDAT0115 показано дозозависимое уменьшение массы тела и потребления пищи по сравнению с DOM7h14 в качестве контроля (см. фиг. 3 а и 3b). Поэтому было сделано заключение, что данные, полученные в этом исследовании на мышах, подтверждают гипотезу о том, что DAT0115 может быть хорошим кандидатом для применения в клинике. Пример 8. Определение периода полувыведения DAT0115, DAT0116 и DAT0117 из плазмы крови в мышиной модели диабета II типа. Цель этого исследования заключалась в определении профиля элиминирования DAT0115, DAT0116 и DAT0117 из плазмы крови в мышиной модели диабета II типа (db/db мыши) и расчете ФК (фармакокинетических) параметров на основании этих результатов. Белок DAT0115, DAT0116 и DAT0117 получали,как описано ранее. Кратко, проводили экспрессию белка в культуре ткани млекопитающих, используя клетки НЕК 293 Е, и очищали, используя серийную абсорбцию на белок L-агарозной аффинной смоле с последующим элюированием глицином при рН 2,0 и нейтрализацией Трис, рН 8,0. Затем проводили ионообменную хроматографию на колонке Resource S с использованием 0-1 М градиента соли в 20 мМ ацетате, рН 5,0. Фракции, содержащие желаемый белок, далее объединяли и проводили замену буфера на 100 мМ NaCl, 20 мМ цитрат, рН 6,2. Белок подвергали стерилизации фильтрованием, проводили замену буфера, эндотоксин удаляли и тестировали перед использованием in vivo. Группам не подвергавшихся голоданию самцов db/db мышей (LEPr db-гомозиготных мышей, дефицитных по лептиновому рецептору с мутациями в гене лептинового рецептора (lepr вводили либо подкожно (п/к), либо внутривенно (в/в)DAT0115, DAT0116 или DAT0117 по 1 мг/кг. Перед введением через 0,25, 0,5, 1, 4, 7, 12, 24, 36, 48 и 60 ч после введения в/в доз и перед введением через 0,5, 1, 4, 7, 12, 24, 36, 48 и 60 ч после введения п/к доз собирали образцы крови путем полного обескровливания и готовили плазму. Образцы плазмы замораживали и позднее размораживали для анализа уровней DAT0115, DAT0116 или DAT0117, как целесообразно, посредством твердофазной экстракции и LC (жидкостная хроматография)/MS/MS для детекции наличия фрагмента белка (из участка эксендин-4 белка). Рассчитанные уровни в плазме крови затем использовали для подгонки фармакокинетических параметров с применением программного обеспеченияWinNonLin. Период полувыведения после подкожного и внутривенного введения и биодоступность приведены ниже в таблице. На основании данных результатов (см. табл. 7 ниже) было сделано заключение,что все три соединения показывают желаемые фармакокинетические параметры в мышиной модели диабета II типа. Следовательно, эти молекулы демонстрируют потенциал для получения хороших ФК параметров у людей с диабетом, при этом в данном исследовании предпочтителен выбор DAT0115 илиDAT0116 по сравнению с DAT0117. Таблица 7 Период полувыведения DAT0115, DAT0116 и DAT0117 из плазмы крови в мышиной модели диабета II типа Пример 9. Определение периода полувыведения DAT0115, DAT0116, DAT0117 из плазмы крови крысы. Цель этого исследования заключалась в определении профиля элиминирования DAT0115, DAT0116 и DAT0117 из плазмы крови крысы и расчете ФК параметров на основании этих результатов. БелокDAT0115, DAT0116 и DAT0117 получали, как описано ранее. Кратко, проводили экспрессию белка в культуре ткани млекопитающих, используя НЕК 293 Е-клетки, и очищали, используя серийную абсорбцию на белок L-агарозной аффинной смоле с последующим элюированием глицином при рН 2,0 и нейтрализацией с помощью Трис, рН 8,0. После этого проводили ионообменную хроматографию на колонкеResource S с использованием 0-1 М градиента соли в 20 мМ ацетата, рН 5,0. Фракции, содержащие желаемый белок, далее объединяли и проводили замену буфера на 100 мМ NaCl, 20 мМ цитрат, рН 6,2. Белок подвергали стерилизации фильтрованием, проводили замену буфера и осуществляли QC (контроль качества) перед использованием in vivo. Для определения периода полувыведения из плазмы группы из 3 крыс получали разовую в/в или п/к инъекцию DAT0115, DAT0116 или DAT0117 в дозе 0,3 мг/кг (в/в) или 1,0 мг/кг (п/к). Образцы плазмы получали путем периодических отборов крови из хвостовой вены в течение периода времени 72 ч и анализировали посредством LC/MS/MS для детекции наличия фрагмента слитой конструкции (из участка эксендин-4 белка). Рассчитанные уровни в плазме крови затем использовали для подгонки фармакокинетических параметров с применением программного обеспеченияWinNonLin. Период полувыведения после подкожного и внутривенного введения и биодоступность приведены ниже в табл. 8. На основании данных результатов было сделано заключение, что все три соединения показывают желаемые фармакокинетические параметры у крысы. Следовательно, все эти молекулы демонстрируют потенциал для получения хороших ФК параметров у людей, при этом в данном исследовании предпочтителен выбор DAT0115 по сравнению с DAT0116 или DAT0117. Таблица 8 Период полувыведения после подкожного и внутривенного введения и биодоступность Пример 10. Определение периода полувыведения DAT0115 из плазмы крови яванского макака. Цель этого исследования заключалась в определении фармакокинетических параметров дляDAT0115 у примата, не являющегося человеком (яванский макак), чтобы иметь возможность аллометрической балльной оценки параметров и дать наилучшее возможное указание на то, будет ли DAT0115 иметь хороший ФК профиль у людей. Слитую конструкцию DAT0115 эксендин-4 AlbudAb экспрессировали в НЕК 293 Е-клетках в культуре ткани млекопитающих и очищали, как описано ранее. Кратко, белок очищали, используя серийную абсорбцию на белок L-аффинной агарозной смоле с последующим элюированием глицином при рН 2,0 и нейтрализацией Трис, рН 8,0. Затем проводили ионообменную хроматографию на колонке Resource S с использованием 0-1 М градиента соли в 20 мМ ацетате, рН 5,0. Фракции, содержащие желаемый белок, далее объединяли и проводили замену буфера на 100 мМ NaCl, 20 мМ цитрат, рН 6,2. Белок подвергали тщательному QC (контроль качества, включая SDS-PAGE, масс-спектрометрию,анализ активности (GLP-1R-BA), контроль рН, контроль осмомолярности), подвергали стерилизации фильтрованием и удаляли эндотоксин. Белок с подтвержденным низким содержанием эндотоксина (менее 0,05 EU (эндотоксиновых единиц) на 1 мг белка) использовали далее для исследования in vivo. В этом исследовании использовали шесть самок яванского макака (Масаса fascicularis; Charles RiverLaboratories BRF, Houston, TX, Primate Products, Miami, FL и/или Covance Research Products, Inc., Alice,TX). Возраст макак составлял приблизительно 2-9 лет (с диапазоном массы тела приблизительно 2-5 кг) на момент начала введения доз. Макак размещали по отдельности в клетки из нержавеющей стали в комнате(ах) с регулируемыми параметрами окружающей среды (от 64 до 84 F (от 36 до 47 С); относительная влажность 30-70%) с 12-часовым циклом свет/темнота. Самкам макак два раза в сутки давали приблизительно 6 галет корма для макак 5038 (PMI Nutrition International, Richmond, IN) и один раз в сутки выделяли свежие фрукты. Каждому животному вводили тестируемое соединение (DAT0115) либо подкожно, либо внутривенно в соответствии с группой введения дозы (3 п/к и 3 в/в). Доза составляла 0,1 мг/кг. В дни введения доз первое кормление осуществляли приблизительно через 1 ч после введения дозы каждой макаке (и до 2,5 ч после введения дозы, если для проведения связанных с исследованием процедур животным необходимо было находиться вне мест их размещения в течение продолжительного периода времени). Второе кормление выполняли не раньше, чем через два часа после первого кормления. В целях улучшения качества жизни каждой макаке предоставляли дополнительные фрукты, бобовые и/или овощи(например, виноград, морковь для цельноплодного консервирования, арахис) во время теста или приблизительно во время теста на жизнеспособность или в качестве способа поощрения после акклиматизации или связанных с исследованием процедур. Фильтрованная водопроводная вода (поставляемая Aqua Pennsylvania, Inc. и периодически анализируемая) была доступна без ограничения. Отбирали образцы плазмы крови (приблизительно 2 мл) из бедренного сосуда перед введением (0 ч) и в пределах допустимой погрешности через 5 мин (только для в/в группы), 0,5, 4, 8, 24, 48, 96, 144,192, 288, 336, 504 и 672 ч после введения (ФК образцы от одного из животных в группе в/в доз были собраны только для 24 ч, поэтому это животное было исключено из подгонки ФК параметров). Анализ образцов осуществляли посредством масс-спектрометрии и подгонку данных выполняли, используя программное обеспечение для подгонки WinNonLin. Получали следующие ФК параметры для в/в введенияCl (клиренс) 3,3 мл/ч/кг; и для п/к введения (n=3): Т 1/2 68 ч, MRT 98 ч, Vz 306 мл/кг и Cl 3,1 мл/ч/кг. Рассчитанная биодоступность составила 99%. На основании этого исследования (и на основании biacore-данных связывания с сывороточным альбумином яванского макака и человека) было сделано заключение, что период полувыведения DAT0115 при п/к введении, равный 68 ч у яванского макака (как описано выше), дает уверенность в том, что продолжительность периода полувыведения той же молекулы у людей с вероятностью будет достаточной,чтобы коррелировать с необходимостью введения один раз в неделю (или менее часто). Пример 11. Определение ФД (фармакодинамики) DAT0115 у яванского макака. ФК исследование на яванском макаке проводили, как описано выше. Главная цель этого исследования заключалась в определении фармакокинетических параметров DAT0115 на яванском макаке (как описано в предшествующем примере), а вторая цель заключалась в получении показания эффективности соединения DAT0115 на этих макаках (без применения в данном исследовании усилий, достаточных для получения статистически значимых результатов). Для достижения этой второй цели проводили мониторинг потребления пищи макаками на протяжении всего исследования. Было отмечено, что в следующие после введения сутки имелась тенденция к уменьшению потребления пищи у всех макак. Было сделано заключение, что это вероятно происходило вследствие известного документально подтвержденного эффекта, вызываемого относящейся к эксендину-4 частью молекулы как средству, подавляющему аппетит. Следовательно, показано, что DAT0115 обладает активностью in vivo. С целью обеспечения улучшения здоровья животных в большинство из дней помимо потребления галет животные получали фрукты и лакомства. Таблица 9 Измерение количества галет, потребляемых ежесуточно яванским макаком Пример 12. Согласно данным поверхностного плазмонного резонанса DAT0115 слитая конструкция эксендин-4 AlbudAb связывается с сывороточным альбумином крысы, яванского макака и человека. Проводили экспрессию DAT0115, очищали и затем анализировали с использованием поверхностного плазмонного резонанса (Biacore, GE Healthcare) для получения информации по аффинности. Анализ проводили, используя стрептавидиновый (SA) чип, покрытый биотинилированным сывороточным альбумином. На этом чипе было иммобилизовано 200-1000 единиц резонанса (RU) каждого сывороточного альбумина. Проточная ячейка 1 оставалась непокрытой, проточную ячейку 2 покрывали HSA, проточную ячейку 3 покрывали RSA и проточную ячейку 4 покрывали CSA (сывороточный альбумин яванского макака). Готовили несколько концентраций слитой конструкции (в диапазоне от 15,6 нМ до 2 мкМ) путем разведения в HBS-EP-буфере (BIACORE) (0,01 М HEPES, рН 7,4; 0,15 М NaCl; 3 мМ EDTA; 0,005% поверхностно-активного вещества Р 20) и пропускали через BIACORE-чип. Аффинность (KD) рассчитывали из BIACORE-кривых подгонкой кривых констант скоростей ассоциации и диссоциации к кривым,образованным dAb с концентрациями, лежащими в области KD. Величины аффинности (KD) суммированы в следующей далее таблице. Таблица 10 Аффинность (KD) DAT0115 Пример 13. Характеристика тепловой денатурации DAT0115 посредством дифференциальной сканирующей калориметрии (DSC). Цель этого эксперимента заключалась в мониторинге тепловой денатурации DAT0115 посредствомDSC (дифференциальной сканирующей калориметрии) с использованием микрокалориметра с капиллярной ячейкой VP-DSC (Microcal), оборудованного автосэмплером. Белок подвергали диализу в течение ночи, переводя в 20 мМ цитрат, рН 6,2, с 100 мМ NaCl, фильтровали и затем готовили растворы в концентрации 1 мг/мл, что определяли по поглощению на 280 нм. Отфильтрованный буфер для диализа использовали в качестве раствора сравнения для всех образцов. DSC проводили при скорости нагревания 180 С/ч. Перед пропусканием каждого образца вводили раствор 1%-ного декона (decon) и затем буфер для промывки ячеек и получения базовой линии прибора. Полученные кривые анализировали, используя программное обеспечение Origin 7 от Microcal. DSC-кривую, полученную для буфера сравнения, вычитали из кривой для образца. Для расчетов (осуществленных автоматически с применением Origin) использовали точную молярную концентрацию образца. Подбирали установочные параметры базовой линии как для верхних, так и нижних линейных участков базовых линий до/после перехода и соединяли,используя кривую 3-го порядка. Полученный график подгоняли к модели для независимых переходов"non-two-state", получая кажущуюся т.пл. и величины H/Hv. Кривую для DAT0115 подгоняли к модели для независимых переходов "non-two-state" с кажущейся т.пл. 56,3 С. Было получено удовлетворительное соответствие (см. фиг. 4). Контрольная кривая с лизоцимом, полученная с использованием того же оборудования, позволила получить данные хорошего качества, ожидаемые при идеальной подгонке (кажущаяся т.пл., полученная для лизоцима, составляла 76,2 С,что согласуется с приведенной в литературе (см. фиг. 5. Поэтому было сделано заключение, что в результате этого эксперимента были получены достоверные данные, указывающие на то, что DAT0115 представляет собой молекулу с температурой плавления 56,3 С, что является приемлемым для кандидата для применения в клинике. Пример 14. Характеристика DAT0115, DAT0117 и DAT0120 в растворенном состоянии посредством SEC-MALLS. Цель этого эксперимента заключалась в определении состояния DAT0115, DAT0117 и DAT0120 в растворе посредством SEC-MALLS. Образцы очищали и подвергали диализу, переводя в соответствующий буфер (PBS), и фильтровали после диализа, определяли концентрацию и подводили до 1 мг/мл. BSA(бычий сывороточный альбумин) и HSA закупали у Sigma и использовали без дополнительной очистки. Подробное описание оборудования.HPLC-система Shimadzu LC-20AD Prominence с автосэмплером (SIL-20A) и UV/Vis-детектором (детектор для ультрафиолетовой/видимой области спектра) SPD-20A Prominence подсоединяли к MALLSдетектору (детектору многоуглового лазерного светорассеяния) Mini Dawn Treos от Wyatt и DRIдетектору (дифференциальному рефрактометрическому детектору) Optilab rEX от Wyatt. Детекторы подсоединяли в следующем порядке - LS-UV-RI. Как RI-, так и LS-приборы работали на длине волны 488 нм. Использовали колонки TSK2000 (Tosoh corporation) или BioSep2000 (Phenomenex) (обе представляют собой HPLC-колонки с носителем на основе диоксида кремния и со схожим диапазоном разделения 1300 кДа) с подвижной фазой в виде 50 или 200 мМ фосфатного буфера (с солью или без нее), рН 7,4, или 1PBS. Используемая скорость потока составляет 0,5 или 1 мл/мин, время прогона регулировали в соответствии с разными скоростям потока (45 или 23 мин), и ожидается, что это не окажет существенного воздействия на разделение молекул. Белки готовили в PBS в концентрации 1 мг/мл, и вводимый объем составлял 100 мкл. Детектор светорассеяния калибровали с использованием толуола в соответствии с инструкциями производителя. Выход UV-детектора и выход RI-детектора подсоединяли к прибору для измерения светорассеяния с тем, чтобы сигналы со всех трех детекторов можно было собирать одновременно с помощью программного обеспечения ASTRA от Wyatt. Через колонку Tosoh TSK2000 пропускают несколько инъекций BSA в подвижной фазе PBS (0,5 или 1 мл/мин), при этом UV-, LS- и RIсигналы собирают с помощью программного обеспечения Wyatt. Затем кривые анализируют, используя программное обеспечение ASTRA, и сигналы нормируют, выравнивают и корректируют с учетом уширения зон, следуя инструкциям производителя. Калибровочные константы затем усредняют и вводят в матрицу, которую используют для анализа последующих прогонов образцов. Вычисления абсолютной молекулярной массы. 100 мкл образца (1 мг/мл) вводят в соответствующую предварительно уравновешенную колонку. После SEC-колонки образец проходит через 3 соединенных он-лайн детектора - UV, MALLS (детектор многоуглового лазерного светорассеяния) и DRI (дифференциальный рефрактометрический детектор),что позволяет определить абсолютную молекулярную массу. Разбавление, которое происходит в колонке, является примерно 10-кратным, поэтому концентрация, при которой определяют состояние в растворе, составляет 100 мкг/мл или примерно 8 мкМ dAb. Основу для вычислений в ASTRA, а также в методе построения графиков зависимостей по Zimm,который часто задействуют в режиме пакетной обработки образцов (a batch sample mode), составляет уравнение из статьи Zimm, J. Chem. Phys. 16, 1093-1099 (1948) где с представляет собой массовую концентрацию молекул растворенного вещества в растворителе(г/мл); М представляет собой средневзвешенную молярную массу (г/моль); А 2 представляет собой второй вириальный коэффициент (мольмл/г 2);K = 4p2n02(dn/dc)2l0-4NA-1 является оптической постоянной, где n0 представляет собой коэффициент преломления растворителя при длине волны (вакуум) падающего излучения, l0 представляет собой длину волны (вакуум) падающего излучения, выраженную в нанометрах, NA представляет собой число Авогадро, равное 6,0221023 моль-1, и dn/dc представляет собой дифференциальное приращение коэффициента преломления раствора растворенное вещество - растворитель относительно изменения концентрации растворенного вещества, выраженное в мл/г (этот фактор должен быть измерен независимо с использованием dRI-детектора);P(q) представляет собой теоретически выведенный фактор формы, приблизительно равный где= (4/)sin(/2) и r2 представляет собой средний квадрат радиуса; P(q) является функцией z - среднего размера, формы и структуры;Rq представляет собой избыточный коэффициент Релея (см-1). Это уравнение допустимо для вертикально поляризованного падающего света и справедливо до порядка с 2. Чтобы провести вычисления с использованием метода подгонки по Zimm, которая представляет собой подгонку к зависимости Rq/Kc от sin2(q/2), авторам изобретения необходимо произвести обращение уравнения для приведения к первому порядку по с: Данные расчеты осуществляли автоматически, используя программное обеспечение ASTRA, с получением графического изображения для молекулярной массы, определенной для каждого из секторов в диаграмме (инструкция Astra). Молекулярную массу, полученную из графика для каждого из пиков, наблюдаемых на хроматограмме, сравнивают с ожидаемой молекулярной массой единичного мономера белка. Это позволяет авторам делать выводы относительно состояния белка в растворе. Экспериментальные данные DAT0115. 100 мкл DAT0115 в концентрации 1 мг/мл наносили на колонку Superdex 200, уравновешенную 20 мМ цитрата, 0,1 М NaCl, pH 6,2. Скорость потока устанавливали на 0,5 мл/мин. Белок элюировался в виде одного пика, при этом Mw была определена по всей ширине пика как 17,4 кДа (ожидаемая Mw для мономера составляет 16,9 кДа). Эффективность элюирования составляет 100%, см. фиг. 6. (HSAконтроль вел себя, как и ожидалось, подтверждая экспериментальные результаты для DAT0115. Он элюируется двумя пиками с Mw 64 кДа (мономер) и 110 кДа (димер). Mw димера HSA невозможно определить очень точно вследствие весьма малого количества белка в этом пике).DAT0117. 100 мкл DAT0117 в концентрации 1 мг/мл наносили на колонку TSK2000, уравновешенную 50 мМ фосфатным буфером, рН 7,4. Скорость потока устанавливали на 1 мл/мин. Примерно 50% вводимого количества DAT0117 элюировалось с колонки в виде двух перекрывающихся пиков с Mw около 35-45 кДа (димер и более), что указывает на сильную самоассоциацию в тестируемых в данной работе условиях (BSA-контроль вел себя, как и ожидалось, подтверждая экспериментальные результаты для DAT0117,давая два пика с молекулярной массой 61 и 146 кДа (мономер и димер; см. фиг. 7 для SEC-Malрезультатов.DAT0120. 100 мкл DAT0120 в концентрации 1 мг/мл наносили на колонку TSK2000, уравновешенную 50 мМ фосфатным буфером, рН 7,4. Скорость потока устанавливали на 1 мл/мин. Примерно 50% вводимого количества DAT0120 элюировалось с гель-фильтрационной (GF) колонки в виде немного асимметричного пика с Mw, определенной как примерно 25 кДа. Это указывает на самоассоциацию DAT0120 в тестируемых в данной работе условиях, по-видимому, белок находится в быстроустанавливающемся равновесии между мономером и димером (BSA-контроль вел себя, как и ожидалось, подтверждая экспериментальные результаты для DAT0120, давая два пика с молекулярной массой 61 и 146 кДа (мономер и димер; см. фиг. 8 для SEC-Mal-результатов. Из этих приведенных выше экспериментов было сделано заключение, что DAT0115 демонстрирует значительно меньшую самоассоциацию (и возможно никакой) в используемых в данной работе условиях по сравнению с другими двумя молекулами, которые показывают значительную самоассоциацию. Мономерное состояние в растворе может быть предпочтительным в плане действия in vivo и в плане предшествующего и последующего процесса при изготовлении (лекарственного средства), поэтому благодаря своему состоянию в растворе DAT0115 может представлять собой наиболее идеальную молекулу для продвижения к применению в клинике. Пример 15. Очистка после экспрессии в клетках млекопитающих без использования аффинной матрицы с белком L. Проводили очистку как DAT0120, так и DAT0115 из НЕК 293-супернатантов. Проводили экспрессию каждого белка в культуре ткани млекопитающих в НЕК 293 Е-клетках из вектора рТТ-5. Колонку с 1 мл носителя МЕР Hypercel уравновешивали PBS, промывали 0,1 М гидроксидом натрия и затем вновь уравновешивали PBS. По 200 мл супернатанта наносили на колонку при скорости 2,5 мл/мин, затем колонку промывали PBS и проводили элюирование 0,1 М глицином, рН 2. Полученный после элюирования образец нейтрализовали путем добавления 1 М Трис, рН 8, в количестве 1/5 об. и хранили при комнатной температуре. После хранения в образце было отмечено незначительное количество осадка, и его фильтровали, используя устройство Steriflip, после чего обессоливали. Две колонки для обессоливания 26/10 HiPrep уравновешивали 20-мМ ацетатом натрия, рН 5 (измерено рН 5,3) при 10 мл/мин, очищали путем добавления 0,1 М NaOH и повторно уравновешивали 20 мМ ацетатом натрия, рН 5. Обессоливание DAT0115 проводили, используя 20 мМ ацетат натрия, рН 5, после чего наносили на 1 мл HiTrap SPFF, уравновешенной 20 мМ ацетатом натрия, рН 5 (в действительности 5,2). После промывки колонки ее подвергали обработке 0-100%-ным градиентом 20 мМ ацетата натрия, рН 5, с 1 MNaCl, и элюируемые фракции с величиной поглощения более 5 mAU собирали и анализировали посредством SDS-PAGE. После хранения SP-FF-фракций в течение ночи образец фильтровали через 0,2-мкм фильтр и наносили на 2 Х колонки для обессоливания 26/10 HiPrep, уравновешенные 20 мМ цитратом натрия, рН 6,2,100 мМ NaCl. Элюат концентрировали с использованием центрифужного концентратора (20 мл), подвергали стерилизации фильтрованием и тестировали эндотоксин в разведениях 1/10 и 1/200. Эндотоксин тестировали в двух разведениях, для разведения 1/10 получали величину 30 Eu/мл со степенью извлечения 250. Для теста с 1/200 получали величину менее 10,8 Eu/мл со степенью извлечения 126%. Образец передавали для проведения MS-анализа, используя ID 27823. Наблюдается низкий уровень примесей,отмечаемых ниже маркера 80 кДа и в диапазоне маркеров 110-160 кДа при большой загрузке. Ожидается,что чистота образца будет превышать 95%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция слитой конструкции или конъюгата, содержащая или состоящая из следующего: (а) лекарственное средство, выбранное из эксендинов, PYY (пептида YY), GLP (глюкагоноподобного пептида), ОХМ (окситомодулина), VIP (вазоактивного интестинального пептида) или РР (панкреатического полипептида), присутствующее в виде слитой конструкции или конъюгата с (б) однодоменным антителом (dAb) DOM 7h-14, которое связывает сывороточный альбумин и которое имеет аминокислотную последовательность, показанную на фиг. 1(h) (SEQ ID NO: 8). 2. Композиция по п.1, где лекарственным средством является молекула эксендина-4 или GLP-1(глюкагоноподобного пептида 1). 3. Композиция по п.1 или 2, где лекарственное средство выбрано из (a) GLP-1 (7-37) A8G мутанта,который имеет аминокислотную последовательность, показанную на фиг. 1(i) (SEQ ID NO: 9), или (б) молекулы эксендина-4, которая имеет аминокислотную последовательность, показанную на фиг. 1(j)(SEQ ID NO: 10). 4. Композиция по любому из пп.1-3, которая содержит аминокислотный или химический линкер,соединяющий лекарственное средство и dAb. 5. Композиция по п.4, где аминокислотный линкер представляет собой спиральный линкер с аминокислотной последовательностью, показанной на фиг. 1(k) (SEQ ID NO: 11), или gly-ser-линкер с аминокислотной последовательностью, показанной на фиг. 1(l) (SEQ ID NO: 12). 6. Композиция по любому из пп.1-5, где лекарственное средство присутствует в качестве части слитой конструкции либо на N-конце, либо на С-конце dAb. 7. Композиция по п.6, которая содержит аминокислотную последовательность или состоит из аминокислотной последовательности, которая выбрана из следующего:(б) слитая конструкция эксендин 4, (G4S)3-линкер, DOM7h-14 (DAT0115)(в) слитая конструкция эксендин 4 DOM7h-14 (DAT0116)(г) слитая конструкция эксендин 4, спиральный линкер, DOM7h-14 (DAT0117) 8. Композиция по любому из пп.1-7, где dAb дополнительно отформатировано для увеличения его гидродинамического размера посредством присоединения к dAb молекул(ы), выбранных(ой) из следующего: группа ПЭГ (полиэтиленгликоль), сывороточный альбумин, трансферрин, рецептор трансферрина или, по меньшей мере, его трансферринсвязывающий участок, Fc-область антитела, или посредством конъюгирования с доменом антитела. 9. Композиция по любому из пп.1-8, содержащая дополнительную пептидную или полипептидную группировку. 10. Композиция по любому из пп.1-9, содержащая дополнительные группировки dAb, которые имеют одинаковые или разные специфичности связывания с dAb Dom7h-14. 11. Композиция по любому из пп.1-10, имеющая период полувыведения из организма человека 12 ч или больше, например 12-21 день. 12. Композиция по любому из пп.1-11, которая связывает человеческий сывороточный альбумин сKD в диапазоне от примерно 5 мкмоль до примерно 1 пкмоль. 13. Фармацевтическая композиция, содержащая композицию по любому из пп.1-12 в комбинации с фармацевтически или физиологически приемлемым носителем, эксципиентом или разбавителем. 14. Фармацевтическая композиция по п.13, содержащая дополнительные терапевтические или активные агенты. 15. Композиция, содержащая (а) композицию по любому из пп.1-12 и (б) дополнительные терапевтические или активные агенты, для раздельного, последовательного или одновременного введения субъекту. 16. Композиция по любому из пп.1-15 для применения в лечении или предупреждении метаболического заболевания или расстройства. 17. Композиция по п.16, где заболевание или расстройство выбрано из гипергликемии, нарушенной толерантности к глюкозе, бета-клеточной недостаточности, диабета (диабета I или II типа или гестационного диабета), ожирения, заболеваний, характеризующихся перееданием. 18. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для лечения или предупреждения метаболического заболевания или расстройства. 19. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для доставки субъекту путем подкожной, внутривенной или внутримышечной инъекции. 20. Применение композиции по любому из пп.1-15 в изготовлении лекарственного средства для парентеральной, пероральной, ректальной, трансмукозальной, глазной, легочной доставки или доставки через ЖК (желудочно-кишечный) тракт. 21. Способ лечения или предупреждения метаболического заболевания, включающий введение пациенту терапевтически или профилактически эффективного количества композиции по любому из пп.115. 22. Пероральный, инъекционный, ингалируемый или распыляемый препарат, содержащий композицию по любому из пп.1-15. 23. Препарат с длительным высвобождением, например, в форме суппозитория, содержащий композицию по любому из пп.1-15. 24. Лиофильно высушенный препарат, содержащий композицию по любому из пп.1-15. 25. Выделенная или рекомбинантная нуклеиновая кислота, кодирующая композицию по любому из пп.1-7. 26. Нуклеиновая кислота, кодирующая композицию по п.7. 27. Вектор, содержащий нуклеиновую кислоту по п.25 или 26. 28. Клетка-хозяин, содержащая нуклеиновую кислоту по п.25 или 26 или вектор по п.27. 29. Способ получения слитого полипептида, содержащего или состоящего из следующего: (а) лекарственное средство, выбранное из эксендинов, PYY (пептида YY), GLP (глюкагоноподобного пептида), ОХМ (окситомодулина), VIP (вазоактивного интестинального пептида) или РР (панкреатического полипептида), присутствующее в виде слитой конструкции с (б) однодоменным антителом (dAb)DOM7h-14, которое связывает сывороточный альбумин и которое имеет аминокислотную последовательность, показанную на фиг. 1(h), включающий поддержание клетки-хозяина по п.28 в условиях, подходящих для экспрессии указанных нуклеиновой кислоты или вектора, в результате чего продуцируется слитый полипептид. 30. Способ лечения или предупреждения заболевания или расстройства, ассоциированного с повышенным содержанием глюкозы в крови у пациента, например пациента-человека, включающий введение указанному пациенту терапевтически или профилактически эффективного количества композиции по любому из пп.1-15. 31. Способ стимулирования продуцирования инсулина и/или увеличения чувствительности к инсулину у пациента, например пациента-человека, включающий введение указанному пациенту по меньшей мере одной дозы композиции по любому из пп.1-15.
МПК / Метки
МПК: C07K 16/46, C12N 5/10, A61K 47/48, C07K 19/00, C12N 15/62
Метки: средства, конструкции, слитые, лекарственного, конъюгаты
Код ссылки
<a href="https://eas.patents.su/30-18471-slitye-konstrukcii-i-konyugaty-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Слитые конструкции и конъюгаты лекарственного средства</a>
Предыдущий патент: Одоризационная композиция для газообразного топлива, не имеющего запаха, способ одоризации и газообразное топливо
Следующий патент: Частицы, содержащие эритропоэтин, для лечения и профилактики неврологических и гематологических заболеваний и нарушений
Случайный патент: Железобетонная шпала и способ ее изготовления












